Новые и действенные пептиды мнс ii класса, полученные из сурвивина
Номер патента: 19603
Опубликовано: 30.04.2014
Авторы: Левандровский Петер, Гуттефанж Сесиль, Штефанофик Штефан, Раммензее Ханс-Георг, Вайншенк Тони
Формула / Реферат
1. Пептид, содержащий последовательность, выбранную из группы SEQ ID NO: 1 - SEQ ID NO: 3, где указанный пептид имеет длину от 15 до 30 аминокислот.
2. Пептид по п.1, где пептид состоит из аминокислотной последовательности SEQ ID NO: 1 - SEQ ID NO: 3.
3. Пептид по п.1 или 2, где указанный пептид является слитым белком, в частности, содержащим N-концевые аминокислоты антиген-ассоциированной инвариантной цепи (Ii) HLA-DR.
4. Нуклеиновая кислота, кодирующая пептид по любому из пп.1-3.
5. Вектор экспрессии, включающий нуклеиновую кислоту по п.4.
6. Клетка-хозяин, не являющаяся клеткой человека, содержащая нуклеиновую кислоту по п.4 или вектор экспрессии по п.5, причем клетка является антигенпрезентирующей клеткой, в частности дендритной клеткой.
7. Способ получения пептида по любому из пп.1-3, включающий культивирование клетки-хозяина по п.6 в условиях, обеспечивающих экспрессию нуклеиновой кислоты по п.4 и выделение пептида из культуральной среды.
8. Способ получения активированных цитотоксических Т-лимфоцитов (ЦТЛ) in vitro, включающий приведение в контакт ЦТЛ in vitro с нагруженными антигеном человеческими молекулами МНС I или II класса, экспрессированными на поверхности подходящей антигенпрезентирующей клетки или искусственной конструкции, имитирующей антигенпрезентирующую клетку, в течение времени, достаточного для активации указанных ЦТЛ антигенспецифическим образом, где указанный антиген является пептидом по любому из пп.1-3.
9. Применение пептида по любому из пп.1-3, нуклеиновой кислоты по п.4 или вектора экспрессии по п.5, клетки-хозяина по п.6 или активированного Т-лимфоцита, полученного в соответствии с п.8 для получения лекарственного средства для лечения рака.
10. Применение по п.9, где лекарственное средство является вакциной.
11. Применение по п.9 или 10, где указанный рак выбран из астроцитомы, пилоидной астроцитомы, дисэмбриопластической нейроэпителиальной опухоли, олигодендроглиомы, эпендимомы, мультиформной глиобластомы, смешанных глиом, олигоастроцитомы, медуллобластомы, ретинобластомы, нейробластомы, герминомы, тератомы, ганглиоглиомы, ганглиоцитомы, центральной ганглиоцитомы, примитивных нейроэктодермальных опухолей (PNET, к примеру медуллобластомы, медуллоэпителиомы, нейробластомы, ретинобластомы, эпендимобластомы), опухолей паренхимы шишковидной железы (к примеру, пинеоцитомы, пинеобластомы), опухолей, развивающихся из эпендимных клеток, опухолей хориоидного сплетения, нейроэпителиальных опухолей неопределенного происхождения (к примеру, глиоматоза головного мозга, астробластомы), глиобластомы, опухоли предстательной железы, рака груди, рака пищевода, рака толстого кишечника, колоректального рака, почечно-клеточной карциномы, рака легких, ЦНС, яичника, меланомы, рака поджелудочной железы, плоскоклеточной карциномы, лейкемии или медуллобластомы и других опухолей или видов рака, проявляющих гиперэкспрессию сурвивина или нейрокана.
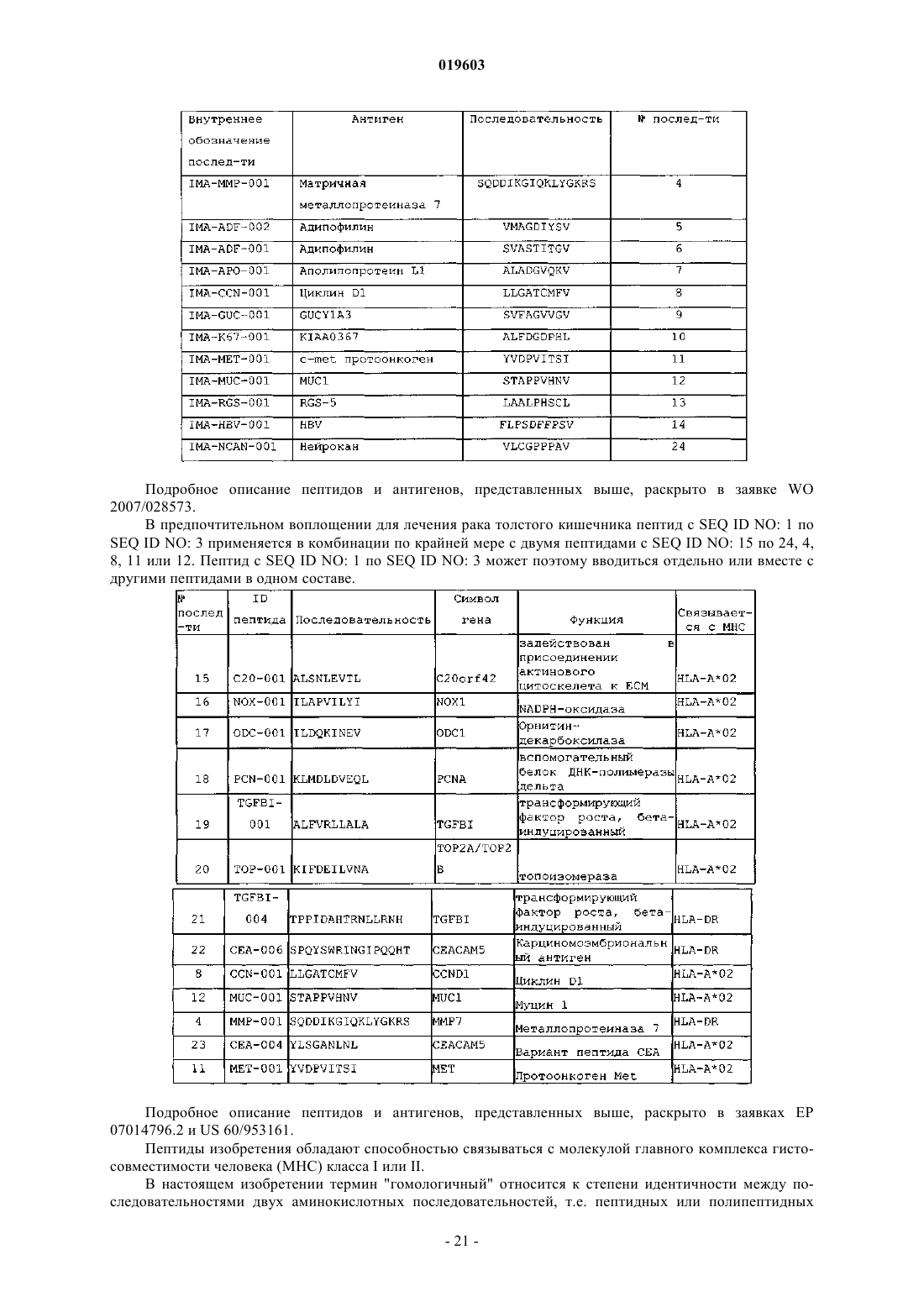
12. Применение по любому из пп.9-11, дополнительно включающее комбинированное использование по крайней мере одного пептида, выбранного из группы, состоящей из пептидов SEQ ID NO: 4-13 и 24, для получения лекарственного средства для лечения рака почек.
13. Применение по любому из пп.9-11, дополнительно включающее комбинированное использование по крайней мере одного пептида, выбранного из группы, состоящей из пептидов SEQ ID NO: 4, 8, 11, 12 и 15-24, для получения лекарственного средства для лечения рака толстого кишечника.
14. Набор, содержащий:
(а) контейнер, который содержит фармацевтическую композицию, содержащую пептид по любому из пп.1-3, нуклеиновую кислоту по п.4 или вектор экспрессии по п.5, клетку-хозяин по п.6 или активированный цитотоксический Т-лимфоцит, полученный способом по п.8, в виде раствора или в лиофилизованной форме;
(b) при необходимости, второй контейнер, содержащий разбавитель или восстанавливающий раствор для лиофилизованного состава; и
(c) при необходимости, по крайней мере один пептид, выбранный из группы, состоящей из пептидов SEQ ID NO: 4-24.
15. Применение любого пептида SEQ ID NO: 1-24 для получения антитела, которое является специфическим против комплекса указанного пептида и соответствующей молекулы HLA.
Текст
НОВЫЕ И ДЕЙСТВЕННЫЕ ПЕПТИДЫ МНС II КЛАССА, ПОЛУЧЕННЫЕ ИЗ СУРВИВИНА Настоящее изобретение относится к пептидам, нуклеиновым кислотам и клеткам для применения в иммунотерапевтических методах. В частности, настоящее изобретение относится к иммунотерапии рака. Настоящее изобретение относится в дальнейшем к полученным из сурвивина опухолеассоциированным пептидным эпитопам цитотоксических Т-клеток (ЦТЛ), в отдельности или в комбинации с другими опухолеассоциированными пептидами, которые служат как активные фармацевтические ингредиенты для композиций вакцины, которая стимулирует антиопухолевые иммунные ответы. Настоящее изобретение специфически относится к трем новым пептидным последовательностям и их вариантам, образованным из молекул HLA класса I и II человеческих опухолевых клеток, которые могут быть использованы в вакцинных композициях для вызывания противоопухолевых иммунных ответов.(71)(73) Заявитель и патентовладелец: ИММАТИКС БАЙОТЕКНОЛОДЖИЗ ГМБХ (DE) 019603 Настоящее изобретение относится к пептидам, нуклеиновым кислотам и клеткам для применения в иммунотерапевтических методах. В частности, настоящее изобретение относится к иммунотерапии рака. Настоящее изобретение относится в дальнейшем к полученным из сурвивина опухолеассоциированным пептидным эпитопам цитотоксических Т-клеток (ЦТЛ), в отдельности или в комбинации с другими опухолеассоциированными пептидами, которые служат как активные фармацевтические ингредиенты для композиций вакцины, которая стимулирует противоопухолевые иммунные ответы. Настоящее изобретение специфически относится к трем новым пептидным последовательностям и их вариантам, образованным из молекул HLA класса I и II человеческих опухолевых клеток, которые могут быть использованы в вакцинных композициях для вызывания противоопухолевых иммунных ответов. Уровень техники Глиомы являются опухолями головного мозга, возникающими из глиальных клеток нервной системы. Глиальные клетки, называемые обычно нейроглия или просто глия, являются ненейрональными клетками, которые обеспечивают поддержку и питание, поддерживают гомеостаз, формируют миелин и участвуют в передаче сигналов в нервной системе. Две наиболее важные подгруппы глиом - это астроцитомы и олигодендроглиомы, называемые в соответствии с видами нормальных глиальных клеток, из которых они образуются (астроциты или олигодендроциты соответственно). Относящаяся к подгруппе астроцитов мультиформная глиобластома (называемая далее глиобластомой) является наиболее распространенной злокачественной опухолью головного мозга взрослых людей, и на ее счет приходится прибл. 40% всех злокачественных опухолей головного мозга и прибл. 50% глиом (CBTRUS, 2006). Она агрессивно поражает центральную нервную систему и имеет наивысший уровень злокачественности (степеньIV) среди всех глиом. Хотя наблюдается постоянный прогресс в их лечении благодаря усовершенствованию нейровизуализации, микрохирургии, различным возможностям лечения, таким как Темозоломид или облучение, глиобластомы остаются неизлечимыми (Macdonald, 2001; Burton and Prados, 2000; Pradosand Levin, 2000). Процент летальных исходов при этой опухоли головного мозга очень высок: средняя ожидаемая продолжительность жизни после постановки первого диагноза составляет 9-12 месяцев. 5 летний срок выживаемости в течение периода наблюдения с 1986 по 1990 составил 8,0%. На данный момент пятилетний срок выживаемости вследствие агрессивной терапии, включая макроскопическое удаление опухоли, все еще ниже 10% (Burton and Prados, 2000; Nieder et al., 2000; Napolitano et al., 1999; Dazzi et al., 2000). Соответственно, существует высокая потребность медицины в альтернативном и эффективном методе лечения. Опухолевые клетки глиобластомы являются наиболее недифференцированными среди опухолей головного мозга, так что опухолевые клетки имеют высокий потенциал для миграции и пролиферации и являются высокоинвазивными, приводя к очень неутешительному прогнозу. Глиобластомы приводят к смерти из-за быстрого, агрессивного и инфильтрирующего роста в головном мозге. Паттерны инфильтрирующего роста являются причиной нерезектабельности этих опухолей. Глиобластомы также относительно резистентны к облучению и химиотерапии, и поэтому высок процент рецидивов после лечения. Кроме того, иммунный ответ на неопластические клетки довольно неэффективен для полного устранения всех неопластических клеток после резекции и лучевой терапии (Roth and Weller, 1999; Dix et al.,1999; Sablotzki et al., 2000). Глиобластома подразделяется на первичную глиобластому (de novo) и вторичную глиобластому в зависимости от различий в генном механизме во время злокачественной трансформации недифференцированных астроцитов или глиальных клеток-предшественников. Вторичная глиобластома возникает в более молодом возрасте, до 45 лет. В течение 4-5 лет, в среднем, вторичная глиобластома развивается из астроцитомы низкой степени, проходя стадию недифференцированной астроцитомы. Первичная глиобластома, напротив, возникает в более пожилом возрасте, в среднем это 55 лет. В целом, первичная глиобластома возникает как молниеносная глиобластома, характеризуясь прогрессированием опухоли в течение 3 месяцев, начиная с состояния без клинических или патологических отклонений (Pathology andGenetics of the Nervous Systems. 29-39 (IARC Press, Lyon, France, 2000. Глиобластома мигрирует вдоль миелинизированных нервов и широко распространяется по центральной нервной системе. В большинстве случаев хирургическое вмешательство дает лишь ограниченно устойчивый терапевтический эффект (Neurol. Med. Chir. (Tokyo) 34, 91-94, 1994; Neurol. Med. Chir.(Tokyo) 33, 425-458, 1993; Neuropathology 17, 186-188, 1997) (Macdonald, 2001; Prados and Levin, 2000). Злокачественные клетки глиомы ускользают от обнаружения иммунной системой хозяина за счет выработки иммуноподавляющих веществ, которые наносят вред пролиферации Т-клеток и выработке иммуностимулирующего цитокина ИЛ-2 (Dix et al., 1999). Внутричерепные неоплазмы могут возникнуть из любых структур или видов клеток, присутствующих в ЦНС, включая головной мозг, мягкие мозговые оболочки, мозговой придаток, череп и даже остаточную эмбриональную ткань. Общая ежегодная частота заболеваемости первичными опухолями головного мозга в Соединенных Штатах составляет 14 случаев на 100000. Наиболее распространенные первичные опухоли головного мозга - менингиомы, составляющие 27% всех первичных опухолей головного мозга, и глиобластомы, составляющие 23% всех первичных опухолей головного мозга (причем на счет глиобластомы приходятся 40% всех случаев злокачественных опухолей головного мозга взрослого насе-1 019603 ления). Многие из этих опухолей агрессивны и имеют высокую степень злокачественности. Первичные опухоли головного мозга являются наиболее распространенными солидными опухолями у детей и второй по частоте причиной смерти от рака после лейкемии у детей. Поиск методов эффективного лечения пациентов от глиобластом продолжается и сейчас. Была изучена иммунотерапия, или лечение посредством стимуляции иммунной системы, в целях борьбы с данными неопластическими клетками. Первые обнадеживающие результаты были получены "NorthwestTherapeutics" с использованием препарата "DCVax Brain" для лечения глиобластомы в рамках иммунотерапевтических исследований с человеческими пациентами, в которых могли быть индуцированы антигенспецифические ответы ЦТЛ, приводившие к увеличению средних сроков выживаемости в сравнении с теми, что были получены с применением стандартных методов лечения, сопровождаемых минимальной токсичностью (Heimberger et al., 2006). Колоректальная карцинома По данным Американского общества по борьбе с раком колоректальный рак (КРР) занимает третье место по частоте распространения в США, это заболевание поражает ежегодно более 175000 новых пациентов. В США, Японии, Франции, Германии, Италии, Испании и Великобритании оно поражает более 480000 пациентов. Это одна из наиболее частых причин смертности от рака в развитых странах. 1 Годичный и 5-летний срок выживаемости для людей с колоректальным раком составляет 84 и 64% соответственно. Срок выживаемости продолжает снижается после 5 лет до 57% по истечении 10 лет после постановки диагноза. Если колоректальный рак обнаруживают на ранней, локализованной стадии, то 5 летняя выживаемость составляет 90%; однако на этой стадии диагностируются лишь 39% случаев заболевания колоректальным раком, причиной тому - слишком низкий процент обследований. После того как рак распространился регионально, поразив соседние органы или лимфатические узлы, 5-летняя выживаемость сокращается до 68%. Для лиц с отдаленными метастазами 5-летняя выживаемость составляет 10%. Исследователи предполагают, что возникновение колоректального рака является результатом взаимодействия между наследственными факторами и факторами окружающей среды. В большинстве случаев появляются аденоматозные полипы, становясь предшественниками колоректальных опухолей, хотя процесс их перехода в опухоль может занять много лет. Первостепенный фактор риска для заболевания колоректальным раком - это возраст, в 90% случаев диагноз был поставлен в возрасте более 50 лет. Другие факторы риска заболевания колоректальным раком по данным Американского общества по борьбе с раком включают употребление алкоголя, питание с высоким содержанием жиров и/или сырого мяса и неадекватное потребление фруктов и овощей. Число новых случаев продолжает расти, в особенности на территории таких стран, как Япония, где виновником может быть внедрение западных образцов питания с избыточным потреблением жира и мяса и снижение потребления волокнистой пищи. Несмотря на это,частота заболеваемости растет не так быстро, как раньше, что может быть связано с увеличением количества скринингов и удалением полипов, предотвращая, таким образом, прогрессирование заболевания и переход полипов в рак. Как и при большинстве солидных опухолей, терапия первого ряда - операция, однако только пациенты на ранней стадии могут получить от этого пользу, значительной же доле пациентов диагноз ставится лишь на поздних стадиях заболевания. В химиотерапии колоректального рака на поздних стадиях стандартом лечения являются лечебные схемы, основанные на фторурациле. Большинство данных лечебных схем представляют собой т.н. курсы лечения "FOLFOX" (вливание 5-FU/лейковорин плюс оксалиплатин) и "FOLFIRI" (иринотекан, лейковорин, болюсное и продолжительное вливание 5-FU). Внедрение цитотоксических препаратов третьего поколения, таких как иринотекан и оксалиплатин,увеличило надежду на значительное улучшение эффективности, однако прогнозы до сих пор относительно безнадежные. Срок выживаемости при метастатической болезни, как правило, составляет приблизительно 20 месяцев и, в результате этого, остается высокой беспомощность медицины при данном заболевании. Недавно стало доступным новое поколение медикаментов, действующих на молекулярные мишени,таких как Авастин (Avastin) (бевацизумаб) и Эрбитукс (Erbitux) (цетуксимаб), а около 40 соединений находятся на поздней стадии клинических исследований по лечению различных стадий колоректального рака. Комбинации из нескольких таких соединений повышают число потенциальных возможностей лечения, ожидаемых в будущем. Подавляющее большинство веществ находятся на 2-й фазе исследований,при этом данные соединения более часто, чем другие разрабатываемые медикаменты против колоректального рака, адресованы против EGFR (рецептор эпидермального фактора роста), что связано с тем фактом, что у 80% пациентов с колоректальным раком наблюдается повышенная экспрессия EGFR. На данный момент проводятся клинические исследования с пациентами II стадии с комбинацией химиотерапии с одобренными недавно моноклональными антителами (mAbs) (цетуксимаб + иринотекан или FOLFOX4; бевацизумаб в качестве монотерапии или вместе с FOLFOX4). Для получения статистически достоверных результатов по данным исследованиям необходимы 3-4-годичные периоды наблюдения. Моноклональные антитела (mAbs), используемые в настоящее время в онкологии, в целом имеют-2 019603 превосходные шансы на то, что они не будут создавать помех активной иммунотерапии. Действительно,имеются доклинические (GABRILOVICH 1999) и клинические данные, предполагающие, что элиминация фактора роста эндотелия сосудов VEGF (в случае бевацизумаба) вносит положительный вклад в опосредованную ДК (дендритные клетки) активацию Т-клеток (Osada T., Chong G., Tansik R., Hong T., Spector N., Kumar R., Hurwitz H.I., Dev I., Nixon A.B., Lyerly H.K., Clay T., Morse M.A. The effect of anti-VEGFJan. 10). Рак предстательной железы и другие опухоли Число смертей от рака предстательной железы в 2007 г. ожидалось 27050, что делает его наиболее частой причиной смерти от рака у мужчин. Несмотря на то, что процент смертности среди белого и афроамериканского населения снижается с начала 1990-х годов, до сих пор число афроамериканских мужчин более чем в два раза превышает число белых мужчин. Рак предстательной железы является наиболее часто диагностируемым видом рака у мужчин. По неизвестным причинам частота заболеваемости значительно выше среди афроамериканцев, чем среди белых мужчин. Частота заболеваемости раком предстательной железы постоянно менялась на протяжении последних 20 лет: быстрый рост с 1988 г. по 1992 г.,резкое снижение с 1992 г. по 1995 г. и умеренный рост с 1995 г. Данные тенденции отражают большей частью увеличение числа обследований на рак предстательной железы с помощью анализа крови на простатспецифический антиген (PSA). Умеренный рост частоты заболеваемости за последнее десятилетие связан, скорее всего, с распространенным скринингом PSA среди мужчин моложе 65 лет. Частота заболеваемости раком предстательной железы стабилизируется у мужчин 65 лет и старше. Число случаев достигло своего пика для белых мужчин в 1992 г. (237,6 случаев на 100000 человек) и для афроамериканцев - в 1993 г. (342,8 случаев на 100000 человек). Лечение рака предстательной железы может включать внимательное наблюдение, операцию, лучевую терапию, высокоинтенсивный фокусированный ультразвук (HIFU), химиотерапию, криохирургию,гормональное лечение или какую-либо комбинацию. Какая из возможностей является наилучшей зависит от стадии заболевания, оценки по шкале Глисона и уровня PSA. Другие важные факторы - это возраст мужчины, общее состояние его здоровья и его отношение к возможным способам лечения и побочным эффектам от них. Так как все способы лечения могут иметь побочные эффекты, такие как эректильная дисфункция и недержание мочи, то в центре внимания при дискуссиях о способе лечения часто стоит возможность нахождения баланса между целью лечения и рисками, связанными с изменением стиля жизни. Если рак распространился за пределы простаты, то возможности для лечения значительно изменяются, так что большинство врачей, лечащих рак предстательной железы, используют множество номограмм для предсказания вероятности распространения. Лечение с использованием внимательного наблюдения, высокоинтенсивного фокусированного ультразвука (HIFU), лучевой терапии, криохирургии и операции предлагаются обычно мужчинам, рак которых остается в пределах предстательной железы. Гормональная терапия и химиотерапия часто предусматриваются для лечения заболевания, которое распространилось за пределы простаты. Однако возможны исключения: лучевая терапия может использоваться для некоторых опухолей на поздних стадиях, а гормональная терапия - для опухолей на ранней стадии. Криотерапия, гормональная терапия и химиотерапия могут быть также предложены, если первоначальное лечение было неудачным, и рак прогрессирует. У значительного числа пациентов с раком предстательной железы, которые подвергаются простатэктомии из-за клинического подозрения на рост внутри органа, окончательное гистологическое обследование операционного материала показывает локально экстенсивное распространение опухоли за пределы органа. Для этих пациентов существует высокий риск быстрого локального рецидива, обнаруживаемого обычно как повышение уровня PSA с точки зрения биохимического рецидивирования заболевания. Терапевтические возможности в данной ситуации включают наружную лучевую терапию и гормональную абляцию; однако значимость данных терапевтических подходов, в особенности в отношении продления жизни пациента в долгосрочной перспективе, не подтверждена. Кроме того, необходимо учитывать возможность связанных с лечением осложнений, таких как появление стриктуры уретры (лучевая терапия), потеря полового влечения и импотенция, риск снижения содержания солей кальция в костях в связи с остеопорозом и существенно возросший риск патологической хрупкости костей (гормональная абляция). Более 90% всех случаев заболевания раком предстательной железы обнаруживаются на локальной и региональной стадиях; 5-летняя относительная выживаемость для пациентов, опухоли которых были диагностированы на этих стадиях, достигает 100%. В течение последних 25 лет 5-летняя выживаемость для всех стадий в целом увеличилась с 69 до примерно 90%. В соответствии с последними данными относительная 10-летняя выживаемость составляет 93%, а 15-летняя - 77%. Разительное увеличение выживаемости, в особенности 5-летней, отчасти связано с ранней постановкой диагноза и улучшениями в лечении. Несмотря на это, сроки выживаемости значительно сокращаются после распространения на другие ткани и органы. Рак легких-3 019603 В 2007 г. ожидается приблизительно 210000 новых случаев в США, что составляет около 15% всех диагнозов рака. Частота заболеваемости значительно снижается среди мужчин с 102 случаев на 100000 человек в 1984 г. до 78,5 в 2003 г. Среди женщин частота заболеваемости стабилизировалась после долгого периода роста. В целях лечения рак легких классифицируется клинически на мелкоклеточный (13%) или немелкоклеточный (87%). Рак легких является наиболее частой причиной смертности от рака как среди мужчин, так и среди женщин. Около 160390 смертей, составляющих приблизительно 29% всех летальных исходов от рака,ожидаются в 2007 г. Начиная с 1987 г., от рака легких ежегодно умирало больше женщин, чем от рака молочной железы. Число смертей среди мужчин значительно снижалось в период с 1991 по 2003 гг.,примерно на 1,9% ежегодно. Смертность от рака легких среди женщин сохраняется на неизменном уровне после продолжительного роста на протяжении нескольких десятилетий. Данные тенденции по смертности от рака легких отражают снижение числа курящих на протяжении последних 30 лет. Вид лечения определяется типом (мелкоклеточный или немелкоклеточный) и стадией ракового заболевания и включают хирургическое вмешательство, лучевую терапию, химиотерапию, а также нацеленные биологические терапии, такие как бевацизумаб (Avastin) и эрлотиниб (Tarceva). Для локализованного рака в качестве терапии обычно выбирается операция. Последние исследования указывают на то, что выживаемость с немелкоклеточным раком легких ранней стадии улучшается, если за операцией следует химиотерапия. Так как на момент своего обнаружения заболевание обычно распространилось,часто используются лучевая терапия и химиотерапия, иногда в сочетании с операцией. Химиотерапия в отдельности или в сочетании с лучевой терапией является стандартным лечением, выбираемым для мелкоклеточного рака легких; при данной схеме лечения большой процент пациентов испытывает ремиссию, которая в некоторых случаях бывает продолжительной. Одногодичная относительная выживаемость для рака легких слегка возросла с 37% в 1975-1979 гг. до 42% в 2002 г. во многом благодаря усовершенствованиям в хирургической технике и комбинированным способам лечения. Однако 5-летний срок выживаемости для всех стадий в целом составил лишь 16%. Процент выживаемости для всех случаев, обнаруживаемых, когда заболевание все еще локализовано, составляет 49%; однако только 16% всех случаев рака легких диагностируются на этой ранней стадии. Таблица 1 Предполагаемое количество случаев заболевания раком и смертей в зависимости от пола для США в 2007 г. (данные American Cancer Society - Американское общество по борьбе с раком. Таким образом, существует потребность в новом, эффективном и безопасном способе лечения глиобластомы, опухоли предстательной железы, рака молочной железы, рака пищевода, рака толстого кишечника, светлоклеточной почечно-клеточной карциномы, рака легких, ЦНС, яичника, меланомы (Tammet al. 1998), рака поджелудочной железы, плоскоклеточной карциномы, лейкемии и медуллобластомы, а также других видов опухолей, демонстрирующих гиперэкспрессию сурвивина, который улучшал бы самочувствие пациентов без применения химиотерапевтических средств или других веществ, которые могут вызывать серьезные побочные эффекты. Краткое изложение сущности изобретения В первом своем аспекте настоящее изобретение относится к пептиду, включающему последова-4 019603 тельность, которая выбирается из группы с SEQ ID NO: 1 по SEQ ID NO: 3 или его вариант, который по крайней мере на 85% гомологичен с SEQ ID NO: 1 по SEQ ID3, или его вариант, который индуцирует Т-клеточную перекрестную реакцию с указанным вариантным пептидом; причем указанный пептид не является полипептидом полной длины человеческого сурвивина. Предпочтительно указанный пептид выбирается из пептида, имеющего специфический подвид HLA, такой как HLA-A02 или HLA-DR. Во втором своем аспекте настоящее изобретение относится к нуклеиновой кислоте, кодирующей пептид в соответствии с настоящим изобретением, или вектору экспрессии, способному экспрессировать указанную нуклеиновую кислоту. В третьем своем аспекте настоящее изобретение относится к клетке-хозяину, включающей нуклеиновую кислоту или вектор экспрессии в соответствии с настоящим изобретением, где указанная клеткахозяин предпочтительно является антигенпрезентирующей клеткой, в частности дендритной клеткой или антигенпрезентирующей клеткой. В четвертом своем аспекте настоящее изобретение относится к способу получения активированных цитотоксических Т-лимфоцитов (ЦТЛ) in vitro, включающему контактирование ЦТЛ in vitro с нагруженными антигеном молекулами человека МНС I класса, экспрессированными на поверхности подходящей антигенпрезентирующей клетки или искусственной конструкции, имитирующей антигенпрезентирующую клетку, на период времени, достаточного для активации указанных ЦТЛ антиген-специфическим образом, где указанный антиген является пептидом в соответствии с настоящим изобретением. Применение пептида в соответствии с настоящим изобретением, нуклеиновая кислота или вектор экспрессии в соответствии с настоящим изобретением, клетка в соответствии с настоящим изобретением или активированный цитотоксический Т-лимфоцит, полученный в соответствии с настоящим изобретением для лечения рака или для изготовления медикамента против рака, где указанный медикамент предпочтительно является вакциной. Предпочтительно, если указанный рак выбирается из астроцитомы, пилоидной астроцитомы, дисэмбриопластической нейроэпителиальной опухоли, олигодендроглиомы,эпендимомы, мультиформной глиобластомы, смешанных глиом, олигоастроцитомы, медуллобластомы,ретинобластомы, нейробластомы, герминомы, тератомы, ганглиоглиомы, ганглиоцитомы, центральной ганглиоцитомы, примитивной нейроэктодермальной опухоли (PNET, к примеру медуллобластома, медуллоэпителиома, нейробластома, ретинобластома, эпендимобластома), опухоли паренхимы шишковидной железы (к примеру, пинеоцитома, пинеобластома), опухолей, развивающихся из эпендимных клеток,опухолуй хороидного сплетения, нейроэпителиальных опухолей неопределенного происхождения (к примеру, глиоматоз гловного мозга, астробластома), глиобластомы, рака предстательной железы, рака молочной железы, рака пищевода, рака толстого кишечника, почечно-клеточной карциномы, светлоклеточной почечно-клеточной карциномы, рака легких, ЦНС, яичника, меланомы, рака поджелудочной железы, плоскоклеточной карциномы, лейкемии и медуллобластомы, а также других видов опухолей или рака, демонстрирующих гиперэкспрессию сурвивина. Вспомогательное оборудование, включающее контейнер, который содержит фармацевтическую композицию, содержащую пептид в соответствии с настоящим изобретением, нуклеиновую кислоту или вектор экспрессии в соответствии с настоящим изобретением, клетку в соответствии с настоящим изобретением или активированный Т-лимфоцит в соответствии с настоящим изобретением, в виде раствора или в лиофилизованной форме; (b) опционально - второй контейнер, содержащий разбавитель или восстанавливающий раствор для лиофилизованного состава; и (с) опционально - по крайней мере один пептид, выбранный из группы, состоящей из пептидов в соответствии с SEQ ID NO: с 4 по 24, и (d) опционально - инструкции по применению раствора и/или восстановителя и/или по применению лиофилизованного состава. Способ получения рекомбинантного антитела, специфически связывающегося с главным комплексом гистосовместимости человека (МНС) класса I или II в комплексе с рестриктированным по HLA антигеном; метод, включающий иммунизацию измененного методом генной инженерии нечеловеческого млекопитающего, включающего клетки, экспрессирующие молекулы указанного главного комплекса гистосовместимости человека (МНС) класса I или II с растворимой формой молекулы МНС класса I илиII в комплексе с указанным рестриктированным по HLA антигеном; изоляция молекул мРНК из антитела для получения клеток указанного нечеловеческого млекопитающего; создание библиотеки фагового отображения, отображающего белковые молекулы, закодированные указанными молекулами мРНК; и изоляцию по меньшей мере одного фага из указанной библиотеки фагового отображения, указанный по меньшей мере один фаг, отображающий указанное антитело, специфически связываемое с указанным главным комплексом гистосовместимости человека (МНС) класса I или II в комплексе с указанным рестриктированным по HLA антигеном. Антитело, которое специфически связывается с главным комплексом гистосовместимости человека(МНС) класса I или II в комплексе с рестриктированным по HLA антигеном, где антитело предпочтительно является поликлональным антителом, моноклональным антителом и/или химерным антителом. Детальное описание изобретения Термин "пептид" используется здесь для обозначения серий аминокислотных остатков, связанных друг с другом типично пептидными связями между -аминными и карбонильными группами смежных-5 019603 аминокислот. Пептиды типично обладают длиной в 9 аминокислот, но могут быть короче - 8 аминокислот в длину и длиннее - 16 аминокислот в длину. Термин "олигопептид" используется здесь для обозначения серий аминокислотных остатков, связанных один с другим типично пептидными связями между -аминными и карбонильными группами смежных аминокислот. Длина олигопептида не особенно важна для изобретения до тех пор, пока в нем сохраняются надлежащие эпитоп или эпитопы. Олигопептиды типично бывают менее чем около 30 аминокислотных остатков в длину и более чем около 14 аминокислот в длину. Термин "полипептид" обозначает серии аминокислотных остатков, связанных друг с другом типично пептидными связями между -аминными и карбонильными группами смежных аминокислот. Длина полипептида не особенно важна для изобретения до тех пор, пока сохраняются надлежащие эпитопы. В отличие от терминов "пептид" или "олигопептид", термин "полипептид" введен для обозначения молекул, содержащих более приблизительно 30 аминокислотных остатков. Пептид, олигопептид, белок или полинуклеотид, кодирующий для такой молекулы, является "иммуногенным" (и, таким образом, "иммуногеном" в рамках настоящего изобретения), если он способен индуцировать иммунный ответ. В случае настоящего изобретения иммуногенность получает более специфическое определение как способность индуцировать Т-клеточный ответ. Таким образом, "иммуноген" должен представлять собой молекулу, которая способна индуцировать иммунный ответ, и, в случае настоящего изобретения, молекулу, способную индуцировать ответ Т-клетки. Для Т-клеточного "эпитопа" необходим короткий пептид, который связан с рецептором МНС I илиII класса, образующий трехчленный комплекс (-цепь МНС класса I, -2-микроглобулин и пептид), который может быть распознан Т-клеткой, несущей подходящий Т-клеточный рецептор, связывающийся с комплексом МНС/пептид с подходящей аффинностью. Пептиды, связывающиеся с молекулами МНС I класса, типично имеют длину в 8-14 аминокислот и, особенно типично, длину в 9 аминокислот. Тклеточные эпитопы, которые связываются с молекулами МНС II класса, типично имеют длину в 12-30 аминокислот. В случае пептидов, которые связываются с молекулами МНС II класса, один и тот же пептид и соответствующий Т-клеточный эпитоп могут иметь общий центральный сегмент, но различаться по общей длине из-за примыкающих последовательностей с различными длинами, расположенными перед аминным концом центральной последовательности и после ее карбоксильного конца соответственно. Рецепторы МНС II класса имеют более открытую структуру, пептиды, связанные с рецепторами МНС II класса, соответствующим образом, не полностью углублены в структуру пептидсвязывающей бороздки молекулы МНС II класса, как то имеет место быть с пептидсвязывающей бороздкой молекулы МНС I класса. Как ни удивительно, это не применимо к пептиду в соответствии с SEQ ID NO: 1, так как небольшие изменения в длине пептида ведут к экстремальному снижению активности (см. ниже). У человека имеется три различных генетических локуса, которые кодируют для молекул МНС I класса (молекулы МНС человека называются также человеческими лейкоцитарными антигенами (HLA:HLA-A, HLA-B и HLA-C. HLA-A01, HLA-A02 и HLA-A11 являются примерами различных аллелей МНС I класса, которые могут экспрессироваться из этих локусов. Таблица 2 30 аллелей, наиболее часто экспрессируемых в различных популяциях Человеческий геном имеет 3 различных локуса для генов МНС II класса: HLA-DR, HLA-DQ и HLADP. Рецепторы МНС II класса являются гетеродимерами, состоящими из - и -цепи, которые обе фиксируются на клеточной мембране с помощью трансмембранного региона. HLA-DRB104 и HLADRB107 - это два примера различных -аллелей МНС II класса, о которых известно, что они кодируются в данных локусах. Аллели II класса сильно полиморфичны, к примеру, было описано несколько сотен различных аллелей HLA-DRB1. Поэтому для терапевтических и диагностических целей крайне желателен пептид, который связывается с подходящей аффинностью с несколькими различными рецепторамиHLA II класса. Пептид, связывающийся с несколькими различными молекулами HLA II класса, называется беспорядочно связывающимся пептидом. Используемая здесь ссылка на последовательность ДНК включает как однонитевую, так и двунитевую ДНК. Таким образом, специфическая последовательность, если в контексте не указано иное, относится к однонитевой ДНК такой последовательности, дуплексу такой последовательности с его комплементом (двунитевая ДНК) и комплементу такой последовательности. Термин "кодирующая область" относится к тому участку гена, который естественно или нормально кодирует для экспрессионного продукта того гена в его естественном геномном окружении, т.е. участку, кодирующему in vivo для нативного продукта экспрессии гена. Кодирующая область может быть из нормального, мутировавшего или измененного гена или может даже быть из последовательности ДНК, или же гена, целиком синтезированного в лаборатории с использованием методов, хорошо известных специалистам из области синтеза ДНК. Термин "нуклеотидная последовательность" относится к гетерополимеру дезоксирибонуклеотидов. Нуклеотидная последовательность, кодирующая для конкретного пептида, олигопептида или полипептида, может быть встречающейся в природе или может быть получена синтетически. В целом, фрагменты ДНК, кодирующие пептиды, полипептиды и белки данного изобретения, собраны из фрагментов кДНК и коротких олигонуклеотидных линкеров или же из серий олигонуклеотидов для обеспечения синтетического гена, который способен экспрессироваться в рекомбинантной транскрипционной единице,включающей регуляторные элементы, образованные из микробиального или вирусного оперона. Термин "продукт экспрессии" означает полипептид или белок, являющийся естественным продуктом трансляции гена и кодирующих эквивалентов любой последовательности нуклеиновой кислоты, образующихся в результате вырожденности генетического кода и, таким образом, кодирующих для той/тех же самой(ых) нуклеиновой(ых) кислот(ы). Термин "фрагмент", если относится к кодирующей последовательности, означает участок ДНК,-7 019603 включающий меньше, чем полную кодирующую область, продукт экспрессии которого обязательно сохраняет ту же самую биологическую функцию или активность, что и продукт экспрессии полной кодирующей области. Термин "фрагмент ДНК" относится к полимеру ДНК в виде отдельного фрагмента или в качестве компонента более крупной конструкции ДНК, которая была образована из ДНК, изолированной по крайней мере один раз в существенно чистой форме, т.е. без контаминирующих эндогенных материалов и в количестве или с концентрацией, позволяющей идентификацию, манипуляцию и получение фрагмента и его составных нуклеотидных последовательностей стандартными биохимическими методами, например с использованием вектора для клонирования. Такие фрагменты обеспечиваются в форме открытой рамки считывания, не прерываемой внутренними нетранслированными последовательностями или интронами,которые типично присутствуют в эукариотических генах. Последовательности нетранслированной ДНК могут быть представлены по ходу транскрипции из открытой рамки считывания, где она не интерферирует с манипуляцией или экспрессией кодирующих областей. Термин "праймер" означает короткую последовательность нуклеиновой кислоты, которая может быть спарена с одной нитью ДНК и обеспечивает свободный конец 3'ОН, на котором ДНК-полимераза начинает синтезировать дезоксирибонуклеотидную цепь. Термин "промотор" означает участок ДНК, задействованный в связывании РНК-полимеразы для инициации транскрипции. Термин "открытая рамка считывания (ОРС)" означает серии триплетов, кодирующих для аминокислот без каких-либо терминирующих кодонов, и является последовательностью (потенциально), способной транслироваться в белок. Понятие "изолированный" означает, что материал удален из его исходного окружения (к примеру,естественное окружение, если он встречается в природе). Например, встречающийся в природе полинуклеотид или полипептид, представленный в живых организмах, не является изолированным, но тот же самый полинуклеотид или полипептид, выделенный из некоторых или всех сосуществующих материалов природной системы, является изолированным. Такие полинуклеотиды могли быть частью вектора и/или такие полинуклеотиды или полипептиды могли быть частью композиции и все-таки могли быть изолированы, так что такой вектор или композиция не является частью своего естественного окружения. Полинуклеотиды и рекомбинантные или иммуногенные полипептиды, раскрытые в соответствии с настоящим изобретением, могут также быть в "очищенной" форме. Термин "очищенный" не требует абсолютной чистоты; скорее он предназначен для дачи относительного определения и может включать препараты с высокой очисткой или препараты только с частичной очисткой в соответствии с тем, как эти термины понимаются специалистами соответствующей области. Например, отдельные клоны, изолированные из библиотеки кДНК, обычно очищались до электрофоретической чистоты. Очистка исходного материала или природного материала по крайней мере до одного порядка величины, предпочтительно двух или трех порядков и более предпочтительно четырех или пяти порядков величины определенно рассматривается. Более того, определенно рассматривается заявленный полипептид, чистота которого составляет предпочтительным образом 99,999% или по крайней мере 99,99 или 99,9% и еще более желательно 99 вес.% или более. Нуклеиновые кислоты и продукты экспрессии полипептида, раскрываемые в соответствии с настоящим изобретением, в равной степени, как и векторы экспрессии, содержащие такие нуклеиновые кислоты и/или такие полипептиды, могут быть в "обогащенной форме". Используемый здесь термин"обогащенный" означает, что концентрация материала по крайней мере приблизительно в 2, 5, 10, 100 или 1000 раз выше его естественной концентрации (например), преимущественно 0,01 вес.%, предпочтительно по крайней мере около 0,1 вес.%. Рассматриваются также препараты с около 0,5, 1, 5, 10 и 20 вес.%. Последовательности, конструкции, векторы, клоны и другие материалы, включенные в настоящее изобретение, могут предпочтительно быть в обогащенной или изолированной форме. Термин "активный фрагмент" означает фрагмент, который дает иммунный ответ (т.е. обладает иммуногенной активностью), если он введен отдельно или опционально с подходящим адъювантом животному, такому как млекопитающее, например кролику или мыши, также включая человека; таковой иммунный ответ, принимающий форму стимуляции ответа Т-клетки у животного-реципиента, такого как человек. Альтернативно "активный фрагмент" может также быть использован для инициации ответа Тклетки in vitro. Используемые здесь термины "участок", "сегмент" и "фрагмент", если они использованы по отношению к полипептидам, относятся к непрерывной последовательности остатков, таких как аминокислотные остатки, последовательность которых формирует подкласс более крупной последовательности. Например, если полипептид был подвергнут обработке любой из известных эндопептидаз, таких как трипсин или химотрипсин, то полученные в результате такой обработки олигопептиды будут представлять участки, сегменты или фрагменты исходного полипептида. Это означает, что любой таковой фрагмент будет обязательно содержать как часть его аминокислотной последовательности сегмент, фрагмент или участок, который в значительной степени идентичен, если не в точности идентичен последовательности с SEQ ID NO: 1 по SEQ ID NO: 3, которая соответствует встречающемуся в природе или "материнскому"-8 019603 белку с последовательностями с SEQ ID NO: 1 по SEQ ID NO: 3, а именно сурвивину. При использовании по отношению к полинуклеотидам такие термины относятся к продуктам, полученным при обработке указанных полинуклеотидов любой из известных эндонуклеаз. В соответствии с настоящим изобретением термин "процентная доля идентичности" или "идентичный с процентной долей", если он относится к последовательности, означает, что последовательность сравнивается с заявленной или описанной последовательностью после противопоставления сравниваемой последовательности (Сравниваемая последовательность) описанной или заявленной последовательностьи (Контрольная последовательность). Процентная доля идентичности определяется затем по следующей формуле: Процентная доля идентичности = 100 [I-(C/R)],где С является числом различий между Контрольной последовательностью и Сравниваемой последовательностью по длине противопоставления между Контрольной последовательностью и Сравниваемой последовательностью, где(i) каждое основание или аминокислота в Контрольной последовательности, которые не имеют соответствующего противопоставленного основания или аминокислоты в Сравниваемой последовательности, и(iii) каждое противопоставленное основание или аминокислота в Контрольной последовательности,которые отличаются от противопоставленного основания или аминокислоты в Сравниваемой последовательности, представляют собой различие;R - это число оснований или аминокислот в Контрольной последовательности по длине противопоставления Сравниваемой последовательности с любой брешью, образующейся в Контрольной последовательности, считающейся также за основание или аминокислоту. Если существует противопоставление между Сравниваемой последовательностью и Контрольной последовательностью, для которых процентная доля идентичности по расчетам выше, имеет значение приблизительного равенства или "более чем" установленной минимальной процентной доли идентичности, тогда Сравниваемая последовательность имеет установленную минимальную процентную долю идентичности с Контрольной последовательностью, если даже могут существовать противопоставления,в которых подсчитанная здесь выше процентная доля идентичности меньше, чем установленная процентная доля идентичности. Исходные пептиды, раскрываемые здесь, могут быть модифицированы путем замещения одного или нескольких остатков в различных, по возможности отобранных, местах по длине пептидной цепи,если не заявлено иное. Такие замещения могут носить консервативный характер, например, где одна аминокислота заменяется аминокислотой с похожей структурой и характеристиками, так же как при замене гидрофобной аминокислоты на другую гидрофобную аминокислоту. Еще более консервативным будет замещение аминокислот одинакового или похожего размера и химического характера, такое как при замене лейцина на изолейцин. В исследованиях вариаций последовательностей внутри семейств встречающихся в природе гомологичных белков определенные замещения аминокислот переносятся гораздо чаще, чем другие, и они часто проявляют взаимосвязь со сходствами по размеру, заряду, полярности и гидрофобности между исходной аминокислотой и ее заменой; и таковой является основа определения "консервативных замещений". Консервативные замещения определены здесь как обмены внутри одной из последующих пяти групп: группа 1 - малые, алифатические, неполярные или слабо полярные остатки (Ala, Ser, Thr, Pro,Gly); группа 2 - полярные, отрицательно заряженные остатки и их амиды (Asp, Asn, Glu, Gln); группа 3 полярные, положительно заряженные остатки (His, Arg, Lys); группа 4 - крупные, алифатические, неполярные остатки (Met, Leu, Ile, Val, Cys); и группа 5 - крупные, ароматические остатки (Phe, Tyr, Trp). Менее консервативные замещения могут охватывать замещение одной аминокислоты другой, имеющей похожие характеристики, но отличающейся в какой-то степени по размеру, как в случае замещения аланина остатком изолейцина. Высоконеконсервативные замещения могут охватывать замещение кислой аминокислоты другой, которая имеет полярность, или даже такой, которая имеет щелочной характер. Такие "радикальные" замещения не могут, однако, быть отвергнуты как потенциально неэффективные из-за того, что химические эффекты не полностью предсказуемы, и радикальные замещения могут привести к увеличению случайных эффектов, в противном случае не предсказуемых, исходя из обычных химических принципов. Разумеется, в таких замещениях могут участвовать другие структуры, отличающиеся от обычныхL-аминокислот. Таким образом, D-аминокислоты могут быть замещены L-аминокислотами, обычно встречающимися в антигенных пептидах по изобретению и также охватываемые настоящим раскрытием сущности изобретения. Кроме того, аминокислоты, содержащие нестандартные R-группы (т.е. R-группы,отличающиеся от обнаруженных в распространенных 20 аминокислотах природных белков), могут быть также использованы в целях замещения для получения иммуногена и иммуногенных полипептидов в соответствии с настоящим изобретением. Если были произведены замещения на более чем одной позиции для получения пептида с практиче-9 019603 ски эквивалентной или большей антигенной активностью, чем та, что определена ниже, то комбинации таких замещений будут проанализированы для определения того, приведут ли эти комбинации замещений к дополнительным или синергетическим эффектам по отношению к антигенности пептида. По большей части не более четырех позиций внутри пептида должны замещаться одновременно. Термин "Т-клеточный ответ" означает специфическую пролиферацию и активацию эффекторных функций, индуцированных пептидом in vitro или in vivo. Для ЦТЛ, рестриктированных по МНС класса I,эффекторными функциями может быть лизис клеток-мишеней с введенным импульсным способом пептидом, с введенным импульсным способом предшественником пептида или клеток-мишеней, естественно презентирующих пептид, секреция цитокинов, предпочтительно интерферона-, TNF- или ИЛ-2,индуцированная пептидом, секреция эффекторных молекул, предпочтительно гранзимов или перфоринов, индуцированная пептидом, или дегрануляция. Для Т-хелперных клеток, рестриктированных по МНС класса II, эффекторными функциями может быть индуцированная пептидом секреция цитокинов,предпочтительно IFN-, TNF-, ИЛ-4, ИЛ-5, ИЛ-10 или ИЛ-2, или индуцированная пептидом дегрануляция. Возможные эффекторные функции ЦТЛ и Т-хелперных клеток не ограничиваются данным списком. Предпочтительно, если ЦТЛ, специфичные для пептида с SEQ ID NO: 1 по 3, протестированы на замещенные пептиды; концентрация пептида, при которой замещенные пептиды достигают половины максимального роста лизиса относительно фона, составляет не более чем около 1 мМ, предпочтительно не более чем около 1 мкМ, более предпочтительно не более чем около 1 нМ и еще более предпочтительно не более чем около 100 пМ и наиболее предпочтительно не более чем около 10 пМ. Также предпочтительно, чтобы замещенный пептид распознавался ЦТЛ более чем одного индивида, по крайней мере двух и более предпочтительно трех индивидов. Таким образом, эпитопы настоящего изобретения могут быть идентичны встречающимся в природе опухолеассоциированным или опухолеспецифическим эпитопам или могут включать эпитопы, отличающиеся не более чем четырьмя остатками от контрольного пептида, при условии, что они имеют, по существу, идентичную антигенную активность. Стимуляция иммунных ответов находится под воздействием присутствия антигенов, распознающихся иммунной системой хозяина как чужеродные. Открытие существования опухолеассоциированных антигенов сейчас улучшило возможности для использования иммунной системы хозяина для способствования иммунному ответу, специфическому для антигенов-мишеней, экспрессированных на поверхности опухолевых клеток, который благодаря данному механизму действия способен вызывать регрессию, задержку или замедление роста опухоли. Различные механизмы объединения обеих ветвей иммунной системы как гуморальной, так и клеточной, исследуются в настоящее время для иммунотерапии рака. Специфические элементы клеточных иммунных ответов способны к специфическому распознаванию и уничтожению опухолевых клеток. Изоляция цитотоксических Т-клеток (ЦТЛ) из популяций опухоль-инфильтрирующих клеточных популяций или из периферической крови предполагает, что такие клетки играют важную роль в естественной иммунной защите против рака (Cheever et al., 1993; Zeh, III etal., 1999). Основываясь на 415 тканевых препаратах пациентов, страдающих от колоректального рака,Galon и соавторы были в состоянии продемонстрировать, что вид, плотность и местонахождение иммунных клеток в опухолевой ткани являются действительно лучшим прогностическим фактором выживаемости пациентов, чем широко используемая классификация опухолей по TNM (Galon et al., 2006).MHC класса I презентируют пептиды, образующиеся из протеолитического расщепления преимущественно эндогенных белков, DRIPs и более крупных пептидов. Молекулы МНС II класса могут встречаться преимущественно на профессиональных антигенпрезентирующих клетках (АПК) и, в первую очередь, презентировать пептиды экзогенных или трансмембранных белков, которые поглощаются АПК в период эндоцитоза и впоследствии процессируются (Cresswell, 1994). Комплексы из пептида и молекул МНС класса I распознаются CD8-положительными цитотоксическими Т-лимфоцитами, несущими подходящий ТКР (Т-клеточный рецептор), а комплексы из пептида и молекул МНС класса II распознаютсяCD4-положительными хелперными Т-клетками, несущими подходящий ТКР. Хорошо известно, что ТКР,пептид и МНС часто встречаются в стехиометрическом соотношении 1:1:1.CD4-положительные хелперные Т-клетки играют важную роль в индуцировании и поддержании эффективных ответов CD8-положительных цитотоксических Т-клеток (Wang and Livingstone, 2003; Sunand Bevan, 2003; Shedlock and Shen, 2003). Первоначально прайминг и экспансия ЦТЛ в лимфатических узлах поддерживается CD4+ Т-клетками (Schoenberger et al., 1998). Один механизм поэтому может служить руководством для наивных CD8+ клеток к месту функционального взаимодействия CD4+ Т-клетокАПК (Castellino et al., 2006). В итоге образование функциональных клеток памяти CD8+ во многих случаях зависит от поддержки CD4+ Т-клеток (Sun and Bevan, 2003; Janssen et al., 2003). Для этих целей идентификация CD4-положительных Т-клеточных эпитопов, образованных из опухолеассоциированных антигенов (ТАА), может быть чрезвычайно важна для разработки фармацевтических препаратов для инициации противоопухолевых иммунных ответов (Kobayashi et al., 2002; Qin et al., 2003; Gnjatic et al.,2003). В области опухоли Т-хелперные клетки поддерживают благоприятное для ЦТЛ цитокиновое окружение (Qin and Blankenstein, 2000; Mortara et al., 2006) и привлекают эффекторные клетки, к примеру- 10019603 ЦТЛ, естественные киллерные клетки (NK), макрофаги, гранулоциты (Marzo et al., 2000; Hwang et al.,2007). При отсутствии воспаления экспрессия молекул МНС II класса преимущественно рестриктирована по клеткам иммунной системы, в особенности профессиональным антигенпрезентирующим клеткам(АПК), например моноцитам, образованным из моноцитов клеткам, макрофагам, дендритным клеткам. Неожиданно было обнаружено, что опухолевые клетки раковых пациентов экспрессируют молекулы МНС класса II (Dengjel et al., 2006). На моделях млекопитающих животных, например мышах, было показано, что даже при отсутствии эффекторных клеток (т.е. CD8-положительных Т-лимфоцитов), CD4-положительных Т-клеток достаточно для ингибирующего проявления опухолей посредством ингибирования ангиогенеза при секреции интерферон- (IFN) (Qin and Blankenstein, 2000). Также предлагалось прямое уничтожение опухолевых клеток цитотоксическими CD4+ Т-клетками посредством лимфотоксинов и гранзимов В (Penna et al.,1992; Littaua et al., 1992). К тому же было показано, что CD4-положительные Т-клетки, распознающие пептиды из опухолеассоциированных антигенов, презентированные молекулами HLA класса II, могут препятствовать опухолевой прогрессии посредством индукции ответов антител (Ab) (Kennedy et al., 2003). В отличие от опухолеассоциированных пептидов, связывающихся с молекулами HLA класса I, до сих пор было описано лишь небольшое число лигандов класса II опухолеассоциированных антигенов(ТАА). Так как конститутивная экспрессия молекул HLA класса II обычно ограничена клетками иммунной системы (Mach et al., 1996), то возможность изоляции пептидов класса II напрямую из первичных опухолей считалась невозможной. Тем не менее, Dengjel с соавторами недавно удалось идентифицировать ряд эпитопов МНС класса II напрямую из опухолей (WO 2007/028574, ЕР 1760088 B1; (Dengjel et al., 2006). Антигены, которые распознаются опухолевыми специфическими цитотоксическими Тлимфоцитами, то есть их эпитопами, могут быть молекулами, образованными из любого класса белков,таких как ферменты, рецепторы, факторы транскрипции и т.д., которые экспрессированы и по сравнению с неизмененными клетками того же происхождения находятся в повышенном количестве в клетках соответствующей опухоли. Актуальная классификация опухолеассоциированных антигенов (ТАА) включает следующие основные группы (Novellino et al., 2005). 1. Раковые антигены семенника: первые в истории идентифицированные ТАА, которые могут распознаваться Т-клетками (van der Bruggen et al., 1991), принадлежат к этому классу, называвшемуся первоначально "антиген ракового семенника" (СТ), так как его члены экспрессируются в отличных по гистологической структуре опухолях человека, а среди нормальных тканей - только в сперматоцитах/сперматогониях семенника и изредка в плаценте. Так как клетки семенника не экспрессируют молекулы HLA I и II класса, то эти антигены не могут быть распознаны Т-клетками в нормальных тканях и поэтому могут рассматриваться как иммунологически опухолеспецифические. Хорошо известными примерами антигенов СТ являются члены семейства MAGE или NY-ESO-1. 2. Дифференциационные антигены: данные ТАА встречаются в опухолевых и нормальных тканях,из которых образуется опухоль; большинство из них имеется в меланомах и нормальных меланоцитах. Многие из этих линиеспецифических белков меланоцитов участвуют в биосинтезе меланина и поэтому не являются опухолеспецифическими, однако, несмотря на это, они широко применяются в противораковой терапии. Примеры включают, но не ограничиваются, тирозиназу и Melan-A/MART-1 для меланомы или PSA для рака простаты. 3. Гиперэкспрессированные ТАА: гены, кодирующие широко экспрессированные ТАА, были обнаружены в отличных по гистологической структуре опухолях, а также во многих нормальных тканях, в основном, с более низким уровнем экспрессии. Возможно, что многие эпитопы, процессируемые и потенциально презентируемые нормальными тканями, находятся ниже порогового уровня для распознавания Т-клетками, в то время как их гиперэкспрессия в опухолевых клетках может инициировать противораковый ответ, нарушая установившуюся ранее толерантность. Известными примерами ТАА этого класса являются Her-2/neu, сурвивин, теломераза или WT1. 4. Опухолеспецифические антигены: данные уникальные ТАА образуются из мутаций нормальных генов (таких как -катенин, CDK4 и т.д.). Некоторые из этих молекулярных изменений ассоциированы с неопластической трансформацией и/или прогрессией. Опухолеспецифические антигены, в основном,способны индуцировать сильные иммунные ответы, не заключая в себе риска аутоиммунных реакций по отношению к нормальным тканям. С другой стороны, данные ТАА в большинстве случаев релевантны только для определенной опухоли, на которой они были идентифицированы, и обычно не являются общими для многих отдельных опухолей. 5. ТАА, образующиеся из абнормальных пост-трансляционных модификаций: такие ТАА могут образоваться из белков, которые не являются ни специфическими, ни гиперэкспрессированными в опухолях, однако, несмотря на это, становятся опухолеассоциированными в ходе посттрансляционных процес- 11019603 сов, происходящих первоначально в опухолях. Примеры для этого класса берут свое начало в измененных паттернах гликозилирования, приводящих к новым эпитопам в опухолях, как в случае MUC1, или таких процессах, как белковый сплайсинг во время деградации, который может или не может быть опухолеспецифическим (Hanada et al., 2004; Vigneron et al., 2004). 6. Онковирусные белки: данные ТАА являются вирусными белками и могут играть ведущую роль в онкогенном процессе, и, так как они являются чужеродными (не человеческого происхождения), они могут провоцировать Т-клеточный ответ. Примерами таких белков являются вирусные белки человеческой папилломы типа 16, Е 6 и Е 7, которые экспрессированы в карциноме шейки матки. Для того чтобы белки были узнаны цитотоксическими Т-лимфоцитами в качестве опухолеспецифического или -ассоциированного антигена, и в целях применения в терапии должны выполняться особые предварительные требования. Антиген должен экспрессироваться преимущественно опухолевыми клетками, а не здоровыми тканями или в сравнительно малом объеме. В дальнейшем желательно, чтобы соответствующий антиген не только присутствовал в каком-либо виде опухоли, но и также имел высокую концентрацию (т.е. число копий соответствующего пептида на клетку). Опухолеспецифические и опухолеассоциированные антигены часто образованы из белков, напрямую задействованных в трансформации нормальной клетки в опухолевую, в связи с функцией, например при контроле клеточного цикла или подавлении апоптоза. Кроме того, мишени нисходящего пути белков, напрямую являющихся причиной трансформации, могут быть также представлены в повышенном количестве и, таким образом, косвенно опухолеассоциированными. Такие косвенно опухолеассоциированные антигены могут также быть мишенями вакцинационного подхода (Singh-Jasuja et al., 2004). В обоих случаях необходимо, чтобы эпитопы присутствовали в аминокислотной последовательности антигена, поскольку такой пептид ("иммуногенный пептид"), который образован из опухолеассоциированного антигена, должен вести in vitro или invivo к Т-клеточному ответу. В основном, любой пептид, способный связываться с молекулой МНС, может выполнять функцию Т-клеточного эпитопа. Предварительным условием для индукции Т-клеточного ответа in vitro или in vivo является присутствие Т-клетки с соответствующим ТКР и отсутствие иммунологической толерантности к данному конкретному эпитопу. Поэтому опухолеассоциированные антигены (ТАА) являются отправным пунктом для разработки противораковой вакцины. Методы идентификации и характеристики ТАА основаны на использовании ЦТЛ, которые могут быть изолированы у пациентов или здоровых субъектов, или же они основаны на генерировании дифференциальных транскрипционных профилей или дифференциальных паттернов пептидной экспрессии между опухолевыми и нормальными тканями (Lemmel et al., 2004; Weinschenk et al.,2002). Однако идентификация генов, гиперэкспрессированных в опухолевых тканях или человеческих опухолевых клеточных линиях или же селективно экспрессированных в таких тканях или клеточных линиях, не обеспечивает точной информацией об использовании антигенов, транскрибированных с данных генов, в иммунотерапии. Причиной тому то, что только отдельная субпопуляция эпитопов этих антигенов подходит для такого применения, так как Т-клетка с соответствующим ТКР должна быть в наличии,и необходимо, чтобы отсутствовала или была минимальной иммунологическая толерантность к этому конкретному эпитопу. Поэтому важно выбрать лишь те пептиды из гиперэкспрессированных или селективно экспрессированных белков, которые презентируются в соединении с молекулами МНС, против которых может быть обнаружена функциональная Т-клетка. Такая функциональная Т-клетка определяется как Т-клетка, которая при стимуляции специфическим антигеном может быть распространена клонально и способна к выполнению эффекторных функций ("эффекторная Т-клетка"). Т-хелперные клетки играют важную роль в управлении эффекторной функцией ЦТЛ в противоопухолевом иммунитете. Эпитопы Т-хелперных клеток, инициирующие ответы Т-хелперных клеток типаTH1, поддерживают эффекторные функции CD8-положительных киллерных Т-клеток, которые включают цитотоксические функции, направленные против опухолевых клеток, проявляющих опухолеассоциированные пептиды/МНС-комплексы на их клеточной поверхности. Таким образом, опухолеассоциированные пептидные эпитопы Т-хелперных клеток, одни или в комбинации с другими опухолеассоциированными пептидами, могут служить в качестве активных фармацевтических ингредиентов вакцинных композиций, которые стимулируют противоопухолевые иммунные ответы. Так как оба вида ответов, зависящие от CD8 и от CD4, вносят свой вклад в противоопухолевый эффект сообща и усиливая друг друга, то идентификация и характеристика опухолеассоциированных антигенов, распознаваемых как CD8+ ЦТЛ (лиганд: молекула МНС I класса + пептидный эпитоп), так и CD4 положительными хелперными Т-клетками (лиганд: молекула МНС II класса + пептидный эпитоп) являются важными при разработке противоопухолевых вакцин. Ввиду серьезных побочных эффектов и расходов, связанных с лечением рака, крайне необходимы улучшенные методы прогнозирования и диагностики. Поэтому существует необходимость в идентификации других факторов, репрезентирующих биомаркеры для рака вообще и глиобластомы в частности. Кроме того, существует необходимость в идентификации факторов, которые могут быть использованы при лечении рака вообще и глиобластомы в частности.- 12019603 Кроме того, не существует признанного подхода к лечению пациентов с раком предстательной железы с биохимическим рецидивом после радикальной простатэктомии, обычно вызываемым резидуальным остатком опухоли in situ при наличии локально прогрессирующего роста опухоли. Желательны были бы новые терапевтические подходы, которые бы сопровождались низкой смертностью с адекватной терапевтической эффективностью по сравнению с имеющимися на данный момент терапевтическими подходами. Данным изобретением обеспечиваются пептиды, которые полезны для лечения глиобластомы, рака предстательной железы и других опухолей, которые гиперэкспрессируют сурвивин. Как непосредственно показал масс-спектрометрический анализ, эти пептиды естественно презентировались молекуламиHLA на пробах первичной глиобластомы человека (см. пример 1 и фиг. 1) или в случае SEQ ID NO: 1 и 2,предсказанных по алгоритму SYFPEITHI (Rammensee et al., 1995), они должны беспорядочно связываться с аллелями HLA-DR, HLA-DRB101, DRB103, DRB104, DRB111 и DRB115 (см. приложение). Основываясь на этих данных и частотности данных часто встречающихся аллелей DRB1 (Mori et al.,1995; Chanock et al., 2004), можно предположить, что 92% А 02-положительных европеоидов экспрессируют по крайней мере один аллель DRB1, который связывается с данными пептидами (SEQ ID NO: 1 поSEQ ID NO: 3). SEQ ID NO: 2 содержит такую же центральную последовательность как и SEQ ID NO: 1,продленную двумя N-терминальными аминокислотами из естественной последовательности сурвивина,содержа описанный Т-клеточный эпитоп I класса из сурвивина (Schmitz et al., 2000). SEQ ID NO: 3 содержит такую же последовательность как и SEQ ID NO: 1, где последняя С-терминальная аминокислота модифицирована из аспарагина (N) до аспарагиновой кислоты (D). Исходный ген, из которого образованы c SEQ ID NO: 1 по SEQ ID NO: 3 сурвивин, был представлен в гиперэкспрессированном состоянии при глиобластоме, опухоли предстательной железы, раке молочной железы, раке пищевода, колоректальном раке, светлоклеточной почечной карциноме, раке легких, ЦНС, яичника, меланоме (Tamm et al. 1998), раке поджелудочной железы, плоскоклеточной карциноме, лейкемии и медуллобластоме в сравнении с нормальными тканями (см. пример 2 и фиг. 2), демонстрируя высокую степень ассоциации данных пептидов с опухолью, т.е. эти пептиды в большом количестве презентируются на опухолевой ткани, но не на нормальных тканях. Связанные с HLA пептиды могут распознаваться иммунной системой, специально Тлимфоцитами/Т-клетками. Т-клетки могут разрушать клетки, презентирующие распознанный комплексHLA/пептид; к примеру опухолевые клетки глиобластомы, презентирующие образованные из сурвивина(c SEQ ID NO: 1 по SEQ ID NO: 3). Т-хелперные клетки, активированные образованными из сурвивина пептидами, могут ингибировать васкуляризацию опухоли, могут привлекать эффекторные клетки иммунной системы и способствовать праймингу ЦТЛ, пролиферации и устойчивому CD8+ Т-клеточному ответу. Как было показано, все пептиды настоящего изобретения в состоянии стимулировать Т-клеточные ответы (см. пример 3 и фиг. 3). Таким образом, пептиды полезны для генерирования иммунного ответа у пациента, который может уничтожать опухолевые клетки. Иммунный ответ у пациента может быть индуцирован при непосредственном введении описанных пептидов или подходящих веществпредшественников (к примеру, удлиненных пептидов, белков или нуклеиновых кислот, кодирующих эти пептиды) пациенту, в идеальном случае в комбинации с веществом, усиливающим иммуногенность (т.е. адъювантом). От иммунного ответа, вызванного такой терапевтической вакцинацией, может ожидаться,что он будет высокоспецифическим против опухолевых клеток, так как целевые пептиды настоящего изобретения не презентируются на нормальных тканях со сравнимыми количествами копий, предотвращая тем самым риск нежелательных аутоиммунных реакций против нормальных клеток у пациента. Фармацевтические композиции включают пептиды как в свободной форме, так и в форме фармацевтически приемлемой соли. Используемое здесь понятие "фармацевтически приемлемая соль" относится к производным раскрытых пептидов, причем пептид модифицирован путем получения кислотных или щелочных солей агента. Например, кислотные соли получают из свободного основания (типично, где нейтральная форма лекарственного средства имеет нейтральную группу -NH2) с применением реакции с подходящей кислотой. Подходящие кислоты для получения кислотных солей включают как органические кислоты, например уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, оксиянтарную кислоту, малоновую кислоту, янтарную кислоту, малеиновую кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, р-толуолсульфокислоту, салициловую кислоту и подобные, так и неорганические кислоты, например хлористо-водородную кислоту,бромисто-водородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и подобные. И наоборот, приготовление щелочных солей кислотных составляющих, которые могут присутствовать на пептиде, приготовляются при использовании фармацевтически приемлемого основания, такого как гидроксид натрия, гидроксид калия, гидроксид аммония, гидроксид кальция, триметиламин или подобных. В одном особенно предпочтительном воплощении фармацевтические композиции включают пептиды в виде солей уксусной кислоты (ацетаты) или хлористо-водородной кислоты (хлориды).- 13019603 Кроме того, пептиды настоящего изобретения полезны не только для лечения рака, но и также в качестве диагностических средств. Так как пептиды были получены из глиобластомы и так как было определено, что данные пептиды не присутствуют в нормальных тканях, то эти пептиды могут быть использованы для постановки диагноза о наличии рака. Присутствие заявленных пептидов на тканевых биоптатах может помочь патологу в постановке диагноза рака. Детекция конкретных пептидов с помощью антител, масс-спектрометрии или других методов, известных из уровня техники, могут дать знать патологу, что ткань является злокачественной или воспаленной или же поражена заболеванием общего порядка. Присутствие групп пептидов может позволить классифицировать или выделить подклассы пораженных тканей. Детекция пептидов на образцах пораженной заболеванием ткани может позволить принять решение о преимуществах от терапии, воздействующей на иммунную систему, в особенности, если Т-лимфоциты,как известно или ожидается, задействованы в механизме действия. Отсутствие экспрессии МНС является хорошо описанным механизмом, при котором инфицированные или злокачественные клетки уклоняются от иммунного надзора. Таким образом, присутствие пептидов показывает, что этот механизм не используется проанализированными клетками. Пептиды могут использоваться в анализе ответов лимфоцитов против таковых пептидов, таких как Т-клеточные ответы или ответы антител против пептида или пептида в комплексе с молекулами МНС. Данные иммунные ответы лимфоцитов могут использоваться в качестве прогностических маркеров для принятия решения о дальнейших этапах терапии. Данные иммунные ответы могут также использоваться в качестве суррогатных маркеров в иммунотерапевтических подходах, направленных на индуцирование ответов лимфоцитов с помощью различных средств, как, например, вакцинации белком, нуклеиновыми кислотами, аутологичными материалами, адаптивного переноса лимфоцитов. При генной терапии ответы лимфоцитов на пептиды могут быть рассмотрены в рамках оценки побочных эффектов. Мониторинг ответов лимфоцитов может также быть ценным инструментом для последующих обследований в случае трансплантации, к примеру, для детекции реакций "хозяин против трансплантата" и "трансплантат против хозяина". Пептиды могут использоваться для генерации и разработки специфических антител к комплексам МНС/пептид. Они могут быть использованы в терапии, нацеливающей токсины или радиоактивные вещества на пораженную ткань. Другим видом использования данных антител может быть "нацеливание" радионуклидов на пораженную ткань в целях визуализации, такой как PET (позитронно-эмиссионная томография). Это может помочь в обнаружении небольших метастазов или в определении размера и точного расположения пораженных тканей. Кроме того, пептиды могут быть использованы для верификации диагноза патолога, поставленного на основании биоптата. В табл. 3 показаны пептиды в соответствии с настоящим изобретением, соответствующие им номера последовательностей SEQ ID NO; аллели HLA, с которыми связываются соответствующие пептиды, и исходные белки, из которых могут быть образованы данные пептиды. Особенно интересен факт, что пептид в соответствии с SEQ ID NO: 2 связывается с HLA-DR в равной степени, как и с HLA-A02, таким образом, вызывая два различных ответа. Таблица 3 Пептиды настоящего изобретения Экспрессия BIRC5 (сурвивин), члена семейства белков-ингибиторов апоптоза (IAP), содержится в повышенном количестве в фетальных тканях и различных видах рака человека и со значительно сниженной экспрессией в нормальных взрослых дифференцированных тканях, в особенности, если у них низкий индекс пролиферации. Предполагается, что сурвивин способен к регуляции как клеточной пролиферации, так и отмирания апоптических клеток. Хотя сурвивин обычно находится на цитоплазматическом участке клетки и ассоциируется с плохим прогнозом при раке, также сообщалось о ядерной локализации,указывающей на благоприятный прогноз (O'Driscoll et al., 2003). Регуляцию сурвивина и с его помощью описывают несколькими механизмами. Предполагается, что сурвивин ассоциирован с молекулярным шапероном Hsp60. In vivo, Hsp60 с избытком экспрессирован в первичных опухолях человека по сравнению с соответствующими нормальными тканями. Экстренная абляция Hsp60 небольшой интерферирующей РНК дестабилизирует митохондриальный пул сурвивина, вызывает митохондриальную дисфункцию и активирует каспазазависимый апоптоз (Ghosh et al., 2008). Кроме того, ингибирование Ras- 14019603 приводит к снятию сурвивинового "тормоза" на апоптозе и активации митохондриального апоптотического каскада реакций. В особенности в глиобластоме устойчивость к апоптозу может быть ликвидирована посредством Ras-ингибитора, мишенью которого является сурвивин (Blum et al., 2006). Вероятно,существует взаимосвязь между NF-B гиперактивностью в глиомах и гиперэкспрессией сурвивина, одного из генов-мишеней NF-B. Таким образом, активированные NF-B антиапоптотические гены гиперэкспрессированы в пробах опухолей. В особенности, в глиобластоме обнаруживаются очень высокие уровни экспрессии сурвивина (Angileri et al., 2008). Предполагается, что гиперэкспрессия сурвивина в глиомах головного мозга может играть важную роль в злокачественной пролиферации, антиапоптозе и ангиогенезе (Zhen et al., 2005; Liu et al., 2006). Было произведено несколько анализов для изучения экспрессии сурвивина и его влияния на выживаемость при глиобластоме. В качестве обобщения экспрессия сурвивина, в особенности одновременная экспрессия в ядре и цитоплазме в астроцитных опухолях, была значительно ассоциирована со степенью злокачественности (с наибольшей экспрессией сурвивина в глиобластоме) и более короткими общими сроками выживаемости по сравнению с пациентами, у которых были сурвивин-негативные опухоли (Kajiwara et al., 2003; Saito et al., 2007; Uematsu et al., 2005; Mellai etal., 2008; Grunda et al., 2006; Xie et al., 2006; Sasaki et al., 2002; Chakravarti et al., 2002). Гиперэкспрессия сурвивина описывалась также для других опухолевых форм. При раке молочной железы гиперэкспрессия сурвивина ассоциирована с более высокой степенью злокачественности и более коротким сроком выживаемости без заболевания (Yamashita et al., 2007; Al-Joudi et al., 2007; Span et al.,2004) Как было зафиксировано, в клеточных линиях рака пищевода, промоторная активность сурвивина была в 28,5 раз выше, чем в нормальных тканях (Sato et al., 2006). При колоректальном раке экспрессия сурвивина также ассоциирована с патологической степенью и метастазами лимфатических узлов (Tan etal., 2005). Как было показано, агрессивность светлоклеточной почечной карциномы ассоциирована с экспрессией сурвивина. Кроме того, экспрессия сурвивина обратно пропорционально ассоциирована со специфичной для рака выживаемостью (Kosari et al., 2005). Экспрессия сурвивина может быть обнаружена в наборе неоплазмов с участием кератиноцитов и гиперпролиферативных поражениях кожи, но не в нормальной коже (Bowen et al., 2004). В клеточных линиях рака поджелудочной железы сурвивин был амплифицирован в 58% проанализированных клеточных линий (Mahlamaki et al., 2002). При плоскоклеточной карциноме экспрессия сурвивина может помочь идентифицировать случаи с более агрессивным и инвазивным клиническим фенотипом (Lo et al., 2001). Так как сурвивин является такой многообещающей мишенью при лечении рака, то исследования с использованием образованных из сурвивина пептидов показали, что сурвивин является иммуногенным для пациентов с опухолями, вызывая ответы, опосредованные CD8+ Т-клетками. В дополнение к этому,сурвивин специфически стимулировал CD4+ Т-клеточную реактивность лимфоцитов в периферической крови у тех же пациентов (Casati et al., 2003; Piesche et al., 2007). Сурвивин (SVN, BIRC) гиперэкспрессирован во множестве раковых форм. Итак, гиперэкспрессия сурвивина в целом, как считается, ассоциирована с более коротким общим сроком выживаемости и более высокими степенями злокачественности.Piesche (2006) раскрыл в рамках своего исследования (см. также (Piesche et al., 2007 эпитопыкандидаты, рестриктированные по МНС II класса и HLA II класса, из сурвивина (SVN) и протеиназы-3(PR3), которые были определены с помощью компьютерной программы TEPITOPE (Bian and Hammer,2004). В результате анализа на TEPITOPE было получено 6 эпитопов-кандидатов для SVN и 11 эпитоповкандидатов для PR3 с большой вероятностью связывания для различных аллелей HLA-DR. Данные 17 пептидов были использованы в иммунологических экспериментах с Т-клетками после синтеза и хроматографической очистки. Различные длины пептидов, полученные из перекрывающихся эпитопов, которые были учтены в одном пептиде (табл. 4). Таблица 4 Названия, позиция АА и последовательности АА синтетических SVN пептидов,раскрытых в работе Piesche 2006 Примечания: S88 является фактически S98, таким образом, Piesche и соавторы могли ошибаться в определении позиции данного эпитопа.Piesche проводил эксперименты по титрации с соответствующими пептидами для определенияHLA-аффинности пептида или HLA/TCR-авидности пептида. Чем ниже концентрация пептида, тем выше аффинность связывания пептидных эпитопов с молекулами МНС, что является важной предпосылкой для естественной презентации "истинных" Т-клеточных эпитопов из внутриклеточного процессинга белкового антигена. Измеренная полумаксимальная пролиферативная активность пептид-специфических Тклеточных клонов составляла 50 нМ для S10, 400 - 700 нМ для S40, 2000 - 3000 нМ для S88 и 100 - 300 нМ для Р 58. Далее Piesche раскрывает, что лишь SVN-пептид S10 вызывал специфическую Т-клеточную пролиферацию во время воздействия рекомбинантным SVN-белком. Это было продемонстрировано для трехS11-специфических Т-клеточных клонов различных доноров. Piesche и соавторы исследовали процессинг и презентацию SVN пептидных эпитопов из естественного антигена посредством кокультивирования пептид-специфических Т-клеточных клонов с ДК с введенным импульсным способом SVN-белком. Только SVN-пептид S10 был в состоянии вызвать специфическую Т-клеточную пролиферацию во время воздействия рекомбинантным SVN-белком. Это было продемонстрировано для трех S10-специфических Т-клеточных клонов различных доноров. Для PR3-специфических Т-клеточных клонов специфической пролиферации в ответ на естественный антиген обнаружено не было. Кроме того, опухолевые антигены из апоптических или некротических опухолевых клеток были усвоены АПК in vivo, процессированы независимо от МНС II и презентированы CD4+ Т-клеткам. Для распознавания истинных S10 эпитопов Т-клетками в ДК импульсным способом были введены лизаты опухолевых клеток из различных SVN-положительных опухолевых клеточных линий. Для S10 эпитопа in vitro детектировалось непосредственное распознавание ДК с введенным импульсным способом лизатом из опухолевых клеточных линий Karpas-422, Jurkat и HL-60. Это было продемонстрировано по крайней мере для трех S10-специфических Т-клеточных клонов различных доноров. Чтобы показать, что эпитоп S10 может вызывать иммунный ответ у раковых пациентов, должно быть подтверждено присутствие соответствующих CD4+ Т-лимфоцитов в крови пациентов с опухолевыми заболеваниями. МПК различных пациентов изолировали и стимулировали пептидом S10. В этих целях у пациентов брали пробы МПК до начала лечения и после начала цитотоксической терапии; моноциты и В-клетки, содержащиеся во фракции МПК, использовали в качестве антиген-/пептидпрезентирующих клеток. После культивирования в течение одной недели клетки анализировали с учетом их пептид-специфической пролиферации с использованием метода включения [3 Н]-тимидина. Из 13 обследованных пациентов у трех имелся обнаруживаемый пролиферативный ответ in vitro. Потенциальное применение пептидных эпитопов в иммунотерапии обязательно зависит от того, реагируют ли пептид-специфические CD4+ Т-лимфоциты на соответствующий антиген. Распознавание естественно процессированного белкового антигена в виде "подлинных" или "истинных" эпитопов, в принципе, подвержено влиянию различных факторов.Piesche показал, что распознавание белка могло быть установлено лишь для SVN-эпитопа S10. Для других идентифицированных пептидов (SVN: S40, S88; PR3: Р 58, P216, P235 и Р 239) распознавание белка не могло быть установлено. Piesche и соавторы заявили, что во время эндосомального протеолиза важно,чтобы фрагменты настоящей последовательности не были деградированы, как в случае "криптических" эпитопов. В отличие от эпитопов, рестриктированных по МНС класса I, молекулы МНС II класса могут поглощать пептиды различных длин (12-28); поэтому не требуется протеолитического расщепления пептидных эпитопов до указанной длины. Неожиданным образом, изобретатели показывают в настоящем изобретении, что другой эпитопSEQ ID NO: 1, образованный из сурвивина, который короче, чем S88, но имеющий также перекрывающиеся участки, вызывал сильный иммунный ответ у 16 из 19 пациентов in vivo (см. пример 4). Из-за высокого полиморфизма локуса HLA-DR это также является подтверждением высоко беспорядочного связывания пептида с SEQ ID NO: 1, как и было предсказано, так как иммунный ответ может быть вызван только пептидом, связанным с молекулой HLA. Важность раковых форм, для которых в литературе была описана гиперэкспрессия сурвивина, проиллюстрирована в табл. 2. Формы рака, для которых гиперэкспрессия сурвивина является обычно описываемым свойством, стали причиной смерти в 415000 случаев в 2007 г. (см. табл. 1).Piesche и соавторы (2006) показали in vitro присутствие подходящих предшественников для пептидаS88 у трех из четырех доноров с перекрывающимися аллелями HLA-DR. В данном случае совокупность фактов слишком мала, чтобы из этого можно было вывести беспорядочное связывание S88 с HLA-DR, так как полученные результаты могут быть объяснены связыванием с двумя различными аллелями HLA-DR(например, DR3 и DR11 или DR1 и DR3 или DR11 и DR4). Помимо этого, индикаторы стимуляции, полученные из довольно не специфического анализа пролиферации (включение [3 Н]-тимидина) из цельных культур МПК, довольно низки, положительного контроля нет (к примеру, смесь хорошо охарактеризованных, сильно иммуногенных вирусных пептидов), и также нет подходящих негативных контролей(стимуляция во время анализа пролиферации с нерелевантным контрольным пептидом). Данные по частотности предшественников не были подтверждены вторым видом анализа. В патенте WO 2007/036638 (Wang et al.), среди прочих, раскрываются сурвивиновые пептиды аминокислотных последовательностей(IC50 1000 нМ), описан участок с 84 по 113. Несмотря на это, пептиды, исследованные Wang и соавторами, проявляют очень широкий спектр свойств связывания по отношению к различным молекуламHLA, и указанные свойства связывания радикально отличаются даже внутри указанного региона, как было описано, если пептиды изменены в своей последовательности одной или двумя аминокислотами. Пептид настоящего изобретения с SEQ ID NO: 3 (TLGEFLKLDRERAKD; пептид BIR-002a) включает последовательность пептида BIR-002 настоящего изобретения с SEQ ID NO: 1, за исключением того, что на С-конце указанный пептид оканчивается аспарагиновой кислотой (D) вместо аспарагина (N). Пептид перекрывается с пептидом Piesche S88, который содержит последние три аминокислоты NKI. Как было упомянуто выше, пептид S88 не был активным в специфическом анализе на Т-клеточную пролиферацию во время воздействия рекомбинантным белком SVN. В отличие от этого, пептид BIR-002a давал сильный, относящийся к МНС II иммунный ответ. Не желая привязываться к теории, предполагается, что ферментативная конверсия аспарагина в аспарагиновую кислоту через аспарагиназу происходит in vivo,и, таким образом, С-терминальная аминокислота модифицирована (пептид активируется и/или активируется впоследствии). Так как С-терминальный аспарагин пептида Piesche S88 заблокирован двумя аминокислотами, указанный пептид не активен (в дальнейшем показывая важность изменения одной аминокислоты в активности данного пептида). Более того, было замечено, что иммунные ответы и активности других пептидов, включающих Стерминальный аспарагин (такие как, например, SEQ ID NO: 1), могут также зависеть от С-терминальной конверсии в кислую аминокислоту, в частности аспарагиновую кислоту. Таким образом, в одном аспекте настоящего изобретения пептид в соответствии с SEQ ID NO: 1 может рассматриваться как "пролекарство" для SEQ ID NO: 3, которой обеспечивается активный пептид в соответствии с SEQ ID NO: 3 после ферментативной конверсии. Должно быть понятно, что настоящее изобретение также охватывает химическую конверсию аминокислоты, особенно аспарагина, и спонтанное деамидирование при потере одной молекулы воды. Кроме того, примеры, показывающие активность для пептида в соответствии с SEQ ID NO: 1 поддерживают также активность для модифицированного пептида в соответствии с SEQ ID NO: 3. В контексте настоящего изобретения может, кроме того, быть обнаружено, что растворимости пептидов в области пептида BIR-002 (участок с 84 по 113) радикально отличаются для очень похожих пептидов. Необходимо отметить, что у Wang и соавторов пептиды участка, близкого к пептиду BIR-002, были фактически не растворимы, а измерения связывания не могли быть выполнены. Растворимости были определены следующим образом:BIR-002 (SEQ ID NO: 1): 32,9 мг/мл (ацетат),BIR-002a (SEQ ID NO: 3) (D вместо N на С-терминальном конце): 23,5 мг/мл,BIR-014 (соотносимый пептид по Wang, SEQ ID NO: 25): 99,5 мг/мл. Еще один другой аспект настоящего изобретения относится к антителу, которое специфически связывается с главным комплексом гистосовместимости человека (МНС) I или II класса в комплексе с HLAрестриктированным антигеном (именуемое в дальнейшем также "комплекс-специфическое антитело"). Еще один другой аспект настоящего изобретения относится затем к методу получения указанного антитела, специфически связывающегося с главным комплексом гистосовместимости человека (МНС) I илиII класса в комплексе с HLA-рестриктированным антигеном, метод, включающий иммунизацию полученного с помощью генной инженерии нечеловеческого млекопитающего, включающего клетки, экспрессирующие указанный главный комплекс гистосовместимости человека (МНС) I или II класса с растворимой формой молекулы МНС I или II класса в комплексе с указанным HLA-рестриктированным антигеном; изолирование молекул мРНК из антитела, вырабатывающего клетки указанного нечеловеческого млекопитающего; получение библиотеки фагового отображения, отображающей белковые молекулы,закодированные указанными молекулами мРНК; и изолирование по крайней мере одного фага из указанной библиотеки фагового отображения, указанный по крайней мере один фаг, отображающий указанное антитело, специфически связываемое с указанным главным комплексом гистосовместимости человека(МНС) I или II класса, в комплексе с указанным HLA-рестриктированным антигеном. Соответствующие методы для получения таких антител и одноцепочных главных комплексов гистосовместимости I класса,в равной степени, как и другие инструменты для получения данных антител, раскрыты в WO 03/068201,WO 2004/084798, WO 01/72768, WO 03/070752 и у Cohen C.J., Denkberg G., Lev A., Epel M., Reiter Y. Recombinant antibodies with MHC-restricted, peptide-specific, T-cell receptor-like specificity: new tools to studyApr. 15; 170(8): 4349-61, которые в целях настоящего изобретения в открытой форме включены сюда в своей целостности путем ссылки. Предпочтительно, если антитело связывается с аффинностью связывания ниже 20 нмоль, предпочтительно ниже 10 нмоль с комплексом, который называется "специфическим" в контексте настоящего изобретения. Термин "антитело" используется здесь в широком смысле и включает как поликлональные, так и моноклональные антитела. В дополнение к интактным молекулам иммуноглобулина в термин "антитела" включены также фрагменты или полимеры таких молекул иммуноглобулина и гуманизированные версии молекул иммуноглобулина при условии, что они проявляют одно из желаемых свойств (например, являются комплекс-специфическим антителом, как упомянуто выше, доставляют токсин к раковой клетке,экспрессирующей раковый ген-маркер на повышенном уровне, и/или ингибируют активность ракового полипептида-маркера, такого как сурвивин), описанных здесь. Если возможно, антитела по изобретению могут быть куплены в коммерческих источниках. Антитела по изобретению могут быть также генерированы при использовании хорошо известных методов. Специалисту будет понятно, что для генерирования антител по изобретению могут использоваться либо раковые полипептиды-маркеры полной длины, либо их фрагменты. Полипептид, необходимый для генерирования антитела по изобретению, может быть частично или полностью очищенным из естественного источника или же может быть получен с помощью техники рекомбинантной ДНК. Например, кДНК, кодирующая сурвивиновый полипептид или его фрагмент, может быть экспрессирована в прокариотические клетки (например, бактерии) или эукариотические клетки (например, клетки дрожжей, насекомых или млекопитающих), после чего рекомбинантный белок может быть очищен и использован для получения препарата из моноклонального или поликлонального антитела, которое специфически связывается с раковым полипептидом-маркером, использованным для получения антитела. Комплекс-специфические антитела всегда будут получать, как описано выше. Специалисту данной области будет известно, что получение двух или более различных панелей моноклональных или поликлональных антител увеличивает вероятность получения антитела со специфичностью и аффинностью, необходимыми для предназначенного для него использования (например,ELISA, иммуногистохимия, визуализация in vivo, терапия на основе иммунотоксина). Антитела протестированы на желаемую для них активность с помощью известных методов в соответствии с целью использования антител (например, ELISA, иммуногистохимия, иммунотерапия и т.д.; для получения дальнейшей информации по генерированию и испытанию антител см., например, Harlow and Lane,Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1988). Например, антитела могут быть протестированы с помощью анализов ELISA, метода иммунного блотинга(Western-blot), иммуногистохимического окрашивания законсервированных формальдегидом раковых образцов или замороженных тканевых срезов. После их первоначальной характеристики in vitro антитела, предназначаемые для терапевтического или диагностического использования in vivo тестируются в соответствии с известными клиническими методами анализа. Термин "моноклональное антитело", используемый здесь, обозначает антитело, полученное из, по существу, гомогенной популяции антител, т.е. отдельные антитела внутри популяции идентичны за исключением возможных естественных мутаций, которые могут быть представлены в небольших количествах. Моноклональные антитела здесь специфически включают "химерные" антитела, в которых участок тяжелой и/или легкой цепи идентичен или гомологичен с соответствующими последовательностями антител, образованных из конкретных видов или относящихся к конкретному классу или подклассу антител, в то время как остальная(ые) цепь(и) идентична с или гомологична с соответствующими последовательностями антител, образованных из других видов или относящихся к другому классу или подклассу антител, в равной степени, как и фрагменты таких антител, пока они проявляют желаемую антагонистическую активность (патент США 4816567). Моноклональные антитела по изобретению могут быть приготовлены при использовании гибридомного метода. В рамках гибридомного метода мышь или другое подходящее животное-хозяин обычно иммунизируется иммунизирующим веществом, чтобы инициировать лимфоциты, которые вырабатывают или способны вырабатывать антитела, которые будут специфически связываться с иммунизирующим веществом. Альтернативно лимфоциты могут быть иммунизированы in vitro. Моноклональные антитела могут быть также получены с помощью методов с рекомбинантной ДНК, таких как описываемые в патенте США 4816567. ДНК, кодирующая моноклональные антитела по изобретению, может быть без труда изолирована и разделена на последовательности с помощью стандартной методики (например, при использовании олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи мышиных антител).In vitro-методы также подходят для приготовления моновалентных антител. Расщепление антител для получения их фрагментов, в особенности Fab-фрагментов, может быть произведено при использовании стандартных техник, известных из уровня техники. К примеру, расщепление может производиться при использовании папаина. Примеры расщепления под воздействием папаина описываются в заявкеWO 94/29348, опубликованной 22 декабря 1994 г., и в патенте США 4342566. Расщепление антител под воздействием папаина обычно приводит к двум идентичным фрагментам, связывающимся с антигеном, называемым Fab-фрагментами, каждый из которых имеет отдельный антиген-связывающий сайт и остаточный Fe-фрагмент. В результате воздействия пепсином получается фрагмент, который имеет два антиген-комбинирующих сайта и все еще способен к кросс-линкингу антигена. Фрагменты антитела, как связанные с другими последовательностями, так и не связанные, могут также включать вставки, делеции, замещения или другие избранные модификации конкретных участков или специфических аминокислотных остатков при условии, что активность фрагмента незначительно изменена или повреждена по сравнению с немодифицированным антителом или фрагментом антитела. Данные модификации могут обеспечивать некоторые дополнительные свойства, такие как добавление/удаление аминокислот, способных к дисульфидному связыванию, увеличение их биостойкости, изменение их секреторных характеристик и т.д. В любом случае фрагмент антитела должен обладать свойством биоактивности, таким как активностью связывания, регуляцией связывания на связывающем домене и т.д. Функциональные или активные участки антитела могут быть идентифицированы при мутагенезе специфического участка белка с последующей экспрессией и контролем экспрессированного полипептида. Такие методы полностью очевидны для опытного специалиста данной области техники и могут включать сайт-специфический мутагенез нуклеиновой кислоты, кодирующей фрагмент антитела. Антитела по изобретению могут в дальнейшем включать гуманизированные антитела или человеческие антитела. Гуманизированные формы нечеловеческих (например, мышиных) антител - это химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab' или другие антиген-связывающие субпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают человеческие иммуноглобулины (антитело-реципиент), в которых остатки из определяющего комплементарного участка (CDR) реципиента замещены остатками из CDR нечеловеческих видов (донорское антитело), таких как мыши, крысы или кролики, имеющими желаемую специфичность, аффинность и емкость. В некоторых случаях остатки Fv-каркаса (FR) человеческого иммуноглобулина замещены соответствующими нечеловеческими остатками. Гуманизированные антитела могут также включать остатки, которые не встречаются ни в антителе-реципиенте, ни в импортированном CDR или каркасных последовательностях. В целом, гуманизированное антитело будет включать, по существу, все из по крайней мере одного и типично двух вариабельных доменов, в которых все или, по существу, все участки CDR соответствуют таковым из нечеловеческого иммуноглобулина, и все или, по существу, все из участков FR являются таковыми консенсусной последовательности человеческого иммуноглобулина. Гуманизированное антитело оптимально также будет содержать по крайней мере один сегмент константного участка иммуноглобулина (Fc), типично - человеческого иммуноглобулина. Методы гуманизации нечеловеческих антител хорошо известны из уровня техники. В целом, гуманизированное антитело имеет один или более аминокислотный остаток, введенный в него из источника,являющегося нечеловеческим. Такие нечеловеческие аминокислотные остатки называются часто "импортированными" остатками, которые обычно берутся из "импортированного" вариабельного домена. Гуманизация может быть произведена в обязательном порядке посредством замены участков CDR или последовательностей CDR грызунов на соответствующие последовательности человеческого антитела. Соответственно, такие "гуманизированные" антитела являются химерными антителами (патент США 4816567), где в обязательном порядке менее чем один интактный человеческий вариабельный домен был заменен соответствующей последовательностью нечеловеческого вида. На практике гуманизированные антитела являются типично человеческими антителами, в которых некоторые остатки CDR и, возможно,остатки FR заменены на остатки аналогичных сайтов антител грызунов. Использоваться могут трансгенные животные (например, мыши), которые способны при иммунизации вырабатывать полный спектр человеческих антител при отсутствии выработки эндогенного иммуноглобулина. Например, было описано, что гомозиготная делеция гена участка присоединения тяжелой цепи антитела у химерных и мутантных мышей зародышевой линии приводит к полному ингибированию выработки эндогенных антител. Перенос генной матрицы иммуноглобулина человеческой зародышевой линии в таких мутантных мышей зародышевой линии будет приводить к выработке человеческих антител с антигенной стимуляцией. Человеческие антитела могут также быть получены в библиотеке фагового отображения, как это, например, описывается выше для комплекс-специфических антител. Антитела по изобретению предпочтительно вводятся в субъект в фармацевтически приемлемом носителе. Подходящее количество фармацевтически приемлемой соли типично используется в составе для усиления изотонности состава. Примеры фармацевтически приемлемых носителей включают раствор натрия хлорида, раствор Рингера и раствор декстрозы. Уровень рН раствора составляет предпочтительно от около 5 до около 8 и более предпочтительно от около 7 до около 7,5. Кроме того, носители включают препараты продолжительного высвобождения, такие как полупроницаемые матрицы твердых гидрофобных полимеров, содержащие антитело, матрицы которых имеют вид профилированных изделий, к примеру пленки, липосомы или микрочастицы. Для специалиста данной области будет очевидно, что определенные носители могут быть более предпочтительными в зависимости, например, от способа введения- 19019603 и концентрации вводимого антитела. Антитела могут вводиться в субъект, в пациента или клетку посредством инъекции (например,внутривенно, внутрибрюшинно, подкожно, внутримышечно) или другими способами, такими как вливание, которое гарантирует доставку к кровотоку эффективным образом. Антитела могут также вводиться внутритуморальными или перитуморальными способами, чтобы вызвать локальные, а также и системные терапевтические эффекты. Предпочтительными являются локальная или внутривенная инъекция. Эффективная дозировка и график введения антител могут быть определены эмпирически, а принятие таковых решений под силу специалисту данной области. Специалистам данной области будет понятно, что дозировка антител, которые должны быть введены, будет варьироваться в зависимости, например, от субъекта, которому будет вводиться антитело, способа введения, конкретного типа используемого антитела и других вводимых медикаментов. Antibodies in Human Diagnosis and Therapy, Haber et al.,eds. Raven Press, New York (1977) стр. 365-389. Типичная дневная дозировка антитела, используемого отдельно, может варьироваться от около 1 мкг/кг вплоть до 100 мг/кг по весу тела или более в день в зависимости от факторов, упоминаемых выше. Последующее введение антитела для лечения рака, эффективность терапевтического антитела могут быть оценены различными способами, известными компетентному специалисту. Например, размер, количество и/или распределение рака у субъекта, проходящего лечение, может контролироваться с помощью стандартных методов визуализации опухоли. Введенное в терапевтических целях антитело, которое блокирует рост опухоли, приводит к уменьшению размера и/или предотвращает развитие новых опухолей в сравнении с течением болезни, которое бы имело место без введения антитела, и является эффективным антителом для лечения раковых заболеваний. Антитела могут также использоваться для диагностических анализов in vivo. В целом, антитело помечают радионуклеотидом (таким как 111In, 99 Тс, 14 С, 131I, 3 Н, 32 Р или 35S), так что опухоль может быть локализована с помощью иммуносцинтиграфии. В одном воплощении антитела или их фрагменты связываются с внеклеточными доменами двух или более раковых мишеней при показателе аффинности (Kd) ниже чем 110 мкМ. Антитела для диагностического применения могут помечаться зондами, подходящими для обнаружения различными способами визуализации. Способы обнаружения зондов включают, но не ограничиваются, флуоресценцию, свет, конфокальную и электронную микроскопию; магнитно-резонансную визуализацию и спректроскопию; флюороскопию, компьютерную томографию и позитронно-эмиссионную томографию. Подходящие зонды включают, но не ограничиваются, флуоресцеин, родамин, эозин и другие флюорофоры, радиоизотопы, золото, гадолиний и другие лантаноиды, парамагнитное железо, фтор 18 и другие позитронно-активные радионуклиды. Кроме того, зонды могут быть би- или мультифункциональными и обнаруживаться более чем одним из приведенных способов. Данные антитела могут быть помечены напрямую или опосредованно указанными зондами. Присоединение зондов к антителам включает ковалентное присоединение зонда, внедрение зонда в антитело и ковалентное присоединение комплексообразующего соединения для присоединения зонда, широко признанное среди прочих в данной области. Для иммуногистохимических исследований проба пораженной ткани может быть свежей,или замороженной, или может быть заделанной в парафин и законсервирована таким консервантом, как формалин. Законсервированный или заделанный срез содержит пробу, контактировавшую с помеченным первичным антителом и вторичным антителом, где антитело используется для обнаружения экспрессии белка NCAN in situ. Настоящее изобретение обеспечивает, таким образом, пептид, включающий последовательность,которая выбирается из группы с SEQ ID NO: 1 по SEQ ID NO: 3 или их вариант, который по крайней мере на 85%, предпочтительно на 95% гомологичен с SEQ ID NO: 1 по SEQ ID NO: 3 или их вариант, который будет индуцировать Т-клеточную перекрестную реакцию с указанным пептидом. В предпочтительном воплощении для лечения почечно-клеточной карциномы пептид с SEQ ID NO: 1, и/или SEQ ID NO: 2, и/или SEQ ID NO: 3 применяется в комбинации по крайней мере с двумя пептидами с SEQ ID NO: 4 по SEQ ID NO: 13 и SEQ ID NO: 24. Пептид с SEQ ID NO: 1 по SEQ ID NO: 3 может поэтому вводиться отдельно или вместе с другими пептидами в одном составе. Подробное описание пептидов и антигенов, представленных выше, раскрыто в заявке WO 2007/028573. В предпочтительном воплощении для лечения рака толстого кишечника пептид с SEQ ID NO: 1 поSEQ ID NO: 3 применяется в комбинации по крайней мере с двумя пептидами с SEQ ID NO: 15 по 24, 4,8, 11 или 12. Пептид с SEQ ID NO: 1 по SEQ ID NO: 3 может поэтому вводиться отдельно или вместе с другими пептидами в одном составе. Подробное описание пептидов и антигенов, представленных выше, раскрыто в заявках ЕР 07014796.2 и US 60/953161. Пептиды изобретения обладают способностью связываться с молекулой главного комплекса гистосовместимости человека (МНС) класса I или II. В настоящем изобретении термин "гомологичный" относится к степени идентичности между последовательностями двух аминокислотных последовательностей, т.е. пептидных или полипептидных- 21019603 последовательностей. Упомянутая ранее "гомология" определяется при сравнении двух последовательностей, сопоставляемых в оптимальных условиях со сравниваемыми последовательностями. Сравниваемые последовательности могут иметь дополнение или делецию (например, разрыв и т.п.) в оптимальном противопоставлении двух последовательностей. Такая гомология последовательности может быть подсчитана с помощью создания противопоставления, например, по алгоритму ClustalW (Nucleic Acid Res.,22(22): 4673 4680 (1994). Широкораспространенное программное обеспечение для анализа последовательностей, в частности Vector NTI, GENETYX, или аналитические инструменты, предоставляемые общественными банками данных. Специалист данной области будет в состоянии оценить, будут ли Т-клетки, индуцированные вариантом специфического пептида, способны к перекрестной реакции с самим пептидом (Fong et al., 2001);"Вариантом" данной аминокислотной последовательности изобретатели обозначают, что боковые цепи, например, одного или двух аминокислотных остатков изменены (например, при их замещении боковой цепью другого встречающегося в природе аминокислотного остатка или какой-либо другой боковой цепью) так, что пептид по-прежнему способен связываться с молекулой HLA, по существу, таким же путем, как и пептид, состоящий из данной аминокислотной последовательности с SEQ ID NO: 1 по 24. Например, пептид может быть модифицирован таким образом, что он, по крайней мере, сохранит, если не улучшит, способность взаимодействовать и связываться со связывающей бороздкой подходящей молекулы МНС, такой как HLA-A02 или -DR, и, таким образом, он, по крайней мере, сохранит, если не улучшит, способность связываться с ТКР активированных ЦТЛ. Данные ЦТЛ могут впоследствии вступать в перекрестную реакцию с клетками и уничтожать клетки, которые экспрессируют полипептид, который содержит естественную аминокислотную последовательность родственного пептида, как определено в аспектах этого изобретения. По информации из научной литературы (Rammensee et al., 1997) и банков данных (Rammensee et al., 1999) конкретные позиции связывающихся с HLA пептидов являются типичными якорными остатками, формирующими центральную последовательность, подходящую к соединительному элементу рецептора HLA, который определяется полярными, электрофизическими, гидрофобными и пространственными свойствами полипептидных цепей, образующих связывающую бороздку. Так, специалист данной области будет в состоянии модифицировать аминокислотные последовательности, предложенные в SEQ ID NO: 1 по 24, сохраняя известные якорные остатки, и будет способен определить, сохранят ли варианты способность связываться с молекулами МНС класса I или II. Варианты настоящего изобретения сохраняют способность связываться с ТКР активированных ЦТЛ, которые могут впоследствии вступать в перекрестную реакцию с и уничтожать клетки, экспрессирующие полипептид, который содержит естественную аминокислотную последовательность родственного пептида,как определено в аспектах этого изобретения. Те аминокислотные остатки, которые не обязательно вносят вклад во взаимодействие с Тклеточным рецептором, могут быть модифицированы при замещении другой аминокислотой, чье включение, по существу, не влияет на реактивность Т-клетки и не устраняет связь с релевантным МНС. Таким образом, помимо данного условия, пептид по изобретению может быть любым пептидом (в обозначение которого изобретатели включают олигопептиды или полипептиды), который включает аминокислотные последовательности, или их участок, или их вариант, как дано. Таблица 5 Варианты и участок пептида в соответствии с SEQ ID NO: 24 В дальнейшем известно, что пептиды, презентированные МНС класса II, образованы "коровой по- 22019603 следовательностью", имеющей аминокислотную последовательность, подходящую к конкретному HLAаллель-специфическому фрагменту и, факультативно, N- и/или С-терминальные удлиняющие сегменты,которые не препятствуют функции коровой последовательности (т.е. считаются нерелевантными для взаимодействия пептида и всех или подклассов клонов Т-клетки, распознающих естественную копию).N- и/или С-терминальные удлиняющие сегменты могут иметь длину, например, от 1 до 10 аминокислот соответственно. Эти пептиды могут быть использованы как непосредственно для погрузки на молекулы МНС класса II, так и последовательность может быть клонирована на векторы в соответствии с описанным ниже. Так как эти пептиды образуют конечный продукт процессинга более длинных пептидов внутри клетки, то более длинные пептиды могут использоваться в равной степени. Пептиды по изобретению могут быть любого размера, но, в основном, они могут иметь молекулярный вес меньше чем 100000,предпочтительно меньше чем 50000, более предпочтительно меньше чем 10000 и типично около 5000. В отношении числа аминокислотных остатков пептиды по изобретению могут иметь менее чем 1000 остатков, предпочтительно менее чем 500 остатков, более предпочтительно менее чем 100 остатков и наиболее предпочтительно между 30 и 8 остатками. Соответственно, настоящее изобретение обеспечивает также пептиды и их варианты, в которых указанный пептид или вариант имеет общую длину между 8 и 100, предпочтительно между 8 и 30 и наиболее предпочтительно между 8 и 16, а именно 8, 9, 10, 11, 12,13, 14, 15 или 16 аминокислот. Для пептидов, рестриктированных по МНС II класса, в молекуле МНС могут быть представлены несколько различных пептидов с одинаковой центральной (коровой) последовательностью. Так как взаимодействие с распознающей Т-(хелперной) клеткой определяется центральной последовательностью из 9 до 11 аминокислот, то одним и тем же клоном Т-(хелперной) клетки могут распознаваться несколько вариантов по длине. Таким образом, несколько различных вариантов по длине центральной связывающейся последовательности могут быть использованы для непосредственной погрузки на молекулы МНСII класса без нужды в дальнейшем процессинге и обработке на N- или С-терминальных концах. В соответствии с этим, встречающиеся в природе или искусственные варианты, которые индуцируют Тклеточную перекрестную реакцию с пептидом по изобретению, часто являются вариантами по длине. Если пептид, который длиннее, чем около 12 аминокислотных остатков, непосредственно используется для связывания с молекулой МНС II класса, предпочтительно, чтобы остатки, которые примыкают к центральному HLA-связывающему участку, по существу, не влияли на способность пептида специфически связываться со связывающей бороздкой молекулы МНС II класса или презентировать пептид Т(хелперной) клетке. Тем не менее, как уже было указано выше, следует понимать, что могут быть использованы более крупные пептиды, например, если они закодированы полинуклеотидом, потому что такие крупные пептиды могут быть разделены на фрагменты подходящими антигенпрезентирующими клетками. Однако в одинаковых случаях было показано, что примыкающие участки центральной последовательности могут оказывать влияние на связывание пептида с молекулой МНС II класса или взаимодействие димерного комплекса МНС-пептид с ТКР в обоих направлениях по сравнению с контрольным пептидом с такой же центральной последовательностью. Внутримолекулярные третичные структуры внутри пептида (к примеру, петлеобразное образование) обычно снижают аффинности к МНС или ТКР. Внутримолекулярные взаимодействия примыкающих участков с частями МНС или ТКР вне связывающих бороздок пептида могут стабилизировать взаимодействие. Такие изменения в аффинности могут иметь исключительное влияние на потенциал пептида МНС класса II по вызыванию ответов Т(хелперных) клеток. Также возможно, чтобы эпитопы МНС I класса, хотя они обычно имеют длину между 8-10 аминокислотами, генерировались при процессинге пептидов из более длинных пептидов или белков, включающих истинный эпитоп. Предпочтительно, чтобы остатки, которые примыкают к истинному эпитопу,по существу, не влияли на протеолитическое расщепление, необходимое для выявления истинного эпитопа во время процессинга. Соответственно, настоящее изобретение обеспечивает также пептиды и варианты эпитопов МНС класса I, в которых указанный пептид или вариант имеет общую длину между 8 и 100, предпочтительно между 8 и 30 и наиболее предпочтительно между 8 и 16, а именно 8, 9, 10, 11, 12, 13, 14, 15, 16 аминокислот. Разумеется, пептид или вариант в соответствии с настоящим изобретением будет обладать способностью связываться с молекулой главного комплекса гистосовместимости человека (МНС) I или II класса. Связывание пептида или варианта с комплексом МНС может быть проверено методами, известными из уровня техники, например, теми, что описываются в литературе для различных аллелей МНС II класса(к примеру, Vogt et al., 1994; Malcherek et al., 1994; Manici et al., 1999; Hammer et al., 1995; Tompkins et al.,1993; Boyton et al., 1998). В особенно предпочтительном воплощении изобретения пептид состоит или преимущественно состоит из аминокислотной последовательности в соответствии с SEQ ID NO: 1 по SEQ ID NO: 3. Пептиды в соответствии с настоящим изобретением могут также состоять из непрерывного фрагмента аминокислот, как обозначено в SEQ ID NO: 1 по 3, где указанный фрагмент является частью указанной последовательности, имеющей длину по крайней мере 8 аминокислот (к примеру, 8, 9, 10, 11, 12,- 23019603 13, 14, 15 или 16) при условии, что центральная последовательность присутствует в указанном пептиде,усиливая его функциональность в инициации иммунного ответа в соответствии с описываемым здесь."Состоящий преимущественно из" подразумевает, что пептид в соответствии с настоящим изобретением, помимо последовательности в соответствии с любой из SEQ ID NO: 1 по SEQ ID NO: 3 или одним из их вариантов, содержит дополнительные находящиеся на N- и/или С-конце фрагменты аминокислот, которые не являются обязательно формирующими часть пептида, которая функционирует как эпитоп для эпитопа молекул МНС. Тем не менее, эти фрагменты могут быть важны для обеспечения эффективного введения пептида в соответствии с настоящим изобретением в клетки. В одном воплощении настоящего изобретения пептид является белком слияния, который включает, например, 80 N-терминальных аминокислот HLA-DR антиген-ассоциированной инвариантной цепи (р 33, в дальнейшем Ii), как взятый из банка данных NCBI, инвентарный номер - GenBank Accession-number X00497 (Strubin, M. et al., 1984). Примеры для дальнейших предпочтительных пептидов включают пептиды, имеющие специфический подвид HLA, и способны стимулировать клетки CD8, и где указанный пептид включает специфический якорный аминокислотный фрагмент, как приведено в последующей табл. 6. Таблица 6 Подвиды HLA и якорные фрагменты предпочтительных пептидов в соответствии с SEQ ID NO: 24 Кроме того, пептид или вариант может быть модифицирован в дальнейшем для улучшения стабильности и/или связывания с молекулами МНС в целях получения более сильного иммунного ответа. Методы для такой оптимизации пептидной последовательности хорошо известны из уровня техники и включают, например, введение обратных пептидных или непептидных связей. В пептидах с обратной связью аминокислотные остатки присоединены не пептидными связями(-CO-NH-), но пептидная связь является обратной. Такие ретро-обратные пептидомиметики могут быть получены методами, известными из уровня техники, например такими, как описано в работе Meziere и соавторов (1997) J. Immunol. 159-3237, включенной сюда путем ссылки. Этот принцип охватывает получение псевдопептидов, содержащих изменения, которые охватывают остов, но не ориентацию боковых цепей. Meziere и соавторы (1997) показывают, что эти псевдопептиды пригодны для связывания с МНС и ответов Т-хелперных клеток. Ретро-обратные пептиды, которые содержат связи NH-CO вместо пептидных связей CO-NH, намного более устойчивы к протеолизу. Непептидной связью, является, например, -CH2-NH, -CH2S-, -СН 2 СН 2-, -СН=СН-, -СОСН 2-,-СН(ОН)СН 2- и -CH2SO-. Патент США 4897445 обеспечивает метод твердофазного синтеза непептидных связей (-CH2-NH) в полипептидных цепях, что включает полипептиды, синтезированные с использованием стандартной методики, и непептидную связь, синтезированную при реакции аминоальдегида и аминокислоты в присутствии NaCNBH3. Пептиды, включающие последовательности, описанные выше, могут быть синтезированы с дополнительными химическими группами, находящимися на их аминном и/или карбоксильном концах, для увеличения стабильности, биологической доступности и/или аффинности пептидов. Например, гидрофобные группы, такие как карбобензоксильные, данзильные или трет-бутилоксикарбонильные группы,могут быть добавлены к аминным окончаниям пептидов. Подобным образом, ацетильная группа или 9 фторенилметоксикарбонильная группа может быть введена в аминные окончания пептидов. Кроме того,гидрофобная группа, трет-бутилоксикарбонильная или амидная группа может быть добавлена к карбоксильным окончаниям пептидов. Далее, все пептиды по изобретению могут быть синтезированы в целях изменения их пространственной конфигурации. Например, D-изомер одного или более аминокислотных остатков пептида может быть использован скорее, чем обычный L-изомер. Более того, по крайней мере один из аминокислотных остатков пептидов по изобретению может быть замещен одним из хорошо известных не встречающихся в природе аминокислотных остатков. Изменения, такие как данные, могут служить для повышения стабильности, биологической доступности и/или связывающих свойств пептидов по изобретению. Подобным образом, пептид или вариант по изобретению может быть модифицирован химическим способом посредством реакции специфических аминокислот как до, так и после синтеза пептида. Примеры таких модификаций хорошо известны из уровня техники и обобщаются, например, в работе R.Lundblad, Chemical Reagents for Protein Modification, 3rd ed. CRC Press, 2005, которая включена сюда путем ссылки. Химическая модификация аминокислот включает, но не ограничивается, модификацию с- 24019603 помощью ацилирования, амидирования, пиридоксилирования лизина, восстановительного алкилирования, тринитробензилирования аминных групп 2,4,6-тринитробензолсульфоновой кислотой (TNBS),амидную модификацию карбоксильных групп и сульфгидрильную модификацию с помощью окисления надмуравьиной кислотой цистеина до цистеиновой кислоты, образование ртутных производных, образование смешанных дисульфидов с другими тиоловыми соединениями, реакцию с малеимидом, карбоксиметилирование йодоуксусной кислотой или йодацетамидом и карбамоилирование цианатом при щелочном уровне рН, хотя не ограничиваясь ими. В этой связи специалист данной области может проконсультироваться с главой 15 раздела "Current Protocols" в журнале "Protein Science", Eds. Coligan et al. (JohnWileySons NY 1995-2000) для получения более обширной информации о методах, связанных с химической модификацией белков. Вкратце, модификация, например, остатков аргинила в белках часто основана на реакции вицинальных дикарбонильных соединений, таких как фенилглиоксаль, 2,3-бутандион и 1,2-циклогександион для формирования аддукта. Другим примером является реакция метилглиоксаля с остатками аргинина. Цистеин может быть модифицирован без сопутствующей модификации других нуклеофильных сайтов,таких как лизин и гистидин. В результате для модификации цистеина доступно большое число реагентов. Веб-сайты компаний, таких как "Sigma-Aldrich" (http://www.sigma-aldrich.com), предоставляют информацию по специфическим веществам. Также распространена селективная редукция дисульфидных связей в белках. Дисульфидные связи могут быть образованы и оксидированы во время тепловой обработки биофармацевтических средств.K-реагент Вудворда может использоваться для модификации специфических остатков глютаминовой кислоты. N-(3-(диметиламинопропил)-N'-этилкарбодиимид может использоваться для формирования внутримолекулярных поперечных связей между остатком лизина и остатком глютаминовой кислоты. Например, диэтилпирокарбонат является реагентом для модификации остатков гистидила в белках. Гистидин может также быть модифицирован при использовании 4-гидрокси-2-ноненала. Реакция остатков лизина и других -аминных групп полезна, например, при связывании пептидов с поверхностями или перекрестном связывании (кросс-линкинг) белков/пептидов. Лизин является сайтом присоединения поли(этилен)гликоля и основным сайтом модификации при гликировании белков. Остатки метионина в белках могут быть модифицированы с помощью, например, йодацетамида, бромэтиламина и хлорамина T. Тетранитрометан и N-ацетилимидазол могут быть использованы для модификации остатков тирозила. Кросс-линкинг через образование дитирозина может быть произведен с ионами перекиси водорода/меди. В последних исследованиях по модификации триптофана используются N-бромсукцинимид, 2 гидрокси-5-нитробензилбромид или 3-бром-3-метил-2-(2-нитрофенилмеркапто)-3 Н-индол (BPNSскатол). Успешная модификация терапевтических белков и пептидов с PEG-полиэтиленгликолем часто ассоциируется с увеличением циркуляторного полураспада, в то время как кросс-линкинг белков с глутаральдегидом, полиэтиленгликоль-диакрилатом и формальдегидом используется для приготовления гидрогелей. Химическая модификация аллергенов для иммунотерапии часто достигается при карбамоилировании цианатом калия. Пептид или вариант, в котором пептид модифицирован или включает непептидные связи, является предпочтительным воплощением изобретения. В целом, пептиды и варианты (по крайней мере, те, что содержат пептидные связи между аминокислотными остатками) могут быть синтезированы Fmocполиамидным способом твердофазного пептидного синтеза, как раскрыто у Lu и соавторов (1981), и в прилагающихся ссылках. Временная защита N-аминогруппы предусмотрена группой 9 флуоренилметилоксикарбонил (Fmoc). Повторное расщепление этой высоко щелоче-лабильной защитной группы осуществляется при использовании 20% пиперидина в N,N-диметилформамиде. Функциональности боковой цепи могут быть защищены как их бутиловые эфиры (в случае серинтреонина и тирозина), бутиловые сложные эфиры (в случае глютаминовой кислоты и аспарагиновой кислоты), бутилоксикарбониловое производное (в случае лизина и гистидина), тритиловое производное (в случае цистеина) и производное 4-метокси-2,3,6-триметилбензолсульфонила (в случае аргинина). Где глютамин или аспарагин являются С-терминальными остатками, для защиты боковой цепи амидо-функциональностей используется 4,4'-диметоксибензгидрильная группа. Твердофазный носитель основан на полимере полидиметилакриламида, состоящем из трех мономеров: диметилакриламида (остов-мономер), бисакрилоилэтилендиамина (кросс-линкер) и метилового эфира акрилоилсаркозина (функционализирующий агент). Использованным агентом с расщепляемым соединением пептид-смола является кислотнолабильное производное 4-гидроксиметилфеноксиуксусной кислоты. Все аминокислотные производные добавляются как их преформированные симметричные ангидридные производные за исключением аспарагина и глютамина, которые добавляются с применением метода обратного соединения, опосредованного N,N-дициклогексилкарбодиимид/1-гидроксибензотриазолом. Все реакции сочетания и снятия защитных групп отслеживались с помощью нингидрина, тринитробензолсульфоновой кислоты или технологии контроля изотином. После завершения синтеза пептиды отщепляются от смолы-носителя сопутствующим удалением защитных групп боковой цепи при обработке 95% трифторуксусной кислотой, со- 25019603 держащей 50% поглотителя примесей. Обычно используемые поглотители включают этандитиол, фенол,анизол и воду, окончательный выбор зависит от составляющих аминокислот синтезированного пептида. Также возможна комбинация твердофазных и жидкофазных методов для синтеза пептидов (см., например, Bruckdorfer et al. 2004 и прилагающиеся ссылки). Трифторуксусная кислота удаляется выпариванием в вакууме с последующим измельчением с диэтиловым эфиром для получения сырого пептида. Любые представленные поглотители удаляются простой технологией экстракции, которая при лиофилизации водной фазы позволяет получить сырой пептид без поглотителей. Реагенты для синтеза пептидов, как правило, имеются в наличии, например, в Calbiochem-Novabiochem (Великобритания) Ltd, Nottingham NG7 2QJ, Великобритания. Очистка может быть произведена любой техникой или комбинацией таких техник как рекристаллизация, эксклюзивная (по размеру) хроматография, ионообменная хроматография, хроматография гидрофобного взаимодействия и (обычно) обратнофазная высокоэффективная жидкостная хроматография с использованием, к примеру, градиентного разделения ацетонитрил/вода. Анализ пептидов может быть произведен при использовании тонкослойной хроматографии, электрофореза, в частности капиллярного электрофореза, твердофазной экстракции (ТФЭ), обратнофазной высокоэффективной жидкостной хроматографии, аминокислотного анализа после кислотного гидролиза и масс-спектрометрического анализа при быстрой бомбардировке атомами (FAB), а также массспектрометрический анализ MALDI и ESI-Q-TOF. Дальнейший аспект изобретения обеспечивает нуклеиновую кислоту (например, полинуклеотид),кодирующую пептид или вариант пептида по изобретению. Полинуклеотид может быть, например, ДНК,кДНК, ПНК, ЦНК, РНК или их комбинациями, как одно-, так и/или двухнитевыми; натуральными или стабилизированными формами полинуклеотидов, таких как, например, полинуклеотиды с фосфоротиоатным остовом, и может или не может содержать интроны в период времени кодирования для пептида. Разумеется, только пептиды, которые содержат встречающиеся в природе аминокислотные остатки, присоединенные встречающимися в природе пептидными связями, могут кодироваться полинуклеотидом. Еще один дальнейший аспект изобретения обеспечивает вектор экспрессии, способный экспрессировать полипептид в соответствии с изобретением. Был разработан ряд методов для связывания полинуклеотидов, в особенности ДНК, с векторами,например, с помощью дополнительных липких концов. К примеру, в сегмент ДНК могут быть добавлены дополнительные гомополимерные участки для внесения в вектор ДНК. Вектор и сегмент ДНК в таком случае соединены водородной связью между дополнительными гомополимерными концевыми участками, образуя рекомбинантные молекулы ДНК. Синтетические сшивающие агенты, содержащие один или несколько сайтов рестрикции, обеспечивают альтернативный способ присоединения сегмента ДНК к векторам. Синтетические сшивающие агенты, содержащие ряд сайтов рестрикционной эндонуклеазы, имеются в продаже в различных источниках, включая International Biotechnologies Inc., New Haven, CN, США. Желаемый способ модификации ДНК, кодирующей полипептид по изобретению, - это использование цепной реакции полимеразы, как раскрыто в работе (Saiki et al. (1988. Этот метод может быть использован для введения ДНК в подходящий вектор, например при инженерии в подходящих сайтах рестрикции, или же он может быть использован для модификации ДНК другими пригодными путями, известными из уровня техники. Если используются векторы, то предпочтительными являются оспенные или аденовирусные векторы. Затем ДНК (или в случае ретровирусных векторов РНК) может экспрессироваться в подходящего хозяина для получения полипептида, включающего пептид или вариант по изобретению. Таким образом,ДНК, кодирующая пептид или вариант по изобретению, может быть использована в соответствии с известными техниками, модифицированная соответствующим образом с учетом приведенных здесь идей,для создания вектора экспрессии, который затем используется для трансформации подходящей клеткихозяина для экспрессии и получения полипептида по изобретению. Такие техники включают те, что раскрыты в патентах США 4440859, 4530901, 4582800, 4677063, 4678751, 4704362, 4710463, 4757006,4766075 и 4810648. ДНК (или в случае ретровирусных векторов - РНК), кодирующая полипептид, представляющий собой соединение по изобретению, может быть присоединена к обширному ряду других последовательностей ДНК для введения в адекватного хозяина. ДНК-спутник будет зависеть от природы хозяина, способа введения ДНК хозяину и от того, желательно ли эписомальное поддержание или интеграция. Как правило, ДНК вводится в вектор экспрессии, такой как плазмида, с правильной ориентацией и корректной рамкой считывания экспрессии. Если необходимо, то ДНК может быть сцеплена с адекватными транскрипционными и трансляционными регулирующими контрольными нуклеотидными последовательностями, распознающимися желательным хозяином, хотя такой контроль обычно имеется в векторе экспрессии. Вектор вводится затем хозяину стандартными способами. Как правило, не все хозяева трансформируются вектором. Поэтому будет необходимо выбрать трансформированные клетки-хозяева. Одна из техник отбора включает введение в вектор экспрессии последовательности ДНК с любыми необходимыми элементами контроля, кодирующей выбранный признак в трансформированной клетке, та- 26019603 кой как невосприимчивость к антибиотикам. Альтернативно ген для такого выбираемого признака может быть на другом векторе, который используется для котрансформации желаемой клетки-хозяина. Клетки-хозяева, которые были трансформированы рекомбинантной ДНК по изобретению, культивируются затем в течение достаточного времени и при адекватных условиях, известных специалистам данной области, с учетом раскрытых здесь идей, что ведет к экспрессии полипептида, который после этого может быть получен. Известно множество систем экспрессии, включающих бактерии (например, Е. coli и Bacillusspec.), растительные клетки, клетки животных и насекомых. Предпочтительно, чтобы система была клетками млекопитающих, такими как клетки СНО, имеющимися в наличии в АТСС Cell Biology Collection. Типичная клеточная векторная плазмида млекопитающих для конститутивной экспрессии включает промотор CMV или SV40 с подходящим концевым участком поли А и маркером устойчивости, таким как неомицин. Одним примером является pSVL, имеющимся в наличии в Pharmacia, Piscataway, NJ,США. Примером индуцируемого вектора экспрессии млекопитающих является pMSG, имеющийся также в наличии в Pharmacia. Пригодными плазмидными векторами дрожжей являются pRS403-406 и pRS413416, и они, как правило, имеются в наличии в Stratagene Cloning Systems, La Jolla, CA 92037, США. Плазмиды pRS403, pRS404, pRS405 и pRS406 являются дрожжевыми интегрирующими плазмидами(YIps) и включают дрожжевые селектируемые маркеры HIS3, TRP1, LEU2 и URA3. Плазмиды pRS413416 являются дрожжевыми центромерными плазмидами (Ycps). Основанные на промоторе векторы CMV(например, из Sigma-Aldrich) обеспечивают кратковременную или устойчивую экспрессию, цитоплазмическую экспрессию или секрецию и N-терминальную или С-терминальную маркировку в различных комбинациях FLAG, 3FLAG, c-myc или МАТ. Данные белки слияния позволяют детекцию, очистку и анализ рекомбинантного белка. Слияния с двойной меткой обеспечивают гибкость при детекции. Сильный промоторный регуляторный участок цитомегаловируса человека (CMV) возбуждает конститутивные уровни белковой экспрессии, достигающие 1 мг/л в клетках COS. Для менее активных клеточных линий белковые уровни типично составляют 0,1 мг/л. Присутствие точки начала репликацииSV40 будет приводить к высоким уровням репликации ДНК в терпящих репликацию SV40 клетках COS. Векторы CMV, например, могут содержать точку начала для репликации рМВ 1 (производное pBR322) в бактериальных клетках, ген b-лактамазы для отбора устойчивости к ампициллину у бактерий, hGH polyA и точку начала f1. Векторы, содержащие лидерную последовательность пре-про-трипсина (РРТ), могут направлять секрецию белков слияния FLAG в культуральную среду для очистки с использованием антител ANTI-FLAG, смол и планшетов. Другие векторы и системы экспрессии для применения с различными клетками-хозяевами хорошо известны из уровня техники. Настоящее изобретение относится также к клетке-хозяину, трансформированной с помощью полинуклеотидной векторной модели настоящего изобретения. Клетка-хозяин может быть как прокариотической, так и эукариотической. Бактериальные клетки могут быть, предпочтительно, прокариотическими клетками-хозяевами при некоторых условиях и типично являются штаммом Е. coli, таким как, например,Е. coli штамма DH5, имеющимся в наличии в Bethesda Research Laboratories Inc., Bethesda, MD, США, иRR1, имеющимся в наличии в Американской коллекции типов культур (American Type Culture Collection(ATCC, Rockville, MD, США ( ATCC 31343). Предпочтительные эукариотические клетки-хозяева включают дрожжи, клетки насекомых и млекопитающих, предпочтительно клетки позвоночных, таких как мышь, крыса, обезьяна или человеческие фибробластные клетки и клеточные линии толстого кишечника. Дрожжевые клетки-хозяева включают YPH499, YPH500 и YPH501, которые, как правило, имеются в наличии в Stratagene Cloning Systems, La Jolla, CA 92037, США. Предпочтительные клетки-хозяева млекопитающих включают клетки яичника китайского хомяка (СНО), имеющиеся в наличии в АТСС какCCL61, NIH эмбриональные клетки швейцарской мыши NIH/3T3, имеющиеся в наличии в АТСС какCRL 1658, почечные клетки обезьяны COS-1, имеющиеся в наличии в АТСС как CRL 1650 и клетки 293,являющиеся эмбриональными клетками печени человека. Предпочтительными клетками насекомых являются клетки Sf9, которые могут трансфецироваться с помощью бакуловирусных векторов экспрессии. Обзор в отношении выбора подходящих клеток-хозяев для экспрессии представлен, например, в пособии авторов Paulina Balbas и Argelia Lorence "Methods in Molecular Biology Recombinant Gene Expression, Reviews and Protocols", ч. 1, 2 изд., ISBN 978-1-58829-262-9, и другой литературе, известной специалисту данной области. Трансформация адекватных клеток-хозяев с помощью модели ДНК настоящего изобретения совершается при помощи хорошо известных способов, которые обычно зависят от типа используемого вектора. Относительно трансформации прокариотических клеток-хозяев см., например, Cohen и соавторыManual, Cold Spring Harbor Laboratory, Cold Spring Harbor, Нью-Йорк. Трансформация дрожжевых клеток описывается у Sherman и соавторов (1986) Methods In Yeast Genetics, A Laboratory Manual, Cold SpringHarbor, Нью-Йорк. Также подходит метод Бигса (Beggs) (1978) Nature 275,104-109. Что касается клеток позвоночных, то подходящие для трансфекции таких клеток реагенты, например фосфат кальция и DEAE-декстран или липосомальные составы, имеются в наличии в Stratagene Cloning Systems или LifeTechnologies Inc., Gaithersburg, MD 20877, США. Электропорация также подходит для трансформации и/или трансфекции клеток и хорошо известна из уровня техники для трансформации дрожжевых клеток,бактериальных клеток, клеток насекомых и клеток позвоночных. Успешно трансформированные клетки, т.е. клетки, которые содержат конструкцию ДНК настоящего изобретения, могут быть идентифицированы хорошо известными способами, такими как ПЦР. Альтернативно наличие белка в супернатанте может выявляться применением антител. Следует понимать, что некоторые клетки-хозяева по изобретению подходят для получения пептидов по изобретению, например бактериальные, дрожжевые клетки и клетки насекомых. Тем не менее,другие клетки-хозяева могут быть пригодны в конкретных терапевтических методах. Например, антигенпрезентирующие клетки, такие как дендритные клетки, могут с пользой быть использованы для экспрессии пептидов по изобретению так, что их можно будет нагружать на адекватные молекулы МНС. Таким образом, актуальное изобретение обеспечивает клетку-хозяина, включающую нуклеиновую кислоту или вектор экспрессии в соответствии с изобретением. В предпочтительном воплощении клетка-хозяин является антигенпрезентирующей клеткой, в частности дендритной клеткой или антигенпрезентирующей клеткой. АПК, нагруженные рекомбинантным белком слияния, содержащим простатическую кислую фосфатазу (РАР), на данный момент проходят исследования в целях лечения рака простаты (Sipuleucel-T) (Small E.J. et al., 2006; Rini et al., 2006). Дальнейший аспект изобретения обеспечивает способ получения пептида или его варианта; способ,включающий культивацию клетки-хозяина и изоляцию пептида из клетки-хозяина или его культуральной среды. В другом воплощении пептид, нуклеиновая кислота или вектор экспрессии по изобретению используются в медицине. Например, пептид или его вариант может приготавливаться для внутривенной (i.v.) инъекции, подкожной (s.с.) инъекции, внутрикожной (i.d.) инъекции, внутрибрюшной (i.p.) инъекции,внутримышечной (i.m.) инъекции. Предпочтительные способы пептидной инъекции включают s.c., i.d.,i.p., i.m. и i.v. Предпочтительные способы инъекции ДНК включают i.d., i.m., s.c, i.p. и i.v. Вводиться могут дозы, к примеру, между 50 мкг и 1,5 мг, предпочтительно от 125 до 500 мкг пептида или ДНК и будут зависеть от соответствующего пептида или ДНК. Дозы в данных пределах успешно использовались в предыдущих клинических исследованиях (Brunsvig et al., 2006; Staehler et al., 2007). Другой аспект настоящего изобретения включает способ получения активированных Т-клеток in vitro; способ, включающий контактирование Т-клеток in vitro с нагруженными антигеном молекулами МНС I или II класса человека, экспрессированными на поверхности подходящей антигенпрезентирующей клетки на период времени, достаточного для активации антиген-специфическим образом Т-клетки,где антиген является пептидом в соответствии с изобретением. Предпочтительным образом, достаточное количество антигена используется с антигенпрезентирующей клеткой. В случае эпитопа МНС класса II, используемого в качестве антигена, Т-клетки являются CD4 положительными хелперными клетками, предпочтительным образом типа TH1. Молекулы МНС класса II могут быть экспрессированы на поверхности любой подходящей клетки. Предпочтительно, если клетка в естественных условиях не экспрессирует молекулы МНС класса II (в этом случае клетка трансфецирована для экспрессии такой молекулы). Альтернативно, если клетка в естественных условиях экспрессирует молекулы МНС класса II, то предпочтительно, чтобы клетка была дефектной для сигнальных путей процессинга или презентации антигена. Тогда на клетку, экспрессирующую молекулы МНС класса II, возможна полная погрузка выбранного пептидного антигена до активации Т-клетки. Антигенпрезентирующая клетка (или клетка-стимулятор) типично имеет молекулы МНС класса II на своей поверхности и предпочтительно обычно является не способной самостоятельно нагружать на указанную молекулу МНС класса II выбранный антиген. Молекула МНС II класса может быть легко нагружена выбранным антигеном in vitro. Предпочтительно, если в клетке млекопитающих не хватает или имеется пониженный уровень или пониженная функция пептидного транспортера ТАР. Подходящие клетки, в которых не хватает пептидного транспортера ТАР, включают Т 2, RMA-S и клетки дрозофилы. ТАР - это транспортер, ассоциированный с процессингом антигена. Нагружающая пептидом дефектная клеточная линия Т 2 человека имеется в наличии в AmericanType Culture Collection, 12301 Parklawn Drive, Rockville, Maryland 20852, США под каталоговымCRL 1992; клеточная линия дрозофилы линия Schneider 2 имеется в наличии в АТСС под каталоговымCRL 19863; клеточная линия мыши RMA-S описывается у Karre и соавторов 1985. Предпочтительно, если указанная клетка-хозяин до трансфекции, в основном, не экспрессирует молекулы МНС I класса. Также предпочтительно, если клетка-стимулятор экспрессирует молекулу, важную для обеспечения сигнала костимуляции для Т-клеток, такую как любая из В 7.1, В 7.2, ICAM-1 и LFA 3. Последовательности нуклеиновой кислоты многочисленных молекул МНС II класса и костимулирующих молекул общедоступны в банках данных GenBank и EMBL. Аналогично, в случае использования эпитопа МНС класса I в качестве антигена, Т-клетки являютсяCD8-положительными ЦТЛ. Если антигенпрезентирующая клетка трансфецирована для экспрессии такого эпитопа, то предпоч- 28019603 тительно, чтобы клетка включала вектор экспрессии, способный экспрессировать пептид, содержащий сSEQ ID NO: 1 по SEQ ID NO: 3 или их вариантную аминокислотную последовательность. Для генерации ЦТЛ in vitro могут быть использованы многие другие способы. Например, в методах,описанных у Peoples и соавторов (1995) и Kawakami и соавторов (1992), используются аутологичные опухоль-инфильтрующие лимфоциты при генерации ЦТЛ. Для приготовления ЦТЛ Plebanski и соавторы(1995) используют аутологичные лимфоциты периферической крови (ЛПК). Jochmus и соавторы (1997) описывают получение аутологичных ЦТЛ посредством импульсного введения пептида или полипептида в дендритные клетки или посредством инфицирования рекомбинантным вирусом. Hill и соавторы (1995) и Jerome и соавторы (1993) для получения аутологичных ЦТЛ используют В-клетки. Кроме того, для получения аутологичных ЦТЛ могут быть использованы макрофаги с введенным импульсным методом пептидом или полипептидом или инфицированные рекомбинантным вирусом. S. Walter и соавторы(аАПК) клеток, что является также подходящим способом генерации Т-клеток против выбранного пептида. В данном исследовании аАПК были генерированы при соединении преформированных комплексов МНС-пептид с поверхностью полистироловых частиц (микрошарики) с помощью биохимического способа с биотином-стрептавидином. Данная система допускает точный контроль плотности МНС на аАПК,который позволяет селективно вызвать высоко- или низкоавидные антигенспецифические Т-клеточные ответы с высокой эффективностью из проб крови. Кроме комплексов МНС/пептид аАПК должны нести другие белки с костимулирующей активностью, такие как антитела анти-CD28, соединенные с их поверхностью. Кроме того, такая основанная на аАПК система часто требует добавления адекватных растворимых факторов, к примеру цитокинов, таких как интерлейкин-12. При получении Т-клеток могут быть также использованы аллогенные клетки, и метод детально описывается в патенте WO 97/26328, включенном сюда путем ссылки. Например, кроме клеток дрозофилы и Т 2-клеток для презентации антигенов могут использоваться другие клетки, такие как клетки яичника китайского хомяка (СНО), бакуловирус-инфицированные клетки насекомых, бактерии, дрожжи, инфицированные осповакциной клетки-мишени. Кроме того, могут быть использованы растительные вирусы (см., например, работу Porta et al. (1994, которая описывает развитие мозаичного вируса китайской вигны как высокопродуктивную систему для презентации чужеродных пептидов. Активированные ЦТЛ, которые направлены против пептидов по изобретению, полезны для терапии. Таким образом, дальнейший аспект изобретения обеспечивает активированные Т-клетки, получаемые вышеупомянутыми методами по изобретению. Активированные Т-клетки, полученные с помощью приведенного выше способа, будут селективно распознавать клетку, которая аберрантно экспрессирует полипептид, включающий аминокислотную последовательность с SEQ ID1 по SEQ ID NO: 3. Предпочтительно, чтобы Т-клетка распознавала клетку при взаимодействии посредством своего ТКР с комплексом HLA-пептид (например, присоединение). Т-клетки применимы в методе уничтожения клеток-мишеней у пациента, клетки-мишени которого аберрантно экспрессируют полипептид, включающий аминокислотную последовательность по изобретению, где пациенту вводится эффективное число активированных Т-клеток. Т-клетки, которые введены пациенту, могут быть получены от пациента и активироваться, как описывалось выше (т.е. они являются аутологичными Т-клетками). Альтернативно Т-клетки получают не от пациента, а от другого индивида. Разумеется, предпочтительно, если индивид является здоровым индивидом. "Здоровым индивидом" изобретатели обозначают, что индивид имеет, в общем, хорошее здоровье, предпочтительно он имеет компетентную иммунную систему и более предпочтительно не страдает ни одним заболеванием, которые можно легко проконтролировать и выявить. Клетками-мишенями для CD4-положительных Т-клеток in vivo в соответствии с настоящим изобретением могут быть клетки опухоли (которые иногда экспрессируют МНС класса II) и/или стромальные клетки, окружающие опухоль (опухолевые клетки) (которые иногда также экспрессируют МНС классаII); (Dengjel et al., 2006. Т-клетки настоящего изобретения могут быть использованы в качестве активных ингредиентов в терапевтической композиции. Таким образом, изобретение обеспечивает также способ уничтожения клеток-мишеней у пациента, клетки-мишени которого аберрантно экспрессируют полипептид, включающий аминокислотную последовательность по изобретению; способ, включающий введение пациенту эффективного числа Т-клеток, как определено выше. Под понятием "аберрантно экспрессированный" изобретатели подразумевают также, что полипептид гиперэкспрессирован по сравнению с нормальными уровнями экспрессии или что ген является "молчащим" в ткани, из которой образовалась опухоль, однако он экспрессирован в опухоли. Под понятием"гиперэкспрессирован" изобретатели понимают, что полипептид представлен на уровне, который по крайней мере в 1,2 раза выше уровня, представленного в нормальной ткани; предпочтительно по крайней мере в 2 раза и более предпочтительно по крайней мере в 5 или 10 раз выше уровня, представленного в нормальной ткани. Т-клетки могут быть получены способами, известными из уровня техники, например теми, что описаны выше. Протоколы для этого т.н. адоптивного переноса Т-клеток хорошо известны из уровня техни- 29
МПК / Метки
МПК: C07K 14/47, C07K 16/18, A61K 38/00, C12N 15/12
Метки: класса, действенные, сурвивина, мнс, новые, пептиды, полученные
Код ссылки
<a href="https://eas.patents.su/30-19603-novye-i-dejjstvennye-peptidy-mns-ii-klassa-poluchennye-iz-survivina.html" rel="bookmark" title="База патентов Евразийского Союза">Новые и действенные пептиды мнс ii класса, полученные из сурвивина</a>
Предыдущий патент: Основанные на биполярных транзисторах с изолированным затвором/полевых транзисторах устройство, система и способ энергосбережения
Следующий патент: Индивидуальный летательный аппарат, включающий канал охлаждения радиатора
Случайный патент: Моноклональное антитело, связывающее домен γ-с фибрина или фибриногена