Композиции и методы для лечения рака молочной железы
Формула / Реферат
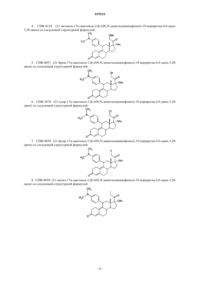
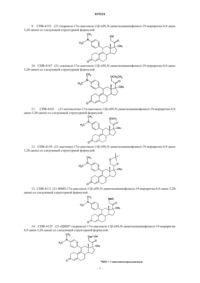
1. Способ лечения рака молочной железы, включающий совместное введение женщине, нуждающейся в этом, дозы соединения CDB-4124, подавляющей пролиферацию тканей рака молочной железы, и эффективного количества ингибитора ароматазы, выбранного из анастразола, летрозола и DL-аминоглутетимида.
2. Способ по п.1, где ингибитором ароматазы является DL-аминоглутетимид.
3. Способ по п.1, где указанное CDB-4124 и ингибитор ароматазы вводятся одновременно.
4. Способ подавления пролиферации тканей рака молочной железы, включающий этап одновременного воздействия на раковые ткани молочной железы ингибитором ароматазы, выбранным из группы, включающей анастразол, летрозол и DL-аминоглутетимид, и количеством соединения CDB-4124, подавляющим пролиферацию.
5. Способ по п.4, где ингибитором ароматазы является DL-аминоглутетимид.
Текст
КОМПОЗИЦИИ И МЕТОДЫ ДЛЯ ЛЕЧЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ Настоящее изобретение относится к способу лечения рака молочной железы и способу подавления пролиферации тканей рака молочной железы. Способ лечения рака молочной железы включает совместное введение женщине, нуждающейся в этом, дозы соединенияCDB-4124, подавляющей пролиферацию тканей рака молочной железы, и эффективного количества ингибитора ароматазы, выбранного из анастразола, летрозола и DL-аминоглутетимида. Способ подавления пролиферации тканей рака молочной железы включает этап одновременного воздействия на раковые ткани молочной железы ингибитором ароматазы, выбранным из группы,включающей анастразол, летрозол и DL-аминоглутетимид, и количеством соединения CDB-4124,подавляющим пролиферацию. Изобретение обеспечивает синергическое химиотерапевтическое воздействие при лечении рака молочной железы. Перекрестные ссылки на родственные заявки Заявка на данный патент притязает на преимущество приоритета предварительной заявки США 61/048472, поданной 28 апреля 2008 г., содержание которой включено в настоящий документ путем ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к составам и способам, предназначенным для лечения рака молочной железы. В частности, данное изобретение относится к составам, включающим в себя один или более селективных модуляторов рецепторов прогестерона с низкой глюкокортикоидной активностью,для лечения рака молочной железы. Предпосылки создания изобретения Примерно 200000 женщин в США в 2007 году будет поставлен диагноз "рак молочной железы". Последние данные предполагают, что прогестерон играет определенную роль в развитии этого заболевания. В результате ряда исследований были представлены доказательства того, что прогестерон оказывает противоположное воздействие на матку и молочную железу: в матке прогестерон действует как агент дифференцировки, который противостоит пролиферативным воздействиям эстрогена, а в молочной железе - как митогенный агент. В частности, прогестины продемонстрировали способность повышать частоту спонтанных опухолей молочной железы у собак и мышей. Более того, исследования рецепторов прогестерона у мышей с модифицированным геном продемонстрировали, что химические канцерогены,направленно воздействующие на молочную железу, зависят от рецептора прогестеронов. К тому же, эксперименты с тканевой культурой показали, что воздействия прогестинов можно ограничить до одного цикла разрастания, после чего следует угнетение. Было определено, что прогестины могут повышающе регулировать рецепторы EGF, c-erbB2 и c-erbB3 или направить их воздействие по потоку связывания фактора роста. Это повышает вероятность того, что прогестины "предварительно заряжают" ткани для разрастания и могут быть способными к переходу из гормонозависимого состояния в состояние зависимости от фактора роста. Роль прогестерона в развитии рака молочной железы получила дальнейшее рассмотрение в крупномасштабных клинических исследованиях в рамках инициатив "Здоровье женщины" (Women's HealthInitiative) и "Исследование миллиона женщин" (The Million Women Study), которые подтверждают вывод о том, что повышенный риск рака молочной железы существует у женщин, проходящих гормонозаместительную терапию (ГЗТ), состоящую из сопряженных конских эстрогенов (СКЭ) и медроксипрогестерон ацетата (МПА) прогестина, в сравнении с теми, кто получал плацебо. В "Исследовании миллиона женщин" любое использование эстрогена с одним из нескольких антагонистов прогестерона (МПА, норэтистерон, норгестрел/левоноргестрел) повышало такой риск в сравнении с использованием только эстрогена, и этот риск повышался с увеличением продолжительности применения. Эти статистические данные также подтверждаются гистологическими данными, указывающими на то, что у женщин, применяющих медроксипрогестерон ацетат (МПА) прогестина в качестве составной части ГЗТ, разрастание доли проток концевых секреторных отделов молочной железы проявлялось в большей степени. Наряду с результатами клинических исследований, данные, полученные экспериментальным путем при проведении хирургических операций на макаках по вызыванию менопаузы, показали, что режим комбинированного лечения эстрогеном с прогестероном приводил к более высоким уровням разрастаний и гиперплазии, чем лечение только эстрогеном. При катамнестическом исследовании Cline и др. обнаружил, что комбинирование МПА и сопряженных конских эстрогенов (т.е. стандартная комбинация ГЗТ у женщин) повышает количественное соотношение железистого эпителия молочной железы и окрашивание Ki-67(разрастание) в долях клеток эпителия молочной железы макак. Прогестины оказывают свое действие путем взаимодействия с рецептором прогестерона (РП), принадлежащим к классу структурно связанных ген-регуляторов, известных как "лиганд-зависимые транскрипционные факторы" (R.M. Evans, Science, 240, 889, 1988). Семейство рецепторов прогестерона представляет собой подгруппу семейства внутриклеточных рецепторов, которое также включает в себя рецептор эстрогена (РЭ), рецептор андрогена (РА), рецептор глюкокортикоида (РГ) и рецептор минералокортикоида (РМ). Внутриклеточный рецептор прогестерона (РП) занимает центральное место по отношению к большинству воздействий прогестерона. В человеческом организме есть две различные изоформы РП: РП-А и РП-В. Оба РП являются гормонально-активируемыми транскрипционными факторами, которые при активации напрямую взаимодействуют с регулирующими транскрипцию геномными последовательностями и другими транскрипционными факторами. Транскрипционные воздействия РП зависят от взаимодействия с прогестинами. Восприимчивые к прогестерону ткани женщины репродуктивного возраста значительно отличаются по уровню экспрессии РП во время менструального цикла. В отрасли известны многие композиции, оказывающие воздействие на прогестин-зависимую активацию РП. Известно, что некоторые из этих композиций блокируют воздействие прогестерона во всех тканях. Такие композиции называются "чистыми антагонистами", их следует отличать от селективных модуляторов рецепторов прогестерона (СМРП), которые в зависимости от тканей способны действовать либо как агонисты, либо как антагонисты прогестерона. Известные в отрасли примеры СМРП включают в себя антипрогестины RU486 и ZK112993.RU486 (мифепристон) продемонстрировал способность задерживать появление новообразований у крыс при ежедневном введении в течение 3 недель после стимулирования онкогенеза при помощи 7,12 диметилбенз(а)антрацена (ДМБА). RU486 также проявил способность к снижению размера новообразования в сравнении с контрольными группами животных с установившимися новообразованиями. Однако уменьшение размера новообразований сопровождалось повышением в сыворотке крови РЭ и прогестерона. Как показали два небольших исследования, проведенных на женщинах с метастатическим раком молочной железы, RU486 обладает определенной эффективностью против болезни, хотя более масштабные испытания, проведенные во время этапа II, не смогли подтвердить этого. При дальнейшем изучении наблюдались симптомы недостаточности надпочечников. Эти побочные эффекты не явились неожиданными, если принять во внимание значительное антиглюкокортикоидное воздействие RU486 и его склонность повышать содержание РЭ в сыворотке крови. Оба этих фактора делают невозможным его постоянное применение у женщин. Статистические данные показывают, что из 200000 женщин США, которым в 2005 году был поставлен диагноз "рак молочной железы", у 60% женщин не было метастазирующих опухолей на момент хирургической операции, хотя у 30% женщин из той же самой группы со временем произошел бы рецидив. Женщин, чье первичное поражение содержит рецептор эстрогена (РЭ) и рецептор прогестерона(РП), в основном лечат гормональной терапией с использованием таких анти-РЭ, как тамоксифен или ингибиторы ароматазы. Около 70% РЭ- и РП-положительных больных восприимчивы к тамоксифену. И хотя присутствие как РЭ, так и РП имеет решающее значение для восприимчивости, и РЭ индуцирует РП, относительно небольшие усилия направлены на разработку антипрогестинов как возможных модуляторов развития и прогрессирования рака молочной железы. Таким образом, терапия, использующая восприимчивость к прогестерону рака молочной железы женщины, может предоставить значительное преимущество при лечении восприимчивого к гормонам рака молочной железы. В согласованном заявлении, сделанном Национальным институтом рака (НИР) в 1998 году, сообщалось, что тамоксифен может быть полезен для профилактического применения с целью предупреждения развития рака молочной железы. Подобные способы лечения могут иметь особые преимущества в предотвращении развития рака молочной железы у пациенток, проходящих ГЗТ. Предпочтительно, чтобы такие способы лечения не допускали высокого антиглюкокортикоидного воздействия, связанного со многими антипрогестиновыми композициями. Сущность изобретения Настоящее изобретение относится к способу лечения рака молочной железы, включающему совместное введение женщине, нуждающейся в этом, дозы соединения CDB-4124, подавляющей пролиферацию тканей рака молочной железы, и эффективного количества ингибитора ароматазы, выбранного из анастразола, летрозола и DL-аминоглутетимида. Вариантом данного способа является способ, где ингибитором ароматазы является DLаминоглутетимид. Другим вариантом данного способа является способ, где указанное CDB-4124 и ингибитор ароматазы вводятся одновременно. Настоящее изобретение также относится к способу подавления пролиферации тканей рака молочной железы, включающему этап одновременного воздействия на раковые ткани молочной железы ингибитором ароматазы, выбранным из группы, включающей анастразол, летрозол и DL-аминоглутетимид, и количеством соединения CDB-4124, подавляющим пролиферацию. Вариантом данного способа является способ, где ингибитором ароматазы является DL-аминоглутетимид. Изобретение обеспечивает синергическое химиотерапевтическое воздействие при лечении рака молочной железы. Настоящее изобретение также может оказаться полезными для лечения других состояний, таких как гиперпролиферация эндометрия, психическая депрессия, заболевания желчного пузыря, гипертензия,ненормальная толерантность к глюкозе и состояния гиперкоагуляции. Краткое описание фигур На фиг. 1 приведен график картины роста новообразований у крыс, не получавших лечение(С=контрольная группа), получавших по 10 мг RU-486 (RU), получавших по 10 мг прогестерона (Р 4),получавших по 20, 10, 2, 1 и 0,1 мг CDB-4124 (4124) и получавших те же самые концентрации CDB-4124+ 10 мг прогестерона (4124 + Р 4). Новообразования, увеличившиеся в площади поперечного сечения не менее чем на 33% в течение 28-дневного периода наблюдений, рассматривались как растущие (прямоугольники черного цвета). Те же новообразования, которые уменьшились не более чем на 33% за тот же самый период времени, рассматривались как регрессирующие (прямоугольники белого цвета). Другие новообразования рассматривались как статичные (прямоугольники серого цвета). На графике показаны проценты для каждого типа картины роста, для каждой лечебной группы, у которой наблюдались новообразования. На фиг. 2 приведен график, отображающий воздействие CDB-4124 в концентрациях 1, 2, 3, 4 и 5 мкмоль на клетки T47D (рак молочной железы женщины), сконструированные для экспрессии высоких уровней ароматазы (T47D аром клеток). Необработанные клетки использовали в качестве контрольных. Из графика видно, что лечение CDB-4124 подавляло разрастание T47D аром клеток в зависимости от дозы.(4) 100 мкмоль DL-аминоглутетимида (АГМ) + 4 мкмоль CDB-4124 на T47D аром клетки в присутствии 1 нмоль тестостерона. График демонстрирует синергетическое воздействие комбинации АГМ и CDB-4124 по подавлению разрастания клеток рака молочной железы, экспрессирующих ароматазу. Для комбинации 4 мкмольCDB-4124 и 100 мкмоль АГМ наблюдалось почти 70% подавление разрастания клеток, в то время как для тех же самых композиций и в тех же самых концентрациях, но вводимых раздельно, наблюдалось подавление менее 30%. Подробное описание изобретения Термин "эффективная дозировка" означает количество активного компонента композиции, достаточное для лечения конкретного состояния. Термин "селективные модуляторы рецепторов прогестерона" означает композиции, влияющие на функции рецептора прогестерона тканеспецифичным образом. Композиции, действующие как антагонисты рецепторов прогестерона в некоторых тканях (например, в тканях молочной железы) и как агонисты рецепторов прогестерона в других тканях (например, в матке). Термин "лечить" или "лечение", как он используется в настоящем документе, относится к лечению любого нарушения или заболевания, связанного с невозможностью остановить рост, апоптоз или пролиферативное физиологическое старение, и включает в себя, среди прочего: подавление нарушения или заболевания, которое приводит к прекращению развития нарушения или заболевания; облегчение нарушения или заболевания, например, способствуя регрессии нарушения или заболевания; или же облегчение состояния, вызванного нарушением или заболеванием, облегчение симптомов заболевания или нарушения. Термин "предупредить" или "предупреждение" в отношении нарушения или заболевания, связанный с невозможностью остановить рост, апоптоз или пролиферативное физиологическое старение, означает предотвращение начала развития нарушения или заболевания, если таковые еще не возникли, или предотвращение дальнейшего развития нарушения или заболевания, если таковые уже присутствуют. Например, композиции настоящего изобретения можно использовать для предупреждения рецидива новообразований. Рецидив новообразований может возникнуть по причине остаточных микроскопических групп или гнезд клеток новообразований, которые впоследствии разрастаются в клинически выявляемые новообразования. Термин "агонист прогестерона" означает такую композицию, которая связывается с рецептором прогестерона и имитирует действие естественного гормона. Термин "антагонист прогестерона" означает такую композицию, которая связывается с рецептором прогестерона и препятствует воздействию прогестерона. Термин "подавить", или "подавляет", или "подавление/подавляющий", используемый в настоящем документе в отношении разрастания ткани молочной железы, означает подавление митотического разрастания эндометриальной ткани при введении антагониста прогестерона в сравнении с отсутствием лечения эндометриальной ткани при одинаковых условиях, которое следует отличать от некроза клеток вследствие, например, апоптоза. Активность антагониста прогестерона в подавлении эндометриального митотического разрастания можно проверить, например, в колонии маточных клеток путем, например,сравнения включения бромдезоксиуридина (БДУ) в колонию клеток, обработанных антагонистом прогестерона, с контрольными (необработанными) клетками. Термин "без значительного снижения", как он используется в настоящем документе в отношении гормональных уровней у женщины, означает, что во время введения композиций изобретения гормональные уровни поддерживаются в пределах нормального диапазона. Таким образом, некоторое снижение гормонального уровня считается возможным, если только он удерживается в пределах нормального диапазона. Термин "без значительного повышения", как он используется в настоящем документе в отношении гормональных уровней у женщины, означает, что во время введения композиций изобретения гормональные уровни поддерживаются в пределах нормального диапазона. Таким образом, некоторое повышение гормонального уровня считается возможным, если только он удерживается в пределах нормального диапазона. Настоящее изобретение относится к методам лечения рака молочной железы путем введения композиции, включающей в себя один или более антипрогестинов в количестве, эффективном для подавления разрастания раковой ткани молочной железы. Эти методы возникают из неожиданного результата,заключающегося в том, что некоторые антипрогестины являются эффективными как для индуцирования апоптоза в раковой ткани молочной железы, так и для подавления разрастания раковой ткани молочной железы, что, таким образом, отличает данные композиции от других антипрогестинов, таких как RU486,-3 019224 который способен индуцировать апоптоз в раковой ткани молочной железы, но не может подавить разрастание той же самой ткани. Следовательно, антипрогестины настоящего изобретения поразительно эффективны для уменьшения роста существующих новообразований и предупреждения возникновения новых в ткани молочной железы. Антипрогестин может быть либо чистым антипрогестином, либо селективным модулятором рецепторов прогестерона (СМРП), если только антипрогестин обладает низким глюкокортикоидным воздействием. Предпочтительно, чтобы антипрогестин обладал таким низким эстрогенным/антиэстрогенным воздействием, при котором уровни эстрогенов в сыворотке крови сохраняются в значительной степени у пациентки, проходящей лечение антипрогестинами. В одном варианте изобретения указанная в нем композиция, состоящая из эффективного количества одного или более антипрогестинов, вводится пациентке, больной раком молочной железы, для лечения этого заболевания. Такое количество антипрогестина является эффективным для подавления разрастания раковой ткани молочной железы. В связанном аспекте настоящее изобретение обеспечивает использование антипрогестина для подавления пролиферации клетки рака молочной железы. Клеткой рака молочной железы может быть клетка рака млекопитающих, такая как клетка рака молочной железы человека. Клетка рака молочной железы также может быть устойчивой к антиэстрогену, такому как тамоксифен. В другом варианте изобретения указанная в нем композиция, состоящая из эффективного количества одного или более антипрогестинов, вводится пациентке, больной раком молочной железы, с одним или более новообразованиями, устойчивыми к антиэстрогеновой терапии, для лечения этого заболевания. Например, композиции настоящего изобретения могут быть, в частности, полезными для лечения пациенток с раком молочной железы, устойчивым к тамоксифену. В другом варианте изобретения указанная в нем композиция, состоящая из количества одного или более антипрогестинов, эффективного для подавления разрастания раковой ткани молочной железы,вводится в качестве одного из компонентов комбинированного режима при лечении этого заболевания. В этом отношении композиции настоящего изобретения могут вводиться до, во время или после введения какого-либо лечебного препарата, предназначенного для лечения рака молочной железы. Например, антипрогестины настоящего изобретения можно применять в комбинации с антиэстрогеном, антиандрогеном, селективным модулятором рецепторов эстрогена, например тамоксифеном, и ингибитором ароматазы, таким как анастразол, летрозол, эксеместан или DL-аминоглутетимид, а также с такими химиотерапевтическими средствами, как антрациклины, таксаны, алкилирующие препараты, метотрексат, винбластин, винкристин, цисплатин или любом их сочетании. Композиции изобретения могут действовать синергитически совместно с другими активными агентами, такими как антиэстрогены, антиандрогены, ингибиторы ароматазы, чтобы подавить разрастание клеток рака молочной железы у пациентки. В предпочтительном варианте композиции изобретения вводятся совместно с одним или более ингибиторами ароматазы при лечении пациенток, больных раком молочной железы. В настоящем изобретении также рассматриваются композиции, состоящие из эффективного количества антипрогестина и ингибитора ароматазы. Предпочтительная композиция состоит из CDB-4124 и ингибитора ароматазы, выбранного из группы, включающей в себя анастрозол, летрозол, эксеместан и DL-аминоглутетимид. В другом варианте изобретения указанная в нем композиция, состоящая из количества одного или более антипрогестинов, эффективного для подавления разрастания раковой ткани молочной железы,вводится пациентке, проходящей гормонотерапию, с целью предотвращения развития рака молочной железы. Например, композиции настоящего изобретения могут вводиться пациентке, проходящей гормонозаместительную терапию, с целью предотвращения развития рака молочной железы. Композиции настоящего изобретения могут также вводиться пациентке, проходящей эстрогенотерапию, с целью предотвращения развития рака молочной железы. Композиции настоящего изобретения подходят для длительного применения, которое необходимо для пациенток, больных раком молочной железы, проходящих гормоноблокирующую терапию, так как эти композиции обладают только низким связывающим действием на рецептор глюкокортикоидов и, следовательно, не оказывают воздействия на функции рецептора глюкокортикоидов. Соответственно, применение таких композиций может снизить побочные эффекты, такие как перепады настроения, усталость и потеря веса, типичные при использовании антипрогестинов с высоким сродством к рецептору глюкокортикоидов. Предпочтительно, чтобы композиции настоящего изобретения также обладали низким эстрогенным, антиэстрогенным и антиандрогенным воздействием или практически не оказывали такого воздействия. В этом отношении предпочтительными антипрогестинами являются CDB-4124 и CDB-4059, каждый из которых обладает низким антиглюкокортикоидным воздействием и продемонстрировал способность поддерживать уровни эстрогена в пределах нормального диапазона у пациенток во время лечения в течение не менее шести месяцев. Методы изобретения могут включать в себя введение композиции, содержащей такое количество антипрогестина,которое является достаточным для подавления разрастания раковых клеток молочной железы в течение курса лечения продолжительностью по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 или более дней. Введение композиции также может осуществляться в течение курса лечения продолжительностью по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 12 или более месяцев. Введение композиции также может осуществляться в течение курса лечения продолжительностью по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более лет. Во время периода приема композиция может вводиться ежедневно или периодически, например через день, через месяц и т.п. Введение композиции также может осуществляться с перерывами. Например, композиция может вводиться во время периода приема в течение 1, 2, 3, 4, 5 или более месяцев, после чего следует период приостановки введения, а за ним - период приема в течение 1, 2, 3, 4, 5 или более месяцев и т.д. Любой известный антипрогестин с характеристиками композиций, описанных выше, может применяться специалистом, использующим это изобретение. Особенно полезными являются такие композиции, которые раскрыты в патенте США 6861415, включенном в настоящий документ посредством ссылки во всей его полноте, имеющие общую формулу 21-замещенный 19-норпрегнаны где X может представлять, например, алкил, алкенил, алкинил, водород, галоген, моноалкиламино или диалкиламино амино, такие как N,N-диметиламино;R3 может представлять, например, метилокси, формилокси, ацетокси, ацилокси, S-алкокси, ацетилтеонил, глицимат, виниловый эфир, ацетилоксиметил, угольно-метиловый эфир, галогены, метил, гидрокси и этилокси. Примеры 21-замещенной 19-норпрегнаны включают в себя, среди прочего, следующие 24 композиции, раскрытые ниже. 1. CDB-4247 (21-пропионилокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9 диен-3,20-дион) со следующей структурной формулой: 2. CDB-4361 (21-виниловый эфир-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9 диен-3,20-дион) со следующей структурной формулой: 3. CDB-4059 (21-ацетокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 4. CDB-4124 (21-метокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 5. CDB-4031 (21-бром-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20 дион) со следующей структурной формулой: 6. CDB-3876 (21-хлор-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20 дион) со следующей структурной формулой: 7. CDB-4058 (21-фтор-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20 дион) со следующей структурной формулой: 8. CDB-4030 (21-метил-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20 дион) со следующей структурной формулой: 9. CDB-4152 (21-гидрокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 10. CDB-4167 (21-этилокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 11. CDB-4101 (21-метокситио-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9 диен-3,20-дион) со следующей структурной формулой: 12. CDB-4110 (21-ацетонид-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 13. CDB-4111 (21-BMD-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20 дион) со следующей структурной формулой: 14. CDB-4125 (21-(ЦИП-гидрокси)-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна 4,9-диен-3,20-дион) со следующей структурной формулой: 15. CDB-4205 (3-гидроксиамино-21-метокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19 норпрегна-4,9-диен-3,20-дион) со следующей структурной формулой: 16. CDB-4206 (3-гидроксиамино-21-ацетокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19 норпрегна-4,9-диен-3,20-дион) со следующей структурной формулой: 17. CDB-4226 (3-гидроксиамино-21-этилокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19 норпрегна-4,9-диен-3,20-дион) со следующей структурной формулой: 18. CDB-4262 (3-метоксиамино-21-этилокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19 норпрегна-4,9-диен-3,20-дион) со следующей структурной формулой: 19. CDB-4223 (21-метилтио-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой:(4-бензоин-21-ацетилтио-17-ацетокси-11-(4N,N-диметиламинофенил)-19 норпрегна-4,9-диен-3,20-дион) со следующей структурной формулой: 21. CDB-4239 (4-бензоин-21-метокси-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна 4,9-диен-3,20-дион) со следующей структурной формулой: 22. CDB-4306 (21-глицинат-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 23. CDB-4352 (21-цианотио-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен 3,20-дион) со следующей структурной формулой: 24. CDB-4362 (21-метоксиацетил-17-ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9 диен-3,20-дион) со следующей структурной формулой: 11-монодеметилированные производные 24 композиций, раскрытых выше (т.е. те, в которых X является N-метиламино), также особенно полезны при использовании настоящего изобретения. В этой связи композиция CDB-4453 (21-метокси-17-ацетокси-11-(4-N-метиламинофенил)-19-норпрегна-4,9 диен-3,20-дион), представляющая собой монодеметилированную производную CDB-4124, продемонстрировала еще меньшее антиглюкокортикоидное воздействие, чем его "родитель". Attardi и др., 2002,Мол. Клет. Эндокрин. 188:111-123, содержание которой включено в настоящий документ путем ссылки. Хотя композиции с общей формулой, приведенные выше, и их монодеметилированные производные являются предпочтительными, при использовании настоящего изобретения можно использовать любой антипрогестин для достижения антагонистического воздействия на рецептор прогестеронов при условии, что антипрогестин способен подавлять разрастание раковых клеток молочной железы. Предпочтительно, чтобы антипрогестин также обладал низким антиглюкокортикоидным воздействием. Предпочтительно, чтобы антипрогестин обладал минимальным эстрогенным и антиэстрогенным воздействием. Антипрогестины, которые могут быть полезны для изобретения, включают в себя, среди прочего: азоприснил (бензальдегид, 4-[(11,17)-17-метокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11-ил]-1(Е)-оксим; J867), его метаболит J912 (4-[17-гидрокси-17-(метоксиметил)-3-оксоэстра-4,9-диен-11 ил]бензальдегид-(1 Е)-оксим), а также другие композиции, описанные в DE 4332283 и DE 4332284; CDB2914 (17-ацетокси-11-(4-N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20-дион) и другие композиции, описанные в Stratton и др., 2000, Чел. Репрод. 15:1092-1099; JNJ-1250132 и другие композиции,описанные в Allan и др., 2006, Стероиды 71:949-954; 5-Арил-1,2-дигидрохромено[3,4-f]хинолины, описанные в Zhi и др., 1998, Ж. Мед. Хим. 41:291-302; 1,4-дигидро-бензо[d][1,3]оксазин-2-оны, описанные в патентах США 6509334, 6566358 и 6713478 под авторством Zhang и др.; 1,3-дигидроиндол-2-оны,описанные в патенте США 6391907 под авторством Fensome и др.; 2,3-дигидро-1 Н-индолы, описанные в патенте США 6417214 под авторством Ulrich и др.; бензимидазолоны и их аналоги, описанные в патенте США 6380235 под авторством Zhang и др.; 2,1-бензизотиазалон 2,2-диоксиды, описанные в патенте США 6339098 под авторством Collins и др.; циклокарбаматы и циклоамиды, описанные в патентах США 6306851 и 6441019 под авторством Santilli и др.; производные цикломочевины и циклического амида, описанные в патенте США 6369056 под авторством Zhang и др.; и производные хиназолина и банзоксазина, описанные в патенте США 6358948 под авторством Zhang и др. Другие антипрогестины, которые могут быть полезны для настоящего изобретения, включают в себя, среди прочего: (6,11,17)-11-(4-диметиламинофенил)-6-метил-4',5'-дигидроспиро[эстра-4,9-диен 17,2'(3'Н)-фуран]-3-он (ORG-31710) и другие композиции, описанные в патенте США 4871724;LG1127; LG120753; LG120830; LG1447; LG121046; CGP-19984A; RTI-3021-012; RTI-3021-022; RTI-3021020; RWJ-25333; ZK-136796; ZK-114043; ZK-230211; ZK-136798; ZK-98229; ZK-98734 и ZK-137316. Другие антипрогестины, которые могут быть полезными в изобретении, включают, среди прочего,композиции, описанные в патентах США 4386085, 4447424, 4519946 и 4634695; аналоги фосфорсодержащего 17-стороннего миферпристона, описанные в Jiang и др., 2006, Стероиды 71:949-954; онапристон (11-[p-(диметиламино)фенил]-17-гидрокси-17-(3-гидроксипропил)-13-эстра-4,9-диен-3-он) и другие композиции, описанные в патенте США 4780461; лилопристон Z)-11-[(4 диметиламино)фенил]-17-гидрокси-17-(3-гидрокси-1-пропенил)эстра-4,9-диен-3-он) и другие композиции, описанные в патенте США 4609651; 11-замещенные 19-норстероиды, такие как 11-(4 метоксифенил)-17-гидрокси-17-этинил-4,9-эстрадиен-3-он, описанные в Belagner и др., 1981, Стероиды 37:361-382; 11-арил-4-эстрины, такие как (Z)-11-[(4-диметиламино)фенил]-17-гидрокси-17-(3 гидрокси-1-пропенил)эстра-4-ен-3-он, описанные в патенте США 5728689; производные 11-арилэстрина, описанные в патентах США 5843933 и 5843931; производные 11-бензальдоксим-эстра-диен,- 10019224DE 19652408, DE 4434488, DE 4216003, DE 4216004 и WO 98/24803; фторированные стероиды 17-алкил цепи, такие как 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он,описанные в WO 98/34947; 17-спирофуран-3'-илидин стероиды, такие как 11-(4-ацетилфенил)-19,24 динор-17,23-эпокси-17-хола-4,9,20-триен-3-он, описанные в патенте США 5292878; (Z)-11,19-[4-(3 пиридинил)-о-фенилин]-17-гидрокси-17-[3-гидрокси-1-пропенил]-4-андростен-3-он и другие композиции, описанные в патенте США 5439913; 13-алкил-11 фенил гонаны, такие как 11-[4-(1 метилэтинил)фенил]-17-гидрокси-17-(3-гидроксипропил)-13-эстра-4,9-диен-3-он, описанные в патенте США 5446036; 11-арилстероиды, такие как 4',5'-дигидро-11-[4-(диметиламино)фенил]-6 метилспиро[эстра-4,9-диен-17,2'(3'Н)-фуран]-3-он, описанные в патенте США 4921845; 11 акрилэстрадины, описанные в патентах США 4829060, 4814327 и 5089488; 11 арил-4,9 гонадиены и 11-арил-13-алкил-4,9-гонадиены, описанные в патентах США 5739125, 5407928 и 5273971; 11 арил-6 алкил (или алкенил либо алкинил) стероиды, описанные в ЕР 289073; 10-, 11- стероиды, соединенные мостиковой связью, описанные в патенте США 5093507; 11 арил-14 стероиды, описанные в патенте США 5244886; 19,11- стероиды, соединенные мостиковой связью, описанные в патентах США 5095129, 5446178, 5478956 и 5232915; 1-арилсульфонил, арилкарбонил и 1-арилфосфонил-3-фенил 1,4,5,6-тетрагидропиридазины, описанные в патенте США 5684151; производные 1-арилсульфонил,арилкарбонил и арилтиокарбонил пиридазино, описанные в патенте США 5753655; производные 1,2 дигидро[1,2-g]хинолина и производные 1,2-дигидрохромено[3,4-f]хинолина, описанные в патентах США 5688808, 5693646, 5693647, 5696127, 5696130 и 5696133; оксастероиды 6, полученные из (8S,13S,14R)7-окса-эстра-4,9-диен-3,17-диона 1, описанные в Kang и др., 2007, Биоорг. Мед. Хим. Букв. 15:907-910; и 7-оксастероиды 4, описанные в Kang и др., 2007, Биоорг. Мед. Хим. Букв. 17:2531-2534. В предпочтительном варианте антипрогестином является CDB-4059 (21-ацетокси-17-ацетокси 11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20-дион). В наиболее предпочтительном варианте антипрогестином является CDB-4124 (21-метокси-17 ацетокси-11-(4N,N-диметиламинофенил)-19-норпрегна-4,9-диен-3,20-дион). Предпочтительно, чтобы антипрогестин снижал количество разрастающихся клеток на 100 клеток в линии раковых клеток молочной железы не менее чем примерно на 10, 15, 20, 25, 30, 35, 40, 45, 50, 55,60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99%. Линия раковых клеток молочной железы может быть чувствительна к тамоксифену, такому как MCF-7, или же она может быть устойчивой к тамоксифену,такому как LY-2. Другой вариант настоящего изобретения обучает методам, которые можно использовать для идентификации композиций, обладающих селективным воздействием на связывание рецепторов прогестерона. Эти методы включают в себя связывание рецепторов и биологические пробы in vivo, такие как антиMcGinty, анти-Clauberg, глюкокортикоидная, эстрогенная, андрогенная, антиглюкокортикоидная (АГ),антиэстрогенная и антиандрогенная активность, а также посткоитальная и антиовуляраторная активность, где в качестве ссылки используются ведущие композиции настоящего изобретения. Другой вариант настоящего изобретения обучает тому, что потенциальные антипрогестины также можно анализировать на их транскрипционную активность в клетках человеческого организма. При использовании раскрытых в настоящем изобретении антипрогестинов в качестве справочного материала такой анализ может предоставить данные о (1) взаимодействии возможного варианта композиции с рецептором прогестеронов; (2) взаимодействии активированного рецептора прогестеронов с другими транскрипционными факторами; (3) активации транскрипционного комплекса на чувствительном к прогестерону элементе(ЧПЭ). В этих экспериментах плазмиду, экспрессирующую человеческую изоформу PR-B (hPR-B), можно контрансфектировать в клетки HeLa, HepG2 или T47D любым индикатором, известным специалисту в соответствующей отрасли, под воздействием ЧПЭ-зависимого активатора. Такие индикаторы могут включать в себя, среди прочего, люциферазу, -галактозидазу, зеленый флюоресцирующий белок, красный флюоресцирующий белок или желтый флюоресцирующий белок. После трансфекции клетки обрабатывают либо возможным вариантом композиции, либо одним из раскрытых в настоящем патенте антипрогестинов, который выступает в качестве положительного контроля. После обработки клетки подвергаются анализу с целью экспрессии индикаторов. Другой вариант настоящего изобретения обучает тому, что предполагаемые антипрогестины можно проверить на их способность противодействовать отмиранию дексаметазон-введенных клеток в лимфоцитарной линии клеток СЕМ-7 человеческого орга- 11019224 низма и сравнивать с воздействием антипрогестинов, раскрытых в настоящей спецификации. В этих экспериментах дексаметазон можно добавлять в таких концентрациях, которые вызывают отмирание клеток. Затем клетки обрабатывают либо RU486, либо одним из антипрогестинов настоящего изобретения или контрольной композицией в концентрациях от 10-6 до 10-8 М. Композиции антипрогестина, которые можно использовать в соответствии с настоящим изобретением, могут быть синтезированы с применением таких известных в отрасли технологий для производства синтетических химических продуктов, как те, что раскрыты в патенте США 6861415. Следует понимать, что в условиях реакции некоторые функциональные группы могут сталкиваться с другими реактантами или реагентами и, следовательно, могут нуждаться во временной защите. Использование групп защиты описано в "Protective Groups in Organic Synthesis", 2nd edition ("Защитные группы в органическом синтезе", 2-е издание), Т.W. GreeneP.G.M. Wutz, Wiley-Interscience (1991). В одном варианте изобретения композиции изобретения включают в себя один или более антипрогестинов или соответствующих фармацевтически приемлемых солей. В зависимости от условий процесса полученная соляная композиция может быть либо в нейтральной форме, либо в форме соли. К соляным формам относятся гидраты и другие сольваты, а также кристаллические полиморфы. В соответствии с этим изобретением можно использовать как свободные основания, так и соли этих конечных продуктов. Соли с добавлением кислоты можно сами по себе трансформировать в свободные основания, используя такие агенты основания, как щелочь, или ионный обмен. Полученные свободные основания также могут создавать соли с органическими или неорганическими кислотами. При приготовлении солей с добавлением кислот предпочтительно использовать такие соли, которые образуют фармацевтически приемлемые соли. Примерами таких кислот являются соляная кислота,серная кислота, фосфорная кислота, азотная кислота, алифатическая кислота, алициклические карбоновые или сульфоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота,янтарная кислота, гликолевая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, глюкуроновая кислота, фумаровая кислота, малеиновая кислота, гидроксималеиновая кислота, пировиноградная кислота, аспарагиновая кислота, глютаминовая кислота, пгидроксибензойная кислота, памовая кислота, этансульфоновая кислота, гидроксиэтансульфоновая кислота, фенилуксусная кислота, миндальная кислота, галогенбензолсульфоновая кислота, толуолсульфоновая кислота, галактаровая кислота, галактуроновая кислота или нафталинсульфоновая кислота. Все кристаллические формы полиморфов могут быть использованы в соответствии с изобретением. Добавляемые соли основания также можно использовать в соответствии с изобретением, и приготовить их можно путем соединения свободных кислот с достаточным количеством основания, необходимого для производства соли обычным способом. Свободные кислоты можно регенерировать путем соединения соли с кислотой и изолирования свободной кислоты обычным способом. Фармацевтически приемлемые соли основания образуются с такими металлами или аминами, как щелочь или щелочноземельные металлы либо органические амины. Примерами металлов, используемых в качестве катионов,являются натрий, калий, кальций, магний и им аналогичные. Примерами подходящих аминов служат аминокислоты, такие как лизин, холин, диэтаноламин, этилендиамин, N-метилглюкамин и им аналогичные. Композиции настоящего изобретения можно приготовить в форме стандартной дозы или стандартных доз, пригодных для перорального, парентерального, трансдермального, ректального, трансмукозального или местного введения. Парентеральное введение включает в себя, среди прочего, внутривенное,внутриартериальное, внутрибрюшинное, подкожное, внутримышечное, интратекальное и интраартикулярное введение. Термин "пероральное введение" или "принимаемое через рот", используемый в настоящем документе, включает в себя любую форму приема лекарственного средства или указанной в настоящем документе композиции пациентом, когда средство или композиция помещается в рот, независимо от того,проглатывается это средство или композиция или нет. Таким образом, "пероральное введение" включает в себя трансбуккальное и сублингвальное введение, а также пищеводное (например, путем вдыхания) введение. В другом варианте композиции настоящего изобретения приготовлены в виде ректальных суппозиториев, которые могут содержать основы для суппозиториев, включая, среди прочего, масло какао или глицериды. Композиции настоящего изобретения также могут быть приготовлены как лекарственная форма для ингаляции, которая может быть в форме, включающей в себя, среди прочего, растворы, взвеси, суспензии или эмульсии, предназначенных для приема либо в форме сухого порошка, либо аэрозоля с использованием такого распыляющего вещества, как дихлорфторметан или трихлорфторметан. Композиции настоящего изобретения также могут быть приготовлены в формах для трансдермального введения, например в виде кремов, мазей, лосьонов, паст, гелей, медикаментозных пластырей, накладок или мембран. Такие композиции могут включать в себя любые подходящие формообразующие,например промоторы всасывания и им подобные вещества. Композиции настоящего изобретения также могут быть приготовлены в форме для парентерального введения, включая, среди прочего, инъекции и продолженные инфузии. Лекарственные формы могут включать в себя суспензии, растворы или эмульсии в масляных либо аналогичных им наполнителях. Такие композиции также можно выпускать в порошках для восстановления с соответствующими наполнителями, включая, среди прочего, стерильную, апирогенную воду, воду для инъекций и им аналогичные. Композиции настоящего изобретения также могут быть приготовлены в виде депо-препаратов, которые могут вводиться путем имплантации или внутримышечных инъекций. Такие композиции также могут быть приготовлены с применением подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в соответствующем масле), ионитов или умеренно растворимых производных (например,умеренно растворимой соли). Композиции настоящего изобретения также могут быть приготовлены в виде липосомного препарата. Липосомные препараты могут включать в себя липосомы, проникающие в необходимые клетки или роговой слой и сливающиеся с клеточной мембраной, обеспечивая доставку содержимого липосомы в клетку. Например, можно использовать липосомы, описанные в патентах США 5077211 под авторством Yarosh,4621023 под авторством Redziniak и др. или 4508703 под авторством Redziniak и др. Композиция настоящего изобретения может быть в форме таких твердых стандартных доз, как таблетки (например, суспензионные таблетки, раскусываемые суспензионные таблетки, быстро рассасываемые таблетки, жевательные таблетки, шипучие таблетки, двухслойные таблетки и т.д.); таблетки в форме капсулы, капсулы (например, капсулы из мягкого или твердого желатина); порошок (например, расфасованный порошок, одноразовый порошок или шипучий порошок); пастилки, саше, крахмальные облатки,лепешки, пилюли, гранулы, микрогранулы, микрогранулы в желатиновой капсуле, порошковые аэрозоли либо любые иные формы твердой дозировки, разумно пригодные для введения препаратов. Таблетки могут быть приготовлены в соответствии с любыми подходящими, хорошо известными фармакологическими технологиями. В одном варианте таблетки или другие формы твердой дозировки могут быть приготовлены путем использования процессов, в которых применяется один из методов,включающих в себя, среди прочего, (1) сухое смешивание, (2) прямое прессование, (3) помол, (4) сухую или безводную грануляцию, (5) влажную грануляцию, или (6) синтез, или комбинацию этих методов. Отдельные этапы процесса влажной грануляции при приготовлении таблеток обычно включают в себя помол и просеивание компонентов, смешивание сухих порошков, влажную компоновку массы, гранулирование и окончательное размалывание. Сухая грануляции включает в себя прессование сухой порошковой смеси в необработанную таблетку или "заготовку" на мощной ротационной таблеточной машине. Затем такие заготовки разбивают на гранулированные частицы за счет помола, что обычно выполняется путем их прохождения через вибрационный гранулятор. Отдельные этапы включают в себя смешивание порошков, прессование (комкование) и помол (измельчение заготовки или гранулирование). Как правило, ни на одном из этих этапов ни влажное связующее вещество, ни влага не применяются. В другом варианте формы твердой дозировки могут быть приготовлены путем смешивания антипрогестина с одним или более фармацевтическим наполнителем, чтобы создать в значительной степени однородную предварительную смесь. Затем предварительную смесь можно разделить и, как вариант,переработать дополнительно (например, спрессовать, инкапсулировать, расфасовать, диспергировать и т.д.) в любую необходимую форму дозировки. Спрессованные таблетки можно приготовить путем сжатия порошка или гранулированной композиции настоящего изобретения. В целом термин "спрессованная таблетка" относится к гладкой, непокрытой таблетке, пригодной для перорального приема внутрь, приготовленной путем простого прессования или путем обработки на вибрационном столе перед прессованием с последующим завершающим прессованием. Таблетки в соответствии с настоящим изобретением могут быть либо покрыты оболочкой,либо иным образом соединены, чтобы обеспечить дозировочную форму, обладающую улучшенными характеристиками по обработке или хранению. В одном варианте такое покрытие выбирают таким образом, чтобы оно не задерживало значительно наступление терапевтического эффекта композиции настоящего изобретения после его введения пациентке. Термин "суспензионная таблетка", как он используется в настоящем документе в отношении спрессованной таблетки, означает такую таблетку, которая быстро расщепляется после помещения в воду. Подходящие формы жидких доз композиции настоящего изобретения включают в себя растворы,водные или масляные суспензии, эликсиры, сиропы, эмульсии, жидкие аэрозоли, гели, кремы, мази и т.д. Такие композиции также могут выпускаться в виде сухого продукта для разбавления водой или иным подходящим наполнителем перед использованием. В одном варианте жидкие или полужидкие композиции после хранения в закрытой емкости либо при комнатной температуре, либо охлажденными (например, при температуре 5-10 С), либо замороженными в течение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев демонстрируют не менее 90%, не менее 92,5%, не менее 95%, не менее 97,5% исходного содержания антипрогестина в таких композициях. При необходимости композиции настоящего изобретения могут включать в себя один или более фармацевтически приемлемый наполнитель. Термин "наполнитель", как он используется в настоящем документе, означает любую субстанцию, которая сама по себе не является терапевтическим средством,использующуюся в качестве носителя или среды для введения терапевтического средства пациентке,либо добавляемую в фармацевтическую композицию с целью улучшения ее свойств при использовании или хранении, или же обеспечивающую или облегчающую формирование стандартной дозы композиции. В качестве примера наполнители включают в себя, среди прочего, разбавители, разрыхлители, связующие компоненты, клейкие вещества, смачивающие реагенты, смазывающие вещества, глиданты,агенты модифицирования поверхности или поверхностно-активные вещества, отдушки, суспендирующие агенты, эмульгаторы, безводные среды, консерванты, антиоксиданты, адгезивы, агенты для корректировки рН и осмолярности (например, буферные вещества), фиксаторы, загустители, подсластители,ароматизаторы, вкусовые добавки, красители или красящие вещества, промоторы всасывания и вещества, добавляемые с целью улучшения внешнего вида композиции. В качестве дополнительных наполнителей, используемых в композициях настоящего изобретения,могут применяться твердые вещества, полутвердые вещества, жидкости или их сочетания. Композиции настоящего изобретения, содержащие наполнители, могут быть приготовлены с использованием любой известной фармакологической технологии, которая включает в себя смешивание наполнителя с лекарственным или терапевтическим средством. Дополнительно композиции настоящего изобретения в качестве наполнителей могут включать в себя один или более фармацевтически приемлемых разбавителей. В качестве примера разбавители могут включать в себя либо по отдельности, либо в сочетании: лактозу, включая безводную лактозу и моногидрат лактозы; крахмалы, включая крахмал прямого сжатия и гидролизованные крахмалы (например, Celutab и Emdex); маннит; сорбит; ксилит; декстрозу (например, Cerelose 2000) и моногидрат декстрозы; дигидрат дикальций ортофосфата; разбавители на основе сахарозы; кондитерский сахар; одноосновной моногидрат сульфата кальция; двуводный сульфат кальция; гранулированный тригидрат лактата кальция; декстраты; инозит; гидролизированные сухие злаки; амилозу; целлюлозу, включая микрокристаллическую целлюлозу, пищевую и аморфную целлюлозу (например, Rexcel), а также целлюлозу в порошке; карбонат кальция; глицин; бентонит; поливинилпирролидон и им аналогичные. Такие разбавители, если они применяются, в общем составляют от приблизительно 5 до приблизительно 99%, от приблизительно 10 до приблизительно 85% или от приблизительно 20 до приблизительно 80% общей массы композиции. Любой выбранный разбавитель или любые выбранные разбавители в качестве предпочтительных демонстрируют подходящие реологические свойства и, если необходимо для производства таблеток, прессуемость. Использование сверхгранулированной микрокристаллической целлюлозы (т.е. микрокристаллической целлюлозы, добавляемой во влажную гранулированную композицию после этапа высушивания) может повысить твердость (таблеток) и/или улучшить время расщепления. Дополнительно композиции настоящего изобретения в качестве наполнителей могут включать в себя один или более фармацевтически приемлемых разрыхлителей, особенно для таблеток, капсул или других твердых препаратов. Подходящие разрыхлители включают в себя, либо по отдельности, либо в сочетании: крахмалы,включая натрия гликоля крахмала (например, Explotab производства PenWest) и пептизированные кукурузные крахмалы (например, National 1551, National 1550 и Colocorn 1500), глины (например,Veegum HV), целлюлозу, такую как очищенная целлюлоза, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза и натрий-карбоксиметилцеллюлоза, кроскармеллоза натрия (например, Ac-Di-Sol производства FMC), альгинаты, кросповидон и такие гумми, как агар, гуар, ксантан,сладкий рожок, карайя, пектин и трагакантовая камедь. Разрыхлители можно добавлять на любом подходящем этапе во время приготовления композиции,в частности перед этапом гранулирования или же во время смазывания перед прессованием. Такие разрыхлители, если они применяются, в общем составляют от приблизительно 0,2 до приблизительно 30%,от приблизительно 0,2 до приблизительно 10% или от приблизительно 0,2 до приблизительно 5% общей массы композиции. Дополнительно композиции настоящего изобретения в качестве наполнителей могут включать в себя один или более фармацевтически приемлемых связующих компонентов или клейких веществ, особенно для таблеток. Предпочтительно, чтобы такие связующие компоненты и клейкие вещества придавали достаточное слипание таблетируемому порошку, чтобы обеспечить нормальную обработку, например задание размеров, смазывание, прессование и упаковку, и одновременно обеспечивали расщепление таблетки и абсорбирование композиции при приеме внутрь. Подходящие связующие компоненты и клейкие вещества включают в себя, либо по отдельности, либо в комбинации: гуммиарабик; трагакант; сахарозу; желатин; глюкозы; крахмалы, такие как, среди прочего, пептизированные крахмалы(например, National 1511 и National 1500); целлюлозу, такую как, среди прочего, метилцеллюлоза и кармелоза натрия (например, Tylose); альгиновую кислоту и соли альгиновой кислоты; алюмосиликат магния; ПЭГ; гуаровую смолу; полисахаридные кислоты; бентониты; повидон, например, повидон K-15,K-30 и K-29/32; полиметакрилаты; ГПМЦ; гидроксипропилцеллюлозу (например, Klucel) и этилцеллюлозу (например, Ethocel). Такие связующие компоненты и/или клейкие вещества, если они применяются, в общем составляют от приблизительно 0,5 до приблизительно 25%, от приблизительно 0,75 до приблизительно 15% или от приблизительно 1 до приблизительно 10% общей массы композиции. Дополнительно композиции настоящего изобретения в качестве наполнителей могут включать в себя один или более фармацевтически приемлемых смачивающих реагентов. Примеры поверхностноактивных веществ, которые можно использовать в качестве смачивающих реагентов в композициях на- 14019224(блок-сополимеры полиоксиэтилена и полиоксипропилена), глицериды и масла жирных кислот полиоксиэтилена, например полиоксиэтилен (8) каприловые/каприновые моно- и диглицериды (например,Labrasol производства Gattefoss), полиоксиэтилен (35) касторовое масло и полиоксиэтилен (40) гидрогенизированное касторовое масло; полиоксиэтилен алкилэфиры, например полиоксиэтилен (20) цетостеариловый эфир, полиоксиэтилен эфиры жирных кислот, например полиоксиэтилен (40) стеарат, полиоксиэтилен сорбитанэфиры, например полисорбат 20 и полисорбат 80 (например, Tween 80 производства ICI), пропиленгликолевые эфиры жирных кислот, например пропиленгликоль лаурат (например,Lauroglycol производства Gattefoss), лаурилсульфат натрия, жирные кислоты и их соли, например олеиновая кислота, олеиново-кислый натрий и триэтаноламин олеат, глицерилэфиры жирных кислот,например глицерилмоностеарат, сорбитанэфиры, например сорбитанмонолаурат, сорбитанмоноолеат,сорбитанмонопалмитат и сорбитанмоностеарат, тилоксапол и их смеси. Такие смачивающие реагенты,если они применяются, в общем составляют от приблизительно 0,25 до приблизительно 15%, от приблизительно 0,4 до приблизительно 10% или от приблизительно 0,5 до приблизительно 5% общей массы композиции. Дополнительно композиции настоящего изобретения в качестве наполнителей могут включать в себя один или более фармацевтически приемлемых смазывающих веществ (включая антиадгезивы и/или глиданты). Подходящие смазывающие вещества включают в себя, либо по отдельности, либо в комбинации: глицерил бегенат (например, Compritol 888); стеариновую кислоту и ее соли, включая стеараты магния (стеарат магния), кальция и натрия; гидрогенизированные растительные масла (например, Sterotex); коллоидную кремнекислоту; тальк; воск; борную кислоту; бензойно-кислый натрий; ацетат натрия; фумарат натрия; хлорид натрия; DL-лейцин; ПЭГ (например, Carbowax 4000 и Carbowax 6000); олеиново-кислый натрий; лаурилсульфат натрия и лаурилсульфат магния. Такие смазывающие вещества,если они применяются, в общем составляют от приблизительно 0,1 до приблизительно 10%, от приблизительно 0,2 до приблизительно 8% или от приблизительно 0,25 до приблизительно 5% общей массы композиции. Подходящие антиадгезивы включают в себя тальк, кукурузный крахмал, DL-лейцин, лаурилсульфат натрия и стеараты металлов. В качестве антиадгезива или глиданта тальк применяется, например, для снижения прилипания препарата к поверхностям оборудования, а также для уменьшения статичности в смеси. Один или более антиадгезивов, если они применяются, в общем составляют от приблизительно 0,1 до приблизительно 10%, от приблизительно 0,25 до приблизительно 5% или от приблизительно 0,5 до приблизительно 2% общей массы композиции. Глиданты могут применяться для активирования текучести порошка в твердых препаратах. Подходящие глиданты включают в себя коллоидный диоксид кремния, крахмал, тальк, трикальцийфосфат, порошкообразную целлюлозу и трисиликат магния. Особенно предпочтительным является коллоидный диоксид кремния. Композиции настоящего изобретения могут содержать один или более антивспенивателей. В качестве примера антивспенивателя можно привести симетикон. Антивспениватели, если они применяются, в общем составляют от приблизительно 0,001 до приблизительно 5%, от приблизительно 0,001 до приблизительно 2% или от приблизительно 0,001 до приблизительно 1% общей массы композиции. В качестве примера антиоксидантов для использования в настоящем изобретении можно привести,среди прочего, бутилированный гидрокситолуол, бутилированный гидроксианизол, метабисульфит калия и им аналогичные вещества. При необходимости в композиции обычно присутствует один или более антиоксидантов в количестве от приблизительно 0,01 до приблизительно 2,5%, например приблизительно 0,01, приблизительно 0,05, приблизительно 0,1, приблизительно 0,5, приблизительно 1, приблизительно 1,5, приблизительно 1,75, приблизительно 2, приблизительно 2,25 или приблизительно 2,5% по массе. В различных вариантах изобретения композиции изобретения могут содержать консервант. Подходящие консерванты включают в себя, среди прочего, бензалкония хлорид, метил, этил, пропил или бутилпарабен, бензиловый спирт, фенилэтиловый спирт, бензетоний, метил или пропил ргидроксибензоат и сорбиновую кислоту либо их сочетания. Обычно дополнительный консервант присутствует в количестве от приблизительно 0,01% до приблизительно 0,5% или от приблизительно 0,01% до приблизительно 2,5% по массе. В одном варианте изобретения композиции изобретения могут дополнительно содержать буферное вещество. Буферные вещества включают в себя такие вещества, которые понижают изменения рН. В качестве примерных классов буферных веществ для использования в различных вариантах настоящего изобретения можно привести соль металлов группы 1A, включая, например, бикарбонатную соль металлов группы 1A, карбонатную соль металлов группы 1A, буферные вещества на основе щелочных или щелочно-земельных металлов, буферные вещества на основе алюминия, буферные вещества на основе кальция, буферные вещества на основе натрия или буферные вещества на основе магния. Подходящие буферные вещества включают в себя карбонаты, фосфаты, бикарбонаты, цитраты, бораты, ацетаты, фталаты, тартраты, сукцинаты любого из указанных выше веществ, например фосфат, цитрат, борат, ацетат,бикарбонат и карбонат кальция или калия. Среди прочего, примеры подходящих буферных веществ в себя включают алюминий, гидроксид магния, глицинат алюминия, ацетат кальция, бикарбонат кальция, борат кальция, карбонат кальция, цитрат кальция, глюконат кальция, глицерофосфат кальция, гидроксид кальция, лактат кальция, фталат кальция, фосфат кальция, сукцинат кальция, тартрат кальция, двухосновной фосфат натрия, вторичный кислый фосфат калия, дикалий фосфат, вторичный кислый фосфат натрия, двунатриевый сукцинат, сухой гель гидроокиси алюминия, ацетат магния, алюминат магния, борат магния, бикарбонат магния, карбонат магния, цитрат магния, глюконат магния, гидроксид магния, лактат магния, алюминат метасиликата магния, оксид магния, фталат магния, фосфат магния, силикат магния, сукцинат магния, тартрат магния, ацетат калия, карбонат калия, бикарбонат калия, борат калия, цитрат калия, метафосфат калия, фталат калия, фосфат калия, полифосфат калия, пирофосфат калия, сукцинат калия, тартат калия, ацетат натрия, бикарбонат натрия, борат натрия, карбонат натрия, цитрат натрия, глюконат натрия, вторичный кислый фосфат натрия, гидроксид натрия, лактат натрия, фталат натрия, фосфат натрия, полифосфат натрия, пирофосфат натрия, сесквикарбонат натрия, сукцинат натрия, тартрат натрия, триполифосфат натрия, синтетический гидроталькит, пирофосфат тетракалия, пирофосфат тетранатрия, трикалий фосфат,тринатрийфосфат и трометарнол (частично основано на перечне, предоставленном в каталоге The MerckIndex, MerckCo. Rahway, N.J. (2001. Кроме того, в описанных в настоящем документе фармацевтических композициях могут использоваться комбинации или смеси любых двух или более из указанных выше буферных веществ. Один или более буферных веществ, если они применяются, в общем составляют от приблизительно 0,01 до приблизительно 5% или от приблизительно 0,01 до приблизительно 3% по массе. В различных вариантах изобретения композиции изобретения могут содержать одно или более веществ, повышающих вязкость. В качестве примера веществ, повышающих вязкость, можно привести,среди прочего, метилцеллюлозу, натрий-карбоксиметилцеллюлозу, этилцеллюлозу, каррагенин, карбопол и/или их сочетания. Обычно одно или более веществ, повышающих вязкость, если они применяются,в общем составляют от приблизительно 0,1 до приблизительно 10% или от приблизительно 0,1 до приблизительно 5% по массе. В различных вариантах изобретения композиции изобретения могут содержать "органолептический агент", предназначенный для улучшения органолептических свойств композиции. Термин "органолептический агент", как он используется в настоящем документе, означает любой наполнитель, способный улучшить вкус или запах, либо помогающий скрыть неприятный вкус или запах композиции настоящего изобретения. Такие агенты включают в себя подсластители, ароматизаторы и/или вещества, корригирующие вкус и запах лекарственного средства. Подходящие подсластители и/или ароматизаторы включают в себя любое вещество, подслащивающее фармацевтическую композицию или придающее ей вкус и запах. Дополнительные органолептические агенты обычно присутствуют в композиции настоящего изобретения в количестве от приблизительно 0,1 до приблизительно 10 мг/мл, от приблизительно 0,5 до приблизительно 5 мг/мл или приблизительно 1 мг/мл. В качестве примера подсластителей или ароматизаторов можно привести, среди прочего, сироп акации, анетол, анисовое масло, ароматизирующий эликсир, бензальдегид, бензальдегидный эликсир,циклодекстрины, тмин, тминное масло, кардамоновое масло, семена кардамона, кардамоновый спирт,настойку кардамона, вишневый сок, вишневый сироп, корицу, коричное масло, коричную воду, лимонную кислоту, сироп лимонной кислоты, гвоздичное масло, какао, сироп какао, кориандровое масло, декстрозу, эриодиктион, жидкий экстракт эриодиктиона, сироп эриодиктиона, ароматик, этилацетат, этилванилин, фенхелевое масло, имбирь, жидкий экстракт имбиря, экстракционное эфирное масло имбиря,декстрозу, глюкозу, сахар, мальтодекстрин, глицерин, солодку, эликсир солодкового корня, экстракт солодкового корня, чистый экстракт солодкового корня, жидкий экстракт солодкового корня, сироп солодкового корня, мед, изоспиртовой эликсир, лавандовое масло, лимонное масло, лимонную настойку, маннитол, метилсалицилат, мускатное масло, эликсир горького апельсина, масло горького апельсина, масло из цветков померанца, флердоранжевую воду, апельсиновое масло, горечь апельсиновой цедры, сладкую настойку апельсиновой цедры, апельсиновый спирт, апельсиновый сироп, перечную мяту, масло перечной мяты, мятный спирт, перечно-мятный настой, фенилэтиловый спирт, сок малины, малиновый сироп,розмариновое масло, розовое масло, концентрированную розовую воду, сахарин, сахарин кальция, сахарин натрия, сироп сарсапарели, сарсапарель, раствор сорбитола, мяту кудрявую, масло мяты кудрявой,сахарозу, сироп сукралоза, тимьяновое масло, толуанский бальзам, сироп толуанского бальзама, ваниль,ванильную настойку, ванилин, черешневый сироп или их комбинации. В качестве примера веществ, корригирующие вкус и запах лекарственного средства, можно привести, среди прочего, циклодекстрины, эмульсии циклодекстринов, частицы циклодекстринов, комплексы циклодекстринов и/или их сочетания. В качестве примера суспендирующих средств можно привести, среди прочего, сорбитовый сироп,метилцеллюлозу, сироп глюкозы/сахара, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу,- 16019224 гель стеарата алюминия и гидрогенизированные пищевые жиры. В качестве примера эмульгаторов можно привести, среди прочего, лецитин, моноолеат сорбитана и гуммиарабик. Безводные наполнители включают в себя, среди прочего, пищевые масла, миндальное масло, фракционированное кокосовое масло, масляные эфиры, пропиленгликоль и этиловый спирт. Указанные выше наполнители могут выполнять несколько задач, как это известно в отрасли. Например, крахмал может выступать как в качестве заполнителя, так и в качестве разрыхлителя. Приведенная выше классификация наполнителей не должна толковаться в качестве ограничивающей ни при каких обстоятельствах. Композиции настоящего изобретения могут вводиться любым способом, включая, среди прочего,перорально, парентерально, сублингвально, трансдермально, ректально, трансмукозально, местно, путем вдыхания, трансбуккально либо путем сочетания этих способов. Парентеральное введение включает в себя, среди прочего, внутривенное, внутриартериальное, внутрибрюшинное, подкожное, внутримышечное, интратекальное, интраартикулярное, интрацистернальное и интравентрикулярное введение. Терапевтически эффективное количество композиции, необходимое для применения при лечении, среди прочих факторов изменяется в зависимости от необходимой продолжительности лечения, возраста и состояния здоровья пациентки и окончательно определяется лечащим врачом. Тем не менее, дозы, используемые для лечения людей, обычно составляют от 0,001 до 500 мг/кг в день, например от приблизительно 1 мкг/кг до приблизительно 1 мг/кг в день или приблизительно от 1 до приблизительно 100 мкг/кг в день. Для большинства крупных млекопитающих общая суточная доза составляет от 1 до 100 мг, предпочтительно от 2 до 80 мг. Режим дозирования можно корректировать, чтобы обеспечить оптимальный коэффициент эффективности. Необходимую дозу можно стандартно вводить разово или в виде нескольких доз через соответствующие интервалы, например, по две, три, четыре или более поддоз в день. В качестве примера, композиция изобретения может вводиться пациентке с целью получения антипрогестина в дозах от приблизительно 1 мкг/кг до приблизительно 1 мг/кг веса, например приблизительно 1, приблизительно 25, приблизительно 50, приблизительно 75, приблизительно 100, приблизительно 125, приблизительно 150, приблизительно 175, приблизительно 200, приблизительно 225, приблизительно 250, приблизительно 275, приблизительно 300, приблизительно 325, приблизительно 350, приблизительно 375, приблизительно 400, приблизительно 425, приблизительно 450, приблизительно 475, приблизительно 500, приблизительно 525, приблизительно 550, приблизительно 575, приблизительно 600, приблизительно 625, приблизительно 650, приблизительно 675, приблизительно 700, приблизительно 725,приблизительно 750, приблизительно 775, приблизительно 800, приблизительно 825, приблизительно 850, приблизительно 875, приблизительно 900, приблизительно 925, приблизительно 950, приблизительно 975 мкг/кг или приблизительно 1 мг/кг веса. Пациентки, проходящие лечение композициями настоящего изобретения, должны регулярно проходить проверку на содержание эстрогена в сыворотке крови и уровни глюкокортикоидов. Ниже приведен неполный ряд примеров, призванных помочь понять идеи настоящего изобретения. Пример 1. Препараты по настоящему изобретению могут быть приготовлены в виде таблеток. Для получения таблеток с целью использования настоящего изобретения следующие ингредиенты могут быть спрессованы вместе в таблеточной машине: Для получения двухслойных таблеток с целью использования настоящего изобретения следующие ингредиенты могут быть спрессованы вместе в таблеточной машине: Для получения таблеток, содержащих антиэстрогены, с целью использования настоящего изобретения следующие ингредиенты могут быть спрессованы вместе в таблеточной машине: Для получения маслянистых препаратов с целью использования настоящего изобретения следующие ингредиенты могут быть смешаны вместе и залиты в ампулы: Пример 2. Композиции настоящего изобретения обладают только слабой способностью на связывание рецепторов антиглюкокортикоидов. Для ряда антипрогестинов был проведен анализ на связывание рецепторов с целью определить их способность связывать рецептор прогестеронов (rbPR) и рецептор глюкокортикоидов (rbGR) кролика. Коротко говоря, в буферном растворе TEGMD (10 ммоль Tris, pH 7,2, 1,5 ммоль EDTA, 0,2 ммоль молибдата натрия, 10% глицерин, 1 ммоль DTT) из матки или тимуса соответственно молодых крольчих,которым предварительно был введен эстрадиол, были подготовлены PR или GR, содержащие цитозоль. Для связывания PR цитозоль был инкубирован 6 нмоль 1,2-[3 Н]прогестероном (50,0 Ci/ммоль) и в него были добавлены конкуренты в концентрации от 2 до 100 нмоль. Для связывания с GR цитозоль был инкубирован 6 нмоль 6,7-[3 Н]-дексаметазоном (40 Ci/ммоль) и в него были добавлены контрольные композиции в концентрации от 20 до 100 нмоль. После инкубации в течение ночи при 4 С связанные и несвязанные [3 Н] стероиды были разделены за счет добавления нагруженной декстраном угольной пыли при 2100g в течение 15 мин при 4 С. Супернатанты, содержащие комплексы рецепторов [3 Н]-стероидов,были сцежены в пробирки с 4 мл Optifluor (Packard Instrument Co.), перемешаны, уравновешены в жидкостном сцинтилляционном счетчике в течение 30 мин, а затем посчитаны в течение 2 мин. ЭК 50 (эффективная концентрация) для каждой калибровочной кривой и кривой каждой из композиций были определены путем считывания данных в компьютерную программу определения четырех сигмоидальных параметров (RiaSmart Immunoassay Data Reduction Program, Packard Instrument Co., Meriden, Conn.). Относительное связывающее сродство (ОСС) к каждой композиции было рассчитано по следующей формуле: ЭК 50 калибровочной/ЭК 50 контрольной композиции 100. Калибровочными для анализа PR и GR явились непомеченный прогестерон и дексаметазон соответственно. Результаты этих экспериментов были сведены в табл. 1 в виде соотношений соответствующего связующего сродства каждой композиции к рецепторам rbPR и rbGR (rbPR/rbGR). Разность отражает относительную активность композиции в клетке или ткани, которые обладают двумя рецепторами и необходимыми транскрипционными кофакторами. В таблице также приведены относительные биологические активности тех же самых композиций в матке крольчих по анализам анти-McGinty и анти-Clauberg. В этих экспериментах композиция CDB-2914(указанная в конце таблицы) использовалась в качестве контрольной или эталонной композиции (биологическая активность у крольчихи=1,00), так как результаты экспериментов с использованием CDB-2914 были опубликованы ранее (Hild-Petito и др., 1996; Passaro и др., 1997; Reel и др., 1998; Larner и др., 2000). Для теста анти-McGinty молодые крольчихи ежедневно получали подкожные инъекции по 5 мкг эстрадиола в растворе 10% этанол/кунжутное масло в течение шести дней подряд. На седьмой день животным была сделана абдоминальная хирургическая операция по стерилизации с легированием 3-4 см сегментов обоих рогов матки. Контрольная композиция в соответствующем растворителе была интралюминально введена в легированный сегмент одного рога матки, а в другой был введен только наполнитель. В течение следующих трех дней каждой крольчихе вводили стимулирующую дозу прогестерона (267 мкг/день),чтобы вызвать эндометриальное разрастание. Все животные были умерщвлены на 10 день, чтобы извлечь матки. После чего сегмент, расположенный по центру лигатур, был удален и зафиксирован в 10% нейтральном буферном формалине, а затем передан на гистологическую обработку. Пятимикронные срезы, окрашенные гематоксилином и козином, были изучены при помощи микроскопа на степень разрастания эндометриальных желез. Был рассчитан процент подавления эндометриального разрастания для каждой крольчихи и записано среднее значение для группы из пяти животных. Для теста анти-Clauberg молодые крольчихи ежедневно получали подкожные инъекции по 5 мкг эстрадиола в растворе 10% этанол/кунжутное масло в течение шести дней подряд. На седьмой день животные стали получать прогестерон путем подкожной инъекции (160 мкг/день) и экспериментальную композицию в соответствующем наполнителе перорально или подкожно в течение 5 последующих дней. Одна группа крольчих получала только прогестерон. Через 24 ч после последней дозы все животные были умерщвлены для удаления матки, которая была очищена от всего жира и соединительной ткани, взвешена с точностью до 0,2 мг и помещена в 10% нейтральный буферный формалин для последующей гистологической обработки. 5 микронные срезы, окрашенные гематоксилином и эозином, были изучены при помощи микроскопа на степень разрастания эндометриальных желез. Процент подавления эндометриального разрастания для каждого уровня дозировки контрольной композиции был выведен путем сравнения только с прогестерон-стимулированными животными. Данные, приведенные в табл. 1 (биолог. актив. у крольчих), отражают среднее значение результатов, полученных для каждой композиции путем анализа анти-McGinty и анти-Clauberg в сравнении с CDB-2914. Протестированные антипрогестины были категоризированы на основе селективности каждой композиции для крольчихи PR в сравнении с крольчихой GR, как указано в табл. 1. Антипрогестины также были категоризированы на основе биологической активности в матке крольчих. Из данных, приведенных в табл. 1, видно, что сродство ведущих композиций к рецептору прогестеронов было не менее чем в 1,5 раза больше, чем сродство к рецептору глюкокортикоидов. Результаты этих исследований также показывают, что две ведущие композиции CDB-4124 и CDB4059 обладают сильной антипрогестиновой активностью в матке крольчих по сравнению с RU486 иCDB-2914. У обеих композиций отсутствуют эстрогенные, андрогенные, антиэстрогенные и антиандрогенные активности. Обе композиции обладают минимальным антиглюкокортикоидным эффектом на рецептор, особенностью, которая отличает их от RU486 и CDB-2914, которые оказывают умеренное воздействие по связыванию рецептора глюкокортикоидов. В этих анализах CDB-4124 показала себя несколько лучше, чем CDB-4059. Таблица 1 Активность по связыванию рецепторов и биологическая активность антипрогестинов Пример 3. Индукция опухолевого роста и латентность появления опухоли. Чтобы вызвать опухоли молочной железы, самкам крыс Sprague-Dawley в возрасте 50 дней дали по 10 мг/кг веса тела ДМБА. Одна из 14 групп крыс (группа 2) в возрасте 50 дней вместо ДМБА получила сезамовое масло для контроля в качестве не-ДМБА. Еженедельно крыс взвешивали и пальпировали вдоль сосковой линии на предмет каких-либо признаков патологических изменений или набуханий. Опухолевые узлы регистрировались и измерялись циркулем в двух направлениях еженедельно. Когда размер опухолей достигал размера 10-12 мм в любом из направлений, отдельное животное случайным образом распределялось в одну из 14 групп. Опухоли появлялись самое раннее на 39 дней и самое позднее на 194 день после принудительного перорального введения (животные с более поздним проявлением в исследование не включены). Средний латентный период появления опухоли составил 10630 дней. С точки зрения латентности между группами, получавшими ДМБА, разницы не было (р=0,545, критерий Краскала-Уоллиса). Животные проходили лечение в течение 28 дней по следующей схеме. Группа 1 ежедневно получала подкожные (п.к.) инъекции наполнителя (10% раствор этанола в кунжутном масле). Группа 2 (неДМБА контрольная группа - опухоли не ожидались) получала наполнитель по схеме, выбранной предварительно, для имитации начала лечения сроком три месяца. Группы 3 и 4 ежедневно получали п.к. инъекции RU486 или тонкодисперсного прогестерона в количестве 10 мг/кг веса тела соответственно. Группы с 5 по 9 получали по 20, 10, 2, 1 и 0,1 мг/кг CDB-4124 соответственно. Группы 10-14 получали лечение, аналогичное группам 5-9, за исключением того, что в композиции для инъекций также добавляли по 10 мг/кг тонко дисперсного прогестерона. Уровень прогестерона у животных оценивался три раза: первоначально перед началом лечения,второй раз через 21 день после начала лечения и последний раз после завершения лечения во время умерщвления через 2-4 дня после последней п.к. инъекции. Все пробы крови были забраны путем сердечной пункции; была приготовлена сыворотка крови, которая хранилась в замороженном виде при температуре -40 С. Уровни прогестерона, кортизола и кортикостерона в стероидных гормонах были определены способом ИФА (иммуноферментный анализ). Анализ выполнялся с использованием Statgraphics Plus. Различие между группами определялись по ДА (дисперсионный анализ), если средние значения по группам были хорошо распределены. В противном случае применялся тест Краскала-Уоллиса. Оценка различий между средними значениями выполнялась с использованием критерия Стьюдента, если группы отвечали критерию и не являлись ни эксцессом, ни асимметричной группой. В противном случае применялся непараметрический критерий МаннаУитни-Уилкоксона. При последовательной оценке одних и тех же крыс применялся двусторонний критерий Стьюдента. Если представлялось возможным разместить данные в группы для сравнения, применялся точный критерий Фишера. Пример 5. Количество опухолей и тип опухолей при аутопсии. Животные были умерщвлены на 3-5 день после завершения 28-дневного курса лечения, с них была слита кровь, были удалены опухоли; животные были взвешены, измерены, осмотрены и часть из них была заморожена и/или помещена в 10% фосфатный буферный формалин для гистопатологии. Образцы тканей были нарезаны и окрашены гематоксилином и эозином, затем прошли исследование на гистопатологическую классификацию. Гистологически были определены четыре типа опухолей (табл. 2): аденокарциномы (АКА), папиллокарциномы (ПКА), фибросаркома и фиброаденомы или аденофибромы (ФА или АФ). Опухоли последних двух типов не рассматривались в качестве представляющих явно выраженные злокачественные опухоли. Минимальное количество опухолей для начала лечения составляло 1 при условии, что самая крупная ("ведущая") опухоль сопровождалась одной или более меньшими опухолями, не достигшими минимального размера. Результаты этих экспериментов сведены в табл. 2. При умерщвлении множественность АКА, дополненных ПКА, у крыс, получавших только наполнитель, составляла 2,7 опухолей на крысу (столбец АКА+ПКА не всегда выражает дополнение АКА у крысы ПКА, так как опухоли могут быть смешанных типов). Как видно из табл. 2, у группы 2 (не получавшей канцероген ДМБА) опухолей не было. У крыс, получавших только ДМБА, среднее количество опухолей составляло 2,67 на крысу. Добавление прогестерона повысило среднее количество опухолей почти до 5 на крысу. Лечение с применением CDB-4124 оказало общее воздействие на сокращение количества опухолей. Средняя множественность у четырех групп, лечение которых являлось наиболее эффективным (т.е. 20, 10, 2, 1 мг/кг/день), составила 1,58 опухолей на крысу. Такое снижение количества опухолей показывает, что композиция CDB-4124 не только уменьшила рост существующих опухолей, но также предотвратила возникновение новых опухолей у этих животных, так как каждое животное выбиралось для лечения в произвольном порядке на основе обнаружения одной опухоли определенного размера. Таблица 2 Воздействие лечения на тип и количество опухолейa ТХ в течение 28 дней после появления первой опухоли;b ТХ по 10 мг/кг веса тела. Пример 6. Воздействия антипрогестинов на развитие опухоли. Чтобы оценить воздействия CDB-4124, RU486 и прогестерона на рост и развитие опухоли, во время курса лечения осуществлялся текущий контроль кинетики роста и размера опухоли. У животных с опухолями, участвовавшими в исследовании, еженедельно измеряли циркулем отдельные опухоли в двух направлениях. Общие результаты этих экспериментов приведены на фиг. 1. Данные были скорректированы таким образом, чтобы исключить доброкачественные типы опухолей ФА/АФ. Новообразования,увеличившиеся в площади поперечного сечения не менее чем на 33% в течение 28-дневного периода наблюдений, рассматривались как растущие (фиг. 1, прямоугольники черного цвета). Те же новообразования, которые уменьшились примерно на 33%, рассматривались как регрессирующие (фиг. 1, прямоугольники белого цвета). Другие новообразования рассматривались как статичные (фиг. 1, прямоугольники серого цвета). Как показано на фиг. 1, лечение прогестероном увеличило количество растущих опухолей молочной железы. И хотя доля (8%) регрессирующих опухолей у животных из группы, получавшей прогестерон, статистически была аналогична доле у животных из контрольной группы, доля растущих опухолей (80%) у них была значительно выше (р 0,004, точный критерий Фишера). Лечение RU486 привело к явному увеличению доли регрессирующих опухолей в сравнении с контрольной группой, хотя такое увеличение и не являлось статистически значимым. В отличие от лечения прогестероном, лечение CDB-4124 в дозах по 10 мг/кг веса тела уменьшило долю растущих опухолей (р 0,013) и повысило долю регрессировавших опухолей (р 0,003). Результаты показали, что 70% опухолей стали регрессировать после лечения CDB4124. Наблюдалась явная зависимость от дозы, и неэффективными являлись только самые маленькие дозы CDB-4124. Воздействия CDB-4124 были устранены при лечении животных дополнительным прогестероном в соотношении 5:1 или выше. Дававшийся в меньших соотношениях прогестерон был неспособен преодолеть воздействия CDB-4124. С точки зрения темпа роста доза 10 мг/кг CDB-4124 была более эффективна, чем доза 20 мг/кг, что предполагает, что в более высоких дозах CDB-4124 может обладать некоторым воздействием, аналогичным воздействию агониста прогестерона, хотя воздействия дозы в 20 мг/кг CDB-4124 на рост опухолей и близко не подходят к воздействию прогестерона (р=0,0008, точный критерий Фишера, двусторонний). Однако доза 20 мг/кг (но не меньшие дозы) также значительно повышала уровни циркулирующего прогестерона, и воздействия не зависели от дозы. Таким образом,CDB-4124 способен подавлять рост вызванных ДМБА опухолей молочной железы крыс, и такое подав- 21019224 ление включает в себя уменьшение размера и количества опухолей молочной железы. Такой прогестерон, продемонстрировавший пролиферативное и увеличивающее опухоль воздействие, демонстрирует всю важность подавления прогестерона у животных с уже сформировавшимися и возникающими опухолями молочной железы. Результаты использования CDB-4059 были аналогичны результатам, раскрытым выше для CDB-4124. Таким образом, воздействие CDB-4059 на подавление опухолей аналогично воздействию, оказываемому CDB-4124, и обе эти композиции обладают значительно более сильным воздействием на подавление опухолей, чем RU486. При введении только CDB-4124 в умеренных концентрациях или при ее избытке по отношению к прогестерону воздействия композиции играют предоминирующую роль и стимулируют регрессию опухолей. И наоборот, при введении только прогестерона или при его избытке по отношению к CDB-4124 прогестерон действует таким образом, что опухоли растут. Пример 7. Количество опухолей, размер опухолей и опухолевая масса при аутопсии. В табл. 3 показаны воздействия прогестерона, RU486 и CDB-4124 на средний размер опухолей и средний общий вес опухоли на одно животное (опухолевая масса). В табл. 3 приведены результаты для АКА, ПКА и комбинации АКА/ПКА. Опухоли ФА и АФ из нее исключены. Таблица 3 Воздействие лечения на количество опухолей, размер опухолей и опухолевую массу ДМБА - 7,12-диметилбенз(а)антрацена; ТХ в течение 28 дней после появления первой опухоли;b в сравнении со средним весом опухоли в контрольной группе;c ТХ по 10 мг/кг веса тела. Прогестерон явным образом увеличил опухолевую массу и средний размер опухолей. Однако эти значения не были статистически значимыми в сравнении со значениями у контрольной группы (р 0,4,критерий Манна-Уитни-Уилкоксона). Данные для прогестерона резко контрастируют с данными для антипрогестинов. RU486 и CDB-4124 снизили опухолевую массу и средние размеры опухолей: в 5 раз дляRU486 (р 0,01) и в 10 раз для CDB-4124 (р 0,001). Уменьшение опухолевой массы и размера опухоли в других группах было аналогично воздействию CDB-4124 на размер опухоли при дозировках 10, 2 и 1 мг/кг. CDB-4124 была неэффективна при самых низких дозировках, а самая высокая доза CDB-4124(20 мг/кг) имела меньшую эффективность, чем доза в 10 мг/кг. Следует отметить, что некоторые опухоли регрессировали полностью и больше не пальпировались. Среди 11 опухолей данного типа, которые контролировались во время лечения, при аутопсии мы обнаружили кистозные структуры, наполненные геморрагической субстанцией, что предполагает регрессию. Такие структуры были обнаружены только в группах, проходивших лечение с применением RU486 (n=2), с применением CDB-4124 по 20, 10, 2 или 1 мг/кг (n=7) или с применением 20 мг/кг CDB-4124 плюс 10 мг/кг прогестерона (n=2). По той причине,что они не поддавались гистологической оценке, подтвердить их идентичность невозможно. Тем не менее, данные результаты предполагают, что антипрогестины способны регрессировать опухоли полностью. Пример 8. Вес животных во время исследования. Вес животных из контрольной группы сравнивали с весом животных, получавших гормональное лечение, чтобы лучше оценить токсичность, особенно вызываемую CDB-4124. Животных взвешивали еженедельно на протяжении 27-недельного периода исследования. В конце экспериментов значительные различия веса у животных, проходивших лечение, в сравнении с весом животных из контрольной группы обнаружены не были, что указывает на нетоксичность CDB-4124 даже в больших дозах. Пример 9. Пролиферация опухолей и апоптоз. Чтобы оценить воздействия прогестинов и антипрогестинов на пролиферацию клеток, были изучены срезы тканей, взятые у 46 отдельных крыс с опухолями из лечебных групп и контрольной группы,путем измерения экспрессии маркера пролиферации Ki-67 с использованием антитела Ki-67(NeoMarkers, Фремонт, шт. Калифорния) и иммуногистохимии. Несмотря на уменьшение размера многих опухолей в группах 3 и 6, последующее лечение в группах 3 и 6 сделало опухоли слишком маленькими для вторичного среза. В группах 1, 3, 4, 6 и 11 было выполнено 7-12 вторичных срезов АКА. Результаты экспериментов по пролиферации, в которых пролиферация измерялась как процент клеток,экспрессирующих Ki-67, сведены в табл. 4. Таблица 4 Пролиферирующие опухолевые клетки по Ki-67 Прогестерон увеличил процентное содержание пролиферирующих клеток в сравнении с животными из контрольной группы и животными, проходившими лечение с применением CDB-4124. Прогестерон привел к самой высокой доле пролиферирующих клеток, и такой рост намного превышал тот, что наблюдался в контрольной группе и группах, проходивших лечение с применением RU486 или CDB4124 плюс прогестерон. Лечение только CDB-4124 привело к более низкой доле Ki-67-положительных клеток, чем при лечении любыми другими композициями, и такая доля была меньше, чем в контрольной группе. Образцы тканей крыс, проходивших лечение композицией CDB-4124, показали меньшую пролиферацию (меньшее количество Ki-67-положительных клеток), чем образцы тканей, взятые у крыс,проходивших лечение композицией RU486 (р=0,021, критерий Стьюдента). Таким образом, композицияCDB-4124 оказала более сильное воздействие, чем RU486 с точки зрения предотвращения пролиферации в тканях молочной железы (р=0,011, односторонний критерий Стьюдента). Воздействия CDB-4124 также отличались от воздействий CDB-4124 + Р 4 (р=0,048, критерий Стьюдента). Более того, лечение композицией CDB-4124 и Р 4 вызывало меньшее количество пролиферирующих клеток, чем лечение одним Р 4(р=0,030, критерий Стьюдента). Пролиферация уменьшалась в группах в следующем порядке: прогестерон (наибольшая пролиферация)контрольная=RU486=CDB-4124 + прогестеронтолько CDB-4124. Следовательно, CDB-4124 сокращает количество пролиферирующих клеток даже в присутствии равного количества добавленного прогестерона. Апоптоз оценивался в тех же самых опухолях с применением комплекта для гибридизации апоптоза (Oncor, Гейтерсберг, шт. Мэриленд). Клетки в апоптозе были оценены в периферийных областях опухолей вдали от некроза. Было оценено не менее 1000 клеток на опухоль. Четкое различие групп, получавших лечение, по отношению к контрольной группе, не получавшей лечение, показано в табл. 5. Анализ последствий по критерию размаха множественной выборки показал, что CDB-4124 вместе с прогестероном вызывают больший апоптоз, чем наблюдался у животных из контрольной группы или группы, проходившей лечение прогестероном. Более того, RU486, CDB-4124 и CDB4124+прогестерон вызывали более высокий апоптический некроз клеток, чем тот, что наблюдался в опухолях животных контрольной группы. Воздействия лечения с применением CDB-4124 также отличались от воздействийRU486 (р=0,73, критерий Стьюдента). Подобным образом, воздействия CDB-4124 были аналогичны воздействиям CDB-4124 + Р 4 (р=0,98, критерий Стьюдента). Эти результаты предполагают, что в присутствии примерно одинакового количества прогестерона опухоли реагируют апоптозом на антипрогестинCDB4124. И напротив, CDB-4124 вызывает повышение апоптоза в сравнении с Р 4 (р=0,020, критерий Стьюдента). Явный синергизм между CDB-4124 и прогестероном отсутствует. По-видимому, способность CDB-4124 понижать пролиферацию является важной для подавляющего воздействия CDB-4124 на опухоль, так как одно из основных различий между CDB-4124 и RU486 заключается в том, что CDB4124 уменьшает пролиферацию более эффективно, чем RU486. Прерывание или подавление сильного пролиферативного воздействия прогестерона представляет собой вероятный механизм, за счет которогоCDB-4124 может снизить пролиферацию. Пример 10. Экспрессия рецепторов эстрогенов и прогестеронов (РЭ и РП) в опухолевых тканях. Опухоли, оцененные на пролиферацию и апоптоз, также были оценены на экспрессию рецепторов эстрогенов и прогестеронов путем иммуногистохимии (ИГХ). Был определен и проанализирован процент клеток, положительных к РЭ и РП. Опухоли были сгруппированы в четыре различные категории: опухоли с 0% клеток, экспрессирующих РЭ; опухоли с 10% клеток, экспрессирующих РЭ; опухоли с 1530% клеток, экспрессирующих РЭ; опухоли с 30-50% клеток, экспрессирующих РЭ. В общем, опухоли,не подвергавшиеся лечению, постоянно экспрессировали РЭ. Все 12 проанализированных опухолей экспрессировали РЭ. Четыре из этих 12 опухолей содержали 30-50% РЭ-положительных клеток. В отличие от опухолей, не подвергавшихся лечению животных из контрольной группы, 3 из 7 проанализированных опухолей, лечившихся CDB-4124, не содержали клеток, экспрессирующих РЭ, ни одна из них не содержала 30-50% клеток, экспрессирующих РЭ, и только одна проба содержала 15-30% клеток, экспрессирующих РЭ. Таким образом, лечение с применением RU486 или CDB-4124 снижало количество клеток,экспрессирующих РЭ. Лечение прогестероном привело к увеличению количества клеток, экспрессирующих РЭ, в сравнении с образцами, взятыми у животных, проходивших лечение с применением CDB-4124 или RU486. Сочетание CDB-4124 и прогестерона имело тенденцию к созданию картины, более схожей с той, что характерна для лечения только с использованием CDB-4124. Этот результат совпадает с наблюдением относительного того, что сочетание 10 мг/кг CDB-4124 с 10 мг/кг прогестерона оказывала воздействие, подавляющее опухоли, включая уменьшение количества опухолей, подавление роста опухолей и снижение веса опухоли. В общем, продолжительное лечение антипрогестином имеет тенденцию к снижению уровня РЭ в опухолях, в то время как прогестерон оказывает противоположное воздействие. Пример 11. Экспрессия рецептора прогестеронов (РП) в опухолях. Опухоли, не подвергавшиеся лечению, постоянно экспрессировали РП (12 из 12 опухолей). В общем, опухоли, не подвергавшиеся лечению, экспрессировали больше рецепторов как РЭ, так и РП, следовательно, возможно, что многие злокачественные опухоли являются экспрессорами этих двух транскрипционных факторов. По-видимому, лечение с применением RU486 является более нейтральным для РП, a CDB-4124 снижала уровень экспрессии РП. Интересно, что в трех опухолях RU486 вызвала потерю РЭ, но удержала низкие положительные уровни РП. Прогестерон имеет тенденцию повышать экспрес- 24019224 сию РП. Комбинация CDB-4124 и прогестерона имеет тенденцию создавать картину, более схожую с применением только одной композиции CDB-4124, что опять же сопоставимо с воздействием комбинации 10 мг/кг CDB-4124 + 10 мг/кг прогестерона на количество опухолей, картину роста и вес опухолей. В общем, продолжительное лечение с применением CDB-4124 имеет тенденцию к снижению уровня РП в опухолях, в то время как прогестерон оказывает противоположное воздействие. Таким образом, опухоли поддерживают восприимчивость к прогестерону в присутствии прогестерона. Пример 12. Проверка воздействий антипрогестинов на уровни гормонов в сыворотке крови. Во время исследования концентрации стероидных гормонов определялись три раза: перед началом лечения, через 21 день лечения после начала лечения и последний раз после завершения лечения во время умерщвления через 2-4 дня после последней п.к. инъекции. Все образцы были забраны путем сердечной пункции. Была приготовлена сыворотка крови, которая хранилась в замороженном виде при температуре -40 С. Уровни стероидных гормонов были определены способом ИФА (иммуноферментный анализ). Результаты измерения прогестерона у крыс приведены в табл. 6. Таблица 6 Воздействие лечения на уровень прогестерона в сыворотке крови р 0,05 композиции контрольным (группа 1)=р 0,05, композиции для Р 4 (группа 4) Различия в уровнях прогестерона в сыворотке крови между группами перед лечением (р=0,49, ДА) или после лечения (р=0,35, ДА) не было, но значительные изменения были обнаружены во время лечения(р=0,000, ДА). Многие схемы вызывали повышение прогестерона в сравнении с животными контрольной группы, особенно в тех группах, получавших самые большие количества RU486 и CDB-4124 (табл. 6). Значительные различия, наблюдавшиеся между проходившими лечение группами на 21 день, характерны для следующих групп (р=710-6, критерий Краскала-Уоллиса): RU486, три самые высокие дозы CDB4124 и две самые высокие дозы CDB-4124 плюс прогестерон. CDB-4059 не повышал уровни прогестерона в сыворотке крови выше тех, что были определены перед началом лечения дозами по 10 мг/кг. Прогестерон в сыворотке крови вернулся к значению дня 0 во всех группах, кроме группы, получавшей по 20 мг/кг CDB-4124 плюс прогестерон, у которой после прекращения лечения падение прогестерона в сыворотке крови не наблюдалось (р=0,004, двусторонний критерий Стьюдента, односторонний). Неспособность прогестерона самого по себе повысить собственную концентрацию в сыворотке крови озадачила,но, возможно, причиной этого явился тот факт, что высокий экзогенный прогестерон подавлял эндогенное продуцирование. Экзогенный прогестерон также мог метаболизироваться в период между п.к. инъекцией и забором крови, который выполнялся на 20-24 ч позже. Отсутствие воздействия CDB-4059 в концентрации 10 мг/кг на уровни эндогенного прогестерона у женщин может явиться его преимуществом в сравнении с CDB-4124 в той же самой концентрации. Пример 13. Измерение кортизола. Ряд различных экспериментальных систем подтверждает тот вывод, что RU486 повышает кортизол,так как RU486 обладает сильными антиглюкокортикоидными свойствами у людей и приматов. Однако у крыс, получавших по 10 мг/кг RU486, значительные расхождения в уровнях кортизола не наблюдались. И наоборот, у крыс, получавших аналогичные дозы CDB-4124 или CDB-4059, содержание кортизола в сыворотке крови было значительно выше, чем у крыс из контрольной группы. Такие повышенные уровни составляли 3-4 мкг/дл (30-40 нг/мл). Результатом дозозависимости этих повышенных доз CDB-4124 явилось повышение кортизола. Различие воздействий RU486 в сравнении с CDB-4124 или CDB-4059 на уровни кортизола можно объяснить, предположив, что после 21 дня постоянного введения печень крысы была способна усваиватьRU486 лучше, чем любую из двух CDB-композиций. Пример 14. Измерение кортикостерона. У крыс кортикостерон является самым широко распространенным глюкокортикоидом. Воздействие СМРП на кортизол может быть вторичным в сравнении с сильным воздействием на кортикостерон. Для лучшего изучения этого явления были измерены уровни кортикостерона в группах, в которых проявились самые значительные изменения уровней кортизола, например, в группах, получавших дозы 20 или 10 мг/кг CDB-4124. Для сравнения были исследованы следующие группы: группа, получавшая по 20 мг/кг CDB-4124 одновременно с 10 мг/кг прогестерона; группа, получавшая по 10 мг/кг CDB-4124 одновременно с 10 мг/кг прогестерона; группа, получавшая 10 мг/кг RU486; группа, получавшая только 10 мг/кг прогестерона; контрольная группа; группа, не получавшая ДМБА, у которой не было опухолей. Уровни кортикостерона были в 10-40 раз выше уровней кортизола. Однако в отношении средних уровней кортикостерона разницы между группами практически не наблюдалось. Различий между 8 группами перед лечением не было (р=0,43, критерий Краскала-Уоллиса), через 21 день лечения (р=0,57, критерий Краскала-Уоллиса) или после 28 дней лечения и при умерщвлении (р=0,061, критерий КраскалаУоллиса). Статистической разницы в уровнях кортикостерона у животных с опухолями и животных без опухолей не было ни на 21 день (р=0,94, критерий Стьюдента, двусторонний), ни при умерщвлении(р=0,37, критерий Стьюдента, двусторонний). Для измерения воздействий экзогенного прогестерона на содержание кортикостерона в сыворотке крови выполнялось сравнение уровней кортикостерона в трех группах пар, различавшихся по тому, получали они экзогенный прогестерон или нет (например, проводились сравнения контрольной группы с группой, получавшей прогестерон; или группы, получавшей CDB-4124 в дозах 20 мг/кг, с группой, получавшей CDB-4124 в дозах 20 мг/кг вместе с прогестероном; или группы, получавшей CDB-4124 в дозах 10 мг/кг, с группой, получавшей CDB-4124 в дозах 10 мг/кг вместе с прогестероном). Были выявлены статистически значимые различия: уровни кортикостерона были снижены у тех животных, которые после 21 дня лечения стали получать прогестерон (р=0,029, критерий Манна-Уитни-Уилкоксона, двусторонний). Данное воздействие не было подтверждено в серозных жидкостях, взятых при умерщвлении. Различия в уровне кортикостерона в сыворотке крови между группами, получавшими прогестерон иCDB-4124, прогестерон и RU-486 или RU-486 и CDB-4124, обнаружены не были. Также была исследована взаимосвязь между серозной жидкостью кортизола и серозной жидкостью кортикостерона в каждой группе. Между двумя группами, получавшими CDB-4124 в дозах 20 мг/кг (r2=0,78) и CDB-4124 в дозах 10 мг/кг (r2=0,82), и группой, получавшей RU486 (r2=0,85), наблюдалась значительная линейная корреляция. Добавление прогестерона в первые две группы, получавшие CDB-4124, сделало взаимосвязь менее значительной (r2=0,34 для группы 10 и r2=0,37 для группы 11 соответственно). Сам по себе прогестерон такой положительной взаимосвязи не показал (r2=-1,0). У контрольной группы взаимосвязь между двумя глюкокортикоидами не проявилась (r2=0,064). Таким образом, возможно, что повышенные уровни кортизола у групп, получавших CDB-4124, взаимосвязаны с уровнями кортикостерона по причине трансформации из кортикостерона, уровень которого каким-либо образом повышен. Данное предположение согласуется с воздействием CDB-4124, рассмотренным выше - воздействие на метаболические энзимы,ответственные за уровни прогестерона и кортизола. Несмотря на то что значительного воздействия CDB4124 на первичный глюкокортикоид крысы обнаружено не было, однако для целей безопасности пациенток, получавших CDB-4124 или CDB-4059 на этапе I клинических исследований, следует контролировать на предмет возможного антиглюкокортикоидного воздействия, включая возможное повышение содержания кортизола, кортикостерона или АКТГ в сыворотке крови. Пример 15. Проверка антипролиферативного воздействия СМРП в клетках рака молочной железы,устойчивых к тамоксифену. Использовались две линии клеток: MCF-7 (линия клеток, чувствительных к антиэстрогену, тамоксифену) и LY-2 (разновидность MCF-7, устойчивая к тамоксифену). Разрастание измеряется в 96 ячеистых пластинах микротитратора. 5103 клеток добавлено в каждую ячейку. В ячейки добавлены растворы питательной среды и препарата при помощи Perkin Elmer Cetus PRO/PETTE. В качестве питательной среды применяется IMEM с добавлением 5% бычьей плодной жидкости. Было протестировано восемь концентраций от 0,078 до 10 мкмоль в двух повторностях. Образцы включают в себя только тамоксифен и каждую из композиций, раскрытых в настоящей спецификации в комбинации с тамоксифеном. После четырехдневной инкубации среда была заменена свежей, содержащей препарат, и, в общей сложности, через семь дней монослои клеток были закреплены трихлоруксусной кислотой и окрашены сульфорходаминовым красителем. Спектральные поглощающие способности (492 нм) извлеченных окрашенных растворов измеряются на сканирующем спектрофотометре для прочтения планшетов TitertekMultiscan. Были построены кривые зависимости "доза-эффект" (процент контрольных спектральных поглощательных способностей в сравнении с концентрациями препарата) с целью оценить значения IC50,определенные как концентрации препарата (микромолярные), подавляющие разрастание на 50%. Значения IC50 являются коррелятивными действенности протестированных препаратов в отношении подавления разрастания и, следовательно, предоставляют информацию, необходимую для идентификации композиций, подходящих для предотвращения гиперпролиферации клеток рака молочной железы, устойчивых к тамоксифену. Пример 16. Антипролиферативное воздействие CDB-4124 и ингибитор ароматазы DLаминоглутетимид в клетках рака молочной железы T47D со сверхэкспрессией ароматазы. Ингибирование ароматазы стало первой линией лечения пациенток с раком молочной железы, положительным к рецепторам стероидов. Определение эффективности ингибиторов ароматазы in vitro было затруднительно, поскольку известные клетки рака молочной железы экспрессируют очень низкое ароматазное воздействие. Таким образом, построение линии клеток T47D со сверхэкспрессией ароматазы было выполнено путем клонирования гена ароматазы (hCYP19A1) от кДНК человеческой плаценты в вектор экспрессии pcDNA3.1 и устойчиво трансформирующие клетки рака молочной железы T47D млекопитающих с сохранением пустого вектора в качестве контрольного. Последовательные данные по рекомбинированной pcDNA3.1, несущей hCYP19A1, продемонстрировали 100% попадание в области открытой рамки считывания hCYP19A1. Трансфецированные клетки ароматазы были профильтрованы и отобраны на сверхэкспрессию ароматаза-активных протеинов. Экспрессия ароматазы одноклеточного клона (T47D аром) была подтверждена анализами ОТ-ПЦР, Вестерн блоттинг, ИФА эстронов и анализом на пролиферацию клеток. ОТ-ПЦР показала экспрессию ароматазы иРНК в T47D аром примерно в 32 раза выше, чем у родительских Т 47D-клеток, продемонстрировав большую экспрессию иРНК как с введением тестостерона, так и без такового. Экспрессия протеина ароматазы 58 kD была подтверждена анализом Вестерн блоттинга с использованием моноклональных антител антиароматазы мышей. Экспрессия ароматазы в контрольных клетках T47D выявлена не была. Высокое ароматазное воздействие в клеткахT47D аром было подтверждено комплектом ИФА эстронов. Коротко, высокие уровни эстрона были определены при обработке 10 нмоль андростендиона в течение 24 ч в сравнении с контрольными клеткамиT47D. ИФА эстронов демонстрирует меньшую абсорбцию при 450 нмоль для клеток T47D аром в сравнении с контрольными клетками T47D. Клетки T47D аром были высеяны в 24-луночные планшеты по 10000 клеток на лунку, инкубированы в течение двух дней, а затем обрабатывались CDB-4124 в концентрации 1, 2, 3, 4 и 5 мкмоль в течение четырех дней в условиях нормальной культуры (минимальная поддерживающая среда - 10% телячья сыворотка крови на полоске древесного угля/без фенола). Необработанные клетки использовали в качестве контрольных. Для измерения пролиферации клеток применялся анализ с использованием кристаллического фиолетового. Краситель (кристаллический фиолетовый), использовавшийся в этом анализе, окрашивает ДНК. После солюбилизации количество красителя, захваченное клетками, можно определить по спектрофотометру. Лечение CDB-4124 подавляло разрастание T47D аром клеток в зависимости от дозы. См. фиг. 2. Затем клетки T47D аром были высеяны в 24-луночные планшеты по 10000 клеток на лунку и через два дня инкубации обрабатывались 50, 75, 100 или 150 мкмоль DL-аминоглутетимида (АГМ) в присутствии 1 нмоль тестостерона в течение четырех дней при нормальной культуре, после чего были измерены воздействия на пролиферацию клеток. Результаты приведены на фиг. 3. Затем клетки T47D аром были высеяны в 24-луночные планшеты по 10000 клеток на лунку и через два дня инкубации обрабатывались:(4) 100 мкмоль DL-аминоглутетимида (АГМ) + 4 мкмоль CDB-4124 в течение четырех дней при нормальной культуре в присутствии 1 нмоль тестостерона, после чего были измерены воздействия на пролиферацию клеток. Результаты приведены на фиг. 4. Подавление разрастания клеток во время комбинированного лечения АГМ и CDB-4124 зависело от дозы. Удивительно, но наблюдалось синергетическое воздействие комбинации АГМ и CDB-4124 по подавлению разрастания клеток рака молочной железы, экспрессирующих ароматазу. На фиг. 4 видно, что для комбинации 4 мкмоль CDB-4124 и АГМ наблюдалось почти 70% подавление разрастания клеток, в то время как для тех же самых композиций и в тех же самых концентрациях, но вводимых раздельно, наблюдалось подавление менее 30%. Иначе говоря, наблюдавшееся подавление разрастания клеток во время комбинированного лечения АГМ и CDB-4124 было больше того, что можно было ожидать, исходя из подавления, наблюдавшегося при лечении либо только АГМ,- 27019224 либо только CDB-4124. Эти результаты демонстрируют, что высокие дозы CDB-4124 вместе с подавлением ароматазы обеспечивают признак синергически улучшенного химиотерапевтического воздействия при лечении рака молочной железы. Аналогичное синергическое воздействие на разрастание клеток можно ожидать при лечении композицией CDB-4124 в комбинации с другими ингибиторами ароматазы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рака молочной железы, включающий совместное введение женщине, нуждающейся в этом, дозы соединения CDB-4124, подавляющей пролиферацию тканей рака молочной железы, и эффективного количества ингибитора ароматазы, выбранного из анастразола, летрозола и DLаминоглутетимида. 2. Способ по п.1, где ингибитором ароматазы является DL-аминоглутетимид. 3. Способ по п.1, где указанное CDB-4124 и ингибитор ароматазы вводятся одновременно. 4. Способ подавления пролиферации тканей рака молочной железы, включающий этап одновременного воздействия на раковые ткани молочной железы ингибитором ароматазы, выбранным из группы, включающей анастразол, летрозол и DL-аминоглутетимид, и количеством соединения CDB-4124,подавляющим пролиферацию. 5. Способ по п.4, где ингибитором ароматазы является DL-аминоглутетимид.
МПК / Метки
МПК: A61K 31/4196, A61P 35/00, A61K 31/56
Метки: рака, молочной, железы, композиции, лечения, методы
Код ссылки
<a href="https://eas.patents.su/30-19224-kompozicii-i-metody-dlya-lecheniya-raka-molochnojj-zhelezy.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции и методы для лечения рака молочной железы</a>
Предыдущий патент: Кристаллические формы производных фениламинопиримидина
Следующий патент: Способ изготовления линзы для установки на светодиоде
Случайный патент: Способ нейтрализации катализатора полимеризации