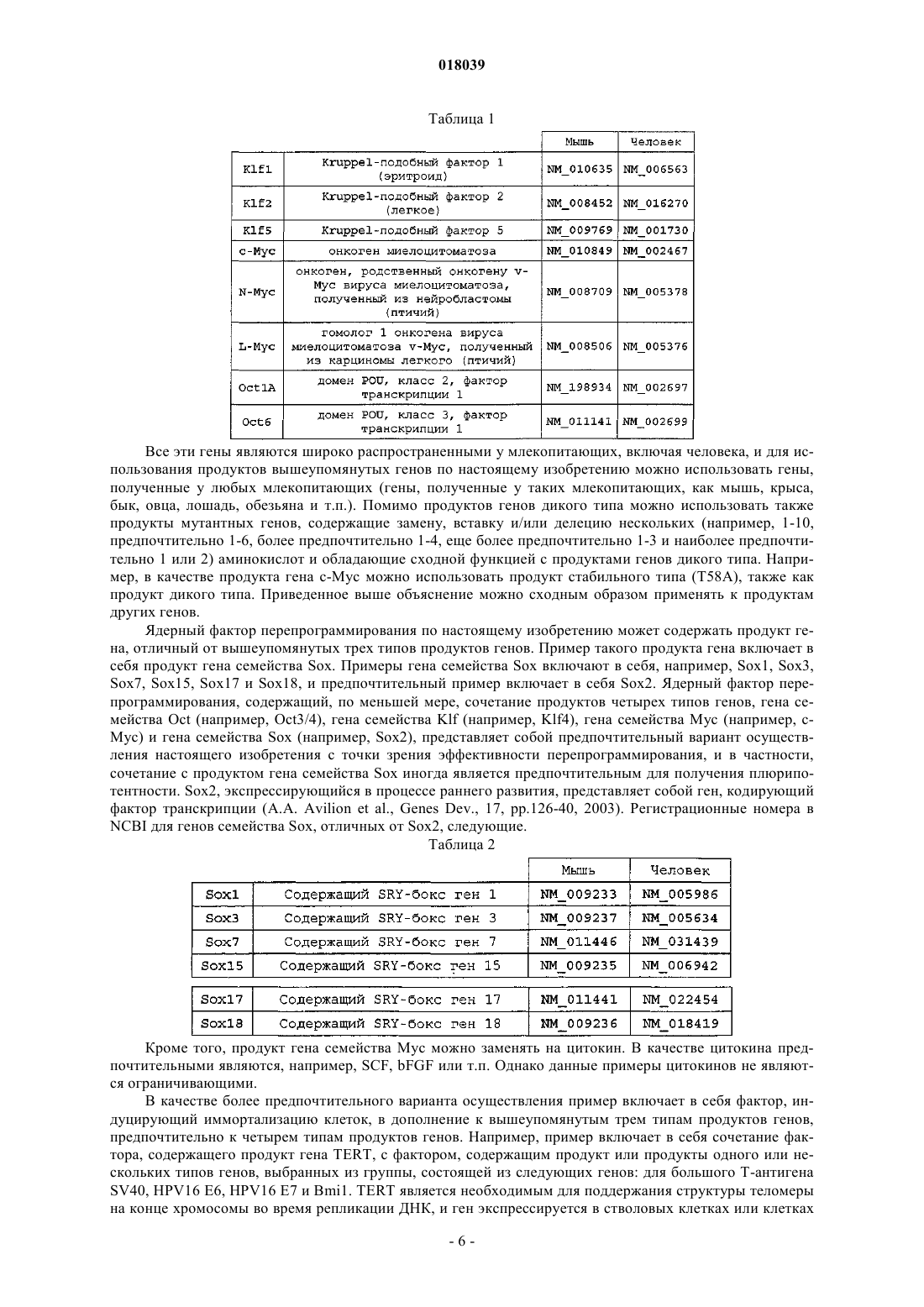
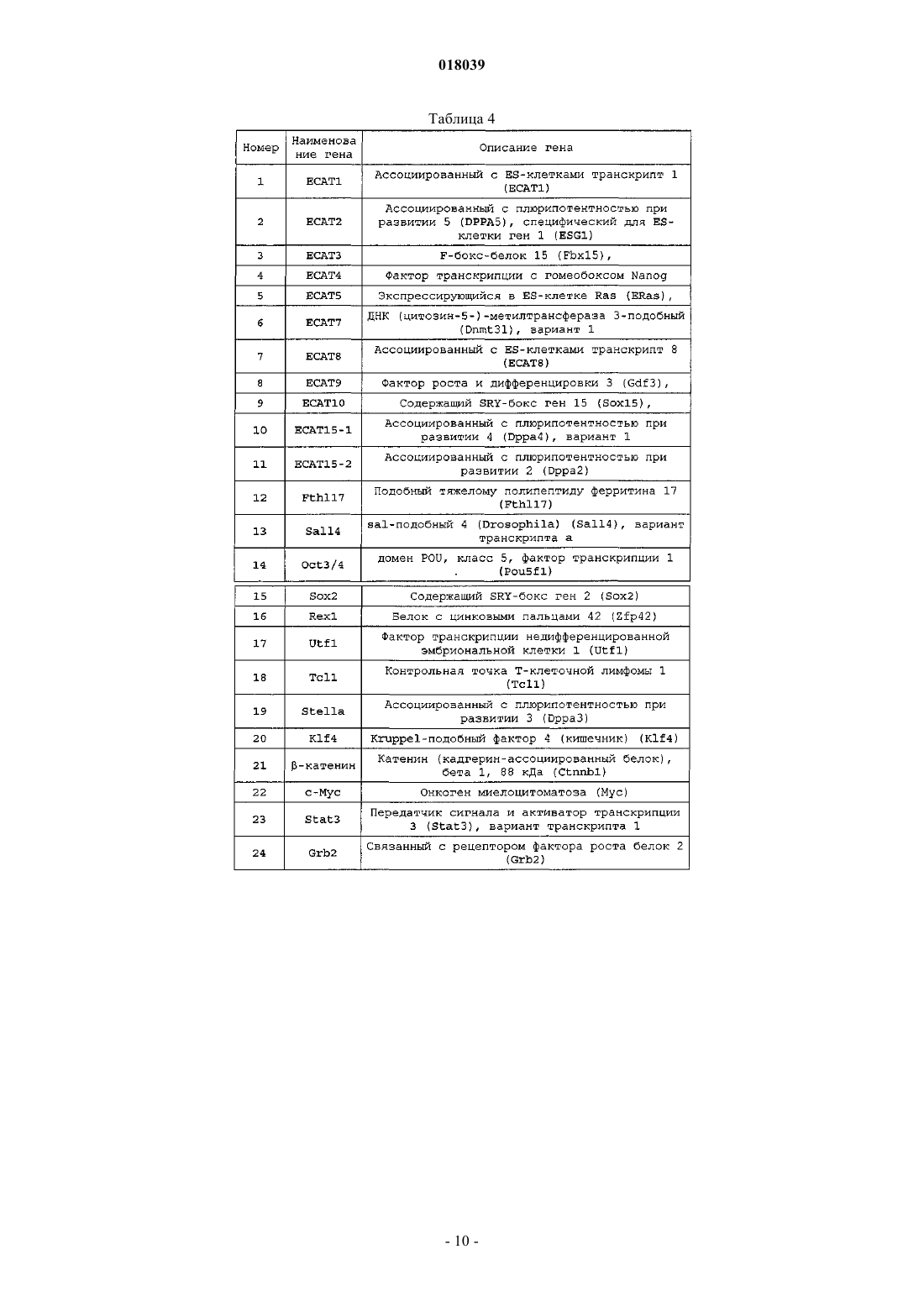
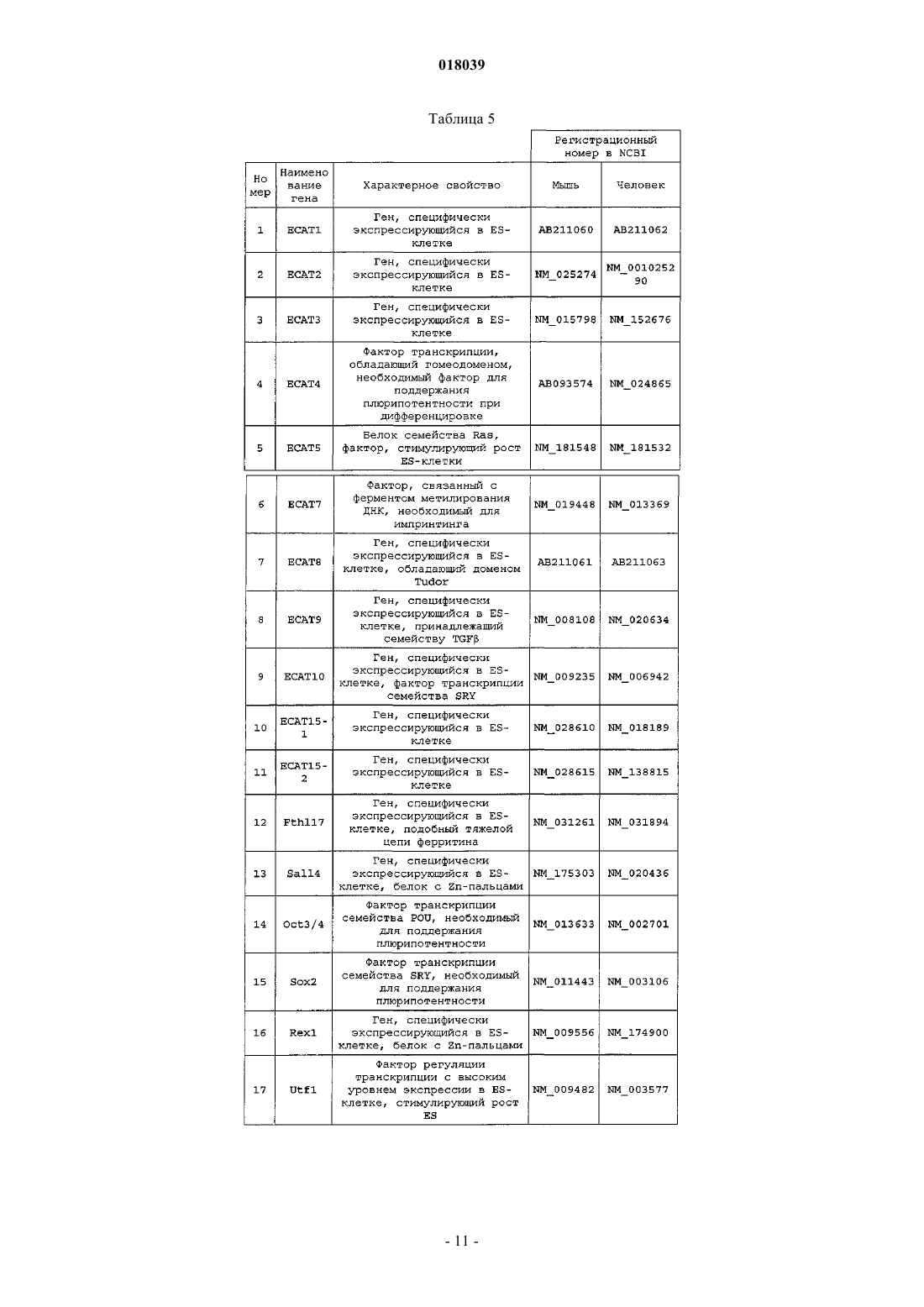
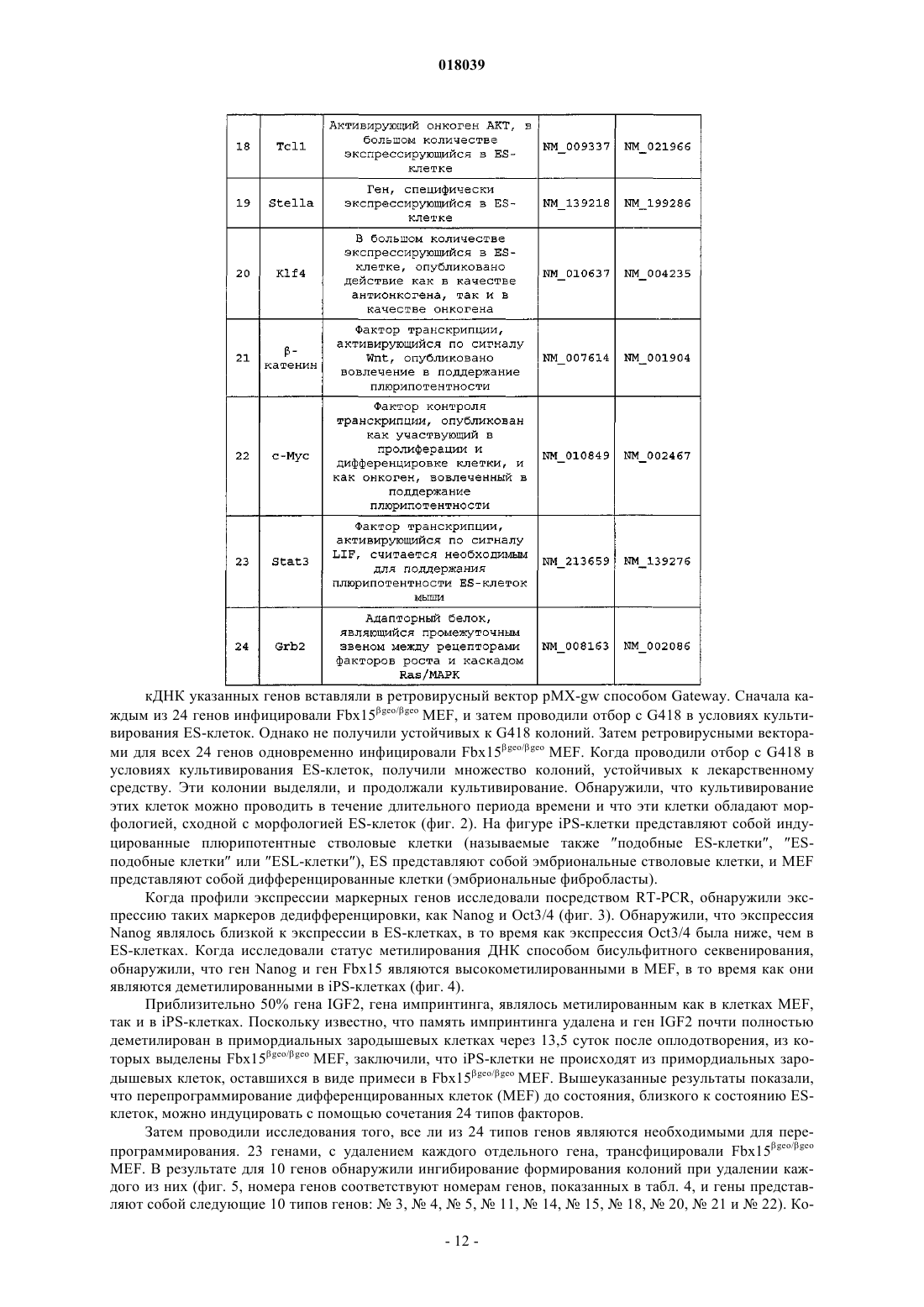
Ядерный фактор перепрограммирования
Формула / Реферат
1. Ядерный фактор перепрограммирования для соматической клетки, содержащий каждый из следующих трех типов генов: гена семейства Oct, гена семейства Klf и гена семейства Мус.
2. Фактор по п.1, содержащий каждый из трех следующих типов генов: Oct3/4, Klf4 и c-Myc.
3. Фактор по п.1 или 2, дополнительно содержащий ген семейства Sox.
4. Фактор по п.3, содержащий следующий ген Sox2.
5. Фактор по любому из пп.1-4, содержащий цитокин вместе с геном семейства Мус или вместо гена семейства Myc.
6. Фактор по п.5, где цитокин представляет собой bFGF и/или SCF.
7. Фактор по любому из пп.1-6, дополнительно содержащий ген TERT.
8. Фактор по любому из пп.1-7, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из следующих генов: гена большого Т-антигена SV40, гена HPV16 Е6, гена HPV16 Е7и гена Bmi1.
9. Фактор по любому из пп.1-8, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из генов Fbx15, Nanog, ERas, ECAT15-2, Tcel1 и β-катенина.
10. Фактор по любому из пп.1-9, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из генов ECAT1, Esg1, Dnmt3L, ECAT8, Gdf3, Sox15, ECAT15-1, Fthl17, Sall4, Rex1, UTF1, Stella, Stat3 и Grb2.
11. Способ получения индуцированной плюрипотентной стволовой клетки посредством перепрограммирования ядра соматической клетки, включающий в себя стадию приведения в контакт ядерного фактора перепрограммирования по любому из пп.1-10 с соматической клеткой.
12. Способ по п.11, где соматическая клетка является клеткой человека.
13. Индуцированная плюрипотентная стволовая клетка, полученная способом по п.11 или 12.
14. Соматическая клетка, полученная посредством индукции дифференцировки индуцированной плюрипотентной стволовой клетки по п.13.
15. Способ улучшения способности к дифференцировке и/или способности роста клетки, который включает в себя стадию приведения в контакт ядерного фактора перепрограммирования по любому из пп.1-10 с клеткой.
16. Способ по п.15, где клетка является клеткой человека.
Текст
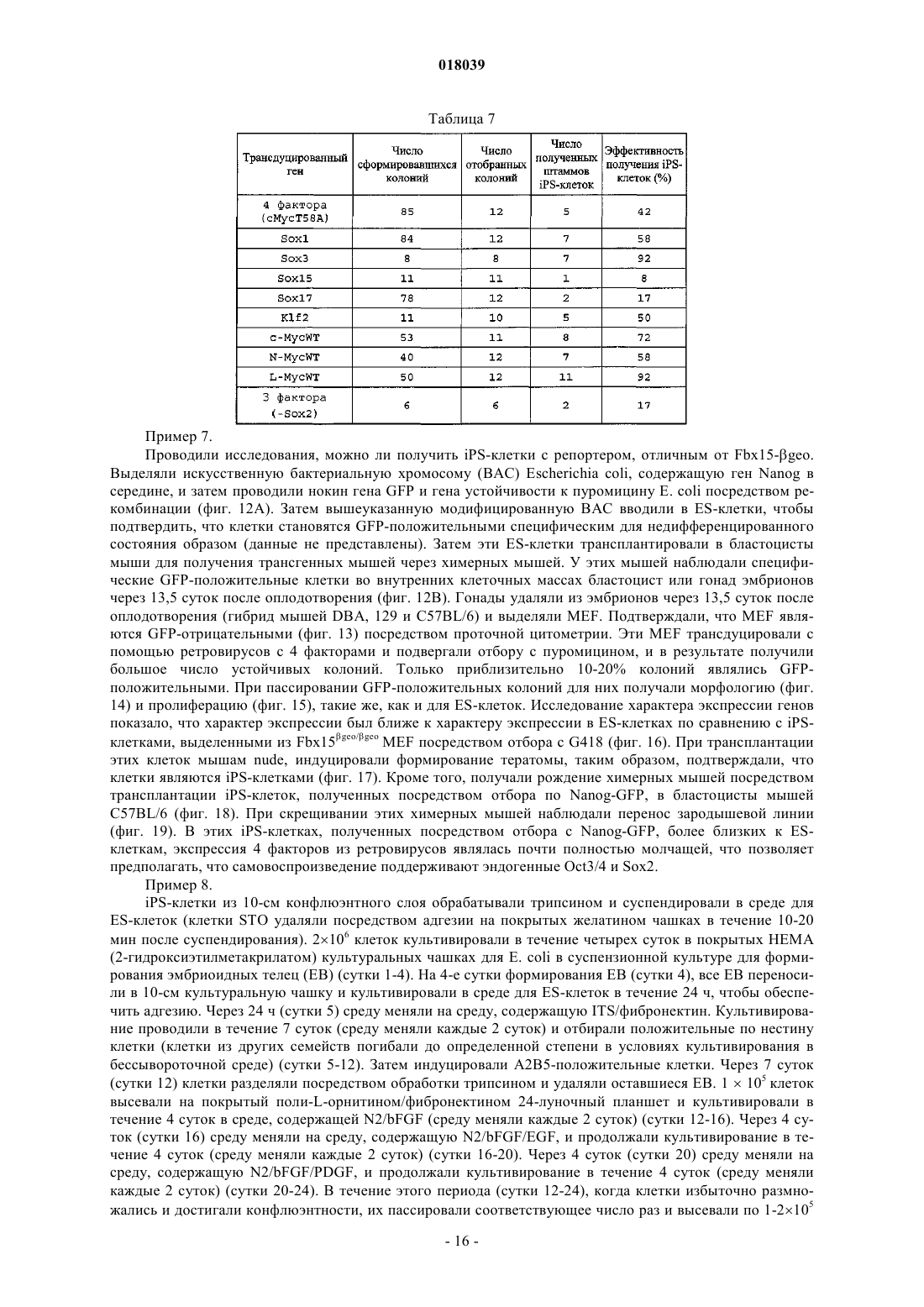
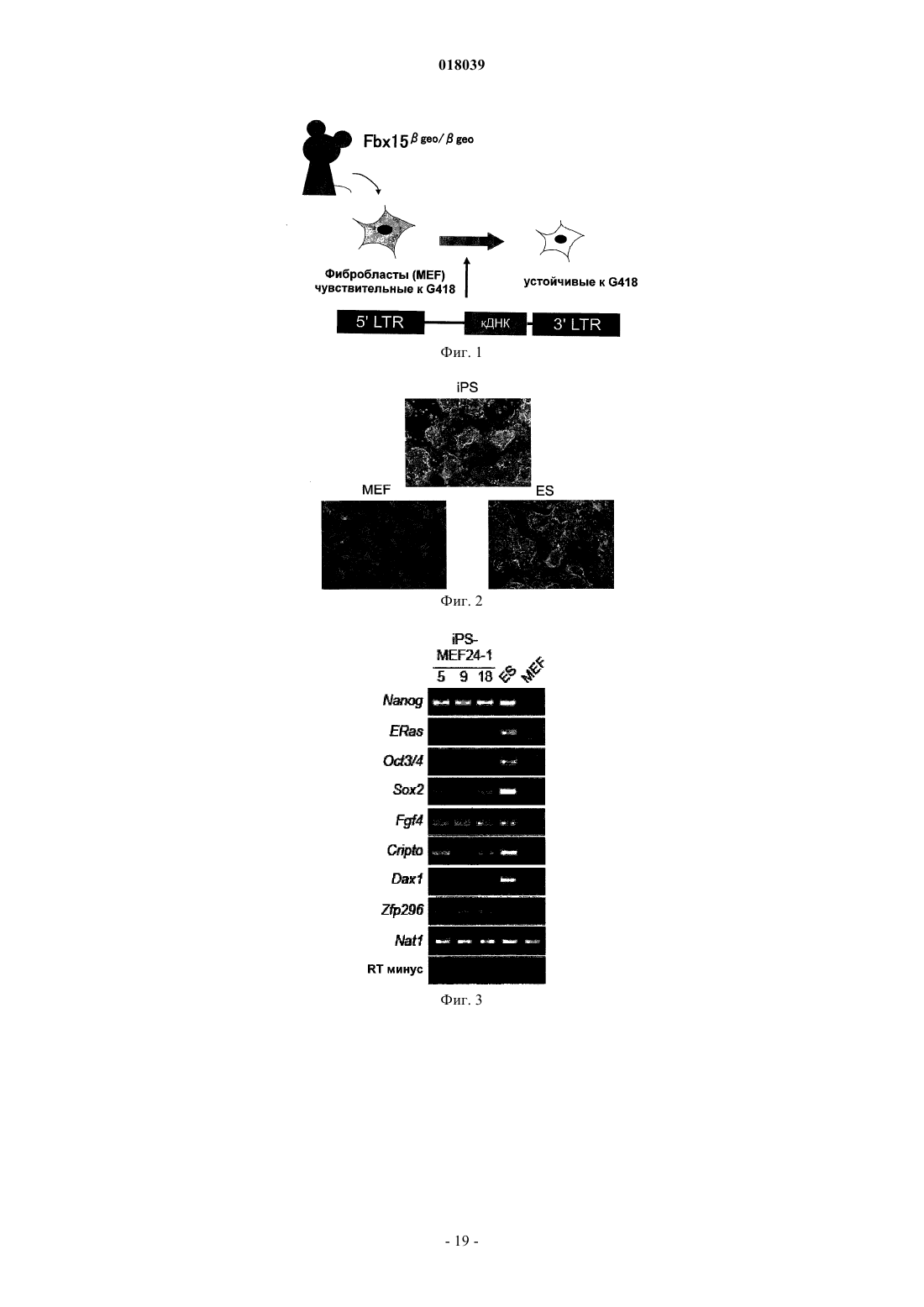
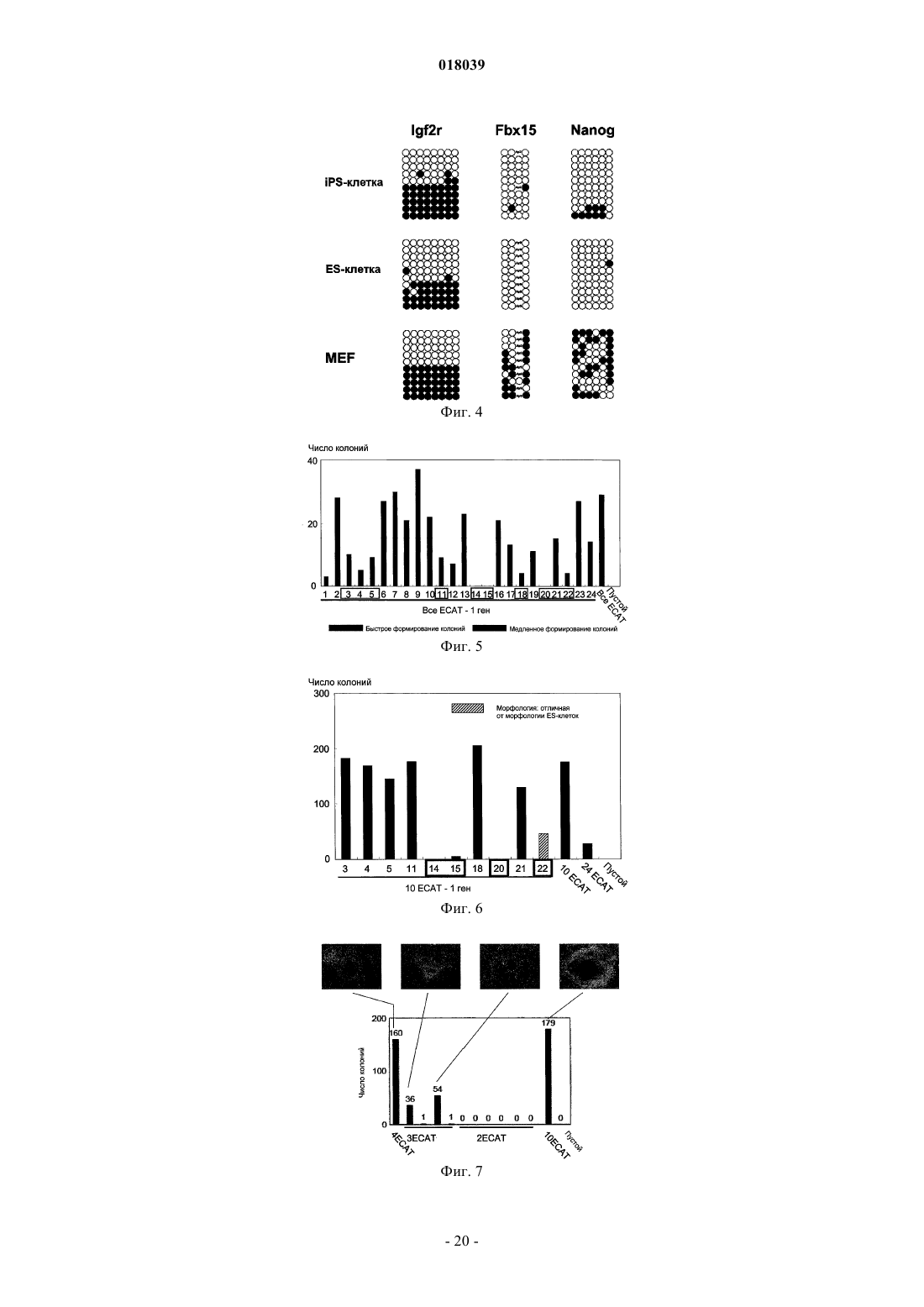
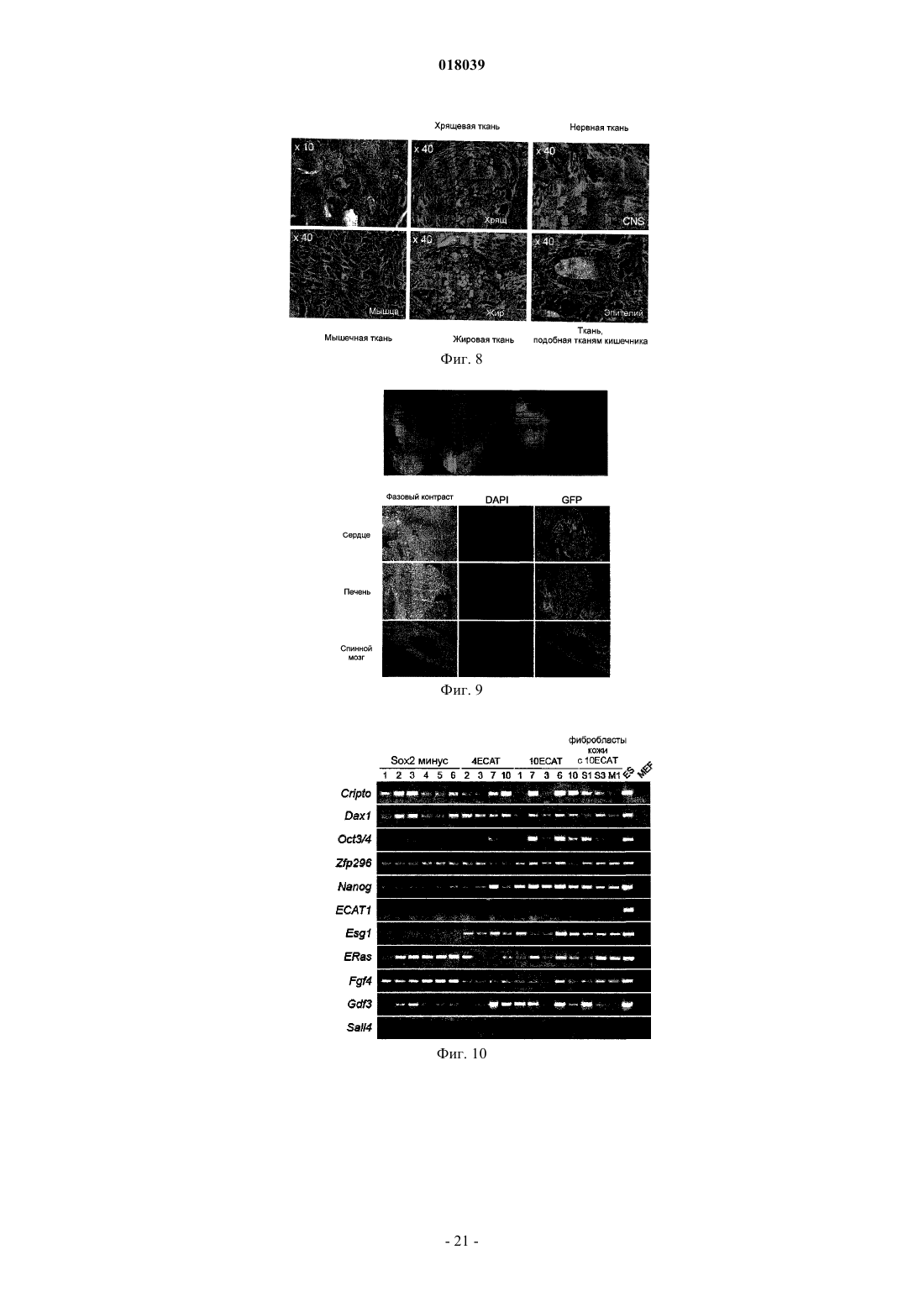
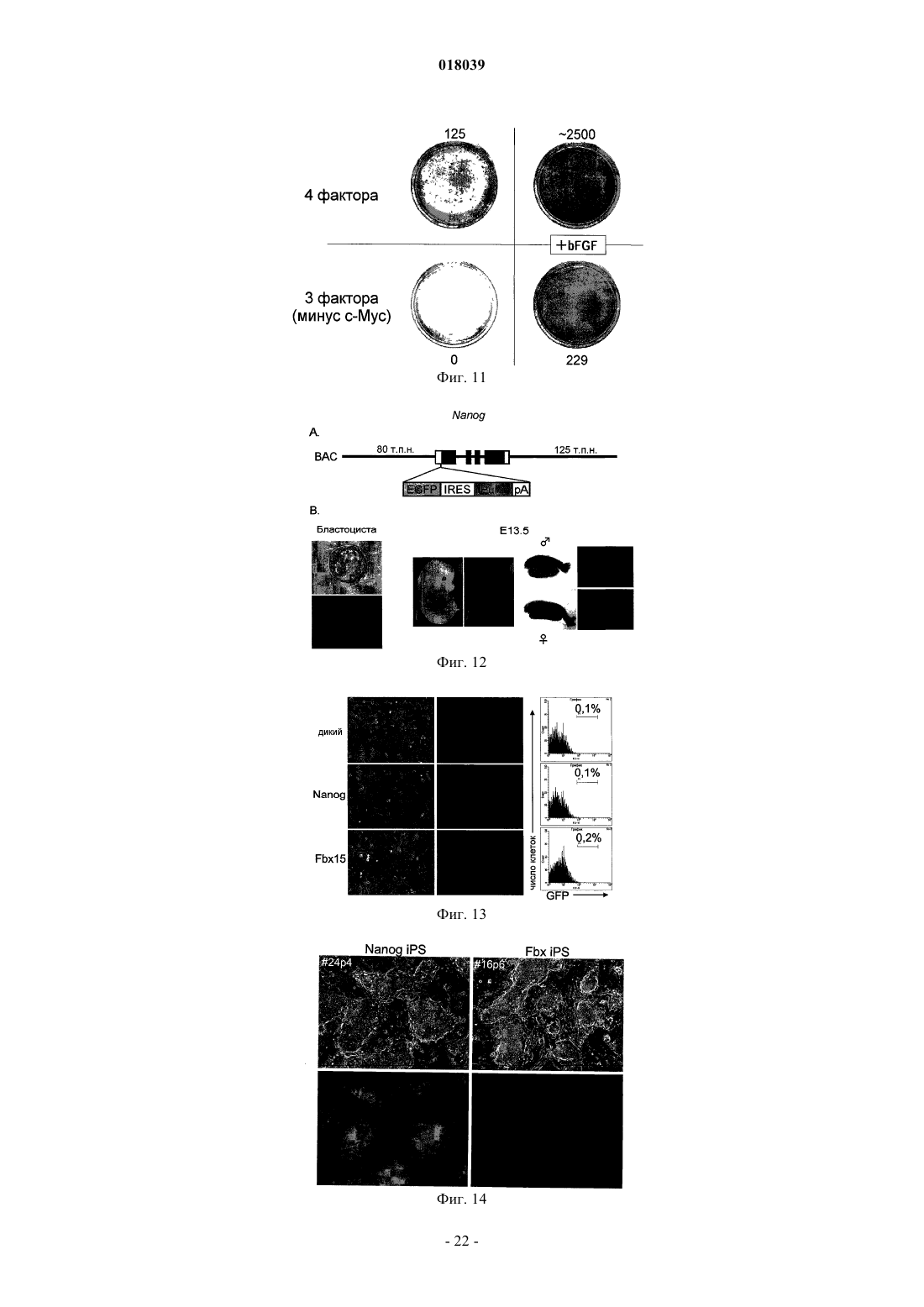
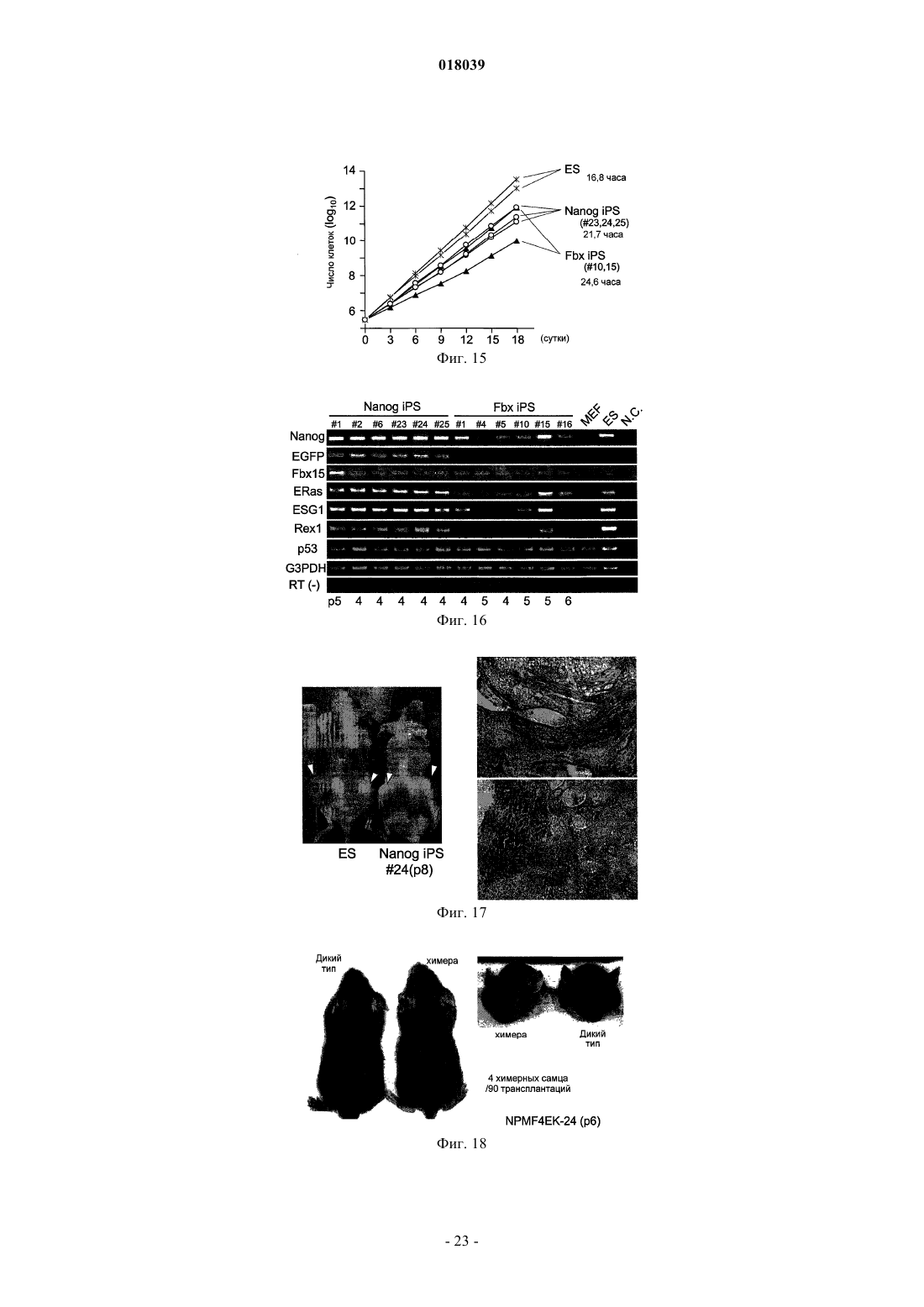
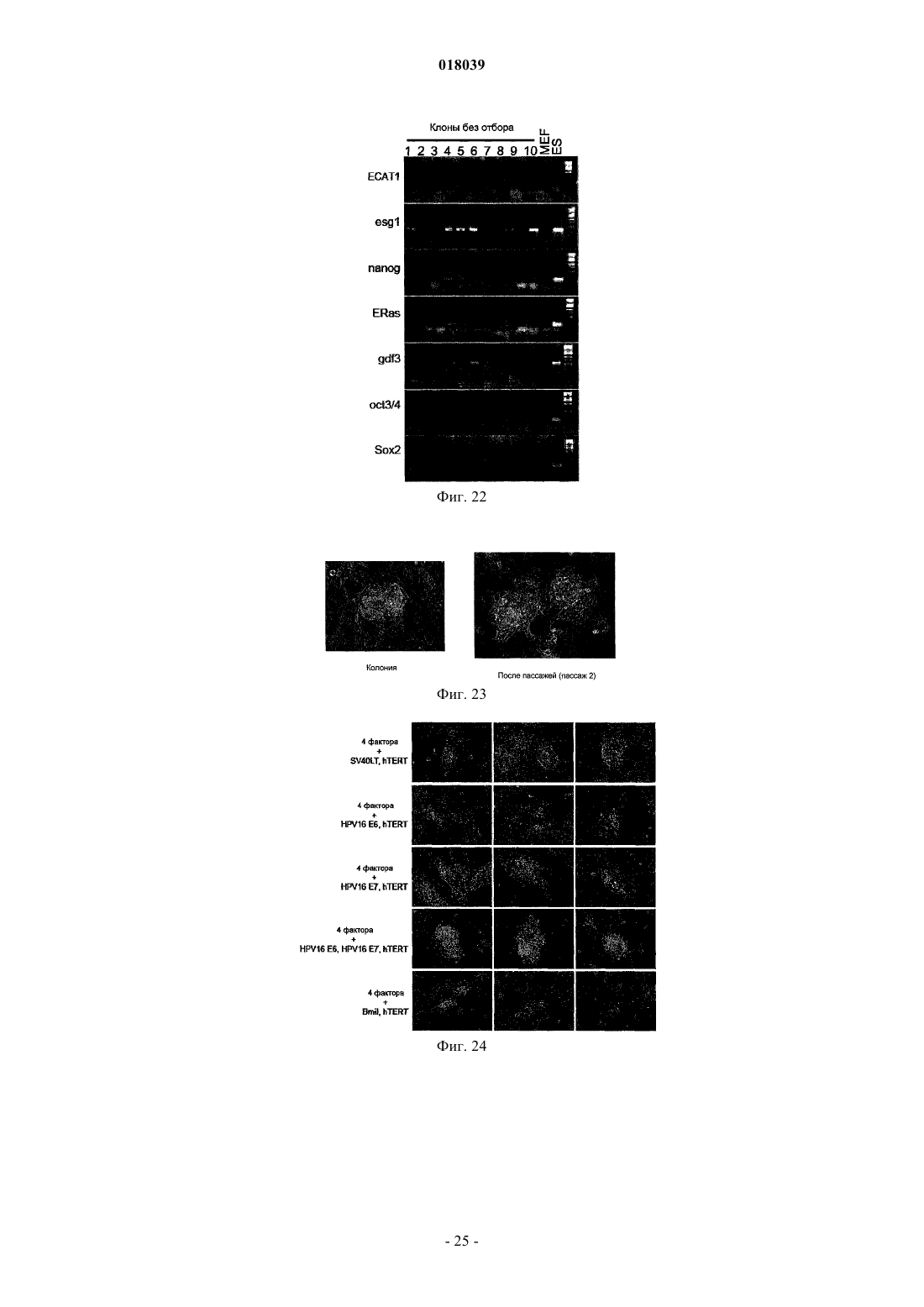
Настоящее изобретение относится к ядерному фактору перепрограммирования, обладающему способностью перепрограммирования дифференцированной соматической клетки для получения индуцированной плюрипотентной стволовой клетки. Ядерный фактор перепрограммирования для соматической клетки, содержащий каждый из следующих трех типов генов: гена семействаOct, гена семейства Klf и гена семейства Myc, используется в качестве средства для индукции перепрограммирования дифференцированной клетки для удобного и высоковоспроизводимого получения индуцированной плюрипотентной стволовой клетки, обладающей плюрипотентностью и способностью к росту, такими же, как у ES-клеток, без использования эмбриона или ES-клетки. Область техники Настоящее изобретение относится к ядерному фактору перепрограммирования, обладающему способностью перепрограммирования дифференцированной соматической клетки для получения индуцированной плюрипотентной стволовой клетки. Предшествующий уровень техники Эмбриональные стволовые клетки (ES-клетки) представляют собой стволовые клетки, полученные из ранних эмбрионов человека или мыши, обладающие тем характерным свойством, что их можно культивировать в течение длительного периода, поддерживая плюрипотентную способность к дифференцировке во все виды клеток, существующие в живых организмах. Считается, что эмбриональные стволовые клетки человека можно использовать в качестве ресурса для способов трансплантационной клеточной терапии различных заболеваний, таких как болезнь Паркинсона, юношеский диабет и лейкоз, пользуясь преимуществами вышеупомянутых свойств. Однако при трансплантации ES-клеток существует проблема отторжения таким же образом, что и при трансплантации органов. Более того, с этической точки зрения существует много особых мнений против использования ES-клеток, которые получают, разрушая эмбрионы человека. Если можно индуцировать дедифференцировку собственных дифференцированных соматических клеток пациента для получения клеток, обладающих плюрипотентностью и способностью к росту, такой же, как у ES-клеток (в данном описании эти клетки обозначены как индуцированные плюрипотентные стволовые клетки (iPS-клетки), хотя иногда их называют клетками, подобными эмбриональным стволовым клеткам, или ES-подобными клетками), полагают, что такие клетки можно использовать как идеальные плюрипотентные клетки, свободные от отторжения или этических проблем. В качестве способа перепрограммирования соматического ядра опубликован, например, способ получения эмбриональной стволовой клетки из клонированного эмбриона, полученного путем трансплантации ядра соматической клетки в яйцеклетку (W.S. Hwang et al., Science, 303, pp. 1669-74, 2004; W.S.Hwang et al., Science, 308, pp.1777-83, 2005: однако было доказано, что эти статьи являлись фальсификациями, и позднее они были отозваны). Однако этот способ получения клонированного эмбриона только с целью получения ES-клеток обладает гораздо более серьезными этическими проблемами по сравнению с обычными ES-клетками с использованием избыточных эмбрионов, полученных при терапии для оплодотворения. Опубликован также способ перепрограммирования ядра соматической клетки посредством слияния соматической клетки и ES-клетки (М. Tada et al., Curr. Biol., 11, pp.1553-1558, 2001; C.A. Cowanet al., Science, 309, pp.1369-73, 2005). Однако данный способ приводит к использованию ES-клеток человека, что не дает возможности решения этических трудностей. Кроме того, опубликован способ перепрограммирования ядра клетки посредством реакции экстракта линии клеток, полученных из опухоли зародышевых клеток, развившейся у человека, с дифференцированной клеткой (C.K. Taranger et al., Mol. Biol.Cell, 16, pp.5719-35, 2005). Однако оставалось совершенно неизвестным, какой компонент в экстракте индуцирует перепрограммирование по этому способу, и таким образом, этот способ связан с проблемами технической надежности и безопасности. Предложен способ скрининга ядерного фактора перепрограммирования, обладающего действием перепрограммирования дифференцированных соматических клеток для получения индуцированных плюрипотентных стволовых клеток (Международная публикация WO 2005/80598). Этот способ включает в себя стадии контактирования соматических клеток, содержащих ген, в которых маркерный ген расположен так, чтобы его экспрессия находилась под контролем области контроля экспрессии генов ЕСАТES-клетках), с каждым тестируемым веществом; проверки присутствия или отсутствия появления клетки, экспрессирующей маркерный ген; и выбора тестируемого соединения, индуцирующего появление указанной клетки, в качестве кандидата на роль ядерного фактора перепрограммирования соматических клеток. Способ перепрограммирования соматической клетки описан в примере 6 и т.п. вышеуказанной публикации. Однако в этой публикации не смогли опубликовать действительную идентификацию ядерного фактора перепрограммирования. Патентный документ 1: Международная публикация WO 2005/80598 Описание изобретения Целью настоящего изобретения является предоставление ядерного фактора перепрограммирования. Более конкретно, целью настоящего изобретения является предоставление средств для индукции перепрограммирования дифференцированной клетки без использования яйцеклеток, эмбрионов или ESклеток для удобного и высоковоспроизводимого получения индуцированной плюрипотентной стволовой клетки, обладающей плюрипотентностью и способностью к росту, такими же, как у ES-клеток. Авторы настоящего изобретения проводили различные исследования для достижения вышеупомянутой цели и пытались идентифицировать ядерный фактор перепрограммирования с использованием способа скрининга ядерного фактора перепрограммирования, описанного в Международной публикацииWO 2005/80598. В результате обнаружили 24 вида генов-кандидатов на роль генов, относящихся к перепрограммированию ядра, и среди них обнаружили три вида генов, необходимых для перепрограммирования ядра. Настоящее изобретение сделано на основе вышеупомянутых обнаружений. Таким образом, настоящее изобретение относится к ядерному фактору перепрограммирования для соматической клетки, который содержит каждый из следующих трех типов генов: гена семейства Oct,гена семейства Klf и гена семейства Мус. Согласно предпочтительному варианту осуществления изобретения здесь представлен вышеупомянутый фактор, содержащий гена каждого из трех следующих типов генов: Oct3/4, Klf4 и c-Myc. Согласно другому предпочтительному варианту осуществления представлен вышеупомянутый фактор, дополнительно содержащий ген семейства Sox, и в качестве более предпочтительного варианта осуществления представлен вышеупомянутый фактор, содержащий ген Sox2. Согласно другому предпочтительному варианту осуществления представлен вышеупомянутый фактор, содержащий цитокин вместе с геном семейства Myc, или, альтернативно, вместо гена семейства Мус. В качестве более предпочтительного варианта осуществления представлен вышеупомянутый фактор, где цитокин представляет собой основной фактор роста фибробластов (bFGF) и/или фактор стволовых клеток (SCF). Согласно особенно предпочтительным вариантам осуществления представлены ядерный фактор перепрограммирования для соматической клетки, содержащий ген TERT в дополнение к каждому из: гена семейства Oct, гена семейства Klf, гена семейства Мус и гена семейства Sox; и вышеупомянутый фактор, содержащий ген или один или нескольких типов генов, выбранных из группы, состоящей из следующих генов: для большого Т-антигена SV40, HPV16 Е 6, HPV16 Е 7 и Bmi1, в дополнение к продукту каждого из: гена семейства Oct, гена семейства Klf, гена семейства Myc, гена семейства Sox и гена TERT. В дополнение к этим факторам представлен вышеупомянутый фактор, дополнительно содержащий один или нескольких типов генов, выбранных из группы, состоящей из следующих: Fbx15, Nanog, ERas,ЕСАТ 15-2, Tcl1 и -катенин. Согласно другому предпочтительному варианту осуществления вышеупомянутого изобретения представлен также вышеупомянутый фактор, содержащий один или нескольких типов генов, выбранных из группы, состоящей из следующего: ЕСАТ 1, Esg1, Dnmt3L, ECAT8, Gdf3, Sox15, ECAT15-1, Fthl17,Sall4, Rex1, UTF1, Stella, Stat3 и Grb2. В другом аспекте настоящее изобретение относится к способу получения индуцированной плюрипотентной стволовой клетки посредством перепрограммирования ядра соматической клетки, который включает в себя стадию контактирования вышеупомянутого ядерного фактора перепрограммирования с соматической клеткой. Согласно предпочтительному варианту осуществления изобретения представлен вышеупомянутый способ, который включает в себя стадию добавления вышеупомянутого ядерного фактора перепрограммирования к культуре соматической клетки; вышеупомянутый способ, который включает в себя стадию введения гена, кодирующего вышеупомянутый ядерный фактор перепрограммирования, в соматическую клетку; вышеупомянутый способ, который включает в себя стадию введения указанного гена в соматическую клетку с использованием рекомбинантного вектора, содержащего по меньшей мере один тип гена, кодирующего вышеупомянутый ядерный фактор перепрограммирования; и вышеупомянутый способ,где в качестве соматической клетки используют соматическую клетку, выделенную у пациента. В другом аспекте настоящее изобретение относится к индуцированной плюрипотентной стволовой клетке, полученной посредством вышеупомянутого способа. Настоящее изобретение также относится к соматической клетке, полученной посредством индукции дифференцировки вышеупомянутой индуцированной плюрипотентной стволовой клетки. Настоящее изобретение также относится к способу улучшения способности к дифференцировке и/или росту клетки, который включает в себя стадию контактирования вышеупомянутого ядерного фактора перепрограммирования с клеткой и, кроме того, относится к клетке, которую можно получить посредством вышеупомянутого способа, и к соматической клетке, полученной посредством индукции дифференцировки клетки, полученной посредством вышеупомянутого способа. Посредством использования ядерного фактора перепрограммирования, представленного по настоящему изобретению, перепрограммирование ядра дифференцированной клетки можно удобно и с высокой воспроизводимостью индуцировать без использования эмбрионов или ES-клеток, и можно получить индуцированную плюрипотентную стволовую клетку в форме недифференцированной клетки,обладающей способностью к дифференцировке, плюрипотентностью и способностью к росту, такими же, как у ES-клеток. Например, индуцированную плюрипотентную стволовую клетку, обладающую высокой способностью к росту и плюрипотентностью при дифференцировке, можно получить из собственной соматической клетки пациента с использованием ядерного фактора перепрограммирования по настоящему изобретению. Клетки, которые можно получить посредством дифференцировки указанной клетки (например, клетки сердечной мышцы, инсулинпродуцирующие клетки, нервные клетки и т.п.),являются необычайно полезными, поскольку их можно использовать для видов терапии трансплантацией стволовых клеток для множества заболеваний, таких как сердечная недостаточность, инсулинозависимый сахарный диабет, болезнь Паркинсона и повреждение спинного мозга; таким образом, можно избегать этических проблем, касающихся использования эмбриона человека, и отторжения после трансплантации. Кроме того, различные клетки, которые можно получить посредством дифференцировки индуци-2 018039 рованной плюрипотентной стволовой клетки (например, клетки сердечной мышцы, клетки печени и т.п.),являются очень полезными в качестве систем для оценки эффективности или токсичности соединений,лекарственных средств, ядов и т.п. Краткое описание фигур На фиг. 1 показан способ скрининга факторов перепрограммирования с использованием эмбриональных фибробластов (MEF) мыши с нокином geo в гене Fbx15. На фиг. 2 - фотографии, изображающие морфологию iPS-клеток, полученных посредством введения 24 генов, показанных в табл. 4. Морфология дифференцированных клеток (MEF) и нормальных эмбриональных стволовых клеток (ES) также показана в качестве контроля. На фиг. 3 - профили экспрессии маркерных генов в iPS-клетках. Показаны результаты RT-PCR с использованием тотальной РНК, выделенной из iPS-клеток, ES-клеток и MEF-клеток в качестве матриц. На фиг. 4 - статус метилирования ДНК в iPS-клетках. Геномную ДНК, выделенную из iPS-клеток,ES-клеток и MEF-клеток, обрабатывали бисульфитом. ДНК-мишени амплифицировали PCR и затем вставляли в плазмиду. Для каждого из генов выделяли и секвенировали десять клонов плазмиды. Метилированные CpG показаны сплошными кругами, а неметилированные CpG незакрашенными кругами. На фиг. 5 - число колоний устойчивых к G418 клеток, полученных посредством трансдукции группы из 24 генов и групп из 23 генов, где каждый отдельный ген убирали из группы из 24 генов. На нижних частях графика показано число колоний, полученное через одну неделю после отбора с G418, а на верхних частях графика показано число клонов, полученных за три недели. Когда каждый из заключенных в рамку генов (идентификационный номер для каждого гена является таким же, как указано в табл. 1) удаляли, колоний не получали совсем, или через 3 недели наблюдали только небольшое число колоний. На фиг. 6 показано число колоний устойчивых к G418 клеток, полученных посредством трансдукции группы из 10 генов и групп из 9 генов, где каждый отдельный ген убирали из группы из 10 генов. Когда убирали каждый из генов 14, 15 или 20, колоний не получали. Когда удаляли ген 22, получали немного устойчивых к G418 колоний. Однако клетки обладали дифференцированной морфологией,явно отличной от морфологии iPS-клеток. На фиг. 7 - число появившихся устойчивых к G418 колоний (перепрограммированных колоний) для группы из 10 генов, группы из 4 генов, групп из 3 генов или групп из 2 генов. Показаны типичные морфология и размеры колоний. На фиг. 8 показаны фотографии, изображающие результаты окрашивания гематоксилином-эозином(Н и Е) опухолей, сформировавшихся после подкожной трансплантации iPS-клеток, полученных из MEF,мышам nude. Наблюдали дифференцировку во многие ткани системы трех зародышевых листков. На фиг. 9 показаны фотографии эмбрионов, полученных посредством трансплантации iPS-клеток,полученных из фибробластов кожи взрослых, в бластоцисты мыши и трансплантации клеток в матки псевдобеременных мышей. Можно наблюдать, что в верхнем левом эмбрионе клетки, полученные изiPS-клеток (испускающие зеленую флуоресценцию), распределены системно. На нижних фотографиях можно наблюдать, что почти все клетки сердца, печени и спинного мозга эмбриона являются GFPположительными и происходят из iPS-клеток. На фиг. 10 показаны фотографии, изображающие результаты RT-PCR, подтверждающие экспрессию маркерных генов ES-клетки. На фотографиях Sox2 минус обозначает iPS-клетки, полученные посредством трансдукции 3 генов в MEF, 4ECAT обозначает iPS-клетки, полученные посредством трансдукции 4 генов в MEF, 10ECAT обозначает iPS-клетки, полученные посредством трансдукции 10 генов вMEF, фибробласт кожи с 10ECAT обозначает iPS-клетки, полученные посредством трансдукции 10 генов в фибробласты кожи, ES обозначает ES-клетки мыши и MEF обозначает клетки MEF без трансдукции гена. Числовые значения под символами обозначают номера клонов. На фиг. 11 показано действие bFGF на получение iPS-клеток из MEF. Четыре фактора (верхний ряд) или три фактора за исключением c-Myc (нижний ряд) с помощью ретровирусов трансдуцировали в MEF,полученные у мышей Fbx15geo/geo, и культивировали на обычных клетках-фидерах (клетки STO) (слева) и клетках STO с введенным экспрессирующим bFGF вектором (справа). Отбор с G418 проводили в течение 2 недель, клетки окрашивали кристаллическим синим и фотографировали. Числовые значения обозначают число колоний. На фиг. 12 показаны объяснения экспериментов с использованием мышей Nanog-EGFP-IRES-Puro. А: Выделяли искусственную хромосому Е. coli (ВАС), содержащую ген Nanog мыши в середине, и кассету EGFP-IRES-Puro вставляли выше кодирующей области Nanog посредством рекомбинации. В: Получали трансгенных мышей с модифицированной ВАС. Наблюдали экспрессию GFP, ограниченную внутренними массами клеток бластоцист и гонад. На фиг. 13 показаны объяснения экспериментов с использованием мышей Nanog-EGFP-IRES-Puro. Из эмбрионов мышей Nanog-EGFP-IRES-Puro (13,5 суток после оплодотворения) извлекали головы,внутренние органы и гонады для получения MEF. По результатам анализа на сортере клеток почти не присутствовало GFP-положительных клеток в MEF, полученных у мышей Nanog-EGFP-IRES-Puro(Nanog), а также в MEF, полученных у мыши Fbx15geo/geo (Fbx15) или в MEF, полученных у мыши дикого типа (дикий). На фиг. 14 показаны фотографии iPS-клеток, полученных у MEF мыши Nanog-EGFP-IRES-Puro(слева) и у MEF мыши Fbx15geo/geo (справа). Клетки отбирали с пуромицином и G418, соответственно. На фиг. 15 показаны результаты роста iPS-клеток. 100000 клеток каждых из ES-клеток, iPS-клеток,полученных у MEF мыши Nanog-EGFP-IRES-Puro (Nanog iPS, слева), и iPS-клеток, полученных у MEF мыши Fbx15geo/geo (Fbx iPS), высевали на 24-луночные планшеты и пассировали каждые 3 суток. Показаны результаты подсчета клеток. Числовые значения представляют среднее время удвоения. На фиг. 16 показаны профили экспрессии генов в iPS-клетках. Экспрессию маркерных генов в MEF,ES-клетках, iPS-клетках, полученных у MEF мыши Nanog-EGFP-IRES-Puro (Nanog iPS, слева), и iPSклетках, полученных у MEF мыши Fbx15geo/geo (Fbx iPS), анализировали посредством RT-PCR. Числовые значения внизу указывают число пассажей. На фиг. 17 показано формирование тератомы из Nanog iPS-клеток. 1000000 клеток каждых из ESклеток или Nanog iPS-клеток подкожно инъецировали в спину мышей nude, и показан внешний вид опухолей, сформированных через 3 недели (слева), и изображения тканей (справа, окрашенные Н и Е). На фиг. 18 показано получение химерных мышей с помощью Nanog iPS-клеток. Химерные мыши рождались после трансплантации Nanog iPS-клеток (клон NPMF4EK-24, пассированный 6 раз) в бластоцисты. Из 90 трансплантированных эмбрионов родилось четыре химерных мыши. На фиг. 19 показан перенос зародышевой линии из Nanog iPS-клеток. Анализом PCR геномной ДНК мышей, рожденных благодаря скрещиванию химерных мышей, показанных на фиг. 18, и мышейC57BL/6, выявили присутствие трансгенов Oct3/4 и Klf4 у всех мышей, таким образом подтверждая перенос зародышевой линии. На фиг. 20 показана индукция дифференцировки в нервные клетки из iPS-клеток. Показаны нервные клетки (сверху, III-тубулин-положительные), олигодендроциты (слева, O4-положительные) и астроциты (справа, GFAP-положительные), дифференцированные in vitro из iPS-клеток, полученных из фибробластов кожи. На фиг. 21 показано объяснение получения iPS-клеток без использования отбора с лекарственным средством. MEF высевали до от 10000 до 100000 клеток на 10-см чашку и 4 фактора трансдуцировали с помощью ретровирусов. В контроле (пустой, слева) не появилось колоний, в то время как на чашках с трансдукцией 4 факторов получили выпуклые колонии, сходные с колониями iPS-клеток (в центре), а также плоские колонии трансформантов. При пассировании клеток получили клетки, сходные с iPSклетками (справа). На фиг. 22 показаны профили экспрессии генов в клетках, полученных без использования отбора с лекарственным средством. РНК выделяли из полученных клеток, показанных на фиг. 21, и экспрессию маркерных генов ES-клетки анализировали посредством RT-PCR. На фиг. 23 показаны клетки, подобные iPS-клеткам, полученные из фибробластов человека. Показаны колонии, полученные посредством трансдукции с помощью ретровирусов гомологичных генов человека для 4 факторов в фибробласты, полученные из эмбрионов человека (слева), и клетки после двух пассажей (справа). На фиг. 24 показано получение iPS-клеток из фибробластов кожи взрослого человека. Факторы,упомянутые в левой колонке, трансдуцировали с помощью ретровирусов в фибробласты кожи взрослого человека, инфицированные рецептором для ретровирусов мыши с помощью лентивируса. На фотографиях показаны фазово-контрастные изображения (объект 10) на сутки 8 после вирусной инфекции. Наилучший способ осуществления изобретения Ядерный фактор перепрограммирования по настоящему изобретению характеризуется тем, что содержит продукт гена для каждого из следующих трех типов генов: гена семейства Oct, гена семейства Klf и гена семейства Myc; и согласно предпочтительному варианту осуществления он характеризуется тем,что содержит продукт гена семейства Sox в дополнение к вышеупомянутым трем типам генов. В качестве средства для подтверждения ядерного фактора перепрограммирования по настоящему изобретению можно использовать, например, способ скрининга ядерных факторов перепрограммирования, описанный в Международной публикации WO 2005/80598. Полное содержание вышеупомянутой публикации включено в содержание данного описания посредством ссылки. С помощью ссылки на вышеупомянутую публикацию специалисты в данной области могут проводить скрининг ядерных факторов перепрограммирования для подтверждения присутствия и действия фактора перепрограммирования по настоящему изобретению. Например, в качестве экспериментальной системы, позволяющей наблюдать феномен перепрограммирования, можно использовать мышь, у которой проведен нокин geo (гена, слитого из генагалактозидазы и гена устойчивости к неомицину) в локусе Fbx15. Подробности описаны в примерах данного описания. Ген Fbx15 мыши представляет собой ген, специфически экспрессирующийся в плюрипотентных при дифференцировке клетках, таких как ES-клетки и ранние эмбрионы. В гомомутантной мыши, у которой проведен нокин geo в гене Fbx15 мыши, так что она является дефектной по функцииFbx15; аномальных фенотипов, включая относящиеся к плюрипотентности при дифференцировке или размножении, как правило, не наблюдают. У этой мыши экспрессия geo находится под контролем энхансера и промотора гена Fbx15, и дифференцированные соматические клетки, в которых не экспрессируется geo, обладают чувствительностью к G418. В отличие от этого, гомомутантные ES-клетки с нокином geo обладают устойчивостью к G418 в очень высокой концентрации (равной или превышающей 12 мг/мл). Посредством использования этого феномена можно сконструировать экспериментальную систему для визуализации перепрограммирования соматических клеток. Посредством применения вышеупомянутой экспериментальной системы фибробласты(Fbx15geo/geo MEF) можно сначала выделить из эмбриона гомомутантной мыши с нокином geo (13,5 суток после оплодотворения. MEF не экспрессируют ген Fbx15 и, соответственно, также не экспрессируют geo, что приводит к чувствительности к G418. Однако, когда MEF сливают со свободными от генетических манипуляций ES-клетками (также обладающими чувствительностью к G418), geo экспрессируется, и клетки становятся устойчивыми к G418 в результате перепрограммирования ядер MEF. Таким образом, посредством использования этой экспериментальной системы феномен перепрограммирования можно визуализировать как устойчивость к G418. Ядерные факторы перепрограммирования можно отбирать с использованием вышеупомянутой экспериментальной системы. В качестве кандидатов на роль генов, относящихся к ядерным факторам перепрограммирования, можно отобрать множество генов, которые обладают специфической экспрессией вES-клетках, или для которых предполагают важную роль в поддержании плюрипотентности при дифференцировке ES-клеток, и можно подтвердить, может ли каждый из генов-кандидатов индуцировать перепрограммирование ядра самостоятельно или в подходящем их сочетании. Например, подтвердили, что сочетание всех выбранных первичных генов-кандидатов способно индуцировать перепрограммирование дифференцированных клеток в состояние, близкое к состоянию ES-клеток. Затем получали сочетания посредством удаления каждого отдельного гена из вышеупомянутого сочетания и подтверждали то же самое действие сочетаний, чтобы выбрать каждый из вторичных генов-кандидатов, отсутствие которых вызывает снижение способности к индукции перепрограммирования или потерю способности к индукции перепрограммирования. Посредством повтора таких же стадий для вторичных генов-кандидатов,выбранных, как описано выше, можно выбрать необходимые сочетания генов для перепрограммирования ядра и можно подтвердить, что сочетание продуктов каждого из трех типов генов, гена семействаOct, гена семейства Klf и гена семейства Myc, действует как ядерный фактор перепрограммирования. Кроме того, можно подтвердить, что сочетание продукта гена семейства Sox в дополнение к продуктам вышеупомянутых трех типов генов обладает необычайно превосходными характеристиками в качестве ядерного фактора перепрограммирования. Конкретные примеры способа отбора ядерных факторов перепрограммирования показаны в примерах данного описания. Таким образом, с помощью ссылки на приведенные выше общие объяснения и конкретные объяснения в примерах, специалисты в данной области легко могут подтвердить, что сочетание указанных трех типов генов индуцирует перепрограммирование соматических клеток и что сочетание продуктов указанных трех типов генов является необходимым для перепрограммирования ядра. Ядерный фактор перепрограммирования, представленный по настоящему изобретению, содержит по меньшей мере сочетание продуктов гена семейства Oct, гена семейства Klf и гена семейства Myc, например, сочетание продуктов трех типов генов Oct3/4, Klf 4 и c-Myc. Примеры гена семейства Oct включают в себя, например, Oct3/4, Oct1A, Oct6 и т.п. Oct3/4 представляет собой фактор транскрипции, принадлежащий к семейству POU, и опубликовано, что он является маркером недифференцированных клеток (K. Okamoto et al., Cell, 60, pp. 461-72, 1990). Опубликовано, что Oct3/4 также участвует в поддержании плюрипотентности (J. Nichols et al., Cell,95, pp. 379-91, 1998). Примеры гена семейства Klf включают в себя Klfl, Klf2, Klf4, Klf5 и т.п. Klf 4(Kruppel-подобный фактор-4) опубликован в качестве фактора репрессии опухолей (A.M. Ghaleb et al.,Cell Res., 15, pp.92-6, 2005). Примеры гена семейства Мус включают в себя c-Myc, N-Myc, L-Myc и т.п. cMyc представляет собой фактор контроля транскрипции, вовлеченный в дифференцировку и пролиферацию клеток (S. Adhikary, M. Eilers, Nat. Rev. Mol. Cell Biol., 6, pp. 635-45, 2005), и опубликовано также,что он вовлечен в поддержание плюрипотентности (P. Cartwright et al., Development, 132, pp.885-96,2005). Регистрационные номера в NCBI для генов из семейств, отличных от Oct3/4, Klf4 и c-Myc, следующие: Все эти гены являются широко распространенными у млекопитающих, включая человека, и для использования продуктов вышеупомянутых генов по настоящему изобретению можно использовать гены,полученные у любых млекопитающих (гены, полученные у таких млекопитающих, как мышь, крыса,бык, овца, лошадь, обезьяна и т.п.). Помимо продуктов генов дикого типа можно использовать также продукты мутантных генов, содержащие замену, вставку и/или делецию нескольких (например, 1-10,предпочтительно 1-6, более предпочтительно 1-4, еще более предпочтительно 1-3 и наиболее предпочтительно 1 или 2) аминокислот и обладающие сходной функцией с продуктами генов дикого типа. Например, в качестве продукта гена c-Myc можно использовать продукт стабильного типа (Т 58 А), также как продукт дикого типа. Приведенное выше объяснение можно сходным образом применять к продуктам других генов. Ядерный фактор перепрограммирования по настоящему изобретению может содержать продукт гена, отличный от вышеупомянутых трех типов продуктов генов. Пример такого продукта гена включает в себя продукт гена семейства Sox. Примеры гена семейства Sox включают в себя, например, Sox1, Sox3,Sox7, Sox15, Sox17 и Sox18, и предпочтительный пример включает в себя Sox2. Ядерный фактор перепрограммирования, содержащий, по меньшей мере, сочетание продуктов четырех типов генов, гена семейства Oct (например, Oct3/4), гена семейства Klf (например, Klf4), гена семейства Myc (например, cMyc) и гена семейства Sox (например, Sox2), представляет собой предпочтительный вариант осуществления настоящего изобретения с точки зрения эффективности перепрограммирования, и в частности,сочетание с продуктом гена семейства Sox иногда является предпочтительным для получения плюрипотентности. Sox2, экспрессирующийся в процессе раннего развития, представляет собой ген, кодирующий фактор транскрипции (A.A. Avilion et al., Genes Dev., 17, pp.126-40, 2003). Регистрационные номера вNCBI для генов семейства Sox, отличных от Sox2, следующие. Таблица 2 Кроме того, продукт гена семейства Мус можно заменять на цитокин. В качестве цитокина предпочтительными являются, например, SCF, bFGF или т.п. Однако данные примеры цитокинов не являются ограничивающими. В качестве более предпочтительного варианта осуществления пример включает в себя фактор, индуцирующий иммортализацию клеток, в дополнение к вышеупомянутым трем типам продуктов генов,предпочтительно к четырем типам продуктов генов. Например, пример включает в себя сочетание фактора, содержащего продукт гена TERT, с фактором, содержащим продукт или продукты одного или нескольких типов генов, выбранных из группы, состоящей из следующих генов: для большого T-антигенаSV40, HPV16 Е 6, HPV16 Е 7 и Bmi1. TERT является необходимым для поддержания структуры теломеры на конце хромосомы во время репликации ДНК, и ген экспрессируется в стволовых клетках или клетках опухоли человека, в то время как он не экспрессируется во многих соматических клетках (I. Horikawa, etal., Proc. Natl. Acad. Sci. USA, 102, pp.18437-442, 2005). Опубликовано, что большой Т-антиген SV40,HPV16 Е 6, HPV16 Е 7 или Bmi1 индуцируют иммортализацию соматических клеток человека в сочетании с большим Т-антигеном (S. Akimov et al., Stem Cells, 23, pp.1423-1433, 2005; P. Salmon et al., Mol.Ther., 2, pp. 404-414, 2000). Указанные факторы являются особенно полезными, в частности, когда iPSклетки являются индуцированными из клеток человека. Регистрационные номера в NCBI для генов Более того, продукт или продукты одного или нескольких типов генов, выбранных из группы, состоящей из следующих:Fbx15, Nanog, ERas, ECAT15-2, Tell и -катенина, можно объединять. Пример особенно предпочтительного варианта осуществления с точки зрения эффективности перепрограммирования, включает в себя ядерный фактор перепрограммирования, содержащий всего десять типов продуктов генов, где продукты генов Fbx15, Nanog, ERas, ECAT15-2, Tell и -катенина объединяют с вышеупомянутыми четырьмя типами продуктов генов. Fbx15 (Y. Tokuzawa et al., Mol. Cell Biol., 23, pp. 2699-708, 2003), Nanog (K.Mitsui et al., Cell, 113, pp. 631-42, 2003), ERas (K. Takahashi, K. Mitsui, S. Yamanaka, Nature, 423, pp. 541-5,2003) и ECAT15-2 (A. Bortvin et al., Development, 130, pp. 1673-80, 2003) представляют собой гены, специфически экспрессирующиеся в ES-клетках. Tell вовлечен в активацию Akt (A. Bortvin et al., Development, 130, pp. 1673-80, 2003), и -катенин представляет собой важный фактор, приводящий в действие путь передачи сигнала Wnt, и опубликовано также, что он вовлечен в поддержание плюрипотентности(N. Sato et al, Nat. Med., 10, pp. 55-63, 2004). Кроме того, ядерный фактор перепрограммирования по настоящему изобретению может содержать,например, продукт или продукты одного или нескольких типов генов, выбранных из группы, состоящей из следующих: ECAT1, Esg1, Dnmt3L, ECAT8, Gdf3, Sox15, ECAT15-1, Fthl17, Sall4, Rex1, UTF1, Stella,Stat3 и Grb2. ECAT1, Esg1, ECAT8, Gdf3 и ECAT15-1 представляют собой гены, специфически экспрессирующиеся в ES-клетках (K. Mitsui et al., Cell, 113, pp. 631-42, 2003). Dnmt3L представляет собой фактор, связанный с метилирующим ДНК ферментом, и Sox15 представляет собой класс генов, экспрессирующихся в процессе раннего развития и кодирующих факторы транскрипции (M. Maruyama et al., J.Biol. Chem., 280, pp.24371-9, 2005). Fthl17 кодирует подобный тяжелому полипептиду ферритина 17 (A.colLoriot, Т. Boon, С. De Smet, Int. J. Cancer, 105, pp.371-6, 2003), Sall4 кодирует белок с Zn-пальцами, в большом количестве экспрессирующийся в эмбриональных стволовых клетках (J. Kohlhase et al., Cytogenet. Genome Res., 98, pp.274-7, 2002), и Rex1 кодирует фактор транскрипции, расположенный нижеUTF1 представляет собой кофактор транскрипции, расположенный ниже Oct3/4, и опубликовано, что супрессия пролиферации ES-клеток индуцирована, когда данный фактор супрессирован (A. Okuda et al.,EMBO J., 17, pp.2019-32, 1998). Stat3 представляет собой сигнальный фактор для пролиферации и дифференцировки клеток. Активация Stat3 запускает действие LIF, и таким образом, фактор играет важную роль в поддержании плюрипотентности (H. Niwa, T. Burdon, I. Chambers, A. Smith, Genes Dev., 12,pp.2048-60, 1998). Grb2 кодирует белок, являющийся промежуточным звеном между различными рецепторами факторов роста, существующими на мембранах клетки, и каскадом Ras/MAPK (A.M. Cheng et al.,Cell, 95, pp.793-803, 1998). Однако продукты генов, которые можно включать в ядерный фактор перепрограммирования по настоящему изобретению, не являются ограниченными продуктами генов, конкретно указанных выше. Ядерный фактор перепрограммирования по настоящему изобретению может содержать один или несколько факторов, относящихся к дифференцировке, развитию, пролиферации или т.п., и факторов, обладающих другими видами физиологической активности, а также другие продукты генов, которые могут функционировать как ядерный фактор перепрограммирования. Понятно, что такие варианты осуществления попадают в объем настоящего изобретения. Посредством использования соматических клеток, в которых экспрессируются только один или два гена из трех типов генов Oct3/4, Klf4 и c-Myc, можно идентифицировать продукты других генов, которые могут функционировать как ядерный фактор перепрограммирования, например, посредством скрининга продукта гена, который может индуцировать перепрограммирование ядер указанных клеток. В соответствии с настоящим изобретением вышеупомянутый способ скрининга также представлен как новый способ скрининга ядерного фактора перепрограммирования. Продукты генов, содержащиеся в ядерном факторе перепрограммирования по настоящему изобретению, могут представлять собой, например, белок, собственно полученный с помощью вышеупомяну-7 018039 того гена, или, альтернативно, в форме продукта слитного гена для указанного белка с другим белком,пептидом или т.п. Например, можно использовать также слитый белок с зеленым флуоресцентным белком (GFP) или продукт слитого гена с таким пептидом, как гистидиновая метка. Кроме того, посредством получения и использования слитого белка с пептидом ТАТ, полученным из вируса HIV, можно способствовать внутриклеточному поглощению ядерного фактора перепрограммирования через мембраны клеток, таким образом, обеспечивая возможность индукции перепрограммирования посредством только добавления слитого белка в среду, таким образом, исключая сложные операции, такие как трансдукция гена. Поскольку способы получения продуктов таких слитых генов хорошо известны специалистам в данной области, специалисты в данной области легко могут сконструировать и получить продукт соответствующего слитого гена в зависимости от цели. Посредством использования ядерного фактора перепрограммирования по настоящему изобретению,ядро соматической клетки можно перепрограммировать для получения индуцированной плюрипотентной стволовой клетки. В данном описании термин индуцированные плюрипотентные стволовые клетки обозначает клетки, обладающие свойствами, сходными со свойствами ES-клеток, и более конкретно термин относится к недифференцированным клеткам, обладающим плюрипотентностью и способностью к росту. Однако термин не следует истолковывать узко в каком-либо смысле, и следует истолковывать его в самом широком смысле. Способ получения индуцированных плюрипотентных стволовых клеток с использованием ядерного фактора перепрограммирования описан в Международной публикации WO 2005/80598 (в публикации используют термин ES-подобные клетки), и конкретно описаны также способы для выделения индуцированных плюрипотентных стволовых клеток. Таким образом, с помощью ссылки на вышеупомянутую публикацию специалисты в данной области могут легко получить индуцированные плюрипотентные стволовые клетки с использованием ядерного фактора перепрограммирования по настоящему изобретению. Способ получения индуцированных плюрипотентных стволовых клеток из соматических клеток с использованием ядерного фактора перепрограммирования по настоящему изобретению не является ограниченным конкретно. Можно применять любой способ до тех пор, пока ядерный фактор перепрограммирования может контактировать с соматическими клетками в условиях, при которых возможна пролиферация соматических клеток и индуцированных плюрипотентных стволовых клеток. Например, продукт гена, содержащийся в ядерном факторе перепрограммирования по настоящему изобретению, можно добавлять в среду. Альтернативно, с использованием вектора, содержащего ген, с которого можно экспрессировать ядерный фактор перепрограммирования по настоящему изобретению, можно применять способы трансдукции указанного гена в соматическую клетку. При использовании такого вектора два или более типов генов можно вводить в вектор, и продукты каждого из генов можно одновременно экспрессировать в соматической клетке. Когда один или несколько из продуктов генов, содержащихся в ядерном факторе перепрограммирования по настоящему изобретению, уже экспрессируются в соматической клетке, подлежащей перепрограммированию, продукты указанных генов можно исключить из ядерного фактора перепрограммирования по настоящему изобретению. Понятно, что такой вариант осуществления попадает в объем настоящего изобретения. При получении индуцированных плюрипотентных стволовых клеток с использованием ядерного фактора перепрограммирования по настоящему изобретению типы соматических клеток, подлежащих перепрограммированию, не являются ограниченными конкретно, и можно использовать любые виды соматических клеток. Например, можно использовать зрелые соматические клетки, а также соматические клетки эмбрионального периода. Когда индуцированные плюрипотентные стволовые клетки используют для терапевтического лечения заболеваний, желательно использовать соматические клетки, выделенные у пациентов. Например, можно использовать соматические клетки, вовлеченные в заболевания, соматические клетки, участвующие в терапевтическом лечении заболеваний, и т.п. Способ для отбора индуцированных плюрипотентных стволовых клеток, которые присутствуют в среде согласно способу по настоящему изобретению, не является ограниченным конкретно, и соответственно, можно использовать хорошо известные способы, например, ген устойчивости к лекарственному средству или т.п. можно использовать в качестве маркерного гена для выделения индуцированных плюрипотентных стволовых клеток с использованием устойчивости к лекарственному средству в качестве показателя. Различные среды,которые могут поддерживать недифференцированное состояние и плюрипотентность ES-клеток, и различные среды, которые не могут поддерживать такие свойства, известны в данной области, и индуцированные плюрипотентные стволовые клетки можно эффективно выделить с использованием сочетания подходящей среды. Специалисты в данной области легко могут подтвердить способность к дифференцировке и пролиферации выделенных индуцированных плюрипотентных стволовых клеток с использованием способов подтверждения, широко применяемых для ES-клеток. Применения индуцированных плюрипотентных стволовых клеток, полученных способом по настоящему изобретению, не являются ограниченными конкретно. Клетки можно использовать для любых экспериментов и исследований, проводимых с ES-клетками, видов терапевтического лечения с использованием ES-клеток и т.п. Например, желаемые дифференцированные клетки (например, нервные клетки,-8 018039 клетки сердечной мышцы, гемоциты и т.п.) можно получить посредством обработки индуцированных плюрипотентных стволовых клеток, полученных способом по настоящему изобретению, ретиноевой кислотой, факторами роста, такими как EGF, глюкокортикоид или т.п., и терапию стволовыми клетками,основанную на аутотрансплантации клеток, можно выполнять посредством возвращения пациенту дифференцированных клеток, полученных, как описано выше. Однако применения индуцированных плюрипотентных стволовых клеток по настоящему изобретению не являются ограниченными вышеупомянутыми конкретными вариантами осуществления. Примеры Настоящее изобретение будет более конкретно объяснено на примерах. Однако объем настоящего изобретения не является ограниченным следующими примерами. Пример 1. Отбор фактора перепрограммирования. Чтобы идентифицировать факторы перепрограммирования, требуется экспериментальная система для простого наблюдения феномена перепрограммирования. В качестве экспериментальной системы использовали мышь с нокином geo (слитого гена из гена -галактозидазы и гена устойчивости к неомицину) в локусе Fbx15. Ген Fbx15 мыши представляет собой ген, специфически экспрессирующийся при дифференцировке плюрипотентных клеток, таких как ES-клетки, и в ранних эмбрионах. Однако у гомомутантной мыши, с нокином geo в гене Fbx15 мыши таким, что удалена функция Fbx15, не наблюдали аномальных фенотипов, включая фенотипы, относящиеся к плюрипотентности при дифференцировке или развитии. У этой мыши контроль экспрессии geo осуществляют посредством энхансера и промотора гена Fbx15. Конкретно, geo не экспрессируется в дифференцированных соматических клетках, и они являются чувствительными к G418. В отличие от этого, гомомутантные ES-клетки с нокином geo обладают устойчивостью к G418 в необычайно высокой концентрации (равной или превышающей 12 мг/мл). Посредством использования вышеуказанного феномена сконструировали экспериментальную систему для визуализации перепрограммирования соматических клеток. В вышеупомянутой экспериментальной системе фибробласты (Fbx15geo/geo MEF) сначала выделяли из эмбриона гомоутантной мыши с нокином geo (13,5 суток после оплодотворения). Поскольку MEF не экспрессируют ген Fbx15, клетки также не экспрессируют geo и таким образом обладают чувствительностью к G418. В то же время, когда MEF слиты с ES-клетками, не подвергавшимися манипуляции с генами (также обладающими чувствительностью к G418), ядра MEF являются перепрограммированными,и в результате geo экспрессируется и придает устойчивость к G418. Феномен перепрограммирования можно таким образом визуализировать как устойчивость к G418 посредством использования этой экспериментальной системы (Международная публикация WO 2005/80598). Поиски факторов перепрограммирования проводили с использованием вышеупомянутой экспериментальной системы (фиг. 1), и всего 24 типа генов выбрали в качестве кандидатов на роль факторов перепрограммирования, включая гены,для которых показали специфическую экспрессию в ES-клетках, и гены, для которых предполагают важную роль в поддержании плюрипотентности при дифференцировке ES-клеток. Эти гены показаны в табл. 4 и 5 ниже. В случае -катенина ( 21) и c-Myc ( 22) использовали мутанты активного типа (катенин: кДНК указанных генов вставляли в ретровирусный вектор рМХ-gw способом Gateway. Сначала каждым из 24 генов инфицировали Fbx15geo/geo MEF, и затем проводили отбор с G418 в условиях культивирования ES-клеток. Однако не получили устойчивых к G418 колоний. Затем ретровирусными векторами для всех 24 генов одновременно инфицировали Fbx15geo/geo MEF. Когда проводили отбор с G418 в условиях культивирования ES-клеток, получили множество колоний, устойчивых к лекарственному средству. Эти колонии выделяли, и продолжали культивирование. Обнаружили, что культивирование этих клеток можно проводить в течение длительного периода времени и что эти клетки обладают морфологией, сходной с морфологией ES-клеток (фиг. 2). На фигуре iPS-клетки представляют собой индуцированные плюрипотентные стволовые клетки (называемые также подобные ES-клетки, ESподобные клетки или ESL-клетки), ES представляют собой эмбриональные стволовые клетки, и MEF представляют собой дифференцированные клетки (эмбриональные фибробласты). Когда профили экспрессии маркерных генов исследовали посредством RT-PCR, обнаружили экспрессию таких маркеров дедифференцировки, как Nanog и Oct3/4 (фиг. 3). Обнаружили, что экспрессияNanog являлось близкой к экспрессии в ES-клетках, в то время как экспрессия Oct3/4 была ниже, чем вES-клетках. Когда исследовали статус метилирования ДНК способом бисульфитного секвенирования,обнаружили, что ген Nanog и ген Fbx15 являются высокометилированными в MEF, в то время как они являются деметилированными в iPS-клетках (фиг. 4). Приблизительно 50% гена IGF2, гена импринтинга, являлось метилированным как в клетках MEF,так и в iPS-клетках. Поскольку известно, что память импринтинга удалена и ген IGF2 почти полностью деметилирован в примордиальных зародышевых клетках через 13,5 суток после оплодотворения, из которых выделены Fbx15geo/geo MEF, заключили, что iPS-клетки не происходят из примордиальных зародышевых клеток, оставшихся в виде примеси в Fbx15geo/geo MEF. Вышеуказанные результаты показали,что перепрограммирование дифференцированных клеток (MEF) до состояния, близкого к состоянию ESклеток, можно индуцировать с помощью сочетания 24 типов факторов. Затем проводили исследования того, все ли из 24 типов генов являются необходимыми для перепрограммирования. 23 генами, с удалением каждого отдельного гена, трансфицировали Fbx15geo/geoMEF. В результате для 10 генов обнаружили ингибирование формирования колоний при удалении каждого из них (фиг. 5, номера генов соответствуют номерам генов, показанных в табл. 4, и гены представляют собой следующие 10 типов генов:3,4,5,11,14,15,18,20,21 и 22). Ко- 12018039 гда этими десятью генами одновременно трансфицировали Fbx15geo/geo MEF, устойчивые к G418 колонии получали со значительно большей эффективностью по сравнению с одновременной трансфекцией 24 генами. Кроме того, 9 генами, с удалением каждого отдельного гена из 10 генов, трансфицировалиFbx15geo/geo MEF. В результате обнаружили, что колонии устойчивых к G418 iPS-клеток не формировались, когда удаляли каждый из 4 типов генов ( 14,15,20 или 22) (фиг. 6). Таким образом,предположили, что эти четыре типа генов среди десяти генов играют особенно важные роли в индукции перепрограммирования. Пример 2. Индукция перепрограммирования с помощью сочетания 4 типов генов. Исследовали, можно ли достичь индукции перепрограммирования соматических клеток с помощью четырех типов генов, для которых предполагали особенную важность среди 10 генов. С использованием сочетания вышеупомянутых 10 типов генов, сочетания вышеупомянутых 4 типов генов, сочетаний только 3 типов генов среди 4 типов генов и сочетаний только 2 типов генов среди 4 типов генов, эти наборы генов трансдуцировали с помощью ретровирусов в MEF-клетки, как в соматические клетки, в которых проведен нокин гена geo в гене Fbx15. В результате при трансдукции 4 типов генов получили 160 устойчивых к G418 колоний. Хотя этот результат является почти таким же, как результат, полученный посредством трансдукции с 10 типами генов (179 колоний), колонии, полученные посредством трансдукции 4 генов, были меньше, чем колонии после трансдукции 10 генами. При пассировании этих колоний число колоний, обладающих морфологией iPS-клеток, составляло 9 клонов среди 12 клонов в случае трансдукции 10 генами, в то время как присутствовала тенденция к некоторому понижению - 7 клонов среди 12 клонов в случае трансдукции 4 генами. В случае 4 генов почти такое же число iPS-клеток получили как для клеток, полученных у мыши, так и для клеток, полученных у человека. При трансдукции 3 генов, выбранных из вышеупомянутых 4 генов, получили 36 плоских колоний с одним из сочетаний ( 14,15 и 20). Однако при их пассировании iPS-клеток не наблюдали. С другим сочетанием ( 14,20 и 22) получили 54 небольшие колонии. При пассировании 6 относительно крупных колоний из этих колоний, клетки, подобные ES-клеткам, получили для всех этих 6 клонов. Однако, по-видимому, адгезия этих клеток между собой и к культуральной чашке была слабее, чем адгезия ES-клеток. Скорость пролиферации клеток также являлась более медленной, чем скорость, наблюдаемая в случае трансдукции 4 генами. Кроме того, по одной колонии сформировалось с каждым из двух других видов сочетаний 3 генов из 4 генов. Однако пролиферации клеток не наблюдали при пассировании клеток. С любым из сочетаний 2 генов, выбранных из 4 генов (6 сочетаний), не сформировалось устойчивых к G418 колоний. Вышеуказанные результаты показаны на фиг. 7. Кроме того, результаты наблюдения профилей экспрессии маркерных генов ES-клетки посредствомRT-PCR показаны на фиг. 10. Подробности способа следующие. Из iPS-клеток, полученных посредством трансдукции 3 генов (Oct3/4, Klf4 и с-Myc: представлены как Sox2 минус), 4 генов (Sox2 добавляли к трем генам: представлены как 4ECAT) и 10 генов ( 3,4,5,11,18 и 21 в табл. 4 добавляли к четырем генам: представлены как 10ECAT) в Fbx15geo/geo MEF, iPS-клеток, полученных посредством трансдукции 10 генов в фибробласты, полученные из кончика хвоста взрослой мыши, у которой проведен нокин geo в гене Fbx15 (представлены как фибробласты кожи с 10ECAT), ES-клеток мыши и MEF-клеток без трансдукции генов выделяли тотальную РНК и обрабатывали ДНКазой I для удаления загрязнения геномной ДНК. Первые цепи кДНК получали реакцией обратной транскрипции, и профили экспрессии маркерных генов ES-клетки исследовали посредством PCR. В случае Oct3/4, Nanog и ERas, PCR проводили с использованием праймеров, которые амплифицируют только продукт транскрипции эндогенного гена, не с трансдуцированного ретровируса. Последовательности праймеров показаны в табл. 6. Результаты, показанные на данной фигуре, показывают, что посредством трансдукции 3 генов эффективно индуцирована экспрессия каждого из ERas и Fgf4, однако экспрессия каждого из Oct3/4 иNanog, факторов, необходимых для поддержания плюрипотентности, не являлась индуцированной или являлась очень слабой даже при индукции. Однако при трансдукции 4 генов присутствовал один клон( 7), в котором Oct3/4 и Nanog являлись относительно сильно индуцированными среди изучаемых 4 клонов. Кроме того, при трансдукции 10 генов сильную индукцию каждого из Oct3/4 и Nanog наблюдали в 3 клонах среди исследуемых 5 клонов. Эти результаты показывают, что сочетание по меньшей мере 3 генов ( 14,20 и 22) является необходимым для перепрограммирования, и в случае группы из 4 генов и группы из 10 генов, включая 3 типа генов, эффективность перепрограммирования увеличивалась пропорционально увеличению числа генов. Пример 3. Анализ плюрипотентности перепрограммированных клеток. Чтобы оценить плюрипотентность при дифференцировке полученных iPS-клеток, iPS-клетки, полученные с помощью 24 факторов, 10 факторов и 4 факторов, подкожно трансплантировали мышам nude. В результате опухоли, обладающие размером, сходным с опухолями, наблюдаемыми в случае ES-клеток,сформировались у всех животных. Гистологически опухоли состояли из множества типов клеток, и наблюдали хрящевые ткани, нервные ткани, мышечные ткани, жировые ткани и ткани, подобные тканям кишечника (фиг. 8), что подтверждает плюрипотентность iPS-клеток. В отличие от этого, хотя опухоли формировались, когда клетки, полученные с помощью 3 факторов трансплантировали мышам nude, гистологически они являлись сформированными только из недифференцированных клеток. Таким образом,обнаружили, что ген семейства Sox является необходимым для индукции плюрипотентности при дифференцировке. Пример 4. Перепрограммирование фибробластов, полученных из хвостов взрослых мышей. 4 фактора, идентифицированные в эмбриональных фибробластах мыши (MEF), трансдуцировали в фибробласты, полученные из хвостов взрослых мышей с нокином geo Fbx15, с системной экспрессией зеленого флуоресцентного белка (GFP). Затем клетки культивировали на фидерных клетках в тех же самых условиях, что и условия культивирования ES-клеток, и проводили отбор по G418. Через приблизительно две недели после начала отбора с лекарственным средством получили множество колоний iPSклеток. Когда эти клетки подкожно трансплантировали мышам nude, формировались тератомы, состоящие из множества тканей из всех трех зародышевых листков. Кроме того, когда iPS-клетки, полученные из фибробластов кожи взрослых, трансплантировали в бластоцисты, и затем трансплантировали в матки псевдобеременных мышей, получили эмбрионы, в которых GFP-положительные клетки являлись системно распределенными через 13,5 суток после оплодотворения (фиг. 9), что показывает, что iPS-клетки обладают плюрипотентностью и способны вносить вклад в эмбриогенез мыши. Эти результаты показывают, что идентифицированный класс факторов обладает способностью индуцировать перепрограммирование не только соматических клеток в эмбриональном периоде, но также соматических клеток зрелой мыши. На практике является чрезвычайно важным, что перепрограммирование можно индуцировать в клетках, полученных из кожи взрослых. Пример 5. Исследовали действие цитокинов на получение iPS-клеток. Экспрессирующий вектор (ретровирусный вектор рМХ) для основного фактора роста фибробластов (bFGF) или фактора стволовых клеток(SCF) трансдуцировали в фидерные клетки (клетки STO) для получения клеток, постоянно экспрессирующих цитокины. MEF, полученные у мыши Fbx15geo/geo (500000 клеток/100-мм чашку) культивировали на этих клетках STO, трансдуцировали 4 факторами и затем подвергали отбору с G418. В результате число сформированных колоний увеличивалось в 20 раз или выше на клетках STO, продуцирующихbFGF (фиг. 11) или SCF (данные не представлены), по сравнению с культивированием на нормальных клетках STO. Кроме того, хотя при трансдукции 3 факторов, отличных от c-Myc, не сформировалось колоний iPS-клеток на нормальных клетках STO, формирование колоний наблюдали на клетках STO, продуцирующих bFGF (фиг. 11) или SCF (данные не представлены). Эти результаты показывают, что стимуляция цитокином увеличивает эффективность получения iPS-клеток из MEF и перепрограммирования ядер можно достигать с использованием цитокина вместо c-Myc. Пример 6. Существуют семейства всех генов Oct3/4, Klf4, c-Myc и Sox2 (табл. 1 и 2). Соответственно, проводили исследования, можно ли получить iPS-клетки с генами из семейств вместо этих 4 генов. В табл. 7 показаны объединенные экспериментальные результаты для двух параллелей. По отношению к семейству Sox, для Sox1 получили почти такое же число сформированных устойчивых к G418 колоний и эффективность получения iPS-клеток, как и полученные с Sox2. Что касается Sox3, число сформировавшихся устойчивых к G418 колоний составляло приблизительно 1/10 от числа колоний с Sox2, однако эффективность получения iPS-клеток из отобранных колоний фактически была выше, чем эффективность с Sox2. Что касается Sox15, как число сформировавшихся устойчивых к G418 колоний, так и эффективность получения iPS-клеток были ниже, чем с Sox2. Что касается Sox17, число сформировавшихся устойчивых кG418 колоний являлось почти таким же, как с Sox2, однако эффективность получения iPS-клеток являлась низкой. Что касается семейства Klf, для Klf2 получили меньшее число устойчивых к G418 колоний,чем с Klf4, однако для них получили почти такую же эффективность получения iPS-клеток. Что касается семейства Myc, обнаружили, что c-Myc дикого типа являлся почти таким же, как мутант Т 58 А, как по числу сформировавшихся устойчивых к G418 колоний, так и по эффективности получения iPS-клеток. Кроме того, каждый из N-Myc и L-Myc (каждый дикого типа) являлся почти таким же, как c-Myc, как по числу сформировавшихся устойчивых к G418 колоний, так и по эффективности получения iPS-клеток. Пример 7. Проводили исследования, можно ли получить iPS-клетки с репортером, отличным от Fbx15-geo. Выделяли искусственную бактериальную хромосому (ВАС) Escherichia coli, содержащую ген Nanog в середине, и затем проводили нокин гена GFP и гена устойчивости к пуромицину Е. coli посредством рекомбинации (фиг. 12 А). Затем вышеуказанную модифицированную ВАС вводили в ES-клетки, чтобы подтвердить, что клетки становятся GFP-положительными специфическим для недифференцированного состояния образом (данные не представлены). Затем эти ES-клетки трансплантировали в бластоцисты мыши для получения трансгенных мышей через химерных мышей. У этих мышей наблюдали специфические GFP-положительные клетки во внутренних клеточных массах бластоцист или гонад эмбрионов через 13,5 суток после оплодотворения (фиг. 12 В). Гонады удаляли из эмбрионов через 13,5 суток после оплодотворения (гибрид мышей DBA, 129 и C57BL/6) и выделяли MEF. Подтверждали, что MEF являются GFP-отрицательными (фиг. 13) посредством проточной цитометрии. Эти MEF трансдуцировали с помощью ретровирусов с 4 факторами и подвергали отбору с пуромицином, и в результате получили большое число устойчивых колоний. Только приблизительно 10-20% колоний являлись GFPположительными. При пассировании GFP-положительных колоний для них получали морфологию (фиг. 14) и пролиферацию (фиг. 15), такие же, как и для ES-клеток. Исследование характера экспрессии генов показало, что характер экспрессии был ближе к характеру экспрессии в ES-клетках по сравнению с iPSклетками, выделенными из Fbx15geo/geo MEF посредством отбора с G418 (фиг. 16). При трансплантации этих клеток мышам nude, индуцировали формирование тератомы, таким образом, подтверждали, что клетки являются iPS-клетками (фиг. 17). Кроме того, получали рождение химерных мышей посредством трансплантации iPS-клеток, полученных посредством отбора по Nanog-GFP, в бластоцисты мышейC57BL/6 (фиг. 18). При скрещивании этих химерных мышей наблюдали перенос зародышевой линии(фиг. 19). В этих iPS-клетках, полученных посредством отбора с Nanog-GFP, более близких к ESклеткам, экспрессия 4 факторов из ретровирусов являлась почти полностью молчащей, что позволяет предполагать, что самовоспроизведение поддерживают эндогенные Oct3/4 и Sox2. Пример 8.iPS-клетки из 10-см конфлюэнтного слоя обрабатывали трипсином и суспендировали в среде дляES-клеток (клетки STO удаляли посредством адгезии на покрытых желатином чашках в течение 10-20 мин после суспендирования). 2106 клеток культивировали в течение четырех суток в покрытых НЕМА(2-гидроксиэтилметакрилатом) культуральных чашках для Е. coli в суспензионной культуре для формирования эмбриоидных телец (ЕВ) (сутки 1-4). На 4-е сутки формирования ЕВ (сутки 4), все ЕВ переносили в 10-см культуральную чашку и культивировали в среде для ES-клеток в течение 24 ч, чтобы обеспечить адгезию. Через 24 ч (сутки 5) среду меняли на среду, содержащую ITS/фибронектин. Культивирование проводили в течение 7 суток (среду меняли каждые 2 суток) и отбирали положительные по нестину клетки (клетки из других семейств погибали до определенной степени в условиях культивирования в бессывороточной среде) (сутки 5-12). Затем индуцировали А 2 В 5-положительные клетки. Через 7 суток(сутки 12) клетки разделяли посредством обработки трипсином и удаляли оставшиеся ЕВ. 1105 клеток высевали на покрытый поли-L-орнитином/фибронектином 24-луночный планшет и культивировали в течение 4 суток в среде, содержащей N2/bFGF (среду меняли каждые 2 суток) (сутки 12-16). Через 4 суток (сутки 16) среду меняли на среду, содержащую N2/bFGF/EGF, и продолжали культивирование в течение 4 суток (среду меняли каждые 2 суток) (сутки 16-20). Через 4 суток (сутки 20) среду меняли на среду, содержащую N2/bFGF/PDGF, и продолжали культивирование в течение 4 суток (среду меняли каждые 2 суток) (сутки 20-24). В течение этого периода (сутки 12-24), когда клетки избыточно размножались и достигали конфлюэнтности, их пассировали соответствующее число раз и высевали по 1-2105 клеток (число клеток менялось в зависимости от интервалов времени пассирования). Через 4 суток (сутки 24) среду меняли на среду N2/T3 и продолжали культивирование в течение 7 суток (сутки 24-31) с заменой среды каждые 2 суток. На сутки 31 клетки фиксировали и подвергали иммуноокрашиванию. В результате наблюдали дифференцировку iPS-клеток в положительные по III-тубулину нервные клетки,O4-положительные олигодендроциты и GFAP-положительные астроциты (фиг. 20). Пример 9. Для получения iPS-клеток из произвольно выбранных соматических клеток мыши, отличных от клеток, полученных у мыши с нокином Fbx15-geo, разработали способ получения без использования отбора с лекарственным средством. Эмбриональные фибробласты мыши (MEF) культивировали в 10-см чашке (на фидерных клетках STO) в меньших количествах, чем используемые выше (10000, 50000 или 100000 клеток), и контрольную ДНК или 4 фактора трансдуцировали с помощью ретровирусов. Когда культивирование проводили в течение 2 недель в среде для ES-клеток (без отбора с G418), не наблюдали формирования колоний на чашке с трансдукцией контрольной ДНК, в то время как на чашке с трансдукцией 4 факторов сформировалось множество компактных колоний, а также плоских колоний, которые считали трансформированными (фиг. 21). Когда из этих колоний отбирали 24 колонии и продолжали культивирование, наблюдали морфологию, подобную морфологии ES-клеток. Профили экспрессии их генов исследовали посредством RT-PCR, и в результате экспрессию Esg1, маркера ES-клеток, наблюдали в 7 клонах. Индукцию многих маркеров ES-клеток, таких как Nanog, ERas, GDF3, Oct3/4 и Sox2, наблюдали в клоне 4, и таким образом, считали, что клетки являются iPS-клетками (фиг. 22). Вышеуказанные результаты показали, что отбор с лекарственным средством с использованием нокина Fbx15-geo или т.п. не является обязательным для получения iPS-клетки, и iPS-клетки можно получать из соматических клеток, полученных из выбранной случайным образом мыши. Это также позволяет предполагать возможность того, что посредством вышеупомянутого способа iPS-клетки можно получать из соматических клеток мыши, являющейся модельной для заболевания. Пример 10. В качестве клеток, из которых индуцировали iPS-клетки, исследовали гепатоциты и клетки слизистой оболочки желудка, являющиеся клетками, отличными от фибробластов. Гепатоциты выделяли из печени мышей Fbx15geo/geo посредством перфузии. В эти гепатоциты с помощью ретровирусов вводили 4 фактора и затем подвергали их отбору с G418 для получения множества колоний iPS-клеток. В качестве результата анализа характера экспрессии генов с использованием микрочипов ДНК обнаружили, чтоiPS-клетки, полученные из печени, являются более сходными с ES-клетками, чем iPS-клетки, полученные из фибробластов кожи или эмбриональных фибробластов. iPS-клетки получили также из клеток слизистой оболочки желудка таким же способом, как из гепатоцитов. Пример 11.PD98059 представляет собой ингибитор MAP-киназы, супрессирующий пролиферацию различных дифференцированных клеток. Однако известно, что он стимулирует поддержание недифференцированного статуса и пролиферации ES-клеток. Таким образом, изучали действия PD98059 на получение iPSклеток. В MEF, полученные у мыши, обладающей селективными маркерами Nanog-EGFP-IRES-Puro, с помощью ретровирусов вводили 4 фактора и подвергали отбору с пуромицином. Без добавленияPD98059 процент GFP-положительных колоний составлял 8% из полученных колоний iPS-клеток. Однако в группе, в которой PD98059 (конечная концентрация: 25 мкМ) постоянно добавляли со следующих суток после ретровирусной трансфекции, 45% из полученных колоний являлись GFP-положительными. Результаты интерпретировали, как обусловленные тем, что PD98059 стимулирует пролиферацию GFPположительных iPS-клеток, которые являются более близкими к ES-клеткам, в то время как PD98059 супрессирует пролиферацию GFP-отрицательных iPS-клеток или дифференцированных клеток. По этим результатам показали, что PD98059 можно использовать для получения iPS-клеток, более близких к ESклеткам, или получения iPS-клеток без использования отбора с лекарственным средством. Пример 12. Плазмиду, содержащую ген красного флуоресцентного белка ниже промотора гена Oct3/4 мыши и ген устойчивости к гигромицину ниже промотора PGK, вводили посредством нуклеофекции в эмбриональные фибробласты кожи человека (HDF), в которых посредством лентивирусной трансдукции экспрессировали растворимый носитель семейства 7 (Slc7a1, регистрационный номер в NCBI NM007513) в качестве рецептора экотропного вируса мыши. Проводили отбор с гигромицином для получения штаммов со стабильной экспрессией. 800000 клеток высевали на клетках STO, обработанных митомицином, и на следующие сутки Oct3/4, Sox2, Klf4 и c-Myc (каждый получен у человека) с помощью ретровирусов трансдуцировали в клетки. Отбирали 24 колонии из полученных через 3 недели (фиг. 23, слева), переносили в 24-луночный планшет, на котором рассеяны клетки STO, и затем культивировали. Через 2 недели один из выращиваемых клонов высевали в 6-луночном планшете, на котором высеяны клетки STO, и культивировали. В результате получили клетки, морфологически сходные с ES-клетками (фиг. 23, справа), что позволяет предполагать, что клетки представляли собой iPS-клетки. В качестве среды в каждом случае использовали среду для ES-клеток мыши. Пример 13. Фибробласты кожи взрослого человека (взрослые HDF) трансдуцировали Slc7a1 (рецептор для ретровирусов мыши) с использованием лентивируса и полученные клетки высевали на 800000 фидерных клеток (обработанные митомицином клетки STO). Гены трансдуцировали с помощью ретровирусов в виде следующих сочетаний. 1. Oct3/4, Sox2, Klf4, c-Myc, TERT и большой T антиген SV40 2. Oct3/4, Sox2, Klf4, C-Myc, TERT, HPV16 E6 3. Oct3/4, Sox2, Klf4, C-Myc, TERT, HPV16 E7 4. Oct3/4, Sox2, Klf4, C-Myc, TERT, HPV16 E6, HPV16 E7 5. Oct3/4, Sox2, Klf4, c-Myc, TERT, Bmi1(Oct3/4, Sox2, Klf4, c-Myc и TERT получены у человека, а Bmi1 получен у мыши). Культивирование продолжали в условиях культивирования для ES-клеток мыши без отбора с лекарственным средством. В результате колонии, которые сочли колониями iPS-клеток, появились на 8-е сутки после вирусной трансфекции на чашке, на которую факторы вводили согласно сочетанию 1 (фиг. 24). Колонии iPS-подобных-клеток появлялись также с другими сочетаниями (2-5), хотя они являлись не такими заметными по сравнению с сочетанием 1. При трансдукции только 4 факторами не появлялось колоний. Промышленная применимость С использованием ядерного фактора перепрограммирования, предоставленного по настоящему изобретению, можно удобно с высокой воспроизводимостью индуцировать перепрограммирование ядер дифференцированных клеток без использования эмбрионов или ES-клеток и можно получать индуцированные плюрипотентные стволовые клетки в виде недифференцированных клеток, обладающих способностью к дифференцировке, плюрипотентностью и способностью к росту, сходными с ES-клетками. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ядерный фактор перепрограммирования для соматической клетки, содержащий каждый из следующих трех типов генов: гена семейства Oct, гена семейства Klf и гена семейства Мус. 2. Фактор по п.1, содержащий каждый из трех следующих типов генов: Oct3/4, Klf4 и c-Myc. 3. Фактор по п.1 или 2, дополнительно содержащий ген семейства Sox. 4. Фактор по п.3, содержащий следующий ген Sox2. 5. Фактор по любому из пп.1-4, содержащий цитокин вместе с геном семейства Мус или вместо гена семейства Myc. 6. Фактор по п.5, где цитокин представляет собой bFGF и/или SCF. 7. Фактор по любому из пп.1-6, дополнительно содержащий ген TERT. 8. Фактор по любому из пп.1-7, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из следующих генов: гена большого Т-антигена SV40, гена HPV16 Е 6,гена HPV16 Е 7 и гена Bmi1. 9. Фактор по любому из пп.1-8, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из генов Fbx15, Nanog, ERas, ECAT15-2, Tcl1 и -катенина. 10. Фактор по любому из пп.1-9, дополнительно содержащий один или несколько типов генов, выбранных из группы, состоящей из генов ECAT1, Esg1, Dnmt3L, ECAT8, Gdf3, Sox15, ECAT15-1, Fthl17,Sall4, Rex1, UTF1, Stella, Stat3 и Grb2. 11. Способ получения индуцированной плюрипотентной стволовой клетки посредством перепрограммирования ядра соматической клетки, включающий в себя стадию приведения в контакт ядерного фактора перепрограммирования по любому из пп.1-10 с соматической клеткой. 12. Способ по п.11, где соматическая клетка является клеткой человека. 13. Индуцированная плюрипотентная стволовая клетка, полученная способом по п.11 или 12. 14. Соматическая клетка, полученная посредством индукции дифференцировки индуцированной плюрипотентной стволовой клетки по п.13. 15. Способ улучшения способности к дифференцировке и/или способности роста клетки, который включает в себя стадию приведения в контакт ядерного фактора перепрограммирования по любому из пп.1-10 с клеткой. 16. Способ по п.15, где клетка является клеткой человека.
МПК / Метки
МПК: C12N 15/09, C07K 14/47
Метки: ядерный, перепрограммирования, фактор
Код ссылки
<a href="https://eas.patents.su/30-18039-yadernyjj-faktor-pereprogrammirovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Ядерный фактор перепрограммирования</a>
Предыдущий патент: Ингибиторы активности akt
Следующий патент: Тепловая изоляция трубопровода
Случайный патент: Фунгицидная смесь