Высокоаффинный сайт связывания hgfr и способы идентификации его антагонистов
Номер патента: 17863
Опубликовано: 29.03.2013
Авторы: Базилико Кристина, Карминати Паоло, Микьели Паоло, Комольо Паоло Мария
Формула / Реферат
1. Применение полинуклеотида, кодирующего полипептид, состоящий из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, для скрининга и/или разработки фармакологически активных агентов, полезных при лечении рака.
2. Применение полипептида, состоящего из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, для скрининга и/или разработки фармакологически активных агентов, полезных при лечении рака.
3. Применение по п.1 или 2, где указанный фармакологически активный агент препятствует проявлению каталитической активности, функции, стабильности и/или экспрессии рецептора фактора роста гепатоцитов.
4. Применение по п.1 или 2, где указанный фармакологически активный агент осуществляет регуляцию по типу отрицательной обратной связи каталитической активности, функции, стабильности и/или экспрессии рецептора фактора роста гепатоцитов.
5. Применение по любому из предшествующих пунктов, где указанный фармакологически активный агент представляет собой ингибитор и/или антагонист рецептора фактора роста гепатоцитов.
6. Применение по любому из предшествующих пунктов, где указанный фармакологически активный агент выбирают из ингибиторов в виде малых молекул, аптамеров, антисмысловых нуклеотидов, ингибиторов на основе РНК, киРНК, антител, пептидов, негативных доминантных факторов.
7. Применение по любому из предшествующих пунктов, где рак представляет собой рак, характеризующийся нарушением активности рецептора фактора роста гепатоцитов.
8. Способ выявления способности исследуемого агента действовать в качестве антагониста/ингибитора рецептора фактора роста гепатоцитов, полезного при лечении рака, предпочтительно рака, характеризующегося нарушением активности рецептора фактора роста гепатоцитов, включающий стадии:
(а) приведения исследуемого агента в контакт с i) полинуклеотидом, кодирующим полипептид, состоящий из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, ii) полипептидом, состоящим из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, или iii) клетками, экспрессирующими внеклеточные домены IPT-3 и IPT-4, трансмембранную спираль и полный цитоплазматический участок рецептора фактора роста гепатоцитов;
(b) измерения активности рецептора фактора роста гепатоцитов, его функции, стабильности и/или экспрессии;
(c) отбора агента, который снижает активность, функцию, стабильность и/или экспрессию рецептора фактора роста гепатоцитов.
9. Способ по п.8, где указанное измерение на стадии (b) включает измерение сигнальной функции в клетках, выживания клеток и клеточной пролиферации.
10. Применение внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов в качестве лекарственного средства для лечения рака.
11. Применение вектора, включающего нуклеотидную последовательность, кодирующую полипептид, состоящий из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, в качестве лекарственного средства для лечения рака.
Текст
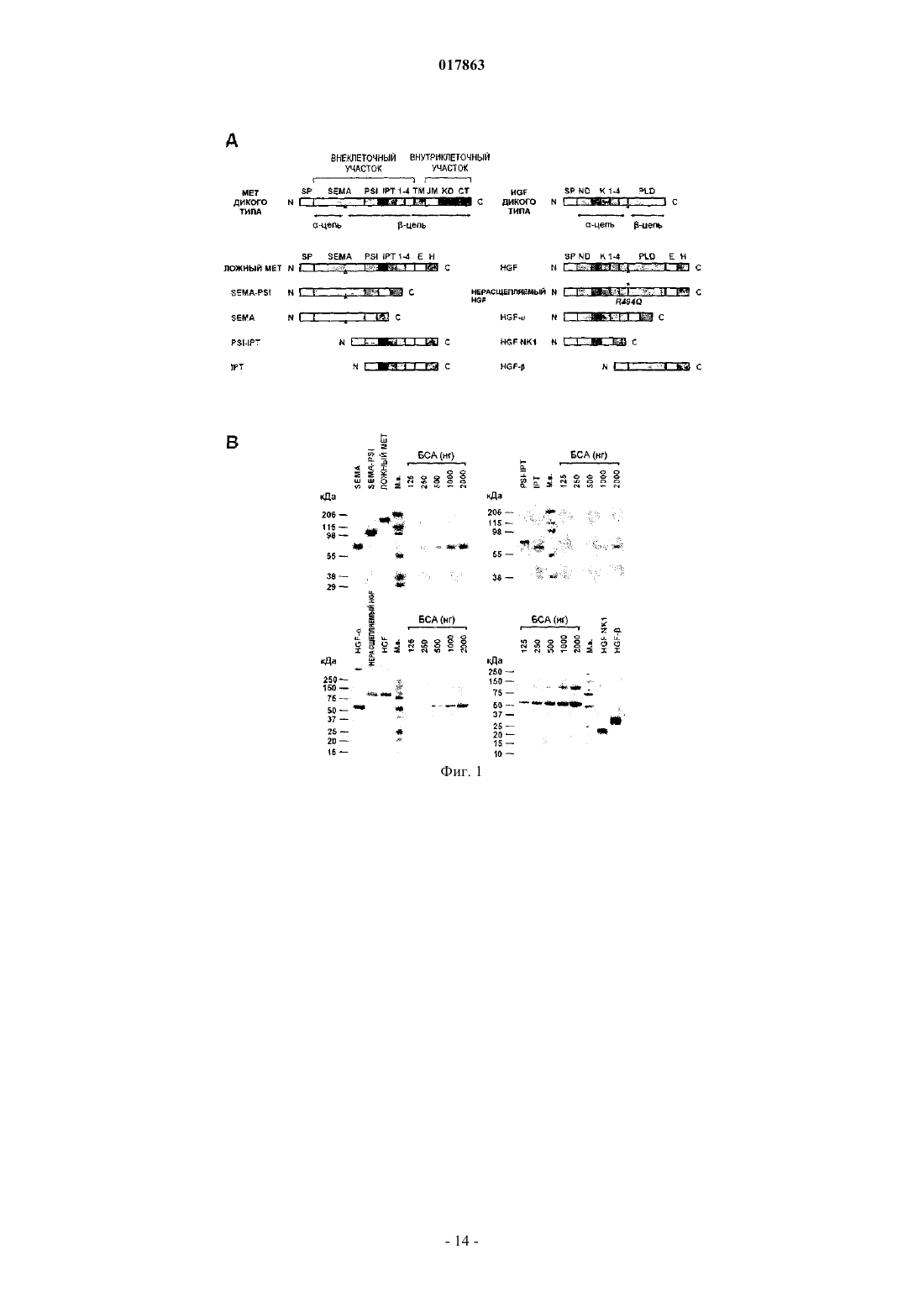
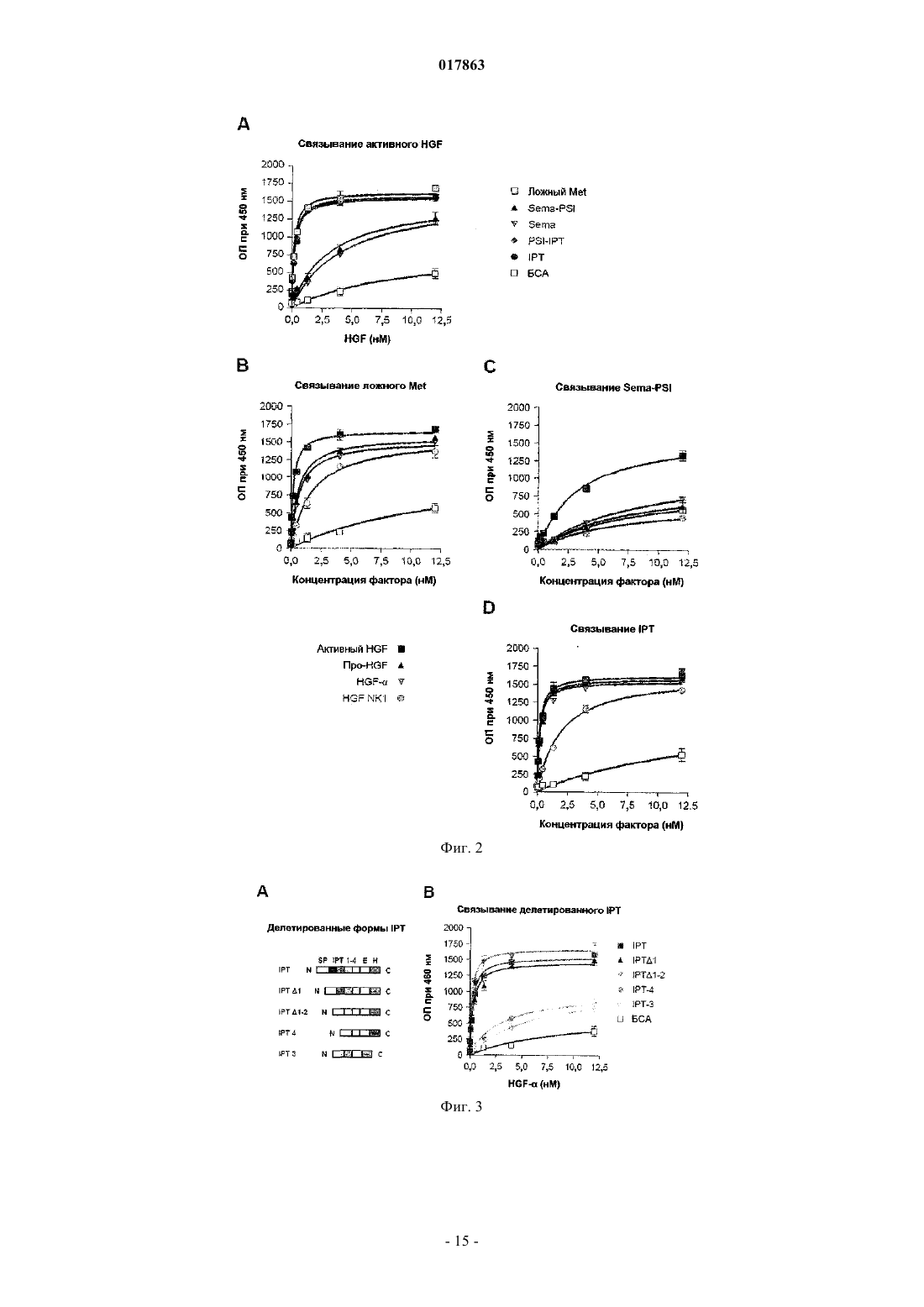
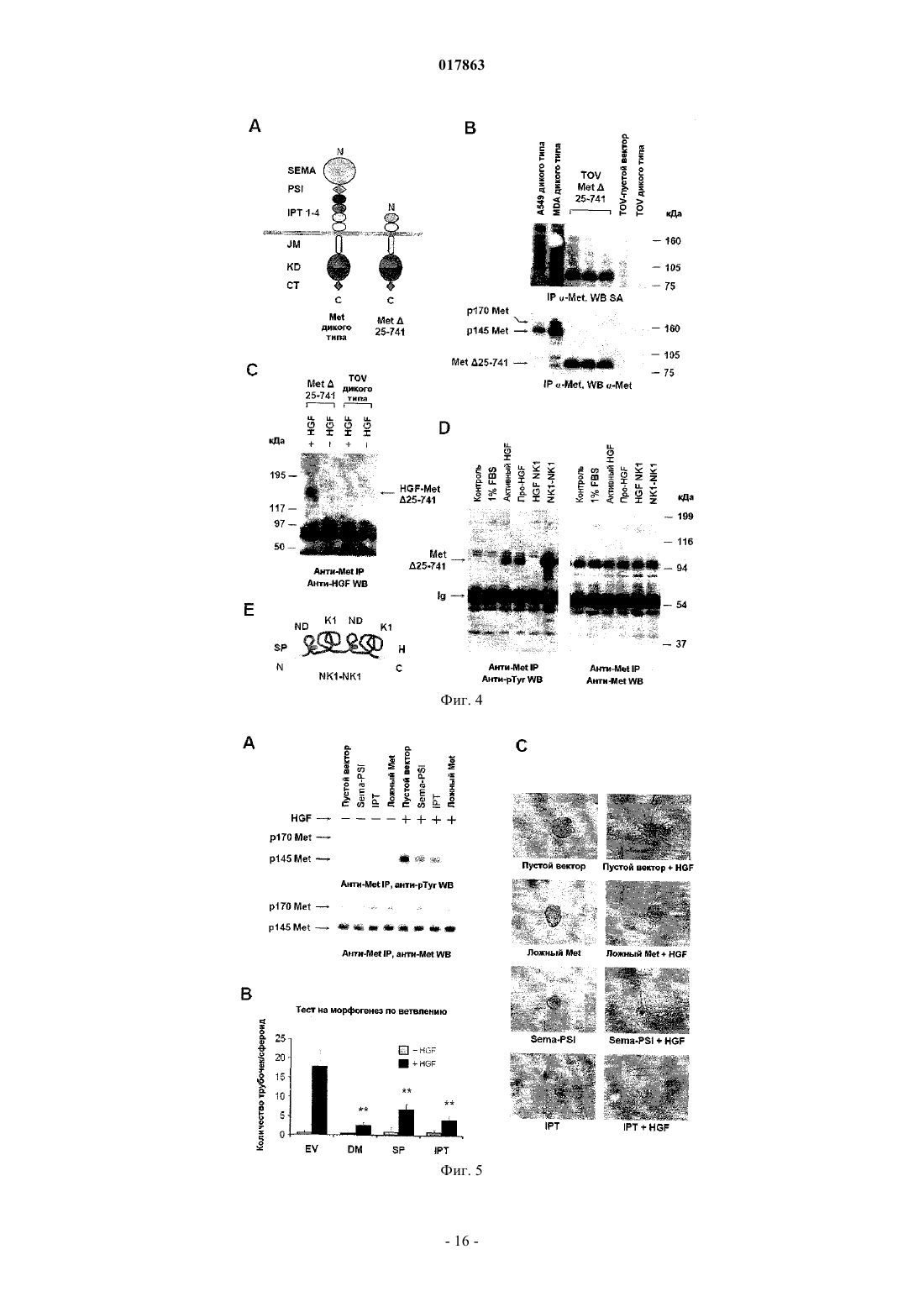
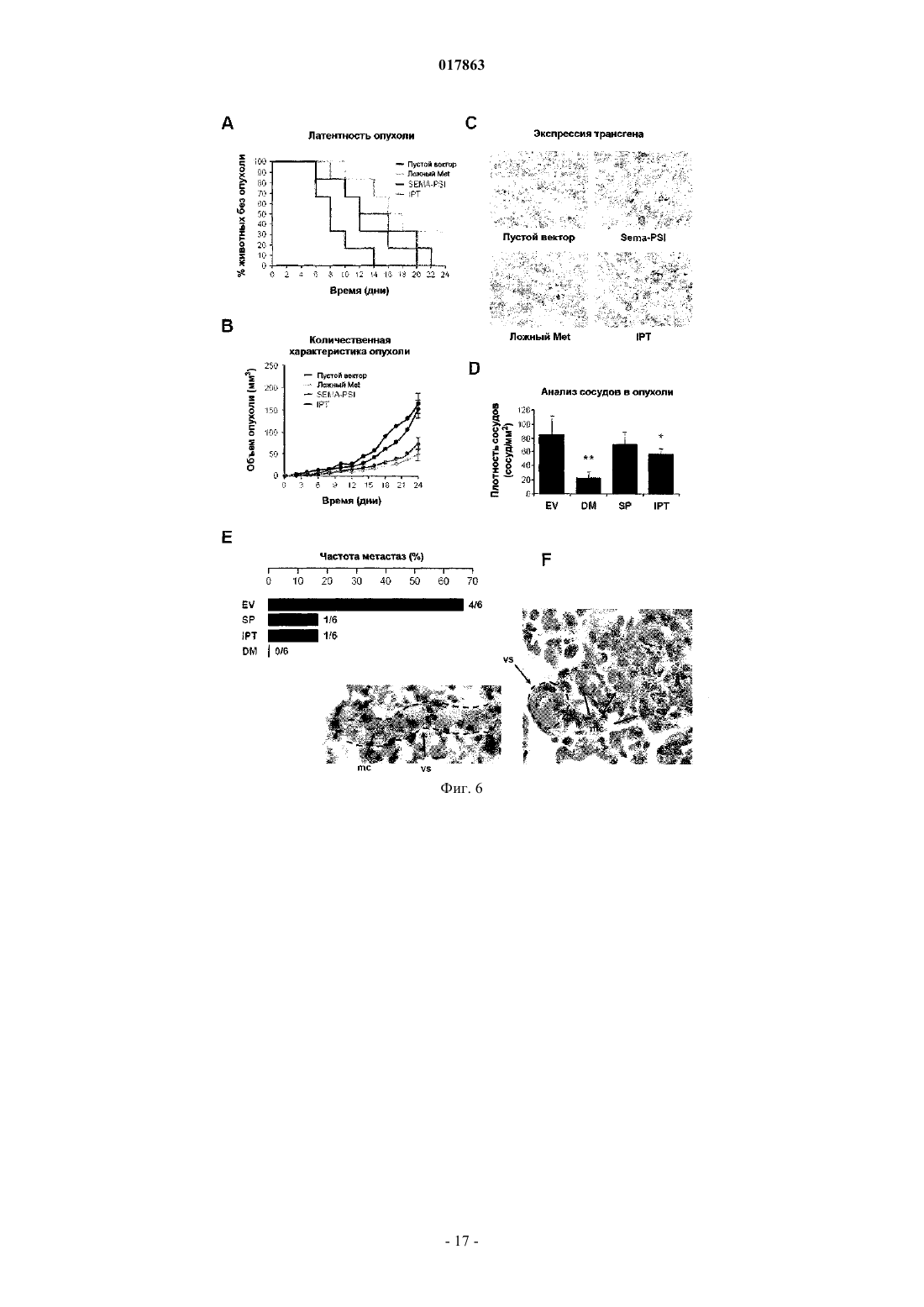
ВЫСОКОАФФИННЫЙ САЙТ СВЯЗЫВАНИЯ HGFR И СПОСОБЫ ИДЕНТИФИКАЦИИ ЕГО АНТАГОНИСТОВIPT-4 рецептора фактора роста гепатоцитов, или полипептида, включающего, по меньшей мере,внеклеточные домены IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, для скрининга и/или разработки фармакологически активных агентов, применяемых при лечении рака, предпочтительно рака, характеризующегося разбалансировкой рецептора фактора роста гепатоцитов.(71)(73) Заявитель и патентовладелец: МЕТЕРЕЗИС ТРАНСЛЕЙШНЛ РЕСЕРЧ СА (CH) Область техники, к которой относится изобретение Настоящее изобретение относится к белковому рецептору фактора роста гепатоцитов (HGFR). Более конкретно, настоящее изобретение относится к идентификации высокоаффинного сайта связыванияHGFR с его лигандом, фактором роста гепатоцитов (HGF) и к способам идентификации антагонистовHGFR, направленных на высокоаффинный сайт связывания HGFR. Предпосылки создания изобретения Рецептор фактора роста гепатоцитов (также известный как Met) представляет собой тирозинкиназу и является продуктом протоонкогена c-met. Он состоит из -субъединицы размером 50 кДа и субъединицы размером 145 кДа, которые соединены дисульфидной связью, при этом -субъединица представляет собой полностью внеклеточный домен, тогда как -субъединица включает (от N- до Сконца) внеклеточный участок, трансмембранный домен и цитоплазматический домен тирозинкиназы. Зрелый / гетеродимерный рецептор образуется при протеолитическом процессинге и терминальном гликозилировании одноцепочечного предшественника размером от 170 кДа.HGF, также известный как фактор рассеяния, представляет собой гепаринсвязывающий гликопротеин с широким спектром биологической активности, включающим клеточную пролиферацию, мобильность, выживание и морфогенез клеток. Он синтезируется и секретируется в виде неактивного одноцепочечного предшественника (про-HGF), который хранится во внеклеточном матриксе в связи с его высокой аффинностью к протеогликанам. Про-HGF подвергается протеолитическому расщеплению по остаткамR494-V495, так что при этом может быть образована биологически активная форма, соединенный дисульфидной связью / гетеродимер, где -цепь состоит из N-концевого домена, за которым следуют четыре крингл-домена, и где -цепь характеризуется структурной гомологией с сериновыми протеазами из семейства химотрипсина. Однако -цепь не обладает протеолитической активностью, поскольку два из трех важнейших участков, которые формируют каталитическую триаду, типичную для сериновых протеаз, не сохраняются в HGF. Несмотря на свою способность переносить сигнал, про-HGF связывается с Met с высокой аффинностью и замещает активный HGF. В последнее время проводимые исследования структурно-функциональной взаимосвязи пролили некоторый свет на взаимодействия между внеклеточной частью Met и HGF. Внеклеточный участок Met имеет модулярную структуру, которая охватывает три функциональных домена: домен Sema (присутствует также в семафоринах и плексинах), который включает первые 500 остатков на N-конце белка и содержит семилопастную -пропеллерную структуру, домен PSI (также обнаруженный в плексинах, семафоринах и интегринах), который включает примерно 50 остатков и содержат четыре консервативных дисульфидных связи, а также дополнительные 400 остатков, которые соединяют домен PSI с трансмембранной спиральной структурой и которые заняты четырьмя доменами IPTHGF представляет собой двухвалентный лиганд, содержащий высокоаффинный сайт связывания для Met в -цепи и низкоаффинный сайт связывания в -цепи. Взаимодействие между - и -цепью необходимо для достижения биологической активности HGF; тогда как -цепь и, более точно, N-домен и первый крингл достаточны для связывания Met, для активации необходима -цепь. Определение кристаллической структуры доменов SEMA и PSI Met в комплексе с -цепью HGF(см., например, WO-A-2005/108424) показало, что низкоаффинный сайт связывания HGF расположен на лопасти 2-3 -пропеллера и что часть HGF-, которая связывается с Met, представляет собой тот же участок, который сериновые протеазы используют для связывания со своими субстратами или ингибиторами. Важно отметить, что определение кристаллической структуры -цепи HGF с разрешением 2,53 и специфический мутагенный анализ показали, что остатки, вовлекаемые в связывание Met в кармане активации -цепи HGF, подвергаются экспонированию только после протеолитического превращения проHGF, и это объясняет, почему про-HGF связывается с Met с высокой аффинностью без его активации. Тогда как низкоаффинное взаимодействие -цепи HGF и домена Sema в Met хорошо охарактеризовано и структурно, и функционально, в настоящее время неизвестно, какой участок Met связывается с -цепьюHGF с высокой аффинностью. Таким образом, основной механизм, посредством которого HGF активирует Met, все еще остается малопонятным. Это является в некоторой степени неожиданным, учитывая высокую биологическую и терапевтическую важность этого пути. Сигнальная функция HGF-Met необходима в ходе эмбриогенеза и в процессе регенерации ткани у взрослого организма. Важно отметить, что разбалансированная сигнальная функция HGF-Met играет ключевую роль в канцерогенезе и метастазировании. Несоответствующая активация Met посредством различных механизмов, включающих аутокринную стимуляцию HGF, суперэкспрессию рецептора, генную амплификацию и точечную мутацию, описана во многих случаях злокачественных образований человека и коррелирует с плохим прогнозом. В совокупности, все данные такого рода способствовали росту интереса к исследованию функции HGF-Met, в качестве мишени при терапии рака, что привело к разработке множества ингибиторов Met/HGF. Указанные ингибиторы включают соединения на основе небольших молекул, действие которых направлено на активность Met-киназы, нейтрализацию анти-Met или анти-HGF антител, ложных рецепторов и производных от факторов HGF. Тем не менее, достигают-1 017863 ли молекулы высокоаффинного сайта связывания для HGF и каков точный молекулярный механизм, лежащий в основе высокоаффинного связывания HGF с Met, все еще неизвестно. Это незнание может мешать выделению более селективных терапевтических агентов с повышенной чувствительностью и с меньшими побочными эффектами. Точное знание высокоаффинного сайта связывания Met для HGF, несомненно, может способствовать разработке высокоспецифичных антагонистов Met. Краткое описание сущности изобретения Соответственно, имеется потребность в усовершенствованных подходах к идентификации антагонистов Met с повышенной чувствительностью и меньшими побочными эффектами с целью разработки более эффективных терапевтических стратегий лечения рака. Целью настоящего изобретения является разработка такого усовершенствованного подхода. Согласно настоящему изобретению такие цели достигаются благодаря подходу, характеристики которого описаны в прилагаемой формуле изобретения. Указанная формула изобретения составляет интегральную часть технического описания, приведенного по материалам настоящего изобретения. Таким образом, объектом настоящего изобретения является идентификация высокоаффинного сайта связывания HGF с рецептором фактора роста гепатоцита (HGFR), т.е. внеклеточными доменами IPT-3 и IPT-4 HGFR. Другим объектом настоящего изобретения является разработка средств идентификации антагонистов HGFR, направленных на высокоаффинный сайт связывания HGFR с HGF, с целью разработки новых терапевтических стратегий лечения рака. Согласно одному варианту настоящее изобретение относится к использованию полипептида, включающего, или полинуклеотида, кодирующего по меньшей мере один из внеклеточных доменов IPT-3 иIPT-4 фактора роста гепатоцитов, для скрининга и/или разработки фармацевтически активных агентов,применимых при лечении рака, в частности рака, для которого характерно нерегулируемая активность рецептора фактора роста гепатоцитов. В одном варианте осуществления настоящего изобретения указанный фармацевтически активный агент представляет собой ингибитор и/или антагонист рецептора фактора роста гепатоцитов, и он может быть выбран из числа ингибиторов на основе малых молекул, аптамеров, антисмысловых нуклеотидов,РНК-ингибиторов, киРНК, антител, пептидов, доминантных отрицательных факторов. В еще одном варианте настоящее изобретение относится к способу выявления способности исследуемого агента действовать в качестве антагониста/ингибитора рецептора фактора роста гепатоцитов,который может использоваться при лечении рака, предпочтительно рака, для которого характерно нерегулируемая активность рецептора фактора роста гепатоцитов, где указанный способ включает стадии:(a) приведения в контакт исследуемого агента по меньшей мере с одним из внеклеточных доменовIPT-3 и IPT-4 рецептора фактора роста гепатоцитов или с клетками, экспрессирующими по меньшей мере один из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов;(b) определения активности рецептора фактора роста гепатоцитов, его функции, стабильности и/или экспрессии;(c) отбора агента, который снижает активность рецептора фактора роста гепатоцитов, его функцию,стабильность и/или экспрессию. В еще одном варианте осуществления настоящее изобретение относится к использованию внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов в качестве лекарственного средства для лечения рака. Подробное описание изобретение Ниже настоящее изобретение описывается подробно применительно к некоторым предпочтительным вариантам с помощью неограничивающих примеров и со ссылкой на прилагаемые фигуры. На фиг. 1 проиллюстрированы процессы конструирования и очистки субдоменов Met и HGF.(А) В схематическом виде приведены сконструированные белки, использованные в данном исследовании. На левой панели: сконструированные рецепторы. W.T. МЕТ означает Met дикого типа; EXTRA означает внеклеточную часть; INTRA означает внутриклеточную часть, SP означает сигнальный пептид;SEMA означает домен, гомологичный семафорину; PSI означает домен, гомологичный плексинсемафорин-интегрину; IPT 1-4 означает домен 1-4, гомологичный фактору транскрипции иммуноглобулина-плексина; ТМ означает трансмембранный домен; JM означает смежный мембранный домен; KD означает киназный домен; СТ означает С-концевой фрагмент; Е означает эпитоп FLAG или MYC; Н означает полигистидиновый фрагмент. Красный треугольник означает сайт протеолитического расщепления между - и -цепью. Правая панель: сконструированные лиганды. W.T. HGF означает HGF дикого типа; ND означает N-домен; К 1-4 означает крингл 1-4; PLD означает протеазоподобный домен;UNCL. HGF означает нерасщепляемый HGF. Стрелка указывает замещение по аминокислотам R494Q в протеолитическом сайте. (В) Окрашивание кумасси-красителем очищенных аффинной хроматографией рецепторов и лигандов. Каждая белковая группа (Sema, Sema-PSI, ложный Met; PSI-IPT, IPT; HGF-,нерасщепляемый HGF, HGF; HGF NK1, HGF-) была отделена путем электрофореза в SDS-PAGE в невосстановительных условиях и количественно определена по стандартной кривой, построенной на основе бычьего сывороточного альбумина (БСА). М.в. означает маркер молекулярного веса; кДа - обозначе-2 017863 ние килодальтон. На фиг. 2 показаны результаты анализа продуктов взаимодействия HGF-Met по процедуре ELISA.(А) Связывание субдоменов Met с активным HGF. Генетически сконструированные рецепторы иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями активного HGF в жидкой фазе. Наличие связывания выявляют с использованием анти-HGF антител. Неспецифическое связывание определяют при использовании БСА вместо очищенных рецепторов в твердой фазе. (В, С, D) Связывание ложного Met, Sema-PSI и IPT с разными формами HGF. Генетически сконструированные рецепторы иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями активного HGF с MYCфрагментом, про-HGF, HGF- или HGF NK1 в жидкой фазе. Наличие связывания выявляют с использованием анти-MYC антител. Неспецифическое связывание определяют при использовании ангиостатина(AS) с MYC-фрагментом в жидкой фазе. На фиг. 3 показано, что домены IPT 3 и 4 являются достаточными для высокоаффинного связывания с HGF-. (А) Дано схематическое описание вариантов IPT с делециями. Маркировка по цвету и условия соответствуют описанию, приведенному на фиг. 1 А. (В) Анализ взаимодействия между вариантами IPT и HGF- по процедуре ELISA. Генетически сконструированные IPT иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями HGF- в жидкой фазе. Наличие связывания выявляют с использованием анти-HGF антител. На фиг. 4 показано, что домены IPT 3 и 4 являются достаточными для связывания с HGF в живых клетках. (А) Дано схематическое описание делетированного рецептора Met25-741 (Met25-741). Маркировка по цвету и условия соответствуют описанию, приведенному на фиг. 1 А. (В) Анализ характера поверхностного биотинилирования. Клеточные белки подвергают иммунопреципитации (IP) с использованием антител против С-концевой части Met и анализируют путем вестерн-блоттинга (WB) с использованием пероксидазы хрена, конъюгированной со стрептавидином (SA). Те же самые блоты подвергают повторному зондированию с использованием анти-Met антител. W.T. означает дикий тип; А 549 означает клетки карциномы легкого человека А 549; MDA означает клетки меланомы человека MDA-VD-435;TOV означает клетки карциномы яичника человека TOV-112D; Empty V. означает пустой вектор. Полоса р 170 соответствует непроцессированному Met; p145 представляет собой зрелую форму рецептора. (С) Анализ химической перекрестной сшивки. Клетки TOV-112D, экспрессирующие Met25-741, и клеткиTOV-112D дикого типа (W.T. TOV) ингибируют с HGF и затем подвергают химической сшивке. Клеточные лизаты подвергают иммунопреципитации с использованием анти-Met антител и анализируют по методу вестерн-блоттинга с использованием анти-HGF антител. Стрелка указывает на комплексы HGFMet25-741. (D) Анализ фосфорилирования Met. Клетки TOV-112D, экспрессирующие Met25-741, стимулируют с использованием 1% FBS, в качестве отрицательного контроля, и равных количеств HGF, проHGF, HGF NK1 или NK1-NK1. Уровень фосфорилирования рецептора определяют путем иммунопреципитации с использованием анти-Met антител и процедуры вестерн-блоттинга с анти-фосфотирозиновыми антителами (anti-pTyr). Те же самые блоты подвергают повторному зондированию с использованием анти-Met антител. Стрелки указывают на полосы, соответствующие Met25-741 или иммуноглобулинам (Ig).(E) Схематическое изображение NK1-NK1. В направлении от N- к С-концу: SP означает сигнальный пептид; ND означает домен N; K1 означает крингл 1; Н означает полигистидиновый фрагмент. На фиг. 5 показано, что растворимый IPT ингибирует HGF-индуцированный инвазивный рост in vitro. (А) Клетки MDA-MB-435, трансдуцированные лентивирусным вектором, стимулируют рекомбинантным HGF, и определяют фосфорилирование Met путем иммуноблоттинга с использованием антифосфотирозиновых антител (верхняя панель). Тот же самый блот подвергают повторному зондированию с использованием анти-Met антител (нижняя панель). Empty V. означает пустой вектор. (В) Тест на морфогенез в направлении ветвления. Предварительно сформированные сфероиды клеток MDA-MB-435,трансдуцированные лентивирусным вектором, погружают в коллаген и затем стимулируют рекомбинантным HGF с образованием разветвленных трубочек. Инвазию коллагена определяют количественно путем подсчета среднего числа трубочек, прорастающих из каждого сфероида. EV означает пустой вектор; DM означает ложный Met; SP означает Sema-PSI. (С) Репрезентативные снимки, полученные в рамках эксперимента, согласно пункту В. Увеличение: 200 раз. На фиг. 6 показано, что растворимый IPT проявляет противоопухолевую и антиметастатическую активность у мышей. Мышам линии CD-1 nu-/- инъецируют подкожно клетки MDA-MB-435, трансдуцированные лентивирусным вектором, и отслеживают рост опухоли с течением времени. (А) График типа графика Каплан-Мейер по оценке латентного периода роста опухоли (на оси X показано время в днях, на оси Y показан процент животных, не содержащих опухоли). Empty V. означает пустой вектор. (В) Средний объем опухоли с течением времени. (С) Иммуногистохимический анализ срезов опухолевой ткани с использованием анти-FLAG антител. Увеличение: 400 раз. (D) Исследование опухоли сосудов. Срезы опухолевой ткани окрашивают антителами против фактора Фон Виллебранда. Количество сосудов на квадратный мм среза опухоли определяют путем микроскопирования. EV означает пустой вектор; DM означает ложный Met; SP означает Sema-PSI. (E) Анализ частоты метастазирования. После аутопсии проводят серийный анализ срезов ткани из легкого, путем микроскопирования, с целью выявления нали-3 017863 чия микрометастаз. Частота метастаз, т.е. количество мышей с метастазами, относительно их суммарного количества, указывается в виде процентного значения (на диаграмме) и размера фракции (в конце соответствующего столбика на диаграмме). (F) Репрезентативные снимки микрометастаз, полученные в группе с пустым вектором. Срезы ткани легкого окрашивают гематоксилином и эозином. Пунктирной линией обозначены стенки кровеносных сосудов (vs). Метастазные клетки (mc) обнаруживаются внутри сосудов в виде эмбол или в паренхиме. Увеличение: 400 раз. Данные, представленные в настоящем описании, дают основания полагать, что -цепь HGF связывается с участком IPT Met с высокой аффинностью и что это происходит независимо от процессинга лиганда. Указанные данные также позволяют полагать, что связывание HGF с IPT в том случае, когда трансмембранный Met не содержит домен Sema, является достаточным для переноса сигнала, необходимого для активации рецептора, в цитоплазматический киназный домен, даже без разграничения между неактивной и активной формами лиганда. Таким образом, в совокупности, представленные данные подтверждают тот факт, что генетически сконструированные белки, полученные на основе участка IPT и домена Sema Met, способны нейтрализовать проинвазивную активность HGF как in vitro, так и in vivo. Уже достаточно давно известно, что HGF представляет собой бивалентный фактор. Предшествующие исследования в области конструирования белков идентифицировали высокоаффинный Metсвязывающий сайт, включающий домен N и первый крингл HGF. Впоследствии в рамках биохимического и биологического анализа удалось продемонстрировать, что протеазоподобный сериновый домен HGF(-цепь), будучи необязательным для связывания, выполняет ключевую роль в процессе активации рецептора. В последнее время были получены детальные кристаллографические данные и результаты исследования мутагенеза, которые дали хорошую базу для структурной и функциональной характеристики низкоаффинного Met-связывающего сайта на -цепи HGF и его способности взаимодействовать с доменом Sema Met. Интерфейс между -цепью HGF и Met оставался, тем не менее, неисследованным. Результаты анализа малоуглового рассеяния рентгеновских лучей, а также данные криоэлектронной микроскопии позволили предположить наличие контактов между N-концевым и первым доменом крингл HGF и доменом Sema Met. Однако результаты анализа по методу плазмонного резонанса показали, что это взаимодействие характеризуется очень низкой аффинностью (примерно в 2 раза ниже, чем соответствующая аффинность HGF- для Sema, и в 100 раз ниже, чем соответствующая аффинность HGF- для интактного рецептора). Поскольку такое слабое взаимодействие не может отвечать за наблюдаемую жесткую связь между HGF и Met, следует признать, что высокоаффинный HGF-связывающий сайт на Met до сих пор не исследован и его предстоит идентифицировать. Представленные в настоящем описании результаты вносят определенный вклад в заполнение этого пробела и дают основание полагать, что рассматриваемый HGF-связывающий сайт находится в участкеIPT Met и, точнее, в двух последних иммуноглобулинных доменах, вблизи клеточной мембраны. Несколько представленных в настоящем описании экспериментальных доказательств указывают, что это действительно может иметь место. Во-первых, растворимый делетированный рецептор Met, не содержащий ничего, кроме четырех доменов IPT (IPT), связывается с HGF практически с той же аффинностью,что и полная внеклеточная часть Met. И наоборот, Sema демонстрирует очень низкую активность в отношении HGF. Во-вторых, IPT связывается с активным HGF, про-HGF или HGF-, с неизмененной прочностью. В-третьих, делеция IPT 1 и IPT 2 не влияет на аффинность IPT для любой из форм HGF. Вчетвертых, сконструированный рецептор Met, содержащий крупную делецию в эктодомене, соответствующем домену Sema, модуль PSI и два первых иммуноглобулиноподобных домена (Met25-741), сохраняет способность связываться с HGF и переносить соответствующий сигнал для активации киназы внутрь клетки, хотя при этом не происходит разграничения между активным HGF и про-HGF. И, наконец, димерная форма HGF NK1, которая, как известно, содержит минимальный Met-связывающий домен HGF, способна вызывать активацию Met25-741 столь же эффективно, если не более выражено, чем HGF,идентифицируя таким образом в IPT 3-4 HGF NK1-связывающий сайт. В то время как представленные данные указывают на ключевую роль IPT в связывании HGF, следует отметить, что в двух предшествующих структурно-функциональных исследованиях внеклеточной части Met не удалось идентифицировать какого-либо сайта связывания лиганда в данном участке. Результаты первого предварительного исследования по картированию эктодомена Met дали основание полагать, на основе данных ELISA, что Sema является необходимым и достаточным для связывания HGF. В рамках второго исследования была проанализирована роль домена Sema в димеризации рецептора, и полагают, что сконструированная форма внеклеточной части Met, содержащая делецию в домене Sema, не способна к сопреципитации с HGF. В настоящем изобретении также показано, что взаимодействие между Sema и IPT наблюдается и в том случае, когда внеклеточную часть Met используют в качестве биотехнологического инструмента для ингибирования HGF-индуцированного инвазивного роста. По данным анализа in vitro, а также с использованием мышиных ксенотрансплантатов растворимые белки и IPT, и Sema-PSI демонстрировали значительный ингибирующий эффект. Однако ни один из них не демонстрировал мощного ингибирования,которое проявил полноразмерный эктодомен Met, который содержит и низкоаффинный, и высокоаф-4 017863 финный HGF-связывающий сайт. Это означает, что оба рассматриваемых вида взаимодействия вносят определенный вклад в контроль активности Met. Несмотря на то что контакт HGFSema уже был идентифицирован в качестве мишени для проведения терапии, представленные результаты описывают второй интерфейс, который дает возможности для фармакологической интервенции. Рекомбинантные белки или антитела, которые связываются с IPT участком вместо истинного HGF, могут использоваться в качестве высококонкурентных ингибиторов Met при проведении лечения HGF/Met-зависимых видов рака. Материалы и методы Конструирование белков. Растворимые или трансмембранные рецепторы и сконструированные лиганды, описанные в настоящей работе, были получены по стандартам процедурам ПЦР и генетической инженерии. Все факторы сохраняют консервативную последовательность своих исходных белков на N-конце. Аминокислотные (ак) последовательности растворимых белков Met (Gene Bank N. Х 54559) соответствуют 1-24 (сигнальный пептид) плюс: ложный Met, ак 25-932; Sema, ак 25-515; Sema-PSI, ак 25-562; PSIIPT, ак 516-932;IPT, ак 563-932; 1 РТД 1, ак 657-932; IPT1-2, ак 742-932; IPT-3, ак 742-838; IPT-4, ак 839-932. На С-конце каждой молекулы добавляется двойной FLAG (SDYKDDDDK - SEQ ID NO:19) или один MYC (EQKLISEEDLN - SEQ ID NO:20) эпитопная последовательность и полигистидиновый фрагмент (ННННННН SEQ ID NO:21) для детекции белка и его очистки. Трансмембранный сконструированный Met25-741 идентичен Met дикого типа, за исключением делетированного участка (ак 25-741). Аминокислотные последовательности сконструированных белков HGF (Gene Bank N. М 73239) соответствуют ак 1-31 (сигнальный пептид) плюс: HGF, ак 32-728; HGF-, ак 32-473; HGF NK1, ак 32-205; HGF-, ак 495-728. Указанные выше эпитопы MYC или FLAG и полигистидиновый фрагмент добавляют на С-конце. НерасщепляемыйHGF был описан ранее (Mazzone, M. et al. (2004), J. Clin Invest. 114(10), 1418-5 1432). NK1-NK1 представляет собой димерную форму HGF NK1, состоящую из того же N-концевого участка HGF, с тандемным повтором (ак 1-205, непосредственно соединенные с ак 32-205, без спейсера). кДНК, кодирующие все сконструированные белки,субклонируют в лентивирусном трансфер-вектореpRRLsin.PPT.CMV.eGFP.Wpre (SEQ ID NO:1) вместо gfp кДНК, как было описано ранее (Follenzi, A. etN0:16), NK1-NK1 his (SEQ ID NO:17), MYC his ангиостатина (SEQ ID NO:18). Иммуноферментный твердофазный анализ. Все сконструированные рецепторы и факторы собирают из кондиционированной бессывороточной среды, в которой выращивались клетки меланомы человека MDA-MB-345, трансдуцированные лентивирусным вектором. Очистку фактора проводят в рамках процедуры аффинной хроматографии с иммобилизованным металлом, как было описано ранее (в работе Michieli P. et al. (2002), Nat Biotechnol. 20(5),488-495). Конверсию про-HGF в активный HGF осуществляют в ходе инкубации очищенного про-HGF(максимальная концентрация 100 нг/мкл) с наличием 2-10% FBS (Sigma, St. Louis, Missouri) при температуре 37 С в течение 24 ч. Указанную конверсию фактора анализируют по методу вестерн-блоттинга с использованием анти-HGF антител (RD Systems, Minneapolis, Minnesota). Нерасщепляемый HGF подвергают тем же процедурам инкубации с FBS, как и в случае про-HGF, и далее используют во всех тестах, которые позволяют проводить сравнение активного HGF с непроцессированным HGF. Связывание сконструированных лигандов с растворимыми рецепторами определяют по методу ELISA с использованием растворимых рецепторов с фрагментом FLAG в твердой фазе, а также сконструированных лигандов с фрагментом MYC в жидкой фазе. Фиксированную концентрацию очищенного растворимого рецептора (100 нг/лунку) вносят для адсорбции в 96-луночные планшеты дляELISA. Планшеты с наслоенным белком инкубируют с возрастающими концентрациями сконструированных лигандов, и достигаемое при этом связывание выявляют с использованием биотинилированных анти-HGF антител (RD Systems, Minneapolis, Minnesota) или анти-MYC антител (Santa Cruz Biotechnology, Santa Cruz, California). Полученные данные по связыванию анализируют и оценивают с использованием программного обеспечения Prism (Graph Pad Software, San Diego, California). Клеточная культура. Клетки меланомы человека MDA-MB-435 получают из Georgetown University Tissue Culture Shared(Sigma). Клетки карциномы яичника человека TOV-112D получают из АТСС (Rockville, Maryland; АТССN. CRL-11731) и культивируют с использованием смеси 1:1 среды MCDB 105 и среды 199 с добавкой 15% FBS (все компоненты от компании Sigma). Клетки карциномы легкого человека А 549 также получают из АТСС (АТСС N. CCL-185) и поддерживают в среде RPMI с добавкой 10% FBS.-5 017863 Лентивирусные векторы. Основную массу вектора получают путем временной трансфекции 293 Т клеток по описанной ранее методике (Follenzi, A. et al. (2000), Nat Genet. 25 (2), 217-222). В общих чертах, методика состоит в том,что получают смесь плазмидных ДНК для трансфекции при объединении: плазмиды ENV (VSV-G),9 мкг; УПАКОВОЧНОЙ плазмиды pMDLg/pRRE, 16,2 мкг; плазмиды REV, 6,25 мкг; ТРАНСФЕРВЕКТОРА (плазмида 2-18), 37,5 мкг. Указанные плазмиды разбавляют раствором ТЕ/CaCl2, к которому добавляют раствор HBS, при перемешивании в вихревом смесителе с максимальной скоростью. Полученную смесь ДНК/CaCl2/HBS сразу добавляют по каплям к планшету для клеток, который инкубируют при температуре 37 С. Через 14-16 ч культуральную среду заменяют свежей средой. Супернатанты клеточной культуры, содержащие векторные частицы, собирают через 36 ч после замены среды. После сбора супернатанты фильтруют через мембраны с размером пор 0,2 мкм и хранят при температуре -80 С. Концентрацию вирусного антигена р 24 определяют с использованием набора для выявления основного профиля ВИЧ-1 р 24 в рамках ELISA (NEN Life Science Products, Boston, Massachusetts), в соответствии с инструкциями производителя. Далее клетки трансдуцируют в 6-луночных планшетах(Sigma) по описанной ранее методике (Vigna, E. и Naldini, L. (2000), J. Gene Med. 2(5), 308-316). Среду заменяют через 18 ч после трансдукции. С течением времени отслеживают рост клеток и оценивают продукцию белка. Далее, трансдуцированные клеточные линии высевают в чашки Петри диаметром 15 см,растят до 80% слияния и инкубируют в бессывороточной среде. Через 72 ч супернатанты, содержащие рекомбинантные растворимые белки, собирают, фильтруют и очищают аффинной хроматографией или хранят при температуре -30 С. Иммунопреципитация и вестерн-блот анализ. Клеточный лизис, иммунопреципитацию и вестерн-блоттинг проводят с использованием экстрагирующего буфера (ЕВ) по описанной ранее методике (Longati, P. et al. (1994), Oncogene 9(1), 49-57). Сигнал выявляют с использованием системы ECL (Amersham Biosciences, Piscataway, New Jersey) в соответствии с инструкциями производителя. Анти-Met антитела, описанные Ruco, L.P. et al. (1996), J. Pathol. 180(3), 266-270, получают от UBI (Lake Placid, New York). Анти-Met антитела для вестерн-блоттинга получают от компании Santa Cruz. Анти-FLAG антитела получают от компании Sigma. Анализ фосфорилирования Met в клетках MDA-MB-435, трансдуцированных лентивирусным вектором, проводят по описанной ранее методике (Michieli, P. et al. (2004), Cancer Cell 6(1), 61-73). Анализ сшивки HGF и активации Met. Клетки TOV-112D, трансдуцированные лентивирусным вектором, которые экспрессируютMet25-741, подвергают анализу для оценки поверхностного биотинилирования с использованием модульного набора для определения поверхностного биотинилирования ECL (Amersham Biosciences) в соответствии с инструкциями производителя. Химическую сшивку проводят по описанной ранее методике(Mazzone, M. et al. (2004), J. Clin Invest. 114(10), 1418-1432). В общих чертах процедура состоит в том,что клетки подвергают депривации в отношении сывороточных факторов роста в течение 3 дней и затем инкубируют с 1 нМ HGF в течение 3 ч. Клеточные лизаты подвергают иммунопреципитации с использованием антител против С-концевой части Met по описанной ранее методике (Ruco, L.P. et al. (1996), J.Pathol. 180(3), 266-270), разрешают электрофорезом в SDS-PAGE с использованием 3-10% градиента полиакриламида и анализируют по процедуре вестерн-блоттинга с использованием анти-HGF антител(RD). Для проведения анализа активации рецепторов клетки TOV-112D, экспрессирующие Met25-741,подвергают депривации в отношении сывороточных факторов роста в течение 3 дней и затем стимулируют с использованием 1 нМ HGF, нерасщепляемого HGF, HGF NK1 или NK1-NK1 в течение 10 мин. Далее клетки лизируют с использованием буфера ЕВ по описанной ранее методике (Longati, P. et al.(1994), Oncogene 9(1), 49-57). Клеточные белки подвергают иммунопреципитации с использованием анти-Met антител по описанной ранее методике и анализируют по процедуре вестерн-блоттинга с использованием анти-фосфотирозиновых антител (UBI). Те же самые блоты подвергают повторному зондированию анти-Met антителами (Ruco, L.P. et al. (1996), J. Pathol. 180(3), 266-270). Биологические тесты. Тесты на инвазию коллагена с использованием клеток MDA-MB-435 проводят с использованием предварительно сформированных сфероидов по описанной ранее методике (Michieli, P. et al. (2004), Cancer Cell 6(1), 61-73). В общих чертах процедура состоит в том, что сфероиды получают при инкубации клеток в течение ночи (700 клеток/лунку) в неадгезирующих условиях в 96-луночных планшетах(Greiner, Frickenhausen, Germany) в присутствии 0,24 г/мл метилцеллюлозы (Sigma). Сфероиды погружают в коллагеновую матрицу, содержащую 1,3 мг/мл коллагена типа I из хвостовой части крыс (BD Biosciences, Bedford, Massachusetts) и 10% FBS, с использованием 96-луночных планшетов (40 сфероидов/лунку). Погруженные в коллаген сфероиды культивируют при температуре 37 С в течение 24 ч и затем стимулируют с использованием 30 нг/мл HGF (RD) или без фактора культивируют в течение дополнительных 24 ч. Подсчитывают под микроскопом количество трубочек, прорастающих из каждого сфероида. Анализируют по меньшей мере 12 сфероидов на каждую экспериментальную точку.-6 017863 Тесты на канцерогенез. Опухолевые клетки MDA-MB-435, трансдуцированные лентивирусным вектором (3106 клеток/мышь), в 0,2 мл DMEM инъецируют подкожно в правый задний бок шестинедельных иммунодефицитных nu-/- самок мышей линии Swiss CD-1 (Charles River Laboratories, Calco, Italy). Размер опухоли оценивают каждые 2 дня с помощью циркуля. Объем опухоли вычисляют по формуле V=4/3 пх 2y/2, где х означает ось, на которой указывается размер малой опухоли; у означает ось, на которой указывается размер крупной опухоли. Массу опухоли в 15 мм 3, примерно соответствующую исходному объему, занимаемому инъецированными клетками, выбирают в качестве порогового значения для оценки положительных результатов по наличию опухоли. Тех мышей, у которых опухоли ниже этого порогового значения, рассматривают как несодержащих опухоль. Примерно через 4 недели мышей умерщвляют и отбирают опухоли для анализа. Далее животных подвергают аутопсии. Опухоли и легкие погружают в парафин и обрабатывают для целей гистологического анализа. Анализ микрометастазирования проводят под микроскопом на серийных срезах ткани легкого, окрашенных гематоксилином и эозином. Срезы опухолевых тканей окрашивают гематоксилином и эозином и отправляют для анализа независимому патологу,не информированному о природе того или иного образца. Экспрессию трансгена определяют на срезах опухолевой ткани путем иммуногистохимического анализа с использованием анти-FLAG антител(Sigma). Срезы подвергают контрастному окрашиванию гематоксилином Мейера (Sigma). Ангиогенез опухоли оценивают в рамках иммуногистохимического анализа с использованием антител против фактора Фон Виллебранда (DAKO, Glostrup, Denmark). Срезы тканей подвергают контрастному окрашиванию по указанной выше методике. Плотность сосудов оценивают под микроскопом. При этом анализируют по меньшей мере 12 полей в расчете на одно животное. Все процедуры, выполняемые на животных,одобрены Этической Комиссией Университета Турина, Италия, и Министерством Здравоохранения Италии. Статистический анализ. Статистическую значимость полученных результатов оценивают с использованием двустороннего гомоскедастичного критерия Стьюдента (совокупность данных 1 - контрольная группа; совокупность данных 2 - экспериментальная группа). Для всех проанализированных данных принимают в качестве порогового значения значимости показатель р 0,05. На всех чертежах приведенные значения выражены в виде среднего значениястандартное отклонение, а статистическая значимость указывается одной(р 0,05) или двойной (р 0,01) стрелкой. Результаты Конструирование функциональных доменов HGF/Met. Схематическое изображение функциональных доменов, содержащихся в Met и HGF, показано на фиг. 1 А. Внеклеточная часть Met включает домен Sema, шарнирную область PSI и четыре модуля IPT(левая панель). HGF состоит из - и -цепей, соединенных дисульфидным мостиком в зрелом белке. В свою очередь, -цепь состоит из N-концевого домена и четырех кринглов (правая панель). Для анализа характера взаимодействия между Met и HGF авторы выражают все данные, описывающие указанные функциональные домены, применительно к индивидуальным растворимым белкам. Функциональные домены конструируют таким образом, чтобы они содержали на своем N-конце сигнальный пептид исходного белка, чтобы они могли быть секретированы. Добавляют на С-конце экзогенный эпитоп (FLAG или MYC) для распознавания антитела и полигистидиновый фрагмент для очистки белка. Все кДНК,кодирующие сконструированные факторы, подвергают клонированию в лентивирусном вектореpRRLsin.PPT.CMV.Wpre, a частицы рекомбинантного лентивируса получают по методике, описанной в разделе "Материалы и методы". Рекомбинантные белки собирают из кондиционированной среды клеток меланомы человека MDA-MB-435, трансдуцированных лентивирусным вектором, и очищают до гомогенности аффинной хроматографией. Очищенные белки оценивают количественно в рамках SDS-PAGE с использованием стандартов (фиг. 1 В). Анализ взаимодействий Met-HGF с использованием процедуры ELISA. Способность эктодоменов Met взаимодействовать с HGF исследовали в тестах на связывание по методу ELISA. Растворимые рецепторы (ложный Met, Sema-PSI, Sema, PSI-IPT, IPT) иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями активного HGF. Наличие связывания выявляют с использованием биотинилированных анти-HGF антител. Неспецифическое связывание HGF определяют с использованием, вместо доменов растворимого Met, бычьего сывороточного альбумина(БСА) в твердой фазе. Связывающую аффинность определяют в рамках нелинейного регрессионного анализа, в соответствии с описанием, приведенным в разделе "Материалы и методы". В используемых условиях ложный Met связывается с HGF со значением KD примерно 0,2-0,3 нМ. Как и в предыдущих экспериментах, Sema-PSI и Sema связываются с HGF с аффинностью, которая по меньшей мере на один логарифм ниже, в сравнении с таковой для ложного Met. Неожиданно было обнаружено, что и PSI-IPT, иIPT связываются с HGF очень эффективно, почти с той же эффективностью, что и ложный Met (фиг. 2 А). Присутствие или отсутствие домена PSI не влияет на связывающую аффинность с HGF ни Sema, ни IPT. Поскольку практически все домены Sema, которые обнаружены в природных условиях, содержат модульPSI на С-конце, авторы далее проводили анализ связывания с использованием ложного Met, Sema-PSI иIPT. Для определения аффинности каждого из модулей Met относительно про-HGF, HGF-, HGF NK1 иHGF- и для сравнения ее с аффинностью, свойственной активному HGF, сконструированные рецепторы иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями лигандов, содержащих фрагмент MYC. Наличие связывания выявляют с использованием анти-MYC антител. Неспецифическое связывание определяют в жидкой фазе с использованием ангиостатина, крингл-содержащего белка (AS),который также включает присоединенный эпитоп MYC. При этом про-HGF, -цепь HGF и HGF NK1,который отражает минимальный Met-связывающий модуль -цепи HGF, связываются с ложным Met с аффинностью, которая в 3, 4 и 10 раз ниже в сравнении с аффинностью активного HGF, соответственно(фиг. 2 В). Связывание HGF- с ложным Met (или с любым другим доменом Met) было слишком низким для его выявления в рамках данного вида анализа. Sema-PSI связывается с выраженной аффинностью только с активным HGF, тогда как его связывание с про-HGF, HGF- или HGF NK1 не превышает уровня специфического связывания (фиг. 2 С). В то время как IPT связывается с активным HGF, про-HGF иHGF- примерно с одинаковой высокой аффинностью (фиг. 2B). HGF NK1 связывается с IPT в 10 раз менее прочно, чем активный HGF, т.е. с той же аффинностью, с которой он связывается с ложным Met. Полученные данные позволяют полагать, что участок IPT Met связывается с -цепью HGF с высокой аффинностью независимо от протеолитического процессинга лиганда.-цепь HGF связывается с доменами IPT 3 и 4 с высокой аффинностью. Участок IPT Met охватывает примерно 400 аминокислот и содержит четыре домена IPT. Для более точного картирования интерфейса IPT-HGF конструируют серию вариантов IPT, которые содержат делецию в одном или нескольких доменах (фиг. 3 А). IPT1 и IPT1-2 представляют собой две формы IPT сN-концевой делецией, которые не содержат первый или два первых иммуноглобулиноподобных домена,соответственно. IPT-3 и IPT-4 соответствуют двум С-концевым иммуноглобулиноподобным доменам,экспрессируемым в виде отдельных белков. Продукцию белка и его очистку проводят по описанной выше процедуре. Способность сконструированных IPT взаимодействовать с -цепью HGF исследуют в тестах на связывание по процедуре ELISA, с использованием полноразмерного участка IPT в качестве контроля. IPT, IPT1, IPT1-2, IPT-3 и IPT-4 иммобилизуют в твердой фазе и экспонируют с возрастающими концентрациями HGF-. Наличие связывания выявляют с использованием анти-HGF антител. Неспецифическое связывание определяют с использованием БСА, как было описано выше. Как показано на фиг. 3 В, делеция первых двух иммуноглобулиноподобных доменов не оказывает существенного воздействия на связывание HGF. Фактически, IPT1-2, белок, которой соответствует двум последним иммуноглобулиноподобным доменам Met, связывается с -цепью HGF с такой же, если не с более высокой прочностью, что и IPT. Однако дополнительная делеция третьего или четвертого иммуноглобулиноподобного домена практически полностью устраняет возможность связывания HGF-. Аналогичные результаты были получены с использованием активного HGF или про-HGF вместо HGF-. Полученные данные позволяют полагать,что два последних иммуноглобулиноподобных домена Met, которые находятся вблизи трансмембранного спирального участка в настоящем Met, достаточны для связывания -цепи HGF с высокой аффинностью. Домены IPT 3 и 4 достаточны для связывания HGF в живых клетках. Для того чтобы определить, может ли HGF связываться с IPT 3 и 4 в рамках мембранного рецептора, конструируют белок Met, содержащий крупную делецию во внеклеточном участке. Делетируют аминокислоты 25-741 на участке, соответствующем домену Sema (ак 25-515), домену PSI (ак 516-562) и первым двум доменам IPT (IPT 1 и 2, ак 563-741), получая рекомбинантные рецепторы, которые содержат домены IPT 3 и 4, трансмембранный спиральный участок и полноразмерный цитоплазматический участок (фиг. 4 А). кДНК, кодирующую сконструированный рецептор Met25-741, подвергают субклонированию в лентивирусном векторе, как это было описано выше. Рекомбинантные лентивирусные частицы используют для трансдукции клеточной линии карциномы яичника человека TOV-112D, которая не содержит системы эндогенной экспрессии Met, что следовало из результатов анализа по методу RT-ПЦР(Michieli, P., et al. (2004), Cancer Cell 6(1), 61-73). Результаты анализа поверхностного биотинилирования показали, что Met25-741 соответствующим образом экспрессируется и открыт для взаимодействия на мембране клеток TOV-112D (фиг. 4 В). Для определения, может ли Met25-741 связываться с HGF, клетки, трансдуцированные лентивирусным вектором, инкубируют в присутствии или в отсутствие рекомбинантного HGF и затем обрабатывают сшивающим агентом BS3. Клеточные лизаты подвергают иммунопреципитации с антителом против С-концевой части Met, разрешают путем электрофореза в SDS-PAGE и анализируют по методу вестернблоттинга с использованием биотинилированных анти-HGF антител. В качестве контроля используют клетки TOV-112D дикого типа по процедуре такого же анализа. Полученные иммуноблоты демонстрируют четкую полосу с молекулярным весом примерно 180 кДа на треке, соответствующем клеткам, экс-8 017863 прессирующим Met25-741, которые были обработаны HGF, но не на треках, соответствующих тем же клеткам, но без HGF, или клеткам TOV-112D дикого типа в присутствии или в отсутствие лиганда (фиг. 4 С). Полагая, что и Met25-741, и HGF имеют молекулярный вес примерно 90 кДа, иммунопреципитированный сшитый белок, предположительно, будет совместим с комплексом, образованным HGF плюсMet-киназы. В этой связи, клетки TOV-112D, трансдуцированные лентивирусным вектором, стимулируют про-HGF или активным HGF, и клеточные лизаты подвергают иммунопреципитации с использованием анти-Met антител, как было описано выше. Активацию рецептора определяют по методу вестернблоттинга с использованием анти-фосфотирозиновых антител. Эти же блоты подвергают повторному зондированию с использованием анти-Met антител для нормализации количества иммунопреципитированного рецептора. Следует отметить, что и про-HGF, и активный HGF были способны индуцировать стабильное фосфорилирование Met25-741 (фиг. 4D). Поскольку связывание про-HGF с полноразмернымMet не индуцирует активацию киназы, эти данные дают основание полагать, что домен Sema оказывает в некоторой мере аутоингибирующий эффект на каталитическую активность Met, которая выявляется при связывании с активным HGF. Стимуляцию рецептора также проводят с использованием HGF NK1 и сконструированного димерного лиганда, состоящего из двух фрагментов NK1 с тандемным повтором(NK1-NK1; фиг. 4 Е). Как показано на фиг. 4D, стимуляция NK1-NK1 клеток TOV-112D, трансдуцированных лентивирусным вектором, приводит к значительному фосфорилированию Met25-741, тогда как стимуляция мономерным NK1 не оказывает такого эффекта. Полученные данные позволяют полагать,что два С-концевых домена IPT Met (IPT 3 и 4) являются достаточными для связывания с HGF (и, более точно, с HGF NK1, который отражает минимальный Met-связывающий модуль -цепи HGF) и для переноса сигнала для активации рецептора в цитоплазматический киназный домен, предположительно, после димеризации рецептора при индукции лигандом. Однако эти данные также позволяют полагать, что IPT 3 и 4, сами по себе, являются недостаточными для разграничения биологически активной формы HGF и его инактивного предшественника, про-HGF. Растворимый IPT ингибирует HGF-индуцированный инвазивный рост in vitro. В предшествующем исследовании было показано, что внеклеточная часть Met, экспрессируемая в виде растворимого белка (ложный Met), ингибирует HGF-индуцированный инвазивный рост как in vitro,так и на моделях рака у мышей (Michieli P. et al. (2004), Cancer Cell 6(1), 61-73). Было также показано, что рекомбинантный растворимый Sema-PSI ингибирует и лиганд-зависимое, и лиганд-независимое фосфорилирование Met (Kong-Beltran M. et al. (2004), Cancer Cell 6(1), 75-84). Исходя из этих результатов, авторы исследовали, проявляет ли растворимый IPT HGF/Met антагонистическую активность в живых клетках. Клетки меланомы человека MDA-MB-435, которые экспрессируют Met и которые были установлены в качестве модельной системы для анализа HGF-опосредованного инвазивного роста, трансдуцируют лентивирусными векторами, кодирующими растворимый ложный Met, Sema-PSI или IPT. Клетки, трансдуцированные пустым вектором, используют в качестве контроля. Клетки, трансдуцированные ленивирусным вектором, которые секретируют сравнимые уровни растворимых факторов (примерно 50 пмоль/106 клеток/24 часа), выдерживают в бессывороточных условиях в течение нескольких дней, позволяя рекомбинантным факторам аккумулироваться в среде и затем стимулируют рекомбинантным HGF. Фосфорилирование Met-тирозина определяют путем иммуноблоттинга с антифосфотирозиновыми антителами, как было описано выше. Как показано на фиг. 5 А, и IPT, и Sema-PSI частично ингибируют HGFиндуцированное фосфорилирование Met, тогда как ложный Met полностью нейтрализует способностьHGF индуцировать активацию Met. Повторное зондирование тех же иммуноблотов антителами против С-концевого фрагмента не выявляет существенной разницы в количествах иммунопреципитированного белка. Для исследования ингибирующего потенциала эктодоменов Met в условиях, позволяющих лучше оценить биологические характеристики, такие же клетки используют для проведения теста на HGFзависимый морфогенез по ветвлению. Сформированные клеточные сфероиды высевают в трехмерную коллагеновую матрицу и затем стимулируют рекомбинантным HGF для образования трубчатых структур. Ветвление определяют количественно путем подсчета среднего числа трубочек, прорастающих из каждой колонии. Как показано на фиг. 5 В, и растворимый IPT, и Sema-PSI ингибируют HGFиндуцированное ветвление колоний (пустой вектор, 17,5 трубочки/колонию; IPT, 4,0 трубочки/колонию;Sema-PSI, 6,7 трубочки/колонию). Однако в соответствии с результатами, полученными в экспериментах по фосфорилированию, ложный Met демонстрировал более мощный HGF-ингибирующий эффект, чем его субдомен (2,5 трубочки/колонию). Репрезентативные снимки морфологии колоний показаны на фиг. 5 С. Растворимый IPT демонстрирует противоопухолевую и антиметастатическую активность у мышей. Полученные выше результаты дали основание авторам настоящего изобретения исследовать терапевтический потенциал растворимого IPT на моделях рака у мышей. Клетки меланомы MDA-МВ-435,-9 017863 трансдуцированные лентивирусным вектором, инъецируют подкожно мышам CD-1 nu-/- и отслеживают опухолевый рост с течением времени. Примерно через три недели опухоли удаляют для анализа и мышей подвергают аутопсии. При проведении анализа, аналогичного методу Каплана-Мейер, строят графики, где процент животных без опухолей наносят на график в зависимости от оси времени, и латентность опухоли подсчитывают количественно, как среднее значение в днях, при этом было показано, что все сконструированные растворимые рецепторы задерживают появление экспериментальных опухолей. Однако IPT был значительно более эффективным ингибитором, чем Sema-PSI, и ложный Met был более мощным ингибитором, чем IPT или Sema-PSI (фиг. 6 А). Анализ наличия опухолей с течением времени показал, что IPT был лишь немного менее эффективным, чем ложный Met, тогда как Sema-PSI ингибировал опухолевый рост только на очень ранних стадиях эксперимента (фиг. 6 В). Иммуногистохимический анализ экспрессии трансгена показал, что ложный Met, Sema-PSI и IPT характеризуются близкими уровнями и картиной распределения по опухоли (фиг. 6 С). Поскольку HGF является мощным про-ангиогенным фактором, было исследовано, приводит ли ингибирование HGF/Met в опухолях к нарушению ангиогенеза. Срез опухолевой ткани анализируют иммуногистохимическими методами с использованием антител против фактора Фон Виллебранда, а также определяют плотность сосудов под микроскопом (фиг. 6D). Было показано, что IPT снижает плотность опухолевых сосудов в 1,5 раза, тогда как ложный Met приводит к более мощному ингибированию (примерно в 4 раза); Sema-PSI не оказывает выраженного эффекта на опухолевый ангиогенез. У описанных выше мышей после аутопсии отбирают легкие и далее проводят обработку для проведения гистологического анализа. Серийные срезы тканей легкого окрашивают гематоксилином и эозином и анализируют под микроскопом для определения наличия микрометастаз. Полученные результаты проиллюстрированы на фиг. 6 А. В контрольной группе 4 из 6 мышей (67%) содержат микрометастазы. В IPT и Sema-PSI группах метастазы обнаружены только у 1 из 6 мышей (17%), тогда как в группе с ложным Met метастазы не были обнаружены. Метастазные поражения обнаруживаются и в паренхимных (внесосудистых), и в эмболических образованиях (внутрисосудистых; см. фиг. 6F в качестве репрезентативных снимков). Идентификация высокоаффинного сайта связывания HGF на HGFR согласно настоящему описанию позволяет разрабатывать новые процедуры, ведущие к созданию более специфических ингибиторов/антагонистов HGF и HGFR. Приведенные ниже неограничивающие примеры новых способов идентификации ингибиторов/антагонистов HGF/HGFR направлены на высокоаффинный сайт связыванияHGFR или на использование высокоаффинного сайта связывания HGFR в качестве создания новых ингибиторов/антагонистов. Разработка моноклональных антител, которые связываются с внеклеточными доменами IPT-3 иIPT-4 HGFR, препятствуя связыванию HGF. Ввиду того что взаимодействие HGF с внеклеточными доменами IPT-3 и IPT-4 необходимо для высокоаффинного связывания HGF, можно создать специфические моноклональные антитела, которые связываются с IPT-3 и IPT-4 и конкурируют с HGF за связывание с HGFR. Этого можно достичь в рамках нескольких стратегий.(A) Рекомбинантный белок или пептид, полученный из IPT-3 и IPT-4, получают по стандартным методам генетической инженерии или химического синтеза. Указанный белок или пептид инъецируют соответствующему лабораторному животному (обычно мыши или крысе) для проявления иммунной реакции. Далее у данного иммунизированного животного отбирают спленоциты и сливают их с миеломной клеточной линией и отбирают антитело-продуцирующие гибридомные клоны по стандартным методам работы с моноклональными антителами. Антитела против IPT-3 и IPT-4 далее подвергают скринингу по процедуре ELISA, аналогично методам согласно настоящему описанию, в которых используются рекомбинантный IPT-3 и IPT-4 в твердой фазе, а также продуцируемые гибридомой антитела в жидкой фазе. Наличие связывания выявляют с использованием противомышиных иммуноглобулиновых антител, которые доступны в коммерческом варианте. Альтернативно, антитела подвергают скринингу на их способность замещать рекомбинантный HGF (в жидкой фазе) из IPT-3 и IPT-4 (в твердой фазе) или по их способности к иммунопреципитации с рекомбинантными белками IPT-3 и IPT-4.(B) Полинуклеотидную последовательность, кодирующую IPT-3 и IPT-4, встроенную в соответствующий вектор экспрессии, инъецируют непосредственно лабораторному животному, чтобы на данный генный продукт у животного проявилась иммунная реакция. Далее антитела против IPT-3 и IPT-4 выделяют и подвергают скринингу по описанной выше методике.(C) Полинуклеотидную последовательность, кодирующую IPT-3 и IPT-4, встроенную в соответствующий вектор экспрессии, переносят в линию клеток млекопитающего, где указанные клетки не экспрессируют HGFR, для достижения экспрессии IPT-3 и IPT-4 на клеточной поверхности. Клетки, экспрессирующие IPT-3 и IPT-4, далее инъецируют лабораторному животному для проявления иммунного ответа, и антитела против IPT-3 и IPT-4 выделяют и подвергают скринингу по описанной выше методике.(D) Библиотеку нативных антител, созданную по стандартным методикам генетической инженерии(например, по технологии, известной как проявление фага) из лимфоцитов млекопитающего (предпочтительно лимфоцитов человека, например, лимфоцитов, инфильтрующих опухоль, экспрессирующуюHGFR), подвергают скринингу с использованием белков IPT-3 и IPT-4. Положительные клоны (т.е. те клоны, которые связываются с IPT-3 и IPT-4 с высокой аффинностью) затем выделяют, размножают, и полученные антитела характеризуют биохимически.(E) Человеческие В-клетки памяти выделяют из периферической крови пациента с опухоль, которая экспрессирует HGFR, в соответствии с методами ряда исследований (включая Traggiai E. et al. (2004), NatMed. 10(8), 871-875). Как только культуры иммортализованных В-клеток памяти человека устанавливаются, любой специалист со средним знанием в данной области может провести скрининг на клетки, секретирующие антитела против IPT-3 и IPT-4, с использованием методов, приведенных в настоящем описании, в разделе (А). После идентификации таких антителопродуцирующих клеток, желательное антитело может быть клонировано в рамках полимеразно-цепной реакции и стандартных процедур генетической инженерии. Идентификация исследуемого соединения, которое связывается с внеклеточными доменами IPT-3 иIPT-4 HGFR, ингибируя активность HGFR. При использовании разных подходов возможно выделить исследуемые соединения разного происхождения, которые связываются с высокоаффинным сайтом связывания HGF на HGFR и препятствуютHGF-индуцированной активации HGFR. Это может быть достигнуто в ходе нескольких стратегий.(A) С использованием тестов по процедуре ELISA, аналогичных описанным в настоящей работе,любой специалист со средним уровнем знаний в данной области может провести скрининг в библиотеке соединений (включая, без ограничения, библиотеку химически синтезированных соединений, библиотеку природных соединений, библиотеку малых молекул, пептидную библиотеку) для поиска агентов, которые замещают HGF во взаимодействии с IPT-3 и IPT-4. При проведении тестов данного вида рекомбинантные белки IPT-3 и IPT-4 иммобилизуют в твердой фазе и инкубируют с фиксированным количеством HGF, содержащимся в жидкой фазе. После экспозиции с соединениями из библиотеки определяют уровень связывания HGF с помощью коммерчески доступных анти-HGF антител.(B) С использованием клеточной линии, экспрессирующей сконструированную форму HGFR, которая во внеклеточной части не содержит ничего, кроме доменов IPT-3 и IPT-4, как и в случае приведенной ранее в описании процедуры, т.е. Met25-741, любой специалист со средним уровнем знаний в данной области может провести скрининг библиотеки соединений (включая, без ограничения, библиотеку химически синтезированных соединений, библиотеку природных соединений, библиотеку малых молекул, пептидную библиотеку) для поиска агентов, которые замещают HGF во взаимодействии с IPT-3 и IPT-4 или которые ингибируют HGF-индуцированную активацию HGFR. Это же может быть достигнуто в случае приведения указанных сконструированных клеток в контакт с соединениями библиотеки, с последующим определением уровня HGF-индуцированного фосфорилирования HGFR, как описано в настоящем исследовании, или с использованием других способов, которые позволяют выявить активацию HGFR,включая метод анализа рассеяния, тест на инвазию восстановленной матрицы, тест на морфогенез в направлении ветвления, тест на выживание клеток или любые другие биологические тесты in vitro, описанные в Michieli, P. et al. (2004), Cancer Cell 6(1), 61-73.(С) С использованием сконструированной клеточной линии согласно приведенному выше описанию любой специалист со средним уровнем знаний в данной области может провести скрининг генетической библиотеки (включая, без ограничения, библиотеку экспрессии кДНК, библиотеку короткошпилечных РНК, библиотеку антисмысловых ДНК, библиотеку случайных нуклеотидов) для поиска полинуклеотидных или генных продуктов, которые замещают HGF во взаимодействии с IPT-3 и IPT-4 или которые ингибируют HGF-индуцированную активацию HGFR. Это может быть достигнуто путем трансфекции, трансдукции или введения любым другим способом соединения из нуклеотидной библиотеки в указанные клетки, с последующим тестированием способности HGF активировать экспрессируемую этими клетками делетированную форму HGFR. Активацию HGFR определяют по методике, описанной в разделе (В). Репрезентативные функциональные тесты, которые позволяют определить биологическую активность соединений, связывающихся с внеклеточными доменами IPT-3 и IPT-4 HGFR. Независимо от того, какая стратегия используется для создания анти-IPT антител или IPTсвязывающих соединений, конечный продукт (например, моноклональные антитела против IPT-3 и IPT-4 и природных или синтетических соединений, которые связываются с IPT-3 и IPT-4) далее подвергают анализу в рамках биологических тестов, направленных на определение, обладают ли данные агенты способностью препятствовать проявлению активности HGFR. Указанные тесты могут проводиться in vitro с использованием культуры клеток млекопитающих или in vivo с использованием лабораторных животных.(А) Тест на рассеяние. Эпителиальные клетки, растущие в виде компактных колоний в чашке Петри и экспрессирующие HGFR, индуцируют к "рассеянию" путем стимуляции HGF. В результате стимуляции HGF клетки в чашке Петри становятся более обособленными и диспергированными. Этот тест может проводиться в присутствии нескольких исследуемых соединений. Среди исследуемых соединений ингибитор/антагонист HGF/HGFR может быть идентифицирован по отсутствию рассеянного фенотипа в ответ на стимуляцию HGF.(B) Тест на миграцию клеток. Клетки, экспрессирующие HGFR, обладают способностью мигрировать по градиенту HGF. Иными словами, клетки притягиваются хемотоксически в направлении повышенных концентраций HGF. Эта способность может быть использована при проведении скрининга ингибиторов HGF в экспериментальной камере Бойдена. Клетки высевают в первой камере и вносят HGF во вторую камеру, которая отделена от первой камеры пористой мембраной. Клетки мигрируют через мембрану и поступают во вторую камеру, где находится более концентрированный HGF. Агенты, которые ингибируют этот процесс, идентифицируются как ингибиторы/антагонисты HGF/HGFR.(C) Тест на миграцию Transwell или повторный тест на инвазию с использованием восстановленной матрицы. Указанный тест представляет собой вариацию метода, описанного выше в разделе (В), в ходе которого пористые мембраны покрывают слоем коллагена, Matrigel или других восстановленных органических матриц. Клетки, для того чтобы мигрировать, должны вначале расщепить органическую матрицу. Этот тест представляет собой более жесткий вариант исследования, которое позволяет измерить, в большей мере, инвазию, а не просто миграцию клеток.(D) Тест на инвазию коллагена или тест на морфогенез по ветвлению. В рамках данного теста клетки млекопитающего, экспрессирующие HGFR (предпочтительно эпителиальные клетки или клетки карциномы), высевают в трехмерном слое коллагена и затем оставляют расти до образования сфероидов, где каждый из них содержит примерно 1000 клеток. Альтернативно, сфероиды могут быть предварительно сформированы путем инкубирования клеток в течение ночи в неадгезивных условиях в 96-луночных планшетах в присутствии метилцеллюлозы, как было описано в Michieli, P. et al. (2004), Cancer Cell 6(1),61-73. После того как сфероиды погружаются в коллагеновый слой, их стимулируют HGF и инкубируют при температуре 37 С. Это приводит к прорастанию трубок и сфероидов; каждая трубочка формируется несколькими клетками, организованными в виде трубчатой структуры и поляризованными таким образом, что имеется одна сторона клетки, которая обращена к внутреннему просвету, и вторая сторона, которая обращена к наружной среде. По мере проведения теста трубочки начинают ветвиться и образовывать более сложную архитектуру. Этот тест является высокоспецифичным для HGF. Агенты, которые ингибируют данный процесс, с очень высокой степенью вероятности могут быть отнесены к высокоспецифичным антагонистам HGF/HGFR.(E) Митогенный тест. HGF обладает способностью индуцировать репликацию ДНК и клеточное деление в некоторых клетках, экспрессирующих HGFR. Наиболее отзывчивыми клетками являются первичные гепатоциты, обычно это гепатоциты мыши или крысы. Для тестирования HGF-индуцированной репликации ДНК клетки подвергают депривации в отношении сывороточных факторов роста и затем стимулируют возрастающими концентрациями HGF. Сразу после этого добавляют радиоактивный тимидин и клетки инкубируют при температуре 37 С в течение примерно одного дня. После тщательной промывки и фиксации определяют радиоактивный тимидин, включенный в клеточную ДНК, путем жидкого сцинтилляционного счета или с использованием других стандартных методик, которые позволяют количественно определить уровень радиоактивности.(F) Тест на выживание. HGF обладает способностью защищать HGFR-экспрессирующие клетки от апоптоза или запрограммированной гибели клеток. Это свойство может использоваться для определения активности HGFR в тесте на выживание. Клетки подвергают предварительной инкубации с HGF и исследуемым соединением (потенциальным ингибитором HGFR) и затем подвергают воздействию апоптозного стимула, такого как токсическое вещество, отсутствие возможности адгезии, гипоксия, тепловой шок,облучение или повреждение ДНК. По истечению соответствующего периода времени измеряют уровень гибели клеток по стандартным методикам, включая метод TUNEL (использование терминальной дезоксинуклеотидилтрансферазы для переноса биотин-dUTP к свободной 3'-ОН расщепленной ДНК), нуклеосомный метод, метод электрофоретического расщепления ДНК (оценка эффекта "лестницы"), метод определения активности каспазы, метод окрашивания красителем, специфичным для жизнеспособной клетки, или в рамках любых вариаций указанных методов.(G) Тест на канцерогенез у мышей. В рамках данного теста активность потенциального ингибитораHGF/HGFR выявляют непосредственно у лабораторного животного, предпочтительно мыши или крысы. Имеется несколько способов получения опухоли у мыши. Чаще всего используемая стратегия включает получение ксенотрансплантата, т.е. трансплантата опухолевых клеток (обычно человеческого происхождения) у животного-реципиента (обычно у иммунодефицитной мыши). Клетки могут быть имплантированы подкожно (быстрый и простой метод получения экспериментальной опухоли) или ортотропно, т.е. в тот же самый орган, из которого данная опухолевая клетка была выделена (например, клетки карцинома молочной железы имплантируются в жировой слой молочной железы, клетки карциномы толстой кишки имплантируются в слизистую кишечника, клетки гепатокарциномы имплантируются в паренхиму печени и т.п.). Независимо от используемого метода инъекция опухолевых клеток лабораторному животному может привести к образованию экспериментальной опухоли. Далее такое животное с опухолью может использоваться для оценки противоопухолевого потенциала исследуемых соединений. АнтиHGF/HGFR антитела или соединения могут быть введены животному, содержащему опухолевые поражения, характеризующиеся разбалансированной сигнальной функцией HGF/HGFR, с использованием- 12017863 для такого введения наиболее подходящего известного способа, включая внутривенную инъекцию, внутрибрюшинную инъекцию, использование осмотического насоса, пероральное введение, введение с помощью суппозитория, введение согласно протоколу генной терапии, путем локального введения и т.п. После проведения лечения в течение соответствующего периода времени, животное подвергают эвтаназии, отбирают опухоль и органы для анализа.(Н) Тест на метастазогенез у мыши. Экспериментальные метастазы могут быть индуцированы у мыши путем системной инъекции опухолевых клеток. Указанные клетки захватываются капиллярами легкого и впоследствии в ходе экстравазации приводят к образованию легочных метастаз. Образование таких метастаз может быть количественно оценено после аутопсии в рамках подходов, включающих микроскопирование, гистологический анализ, иммуногистохимические методы, оценку на уровне всего организма. Исследуемые соединения доставляются по методу, описанному в разделе (G).(I) Протокол генной терапии. В том случае, если ингибитор HGF/HGFR представляет собой антитело, рекомбинантный белок, пептид или малую молекулу интерферирующей РНК, доставка в организм животного с опухолью может быть достигнута согласно протоколу генной терапии. Данный метод состоит в том, что вначале желательный полинуклеотид встраивают в вектор доставки, который может быть выбран из числа лентивирусных векторов, аденовирусных векторов, ретровирусных векторов, "оголенной" ДНК или любой их вариации. Далее указанный векторный препарат может быть доставлен системно или местно в опухоль в зависимости от локализации опухоли, от выбранного вектора или от гистотипа опухоли. Биологические эффекты генной терапии анализируют в соответствии с описанием, приведенным для других соединений в разделе (G). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение полинуклеотида, кодирующего полипептид, состоящий из внеклеточных доменовIPT-3 и IPT-4 рецептора фактора роста гепатоцитов, для скрининга и/или разработки фармакологически активных агентов, полезных при лечении рака. 2. Применение полипептида, состоящего из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, для скрининга и/или разработки фармакологически активных агентов, полезных при лечении рака. 3. Применение по п.1 или 2, где указанный фармакологически активный агент препятствует проявлению каталитической активности, функции, стабильности и/или экспрессии рецептора фактора роста гепатоцитов. 4. Применение по п.1 или 2, где указанный фармакологически активный агент осуществляет регуляцию по типу отрицательной обратной связи каталитической активности, функции, стабильности и/или экспрессии рецептора фактора роста гепатоцитов. 5. Применение по любому из предшествующих пунктов, где указанный фармакологически активный агент представляет собой ингибитор и/или антагонист рецептора фактора роста гепатоцитов. 6. Применение по любому из предшествующих пунктов, где указанный фармакологически активный агент выбирают из ингибиторов в виде малых молекул, аптамеров, антисмысловых нуклеотидов,ингибиторов на основе РНК, киРНК, антител, пептидов, негативных доминантных факторов. 7. Применение по любому из предшествующих пунктов, где рак представляет собой рак, характеризующийся нарушением активности рецептора фактора роста гепатоцитов. 8. Способ выявления способности исследуемого агента действовать в качестве антагониста/ингибитора рецептора фактора роста гепатоцитов, полезного при лечении рака, предпочтительно рака, характеризующегося нарушением активности рецептора фактора роста гепатоцитов, включающий стадии:(а) приведения исследуемого агента в контакт с i) полинуклеотидом, кодирующим полипептид, состоящий из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, ii) полипептидом, состоящим из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, илиiii) клетками, экспрессирующими внеклеточные домены IPT-3 и IPT-4, трансмембранную спираль и полный цитоплазматический участок рецептора фактора роста гепатоцитов;(b) измерения активности рецептора фактора роста гепатоцитов, его функции, стабильности и/или экспрессии;(c) отбора агента, который снижает активность, функцию, стабильность и/или экспрессию рецептора фактора роста гепатоцитов. 9. Способ по п.8, где указанное измерение на стадии (b) включает измерение сигнальной функции в клетках, выживания клеток и клеточной пролиферации. 10. Применение внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов в качестве лекарственного средства для лечения рака. 11. Применение вектора, включающего нуклеотидную последовательность, кодирующую полипептид, состоящий из внеклеточных доменов IPT-3 и IPT-4 рецептора фактора роста гепатоцитов, в качестве лекарственного средства для лечения рака.
МПК / Метки
МПК: C12Q 1/25, C12N 9/12, A61K 38/00, A61K 48/00, C12P 21/02
Метки: антагонистов, сайт, идентификации, способы, связывания, высокоаффинный
Код ссылки
<a href="https://eas.patents.su/30-17863-vysokoaffinnyjj-sajjt-svyazyvaniya-hgfr-i-sposoby-identifikacii-ego-antagonistov.html" rel="bookmark" title="База патентов Евразийского Союза">Высокоаффинный сайт связывания hgfr и способы идентификации его антагонистов</a>
Предыдущий патент: Полислой из холестерического жидкокристаллического полимера, способ его получения и применение
Следующий патент: Специфическая терапия и лекарственное средство на основе интегриновых лигандов для лечения рака
Случайный патент: Пероральный концентрат сертралина