Специфическая терапия, использующая интегриновые лиганды для лечения рака
Номер патента: 16817
Опубликовано: 30.07.2012
Авторы: Ниппген Иоганнес, Гудман Саймон, Харштрик Андреас, Пикард Мартин Андреас, Гримм Ульрике, Миккелсен Том, Грелль Маттиас, Ступп Роже, Веллер Михаэль
Формула / Реферат
1. Применение по меньшей мере одного специфического лиганда интегрина, выбранного из цикло-(Arg-Gly-Asp-DPhe-NMeVal) и его фармацевтически приемлемых сольватов и солей, для получения лекарственного средства для лечения астроцитомы, где лекарственное средство используется в комбинации с двумя дополнительными противораковыми котерапевтическими агентами, которыми являются темозоломид и лучевая терапия.
2. Применение по п. 1, где астроцитомой является глиобластома или мультиформная глиобластома.
3. Применение по п.1 и/или 2, где лучевой терапией является фракционированное внешнее облучение.
4. Применение по одному или более пп.1-3, где указанный специфический лиганд интегрина применяется, главным образом, одновременно или последовательно по меньшей мере с одним противораковым котерапевтическим агентом.
5. Применение по одному или более пп.1-4, где по меньшей мере одним лигандом интегрина является цикло-(Arg-Gly-Asp-DPhe-NMeVal).
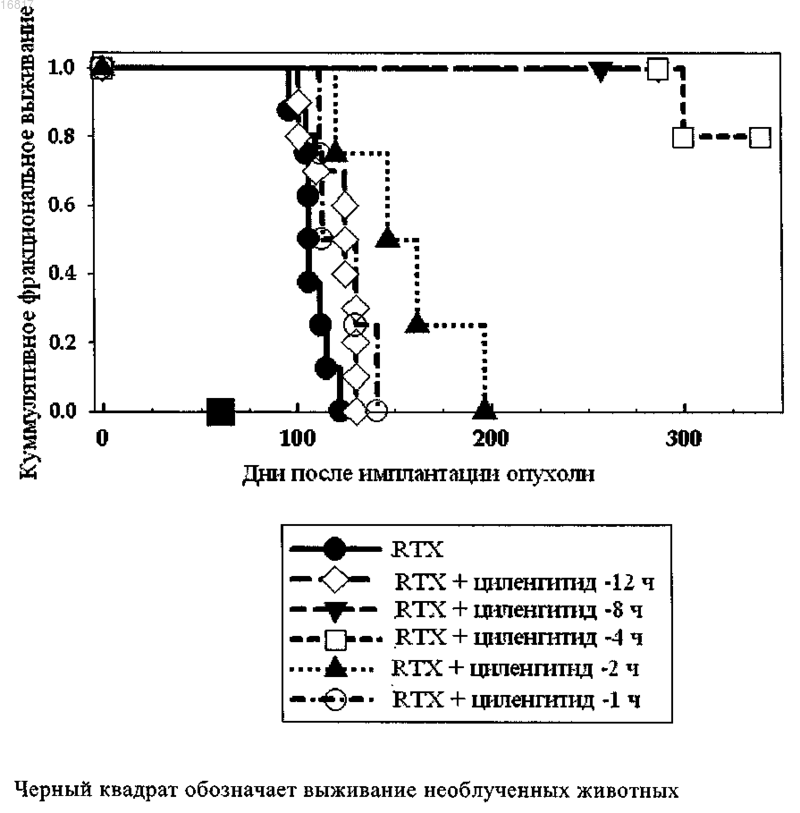
6. Применение по одному или более пп.1-5, где по меньшей мере один специфический лиганд интегрина вводится за 1-8 ч до применения лучевой терапии и/или темозоломида.
7. Применение по одному или более пп.1-6, где по меньшей мере один специфический лиганд интегрина вводится за 2-6 ч до применения лучевой терапии и/или темозоломида.
8. Применение по меньшей мере одного специфического лиганда интегрина, включающего цикло-(Arg-Gly-Asp-DPhe-NMeVal), его фармацевтически приемлемые производные, сольваты и/или соли, для получения лекарственного средства для лечения астроцитомы, где лекарственное средство используется в комбинации с лучевой терапией, где цикло-(Arg-Gly-Asp-DPhe-NMeVal), его фармацевтически приемлемые производные, сольваты и/или соли, вводятся за 1-10 ч до применения лучевой терапии и где по меньшей мере один применяемый противораковый котерапевтический агент иной, чем лучевая терапия, включает темозоломид.
9. Применение по меньшей мере одного специфического лиганда интегрина, включающего цикло-(Arg-Gly-Asp-DPhe-NMeVal), для получения лекарственного средства для лечения мультиформной глиобластомы, где лекарственное средство применяется в комбинации с двумя дополнительными противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией.
10. Применение по п.8 или 9, где лучевой терапией является внешнее облучение.
11. Применение по одному или более пп.1, 2, 3, 4, 5, 9 и 10, где по меньшей мере специфический лиаганд интегрина применяется за 1-32 ч до применения одного или более противоопухолевых котерапевтических агентов.
12. Применение по меньшей мере одного специфического лиганда интегрина, включающего цикло-(Arg-Gly-Asp-DPhe-NMeVal), его фармацевтически приемлемые производные, сольваты и/или соли, для получения лекарственного средства для лечения астроцитомы, где лекарственное средство используется в комбинации с темозоломидом и лучевой терапией, где по меньшей мере специфический лиганд интегрина цикло-(Arg-Gly-Asp-DPhe-NMeVal), его фармацевтически приемлемые производные, сольваты и/или соли, вводятся пациенту в количестве 800 до 7000 мг в неделю.
13. Применение по одному или более предыдущих пунктов, где цикло-(Arg-Gly-Asp-DPhe-NMeVal) вводится пациенту в количестве приблизительно 1000 мг в неделю, приблизительно 1500 мг в неделю, приблизительно 2500 мг в неделю, приблизительно 4000 мг в неделю или приблизительно до 6000 мг в неделю.
14. Применение по одному или более предыдущих пунктов, где количество приблизительно 1000 мг в неделю или приблизительно 4000 мг в неделю вводится с помощью схемы введения два раза в неделю, а количество приблизительно 1500 мг в неделю или 6000 мг в неделю вводится с помощью схемы введения три раза в неделю.
15. Применение по одному или более предыдущих пунктов, где количество приблизительно 1000 мг в неделю вводится с помощью схемы введения два раза в неделю, состоящей из приблизительно 500 мг на введение, или количество приблизительно 4000 мг в неделю вводится с помощью схемы введения два раза в неделю, состоящей из 2000 мг на введение.
16. Применение по одному или более предыдущих пунктов, где по меньшей мере специфический лиганд интегрина цикло-(Arg-Gly-Asp-DPhe-NMeVal), его фармацевтически приемлемые производные, сольваты и/или соли вводятся за 2-8 или 3-6 ч до применения лучевой терапии.
17. Применение по одному или более пп.8 и 10-16, в котором дополнительно применяется дополнительный противораковый котерапевтический агент, выбранный из Цисплатина, Оксалиплатина, Карбоплатина, 5-FU, Дакарбазина, Прокарбазина, Винбластина, Винкристина, Иринотекана, Таксола, Паклитакселя, Доцетакселя, Гемцитабина, Гливека, Ирессы, Тарцевы и Нексавара, Герцептина, Бевацизумаба, Цетуксимаба, Нимотузумаба, Сорафениба, Сунитиниба и ZD6474 (ЗАКТИМАÔ), и еще более предпочтительно выбранный из Темозоломида, Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы.
18. Применение по одному или более предыдущих пунктов, в котором лекарственное средство должно использоваться при лечении пациентов, имеющих статус повышенного ДНК метилирования.
19. Применение по одному или более предшествующих пунктов, в котором лекарственное средство должно использоваться при лечении пациентов, показывающих частичное или полное метилирование по крайней мере одного промотора по крайней мере одного гена MGMT.
20. Применение по одному или более предшествующих пунктов, в котором лекарственное средство должно использоваться при лечении недавно диагностированного рака, предпочтительно при назначении первой линии терапии.
21. Способ лечения астроцитомы, включающий введение субъекту:
а) цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых сольватов и/или солей;
б) темозоломида и/или его фармацевтически приемлемых сольватов и/или солей и
в) лучевой терапии.
22. Способ по п.21, где астроцитомой является глиобластома или мультиформная глиобластома.
23. Способ по п.21 и/или 22, где лучевой терапией является фракционированное внешнее облучение.
24. Способ по пп.21, 22 и/или 23, где цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые сольваты и/или соли применяются, главным образом, одновременно или последовательно:
i) с темозоломидом и/или его фармацевтически приемлемыми сольватами и/или солями и/или
ii) с лучевой терапией.
25. Способ по пп.21-23 и/или 24, где цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые сольваты и/или соли вводятся за 1-10 ч до применения:
i) лучевой терапии и/или
i) темозоломида и/или его фармацевтически приемлемых сольватов и/или солей.
26. Способ по пп.21-24 и/или 25, где указанный цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые сольваты и/или соли вводятся за 2-8 ч до применения:
ii) лучевой терапии и/или
iii) темозоломида и/или его фармацевтически приемлемых сольватов и/или солей.
27. Способ по пп.21-25 и/или 26, где указанный цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые сольваты и/или соли, по существу, состоят из или содержат внутреннюю соль цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его сольватов.
Текст
СПЕЦИФИЧЕСКАЯ ТЕРАПИЯ, ИСПОЛЬЗУЮЩАЯ ИНТЕГРИНОВЫЕ ЛИГАНДЫ ДЛЯ ЛЕЧЕНИЯ РАКА Гудман Саймон, Пикард Мартин Андреас (DE), Миккелсен Том (US),Ниппген Иоганнес, Гримм Ульрике Изобретение касается комбинированной терапии для лечения опухолей и опухолевых метастазов,включающей введение интегриновых лигандов, предпочтительно интегриновых антагонистов,вместе с котерапевтическими агентами или формами терапии, которые имеют синергистическую эффективность при последовательном введении с указанными лигандами, такими как химиотерапевтические агенты и/или лучевая терапия. Терапия приводит к синергистическому потенциальному увеличению эффекта ингибирования каждого индивидуального терапевтического средства на пролиферацию опухолевых клеток, приводя к более эффективному лечению, чем обнаружено при введении индивидуального компонента по отдельности, одновременно или не в режиме дозировки настоящего изобретения.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) 016817 Область техники изобретения Изобретение касается специфической терапии для лечения опухолей (или опухоли) и опухолевых метастазов, включающей введение интегриновых лигандов вместе с противораковыми котерапевтическими агентами или другими формами противораковой котерапевтический терапии, обладающими совокупной или синергистической эффективностью при введении вместе с указанным интегриновым лигандом, такими как химиотерапевтические агенты, иммунотерапевтические агенты, включая антитела, радиоиммуноконъюгаты и иммуноцитокины и/или лучевая терапия, предпочтительно контролированным по времени способом. Терапия приводит к синергистическому потенциальному увеличению эффекта ингибирования каждого индивидуального терапевтического средства на опухолевую клетку и пролиферацию опухолевых эндотелиальных клеток, приводя к более эффективному лечению, чем обнаружено при введении индивидуального компонента по отдельности, вместе или в другом режиме терапии, но не режиме настоящего изобретения. Предпосылки создания изобретения Сосудистые эндотелиальные клетки, как известно, содержат по крайней мере три RGD-зависимых интегрина, включая витронектиновые рецепторы V3 или V5, a также коллагеновые рецепторы типов I и IV V1 и 21 ламининовые рецепторы 61 и 31 и фибронектиновый рецептор 51 (Davis et al.,1993, J. Cell. Biochem. 51, 206). Клетка гладой мускулатуры, как известно, содержит по крайней мере шесть RGD-зависимых интегринов, включая V3 и aV5. Ингибирование клеточной адгезии in vitro с использованием моноклональных антител, иммуноспецифических для различных интегриновыхилисубъединиц вовлекло витронектиновый рецептор V3 в процессы клеточной адгезии различных типов клеток, включая капиллярные эндотелиальные клетки (Davis et al., 1993, J. Cell. Biol. 51, 206). Интегрины представляют собой класс клеточных рецепторов, как известно, связывающих белки внеклеточного матрикса и опосредующих взаимодействия клетка-внеклеточный матрикс и клеткаклетка, относящихся, как правило, к событиям, связанным с клеточной адгезией. Интегриновые рецепторы составляют семью белков, обладающих структурными особенностями не ковалентно связанных гетеродимерных комплексов гликопротеинов, сформированных изисубъединиц. Витронектиновый рецептор, названный так из-за его оригинальной особенности предпочтительного связывания с витронектином, как теперь известно, относится к четырем различным интегринам, определенным как V1, V3,V5 и V8. V1, связывается с фибронектином и витронектином. V3 связывается с большим разнообразием лигандов, включая фибрин, фибриноген, ламинин, тромбоспондин, витронектин и фактор фон Виллебранда. V5 связывается с витронектином. Очевидно, что существуют различные интегринов с различными биологическими функциями, а также различные интегрины и субъединицы, обладающие сходной биологической специфичностью и функцией. Один важный участок распознавания в лиганде для многих интегринов представляет собой Arg-Gly-Asp (RGD) трипептидную последовательность. RGD обнаружена во всех лигандах, идентифицированных выше, для интегринов витронектинового рецептора. Был идентифицирован молекулярный вес распознавания RGD с помощью V3 (Xiong et al., 2001). Этот участок распознавания RGD можно имитировать линейными и циклическими (поли) пептидами, которые содержат последовательность RGD. Такие пептиды RGD, как известно, являются ингибиторами или антагонистами, соответственно, функции интегринов. Важно отметить, однако, что в зависимости от последовательности и структуры пептида RGD, специфичность ингибирования может быть изменена для нацеливания на определенные интегрины. Были описаны различные полипептиды RGD с варьирующей интегриновой специфичностью, например, в Cheresh, et al., 1989, Cell 58, 945, Aumailley et al., 1991, FEBSLetts. 291, 50, и в многочисленных патентных заявках и патентах (например, патентах США 4517686,4578079, 4589881, 4614517, 46611114 792525; EP 0770622). Образование новых кровеносных сосудов или ангиогенез играет ключевую роль в росте злокачественного заболевания, и это представляет большой интерес при разработке агентов, ингибирующих ангиогенез. Однако, хотя в клинических исследованиях и на рынке исследуются различные виды комбинированной терапии, использующие потенциал ингибиторов ангиогенез, а результаты этих видов терапии не являются достаточно удовлетворительными. Поэтому в данной области все еще существует потребность в разработке дальнейших комбинаций, которые могут показать повышение эффективности и уменьшение побочных эффектов. Сегодня известно, что сосудистая сеть опухоли отличается от сосудистой сети здоровой ткани. Сосудистая сеть характеристична для опухоли и отличается от стабильной, неактивной сосудистой сети здоровой ткани. Она часто характеризуется увеличением экспрессии и стимуляцию определенных молекул клеточной адгезии альфа-V-интегринового ряда, особенно V3 и V5. При активизации эти интегринов увеличивается клеточный ответ на факторы роста, которые запускают ангиогенез,например VEGFA и FGF2: VEGFA первоначально был назван фактором сосудистой проницаемости, и он действует через SRC киназный путь для увеличения местной сосудистой проницаемости. VEGRF2, при активизации, увеличивает активность V3 интегрина. Кроме того, развитие солидных опухолей зависит от индуцированной и окружающей их сосудистой сети хозяина. Эта сосудистая сеть имеет необычные молекулярные свойства, которые отличают ее от нормальной сосудистой сети хозяина: она имеет тенденцию к активации, то есть прогрессирования через клеточный цикл под влиянием опухолевых факто-1 016817 ров, таких как VEGF, FGF и другие, и экспрессирует эндотелиальные маркеры активации, такие какICAM, VCAM и интегрины альфа-V-ряда, например V3 и V5, в лиганд компетентном состоянии. Она обладает дефектным внеклеточным матриксом, и классически описывается как проницаемая. Известно,что опухоли часто резистентны к терапиям, систематически применяемым через кровеносный поток, изза патологической природы опухолевой сосудистой сети. Метастатический процесс представляет собой многостадийное явление и самый ужасный аспект рака. В момент диагноза раковые образования часто очень запущенные по своей природе, и наличие метастазов - это очень распространенный случай. Фактически, приблизительно у 30% пациентов обнаруживаются метастазы в момент клинического диагноза, а у еще 30% пациентов - скрытые метастазы. Метастазы могут диссеминироваться и попадать в различные органы в то же самое время, или локализоваться в определенном органе. В случае локализированной болезни хирургия представляет собой терапию выбора; однако рецидивирование и прогноз зависят от многих критериев, таких как возможность осуществить резекцию, клиническое состояние пациента и количество метастазов. После резекции часто возникает рецидив, свидетельствуя о том, что на момент диагноза присутствовали микрометастатические очаги. Системная химиотерапия является идеальным решением, но только немного пациентов вылечивается с ее помощью, и в большинстве случаев системная химиотерапия неэффективна. Снижению ее эффективности способствуют много физиологических барьеров и фармакокинетических параметров. Печень, легкие и лимфоузлы представляют собой органы фильтрации и поэтому склонны к метастазированию. Плохая чувствительность к химическому воздействию метастазов, особенно колоректального происхождение, вынудила многих исследователей использовать методы для увеличения времени воздействия и концентрации препаратов. Потребность в уменьшении или ограничении побочных эффектов для этого важного и деликатного органа привела к разработке техники изоляции печени для перфузии противоопухолевых агентов (K. R. Aigner, Isolated liver perfusion. In: Morris DL, McArdle CS, OnikGM, eds. Hepatic Metastases. Oxford: Butterworth Heinemann, 1996. 101-107). С 1981 г. непрерывно вводились модификации и технические усовершенствования. Метастазы в печень могут иметь различное происхождение, и их чувствительность к химическому воздействию может измениться согласно гистологическому типу и их ответу в присутствии высокой температуры. В данной области все еще существует растущая потребность в разработке новых терапевтических стратегий для систематического лечения рака, особенно метастазов. Поэтому цель настоящего изобретения состояла в разработке такой новой стратегии. Она должна быть применима к системному лечению, и должна понизить дозу и/или увеличить эффективность противораковых терапевтических агентов, которые применяются. Еще одна цель состояла в нормализации опухолевой сосудистой сети, чтобы увеличить доставку системной терапии к опухоли, то есть перестроить сосудистую сеть опухоли на функциональные возможности сосудистой сети неопухолевой ткани. Таким образом, предпочтительная цель настоящего изобретения состоит в обеспечении более эффективного, лучше переносимого лечения для больных раком, приводящего к увеличению показателя выживания без прогрессии (PFS), QOL и увеличения медианы выживания. Краткое описание фигур Фиг. 1 показывает результаты лучевой терапии на крысиной модели ортотопической глиобластомы,эксперименты по схемам введения циленгитида. Результаты также показаны в табл. 1. Фиг. 2 показывает результаты клинического исследования глиобластомы (GBM). Результаты также показаны в примере 3. Краткое описание изобретения Настоящее изобретение впервые описывает новое фармацевтическое лечение, которое основывается на новой концепции в терапии опухолей введения субъекту в терапевтически эффективном количестве интегринового лиганда до применения противоракового котерапевтического агента. К удивлению было обнаружено, что сосудистая сеть опухоли может быть функционально нормализована путем систематического применения интегриновых лигандов, определенных ниже. Такие ингибиторы интегриновых функций, также названные интегриновыми лигандами в контексте настоящего изобретения, увеличивают количество цитотоксических и других противораковых котерапевтических агентов, попадающих в опухоль. Кроме того, как показано, они увеличивают числа лейкоцитов, входящих в опухоль после системной иммуноцитокиновой терапии, и могут непосредственно увеличивать количества антител, входящих в участок опухоли при противоопухолевой терапии антителами, или увеличивать доступ к противоопухолевым вакцинам. Хотя на сегодня не известно, существует возможность, что эта функциональная нормализация сосудистой сети опухоли может привести к более высокой концентрации кислорода в опухоли, и позволить кислородозависимым терапиям, таким как внешняя лучевая терапия, становиться более эффективными."Функциональный нормализирующий агент" настоящего изобретения определен авторами эмпирически как реагент, нацеливающийся на альфа-V-интегрины в пределах опухолевого участка, что увеличивает уровни системных противоопухолевых терапевтических средств или определенных биоиндикаторов сис-2 016817 темной терапии в пределах опухоли. Местное увеличение терапевтического средства преодолевает механизмы резистентности опухоли и увеличивает терапевтический индекс. Например, системным терапевтическим средством мог бы быть классический химиотерапевтический реагент, иммуноцитокины, иммунотоксин или лучевая иммунотерапия и т.д. В одном варианте осуществления настоящее изобретение касается композиции, включающей в качестве котерапевтического агента терапевтически активные соединения, предпочтительно выбранные из группы, состоящей из цитотоксических агентов, химиотерапевтических агентов и иммунотоксических агентов, и в зависимости от обстоятельств других фармакологически активных соединений, которые могут увеличить эффективность указанных агентов или уменьшать побочные эффекты указанных агентов. Таким образом, в том же самом варианте осуществления настоящее изобретение касается фармацевтических композиций, включающих интегриновый лиганд, предпочтительно любой из V3, V5,V6 или V8 интегриновых рецепторных лигандов, более предпочтительно RGD-содержащий линейный или циклический пептид, еще более предпочтительно - RGD-содержащие интегриновые ингибиторы, наиболее предпочтительно циклический пептид цикло-(Arg-Gly-Asp-DPhe-NMe-Val). Согласно настоящему изобретению терапевтически активные композиции можно также обеспечить посредством фармацевтического набора, включающего упаковку, содержащую один или несколько упомянутых интегриновых лигандов, и один или несколько цитотоксических и/или химиотерапевтических и/или иммунотоксический агентов в отдельных упаковках или в отдельных контейнерах. Терапия этими комбинациями может произвольно включать лечение с помощью облучения с дополнительным котерапевтическим агентом или без него, как определено выше. Кроме того, изобретение касается новой формы терапии, включающей введение интегринового лиганда перед проведением лучевой терапии. В этой новой форме терапии, включающей введение интегринового лиганда перед лучевой терапией, предпочтительная особенность состоит в том, что интегриновый лиганд вводят перед дальнейшим противораковым котерапевтическим агентом. В этом контексте согласно настоящему изобретению, облучение или лучевая терапия должны рассматриваться как противораковый котерапевтический агент. Вообще, это предшествующее применение имеет место за 1-8 ч, предпочтительно 1-5 ч, и более предпочтительно - 1-3 ч перед применением дальнейшего противоракового котерапевтического агента. Еще более предпочтительно это предшествующее применение имеет место за 2-8 ч, предпочтительно 2-6 ч, и более предпочтительно 2-4 ч перед применением дальнейшего противоракового котерапевтического агента, как например, за 1-2, 2-3, 3-6, 2-5 или 3-7 ч перед применением дальнейшего противоракового терапевтического агента. Относительно изобретения это предшествующее применение или введение также упоминается как "рассчитанное по времени введение" или "рассчитанное по времени применение". Как показано с помощью данных, содержащихся в этой заявке, эффект согласно изобретению достигается у не человеческих животных, особенно крысах, если это предшествующее применение предпочтительно имеет место за 1-8 ч, предпочтительно 1-5 ч и более предпочтительно 1-3 ч перед применением дальнейшего противоракового котерапевтического агента; и еще более предпочтительно это предшествующее применение имеет место за 2-8 ч, предпочтительно 2-6 ч и более предпочтительно 2-4 ч перед применением дальнейшего противоракового котерапевтического агента, как например, за 1-2, 2-3, 3-6, 25 или 3-7 ч перед применением дальнейшего противоракового терапевтического агента. Относительно изобретения это предшествующее применение или введение также упоминается как "рассчитанное по времени введение" или "рассчитанное по времени применение". Однако, данные из экспериментов с человеческими животными предпочтительно показывают, что время выше/ниже описанного и обсужденного "предшествующего применения" может быть отсрочено или умножено на коэффициент 1-4 и особенно 2-4. Это различие во время ответа или ответе между не человеческими животными, особенно грызунами, такими как крысы, и человеческими животными известно и широко обсуждается в данной области. В то время как заявитель не желает привязываться к этой теории, он полагает, что это различие по крайней мере частично вызвано различным фармакокинетическим поведением различных видов, которое, например, отражается в различном времени полувыведения (t1/2) у различных видов животных. Например, для соединений, таких как циклопептиды, периоды полувыведения у крыс обычно находятся в диапазоне 10-30 мин, тогда как периоды полувыведения у человеческих животных для тех же соединений составляют 2-6 ч и, особенно, 3-4 ч. Соответственно, предмет этой заявки состоит в способе лечения и/или способе изготовления, описанном выше/ниже, в котором предшествующее применение предпочтительно имеет место за 1-32 ч,предпочтительно 2-32 ч, более предпочтительно 2-24 ч, еще более предпочтительно 4-24 ч, еще более предпочтительно 6-20 ч и особенно 6-16 ч, перед применением дальнейшего противоракового котерапевтического агента; или альтернативно предпочтительно это предшествующее применение имеет место за 6-32 ч (ч), предпочтительно 10-24 ч, и более предпочтительно 12-20 ч перед применением дальнейшего противоракового котерапевтического агента. Относительно изобретения это предшествующее применение или введение также упоминается как "рассчитанное по времени введение" или "рассчитанное по времени применение".-3 016817 Дальнейший предмет этой заявки состоит в способе лечения и/или способе изготовления, описанном выше/ниже, в котором предшествующее применение предпочтительно имеет место за 18-23 ч, предпочтительно 20-23 ч, более предпочтительно 20-22 ч перед применением дальнейшего противоракового котерапевтического агента; или альтернативно предпочтительно это предшествующее применение имеет место за 25-32 ч, предпочтительно 25-30 ч, и более предпочтительно 26-30 ч перед применением дальнейшего противоракового котерапевтического агента. Относительно изобретения, это предшествующее применение или введение также упоминается как "рассчитанное по времени введение" или "рассчитанное по времени применение". Однако, в более предпочтительном аспекте настоящего изобретения, рассчитанное по времени введение (независимо от того, является ли пациент человеческим или нечеловеческим животным) специфического интегринового лиганда имеет место за 1-10 ч, предпочтительно 2-8 ч, более предпочтительно 2-6 ч, еще более предпочтительно 3-8 ч, еще более предпочтительно 3-6 ч и особенно 4-8 ч до применения одного или нескольких противораковых котерапевтических агентов, например за 1-2, 1-3, 1-4, 2-3, 2-4, 26, 2-8, 2-10, 3-4, 3-10, 4-6, 4-10, 5-8 или 5-10 ч. Особенно предпочтительно, если один или несколько противораковых котерапевтических агентов включают внешнее облучение или состоят из внешнего облучения. Относительно изобретения, это предшествующее применение или введение также упоминается как"рассчитанное по времени введение" или "рассчитанное по времени применение". Относительно указанного рассчитанного по времени введения или рассчитанного по времени применения (специфического интегринового лиганда), часы, заданные для указанного предшествующего введения или применения предпочтительно касаются начала или старта соответствующего введения или применения. Соответственно, например, введение специфического интегринового лиганда, начинающееся за три часа перед применением соответствующего противоракового котерапевтического агента, должно быть расценено как рассчитанное по времени введение или рассчитанное по времени применение за 3 ч перед применением одного или нескольких противораковых котерапевтических агентов согласно изобретению, даже если специфический интегриновый лиганд вводится путем в/в инфузии, которая занимает час или два часа. Это определение предшествующего применения/предшествующего введения прекрасно соответствует пониманию специалистов, квалифицированных в данной области. Если по крайней мере один специфический интегриновый лиганд вводят пациенту при рассчитанном по времени введении, описанном авторами, оно предпочтительно рассчитано относительно одного или нескольких противораковых котерапевтических агентов, с которыми оно комбинируется. Относительно рассчитанного по времени введения специфического интегринового лиганда в комбинации с двумя или больше противораковыми котерапевтическими агентами, оно предпочтительно рассчитано относительно двух или больше противораковых котерапевтических агентов, более предпочтительно рассчитано относительно по крайней мере одного из противораковых котерапевтических агентов. Если один или несколько противораковых котерапевтических агентов включают лучевую терапию, особенно лучевую терапию, описанную авторами, рассчитанное по времени введение предпочтительно касается по крайней мере лучевой терапии. Особенно предпочтительно, рассчитанное по времени введение специфического интегринового лиганда касается лучевой терапии как зависимого от времени противоракового котерапевтического агента. Соответственно, при рассчитанном по времени введении предшествующее введение специфического интегринового лиганда предпочтительно касается времени перед введением лучевой терапии. Однако, во многих случаях, может быть выгодным также вводить один или несколько дальнейших противораковых котерапевтических агентов, кроме лучевой терапии, в пределах временного окна, заданного рассчитанным по времени введением специфического интегринового лиганда и введением или доставкой лучевой терапии. Относительно рассчитанного по времени введения по крайней мере одного специфического интегринового лиганда, предпочтительно специфический интегриновый лиганд, выбранный из группы, состоящей из цикло-(Arg-Gly-Asp-DPhe-NMe-Val), его фармацевтически приемлемых производных, сольватов и/или солей, и противораковых котерапевтических агентов темозоломида и лучевой терапии, рассчитанное по времени введение по крайней мере одного специфического интегринового лиганда предпочтительно касается введения или доставки лучевой терапии, и более предпочтительно введения или доставки лучевой терапии и введения темозоломида. Более предпочтительно, рассчитанное по времени введение специфического интегринового лиганда касается введения специфического интегринового лиганда и лучевой терапии, и дополнительный противораковый котерапевтический агент, например темозоломид, предпочтительно вводят после введения специфического интегринового лиганда, как например, за 1-2 или 1-3 ч после введение этого специфического интегринового лиганда, но предпочтительно перед введением или доставкой лучевой терапии,предпочтительно по крайней мере в течение одного часа перед введением или доставкой лучевой терапии, и более предпочтительно по крайней мере за 1 ч перед лучевой терапией, например за 1-2 или 1-3 ч перед введением или доставкой лучевой терапии. Если два или больше определенных интегриновых лиганда вводятся при рассчитанном по времени введении, описанном авторами, рассчитанный по времени и введение предпочтительно касается по край-4 016817 ней мере одного из определенных интегриновых лигандов и более предпочтительно двух или больше определенных интегриновых лигандов, которые вводятся при рассчитанном по времени введении, описанном авторами. Должно пониматься, что введение любой комбинации настоящего изобретения может произвольно сопровождаться лучевой терапией, причем лучевая терапия может предпочтительно быть проведена после введения интегринового лиганда. Введение различных агентов комбинированной терапии согласно изобретению может произвольно также быть достигнуто практически одновременно или последовательно. Известно, что опухоли выявляют альтернативные пути для их развития и роста. Если один путь блокирован, они часто имеют способность переключиться на другой путь, экспрессируя и используя другие рецепторы и сигнальные пути. Поэтому фармацевтические комбинации настоящего изобретения могут блокировать несколько из таких возможных стратегий развития опухоли и, следовательно, обеспечить различные терапевтические преимущества. Комбинации согласно настоящему изобретению полезны при лечении и профилактике опухолей, опухолеподобных и неопластических нарушений и опухолевых метастазов, которые развиваются и растут при активации их соответствующих гормональных рецепторов, которые присутствуют на поверхности опухолевых клеток. Предпочтительно различные комбинированные агенты настоящего изобретения вводятся в низкой дозе, то есть в дозе ниже, чем традиционно используется в клинических ситуациях. Преимущество от понижения дозы соединений, композиций, агентов и терапий настоящего изобретения, которые вводятся субъекту, включает уменьшение частоты неблагоприятных эффектов, связанных с более высокими дозировками. Например, понижение дозировки агента, описанного выше и ниже, приведет к сокращению частоты и степени тяжести тошноты и рвоты, по сравнению с теми, которые наблюдаются при более высоких дозировках. При понижении частоты неблагоприятных эффектов ожидается улучшение качества жизни больного раком. Дальнейшие преимущества снижения частоты неблагоприятных эффектов включают улучшение соблюдения пациентами режима терапии, сокращение числа госпитализаций, необходимых для лечения неблагоприятных эффектов, и сокращение количества введения болеутоляющих агентов, необходимых для купирования боли, связанной с неблагоприятными эффектами. Альтернативно, способы и комбинация настоящего изобретения могут также максимизировать терапевтический эффект при более высоких дозах. Опухоли, предпочтительно показывающие увеличение экспресии и стимуляции определенных молекул клеточной адгезии альфа-V-интегринового ряда, особенно V3 и V5 в их сосудистой сети, можно успешно лечить комбинациями и терапевтическим режимом согласно изобретению. Комбинации в пределах фармацевтической лечения согласно изобретению показывают удивительный синергетический эффект. При введении комбинации препаратов в течение клинических исследований могло наблюдаться реальное сокращение и распад опухоли, в то время как не было обнаружено никаких существенных неблагоприятных реакций препарата. Предпочтительные варианты осуществления настоящего изобретения касаются способа для производства лекарственного средства для рассчитанного по времени и комбинированного использования в качестве комбинированной терапии для лечения рака, лекарственного средства, включающего, предпочтительно в двух отличных (дискретных) формах применения:a) композицию, содержащую по крайней мере один специфический интегриновый лиганд; иb) по крайней мере один дополнительный противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда а), в котором a) вводят за 1-8 ч, предпочтительно 1-5 ч, и наиболее предпочтительно 1-3 ч перед применением b). Предпочтительного способа для производства лекарственного средства для рассчитанного по времени и комбинированного использования в качестве комбинированной терапии для лечения рака лекарственного средства, включающего предпочтительно в двух отличных (дискретных) формах применения:a) композицию, содержащую по крайней мере один специфический интегриновый лиганд; иb) по крайней мере один дополнительный противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a), в котором a) вводят за 1-8 ч, предпочтительно 2-6 ч, и наиболее предпочтительно 2-4 ч перед применением b). Другого предпочтительного способа для производства лекарственного средства для рассчитанного по времени и комбинированного использования в качестве комбинированной терапии для лечения рака,лекарственного средства, включающего предпочтительно в двух отличных (дискретных) формах применения:a) композицию, содержащую по крайней мере один специфический интегриновый лиганд; иb) по крайней мере один дополнительный противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a),в котором a) вводят за 2-8 ч, предпочтительно 3-6 ч и наиболее предпочтительно 3-4 ч перед применением b). Указанного лекарственного средства, в котором по крайней мере один интегриновый лиганд вы-5 016817 брано из группы, состоящей из V интегриновых ингибиторов, предпочтительно V3 ингибиторов, наиболее предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal). Указанного лекарственного средства, в котором по крайней мере один противораковый котерапевтический агент выбирается из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов, иммунотоксических агентов и лучевой терапии. Предпочтительного указанного лекарственного средства, в котором по крайней мере один противораковый котерапевтический агент выбирется из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и иммунотоксических агентов. Другого предпочтительного указанного лекарственного средства, в котором по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a) представляет собой лучевую терапию. Способа для лечения рака, характеризующегося лечением субъекта, который нуждается в таком лечении, терапевтически эффективным количеством по крайней мере одного интегринового лиганда a) и по крайней мере одного противоракового котерапевтического агента b), в котором a) вводят за 1-8 ч,предпочтительно 1-5 ч и наиболее предпочтительно 1-3 ч перед применением b). Предпочтительного способа для лечения рака, характеризующегося лечением субъекта, который нуждается в таком лечении, терапевтически эффективным количеством по крайней мере одного интегринового лиганда a) и по крайней мере одного противоракового котерапевтического агента b), в которомa) вводят за 2-8 ч, предпочтительно 2-5 ч и наиболее предпочтительно 2-4 ч перед применением b). Другого предпочтительного способа для лечения рака, характеризующегося лечением субъекта, который нуждается в таком лечении, терапевтически эффективным количеством по крайней мере одного интегринового лиганда a) и по крайней мере одного противоракового котерапевтического агента b), в котором a) вводят за 3-8 ч, предпочтительно 3-5 ч и наиболее предпочтительно 3-4 ч перед применениемb). Другого предпочтительного способа для лечения рака, характеризующегося лечением субъекта, который нуждается в таком лечении, терапевтически эффективным количеством по крайней мере одного интегринового лиганда a) и по крайней мере одного противоракового котерапевтического агента b), в котором a) вводят за 4-8 ч, предпочтительно 4-7 ч и наиболее предпочтительно 4-6 ч перед применениемb). Указанного способа, в котором по крайней мере один интегриновый лиганд выбирается из группы,состоящей из V интегриновых ингибиторов, предпочтительно V3 ингибиторов, наиболее предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal). Указанного способа, в котором по крайней мере один противораковый котерапевтический агент выбирается из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов, иммунотоксических агентов и лучевой терапии. Набора для лечения рака, включающего независимые формы дозировки:a) терапевтически эффективного количества по крайней мере одного интегринового лиганда, предпочтительно выбираемого из группы, состоящей из V интегриновых ингибиторов, предпочтительноb) терапевтически эффективного количества по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного от интегринового лиганда a), выбранного из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и иммунотоксических агентов, в котором a) вводят за 1-8 ч, предпочтительно 1-5 ч и наиболее предпочтительно 1-3 ч перед применением b). Набора для лечения рака, включающего независимые формы дозировки:a) терапевтически эффективного количества по крайней мере одного интегринового лиганда, предпочтительно отбираемого из группы, состоящей из V интегриновых ингибиторов, предпочтительноb) терапевтически эффективного количества по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного от интегринового лиганда a), выбранного из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и иммунотоксических агентов, в котором a) вводят за 2-8 ч, предпочтительно 2-5 ч и наиболее предпочтительно 2-4 ч перед применением b). Набора для лечения рака, включающего независимые формы дозировки:a) терапевтически эффективного количества по крайней мере одного интегринового лиганда, предпочтительно отбираемого из группы, состоящей из V интегриновых ингибиторов, предпочтительно V3 ингибиторов, наиболее предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal); иb) терапевтически эффективного количества по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного от интегринового лиганда a), выбранного из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и иммунотоксических агентов, в котором a) вводят за 3-8 ч (ч), предпочтительно 3-5 ч и наиболее предпочтительно 3-4 ч перед применением b). Набор для лечения рака, включающего независимые формы дозировки:a) терапевтически эффективного количества по крайней мере одного интегринового лиганда, пред-6 016817 почтительно отбираемого из группы, состоящей из V интегриновых ингибиторов, предпочтительно V3 ингибиторов, наиболее предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal); иb) терапевтически эффективного количества по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного от интегринового лиганда a), выбранного из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и иммунотоксических агентов, в котором a) вводят за 4-8 ч, предпочтительно 4-7 ч и наиболее предпочтительно 4-6 ч перед применением b). Указанный набор далее характеризуется тем, что будет преимуществом предоставить детализированные инструкции к нему и как использовать противораковый котерапевтический агент, например лучевую терапию, в связи с интегриновым лигандом в виде определенной упаковки, определенных листков-вкладышей и т.д. Поэтому дальнейший предпочтительный вариант осуществления настоящего изобретения - лекарственное средство, состоящее из интегринового лиганда как одного активного компонента, разработанного для применения перед дальнейшим противораковым котерапевтическим агентом, например лучевой терапией, и содержащийся в контейнере или подобной упаковке, в контейнере предоставляются письменные детальные инструкции и/или другая техническая информация относительно того, как использовать указанное лекарственное средство в комбинации с лучевой терапией, например относительно вышеупомянутой схемы применения. Дальнейший предпочтительный вариант осуществления настоящего изобретения - использование по крайней мере одного интегринового лиганда а) и по крайней мере одного противоракового котерапевтического агента b) для подготовки лекарственного средства для лечения рака, причем по крайней мере один интегриновый лиганд предпочтительно выбирается из группы, состоящей из V интегриновых ингибиторов, предпочтительно V3 ингибиторов, наиболее предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal) и противораковый котерапевтический агент b) выбирается из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, в котором a) вводится за 1-8 ч (ч), предпочтительно 1-5 ч и наиболее предпочтительно 1-3 ч перед применением b), и a) и b) обеспечиваются и/или формулируются в дискретные формы применения. Указанное использование, в котором орган - печень, а рак - гепатоцеллюлярная карцинома. Предпочтительный вариант осуществления настоящего изобретения, таким образом, касается соответствующей фармацевтической композиции, в которой упомянутый интегриновый лиганд представляет собой V3, V5, V6 или V8 интегриновый ингибитор; соответствующей фармацевтической композиции, в которой указанный интегриновый ингибитор представляет собой RGD-содержащий линейный или циклический пептид; и, как определенный и очень предпочтительный вариант осуществления, указанная фармацевтическая композиция, в которой указанный интегриновый лиганд представляет собой цикло(Arg-Gly-Asp-DPhe-NMeVal), произвольно в отдельных контейнерах или упаковках, химиотерапевтический агент, выбранный из любого из соединений группы: цисплатин, доксорубицин, гемцитабин,доцетаксель, паклитаксель, блеомицин; и соответствующая фармацевтическая композиция, произвольно в отдельных контейнерах или упаковках, в которой указанный интегриновый ингибитор представляет собой антитело или его функционально интактное производное, включающее участок связывания, который связывается с эпитопом интегринового рецептора, предпочтительно выбранного из группы антител или их би- или одновалентных производных (Fab'2)-(Fab'):LM609, Vitaxin, Abegrin, Abciximab (7E3),P1F6, 14D9. F8, CNTO95, их гуманизированных, химерных и де-иммунизированных версий. В другом варианте осуществления настоящего изобретения химиотерапевтический агент может представлять собой мелфалан или TNF, предпочтительно применяемые в комбинации. Должно пониматься, что все противораковые котерапевтические агенты, независимо от их природы, могут использоваться в комбинации. Например, можно использовать цисплатин, доксорубицин, гемцитабин, доцетаксель, паклитаксель, блеомицин вместе с TNF. Предпочтительный вариант осуществления настоящего изобретения касается упаковки для использования в противораковой терапии, включающей по крайней мере один интегриновый лиганд, предпочтительно ингибирующий агент V3, V5, V6 или V8 интегриновых рецепторов, более предпочтительно RGD-содержащий линейный или циклический пептид, особенно цикло(Arg-Gly-Asp-DPheNMeVal); произвольно дополнительно включая упаковку, содержащий цитотоксический агент. Дальнейший предпочтительный вариант осуществления настоящего изобретения касается соответствующего фармацевтического набора, в которомуказанный интегриновый лиганд представляет собой антитело или его активное производное, предпочтительно выбранное из группы антител: LM609, P1F6, и 14D9. F8, а также Vitaxin, Abegrin, CNTO95, Abciximab. Предпочтительный вариант осуществления настоящего изобретения касается специфического варианта осуществления изобретения, определенного фармацевтического набора, включающего:(ii) упаковку, включающую по крайней мере один химиотерапевтический агент, который выбран из любого из соединений группы: цисплатин, доксорубицин, гемцитабин, доцетаксель, паклитаксель, блеомицин и 5FU, произвольно в комбинации с TNF, для лечения рака с помощью схемы применения на-7 016817 стоящего изобретения. В дальнейшем предпочтительном варианте осуществления набор включает мелфалан и/или TNF в качестве противораковых котерапевтических агентов. Дальнейший предпочтительный вариант осуществления настоящего изобретения касается использования фармацевтической композиции или фармацевтического набора, определенного выше, ниже и в формуле изобретения, для изготовления лекарственного средства для лечения опухолей и опухолевых метастазов, в котором интегриновый лиганд a) вводят за 1-8 ч, предпочтительно 1-5 ч и наиболее предпочтительно 1-3 ч перед применением противоракового котерапевтического агента b). Другой дальнейший предпочтительный вариант осуществления настоящего изобретения касается использования фармацевтической композиции или фармацевтического набора, определенного выше,ниже и в формуле изобретения, для изготовления лекарственного средства для лечения опухолей и опухолевых метастазов, в котором интегриновый лиганд а) вводят за 2-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением противоракового котерапевтического агента b). Дальнейший предпочтительный вариант осуществления настоящего изобретения касается фармацевтического лечения или способа для лечения опухолей или опухолевых метастазов у пациента, лечения или способа, включающего введение указанному пациенту терапевтически эффективного количества агента или агентов, обладающих:(ii) противоракового котерапевтического агента в котором a) вводят за 1-8 ч, предпочтительно 1-5 ч и наиболее предпочтительно 1-3 ч перед применением b). Другой дальнейший предпочтительный вариант осуществления настоящего изобретения касается фармацевтического лечения или способа для лечения опухолей или опухолевых метастазов у пациента,лечения или способа, включающего введение указанному пациенту терапевтически эффективного количества агента или агентов, обладающих:(ii) противоракового котерапевтического агента в котором a) вводят за 2-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением b). Противораковый котерапевтический агент произвольно цитотоксический, предпочтительно химиотерапевтический агент, и указанный агент (i) представляет собой V3, V5 или V6 интегриновый ингибитор или блокирующий агент VEGF рецептора. Дальнейший предпочтительный вариант осуществления настоящего изобретения касается соответствующего способа, в котором указанный интегриновый лиганд представляет собой цикло(Arg-Gly-AspDPhe-NMeVal), и произвольно вводится вместе с цитотоксическим препаратом, выбранным из группы: цисплатин, доксорубицин, гемцитабин, доцетаксель, паклитаксель, блеомицин. Фармацевтическое лечение, использующее фармацевтические композиции и комплекты согласно изобретению, может сопровождаться одновременно или последовательно лучевой терапией. Лучевая терапия может представлять собой единственный котерапевтический агент для применения вместе с интегриновым лигандом. Фармацевтические комбинации и способы настоящего изобретения обеспечивают различные преимущества. Комбинации согласно настоящему изобретению полезны для лечения и профилактики опухолей, опухолеподобных и неопластических нарушений. Предпочтительно различные комбинированные агенты настоящего изобретения вводят в комбинации в низкой дозе, то есть в дозе ниже, чем традиционно используется в клинических ситуациях. Преимущество понижения дозы соединений, композиций,агентов и терапий настоящего изобретения, которые вводятся млекопитающему, включает уменьшение частоты неблагоприятных эффектов, связанных с более высокими дозировками. Например, понижение дозировки химиотерапевтического агента, такого как метотрексат, доксорубицин, гемцитабин, доцетаксель, паклитаксель, блеомицин, цисплатина и/или мелфалан, приводит к сокращению частоты и степени тяжести тошноты и рвоты, по сравнению с теми, что наблюдаются при более высоких дозировках. Подобные преимущества рассмотрены для соединений, композиций, агентов и терапий в комбинации с интегриновыми антагонистами настоящего изобретения. При понижении частоты неблагоприятных эффектов ожидается улучшение качества жизни больного раком. Дополнительные преимущества снижения частоты неблагоприятных эффектов включают улучшение соблюдения пациентами режима терапии, сокращение числа госпитализаций, необходимых для лечения неблагоприятных эффектов и сокращение количества введения болеутоляющих агентов, необходимых для купирования боли, связанной с неблагоприятными эффектами. Альтернативно, способы и комбинации настоящего изобретения могут также максимизировать терапевтический эффект в более высоких дозах. Детальное описание изобретения Если не указано иначе, термины и фразы, используемые в этом изобретении, предпочтительно имеют значения и определения, указанные ниже. Кроме того, эти определения и значения описывают изобретение более подробно, включая предпочтительные варианты осуществления. Если не указано иначе, ссылка на соединение, которое используется соответственно согласно изо-8 016817 бретению, предпочтительно включает ссылку на его фармацевтически приемлемые производные, сольваты и соли. Если не указано иначе, ссылка на интегриновые лиганды, интегриновые антагонисты, интегриновые агонисты, а также ссылка на противораковые котерапевтические агенты, которые являются соединениями, предпочтительно включает их фармацевтически приемлемые производные, сольваты и соли. Еще более предпочтительно ссылка на интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) также включает его фармацевтически приемлемые производные, сольваты и соли, более предпочтительно фармацевтически приемлемые сольваты и соли и особенно предпочтительно его фармацевтически приемлемые соли, если не обозначено иначе."Комбинированная терапия" предпочтительно означает комбинацию по крайней мере двух различных форм терапии, объединенных таким образом, чтобы сформировать одну терапевтическую концепцию временно контролируемым, последовательным образом. В предпочтительном варианте осуществления настоящего изобретения она означает комбинацию интегринового лиганда с дальнейшим котерапевтическим агентом. Важно отметить, что "комбинированная терапия" предпочтительно не означает отличную и/или единственную фармацевтическую композицию или лекарственное средство. И наоборот, в предпочтительном варианте осуществления настоящего изобретения интегриновый лиганд и дальнейший котерапевтический агент предоставляются в отдельных контейнерах, упаковках, лекарственных средствах, формулировках или эквивалентах. Одинаково, комбинация терапии интегриновым лигандом с лучевой терапией предпочтительно находится в пределах значения "комбинированной терапии" настоящего изобретения."Формы терапии" предпочтительно являются любыми средствами, использованиями и/или формулировками для лечения рака, известными в данной области. Поэтому термин "отличные формы терапии" означают, что комбинируются два различных средства, использования и/или формулировки для лечения рака. В контексте настоящего изобретения предпочтительно, чтобы первая применяемая форма терапии обладала противоинтегриновой активностью (синоним: интегриновый лиганд), и применялась перед второй формой терапии, предпочтительно после режима, как детализировано выше. Термин "композиция, включающая лучевую терапию" предпочтительно просто означает, что после интегринового лиганда применяется лучевая терапия. Поэтому термин "композиция, включающая лучевую терапию" в контексте настоящего изобретения предпочтительно не касается отдельной фармацевтической композиции, а фармацевтической композиции, которая используется в комбинации с лучевой терапией."Противораковый котерапевтический агент" или "котерапевтический агент" предпочтительно означает цитотоксический, хемотерапевтический или иммунотоксический агент. Одинаково предпочтительной является лучевая терапия."Рецептор" или "рецепторная молекула" является предпочтительно растворимым или связанным с мембраной или ассоциированным с мембраной белком или гликопротеином, включающим один или несколько доменов, с которыми связывается лиганд, чтобы сформировать комплекс лиганд-рецептор. При связывании лиганда, который может быть агонистом или антагонистом, рецептор активируется или инактивируется и может инициировать или блокировать путь передачи сигналов."Лиганд" или "лиганд рецептора" предпочтительно означает природное или синтетическое соединение, которое связывает молекулу рецептора для формирования комплекса лиганд-рецептор. Термин лиганд включает агонисты, антагонисты и соединения с частичной агонистической/антагонистической активностью."Агонист" или "агонист рецептора" является предпочтительно природным или синтетическим соединением, которое связывает рецептор для формирования комплекса рецептор-агонист путем активирования указанного рецептора и комплекса рецептор-агонист, соответственно, инициируя передачу сигналов и дальнейшие биологические процессы."Антагонист" или "антагонист рецептора" предпочтительно означает природное или синтетическое соединение, обладающее биологическим эффектом, противоположным эффекту агониста. Антагонист связывается с рецептором и блокирует действие агониста рецептора, конкурируя с агонистом за рецептор. Антагонист определяется его способностью блокировать действия агониста. Антагонист рецептора может быть также антителом или его иммунотерапевтически эффективным фрагментом. Предпочтительные антагонисты согласно настоящему изобретению приведены и обсуждаются ниже. Термин "интегриновые антагонисты/ингибиторы" или "антагонисты/ингибиторы интегриновых рецепторов" предпочтительно касается природной или синтетической молекулы, предпочтительно синтетической молекулы,которая блокирует и ингибирует интегриновый рецептор. В некоторых случаях термин включает антагонисты, направленные на лиганды указанных интегриновых рецепторов (такие как для V3: витронектин,фибрин, фибриноген, фактор фон Виллебранда, тромбоспондин, ламинин; для V5: витронектин; дляV1: фибронектин и витронектин; для V6: фибронектин). Антагонисты, направленные на интегриновые рецепторы, предпочтительны согласно изобретению. Антагонисты интегринов (рецепторов) могут представлять собой природные или синтетические пептиды, непептиды, пептидомиметики, иммуноглобулины, такие как антитела или их функциональные фрагменты, или иммуноконъюгаты (слитые белки).-9 016817 Предпочтительные интегриновые ингибиторы изобретения направлены на рецептор V интегринов (например, V3, V5, V6 и подклассы). Предпочтительные интегриновые ингибиторы представляют собой V антагонисты, и в особенности V3 антагонисты. Предпочтительные V антагонисты согласно изобретению представляют собой пептиды RGD, пептидоимитирующие (непептидные) антагонисты и противоинтегриновые рецепторные антитела, типа антител, блокирующих V рецепторы. Образцовые, неиммунологические V3 антагонисты описаны в руководствах США 5753230 и США 5766591. Предпочтительные антагонисты представляют собой линейные и циклические RGDсодержащие пептиды. Циклические пептиды, как правило, более устойчивы и имеют более длительный период полувыведения из сыворотки. Самый предпочтительный интегриновый антагонист изобретения,однако, представляет собой цикло-(Arg-Gly-Asp-DPhe-NMeVal) (EMD 121974, Циленгитид, MerckKGaA, Германия; EP 0770622), который является эффективным в блокировании интегриновых рецепторов V3, V1, V6, V8, llb3, и предпочтительно особенно эффективным относительно интегриновых рецепторов V3 и/или V5. Как очевидно специалистам, квалифицированным в данной области, цикло(Arg-Gly-Asp-DPhe-NMeVal) может также применяться в контексте настоящего изобретения в виде его физиологически функционального производного, физиологически приемлемого производного, сольвата и/или соли. То же самое предпочтительно также касается всех других соединений или активных компонентов, которые используются в контексте настоящего изобретения. Подходящие пептидильные, а также пептидоимитирующие (непептидные) антагонисты V3/V5/ V6 интегринового рецептора были описаны и в научной и патентной литературе. Например, ссылка сделана наWO 97/45137; WO 97/41844; WO 98/08840; WO 98/18460; WO 98/18461; WO 98/25892; WO 98/31359; WO 98/30542; WO 99/15506; WO 99/15507; WO 99/31061; WO 00/06169; EP 0853084; EP 0854 140; EP 0854145; US 5780426 и US 6048861. Патенты, которые раскрывают бензазепин, а также родственные бензодиазепиновый и бензоциклогептеновый антагонисты V3 интегринового рецептора, которые являются также подходящими для использования в этом изобретении, включают, WO 96/00574, WO 96/00730, WO 96/06087,WO 96/26190, WO 97/24119, WO 97/24122, WO 97/24124, WO 98/15278, WO 99/05107, WO 99/06049, WO 99/15170, WO 99/15178, WO 97/34865, WO 97/01540, WO 98/30542, WO 99/11626 и WO 99/15508. Другие антагонисты интегриновых рецепторов, характеризующиеся каркасными конформационными ограничениями кольца были описаны в WO 98/08840; WO 99/30709; WO 99/30713; WO 99/31099; WO 00/09503;US 5919792; US 5925655; US 5981546 и US 6017926. В US 6048861 и WO 00/72801 был раскрыт ряд нонановых кислотных производных, которые являются мощными антагонистами V3 интегринового рецептора. Другие интегриновые антагонисты (химические малые молекулы) (главным образом витронектиновые антагонисты) описаны в WO 00/38665. Другие антагонисты рецептора V3 показали эффективность в отношении ингибирования ангиогенеза. Например, синтетические антагонисты рецептора, такие как(S)-10,11-дигидро-3-[3-(пиридин-2-иламино)-1-пропилокси]-5H-дибензо[a,d]циклогептен-10 уксусная кислота (известный как SB-265123) были проверены на разных системах моделей млекопитающих (Keenan et al., 1998, Bioorg. Med. Chem. Lett. 8(22), 3171; Ward et al., 1999, Drug Metab. Dispos. 27(11), 1232). Испытание на идентификацию интегриновых антагонистов, подходящих для использования в качестве антагониста, описано, например Смитом и соавт., 1990, J. Biol. Chem. 265, 12267, и в доступной литературе, на которую ссылаются. Также известны антитела к антиинтегриновым рецепторам. Подходящие антиинтегриновые (например, V3, V5, V6), моноклональные антитела могут быть модифицированы, чтобы охватить их антигенсвязывающие фрагменты, включая F(ab)2, Fab, и генноинженерное Fv или одноцепочечное антитело. Одно подходящее и предпочтительно используемое моноклональное антитело, направленное против интегринового рецептора V3, идентифицировано как LM609(Brooks et al., 1994, Cell 79, 1157; ATCC HB 9537). Мощное специфическое анти-V5 антитело, P1F6,раскрыто в WO 97/45447, которое также является предпочтительным согласно этому изобретению. Еще одно подходящее V6 селективное антитело представляет собой MAb 14D9.F8 (WO 99/37683, DSMACC2331, Merck KGaA, Германия), селективно направленное на V-цепи интегриновых рецепторов. Другое подходящее антиинтегриновое антитело представляет собой коммерчески доступный Витраксин. Термин "антитело" или "иммуноглобулин" авторами предпочтительно используется в самом широком смысле и определенно охватывает интактные моноклональные антитела, поликлональные антитела,мультиспецифичные антитела (например, биспецифичные антитела), образованные по крайней мере из двух интактных антител, и фрагментов антител, если они демонстрируют желательную биологическую активность. Термин вообще включает гетероантитела, которые состоят из двух или больше антител или их фрагментов различной связывающей специфичности, которые соединены вместе. В зависимости от аминокислотной последовательности их константных участков интактные антитела могут быть отнесены к различным "классам антител (иммуноглобулинов)". Есть пять главных классов интактных антител:IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть далее разделены на "подклассы" (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA и IgA2. Тяжелоцепочечные константные домены, которые соответст- 10016817 вуют различным классам антител, названы , , ,и , соответственно. Предпочтительный главный класс антител согласно изобретению представляет собой IgG, более подробно IgG1 и IgG2. Антитела - обычно гликопротеины, имеющие молекулярную массу, составляющую приблизительно 150000, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. Каждая легкая цепь связана с тяжелой цепью с помощью одной ковалентной дисульфидной связи, в то время как число дисульфидных связей среди тяжелых цепей различных иммуноглобулиновых изотипов варьирует. Каждая тяжелая и легкая цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), сопровождаемый множеством константных доменов. Вариабельные участки включают гипервариабельные участки или"CDR" участки, которые содержат антигенсвязывающий участок и отвечают за специфичность антитела,и "FR" участки, которые имеют важное значение относительно аффинности/авидности антитела. Гипервариабельный участок вообще включает остатки аминокислот из "участка, определяющего комплементарность" или "CDR" (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в легкоцепочечном вариабельном домене и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в тяжелоцепочечном вариабельном домене; и/или эти остатки из "гипервариабельной петли" (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в легкоцепочечном вариабельном домене и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в тяжелоцепочечном вариабельном домене; Chothia and Lesk J. Mol, Biol. 196:901-917 (1987. "FR" остатки (каркасный участок) представляют собой остатки вариабельных доменов, кроме остатков гипервариабельных доменов, определенных авторами. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на ее другом конце. Константный домен легкой цепи выравнен с первым константным доменом тяжелой цепи, и легкоцепочечный вариабельный домен выравнен с вариабельным доменом тяжелой цепи. Определенные аминокислотные остатки, как полагают, формируют интерфейс между легкоцепочечными и тяжелоцепочечными вариабельными доменами. "Легкие цепи" антител от любых видов позвоночных могут быть отнесены к одному из двух четко отличающихся типов, названных каппаи лямбда , на основании аминокислотных последовательностей их константных доменов. Используемый авторами термин "моноклональное антитело" предпочтительно касается антитела,полученного из популяции практически гомогенных антител, то есть индивидуальные антитела, составляющие популяцию, идентичны за исключением возможных природно происходящих мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются очень специфичными, будучи направленными против единственного антигенного участка. Кроме того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела выгодны в том,что их можно синтезировать незагрязненными другими антителами. Методы для получения моноклональных антител включают гибридомный метод, описанный в Kohler and Milstein (1975, Nature 256, 495) и в "Monoclonal Antibody Technology, The Production and Characterization of Rodent and Human Hybridomas" (1985, Burdon et al., Eds, Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13,Elsevier Science Publishers, Amsterdam), или могут быть сделаны известными методами рекомбинантной ДНК (см., например, патент США 4816567). Моноклональные антитела могут также быть изолированы из фаговых библиотек антител с помощью методов, описанных в Clackson et al., Nature, 352:624-628(1991) and Marks et al., J. Mol. Biol, 222:58, 1-597(1991), например. Термин "химерное антитело" предпочтительно означает антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретных видов, или принадлежащих к определенному классу или подклассу антител, в то время как остаток цепи (ей) идентичен или гомологичен соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих другому классу или подклассу антител, а также фрагментам таких антител, пока они демонстрируют желательную биологическую активность (например: США 4816567; Morrison et al.,Proc. Nat. Acad. Sci., USA, 81:6851-6855 (1984. Методы для получения химерных и гуманизированных антител также известны в данной области. Например, методы для получения химерных антител включают описанные в патентах Boss (Celltech) и Cabilly (Genentech) (США 4816397; США 4816567). "Гуманизированные антитела" предпочтительно являются формами нечеловеческих (например, грызунов) химерных антител, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Главным образом, гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело реципиент), в которых остатки из гипервариабельного участка (CDR) реципиента заменены остатками из гипервариабельного участка нечеловеческого вида (антитела донора), такого как мышь, крыса, кролик или нечеловеческого примата, имеющего желательную специфичность,аффинность и емкость. В некоторых случаях, остатки каркасного участка (FR) человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут включать остатки, которые не обнаружены в антителе реципиента или в антителе донора. Эти модификации сделаны для дальнейшей очистки эффективности антитела. Вообще, гуманизированное антитело будет включать практически все из по крайней мере одного, и типично двух, вариабельных- 11016817 доменов, в которых все или практически все гипервариабельные петли соответствуют таковым из нечеловеческого иммуноглобулина и все или практически все из FR являются таковыми из последовательности человеческого иммуноглобулина. Гуманизированное антитело произвольно также будет включать по крайней мере часть иммуноглобулинового константного участка (Fc), типично из человеческого иммуноглобулина. Методы для получения гуманизированных антител описаны, например, в Winter (США 5225539) и Boss (Celltech, США 4816397)."Фрагменты антитела" предпочтительно включают часть интактного антитела, предпочтительно включающего его антигенсвязывающий или вариабельный участок. Примеры фрагментов антител включают Fab, Fab', F(ab')2, Fv и Fc фрагменты, диатела, линейные антитела, одноцепочечные молекулы антител; и мультиспецифические антитела, образованные из фрагмента (ов) антител. "Интактное" антитело представляет собой антитело, которое включает антигенсвязывающий вариабельный участок, а также легкоцепочечный константный домен (CL) и тяжелоцепочечные константные домены, CH1, CH2 и CH3. Предпочтительно, интактное антитело имеет одну или несколько эффекторных функций. Папаиновое расщепление антител приводит к получению двух идентичных антигенсвязывающих фрагментов, названных "Fab" фрагментами, каждый из которых включает один антигенсвязывающий участок и CL иCH1 участок, и остаточного фрагмента "Fc", название которого отражает его способность легко кристаллизоваться. "Fc" участок антител включает, как правило, CH2, CH3 и шарнирный участок главного класса IgG1 или IgG2 антител. Шарнирный участок представляет собой группу приблизительно из 15 аминокислотных остатков, которые комбинируют CH1 участок с CH2-CH3 участком. Обработка пепсином приводит к получению "F(ab')2" фрагментов, которые имеют два антигенсвязывающих участка и все еще способны к поперечному связыванию антигена. "Fv" является минимальным фрагментом антитела, который содержит целый распознающий антиген и антигенсвязывающий участок. Этот участок состоит из димера одного тяжелоцепочечного и одного легкоцепочечного вариабельного домена в тесной, нековалентной ассоциации. Именно в этой конфигурации три гипервариабельных участка (CDR) каждого вариабельного домена взаимодействуют, чтобы определить антигенсвязывающий участок на поверхностиVH-VL димера. Все вместе, шесть гипервариабельных участков придают антителу антигенсвязывающую специфичность. Однако даже единственный вариабельный домен (или половина Fv, включающая только три гипервариабельных участка, определенные для антигена) имеет способность распознавать и связывать антиген, хотя с более низкой аффинностью, чем весь связывающий участок. Fab фрагмент также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. "Fab'" фрагменты отличаются от Fab фрагментов дополнением нескольких остатков на карбоксиконце CH1 домена тяжелой цепи, включающего один или несколько цистеинов из шарнирного участка антитела.F(ab')2 фрагменты антитела первоначально были произведены как пары Fab' фрагментов, которые имеют шарнирные цистеины между ними. Другие химические сцепления фрагментов антител также известны(см. например, Hermanson, Bioconjugate Techniques, Academic Press, 1996; США 4342566). "Одноцепочечный Fv" или "scFv" фрагменты антител предпочтительно включают V, и V, домены антитела, причем эти домены присутствуют в единственной полипептидной цепи. Предпочтительно, полипептид Fv дополнительно включает полипептидный линкер между VH и VL доменами, который позволяет scFv формировать желательную структуру для связывания антигена. Одноцепочечные антитела FV известны, например, из Plckthun (The Pharmacology of Monoclonal Antibodies, Vol. 113, Rosenburg and Moore eds.,Springer-Verlag, New York, pp. 269-315 (1994, WO 93/16185; США 5571894; США 5587458; Huston et al.(1988, Proc. Natl. Acad. Sci. 85, 5879) или Skerra и Plckthun (1988, Science 240, 1038). "Биспецифичные антитела" предпочтительно являются одно-, двухвалентными антителами (или их иммунотерапевтически эффективными фрагментами), которые имеют два различных специфичных антигенсвязывающих участка. Например, первый антигенсвязывающий участок направлен на рецептор ангиогенеза (например, интегрин или рецептор VEGF), тогда как второй антигенсвязывающий участок направлен на рецептор ErbB(например, EGFR или Her 2). Биспецифичные антитела могут быть произведены химическими методами(см. например, Kranz et al. (1981) Proc. Natl. Acad. Sci. USA 785807), "полидомными" методами (см. США 4474893), или методами рекомбинантной ДНК, которые все, по существу, известны. Дальнейшие способы описаны в WO 91/00360, WO 92/05793 и WO 96/04305. Биспецифичные антитела могут также быть получены из одноцепочечных антител (см. например, Huston et al. (1988) Proc. Natl. Acad. Sci. 85, 5879;Skerra and Plckthun (1988) Science 240, 1038). Они являются аналогами вариабельных участков антител,произведенных в виде одной цепи полипептида. Чтобы сформировать биспецифичный связывающий агент, одноцепочечные антитела могут быть соединены вместе химически или способами генной инженерии, известными в данной области. Также возможно получить биспецифичные антитела согласно этому изобретению при использовании лейциновых зипперных последовательностей. Применяемые последовательности получают из лейциновых зипперных участков факторов транскрипции Fos и Jun (Landschulz et al., 1988, Science 240,1759; для обзора, см. Maniatis and Abel, 1989, Nature 341, 24). Лейциновые зипперы представляют собой специфические аминокислотные последовательности, приблизительно 2040 остатков длиной с лейцином, типично расположенным в каждом седьмом остатке. Такие зипперные последовательности формируют амфипатильные -спирали, с лейциновыми остатками, выстроенными в линию на гидрофобной стороне для образования димеров. Пептиды, соответствующие лейциновым зип- 12016817 перам Fos и Jun белков формируют предпочтительно гетеродимеры (O'Shea et al., 1989, Science 245, 646). Зиппер содержащие биспецифичные антитела и способы для их получения также раскрыты в WO 92/10209 и WO 93/11162. Биспецифичное антитело согласно изобретению может быть антителом, направленным на рецептор VEGF и рецептор V3, как обсуждалось выше относительно антител, имеющих одну специфичность."Гетероантитела" предпочтительно представляют собой два или больше антител или антигенсвязывающих фрагментов, которые соединены вместе, каждый из которых обладает различной связывающей специфичностью. Гетероантитела могут быть получены путем конъюгации двух или больше антител или фрагментов антитела. Предпочтительные гетероантитела состоят из поперечно связанныхFab/Fab' фрагментов. Для конъюгации антител могут использоваться разные сцепляющие или поперечно связывающие агенты. Примеры включают белок A, карбоимид, N-сукцинимидил-S-ацетилтиоацетатJ. EXP. Med. 160,1686; Liu et al. (1985) Proc. Natl. Acad. Sci. USA 82, 8648). Другие методы включают описанные Paulus, Behring Inst. Mitt., No. 78, 118 (1985); Brennan et al. (1985) Science 30 Method:81 orGlennie et al. (1987) J. Immunol. 139, 2367. Другой метод использует о-фенилендималеимид (oPDM) для сцепления трех Fab' фрагментов (WO 91/03493). Мультиспецифические антитела находятся в контексте этого изобретения и могут быть получены, например, согласно руководству в WO 94/13804 и WO 98/50431. Термин "слитый белок" предпочтительно касается природной или синтетической молекулы, состоящей из одного или нескольких белков или пептидов или их фрагментов, имеющих различную специфичность, которые слиты вместе произвольно с помощью линкерной молекулы. Как определенный вариант осуществления термин включает слитые конструкции, в которых по крайней мере один белок или пептид представляет собой иммуноглобулин или антитело, соответственно, или его части ("иммуноконъюгаты"). Термин "иммуноконъюгат" предпочтительно касается антитела или иммуноглобулина соответственно, или их иммунологично эффективного фрагмента, который слит ковалентной связью с не иммунологично эффективной молекулой. Предпочтительно этот слитой партнер представляет собой пептид или белок, который может быть гликозилированным. Указанная молекула неантитела может быть связана сC-концом константных тяжелых цепей антитела или с N-концами вариабельных легких и/или тяжелых цепей. Слитые партнеры могут быть связаны через линкерную молекулу, которая, как правило, представляет содержащий 3-15 аминокислотных остатков пептид. Иммуноконъюгаты согласно изобретению состоят из иммуноглобулина или его иммунотерапевтически эффективного фрагмента, направленного на рецепторную тирозинкиназу, предпочтительно ErbB (ErbBl/ErbB2) рецептор и интегриновый антагонистический пептид, или ангиогенный рецептор, предпочтительно интегрин или рецептор VEGF и TNF или слитый белок, состоящий, по существу, из TNF и IFN или другого подходящего цитокина, который связан с его N-концом к С-концу указанного иммуноглобулина, предпочтительно его Fc части. Термин включает также соответствующее слитые конструкции, включающие би- или мультиспецифичные иммуноглобулины (антитела) или их фрагменты. Термин "функционально интактное производное" означает согласно пониманию этого изобретения предпочтительно фрагмент или часть, модификацию, вариант, гомолог или де-иммунизированную форму (модификация, в которой эпитопы, которые отвечают за имунные ответы, удалены) соединения, пептида, белка, антитела (иммуноглобулина), иммуноконъюгата и т.д., который имеет преимущественно ту же самую биологическую и/или терапевтическую функцию по сравнению с оригинальным соединением,пептидом, белком, антителом (иммуноглобулином), иммуноконъюгатом и т.д. Однако термин включает также такие производные, которые выявляют уменьшенную или расширенную эффективность. Термин "цитокин" - предпочтительно родовой термин для белков, высвобожденных одной клеточной популяцией, которые действуют на другую клетку как межклеточные медиаторы. Примеры таких цитокинов включают лимфокины, монокины и традиционные полипептидные гормоны. Цитокины включают гормон роста, такой как человеческий гормона роста, N-метиониловый человеческий гормона роста и бычий гормона роста; гормон паращитовидной железы; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тироидостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); печеночный фактор роста; фибробластный фактор роста; пролактин; плацентарный лактоген; мышиный гонадотропинассоциированный пептид; ингибин; активин; сосудистый эндотелиальный фактор роста (VEGF); интегрин; тромбопоэтин (ТРО); факторы роста нервов, такой как NGF; тромбоцитарный фактор роста; трансформирующие факторы роста (TGFs), такие как TGF и TGF; эритропоэтин (EPO); интерфероны,такие как IFN, IFN и IFN; колония-стимулирующие факторы, такие как M-CSF, GM-CSF и G-CSF; интерлейкины, такие как IL-1, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; иTNF или TNF. Предпочтительные цитокины согласно изобретению - интерфероны и TNF. Используемый авторами термин "цитотоксический агент" предпочтительно касается вещества, которое ингибирует или предотвращает функцию клеток и/или вызывает разрушение клеток. Термин пред- 13016817 почтительно предназначен, чтобы включать радиоактивные изотопы, химиотерапевтические агенты и токсины, такие как ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты. Термин может включать также членов семьи цитокинов,предпочтительно IFN, а также противоопухолевые агенты, обладающие также цитотоксической активностью. Термин "химиотерапевтический агент", "хемотерапевтический агент" или "противоопухолевый агент" расценивается согласно пониманию этого изобретения предпочтительно как член класса "цитотоксических агентов", определенных выше, и включает химические вещества, которые проявляют противоопухолевые эффекты, то есть предотвращают развитие, созревание или распространение неопластических клеток, непосредственно на опухолевой клетке, например, с помощью цитостатического или цитотоксического эффектов, и непрямо через механизмы, такие как модификация биологического ответа. Подходящие химиотерапевтические агенты согласно изобретению предпочтительно природные или синтетические химические соединения, но и биологические молекулы, такие как белки, полипептиды и т.д. Есть большое количество противоопухолевых агентов, доступных в коммерческом использовании, на стадии клинической оценки и в доклинических исследованиях, которые могли бы быть включены в настоящее изобретение для лечения опухолей/неоплазий путем комбинированной терапии с TNF и антиангиогенными агентами, приведенными выше, произвольно с другими агентами, такими как антагонисты рецептора EGF. Должно быть указано, что химиотерапевтические агенты можно вводить произвольно вместе с вышеупомянутой комбинацией препаратов. Примеры химиотерапевтических агентов включают алкилирующие агенты, например азотные горчицы, этилениминовые соединения, алкилсульфонаты и другие соединения с алкилирующим действием, такие как нитрозомочевины, цисплатин и дакарбазин; антиметаболиты, например, фолиевая кислота, пуриновые или пиримидиновые антагонисты; митотические ингибиторы, например, алкалоиды барвинка и производные подофиллотоксина; цитотоксические антибиотики и камптотекиновые производные. Предпочтительные химиотерапевтические агенты или химиотерапия включают амифостин (этиол), цисплатин, дакарбазин (DTIC), дактиномицин, мехлоретамин (азотная горчица), стрептозоцин, циклофосфамид, кармустин (BCNU), ломустин (CCNU), доксорубицин (адриамицин), доксорубицин липо (доксил), гемцитабин (гемзар), даунорубицин, даунорубицин липо (дауноксом), прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фтороурацил (5-FU),винбластин, винкристин, блеомицин, паклитаксель (таксол), доцетаксель (таксотер), альдеслейкин, аспарагиназу, бусульфан, карбоплатин, кладрибин, камптотекин, СРТ-11, 10-гидрокси-7-этилкамптотекин(SN38), дакарбазин, флоксуридин, флударабин, гидроксимочевину, ифосфамид, идарубицин, месну, интерферон альфа, интерферон бета, иринотекан, митоксантрон, топотекан, лейпролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пегаспаргаза, пентостатин, пипоброман, пликамицин, стрептозоцин, тамоксифен, тенипозид, тестолактон, тиогуанин, тиотепу, урацильную горчицу, винорелбин,хлорамбуцил и их комбинации. Предпочтительные химиотерапевтические агенты согласно изобретению включают цисплатин, гемцитабин, темозоломид, доксорубицин, паклитаксель (таксол) и блеомицин. Термин "иммунотоксический" предпочтительно касается агента, который комбинирует специфичность иммуномолекулы, например антитела или его функционального эквивалента с токсическим остатком, например цитотоксической функцией, определенной выше. Дальнейшие примеры противораковых котерапевтических агентов и предпочтительно хемотерапевтических агентов, цитостатических агентов, иммуномодулирующих агентов и/или иммунотоксических агентов предпочтительно включают антитела против одной или нескольких мишеней, предпочтительно выбранных из группы, состоящей из HER, HER2, PDGF, PDGFR, EGF, EGFR, VEGF, VEGFR и/илиVEGFR2, причем указанные антитела предпочтительно выбраны из Герцептина, Бевацизумаба (rhuMAbVEGF, Авастин), Цетуксимаба (Эрбитукс) и Нимотузумаба, и предпочтительно малых молекул илиNCEs против одной или нескольких указанных мишеней, предпочтительно выбранных из группы, состоящей из Сорафениба (Нексавар), Сунитиниба (Сутент) и ZD6474 (ЗАКТИМА). В предпочтительном аспекте настоящего изобретения, хемотерапевтические агенты, цитостатические агенты, иммуномодулирующие агенты и/или иммунотоксические агенты выбираются из одной или нескольких следующих групп:h) ингибиторы протеинкиназ. В более предпочтительном аспекте настоящего изобретения, хемотерапевтический агенты, цитостатические агенты, иммуномодулирующие агенты и/или иммунотоксические агенты выбираются из одной или нескольких следующих групп:d) биологических соединенений и иммуномодуляторов, выбранных из интерферона а 2A, интерлейкина 2 и левамизола;g) алкалоидов, выбранных из таксанов, доцетакселя, паклитакселя, этопозида, винкристина, винбластина и винорелбина. В данной области известны дозирования и предпочтительно стандартные схемы введения для вышеупомянутых противораковых котерапевтические агентов. Термины "рак" и "опухоль" предпочтительно касаются или описывают физиологическое состояние у млекопитающих, которое типично характеризуется нерегулируемым ростом клеток. С помощью фармацевтических композиций соответственно настоящему изобретению опухоли можно лечить, такие как опухоли молочной железы, сердца, легкого, тонкой кишки, толстой кишки, селезенки, почки, мочевого пузыря, головы и шеи, яичника, простаты, мозга, поджелудочной железы, кожи, кости, костного мозга,крови, тимуса, матки, яичек, шейки матки и печени. Более специфично опухоль выбирается из группы,состоящей из аденомы, ангиосаркомы, астроцитомы, эпителиальной карциномы, герминомы, глиобластомы, глиомы, гамартомы, гемангиоэндотелиомы, гемангиосаркомы, гематомы, гепатобластомы, лейкемии, лимфомы, медуллобластомы, меланомы, нейробластомы, остеосаркомы, ретинобластомы, рабдомиосаркомы, саркомы и тератомы. Подробно, опухоль/рак выбираются из группы, состоящей из лентигиоза конечностей, актинического кератоза, аденокарциномы, аденоидной кистозной карциномы, аденом, аденосаркомы, аденоплоскоклеточной карциномы, астроцитарной опухоли, карциномы бартолиновой железы, базальноклеточной карциномы, карцином бронхиальных желез, капиллярной, карциноидов, карциномы, карциносаркомы,кавернозной, холангиокарциномы, хондосаркомы, папилломы/карциномы хориоидального сплетения,светлоклеточной карциномы, кистаденомы, опухоли эндодермальной пазухи, гиперплазии эндометрия,эндометриальной стромальной саркомы, эндометриоидной аденокарциномы, эпендимальной, эпителиоидной, саркомы Эвинга, фиброламеллярной, фокальной узловой гиперплазии, гастриномы, опухоли зародышевых клеток, глиобластомы, глюкагономы, гемангибластом, гемангиоэндотелиомы, гемангиом,аденомы печени, аденоматоза печени, гепатоцеллюлярной карциномы, инсулиномы, интаэпителиальной неоплазии, межэпителиальной плоскоклеточной неоплазии, инвазивной плоскоклеточной карциномы,крупноклеточной карциномы, лейомиосаркомы, ограниченного предракового меланоза, злокачественной меланомы, злокачественых мезотелиальных опухолей, медуллобластомы, медуллоэпителиомы, меланомы, менингеальной, мезотелиальной, метастатической карциномы, мукоэпидермоидной карциномы, нейробластомы, нейроэпителиальной аденокарциномы, узловой меланомы, овсяноклеточной карциномы,олигодендроглиальной, остеосаркомы, панкреатического полипептида, папиллярной серозной аденокарциномы, шишковидноклеточных, гипофизарных опухолей, плазмацитомы, псевдосаркомы, легочной бластомы, почечноклеточной карциномы, ретинобластомы, рабдомиосаркомы, саркомы, серозной карциномы, мелкоклеточной карциномы, карциномы мягких тканей, соматостатин-секретирующей опухоли,плоской карциномы, плоскоклеточной карциномы, субмезотелиальной, поверхностнораспространяющейся меланомы, недифференцированной карциномы, увеальной меланомы, сосочковой карциномы,випомы, хорошо дифференцированной карциномы и опухоли Вильма. Более предпочтительно, опухоль/рак выбирается из группы, состоящей из внутримозгового рака, рака головы-и-шеи, ректального рака, астроцитомы, предпочтительно астроцитомы стадии II, III или IV, глиобластомы, предпочтительно мультиформной глиобластомы (GBM), мелкоклеточного рака легкого (SCLC) и немелкоклеточного рака легкого (NSCLC), предпочтительно мелкоклеточного рака легкого (NSCLC), метастатической меланомы,метастатического андроген-независимого рака простаты (AIPCa), метастатического андроген-зависимого рака простаты (ADPCa) и рака молочной железы. Еще более предпочтительно, опухоль/рак выбирается из группы, состоящей из астроцитомы, предпочтительно астроцитомы стадии II, III или IV, глиобластомы, предпочтительно мультиформной глиобластомы, мелкоклеточного рака легкого (SCLC) и не мелкоклеточного рака легкого (NSCLC), предпочтительно немелкоклеточного рака легкого (NSCLC), метастатической меланомы, метастатического андроген-независимого рака простаты (AIPCa), метастатического андроген-зависимого рака простаты (ADPCa). Также более предпочтительно, опухоль/рак выбирается из метастазов, предпочтительно метастазов в головной мозг, мелкоклеточного рака легкого (SCLC) и немелкоклеточного рака легкого (NSCLC), предпочтительно немелкоклеточного рака легкого (NSCLC),- 15016817 метастатической меланомы, метастатического андроген-независимого рака простаты (AIPCa), метастатического андроген-зависимого рака простаты (ADPCa) и рака молочной железы."Фармацевтические композиции" изобретения могут включать агенты, которые уменьшают или нивелируют побочные эффекты, связанные с комбинированной терапией настоящего изобретения ("адъюнктивная терапия"), включая, кроме прочих, те агенты, например, которые уменьшают токсический эффект противораковых препаратов, например, ингибиторы резорбции костей, кардиопротективные агенты. Указанные адъюнктивные агенты предотвращают или снижают частоту тошноты и рвоты, связанных с химиотерапией, лучевой терапией или операцией, или снижают частоту инфекции, связанной с введением миелосупрессивных противораковых препаратов. Адъюнктивные агенты известны в данной области. Имуунотерапевтические агенты согласно изобретению могут дополнительно вводиться с адъювантами, такими как стимуляторы иммунной системы и BCG. Кроме того, композиции могут включать иммунотерапевтические агенты или химиотерапевтические агенты, которые содержат цитостатически эффективные меченные изотопы, или другие цитотоксические агенты, такие как цитотоксические пептиды (например, цитокины) или цитотоксические препараты и т.п. Термин "фармацевтический набор" для лечения опухоли или опухолевых метастазов касается упаковки и, как правило, инструкции для использования реагентов в способах для лечения опухолевых метастазов и опухолей. Реагент в наборе этого изобретения типично формулируется как терапевтическая композиция, описанная авторами, и поэтому может быть в любой из разных форм, подходящих для распределения в наборе. Такие формы могут включать жидкость, порошок, таблетку, суспензию и подобную формулировку для обеспечения антагониста и/или слитого белка настоящего изобретения. Реагенты можно предоставить в отдельных контейнерах, подходящих для введения отдельно согласно настоящим способам, или альтернативно можно предоставить комбинированными в композиции в одном контейнере в упаковке. Упаковка может содержать количество, достаточное для одной или нескольких дозировок реагентов согласно способам лечения, описанным авторами. Набор этого изобретения также содержит"инструкцию для использования" материалов, содержащихся в упаковке. Используемые авторами термины "фармацевтически приемлемые" и их грамматические вариации,поскольку они касаются композиций, носителей, разжижителей и реагентов, используются попеременно и означают, что эти материалы способны к введению в или на млекопитающее без производства нежелательных физиологических эффектов, таких как тошнота, головокружение, расстройство желудка и т.п. Подготовка фармакологической композиции, которая содержит активные компоненты, растворенные или диспергированные в ней, хорошо понятна в данной области и не должна быть ограничена на основании формулировки. Как правило, такие композиции готовятся в виде инъекционных или в виде жидких растворов или суспензий, однакомогут также быть приготовлены твердые формы, подходящие для раствора, или суспензии, в жидкости до использования. Препарат может также быть эмульгирован. Активный компонент может быть смешан со вспомогательными веществами, которые являются фармацевтически приемлемыми и совместимыми с активным компонентом и в количествах, подходящих для использования в терапевтических способах, описанных авторами. К подходящим вспомогательным веществам,относятся, например, вода, физиологический раствор, декстроза, глицерин, этанол или подобные и их комбинации. Кроме того, если желательно, композиция может содержать незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН буферизирующие агенты и т.п., которые увеличивают эффективность активного компонента. Терапевтическая композиция настоящего изобретения может включать фармацевтически приемлемые соли компонентов. Фармацевтически приемлемые соли включают кислотно-аддитивные соли (сформированные со свободными аминогруппами полипептида), которые образованы с неорганическими кислотами, такими например, как хлористоводородная или фосфорная кислота, или такими органическими кислотами, как уксусная, виноградная, манделовая и т.п. Соли, сформированные со свободными карбоксильными группами, могут также быть получены из неорганических оснований, таких как, например, гидроксид натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, 2 этиламиноэтанол, гистидин, прокаин и т.п. Особенно предпочтительна соль HCl при использовании в подготовке циклических полипептидных V антагонистов. Физиологически приемлемые носители известны в данной области. Примеры жидких носителей представляют собой стерильные водные растворы,которые не содержат никаких материалов в дополнение к активным компонентам и воде, или содержат буфер, типа фосфата натрия при физиологическом значении pH, физиологический раствор или оба, такие как буферизированный фосфатом физиологический раствор. Кроме того, водные носители могут содержать больше чем одну буферную соль, а также соли, такие как хлориды натрия и калия, декстроза, полиэтиленгликоли и другие растворы. Жидкие композиции могут также содержать жидкие фазы, кроме и за исключением воды. Примеры таких дополнительных жидких фаз представляют собой глицерин, растительные масла, такие как хлопковое масло и эмульсии вода-масло. Как правило, терапевтически эффективное количество иммунотерапевтического агента в форме а,например, антитела или фрагмента антитела или конъюгата антитела представляет собой количество,которое при введении в физиологически переносимой композиции является достаточным, чтобы достигнуть концентрации в плазме, составляющей приблизительно от 0,01 микрограмм (мкг) на миллилитр(мл), приблизительно до 100 мг/мл, предпочтительно приблизительно от 1 мг/мл приблизительно до 5 мг/мл и обычно приблизительно 5 мг/мл. Заявленная по-другому дозировка может варьировать приблизительно от 0,1 мг/кг приблизительно до 300 мг/кг, предпочтительно приблизительно от 0,2 мг/кг приблизительно до 200 мг/кг, наиболее предпочтительно приблизительно от 0,5 мг/кг приблизительно до 20 мг/кг, в одном или нескольких введениях дозы ежедневно в течение одной или нескольких суток. Если иммунотерапевтический агент находится в виде фрагмента моноклонального антитела или конъюгата,количество может легко быть приспособлено на основании массы фрагмента/конъюгата относительно массы целого антитела. Предпочтительная концентрация в плазме в молярной концентрации составляет приблизительно от 2 микромолярной (мкМ) приблизительно до 5 миллимолярной (мМ) и предпочтительно приблизительно от 100 мкМ до 1 мМ антагониста антитела. Терапевтически эффективное количество агента соответственно этого изобретения, который является не иммунотерапевтическим пептидом или протеинполипептидом (например, IFN-альфа), или другой маленькой молекулы подобного размера,является типично таким количеством полипептида, которое при введении в физиологически переносимой композиции является достаточным, чтобы достигнуть концентрации в плазме, составляющей приблизительно от 0,1 микрограмм (мкг) на миллилитр (мл) приблизительно до 200 мг/мл, предпочтительно приблизительно от 1 мг/мл приблизительно до 150 мг/мл. На основании полипептида, имеющего массу приблизительно 500 г на моль, предпочтительная плазменная концентрация в молярной концентрации составляет приблизительно от 2 микромолярной (мкМ) приблизительно до 5 миллимолярной (мМ) и предпочтительно приблизительно от 100 мкМ до 1 мМ антагониста полипептида. Типичная дозировка активного агента, который является предпочтительно химическим антагонистом или (химическим) химиотерапевтическим агентом согласно изобретению (ни иммунотерапевтическим агентом, ни неиммунотерапевтическим пептидом/белком) составляет от 10 до 1000 мг, предпочтительно приблизительно 20-200 мг, и более предпочтительно 50-100 мг на килограмм массы тела в сутки. Предпочтительная дозировка активного агента, который является предпочтительно химическим антагонистом или (химическим) химиотерапевтическим агентом согласно изобретению (ни иммунотерапевтическим агентом, ни не иммунотерапевтическим пептидом/белком) составляет от 0,5 до 3000 мг на пациента в сутки, более предпочтительно 10-2500 мг на пациента и в сутки, и особенно 50-1000 мг на пациента и в сутки, или на килограмм массы тела, предпочтительно приблизительно от 0,1 до 100 мг/кг и более предпочтительно от 1 мг до 50 мг/кг, предпочтительно на единицу дозировки и более предпочтительно в сутки, или, на квадратный метр поверхности тела, предпочтительно от 0,5 мг до 2000 мг/м 2, более предпочтительно 5-1500 мг/м 2 и особенно 50-1000 мг/м 2, предпочтительно на единицу дозировки и более предпочтительно в сутки. Термин "терапевтически эффективный" или "терапевтически эффективное количество" касается количества препарата, эффективного для лечения болезни или расстройства у млекопитающего. В случае рака, терапевтически эффективное количество препарата может уменьшить число раковых клеток; уменьшить размер опухоли; ингибировать (то есть замедлить до некоторой степени и предпочтительно останавить) инфильтрацию раковых клеток в периферические органы; ингибировать (то есть замедлить до некоторой степени и предпочтительно остановить) опухолевые метастазы; ингибировать, до некоторой степени, рост опухоли; и/или снизить до некоторой степени один или несколько симптомов, связанных с раком. В зависимости от степени, до которой препарат может предотвратить рост и/или убить существующие раковые клетки, он может представлять собой цитостатический и/или цитотоксический. Для противораковой терапии эффективность может, например, быть определена путем оценки времени до прогрессирования заболевания (TTP) и/или определения скорости ответа (RR). Используемый авторами термин "физиологически функциональное производное" предпочтительно касается любого фармацевтически приемлемого производного соединения, которое используется согласно настоящему изобретению, например эстера или амида, которое при введении млекопитающему обладает способностью к предоставлению (прямо или косвенно) соединения настоящего изобретения или его активного метаболита. Такие производные очевидны специалистам, квалифицированным в данной области, не прибегая к экспериментированию, и со ссылкой на руководство Burger's Medicinal ChemistryAnd Drug Discovery, 5th Edition, vol 1: Principles and Practice, которое включено авторами в том объеме,который касается физиологически функциональных производных. Используемый авторами термин "сольват" предпочтительно касается комплекса разной стехиометрии, образованного солютом (в этом изобретении, определенным интегриновым лигандом и/или дальнейшим противораковым котерапевтическим агентом (или его солью или физиологически функциональным производным и растворителем. Такие растворители для целей изобретения могут не препятствовать биологической активности солюта. Примеры подходящих растворителей включают, кроме прочих,воду, метанол, этанол и уксусную кислоту. Предпочтительно используемый растворитель фармацевтически приемлемый растворитель. Примеры подходящих фармацевтически приемлемых растворителей включают, кроме прочих, воду, этанол и уксусную кислоту. Наиболее предпочтительно используемый растворитель - вода. Фармацевтически приемлемые соли соединений, которые используются согласно изобретению, и их получение известны в данной области. Если само по себе соединение не представляет соль, оно может быть легко превращено в соль добавлением фармацевтически приемлемой кислоты или фармацевтически приемлемого основания. Фармацевтически приемлемые кислоты и осно- 17016817 вания известны в данной области, например из литературы, процитированной авторами. Соединения, которые используются согласно изобретению, предпочтительно специфический интегриновый лиганд и/или по крайней мере один дальнейший противораковый котерапевтический агент,отличный по крайней мере от одного специфического интегринового лиганда, можно вообще вводить пациенту в форме и путем или способом, которые известны в данной области для соответствующих соединений или классов соединений, например, как описано авторами, или как описано в литературе, процитированной авторами. Специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) предпочтительно применяется в качестве фармацевтически приемлемой соли, более предпочтительно фармакологически приемлемой хлористоводородной соли, и особенно предпочтительно применяется как внутренняя соль, которая представляет собой соединение цикло-(Arg-Gly-Asp-DPhe-NMeVal), как таковое. Относительно специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal), следующие виды написания названия должны предпочтительно расцениваться как эквивалентные: цикло-(Arg-Gly-Asp-DPhe-NMeVal) = цикло- (Arg-Gly-Asp-DPhe-NMe-Val) = цикло (Arg-Gly-AspDPhe-NMeVal) = цикло (Arg-Gly-Asp-DPhe-NMe-Val) = cRGDfNMeV = с (RGDfNMeV). Недавние результаты показывают, что ингибирование интегринов, особенно V3 и/или V5,обычно экспрессируемых в различных злокачественных клетках, таких как глиобластомы, может значительно уменьшать резистентность к ионизирующему облучению иначе радиорезистентных злокачественных клеток и/или могут индуцировать повышенную чувствительность злокачественных клеток к ионизирующему облучению. Ионизирующее облучение в этом отношении предпочтительно представляет собой внешнее облучение и особенно фракционированное внешнее облучение. Особенно относительно первичных опухолей головного мозга, таких как астроцитома и мультиформная глиобластома, существенный процент от пациентов умирает от рецидива, возникающего в полях облучения, вероятно в результате низкой чувствительности опухоли к облучению, вызванной активацией сигналов выживания. Эта повышенная резистентность к облучению (после этого названная "лучевая резистентность") происходит из-за модуляции различных биологических путей трансдукции сигнала и к перекрестной связи между клетками опухоли и их окружающей микросредой. Соответственно, определенные интегриновые лиганды, особенно интегриновые лиганды, специфические для V3 и/или V5 интегринов, согласно изобретению могут быть успешно применены для улучшения эффективности различных противораковых котерапевтических агентов и особенно эффективности лучевой терапии. Лучевая терапия в этом отношении предпочтительно представляет собой внешнее облучение и особенно фракционированное внешнее облучение. Глиобластома (GBM, Астроцитома, WHO стадия IV), также называемая Glioblastoma multiforma или мультиформная глиобластома, представляет собой агрессивные опухоли головного мозга с плохим прогнозом, и медианой выживания независимо от лечения, составляющей приблизительно 14-15 месяцев. Вообще, в местном масштабе инвазивные опухоли неизбежно вновь рецидивируют, независимо от проведенного лечения с помощью хирургии, химиотерапии или облучения. На текущий момент в схеме лечения ("протокол EORTC", как установлено Stupp и сотрудниками) используется градуированное RTX,сопровождаемое цитотоксическим агентом темозоломидом (см. особенно R.Stupp и соавт., NEJM 2005). Пока оно удлинило продолжительность жизни пациентов в лучшем случае на несколько месяцев. Глиобластома высоко васкуляризирована, и ангиогенный процесс необходим для развития опухоли. И сосудистая сеть GBM, и GBM по себе сверхэкспрессируют интегрин V3. Это было показано in vitro происходит для поддержки выживания клеточных линий GBM, а также является особенностью ангиогенного эндотелия, запущенного в клеточный цикл с помощью опухолевых факторов роста, таких какVEGF. Ингибирование V3 на эндотелиальных клетках и изолированных клеточных линиях глиобластомы индуцирует смерть клетки, и может активировать апоптоз. RTX также, как показано, индуцирует экспрессирование V3 на эндотелиальных клетках. Вместе эти данные свидетельствуют, что V3 может поддерживать выживание сосудистого и опухолевого участка GBM. Циленгитид - циклический пентапептид, который специфично связывается с альфа-V интегринами,особенно с V3, и ингибирует их активацию лигандами в пределах внеклеточного матрикса. Циленгитид предпочтительно вызывает апоптоз в эндотелиальных и клеточных культурах GBM. В клиническом исследовании Фазы I использовалось лечение циленгитидом в исследовании с эскалацией дозы различных опухолей головного мозга (NABT 9911). У некоторых пациентов GBM в этом исследовании был замечен признак ответа. Циленгитид (= цикло-(Arg-Gly-Asp-DPhe-NMe-Val), в очень сильный противовес большинству используемых в настоящее время противораковых терапевтических средств, имеет очень безвредный профиль побочных эффектов, без известной MTD у людей - и очень хорошо переносится. В дополнение к по существу 100% смертности у пациентов GBM (2-летняя норма выживания приблизительно 25%) заболеваемость от неврологических осложнений также быстро ухудшает качество жизни (QOL). Таким образом, цель настоящего изобретения состоит в обеспечении более эффективного и лучше- 18016817 переносимого лечения для пациентов GBM, приводящего к увеличению QOL и увеличению медианы выживания, предпочтительно также у пациентов GBM после 1-го рецидива как в лечении первой линии пациентов GBM. Таким образом, предпочтительный предмет настоящего изобретения состоит в способе леченияGBM, включающего введение Циленгитида в/в инфузией у пациентов GBM, предпочтительно пациентовGBM после 1-го рецидива, более предпочтительно у пациентов GBM с недавно установленным диагнозом (терапия 1-й линии), предпочтительно до наступления прогрессии опухоли, стабильного заболевания или излечивания. В этом способе лечения, Циленгитид предпочтительно вводят дважды еженедельно(например q3q4), предпочтительно приблизительно 1-часовой в/в инфузией, предпочтительно в растворе для инфузии, и предпочтительно или при плоской дозе на 500 мг или при плоской дозе 2000 мг. Преимущественно, MPT и неврологические признаки объективного ответа опухоли на этот способ лечения можно показать по крайней мере у 20% пациентов GBM с подтвержденной патологией, получающих терапию. Этот способ лечения может произвольно быть комбинирован, частично или полностью, с введением одного или нескольких противораковых котерапевтических агентов, предпочтительно как описано авторами. Кроме того, из-за синергистических повышающих эффективность свойств специфического интегринового лиганда Циленгитида с различным противораковыми котерапевтическими агентами, комбинация Циленгитид, по крайней мере одного химиотерапевтического средства и внешнего облучения представляет собой предпочтительный аспект настоящего изобретения. Например, стандарт лечения мультиформной глиобластомы, связывающий лучевую терапию и темозоломид, только увеличил медиану выживания пациентов после резекции на 2.5 месяца (12.114.6 месяцев) по сравнению только с лучевой терапией (Stupp и соавт., 2005). Однако в комбинации по крайней мере с одним специфическим интегриновым лигандом согласно изобретению, предпочтительно выбранному из Витаксина, Абегрина, CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбранного из Витаксина, Абегрина и цикло- (Arg-Gly-Asp-DPhe-NMe-Val) и особенно предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMe-Val), эта стандартное лечение показывает значительно улучшенную эффективность относительно увеличения медианы выживания и качества жизни. Соответственно, эта комбинация лучевой терапии, темозоломида и по крайней мере одного специфического интегринового лиганда, описанного авторами, является предпочтительным аспектом настоящего изобретения. Таким образом, комбинации по крайней мере одного специфического интегринового лиганда, описанного авторами, и по крайней мере одного противоракового котерапевтического агента, описанного авторами, могут эффективно использоваться для лечения роста внутримозговой опухоли в мозге хозяина. Рост внутримозговой опухоли в мозге хозяина согласно изобретению включает, кроме прочих, первичные опухоли головного мозга, астроцитому, такую как астроцитома стадии I-IV (WHO), и особенно мультиформную глиобластому. Рост внутримозговой опухоли предпочтительно также включает межмозговые метастазы других типов рака, предпочтительно типов рака, выбранных из мелкоклеточного рака легкого и немелкоклеточного рака легкого, предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической меланомы, метастатического андроген-независимого рака простаты,метастатического андроген-зависимого рака простаты, и более предпочтительно из рака молочной железы, мелкоклеточного рака легкого и особенно немелкоклеточного рака легкого. Таким образом, настоящее изобретение предпочтительно также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы. Более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина, CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val),предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMe-Val). Более предпочтительно изобретение также касается использованияa) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором по крайней мере один специфический интег- 19016817 риновый лиганд выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a), выбирается из лучевой терапии, предпочтительно внешнего облучения, и темозоломида. Особенно предпочтительно, изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, выбранного из цикло-(Arg-Gly-AspDPhe-NMe-Val), для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, предпочтительно более предпочтительно внешним облучением и особенно фракционированным внешним облучением. Специфический интегриновый лиганд предпочтительно применяется практически одновременно или последовательно к по крайней мере одному из противораковых котерапевтических агентов. Соответственно, один предпочтительный аспект настоящего изобретения касается использования(композиции, содержащей) по крайней мере одного специфического интегринового лиганда, включая цикло-(Arg-Gly-Asp-DPhe-NMe-Val), для изготовления лекарственного средства для лечения мультиформной глиобластомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией,предпочтительно темозоломидом и внешним облучением и особенно темозоломидом и фракционированным внешним облучением. Также в этом предпочтительном аспекте, по крайней мере специфический интегриновый лиганд предпочтительно применяется рассчитанным по времени, как описано авторами. Особенно предпочтительно, изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, выбранного из цикло-(Arg-Gly-AspDPhe-NMe-Val), для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, более предпочтительно внешним облучением и особенно фракционированным внешним облучением, в котором по крайней мере один из специфических интегриновых лигандов вводят в рассчитанном по времени введении, описанном авторами, предпочтительно за 1-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением лучевой терапии и/или темозоломида. Еще более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения глиобластомы, предпочтительно мультиформной глиобластомы, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина и цикло(Arg-Gly-Asp-DPhe-NMe-Val), в котором a) вводят в рассчитанном по времени введении, как описано авторами, предпочтительно за 1-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением b). Еще более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения глиобластомы, предпочтительно мультиформной глиобластомы, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина и цикло(Arg-Gly-Asp-DPhe-NMe-Val), и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a) выбирается из лучевой терапии, предпочтительно внешнего облучения и хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, предпочтительно темозоломида, в котором a) вводят в рассчитанном по времени введении, как описано авторами, предпочтительно за 1-8 ч (ч), предпочтительно 2-6 ч, и наиболее предпочтительно 2-4 ч перед применением b). Еще более предпочтительно, изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения глиобластомы, предпочтительно мультиформной глиобластомы, у человеческих животных, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), в котором a) вводят за 2-32 ч (ч), предпочтительно 4-24 ч, более предпочтительно 6-20 ч и наиболее предпочтительно 6-16 ч перед применением b). Еще более предпочтительно изобретение также касается использованияa) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения глиобластомы, предпочтительно мультиформной глиобластомы, у человеческих животных, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда a) выбирается из лучевой терапии, предпочтительно внешнего облучения и хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, предпочтительно темозоломида, в котором a) вводят за 2-32 ч (ч), предпочтительно 4-24 ч, более предпочтительно 6-20 ч и наиболее предпочтительно 6-16 ч перед применением b). Особенно предпочтительно изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, выбранного из цикло-(Arg-Gly-AspDPhe-NMe-Val), его фармацевтически приемлемых производных, сольватов и солей, и особенно цикло(Arg-Gly-Asp-DPhe-NMe-Val), для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге хозяина, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, предпочтительно темозоломидом и внешним облучением и особенно темозоломидом и фракционированным внешним облучением, в котором по крайней мере один из специфических интегриновых лигандов вводят в рассчитанном по времени введении, описанном авторами, предпочтительно за 1-8 ч, предпочтительно 26 ч и наиболее предпочтительно 2-4 ч перед применением лучевой терапии и/или темозоломида. Особенно предпочтительно изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, выбранного из цикло-(Arg-Gly-AspDPhe-NMe-Val) и его фармацевтически приемлемых солей, для изготовления лекарственного средства для лечения роста внутримозговой опухоли в мозге человеческого животного, предпочтительно первичных опухолей головного мозга и особенно астроцитомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, предпочтительно темозоломидом и внешним облучением и особенно темозоломидом и фракционированным внешним облучением, в котором по крайней мере один из специфических интегриновых лигандов вводят за 2-32 ч, предпочтительно 4-24 ч, более предпочтительно 6- 20 ч и наиболее предпочтительно 6-16 ч перед применением лучевой терапии и/или темозоломида. Особенно предпочтительно, изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, включая цикло-(Arg-Gly-Asp-DPheNMe-Val), для изготовления лекарственного средства для лечения мультиформной глиобластомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, предпочтительно темозоломидом и внешним облучением и особенно темозоломидом и фракционированным внешним облучением, в котором по крайней мере специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMe-Val) вводят в рассчитанном по времени введении, как описано авторами, предпочтительно за 1-24 ч, предпочтительно 1-20 ч, более предпочтительно 2-20 ч, более предпочтительно 2-16 ч, 3-16, еще более предпочтительно 3-12 ч и особенно 4-10 ч перед применением лучевой терапии и/или темозоломида. Особенно предпочтительно, изобретение также касается использования (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, включая цикло-(Arg-Gly-Asp-DPheNMe-Val), для изготовления лекарственного средства для лечения мультиформной глиобластомы, в котором лекарственное средство должно использоваться в комбинации с двумя дальнейшими противораковыми котерапевтическими агентами, темозоломидом и лучевой терапией, предпочтительно темозоломидом и внешним облучением и особенно темозоломидом и фракционированным внешним облучением, в котором по крайней мере специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMe-Val) вводят в рассчитанном по времени введении, как описано авторами, предпочтительно за 1-10 ч, предпочтительно 2-8 ч, более предпочтительно 2-6 ч, еще более предпочтительно 3-8 ч, еще более предпочтительно 3-6 ч и особенно 4-8 ч перед применением лучевой терапии и/или темозоломида. Недавние результаты in vitro показывают увеличение смерти/ухудшения состояния клеток после комбинированной обработки клеточных линий рака легкого, таких как A549, H157, H322, H460 и/илиH1975, с помощью специфических интегриновых лигандов, таких как Витаксин, Абегрин, CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), и противораковых котерапевтических агентов, таких как Цисплатин, Оксалиплатин, Винбластин, Таксол, Гемцитабин, Гливек, Иресса и лучевой терапии, предпочтительно внешнего облучения и/или фракционированного внешнего облучения. Результаты свидетельствуют, что противораковые котерапевтические агенты, такие как облучение, могут индуцировать экспрессию соответствующих интегринов в клетках рака легкого, и/или что специфический интегриновый лиганд действует как усилитель эффективности, например как усилитель лучевой терапии. Кроме того,комбинированное применение по крайней мере одного специфического интегринового лиганда и по крайней мере одного противоракового котерапевтического агента, предпочтительно облучения, приво- 21016817 дит к значительному уничтожению клеток и, таким образом, значительному уменьшению кривых выживания соответствующих обработанных клеток. Соответственно, комбинации эффективно индуцируют клеточную смерть, вероятно из-за апоптоза и/или митотической смерти клеток, в эндотелиальный клетках и опухолевых клетках, особенно в клетках рака легкого и особенно в клетках немелкоклеточного рака легкого. Степень эффекта может зависеть от степени мишеневой экспрессии, то есть интегриновой экспрессии. Таким образом, комбинации по крайней мере одного специфического интегринового лиганда, описанного авторами, и по крайней мере одного противоракового котерапевтического агента, описанного авторами, могут эффективно использоваться для лечения рака легкого, и особенно мелкоклеточного рака легкого, немелкоклеточного рака легкого и/или его метастазов. Таким образом, настоящее изобретение предпочтительно также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC). Более предпочтительно изобретение также касается использованияa) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина,CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбирается из цикло-(Arg-Gly-Asp-DPheNMe-Val) и его фармацевтически приемлемых солей. Более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегриновый лиганда a) выбирается из лучевой терапии, предпочтительно внешнего облучения, хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, предпочтительно выбирается из Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы. Еще более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина,CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбирается из цикло-(Arg-Gly-Asp-DPheNMe-Val) и его фармацевтически приемлемых солей, в котором a) вводят в рассчитанном по времени введении, описанном авторами, предпочтительно за 1-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением b). Еще более предпочтительно изобретение также касается использованияa) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина,CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбирается из цикло-(Arg-Gly-Asp-DPheNMe-Val) и его фармацевтически приемлемых солей, и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегриновый лиганда a) выбирается из лучевой терапии, предпочтительно внешнего облучения, хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, предпочтительно выбирается из Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы, в котором a) вводят в рассчитанном по времени введении, описанном авторами, предпочтительно за 1-8 ч, предпочтительно 2-6 ч и наиболее предпочтительно 2-4 ч перед применением b). Еще более предпочтительно изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), у человеческих животных, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина, CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбирается из цикло-(Arg-Gly-Asp-DPhe-NMe-Val), в котором a) вводят за 2-32 часа (ч), предпочтительно 4-24 ч, более предпочтительно 6-20 ч и наиболее предпочтительно 6-16 ч перед применением b). Еще более предпочтительно, изобретение также касается использования:a) (композиции, содержащей) по крайней мере одного специфического интегринового лиганда, иb) по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда a) для изготовления лекарственного средства для лечения рака легкого, предпочтительно немелкоклеточного рака легкого (NSCLC), у человеческих животных, в котором по крайней мере один специфический интегриновый лиганд выбирается из Витаксина, Абегрина, CNTO95 и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), предпочтительно выбирается из Витаксина, Абегрина и цикло-(Arg-Gly-Asp-DPhe-NMe-Val), более предпочтительно выбирается из цикло-(Arg-Gly-Asp-DPhe-NMe-Val) и его фармацевтически приемлемых солей, и по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегриновый лиганда а) выбирается из лучевой терапии, предпочтительно внешнего облучения,хемотерапевтических агентов, цитотоксических агентов и/или иммунотоксических агентов, предпочтительно выбирается из Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы, в котором a) вводят за 2-32 ч, предпочтительно 4-24 ч, более предпочтительно 6-20 ч и наиболее предпочтительно 6-16 ч перед применением b). Использование цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей для изготовления лекарственного средства для лечения рака, в котором лекарственное средство должно использоваться в комбинации с лучевой терапией, предпочтительно внешним облучением, в котором цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли вводят за 2-32 ч, предпочтительно 4-24 ч, более предпочтительно 6-20 ч и наиболее предпочтительно 6-16 ч перед применением лучевой терапии. В этом отношении рак предпочтительно выбирается из внутримозгового рака, рака головы-и-шеи, ректального рака, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого и особенно из мультиформной глиобластомы, рака молочной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого и их метастазов в мозг. Предмет настоящего изобретения состоит в использовании по крайней мере одного специфического интегринового лиганда, включая цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, для изготовления лекарственного средства для лечения первичных опухолей головного мозга, в котором лекарственное средство должно использоваться в комбинации с лучевой терапией, предпочтительно внешним облучением, в котором, по крайней мере, специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли вводят пациенту в количестве приблизительно 1000 мг в неделю или приблизительно 4000 мг в неделю. В одном аспекте настоящего изобретения, лекарственное средство используется в отсутствии дальнейшего противоракового котерапевтического агента. В другом аспекте настоящего изобретения лекарственное средство комбинируется с одним или несколькими дальнейшими противораковыми котерапевтическими агентами, предпочтительно противораковым котерапевтическим агентом, описанным авторами. Предмет настоящего изобретения состоит в использовании по крайней мере одного специфического интегринового лиганда, включая цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, для изготовления лекарственного средства для лечения опухолей, в котором лекарственное средство должно использоваться в комбинации с темозоломидом и/или лучевой терапией, предпочтительно внешним облучением, в котором по крайней мере специфический интегриновый лиганд цикло(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли вводят пациенту в количестве от 800 мг до 7000 мг в неделю. Предпочтительно количество цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), которое должно вводиться пациенту в неделю, вводят приблизительно равными количествами, составляющими приблизительно 500 мг или приблизительно 2000 мг для каждого введения. Более предпочтительно количество цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), вводят пациенту в количестве приблизительно 1000 мг в неделю, приблизительно 1500 мг в неделю, приблизительно 2500 мг в неделю,приблизительно 4000 мг в неделю или приблизительно 6000 мг в неделю. Предпочтительно количество приблизительно 1000 мг цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), в неделю вводится по схеме введения дважды в неделю. Предпочтительно количество приблизительно 4000 мг цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или- 23016817 его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), в неделю вводится по схеме введения дважды в неделю, предпочтительно в приблизительно равных количествах приблизительно по 2000 мг. По схеме введения дважды в неделю, введение предпочтительно осуществляется в день один и затем в день три или день четыре. Таким образом, схема введения дважды в неделю предпочтительно осуществляется или схемой чередования каждый третий день/каждый четвертый день или схемой чередования каждый четвертый день/в каждый третий день, так, например, введение по понедельникам и четвергам (как пример схемы 3/4) или по вторникам и пятницам (как еще один пример схемы 3/4), или по четвергам и понедельникам (как пример схемы 4/3) или по пятницам и вторникам (как еще один пример схемы 4/3). Схема введения дважды в неделю, предпочтительно схема введения дважды в неделю, описанная выше, может быть применена у пациента один или несколько раз. Предпочтительно, ее применяют несколько раз, еще более предпочтительно по крайней мере три раза или по крайней мере шесть раз. Например, схема введения дважды в неделю может применяться непрерывно до наступления излечивания,стабильного заболевания или прогрессии опухоли. Как правило, схема введения дважды в неделю, предпочтительно схема введения дважды в неделю, описанная выше, применяется 4-156 раз, так, например,приблизительно 4 раза, приблизительно 8 раз, приблизительно 16 раз, приблизительно 24 раза, приблизительно 35 раз, приблизительно 70 раз или приблизительно 104 раза. Схема введения дважды в неделю может быть частично или полностью комбинирована с лучевой терапией, предпочтительно лучевой терапией, описанной авторами. Предпочтительно схема введения дважды в неделю частично комбинируется с лучевой терапией. Предпочтительно количество приблизительно 1500 мг цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), в неделю вводится по схеме введения три раза в неделю, предпочтительно в приблизительно равных количествах приблизительно по 500 мг. Предпочтительно количество приблизительно 6000 мг цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), в неделю вводится по схеме введения три раза в неделю, предпочтительно в приблизительно равных количествах приблизительно по 2000 мг. По схеме введения три раза в неделю, введение предпочтительно осуществляется или в день один, в день три или в день четыре и затем в день 6, или более предпочтительно в день один, в день 3 и в день 5,затем сопровождается двумя свободными днями подряд. Последняя схема введения три раза в неделю,например, типично начинается в понедельник, затем следует одно введение в следующую среду и одно введение в пятницу, а суббота и воскресенье свободны от лечения. Эта схема введения три раза в неделю, предпочтительно схема введения три раза в неделю, описанная выше, может быть применена у пациента один или несколько раз. Предпочтительно ее применяют несколько раз, еще более предпочтительно по крайней мере три раза или по крайней мере шесть раз. Например, схема введения три раза в неделю может применяться непрерывно до наступления излечивания или прогрессии опухоли. Как правило, схема введения три раза в неделю, предпочтительно схема введения три раза в неделю, описанная выше, применяется 4-156 раз, так, например, приблизительно 4 раза,приблизительно 8 раз, приблизительно 16 раз, приблизительно 24 раза, приблизительно 35 раз, приблизительно 70 раз или приблизительно 104 раза. Схема введения три раза в неделю может быть частично или полностью комбинирована с лучевой терапией, предпочтительно лучевой терапией, описанной авторами. Предпочтительно, схема введения три раза в неделю частично комбинируется с лучевой терапией. Предпочтительно количество приблизительно 2500 мг цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемой соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), в неделю вводится по схеме введения пять раз в неделю, предпочтительно приблизительно равными количествами приблизительно по 500 мг. По схеме введения пять раз в неделю, введение предпочтительно осуществляется пять дней подряд, за которыми предпочтительно следуют 2 дня перерыва. Эта схема "введение 5 дней подряд, сопровождаемое 2 свободными днями подряд" может повторяться один или несколько раз. Предпочтительно эта вышеописанная схема "введение 5 дней подряд, сопровождаемое 2 свободными днями подряд" выполняется не раз, а предпочтительно меньше чем 18 раз, более предпочтительно 2-12 раз, еще более предпочтительно 3-8 раз и особенно 4-6 раз, например 2 раза, 3 раза, 4 раза, 5 раз, 6 раз, 8 раз или 12 раз. Особенно предпочтительно эта схема "введение 5 дней подряд, сопровождаемое 2 свободными днями подряд" применяется 6 раз. Предпочтительно эта схема "введение 5 дней подряд, сопровождаемое 2 свободными днями подряд" комбинируется с лучевой терапией, описанной авторами, предпочтительно лучевой терапией, описанной авторами, которая применяется у пациента по аналогу схемы "введение 5 дней подряд, сопровождаемое 2 свободными днями подряд", которая предпочтительно следует параллельно другой схеме,предпочтительно с теми же двумя свободными днями. Относительно описанных авторами еженедельных количеств введения и/или схем специфический- 24016817 интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли,предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), предпочтительно вводят в рассчитанном по времени введении, описанном авторами, вообще за 1,5-20 ч (ч), предпочтительно 2-16 ч, более предпочтительно 2-12 ч, еще более предпочтительно 2-10 ч, еще более предпочтительно 3-10 ч и особенно 2-8 ч перед применением лучевой терапии. Альтернативно, специфический интегриновый лиганд цикло-(ArgGly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли вводят в рассчитанном по времени введении, описанном авторами, предпочтительно за 1-10 ч (ч), предпочтительно 1-6 ч, более предпочтительно 2-8 ч, еще более предпочтительно 3-8 ч, еще более предпочтительно 3-6 ч и особенно 4-8 ч перед применением лучевой терапии. Согласно изобретению, специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), и произвольно по крайней мере один дальнейший противораковый котерапевтический агент, отличный по крайней мере от одного специфического интегринового лиганда, предпочтительно выбранного из хемотерапевтический агентов, цитотоксических агентов и/или иммунотоксических агентов, более предпочтительно выбранных из Темозоломида, Цисплатина, Оксалиплатина, Карбоплатина, 5-FU, Дакарбазина,Прокарбазина, Винбластина, Винкристина, Иринотекана, Паклитакселя, Доцетакселя, Гемцитабина, Гливека, Ирессы, Тарцевы и Нексавара, даже более предпочтительно выбранных из Темозоломида, Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы и/или выбранный из группы, состоящей из Герцептина, Бевацизумаба (rhuMAb-VEGF, Авастин), Цетуксимаба (Эрбитукс) и Нимотузумаба, и предпочтительно Сорафениба (Нексавар), Сунитиниба (Сутент) и ZD6474 (ЗАКТИМА), и лучевой терапии, предпочтительно лучевой терапии, описанной авторами, предпочтительно вводят пациенту, который нуждается в этом лечении, в дозе/способе введения/схеме дозирования, приведенных ниже: Специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal) предпочтительно вводят в плоской дозе, составляющей приблизительно 500 мг или приблизительно 2000 мг на введение, предпочтительно по еженедельной схеме введения, выбранной из схемы введения дважды в неделю, схемы введения три раза в неделю и схемы введения пять раз в неделю, предпочтительно как описано авторами,более предпочтительно по схеме введения дважды в неделю, описанной авторами, схема введения предпочтительно повторяется по крайней мере однажды, более предпочтительно по крайней мере дважды,более предпочтительно по крайней мере 5 раз и еще более предпочтительно по крайней мере 35 раз. Предпочтительно она повторяется меньше чем 150 раз, более предпочтительно меньше чем 100 раз, по крайней мере при введении без паузы, перерыва или промежутка, составляющего по крайней мере одну неделю, предпочтительно по крайней мере четыре недели. После такой паузы, промежутка или перерыва вышеупомянутая описанная схема введения может быть повторена один или несколько раз, в случае необходимости. Соответственно, вышеописанная схема введения предпочтительно применяется у пациента в течение по крайней мере 2 недель, предпочтительно по крайней мере 6 недель, более предпочтительно по крайней мере 12 недель, еще более предпочтительно по крайней мере 24 недели, и особенно по крайней мере 35 недель, например в течение приблизительно 4 недель, в течение приблизительно 6 недель, в течение приблизительно 35 недель, в течение приблизительно 36 недель, в течение приблизительно 72 недель или в течение приблизительно 120 недель. По вышеописанной схеме введения предпочтительно вводят специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal). По вышеописанной схеме введения специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), предпочтительно вводят путем в/в инфузии два раза в неделю, предпочтительно в день 1 и 4, например в понедельник и в четверг или во вторник и в пятницу, предпочтительно в течение 35 недель или по крайней мере 35 недель без паузы. По вышеописанной схеме введения введение может продолжаться до наступления прогрессии, стабильного заболевания или излечивания. Предпочтительно, введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), начинают в день 1 каждой недели. Предпочтительно, введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), комбинируется, частично или полностью, предпочтительно частично, с введением по крайней мере одного дальнейшего противоракового котерапевтического агента, отличного по крайней мере от одного специфического интегринового лиганда, причем дальнейший противораковый котерапевтический агент, предпочтительно определенный авторами, более предпочтительно выбирается из группы, состоящей из хемотерапевтических агентов, цитотоксических агентов, иммунотоксических агентов и/или лучевой терапии, и особенно предпочтительно выбирается из группы, состоящей из Темозоломида, Цисплатина, Оксалиплатина, Карбоплатина, 5-FU, Дакарбазина, Прокарбазина, Винбластина, Винкристина,Иринотекана, Паклитакселя, Доцетакселя, Гемцитабина, Гливека, Ирессы, Тарцевы и Нексавара, даже- 25016817 более предпочтительно выбирается из Темозоломида, Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы, и/или выбирается из группы, состоящей из Герцептина, Бевацизумаба (rhuMAb-VEGF, Авастин), Цетуксимаба (Эрбитукс) и Нимотузумаба, и предпочтительно Сорафениба (Нексавар), Сунитиниба (Сутент) и ZD6474 (ЗАКТИМА), и/или лучевой терапии. Предпочтительно введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), комбинируется, частично или полностью, предпочтительно частично, с введением или доставкой лучевой терапии, предпочтительно внешнего облучения и особенно фокальной лучевой терапии. Предпочтительно, лучевая терапия вводится или доставляется в один или несколько дней в течение одной или нескольких недель, в которые специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), вводится по еженедельной схеме введения, предпочтительно еженедельной схеме введения,описанной авторами. Более предпочтительно, лучевая терапия вводится или доставляется в один или несколько дней в течение одной или нескольких недель, в которые специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal) вводится по схеме введения дважды в неделю. Лучевая терапия, предпочтительно внешнее облучение и особенно фокальная лучевая терапия, предпочтительно вводится или доставляется в период от 1 до 12 недель, предпочтительно 2-10 недель, более предпочтительно 3-8 недель и особенно 4-6 недель, например приблизительно 3 недели, приблизительно 5 недель, приблизительно 6 недель, приблизительно 7 недель или приблизительно 9 недель, с введением или доставкой в 17 дней, предпочтительно 2-6 дней и особенно 3-5 дней, например, 2 дня, 3 дня, 5 дней или 7 дней, в неделю. Предпочтительно введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), комбинируется, частично или полностью, предпочтительно частично, с введением или доставкой фокальной лучевой терапии, при которой 40-70 Грэй (Gy), предпочтительно 50-66 Gy, более предпочтительно 55-62 Gy, например приблизительно 58 Gy, приблизительно 60 Gy или приблизительно 65Gy вводятся или доставляются пациенту, предпочтительно фракциями по 0,5-5 Gy, более предпочтительно 1-3 Gy и особенно 1,5-2,5 Gy, например приблизительно 1,3 Gy, приблизительно 1,6 Gy, приблизительно 1,8 Gy, приблизительно 2,0 Gy или приблизительно 2,2 Gy, на введение или доставку, которая является предпочтительно также количеством облучения в сутки, в которые происходит введение или доставка облучения. Соответственно, предпочтительно введение или доставка 1,5-2,5 Gy и предпочтительно 1,8-2,2 Gy в сутки в течение 5 дней в течение одной недели, еще более предпочтительно 5 дней подряд в течение одной недели. Вид применения фокальной лучевой терапии, описанной выше, предпочтителен при лечении первичных опухолей головного мозга, включая астроцитому, предпочтительно астроцитому стадии III и/или стадии IV, и особенно GBM. Альтернативно, введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), комбинируется, частично или полностью, предпочтительно частично, с введением или поставкой фокальной лучевой терапии, в которой 20-50 Грэй (Gy), предпочтительно 25-40 Gy, более предпочтительно 28-25 Gy, например приблизительно 28 Gy, приблизительно 30 Gy или приблизительно 35 Gy вводятся или доставляются пациенту, предпочтительно фракциями 0,5-5 Gy, более предпочтительно 0,83 Gy и особенно 1-2,5 Gy, например приблизительно 1,0, приблизительно 1,3 Gy, приблизительно 1,6 Gy,приблизительно 1,8 Gy, приблизительно 2,0 Gy, приблизительно 2,5 Gy или приблизительно 3,0 Gy, на введение или доставку, которая является предпочтительно также количеством облучения в сутки, в которые происходит введение или доставка облучения. Соответственно, предпочтительны введение или доставка 1,5-2,5 Gy и предпочтительно 1,8-2,2 Gy в сутки в течение 2 или 3 дней в течение одной недели. Соответственно, также предпочтительны введение или доставка 0,7-1,3 Gy и предпочтительно 0,9-1,2 Gy в сутки в течение 3-6 дней, предпочтительно в течение 5 дней и более предпочтительно 5 дней подряд, в течение одной недели. Вообще, особенно предпочтительны введение или доставка 1,0-3,0 Gy, предпочтительно приблизительно 1,0, приблизительно 2,0 Gy или приблизительно 3,0 Gy в сутки в течение 2 или 3 дней в течение одной недели. Вид применения фокальной лучевой терапии, описанной выше, предпочтителен при лечении метастазов в головной мозг, предпочтительно метастазов в мозг типов рака, выбранных из группы, состоящей из мелкоклеточного рака легкого и немелкоклеточного рака легкого,предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической меланомы,метастатического андроген-независимого рака простаты, метастатического андрогензависимого рака простаты. Как правило, количества приблизительно 30 Gy и приблизительно 60 Gy вводятся или доставляются пациенту в течение приблизительно шести недель подряд. Соответственно, предпочтительный предмет настоящего изобретения представляет собой способ лечения (A), включающий на пациента в течение одной недели a) введение специфического интегрино- 26016817 вого лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоской) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение; иb) введение или доставку один раз в сутки фракционируемой фокальной лучевой терапии при 1.5 к 2.5 Gy на фракцию, в течение 2-7 дней, предпочтительно 3-6 дней, более предпочтительно 5 дней и особенно предпочтительно 5 дней подряд в течение одной недели, в котором указанное лечение предпочтительно применяется у пациента в течение по крайней мере 2 недель, более предпочтительно в течение по крайней мере 2 недель подряд, еще более предпочтительно в течение по крайней мере 4 недель подряд и особенно в течение 6 или больше недель подряд, но вообще в течение менее чем 13 недель подряд, предпочтительно менее чем 11 недель подряд и еще более предпочтительно менее чем 9 недель подряд, например применение в течение 2 недель подряд, 4 недель подряд, 5 недель подряд, 6 недель подряд, 7 недель подряд или 10 недель подряд. Относительно этого способа, указанный специфический интегриновый лиганд предпочтительно вводится в дни, в которые фракционируемая фокальная лучевая терапия вводится или доставляется пациенту, более предпочтительно который вводится в рассчитанном по времени введении, описанном авторами. Относительно этого способа, указанный специфический интегриновый лиганд предпочтительно вводится в рассчитанном по времени введении, описанном авторами, более предпочтительно за 1,5-20 ч,предпочтительно 2-16 ч, более предпочтительно 2-12 ч, еще более предпочтительно 2-10 ч, еще более предпочтительно 3-10 ч и особенно 2-8 ч перед применением лучевой терапии. Вышеописанный способ лечения особенно выгоден при лечении опухолей или рака, как описано авторами, предпочтительно опухоли или рака, выбранных из группы, состоящей из первичных опухолей мозга, астроцитомы, предпочтительно астроцитомы стадии II, III и/или IV, глиобластомы, предпочтительно мультиформной глиобластомы, и метастазов в мозг других типов рака, предпочтительно выбранных из группы, состоящей из мелкоклеточного рака легкого и немелкоклеточного рака легкого, предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической меланомы, метастатического андроген-независимого рака простаты, метастатического андрогензависимого рака простаты. Вышеописанный способ лечения может произвольно быть комбинирован с дополнительным введением одного или нескольких специфических интегриновых лигандов, описанных авторами, кроме цикло(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно специфических интегриновых лигандов, выбранных из группы, состоящей из LM609, Витаксина, Абегрина, Абциксимаб, P1F6, 14D9. F8 и CNTO95, более предпочтительно Витаксина, Абегрина, CNTO95 и Абциксимаба), и/или дополнительным введением по крайней мере одного противоракового котерапевтического агента, описанного авторами, кроме лучевой терапии, предпочтительно по крайней мере одного противоракового котерапевтического агента, выбранного из группы, состоящей из Темозоломида, Цисплатина,Оксалиплатина, Карбоплатина, 5-FU, Дакарбазина, Прокарбазина, Винбластина, Винкристина, Иринотекана, Паклитакселя, Доцетакселя, Гемцитабина, Гливека, Ирессы, Тарцевы и Нексавара, даже более предпочтительно выбранное из Темозоломида, Цисплатина, Оксалиплатина, Винбластина, Таксола, Гемцитабина, Гливека и Ирессы, и/или выбранного из группы, состоящей Герцептина, Бевацизумаба (rhuMAb-VEGF, Авастин), Цетуксимаба (Эрбитукс) и Нимотузумаба, и предпочтительно Сорафениба(Нексавар), Сунитиниба (Сутент) и ZD6474 (Зактима). Соответственно, предпочтительный предмет настоящего изобретения представляет собой способ лечения (B), включающий на пациента в течение одной недели.a) введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), по схеме введения дважды в неделю, включающем приблизительно 500 мг или приблизительно 2000 мг (плоская) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение; иb) введение или доставку один раз в сутки фракционируемой фокальной лучевой терапии при 1.5 к 2.5 Gy на фракцию, в течение 2-5 дней в течение одной недели, более предпочтительно на протяжении 5 дней подряд в течение одной недели;c) введение темозоломида в течение 2-7 дней, предпочтительно 3-6 дней, более предпочтительно 5 дней и особенно предпочтительно в 5 дней подряд в течение одной недели, предпочтительно в количестве на сутки, составляющем 25-250 мг/м 2, более предпочтительно 50-150 мг/м 2, еще более предпочтительно 65-100 мг/м 2, и особенно приблизительно 75 мг/м 2; в котором указанный способ лечения предпочтительно применяется у пациента в течение по крайней мере 2 недель, более предпочтительно в течение по крайней мере 2 недель подряд, еще более предпочтительно в течение по крайней мере 4 недель подряд и особенно в течение 6 или больше недель подряд, но вообще в течение менее чем 13 недель подряд, предпочтительно менее чем 11 недель подряд и еще более предпочтительно менее чем 9 недель подряд, например он применяется в течение 2 недель подряд, 4 недель подряд, 5 недель подряд, 6 недель подряд, 7 недель подряд или 10 недель подряд. Относительно этого способа указанный специфический интегриновый лиганд предпочтительно- 27016817 вводится в дни, в которые фракционируемая фокальная лучевая терапия вводится или поставляется пациенту, более предпочтительно вводится в рассчитанном по времени введении, описанном авторами. Относительно этого способа, указанный специфический интегриновый лиганд более предпочтительно вводится в рассчитанном по времени введении, описанном авторами, более предпочтительно за 1,5-20 ч(ч), предпочтительно 2-16 ч, более предпочтительно 2-12 ч, еще более предпочтительно 2-10 ч, еще более предпочтительно 3-10 ч и особенно 2-8 ч перед применением лучевой терапии. Относительно этого способа темозоломид предпочтительно вводится перорально, предпочтительно за 15-300 мин, более предпочтительно 30-180 мин, еще более предпочтительно 45-90 мин и особенно приблизительно один час или в течение одного часа перед введением или доставкой лучевой терапии. Эта схема введения противораковых котерапевтических агентов, кроме лучевой терапии, предпочтительно темозоломида, является предпочтительно также подходящей для других способов или использований, описанных авторами. Вышеописанный способ лечения особенно выгоден при лечении опухолей или рака, как описано авторами, предпочтительно опухоли или рака, выбранных из группы, состоящей из первичных опухолей мозга, астроцитомы, предпочтительно астроцитомы стадии II, III и/или IV, глиобластомы, предпочтительно мультиформной глиобластомы, и метастазов в мозг других типов рака, предпочтительно выбранных из группы, состоящей из мелкоклеточного рака легкого и немелкоклеточного рака легкого, предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической меланомы, метастатического андрогеннезависимого рака простаты, метастатического андрогензависимого рака простаты. Соответственно, предпочтительный предмет настоящего изобретения состоит в способе леченияa) произвольно введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPheNMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPheNMeVal), предпочтительно в виде единственного агента, по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоская) цикло-(Arg-Gly-Asp-DPheNMeVal) на введение, в котором еженедельная схема введения применяется у пациента в течение по крайней мере одной недели, предпочтительно 1-12 недель, более предпочтительно 1-6 недель, еще более предпочтительно 1-3 недель и особенно 1 или 2 недель; что сопровождается предпочтительно в последовательную неделю (ii);b) введением темозоломида в течение 2-7 дней, предпочтительно 3-6 дней, более предпочтительно 5 дней и особенно предпочтительно в течение 5 дней подряд, в течение одной недели, предпочтительно в количестве в сутки, составляющем 50-350 мг/м 2, более предпочтительно 75-250 мг/м 2, еще более предпочтительно 150-250 мг/м 2, и особенно приблизительно 200 мг/м 2; предпочтительно комбинируется в течение указанной недели с введением специфического интегринового лиганда цикло-(Arg-Gly-AspDPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-AspDPhe-NMeVal), по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоская) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение, в которой стадия b) применяется у пациента по крайней мере один раз, предпочтительно 1-12 недель подряд, более предпочтительно 1-6 недель подряд, еще более предпочтительно 1-3 недели подряд и особенно одну неделю или 2 недели подряд; и в которой указанный специфический интегриновый лиганд цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемые соли, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal),предпочтительно вводится в дни, в которые также вводится темозоломид; что произвольно сопровождается, предпочтительно в последовательную неделю (и);c) введением специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), предпочтительно в виде единственного агента, по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоская) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение, в которой еженедельная схема введения применяется у пациента в течение по крайней мере одной недели, предпочтительно 1-12 недель, более предпочтительно 2-6 недель, еще более предпочтительно 2-4 недель и особенно 3 недель. Предпочтительно указанный способ лечения предпочтительно применяется у пациента по крайней мере один раз, более предпочтительно по крайней мере два раза, еще более предпочтительно по крайней мере четыре раза и особенно предпочтительно шесть или больше раз, предпочтительно шесть раз, но вообще менее чем 13 раз, предпочтительно менее чем 9 раз, еще более предпочтительно менее чем семь раз, например 3 раза, 5 раз, 6 раз, 7 раз или 6 раз, предпочтительно подряд, то есть без одной или нескольких пауз между повторением способа. Относительно этого способа, указанный специфический интегриновый лиганд более предпочтительно вводится в рассчитанном по времени введении, описанном авторами, более предпочтительно за 1,5-20 ч, предпочтительно 2-16 ч, более предпочтительно 2-12 ч, еще более предпочтительно 2-10 ч, еще более предпочтительно 3-10 ч и особенно 2-8 ч перед применением лучевой терапии. Относительно этого способа темозоломид предпочтительно вводится перорально предпочтительно аналогично тому, как описано авторами для рассчитанного по времени введения специфического интегринового лиганда, или- 28016817 предпочтительно в пределах 5 ч, предпочтительно в пределах 3 ч и особенно в пределах 1 ч перед или после, предпочтительно после доставки лучевой терапии. Вышеописанный способ лечения (C) особенно выгоден при лечении опухолей или рака как описано авторами, предпочтительно опухоли или рака, выбранных из группы, состоящей из первичных опухолей мозга, астроцитомы, предпочтительно астроцитомы стадии II, III и/или IV, глиобластомы, предпочтительно мультиформной глиобластомы, и метастазов в мозг других типов рака, предпочтительно выбранных из группы, состоящей из мелкоклеточного рака легкого и немелкоклеточного рака легкого, предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической меланомы, метастатического андроген-независимого рака простаты, метастатического андроген-зависимого рака простаты. Соответственно, предпочтительный предмет настоящего изобретения состоит в способе леченияa) в течение одной первой недели: введение темозоломида в течение 2-7 дней, предпочтительно 3-6 дней, более предпочтительно 5 дней и особенно предпочтительно в течение 5 дней подряд, предпочтительно в количестве в сутки, составляющем 50 мг/м 2 - 350 мг/м 2, более предпочтительно 75 мг/м 2 - 250 мг/м 2, еще более предпочтительно 150 мг/м 2 - 250 мг/м 2, и особенно приблизительно 200 мг/м 2; комбинированное в течение указанной первой недели с введением специфического интегринового лиганда цикло(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло(Arg-Gly-Asp-DPhe-NMeVal), по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоский) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение;b) и в непосредственно следующие недели 2, 3 и 4: введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), предпочтительно в виде единственного агента, по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоский) цикло(Arg-Gly-Asp-DPhe-NMeVal) на введение. Предпочтительно указанный способ лечения (D) применяется у пациента по крайней мере один раз,более предпочтительно по крайней мере дважды, еще более предпочтительно по крайней мере четыре раза и особенно шесть или больше раз, но вообще менее чем 24 раза, предпочтительно менее чем 15 раз,более предпочтительно менее чем 11 раз, например 3 раза, 4 раза, 5 раз, 6 раз, 7 раз или 12 раз, предпочтительно по крайней мере, при введении без паузы, перерыва или промежутка, составляющего по крайней мере одну неделю, предпочтительно по крайней мере четыре недели. После такой паузы, промежутка или перерыва, вышеупомянутая описанная схема введения может быть повторена один или несколько раз, в случае необходимости. Относительно этого способа, указанный специфический интегриновый лиганд более предпочтительно вводится в рассчитанном по времени введении, описанном авторами, более предпочтительно за 1,5-20 ч (ч), предпочтительно 2-16 ч, более предпочтительно 2-12 ч, еще более предпочтительно 2-10 ч,еще более предпочтительно 3-10 ч и особенно 2-8 ч перед применением лучевой терапии. Относительно этого способа темозоломид предпочтительно вводится перорально, предпочтительно относительно этого способа, темозоломид предпочтительно вводится перорально, предпочтительно аналогично тому, как описано авторами для рассчитанного по времени введения специфического интегринового лиганда, или предпочтительно в пределах 5 ч, предпочтительно в пределах 3 ч и особенно в пределах 1 ч перед или после, предпочтительно после, доставки лучевой терапии. Вышеописанный способ лечения (D) может произвольно быть комбинирован с одной или несколькими неделями лечения, включающими введение специфического интегринового лиганда цикло-(ArgGly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(ArgGly-Asp-DPhe-NMeVal), пациенту, предпочтительно в виде единственного агента, по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоский) цикло(Arg-Gly-Asp-DPhe-NMeVal) на введение, перед, предпочтительно непосредственно перед, и/или после,предпочтительно непосредственно после вышеописанного способа лечения (D). Предпочтительно, способ лечения (D) комбинирован с одной или несколькими неделями дополнительного лечения, включающего введение специфического интегринового лиганда цикло-(Arg-Gly-Asp-DPhe-NMeVal) и/или его фармацевтически приемлемых солей, предпочтительно цикло-(Arg-Gly-Asp-DPhe-NMeVal), пациенту,предпочтительно в виде единственного агента, по схеме введения дважды в неделю, включающей приблизительно 500 мг или приблизительно 2000 мг (плоский) цикло-(Arg-Gly-Asp-DPhe-NMeVal) на введение, по крайней мере в неделю непосредственно перед первой неделей способа лечения (D), и/или по крайней мере одной неделей указанного дополнительного лечения (с паузой или без), например до наступления прогрессии, стабильного заболевания или вылечивания. Вышеописанный способ лечения (D) особенно выгоден при лечении опухолей или рака как описано авторами, предпочтительно опухоли или рака, выбранных из группы, состоящей из первичных опухолей головного мозга, астроцитомы, предпочтительно астроцитомы стадии II, III и/или IV, глиобластомы,предпочтительно мультиформной глиобластомы, и метастазов в мозг других типов рака, предпочтительно выбранных из группы, состоящей из мелкоклеточного рака легкого и немелкоклеточного рака легкого, предпочтительно немелкоклеточного рака легкого, рака молочной железы, метастатической мелано- 29
МПК / Метки
МПК: A61K 45/06, A61K 31/4188, A61P 35/00, A61K 38/08, A61K 41/00
Метки: интегриновые, лиганды, использующая, специфическая, рака, лечения, терапия
Код ссылки
<a href="https://eas.patents.su/30-16817-specificheskaya-terapiya-ispolzuyushhaya-integrinovye-ligandy-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Специфическая терапия, использующая интегриновые лиганды для лечения рака</a>
Предыдущий патент: Способ нанесения покрытия на изделия
Следующий патент: Слитые белки, содержащие антигены отторжения опухоли ny-eso-1 и lage-1
Случайный патент: Способ быстрого развертывания спирального заграждения из колючей проволоки












