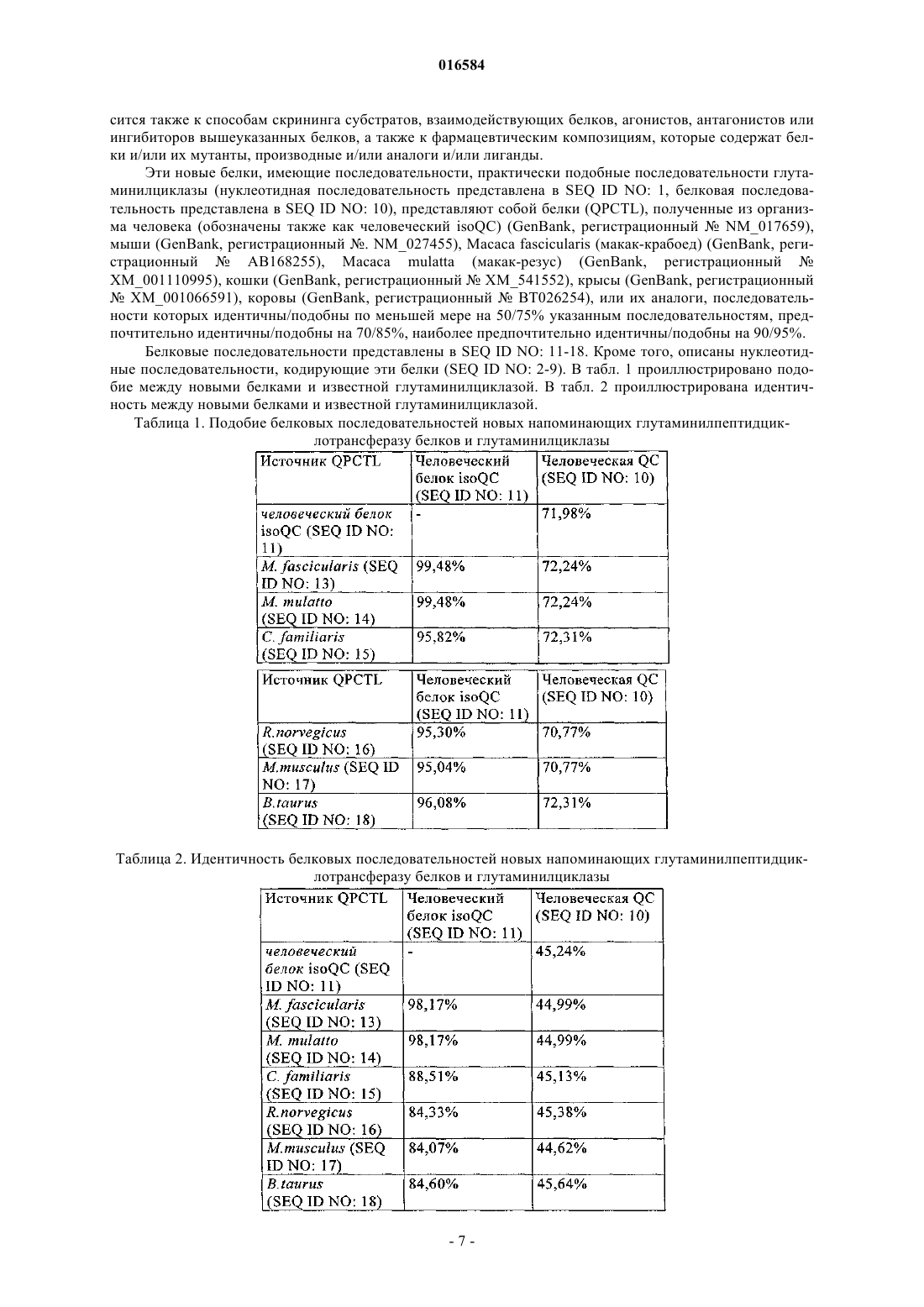
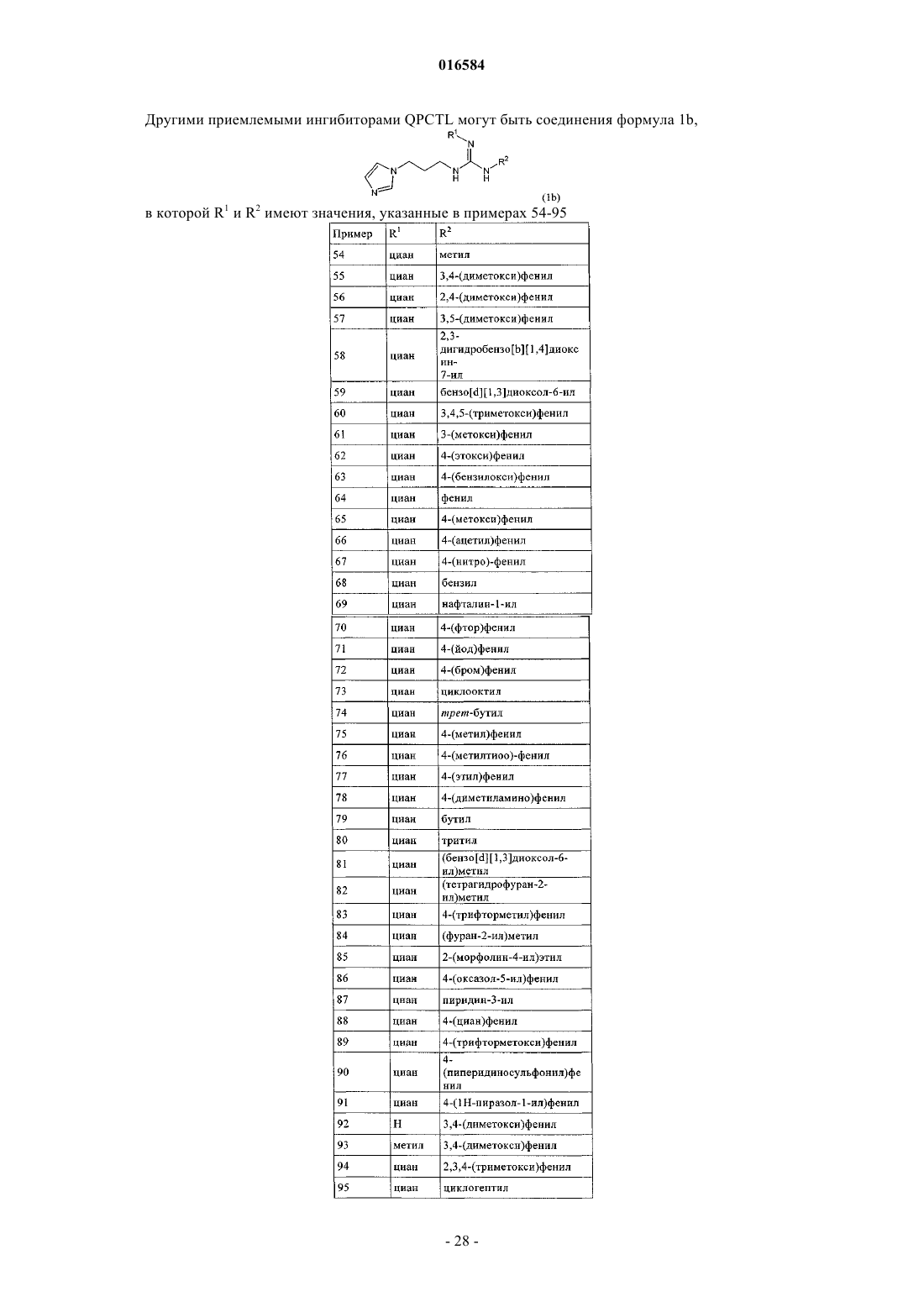
Новые гены, родственные гену глутаминилциклазы
Номер патента: 16584
Опубликовано: 30.06.2012
Авторы: Демут Ханс-Ульрих, Шиллинг Штефан, Цинис Хольгер, Рафельд Йенс-Ульрих
Формула / Реферат
1. Выделенная нуклеиновая кислота, которая кодирует (а) полипептид, включающий аминокислотную последовательность, которая представлена в одной из SEQ ID NO: 11-18, или (б) полипептид, аминокислотная последовательность которого подобна указанным выше последовательностям по меньшей мере на 75%, и который обладает такой же биологической функцией; или полученный в результате альтернативного сплайсинга вариант одной из последовательностей, представленных в SEQ ID NO: 2-9; или которая представляет собой зонд, содержащий по меньшей мере 14 смежных нуклеотидов нуклеиновой кислоты, кодирующей полипептиды, указанные в (а) или (б), или которая является комплементарной любой из вышеуказанных нуклеиновых кислот.
2. Выделенная нуклеиновая кислота по п.1, которая представляет собой ДНК или РНК.
3. Выделенная нуклеиновая кислота по п.1, которая представляет собой ДНК-транскрипт, включающий одну из полноразмерных последовательностей, представленных в SEQ ID NO: 2-9, или которая является комплементарной полной кодирующей области одной из последовательностей, представленных в SEQ ID NO: 2-9.
4. Антисмысловой олигонуклеотид к ДНК по п.3.
5. Выделенная нуклеиновая кислота по п.1, которая представляет собой РНК-транскрипт, включающий одну из полноразмерных последовательностей, представленных в SEQ ID NO: 2-9.
6. Выделенная нуклеиновая кислота по п.1, которая представляет собой полученный в результате альтернативного сплайсинга вариант одной из последовательностей, представленных в SEQ ID NO: 2-9.
7. Полученный в результате альтернативного сплайсинга вариант по п.6, соответствующий SEQ ID NO: 19 или 20.
8. Полипептид, кодируемый нуклеиновой кислотой по п.6 или 7.
9. Выделенная нуклеиновая кислота по п.1, которая кодирует полипептид, аминокислотная последовательность которого подобна по меньшей мере на 85% одной из последовательностей, представленных в SEQ ID NO: 11-18.
10. Выделенная нуклеиновая кислота по п.1, которая кодирует полипептид, аминокислотная последовательность которого подобна по меньшей мере на 95% одной из последовательностей, представленных в SEQ ID NO: 11-18.
11. Выделенная нуклеиновая кислота по п.1, которая кодирует полипептид, идентичный по меньшей мере на 50% одной из последовательностей, представленных в SEQ ID NO: 11-18.
12. Нуклеиновая кислота-зонд по п.1, содержащая по меньшей мере 14 смежных нуклеотидов одной из последовательностей, представленных в SEQ ID NO: 2-9.
13. Нуклеиновая кислота-зонд по п.12, соответствующая одной из последовательностей, представленных в SEQ ID NO: 53-61.
14. Выделенная рекомбинантная полинуклеотидная молекула, содержащая нуклеиновую кислоту по п.1 плюс контролирующие экспрессию элементы, функционально связанные с нуклеиновой кислотой для обеспечения ее экспрессии.
15. Экспрессионный вектор, содержащий нуклеиновую кислоту по п.1, кодирующую полипептид, который имеет полную аминокислотную последовательность, представленную в одной из SEQ ID NO: 11-18, функционально связанную с промотором, где экспрессионный вектор присутствует в совместимой клетке-хозяине.
16. Клетка-хозяин млекопитающего, насекомого или бактерии, созданная с помощью генной инженерии путем инсерции нуклеиновой кислоты по п.1, которая кодирует по меньшей мере часть зрелого белка, соответствующего одной из аминокислотных последовательностей, представленных в SEQ ID NO: 11-18.
17. Способ получения полипептида, включающего часть зрелого белка, соответствующего одной из последовательностей, представленных в SEQ ID NO: 11-18, заключающийся в том, что культивируют клетку-хозяина по п.16 в условиях, достаточных для получения указанного полипептида.
18. Способ по п.17, в котором полипептид экспрессируют на поверхности указанной клетки и который дополнительно включает стадию, на которой выделяют полипептид или его фрагмент из культуры.
19. Полипептид, который может быть необязательно гликозилированным и который (а) имеет аминокислотную последовательность зрелого белка, представленную в одной из SEQ ID NO: 11-18; (б) имеет аминокислотную последовательность зрелого белка, подобную по меньшей мере на 75% одному из зрелых белков, указанных в (а), и который обладает такой же биологической функцией; (в) имеет аминокислотную последовательность зрелого белка, которая по меньшей мере на 50% идентична зрелому белку, представленному в одной из SEQ ID NO: 11-18; или (г) представляет собой иммунологически реактивный фрагмент белка, указанного в (а).
20. Полипептид по п.19, представляющий собой зрелый белок, подобный по меньшей мере на 85% зрелому белку, указанному в (а).
21. Полипептид по п.19, представляющий собой зрелый белок, подобный по меньшей мере на 95% зрелому белку, указанному в (а).
22. Полипептид по п.19, имеющий аминокислотную последовательность зрелого белка, представленную в одной из SEQ ID NO: 11-18, или его фрагмент, обладающий такой же биологической функцией, что и соответствующий зрелый белок.
23. Антитело, которое распознает полипептид или его фрагмент по одному из пп.19-22.
24. Антитело по п.23, которое распознает полипептид, имеющий аминокислотную последовательность, представленную в одной из SEQ ID NO: 11-18.
25. Способ скрининга соединения, которое обладает способностью ингибировать ферментативную активность по меньшей мере одного зрелого белка по п.19, заключающийся в том, что инкубируют зрелый белок и приемлемый субстрат для зрелого белка в присутствии одного или нескольких исследуемых соединений или их солей, оценивают ферментативную активность зрелого белка, сравнивают активность с соответствующей активностью, определенной в отсутствие исследуемого соединения, и отбирают исследуемое(ые) соединение или соединения, которое(ые) снижает(ют) ферментативную активность.
26. Способ скрининга избирательного ингибитора глутамилциклазы, который не ингибирует ферментативную активность по меньшей мере одного зрелого белка по п.19, заключающийся в том, что ингибируют зрелый белок и приемлемый субстрат для зрелого белка в присутствии одного или нескольких ингибиторов глутамилциклазы или их солей, оценивают ферментативную активность зрелого белка, сравнивают активность с соответствующей активностью, определенной в отсутствие ингибитора глутамилциклазы, и отбирают соединение, которое не снижает ферментативную активность зрелого белка.
27. Способ скрининга избирательного ингибитора белка глутаминилпептидциклотрансферазы, который не ингибирует ферментативную активность глутамилциклазы, заключающийся в том, что инкубируют глутамилциклазы в присутствии одного или нескольких ингибиторов белка глутаминилпептидциклотрансферазы или их солей, оценивают ферментативную активность глутамилциклазы, сравнивают активность с соответствующей активностью, определенной в отсутствие ингибитора белка глутаминилпептидциклотрансферазы, и отбирают соединение, которое не снижает ферментативную активность белка глутаминилпептидциклотрансферазы.
28. Антагонист белка глутаминилпептидциклотрансферазы, который ингибирует биологическую функцию одного из зрелых белков по одному из пп.19-22.
29. Антагонист белка глутаминилпептидциклотрансферазы по п.28, который представляет собой низкомолекулярный ингибитор.
30. Ингибитор по п.29, идентифицированный с помощью способа скрининга по п.25 или 27.
31. Избирательный ингибитор глутамилциклазы, идентифицированный с помощью способа скрининга по п.26.
32. Фармацевтическая композиция, предназначенная для парентерального, энтерального или орального введения, содержащая по меньшей мере один ингибитор белка глутаминилпептидциклотрансферазы или его фармацевтически приемлемую соль, необязательно в сочетании с общепринятыми носителями и/или эксципиентами.
33. Применение фармацевтической композиции по п.32 для приготовления лекарственного средства, предназначенного для предупреждения или лечения заболевания, выбранного из группы, включающей болезнь Альцгеймера, семейную британскую деменцию, семейную датскую деменцию, синдром Дауна, болезнь Гентингтона, болезнь Кеннеди, язвенную болезнь, рак двенадцатиперстной кишки, связанный и несвязанный с заражением Helicobacter pyloris, колоректальный рак, синдром Золлингера-Эллисона, рак желудка, связанный и несвязанный с заражением Helicobacter pylori, патогенные психические состояния, шизофрению, бесплодие, неоплазию, воспалительные реакции хозяина, рак, злокачественные метастазы, меланому, псориаз, ревматоидный артрит, атеросклероз, нарушенные гуморальные и клеточно-опосредуемые иммунные ответы, нарушенные процессы адгезии и миграции лейкоцитов в эндотелий, нарушенное всасывание пищи, нарушенный сон, нарушенная связанная с гомеостазом регуляция энергетического метаболизма, нарушенная функция вегетативной нервной системы, нарушенный гормональный баланс и нарушенная регуляция общей воды организма, рассеянный склероз, синдром Гийена-Барре и хроническую воспалительную демиелинизирующую полирадикулоневропатию.
34. Применение ингибитора белка глутаминилпептидиклотрансферазы или его фармацевтически приемлемой соли для приготовления лекарственного средства, предназначенного для предупреждения или лечения заболевания, выбранного из группы, включающей болезнь Альцгеймера, семейную британскую деменцию, семейную датскую деменцию, синдром Дауна, болезнь Гентингтона, болезнь Кеннеди, язвенную болезнь, рак двенадцатиперстной кишки, связанный и несвязанный с заражением Helicobacter pyloris, колоректальный рак, синдром Золлингера-Эллисона, рак желудка, связанный и несвязанный с заражением Helicobacter pylori, патогенные психические состояния, шизофрению, бесплодие, неоплазию, воспалительные реакции хозяина, рак, злокачественные метастазы, меланому, псориаз, ревматоидный артрит, атеросклероз, нарушенные гуморальные и клеточно-опосредуемые иммунные ответы, нарушенные процессы адгезии и миграции лейкоцитов в эндотелий, нарушенное всасывание пищи, нарушенный сон, нарушенная связанная с гомеостазом регуляция энергетического метаболизма, нарушенная функция вегетативной нервной системы, нарушенный гормональный баланс и нарушенная регуляция общей воды организма, рассеянный склероз, синдром Гийена-Барре и хроническую воспалительную демиелинизирующую полирадикулоневропатию.
35. Применение по одному из пп.33-34, где ингибитор белка глутаминилпептидциклотрансферазы представляет собой конкурентный ингибитор.
36. Применение по одному из пп.33-35, где ингибитор белка глутаминилпептидциклотрансферазы связывается с активным сайтом белка глутаминилпептидциклотрансферазы, связанным с ионом металла.
37. Применение по одному из пп.33-36, где последовательность белка глутаминилпептидциклотрансферазы выбрана из одной из последовательностей, представленных в SEQ ID NO: 11-18, 21 и 22.
38. Применение по п.37, где последовательность белка глутаминилпептидциклотрансферазы выбрана из одной из последовательностей, представленных в SEQ ID NO: 11 и 12.
39. Применение по одному из пп.33-38, в которых применяют ингибитор по одному из пп.28-30.
40. Способ диагностики заболевания и/или состояния, выбранного из группы, включающей болезнь Альцгеймера, семейную британскую деменцию, семейную датскую деменцию, синдром Дауна, болезнь Гентингтона, болезнь Кеннеди, язвенную болезнь, рак двенадцатиперстной кишки, связанный и несвязанный с заражением Helicobacter pyloris, колоректальный рак, синдром Золлингера-Эллисона, рак желудка, связанный и несвязанный с заражением Helicobacter pylori, патогенные психические состояния, шизофрению, бесплодие, неоплазию, воспалительные реакции хозяина, рак, злокачественные метастазы, меланому, псориаз, ревматоидный артрит, атеросклероз, нарушенные гуморальные и клеточно-опосредуемые иммунные ответы, нарушенные процессы адгезии и миграции лейкоцитов в эндотелий, нарушенное всасывание пищи, нарушенный сон, нарушенная связанная с гомеостазом регуляция энергетического метаболизма, нарушенная функция вегетативной нервной системы, нарушенный гормональный баланс и нарушенная регуляция общей воды организма, рассеянный склероз, синдром Гийена-Барре и хроническую воспалительную демиелинизирующую полирадикулоневропатию, включающий этапы
получения образца из индивидуума, который, как ожидается, поражен указанным заболеванием и/или состоянием,
контактирования с ингибитором глутаминилпептидциклотрансферазы и
определения, поражен ли индивидуум указанным заболеванием и/или состоянием.
41. Способ по п.40, в котором индивидуум представляет собой человека.
42. Способ по п.40 или 41, в котором образец представляет собой образец крови, образец сыворотки, образец спинно-мозговой жидкости или образец мочи.
43. Диагностический набор для осуществления способа по пп.40-42, содержащий в качестве средства выявления набор для диагностического анализа, включающий ингибитор белка, подобного глутаминилпептидциклотрансферазе, и средства измерения.
Текст
В патенте описаны новые белки, напоминающие глутаминилпептидциклотрансферазу (QPCTL),которые являются изозимами глутаминилциклазы (QC, К.Ф. 2.3.2.5), и выделенные нуклеиновые кислоты, кодирующие эти изозимы, которые все можно применять для выявления новых терапевтических агентов, измерения циклазной активности и для определения ингибирующей активности соединений в отношении этих изозимов глутаминилциклазы. 016584 Область техники, к которой относится изобретение Изобретение относится к новым белкам, напоминающим глутаминилпептидциклотрансферазу(QPCTL), которые представляют собой изозимы глутаминилциклазы (QC, К.Ф. 2.3.2.5), и к выделенным нуклеиновым кислотам, кодирующим эти изозимы, которые все можно применять для разработки новых терапевтических агентов, для оценки циклазной активности и для определения ингибирующей активности соединений в отношении этих изозимов глутаминилциклазы. Предпосылки создания изобретения Глутаминилциклаза (QC, К.Ф. 2.3.2.5) катализирует внутримолекулярную циклизацию N-концевых остатков глутамина с образованием пироглутаминовой кислоты (pGlu) с выделением в свободном состоянии аммиака. QC впервые была выделена Messer из латекса тропического растения Carica papaya в 1963 г. (Messer M., Nature 4874, 1963, с. 1299). Спустя 24 года соответствующая ферментативная активность была обнаружена в гипофизе животных (Busby W. Н. J. и др., J Biol Chem 262, 1987, cc. 8532-8536;Fischer W. Н. и Spiess J., Proc Natl Acad Sci USA 84, 1987, cc. 3628-3632). Касательно QC млекопитающих, превращение Gln в pGlu с помощью QC было обнаружено для предшественников TRH (тиреолиберин) и GnRH (гонадолиберин) (Busby W. H. J. и др., J Biol Chem 262, 1987, cc. 8532-8536; Fischer W. H. иSpiess J., Proc Natl Acad Sci USA 84, 1987, cc. 3628-3632). Кроме того, первые эксперименты по выявлению локализации QC позволили обнаружить ее совместную локализацию с предполагаемыми продуктами катализа в бычьем гипофизе, что является дополнительным доказательством ее участия в синтезе пептидных гормонов (Bockers Т. М. и др. J. Neuroendocrinol 7, 1995, cc. 445-453). В противоположность этому, физиологическая функция растительной QC является менее изученной. Предполагается, что фермент из С. papaya играет роль в защите растений от патогенных микроорганизмов (El Moussaoui А. и др.,Cell Mol Life Sci 58, 2001, cc. 556-570). В настоящее время на основе сравнительного анализа последовательностей были выявлены предполагаемые QC из других растений (Dahl S. W. и др., Protein Expr Purif 20, 2000, cc. 27-36). Однако физиологическая функция этих ферментов все еще остается неясной. Известные выделенные из растений и животных QC обладают строгой специфичностью в отношении L-глутамина в N-концевом положении субстратов, и установлено, что их кинетические характеристики описываются уравнением Михаэлиса-Ментен (Pohl Т. и др., Proc Natl Acad Sci USA 88, 1991, cc. 10059-10063; Consalvo A. P. и др., Anal Biochem 175, 1988, cc. 131-138; Gololobov M. Y. и др., Biol ChemHoppe Seyler 377, 1996, cc. 395-398). Однако сравнение первичных структур QC из С. papaya и высококонсервативных QC млекопитающих не выявило никакой гомологии последовательностей (Dahl S. W. и др., Protein Expr Purif 20, 2000, cc. 27-36). В то время как растительные QC, вероятно, принадлежат к новому семейству ферментов (Dahl S. W. и др., Protein Expr Purif 20, 2000, cc. 27-36), установлено, что QC млекопитающих обладают выраженной гомологией последовательностей с бактериальными аминопептидазами (Bateman R. С. и др., Biochemistry 40, 2001, cc. 11246-11250), это позволило сделать заключение о различном эволюционном происхождении QC из растений и животных. В настоящее время установлено, что не рекомбинантная человеческая QC, а обладающие QCактивностью экстракты, выделенные из головного мозга, катализируют циклизацию как N-концевого глутаминила, так и глутамата. Более конкретно, установлено, что для катализируемого циклазой Glu1 превращения оптимальным является значение рН, близкое к 6,0, а для Gln1-превращения в pGluпроизводные оптимальным является значение рН, близкое к 8,0. Поскольку образование пептидов, родственных pGlu-A, можно подавлять путем ингибирования рекомбинантной человеческой QC и QCактивности экстрактов, выделенных из гипофиза свиньи, то фермент QC является мишенью для разработки лекарственных средств, предназначенных для лечения болезни Альцгеймера. В ЕР 02011349.4 описаны полинуклеотиды, кодирующие глутаминилциклазу насекомых, а также кодируемые ими полипептиды. В этой заявке описаны также клетки-хозяева, которые содержат экспрессионные векторы, несущие полинуклеотиды, предлагаемые в изобретении. Выделенные полипептиды и клетки-хозяева, содержащие QC насекомых, применяют в методах скрининга агентов, которые снижают глутаминилциклазную активность. Такие агенты можно применять в качестве пестицидов. Ингибиторы QC, которые можно применять также в качестве ингибиторов изозимов QC, описаны вWO 2004/098625, WO 2004/098591, WO 2005/039548 и WO 2005/075436, которые полностью включены в настоящее описание в качестве ссылки, прежде всего в части, касающейся структуры ингибиторов, их применения и получения. Определения Ингибиторы ферментов Обратимые ингибиторы ферментов: включают конкурентные ингибиторы, неконкурентные обратимые ингибиторы, медленно связывающиеся или прочно связывающиеся ингибиторы, аналоги переходного состояния и мультисубстратные аналоги. Для конкурентных ингибиторов характерно:I) нековалентные взаимодействия с ферментом,II) конкуренция с субстратом за активный сайт фермента. Основной механизм действия обратимого ингибитора фермента и определение константы диссоциации можно проиллюстрировать с помощью следующей схемы: Образование комплекса фермент-ингибитор [E-I] препятствует связыванию субстратов, в результате не может происходить реакция с образованием обычного физиологического продукта, Р. Более высокая концентрация ингибитора [I] приводит к более высокой концентрации [E-I], что обусловливает снижение уровня свободного фермента, с которым субстрат может связываться. Для неконкурентных ингибиторов характерно:I) связывание в сайте, отличном от активного сайта (аллостерический сайт связывания),II) способность вызывать конформационное изменение в ферменте, которое снижает или прекращает каталитическую активность. Для медленно связывающихся или прочно связывающихся ингибиторов характерно:I) они представляют собой конкурентные ингибиторы, для которых характерно медленное достижение равновесия между ингибитором и ферментом,II) величина kon соответствует медленному процессу, вероятно из-за конформационных изменений,которые должны происходить в ферменте или ингибиторе,а) они часто представляют собой аналоги переходного состояния,б) они обладают эффективностью при концентрации, близкой к концентрации фермента (субнаномолярные значения KD),в) из-за того, что значения koff являются слишком низкими, эти типы ингибиторов являются "практически (почти)" необратимыми. Аналоги переходного состояния Представляют собой конкурентные ингибиторы, которые имитируют переходное состояние фермента, катализирующего реакцию. Происходит ферментный катализ, приводящий к снижению энергии переходного состояния, в результате этого связывание в переходном состоянии является предпочтительным по сравнению со связыванием с субстратом. Мультисубстратные аналоги Для реакции, включающей два или большее количество субстратов, можно создавать конкурентный ингибитор или аналог переходного состояния, который имеет структурные характеристики, сходные с характеристиками двух или большего количества субстратов. Необратимые ингибиторы ферментов Во всех случаях сдвигают равновесие между несвязанным ферментом и ингибитором и комплексом фермент-ингибитор (E+IE-I) в сторону образования ковалентной связи (100 ккал/моль), что делает ингибирование необратимым. Агенты, действие которых основано на аффинности Необратимые ингибиторы, связывающиеся с активным сайтом (мишенью которых является активный сайт) (конкурентные необратимые ингибиторы), распознаются ферментом (обратимое специфическое связывание) с последующим формированием ковалентной связи иI) они обладают структурным сходством с субстратом, переходным состоянием или продуктом, что позволяет осуществлять специфическое взаимодействие между лекарственным средством и ферментоммишенью,II) содержат реактивную функциональную группу (например, нуклеофил, -COCH2Br), что позволяет осуществлять формирование ковалентной связи. Приведенная ниже реакционная схема описывает взаимодействие реагента, связывающегося с активным сайтом, с ферментом-мишенью, где KD обозначает константу диссоциации и kинактивации (kinactivation) обозначает скорость образования ковалентной связи. Инактиваторы, действие которых основано на механизме, связанном с ферментом (называемые также ингибиторы-"самоубийцы"), представляют собой связывающиеся с активным сайтом реагенты(нереактивные), которые связываются с активным сайтом фермента, где они трансформируются в реактивную форму (активированную форму) под воздействием каталитической активности фермента. После активации формируется ковалентная связь между ингибитором и ферментом. На приведенной ниже реакционной схеме показан механизм действия инактиватора, действие которого основано на механизме, связанном с ферментом, где KD обозначает комплекс диссоциации, k2 обозначает скорость активации ингибитора после связывания с ферментом, k3 обозначает скорость диссоциации активированного ингибитора, Р, из фермента (продукт может еще сохранять реактивность) и k4 обозначает скорость формирования ковалентной связи между активированным ингибитором и ферментом. Инактивация (формирование ковалентной связи, k4) должна происходить до диссоциации (k3), в противном случае реактивный ингибитор будет высвобождаться в окружающую среду. Коэффициент распределения, т.е. k3/k4: т.е. соотношение высвободившегося продукта и инактивированного продукта,должен быть минимизирован для эффективной инактивации системы и получения минимальных нежелательных побочных реакций. Высокое значение коэффициента распределения (преобладающая диссоциация) приводит к неспецифическим реакциям. Неконкурентные ингибиторы ферментов Исходя из определения неконкурентного ингибитора (ингибитор, который связывается только с ESкомплексами (субстрат-фермент, можно вывести следующее уравнение: Для диссоциации субстрата из ES-комплекса характерно значение константы диссоциации, равноеKs, в то время как диссоциация комплекса ESI не происходит (т.е. значение Ks равно нулю). Ожидается,что значения Km для ферментов, действие которых удовлетворяет уравнению скорости ферментативной реакции Михаэлиса-Ментен, будет пониженным. Повышение концентрации субстрата приводит к повышению концентрации ESI (из комплекса не может происходить образование продуктов реакции), поэтому не происходит прекращение ингибирования. Предпочтительными согласно настоящему изобретению являются конкурентные ингибиторы ферментов. Наиболее предпочтительными являются обратимые конкурентные ингибиторы ферментов. Понятия "ki" или "Ki" и "KD" относятся к константам связывания, которые характеризуют связывание ингибитора с ферментом и последующее высвобождение из фермента. Другой мерой является значение "IC50", отражающее концентрацию ингибитора, которая при данной концентрации субстрата приводит к 50%-ному ингибированию активности фермента. Понятие "QC" в контексте настоящего описания обозначает глутаминилциклазу (QC), синонимом которой является глутаминилпептидциклотрансфераза (QPCT); и QC-подобные ферменты, синонимом которых являются белки, напоминающие глутаминилпептидциклотрансферазу (QPCTL). QC и QCподобные ферменты имеют идентичную или сходную ферментативную активность, обозначенную далее как QC-активность. Следует отметить, что QC-подобные ферменты могут принципиально отличаться отQC по молекулярной структуре. Понятие "QC-активность" в контексте настоящего описания обозначает каталитическую активность как глутаминилциклазы (QC, QPCT), так и QC-подобных ферментов (QPCTL). Эти ферменты обнаружены в различных тканях организма млекопитающих, включая почку, печень, кишечник, головной мозг и жидкости организма, такие как СМЖ (спинномозговая жидкость), где они осуществляют высоко специфическую циклизацию глутамина или глутамата на N-конце биологически активных пептидов. В частности, понятие "QC-активность" в контексте настоящего описания обозначает внутримолекулярную циклизацию N-концевых остатков глутамина с образованием пироглутаминовой кислоты (pGlu) или N-концевого L-гомоглутамина или Lгомоглутамина с образованием циклического пирогомоглутаминового производного с выделением в свободном состоянии аммиака (см. ниже схемы 1 и 2). Понятие "ЕС" в контексте настоящего описания относится к побочной активности глутаминилциклазы (QC, QPCT) и QC-подобных ферментов (QPCTL), таких как глутаматциклаза (ЕС), которая обозначена далее как ЕС-активность. Понятие "ЕС-активность" в контексте настоящего описания обозначает внутримолекулярную циклизацию N-концевых глутаматных остатков с образованием пироглутаминовой кислоты (pGlu) с помощью глутаминилциклазы (QC, QPCT) и QC-подобных ферментов (QPCTL) (см. ниже схему 3). Схема 3. N-Концевая циклизация незаряженных глутамильных пептидов с помощью QС (ЕС) Понятие "ингибитор QC" или "ингибитор глутаминилциклазы" хорошо известно специалистам в данной области и означает ферментные ингибиторы, которые ингибируют каталитическую активность глутаминилциклазы (QC, QPCT) или QC-подобных ферментов (QPCTL) или их глутамилциклазную (ЕС) активность, предпочтительно путем непосредственного взаимодействия ингибитора с ферментом. Понятие "избирательный QC-ингибитор" в контексте настоящего описания обозначает ферментные ингибиторы, которые ингибируют каталитическую активность глутаминилциклазы (QC, QPCT), но не ингибируют или ингибируют с меньшей эффективностью по меньшей мере один из QC-подобных ферментов (QPCTL). Предпочтительными являются избирательные QC-ингибиторы, ингибирование которыми глутаминилциклазы (QC, QPCT) характеризуется значением ki, которое на один порядок ниже значения ki, характеризующего ингибирование по меньшей мере одного из QC-подобных ферментов(QPCTL). Более предпочтительно значение ki для избирательного QC-ингибитора, характеризующее ингибирование глутаминилциклазы (QC, QPCT), на два порядка ниже значения ki, характеризующего ингибирование по меньшей мере одного из QC-подобных ферментов (QPCTL). Еще более предпочтительно значение ki для избирательных QC-ингибиторов, характеризующее ингибирование глутаминилциклазы(QC, QPCT), на три порядка ниже значения ki, характеризующего ингибирование по меньшей мере одного из QC-подобных ферментов (QPCTL). Наиболее предпочтительными являются избирательные QCингибиторы, которые не ингибируют QC-подобные ферменты (QPCTL). Понятие "избирательный QPCTL-ингибитор" в контексте настоящего описания обозначает ферментные ингибиторы, которые ингибируют каталитическую активность по меньшей мере одного QCподобного фермента (QPCTL), но не ингибируют или ингибируют с меньшей эффективностью активность глутаминилциклазы (QC, QPCT). Предпочтительными являются QPCTL-ингибиторы, ингибирование которыми по меньшей мере одного QC-подобного фермента (QPCTL) характеризуется значением ki,которое на один порядок ниже значения ki, характеризующего ингибирование глутаминилциклазы (QC,QPCT). Более предпочтительно значение ki для избирательного QPCTL-ингибитора, характеризующее ингибирование по меньшей мере одного QC-подобного фермента (QPCTL), на два порядка ниже значе-4 016584 ния ki, характеризующего ингибирование глутаминилциклазы (QC, QPCT). Еще более предпочтительно значение ki для избирательных QPCTL-ингибиторов, характеризующее ингибирование по меньшей мере одного QC-подобного фермента (QPCTL), на три порядка ниже значения ki, характеризующего ингибирование глутаминилциклазы (QC, QPCT). Наиболее предпочтительными являются избирательныеQPCTL-ингибиторы, которые не ингибируют активность глутаминилциклазы (QC, QPCT). Эффективность ингибирования QС С учетом корреляции с ингибированием QC в предпочтительных вариантах осуществления изобретения, заявляемом способе и при медицинском применении используют агент, ингибирование которымQC характеризуется значением Ki 10 мкм или менее, более предпочтительно 1 мкМ или менее, еще более предпочтительно 0,1 мкМ или менее или 0,01 мкМ или менее или наиболее предпочтительно 0,01 мкМ или менее. Фактически, рассматриваются ингибиторы, для которых значения Ki, составляют менее микромоля, предпочтительно находятся на наномолярном уровне или еще более предпочтительно на пикомолярном уровне. Таким образом, хотя представленные в настоящем описании активные агенты для удобства обозначены как "QC-ингибиторы", должно быть очевидно, что согласно изобретению такая номенклатура не ограничена каким-либо конкретным механизмом действия. Молекулярная масса ингибиторов QС В целом, ингибиторы QC, которые используют в заявляемом способе или в медицине, должны представлять собой небольшие молекулы, например, с молекулярной массой 1000 г/моль или менее, 500 г/моль или менее, предпочтительно 400 г/моль или менее и еще более предпочтительно 350 г/моль или менее и наиболее предпочтительно 300 г/моль или менее. Понятие "индивидуум" в контексте настоящего описания относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, которого подвергают лечению, наблюдению или экспериментальной обработке. Понятие "терапевтически эффективное количество" в контексте настоящего описания означает количество действующего вещества или фармацевтического агента, вызывающее биологический или медицинский ответ в тканевой системе животного или человека, который требуется получить исследователю,ветеринару или врачу или другому клиницисту, включающий облегчение симптомов заболевания или нарушения, подлежащего лечению. В контексте настоящего описания понятие "фармацевтически приемлемый" относится к применению, как для лечения человека, так и в ветеринарии: например, к "фармацевтически приемлемым" относятся приемлемое для ветеринарии соединение или соединение, приемлемое для медицины и медикосанитарной помощи человеку. Синдром Гийена-Барре (GBS) Другими названиями являются синдром Ландри-Гийена-Барре, острый идиопатический полиневрит, инфекционный полиневрит или острая воспалительная полиневропатия. Синдром Гийена-Барре представляет собой серьезное нарушение, которое возникает, когда защитная (иммунная) система организма ошибочно атакует часть нервной системы. Это приводит к воспалению нервов, что вызывает мышечную слабость, которая продолжает усугубляться. Синдром Гийена-Барре представляет собой аутоиммунное нарушение. Точная причина синдрома Гийена-Барре неизвестна. Синдром может возникать в любом возрасте, но наиболее часто им страдают люди обоих полов в возрасте от 30 до 50 лет. Он часто возникает после небольшой инфекции, как правило, респираторной (легочной) инфекции или желудочно-кишечной (кишечной) инфекции. Обычно признаки первичной инфекции исчезают до возникновения симптомов синдрома Гийена-Барре. Синдром Гийена-Барре связан с воспалением, которое поражает часть нервов. Это поражение нервов вызывает покалывание, мышечную слабость и паралич. Воспаление, как правило, поражает покрытие нерва (миелиновую оболочку). Такое поражение называют демиелинизацией. Демиелинизация замедляет передачу сигналов нервом. Поражение других частей нервной системы может вызывать прекращение работы нерва. Симптомы синдрома Гийена-Барре очень быстро развиваются. Для достижения наиболее серьезных симптомов может потребоваться всего несколько часов. Мышечная слабость или потеря мышечной функции (паралич) поражает обе стороны тела. Если мышечная слабость сначала появляется в ногах и затем быстро распространяется на руки, то ее называют восходящим параличом. Пациенты могут ощущать покалывание, боль в ногах или руках и ощущение неповоротливости. По мере потери мышечной функции пациентам может потребоваться вспомогательное дыхание. В настоящее время не существует путей исцеления синдрома Гийена-Барре. Однако многие варианты лечения могут способствовать снижению симптомов, лечению осложнений и ускорению восстановления. Когда симптомы являются серьезными, пациента необходимо помещать в больницу для осуществления вспомогательного дыхания, лечения и физиотерапии. Метод, называемый плазмофорез, применяют для изъятия у пациента крови и замены ее на внутривенные жидкости или донорскую кровь, свободную от антител. Лечение высокими дозами иммуноглобулинов представляет собой еще одну процедуру, которую применяют для снижения серьезности и продолжительности синдрома Гийена-Барре. Другие варианты лечения направлены на предупреждение осложнений.-5 016584 Хроническая воспалительная демиелинизирующая полирадикулоневропатия (CIDP) Заболевание, напоминающее GBS, но характеризующееся хроническим течением, называют хронической воспалительной демиелинизирующей полирадикулоневропатий (CIDP). Пока не существует общепринятого определения CIDP за исключением того, что установлено, что в отличие от GBS, фаза развития продолжается более 4 недель, часто более 6 месяцев, и что дефекты у пациентов часто сохраняются. Механизм, обусловливающий серьезный парез при GBS и CIDP, вероятно, включает иммунную реакцию и воспаление, опосредуемое Т-лимфоцитами, после чего возникает демиелинизация периферических нервов. Это предположение подтверждается тем, что в сыворотке и спинномозговой жидкости страдающих GBS пациентов обнаружены повышенные количества комплементов и цитокинов. Процесс демиелинизации, прежде всего в области нервных корешков, в настоящее время рассматривается как имеющий решающее значение механизм в развитии блокады нервной проводимости. Одна из теорий основана на том, что нарушение барьерной функции крови/спинномозговой жидкости (СМЖ) (гемато/СМЖ-барьер) рассматривается как относительно ранняя важная стадия развития заболевания. Другая теория основана на предположении, что в результате заболевания в гемато/СМЖ-барьере образуются"протечки", и это приводит к повышенному содержанию белков в СМЖ. В любом варианте неспецифические компоненты сыворотки, не имеющие прямого отношения к иммунной системе, могут проникать в СМЖ из крови, вызывая дисфункции нейронов или глии и/или модификацию нейронной активности. Альтернативный механизм заключается в снижении скорости потока СМЖ, что может объяснять повышенное содержание белка в СМЖ. Такая интерпретация не предусматривает никакого нарушения или модификации избирательности гемато/СМЖ-барьера. Хотя все указанные выше явления могут быть важными для развития GBS и CIDP, их точная роль в развитии симптомов пока остается не ясной. Пока не удалось установить связь между повышенными концентрациями белков в СМЖ и специфическими электрофизиологическими параметрами или клинической картиной. Недавно описаны факторы, присутствующие в СМЖ страдающих GBS пациентов и страдающих рассеянным склерозом пациентов, которые связаны с зависящими от потенциала натриевыми каналами (Wz и др., Muscle and Nerve 18, 1995, cc. 772-781). Brinkmeier (Brinkmeier и др., Muscle and Nerve 19, 1996, cc. 54-62) установили, что эти факторы имеют молекулярную массу менее 3 кДа, а при использовании более строгих условий оценки менее 1 кДа. На основе этого наблюдения и данных о том, что активность факторов не снижается существенно даже после инкубации СМЖ с протеазами, вышеуказанные авторы сделали заключение о том, что факторы не представляют собой ни антитела, ни цитокины. Рассеянный склероз (MS) Рассеянный склероз представляет собой аутоиммунное заболевание, которое поражает центральную нервную систему (головной мозг и спинной мозг). Рассеянный склероз, как правило, чаще поражает женщин, чем мужчин. Нарушение наиболее часто начинается между 20 и 40 годами, но может возникать в любом возрасте. Точная его причина неизвестна, но, вероятно, MS является результатом поражение миелиновой оболочки, защитного материала, окружающего нервные клетки. Он представляет собой прогрессирующее заболевание, т.е. поражение усиливается с течением времени. Воспаление разрушает миелин, оставляя многочисленные области рубцовой ткани (склероз). Воспаление возникает, когда собственные иммунные клетки организма атакуют нервную систему. Воспаление приводит к тому, что нервные импульсы замедляются или блокируются, что приводит к симптомам MS. Повторяющиеся эпизоды или внезапное обострение воспаления может происходить в любой области головного и спинного мозга. Симптомы варьируются, поскольку локализация и степень атаки каждый раз изменяются. Как правило,эпизоды, сохраняющиеся в течение дней, недель или месяцев, чередуются с периодами со сниженными симптомами или бессимптомными периодами (ремиссия). Рецидивы являются обычными, хотя также может иметь место не прекращающееся развитие без периодов ремиссии. Не ясно, что инициирует атаки. Пациенты, страдающие MS, как правило, имеют более высокое содержание иммунных клеток по сравнению со здоровым человеком, это позволяет предположить, что может играть роль иммунный ответ. Наиболее распространенные теории основываются на связанном с вирусами или генном дефекте или на комбинации их обоих. Существует также вероятность того, что заболевание имеет генетическую природу. MS существенно чаще встречается в северной Европе, северных Соединенных Штатах, южной Австралии и Новой Зеландии, чем в других зонах. Географические исследования свидетельствуют о возможном участии факторов окружающей среды. Люди с семейным анамнезом MS и живущие в географической зоне, в которой более высокая встречаемость MS, имеют более высокий риск возникновения заболевания. К настоящему времени отсутствуют данные об исцелении рассеянного склероза. Однако ряд путей лечения могут замедлять развитие заболевания. Целью лечения является контроль симптомов и поддержание нормального качества жизни. Краткое изложение сущности изобретения Настоящее изобретение относится к белкам, обладающим глутаминилциклазной активностью, которые являются новыми представителями семейства белков, родственных глутаминилциклазе, включая полноразмерные белки, формы, полученные в результате альтернативного сплайсинга, субъединицы и мутанты, а также к нуклеотидным последовательностям, кодирующим их. Настоящее изобретение отно-6 016584 сится также к способам скрининга субстратов, взаимодействующих белков, агонистов, антагонистов или ингибиторов вышеуказанных белков, а также к фармацевтическим композициям, которые содержат белки и/или их мутанты, производные и/или аналоги и/или лиганды. Эти новые белки, имеющие последовательности, практически подобные последовательности глутаминилциклазы (нуклеотидная последовательность представлена в SEQ ID NO: 1, белковая последовательность представлена в SEQ ID NO: 10), представляют собой белки (QPCTL), полученные из организма человека (обозначены также как человеческий isoQC) (GenBank, регистрационныйNM017659),мыши (GenBank, регистрационный . NM027455), Macaca fascicularis (макак-крабоед) (GenBank, регистрационныйАВ 168255), Macaca mulatta (макак-резус) (GenBank, регистрационныйХМ 001110995), кошки (GenBank, регистрационныйХМ 541552), крысы (GenBank, регистрационныйХМ 001066591), коровы (GenBank, регистрационныйВТ 026254), или их аналоги, последовательности которых идентичны/подобны по меньшей мере на 50/75% указанным последовательностям, предпочтительно идентичны/подобны на 70/85%, наиболее предпочтительно идентичны/подобны на 90/95%. Белковые последовательности представлены в SEQ ID NO: 11-18. Кроме того, описаны нуклеотидные последовательности, кодирующие эти белки (SEQ ID NO: 2-9). В табл. 1 проиллюстрировано подобие между новыми белками и известной глутаминилциклазой. В табл. 2 проиллюстрирована идентичность между новыми белками и известной глутаминилциклазой. Таблица 1. Подобие белковых последовательностей новых напоминающих глутаминилпептидциклотрансферазу белков и глутаминилциклазы Таблица 2. Идентичность белковых последовательностей новых напоминающих глутаминилпептидциклотрансферазу белков и глутаминилциклазы-7 016584 Обнаружена высокая степень подобия, находящаяся на уровне 95-99%, и высокая степень идентичности, находящаяся на уровне 84-98%, между QPCTL из различных источников (см. фиг. 2). На основе подобия последовательностей человеческой и мышиной глутаминилциклазы (см. фиг. 1), можно предположить, что эти QPCTL должны иметь функции, которые включают (но, не ограничиваясь только ими) их роль в качестве ферментов. Характеристики, полученные при клонировании, экспрессии, биохимическом и молекулярном анализе, подтверждают эту гипотезу. Схема экспрессии QPCTL в ткани головного мозга, предстательной железы и легкого согласуется с их ролью в описанных ниже заболеваниях. Ферментативная активность в качестве глутаминилциклазы демонстрирует, что активирующие или ингибирующие QPCTL молекулы должны найти различное терапевтическое применение, что будет описано ниже. Различные виды активности QPCTL, представленные в настоящем описании, и схемы их экспрессии сопоставимы с их функциональными ролями в качестве физиологических регуляторов иммунной и нейроэндокринной систем посредством ферментативной модификации биохимических медиаторов типа гормонов, пептидов и хемокинов. Многочисленные функции QC, описанные ранее на основе применения ингибиторов, могут быть частично обусловлены ее активностью и активностью подобных ей белков типаQPCTL. Таким образом, исследование избирательных и эффективных ингибиторов QC, QPCTL и других родственных ферментов считается основным для достижения эффективного и безопасного фармацевтического применения этих и любых, вновь идентифицированных глутаминилпептидциклотрансфераз, а также других активных соединений, которые модифицируют функцию(и) этих белков. Таким образом, изобретение относится к новым белкам или полипептидам, кодирующим их нуклеиновым кислотам, клеткам, модифицированным нуклеиновой кислотой таким образом, чтобы они экспрессировали указанные белки, антителам к этим белкам, способу скринингу для выявления новых терапевтических агентов, которые ингибируют активность этих белков (или которые являются ингибиторамиQC, а не этих белков), и к терапевтическим агентам, обнаруженным с помощью указанных способов скрининга. Новые белки и кодирующие их нуклеиновые кислоты можно применять для выявления новых терапевтических агентов, предназначенных для лечения определенных болезней, таких, например, как нейродегенеративных, репродуктивных, воспалительных и метаболических нарушений, а также для получения антител, имеющих терапевтическое или диагностическое значение. Одним из объектов настоящего изобретения являются новые, зрелые, обладающие биологической активностью белки, предпочтительно человеческого происхождения. Такие белки можно выделять в небольших количествах из тканей или биологических жидкостей пригодного животного (включая человека) с помощью стандартных методов; однако более крупные количества принято получать в культурах клеток, генетически модифицированных с целью экспрессии белка. Другим объектом настоящего изобретения являются выделенные молекулы нуклеиновых кислот,которые кодируют полипептиды, предлагаемые в настоящем изобретении, включая мРНК, ДНК, кДНК,геномные ДНК. Следующим объектом настоящего изобретения являются также нуклеиновые кислоты-зонды, содержащие молекулы нуклеиновых кислот, длина которых является достаточной для того, чтобы гибридизоваться с нуклеотидными последовательностями, предлагаемыми в настоящем изобретении. Еще одним объектом настоящего изобретения являются способы применения методов рекомбинации для получения указанных полипептидов, которые можно применять для научный исследований invitro, например синтеза ДНК и создания ДНК-векторов. Пути получения указанных полипептидов включают культивирование рекомбинантных прокариотических и/или эукариотических клеток-хозяев, трансфектированных ДНК-векторами, которые содержат нуклеотидные последовательности, кодирующие указанный полипептид и/или зрелый белок, в условиях, усиливающих экспрессию указанного белка, и последующее выделение указанного белка или фрагмента экспрессируемого продукта. И еще одним объектом изобретения являются способы применения полипептидов и полинуклеотидов QPCTL для лечения болезней. Таким образом, следующим объектом настоящего изобретения является способ применения указанных полипептидов или полинуклеотидов, кодирующих указанные полипептиды, для выявления соединений, которые ингибируют биологическую активность зрелых белков, например, активность QC или активность ЕС, а также сами указанные ингибиторы. Более конкретным объектом изобретения является выделенная нуклеиновая кислота, которая кодирует (а) полипептид QPCTL, выбранный из SEQ ID NO: 11-18, или (б) полипептид, аминокислотная последовательность которого подобна указанным по меньшей мере примерно на 75%, и обладающий такой же биологической функцией, или полученный в результате альтернативного сплайсинга вариант одной из последовательностей, представленных в SEQ ID NO: 2-9, или представляет собой зонд, содержащий по меньшей мере 14 смежных нуклеотидов нуклеиновой кислоты, кодирующей полипептиды, указанные в (а) или (б), или является комплементарной одной из вышеуказанных нуклеиновых кислот. Следующим конкретным объектом изобретения является полипептид, который необязательно может быть гликозилированным и который (а) имеет аминокислотную последовательность зрелого белка,-8 016584 представленную в одной из SEQ ID NO: 10-18; предпочтительно зрелого белка, последовательность которого представлена в одной из SEQ ID NO: 11-18, (б) имеет аминокислотную последовательность зрелого белка, подобную по меньшей мере примерно на 75% последовательности зрелого белка, представленной в (а), и который обладает такой же биологической функцией; (в) имеет аминокислотную последовательность зрелого белка, идентичную по меньшей мере примерно на 50% последовательности зрелого белка, представленной в одной из SEQ ID NO: 10-18; предпочтительно зрелого белка, последовательность которого представлена в одной из SEQ ID NO: 11-18, или (д) представляет собой иммунологически реактивный фрагмент полипептида, указанного в (а). Еще одним конкретным объектом изобретения является способ скрининга соединений, обладающих способностью ингибировать ферментативную активность по меньшей мере одного зрелого белка,предлагаемого в настоящем изобретении, предпочтительно выбранного из белков, последовательность которых представлена в SEQ ID NO: 11-18, где способ заключается в том, что инкубируют зрелый белок и приемлемый субстрат для зрелого белка в присутствии одного или нескольких тестируемых соединений или их солей, оценивают ферментативную активность зрелого белка, сравнивают активность с аналогичной активностью, определенной в отсутствии тестируемого соединения, и оценивают тестируемое соединение или соединения, которое(ые) снижают ферментативную активность. Кроме того, настоящее изобретение относится к диагностическим наборам и способам, основанным на применении QC-ингибитора, избирательного QC-ингибитора или избирательного QPCTL-ингибитора. Эти и другие объекты настоящего изобретения должны стать очевидными специалистам в данной области из приведенного ниже подробного описания изобретения. Краткое описание чертежей На чертежах показано: на фиг. 1 - сравнительный анализ первичной структуры последовательностей человеческой QC(hQC), человеческой isoQC (hisoQC), мышиной QC (mQC) и мышиной isoQC (misoQC). Множественный сравнительный анализ первичной структуры последовательностей осуществляли с помощью программыClustalW, представленной на сайте PBIL (фирма Ple Bioinformatique Lyonnais) (http://npsa-pbil.ibcp.fr), с установкой принятых по умолчанию параметров. Консервативные связывающиеся с ионами цинка остатки выделены жирным шрифтом и подчеркнуты в человеческой QC (hQC; GenBank X71125, SEQ IDNO: 10), человеческой isoQC (hisoQC, GenBank NM017659, SEQ ID NO: 11), мышиной QC (mQC, GenBank NM-027455, SEQ ID NO: 79) и мышиной isoQC (misoQC, GenBank BC058181, SEQ ID NO: 17); на фиг. 2 - сравнительный анализ первичной структуры последовательностей isoQC из Homo sapienstaurus (Btaurus, GenBank BT026254, SEQ ID NO: 18). Множественный сравнительный анализ первичной структуры последовательностей осуществляли с помощью программы ClustalW, представленной на сайте PBIL (фирма Ple Bioinformatique Lyonnais) (http://npsa-pbil.ibcp.fr), с установкой принятых по умолчанию параметров. Аминокислоты, имеющие консервативные связывающиеся с ионами цинка остатки,подчеркнуты и выделены жирным шрифтом; на фиг. 3 - сравнительный анализ первичной структуры последовательностей человеческой QC(hQC, SEQ ID NO: 10) и человеческой isoQC (hisoQC, SEQ ID NO: 12) и других представителей М 28 семейства металлопептидаз Clan MH. Множественный сравнительный анализ первичной структуры последовательностей осуществляли с помощью программы ClustalW, представленной на сайтеch.EMBnet.org, с установкой принятых по умолчанию параметров. Консервативные связывающиеся с ионами цинка остатки выявлены в человеческой QC (hQC; Swiss-Prot Q16769, SEQ ID NO: 10), в человеческой isoQC (isoQC; Swiss-Prot Q53HE4, SEQ ID NO: 12) (остатки 19-382), в Zn-зависимой аминопептидазе из Streptomyces griseus (SGAP; Swiss-Prot P80561, SEQ ID NO: 80) и в зрелой Zn-зависимой лейциламинопептидазе из Vibrio proteolyticus (VpAP; Swiss-Prot Q01693, SEQ ID NO: 81). Соответствующие аминокислотные остатки подчеркнуты и выделены жирным шрифтом; на фиг. 4 - сравнительный анализ первичной структуры последовательностей человеческой QC(hQC, SEQ ID NO: 10) и человеческой isoQC (hisoQC, SEQ ID NO: 11), показаны два предполагаемых сайта инициации трансляции (метионина I - выделен жирным шрифтом, подчеркнут; метионина II - выделен жирным шрифтом). Множественный сравнительный анализ первичной структуры последовательностей осуществляли с помощью программы ClustalW, представленной на сайте PBIL (фирма Pole Bioinformatique Lyonnais) (http://npsa-pbil.ibcp.fr), с установкой принятых по умолчанию параметров. Трансмембранный домен, присутствующий в QC, обозначен черной полосой; на фиг. 5 - сравнительный анализ первичной структуры последовательностей человеческой QC(hQC, SEQ ID NO: 10) и человеческой isoQC (hisoQC, SEQ ID NO: 12), начиная с метионина II (выделен жирным шрифтом). Множественный сравнительный анализ первичной структуры последовательностей осуществляли с помощью программы ClustalW, представленной на сайте ch.EMBnet.org, с установкой принятых по умолчанию параметров. Аминокислоты, участвующие в связывании металлов, подчеркнуты-9 016584 и выделены жирным шрифтом. Трансмембранный домен, присутствующий в QC, обозначен черной полосой; на фиг. 6 - анализ экспрессии isoQC с помощью ОТ-ПЦР. Осуществляли обнаружение в линиях клеток SH-SY5Y, LN405, НаСаТ и Hep-G2. Полосы: количество пар оснований, ДНК-стандарт; 1, амплифицированный ПЦР-продукт человеческой isoQC из SH-SY5Y; 2, амплифицированный ПЦР-продукт человеческой isoQC из LN405; 3, амплифицированный ПЦР-продукт человеческой isoQC из НаСаТ; 4,амплифицированный ПЦР-продукт человеческой isoQC из Hep-G2; на фиг. 7 - анализ субклеточной локализации isoQC (Met I, SEQ ID NO: 11) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина I (см. фиг. 5), экспрессировали в виде слитого белка с EGFP (isoQC (MetI) EGFP) в LN 405. Осуществляли контрастное окрашивание маннозидазыII с помощью АВ 3712 (фирма Chemicon). "Совмещение" представляет собой наложение окрашиванияisoQC (MetI)-EGFP и маннозидазы II; на фиг. 8 - анализ субклеточной локализации isoQC (Met I, SEQ ID NO: 11) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина I (см. фиг. 5), экспрессировали в виде слитого белка с EGFP (isoQC (MetI) EGFP) в LN 405. Осуществляли контрастное окрашивание митохондрий с помощью МАВ 1273 (фирма Chemicon). "Совмещение" представляет собой наложение окрашиванияisoQC (MetI)-EGFP и митохондрий; на фиг. 9 - анализ субклеточной локализации isoQC (Met II, SEQ ID NO: 12) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина II, экспрессировали в виде слитого белка сEGFP (isoQC (MetII) EGFP) в LN 405. Осуществляли контрастное окрашивание маннозидазы II с помощью АВ 3712 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC(MetII)-EGFP и маннозидазы II; на фиг. 10 - анализ субклеточной локализации isoQC (Met II, SEQ ID NO: 12) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина II, экспрессировали в виде слитого белка сEGFP (isoQC (MetII) EGFP) в LN 405. Осуществляли контрастное окрашивание митохондрий с помощью МАВ 1273 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC (MetII)EGFP и митохондрий; на фиг. 11 - анализ субклеточной локализации isoQC (Met I, SEQ ID NO: 11) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина I, экспрессировали в виде слитого белка сEGFP (isoQC (MetI) EGFP) в COS-7. Осуществляли контрастное окрашивание маннозидазы II с помощью АВ 3712 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC (MetI)EGFP и маннозидазы II; на фиг. 12 - анализ субклеточной локализации isoQC (Met I, SEQ ID NO: 11) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина I, экспрессировали в виде слитого белка сEGFP (isoQC (MetI) EGFP) в COS-7. Осуществляли контрастное окрашивание митохондрий с помощью МАВ 1273 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC (MetI)EGFP и митохондрий; на фиг. 13 - анализ субклеточной локализации isoQC (Met II, SEQ ID NO: 12) с помощью иммуногистохимии. Человеческую isoQC, начинающуюся с метионина II, экспрессировали в виде слитого белка сEGFP (isoQC (MetII) EGFP) в COS-7. Осуществляли контрастное окрашивание маннозидазы II с помощью АВ 3712 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC(MetII)-EGFP и маннозидазы II; на фиг. 14 - анализ субклеточной локализации isoQC (Met II, SEQ ID NO: 12) с помощью иммуногистохимии. Человеческую isoQC, начиная с метионина II, экспрессировали в виде слитого белка с EGFP(isoQC (MetII) EGFP) в COS-7. Осуществляли контрастное окрашивание митохондрий с помощью МАВ 1273 (фирма Chemicon). "Совмещение" представляет собой наложение окрашивания isoQC (MetII)EGFP и митохондрий; на фиг. 15 - ингибирование катализируемого человеческой isoQC превращения H-Gln-AMC в pGluAMC с помощью ингибитора Р 150/03. Данные оценивали на основе кинетической модели МихаэлисаМентена, рассматривая линейное конкурентное ингибирование. Применяли следующие концентрации ингибиторов: Установлено, что значение Ki, составляло 2408 нМ; на фиг. 16 - катализируемое человеческой isoQC превращение H-Gln-Ala-ОН в pGlu-Ala-OH, определенное с помощью спектрофотометрического анализа. Данные оценивали на основе кинетической мо- 10016584 дели Михаэлиса-Ментен. Кинетические параметры составляли 32428 мкМ и 7,40,2 нМ/мин для значений KM и Vmax соответственно; на фиг. 17 - схематическое изображение конструкций человеческого белка isoQC, которые экспрессировали гетерологично в дрожжах P. pastoris. В некоторые белки интродуцировали две мутации, приводящие к получению сайта гликозилирования в положении 55 (I55N) и мутантного остатка цистеина в положении 351 (С 351 А). Для экспрессии N-конец, содержащий трансмембранный домен, заменяли сигналом секреции из дрожжей (YSS). Конструкции, содержащие N-концевой сигнал секреции, должны эффективно секретироваться в среду; на фиг. 18 - данные об активности QC, которую определяли в среде дрожжевых клеток, в которых происходила экспрессиия. Из-за присутствия трансмембранного домена нативные конструкции не секретировались в среду (не применяли). В результате гликозилирования (I55N) белки наиболее эффективно секретировались. Мутация С 351 А приводила также к более высокой активности QC, обнаруженной в среде. Конструкции представлены на фиг. 17; на фиг. 19 - очистка человеческой isoQC, включенной в конструкцию YSShisoQCI55NC351A C-His,из среды, в которой выращивали трансгенный штамм P.pastoris. QC очищали путем комбинации IMAC(аффинная хроматография на иммобилизованном металле, полоса 3), HIC (хроматография, основанная на гидрофобном взаимодействии, полоса 4) и обессоливания (полоса 5). Гликозилирование фермента подтверждали с помощью ферментативного дегликозилирования, что приводило к сдвигу миграции белка(полоса 6). Полоса 1, стандарт белка; полоса 2, среда до очистки; на фиг. 20 - очистка человеческой isoQC, включенной в конструкцию GST-hisoQC C-His, из клеточного гомогената трансформированных Е. coli. Белок isoQC очищали путем комбинации IMAC (аффинная хроматография на иммобилизованном металле, полоса 3), хроматографии на основе GST-аффинности(полоса 4), обессоливания (полоса 5) и ионообменной хроматографии (полоса 6). Полоса 1, стандарт белка; полоса 2, клеточный гомогенат до очистки. Различие в молекулярной массе hisoQC, которую экспрессировали в дрожжах и Е. coli, обусловлено наличием слияния на N-конце с GST-меткой. Экспрессируемая конструкция схематически представлена в верхней части чертежа; на фиг. 21 - константы специфического превращения дипептидов-заменителей (суррогатов), дипептидов и олигопептидов с помощью человеческой isoQC (YSShisoQCI55NC351A C-His; ср. фиг. 17), GSThisoQC и человеческой QC. Специфичность GST-hisoQC оказалась наименьшей, далее в порядке повышения специфичности следовала YSShisoQCI55NC351A C-His. Наиболее высокая специфичность обнаружена у человеческой QC, что свидетельствует о более высокой общей ферментативной активности; на фиг. 22 - зависимость катализа от значения рН, изученная с применением человеческой isoQC(hisoQC), которую экспрессировали в дрожжах, и человеческой QC (hQC). Для обоих белков оптимум рН обнаружен между рН 7 и 8. Подбор кривых был основан на трех полученных в результате диссоциации группах, которые влияют на катализ, одна при кислом значении рН, две при основном значении рН; на фиг. 23 - анализ превращения глутаминовой кислоты, которая присутствует на N-конце родственного амилоиду- пептида А(3-11). Анализ осуществляли с использованием Maldi-Tof-массспектрометрии (времяпролетная масс-спектрометрия с использованием опосредуемой матрицей лазерной десорбции/ионизации), при этом различие в соотношении молекулярной массы/заряда субстрата и продукта соответствовало несущей один заряд молекуле с молекулярной массой примерно 18 Да, представляющей собой массу высвободившейся воды. В обоих случаях в образце концентрация белка была одинаковой, что с большой долей вероятности позволяет предположить, что человеческая isoQC превращает также N-концевую глутаминовую кислоту, но медленнее, чем человеческая QC; на фиг. 24 - распределение в тканях мышиной QC (mQC, SEQ ID NO: 79) и ее изозима misoQC (SEQID NO: 17), проанализированное с помощью ПЦР в реальном времени. Оба фермента экспрессировались в анализируемых органах. Однако уровень экспрессии mQC был выше в головном мозге по сравнению с периферическими органами. В отличие от этого, уровень экспрессии misoQC во всех анализируемых органах и тканях оказался близким, что свидетельствует о том, что этом фермент представляет собой повсеместно распространенный белок "домашнего хозяйства" (конститутивный белок); на фиг. 25 - зависящее от времени ингибирование человеческой isoQC (hisoQC) соединениями, образующими хелатные комплексы с металлами, такими как 1,10-фенантролин (окружности) и ЭДТК(квадраты). Остаточную hisoQC-активность определяли непосредственно после добавления (закрашенные символы) или предварительной инкубации hisoQC с соответствующим реагентом в течение 15 мин при 30 С (незакрашенные символы); на фиг. 26 - биохимический анализ субклеточной локализации QC-активности после экспрессии рсДНК и нативных ферментов hisoQC (Met I, SEQ ID NO: 11), hisoQC (Met II, SEQ ID NO: 12) и hQC(Б)-абсолютная активность в нМ/мин. (В) Экспрессия h-isoQC (Met I, SEQ ID NO: 11), h-isoQC (Met II,SEQ ID NO: 12) и hQC (SEQ ID NO: 10), несущих С-концевую FLAG-метку, в HEK293-клетах в сравнении с трансфектированным контролем вектором (рсДНК), изученная с помощью анализа методом Вестерн-блоттинга с использованием специфических антител либо к FLAG эпитопу (антитело кDYKDDDDK, фирма Cell Signaling), либо белку массой 65 кДа человеческих митохондрий (антитело к человеческим митохондриям, фирма Chemicon), либо к сиалилтрансферазе ST1GAL3 (фирма Abnova); на фиг. 27 - субклеточная локализация человеческой isoQC (hisoQC), несущей сигнальные последовательности (27 А) метионин I - серин 53 и (27 Б) метионин II - серин 53, слитые с EGFP (1, 4). Комплекс Гольджи окрашивали с помощью антитела к маннозидазе II (2), а митохондрии окрашивали с использованием антитела к белку массой 65 кДа человеческих митохондрий (5). Совместную локализацию выявляли с помощью наложения EGFP-флуоресценции и Red Х-флуоресценции (3, 6); на фиг. 28 - основная структура человеческой isoQC (hisoQC) и мышиной isoQC (misoQC) в сравнении с опубликованными последовательностями человеческих гликозилтрансфераз: альфа-Nацетилгалактозаминид-альфа-2,6-сиалилтрансфераза 1 (ST6GalNAC1; К.Ф. 2.4.99.3); бета-1,4-галактозилтрансфераза 1 (b4Gal-T1, К.Ф. 2.4.1.-); галактозид-3(4)-L-фукозилтрансфераза (FucT-III; К.Ф. 2.4.1.65) и гликопротеин-фукозилгалактозид-альфа-N-ацетилгалактозаминилтрансфераза (NAGAT, К.Ф.2.4.1.40). Количество аминокислот указано под колонками. Цитозольная часть затенена, трансмембранная спираль окрашена черным цветом, а находящая в полости часть обозначена белым цветом; на фиг. 29 - количественная оценка мРНК человеческой isoQC (QPCTL) в различных линиях клеток карциномы. Экспрессию QPCTL стандартизовали относительно 50 нг общей РНК. Черными полосами внутри прямоугольников обозначены соответствующие медианы; на фиг. 30 - количественная оценка экспрессии мРНК человеческой isoQC (QPCTL) в различных линиях клеток меланомы. Экспрессию QPCTL стандартизовали относительно 50 нг общей РНК; на фиг. 31 - количественная оценка экспрессии мРНК человеческой isoQC (QPCTL) в образцах карциномы мягких тканей, карциномы желудка и карциномы щитовидной железы различных пациентов. Экспрессию QPCTL стандартизовали относительно 50 нг общей РНК. Черными полосами внутри прямоугольников обозначены соответствующие медианы; на фиг. 32 - количественная оценка экспрессии мРНК человеческой isoQC (QPCTL) в различных желудочных карциномах на различных стадиях дифференцировки. Экспрессию QPCTL стандартизовали относительно 50 нг общей РНК. Черными полосами внутри прямоугольников обозначены соответствующие медианы; на фиг. 33 - сравнение экспрессии мРНК человеческой QC (QPCT) в различных карциномах щитовидной железы. Экспрессию QPCT стандартизовали относительно 50 нг общей РНК. Черными полосами внутри прямоугольника обозначены соответствующие медианы (FTC: фолликулярный рак щитовидной железы; РТС: папиллярный рак щитовидной железы; UTC: недифференцированный рак щитовидной железы); на фиг. 34 - сравнение уровней экспрессии мРНК человеческой isoQC (QPCTL) в различных карциномах щитовидной железы. Экспрессию QPCT стандартизовали относительно 50 нг общей РНК. Черными полосами внутри прямоугольников обозначены соответствующие медианы (FTC: фолликулярный рак щитовидной железы; РТС: папиллярный рак щитовидной железы; UTC: недифференцированный рак щитовидной железы); на фиг. 35 - влияние различных стимулов на экспрессию мРНК человеческой QC (QPCT), человеческой isoQC (QPCTL) и CCL2 в HEK293-клетках. Количество транскриптов обозначено относительно основного уровня экспрессии без стимулов. Применяемая концентрация стимула показана на оси абсцисс; на фиг. 36 - влияние различных стимулов на экспрессию мРНК человеческой QC (QPCT), человеческой isoQC (QPCTL) и CCL2 в FTC-133-клетках. Количество транскриптов обозначено относительно основного уровня экспрессии без стимулов. Применяемая концентрация стимула показана на оси абсцисс; на фиг. 37 - влияние различных стимулов на экспрессию мРНК человеческой QC (QPCT), человеческой isoQC (QPCTL) и CCL2 в ТНР-1-клетках. Количество транскриптов обозначено относительно основного уровня экспрессии без стимулов. Применяемая концентрация стимула показана на оси абсцисс; на фиг. 38 - влияние различных стимулов на экспрессию мРНК человеческой QC (QPCT), CCL2,CCL7, CCL8 и CCL13 в ТНР-1-клетках. Количество транскриптов обозначено относительно основного уровня экспрессии без стимулов. Применяемая концентрация стимула показана на оси абсцисс; на фиг. 39 - влияние гипоксии на уровень мРНК человеческой QC (QPCT), человеческой isoQC Подробное описание изобретения Одним из объектов настоящего изобретения являются выделенные нуклеотидные последовательности (полинуклеотиды), представленные в SEQ ID NO: 2-9, 19 и 20, которые кодируют зрелые полипептиды, имеющие выведенные аминокислотные последовательности QPCTL из различных источников (SEQID NO: 11-18,21 и 22). Предпочтительными согласно настоящему изобретению являются выделенные нуклеотидные последовательности (полинуклеотиды), представленные в SEQ ID NO: 2 и 3, 19 и 20, которые кодируют зрелые полипептиды, имеющие выведенные аминокислотные последовательности человеческих QPCTL(SEQ ID NO: 11 и 12, 21 и 22). Более предпочтительными согласно настоящему изобретению являются выделенные нуклеотидные последовательности (полинуклеотиды), представленные в SEQ ID NO: 2 и 3, которые кодируют зрелые полипептиды, имеющие выведенные аминокислотные последовательности человеческих QPCTL, представленные в SEQ ID NO: 11 и 12. Еще более предпочтительными согласно настоящему изобретению являются выделенные нуклеотидные последовательности (полинуклеотиды), представленные в SEQ ID NO: 19 и 20, которые кодируют зрелые полипептиды, имеющие выведенные аминокислотные последовательности, которые представляют собой полученные в результате альтернативного сплайсинга формы последовательностей человеческих, представленные в QPCTL SEQ ID NO: 21 и 22. Наиболее предпочтительной согласно настоящему изобретению является выделенная нуклеотидная последовательность (полинуклеотид) SEQ ID NO: 2, которая кодирует зрелый полипептид, имеющий выведенную аминокислотную последовательность человеческой QPCTL, представленную в SEQ ID NO: 11. Еще более предпочтительной согласно настоящему изобретению является выделенная нуклеотидная последовательность (полинуклеотид) SEQ ID NO: 3, которая кодирует зрелый полипептид, имеющий выведенную аминокислотную последовательность человеческой QPCTL, представленную в SEQ ID NO: 12. Указанные выше варианты осуществления изобретения и их предпочтительные варианты относятся к нуклеиновым кислотам QPCTL, а также к белкам QPCTL и к любому требуемому способу их применения для диагностики, лечения, скрининга, в качестве эффекторов, ингибиторов и в других вариантах применения и согласно способам, предлагаемым в настоящем изобретении. Полинуклеотиды, предлагаемые в настоящем изобретении, открыты на основе изучения подобия с использованием программы для поиска нуклеотидов BLAST фирмы NCBI (http://www.ncbi.nlm.nih.gov/BLAST/) с использованием человеческой QC в качестве матрицы. Поиск привел к открытию предполагаемой QPCTL на хромосоме 19, кодирующая область которой представляет собой 19q13.32. На основе поиска были сконструированы праймеры для скрининга человеческой isoQC в клеточных линиях (табл. 4). Выделенная кДНК человеческой QPCTL содержит открытую рамку считывания, кодирующую состоящий из 382 аминокислот белок, родственный человеческой QC, последовательность которого идентична ей на 45,24% и подобна на 71,98%. Применение различных биоинформационных алгоритмов(www.expasy.ch) для предсказания субклеточной локализации не привело к получению достоверного результата. В соответствии с прогнозом, вероятно, местом локализации является комплекс Гольджи или митохондрии. Сравнительный анализ первичной структуры аминокислотной последовательности человеческойQPCTL и других представителей М 28-семейства металлопептидаз Clan MH позволил установить, что белок человеческой QPCTL гомологичен на уровне всей последовательности и структуры с человеческой и мышиной QC (фиг. 1) и с бактериальными аминопептидазами (фиг. 3). Поиск в базах данных дополнительных генов, родственных генам человеческой QPCTL, показал присутствие QPCTL у грызунов,обезьян, коров и собак. Сравнительный анализ первичной структуры этих последовательностей и новой человеческой QPCTL показал, что они обладают выраженной гомологией с их человеческой копией. Образующие комплексы с цинком остатки человеческой QC (Asp-Glu-His) являются консервативными вQPCTL различного происхождения (фиг. 2). Ген человеческой isoQC содержит по меньшей мере 8 экзонов. Последовательность, кодирующая человеческий белок isoQC, локализована на экзонах 1-7. Человеческая isoQC картируется на хромосоме 19 в положении 19q13.32. Скрининг клеточных линий в отношении человеческой isoQC доказал наличие транскриптов в клетках, полученных из печени (Hep-G2, печеночно-клеточная карцинома), кожи (НаСаТ,кератиноциты) и нейронной ткани (LN405, астроцитома; SH-SY5Y, нейробластома) (фиг. 6). Функциональную экспрессию выделенной кДНК QPCTL оценивали в нескольких хозяевах, в которых имела место экспрессия. Экспрессия в Р. pastoris, которую с успехом применяли для человеческойQC, не позволила получить обладающий ферментативной активностью белок. Экспрессия в клетках млекопитающих привела к получению активности, однако уровни экспрессии оказались очень низкими. Таким образом, выделение обладающего ферментативной активностью белка оказалось невозможным на основе известных в данной области данных. Обладающий ферментативной активностью белок выделяли только после экспрессии слитого белка GST-QPCTL в Е. coli с использованием нетрадиционных условий экспрессии: экспрессия в течение 4 ч при 37 С в присутствии 1% глюкозы, индукция экспрессии с помощью 20 мкМ ИПТГ. Эти условия экспрессии позволили получить экспрессию невысокого уровня в Е coli, необходимую для функциональной складчатости пептидной цепи.- 15016584 Другим вариантом осуществления настоящего изобретения являются животные с "выключенной"QPCTL, предпочтительно крысы или мыши. Использование мышей с "выключенной" QPCTL для дополнительного анализа функции генов QPCTL является ценным инструментом. Полинуклеотиды, предлагаемые в настоящем изобретении, могут иметь форму РНК или форму ДНК; следует понимать, что ДНК включают кДНК, геномную ДНК и синтетическую ДНК. ДНК может быть двухцепочечной или одноцепочечной и, если является одноцепочечной, может представлять собой кодирующую цепь или некодирующую (антисмысловую) цепь. Кодирующая последовательность, которая кодирует зрелый полипептид, может быть идентична кодирующей последовательности, представленной в SEQ ID NO: 2-9, или может отличаться от кодирующей последовательности, которая кодирует такой же зрелый полипептид, в результате избыточности или вырожденности генетического кода или полиморфизма одного нуклеотида. Например, она может представлять собой также РНК-транскрипт,который включает полноразмерную любую из последовательностей, представленных в SEQ ID NO: 1118. Полинуклеотиды, которые кодируют зрелые белки, имеющие последовательность, представленную в SEQ ID NO: 2-9, могут включать (но, не ограничиваясь только ими) кодирующую последовательность только зрелого белка; кодирующую последовательность зрелого полипептида плюс дополнительную кодирующую последовательность, например лидерную или секреторную последовательность, или последовательность пробелка; и кодирующую последовательность зрелого белка (и необязательно дополнительную кодирующую последовательность) плюс некодирующую последовательность, например, интроны или некодирующую последовательность на 5'- и/или 3'-конце кодирующей последовательности зрелого белка. Таким образом, следует понимать, что понятие "полинуклеотид, кодирующий полипептид" или"нуклеиновая кислота, кодирующая полипептид" относится к полинуклеотиду или нуклеиновой кислоте,который/которая включает только кодирующую последовательность зрелого белка, а также который/которая включает дополнительную кодирующую и/или некодирующую последовательность. Понятие полинуклеотиды и нуклеиновые кислоты используют взаимозаменяемо. Настоящее изобретение относится также к полинуклеотидам, в которых кодирующая последовательность зрелого белка может быть слита в одной и той же рамке считывания с полинуклеотидной последовательностью, которая способствует экспрессии и секреции полипептида из клетки-хозяина; например, может быть слита с лидерной последовательностью, которая функционирует в качестве секреторной последовательности для контроля транспорта полипептида из клетки-хозяина. Полипептид, несущий указанную лидерную последовательность, обозначают как пребелок и препробелок, и он может иметь лидерную последовательность, которая отщепляется под воздействием клетки-хозяина с образованием зрелой формы белка. Эти полинуклеотиды могут иметь удлиненную 5'-область, в результате чего они кодируют пробелок, представляющий собой зрелый белок плюс дополнительные аминокислотные остатки на N-конце. Экспрессионный продукт, имеющий такую пропоследовательность, обозначают как пробелок, который представляет собой неактивную форму зрелого белка; однако после расщепления пропоследовательности остается зрелый белок. Так, например, полинуклеотиды, предлагаемые в настоящем изобретении, могут кодировать зрелые белки или белки, имеющие пропоследовательность, или белки, имеющие и пропоследовательность, и препоследовательность (лидерная последовательность). Полинуклеотиды, предлагаемые в настоящем изобретении, могут иметь также кодирующую последовательность, слитую в рамке считывания с маркерной последовательностью, которая позволяет осуществлять очистку полипептидов, предлагаемых в настоящем изобретении. Маркерная последовательность может представлять собой полигистидиновую метку, гемагглютининовую (НА) метку, c-myc-метку илиV5-метку, когда в качестве хозяина применяют клетку млекопитающего, например COS-1-клетки. НА-метка должна соответствовать эпитопу, выведенному из белка гемагглютинина гриппа (WilsonI. и др., Cell, 37, 1984, с. 767), а с-mус-метка может представлять собой эпитоп из человеческого Мусбелка (Evans G. I. и др., Mol. Cell. Biol.5, 1985, cc. 3610-3616). Понятие "ген" означает сегмент ДНК, участвующий в образовании полипептидной цепи; он включает области, расположенные перед кодирующей областью и позади нее (лидер и хвост), а также последовательности (интроны), лежащие между индивидуальными кодирующими сегментами (экзоны). Понятие "выраженная гомология последовательностей" означает, что по меньшей мере 25%, предпочтительно по меньшей мере 40%, аминокислотных остатков являются консервативными и что из неконсервативных остатков по меньшей мере 40% представляют собой консервативные замены. Фрагменты полноразмерных генов, предлагаемых в настоящем изобретении, можно использовать в качестве зондов для гибридизации библиотек кДНК с целью выделения полноразмерной кДНК, а также выделения других кДНК, которые имеют выраженную гомологию последовательностей с геном и должны кодировать белки или полипептиды, имеющие сходную биологическую активность или функцию. Под сходной биологической активностью или функцией для целей настоящего описания понимают способность образовывать пироглутамат из N-концевого глутамина или глутаминовой кислоты пептидов,белков, гормонов или других субстратов, т.е. QC- и ЕС-активность соответственно. Указанный зонд такого типа содержит по меньшей мере 14 оснований (по меньшей мере 14 смежных нуклеотидов из одной- 16016584 из последовательностей, представленных в SEQ ID NO: 2-9), предпочтительно по меньшей мере 30 оснований, и может содержать, например, 50 или большее количество оснований. Предпочтительными являются зонды, имеющие последовательности SEQ ID NO: 53-61. Такой зонд можно применять также для идентификации клона кДНК, соответствующего первичному транскрипту и/или геномному клону или клонам, которые содержат полный ген, включая регуляторные и промоторные области, экзоны и интроны. Меченые олигонуклеотиды, имеющие последовательность, комплементарную последовательности гена, предлагаемого в настоящем изобретении, применяют для скрининга библиотеки человеческих кДНК, геномных ДНК или мРНК или подобных библиотек из других источников или животных для локализации представителей библиотек, с которыми зонд гибридизуется. Например, известную последовательность ДНК можно применять для синтеза олигонуклеотидного зонда, который затем используют для скрининга библиотеки с целью выделения кодирующей области представляющего интерес гена. Настоящее изобретение относится также к полинуклеотидам, которые гибридизуются с указанными выше последовательностями, если существует по меньшей мере 70%, предпочтительно по меньшей мере 90% и более предпочтительно по меньшей мере 95% идентичность или подобие между последовательностями, и в результате кодируют белки, обладающие сходной биологической активностью. Кроме того,как известно в данной области, существует "подобие" между двумя полипептидами, когда аминокислотные последовательности содержат одинаковые или консервативные замены каждого индивидуального остатка в последовательности. Идентичность и подобие можно оценивать с помощью программы для анализа последовательностей (например, ClustalW фирмы PBIL (Ple Bioinformatique Lyonnais)http://npsa-pbil.ibcp.fr). Настоящее изобретение относится, в частности, к таким полинуклеотидам, которые гибридизуются в строгих условиях с вышеописанными полинуклеотидами. В контексте настоящего описания понятие "строгие условия" означает условия, обеспечивающие гибридизацию между полинуклеотидными последовательностями и полинуклеотидными последовательностями, представленными вSEQ ID NO: 2-9, когда имеет место по меньшей мере примерно 70% идентичность. Приемлемые по строгости условия можно определять, например, по концентрациям соли или формамида в растворе до гибридизации и в растворе для гибридизации или по температуре гибридизации, и они хорошо известны в данной области. В частности, строгость можно повышать путем снижения концентрации соли, повышения концентрации формамида и/или повышения температуры гибридизации. Например, для гибридизации в строгих условиях можно применять формамид в концентрации примерно 50% при температуре примерно от 37 до 42 С, а для гибридизации в условиях пониженной строгости можно применять формамид в концентрации примерно от 35 до 25% при температуре примерно от 30 до 35 С. Один из конкретных вариантов условий для гибридизации в строгих условиях предусматривает использование температуры 42 С, 50%-ного формамида, 5SSPE, 0,3% ДСН и 200 мкг/мл фрагментированной и денатурированной ДНК спермы лосося. Для гибридизации в условиях пониженной строгости можно применять условия, аналогичные вышеуказанным, но используя 35%-ный формамид при пониженной температуре 35 С. Диапазон температур, соответствующий конкретному уровню строгости,можно дополнительно сужать, рассчитывая соотношение пуриновых и пиримидиновых оснований в представляющей интерес нуклеиновой кислоте и регулируя соответствующим образом температуру. Вариации вышеуказанных диапазонов и условий хорошо известны в данной области. Предпочтительно гибридизация должна происходить только в том случае, когда имеет место по меньшей мере 95% и более предпочтительно по меньшей мере 97% идентичность последовательностей. Полинуклеотиды, которые гибридизуются с описанными выше полинуклеотидами, в предпочтительном варианте осуществления изобретения кодируют полипептиды, которые обладают практически такой же биологической функцией или активностью, что и зрелый белок, кодируемый одной из кДНК, последовательность которых представлена в SEQ ID NO: 2-9. Как отмечалось ранее, приемлемый полинуклеотидный зонд может иметь по меньшей мере 14 оснований, предпочтительно 30 оснований и более предпочтительно по меньшей мере 50 оснований и должен гибридизоваться с полинуклеотидом, предлагаемым в настоящем изобретении, который идентичен ему, как указано выше, и который может сохранять или не сохранять активность. Например, указанные полинуклеотиды можно применять в качестве зонда для гибридизации с полинуклеотидами, последовательности которых представлены в SEQ ID NO: 2- 9 соответственно, например, для выделения указанного полинуклеотида, или в качестве диагностического зонда или в качестве ПЦР-праймера. Таким образом, настоящее изобретение относится к полинуклеотидам, идентичным по меньшей мере на 70%, предпочтительно по меньшей мере на 90% и более предпочтительно по меньшей мере на 95% полинуклеотиду, который кодирует полипептиды, последовательности которых представлены в SEQ ID NO: 11-18 соответственно, а также их фрагментам, где фрагменты предпочтительно имеют по меньшей мере 30 оснований и более предпочтительно по меньшей мере 50 оснований, и к полипептидам, кодируемым указанными полинуклеотидами. Как хорошо известно в данной области, генетический код является избыточным в том смысле, что определенные аминокислоты кодируются более чем одним нуклеотидным триплетом (кодон), и изобретение относится к тем полинуклеотидным последовательностям, которые кодируют одни и те же аминокислоты с помощью кодонов, отличных от тех, которые в качестве конкретного примера указаны в при- 17016584 веденных в описании последовательностях. Указанные полинуклеотидные последовательности обозначают как "эквивалентные" полинуклеотидные последовательности. Настоящее изобретение включает также варианты описанных выше полинуклеотидов, которые кодируют фрагменты, такие как часть или весь зрелый белок, аналоги и производные одного из полипептидов, имеющих выведенные аминокислотные последовательности, представленные в SEQ ID NO: 11-18. Варианты полинуклеотидов могут представлять собой встречающийся в естественных условиях аллельный вариант полинуклеотидов или не встречающийся в естественных условиях аллельный вариант полинуклеотидов. Например, вариант нуклеиновой кислоты может просто иметь различие в последовательности кодона аминокислоты, являющееся результатом вырожденности генетического кода, или может представлять собой полученные в результате делеции варианты, полученные в результате замены варианты или полученные в результате инсерции варианты. Как известно в данной области, аллельный вариант представляет собой альтернативную форму полинуклеотидной последовательности, которая может иметь замену, делецию или добавление одного или нескольких нуклеотидов, которые не приводят к заметному изменению биологической функции кодируемого полипептида. Настоящее изобретение относится также к полипептидам, которые имеют выведенную аминокислотную последовательность, представленную в SEQ ID NO: 11-18, а также к фрагментам, аналогам и производным таких полипептидов. Понятия "фрагмент", "производное" и "аналог" касательно полипептидов, последовательности которых представлены в SEQ ID NO: 11-18, означает полипептиды, которые сохраняют в основном такую же биологическую функцию или активность указанных полипептидов. Аналог может, например, включать пробелок, которые может активироваться в результате отщепления участка пробелка с образованием активного зрелого белка. Полипептиды, предлагаемые в настоящем изобретении, могут представлять собой рекомбинантные полипептиды, встречающиеся в естественных условиях полипептиды или синтетические полипептиды; однако они предпочтительно представляют собой рекомбинантные полипептиды, гликозилированные или негликозилированные. Фрагмент, производное или аналог полипептида, которые соответствуют одной из последовательностей, представленных в SEQ ID NO: 11-18, может представлять собой (I) фрагмент, производное или аналог полипептида, в котором один или несколько аминокислотных остатков заменены консервативным или неконсервативным аминокислотным остатком (предпочтительно консервативным аминокислотным остатком) и такой замененный аминокислотный остаток может кодироваться или не кодироваться одним генетическим кодом, или (II) в котором один или несколько аминокислотных остатков включает группузаместитель, или (III) в котором дополнительные аминокислоты слиты со зрелым белком, такие как лидерная или секреторная последовательность, или последовательность, которую применяют для очистки зрелого полипептида или последовательности пробелка. Подразумевается, что такие фрагменты, производные и аналоги, известные в данной области, можно получать на основе данных, приведенных в настоящем описании. Полипептиды и полинуклеотиды, предлагаемые в настоящем изобретении, могут находиться в выделенной форме и предпочтительно их очищают до практически гомогенного или чистого состояния. Под практически гомогенным состоянием подразумевают чистоту, составляющую по меньшей мере примерно 85%. Понятие "выделенный" применяют для обозначения того, что материал удален из его естественного окружения (например, его природного окружения, если он встречается в естественных условиях). Например, встречающийся в естественных условиях полинуклеотид или полипептид, присутствующий в живом организме, не рассматривается как выделенный, но этот же полинуклеотид или полипептид, отделенный от практически всех совместно существующих материалов в естественной системе, рассматривается как выделенный. Для ДНК понятие включает, например, рекомбинантную ДНК, включенную в вектор, в автономно реплицирующуюся плазмиду или вирус или в геномную ДНК прокариот или эукариот; или существующую в виде индивидуальной молекулы (например, фрагмент кДНК или фрагмент геномной ДНК, полученный с помощью полимеразной цепной реакции (ПЦР) или расщепления рестриктазами), не зависящей от других последовательностей. Понятие включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность,например слитый белок. Оно включает также рекомбинантную ДНК, которая несет фрагмент нуклеотидов, представленных в SEQ ID NO: 2-9, который кодирует полученный в результате альтернативного сплайсинга вариант QPCTL. Примеры различных полученных в результате альтернативного сплайсинга вариантов представлены в SEQ ID NO: 19-22. Полипептиды, предлагаемые в настоящем изобретении, включают любой из полипептидов, представленных в SEQ ID NO: 11-18 (в частности, зрелые белки), а также полипептиды, подобные по меньшей мере на 75% (например, идентичные предпочтительно по меньшей мере на 50% и более, предпочтительно по меньшей мере на 70%) одному из полипептидов, представленных в SEQ ID NO: 11-18, более предпочтительно подобные по меньшей мере на 85% (например, предпочтительно идентичные по меньшей мере на 70%) одному из полипептидов, представленных в SEQ ID NO: 11-18, и наиболее предпочтительно подобные по меньшей мере на 95% (например, идентичные предпочтительно по меньшей мере на 90%) одному из полипептидов, представленных в SEQ ID NO: 11-18. Кроме того, они должны предпоч- 18016584 тительно включать правильные участки указанных полипептидов, содержащих последовательность, состоящую по меньшей мере из 30 аминокислот и более, предпочтительно по меньшей мере из 50 аминокислот. Фрагменты или участки полипептидов, предлагаемых в настоящем изобретении, можно применять в качестве промежуточных продуктов для получения соответствующих полноразмерных полипептидов путем пептидного синтеза. Фрагменты или участки полинуклеотидов, предлагаемых в настоящем изобретении, можно применять также для синтеза полноразмерных полинуклеотидов, предлагаемых в настоящем изобретении. Настоящее изобретение относится также к векторам, которые включают указанные полинуклеотиды, клеткам-хозяевам, которые создают с помощью генной инженерии с использованием указанных векторов, и к получению полипептидов методами рекомбинации с использованием вышеуказанных векторов. Клетки-хозяемва создают методами генной инженерии (путем трансдукции или трансформации или трансфекции) с использованием таких векторов, которые могут представлять собой, например, клонирующий вектор или экспрессионный вектор. Вектор может иметь, например, форму плазмиды, вирусной частицы, фага и т.д. Сконструированные клетки-хозяева можно культивировать в общепринятых питательных средах, модифицированных при необходимости для активации промоторов, отбора трансформантов или амплификации генов, предлагаемых в настоящем изобретении. Условия культивирования,такие как температура, значение рН и т.п., представляют собой условия, обычно применяемые для клеток-хозяев, отобранных для экспрессии, которые также хорошо известны обычным специалистам в данной области. Полинуклеотиды, предлагаемые в настоящем изобретении, можно применять для получения полипептидов методами рекомбинации. Так, например, полинуклеотиды можно встраивать в любой из широкого разнообразия экспрессионных векторов с целью экспрессии полипептидов. Указанные векторы включают хромосомные, нехромосомные и синтетические последовательности ДНК, например производные SV40; бактериальные плазмиды; фаговые ДНК; бакуловирусы; плазмиды на основе дрожжей; векторы, полученные из комбинаций плазмид и фаговых ДНК, вирусные ДНК, такие как вирус кори,аденовирус, вирус оспы птиц и вирус псевдобешенства. Однако можно применять любой другой вектор,если он обладает способностью реплицироваться и является жизнеспособным в хозяине. Соответствующую последовательность ДНК можно встраивать в вектор с помощью любой из широкого разнообразия процедур. В целом, последовательность ДНК встраивают в соответствующий(ие) сайт(ы), распознаваемый(ые) рестриктазами, с помощью методик, которые должны быть известны специалистам в данной области. Последовательность ДНК в экспрессионном векторе функционально связывают с соответствующей(ими), контролирующей(ими) экспрессию последовательностью(ями) (промотор) для обеспечения синтеза мРНК. Репрезентативными примерами таких промоторов, которые следует упомянуть, являются: промотор LTR или SV40, промотор Е. coli lac или trp, промотор фага лямбда P.sub.L и другие промоторы,для которых известна способность контролировать экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Экспрессионные векторы должны содержать также сайт связывания рибосомы для инициации трансляции и терминатор транскрипции. Вектор может содержать также соответствующие последовательности для амплификации экспрессии. Кроме того, экспрессионные векторы предпочтительно содержат один или несколько селектируемых маркерных генов для придания фенотипического признака для отбора трансформированных клеток-хозяев, такие как ген дегидрофолатредуктазы и ген, обусловливающий устойчивость к неомицину, для культуры эукариотических клеток, или гены, обусловливающие устойчивость к тетрациклину или ампициллину, для Е. coli. Вектор, содержащий соответствующую последовательность ДНК, указанную выше, а также соответствующий промотор или контролирующую последовательность, можно применять для трансформации соответствующей клетки-хозяина с целью экспрессии белка. В качестве репрезентативных примеров соответствующих хозяев следует упомянуть: клетки бактерий, такие как Е. coli, Streptomyces, SalmonellaSf9; клетки животных, такие как СНО, COS или меланома Боуэса; аденовирусы; клетки растений и т.д. Выбор соответствующего хозяина должен быть очевиден специалистам в данной области на основе представленной в настоящем описании информации. Получение нуклеотидных последовательностей с помощью синтеза хорошо известно в данной области, в частности описано в каталоге фирмы CLONTECH 95/96, cc. 215-216, CLONTECH, 1020 EastMeadow Circle, Palo Alto, Calif. 94303. Таким образом, настоящее изобретение относится также к экспрессионным векторам, которые можно применять для получения белков, предлагаемых в настоящем изобретении. Настоящее изобретение относится также к рекомбинантным конструкциям, содержащим одну или несколько последовательностей, которые в целом описаны выше. Конструкции могут содержать вектор, такой как плазмидный или вирусный вектор, в который встроена последовательность, предлагаемая в изобретении, в прямой или обратной ориентации. В предпочтительном аспекте этого варианта осуществления изобретения конструкция содержит также регуляторные последовательности, включая,- 19016584 например, промотор, функционально связанный с последовательностью. Специалистам в данной области известно широкое разнообразие приемлемых векторов и промоторов, и они поступают в продажу. В качестве примера можно упомянуть следующие векторы: бактериальные: pQE70, pQE60, pQE-9 (фирмаpWLNEO, pSV2CAT, pOG44, pXTI, pSG (фирма Stratagene), pSVK3, pBPV, pMSG и pSVL (фирма Pharmacia). Однако можно применять любую другую приемлемую плазмиду или вектор, если они обладают способностью реплицироваться и обладают жизнеспособностью в хозяине. Промоторные области можно выбирать из любого требуемого гена, используя несущие CAT (хлорамфениколацетилтрансфераза) векторы или другие векторы, содержащие селектируемые маркеры. Двумя приемлемыми векторами являются pKK232-8 и рСМ 7. Среди бактериальных промоторов следует упомянуть lacI, lacZ, Т 3, Т 7, gpt, лямбда P.sub.R, P.sub.L и trp. Эукариотические промоторы представляют собой немедленно ранний промотор CMV, промотор тимидинкиназы HSV, ранний и поздний промотор SV40, промотор LTR из ретровирусов и промотор мышиного металлтионеина-I. Выбор соответствующего вектора и промотора находится в компетенции обычного специалиста в данной области. Компоненты экспрессионного вектора могут, как правило, представлять собой: 1) ген неомицинфосфотрансферазы (G418) или фосфотрансферазы гигромиина В (hyg) в качестве маркера для селекции,2) сайт инициации репликации Е coli, 3) промоторные последовательности фага Т 7 и SP6, 4) операторные последовательности lac, 5) ген-репрессор оперона лактозы (lacIq) и 6) линкерную область множественного сайта клонирования. Указанный сайт инициации репликации (oriC) можно выводить из pUC19 (фирма LTI, Геттисберг, шт. Мэриленд). Нуклеотидную последовательность, кодирующую один из полипептидов, представленных в SEQ IDNO: 2-9, которая несет соответствующий сайт рестрикции, создают, как правило, с помощью ПЦРпротокола, описанного ниже в примерах 1 и 2, используя ПЦР-праймеры, несущие сайты рестрикции,распознаваемые EcoR I (в качестве 5'-праймера) и Sal I (в качестве 3'-праймера), для клонированияEcoR I (в качестве 3'-праймера), для клонирования isoQC в вектор рЕТ 41 а. ПЦР-вставки очищают на геле и расщепляют соответствующими рестриктазами. Вставку и вектор лигируют с помощью стандартных протоколов. Следующим вариантом осуществления настоящего изобретения являются клетки-хозяева, содержащие вышеописанные конструкции. Клетка-хозяин может представлять собой клетку высшего эукариотического организма, такую как клетка млекопитающего, или клетку низшего эукариотического организма, такую как клетка дрожжей, или клетка-хозяин может представлять собой прокариотическую клетку, такую как бактериальная клетка. Интродукцию конструкции в клетку-хозяина можно осуществлять с помощью трансфекции с использованием фосфата кальция, опосредуемой ДЭАЭ диэтиламино)этилцеллюлоза)-декстраном трансфекции, с помощью липофектина или путем электропорации (DavisL., Dibner M., Battey I., Basic Methods in Molecular Biology, 1986). Такие конструкции в клетке-хозяине предпочтительно применяют общепринятым образом для получения генного продукта, кодируемого рекомбинантной последовательностью. В другом варианте полипептиды, предлагаемые в изобретении, можно получать путем синтеза с помощью обычных пептидных синтезаторов или путем химического лигирования приемлемых фрагментов, полученных таким образом. Зрелые белки можно экспрессировать в клетках млекопитающих, дрожжей, бактерий или в других клетках под контролем соответствующих промоторов. Для получения указанных белков можно применять также бесклеточные системы трансляции, используя РНК, выведенные из конструкций ДНК, предлагаемых в настоящем изобретении. Соответствующие клонирующие и экспрессионные векторы, предназначенные для применения в сочетании с прокариотическими и эукариотическими хозяевами, описаны у Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-ое изд., изд-во Cold Spring Harbor, N. Y.,1989. Транскрипцию ДНК, кодирующей полипептиды, предлагаемые в настоящем изобретении, в высших эукариотических организмах повышают путем встраивания в вектор энхансерной последовательности. Энхансеры включают цис-активные элементы ДНК, как правило, состоящие примерно из 10-300 пар оснований, которые оказывают воздействие на промотор, повышая транскрипцию. Их примерами являются энхансер SV40 на удаленной стороне сайта инициации репликации длиной 100-270 пар оснований, энхансер раннего промотора цитомегаловируса, энхансер промотора полиомы на удаленной стороне сайта инициации репликации и энхансеры аденовирусов. Как правило, рекомбинантные экспрессионные векторы должны включать сайты инициации репликации и селектируемые маркеры, обеспечивающие трансформацию клетки-хозяина, например, ген, обусловливающий устойчивость к ампициллину, в Е. coli и ген TRP1 S. cerevisiae, и промотор, выведенный из гена с высоким уровнем экспрессии для обеспечения транскрипции расположенной в прямом направ- 20016584 лении структурной последовательности. Такие промоторы можно выводить из оперонов, кодирующих гликолитические ферменты, такие как (но, не ограничиваясь только ими) 3-фосфоглицераткиназа (PGK),альфа-фактор, кислая фосфатаза или белки теплового шока. Гетерологичную структурную последовательность собирают на соответствующей фазе с последовательностями инициации и терминации трансляции и предпочтительно лидерной последовательностью, обладающей способностью обеспечивать секрецию транслированного белка в периплазматическое пространство или внеклеточную среду. Необязательно гетерологичная последовательность может кодировать слитый белок, включающий N-концевой идентифицирующий пептид, придающий требуемые характеристики, например стабилизацию или упрощение очистки экспрессируемого рекомбинантного продукта. Приемлемые экспрессионные векторы, предназначенные для использования в бактериях, конструируют путем встраивания последовательности структурной ДНК, кодирующей требуемый белок, в сочетании с приемлемыми сигналами инициации и терминации трансляции в функциональной рамке считывания с использованием функционального промотора. Вектор должен содержать один или несколько фенотипических селектируемых маркеров и сайт инициации репликации для гарантии сохранения вектора и при необходимости для обеспечения амплификации в хозяине. Пригодные для трансформации прокариотические хозяева представляют собой Е.coli, Bacillus subtilis, Salmonella typhimurium и различные виды родов Pseudomonas, Streptomyces иStaphylococcus, хотя можно применять также отобранные другие виды. Репрезентативные экспрессионные векторы, которые можно применять в бактериях, могут содержать (но, не ограничиваясь только ими) селектируемый маркер и бактериальный сайт инициации репликации, выведенный из поступающих в продажу плазмид, которые содержат генетические элементы хорошо известного клонирующего вектора pBR322 (ATCC 37017). Такими поступающими в продажу векторами являются, например, pKK223-3 (фирма Pharmacia Fine Chemicals, Уппсала, Швеция) и GEM1(фирма Promega Biotec, Мэдисон, шт. Висконсин, США). Эти "каркасные" секции pBR322 объединяют с соответствующим промотором и структурной последовательностью, подлежащей экспрессии. После трансформации приемлемого штамма-хозяина и выращивания штамма-хозяина до соответствующей клеточной плотности индуцируют выбранный промотор соответствующими средствами (например, изменением температуры или путем химической индукции) и клетки культивируют в течение дополнительного периода времени. Клетки, как правило, собирают центрифугированием и затем разрушают физическими или химическими средствами, а полученный неочищенный экстракт сохраняют для дополнительной очистки. Микробные клетки, применяемые для экспрессии белков, можно разрушать любым традиционным методом, включая циклы замораживания-оттаивания, обработку ультразвуком, механическое разрушение и применение лизирующих клетки агентов; указанные методы хорошо известны специалистам в данной области. Для экспрессии рекомбинантного белка можно применять также различные культуральные системы клеток млекопитающих. Примерами систем экспрессии на основе клеток млекопитающих являются фибробласты почки обезьяны линии COS-7, описанные Gluzman, Cell, 23, 1981, с. 175. Другие клеточные линии, которые могут экспрессировать совместимый с ними вектор, включают, например, клеточные линии С 127, 3 Т 3, СНО, HeLa и BHK. Экспрессионные векторы млекопитающих должны содержать, как правило, сайт инициации репликации, приемлемый промотор и энхансер, а также любые необходимые сайты связывания рибосом, сайт полиаденилирования, донор и акцептор сплайсинга, последовательности терминаторов транскрипции и 5'-фланкирующие нетранскрибируемые последовательности. Последовательности ДНК, выведенные из сайта сплайсинга SV40, и сайты полиаденилирования можно применять для получения требуемых нетранскрибируемых генетических элементов. Полипептиды можно выделять и очищать из рекомбинантных клеточных культур такими методами,как осаждение сульфатом аммония или этанолом, экстракция кислотами, анионо- или катионообменная хроматография, хроматография на фосфоцеллюлозе, хроматография на основе гидрофобных взаимодействий, аффинная хроматография, хроматография на гидроксилапатите и хроматография на лектине. Выделение может облегчаться, если полипептид экспрессируется на поверхности клеток, но это не является необходимым условием. Может требоваться также выделение расщепленных продуктов, которые расщепляют после экспрессии более длинной формы полипептида. При необходимости можно использовать стадии повторной укладки белка, известные в данной области, для завершения конфигурации зрелого белка. Для конечных стадий очистки можно использовать жидкостную хроматографию высокого разрешения (ЖХВР). Полипептиды, предлагаемые в настоящем изобретении, могут представлять собой очищенные натуральные продукты или продукты, полученные с помощью методов рекомбинации, из прокариотического или эукариотического хозяина (например, с использованием культур клеток бактерий, дрожжей,высших растений, насекомых или млекопитающих). В зависимости от применяемого хозяина в процессе рекомбинантного получения полипептиды, предлагаемые в настоящем изобретении, могут быть гликозилированными или не гликозилированными. Полипептиды, предлагаемые в изобретении, могут включать также остаток метионина в качестве начального аминокислотного остатка.- 21016584 В предпочтительном варианте осуществления изобретения белки, предлагаемые в изобретении, выделяют и очищают так, чтобы они практически не содержали других белковых загрязнителей. Например,на долю белков, предлагаемых в изобретении, должно приходиться по меньшей мере 80 мас.% от общего содержания белка в образце, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 98 мас.% от общего содержания белка. Эти белки могут иметь форму раствора в воде, другом приемлемом растворителе, таком как диметилсульфоксид (ДМСО) или этанол, или в смеси приемлемых растворителей. Примерами смесей растворителей являются смеси, включающие 10 мас.% этанола в воде и 2 мас.% ДМСО в воде. Раствор может содержать также соли, забуферивающие агенты, хаотропные агенты, детергенты, консерванты и т.п. В другом варианте белки могут находиться в форме твердого вещества, такого как лиофилизированный порошок или кристаллическое твердое вещество, которое может включать остаточные количества растворителя, соль или т.п. В контексте настоящего описания понятие "антитела" включает поликлональные антитела, очищенные на основе аффинности поликлональные антитела, моноклональные антитела и антигенсвязывающие фрагменты, такие как протеолитические F(ab')2- и Fab'-фрагменты. Под определение подпадают также созданные с помощью генной инженерии интактные антитела или фрагменты, такие как химерные антитела, Fv-фрагменты, одноцепочечные антитела и т.п., а также синтетические антигенсвязывающие пептиды и полипептиды. Нечеловеческие антитела можно гуманизировать путем трансплантации нечеловеческих CDR в человеческие каркасные и константные области или путем включения полных нечеловеческих вариабельных областей (необязательно "маскируя" их с помощью поверхности, напоминающей человеческую, путем замены выставленных "напоказ" (презентуемых) остатков, результатом чего является "облицованное" антитело). В некоторых случаях гуманизированные антитела могут сохранять нечеловеческие остатки в каркасных участках человеческой вариабельной области для усиления соответствующих характеристик связывания. Благодаря гуманизации антител можно повышать биологическое время полужизни и снижать возможные отрицательные иммунные реакции при введении человеку. Другие методы создания или отбора антител, которые можно применять согласно настоящему изобретению, включают обработку in vitro лимфоцитов человеческим белком или пептидом isoQC и отбор презентующих антитела библиотек в фаговых или подобных векторах (например, путем применения иммобилизованного или меченого человеческого белка или пептида isoQC). Гены, кодирующие полипептиды, которые несут потенциальные домены связывания с человеческим полипептидом isoQC, можно получать путем случайного скрининга презентующих пептиды фаговых (фаговая презентация) или бактериальных (например, с использованием Е. coli) библиотек. Нуклеотидные последовательности, кодирующие указанные полипептиды, можно получать различными путями,известными в данной области. Как должно быть очевидно обычному специалисту в данной области, поликлональные антитела можно получать путем введения различным теплокровным животным, таким как лошади, коровы, козы,овцы, куры, кролики, мыши и крысы, человеческого полипептида isoQC или его фрагмента. Иммуногенность человеческого полипептида isoQC можно повышать с помощью адъюванта, такого как квасцы(гидроксид алюминия) или полного или неполного адъюванта Фрейнда, или поверхностно-активных веществ, таких как лизолецитин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, KLH или динитрофенол. Среди адъювантов, которые можно применять для введения человеку, наиболее предпочтительными являются БЦЖ (бацилла Кальмета-Герена) и Corynebacterium parvum. Полипептиды,которые можно применять для иммунизации, включают слитые полипептиды, такие как слияния полипептида isoQC или его участка с полипептидом иммуноглобулина или связывающим мальтозу белком. Иммуногенный полипептид может представлять собой полноразмерную молекулу или ее часть. Если полипептидный участок является "гаптенподобным", то такой участок для иммунизации может оказаться целесообразным соединять или сцеплять с макромолекулярным носителем, таким как гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (БСА) или токсоид столбняка. Антитела к isoQC можно создавать также с помощью методов, хорошо известных в данной области. Такие антитела могут представлять собой (но, не ограничиваясь только ими) поликлональные, моноклональные, химерные и одноцепочечные антитела, Fab-фрагменты и фрагменты, полученные с помощью экспрессионных библиотек Fab-фрагментов. Нейтрализующие антитела (т.е. антитела, которые блокируют или модифицируют взаимодействия на активных сайтах) являются наиболее предпочтительными для терапевтического применения. Для получения антител, связывающих белков или пептидов, которые специфически связываются сQPCTL, можно подвергать скринингу библиотеки одноцепочечных антител, Fab-фрагментов, других фрагментов антител, белковых доменов субстанций, не относящихся к антителам, или пептидов. Библиотеки можно создавать с помощью фаговой презентации, других методов рекомбинантной ДНК или пептидного синтеза (Vaughan T. J. и др., Nature Biotechnology 14, 1966, cc. 309-314). Такие библиотеки, как правило, подвергают скринингу с использованием методов, которые хорошо известны в данной области,для идентификации последовательностей, для которых характерно специфическое связывание с QPCTL.- 22016584 Предпочтительно олигопептиды, пептиды или их фрагменты, применяемые для индукции антител кQPCTL, имеют аминокислотную последовательность, состоящую по меньшей мере примерно из 5 аминокислот и более предпочтительно по меньшей мере примерно из 10 аминокислот. Предпочтительно также эти олигопептиды, пептиды или фрагменты идентичны части аминокислотной последовательности встречающегося в естественных условиях белка. Короткие участки аминокислотной последовательностиQPCTL можно также сливать с другим белком, таким как KLH, и получать в результате антитела к химерной молекуле. Моноклональные антитела к QPCTL можно получать с помощью любого хорошо известного метода, обеспечивающего получение молекул антител с помощью непрерывных культур клеточных линий. Они включают (но, не ограничиваясь только ими) метод гибридом, метод человеческих В-клеточных гибридом и метод на основе EBV-гибридом, хотя предпочтительными являются моноклональные антитела, полученные с помощью клеток гибридом. Кроме того, можно применять методы, разработанные для производства "химерных антител", такие как сплайсинг мышиных генов антител с генами человеческих антител с получением молекулы с соответствующей антигенспецифичностью и биологической активностью (см. Neuberger M. S. и др., Nature 312, 1984, cc. 604-608). В другом варианте методики, описанные для производства одноцепочечных антител, можно адаптировать, используя известные в данной области методы, для получения QPCTLспецифических одноцепочечных антител. Антитела с родственной специфичностью, но с различным идиотипическим составом можно создавать путем перестановки цепи из произвольных комбинаторных библиотек иммуноглобулинов (Burton D. R., Proc. Natl. Acad. Sci. 88, 1991, cc. 11120-11123). Антитела можно получать также путем индукции in vivo производства в популяции лимфоцитов или путем скрининга библиотек иммуноглобулинов или панелей высоко специфических связывающихся реагентов согласно известным из литературы методам (Orlandi R. и др., Proc. Natl. Acad. Sci. 86, 1989, cc. 3833-3837). Можно создавать также фрагменты антител, которые содержат специфические сайты связыванияQPCTL. Например, такие фрагменты включают (но, не ограничиваясь только ими) F(ab')2-фрагменты,которые образуются в результате расщепления пепсином молекулы антитела, и Fab-фрагменты, которые образуются при восстановлении дисульфидных мостиков F(ab')2-фрагментов. В другом варианте можно конструировать экспрессионные библиотеки Fab-фрагментов, что позволяет быстро и просто идентифицировать моноклональные Fab-фрагменты с требуемой специфичностью (Huse W. D. и др., Science 254,1989, cc. 1275-1281). Различные иммуноанализы можно применять для идентификации антител, имеющих требуемую специфичность. В данной области хорошо известны многочисленные протоколы конкурентного связывания или иммунорадиометрических анализов, в которых используют либо поликлональные, либо моноклональные антитела с установленной специфичностью. Такие иммуноанализы, как правило, включают оценку комплексообразования между QPCTL и специфическим для него антителом. Предпочтительным является двусайтовый, основанный на применении моноклональных антител, реактивных к двум не взаимодействующим эпитопам QPCTL, но можно применять также анализ, основанный на конкурентном связывании. Как отмечалось ранее, QPCTL можно применять для лечения болезней. Фармацевтические композиции, приемлемые для применения в этом объекте изобретения, включают композиции, в которых действующие вещества присутствуют в эффективных касательно одного из заболеваний количествах для достижения поставленной цели. Определение терапевтически эффективной дозы находится в компетенции специалистов в данной области и ее можно определять первоначально либо с помощью анализов в клеточных культурах, например в неопластических клетках, или на моделях,созданных на животных, как правило, таких как мыши, крысы, кролики, собаки или свиньи. Созданную на животном модель можно применять также для определения соответствующего диапазона концентраций и пути введения, указанную информацию затем, как правило, используют для определения доз и путей введения, которые можно применять на людях. Терапевтически эффективная доза означает количество действующего вещества, например, QPCTL или фрагмента, антител к DPRP или агониста, антагониста или ингибитора QPCTL, которое облегчает конкретные симптомы или состояния заболевания. Например, количество, подлежащее введению, может обладать эффективностью в отношении циклизации N-концевого Glu или Gln требуемого субстратамишени при контакте с ним. Терапевтическую эффективность и токсичность можно определять также стандартными фармацевтическими процедурами в культурах клеток или на экспериментальных животных, например, статистически рассчитывая значение ED50 (доза, обладающая терапевтической эффективностью в отношении 50% популяции) или LD50 (доза, смертельная для 50% популяции). Соотношение доз, вызывающих токсическое и терапевтическое действие, представляет собой терапевтический индекс,и его можно выражать в виде соотношения LD50/ED50. Фармацевтические композиции, для которых характерен высокий терапевтический индекс, являются предпочтительными. Данные, полученные с помощью анализов клеточных культур и в опытах на животных, применяют при определении диапазона входящих в препаративную форму доз для применения на человеке. Доза, входящая в такие композиции,- 23016584 предпочтительно соответствует диапазону присутствующих в кровотоке концентраций, которые включают ED50, обладающих невысокой токсичностью или не обладающих токсичностью. Уровень доз в указанном диапазоне зависит от применяемой формы лекарственного средства, чувствительности пациента и пути введения. Точную дозу, как правило, должен определять специалист в области медицины с учетом таких факторов, как индивидуум, подлежащий лечению, при этом дозу и ее применение регулируют для обеспечения достаточного уровня активного фрагмента или поддержания требуемого действия. Факторы, которые следует учитывать, включают серьезность болезненного состояния, общее состояние здоровья индивидуума, возраст, вес и пол индивидуума, диету, время и частоту введения, комбинацию(и) лекарственных средств, реакцию чувствительности, переносимость/ответ на терапию. Фармацевтические композиции пролонгированного действия можно вводить каждые 3-4 дня, каждую неделю или даже каждые две недели в зависимости от времени полужизни и скорости клиренса конкретной формы. Еще одним объектом изобретения являются молекулы полинуклеотидов, имеющие последовательности, которые являются антисмысловыми относительно мРНК-транскриптов полинуклеотидов, представленных в SEQ ID NO: 2-9. Введение молекулы антисмыслового полинуклеотида может блокировать производство белка, кодируемого генами QPCTL, последовательности которых представлены в SEQ IDNO: 2-9. Методы получения молекул антисмысловых полинуклеотидов и введение таких молекул известно в данной области. Например, молекулы антисмысловых полинуклеотидов можно капсулировать в липосомах для слияния с клетками. В частности, экспрессия генов QPCTL, последовательности которых представлены в SEQ ID NO: 29, в ткани головного мозга, предстательной железы, легкого, сердца, печени, селезенки и почки свидетельствует о ее возможной роли в патофизиологии указанных ниже болезней. Таким образом, следующим объектом изобретения являются диагностические анализы, предназначенные для выявления болезней, ассоциированных с неадекватной активностью или уровнем экспрессии QPCTL. Антитела, которые специфически связываются с QPCTL, можно применять для диагностики нарушений, характеризующихся экспрессией QPCTL, или в анализах, предназначенных для выявления пациентов, которых можно лечить с помощью QPCTL или агонистов или антагонистов (ингибиторов) QPCTL. Антитела, которые можно применять для целей диагностики, можно получать аналогично методам, описанным выше для получения терапевтических агентов. Диагностические анализы, предназначенные для выявления QPCTL,основаны на методах, которые предусматривают применение антитела и метки для выявления QPCTL в общей воде организма человека или в экстрактах клеток или тканей. Антитела можно применять с модификацией или без модификаций и их можно метить путем ковального или нековалентного связывания с репортерной молекулой. В данной области известно широкое разнообразие репортерных молекул. Рекомбинантные белки QPCTL, модифицированные так, чтобы они становились каталитически неактивными, можно применять также в качестве доминантных ингибиторов отрицательного действия. Такие модификации включают, например, мутацию активного сайта. В данной области известны различные протоколы для оценки QPCTL, включая ELISA, РИА иFACS, и они являются основой для диагностирования измененных или аномальных уровней экспрессииQPCTL. Нормальные или стандартные значения уровня экспрессии QPCTL определяют, объединяя общую воду организма или клеточные экстракты, взятые у здоровых млекопитающих, предпочтительно людей, с антителом к QPCTL в условиях, приемлемых для образования комплекса. Метод выявленияQPCTL в биологическом образце должен включать стадии, на которых а) получают биологический образец; б) объединяют биологический образец с антителом к QPCTL в условиях, приемлемых для образования комплекса между QPCTL и антителом; и в) выявляют образование комплекса между QPCTL и антителом, выявляя тем самым присутствие QPCTL в биологическом образце. Уровень комплексообразования затем можно оценивать количественно различными методами,предпочтительно фотометрически. Уровни QPCTL, экспрессируемые в индивидууме, контроле и образце пораженной болезнью ткани, полученном с помощью биопсии, сравнивают со стандартным значением. Различие между стандартными и полученными для индивидуума значениями представляет собой параметры, позволяющие диагностировать болезнь. В другом варианте осуществления изобретения полинуклеотиды, кодирующие QPCTL, применяют для диагностических целей, при этом полинуклеотиды могут включать олигонуклеотидные последовательности, комплементарные молекулам РНК и ДНК, а также ПНК. Эти полинуклеотиды можно применять для выявления и количественной оценки экспрессии гена в полученных путем биопсии тканях, в которых экспрессия QPCTL может коррелировать с одним из заболеваний. Диагностический анализ можно применять для выявления отсутствия, присутствия или избыточного уровня экспрессии QPCTL и для мониторинга регуляции уровней QPCTL в процессе терапевтического вмешательства. Кроме того,фармакогеномный, основанный на полиморфизмах одного нуклеотида (SNP) анализ генов QPCTL можно применять в качестве метода скрининга мутаций, свидетельствующих о предрасположенности к заболеванию или измененному ответу на лекарственные средства. Полинуклеотидные и полипептидные последовательности QPCTL, их фрагменты, антитела кQPCTL и агонисты, антагонисты или ингибиторы QPCTL можно применять в качестве диагностических- 24016584 инструментов для идентификации случаев молекулярного распознавания и белков, полипептидов и пептидов, которые взаимодействуют с белками QPCTL. Конкретным примером являются фаговые дисплейные пептидные библиотеки, содержащие более 108 пептидных последовательностей, которые можно подвергать скринингу в одном цикле пэннинга. Такие методы, а также другие, известные в данной области, можно использовать для идентификации соединений, которые ингибируют или усиливают активность одной из QPCTL, представленных в SEQ ID NO: 11-18. Полученные в результате сочетания связи представляют собой функциональные взаимодействия,такие как комплексы или каскады реакций, и белки, которые взаимодействуют с QPCTL, можно идентифицировать с помощью дрожжевой двухгибридой системы, такой как протеомикс (дифференциальный анализ в 2D-гелях и масс-спектрометрия), и геномный анализ (дифференциальный анализ генной экспрессии с помощью микромассива или серийный анализ генной экспрессии (SAGE. Белки, идентифицированные в качестве функционально связанных с QPCTL, и процессы их взаимодействия составляют основу методов скрининга ингибиторов, агонистов и антагонистов и модуляторов этих взаимодействий QPCTL-белок. Понятие "антагонист" в контексте настоящего описания относится к молекуле-ингибитору, которая при связывании с QPCTL снижает уровень или продолжительность действия биологической или иммунологической активности QPCTL, например, снижая ферментативную активность пептидазы в отношении циклизации остатков Glu или Gln на N-конце субстратов QPCTL. Антагонисты могут представлять собой белки, нуклеиновые кислоты, углеводы, антитела или любые другие молекулы, которые снижают действие QPCTL; например, они могут представлять собой небольшие молекулы и органические соединения, которые связываются с QPCTL и инактивируют их путем механизма конкурентного или неконкурентного типа. Предпочтительными являются небольшие молекулы-ингибиторы QPCTL. Наиболее предпочтительными являются конкурентные небольшие молекулы-ингибиторы QPCTL. Специфические примеры ингибиторов ферментативной активности QPCTL представлены в примере 4. Ингибиторы могут представлять собой, например, ингибиторы циклазной активности QPCTL или в другом варианте ингибиторы активности связывания QPCTL с белками, с которыми они взаимодействуют. Конкретными примерами указанных ингибиторов могут являться, например, антитела к QPCTL антитела, пептиды, белковые фрагменты или небольшие ингибиторы пептидилпротеаз, или небольшие непептидные органические молекулы-ингибиторы, которые приготавливают в среде, которую можно интродуцировать в требуемый тип клеток. В другом варианте указанные ингибиторы можно присоединять к обеспечивающим направленный перенос лигандам для интродукции путем опосредуемого клеткой эндоцитоза и других опосредуемых рецептором событий. Указанные методы описаны дополнительно ниже и их могут использовать на практике специалисты в данной области с учетом данных о нуклеотидных и аминокислотных последовательностях QPCTL, представленных в настоящем описании. Еще одним вариантом применения QPCTL является скрининг потенциальных антагонистов для применения в качестве терапевтических агентов, например для ингибирования связывания с QPCTL, а также скрининг агонистов. Таким образом, QPCTL, ее иммуногенные фрагменты или олигопептиды можно применять для скрининга библиотек соединений, которые являются перспективными агонистами или антагонистами, с использованием любого из разнообразных методов скрининга лекарственных средств. Фрагмент, применяемый для указанного скрининга, может присутствовать в растворе в свободном состоянии, может фиксироваться на твердой подложке, находиться на клеточной поверхности или может иметь внутриклеточную локализацию. Затем оценивают образование полученных путем связывания комплексов между QPCTL и агентом, подлежащим тестированию. Другие анализы, предназначенные для выявления антагонистов, которые должны ингибировать QPCTL, представлены в заявках на патентWO 2004/098625, WO 2004/098591 и WO 2005/075436, в которых описаны ингибиторы QC и которые полностью включены в настоящее описание в качестве ссылки. Другим вариантом применения этихQPCTL, который следует отметить, является скрининг ингибиторов QC, осуществляемый для того, чтобы продемонстрировать, что они не обладают нежелательными побочными действиями, путем ингибирования также одной или нескольких QPCTL. Метод, предложенный для скрининга библиотек небольших молекул с целью идентификации молекулы, которая связывается с QPCTL, как правило, заключается в том, что: а) получают библиотеку небольших молекул; б) объединяют библиотеку небольших молекул с полипептидом, последовательность которого представлена в одной из SEQ ID NO: 11-18, или его фрагментом в условиях, которые являются пригодными для образования комплекса; и в) выявляют образование комплекса, при этом присутствие такого комплекса позволяет идентифицировать небольшую молекулу, которая связывается с QPCTL. Один из методов идентификации антагониста заключается в том, что вводят небольшую молекулу,которая связывается с QPCTL, в экстракты клеток, трансформированных вектором, который экспрессирует QPCTL, наряду с хромогенным субстратом (например, Ala-Pro-AFC или Ala-Pro-AMC) в условиях, в которых в норме должно происходить расщепление, а затем оценивают ингибирование расщепления ферментом по изменениям флуоресценции или абсорбции УФ-света, с помощью спектрофотометрии для идентификации молекул, которые ингибируют расщепление. Пониженная скорость реакции или общий уровень флуоресценции или абсорбции УФ-света в присутствии молекулы свидетельствуют о том, что- 25016584 небольшая молекула является антагонистом, который снижает каталитическую/ферментативную активность QPCTL. После идентификации таких молекул их можно вводить для снижения или ингибирования циклизации находящихся на N-конце остатков Glu или Gln с помощью QPCTL. Еще одним конкретным объектом изобретения является способ скрининга соединений, обладающих способностью ингибировать ферментативную активность по меньшей мере одного зрелого белка,предлагаемого в настоящем изобретении, предпочтительно выбранного из белков, последовательности которых представлены в SEQ ID NO: 11-18, где способ заключается в том, что инкубируют зрелый белок и приемлемый субстрат зрелого белка в присутствии одного или нескольких тестируемых соединений или их солей, оценивают ферментативную активность зрелого белка, сравнивают указанную активность с соответствующей активностью, определенной в отсутствие тестируемого соединения, и отбирают тестируемое соединение или соединения, которое(ые) снижает(ют) ферментативную активность. Изобретение относится также к способу скрининга избирательных QC-ингибиторов, т.е. соединений, обладающих способностью ингибировать ферментативную активность QC, где QC предпочтительно представляет собой белок, последовательность которого представлена в SEQ ID NO: 10, который не ингибирует ферментативную активность по меньшей мере одного зрелого белка, предлагаемого в настоящем изобретении, предпочтительно выбранного из белков, последовательности которых представлены вSEQ ID NO: 11-18, где способ заключается в том, что инкубируют указанный зрелый белок и приемлемый субстрат в присутствии одного или нескольких ингибиторов QC или их солей, оценивают ферментативную активность зрелого белка, сравнивают указанную активность с соответствующей активностью,определенной в отсутствие ингибитора QC, и отбирают соединение, которое не снижает ферментативную активность зрелого белка. Изобретение относится также к способу скрининга избирательных QPCTL-ингибиторов, т.е. соединений, обладающих способностью ингибировать ферментативную активность по меньшей мере одного белка QPCTL, который предпочтительно выбирают из белков, последовательности которых представлены в SEQ ID NO: 11-18; которые не ингибируют ферментативную активность QC, где QC предпочтительно представляет собой белок, последовательность которого представлена в SEQ ID NO: 10, где способ заключается в том, что инкубируют указанный белок QC и приемлемый субстрат в присутствии одного или нескольких ингибиторов QPCTL или их солей, оценивают ферментативную активность QC,сравнивают указанную активность с соответствующей активностью, определенной в отсутствие ингибитора QPCTL, и отбирают соединение, которое не снижает ферментативную активность указанного белкаQPCTL. Ценные ингибиторы QC, которые можно применять также в качестве ингибиторов QPCTL, описаны в WO 2004/098625, WO 2004/098591, WO 2005/039548 и WO 2005/075436, которые полностью включены в настоящее описание в качестве ссылки, прежде всего касательно структуры ингибиторов и их получения. Примеры QPCTL-ингибиторов Потенциальные QPCTL-ингибиторы, которые пригодны для применения, и способы, предлагаемые в настоящем изобретении, описаны в WO 2005/075436, которая полностью включена в настоящее описание касательно структуры, синтеза и методов применения QC-ингибиторов. В частности, приемлемым является соединение формулы 1: В другом варианте осуществления изобретения ингибиторы QPCTL могут представлять собой соединения формулы 1 а, в которой R имеет значения, указанные в примерах 1-53.- 27016584 Другими приемлемыми ингибиторами QPCTL могут быть соединения формула 1b, в которой R1 и R2 имеют значения, указанные в примерах 54-95- 28016584 Другими приемлемыми ингибиторами QPCTL могут быть соединения формулы 1 с, в которой R3 имеет значения, указанные в примерах 96-102. Другими приемлемыми ингибиторами QPCTL могут быть соединения формулы 1d, в которой положение в кольце указано в примерах 103-105. Другими приемлемыми ингибиторами QPCTL могут быть соединения формулы 1 е, в которой R4 и R5 имеют значения, указанные в примерах 106-109. Другими приемлемыми ингибиторами QPCTL могут быть соединения формулы 1f, в которой R6 имеет значения, указанные в примерах 110-112. Другими приемлемыми ингибиторами QPCTL могут быть соединения формулы 1g,
МПК / Метки
МПК: C07D 233/54, C07D 417/12, C07D 405/12, A61K 31/4164, C07D 403/12, C07D 235/06, C12N 9/10, C12N 15/54
Метки: глутаминилциклазы, родственные, новые, гену, гены
Код ссылки
<a href="https://eas.patents.su/30-16584-novye-geny-rodstvennye-genu-glutaminilciklazy.html" rel="bookmark" title="База патентов Евразийского Союза">Новые гены, родственные гену глутаминилциклазы</a>
Предыдущий патент: Производные бензоазепиноксиуксусной кислоты и их применение в качестве агонистов дельта-ppar для повышения hdl-c и снижения ldl-c и холестерина
Следующий патент: Способ получения полиамидной композиции с использованием карбоновых кислот и амидов
Случайный патент: Улучшенные композиции для нейтрализации химических, биологических и промышленных токсических веществ