Конъюгаты антитело-лекарство и их применение
Номер патента: 16577
Опубликовано: 30.06.2012
Авторы: Хуан Хайчунь, Пань Чинь, Суфи Билал, Герлавэ Винсен, Хорган Килиан, Бойд Шарон Элейн, Чэнь Лян, Кардарелли Жозефин М., Гангвар Санджив, Кинг Дэвид Джон
Формула / Реферат
1. Конъюгат антитело-лекарство, содержащий
антитело, обладающее специфичностью в отношении по крайней мере одного типа опухолей;
лекарство, имеющее строение
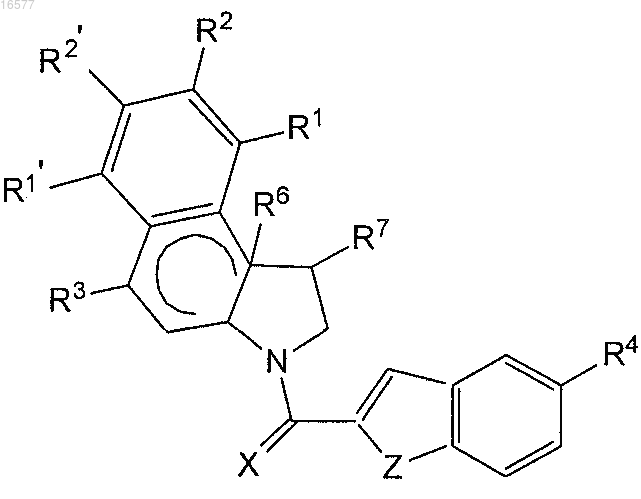
где X представляет собой элемент конструкции, выбранный из О и NR23;
Z представляет собой элемент конструкции, выбранный из О и NR23;
R1 представляет собой Н или замещенный или незамещенный C1-C6-алкил;
R1' представляет собой Н или замещенный или незамещенный C1-C6-алкил;
R2 представляет собой Н, замещенный или незамещенный C1-C6-алкил, или незамещенный C1-C6-гетероалкил, или циано, или алкокси;
R2' представляет собой Н, замещенный или незамещенный C1-C6-алкил или незамещенный C1-C6-гетероалкил;
R23 представляет собой радикал, выбранный из Н и замещенного или незамещенного C1-C10-алкила;
R3 представляет собой радикал, выбранный из группы, состоящей из (=O) и OR11,
где R11 представляет собой радикал, выбранный из группы, состоящей из Н, замещенного или незамещенного C1-C10-алкила, C(O)R12, C(O)OR12, C(O)NR12R13 и C(O)CHR12R13,
где R12 и R13 представляют собой радикалы, независимо выбранные из Н, замещенного или незамещенного C1-C10-алкила, замещенного или незамещенного C1-C10-гетероалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из О, N, Si и S; R12 и R13 необязательно образуют вместе с атомом азота или углерода, к которому они присоединены, замещенную или незамещенную гетероциклоалкильную кольцевую систему, содержащую от 4 до 6 атомов и необязательно содержащую два или несколько гетероатомов;
R4 выбирают из группы, состоящей из Н, замещенного C1-C10-алкила, незамещенного C1-C10-алкила, NHR15, NC(O)R15, C(O)R15, OR15 и O(CH2)nN(CH3)2,
n равно целому числу от 1 до 20;
R15 выбирают из Н, замещенного или незамещенного C1-C10-алкила и замещенного или незамещенного пептидила;
R6 представляет собой одинарную связь, которая присутствует или отсутствует, и при ее наличии R6 и R7 образуют вместе циклопропильное кольцо и
R7 представляет собой СН2-Х1 или -СН2-, объединенные в упомянутом циклопропильном кольце с R6;
X1 представляет собой галоген;
линкер, связывающий лекарство и антитело, где линкер является расщепляемым в присутствии опухоли;
по крайней мере один из R11, R12, R13 или R15 связан с линкером или лекарство представляет собой его фармацевтически приемлемую соль;
где конъюгат антитело-лекарство замедляет или подавляет рост опухоли при введении в количестве, соответствующем суточной дозировке 1 мкмоль/кг или менее.
2. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство замедляет рост опухоли при введении в количестве, соответствующем суточной дозировке 1 мкмоль/кг или менее, в течение по крайней мере пяти суток.
3. Конъюгат антитело-лекарство по п.1, где опухоль представляет собой свойственную человеку опухоль у SCID-мыши.
4. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство замедляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,6 мкмоль/кг или менее, в течение по крайней мере пяти суток.
5. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство замедляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,3 мкмоль/кг или менее, в течение по крайней мере пяти суток.
6. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство замедляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,15 мкмоль/кг или менее, в течение по крайней мере пяти суток.
7. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство подавляет рост опухоли при введении в количестве, соответствующем суточной дозировке 1 мкмоль/кг или менее, в течение по крайней мере пяти суток.
8. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство подавляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,6 мкмоль/кг или менее, в течение по крайней мере пяти суток.
9. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство подавляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,3 мкмоль/кг или менее, в течение по крайней мере пяти суток.
10. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство подавляет рост опухоли при введении в количестве, соответствующем суточной дозировке 0,15 мкмоль/кг или менее, в течение по крайней мере пяти суток.
11. Конъюгат антитело-лекарство по п.1, где линкер содержит гидразиновый фрагмент, расщепляемый в присутствии опухоли.
12. Конъюгат антитело-лекарство по п.1, где линкер содержит полипептид, расщепляемый в присутствии опухоли.
13. Конъюгат антитело-лекарство по п.1, где опухоль представляет собой карциному.
14. Конъюгат антитело-лекарство по п.1, где опухоль представляет собой карциному предстательной железы.
15. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство выбирают из
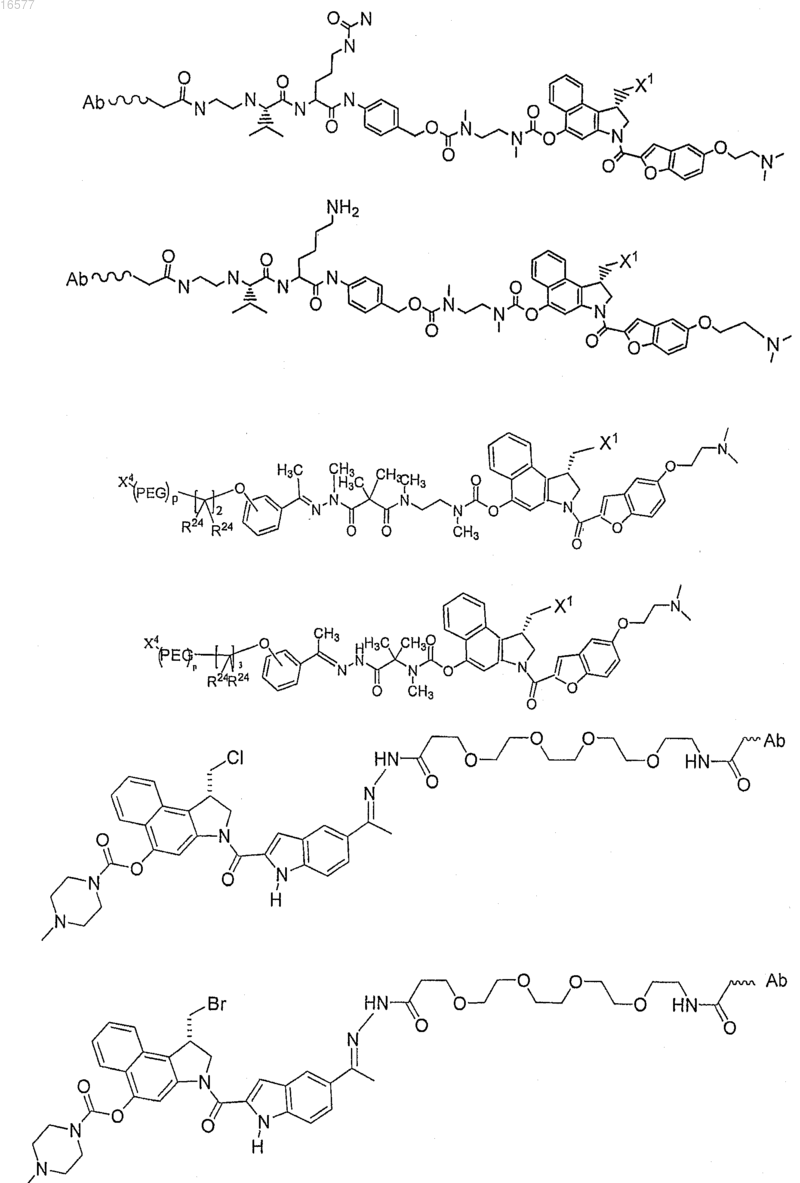
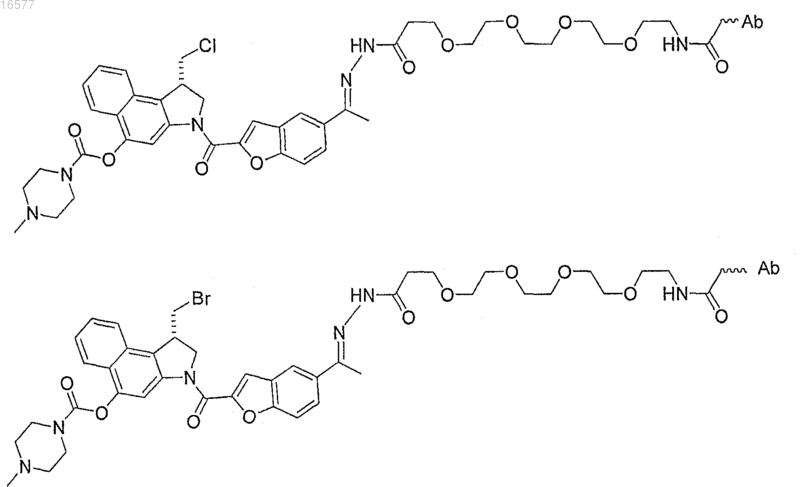
где Ab представляет собой антитело;
X1 представляет собой Cl или Br;
PEG представляет собой фрагмент полиэтиленгликоля.
16. Конъюгат антитело-лекарство по п.1, где конъюгат антитело-лекарство выбирают из
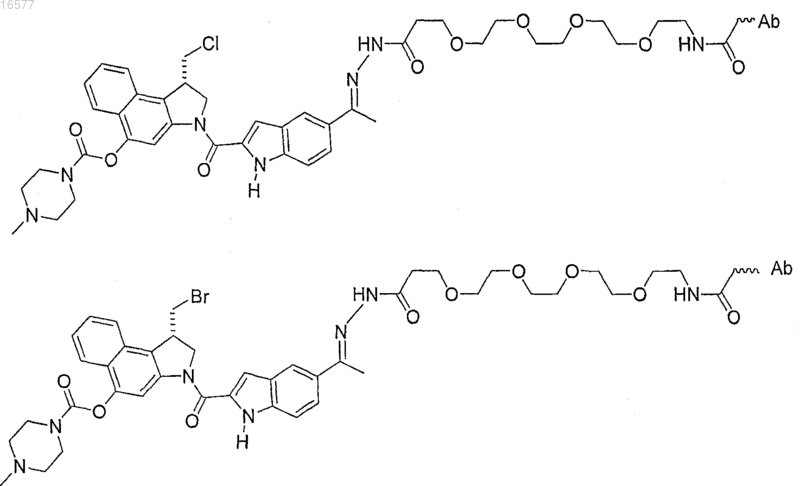
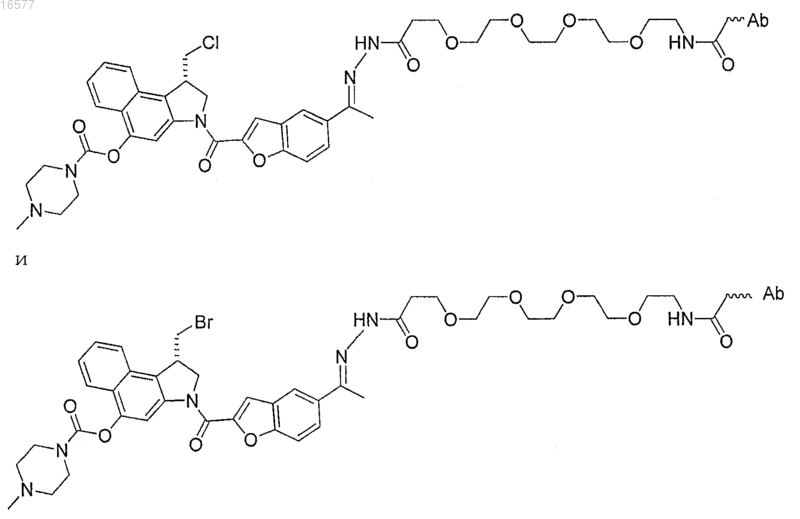
где Ab представляет собой антитело.
17. Фармацевтическая композиция, содержащая конъюгат антитело-лекарство по п.1 и фармацевтически приемлемый носитель.
18. Способ лизиса опухолевой клетки, включающий введение в указанную опухолевую клетку количества конъюгата антитело-лекарство по п.1, достаточного для лизиса упомянутой клетки.
19. Способ замедления или подавления роста опухоли у млекопитающего, включающий введение упомянутому млекопитающему количества конъюгата антитело-лекарство по п.1, достаточного для замедления или подавления роста.
20. Соединение, выбранное из
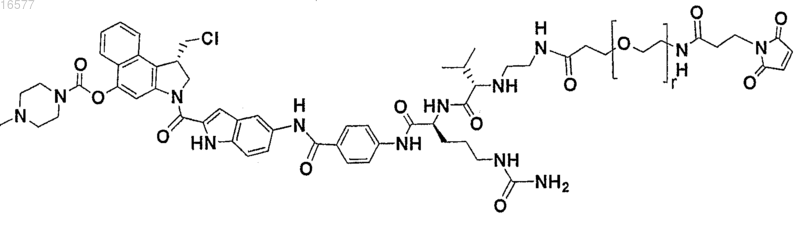


где r представляет собой целое число в диапазоне от 0 до 24.
Текст
Настоящее изобретение относится к являющимся мощными цитотоксинами конъюгатам антителолекарство, в которых лекарство связано с антителом через линкер. Настоящее изобретение также относится к композициям, содержащим конъюгаты антитело-лекарство, и к способам лечения с их применением. 016577 Перекрестные ссылки на родственные заявки По заявке на данный патент согласно 35 U.S.С. 119(e) испрашивается приоритет по более ранней дате подачи предварительной заявки на выдачу патента США 60/720499, поданной 26 сентября 2005 г., и полное содержание которой включено в настоящий документ посредством ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к конъюгатам антитело-лекарство, которые расщепляются invivo. Конъюгаты антитело-лекарство могут образовывать пролекарства и конъюгаты цитотоксинов. Предпосылки создания изобретения Многие терапевтические средства, в частности те, которые особенно эффективны при химиотерапии рака, обычно обладают острой токсичностью in vivo, в особенности токсичностью в отношении костного мозга и слизистых оболочек, а также хронической кардиотоксичностью и нейротоксичностью. Такая высокая токсичность может ограничивать их применение. Для более эффективной борьбы с раковыми клетками и уменьшения числа и тяжести побочных эффектов указанных продуктов (токсичность,разрушение нераковых клеток и т.д.) желательна разработка более многочисленных и безопасных терапевтических средств, в частности противоопухолевых средств. Другой проблемой некоторых существующих терапевтических средств является их менее чем оптимальная стабильность в плазме крови. Введение функциональных групп для стабилизации указанных соединений приводит к значительному снижению активности. Следовательно, является желательным определение путей стабилизации соединений при сохранении приемлемого уровня терапевтической активности. Поиск более избирательных цитотоксических средств очень активно проводился в течение десятилетий, причем лимитируемая дозой токсичность (т.е. нежелательная активность цитотоксинов на нормальные ткани) являлась одной из главных причин неудач при терапии рака. Например, известно, что СС-1065 и дуокармицины являются чрезвычайно мощными цитотоксинами. СС-1065 был впервые выделен из Streptomyces zelensis в 1981 г. Upjohn Company (Hanka et al., J.Antibiot. 31: 1211 (1978); Martin et al., J. Antibiot. 33: 902 (1980); Martin et al., J. Antibiot. 34: 1119 (1981 и было показано, что он обладает мощной противоопухолевой и противомикробной активностью как invitro, так и на экспериментальных животных (Li et al., Cancer Res. 42: 999 (1982. СС-1065 связывается в двухцепочечной В-ДНК в пределах малой бороздки (Swenson et al., Cancer Res. 42: 2821 (1982 с предпочтением последовательности 5'-d(A/GNTTA)-3' и 5'-d(AAAAA)-3' и алкилирует N3-положение 3'аденина при помощи своего CPI left-hand unit, содержащегося в молекуле (Hurley et al., Science 226: 843(1984. Несмотря на свою мощную и широкую противоопухолевую активность, СС-1065 не может применяться людьми, поскольку он вызывает у экспериментальных животных отсроченную смерть. В данной области техники известны многие аналоги и производные СС-1065 и дуокармицинов. Был сделан обзор исследования структуры, синтеза и свойств многих из соединений (см., например, Boger etal., Angew. Chem. Int. Ed. Engl. 35: 1438 (1996); и Boger et al., Chem. Rev. 97: 787 (1997. Группой из Kyowa Hakko Kogya Co., Ltd. был получен ряд производных СС-1065 (см., например,патенты США 5101038; 5641780; 5187186; 5070092; 5703080; 5070092; 5641780; 5101038 и 5084468; опубликованную заявку согласно РСТ WO 96/10405; опубликованную заявку на выдачу европейского патента 0537575 А 1). Активность при получении производных СС-1065 также была проявлена Upjohn Company (Pharmacia Upjohn) (см., например, патенты США 5739350; 4978757; 5332837 и 4912227). Исследования были также сконцентрированы на разработке новых терапевтических средств в форме пролекарств, т.е. соединений, которые способны преобразовываться in vivo в лекарства (активные терапевтические соединения) путем определенных химических или ферментативных модификаций их структуры. С целью снижения токсичности такое преобразование предпочтительно ограничивается местом приложения действия или являющейся мишенью тканью, а не кровеносной системой или не являющейся мишенью тканью. Тем не менее даже использование пролекарств является проблематичным,поскольку многие из них характеризуются низкой стабильностью в крови и в сыворотке крови вследствие содержания ферментов, разрушающих или активирующих пролекарства до того, как пролекарства достигают требуемого места в организме больного. Компанией Bristol-Myers Squibb были описаны расщепляемые лизосомальными ферментами конъюгаты противоопухолевого лекарства (см., например, патент США 6214345). Этот патент относится к аминобензилоксикарбонилу. Компанией Seattle Genetics были опубликованы заявка на выдачу патента США 2003/0096743 и заявка на выдачу патента США 2003/0130189, в которых описаны парааминобензиловые эфиры в средствах для доставки лекарственных средств. Описанные в этих заявках линкеры ограничиваются аминобензилэфирными композициями. Другие группы также содержат описанные линкеры (см., например, de Groot et al., J. Med. Chem. 42,5277 (1999); de Groot et al. J. Org. Chem. 43, 3093 (2000); de Groot et al., J. Med. Chem. 66, 8815, (2001);WO 02/083180; Carl et al., J. Med. Chem. Lett. 24, 479, (1981); Dubowchik et al., BioorgMed. Chem. Lett. 8, 3347 (1998. Такие линкеры включают аминобензилэфирный спейсер, системы с удлиненным каскадом электронов и спейсером циклизации, спейсеры предотвращения циклизации, такие какw-аминоаминокарбонилы, и парааминобензилоксикарбонильный линкер. Стабильность цитотоксических лекарств, включая стабильность in vivo, по-прежнему представляет собой важный аспект, который следует рассматривать. Кроме того, токсичность многих соединений делает их менее пригодными, поэтому требуются композиции, применение которых может снижать токсичность лекарства, например, путем образования расщепляемого пролекарства. Поэтому, несмотря на успехи в данной области техники, по-прежнему сохраняется потребность в разработке усовершенствованных терапевтических средств для лечения млекопитающих, и в частности людей, а более конкретно цитотоксинов, которые обладают высокой специфичностью действия, сниженной токсичностью и улучшенной стабильностью в крови по сравнению с известными соединениями сходной структуры. Настоящее изобретение относится к этим целям. Краткое описание сущности изобретения Настоящее изобретение относится к конъюгатам антитело-лекарство, где лекарство и антитело связаны посредством линкера, такого как петидильный, гидразиновый или дисульфидный линкер. Указанные конъюгаты являются мощными цитотоксинами, которые могут избирательно доставляться в интересующее место приложения действия в активной форме, а затем расщепляться с высвобождением активного лекарства. Ножки линкера по настоящему изобретению могут быть отщеплены от цитотоксичных лекарств in vivo, например, путем ферментативного расщепления или восстановления, с высвобождением фрагмента активного лекарства и пролекарственного производного. Один пример осуществления представляет собой конъюгат антитело-лекарство, который содержит антитело, обладающее специфичностью по крайней мере к одному типу опухолей; лекарство и линкер,соединяющий антитело и лекарство. Линкер является расщепляемым в присутствии опухоли. Конъюгат антитело-лекарство замедляет или блокирует рост опухоли при введении в количестве, соответствующем суточной дозе, равной 1 мкмоль/кг или меньшей. Предпочтительно конъюгат антитело-лекарство замедляет рост опухоли при введении в количестве, соответствующем суточной дозе, равной 1 мкмоль/кг или меньшей (имеется в виду молей лекарства), в течение по крайней мере 5 суток. По крайней мере, в некоторых примерах осуществления опухоль представляет собой свойственная человеку опухоль у мыши с тяжелым комбинированным иммунодефицитом (SCID-мыши). В качестве примера SCID-мышью может являться СВ 17.SCID-мышь (доступная для приобретения от Taconic, Germantown, NY). Настоящее изобретение также относится к группам, пригодным для стабилизации терапевтических средств и маркеров. Стабилизирующие группы выбирают, например, для ограничения выведения и метаболизма терапевтического средства или маркера ферментами, которые могут присутствовать в крови и не являющейся мишенью ткани. Стабилизирующие группы могут служить блокаторами разрушения средства или маркера, а также могут наделять средство или маркер другими физическими свойствами,например повышать растворимость соединения или снижать способность соединения к агрегации. Стабилизирующая группа может улучшать стабильность средства или маркера при хранении как в композиции смеси, так и отдельно. В другом аспекте настоящее изобретение относится к цитотоксичному соединению лекарстволиганд, имеющему строение в соответствии с любой из формул (1)-(3): где символ D представляет собой фрагмент лекарства, содержащий в качестве боковой цепи химически реакционноспособную функциональную группу, причем упомянутую функциональную группу выбирают из группы, состоящей из первичного или вторичного амина, гидроксила, сульфгидрила, карбоксила, альдегида и кетона; символ L1 представляет собой саморазрушающийся спейсер;m представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6; символ X4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия; символ L4 представляет собой элемент конструкции линкера; р равно 0 или 1.L4 представляет собой фрагмент, который наделяет конъюгаты повышенной растворимостью или сниженной способностью к агрегации. Примеры фрагментов L4 включают замещенный алкил, незамещенный алкил, замещенный арил, незамещенный арил, замещенный гетероалкил или незамещенный гетероалкил, каждый из которых может представлять собой неразветвленный, разветвленный или циклический, положительно или отрицательно заряженный, аминокислотный полимер, такой как полилизин или-2 016577 полиаргинин, или другие полимеры, такие как полиэтиленгликоль. Символы F, Н и J. представляют собой линкеры, описанные далее в этом документе. В одном примере осуществления настоящее изобретение относится к содержащему пептидный линкер конъюгату строения где D представляет собой фрагмент лекарства, содержащий в качестве боковой цепи химически реакционноспособную функциональную группу, причем упомянутую функциональную группу выбирают из группы, состоящей из первичного или вторичного амина, гидроксила, тиола, карбоксила, альдегида и кетона;L1 представляет собой саморазрушающийся линкер;m представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6; где АА 1 представляет собой один или несколько элементов конструкции, независимо выбранных из группы, состоящей из природных аминокислот и неприродных -аминокислот; с равно целому числу от 1 до 20;L2 представляет собой саморазрушающийся линкер;L3 представляет собой спейсерную группу, содержащую первичный или вторичный амин или карбоксильную функциональную группу; где m равно 0 при наличии L3 и либо амин группы L3 образует амидную связь с боковой карбоксильной функциональной группой группы D, либо карбоксил группы L3 образует амидную связь с боковой аминогруппой группы D; о равно 0 или 1;L4 представляет собой элемент конструкции линкера,где L4 не содержит карбоксильную ацильную группу, присоединенную непосредственно к N-концу группы (АА 1)с; р равно 0 или 1;X4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия. В одном примере осуществления содержащий пептидный линкер конъюгат содержит следующую структуру: В другом примере осуществления содержащий пептидный линкер конъюгат содержит следующую структуру: В предпочтительном примере осуществления L3 содержит ароматическую группу. Например, L3 может содержать группу бензойной кислоты, анилиновую группу или индольную группу. Неограничивающие примеры -L3-NH- включают структуры, выбранные из следующей группы: где Z представляет собой элемент конструкции, выбранный из О, S и NR23;R23 представляет собой радикал, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и ацила. В предпочтительных примерах осуществления пептидного линкера (АА 1)с представляет собой пептидную последовательность, расщепляемую экспрессируемой в опухолевой ткани протеазой. Предпочтительной протеазой является лизосомальная протеаза. В предпочтительных примерах осуществления с равно целому числу от 2 до 6 или с равно 2, 3 или 4. В определенных примерах осуществления аминокислоту, расположенную в группе (АА 1)с ближе всего к фрагменту лекарства, выбирают из группы, состоящей из Ala, Asn, Asp, Cit, Cys, Gln, Glu, Gly, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val. В предпочтительных примерах осуществления (АА 1)с представляет собой пептидную последовательность,выбранную из группы, состоящей из Val-Cit, Val-Lys, Phe-Lys, Lys-Lys, Ala-Lys, Phe-Cit, Leu-Cit, Ile-Cit,Trp, Cit, Phe-Ala, Phe-N9-тозил-Arg, Phe-N9-нитро-Arg, Phe-Phe-Lys, D-Phe-Phe-Lys, Gly-Phe-Lys, Leu-AlaLeu, Ile-Ala-Leu, Val-Ala-Val, Ala-Leu-Ala-Leu (SEQ ID NO: 1), -Ala-Leu-Ala-Leu (SEQ ID NO: 2) и GlyPhe-Leu-Gly (SEQ ID NO: 3). В особенно предпочтительных примерах осуществления (АА 1)с представляет собой Val-Cit или Val-Lys. В некоторых предпочтительных примерах осуществления пептидный линкер F содержит структуру где R24 выбирают из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила; каждый K представляет собой элемент конструкции, независимо выбранный из группы, состоящей из замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила,замещенного гетероциклоалкила, незамещенного гетероциклоалкила, галогена, NO2, NR21R22,NR21COR22, OCONR21R22, OCOR21 и OR21, где R21 и R22 независимо выбирают из группы, состоящей из Н,замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила,замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила, незамещенного гетероциклоалкила; а представляет собой целое число, равное 0, 1, 2, 3 или 4. В других предпочтительных примерах осуществления -F-(L1)m- содержит структуру где каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н,замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила. В другом аспекте настоящее изобретение относится к содержащим гидразиновый линкер конъюгатам строения где D представляет собой фрагмент лекарства, содержащий в качестве боковой цепи химически ре-4 016577 акционноспособную функциональную группу, причем упомянутую функциональную группу выбирают из группы, состоящей из первичного или вторичного амина, гидроксила, тиола, карбоксила, альдегида и кетона;L1 представляет собой саморазрушающийся линкер;m представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6;X4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия;L4 представляет собой элемент конструкции линкера; р равно 0 или 1; Н представляет собой линкер, содержащий структуру где n1 равно целому числу от 1 до 10;n2 равно 0, 1 или 2; каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила;I представляет собой или связь, или где R представляет собой Me или CH2-CH2-NMe2. В некоторых предпочтительных примерах осуществления замещение фенильного кольца представляет собой замещение в пара-положении. В некоторых предпочтительных примерах осуществления n1 равно 2, 3 или 4 или n1 равно 3 либо n2 равно 1. В определенных примерах осуществления I представляет собой связь. В других примерах осуществления n3 равно 0 и n4 равно 2. В различных аспектах настоящее изобретение относится к гидразиновым линкерам Н, которые при расщеплении могут образовывать 6-членный саморазрушающийся линкер, или два 5-членных саморазрушающихся линкера, или один 5-членный саморазрушающийся линкер, или один 7-членный саморазрушающийся линкер, или 5-членный саморазрушающийся линкер и 6-членный саморазрушающийся линкер. В предпочтительном примере осуществления Н содержит геминальные диметильные заместители. В предпочтительном примере осуществления Н содержит структуруR24 независимо выбирают из СН 3 и Н. В определенных предпочтительных примерах осуществления каждый R24 представляет собой Н. В другом предпочтительном примере осуществления Н содержит структуру Предпочтительно n1 равно 3. Предпочтительно каждый R24 независимо выбирают из СН 3 и Н. В еще одних предпочтительных примерах осуществления Н содержит структуру Предпочтительно каждый R24 независимо представляет собой Н или замещенный или незамещенный алкил. В другом аспекте настоящее изобретение относится к содержащим гидразиновый линкер конъюгатам строения где D представляет собой фрагмент лекарства, содержащий в качестве боковой цепи химически реакционноспособную функциональную группу, причем упомянутую функциональную группу выбирают из группы, состоящей из первичного или вторичного амина, гидроксила, тиола, карбоксила, альдегида и кетона;L1 представляет собой саморазрушающийся линкер;X4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия;L4 представляет собой элемент конструкции линкера; р равно 0 или 1; Н содержит структуру где q равно 0, 1, 2, 3, 4, 5 или 6; каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила. В еще одном аспекте настоящее изобретение относится к содержащему дисульфидный линкер конъюгату строения где D представляет собой фрагмент лекарства, содержащий в качестве боковой цепи химически реакционноспособную функциональную группу, причем упомянутую функциональную группу выбирают из группы, состоящей из первичного или вторичного амина, гидроксила, тиола, карбоксила, альдегида и кетона;L1 представляет собой саморазрушающийся линкер;X4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия;L4 представляет собой элемент конструкции линкера; р равно 0 или 1; где каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н,замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила; каждый K представляет собой элемент конструкции, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила,замещенного гетероциклоалкила, незамещенный гетероциклоалкила, галогена, NO2, NR21R22, NR21COR22,OCONR21R22, OCOR21 и OR21,где R21 и R22 независимо выбирают из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила, незамещенный гетероциклоалкила; а представляет собой целое число, равное 0, 1, 2, 3 или 4;d представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6. В различных примерах осуществления J может содержать одну или несколько из следующих структур: Во всех упомянутых выше содержащих линкер конъюгатах D предпочтительно представляет собой цитотоксическое лекарство. В предпочтительных примерах осуществления D содержит химически реакционноспособную функциональную группу, выбранную из группы, состоящей из первичного или вторичного амина, гидроксила, сульфгидрила и карбоксила. В предпочтительном примере осуществления D представляет собой лекарство, имеющее строение где X представляет собой элемент конструкции, выбранный из О и NR23;Z представляет собой элемент конструкции, выбранный из О и NR23;R1 представляет собой Н или замещенный или незамещенный C1-C6-алкил;R1' представляет собой Н или замещенный или незамещенный C1-C6-алкил;R2 представляет собой Н, замещенный или незамещенный C1-C6-алкил, или незамещенный C1-C6 гетероалкил, или циано, или алкокси; иR2' представляет собой Н, замещенный или незамещенный C1-C6-алкил, или незамещенный C1-C6 гетероалкил;R23 представляет собой радикал, выбранный из Н и замещенного или незамещенного C1-C10-алкила;R3 представляет собой радикал, выбранный из группы, состоящей из (=O) и OR11,где R11 представляет собой радикал, выбранный из группы, состоящей из Н, замещенного или незамещенного C1-C10-алкила, C(O)R12, С(О)OR12, C(O)NR12R13 и С(О)CHR12R13,где R12 и R13 представляют собой радикалы, независимо выбранные из Н, замещенного или незамещенного C1-C10-алкила, замещенного или незамещенного C1-C10-гетероалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из О, N, Si и S, где R12 и R13 необязательно образуют вместе с атомом азота или углерода, к которому они присоединены, замещенную или незамещенную гетероциклоалкильную кольцевую систему, содержащую от 4 до 6 атомов и необязательно содержащую два или несколько гетероатомов;NHR , NC(O)R15, C(O)R15, OR15 и O(CH2)nN(CH3)2,где n равно целому числу от 1 до 20;R15 выбирают из Н, замещенного или незамещенного C1-C10-алкила и замещенного или незамещенного пептидила;R6 представляет собой одинарную связь, которая присутствует или отсутствует, и при ее наличии 6R и R7 образуют вместе циклопропильное кольцо; иR7 представляет собой СН 2-Х 1 или -СН 2-, объединенные в упомянутом циклопропильном кольце с 6R,где X1 представляет собой галоген. В еще одном аспекте настоящее изобретение относится к цитотоксичному соединению лекарстволиганд, имеющему строение следующей формулы: где символ L1 представляет собой саморазрушающийся спейсер, где m представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6. Символ Х 4 представляет собой элемент конструкции, выбранный из группы, состоящей из защищенных реакционноспособных функциональных групп, незащищенных реакционноспособных функциональных групп, детектируемых меток и средств направленного действия. Символ L4 представляет собой элемент конструкции линкера и р равно 0 или 1. L4 представляет собой фрагмент, который наделяет конъюгаты повышенной растворимостью или сниженной способностью к агрегации. Примеры фрагментов L4 включают замещенный алкил, незамещенный алкил, замещенный арил, незамещенный арил, замещенный гетероалкил или незамещенный гетероалкил, любой из которых может представлять собой неразветвленный, разветвленный или циклический, положительно или отрицательно заряженный, аминокислотный полимер, такой как полилизин или полиаргинин, или другие полимеры, такие как полиэтиленгликоль. Символ Q представляет собой любой расщепляемый линкер, включая без ограничения любой из описанных в этом документе пептидильных, гидрозоновых и дисульфидных линкеров. Расщепляемые линкеры включают линкеры, которые могут быть избирательно расщеплены в ходе химического или биологического процесса и отделяют при расщеплении лекарство D1 от X4. Символ D1 представляет собой лекарство следующей формулы: где X представляет собой элемент конструкции, выбранный из О и NR23;Z представляет собой элемент конструкции, выбранный из О и NR23;R1 представляет собой Н или замещенный или незамещенный C1-C6-алкил;R1' представляет собой Н или замещенный или незамещенный C1-C6-алкил;R2 представляет собой Н, замещенный или незамещенный С 1-С 6-алкил, или незамещенный C1-C6 гетероалкил, или циано, или алкокси; иR2' представляет собой Н, замещенный или незамещенный C1-C6-алкил, или незамещенный C1-C6 гетероалкил;R23 представляет собой радикал, выбранный из Н и замещенного или незамещенного C1-C10-алкила;R3 представляет собой радикал, выбранный из группы, состоящей из (=O) и OR11,где R11 представляет собой радикал, выбранный из группы, состоящей из Н, замещенного или незамещенного C1-C10-алкила, C(O)R12, С(О)OR12, C(O)NR12R13 и С(О)CHR12R13, в которыхR12 и R13 представляют собой радикалы, независимо выбранные из Н, замещенного или незамещенного C1-C10-алкила, замещенного или незамещенного C1-C10-гетероалкила, содержащего по меньшей мере один гетероатом, выбранный из группы, состоящей из О, N, Si и S, где R12 и R13 необязательно образуют вместе с атомом азота или углерода, к которому они присоединены, замещенную или незамещенную гетероциклоалкильную кольцевую систему, содержащую от 4 до 6 атомов и необязательно содержащую два или несколько гетероатомов;NHR , NC(O)R15, C(O)R15, OR15 и O(CH2)nN(CH3)2,где n равно целому числу от 1 до 20;R15 выбирают из Н, замещенного или незамещенного C1-C10-алкила и замещенного или незамещенного пептидила;R6 представляет собой одинарную связь, которая присутствует или отсутствует, и при ее наличии 6R и R7 образуют вместе циклопропильное кольцо; иR7 представляет собой CH2-X1 или -СН 2-, объединенные в упомянутом циклопропильном кольце с 6R,где X1 представляет собой галоген. В еще одном аспекте настоящее изобретение относится к фармацевтическим композициям. Такие композиции обычно содержат конъюгат по настоящему изобретению и фармацевтически приемлемый носитель. В еще одном дополнительном аспекте настоящее изобретение относится к способам применения конъюгатов по настоящему изобретению. Например, настоящее изобретение относится к способу лизиса клетки, где конъюгат по настоящему изобретению вводят в клетку в количестве, достаточном для лизиса клетки. В предпочтительном примере осуществления клетка представляет собой опухолевую клетку. В другом примере осуществления настоящее изобретение относится к способу замедления или блокировки роста опухоли у млекопитающего, где конъюгат по настоящему изобретению вводят млекопитающему в количестве, достаточном для замедления или блокировки роста опухоли. Другие аспекты, преимущества и цели настоящего изобретения станут очевидны из обзора представленного ниже подробного описания изобретения. Краткое описание фигур Неограничивающие и неисчерпывающие примеры осуществления настоящего изобретения описаны со ссылкой на следующие фигуры. Для лучшего понимания настоящего изобретения приводится ссылка на последующее подробное описание изобретения, которое следует рассматривать совместно с прилагаемыми фигурами, где фиг. 1 представляет собой график изменений во времени объема опухоли у мышей, которым вводили дозу конъюгата изотипическое контрольное антитело-лекарство, конъюгата PSMA антителолекарство или лишь буфер для конъюгации (растворитель); фиг. 2 - график изменений во времени объема опухоли у мышей, которым вводили различные количества конъюгата PSMA антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 3 - график изменений во времени объема опухоли у мышей, которым вводили различные коли-9 016577 чества конъюгата изотипическое контрольное антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 4 - график изменений во времени массы тела мышей, которым вводили различные количества конъюгата изотипическое контрольное антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 5 - график изменений во времени массы тела мышей, которым вводили различные количества конъюгата изотипическое контрольное антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 6 - график изменений во времени объема опухоли, начальный средний размер которых составлял 240 мм 3, у мышей, которым вводили дозу конъюгата изотипическое контрольное антителолекарство, конъюгата PSMA антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 7 - график изменений во времени объема опухоли, начальный средний размер которых составлял 430 мм 3, у мышей, которым вводили дозу конъюгата PSMA антитело-лекарство или лишь буфер для конъюгации (растворитель); фиг. 8 - график изменений во времени объема опухоли у мышей, которым вводили дозу конъюгатов изотипическое контрольное антитело и токсин-антитело; фиг. 9 - график изменений во времени массы тела мышей, которым вводили дозу конъюгатов изотипическое контрольное антитело и токсин-антитело. Подробное описание изобретения Сокращения. Используемое в этом документе сокращение "Ala" относится к аланину. Сокращение "Boc" относится к трет-бутилоксикарбонилу. Сокращение "CPI" относится к циклопропанпирролоиндолу. Сокращение "Cbz" означает карбобензокси. Используемое в этом документе сокращение "DCM" относится к дихлорметану. Сокращение "DDQ" относится к 2,3-дихлор-5,6-дициано-1,4-бензохинону. Сокращение "DIPEA" означает диизопропилэтиламин. Сокращение "DMDA" означает N,N'-диметилэтилендиамин. Сокращение "RBF" означает круглодонную колбу. Сокращение "DMF" означает N,В-диметилформамид. Сокращение "HATU" означает N-оксид гексафторфосфата N-(диметиламино)-1 Н-1,2,3 триазоло[4,5-b]пиридин-1-ил]метилен]-N-метилметанаминия. Используемый в этом документе символ "Е" означает ферментативно расщепляемую группу. Сокращение "EDCI" означает 1-(3-диметиламинопропил)-3-этилкарбодиимид. Используемое в этом документе сокращение"FMOC" относится к 9 флуоренилметилоксикарбонилу. Сокращение "FMOC" относится к 9-флуоренилметилоксикарбонилу. Сокращение "HOAt" означает 7-аза-1-гидроксибензотриазол. Сокращение "Leu" означает лейцин. Сокращение "РАВА" относится к парааминобензойной кислоте. Сокращение "PEG" относится к полиэтиленгликолю. Сокращение "РМВ" относится к параметоксибензилу. Сокращение "TBAF" относится к фториду тетрабутиламмония. Сокращение "TBSO" относится к трет-бутилдиметилсилиловому эфиру. Используемое в этом документе сокращение "TEA" относится к триэтиламину. Сокращение "TFA" относится к трифторуксусной кислоте. Символ "Q" относится к терапевтическому средству, диагностическому средству или детектируемой метке. Определения. Если иное не определено особо, все используемые в этом документе технические и научные термины имеют, как правило, то же самое значение, что и обычно понимаемое средним специалистом в данной области техники, к которой принадлежит настоящее изобретение. В общем используемая в этом документе номенклатура и описанные ниже методики лабораторных исследований в области клеточных культур, молекулярной генетики, органической химии и химии и гибридизации нуклеиновых кислот хорошо известны и традиционно используются в данной области техники. Для синтеза нуклеиновых кислот и белков используют стандартные методики. В общем ферментативные реакции и стадии очистки проводят в соответствии с инструкциями производителя. Методики и процедуры, как правило, выполняют в соответствии со способами, традиционным в данной области техники, и различными общими ссылкамиSpring Harbor Laboratory Press, Cold Spring Harbor, N.Y., включенный в этот документ посредством ссылки), которые повсеместно приводятся в этом документе. Используемая в этом документе номенклатура и- 10016577 методики проведения лабораторных исследований в области аналитической химии, и описанный ниже органический синтез, хорошо известны и традиционно используются в данной области техники. Для химического синтеза и химического анализа используют стандартные методики или их модификации. Подразумевается, что термин "терапевтическое средство" означает соединение, которое в терапевтически эффективном количестве вызывает желаемый терапевтический эффект у млекопитающего. Для лечения злокачественных опухолей желательно, чтобы терапевтическое средство было способно проникать в клетку-мишень. Подразумевается, что термин "цитотоксин" означает терапевтическое средство, обладающее желаемым цитотоксичным эффектом в отношении раковых клеток. Термин "цитоксичный" означает, что средство блокирует рост или убивает клетки. Типичные цитотоксины включают в качестве примера, но не ограничения, комбретастатины, дуокармицины, противоопухолевые антибиотики на основе СС-1065,антрациклины и родственные соединения. Другие цитотоксины включают микотоксины, рицин и его аналоги, калихеамицины, доксирубицин и майтансиноиды. Термин "пролекарство" и термин "конъюгат лекарства" используются в этом документе взаимозаменяемо. Оба термина относятся к соединению, которое, будучи в конъюгированной форме, сравнительно безопасно для клеток, но избирательно разрушается с образованием фармакологически активной формы в определенных условиях, например, ферментами, расположенными внутри клеток-мишеней или в непосредственной близости от них. Подразумевается, что термин "маркер" означает соединение, пригодное для определения характеристик опухолей и другого заболевания, например, для диагностики, контроля развития опухоли и анализа факторов, секретируемых опухолевыми клетками. Маркеры составляют подкласс "диагностических средств". Используемый применительно к ферментативному расщеплению термин "избирательный" означает, что скорость расщепления линкерного фрагмента больше скорости расщепления пептида со случайной последовательностью аминокислот. Подразумевается, что термины "группа направленного действия" и "агент направленного действия" означают фрагмент, который (1) способен направлять активное вещество, к которому он присоединен(например, терапевтическое средство или маркер), на клетку-мишень, например на специфический тип опухолевых клеток, или (2) предпочтительно активируется в ткани-мишени, например в опухоли. Группа направленного действия или агент направленного действия могут представлять собой малую молекулу,которая, как подразумевается, включает как непептиды, так и пептиды. Группа направленного действия может также представлять собой макромолекулу, которая включает сахариды, лектины, рецепторы, лиганды рецепторов, белки, такие как БСА, антитела и т.д. В предпочтительном примере осуществления настоящего изобретения группа направленного действия представляет собой антитело или фрагмент антитела, более предпочтительно моноклональное антитело или фрагмент моноклонального антитела. Термин "саморазрушающийся спейсер" относится к бифункциональному химическому фрагменту,который способен ковалентно связывать два химических фрагмента с образованием стабильной в обычных условиях молекулы, состоящей из трех частей. Саморазрушающийся спейсер способен спонтанно отделяться от второго фрагмента после расщепления связи с первым фрагментом. Подразумевается, что термин "детектируемая метка" означает фрагмент, обладающий детектируемым физическим или химическим свойством. Подразумевается, что термин "расщепляемая группа" означает фрагмент, который не стабилен invivo. Предпочтительно "расщепляемая группа" предусматривает активацию маркера или терапевтического средства путем отщепления маркера или средства от оставшейся части конъюгата. Функционально определенный линкер предпочтительно расщепляется in vivo своим биологическим микроокружением. Расщепление может происходить в результате любого без ограничения процесса, например ферментативного, восстановительного, при определенном значении рН и т.д. Предпочтительно расщепляемую группу выбирают таким образом, что активация происходит в желаемом месте приложения действия,которое может находиться внутри или близ клеток-мишеней (например, клеток злокачественной опухоли) или тканей, например, в месте приложения терапевтического действия или активности маркера. Такое расщепление может быть ферментативным и примеры ферментативно расщепляемых групп включают природные аминокислоты или пептидные последовательности, которые заканчиваются природной аминокислотой и присоединены своим карбоксилсодержащим концом к линкеру. Хотя степень ускорения скорости расщепления не является критичной для целей настоящего изобретения, предпочтительными примерами расщепляемых линкеров являются такие, в которых по крайней мере приблизительно 10% расщепляемых групп расщепляются в кровотоке в течение 24 ч после введения, наиболее предпочтительно по крайней мере приблизительно 35%. Термин "лиганд" означает любую молекулу, которая специфически связывается или образует ассоциаты или комплексы с рецептором, субстратом, антигенной детерминантой или другим участком связывания на клетке-мишени или в ткани-мишени. Примеры лигандов включают антитела и их фрагменты(например, моноклональное антитело или его фрагмент), ферменты (например, фибринолитические ферменты), модификаторы биологического ответа (например, интерлейкины, интерфероны, эритропоэтин- 11016577 или колониестимулирующие факторы), пептидные гормоны и их антигенсвязывающие фрагменты. Термины "гидразиновый линкер" и "самоциклизующийся гидразиновый линкер" используются в этом документе взаимозаменяемо. Эти термины относятся к линкерному фрагменту, который при изменении условий, таких как сдвиг значения рН, может вступать в реакцию циклизации и образовывать одно или несколько колец. При присоединении гидразиновый фрагмент преобразуется в гидразон. Такое присоединение может протекать, например, путем осуществления взаимодействия с кетоновой группой фрагмента L4. Поэтому вследствие преобразования в гидразон при присоединении для описания линкера по настоящему изобретению также может использоваться термин "гидразоновый линкер". Термин "5-членный гидразиновый линкер" относится к содержащим гидразин фрагментам молекул,которые при изменении условий, таких как сдвиг значения рН, могут вступать в реакцию циклизации и образовывать одно или несколько 5-членных колец. В качестве альтернативы, такой 5-членный линкер может быть сходным образом описан как 5-членный гидразоновый линкер. Термин "6-членный гидразиновый линкер" относится к содержащим гидразин фрагментам молекул,которые при изменении условий, таких как сдвиг значения рН, могут вступать в реакцию циклизации и образовывать одно или несколько 6-членных колец. В качестве альтернативы, такой 6-членный линкер может быть сходным образом описан как 6-членный гидразоновый линкер. Термин "реакция циклизации" применительно к циклизации пептида, гидразина или дисульфидного линкера указывает на циклизацию такого линкера и инициирует разделение комплекса лиганд-лекарство. Скорость реакции может быть измерена ex situ и реакция завершается после образования по крайней мере 90, 95 или 100% продукта. Термины "полипептид", "пептид" и "белок" используются в этом документе взаимозаменяемо и относятся к полимеру, состоящему из аминокислотных остатков. Термины применимы к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляют собой искусственный химический миметик соответствующей встречающейся в природе аминокислоты, а также к встречающимся в природе аминокислотным полимерам и к не встречающимся в природе аминокислотным полимерам. Эти термины также охватывают термин "антитело". Термин "аминокислота" относится к встречающимся в природе и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые действуют тем же путем, что и встречающиеся в природе аминокислоты. Встречающимися в природе аминокислотами являются аминокислоты, которые кодируются генетическим кодом, а также аминокислоты, которые были позже модифицированы, например, гидроксипролин, -карбоксиглутамат и О-фосфосерин. Аналоги аминокислот относится к соединениям, которые имеют то же основное химическое строение, что и встречающаяся в природе аминокислота, т.е. -атом углерода, с которым связан атом водорода, карбоксильная группа, аминогруппа, и R-группа, например гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Такие аналоги содержат модифицированные R-группы (например, норлейцин) или модифицированные пептидные каркасы, но сохраняют то же основное химическое строение, что и встречающаяся в природе аминокислота. Одной аминокислотой, которая, в частности, может использоваться, является цитруллин, который является предшественником аргинина и участвует в образовании мочевины в печени. Аминокислотные миметики относятся к химическим соединениям, которые имеют строение, отличное от общего химического строения аминокислоты, но функционирует сходным путем со встречающейся в природе аминокислотой. Термин "неприродная аминокислота" призван обозначать D-стереохимическую форму двадцати описанных выше встречающихся в природе аминокислот. Дополнительно следует понимать, что термин "неприродная аминокислота" включает гомологи натуральных аминокислот и синтетически модифицированные формы природных аминокислот. Синтетически модифицированные формы включают без ограничения аминокислоты, содержащие алкиленовые цепи, укороченные или удлиненные на 1-2 атома углерода, аминокислоты, содержащие необязательно замещенные арильные группы, и аминокислоты, содержащие галогенированные группы, предпочтительно галогенированные алкильные и арильные группы. При присоединении к линкеру или конъюгату по настоящему изобретению аминокислота находится в форме "аминокислотной боковой цепи", где карбоксильная группа аминокислоты была замещена кето-группой (С(O. Так, например, аланиновая боковая цепь представляет собой -С(О)СН(NH2)-СН 3 и т.д. Аминокислоты и пептиды могут быть защищены блокирующими группами. Блокирующая группа представляет собой атом или химический фрагмент, который защищает N-конец аминокислоты или пептида от нежелательных взаимодействий и может использоваться в процессе синтеза конъюгата лекарство-лиганд. Она может оставаться присоединенной к N-концу в процессе синтеза, и может быть удалена после завершения синтеза конъюгата лекарства химическим путем или в других условиях, в которых избирательно происходит ее удаление. Блокирующие группы, подходящие для защиты N-конца, хорошо известны в области химии пептидов. Примеры блокирующих групп включают без ограничения водород,D-аминокислоту и карбобензокси (Cbz) хлорид. Термин "нуклеиновая кислота" относится к дезоксирибонуклеотидам и рибонуклеотидам и их полимерам в одноцепочечной или двуцепочечной форме. Термин охватывает нуклеиновые кислоты, со- 12016577 держащие известные аналоги нуклеотидов или модифицированные остатки или сцепления каркаса, которые являются синтетическими, встречающимися в природе и не встречающимися в природе, которые обладают сходными со сравниваемой нуклеиновой кислотой свойствами и которые метаболизируются сходным со сравниваемыми нуклеотидами путем. Примеры таких аналогов включают без ограничения фосфортиоаты,фосфорамидаты,метилфосфонаты,хиральные метилфосфонаты,2-Oметилрибонуклеотиды, пептид-нуклеиновые кислоты (PNAs). Если иное не указано особо, то конкретная аминокислотная последовательность также полностью охватывает ее стабильно модифицированные варианты (например, замещения с получением вырожденных кодонов) и комплиментарные последовательности, а также полностью указанную последовательность. Конкретно, замещения с получением вырожденных кодонов могут быть осуществлены путем получения последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено mixed-base и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260: 2605-2608 (1985); Rossolini et al., Mol. Cell. Probes 8: 9198 (1994. Термин "нуклеиновая кислота" используется взаимозаменяемо с терминами "ген", "кДНК","мРНК", "олигонуклеотид" и "полинуклеотид". Символ , используемый в качестве связи или отображаемый перпендикулярно связи, указывает точку, в которой отображаемый фрагмент присоединен с оставшейся частью молекулы, твердой подложкой и т.д. Термин "алкил", отдельно или как часть другого заместителя, означает, если иное не указано особо,неразветвленный или разветвленный или циклический углеводородный радикал или их комбинацию,который может быть полностью насыщенным, моно- или полиненасыщенным и может содержать диили поливалентные радикалы, содержащий указанное число атомов углерода (т.е. C1-C10 означает от 1 до 10 атомов углерода). Примеры насыщенных углеводородных радикалов включают без ограничения группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропилметил, гомологи и изомеры, например, н-пентила, н-гексила, нгептила, н-октила и т.п. Ненасыщенная алкильная группа представляет собой группу, содержащую одну или несколько двойных связей или тройных связей. Примеры ненасыщенных алкильных групп включают без ограничения винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4 пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и полимеры. Также понимают, что если иное не отмечено особо, то термин "алкил" включает производные алкила, более подробно описанные ниже, такие как "гетероалкил". Алкильные группы, которые ограничены углеводородными группами, также называют "гомоалкилом". Термин "алкилен", отдельно или как часть другого заместителя, означает полученный из алкана двухвалентный радикал, например без ограничения -СН 2 СН 2 СН 2 СН 2-, и дополнительно включает группы, описанные ниже как "гетероалкилены". Обычно, алкильная (или алкиленовая) группа содержат от 1 до 24 атомов углерода, причем группы, содержащие 10 или менее атомов углерода, являются предпочтительными для настоящего изобретения. "Низший алкил" или "низший алкилен" представляют собой алкильную или алкиленовую группу с более короткой цепью, содержащей, как правило, 8 или менее атомов углерода. Термин "гетероалкил", отдельно или в сочетании с другим термином, означает, если иное не указано особо, стабильный неразветвленный или разветвленный или циклический углеводородный радикал,или их сочетание, состоящий из определенного числа атомов углерода и по крайней мере одного гетероатома, выбранного из группы, состоящей из О, N, Si и S, где атомы азота, углерода и серы могут быть необязательно окислены, а атом азота может быть необязательно кватернизован. Гетероатом (гетероатомы) О, N, S и Si может находиться в любом положении внутри гетероалкильной группы или в положении, в котором алкильная группа соединена с оставшейся частью молекулы. Примеры включают без ограничения -СН 2-СН 2-O-СН 3, -СН 2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2,-S(O)-СН 3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 и -CH=CH-N(СН 3) -СН 3. До двух гетероатомов могут располагаться последовательно, как, например, -CH2-NH-OCH3 и -CH2-OSi(CH3)3. Сходным образом, термин "гетероалкилен", отдельно или как часть другого заместителя, означает двухвалентный радикал, полученный из гетероалкила, как, например, без ограничения -CH2-CH2-SCH2-СН 2- и -CH2-S-CH2-CH2-NH-CH2-. В гетероалкиленовых группах гетероатомы могут также занимать любой из двух концов цепи или оба вместе (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и т.п.). Термины "гетероалкил" и "гетероалкилен" охватывает полиэтиленгликоль и его производные (например, см. Shearwater Polymers Catalog, 2001). Кроме того, в алкиленовых и гетероалкиленовых линкерных группах ориентация линкерной группы не предусматривает какого-либо определенного направления, в котором следует читать формулу линкерной группы. Например, формула-C(O)2R'- представляет собой и -C(O)2R' и -R'C(O)2-. Термин "низший" в сочетании с терминами "алкил" или "гетероалкил" относится к фрагменту, содержащему от 1 до 6 атомов углерода. Термины "алкокси", "алкиламино", "алкилсульфонил" и "алкилтио" (или "тиоалкокси") используются в их традиционном понимании и относятся к алкильным группам, присоединенным к оставшейся- 13016577 части молекулы через атом кислорода, аминогруппу, SO2-группу или атом серы соответственно. Термин"арилсульфонил" относится к арильной группе, присоединенной к оставшейся части молекулы черезSO2-группы, а термин "сульфгидрил" относится к SH-группе. В целом, "ацильный заместитель" также выбирают из группы, представленной выше. Используемый в этом документе термин "ацильный заместитель" относится к группам, к которым он присоединен,и имеет валентность карбонильного атома углерода, который напрямую или опосредованно присоединен к полициклическому ядру соединений по настоящему изобретению. Термины "циклоалкил" и "гетероциклоалкил", отдельно или в сочетании с другими терминами,представляют собой, если иное не указано особо, циклические варианты замещенного или незамещенного "алкила" и замещенного или незамещенного "гетероалкила" соответственно. Кроме того, в случае гетероциклоалкила гетероатом может занимать положение, по которому гетероцикл присоединен к оставшейся части молекулы. Примеры циклоалкила включают без ограничения циклопентил, циклогексил, 1 циклогексенил, 3-циклогексенил, циклогептил и т.п. Примеры гетероциклоалкила включают без ограничения 1-(1,2,5,6-тетрагидропиридил), 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-морфолинил, 3 морфолинил, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиен-2-ил, тетрагидротиен-3-ил,1-пиперазинил, 2-пиперазинил и т.п. Гетероатомы и атомы углерода в циклических структурах являются необязательно окисленными. Термины "галоген" или "галоген", отдельно или как часть другого заместителя, означают, если иное не указано особо, атом фтора, хлора, брома или йода. Кроме того, это означает, что термины, такие как"галоген(C1-C4)алкил" включает без ограничения трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3 бромпропил и т.п. Термин "арил" означает, если иное не указано особо, замещенный или незамещенный полиненасыщенный, ароматический углеводородный заместитель, который может представлять собой одно кольцо или несколько колец (предпочтительно от 1 до 3 колец), которые конденсированы вместе или соединены ковалентно. Термин "гетероарил" относится к арильным группам (или кольцам), которые содержат от 1 до 4 гетероатомов, выбранных из N, О и S, где атомы азота, углерода и серы необязательно окислены, а атом (атомы) азота необязательно кватернизованы. Гетероарильная группа может быть присоединена к оставшейся части молекулы через гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают фенил, 1-нафтил, 2-нафтил, 4-биденил, 1-пирролил, 2-пирролил, 3-пирролил, 3 пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5 оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3 фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5 бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5 хиноксалинил, 3-хинолинил и 6-хинолинил. Заместители для каждой из приведенных выше арильных и гетероарильных кольцевых систем выбирают из группы подходящих заместителей, описанных ниже. Термины "арил" и "гетероарил" также охватывают кольцевые системы, в которых одна или несколько кольцевых систем конденсированы или иначе связаны с арильной или гетероарильной системой. Для краткости, термин "арил", используемый в сочетании с другими терминами (например, арилокси, арилтиокси, арилалкил), включает и арильные, и гетероарильные кольца, описанные выше. Так, это означает, что термин "арилалкил" включает те радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенэтил, пиридилметил и т.п.), включая алкильные группы, в которых атом углерода (например, метиленовая группа) был заменен, например, атомом кислорода (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.). Каждый из представленных выше терминов (например, "алкил", "гетероалкил", "арил" и "гетероарил") включает и замещенные и незамещенные формы указанного радикала. Предпочтительные заместители для каждого типа радикала представлены ниже. Заместители для алкильных и гетероалкильных радикалов (включая группы, обычно называемые алкиленом, алкенилом, гетероалкиленом, гетероалкенилом, алкинилом, циклоалкилом, гетероциклоалкилом, циклоалкенилом и гетероциклоалкенилом) в общем называют "алкильными заместителями" и "гетероалкильными заместителями" соответственно и они могут представлять собой одну или несколько из целого ряда групп, выбранных без ограничения из -OR', =O, =NR', =N-OR', -NR'R", -SR', галоген,-SiR'R"R"', -OC(O)R', -C(O)R', -CO2R', -CONR'R, -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R'",-NR"C(O)2R', -NR-C(NR'R"R"')=NR, -NR-C(NR'R")=NR"', -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN и -NO2 в количестве от 0 до (2m'+1), где m' равно общему числу атомов углерода в каждом радикале. Каждый R', R, R и R предпочтительно независимо относится к водороду, замещенному или незамещенному гетероалкилу, замещенному или незамещенному арилу, например, замещенному 1-3 галогенами арилу, замещенным или незамещенным алкильным, алкокси или тиоалкоксигруппам или арилалкильным группам. Если соединение по настоящему изобретению содержит более одной R-группы, например, то каждую из R-групп выбирают независимо, как и случае с каждой из R', R, R и R групп, если содержится более одной из указанных групп. Если R' и R присоединены к одному и тому же атому азота, то они могут объединяться с атомом азота с образованием 5-, 6- или 7-членнного кольца. Например, это- 14016577 означает, что -NR'R включает без ограничения 1-пирролидинил и 4-морфолинил. Из представленного выше описания заместителей специалист в данной области техники должен понимать, что термин "алкил" включает группы, содержащие атомы углерода, связанные с отличными от водорода группами, такими как галогеналкил (например, -CF3 и -CH2CF3) и ацил (например, -C(O)CH3, -C(O)CF3,-С(O)СН 2 ОСН 3 и т.п.). По аналогии с заместителями, описанными для алкильного радикала, арильные заместители и гетероарильные заместители в общем называют "арильными заместителями" и "гетероарильными заместителями" соответственно и выбирают, например, из галогена, -OR', =O, =NR', =N-OR', -NR'R, -SR',-галоген, -SiR'R"R'", -OC(O)R', -C(O)R', -CO2R', -CONR'R", -ОС(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"',-NR"C(O)2R', -NR-C(NR'R")=NR"', -S(O)R', -S(O)2R', -S(O)2NR'R", -NRSO2R', -CN и -NO2, -R', -N3,-CH(Ph)2, фтор(C1-C4)алкокси и фтор(C1-C4)алкила, в количестве от 0 до общего числа незаполненных валентностей в ароматической кольцевой системе; и где R', R, R и R предпочтительно независимо выбирают из водорода, (C1-C8)алкила и гетероалкила, незамещенного арила и гетероарила, (незамещенный арил)-(C1-C4)алкила и (незамещенный арил)окси(C1-C4)алкила. Если соединение по настоящему изобретению содержит более одной R-группы, например, то каждую из R-групп выбирают независимо, как и в случае с каждой из R', R, R и R групп, если содержится более одной из указанных групп. Два арильных заместителя на смежных атомах арильного или гетероарильного кольца могут быть необязательно заменены заместителем формулы -Т-С(О)-(CRR')q-U-, в которой Т и U независимо представляют собой -NR-, -O-, -CRR'- или одинарную связь и q равно целому числу от 0 до 3. В качестве альтернативы, два заместителя на смежных атомах арильного или гетероарильного кольца могут быть необязательно заменены заместителем формулы -А-(СН 2)rB-, в которой А и В независимо представляют собой -CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь и r равно целому числу от 1 до 4. Одна из одинарных связей полученного таким образом нового кольца может быть заменена двойной связью. В качестве альтернативы, два заместителя на смежных атомах арильного или гетероарильного кольца могут быть необязательно заменены заместителем формулы -(CRR')s-X-(CRR)d-, в которой s и d независимо представляют собой целое число от 0 до 3 и X представляет собой -O-, -NR'-, -S-, -S(O)-,-S(O)2- или S(O)2NR'-. Заместители R, R', R и R предпочтительно независимо выбирают из водорода или замещенного или незамещенного (C1-C6)алкила. Используемый в этом документе термин "дифосфат" включает без ограничения сложный эфир фосфорной кислоты, содержащий две фосфатные группы. Термин "трифосфат" включает без ограничения сложный эфир фосфорной кислоты, содержащий три фосфатные группы. Например, конкретные лекарства, содержащие дифосфат или трифосфат, включают Используемый в этом документе термин "гетероатом" включает атом кислорода (О), азота (N), серы(S) или кремния (Si). Символ "R" является общим сокращением, которое представляет собой заместитель, который выбирают из замещенных или незамещенных алкильных, замещенных или незамещенных гетероалкильных, замещенных или незамещенных арильных, замещенных или незамещенных гетероарильных и замещенных или незамещенных гетероциклильных групп. Используемый в этом документе термин "фармацевтически приемлемый носитель" означает фармацевтически приемлемый материал, композицию или основу, такие как жидкий или твердый заполнитель, разбавитель, наполнитель, растворитель или герметизирующий материал, используемые для переноса или транспорта химического агента. Фармацевтически приемлемые носители включают фармацевтически приемлемые соли, где термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимо- 15016577 сти от наличия конкретных заместителей у соединений, описанных в этом документе. Если соединения по настоящему изобретению содержат относительно кислотные функциональные группы, то соли добавления основания могут быть получены путем осуществления взаимодействия нейтральной формы таких соединений с достаточным количеством желаемого основания, либо неразбавленного либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей добавления основания включают соль натрия, калия, кальция, аммония, органической аминогруппы или магния, или сходную соль. Если соединения по настоящему из обретению содержат относительно основные функциональные группы, то соли добавления кислоты могут быть получены путем осуществления взаимодействия нейтральной формы таких соединений с достаточным количеством желаемой кислоты, либо неразбавленной либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей добавления кислоты включают соли, полученные из неорганических кислот, таких как соляная, бромисто-водородная, азотная, угольная, monohydrogencarbonic, фосфорная, monohydrogenphosphoric, dihydrogenphosphoric, серная,monohydrogensulfuric, йодисто-водородная или фосфорная кислота и т.п., а также соли, полученные из сравнительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, субериновая, фумаровая, молочная, миндальная, фталевая, бензолсульфоновая, паратолилсульфоновая, лимонная, винная, метансульфоновая и т.п. Также включены соли аминокислот, такие как аргинат и т.п., и соли органических кислота, таких как глюкуроновая или галактуроновая кислота, и т.п. (например, см. Berge et al., "Pharmaceutical Salts", Journal of PharmaceuticalScience, 1977, 66, 1-19). Некоторые конкретные соединения по настоящему изобретению содержат и основные и кислотные функциональные группы, что позволяет преобразовывать соединения в соли добавления либо основания, либо кислоты. Нейтральные формы соединений предпочтительно восстанавливают путем приведения в контакт соединения с основанием или кислотой и выделения исходного соединения стандартным способом. Исходная форма соединения отличается от различных солей по некоторым своим свойствам, таким как растворимость в полярных растворителях, но в остальном соли эквивалентны исходной форме соединения для целей настоящего изобретения. В дополнение к солевым формам настоящее изобретение относится к соединениям, которые находятся в форме пролекарства. Пролекарства описанных в этом документе соединений представляют собой соединения, которые легко претерпевают химические изменения в физиологических условиях с получением соединений по настоящему изобретению. Кроме того, пролекарства могут превращаться ex vivo в соединения по настоящему изобретению химическими и биохимическими способами. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению, будучи помещенными в резервуар трансдермального пластыря вместе с подходящим ферментом или химическим реагентом. Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В общем сольватированные формы являются эквивалентом несольватированных форм и подпадают под объем настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в форме множественных кристаллов или в аморфной форме. В целом все физические формы являются эквивалентными для применений, предусмотренных настоящим изобретением, и считаются подпадающими под объем настоящего изобретения. Некоторые соединения по настоящему изобретению содержат асимметрические атомы углерода(оптические центры) или двойные связи; рацематы, диастереоизомеры, геометрические изомеры и отдельные изомеры подпадают под объем настоящего изобретения. Соединения по настоящему изобретению могут также содержать необычные соотношения изотопов одного или нескольких из атомов, образующих такие соединения. Например, соединения могут быть помечены радиоактивными изотопами, такими как, например, тритий (3 Н), йод-125 (125I) или углерод-14(14 С). Все варианты изотопов соединений по настоящему изобретению, радиоактивные или нет, считаются подпадающими под объем настоящего изобретения. Термин "фрагмент прикрепления" или "фрагмент для прикрепления группы направленного действия" относится к фрагменту, который делает возможным присоединение группы направленного действия к линкеру. Обычные группы прикрепления включают, в качестве пояснения, но не ограничения, алкил,аминоалкил, аминокарбонилалкил, карбоксиалкил, гидроксиалкил, алкилмалеимид, алкил-Nгидроксилсукцинимид, полиэтиленгликоль-малеимид и полиэтиленгликоль-N-гидроксилсукцинимид,каждая из которых может быть дополнительно замещена. Для фактического присоединения к группе направленного действия линкер может также содержать фрагмент прикрепления. Используемый в этом документе термин "уходящая группа" относится к части субстрата, которая отщепляется от субстрата в реакции. Используемый в этом документе термин "антитело" включает целые антитела и любой антигенсвязывающий фрагмент (т.е. "антигенсвязывающую часть") или их отдельные цепи. Термин "антитело" относится к гликопротеину, содержащему по крайней мере две тяжелые (Н) цепи и две легкие (L) цепи,связанных между собой дисульфидными связями, или к их антигенсвязывающей части. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (VH) и константной области тяжелой цепи. Кон- 16016577 стантная область тяжелой цепи состоит из трех доменов, CH1, СН 2 и СН 3, и может иметь , , ,илиизотип. Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL, который может иметьилиизотип. Области VH и VL могут быть дополнительно подразделены на гипервариабельные области, называемые гипервариабельными участками (CDR), которые чередуются с более консервативными участками, называемыми скелетной областью (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от N-конца до С-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента. Используемые в этом документе термины "фрагмент антитела" или "антигенсвязывающая часть" антитела (или просто "часть антитела") относятся к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном. Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами целой молекулы антитела. Примеры связывающих фрагментов, охватываемых термином "фрагмент антитела" или "антигенсвязывающая часть" антитела включают (i) фрагмент Fab, одновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов;(ii) фрагмент F(ab')2, двухвалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в области "талии"; (iii) фрагмент Fd, состоящий из VH и СН 1 доменов; (iv) фрагментFv, состоящий из VL и VH доменов одного плеча антитела, (v) фрагмент dAb (Ward et al., (1989) Nature 341:544-546), который состоит из VH домена; и (vi) и выделенный гипервариабельный участок (CDR). Кроме того, хотя два домена фрагмента Fv, VL и VH кодируются различными генами, они могут быть объединены рекомбинантными методами при помощи синтетического линкера, который делает возможным образование ими единой белковой цепи, в которой области VL и VH соединяются с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv) (например, см. Bird et al. (1988) Science 2A2:A23-426; и Huston et al. (1988), Proc. Natl. Acad. Sci USA 85:5879-5883. Такие одноцепочечные антитела считаются подпадающими под значение термина "антигенсвязывающая часть" антитела. Указанные фрагменты антител получают с использованием стандартных методик, известных специалистам в данной техники, а скрининг на из пригодность проводят тем же путем, что и для интактных антител. Используемый в этом документе термин "моноклональное антитело" относится к препарату молекул антител одного молекулярного строения. Моноклональное антитело обладает специфичностью связывания и сродством к конкретному эпитопу. Для получения моноклональных или поликлональных антител может использоваться любая известная методика (например, см. KohlerMilstein, Nature 256:495-497 (1975); Kozbor et al., Immunology Today 4:72 (1983); Cole et al., p. 77-96 в MONOCLONAL ANTIBODIES AND CANCER THERAPY, Alan R.Liss, Inc. (1985. Способы получения поликлональных антител известны специалистам в данной области техники. Инбредную линию мышей (например, мышей BALB/C) или кроликов иммунизируют белком с использованием стандартного адъюванта, такого как адъювант Фрейнда, и стандартного протокола иммунизации. Проводят мониторинг ответа иммунной системы животного на препарат иммуногена путем отбора образцов крови и определения титра реактивности в отношении -субъединиц. После получения достаточно высоких титров антител к иммуногену у животного отбирают кровь и получают антисыворотку. Затем по желанию может проводиться фракционирование антисыворотки для обогащения антителами, реактивными в отношении белка. Моноклональные антитела могут быть получены различными методиками, известными специалистам в данной области техники. Вкратце, клетки селезенки иммунизированного желаемым антигеном животного иммортализуют, обычно путем слияния с клетками миеломы (см. KohlerMilstein, Eur. J.Immunol. 6:511-519 (1976. Альтернативные способы иммортализации включают трансформацию с вирусом Эпштейна-Барра, онкогенами или ретровирусами, или другие способы, известные в данной области техники. В предпочтительном примере осуществления антитело представляет собой химерное или гуманизированное антитело. Химерные или гуманизированные антитела по настоящему изобретению могут быть получены на основе последовательности мышиного моноклонального антитела. ДНК, кодирующая тяжелую и легкую цепь иммуноглобулинов, может быть получена из представляющей интерес мышиной гибридомы и сконструирована с использованием стандартных методик молекулярной биологии так, чтобы содержать немышиные последовательности иммуноглобулина (например, человека). Например, для создания химерного антитела вариабельные области иммуноглобулина мыши связывают с константными областями иммуноглобулина человека с использованием способов, известных в данной области техники(например, см. патент США 4816567, выданный Cabilly et al.). Для создания гуманизированного антитела CDR области мышей могут быть вставлены в рамку считывания человека с использованием способов, известных в данной области техники (например, см. патент США 5225539, выданный Winter, и- 17016577 патенты США 5530101; 5585089; 5693762 и 6180370, выданные Queen et al.). В другом предпочтительном примере осуществления антитело представляет собой человеческое антитело. Такие человеческие антитела могут быть получены путем иммунизации трансгенных или трансхромосомных мышей, в которых эндогенные гены мышиных иммуноглобулинов были инактивированы и были введены экзогенные гены человеческих иммуноглобулинов. Такие мыши известны в данной области техники (например, см. патенты США 5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429; все выданные Lonberg и Kay; патенты США 5939598; 6075181; 6114598; 6150584 и 6162963, выданные Kucherlapati et al.; и заявку согласно РСТ WO 02/43478,поданную Ishida et al.) Человеческие антитела могут быть также получены с использованием методов фагового дисплея для скрининга библиотек генов, кодирующих человеческие иммуноглобулины. Такие методы фагового дисплея для выделения человеческих антител также хорошо известны в данной области техники (например, см. патенты США 5223409; 5403484; и 5571698, выданные Ladner et al.; патенты США 5427908 и 5580717, выданные Dower et al.; патенты США 5969108 и 6172197, выданныеGriffiths et al.). Используемый в этом документе термин "твердая подложка" относится к материалу, который является, по существу, нерастворимым в выбранной системе растворителей или который может легко разделяться (например, путем выпадения в осадок) из выбранной системы растворителей, в которой он растворен. Твердые подложки, пригодные для применения в практике настоящего изобретения, могут включать группы, которые активированы или способны к активации для возможности связывания выбранных веществ с твердой подложкой. Твердая подложка может также представлять собой субстрат, например чип, слоистую пластину или лунку, к которым может быть прикреплено одно или несколько соединений по настоящему изобретению. Используемый в этом документе термин "реакционноспособная функциональная группа" относится к группам, включая без ограничения олефины, ацетилены, спирты, фенолы, простые эфиры, оксиды, галогениды, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амиды, цианаты, изоцианаты, тиоцианаты, изотиоцианаты, амины, гидразины, гидразоны, гидразиды, диазо, диазоний, нитро, нитрилы,меркаптаны, сульфиды, дисульфиды, сульфоксиды, сульфоны, сульфоные кислоты, сульфиновые кислоты, ацетали, кетали, ангидриды, сульфаты, сульфеновые кислоты, изонитрилы, амидины, имиды, имидаты, нитроны, гидроксиламины, оксимы, гидроксамовые кислоты, тиогидроксамовые кислоты, аллены,орто-эфиры, сульфиты, енамины, инамины, мочевины, псевдомочевины, семикарбазиды, карбодиимиды,карбаматы, имины, азида, азосоединения, азоксисоединения и нитрозосоединения. Реакционноспособные функциональные группы также включают группы, используемые для приготовления биоконъюгатов,например, сложные N-гидроксисукцинимидные эфиры, малеимиды и т.п. (например, см. Hermanson,BIOCONJUGATE TECHNIQUES, Academic press, San Diego, 1996). Способы получения каждой из указанных групп хорошо известны в данной области техники и их применение или модификация для конкретных целей находятся в рамках навыков специалиста в данной области техники (например, см.Sandler and Karo, eds. ORGANIC FUNCTIONAL GROUP PREPARATIONS, Academic Press, San Diego,1989). Реакционноспособные функциональные группы могут быть защищенными или незащищенными. Соединения по настоящему изобретению получают в виде отдельного изомера (например, энантиомера, цис-транс изомера, позиционного изомера, диастереоизомера) или в виде смеси изомеров. В предпочтительном примере осуществления соединения получают, по существу, в виде отдельного изомера. Способы получения, по существу, чистых изомеров соединений известны в данной области техники. Например, обогащенные энантиомерами смеси и энантиомерно чистые соединения могут быть получены с использованием промежуточных продуктов синтеза, которые являются энантиомерно чистыми, в сочетании с реакциями, которые либо не затрагивают стереохимию хирального центра, либо приводят к его полной инверсии. В качестве альтернативы, конечный продукт или промежуточные продукты в процессе синтеза может быть преобразован с отдельный стереоизомер. Методики инвертирования или сохранения неизменным конкретного стереоцентра и преобразования смеси стереоизомеров хорошо известны в данной области техники и находятся в рамках навыков специалиста в данной области техники по выбору подходящего способа в конкретной ситуации (в общем см. Furniss et al. (eds.), VOGEL's ENCYCLOPEDIA OF PRACTICAL ORGANIC CHEMISTRY 5 ТН ED., Longman Scientific and Technical Ltd., Essex, 1991,p. 809-816; и Heller, Ace. Chem. Res. 23: 128 (1990. Линкеры. Настоящее изобретение относится к конъюгатам лекарство-лиганд, где лекарство соединено с лигандом посредством химического линкера, включая без ограничения линкеры, раскрытые в заявке на выдачу патента США 11/134826 и в предварительных заявках на выдачу патента США 60/572667 и 60/661174, каждая из которых включена в этом документ посредством ссылки. Такой линкер представляет собой пептидильный, гидразиновый или дисульфиный линкер, описываемые в этом документе как(L4)p-F-(L1)m, (L4)p-H-(L1)m, (L4)p-J-(L1)m соответственно. В дополнение к линкерам для присоединения к лекарству настоящее изобретение также относится к расщепляемой линкерной "ножке", которая подхо- 18016577 дит для присоединения практически к любым молекулярным частицам. Примеры линкерных ножек по настоящему изобретению представлены в этом документе посредством ссылки к их присоединению к терапевтическому фрагменту. Однако для специалиста в данной области техники совершенно ясно, что линкеры могут быть присоединены к различным частицам, включая без ограничения диагностические средства, аналитические агенты, биомолекулы, агенты направленного действия, детектируемые метки и т.п. В одном аспекте настоящее изобретение относится к линкерам, которые пригодны для присоединения групп направленного действия к терапевтическим агентам и маркерам. В другом аспекте настоящее изобретение относится к линкерам, которые наделяют соединения стабильностью, снижают их токсичность in vivo или иным образом благоприятно влияют на их фармакокинетику, биологическую доступность и/или фармакодинамику. В таких примерах осуществления, как правило, предпочтительно, чтобы линкер расщеплялся, высвобождая активное лекарство, как только лекарство будет доставлено в место приложения его действия. Так, в одном примере осуществления изобретения линкеры по настоящему изобретению не оставляют следов, так как после отделения от терапевтического средства или маркера(как, например, в процессе активации) не остается следов присутствия линкера. В другом примере осуществления изобретения линкеры характеризуются своей способностью к расщеплению внутри или близ клетки-мишени, как, например, в месте приложения терапевтического действия или активности маркера. Такое расщепление может быть ферментативным по своей природе. Это свойство способствует снижению системной активации терапевтического средства или маркера, снижению токсичности и системных побочных эффектов. Предпочтительные расщепляемые ферментами группы включают пептидные связи,сложноэфирные связи и дисульфидные связи. В других примерах осуществления линкеры чувствительны к рН и расщепляются при изменении значения рН. Важным аспектом настоящего изобретения является возможность регуляции скорости, с которой расщепляется линкер. Например, описанные в этом документе гидразиновые линкеры являются особенно применимыми, поскольку в зависимости от конкретного строения применяемого линкера можно варьировать скоростью, с которой линкер циклизуется и тем самым отщепляет лекарство от лиганда. ВWO 02/096910 представлено несколько специфичных комплексов лиганд-лекарство, содержащих гидразиновый линкер. Однако не существует никакой возможности "настраивать" линкерную композицию в зависимости от требуемой скорости циклизации, и конкретно описанные соединения отщепляют лиганд от лекарства со скоростью меньшей, чем это было бы предпочтительно для многих конъюгатов лекарство-линкер. В отличие от этого гидразиновые линкеры по настоящему изобретению обеспечивают широкий спектр скоростей циклизации, от очень быстрых до очень медленных, давая возможность выбрать конкретный гидразиновый линкер в зависимости от требуемой скорости циклизации. Например, очень быстрая циклизация может быть достигнута с гидразиновыми линкерами, которые при расщеплении дают одно 5-членное кольцо. Предпочтительные значения скорости циклизации для направленной доставки цитотоксического агента в клетки достигают путем использования гидразиновых линкеров, которые при расщеплении дают либо два 5-членных кольца, либо одно 6-членное кольцо, в результате расщепления линкера, содержащего два присоединенных к одному и тому атому (геминальных) метила. Было показано, что эффект двух присоединенных к одному и тому атому метилов (gem-диметил-эффект) увеличивает скорость реакции циклизации по сравнению с одним 6-членным кольцом без двух геминальных метилов. Этот эффект является результатом ослабления напряжения в кольце. Однако иногда вместо того, чтобы ускорять реакцию, заместители могут замедлять ее. Обычно причина замедления сводится к стерическому затруднению. Как представлено в примере 2.4, gem-диметил-замещение способствует более быстрому протеканию реакции циклизации по сравнению со случаем, когда геминальный атом углерода представляет собой СН 2. Однако важно отметить, что в некоторых примерах осуществления предпочтительным может оказаться линкер, который расщепляется более медленно. Например, в композиции с замедленным высвобождением или в композиции, содержащей компоненты и с быстрым и с медленным высвобождением,может быть полезным использование линкера, который расщепляется более медленно. В определенных примерах осуществления медленная скорость циклизации достигается путем использования гидразинового линкера, который при расщеплении дает либо одно 6-кольцо без дет-диметил-замещения, либо одно 7-членное кольцо. Линкеры могут также служить для придания устойчивости терапевтическому средству или маркеру к разрушению в процессе кровообращения. Это качество обеспечивает значительный положительный эффект, поскольку такая стабилизация приводит к увеличению продолжительности времени полужизни в кровотоке присоединенного средства или маркера. Линкер также служит для смягчения активности присоединенного средства или маркера таким образом, что конъюгат обладает в кровотоке сравнительно мягким действием, и оказывает желаемое действие (например, токсическое) после активации в желаемом месте приложения действия. В случае конъюгатов терапевтических средств это качество линкера служит для увеличения значения терапевтического индекса средства. Стабилизирующие группы предпочтительно выбирают для замедления выведения и метаболизма терапевтического средства или маркера ферментами, которые могут присутствовать в крови или не в не- 19016577 являющихся мишенью тканях, и, кроме того, выбирают для ограничения транспорта средства или маркера в клетки. Стабилизирующие группы служат для блокировки разрушения средства или маркера, а также могут наделять средство или маркер другими физическими характеристиками. Стабилизирующая группа может также улучшать стабильность средства или маркера в процессе их хранения в композиции лекарственной формулы или отдельно. В идеале, стабилизирующую группу используют для стабилизации терапевтического средства или маркера, если она защищает средство или маркер от разрушения при тестовом хранении средства или маркера в крови человека при 37 С в течение 2 ч, и приводит к расщеплению менее чем 20%, предпочтительно менее чем 10%, более предпочтительно менее чем 5% и еще более предпочтительно менее чем 2%, средства или маркера ферментами, присутствующими в крови человека в данных условиях проведения теста. Настоящее изобретение также относится к конъюгатам, содержащим такие линкеры. Более конкретно, настоящее изобретение относится к пролекарствам, которые могут быть использованы для лечения заболевания, в особенности для химиотерапии рака. В конкретном плане, применение описанных в этом документе линкеров дает пролекарства, которые обладают высокой специфичностью действия,сниженной токсичностью и улучшенной стабильностью в кровотоке по сравнению с пролекарствами сходного строения. Линкеры по настоящему изобретению, такие как описанные в этом документе, могут находиться в любом положении структуры цитотоксичного конъюгата. Таким образом, предложен линкер, который может содержать любую из целого ряда групп как часть своей цепи и расщепляться in vivo, например, в кровотоке, со скоростью, повышенной по сравнению с таковой для конструктов, не содержащих такие группы. Также предложены конъюгаты линкерных"ножек" с терапевтическими и диагностическими средствами. Линкеры применимы для получения пролекарственных аналогов терапевтических средств и для обратимого связывания терапевтического или диагностического средства с агентом направленного действия, детектируемой меткой или твердой подложкой. Линкеры могут входить в композицию комплексов, которые содержат цитотоксины по настоящему изобретению. В дополнение к расщепляемой пептидной, гидразиновой или дисульфидной группе, между цитотоксином и агентом направленного действия необязательно вводят одну или несколько саморазрушающихся линкерных групп L1. Такие линкерные группы могут также описываться как спейсерные группы и содержать по крайней мере две реакционноспособные функциональные группы. Обычно, одна из химических функциональных групп спейсерной группы связана с химической функциональной группой терапевтического средства, например цитотоксина, тогда как другая химическая функциональная группа спейсерной группы используется для связи с химической функциональной группой агента направленного действия или расщепляемого линкера. Примеры химических функциональных групп спейсерной группы включают гидрокси, меркапто, карбонильную, карбокси, амино, кетоновую и меркапто группы. Представленные L1 саморазрушающиеся линкерные группы, как правило, представляют собой замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, или замещенный или незамещенный гетероалкил. В одном примере осуществления алкильные или арильные группы могут содержать от 1 до 20 атомов углерода. Они также могут содержать фрагмент полиэтиленгликоля. Примеры спейсерных групп включают, например, 6-аминогексанол, 6-меркаптогексанол, 10 гидроксидекановую кислоту, глицин и другие аминокислоты, 1,6-гександиол, -аланин, 2-аминоэтанол,цистеамин (2-аминоэтантиол), 5-аминопентановую кислоту, 6-аминогексановую кислоту, 3 малеимидобензойную кислоту, фталид, -замещенные фталиды, карбонильную группу, сложные аминалевые эфиры, нуклеиновые кислоты, пептиды и т.п. Спейсер может служить для добавления комплексу цитотоксин-агент направленного действия дополнительной молекулярной массы и введения химической функциональной группы. Дополнительная масса и функциональная группа, как правило, изменяет значение времени полужизни в сыворотке крови и другие свойства комплекса. Таким образом, путем тщательного подбора спейсерных групп могут быть получены комплексы цитотоксина с целым диапазоном значений времени полужизни в сыворотке крови. Спейсер (спейсеры), располагающиеся непосредственно рядом с фрагментом лекарства, также обозначают как (L1)m, где m равно целому числу, выбранному из 0, 1, 2, 3, 4, 5 или 6. При наличии нескольких спейсеров L1 могут использоваться одинаковые или различные спейсеры. L1 может представлять собой любую саморазрушающуюся группу. В одном примере осуществления L1 предпочтительно представляет собой замещенный алкил, незамещенный алкил, замещенный гетероалкил и незамещенный гетероалкил, незамещенный гетероциклоалкил и замещенный гетероциклоалкил. Если конъюгат лекарство-лиганд содержит гидразиновый линкер, то L1 не содержит дисульфидную связь.L4 представляет собой фрагмент линкера, который придает содержащим такой фрагмент конъюгатам свойства повышенной растворимости и сниженной способности к агрегации. Линкер L4 не должен быть саморазрушающимся. В одном примере осуществления фрагмент L4 представляет собой замещен- 20016577 ный алкил, незамещенный алкил, замещенный арил, незамещенный арил, замещенный гетероалкил или незамещенный гетероалкил, каждый из которых может быть неразветвленным, разветвленным или циклическим. Заместители могут представлять собой, например, низший (C1-C6)алкил, алкокси, алкилтио,алкиламино или диалкиламино. В определенных примерах осуществления L4 содержит нециклический фрагмент. В другом примере осуществления L4 содержит любой положительно или отрицательно заряженный аминокислотный полимер, такой как полилизин или полиаргинин. L4 может содержать полимер,такой как фрагмент полиэтиленгликоля. Кроме того, линкер L4 содержит, например, и полимерный компонент, и небольшой химический фрагмент. В предпочтительном примере осуществления L4 содержит фрагмент полиэтиленгликоля (PEG). Фрагмент PEG в композиции L4 может быть длиной от 1 до 50 звеньев. Предпочтительно фрагмент PEG имеет 1-12 повторяющихся звеньев, более предпочтительно 3-12 повторяющихся звеньев, более предпочтительно 2-6 повторяющихся звеньев, еще более предпочтительно 3-5 повторяющихся звеньев и наиболее предпочтительно 4 повторяющихся звена. L4 может состоять лишь из фрагмента PEG или он может дополнительно содержать замещенный или незамещенный алкил или гетероалкил. ОбъединениеPEG как части фрагмента L4 полезно для улучшения растворимости комплекса в воде. Кроме того, фрагмент PEG снижает способность к агрегации, которая может происходить во время конъюгации лекарства и антитела.(1) Пептидный линкер (F). Как рассматривалось выше, пептидильные линкеры по настоящему изобретению могут быть представлены общей формулой (L4)р-F-(L1)m, где F представляет собой часть линкера, содержащую пептидильный фрагмент. В одном примере осуществления часть F содержит необязательный дополнительный саморазрушающийся линкер (линкеры) L2 и карбонильную группу. В другом примере осуществления часть F содержит аминогруппу и необязательную спейсерную группу (группы) L3. Соответственно в одном примере осуществления конъюгат содержит пептидильный линкер, содержащий структуру формулы (4) В этом примере осуществления L1 представляет собой описанный выше саморазрушающийся линкер и L4 представляет собой фрагмент, который наделяет свойствами повышенной растворимости и сниженной способности к агрегации, как описано выше. L2 представляет собой саморазрушающийся линкерm равно 3, 4, 5 или 6. АА 1 представляет собой одну или несколько природных аминокислот и/или неприродных -аминокислот; с равно целому числу от 1 до 20. В пептидных линкерах по настоящему изобретению представленной выше формулы 4 АА 1 связана своим N-концом либо непосредственно с L4, либо, если L4 отсутствует, непосредственно с группой X(т.е. с агентом направленного действия, детектируемой меткой, защищенной реакционноспособной функциональной группой или незащищенной реакционноспособной функциональной группой). В некоторых примерах осуществления, при наличии L4, L4 не содержит карбоксильную ацильную группу, непосредственно связанную с N-концом (АА 1)с. Таким образом, в указанных примерах осуществления нет необходимости в наличии карбоксильного ацильного звена непосредственно между L4 или X4 и АА 1, как это необходимо в пептидных линкерах в соответствии с патентом США 6214345. В другом примере осуществления конъюгат содержит пептидильный линкер, содержащий структуру формулы (5) В этом примере осуществления L4 представляет собой фрагмент, который наделяет свойствами повышенной растворимости и сниженной способности к агрегации, как описано выше; L3 представляет собой спейсерную группу, содержащую первичный или вторичный амин или карбоксильную функциональную группу, и либо амин группы L3 образует амидную связь с боковой карбоксильной функциональной группой группы D, либо карбоксил группы L3 образует амидную связь с боковой аминогруппой группы D; и о и р независимо равны 0 или 1. АА 1 представляет собой одну или несколько природных аминокислот и/или неприродных -аминокислот; с равно целому числу от 1 до 20. В этом примере осуществления L1 отсутствует (т.е. в общей формуле m равно 0). В пептидных линкерах по настоящему изобретению представленной выше формулы (5) АА 1 связана своим N-концом либо непосредственно с L4, либо, если L4 отсутствует, непосредственно с группой X(т.е. с агентом направленного действия, детектируемой меткой, защищенной реакционноспособной функциональной группой или незащищенной реакционноспособной функциональной группой). В неко- 21016577 торых примерах осуществления, при наличии L4, L4 не содержит карбоксильную ацильную группу, непосредственно связанную с N-концом (АА 1)с. Таким образом, в указанных примерах осуществления нет необходимости в наличии карбоксильного ацильного звена непосредственно между L4 или X4 и АА 1, как этот необходимо в пептидных линкера в соответствии с патентом США 6214345. Саморазрушающийся линкер L2. Саморазрушающийся линкер L2 представляет собой бифункциональный химический фрагмент,способный ковалентно связывать вместе два отстоящих химических фрагмента в стабильную в обычных условиях состоящую из трех частей молекулу, высвобождающий один из упомянутых отстоящих химических фрагментов из состоящей из трех частей молекулы посредством ферментативного расщепления, а другой из упомянутых отстоящих химических фрагментов - вследствие спонтанного отщепления от оставшейся части молекулы после упомянутого ферментативного расщепления. В соответствии с настоящим изобретением саморазрушающийся спейсер ковалентно связан одним из своих концов с пептидным фрагментом и ковалентно связан другим своим концом с химически реакционноспособным участком фрагмента лекарства, чья дериватизация ингибирует фармакологическую активность, с тем, чтобы разнести и ковалентно связать вместе пептидный фрагмент и фрагмент лекарства в состоящую из трех частей молекулу, которая стабильна и фармакологически неактивна в отсутствие определенного фермента,но расщепляема определенным ферментом по связи, ковалентно связывающей спейсерный фрагмент и пептидный фрагмент, с высвобождением тем самым пептидного фрагмента из состоящей из трех частей молекулы. Такое ферментативное расщепление, в свою очередь, активирует саморазрушающийся характер спейсерного фрагмента и инициирует спонтанное расщепление связи, ковалентно связывающей спейсерный фрагмент с фрагментов лекарства, с высвобождением тем самым лекарства в фармакологически активной форме. Саморазрушающийся линкер L2 может представлять собой саморазрушающуюся группу. Предпочтительно L2 представляет собой замещенный алкил, незамещенный алкил, замещенный гетероалкил, незамещенный гетероалкил, незамещенный гетероциклоалкил, замещенный гетероциклоалкил, замещенный и незамещенный арил и замещенный и незамещенный гетероарил. Один особенно предпочтительный саморазрушающийся спейсер L2 может быть представлен формулой (6): Ароматическое кольцо аминобензильной группы может быть замещено одной или несколькими группами K. Группа K представляет собой заместитель ароматического кольца, который замещает атом водорода, иным способом присоединенный к одному из четырех незамещенных атомов углерода, которые являются частью структуры кольца. Группа K может представлять собой одиночный атом, такой как галоген, или может представлять собой многоатомную группу, такую как алкил, гетероалкил, амино,нитро, гидрокси, алкокси, галогеналкил и циано. Каждый K независимо выбирают из группы, состоящей из замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила,замещенного гетероциклоалкила, незамещенного гетероциклоалкила, галогена, NO2, NR21R22,NR21COR22, OCONR21R22, OCOR21 и OR21, где R21 и R22 независимо выбирают из группы, состоящей из Н,замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила,замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила и незамещенного гетероциклоалкила. Примеры заместителей K включают без ограничения F, Cl, Br, I, NO2, ОН, ОСН 3, NHCOCH3, N(CH3)2, NHCOCF3 и метил. Для Ka a представляет собой целое число, равное 0, 1, 2, 3 или 4. В одном предпочтительном примере осуществления а равно 0. Атом кислорода эфирной группы в представленной выше структуре соединен с карбонильной группой. Линия, проведенная от функциональной группы NR24 к ароматическому кольцу, указывает на то, что аминогруппа может быть связана с любым из пяти атомов углерода, которые образуют кольцо и которые не замещены -СН 2-O-группой. Предпочтительно функциональная группа NR24 группы X ковалентно связана с ароматическим кольцом в параположении относительно -СН 2-O-группы. R24 представляет собой радикал, выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила,замещенного гетероалкила и незамещенного гетероалкила. В конкретном примере осуществления R24 представляет собой водород. В предпочтительном примере осуществления настоящее изобретение относится к представленному выше пептидному линкеру формулы (4), где F содержит структуруK представляет собой элемент конструкции, независимо выбранный из группы, состоящей из замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила, незамещенного гетероциклоалкила, галогена, NO2, NR21R22, NR21COR22,OCONR21R22, OCOR21 и OR21,где R21 и R22 независимо выбирают из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила, незамещенного гетероциклоалкила; а представляет собой целое число, равное 0, 1, 2, 3 или 4. В другом примере осуществления пептидный линкер представленной выше формулы (4) содержит в которой каждый R2 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила. Спейсерная группа L3. Спейсерная группа L3 характеризуется тем, что содержит первичный или вторичный амин или карбоксильную функциональную группу, и либо амин группы L3 образует амидную связь с боковой карбоксильной функциональной группой группы D, либо карбоксил группы L3 образует амидную связь с боковой аминогруппой группы D. Группа L3 может быть выбрана из группы, состоящей из замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, или замещенного или незамещенного гетероциклоалкила. В предпочтительном примере осуществления L3 содержит ароматическую группу. Более предпочтительно L3 содержит группу бензойной кислоты, анилиновую группу или индольную группу. Неограничивающими примерами структур, которые могут служить в качестве спейсера -L3-NH-, включают следующие структуры: в которых Z представляет собой элемент конструкции, выбранный из О, S и NR23,где R23 представляет собой радикал, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и ацила. При расщеплении линкера по настоящему изобретению, содержащего L3, фрагмент L3 остается присоединенным к лекарству D. Соответственно фрагмент L3 выбирают таким образом, что его присое- 23016577 динение к D значительно не меняет активность D. В другом примере осуществления часть лекарства D сама по себе выступает в качестве спейсера L3. Например, в одном примере осуществления лекарство D представляет собой производное дуокармицина, в котором часть лекарства выступает в качестве спейсера L3. Неограничивающие примеры таких примеров осуществления включают те из них, в которых NH2(L3)-D имеет структуру, выбранную из группы, состоящей из где Z представляет собой элемент конструкции, выбранный из О, S и NR23,где R23 представляет собой радикал, выбранный из Н, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила и ацила; группа NH2 на каждой структуре взаимодействует с (АА 1)с с образованием -(АА 1)с-NH-. Пептидная последовательность АА 1. Группа АА 1 представляет собой отдельную аминокислоту или несколько аминокислот, которые объединены вместе пептидными связями. Аминокислоты могут быть природными аминокислотами и/или неприродными -аминокислотами. Пептидная последовательность (АА 1)с функционально представляет собой продукт амидирования отдельной аминокислоты (если с=1) или нескольких кислот, объединенных вместе пептидными связями. Пептид по настоящему изобретению выбирают для управления катализируемым ферментом расщеплением пептида ферментом в представляющем интерес месте биологической системе. Например, для конъюгатов, которые были направлены к клетке с использованием агента направленного действия, а затем были поглощены клеткой, выбирают такой пептид, который расщепляется одной или несколькими лизосомальными протеазами, что пептид расщепляется внутриклеточно внутри лизосомы. Число аминокислот в пептиде может варьировать от 1 до 20; но более предпочтительно составляет 2-8 аминокислоты,2-6 аминокислоты или 2, 3 или 4 аминокислоты, содержащие (АА 1)с. Пептидные последовательности,которые подвержены расщеплению определенными ферментами или классами ферментов, хорошо известны в данной области техники. В данной области техники известно множество пептидов, которые расщепляются ферментами в плазме крови, печени, кишечнике и т.д. Пример пептидной последовательности по настоящему изобретению включает пептидную последовательность, которая расщепляется протеазой. Акцент на последующее обсуждение применения чувствительной к действию протеазы последовательности сделан для ясности иллюстрации и не служит для ограничения объема настоящего изобретения. Когда расщепляющим пептид ферментом является протеаза, то линкер, как правило, включает пептид, содержащий последовательность для распознавания и расщепления протеазой. Последовательность для распознавания и расщепления протеазой представляет собой специфичную аминокислотную последовательность, распознаваемую протеазой во время протеолитического расщепления. В данной области техники известно множество сайтов расщепления протеазами, и эти и другие сайты расщепления могутBouvier et al. Meth Enzymol. 248:614 (1995), Hardy et al., в AMYLOID PROTEIN PRECURSOR IN DEVELOPMENT, AGING, AND ALZHEIMER'S DISEASE, ed. Masters et al. p. 190-198 (1994. Аминокислоты пептидной последовательности (АА 1)с выбирают на основе их пригодности для избирательного ферментативного расщепления конкретными молекулами, такими как ассоциированная с опухолью протеаза. Используемые аминокислоты могут быть природными или неприродными аминокислотами. Они могут находиться в L- или в D-конфигурации. В одном примере осуществления используют по крайней мере три различных аминокислоты. В другом примере осуществления используют только две аминокислоты. В предпочтительном примере осуществления пептидную последовательность (АА 1)с выбирают на основе ее способности быть расщепленной лизосомальными протеазами, неограничивающие примеры которых включают катепсины В, С, D, H, L и S. Предпочтительно пептидная последовательность (АА 1)с способна быть расщепленной катепсином В in vitro, что может быть протестировано in vitro с использованием известных в данной области техники методов анализа расщепления протеазами. В другом примере осуществления пептидную последовательность (АА 1)с выбирают на основе ее способности быть расщепленной ассоциированной с опухолью протеазой, такой как протеаза, обнаруженная внеклеточно вблизи раковых клеток, неограничивающие примеры которой включают тиметолигопептидазу (ТОР) и CD10. Способность пептиды быть расщепленным ТОР или CD10 может быть протестирована in vitro с использованием известных в данной области техники методов анализа расщепления протеазами. Подходящие, но неограничивающие, примеры пептидных последовательностей, подходящих для использования в конъюгатах по настоящему изобретению, включают Val-Cit, Val-Lys, Phe-Lys, Lys-Lys,Ala-Lys, Phe-Cit, Leu-Cit, Ile-Cit, Trp, Cit, Phe-Ala, Phe-N9-тозил-Arg, Phe-N9-нитро-Arg, Phe-Phe-Lys, DPhe-Phe-Lys, Gly-Phe-Lys, Leu-Ala-Leu, Ile-Ala-Leu, Val-Ala-Val, Ala-Leu-Ala-Leu (SEQ ID NO: 1), -AlaLeu-Ala-Leu (SEQ ID NO: 2) и Gly-Phe-Leu-Gly (SEQ ID NO: 3). Предпочтительными пептидными последовательностями являются Val-Cit и Val-Lys. В другом примере осуществления аминокислоту, расположенную наиболее близко к фрагменту лекарства, выбирают из группы, состоящей из Ala, Asn, Asp, Cit, Cys, Gln, Glu, Gly, Ile, Leu, Lys, Met, Phe,Pro, Ser, Thr, Trp, Tyr и Val. В еще одном примере осуществления аминокислоту, расположенную наиболее близко в фрагменту лекарства, выбирают из группы, состоящей из Ala, Asn, Asp, Cys, Gln, Glu, Gly,Ile, Leu, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val. Протеазы вовлечены в метастазирование рака. Повышенный синтез протеазы урокиназы коррелирует с повышенной способностью к метастазированию у многих видов рака. Урокиназа активирует плазмин из плазминогена, который расположен повсеместно во внеклеточном пространстве, и его активация может вызывать разрушение белков внеклеточного матрикса, посредством чего распространяются метастазирующие раковые клетки. Плазмин может также активировать коллагеназы, усиливая тем самым разрушение коллагена в базальной мембране, окружающей капилляры и лимфатическую систему,позволяя тем самым раковым клеткам распространяться в ткани-мишени (Dano, et al. Adv. Cancer. Res.,44:139 (1985. Таким образом, в объем настоящего изобретения входит использование в качестве линкера пептидной последовательности, которая расщепляется урокиназой. Настоящее изобретение также относится к использованию пептидных последовательностей, которые чувствительны к расщеплению триптазами. Тучные клетки человека экспрессируют по крайней мере четыре различных триптазы, обозначаемых , I, II и III. Эти ферменты не регулируются ингибиторами протеинах плазмы крови и расщепляют in vitro лишь несколько физиологических субстратов. Триптазное семейство сериновых протеаз участвуют в целом ряде аллергических и воспалительных заболеваний с вовлечением тучных клеток, вследствие повышенного содержания триптаз, обнаруженного в биологических жидкостях у больных с указанными нарушениями. Однако истинная роль триптазы в патофизиологии заболеваний остается лишь описанной в общих чертах. Объем биологических функций и соответствующие физиологические последствия деятельности триптаз по существу определяются ее субстратной специфичностью. Триптаза является мощным активатором проурокиназного активатора плазминогена (uPA), проферментной формой протеазы, ассоциированной с метастазированием и инвазией опухолей. Запуск каскада активации плазминогена, приводящего к разрушению внеклеточного матрикса для просачивания и миграции клеток, может служить показателем активации триптазой проурокиназного активатора плазминогена в Р 4-Р 1 последовательности Pro-Arg-Phe-Lys (SEQ ID NO: 4) (Stack et al., Journal of BiologicalChemistry 269 (13): 9416-9419 (1994. Вазоактивный пептид кишечника, нейропептид, вовлеченный в регуляцию сосудистой проницаемости, также расщепляется триптазой, главным образом по последовательности Thr-Arg-Leu-Arg (SEQ ID NO: 5) (Tarn et al., Am. J. Respir. Cell Mol. Biol. 3:27-32 (1990. Связанный с G-белком рецептор PAR-2 может расщепляться и активироваться триптазой по последователь- 25016577 ности Ser-Lys-Gly-Arg (SEQ ID NO: 6) с индукцией пролиферации фибробластов, тогда как активируемый тромбином рецептор PAR-1 инактивируется расщеплением триптазой по последовательности ProAsn-Asp-Lys (SEQ ID NO: 7) (Molino et al., Journal of Biological Chemistry 272(7):4043-4049 (1997. В своей совокупности эти доказательства наводят на мысль о центральной роли триптазы в перестройке тканей как следствии болезни. Это согласуется с кардинальными изменениями, наблюдаемыми при некоторых опосредуемых тучными клетками заболеваниях. Одним отличительным признаком хронической астмы и других продолжительных респираторных заболеваний является фиброз и утолщение подлегающих тканей, что может являться результатом активации триптазы в этих физиологических мишенях. Аналогичным образом, в целом ряде сообщений было показано, что ангиогенез ассоциирован с плотностью тучных клеток, активностью триптазы и неутешительным прогнозом для целого ряда злокачественных опухолей (Coussens et al., Genes and Development 13 (11):1382-97 (1999); Takanami et al., Cancer 88Journal of Cancer 85(2):171-5 (2000. В данной области техники известны способы оценки, расщепляет ли конкретная протеаза выбранную пептидную последовательность. Например, использование меченного 7-амино-4-метилкумарином(АМС) флуорогенного пептидного субстрата является хорошо обоснованным способом определения специфичности протеаз (Zimmerman M. et al. (1977), Analytical Biochemistry 78:47-51). Специфичное расщепление анилидной связи высвобождает уходящую группу флуорогенного АМС, позволяя проводить простое определение степени расщепления для конкретных субстратов. Совсем недавно для быстрого скрининга N-концевой специфичности протеаз путем исследования широкого ряда субстратов в одном эксперименте были разработаны матрицы (Lee D., et al. (1999), Bioorganic and Medicinal Chemistry Letters 9:1667-72) и позиционно-сканирующие библиотеки (Rano Т.A., et al. (1997), Chemistry and Biology 4:14955) меченных АМС пептидных последовательностей. Таким образом, специалист в данной области техники может легко оценить матрицу пептидных последовательностей для определения их пригодности для целей настоящего изобретения, не прибегая к проведению чрезмерных экспериментов.(2) Гидразиновые линкеры (Н). Во втором примере осуществления конъюгат по настоящему изобретению содержит гидразиновый саморазрушающийся линкер, где конъюгат имеет строение где значения D, L1, L4 и X4 определены выше и описаны далее в этом документе и Н представляет собой линкер, содержащий структуру где n1 равно целому числу от 1 до 10;n2 равно 0, 1 или 2; каждый R2 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила; иI представляет собой либо связь (т.е. связь между атомом углерода каркаса молекулы и смежного атома азота), или: где n3 равно 0 или 1 при условии, что если n3 равно 0, то n2 не равно 0; и n4 равно 1, 2 или 3,где если I представляет собой связь, n1 равно 3, и n2 равно 1, то D не может представлять собой где R представляет собой Me или CH2-СН 2-NMe2. В одном примере осуществления замещение в фенольном кольце является паразамещением. В предпочтительных примерах осуществления n1 равно 2, 3 или 4 либо m равно 3. В предпочтительных- 26016577 примерах осуществления n2 равно 1. В предпочтительных примерах осуществления I представляет собой связь (т.е. связь между атомом углерода каркаса молекулы и смежного атома азота). В одном аспекте гидразиновый линкер Н может образовывать при расщеплении 6-членный саморазрушающийся линкер,например, если n3 равно 0, и n4 равно 2. В другом аспекте гидразиновый линкер Н может образовывать при расщеплении два 5-членных саморазрушающихся линкера. В еще одних аспектах Н образует при расщеплении 5-членный саморазрушающийся линкер, Н образует 7-членный саморазрушающийся линкер, или Н образует 5-членный саморазрушающийся линкер и 6-членный саморазрушающийся линкер. На скорость расщепления влияет размер образующегося при расщеплении кольца. Таким образом, в зависимости от желаемой скорости расщепления может быть выбрано кольцо подходящего размера, которое должно образовываться при расщеплении. 5-Членные гидразиновые линкеры. В одном примере осуществления гидразиновый линкер содержит 5-членный гидразиновый линкер,где Н содержит структуру В предпочтительном примере осуществления n1 равно 2, 3 или 4. В другом предпочтительном примере осуществления n1 равно 3. В представленной выше структуре каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила,замещенного гетероалкила и незамещенного гетероалкила. В одном примере осуществления каждый R24 независимо представляет собой Н или C1-C6-алкил. В другом примере осуществления каждый R24 независимо представляет собой Н или C1-C3-алкил, более предпочтительно Н или СН 3. В другом примере осуществления по крайней мере один R24 представляет собой метильную группу. В другом примере осуществления каждый R24 представляет собой Н. Каждый R24 выбирают для проектирования соединений с заданными стерическими эффектами и для изменения растворимости. 5-Членные гидразиновые линкеры могут претерпевать одну или несколько реакций циклизации, которые отделяют лекарство от линкера и могут быть описаны, например, схемой Пример пути синтеза для получения 5-членного линкера по настоящему изобретению представляет собой Для получения Cbz-DMDA-2,2-димтеилмалоновой кислоты с в растворе с тионилхлоридом осуществляют взаимодействие Cbz-защищенного DMDA b с 2,2-диметилмалоновой кислотой а. Для получения- 27016577 взаимодействие соединения с с Boc-N-метилгидразином d. 6-Членные гидразиновые линкеры. В другом примере осуществления гидразиновый линкер содержит 6-членный гидразиновый линкер,где Н содержит структуру В предпочтительном примере осуществления n1 равно 3. В представленной выше структуре каждыйR24 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила. В одном примере осуществления каждый R24 независимо представляет собой Н или C1-C6-алкил. В другом примере осуществления каждый R24 независимо представляет собой Н или C1-C3-алкил, более предпочтительно Н или СН 3. В другом примере осуществления по крайней мере один R24 представляет собой метильную группу. В другом примере осуществления каждый R24 представляет собой Н. Каждый R24 выбирают для проектирования соединений с заданными стерическими эффектами и для изменения растворимости. В предпочтительном примере осуществления Н содержит структуру В одном примере осуществления Н содержит геминальное диметил-замещение. В одном примере осуществления представленной выше структуры каждый R24 независимо представляет собой Н или замещенный или незамещенный алкил. 6-Членные гидразиновые линкеры могут претерпевать одну или несколько реакций циклизации, которые отделяют лекарство от линкера, и могут быть описаны схемой Пример пути синтеза для получения 6-членного линкера по настоящему изобретению представляет собой Для получения Cbz-защищенного диметилаланингидразина b в растворе с дихлорметаном осуществляют взаимодействие Cbz-защищенного диметилаланина а с HOAt и CPI. Путем обработки метанолом с гидразина b удаляют защитную группу с получением соединения с. Другие гидразиновые линкеры. Предполагается, что настоящее изобретение включает линкер, содержащий семь звеньев. Этот линкер, по всей видимости, не может циклизоваться так же быстро, как и 5- или 6-членные линкеры, но это может быть предпочтительно для получения некоторых конъюгатов лекарство-лиганд. По аналогии, гидразиновый линкер может содержать два 6-членных кольца, или гидразиновый линкер может содержать один 6-членный и один 5-членный продукт циклизации. Также рассматривается 5- и 7-членный линкер, а также 6- и 7-членный линкер. Другая гидразиновая структура Н имеет формулу- 28016577 где q равно 0, 1, 2, 3, 4, 5 или 6; каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила. Эта гидразиновая структура, может также образовывать 5-, 6- или 7-членные кольца, а для образования нескольких колец могут быть добавлены дополнительные компоненты.(3) Дисульфидные линкеры (J). В еще одном примере осуществления линкер содержит ферментативно расщепляемую дисульфидную группу. В одном примере осуществления настоящее изобретение относится к цитотоксичному комплексу лекарство-лиганд, имеющему строение согласно формуле (3) где значения D, L1, L4 и X4 определены выше или описаны далее в этом документе, J. представляет собой дисульфидный линкер, содержащий группу, имеющую следующее строение: где каждый R24 представляет собой радикал, независимо выбранный из группы, состоящей из Н,замещенного алкила, незамещенного алкила, замещенного гетероалкила и незамещенного гетероалкила; каждый K представляет собой элемент конструкции, независимо выбранный из группы, состоящей из замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила,замещенного гетероциклоалкила, незамещенного гетероциклоалкила, галогена, NO2, NR21R22,NR21COR22, OCONR21R22, OCOR21 и OR21,где R21 и R22 независимо выбирают из группы, состоящей из Н, замещенного алкила, незамещенного алкила, замещенного гетероалкила, незамещенного гетероалкила, замещенного арила, незамещенного арила, замещенного гетероарила, незамещенного гетероарила, замещенного гетероциклоалкила и незамещенного гетероциклоалкила; а представляет собой целое число, равное 0, 1, 2, 3 или 4;d представляет собой целое число, равное 0, 1, 2, 3, 4, 5 или 6. Ароматическое кольцо дисульфидного линкера может быть замещено одной или несколькими группами K. Группа K представляет собой заместитель ароматического кольца, который замещает атом водорода, иным способом присоединенный к одному из четырех незамещенных атомов углерода, которые являются частью структуры кольца. Группа K может представлять собой одиночный атом, такой как галоген, или может представлять собой многоатомную группу, такую как алкил, гетероалкил, амино,нитро, гидрокси, алкокси, галогеналкил и циано. Примеры заместителей K независимо включают без ограничения F, Cl, Br, I, NO2, ОН, ОСН 3, NHCOCH3, N(CH3)2, NHCOCF3 и метил. Для Ka а представляет собой целое число, равное 0, 1, 2, 3 или 4. В одном предпочтительном примере осуществления а равно 0. В предпочтительном примере осуществления линкер содержит ферментативно расщепляемую дисульфидную группу следующей формулы: В этом примере осуществления значения L4, X4, р и R24 определены выше, d равно 0, 1, 2, 3, 4, 5 или 6. В конкретном примере осуществления о равно 1 или 2.
МПК / Метки
МПК: C07K 5/06, A61P 13/08, C07K 16/28, A61K 47/48
Метки: конъюгаты, применение, антитело-лекарство
Код ссылки
<a href="https://eas.patents.su/30-16577-konyugaty-antitelo-lekarstvo-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты антитело-лекарство и их применение</a>
Предыдущий патент: Применение сложных эфиров гидроксибензойной кислоты для получения лекарственного средства для предупреждения и лечения папилломавирусной инфекции человека
Следующий патент: Держатель магнита для роторов с постоянными магнитами в ротационных машинах
Случайный патент: Способ получения метаксалона


































