Метаболическая инженерия сбраживающих арабинозу дрожжевых клеток
Номер патента: 16303
Опубликовано: 30.04.2012
Авторы: Висселинк Хендрик Вутер, Винде Де Йоханнес Хендрик, Пронк Якобус Томас, Винклер Аарон Адриан, Ван Дейкен Йоханнес Питер, Марис Ван Антониус Ерун Адриан
Формула / Реферат
1. Эукариотическая клетка, способная экспрессировать нижеследующие нуклеотидные последовательности, причем экспрессия этих нуклеотидных последовательностей придает клеткам способность к утилизации L-арабинозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения:
(a) нуклеотидную последовательность, кодирующую арабинозоизомеразу (araA), причем данная нуклеотидная последовательность выбрана из группы, состоящей из
i) нуклеотидной последовательности, кодирующей araA, причем araA включает аминокислотную последовательность, которая по меньшей мере на 55% идентична аминокислотной последовательности SEQ ID NO: 1,
ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 2,
iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),
iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;
(b) нуклеотидной последовательности, кодирующей L-рибулокиназу (araB), причем данная нуклеотидная последовательность выбирается из группы, состоящей из
i) нуклеотидной последовательности, кодирующей araB, причем araB включает аминокислотную последовательность, которая по меньшей мере на 20% идентична аминокислотной последовательности SEQ ID NO: 3,
ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 50% идентична нуклеотидной последовательности SEQ ID NO: 4,
iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),
iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;
(c) нуклеотидную последовательность, кодирующую L-рибулозо-5-Р-4-эпимеразу (araD), причем данная нуклеотидная последовательность выбирается из группы, состоящей из
i) нуклеотидной последовательности, кодирующей araD, причем araD включает аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательности SEQ ID NO: 5,
ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 6,
iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),
iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода.
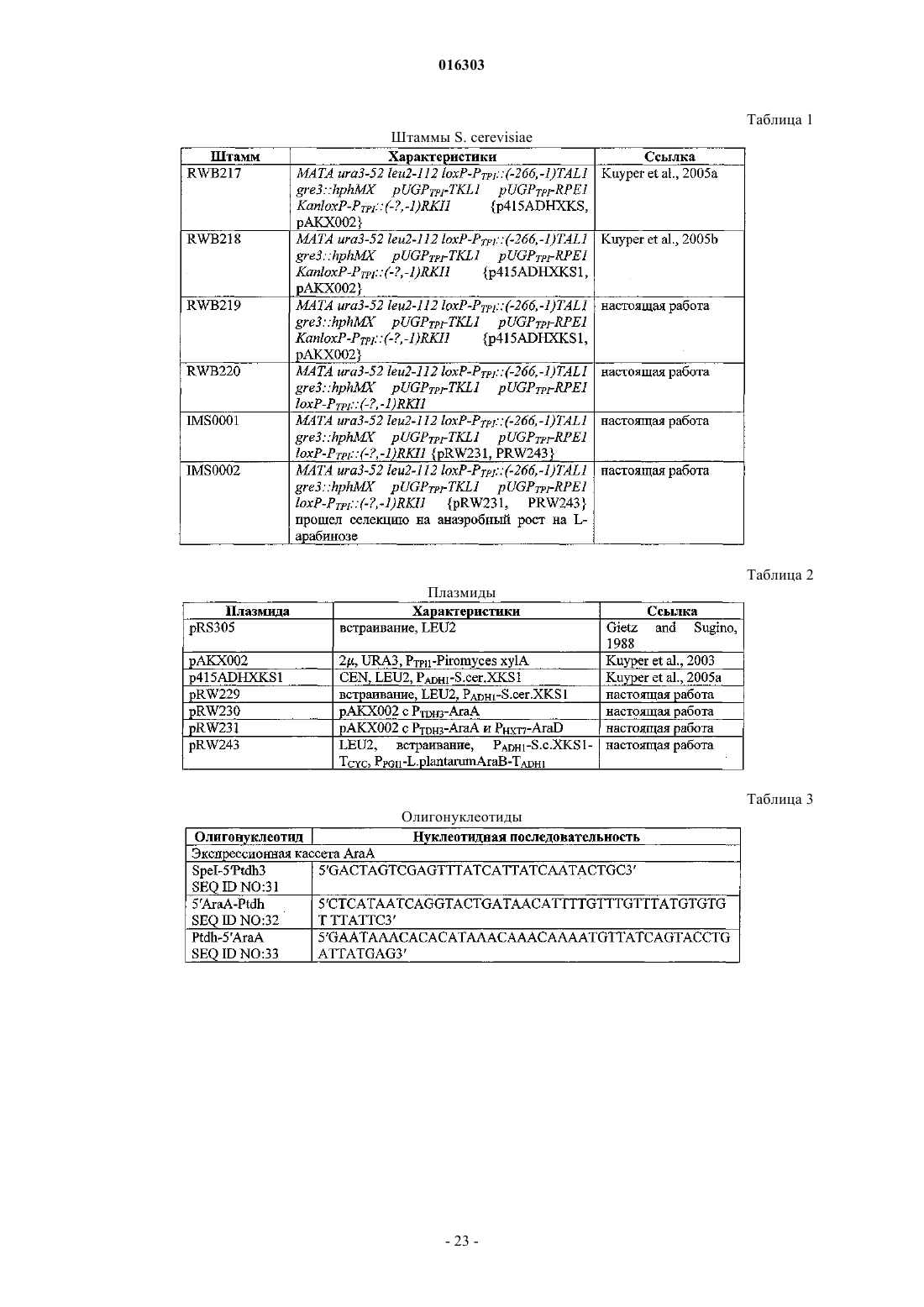
2. Клетка по п.1, в которой одна, две или три из нуклеотидных последовательностей araA, araB и araD происходят из рода бактерий Lactobacillus, наиболее предпочтительно из вида Lactobacillus plantarum.
3. Клетка по п.1 или 2, представляющая собой дрожжевые клетки, предпочтительно принадлежащие к одному из родов Saccharomyces, Kluyveromyces, Candida, Pichia, Schizosaccharomyces, Hansenula, Kloeckera, Schwanniomyces или Yarrowia.
4. Клетка по п.3, представляющая собой дрожжевые клетки, принадлежащие к одному из видов S. cerevisiae, S. bulderi, S. barnetti, S. exiguus, S. uvarum, S. diastaticus, K. lactis, K. marxianus или K. fragilis.
5. Клетка по любому из пп.1-4, в которой нуклеотидные последовательности, кодирующие araA, araB и/или araD, функционально связаны с промотором, вызывающим экспрессию соответствующей нуклеотидной последовательности в клетках, достаточную для придания клеткам способности к утилизации L-арабинозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения.
6. Клетка по любому из пп.1-5, обладающая способностью к прямой изомеризации ксилозы в ксилулозу.
7. Клетка по п.6, содержащая генетическую модификацию, повышающую мощность пентозофосфатного пути.
8. Клетка по п.6 или 7, в которой генетическая модификация заключается в суперэкспрессии по меньшей мере одного гена неокислительной части пентозофосфатного пути.
9. Клетка по п.8, в которой указанный ген выбран из группы, состоящей из генов, кодирующих рибулозо-5-фосфат-изомеразу, рибулозо-5-фофат-эпимеразу, транскетолазу и трансальдолазу.
10. Клетка по п.8, в которой генетическая модификация заключается в суперэкспрессии генов, кодирующих транскетолазу и трансальдолазу.
11. Клетка по любому из пп.8-10, дополнительно содержащая генетическую модификацию, повышающую удельную активность ксилулозокиназы.
12. Клетка по п.11, в которой генетическая модификация заключается в суперэкспрессии гена, кодирующего ксилулозокиназу.
13. Клетка по любому из пп.8-12, в которой подвергаемый суперэкспрессии ген является эндогенным для этих клеток.
14. Клетка по любому из пп.5-13, содержащая генетическую модификацию, снижающую активность неспецифической альдозоредуктазы в клетках.
15. Клетка по п.14, в которой генетическая модификация уменьшает экспрессию или инактивирует ген, кодирующий неспецифическую альдозоредуктазу.
16. Клетка по п.15, в которой ген инактивируется при помощи делеции по крайней мере части гена или разрушения гена.
17. Клетка по п.14 или 15, в которой снижается или инактивируется экспрессия в клетках каждого гена, кодирующего неспецифическую альдозоредуктазу.
18. Клетка по любому из предыдущих пунктов, в которой продукт брожения выбирается из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, β-лактамовых антибиотиков и цефалоспоринов.
19. Конструкция из нуклеиновой кислоты, включающая нуклеотидную последовательность, кодирующую araA, нуклеотидную последовательность, кодирующую araB, и нуклеотидную последовательность, кодирующую araD, которые определены в п.1 или 2.
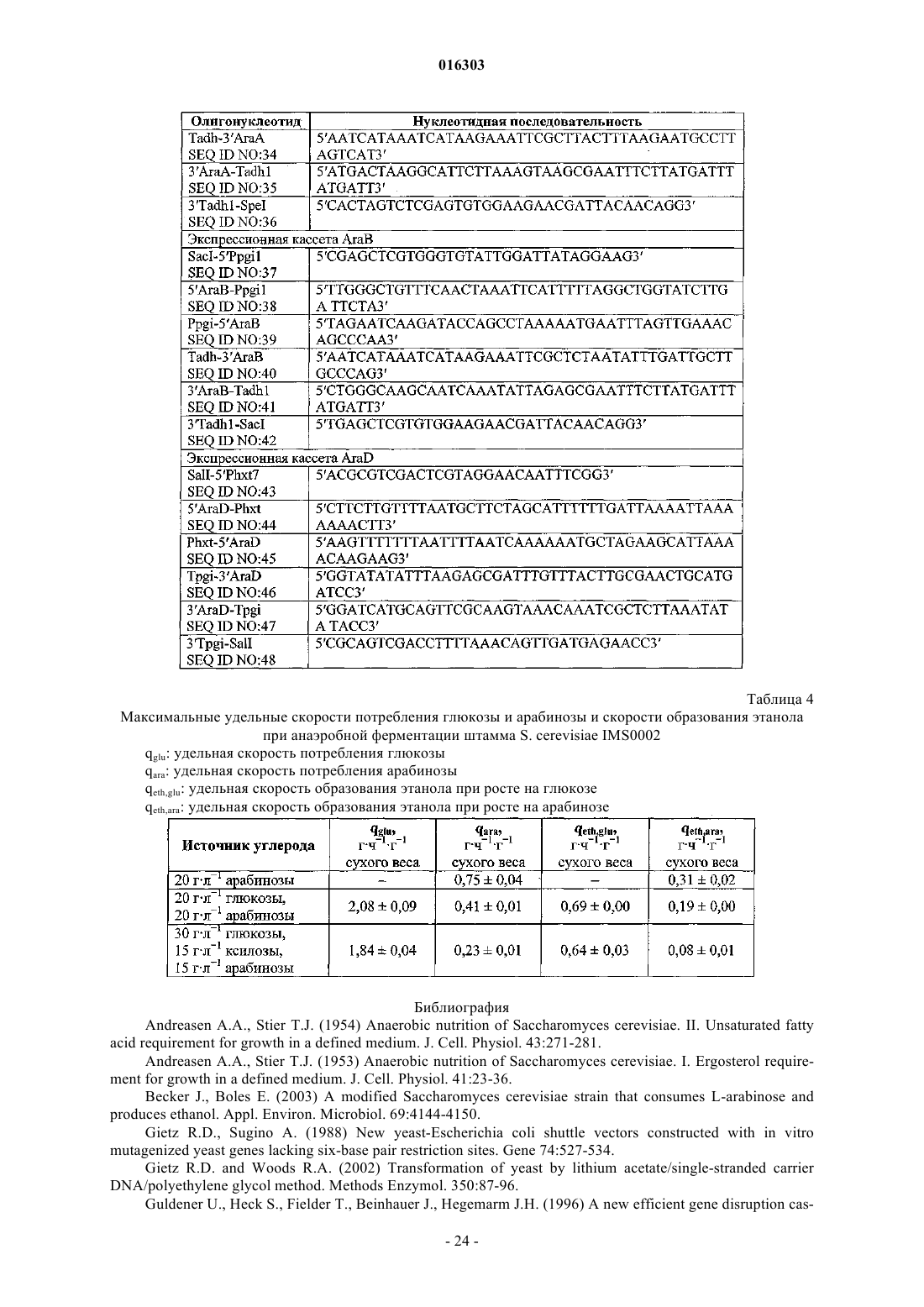
20. Способ получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, β-лактамовых антибиотиков и цефалоспоринов, включающий:
(а) сбраживание среды, содержащей источник L-арабинозы и необязательно ксилозы, с помощью модифицированных клеток по любому из пп.1-18, при этом клетки сбраживают L-арабинозу и необязательно ксилозу до нужного продукта брожения; и при необходимости
(b) извлечение продукта брожения.
21. Способ получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, β-лактамовых антибиотиков и цефалоспоринов, включающий:
(a) сбраживание среды, содержащей, по меньшей мере, источник L-арабинозы и источник ксилозы, с помощью клеток по любому из пп.1-18 и клеток, обладающих способностью к утилизации ксилозы и/или проявляющих способность к прямой изомеризации ксилозы в ксилулозу, при этом каждые клетки сбраживают L-арабинозу и/или ксилозу до нужного продукта брожения; и при необходимости
(b) извлечение продукта брожения.
22. Способ по п.20 или 21, в котором среда дополнительно содержит источник глюкозы.
23. Способ по любому из пп.20-22, в котором продуктом брожения является этанол.
24. Способ по п.23, в котором объемная продукция этанола составляет по меньшей мере 0,5 г этанола на л/ч.
25. Способ по п.23 или 24, в котором выход этанола составляет по меньшей мере 30%.
26. Способ по любому из пп.20-25, который является анаэробным.
27. Способ по любому из пп.20-25, который является аэробным и предпочтительно выполняется в условиях ограничения кислорода.
Текст
МЕТАБОЛИЧЕСКАЯ ИНЖЕНЕРИЯ СБРАЖИВАЮЩИХ АРАБИНОЗУ ДРОЖЖЕВЫХ КЛЕТОК Марис Ван Антониус Ерун Адриан,Пронк Якобус Томас, Висселинк Хендрик Вутер, Ван Дейкен Йоханнес Питер, Винклер Аарон Адриан, Винде Де Йоханнес Хендрик (NL) Саломатина И.С. (RU) Изобретение касается эукариотических клеток,экспрессирующих нуклеотидные последовательности, кодирующие ферменты araA, araB и araD, причем экспрессия этих нуклеотидных последовательностей придает клеткам способность к утилизации L-арабинозы и/ или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения типа этанола. Необязательно эукариотические клетки также обладают способностью к превращению ксилозы в этанол.(71)(73) Заявитель и патентовладелец: ДСМ АйПи АССЕТС Б.В. (NL) 016303 Область техники, к которой относится изобретение Изобретение касается эукариотических клеток, обладающих способностью к утилизации Lарабинозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения, а также способа получения продукта брожения, в котором используются эти клетки. Уровень техники Топливный этанол получил признание как ценная альтернатива ископаемому топливу. Экономически оправданная продукция этанола из гемицеллюлозной фракции растительной биомассы требует одновременного сбраживания и пентоз, и гексоз со сравнимой скоростью и с высоким выходом. Дрожжи, в частности Saccharomyces spp., являются наиболее подходящими кандидатами для этого процесса, так как они могут расти на гексозах и быстро сбраживать их как аэробным, так и анаэробным путем. Кроме того,они намного более устойчивы к токсической среде гидролизатов лигноцеллюлозы, чем (генетически модифицированные) бактерии. В ЕР 1499708 описан способ получения штаммов S. cerevisiae, способных вырабатывать этанол изL-арабинозы. Эти штаммы были модифицированы введением гена araA (L-арабинозоизомеразы) из Bacillus subtilis и генов araB (L-рибулокиназы) и araD (L-рибулозо-5-Р-4-эпимеразы) из Escherichia coli. Кроме того, эти штаммы либо несут дополнительные мутации в своем геноме, либо суперэкспрессируют генTAL1 (трансальдолазы). Однако у этих штаммов есть и некоторые недостатки. Они сбраживают арабинозу в условиях ограничения кислорода. Кроме того, они обладают низкой скоростью продукции этанола в 0,05 гг-1 ч-1 (Becker and Boles, 2003). Более того, эти штаммы не способны утилизировать L-арабинозу в анаэробных условиях. Наконец, эти штаммы S. cerevisiae имеют фон дикого типа, поэтому они не могут использоваться для одновременного сбраживания нескольких сахаров C5. В WO 03/062430 и WO 06/009434 раскрыты дрожжевые штаммы, способные превращать ксилозу в этанол. Эти дрожжевые штаммы обладают способностью к прямой изомеризации ксилозы в ксилулозу. Тем не менее, существует потребность в альтернативных штаммах для продукции этанола, которые бы работали лучше и были бы более сильными и устойчивыми к сравнительно жестким условиям продукции. Краткое описание фигур Фиг. 1 - плазмидные карты pRW231 и pRW243; и фиг. 2 - особенности роста при культивировании в качалочных колбах штамма RWB219 в синтетической среде, содержащей 0,5% глюкозы (А) и 0,1% галактозы + 2% L-арабинозы(В). Культуры выращивали 72 ч в синтетической среде с галактозой (А), а затем переносили в синтетическую среду с галактозой и арабинозой (В). Рост определяли по измерению OD660; фиг. 3 - скорость роста при серийных пересевах культур S. cerevisiae IMS0001 в качалочных колбах,содержащих синтетическую среду с 2% L-арабинозы. Каждая точка представляет скорость роста по измерению OD660 во время экспоненциальной фазы роста. Темными и светлыми кружочками представлены значения из двух параллельных опытов по серийному пересеву; фиг. 4 - скорость роста при анаэробной SBR-ферментации S. cerevisiae IMS0001 в синтетической среде с 2% L-арабинозы. Каждая точка представляет скорость роста по измерению профиля СО 2 (сплошная линия) во время экспоненциальной фазы роста; фиг. 5 - потребление сахара и образование продукта при анаэробной периодической ферментации штамма IMS0002. Ферментация проводилась в 1 л синтетической среды с добавлением: 20 гл-1 арабинозы (А); 20 гл-1 глюкозы и 20 гл-1 арабинозы (В); 30 гл-1 глюкозы, 15 гл-1 ксилозы и 15 гл-1 арабинозы(С). Потребление сахара и образование продукта при анаэробной периодической ферментации смеси штаммов IMS0002 и RWB218. Ферментация проводилась в 1 л синтетической среды с добавлением 30 ксилоза арабиногл-1 глюкозы, 15 гл-1 ксилозы и 15 гл-1 арабинозы (D). Обозначения: глюкоза этанол по данным кумулятивной продукции СО 2 этанол по данным HPLC кумулятивная за ксилитол; продукция СО 2 фиг. 6 - потребление сахара и образование продукта при анаэробной периодической ферментации клеток штамма IMS0002, прошедших отбор на анаэробный рост на ксилозе. Ферментация проводилась в 1 л синтетической среды с добавлением 20 гл-1 ксилозы и 20 гл-1 арабинозы. Обозначения: ксилоза этанол по данным HPLC кумулятивная продукция СО 2 ксилитол; арабиноза фиг. 7 - потребление сахара и образование продукта при анаэробной периодической ферментации штамма IMS0003. Ферментация проводилась в 1 л синтетической среды с добавлением 30 гл-1 глюкозы,ксилоза арабиноза этанол по 15 гл-1 ксилозы и 15 гл-1 арабинозы. Обозначения: глюкоза этанол по данным HPLC кумулятивная продукция CO2 данным кумулятивной продукции СО 2 Описание изобретения Эукариотические клетки В первом аспекте изобретение касается эукариотических клеток, способных экспрессировать сле-1 016303 дующие нуклеотидные последовательности, причем экспрессия этих нуклеотидных последовательностей придает клеткам способность к утилизации L-арабинозы и/или к превращению L-арабинозы в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения типа этанола:(a) нуклеотидная последовательность, кодирующая арабинозоизомеразу (araA), причем данная нуклеотидная последовательность выбирается из группы, состоящей из(i) нуклеотидных последовательностей, кодирующих araA, причем araA включает аминокислотную последовательность, которая по меньшей мере на 55% идентична аминокислотной последовательностиSEQ ID NO: 1,(ii) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 2,(iii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),(iv) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;(b) нуклеотидная последовательность, кодирующая L-рибулокиназу (araB), причем данная нуклеотидная последовательность выбирается из группы, состоящей из(i) нуклеотидных последовательностей, кодирующих araB, причем araB включает аминокислотную последовательность, которая по меньшей мере на 20% идентична аминокислотной последовательностиSEQ ID NO: 3,(ii) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 50% идентична нуклеотидной последовательности SEQ ID NO: 4,(iii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),(iv) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;(с) нуклеотидная последовательность, кодирующая L-рибулозо-5-Р-4-эпимеразу (araD), причем данная нуклеотидная последовательность выбирается из группы, состоящей из(i) нуклеотидных последовательностей, кодирующих araD, причем araD включает аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательностиSEQ ID NO: 5,(ii) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 6,(iii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),(iv) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода. Предпочтительное воплощение касается эукариотических клеток, способных экспрессировать следующие нуклеотидные последовательности, причем экспрессия этих нуклеотидных последовательностей придает клеткам способность к утилизации L-арабинозы и/или к превращению L-арабинозы в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения типа этанола:(a) нуклеотидная последовательность, кодирующая арабинозоизомеразу (araA), причем данная нуклеотидная последовательность выбирается из группы, состоящей из(i) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 2,(ii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i),(iii) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (ii) вследствие вырожденности генетического кода;(b) нуклеотидная последовательность, кодирующая L-рибулокиназу (araB), причем данная нуклеотидная последовательность выбирается из группы, состоящей из(i) нуклеотидных последовательностей, кодирующих araB, причем araB включает аминокислотную последовательность, которая по меньшей мере на 20% идентична аминокислотной последовательностиSEQ ID NO: 3,(ii) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 50% идентична нуклеотидной последовательности SEQ ID NO: 4,(iii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),(iv) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;(с) нуклеотидная последовательность, кодирующая L-рибулозо-5-Р-4-эпимеразу (araD), причем данная нуклеотидная последовательность выбирается из группы, состоящей из-2 016303 последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательностиSEQ ID NO: 5,(ii) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 6,(iii) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),(iv) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода. Идентичность и сходство последовательностей Идентичность последовательностей в настоящем изобретении определяется как родство между двумя или несколькими аминокислотными последовательностями (полипептидов или белков) или двумя или несколькими нуклеотидными последовательностями (полинуклеотидами), которое устанавливается путем сравнения этих последовательностей. Обычно идентичность или сходство последовательностей определяется по всей длине подвергаемых сравнению последовательностей. В этой области "идентичность" также обозначает степень родственности между аминокислотными или нуклеотидными последовательностями в зависимости от обстоятельств, которая определяется по совпадению между отрезками таких последовательностей. "Сходство" между двумя аминокислотными последовательностями определяется путем сравнения аминокислотной последовательности и е консервативных замен аминокислот одного полипептида с последовательностью второго полипептида. "Идентичность" и "сходство" можно легко рассчитать различными способами, известными специалистам в этой области. Предпочтительные способы определения идентичности призваны давать наибольшее совпадение между исследуемыми последовательностями. Методы определения идентичности и сходства систематизированы в общедоступных компьютерных программах. Предпочтительные методы компьютерных программ для определения идентичности и сходства между двумя последовательностями включают, например, BestFit, BLASTP, BLASTN и FASTA (Altschul S.F. et al., J. Mol. Biol. 215: 403-410 (1990), в свободном доступе из NCBI и других источников (BLAST Manual, Altschul S. et al., NCBI NLM NIH Bethesda,MD 20894). Наиболее предпочтительным алгоритмом является(http://www.ebi.ac.uk/emboss/align). Предпочтительные параметры для сравнения аминокислотных последовательностей с помощью EMBOSS: открытый пробел 10,0, перекрывание пробела 0,5, матрица Blosum 62. Предпочтительные параметры для сравнения нуклеотидных последовательностей с помощьюEMBOSS: открытый пробел 10,0, перекрывание пробела 0,5, матрица DNA full matrix (матрица идентичности ДНК). Необязательно при определении степени сходства аминокислот специалисты могут учитывать и"консервативные" замены аминокислот, как это должно быть им ясно. Консервативные замены аминокислот означают взаимозаменяемость остатков со сходными боковыми цепями. Например, в группу аминокислот с алифатическими боковыми цепями входят глицин, аланин, валин, лейцин и изолейцин; в группу аминокислот с гидроксилом на алифатических боковых цепях входят серин и треонин; в группу аминокислот с содержащими амид боковыми цепями входят аспарагин и глутамин; в группу аминокислот с ароматическими боковыми цепями входят фенилаланин, тирозин и триптофан; в группу аминокислот с основными боковыми цепями входят лизин, аргинин и гистидин; а в группу аминокислот с содержащими серу боковыми цепями входят цистеин и метионин. Предпочтительными группами консервативных замен аминокислот являются валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин,аланин-валин и аспарагин-глутамин. Замещенными вариантами аминокислотных последовательностей,приведенных в настоящем изобретении, являются варианты, у которых по меньшей мере один остаток в приведенной последовательности был удален, а на его место вставлен другой остаток. Предпочтительно замена аминокислот является консервативной. Предпочтительными консервативными заменами для каждой из встречающихся в природе аминокислот являются следующие: Ala на Ser; Arg на Lys; Asn на Gln или His; Asp на Glu; Cys на Ser или Ala; Gln на Asn; Glu на Asp; Gly на Pro; His на Asn или Gln; Ile на Leu или Val; Leu на Ile или Val; Lys на Arg; Gln на Glu; Met на Leu или Ile; Phe на Met, Leu или Tyr; Ser наThr; Thr на Ser; Trp на Tyr; Tyr на Trp или Phe; и Val на Ile или Leu. Гибридизация отрезков нуклеиновых кислот Нуклеотидные последовательности, кодирующие ферменты, экспрессируемые в клетках изобретения, также могут характеризоваться по их способности к гибридизации с нуклеотидными последовательностями SEQ ID NO.'s 2, 4, 6, 8, 16, 18, 20, 22, 24, 26, 28, 30 соответственно, при умеренных или предпочтительно строгих условиях гибридизации. Строгие условия гибридизации определяются в настоящем изобретении как условия, способствующие гибридизации отрезка нуклеиновой кислоты по меньшей мере из 25, предпочтительно 50 нуклеотидов, 75 или 100 и наиболее предпочтительно 200 или больше нуклеотидов при температуре около 65 С в растворе, содержащем 1 М соль, предпочтительно в растворе 6SSC или любом ином растворе со сравнимой ионной силой, с отмывкой при 65 С в растворе, содержащем 0,1 М соль или меньше, предпочтительно в растворе 0,2SSC или любом ином растворе со сравнимой ионной силой. Предпочтительно гибридизация выполняется в течение ночи, т.е. в течение как ми-3 016303 нимум 10 ч, а отмывка проводится в течение как минимум 1 ч, по меньшей мере с двумя заменами отмывочного раствора. Эти условия обычно способствуют специфической гибридизации последовательностей, степень идентичности которых составляет 90% или больше. Умеренные условия определяются в настоящем изобретении как условия, способствующие гибридизации отрезка нуклеиновой кислоты по меньшей мере из 50 нуклеотидов, предпочтительно из 200 или больше нуклеотидов при температуре около 45 С в растворе, содержащем 1 М соль, предпочтительно растворе 6SSC или любом ином растворе со сравнимой ионной силой, с отмывкой при комнатной температуре в растворе, содержащем 1 М соль, предпочтительно растворе 6SSC или любом ином растворе со сравнимой ионной силой. Предпочтительно гибридизация выполняется в течение ночи, т.е. в течение как минимум 10 ч, а отмывка проводится в течение как минимум 1 ч, по меньшей мере с двумя заменами отмывочного раствора. Эти условия обычно способствуют специфической гибридизации последовательностей, степень идентичности которых составляет до 50%. Специалисты в этой области смогут модифицировать эти условия гибридизации так, чтобы специфически идентифицировать последовательности,идентичность которых составляет от 50 до 90%.(a) нуклеотидных последовательностей, кодирующих полипептид araA, имеющий аминокислотную последовательность, которая по меньшей мере на 55, 60, 65, 70, 75, 80, 85, 90, 95, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 1;(b) нуклеотидных последовательностей, имеющих нуклеотидную последовательность, которая по меньшей мере на 60, 70, 80, 90, 95, 97, 98 или 99% идентична нуклеотидной последовательности SEQ ID(c) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с последовательностью молекулы нуклеиновой кислоты по (а) или (b);(d) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (с) вследствие вырожденности генетического кода. Нуклеотидная последовательность, кодирующая araA, может кодировать либо прокариотический,либо эукариотический фермент araA, т.е. фермент, аминокислотная последовательность которого идентична той araA, которая в природе встречается в прокариотическом или эукариотическом организме. Авторы настоящего изобретения обнаружили, что способность определенной araA придавать клеткам эукариотического хозяина способность к утилизации арабинозы и/или к превращению арабинозы в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения типа этанола при совместной экспрессии с araB и araD не слишком зависит от того, имеет ли araA прокариотическое или эукариотическое происхождение. Скорее это зависит от родства аминокислотной последовательности araA с последовательностью SEQ ID NO: 1.(a) нуклеотидных последовательностей, кодирующих полипептид агаВ, имеющий аминокислотную последовательность, которая по меньшей мере на 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95,97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 3;(b) нуклеотидных последовательностей, имеющих нуклеотидную последовательность, которая по меньшей мере на 50, 60, 70, 80, 90, 95, 97, 98 или 99% идентична нуклеотидной последовательности SEQ(c) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с последовательностью молекулы нуклеиновой кислоты по (а) или (b);(d) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (с) вследствие вырожденности генетического кода. Нуклеотидная последовательность, кодирующая araB, может кодировать либо прокариотический,либо эукариотический фермент araB, т.е. фермент, аминокислотная последовательность которого идентична той araB, которая в природе встречается в прокариотическом или эукариотическом организме. Авторы настоящего изобретения обнаружили, что способность определенной araB придавать клеткам эукариотического хозяина способность к утилизации арабинозы и/или к превращению арабинозы в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения при совместной экспрессии с araA и araD не слишком зависит от того, имеет ли araB прокариотическое или эукариотическое происхождение. Скорее это зависит от родства аминокислотной последовательности araB с последовательностью SEQ ID NO: 3.(a) нуклеотидных последовательностей, кодирующих полипептид araD, имеющий аминокислотную последовательность, которая по меньшей мере на 60, 65, 70, 75, 80, 85, 90, 95, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 5;(b) нуклеотидных последовательностей, имеющих нуклеотидную последовательность, которая по меньшей мере на 60, 65, 70, 75, 80, 85, 90, 95, 97, 98 или 99% идентична нуклеотидной последовательности SEQ ID NO: 6;(c) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с последовательностью молекулы нуклеиновой кислоты по (а) или (b);(d) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (с) вследствие вырожденности генетического кода. Нуклеотидная последовательность, кодирующая araD, может кодировать либо прокариотический,либо эукариотический фермент araD, т.е. фермент, аминокислотная последовательность которого идентична той araD, которая в природе встречается в прокариотическом или эукариотическом организме. Авторы настоящего изобретения обнаружили, что способность определенной araD придавать клеткам эукариотического хозяина способность к утилизации арабинозы и/или к превращению арабинозы в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения при совместной экспрессии с araA и araB не слишком зависит от того, имеет ли araD прокариотическое или эукариотическое происхождение. Скорее это зависит от родства аминокислотной последовательности araD с последовательностью SEQ ID NO: 5. Вне ожидания, индекс употребительности кодонов показал, что экспрессия генов araA, araB и araD из Lactobacillus plantarum более благоприятна в дрожжевых клетках, чем экспрессия прокариотических генов araA, araB and araD, описанных в ЕР 1499708. Следует отметить, что L. plantarum относится к организмам, которые в общем считаются безопасными (GRAS), то есть признанным безопасными органами надзора за пищевыми продуктами. Поэтому предпочтительные нуклеотидные последовательности кодируют такие araA, araB или araD соответственно, у которых аминокислотные последовательности родственны последовательностям SEQ ID NO: 1, 3 или 5 соответственно, как определено выше. Предпочтительные нуклеотидные последовательности кодируют грибковые araA, araB или araD соответственно (например, из Basidiomycete), более предпочтительно araA, araB или araD соответственно, из анаэробных грибков, например анаэробных грибков, принадлежащих к семействам Neocallimastix, Caecomyces, Piromyces, Orpinomyces или Ruminomyces. В качестве альтернативы предпочтительные нуклеотидные последовательности кодируют бактериальные araA,araB или araD соответственно, предпочтительно из грамположительных бактерий, более предпочтительно из рода Lactobacillus, наиболее предпочтительно из вида Lactobacillus plantarum. Предпочтительно одна, две или три из нуклеотидных последовательностей araA, araB и araD происходят из рода Lactobacillus, наиболее предпочтительно из вида Lactobacillus plantarum. Бактериальная araA, экспрессируемая в клетках изобретения, не является ферментом araA из Bacillus subtilis, который раскрыт в ЕР 1499708 и приведен в SEQ ID NO: 9. Нуклеотидная последовательность, кодирующая SEQ ID NO: 9, представлена вSEQ ID NO: 10. Бактериальные araB и araD, экспрессируемые в клетках изобретения, не являются ферментами из Escherichia coli (E. coli), которые раскрыты в ЕР 1499708 и приведены в SEQ ID NO: 11 иNO: 12. Нуклеотидная последовательность, кодирующая SEQ ID NO: 13, представлена в SEQ ID NO: 14. Для повышения вероятности того, что (бактериальные) ферменты araA, araB и araD соответственно,будут экспрессироваться в активной форме в эукариотических клетках хозяина по изобретению, к примеру дрожжевых клетках, соответствующая кодирующая нуклеотидная последовательность может быть подвергнута оптимизации по употребительности кодонов к выбранным эукариотическим клеткам хозяина. Приспособленность нуклеотидных последовательностей, кодирующих ферменты araA, araB и araD(или другие ферменты изобретения, см. ниже), к употребительности кодонов у выбранных клеток хозяина может быть выражена в виде индекса адаптации кодонов (CAI). Индекс адаптации кодонов в настоящем изобретении определяется как мера относительной приспособленности употребления кодонов гена к употребительности кодонов у генов с высоким уровнем экспрессии. Относительная приспособленность(w) каждого кодона представляет собой отношение употребительности данного кодона к употребительности наиболее распространенного кодона для одной и той же аминокислоты. Индекс CAI определяется как геометрическое среднее этих значений относительной приспособленности. При этом исключаются несинонимические кодоны и кодоны терминации (зависящие от генетического кода). Значения CAI колеблются от 0 до 1, причем более высокие значения означают большую долю наиболее распространенных кодонов (см. Sharp and Li, 1987, Nucleic Acids Research 15: 1281-1295; а также Jansen et al., 2003, Nucleic Acids Res. 31(8):2242-51). Адаптированная нуклеотидная последовательность предпочтительно имеет значение CAI не менее 0,2, 0,3, 0,4, 0,5, 0,6 или 0,7. В предпочтительном воплощении экспрессия нуклеотидных последовательностей, кодирующихaraA, araB и araD, как определено выше, придает клеткам способность к утилизации L-арабинозы и/или к превращению е в L-рибулозу и/или ксилулозо-5-фосфат. Не ограничивая себя какой-либо теорией, отметим, что L-арабиноза сначала превращается в L-рибулозу, которая затем превращается в ксилулозо-5-5 016303 фосфат, который является основным продуктом, поступающим в пентозофосфатный путь. В контексте изобретения "утилизация L-арабинозы" предпочтительно означает то, что измеренная при 660 нм (OD660) оптическая плотность трансформированных клеток, культивируемых в аэробных или анаэробных условиях в присутствии по меньшей мере 0,5% L-арабинозы в течение по меньшей мере 20 дней, повышается примерно от 0,5 до 1,0 или больше. Более предпочтительно OD660 повышается от 0,5 до 1,5 или больше. Более предпочтительно клетки культивируют в присутствии по меньшей мере 1%, по меньшей мере 1,5%, по меньшей мере 2% L-арабинозы. Наиболее предпочтительно клетки культивируют в присутствии приблизительно 2% L-арабинозы. В контексте изобретения клетки обладают способностью "к превращению L-арабинозы в Lрибулозу", если в клетках, культивируемых в аэробных или анаэробных условиях в присутствии Lарабинозы (при тех же предпочтительных концентрациях, что и в предыдущем абзаце) в течение по меньшей мере 20 дней, обнаруживается заметное количество L-рибулозы при помощи соответствующего метода. Предпочтительным методом определения L-рибулозы является метод HPLC. В контексте изобретения клетки обладают способностью "к превращению L-арабинозы в ксилулозо-5-фосфат", если в клетках, культивируемых в аэробных или анаэробных условиях в присутствии Lарабинозы (при тех же предпочтительных концентрациях, что и в предыдущем абзаце) в течение по меньшей мере 20 дней, обнаруживается повышение ксилулозо-5-фосфата по меньшей мере на 2% при помощи соответствующего метода. Предпочтительным методом определения ксилулозо-5-фосфата является метод HPLC, описанный в Zaldivar J. et al. (2002), Appl. Microbiol. Biotechnol., 59: 436-442). Этот метод вкратце описан в экспериментальной части. Наиболее предпочтительно повышение составляет по меньшей мере 5, 10, 15, 20, 25% или больше. В другом предпочтительном воплощении изобретения экспрессия нуклеотидных последовательностей, кодирующих araA, araB и araD, как определено выше, придает клеткам способность к превращениюL-арабинозы в желательный продукт брожения при культивировании в аэробных или анаэробных условиях в присутствии L-арабинозы (при тех же предпочтительных концентрациях, что и в предыдущем абзаце) в течение по меньшей мере от 1 месяца до 1 года. Более предпочтительно клетки обладают способностью к превращению L-арабинозы в желательный продукт брожения, если при культивировании в условиях, приведенных в предыдущем предложении, обнаруживается заметное количество желательного продукта брожения при помощи соответствующего метода. Более предпочтительно методом определения является метод HPLC. Еще более предпочтительно продуктом брожения является этанол. Клетки для трансформирования нуклеотидными последовательностями, кодирующими ферментыaraA, araB и araD соответственно, как описано выше, предпочтительно представляют собой клетки хозяина, обладающие способностью к активному или пассивному транспорту ксилозы внутрь клетки и изомеризации ксилозы внутри клетки. Предпочтительно клетки обладают способностью к активному гликолизу. Клетки могут дополнительно содержать эндогенный пентозофосфатный путь и могут содержать эндогенную ксилулозокиназную активность с тем, чтобы ксилулоза, образовавшаяся при изомеризации ксилозы, могла подвергаться метаболическому превращению в пируват. Клетки предпочтительно дополнительно содержат ферменты для превращения пирувата в желательный продукт брожения, такой как этанол, молочная кислота, 3-гидроксипропионовая кислота, акриловая кислота, уксусная кислота,янтарная кислота, лимонная кислота, яблочная кислота, фумаровая кислота, аминокислоты, 1,3 пропандиол, этилен, глицерин, бутанол, -лактамовый антибиотик или цефалоспорин. Клеткам можно придать способность к вырабатыванию бутанола путем введения одного или нескольких генов бутанолового пути, как изложено в WO 2007/041269. Предпочтительными клетками, естественно, являются клетки, обладающие способностью к спиртовому брожению, предпочтительно анаэробному спиртовому брожению. Клетки-хозяин также предпочтительно обладают высокой устойчивостью к этанолу, высокой устойчивостью к низким значениям рН (т.е. способностью к росту при рН ниже 5, 4, 3 или 2,5) и к органическим кислотам типа молочной, уксусной или муравьиной кислоты и к таким продуктам деградации сахаров, как фурфураль и гидроксиметилфурфураль, а также высокой устойчивостью к повышенным температурам. Любые из этих характеристик или активностей клеток-хозяев могут присутствовать в клетках-хозяин естественным образом либо могут быть введены или модифицированы посредством генетической селекции или генетической модификации. Подходящими клетками-хозяин являются эукариотические микроорганизмы, такие, к примеру,как грибки, однако в качестве клеток-хозяин больше всего подходят дрожжи или нитчатые грибы. Дрожжи в настоящем изобретении определяются как эукариотические микроорганизмы и включают все виды подотдела Eumycotina (Alexopoulos С.J., 1962, In: Introductory Mycology, John WileySons,Inc., New York), преимущественно растущие в виде одноклеточных форм. Дрожжи могут расти либо почкованием из одноклеточного таллома, либо путем деления организма. Предпочтительные в качестве клеток-хозяин дрожжи принадлежат к одному из родов Saccharomyces, Kluyveromyces, Candida, Pichia,Schizosaccharomyces, Hansenula, Kloeckera, Schwanniomyces или Yarrowia. Предпочтительно дрожжи обладают способностью к анаэробному брожению, более предпочтительно к анаэробному спиртовому брожению. Нитчатые грибы в настоящем изобретении определяются как эукариотические микроорганизмы и-6 016303 включают все нитчатые формы подотдела Eumycotina. Эти грибы характеризуются вегетативным мицелием, состоящим из хитина, целлюлозы и других сложных полисахаридов. Нитчатые грибы настоящего изобретения в морфологическом, физиологическом и генетическом отношении отличаются от дрожжей. Вегетативный рост нитчатых грибов происходит путем удлинения гиф, а углеродный катаболизм у большинства нитчатых грибов является облигатно аэробным. Предпочтительные в качестве клетокхозяин нитчатые грибы принадлежат к одному из родов Aspergillus, Trichoderma, Humicola, Acremonium,Fusarium или Penicillium. На протяжении ряда лет высказывались предложения о введении различных организмов для продукции биологического этанола из сахаров сельскохозяйственных культур. Однако на практике во всех основных биологических способах получения этанола продолжали использовать дрожжи из рода Saccharomyces в качестве продуцента этанола. Это обусловлено многими привлекательными для промышленных процессов характеристиками видов Saccharomyces, как то: высокой устойчивостью к кислоте и этанолу и высокой осмотической устойчивостью, способностью к анаэробному росту и, конечно, высокой производительностью спиртового брожения. Предпочтительными в качестве клеток-хозяин видами дрожжей являются S. cerevisiae, S. bulderi, S. barnetti, S. exiguus, S. uvarum, S. diastaticus, K. lactis, K.marxianus, K. fragilis. В предпочтительном воплощении клетками-хозяин являются такие клетки, которые были трансформированы конструкцией из нуклеиновой кислоты, включающей нуклеотидные последовательности,кодирующие ферменты araA, araB и araD, как описано выше. В одном более предпочтительном воплощении клетки-хозяин трансформированы совместно тремя конструкциями из нуклеиновой кислоты, причем каждая конструкция включает нуклеотидную последовательность, кодирующую araA, araB или araD. Конструкции из нуклеиновой кислоты, включающие кодирующие последовательности araA, araB и/илиaraD, обладают способностью к экспрессии ферментов araA, araB и/или araD в клетках-хозяин. Для этой цели конструкции можно сконструировать так, как описано, например, в WO 03/0624430. Клетки-хозяин могут содержать одиночные копии, но предпочтительно содержат множественные копии каждой конструкции из нуклеиновой кислоты. Конструкция из нуклеиновой кислоты может находиться в виде эписомы и при этом содержать последовательность для автономной репликации типа последовательностиARS. Подходящие эписомные конструкции, например, могут быть основаны на дрожжевых плазмидах 2 или pKD1 (Fleer et al., 1991, Biotechnology 9: 968-975). Предпочтительно, однако, каждая конструкция из нуклеиновой кислоты в одной или нескольких копиях встраивается в геном клетки-хозяин. Встраивание в геном клетки-хозяин может происходить случайным образом при неправильной рекомбинации, но предпочтительно конструкция встраивается в геном клетки-хозяин при гомологической рекомбинации,как это хорошо известно в области молекулярной биологии грибов (например, см. WO 90/14423, ЕР-А 0481008, ЕР-А-0635574 и US 6265186). Соответственно, в более предпочтительном воплощении клетки изобретения содержат конструкцию из нуклеиновой кислоты, включающую кодирующие последовательности araA, araB и/или araD, и обладают способностью к экспрессии ферментов araA, araB и/или araD. В еще более предпочтительном воплощении каждая из кодирующих последовательностей araA, araB и/или araD функционально связана с промотором, вызывающим экспрессию соответствующей нуклеотидной последовательности в клетках,достаточную для придания клеткам способности к утилизации L-арабинозы и/или к превращению Lарабинозы в L-рибулозу и/или ксилулозо-5-фосфат. Предпочтительно клетки представляют собой дрожжевые клетки. Соответственно, в следующем аспекте изобретение также охватывает конструкции из нуклеиновой кислоты, как изложено выше. Предпочтительно конструкция из нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую araA, araB и/или araD. Нуклеотидные последовательности, кодирующие araA, araB или araD, уже определены выше. Еще более предпочтительно экспрессия соответствующих нуклеотидных последовательностей в клетках придает клеткам способность к превращению L-арабинозы в желательный продукт брожения,как описано ниже. В еще более предпочтительном воплощении продуктом брожения является этанол. Еще более предпочтительно клетки представляют собой дрожжевые клетки. В настоящем изобретении термин "функционально связан" обозначает соединение полинуклеотидных элементов (или кодирующих последовательностей или нуклеотидных последовательностей) в функциональной взаимосвязи. Последовательность нуклеиновой кислоты "функционально связана", если она находится в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию кодирующей последовательности. Функционально связанные означает то, что связанные последовательности нуклеиновых кислот, как правило, являются смежными, а если нужно соединить кодирующие области двух белков, то смежными и в одной рамке считывания. В настоящем изобретении термин "промотор" обозначает фрагмент нуклеиновой кислоты, который функционирует, контролируя транскрипцию одного или нескольких генов, и располагается перед сайтом инициации транскрипции гена относительно направления транскрипции, а в структурном отношении отличается наличием места связывания ДНК-зависимой РНК-полимеразы, сайтов инициации транскрипции и иных последовательностей ДНК, в том числе мест связывания факторов транскрипции, мест свя-7 016303 зывания белков-репрессоров и белков-активаторов и иных последовательностей нуклеотидов, известных в этой области, которые, действуя прямо или косвенно, регулируют степень транскрипции из промотора."Конститутивный" промотор есть такой промотор, который активен в большей части экологических и онтогенетических ситуаций. "Индуцибельный" промотор есть такой промотор, который активен при экологической или онтогенетической регуляции. Промотор, который может использоваться для осуществления экспрессии нуклеотидных последовательностей, кодирующих araA, araB и/или araD, может быть чужим для нуклеотидных последовательностей, кодирующих экспрессируемые ферменты, т.е. этот промотор гетерологичен той нуклеотидной последовательности (кодирующей последовательности), с которой он функционально связан. Хотя предпочтительно промотор гетерологичен той кодирующей последовательности, с которой он функционально связан, но так же предпочтительно он может быть гомологичным, т.е. эндогенным для клеток-хозяин. Предпочтительно гетерологичный (относительно данной нуклеотидной последовательности) промотор способен обеспечить более высокий стационарный уровень транскрипта, содержащего кодирующую последовательность (или способен продуцировать больше молекул транскрипта, т.е. молекул мРНК за единицу времени), чем промотор, нативный для кодирующей последовательности, предпочтительно в таких условиях, когда источником углерода служит арабиноза, либо арабиноза и глюкоза, либо ксилоза и арабиноза, либо ксилоза, арабиноза и глюкоза, более предпочтительно в качестве основного источника углерода (т.е. более 50% доступного источника углерода составляет арабиноза, либо арабиноза и глюкоза,либо ксилоза и арабиноза, либо ксилоза, арабиноза и глюкоза), наиболее предпочтительно в качестве единственного источника углерода. Подходящие в этом плане промоторы охватывают как конститутивные, так и индуцибельные природные промоторы, а также искусственно созданные промоторы. Предпочтительный промотор для использования в настоящем изобретении, кроме того, должен быть нечувствительным к репрессии катаболитами (глюкозой) и/или предпочтительно не требовать арабинозы и/или ксилозы для индукции. Промоторы, обладающие этими характеристиками, широко доступны и известны специалистам. Подходящие примеры таких промоторов включают, например, промоторы из гликолитических генов, к примеру промоторы фосфофруктокиназы (PPK), триозофосфатизомеразы (TPI), глицеральдегид-3 фосфатдегидрогеназы (GPD, TDH3 или GAPDH), пируваткиназы (PYK), фосфоглицераткиназы (PGK) из дрожжей или нитчатых грибов; более подробно о таких промоторах у дрожжей можно узнать в WO 93/03159. Другими полезными промоторами являются промоторы генов, кодирующих рибосомные белки, промотор гена лактазы (LAC4), промоторы алкогольдегидрогеназы (ADH1, ADH4 и др.), промотор енолазы (ENO), промотор глюкозо-6-фосфатизомеразы (PGI1, Hauf et al., 2000) или промотор переносчика гексоз (глюкозы) (НХТ 7) либо глицеральдегид-3-фосфатдегидрогеназы (TDH3). Последовательность промотора PGI1 приведена в SEQ ID NO: 51. Последовательность промотора НХТ 7 приведена в SEQ IDNO: 52. Последовательность промотора TDH3 приведена в SEQ ID NO: 49. Другие промоторы и конститутивные, и индуцибельные, а также энхансеры или вышележащие активирующие последовательности,должны быть известны специалистам в этой области. Промоторы, используемые в клетках-хозяин по изобретению, могут быть подвергнуты модификации, если нужно, чтобы изменить их контролирующие характеристики. Предпочтительными клетками по изобретению являются эукариотические клетки, трансформированные генами araA, araB и araD из L. plantarum. Более предпочтительно эукариотические клетки представляют собой дрожжевые клетки, еще более предпочтительно клетки штамма S. cerevisiae, трансформированные генами araA, araB и araD из L. plantarum. Наиболее предпочтительно они представляют собой клетки CBS 120327 или CBS 120328, депонированные в Институте CBS (Нидерланды) 27 сентября 2006 г. Термин "гомологичные", когда он используется для обозначения взаимосвязи между данной молекулой (рекомбинантной) нуклеиновой кислоты или полипептида и данным организмом или клетками хозяина, подразумевает то, что в природе эта молекула нуклеиновой кислоты или полипептида вырабатывается клетками или организмами хозяина того же самого вида, предпочтительно той же самой разновидности или штамма. Если последовательность нуклеиновой кислоты, кодирующей полипептид, гомологична клеткам-хозяин, то она, как правило, должна быть функционально связана с последовательностью другого промотора или, если применимо, последовательностью другого сигнала секреции и/или терминатора, чем в своем естественном окружении. Когда он используется для обозначения родственности двух последовательностей нуклеиновых кислот, термин "гомологичные" означает, что одна последовательность однонитчатой нуклеиновой кислоты может гибридизироваться с комплементарной последовательностью однонитчатой нуклеиновой кислоты. Степень гибридизации может зависеть от ряда факторов, включая степень идентичности между последовательностями и такие условия гибридизации, как температура и концентрация соли, как это изложено выше. Предпочтительно участок идентичности составляет более 5 п.о., более предпочтительно участок идентичности составляет более 10 п.о. Термин "гетерологичные", когда он применяется в отношении нуклеиновой кислоты (ДНК или РНК) или белка, означает то, что нуклеиновая кислота или белок не встречается естественным образом в составе того организма, клетки, генома либо последовательности ДНК или РНК, в которых они находят-8 016303 ся, или же они находятся в таких клетках или таком месте в геноме или последовательности ДНК или РНК, которые отличаются от тех, в которых они встречаются в природе. Гетерологичные нуклеиновые кислоты или белки не являются эндогенными для тех клеток, в которые они введены, а были получены из других клеток либо синтетическим или рекомбинантным способом. Обычно, хотя и не обязательно,такие нуклеиновые кислоты кодируют белки, которые в норме не вырабатываются теми клетками, в которых происходит транскрипция или экспрессия. Аналогичным образом экзогенная РНК кодирует белки,которые в норме не экспрессируются в тех клетках, в которых находится эта экзогенная РНК. Гетерологичные нуклеиновые кислоты или белки также могут именоваться чужеродными нуклеиновыми кислотами или белками. Любая нуклеиновая кислота или белок, которую специалист в этой области признает гетерологичной или чужеродной тем клеткам, в которых она подвергается экспрессии, в настоящем изобретении охватывается термином гетерологичная нуклеиновая кислота или белок. Термин гетерологичные также применим к неестественным комбинациям нуклеиновых кислот или аминокислотных последовательностей, т.е. таким комбинациям, в которых по меньшей мере две из комбинируемых последовательностей являются чужеродными относительно друг друга. Предпочтительные эукариотические клетки, обладающие способностью к утилизации и/или превращению L-арабинозы и ксилозы В более предпочтительном воплощении клетки изобретения, экспрессирующие araA, araB и araD,обладают способностью к утилизации L-арабинозы и/или к превращению е в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения, как определено выше, и кроме того, они проявляют способность к утилизации ксилозы и/или к превращению ксилозы в ксилулозу. Превращение ксилозы в ксилулозу предпочтительно представляет собой одностадийный процесс изомеризации (прямой изомеризации ксилозы в ксилулозу). Таким образом, клетки этого типа способны утилизировать и Lарабинозу, и ксилозу. "Утилизация" ксилозы предпочтительно означает то же самое, что и "утилизация"L-арабинозы, как определено выше. Применяются такие же обозначения ферментов, как в WO 06/009434, в отношении ксилозоизомеразы (ЕС 5.3.1.5), ксилулозокиназы (ЕС 2.7.1.17), рибулозо-5-фосфат-эпимеразы (5.1.3.1), рибулозо-5 фосфат-изомеразы (ЕС 5.3.1.6), транскетолазы (ЕС 2.2.1.1), трансальдолазы (ЕС 2.2.1.2) и альдозоредуктазы (ЕС 1.1.1.21). В предпочтительном воплощении эукариотические клетки по изобретению, экспрессирующие araA,araB и araD, как определено выше, обладают способностью к изомеризации ксилозы в ксилулозу, как описано, например, в WO 03/0624430 или в WO 06/009434. Способность к изомеризации ксилозы в ксилулозу придается клеткам-хозяин при трансформации их конструкцией из нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую ксилозоизомеразу. Способность трансформированных клеток к изомеризации ксилозы в ксилулозу представляет собой прямую изомеризацию ксилозы в ксилулозу. Это значит, что ксилоза подвергается изомеризации в ксилулозу при одной единственной реакции, катализируемой ксилозоизомеразой в отличие от двухстадийного превращения ксилозы в ксилулозу через промежуточный продукт ксилитол, которое катализируется ксилозоредуктазой и ксилитолдегидрогеназой соответственно. Нуклеотидная последовательность кодирует такую ксилозоизомеразу, которая предпочтительно экспрессируется в активной форме в трансформированных клетках-хозяин. Так, экспрессия нуклеотидной последовательности в клетках-хозяин дает ксилозоизомеразу с удельной активностью по меньшей мере 10 ед. ксилозоизомеразной активности на 1 мг белка при 30 С, предпочтительно по меньшей мере 20, 25, 30, 50, 100, 200, 300 или 500 ед. на 1 мг белка при 30 С. Удельная активность ксилозоизомеразы,экспрессируемой в трансформированных клетках-хозяин, определяется как количество единиц ксилозоизомеразной активности на 1 мг белка бесклеточного лизата клеток хозяина, например бесклеточного лизата дрожжевых клеток. Определение ксилозоизомеразной активности уже было описано ранее. Предпочтительно экспрессия нуклеотидной последовательности, кодирующей ксилозоизомеразу в клетках-хозяин, дает ксилозоизомеразу со значением KM для ксилозы менее 50, 40, 30 или 25 мМ, более предпочтительно значение KM для ксилозы составляет около 20 мМ или меньше. Предпочтительная нуклеотидная последовательность, кодирующая ксилозоизомеразу, может быть выбрана из группы, состоящей из(e) нуклеотидных последовательностей, кодирующих полипептид, включающий аминокислотную последовательность, которая по меньшей мере на 60, 65, 70, 75, 80, 85, 90, 95, 97, 98 или 99% идентична аминокислотной последовательности SEQ ID NO: 7 или SEQ ID NO: 15;(f) нуклеотидных последовательностей, включающих нуклеотидную последовательность, которая по меньшей мере на 40, 50, 60, 70, 80, 90, 95, 97, 98 или 99% идентична нуклеотидной последовательности SEQ ID NO: 8 или SEQ ID NO: 16;(g) нуклеотидных последовательностей, у которых комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (а) или (b);(h) нуклеотидных последовательностей, у которых последовательность отличается от последовательности молекулы нуклеиновой кислоты (с) вследствие вырожденности генетического кода. Нуклеотидная последовательность, кодирующая ксилозоизомеразу, может кодировать либо прока-9 016303 риотическую, либо эукариотическую ксилозоизомеразу, т.е ксилозоизомеразу, у которой аминокислотная последовательность идентична последовательности ксилозоизомеразы, встречающейся в природе у прокариотического либо эукариотического организма. Авторы настоящего изобретения обнаружили, что способность конкретной ксилозоизомеразы придавать эукариотическим клеткам-хозяин способность к изомеризации ксилозы в ксилулозу не слишком зависит от того, имеет ли изомераза прокариотическое или эукариотическое происхождение. Скорее это зависит от родственности аминокислотной последовательности изомеразы к последовательности Piromyces (SEQ ID NO: 7). Неожиданно эукариотическая изомераза Piromyces оказалась более родственной прокариотическим изомеразам, чем другим известным эукариотическим изомеразам. Поэтому предпочтительная нуклеотидная последовательность кодирует такую ксилозоизомеразу, аминокислотная последовательность которой родственна последовательностиPiromyces, как определено выше. Предпочтительная нуклеотидная последовательность кодирует грибковую ксилозоизомеразу (например, из Basidiomycete), более предпочтительно ксилозоизомеразу из анаэробного грибка, например ксилозоизомеразу из анаэробного грибка, принадлежащего к семейству Neocallimastix, Caecomyces, Piromyces, Orpinomyces или Ruminomyces. В качестве альтернативы предпочтительная нуклеотидная последовательность кодирует бактериальную ксилозоизомеразу предпочтительно из грамотрицательных бактерий, более предпочтительно ксилозоизомеразу из класса Bacteroides или из рода Bacteroides, наиболее предпочтительно из В. thetaiotaomicron (SEQ ID NO: 15). Для повышения вероятности того, что ксилозоизомераза будет экспрессироваться в активной форме в эукариотических клетках-хозяин, к примеру дрожжевых клетках, нуклеотидная последовательность,кодирующая ксилозоизомеразу, может быть подвергнута оптимизации по употребительности кодонов к данным эукариотическим клеткам-хозяин, как определено выше. Клетки-хозяин для трансформирования нуклеотидной последовательностью, кодирующей ксилозоизомеразу, как описано выше, предпочтительно представляют собой клетки-хозяин, обладающие способностью к активному или пассивному транспорту ксилозы внутрь клетки. Предпочтительно клеткихозяин содержат систему активного гликолиза. Клетки-хозяин могут дополнительно содержать эндогенный пентозофосфатный путь и могут содержать эндогенную ксилулозокиназную активность с тем, чтобы ксилулоза, образовавшаяся при изомеризации ксилозы, могла подвергаться метаболическому превращению в пируват. Клетки предпочтительно дополнительно содержат ферменты для превращения пирувата в желательный продукт брожения, такой как этанол, молочная кислота, 3-гидроксипропионовая кислота,акриловая кислота, уксусная кислота, янтарная кислота, лимонная кислота, яблочная кислота, фумаровая кислота, аминокислоты, 1,3-пропандиол, этилен, глицерин, бутанол, -лактамовый антибиотик или цефалоспорин. Предпочтительными клетками-хозяин являются клетки, от природы обладающие способностью к спиртовому брожению, предпочтительно анаэробному спиртовому брожению. Клетки-хозяин также предпочтительно обладают высокой устойчивостью к этанолу, высокой устойчивостью к низким значениям рН (т.е. способностью к росту при рН ниже 5, 4, 3 или 2,5) и к органическим кислотам типа молочной, уксусной или муравьиной кислоты, и к таким продуктам деградации сахаров, как фурфураль и гидроксиметилфурфураль, а также высокой устойчивостью к повышенным температурам. Любые из этих характеристик или активностей клеток-хозяин могут присутствовать в них естественным образом либо могут быть введены или модифицированы посредством генетической модификации. Подходящими клетками являются эукариотические микроорганизмы, такие, к примеру, как грибки, однако, в качестве клеток-хозяин больше всего подходят дрожжи или нитчатые грибы. Предпочтительные дрожжи и нитчатые грибы уже были определены ранее. В настоящем изобретении выражение клетки-хозяин означает то же самое, что клетки. Клетки изобретения предпочтительно трансформируют конструкцией из нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую ксилозоизомеразу. Предпочтительно используется та же самая конструкция, которая используется для нуклеотидных последовательностей, кодирующих araA, araB или araD. В следующем предпочтительном воплощении изобретения клетки по изобретению, экспрессирующие araA, araB и araD и проявляющие способность к прямой изомеризации ксилозы в ксилулозу, как определено выше, дополнительно содержат генетическую модификацию, повышающую мощность пентозофосфатного пути, как описано в WO 06/009434. В частности, генетическая модификация вызывает повышение мощности неокислительной части пентозофосфатного пути. Генетическая модификация, вызывающая повышение мощности неокислительной части пентозофосфатного пути, в настоящем изобретении означает такую модификацию, которая повышает мощность по меньшей мере в 1,1, 1,2, 1,5, 2, 5, 10 или 20 раз по сравнению с мощностью у такого штамма, который генетически идентичен во всем, кроме генетической модификации, вызывающей повышение мощности. Мощность неокислительной части пентозофосфатного пути может быть измерена путем культивирования модифицированных клеток на ксилозе как на единственном источнике углерода, определения удельной скорости потребления ксилозы и вычитания удельной скорости образования ксилитола из удельной скорости потребления ксилозы, если при этом образуется ксилитол. Однако мощность неокислительной части пентозофосфатного пути пропорциональна скорости роста на ксилозе как на единственном источнике углерода, предпочтительно скорости анаэробного роста на ксилозе как на единственном источнике углерода. Существует линейная зави- 10016303 симость между скоростью роста на ксилозе как на единственном источнике углерода (max) и мощностью неокислительной части пентозофосфатного пути. Удельная скорость потребления ксилозы (Qs) равняется скорости роста , деленной на выход биомассы на сахаре (Yxs), поскольку выход биомассы на сахаре является постоянным (при данном наборе условий: анаэробности, среде роста, рН, генетическом фоне штамма и т.п.), т.е. Qs=/Yxs). Поэтому повышение мощности неокислительной части пентозофосфатного пути можно вывести из повышения максимальной скорости роста при этих условиях. В предпочтительном воплощении клетки содержат генетическую модификацию, повышающую мощность пентозофосфатного пути, и имеют удельную скорость потребления ксилозы как минимум 346 мг ксилозы/г биомассы/ч. Генетические модификации, повышающие мощность пентозофосфатного пути, могут быть введены в клетки-хозяин различными способами. Они включают, например, повышение стационарного уровня активности ксилулозокиназы и/или одного или нескольких ферментов неокислительной части пентозофосфатного пути и/или снижение стационарного уровня активности неспецифической альдозоредуктазы. Эти изменения стационарных уровней активности могут осуществляться путем селекции мутантов(спонтанных или индуцированных с помощью химических веществ или радиации) и/или по технологии рекомбинантной ДНК, например, путем суперэкспрессии или инактивации, соответственно, генов, кодирующих ферменты, или факторов, регулирующих эти гены. В более предпочтительных клетках-хозяин генетическая модификация включает суперэкспрессию по меньшей мере одного фермента (неокислительной части) пентозофосфатного пути. Предпочтительно фермент выбирается из группы, состоящей из ферментов рибулозо-5-фосфат-изомеразы, рибулозо-5 фофат-эпимеразы, транскетолазы и трансальдолазы, как описано в WO 06/009434. Суперэкспрессии могут подвергаться различные комбинации ферментов (неокислительной части) пентозофосфатного пути. Например, суперэкспрессии могут подвергаться такие ферменты, как минимум, ферменты рибулозо-5-фосфат-изомераза и рибулозо-5-фосфат-эпимераза; или, как минимум, ферменты рибулозо-5-фосфат-изомераза и транскетолаза; или, как минимум, ферменты рибулозо-5-фосфатизомераза и трансальдолаза; или, как минимум, ферменты рибулозо-5-фосфат-эпимераза и транскетолаза; или, как минимум, ферменты рибулозо-5-фосфат-эпимераза и трансальдолаза; или, как минимум,ферменты транскетолаза и трансальдолаза; или, как минимум, ферменты рибулозо-5-фосфат-эпимераза,транскетолаза и трансальдолаза; или, как минимум, ферменты рибулозо-5-фосфат-изомераза, транскетолаза и трансальдолаза; или, как минимум, ферменты рибулозо-5-фосфат-изомераза, рибулозо-5-фосфатэпимераза и трансальдолаза; или, как минимум, ферменты рибулозо-5-фосфат-изомераза, рибулозо-5 фосфат-эпимераза и транскетолаза. В одном воплощении изобретения суперэкспрессии в клетках-хозяин подвергается каждый из ферментов: рибулозо-5-фосфат-изомераза, рибулозо-5-фосфат-эпимераза,транскетолаза и трансальдолаза. Более предпочтительными являются такие клетки-хозяин, у которых генетическая модификация включает, по меньшей мере, суперэкспрессию двух ферментов - транскетолазы и трансальдолазы, так как такие клетки-хозяин уже обладают способностью к анаэробному росту на ксилозе. В самом деле, оказалось, что в этих условиях клетки-хозяин, суперэкспрессирующие только транскетолазу и трансальдолазу, уже обладают такой же скоростью анаэробного роста на ксилозе, как и клетки-хозяин, суперэкспрессирующие все четыре фермента, т.е. рибулозо-5-фосфат-изомеразу, рибулозо-5-фосфат-эпимеразу, транскетолазу и трансальдолазу. Более того, клетки-хозяин, суперэкспрессирующие два фермента - рибулозо-5-фосфат-изомеразу и рибулозо-5-фосфат-эпимеразу, предпочтительней, чем клетки-хозяин, суперэкспрессирующие только изомеразу или только эпимеразу, так как суперэкспрессия только одного из этих ферментов может вызвать метаболические нарушения. Существуют различные доступные способы суперэкспрессирования ферментов в клетках изобретения. В частности, фермент может быть подвергнут суперэкспрессии путем повышения числа копий гена,кодирующего этот фермент в клетках-хозяин, например, посредством встраивания дополнительных копий гена в геном клеток-хозяин, экспрессирования гена из множественных копий эписомного экспрессионного вектора или введения эписомного экспрессионного вектора, содержащего множественные копии гена. В качестве альтернативы суперэкспрессия ферментов в клетках-хозяин по изобретению может осуществляться при помощи промотора, являющегося чужеродным по отношению к последовательности,кодирующей суперэкспрессируемый фермент, т.е. промотора, гетерологичного для той кодирующей последовательности, с которой он функционально связан. Подходящие для этой цели промоторы уже были определены выше. Кодирующая последовательность, используемая для суперэкспрессии ферментов, предпочтительно является гомологичной для клеток хозяина по изобретению. Однако равным образом можно использовать и кодирующие последовательности, гетерологичные для клеток-хозяин по изобретению, как указано в WO 06/009434. Нуклеотидная последовательность, используемая для суперэкспрессии рибулозо-5-фосфатизомеразы в клетках-хозяин по изобретению, представляет собой нуклеотидную последовательность,кодирующую полипептид с рибулозо-5-фосфат-изомеразной активностью, при этом предпочтительно- 11016303 полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 50, 60, 70,80, 90 или 95% идентична SEQ ID NO: 17, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 18 при умеренных условиях, предпочтительно при строгих условиях. Нуклеотидная последовательность, используемая для суперэкспрессии рибулозо-5-фосфатэпимеразы в клетках-хозяин по изобретению, представляет собой нуклеотидную последовательность,кодирующую полипептид с рибулозо-5-фосфат-эпимеразной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 50, 60, 70,80, 90 или 95% идентична SEQ ID NO: 19, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 20 при умеренных условиях, предпочтительно при строгих условиях. Нуклеотидная последовательность, используемая для суперэкспрессии транскетолазы в клеткаххозяин по изобретению, представляет собой нуклеотидную последовательность, кодирующую полипептид с транскетолазной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 50, 60, 70, 80, 90 или 95% идентична SEQ ID NO: 21, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 22 при умеренных условиях, предпочтительно при строгих условиях. Нуклеотидная последовательность, используемая для суперэкспрессии трансальдолазы в клеткаххозяин по изобретению, представляет собой нуклеотидную последовательность, кодирующую полипептид с трансальдолазной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 50, 60, 70, 80, 90 или 95% идентична SEQ ID NO: 23, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 24 при умеренных условиях, предпочтительно при строгих условиях. Суперэкспрессия фермента, когда это относится к продукции фермента в генетически модифицированных клетках-хозяин, означает то, что фермент вырабатывается при более высоком уровне энзиматической активности по сравнению с немодифицированными клетками-хозяин в идентичных условиях. Обычно это значит, что энзиматически активный белок (или белки в случае ферментов из нескольких субъединиц) вырабатывается в большем количестве или же на более высоком стационарном уровне по сравнению с немодифицированными клетками-хозяин в идентичных условиях. Аналогичным образом это обычно значит, что мРНК, кодирующая энзиматически активный белок, вырабатывается в большем количестве или опять же на более высоком стационарном уровне по сравнению с немодифицированными клетками-хозяин в идентичных условиях. Суперэкспрессия фермента при этом предпочтительно определяется измерением уровня удельной активности фермента в клетках-хозяин при помощи соответствующих методов определения, как описано в настоящем изобретении. С другой стороны, суперэкспрессия фермента может определяться косвенным образом путем количественного определения удельного стационарного уровня белка фермента, например, с помощью антител, специфичных к этому ферменту, либо путем количественного определения удельного стационарного уровня мРНК, кодирующей этот фермент. Последнее может особенно подойти для ферментов пентозофосфатного пути, для которых энзиматические методы трудно достижимы, так как субстраты для ферментов не являются коммерчески доступными. Предпочтительно подлежащий суперэкспрессии в клетках-хозяин по изобретению фермент суперэкспрессируется по меньшей мере в 1,1, 1,2, 1,5, 2, 5, 10 или 20 раз по сравнению со штаммом, который генетически идентичен во всем, кроме генетической модификации, вызывающей суперэкспрессию. Следует иметь в виду, что эти уровни суперэкспрессии могут относиться к стационарному уровню активности фермента, стационарному уровню белка фермента, а также к стационарному уровню транскрипта, кодирующего этот фермент. В следующем предпочтительном воплощении клетки-хозяин по изобретению, экспрессирующиеaraA, araB и araD и проявляющие способность к прямой изомеризации ксилозы в ксилулозу, а также необязательно содержащие генетическую модификацию, повышающую мощность пентозофосфатного пути, как определено выше, дополнительно содержат генетическую модификацию, повышающую удельную активность ксилулозокиназы. Предпочтительно генетическая модификация вызывает суперэкспрессию ксилулозокиназы, например, посредством суперэкспрессии нуклеотидной последовательности, кодирующей ксилулозокиназу. Ген, кодирующий ксилулозокиназу, может быть эндогенным для клетокхозяин или же ксилулозокиназа может быть гетерологична клеткам-хозяин. Нуклеотидная последовательность, используемая для суперэкспрессии ксилулозокиназы в клетках-хозяин по изобретению, представляет собой нуклеотидную последовательность, кодирующую полипептид с ксилулозокиназной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность,которая по меньшей мере на 50, 60, 70, 80, 90 или 95% идентична SEQ ID NO: 25, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 26 при умеренных условиях, предпочтительно при строгих условиях. Особенно предпочтительной ксилулозокиназой является ксилулозокиназа, которая родственна ксилулозокиназе xylB из Piromyces, как указано в WO 03/0624430. Более предпочтительно нуклеотидная последовательность, используемая при суперэкспрессии ксилулозокиназы в клетках-хозяин по изобрете- 12016303 нию, представляет собой нуклеотидную последовательность, кодирующую полипептид с ксилулозокиназной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 45, 50, 55, 60, 65, 70, 80, 90 или 95% идентична SEQ ID NO. 27,или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO. 28 при умеренных условиях, предпочтительно при строгих условиях. В клетках-хозяин по изобретению генетическую модификацию, повышающую удельную активность ксилулозокиназы, можно комбинировать с любой из модификаций, повышающих мощность пентозофосфатного пути, как описано выше, но такое комбинирование не является существенным для изобретения. Так, изобретение определенно охватывает клетки-хозяин по изобретению, содержащие генетическую модификацию, повышающую удельную активность ксилулозокиназы, наряду с экспрессией ферментов araA, araB и araD, как определено в настоящем изобретении. Различные доступные способы осуществления и анализа суперэкспрессии ксилулозокиназы в клетках-хозяин по изобретению являются такими же, как описано выше для ферментов пентозофосфатного пути. Предпочтительно подлежащая суперэкспрессии в клетках-хозяин по изобретению ксилулозокиназа суперэкспрессируется по меньшей мере в 1,1, 1,2, 1,5, 2, 5, 10 или 20 раз по сравнению со штаммом, который генетически идентичен во всем, кроме генетической модификации, вызывающей суперэкспрессию. Следует иметь в виду, что эти уровни суперэкспрессии могут относиться к стационарному уровню активности фермента, стационарному уровню белка фермента, а также к стационарному уровню транскрипта, кодирующего этот фермент. В следующем предпочтительном воплощении клетки-хозяин по изобретению, экспрессирующиеaraA, araB и araD и проявляющие способность к прямой изомеризации ксилозы в ксилулозу, а также необязательно содержащие генетическую модификацию, повышающую мощность пентозофосфатного пути, и/или дополнительно содержащие генетическую модификацию, повышающую удельную активность ксилулозокиназы, как определено выше, дополнительно содержат генетическую модификацию, уменьшающую активность неспецифической альдозоредуктазы в клетках-хозяин. Предпочтительно активность неспецифической альдозоредуктазы уменьшается в клетках-хозяин при одной или нескольких генетических модификациях, снижающих экспрессию или инактивирующих ген, кодирующий неспецифическую альдозоредуктазу, как описано в WO 06/009434. Предпочтительно генетическая модификация снижает или инактивирует экспрессию каждой эндогенной копии гена, кодирующего неспецифическую альдозоредуктазу в клетках-хозяин. Клетки-хозяин могут содержать множественные копии генов, кодирующих вследствие ди-, поли- или анеуплоидности, и/или клетки-хозяин могут содержать несколько различных ферментов с активностью альдозоредуктазы, отличающихся по аминокислотной последовательности,при этом все они кодируются разными генами. И в таких случаях предпочтительно снижается или инактивируется экспрессия каждого гена, кодирующего неспецифическую альдозоредуктазу. Предпочтительно ген инактивируется при помощи делеции по крайней мере части гена или разрушения гена, при этом термин ген также охватывает и некодирующую последовательность впереди или позади от той кодирующей последовательности, (частичная) делеция или инактивация которой приводит к снижению экспрессии неспецифической альдозоредуктазной активности в клетках-хозяина. Нуклеотидная последовательность, кодирующая альдозоредуктазу, активность которой подлежит уменьшению в клеткаххозяин по изобретению, представляет собой нуклеотидную последовательность, кодирующую полипептид с альдозоредуктазной активностью, при этом предпочтительно полипептид имеет такую аминокислотную последовательность, которая по меньшей мере на 50, 60, 70, 80, 90 или 95% идентична SEQ IDNO: 29, или же нуклеотидная последовательность способна гибридизироваться с нуклеотидной последовательностью SEQ ID NO: 30 при умеренных условиях, предпочтительно при строгих условиях. В клетках-хозяин по изобретению экспрессию ферментов araA, araB и araD, как определено выше,можно комбинировать с генетической модификацией, снижающей активность неспецифической альдозоредуктазы. Генетическую модификацию, вызывающую снижение активности неспецифической альдозоредуктазы, можно комбинировать с любой из модификаций, повышающих мощность пентозофосфатного пути, и/или с любой из модификаций, повышающих удельную активность ксилулозокиназы в клетках-хозяин, как описано выше, но такое комбинирование не является существенным для изобретения. Так, изобретение определенно охватывает клетки-хозяин, экспрессирующие araA, araB и araD, содержащие дополнительную генетическую модификацию, вызывающую снижение неспецифической альдозоредуктазной активности. В предпочтительном воплощении клетки-хозяин представляют собой клетки CBS 120327, депонированные в Институте CBS (Нидерланды) 27 сентября 2006 г. В следующем предпочтительном воплощении изобретение касается модифицированных клетокхозяин, дополнительно адаптированных к утилизации L-арабинозы (утилизации L-арабинозы и/или превращению е в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения) и необязательно ксилозы путем селекции мутантов, спонтанных или индуцированных (например, с помощью радиации или химических веществ), в отношении роста на L-арабинозе и необязательно ксилозе как единственном источнике углерода, более предпочтительно в анаэробных условиях. Селекция мутантов может осуществляться методом серийного пересева культур, например, как описано в Kuyper et al. (2004,FEMS Yeast Res. 4: 655-664), и/или методом культивирования при селекционном давлении в хемостате,- 13016303 как описано в примере 4 в WO 06/009434. Процесс селекции может продолжаться столько, сколько нужно. Предпочтительно этот процесс селекции длится от 1 недели до 1 года. Но при необходимости он может продолжаться и дольше. Во время процесса селекции клетки предпочтительно культивируют в присутствии примерно 20 г/л L-арабинозы и/или примерно 20 г/л ксилозы. Полученные по окончании этого процесса селекции клетки должны быть улучшенными в отношении их способности к утилизации Lарабинозы и/или ксилозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат,и/или в желательный продукт брожения типа этанола. При этом "улучшенные клетки" может означать то, что полученные клетки способны утилизировать L-арабинозу и/или ксилозу более эффективным образом, чем клетки, из которых они происходят. Например, полученные клетки должны лучше расти: повышение удельной скорости роста по меньшей мере на 2%, чем клеток, из которых они происходят, в одинаковых условиях. Предпочтительно повышение составляет по меньшей мере 4, 6, 8, 10, 15, 20, 25% или больше. Удельная скорость роста может быть рассчитана из OD660, как это известно специалистам. Таким образом, по значениям OD660 можно вычислить удельную скорость роста. В этом плане "улучшенные клетки" может также означать и то, что полученные клетки должны превращать L-арабинозу вL-рибулозу, и/или ксилулозо-5-фосфат, и/или желательный продукт брожения типа этанола более эффективным образом, чем клетки, из которых они происходят. Например, полученные клетки должны вырабатывать большее количество L-рибулозы, и/или ксилулозо-5-фосфата, и/или желательного продукта брожения типа этанола: повышение по меньшей мере одного из этих соединений по меньшей мере на 2%, чем клетки, из которых они происходят, в одинаковых условиях. Предпочтительно повышение составляет по меньшей мере 4, 6, 8, 10, 15, 20, 25% или больше. В этом плане "улучшенные клетки" может также означать и то, что полученные клетки должны превращать ксилозу в ксилулозу и/или желательный продукт брожения типа этанола более эффективным образом, чем клетки, из которых они происходят. Например, полученные клетки должны вырабатывать большее количество ксилулозы и/или желательного продукта брожения типа этанола: повышение по меньшей мере одного из этих соединений по меньшей мере на 2%, чем клетки, из которых они происходят, в одинаковых условиях. Предпочтительно повышение составляет по меньшей мере 4, 6, 8, 10, 15, 20, 25% или больше. У предпочтительных клеток-хозяин по изобретению по меньшей мере одна из генетических модификаций, описанных выше, включая модификации, полученные путем селекции мутантов, придает клеткам-хозяин способность к росту на L-арабинозе и необязательно ксилозе в качестве источника углерода,предпочтительно единственного источника углерода, предпочтительно в анаэробных условиях. Предпочтительно модифицированные клетки-хозяин практически не вырабатывают ксилитол, например ксилитол образуется на уровне ниже предела обнаружения или же составляет, к примеру, менее 5, 2, 1, 0,5,или 0,3% потребленного углерода в молях. Предпочтительно модифицированные клетки-хозяин обладают способностью к росту на Lарабинозе и необязательно ксилозе в качестве единственного источника углерода со скоростью по меньшей мере 0,001, 0,005, 0,01, 0,03, 0,05, 0,1, 0,2, 0,25 или 0,3 ч-1 в аэробных условиях либо, если это применимо, со скоростью по меньшей мере 0,001, 0,005, 0,01, 0,03, 0,05, 0,07, 0,08, 0,09, 0,1, 0,12, 0,15 или 0,2 ч-1 в анаэробных условиях. Предпочтительно модифицированные клетки-хозяин обладают способностью к росту на смеси глюкозы и L-арабинозы и необязательно ксилозы (в соотношении 1:1 по весу) в качестве единственного источника углерода со скоростью по меньшей мере 0,001, 0,005, 0,01, 0,03, 0,05, 0,1, 0,2,0,25 или 0,3 ч-1 в аэробных условиях либо, если это применимо, со скоростью по меньшей мере 0,001,0,005, 0,01, 0,03, 0,05, ОД, 0,12, 0,15 или 0,2 ч-1 в анаэробных условиях. Предпочтительно у модифицированных клеток-хозяин удельная скорость потребления L-арабинозы и необязательно ксилозы составляет по меньшей мере 346, 350, 400, 500, 600, 650, 700, 750, 800, 900 или 1000 мг/г клеток/ч. Предпочтительно у модифицированных клеток-хозяин выход продукта брожения(типа этанола) на L-арабинозе и необязательно ксилозе составляет по меньшей мере 20, 25, 30, 35, 40, 45,50, 55, 60, 70, 80, 85, 90, 95 или 98% от выхода продукта брожения (типа этанола) на глюкозе у клетокхозяин. Более предпочтительно у модифицированных клеток хозяина выход продукта брожения (типа этанола) на L-арабинозе и необязательно ксилозе равен выходу продукта брожения (типа этанола) на глюкозе у клеток-хозяин. Аналогичным образом, у модифицированных клеток-хозяин выход биомассы на L-арабинозе и необязательно ксилозе предпочтительно составляет по меньшей мере 55, 60, 70, 80, 85,90, 95 или 98% от выхода биомассы на глюкозе у клеток-хозяин. Более предпочтительно у модифицированных клеток-хозяин выход биомассы на L-арабинозе и необязательно ксилозе равен выходу биомассы на глюкозе у клеток-хозяин. Следует иметь в виду, что при сравнении выхода на глюкозе и на Lарабинозе и необязательно ксилозе сравнивают оба значения в аэробных условиях либо оба значения в анаэробных условиях. В более предпочтительном воплощении клетки-хозяин представляют собой клетки CBS 120328, депонированные в Институте CBS (Нидерланды) 27 сентября 2006 г., или клетки CBS 121879, депонированные в Институте CBS (Нидерланды) 20 сентября 2007 г. В предпочтительном воплощении клетки экспрессируют один или несколько ферментов, придающих клеткам способность к вырабатыванию по меньшей мере одного продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты,- 14016303 уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов. В более предпочтительном воплощении клетки-хозяин по изобретению представляют собой клеткихозяин для получения этанола. В другом предпочтительном воплощении изобретение касается трансформированных клеток-хозяин для получения других продуктов брожения, чем этанол. Такие неэтаноловые продукты брожения в принципе включают любые валовые или тонкие химические соединения,вырабатываемые такими эукариотическими микроорганизмами, как дрожжи или нитчатые грибы. К таким продуктам брожения относятся, например, молочная кислота, 3-гидроксипропионовая кислота, акриловая кислота, уксусная кислота, янтарная кислота, лимонная кислота, яблочная кислота, фумаровая кислота, аминокислоты, 1,3-пропандиол, этилен, глицерин, бутанол, -лактамовые антибиотики и цефалоспорины. Предпочтительными клетками-хозяин по изобретению для получения неэтаноловых продуктов брожения являются клетки, содержащие генетическую модификацию, вызывающую снижение активности алкогольдегидрогеназы. Способ. В следующем аспекте изобретение касается процессов брожения, при которых клетки-хозяин по изобретению используются для сбраживания источника углерода, включающего источник L-арабинозы и необязательно источник ксилозы. Предпочтительно источником L-арабинозы и источником ксилозы является L-арабиноза и ксилоза. Кроме того, источник углерода в среде брожения также может включать и источник глюкозы. Источником L-арабинозы, ксилозы или глюкозы может быть сама L-арабиноза, ксилоза или глюкоза либо какой-нибудь углеводный олиго- или полимер, содержащий звенья L-арабинозы,ксилозы или глюкозы, такой, к примеру, как лигноцеллюлоза, ксиланы, целлюлоза, крахмал, арабинан и др. Для высвобождения мономеров ксилозы или глюкозы из таких углеводов в среду брожения могут быть добавлены соответствующие карбогидразы (как ксиланазы, глюканазы, амилазы и т.п.) или же они могут вырабатываться модифицированными клетками-хозяин. В последнем случае модифицированные клетки-хозяин могут подвергаться генетической инженерии, чтобы они вырабатывали и выделяли такие карбогидразы. Дополнительное преимущество использования олиго- или полимерных источников глюкозы состоит в том, что оно позволяет поддерживать низкую концентрацию глюкозы во время брожения,например, используя лимитирующее скорость количество карбогидразы. В свою очередь это должно предотвратить репрессию систем, необходимых для метаболизма и транспорта таких неглюкозных сахаров, как ксилоза. В предпочтительном способе модифицированные клетки-хозяин сбраживают как Lарабинозу (необязательно ксилозу), так и глюкозу, предпочтительно одновременно, причем в этом случае предпочтительно используются модифицированные клетки-хозяин, не чувствительные к репрессии глюкозой, чтобы предотвратить диауксический рост. Наряду с источником L-арабинозы, необязательно ксилозы (и глюкозы) как источника углерода, среда брожения должна дополнительно содержать надлежащие ингредиенты, необходимые для роста модифицированных клеток-хозяин. Составы сред брожения для выращивания таких микроорганизмов, как дрожжи или нитчатые грибы, хорошо известны в этой области. В предпочтительном способе предусматривается способ получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов, при этом способ включает стадии:(a) сбраживания среды, содержащей источник L-арабинозы и необязательно ксилозы, с помощью модифицированных клеток-хозяин, как определено в настоящем изобретении, при этом клетки-хозяин сбраживают L-арабинозу и необязательно ксилозу до этого продукта брожения, и необязательно(b) извлечения продукта брожения. Процесс брожения является способом получения продуктов брожения, таких, например, как этанол,молочная кислота, 3-гидроксипропионовая кислота, акриловая кислота, уксусная кислота, янтарная кислота, лимонная кислота, яблочная кислота, фумаровая кислота, аминокислоты, 1,3-пропандиол, этилен,глицерин, бутанол, -лактамовые антибиотики типа пенициллина G или пенициллина V и их ферментативные производные и/или цефалоспорины. Процесс брожения может быть аэробным или анаэробным процессом. Анаэробный процесс брожения определяется в настоящем изобретении как такой процесс брожения, который протекает в отсутствие кислорода или в котором кислород практически не расходуется, предпочтительно расходуется менее 5, 2,5 или 1 ммоль/л/ч, более предпочтительно расходуется 0 ммоль/л/ч (т.е. потребление кислорода не обнаруживается), и при этом и донорами электронов, и акцепторами электронов служат органические молекулы. В отсутствие кислорода вырабатываемый при гликолизе и образовании биомассы NADH не может подвергаться окислению посредством окислительного фосфорилирования. Чтобы решить эту проблему, многие микроорганизмы в качестве акцептора электронов и водорода используют пируват или одно из его производных и при этом регенерируют NAD+. Так, в предпочтительном способе анаэробного брожения в качестве акцептора электронов (и водорода) используется пируват, который восстанавливается до таких продуктов брожения, как этанол, молочная кислота,- 15016303 3-гидроксипропионовая кислота, акриловая кислота, уксусная кислота, янтарная кислота, лимонная кислота, яблочная кислота, фумаровая кислота, аминокислоты, 1,3-пропандиол, этилен, глицерин, бутанол,-лактамовые антибиотики и цефалоспорины. В предпочтительном воплощении процесс брожения является анаэробным. Анаэробный способ является выгодным, так как он дешевле, чем аэробные способы: требуется меньше специального оборудования. Кроме того, анаэробные способы должны давать больший выход продукта, чем аэробные способы. В аэробных условиях обычно бывает больший выход биомассы, чем в анаэробных условиях. Вследствие этого в аэробных условиях ожидаемый выход продукта обычно бывает ниже, чем в анаэробных условиях. Согласно авторам изобретения способ изобретения является первым анаэробным процессом брожения с использованием среды, содержащей источник Lарабинозы, который был разработан до сих пор. В другом предпочтительном воплощении процесс брожения протекает в условиях ограничения кислорода. Более предпочтительно процесс брожения является аэробным и протекает в условиях ограничения кислорода. Процесс брожения с ограничением кислорода - это такой процесс, в котором потребление кислорода ограничено переносом кислорода из газа в жидкость. Степень ограничения кислорода определяется количеством и составом поступающего потока газа, а также фактическими свойствами перемешивания и массообмена используемого ферментационного оборудования. Предпочтительно в процессе с ограничением кислорода скорость потребления кислорода составляет по меньшей мере 5,5, более предпочтительно по меньшей мере 6 и еще более предпочтительно по меньшей мере 7 ммоль/л/ч. Процесс брожения предпочтительно протекает при температуре, оптимальной для модифицированных клеток. Так, для большинства дрожжевых и грибковых клеток процесс брожения проводится при температуре менее 42 С, предпочтительно менее 38 С. Для клеток-хозяин из дрожжей или нитчатых грибов процесс брожения предпочтительно проводится при температуре менее 35, 33, 30 или 28 С и более 20, 22 или 25 С. Предпочтительным способом является способ получения этанола, при этом способ включает стадии: (а) сбраживания среды, содержащей источник L-арабинозы и необязательно ксилозы, с помощью модифицированных клеток-хозяин, как определено в настоящем изобретении, при этом клетки-хозяин сбраживают L-арабинозу и необязательно ксилозу до этанола, и необязательно (b) извлечения этанола. Среда брожения также может включать источник глюкозы, которая тоже сбраживается до этанола. В предпочтительном воплощении процесс брожения для получения этанола является анаэробным. Анаэробность уже была определена выше. В другом предпочтительном воплощении процесс брожения для получения этанола является аэробным. В следующем предпочтительном воплощении процесс брожения для получения этанола протекает в условиях ограничения кислорода, более предпочтительно он является аэробным и протекает в условиях ограничения кислорода. Условиях ограничения кислорода уже были определены выше. В способе объемная продукция этанола предпочтительно составляет по меньшей мере 0,5, 1,0, 1,5,2,0, 2,5, 3,0, 5,0 или 10,0 г этанола на л/ч. Выход этанола на L-арабинозе и необязательно ксилозе и/или глюкозе в способе предпочтительно составляет по меньшей мере 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90,95 или 98%. Выход этанола при этом определяется как процент от теоретически максимального выхода,который для глюкозы, L-арабинозы и необязательно ксилозы составляет 0,51 г этанола на 1 г глюкозы или ксилозы. В другом предпочтительном воплощении изобретение касается способа получения продукта брожения, выбранного из группы, состоящей из молочной кислоты, 3-гидроксипропионовой кислоты,акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов. Способ предпочтительно включает стадии: (а) сбраживания среды, содержащей источник L-арабинозы и необязательно ксилозы, с помощью модифицированных клеток-хозяин, как определено выше в настоящем изобретении, при этом клетки-хозяин сбраживают L-арабинозу и необязательно ксилозу до продукта брожения, и необязательно (b) извлечения продукта брожения. В предпочтительном способе среда также содержит источник глюкозы. В способе брожения по изобретению, ведущем к получению этанола, можно отметить некоторые преимущества в сравнении с известными способами спиртового брожения: возможны анаэробные процессы,также возможны условия ограничения кислорода,можно получить больший выход этанола и большую скорость продукции этанола,используемый штамм способен утилизировать L-арабинозу и необязательно ксилозу. В качестве альтернативы способам брожения, описанным выше, предлагается и другой способ брожения в качестве дополнительного аспекта изобретения, в котором используются по меньшей мере две разновидности клеток для сбраживания источника углерода, содержащего по меньшей мере два источника углерода, выбранные из группы, состоящей из источника L-арабинозы, источника ксилозы и источника глюкозы. В этом способе брожения "по меньшей мере две разновидности клеток" означают то, что этот способ предпочтительно является способом совместного брожения. В одном предпочтительном воплощении используются две разновидности клеток: одна представляет собой клетки изобретения, как- 16016303 определено выше, обладающие способностью к утилизации L-арабинозы и/или к превращению е в Lрибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения типа этанола и необязательно способностью к утилизации ксилозы, а другая, к примеру, представляет собой штамм, обладающий способностью к утилизации ксилозы и/или к превращению е в желательный продукт брожения типа этанола, как описано в WO 03/062430 и/или WO 06/009434. Клетки, обладающие способностью к утилизации ксилозы, предпочтительно представляют собой штамм, проявляющий способность к прямой изомеризации ксилозы в ксилулозу (в одну стадию), как определено выше. Эти два разных штамма предпочтительно культивируют в присутствии источника L-арабинозы, источника ксилозы и необязательно источника глюкозы. Три разновидности клеток или больше можно культивировать совместно и/или использовать три или больше источников углерода при условии, что по крайней мере одна разновидность клеток способна утилизировать хотя бы один из имеющихся источников углерода и/или превращать его в желательный продукт брожения типа этанола. Выражение "утилизировать хотя бы один источник углерода" имеет то же самое значение, что и выражение "утилизировать L-арабинозу". Выражение "превращать его (т.е. источник углерода) в желательный продукт брожения " имеет то же самое значение, что и выражение "превращать L-арабинозу в желательный продукт брожения". В предпочтительном воплощении изобретение касается способа получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов, при этом способ включает стадии:(a) сбраживания среды, содержащей, по меньшей мере, источник L-арабинозы и источник ксилозы,с помощью клеток по изобретению, как определено ранее в настоящем изобретении, и клеток, обладающих способностью к утилизации ксилозы и/или проявляющих способность к прямой изомеризации ксилозы в ксилулозу, при этом каждые клетки сбраживают L-арабинозу и/или ксилозу до этого продукта брожения, и необязательно(b) извлечения продукта брожения. Все предпочтительные воплощения способов брожения, описанные выше, также являются предпочтительными воплощениями этих дополнительных способов брожения: идентичность продукта брожения,идентичность источника L-арабинозы и источника ксилозы, условия брожения (аэробные или анаэробные условия, условия ограничения кислорода, температура, при которой проводится процесс, продукция этанола, выход этанола). Генетические модификации Для суперэкспрессии ферментов в клетках-хозяин по изобретению, как описано выше, а также для дополнительной генетической модификации клеток-хозяин, предпочтительно дрожжей, клетки подвергают трансформации различными нуклеиновыми конструкциями по изобретению методами, хорошо известными в этой области. Такие методы известны, например, из стандартных пособий, таких как Sambrook and Russel (2001) "Molecular Cloning: A Laboratory Manual" (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press или F. Ausubel et al., eds., "Current Protocols in Molecular Biology", Green Publishing and Wiley Interscience, New York (1987). Методы трансформации и генетической модификации грибковых клеток-хозяин известны, например, из ЕР-А-0635574, WO 98/46772, WO 99/60102 и WO 00/37671. Промоторы для нуклеиновых конструкций, предназначенных для суперэкспрессии ферментов в клетках-хозяин по изобретению, уже были описаны выше. В нуклеиновых конструкциях для суперэкспрессии 3'-конец нуклеотидной последовательности, кодирующей фермент, предпочтительно функционально связан с последовательностью терминатора транскрипции. Предпочтительно последовательность терминатора работает в выбранных клетках-хозяин, таких, к примеру, как выбранный вид дрожжей. В любом случае выбор терминатора не является критическим, например, он может происходить из дрожжевого гена, хотя иногда хорошо работают и терминаторы из недрожжевых эукариотических генов. Последовательность терминатора транскрипции предпочтительно дополнительно содержит сигнал полиаденилирования. Предпочтительными последовательностями терминаторов являются терминатор алкогольдегидрогеназы (ADH1) и терминатор PGI1. Более предпочтительно терминаторы ADH1 и PGI1 оба происходят из S. cerevisiae (SEQ ID NO: 50 и SEQ ID NO: 53 соответственно). Необязательно в нуклеиновой конструкции может находиться селекционный маркер. В настоящем изобретении термин "маркер" относится к гену, кодирующему признак или фенотип, позволяющий проводить селекцию или скрининг клеток-хозяин, содержащих маркер. Геном-маркером может являться ген устойчивости к антибиотику, при этом соответствующий антибиотик может использоваться для отбора трансформированных клеток из не прошедших трансформацию клеток. Однако предпочтительно используются не маркеры устойчивости к антибиотикам, а другие, к примеру, маркеры ауксотрофности (URA3,TRP1, LEU2). В предпочтительном воплощении клетки-хозяин, трансформированные нуклеиновыми конструкциями, лишены генов-маркеров. Методы конструирования микробных клеток-хозяин, лишенных рекомбинантных генов-маркеров, раскрыты в ЕР-А-0635574 на основе применения двунаправленных маркеров. В качестве альтернативы в нуклеиновые конструкции по изобретению может быть введен- 17016303 такой селекционный маркер, как зеленый флуоресцентный белок, lacZ, люцифераза, хлорамфениколацетилтрансфераза, -глюкуронидаза, что позволит проводить скрининг трансформированных клеток. Необязательные дополнительные элементы, которые могут находиться в нуклеиновых конструкциях по изобретению, включают, без ограничения, одну или несколько последовательностей лидеров, энхансеров, факторов интеграции и/или генов-репортеров, последовательностей интронов, центромеров,теломеров и/или последовательностей прикрепления к матриксу (MAR). Нуклеиновые конструкции по изобретению могут дополнительно содержать последовательность для автономной репликации, как последовательность ARS. Подходящие эписомные нуклеиновые конструкции могут основываться, к примеру, на дрожжевых плазмидах 2 или pKD1 (Fleer et al., 1991, Biotechnology 9: 968-975). С другой стороны, нуклеиновая конструкция может содержать последовательности для встраивания предпочтительно путем гомологической рекомбинации. При этом такие последовательности могут быть гомологичны намеченному для встраивания сайту в геноме клеток-хозяин. Нуклеиновые конструкции по изобретению могут быть получены каким-нибудь известным способом, что обычно включает такие методы, как разрезание (рестрикция) и соединение (лигирование) нуклеиновых кислот/последовательностей, за которыми отсылаем к стандартным пособиям, таким как Sambrook and Russel (2001) "Molecular Cloning: A Laboratory Manual" (3rd edition), Cold Spring Harbor Laboratory, Cold Spring Harbor Laboratory Press. Методы инактивации и разрушения генов у дрожжей или грибов хорошо известны в этой области(например, см. Fincham, 1989, Microbiol Rev. 53(1): 148-70; и EP-A-0635574). В настоящем документе и его формуле изобретения глагол "включать" и его формы спряжения применяются в неограничительном смысле, означая то, что включаются следующие за ним предметы, но не исключаются предметы, не отмеченные специально. Кроме того, указание элемента в единственном числе не исключает возможности того, что присутствует больше, чем один элемент, если только по контексту не требуется четко, чтобы был один и только один такой элемент. Так что единственное число обычно означает "по меньшей мере одно". Примеры Конструирование плазмид и штаммов Штаммы Утилизирующий L-арабинозу штамм Saccharomyces cerevisiae, описанный в данной работе, основан на штамме RWB220, который сам является производным RWB217. Штамм RWB217 представляет собойCEN.PK, у которого подвергнуты суперэкспрессии 4 гена, кодирующие ферменты пентозофосфатного пути: TAL1, TKL1, RPE1, RKI1 (Kuyper et al., 2005a). Кроме того, был удален ген, кодирующий альдозоредуктазу (GRE3). Штамм RWB217 также содержит две плазмиды: плазмиду в одной копии с маркеромLEU2 для суперэкспрессии ксилулокиназы (XKS1) и эписомную плазмиду в нескольких копиях с маркером URA3 для экспрессии ксилозоизомеразы XylA. Штамм RWB217 подвергали процедуре селекции для улучшения роста на ксилозе, которая описана в Kuyper et al. (2005b). Процедура привела к получению двух чистых штаммов, RWB218 (Kuyper et al., 2005b) и RWB219. Различие между RWB218 и RWB219 состоит в том, что после процедуры селекции RWB218 был получен при посеве и пересеве штрихом на минеральной среде с глюкозой в качестве источника углерода, тогда как для RWB219 использовалась ксилоза. Штамм RWB219 культивировали неизбирательно на среде YP с глюкозой (YPD) в качестве источника углерода, что способствует потере обеих плазмид. После посева на YPD одиночные колонии тестировали на потерю плазмид, проверяя их на ауксотрофность по урацилу и лейцину. Штамм, потерявший обе плазмиды, подвергали трансформации с помощью pSH47, содержащей рекомбиназу cre, чтобы удалить кассету KanMX (Guldener et al., 1996), которая все еще находилась там после встраивания суперэкспрессирующей конструкции RKI1. Колонии с плазмидой ресуспендировали в среде с дрожжевым пептоном (YP) (10 г/л дрожжевого экстракта и 20 г/л пептона, оба фирмы BD Difco, Бельгия) с 1% галактозы и инкубировали 1 ч при 30 С. Около 200 клеток высеивали на YPD. Образовавшиеся колонии проверяли на потерю маркера KanMX (устойчивости к G418) и pSH47 (URA3). Штамм, потерявший и маркерKanMX, и плазмиду pSH47, назвали RWB220. Для получения штамма, тестируемого в этом патенте,RWB220 подвергали трансформации с помощью pRW231 и pRW243 (табл. 2), получая штамм IMS0001. Во время конструирования штаммы содержали на комплексной среде YP: 10 гл-1 дрожжевого экстракта (BD Difco), 20 гл-1 пептона (BD Difco), либо на синтетической среде (MY) (Verduyn et al., 1992) с добавлением глюкозы (2%) в качестве источника углерода (YPD или MYD) и 1,5% агара в случае чашек. После трансформации плазмидами штаммы высевали на MYD. Трансформацию дрожжей проводили согласно Gietz and Woods (2002). Плазмиды подвергали амплификации в штамме Escherichia coli XL-1blue (Stratagene, La Jolla, CA, USA). Трансформацию проводили согласно Inoue et al. (1990). Клетки E.coli культивировали на чашках со средой LB (Luria-Bertani) или в жидкой среде ТВ (Terrific Broth) для выделения плазмид (Sambrook et al., 1989). Плазмиды Для того чтобы расти на L-арабинозе, дрожжи должны экспрессировать три разных гена: Lарабинозоизомеразы (AraA), L-рибулокиназы (AraB) и L-рибулозо-5-Р-4-эпимеразы (AraD) (Becker andBoles, 2003). В настоящей работе было решено экспрессировать AraA, AraB и AraD из молочнокислой бактерии Lactobacillus plantaram в S. cerevisiae. Поскольку конечной целью является утилизация Lарабинозы в сочетании с другими сахарами типа D-ксилозы, то гены, кодирующие бактериальный Lарабинозный путь, комбинировали на одной и той же плазмиде с генами, кодирующими утилизацию Dксилозы. Для того чтобы достичь высокого уровня экспрессии, гены araA и araD из L. plantarum лигировали в плазмиду pAKX002, т.е. плазмиду 2, несущую XylA. Кассету AraA конструировали путем амплификации укороченного варианта промотора TDH3 с помощью олигонуклеотидов SpeI-5'Ptdh3 и 5'AraA-Ptdh3 (SEQ ID NO: 49), гена AraA с помощью Ptdh5'AraA и Tadh-3'AraA и терминатора ADH1 (SEQ ID NO:50) с помощью 3'AraA-Tadh1 и 3'Tadh1-SpeI. Все три фрагмента экстрагировали из геля и смешивали примерно в эквимолярных количествах. На этой смеси проводили ПЦР с помощью олигонуклеотидов SpeI-5'Ptdh3 и 3'Tadhl-SpeI. Полученную кассету Ptdh3-AraA-TADH1 очищали в геле, расщепляли по 5'- и 3'-сайтам SpeI, а затем лигировали в pAKX002, расщепленную с помощью NheI, получая плазмиду pRW230. Конструкцию AraA получали прежде всего путем амплификации укороченного варианта промотора НХТ 7 (SEQ ID NO: 52) с помощью олигонуклеотидов SalI-5'Phxt7 и 5'AraD-Phxt, гена AraD с помощьюPhxt-5'AraD и Tpgi-3'AraD и области терминатора GPI1 (SEQ ID NO: 53) с помощью олигонуклеотидов 3'AraD-Tpgi и 3'Tpgi-SalI. Полученные фрагменты экстрагировали из геля и смешивали примерно в эквимолярных количествах, после чего проводили ПЦР с помощью олигонуклеотидов SalI-5'Phxt7 и 3'Tpgil-SalI. Полученную кассету PHXT7-AraO-TPGI1 очищали в геле, расщепляли по 5'- и 3'-сайтам SpeI, а затем лигировали в pRW230, расщепленную с помощью XhoI, получая плазмиду pRW231 (фиг. 1). Поскольку слишком высокая экспрессия L-рибулокиназы вредна для роста (Becker and Boles, 2003),ген AraB комбинировали с геном XKS1, кодирующим ксилулокиназу, на встраивающейся плазмиде. Для этого p415ADHXKS (Kuyper et al., 2005a) сначала превращали в pRW229, расщепляя p415ADHXKS иpRS305 с помощью PvuI и лигируя содержащий ADHXKS PvuI-фрагмент из p415ADHXKS на остов вектора из pRS305, получая pRW229. Кассету, содержащую ген AraB из L. plantarum между промотором PGI1 (SEQ ID NO: 51) и терминатором ADH1 (SEQ ID NO: 50), получали путем амплификации промотора PGI1 с помощью олигонуклеотидов SacI-5'Ppgil и 5'AraB-Ppgil, гена AraB с помощью олигонуклеотидов Ppgi-5'AraB и Tadh-3'AraB и терминатора ADH1 с помощью олигонуклеотидов 3'AraB-TadhI и 3'TadhI-SacI. Все три фрагмента экстрагировали из геля и смешивали примерно в эквимолярных количествах. На этой смеси проводили ПЦР с помощью олигонуклеотидов SacI-5'Ppgil и 3'Tadhl-SacI. Полученную кассету PPGI1-AraB-TADH1 очищали в геле, расщепляли по 5'- и 3'-сайтам SacI, а затем лигировали в pRW229, расщепленную с помощью Sad,получая плазмиду pRW243 (фиг. 1). Штамм RWB220 трансформировали плазмидами pRW231 и pRW243 (табл. 2), получая штаммIMS0001. Рестрикционные эндонуклеазы (New England Biolabs, Beverly, MA, США и Roche, Basel, Швейцария) и ДНК-лигазу (Roche) использовали в соответствии с инструкциями изготовителей. Выделение плазмид из Е. coli осуществляли с помощью набора Qiaprep spin miniprep kit (Qiagen, Hilden, Германия). Фрагменты ДНК разделяли на 1% агарозном (Sigma, St. Louis, МО, США) геле в 1TBE (Sambrook et al.,1989). Выделение фрагментов из геля проводили с помощью набора Qiaquick gel extraction kit (Quiagen). Амплификацию (элементов из) кассет AraA, AraB и AraD осуществляли с помощью ДНК-полимеразыVentR (New England Biolabs) в соответствии с инструкцией изготовителя. Матрицей служила хромосомная ДНК S. cerevisiae CEN.PK113-7D для промоторов и терминаторов или Lactobacillus plantarumDSM20205 для генов Ага. Полимеразные цепные реакции (ПЦР) проводили на термоциклизаторе Biometra TGradient Thermocycler (Biometra, Gottingen, Германия) при следующих параметрах: 30 циклов отжига по 1 мин при 55, 60 или 65 С, наращивание от 1 до 3 мин при 75 С в зависимости от ожидаемого размера фрагмента и денатурирование 1 мин при 94 С. Культивирование и среды Культивирование в качалочных колбах проводили при 30 С в синтетической среде (Verduyn et al.,1992). Среду доводили до рН 6,0 с помощью 2 М KOH перед стерилизацией. Для получения твердой синтетической среды добавляли 1,5% агара. Готовили предварительные культуры, инокулируя 100 мл среды, содержащей соответствующий сахар в колбе на 500 мл, порцией замороженной культуры. После инкубации при 30 С на круговой качалке(200 об/мин) эти культуры использовали для инокуляции культур в качалочных колбах или в ферментере. В синтетическую среду для анаэробного культивирования добавляли 0,01 гл-1 эргостерина и 0,42 гл-1Tween 80, растворенного в этаноле (Andreasen and Stier, 1953; Andreasen and Stier, 1954). Анаэробное периодическое культивирование проводили при 30 С в лабораторных ферментерах на 2 л (Applikon,Schiedam, Нидерланды) с рабочим объемом в 1 л. Значения рН в культурах поддерживали при рН 5,0 автоматическим добавлением 2 М KOH. Культуры перемешивали при 800 об/мин и пропускали 0,5 лмин-1 газообразного азота (10 ppm кислорода). Чтобы свести к минимуму диффузию кислорода, ферментеры- 19016303 были оснащены трубками из Norprene (Cole Palmer Instrument Company, Vernon Hills, США). Растворенный кислород регистрировали с помощью кислородного электрода (Applisens, Schiedam, Нидерланды). Условия ограничения кислорода достигались в той же экспериментальной обстановке подачей воздуха в свободное пространство приблизительно 0,05 лмин-1. Определение сухого веса Образцы культур (10,0 мл) фильтровали через предварительно взвешенные нитроцеллюлозные фильтры (размер пор 0,45 мкм; Gelman Laboratory, Ann Arbor, США). После удаления среды фильтры промывали деминерализованной водой и высушивали в микроволновой печи (Bosch, Stuttgart, Германия) в течение 20 мин при 360 W, а затем взвешивали. Двойные пробы отличались менее чем на 1%. Анализ газов Выделяемый газ охлаждали в газоохладителе (2 С) и сушили с помощью сушилки Permapure типаMD-110-48P-4 (Permapure, Toms River, США). Концентрации О 2 и СО 2 определяли с помощью анализатора NGA 2000 (Rosemount Analytical, Orrville, США). Скорость выделения газа и удельные скорости потребления кислорода и образования углекислого газа определяли, как описано ранее (Van Urk et al.,1988; Weusthuis et al., 1994). При вычислении этих приведенных к биомассе показателей учитывали изменения объема, вызванные взятием образцов культур. Анализ метаболитов Глюкозу, ксилозу, арабинозу, ксилитол, органические кислоты, глицерин и этанол определяли методом HPLC на установке для HPLC Waters Alliance 2690 (Waters, Milford, США), снабженной колонкой НРХ 87 Н (BioRad, Hercules, США), детектором показателя преломления Waters 2410 и УФ-детекторомWaters 2487. Колонку элюировали при 60 С с помощью 0,5 гл-1 серной кислоты со скоростью потока 0,6 млмин-1. Определение ксилулозо-5-фосфата (Zaldivar J. et al., Appl. Microbiol. Biotechnol. (2002), 59: 436-442). Для анализа таких внутриклеточных метаболитов, как ксилулозо-5-фосфат, из реактора отбирали 5 мл среды в двух пробах, до истощения глюкозы (через 22 и 26 ч культивирования) и после истощения глюкозы (через 42, 79 и 131 ч культивирования). Методики остановки метаболизма, твердофазной экстракции метаболитов и анализа были описаны подробно в Smits H.P. et al., Anal. Biochem., 261: 36-42(1998). Однако метод ионообменной хроматографии высокого давления в сочетании с импульсным амперометрическим детектированием, используемый для анализа клеточных экстрактов, был слегка модифицирован. Используемые растворы: элюент А - 75 мМ NaOH, элюент В - 500 мМ NaAc. Чтобы предотвратить загрязнение растворов элюентов карбонатом, вместо гранул NaOH использовали 50% растворNaOH с низкой концентрацией карбоната (Baker Analysed, Deventer, Нидерланды). Элюенты дегазировали гелием (Не) в течение 30 мин, а затем хранили в атмосфере Не. Градиентный насос программировали на создание следующих градиентов: 100% А и 0% В (0 мин), линейное уменьшение А до 70% и линейное возрастание В до 30% (0-30 мин), линейное уменьшение А до 30% и линейное возрастание В до 70% (3070 мин), линейное уменьшение А до 0% и линейное возрастание В до 100% (70-75 мин), 0% А и 100% В(75-85 мин), линейное возрастание А до 100% и линейное уменьшение В до 0% (85-95 мин). Подвижную фазу пропускали со скоростью потока 1 мл/мин. Другие условия были согласно Smits et al. (1998). Выход углерода Выход углерода рассчитывали как количество углерода в образовавшихся продуктах, деленное на общее количество израсходованного углерода сахаров, исходя из содержания углерода в биомассе в 48%. Для поправки на испарение этанола во время ферментации количество образовавшегося этанола принимали равным измеренной кумулятивной продукции СО 2 за вычетом продукции, обусловленной синтезом биомассы (5,85 ммоль СО 2 на г биомассы (Verduyn et al., 1990, и СО 2, связанного с образованием ацетата. Селекция на рост на L-арабинозе Штамм IMS0001 (CBS 120327, депонированный в CBS от 27/09/06), содержащий гены, кодирующие метаболические пути ксилозы (XylA and XKS1) и арабинозы (AraA, AraB, AraD), конструировали по методике, описанной выше. Штамм IMS0001, хотя он и способен расти на ксилозе (данные не приводятся),по-видимому, не способен расти на твердой синтетической среде с добавлением 2% L-арабинозы. Мутантов IMS0001, способных утилизировать L-арабинозу в качестве источника углерода для роста, отбирали методом серийного пересева в качалочных колбах и периодического культивирования в ферментерах (SBR). Для экспериментов по серийному пересеву качалочные колбы на 500 мл, содержащие 100 мл синтетической среды, содержащей 0,5% галактозы, инокулировали штаммом IMS0001 или контрольным штаммом RWB219. Через 72 ч при оптической плотности 3,0 при 660 нм эти культуры использовали для инокуляции новых качалочных колб, содержащих 0,1% галактозы и 2% арабинозы. На основании определения методом HPLC с D-рибулозой в качестве калибровочного стандарта было установлено, что уже при первом культивировании штамма IMS0001 на среде, содержащей смесь галактозы и арабинозы,часть арабинозы превращалась в рибулозу и впоследствии выделялась в супернатант. Эти анализы выполнялись на установке для HPLC Waters Alliance 2690 (Waters, Milford, США), снабженной колонкойBioRad HPX 87H (BioRad, Hercules, США), детектором показателя преломления Waters 2410 и УФдетектором Waters 2487. Колонку элюировали при 60 С с помощью 0,5 гл-1 серной кислоты со скоростью потока 0,6 млмин-1. В отличие от контрольного штамма RWB219 в культуре штамма IMS0001 значение OD660 возрастало после истощения галактозы. Когда примерно после 850 ч у штамма IMS0001 был отмечен рост на арабинозе (фиг. 2), эту культуру пересеяли при OD660 = 1,7 в качалочную колбу, содержащую 2% арабинозы. Затем культуры при OD660 = 2-3 опять последовательно пересеивали в свежую среду, содержащую 2% арабинозы. Утилизация арабинозы подтвердилась при измерении время от времени концентрации арабинозы методом HPLC (данные не приводятся). Скорость роста этих культур возросла от 0 до 0,15 ч-1 примерно за 3600 ч (фиг. 3). Периодическую ферментацию в условиях ограничения кислорода запускали путем инокуляции 1 л синтетической среды с добавлением 2% арабинозы с помощью 100 мл из качалочной колбы культуры выращенных на арабинозе клеток IMS0001 с максимальной скоростью роста на 2% L-арабинозе приблизительно в 0,12 ч-1. Когда отмечался рост на арабинозе, культуру подвергали анаэробным условиям путем пропускания газообразного азота. Последовательные циклы анаэробного периодического культивирования запускали, заменяя вручную или автоматически 90% культуры синтетической средой с 20 гл-1 арабинозы. Для каждого цикла во время SBR-ферментации оценивали экспоненциальную скорость роста из профиля СО 2 (фиг. 4). За 13 циклов экспоненциальная скорость роста возрастала с 0,025 до 0,08 ч-1. Через 20 циклов брали образец и делали высев на твердую синтетическую среду с добавлением 2% Lарабинозы и инкубировали при 30 С в течение нескольких дней. Отдельные колонии дважды пересеивали штрихом на твердую синтетическую среду с 2% L-арабинозы. Наконец, одиночной колонией инокулировали качалочную колбу, содержащую синтетическую среду с 2% L-арабинозы, и инкубировали 5 дней при 30 С. Эту культуру обозначили как штамм IMS0002 (CBS 120328, депонирован в Центральном Бюро плесневых культур (CBS) от 27/09/06. Отбирали образцы культур, добавляли 30% глицерина и хранили образцы при -80 С. Ферментация смешанных культур Гидролизаты биомассы, желательное сырье для промышленной биотехнологии, содержат сложные смеси, состоящие из различных сахаров, среди которых глюкоза, ксилоза и арабиноза обычно составляют значительную часть. Для осуществления спиртового брожения не только глюкозы и арабинозы, но также и ксилозы проводили анаэробную порционную ферментацию смешанной культуры сбраживающего арабинозу штамма IMS0002 и сбраживающего ксилозу штамма RWB218. Анаэробный ферментер периодического действия, содержащий 800 мл синтетической среды с добавлением 30 гл-1 D-глюкозы, 15 гл-1 D-ксилозы и 15 гл-1 L-арабинозы, инокулировали с помощью 100 мл предварительной культуры штамма IMS0002. Через 10 ч добавляли 100 мл инокулята RWB218. В отличие от сбраживания смеси сахаров одним только штаммом IMS0002 после истощения глюкозы происходила утилизация и ксилозы,и арабинозы (фиг. 5D). Смешанная культура полностью утилизировала все сахара, и за 80 ч образовалось 564,06,3 ммольл-1 этанола (рассчитывали по продукции СО 2) с высоким общим выходом в 0,42 гг-1 сахара. Ксилитол образовывался лишь в небольшом количестве, до концентрации в 4,7 ммольл-1. Характеристика штамма IMS0002 Определяли рост и образование продуктов у штамма IMS0002 при анаэробной периодической ферментации на синтетической среде либо с L-арабинозой в качестве единственного источника углерода,либо со смесью глюкозы, ксилозы и L-арабинозы. Предварительные культуры для этих анаэробных ферментации готовили в качалочных колбах, содержащих 100 мл синтетической среды с 2% L-арабинозы,инокулируя их замороженными при -80 С образцами штамма IMS0002 и инкубируя 48 ч при 30 С. Из фиг. 5 А видно, что штамм IMS0002 способен сбраживать 20 гл-1 L-арабинозы до этанола при анаэробной периодической ферментации примерно за 70 ч. Удельная скорость роста в анаэробных условиях с L-арабинозой в качестве единственного источника углерода составила 0,050,001 ч-1. С учетом испарения этанола во время периодической ферментации выход этанола из 20 гл-1 L-арабинозы составил 0,430,003 гг-1. Без поправки на испарение выход этанола составил 0,350,01 гг-1 арабинозы. При анаэробном росте на арабинозе не наблюдалось образования арабинитола. На фиг. 5 В представлено спиртовое брожение смеси из 20 гл-1 глюкозы и 20 гл-1 L-арабинозы штаммом IMS0002. Утилизация L-арабинозы начиналась после истощения глюкозы. За 70 ч и глюкоза, иL-арабиноза были полностью израсходованы. Выход этанола из общего количества сахаров составил 0,420,003 гг-1. На фиг. 5 С представлен профиль брожения смеси из 30 гл-1 глюкозы, 15 гл-1 D-ксилозы и 15 гл-1L-арабинозы штаммом IMS0002. Утилизация арабинозы начиналась после истощения глюкозы. За 80 ч и глюкоза, и арабиноза были полностью израсходованы. Из 100 мМ ксилозы только 20 мМ было израсходовано штаммом IMS0002. Кроме того, наблюдалось образование 20 мМ ксилитола. Очевидно, штаммIMS0002 превращал ксилозу в ксилитол. Поэтому выход этанола из общего количества сахаров был ниже, чем при описанных выше условиях брожения: 0,380,001 гг-1. Выход этанола из общего количества глюкозы и арабинозы был близок к другим условиям брожения: 0,430,001 гг-1. В табл. 1 представлены скорости потребления арабинозы и скорости образования этанола, наблю- 21016303 давшиеся при анаэробной периодической ферментации штамма IMS0002. Скорость потребления арабинозы составляла 0,23-0,75 гч-1 г-1 сухого веса биомассы. Скорость образования этанола из арабинозы составляла 0,08-0,31 гч-1 г-1 сухого веса биомассы. Изначально сконструированный штамм IMS0001 обладал способностью к сбраживанию ксилозы(данные не приводятся). В противоположность нашим ожиданиям, отобранный штамм IMS0002 оказался неспособным сбраживать ксилозу до этанола (фиг. 5 С). Чтобы восстановить способность к сбраживанию ксилозы, одну колонию штамма IMS0002 переносили на твердую синтетическую среду с 2% D-ксилозы и инкубировали в анаэробной банке при 30 С в течение 25 дней. После этого одну колонию переносили опять на твердую синтетическую среду с 2% арабинозы. После 4 дней инкубации при 30 С одну колонию переносили в качалочную колбу, содержащую синтетическую среду с 2% арабинозы. После инкубации при 30 С в течение 6 дней отбирали образцы, добавляли 30% глицерина и хранили при -80 С. Таким замороженным образцом инокулировали качалочную колбу, содержащую 100 мл синтетической среды с 2% арабинозой, и использовали в качестве предварительной культуры для анаэробной периодической ферментации в синтетической среде с 20 гл-1 D-ксилозы и 20 гл-1 L-арабинозы. На фиг. 6 представлен профиль брожения этой ферментации. Ксилоза и арабиноза утилизировались одновременно. Арабиноза закончилась через 70 ч, а ксилоза была полностью израсходована за 120 ч. Образовалось как минимум 250 мМ этанола из общего количества сахаров без учета испарения этанола. Принимая конечный сухой вес биомассы в 3,2 гл-1 (принимая выход биомассы равным 0,08 гг-1 сахара), конечная концентрация этанола по оценке из кумулятивной продукции СО 2 (355 ммольл-1) составила примерно 330 ммольл-1,что соответствует выходу этанола в 0,41 гг-1 сахара пентоз. Наряду с этанолом, глицерином и органическими кислотами образовалось небольшое количество ксилитола (приблизительно 5 мМ). Селекция штамма IMS0003 Изначально сконструированный штамм IMS0001 обладал способностью к сбраживанию ксилозы(данные не приводятся). В противоположность нашим ожиданиям отобранный штамм IMS0002 оказался неспособным сбраживать ксилозу до этанола (фиг. 5 С). Чтобы восстановить способность к сбраживанию ксилозы, одну колонию штамма IMS0002 переносили на твердую синтетическую среду с 2% D-ксилозы и инкубировали в анаэробной банке при 30 С в течение 25 дней. После этого одну колонию переносили опять на твердую синтетическую среду с 2% арабинозы. После 4 дней инкубации при 30 С одну колонию переносили в качалочную колбу, содержащую синтетическую среду с 2% арабинозы. После инкубации при 30 С в течение 6 дней отбирали образцы, добавляли 30% глицерина и хранили при -80 С. Порции из этих замороженных образцов размазывали на твердую синтетическую среду с 2% Lарабинозы и инкубировали при 30 С в течение нескольких дней. Отдельные колонии дважды пересеивали штрихом на твердую синтетическую среду с L-арабинозой. Наконец, одиночной колонией инокулировали качалочную колбу, содержащую синтетическую среду с 2% арабинозы, и инкубировали в течение 4 дней при 30 С. Эту культуру обозначили как штамм IMS0003 (CBS 121879, депонирован в CBS от 20/09/07). Отбирали образцы культуры, добавляли 30% глицерина и хранили образцы при -80 С. Характеристика штамма IMS0003 Определяли рост и образование продуктов у штамма IMS0003 при анаэробной периодической ферментации на синтетической среде со смесью 30 гл-1 глюкозы, 15 гл-1 D-ксилозы и 15 гл-1 L-арабинозы. Предварительную культуру для этой анаэробной ферментации готовили в качалочных колбах, содержащих 100 мл синтетической среды с 2% L-арабинозы, инокулируя их замороженными при -80 С образцами штамма IMS0003 и инкубируя 48 ч при 30 С. На фиг. 7 представлен профиль брожения смеси из 30 гл-1 глюкозы, 15 гл-1 D-ксилозы и 15 гл-1 Lарабинозы штаммом IMS0003. Утилизация арабинозы начиналась после истощения глюкозы. За 70 ч глюкоза, ксилоза и арабиноза были полностью израсходованы. Ксилоза и арабиноза утилизировались одновременно. Образовалось по меньшей мере 406 мМ этанола. Конечная концентрация этанола, рассчитанная по кумулятивной продукции СО 2, составила 572 ммольл-1, что соответствует выходу этанола в 0,46 гг-1 общего количества сахаров. В отличие от сбраживания смеси глюкозы, ксилозы и арабинозы штаммом IMS0002 (фиг. 5 С) или смешанной культурой штаммов IMS0002 и RWB218 (фиг. 5D), штаммIMS0003 не вырабатывал заметного количества ксилитола. Таблица 4 Максимальные удельные скорости потребления глюкозы и арабинозы и скорости образования этанола при анаэробной ферментации штамма S. cerevisiae IMS0002qglu: удельная скорость потребления глюкозыqara: удельная скорость потребления арабинозыqeth,glu: удельная скорость образования этанола при росте на глюкозеqeth,ara: удельная скорость образования этанола при росте на арабинозеWeusthuis R.A., Visser W., Pronk J.T., Scheffers W.A., Van Dijken J.P. (1994) Effects of oxygen limitation on sugar metabolism in yeasts - a continuous-culture study of the Kluyver effect. Microbiology 140:703715. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Эукариотическая клетка, способная экспрессировать нижеследующие нуклеотидные последовательности, причем экспрессия этих нуклеотидных последовательностей придает клеткам способность к утилизации L-арабинозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат,и/или в желательный продукт брожения:(a) нуклеотидную последовательность, кодирующую арабинозоизомеразу (araA), причем данная нуклеотидная последовательность выбрана из группы, состоящей изi) нуклеотидной последовательности, кодирующей araA, причем araA включает аминокислотную последовательность, которая по меньшей мере на 55% идентична аминокислотной последовательностиSEQ ID NO: 1,ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 2,iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;(b) нуклеотидной последовательности, кодирующей L-рибулокиназу (araB), причем данная нуклеотидная последовательность выбирается из группы, состоящей изi) нуклеотидной последовательности, кодирующей araB, причем araB включает аминокислотную последовательность, которая по меньшей мере на 20% идентична аминокислотной последовательностиSEQ ID NO: 3,ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 50% идентична нуклеотидной последовательности SEQ ID NO: 4,iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода;(c) нуклеотидную последовательность, кодирующую L-рибулозо-5-Р-4-эпимеразу (araD), причем данная нуклеотидная последовательность выбирается из группы, состоящей изi) нуклеотидной последовательности, кодирующей araD, причем araD включает аминокислотную последовательность, которая по меньшей мере на 60% идентична аминокислотной последовательностиSEQ ID NO: 5,ii) нуклеотидной последовательности, включающей нуклеотидную последовательность, которая по меньшей мере на 60% идентична нуклеотидной последовательности SEQ ID NO: 6,iii) нуклеотидной последовательности, у которой комплементарная нить гибридизируется с молекулой нуклеиновой кислоты, имеющей последовательность (i) или (ii),- 25016303iv) нуклеотидной последовательности, которая отличается от последовательности молекулы нуклеиновой кислоты (iii) вследствие вырожденности генетического кода. 2. Клетка по п.1, в которой одна, две или три из нуклеотидных последовательностей araA, araB иaraD происходят из рода бактерий Lactobacillus, наиболее предпочтительно из вида Lactobacillus plantarum. 3. Клетка по п.1 или 2, представляющая собой дрожжевые клетки, предпочтительно принадлежащие к одному из родов Saccharomyces, Kluyveromyces, Candida, Pichia, Schizosaccharomyces, Hansenula,Kloeckera, Schwanniomyces или Yarrowia. 4. Клетка по п.3, представляющая собой дрожжевые клетки, принадлежащие к одному из видов S.cerevisiae, S. bulderi, S. barnetti, S. exiguus, S. uvarum, S. diastaticus, K. lactis, K. marxianus или K. fragilis. 5. Клетка по любому из пп.1-4, в которой нуклеотидные последовательности, кодирующие araA,araB и/или araD, функционально связаны с промотором, вызывающим экспрессию соответствующей нуклеотидной последовательности в клетках, достаточную для придания клеткам способности к утилизации L-арабинозы и/или к превращению L-арабинозы в L-рибулозу, и/или ксилулозо-5-фосфат, и/или в желательный продукт брожения. 6. Клетка по любому из пп.1-5, обладающая способностью к прямой изомеризации ксилозы в ксилулозу. 7. Клетка по п.6, содержащая генетическую модификацию, повышающую мощность пентозофосфатного пути. 8. Клетка по п.6 или 7, в которой генетическая модификация заключается в суперэкспрессии по меньшей мере одного гена неокислительной части пентозофосфатного пути. 9. Клетка по п.8, в которой указанный ген выбран из группы, состоящей из генов, кодирующих рибулозо-5-фосфат-изомеразу, рибулозо-5-фофат-эпимеразу, транскетолазу и трансальдолазу. 10. Клетка по п.8, в которой генетическая модификация заключается в суперэкспрессии генов, кодирующих транскетолазу и трансальдолазу. 11. Клетка по любому из пп.8-10, дополнительно содержащая генетическую модификацию, повышающую удельную активность ксилулозокиназы. 12. Клетка по п.11, в которой генетическая модификация заключается в суперэкспрессии гена, кодирующего ксилулозокиназу. 13. Клетка по любому из пп.8-12, в которой подвергаемый суперэкспрессии ген является эндогенным для этих клеток. 14. Клетка по любому из пп.5-13, содержащая генетическую модификацию, снижающую активность неспецифической альдозоредуктазы в клетках. 15. Клетка по п.14, в которой генетическая модификация уменьшает экспрессию или инактивирует ген, кодирующий неспецифическую альдозоредуктазу. 16. Клетка по п.15, в которой ген инактивируется при помощи делеции по крайней мере части гена или разрушения гена. 17. Клетка по п.14 или 15, в которой снижается или инактивируется экспрессия в клетках каждого гена, кодирующего неспецифическую альдозоредуктазу. 18. Клетка по любому из предыдущих пунктов, в которой продукт брожения выбирается из группы,состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты, лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена, глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов. 19. Конструкция из нуклеиновой кислоты, включающая нуклеотидную последовательность, кодирующую araA, нуклеотидную последовательность, кодирующую araB, и нуклеотидную последовательность, кодирующую araD, которые определены в п.1 или 2. 20. Способ получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты,лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена,глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов, включающий:(а) сбраживание среды, содержащей источник L-арабинозы и необязательно ксилозы, с помощью модифицированных клеток по любому из пп.1-18, при этом клетки сбраживают L-арабинозу и необязательно ксилозу до нужного продукта брожения; и при необходимости(b) извлечение продукта брожения. 21. Способ получения продукта брожения, выбранного из группы, состоящей из этанола, молочной кислоты, 3-гидроксипропионовой кислоты, акриловой кислоты, уксусной кислоты, янтарной кислоты,лимонной кислоты, яблочной кислоты, фумаровой кислоты, аминокислот, 1,3-пропандиола, этилена,глицерина, бутанола, -лактамовых антибиотиков и цефалоспоринов, включающий:(a) сбраживание среды, содержащей, по меньшей мере, источник L-арабинозы и источник ксилозы,с помощью клеток по любому из пп.1-18 и клеток, обладающих способностью к утилизации ксилозы и/или проявляющих способность к прямой изомеризации ксилозы в ксилулозу, при этом каждые клетки- 26016303 сбраживают L-арабинозу и/или ксилозу до нужного продукта брожения; и при необходимости(b) извлечение продукта брожения. 22. Способ по п.20 или 21, в котором среда дополнительно содержит источник глюкозы. 23. Способ по любому из пп.20-22, в котором продуктом брожения является этанол. 24. Способ по п.23, в котором объемная продукция этанола составляет по меньшей мере 0,5 г этанола на л/ч. 25. Способ по п.23 или 24, в котором выход этанола составляет по меньшей мере 30%. 26. Способ по любому из пп.20-25, который является анаэробным. 27. Способ по любому из пп.20-25, который является аэробным и предпочтительно выполняется в условиях ограничения кислорода. Список последовательностей
МПК / Метки
Метки: клеток, сбраживающих, дрожжевых, арабинозу, инженерия, метаболическая
Код ссылки
<a href="https://eas.patents.su/30-16303-metabolicheskaya-inzheneriya-sbrazhivayushhih-arabinozu-drozhzhevyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Метаболическая инженерия сбраживающих арабинозу дрожжевых клеток</a>
Предыдущий патент: Способы снятия боли с использованием бензоконденсированных гетероциклических сульфамидных производных (варианты)
Следующий патент: Способ сульфинилирования производной пиразола
Случайный патент: Способ получения экстракта клюквы, обогащенного проантоцианидинами