Замещенные имидазолы, композиция на их основе, способ профилактики или лечения нежелательного тромбообразования с их помощью и способ ингибирования коагуляции образцов крови
Номер патента: 15942
Опубликовано: 30.12.2011
Авторы: Сонг Йонгхонг, Цзя Чжаочжон Дж., Скарбара Роберт М., Пэнди Энджейли
Формула / Реферат
1. Замещенные имидазолы, охватываемые общей структурной формулой (I)
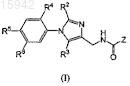
в которых Z выбран из группы, состоящей из
R1 выбран из группы, состоящей из галогена и -СºСН;
R1a выбран из группы, состоящей из водорода и С1-4алкила;
R2 и R3независимо выбраны из группы, состоящей из водорода, галогена, C1-4алкила, SR4a, S(O)R4a и S(O)2R4a;
R4 выбран из группы, состоящей из водорода, галогена, OR4a, SR4a, S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a,
каждая из кольцевых систем в R4 необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, С1-8алкила, C1-8галоалкила, гидрокси, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-С1-4алкила;
R4a представляет собой водород;
R4b представляет собой водород или C1-4алкил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, алкокси, гетероциклила, оксо, амино или карбоксила;
нижний индекс n представляет собой целое число от 0 до 2;
R5 выбран из группы, состоящей из
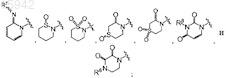
каждая из кольцевых систем в R5 необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, C1-8алкила, C1-8галоалкила, -NH-C(O)-C1-8алкила, гидрокси, амино, оксо, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-C1-4алкила;
R6 выбран из группы, состоящей из водорода, галогена и C1-4алкила;
R7 выбран из группы, состоящей из водорода, С1-4алкила, циано, необязательно замещенного фенила и C(O)R9;
R9 представляет собой С1-4алкил или NH2;
R8 выбран из группы, состоящей из водорода и C1-4алкила;
гетероцикл или гетероциклил представляют собой насыщенную или ненасыщенную неароматическую циклическую группу, содержащую по крайней мере один гетероатом серы, азота или кислорода, которая может быть присоединена по любому доступному кольцевому атому углерода или гетероатома и может иметь одно или несколько ядер;
гетероциклоалкил представляет собой алкилен-гетероцикл;
арил представляет собой полиненасыщенную, ароматическую углеводородную группу, содержащую от 6 до 14 атомов углерода, которая может представлять собой одно ядро или несколько ядер (вплоть до трех ядер), которые конденсированы вместе или связаны ковалентно;
гетероарил представляет собой арильную группу, которая содержит от 1 до 5 гетероатомов, выбранных из О, S и N, в которых атомы азота и серы необязательно окислены, а атом(ы) азота необязательно кватернизован(ы), и может быть присоединена к остальной молекуле через гетероатом или через атом углерода и может содержать от 5 до 10 атомов углерода;
необязательно замещенный фенил представляет собой фенильную группу, замещенную заместителями, выбранными из галогена, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R',
-OC(O)NR'R", -NR"C(O)R', -NR"C(O)R', -NR"C(O)2R', -NR'-C(O)NR"R'", -NH-C(NH2)=NH, -NR'C(NH2)=NH,
-NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -NR'S(O)2R", -N3, перфтор(С1-С4)алкокси и перфтор(С1-С4)алкила, в количестве в пределах от нуля до общего числа допустимых валентностей кольцевой системы; и где R', R" и R'" независимо выбраны из водорода и C1-8алкила;
алкокси представляет собой -О-алкил;
волнистая линия обозначает точку присоединения к остальной молекуле;
и их фармацевтически приемлемые соли и эфиры.
2. Имидазолы по п.1, в которых R2, R3и R6 представляют собой водород.
3. Имидазолы по п.1, в которых R2 выбран из группы, состоящей из водорода, C1-4алкила, SR4a, S(O)R4a и S(O)2R4a.
4. Имидазолы по п.3, в которых R2 выбран из группы, состоящей из водорода, метила, -S-метила, -S(O)-метила и -S(O)2-метила.
5. Имидазолы по п.1, в которых R3 представляет собой водород или метил.
6. Имидазолы по п.1, в которых R6 представляет собой водород или фтор.
7. Имидазолы по п.1, в которых R4 выбран из группы, состоящей из водорода, галогена, OR4a, S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a,
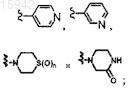
каждая из кольцевых систем R4 необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, C1-8алкила, C1-8галоалкила, гидрокси, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-C1-4алкила;
нижний индекс n представляет собой 0, 1 и 2;
каждый из R4a или R4b представляет собой независимо водород или C1-4алкил, необязательно замещенный гидроксилом, алкокси или гетероциклилом, а волнистая линия обозначает точку присоединения к остальной молекуле.
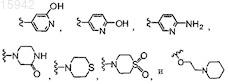
8. Имидазолы по п.7, в которых R4 выбран из группы, состоящей из водорода, гидроксила, фтора, S(O)CH3, S(O)2CH3, NH(CH2)2OH, -C(O)2CH3, -О(СН2)2ОСН3, -ОСН2СН(ОН)СН2ОН,
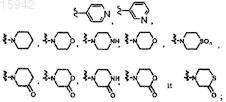
9. Имидазолы по любому из пп.1-8, в которых R5 представляет собой
![]()
необязательно замещенный от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, C1-8алкила, C1-8галоалкила, гидрокси, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-С1-4алкила.
10. Имидазол по п.9, имеющий формулу
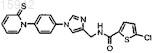
и его фармацевтически приемлемые соли и эфиры.
11. Имидазолы по любому из пп.1-8, в которых R5 представляет собой
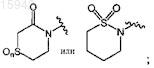
необязательно замещенный от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, C1-8алкила, C1-8галоалкила, гидрокси, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-С1-4алкила; и
нижний индекс n представляет собой 0, 1 или 2.
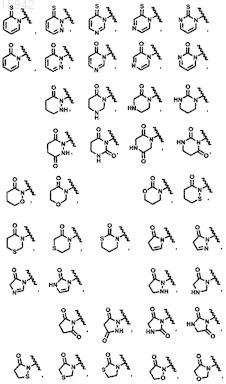
12. Имидазолы по п.11, имеющие структурную формулу, выбранную из группы, состоящей из
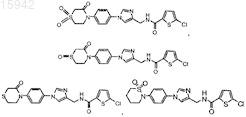
и их фармацевтически приемлемые соли и эфиры.
13. Имидазолы по любому из пп.1-8, в которых R5 выбран из группы, состоящей из
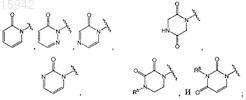
каждая из кольцевых систем в R5 необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, C1-8алкила, -NH-C(O)-C1-8алкила, C1-8галоалкила, гидрокси, амино, оксо, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-С1-4алкила; и
R8 представляет собой водород или C1-4алкил.
14. Имидазолы по п.13, имеющие структурную формулу, выбранную из группы, состоящей из
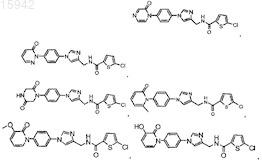

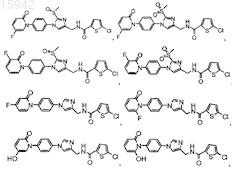
и их фармацевтически приемлемые соли и эфиры.
15. Имидазолы по любому из пп.1-8, в которых R5 представляет собой
![]()
в котором R7 выбран из группы, состоящей из водорода, С1-4алкила, циано, необязательно замещенного фенила и C(O)R9, в котором R9 представляет собой C1-4алкил или амино.
16. Имидазолы по п.15, имеющие структурную формулу, выбранную из группы, состоящей из
![]()

и их фармацевтически приемлемые соли и эфиры.
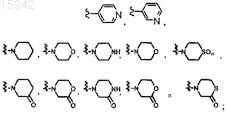
17. Имидазолы по любому из пп.1-8, в которых Z выбран из группы, состоящей из
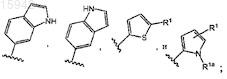
и R1a представляет собой водород или метил.
18. Имидазолы по п.17, в которых Z представляет собой
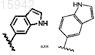
19. Имидазолы по п.18, имеющие структурную формулу, выбранную из группы, состоящей из
![]()
и их фармацевтически приемлемые соли и эфиры.
20. Имидазолы по п.17, в которых Z представляет собой
![]()
21. Имидазолы по п.17, в которых Z представляет собой
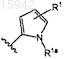
и R1a представляет собой водород или метил.
22. Имидазолы по п.21, имеющие структурную формулу, выбранную из группы, состоящей из
![]()
и их фармацевтически приемлемые соли и эфиры.
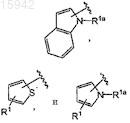
23. Замещенные имидазолы, охватываемые общей структурной формулой (II)
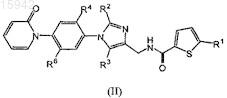
в которых R1 выбран из группы, состоящей из галогена и -СºСН;
R2 и R3независимо выбраны из группы, состоящей из водорода, галогена, C1-4алкила, SR4a, S(O)R4a и S(O)2R4a;
R4 выбран из группы, состоящей из водорода, галогена, OR4a, SR4a, S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a,
каждая из кольцевых систем в R4 необязательно замещена одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, C1-8алкила, C1-8галоалкила, гидрокси, C1-8алкокси, гетероциклоалкила, гетероарила и гетероарил-С1-4алкила;
R4a представляет собой водород;
R4b представляет собой водород или C1-4алкил, необязательно замещенный одним или двумя заместителями, независимо выбранными из группы, состоящей из галогена, гидроксила, алкокси, гетероциклила, оксо, амино или карбоксила;
R6 выбран из группы, состоящей из водорода, галогена и C1-4алкила;
нижний индекс n представляет собой целое число от 0 до 2;
гетероцикл или гетероциклил представляет собой насыщенную или ненасыщенную неароматическую циклическую группу, содержащую по крайней мере один гетероатом серы, азота или кислорода, которая может быть присоединена по любому доступному кольцевому атому углерода или гетероатома и может иметь одно или несколько ядер;
гетероциклоалкил представляет собой алкиленгетероцикл;
арил представляет собой полиненасыщенную, ароматическую углеводородную группу, содержащую от 6 до 14 атомов углерода, которая может представлять собой одно ядро или несколько ядер (вплоть до трех ядер), которые конденсированы вместе или связаны ковалентно;
гетероарил представляет собой арильную группу, которая содержит от 1 до 5 гетероатомов, выбранных из О, S и N, в которых атомы азота и серы необязательно окислены, а атом(ы) азота необязательно кватернизован(ы), и может быть присоединена к остальной молекуле через гетероатом или через атом углерода и может содержать от 5 до 10 атомов углерода;
алкокси представляет собой -О-алкил;
волнистая линия обозначает точку присоединения к остальной молекуле;
и их фармацевтически приемлемые соли и эфиры.
24. Имидазолы по п.23, в которых R1 представляет собой -СºСН.
25. Имидазол по п.24, имеющий структурную формулу
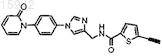
и его фармацевтически приемлемые соли и эфиры.
26. Имидазолы по п.23, в которых R1 представляет собой галоген.
27. Имидазолы по п.23, имеющие структурную формулу, выбранную из группы, состоящей из
![]()
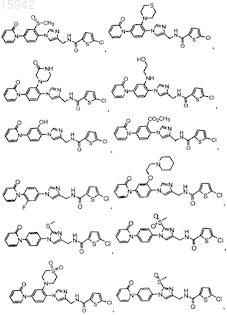
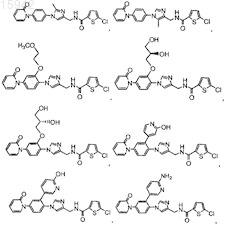
и их фармацевтически приемлемые соли и эфиры.
28. Имидазолы по п.23, в которых R4 представляет собой водород.
29. Имидазол по п.28, имеющий структурную формулу
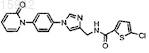
и его фармацевтически приемлемые соли и эфиры.
30. Замещенное соединение имидазола формулы
![]()
и его фармацевтически приемлемые соли.
31. Имидазолы по любому из пп.1-30, которые представляют собой выделенные и очищенные вещества.
32. Композиция для лечения нежелательного тромбообразования, включающая фармацевтически приемлемый эксципиент и замещенный имидазол по любому из пп.1-31.
33. Способ профилактики или лечения заболеваний у млекопитающих, характеризующихся нежелательным тромбообразованием, включающий назначение указанному млекопитающему терапевтически эффективного количества замещенного имидазола по любому из пп.1-31.
34. Способ по п.33, в котором заболевание выбрано из группы, состоящей из острого коронарного синдрома, инфаркта миокарда, нестабильной стенокардии, рефрактерной стенокардии, окклюзивного коронарного тромбоза, возникающего после тромболитической терапии или после коронарной ангиопластики, цереброваскулярного синдрома, обусловленного тромбозом, эмболического инсульта, тромботического инсульта, преходящей ишемической атаки, венозного тромбоза, тромбоза глубоких вен, эмболии легочной артерии, коагулопатии, генерализованного тромбогеморрагического синдрома, тромбоцитопенического акроангиотромбоза, облитерирующего тромбангиита, тромботической болезни, связанной с тромбоцитопенией, вызванной гепарином, тромботических осложнений, связанных с экстракорпоральным кровообращением, тромботических осложнений, связанных с применением технических средств, таких как катетеризация сердечных или других сосудов, внутриаортальный баллонный насос, коронарный стент или сердечный клапан, и заболевания, требующие подгонки протезных устройств.
35. Способ ингибирования коагуляции образцов крови, включающий контактирование указанного образца с соединением по любому из пп.1-31.
Текст
Дата публикации и выдачи патента Номер заявки ЗАМЕЩЕННЫЕ ИМИДАЗОЛЫ, КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ НЕЖЕЛАТЕЛЬНОГО ТРОМБООБРАЗОВАНИЯ С ИХ ПОМОЩЬЮ И СПОСОБ ИНГИБИРОВАНИЯ КОАГУЛЯЦИИ ОБРАЗЦОВ КРОВИ В изобретении предложены замещенные имидазолы формулы (I), где R2-R6 и Z имеют значения,указанные в п.1 формулы изобретения и их фармацевтически приемлемые соли и эфиры,которые представляют собой ингибиторы фактора Ха. Предложены композиции, содержащие эти имидазолы, способ профилактики или лечения заболеваний, характеризующихся нежелательным тромобообразованием, и способ ингибирования коагуляции образцов крови. 015942 Область техники, к которой относится изобретение Настоящее изобретение направлено на соединения замещенного имидазола, которые действуют как ингибиторы фактора Ха. Настоящее изобретение также направлено на фармацевтические композиции,содержащие соединения замещенного имидазола, и способы применения этих соединений или композиций для лечения заболеваний, характеризующихся нежелательным тромбообразованием. Изобретение также направлено на способы получения соединений, описанных здесь. Сведения о предшествующем уровне техники Остановка и контроль кровотечения могут осуществляться хирургическим путем или воздействием на физиологические свойства вазоконстрикции и коагуляции. Настоящее изобретение, в частности, влияет на коагуляцию крови и [метаболические] пути, которые опосредуют сохранение целостности кровообращения млекопитающего после травмы, воспаления, болезни, врожденного дефекта, дисфункции или другого нарушения. Хотя и тромбоциты, и коагуляция крови вовлечены в поддержание гемостаза и тромботические болезни, определенные компоненты коагуляционного каскада в первую очередь ответственны за усиление и ускорение процессов, принимающих участие в агрегации тромбоцитов и отложении фибрина, которые представляют собой основные этапы в тромбообразовании и гемостазе. Образование тромба включает превращение фибриногена в фибрин, который полимеризуется в сетчатую структуру для восстановления гемостаза после травмы. Подобный процесс приводит к закупорке кровеносных сосудов при тромботических болезнях. Превращение фибриногена в фибрин катализируется тромбином, конечным продуктом в серии реакций в каскаде коагуляции крови. Тромбин также играет ключевую роль в активации тромбоцитов, внося таким образом вклад в тромбообразование при болезнях как артериального, так и венозного кровотока. По этой причине постулируется, что эффективное регулирование тромбина может привести к эффективному регулированию тромбообразования. Несколько классов применяемых в настоящее время антикоагулянтов прямо или косвенно влияют на тромбин (например, нефракционированный гепарин, низкомолекулярный гепарин, гепариноподобные соединения, пентасахариды и варфарин). Прямые и непрямые ингибиторы активности тромбина также находятся в фокусе множества антикоагулянтов в стадии клинической разработки (обзор Eriksson и Quinlan, Drugs 11: 1411-1429, 2006). Протромбин, предшественник тромбина, превращается в активный фермент под воздействием фактора Ха. Локализованная активация тканевого фактора/фактора VIIa, опосредованная генерацией фактора Ха, усиливается комплексом фактор IXa/фактор VIIIa и приводит к скоплению протромбиназы на активированных тромбоцитах. Фактор Ха, как часть протромбиназного комплекса, представляет собой единственный фермент, ответственный за постоянное образование тромбина в сосудистой сети. Фактор Ха представляет собой сериновую протеазу, активированную форму своего предшественника, - фактораX, и членом [семейства] зависимых от витамина K факторов коагуляции крови, связывающих ионы кальция и содержащих гамма-карбоксиглутаминовую кислоту (GLA). Фактор Ха, в отличие от тромбина, который действует на множество белковых субстратов, включая фибриноген и PAR-рецепторы (рецепторы,активируемые протеазами, Coughlin, J. Thrombosis Haemostasis 3: 1800-1814, 2005), очевидно имеет единственный физиологический субстрат, а именно протромбин. Так как одна молекула фактора Ха способна генерировать более 1000 молекул тромбина (Mann, et al., J. Thrombosis. Haemostasis 1: 1504-1514, 2003),прямое ингибирование фактора Ха в качестве способа непрямого ингибирования образования тромбина может быть эффективной антикоагулянтной стратегией. Такое утверждение основано на ключевой роли протромбиназы в синтезе тромбина и на том факте, что ингибирование протромбиназы будет иметь ярко выраженный эффект на общую агрегацию тромбоцитов и пути свертывания крови. Активированные протеазы, такие как фактор VIIa, фактор IXa или фактор Ха, обладают слабой протеолитической активностью сами по себе. Однако их объединение в зависимый от кофактора мембранносвязанный комплекс существенно увеличивает их каталитическую эффективность. Этот эффект особенно значительный для фактора Ха - эффективность увеличивается в 105 раз (Mann, et al., Blood 76(1): 1-16,1990). Благодаря более высокой концентрации зимогенов, присутствующих в крови (1,4 мкмоль протромбина и 150 нмоль фактора X), и кинетике активации для достижения эффекта антикоагуляции требуется ингибирование меньшего количества фактора Ха, чем тромбина. Непрямое доказательство гипотезы преимущества фактора Ха как терапевтической мишени по сравнению с тромбином также может быть найдено в клинических испытаниях по предотвращению тромбоза глубокой вены. Было доказано в четырех экспериментах по ортопедической хирургии, что фордапаринукс, зависимый от антитромбинаIII ингибитор фактора Ха, имеет преимущество перед эноксапарином (низкомолекулярным гепарином,ингибирующим как тромбин, так и фактор Ха) (Turpie, et al., Archives Internal Medicine 162(16): 18331840, 2002). Следовательно, было предположено, что соединения, которые селективно ингибируют фактор Ха, могут применяться как в качестве in vitro диагностического вещества, так и для терапевтического назначения при определенных тромботических расстройствах, см., например, WO 94/13693. Сообщалось о нескольких ингибиторах фактора Ха, представляющих собой полипептиды, полученные из питающихся кровью организмов, а также соединения, которые представляют собой небольшие полипептидоподобные ингибиторы. Другие ингибиторы фактора Ха включают небольшие молекулы органических соединений, такие как азотсодержащие гетероциклические соединения, которые содержат амидинозаместите-1 015942 ли, в которых две функциональные группы могут связываться с фактором Ха по двум его активным сайтам. Например, WO 98/28269 описывает соединения пиразола, содержащие концевую C(=NH)-NH2 группу; WO 97/21437 описывает бензимидазольные соединения, замещенные основными радикалами, которые связаны с нафтильной группой через алкиленовую группу с прямой или разветвленной цепью,-С(=О) или -S(=O)2 мостиковые группы; WO 99/10316 описывает соединения, содержащие 4-фенил-Nалкиламидинопиперидиновую и 4-фенокси-N-алкиламидинопиперидиновую группы, связанные с 3 амидинофенильной группой через карбоксамидалкиленаминовый мостик; и ЕР 798295 описывает соединения, содержащие 4-фенокси-N-алкиламидинопиперидиновую группу, связанную с амидинонафтильной группой через замещенную или незамещенную сульфонамидную или карбоксамидную мостиковую группу. Существует потребность в эффективных терапевтических веществах для регулирования гемостаза и для профилактики и лечения тромбообразования и других паталогических процессов в кровеносной сети,индуцируемых тромбином, таких как рестеноз и воспаление. В частности, все еще существует потребность в соединениях, которые селективно ингибируют фактор Ха или его предшественники. Нужны соединения, которые содержат отличные от уже описанных комбинации мостиковых групп и функциональных групп, особенно соединения, которые селективно или предпочтительно связываются с фактором Ха. Желательны соединения с более высокой степенью связывания с фактором Ха по сравнению с тромбином, особенно те соединения, которые обладают хорошей биодоступностью и/или растворимостью. Сущность изобретения В одном аспекте настоящее изобретение предлагает соединения, имеющие следующую формулу: где R1 выбран из группы, состоящей из галогена и -ССН;R1a представляет собой водород или С 1-4 алкил;R2 и R3 независимо выбираются из группы, состоящей из водорода, галогена, С 1-4 алкила, SR4a,S(O)R4a и S(O)2R4a;R4 представляет собой фрагмент, независимо выбранный из группы, состоящей из водорода, галогена, OR4a, SR4a, S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a, в которых каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, С 1-8 алкила, С 1-8 галоалкила, гидрокси, С 1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила;R4b представляет собой водород или С 1-4 алкил, необязательно замещенный от 1 до 2 заместителями,независимо выбранными из группы, состоящей из галогена, гидроксила, алкокси, гетероциклила, оксо,амино и карбоксила; нижний индекс n представляет собой целые числа от 0 до 2; в которых каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-8 алкила, C1-8 галоалкила, -NH-C(O)-C1-8 алкила,гидрокси, амино, оксо, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила. Неожиданно было найдено, что введение кольцевой группы R5, имеющей по крайней мере одну экзосвязь (например, =O, =N-R, =S) и присоединенной через атом азота, обеспечивает улучшенные фармакологические свойства.R7 выбран из группы, состоящей из водорода, C1-4 алкила, циано, необязательно замещенного фенила и C(O)R9, в котором R9 представляет собой C1-4 алкил или амино;R8 выбран из группы, состоящей из водорода и C1-4 алкила. Волнистая линия обозначает точку присоединения к остальной молекуле. Настоящее изобретение также подразумевает фармацевтически приемлемые соли и эфиры соединений формулы (I). Настоящее изобретение, кроме того, предлагает соединения в очищенных формах, химические интермедиаты, фармацевтические композиции и способы профилактики или лечения заболеваний у млекопитающих, характеризующихся нежелательным тромбообразованием, включающие стадию назначения млекопитающему терапевтически эффективного количества соединения настоящего изобретения. Такие заболевания включают острый коронарный синдром, инфаркт миокарда, нестабильную стенокардию,рефракторную стенокардию, окклюзивный коронарный тромбоз, возникающий после тромболитической терапии или после коронарной ангиопластики, цереброваскулярный синдром, обусловленный тромбозом, эмболический инсульт, тромботический инсульт, преходящую ишемическую атаку, венозный тром-3 015942 боз, тромбоз глубоких вен, эмболию легочной артерии, коагулопатию, генерализованный тромбогеморрагический синдром, тромбоцитопенический акроангиотромбоз, облитерирующий тромбангиит, тромботическую болезнь, связанную с тромбоцитопенией, вызванной гепарином, тромботические осложнения,связанные с экстракорпоральным кровообращением, тромботические осложнения, связанные с применением технических средств, таких как катетеризация сердца или других сосудов, внутриаортальный баллонный насос, коронарный стент или сердечный клапан, заболевания, требующие подгонки протезных устройств и т.п., но не ограничиваются ими. Настоящее изобретение, кроме того, предлагает способы ингибирования коагуляции образцов крови, включающие контакт образца с соединением настоящего изобретения. Перечень чертежей Фиг. 1 показывает профиль зависимости концентрации соединения 10 в плазме от времени у самцов крыс Sprague-Dawley после введения 1 мг/кг соединения 10 внутривенно и 10 мг/кг перорально(n=3/группа); образцы плазмы измеряли с использованием LC/MS/MS (жидкостная хроматография/тандемная масс-спектрометрия); фиг. 2 - профиль зависимости концентрации соединения 10 в плазме от времени у самцов собак бигль после введения 1 мг/кг соединения 10 внутривенно и 5 мг/кг перорально (n=3/группа); образцы плазмы измеряли с использованием LC/MS/MS; фиг. 3 - профиль зависимости концентрации соединения 10 в плазме от времени у самцов макакрезус после введения 1 мг/кг соединения 10 внутривенно и 5 мг/кг перорально(n=3/группа); образцы плазмы измеряли с использованием LC/MS/MS. Сведения, подтверждающие возможность осуществления изобретения 1. Сокращения и определения. Термин "алкил", сам по себе или как часть другого заместителя, означает, если не утверждается иного, углеводородный радикал с прямой или разветвленной цепью, имеющий желаемое число атомов углерода (например, C1-8 означает от 1 до 8 атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, н-пентил, н-гексил, н-гептил,н-октил и т.п. Термин "алкенил" относится к ненасыщенной алкильной группе, имеющей одну или более,предпочтительно от 1 до 3, двойные связи. Аналогично, термин "алкинил" относится к ненасыщенной алкильной группе, имеющей одну или более, предпочтительно от 1 до 3, тройные связи. Примеры таких ненасыщенных алкильных групп включают винил, 2-пропенил, кротил, 2-изопентил, 2-(бутадиенил), 2,4 пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин "циклоалкил" относится к углеводородным кольцам, имеющим обозначенное число кольцевых атомов (например, С 3-6 циклоалкил) и являющимся полностью насыщенными между вершинами цикла. Термин "циклоалкенил" относится к циклоалкильной группе, которая имеет по крайней мере одну точку алкенильной ненасыщенности между вершинами цикла. Термин "циклоалкинил" относится к циклоалкильной группе, которая имеет по крайней мере одну точку алкинильной ненасыщенности между вершинами цикла. Когда "циклоалкил" употребляется в комбинации с "алкил", например в С 3-5 циклоалкилалкил, то это означает, что циклоалкильная часть имеет указанное число атомов углерода (например,от 3 до 5 атомов углерода), а алкильная часть представляет собой алкиленовый фрагмент, содержащий от 1 до 3 углеродных атомов (например, -СН 2-, -СН 2 СН 2- или -СН 2 СН 2 СН 2-). Термин "алкилен", сам по себе или как часть другого заместителя, означает двухвалентный радикал, произведенный из алкана, например -СН 2 СН 2 СН 2 СН 2-. Обычно алкильная (или алкиленовая) группа будет содержать от 1 до 24 атомов углерода, при этом предпочтительными в настоящем изобретении являются группы, содержащие 10 или меньше атомов углерода. "Низший алкил" или "низший алкилен" представляют собой алкильную или алкиленовую группу с более короткой цепью, обычно содержащую четыре или меньше атома углерода. Если не утверждается иного, алкил, алкокси, алкенил, алкинил, циклоалкил, циклоалкенил, циклоалкинил и алкилен относятся как к замещенным, так и к незамещенным группам, в которых 1 или более,например от 1 до 5, атомов водорода замещены заместителем, независимо выбранным из группы, состоящей из =O, =S, ацила (-C(O)-R), ацилокси (-O-C(O)-R), алкокси, алкоксиамино (-NH-O-алкил), гидроксиламино (-NH-OH), амино, замещенного амино, такого как -NH2, где один или более атомов водорода могут быть необязательно замещены на другую приемлемую группу, такую как алкиламино и диалкиламино, или в котором аминогруппа может представлять собой циклический амин, арила, гетероциклила,азидо (-N3), карбоксила (-С(О)ОН), алкоксикарбонила (-С(О)-О-алкил), амидо (-С(О)-амино), циано(-CN), циклоалкила, циклоалкенила, галогена, гидроксила, нитро, сульфониламино (-N(R)-S(O)2-OR),аминосульфонила (-S(О)2-амино), сульфанила (-S-R), сульфинила (-S(O)-R), сульфонила (-S(O)2-R) и сульфоновой кислоты (-S(O)2-OH), в которых каждый из R независимо может быть водородом, алкилом,циклоалкилом, арилом, гетероарилом и гетероциклом. Термины "алкокси", "алкиламино" и "алкилтио" (или тиоалкокси) употребляются в их обычном смысле и относятся к алкильным группам, присоединенным к остальной молекуле через атом кислорода(-О-алкил), аминогруппу или атом серы (-S-алкил) соответственно. Кроме того, для диалкиламиногрупп(обычно -NRaRb или его варианта, где Ra и Rb независимо представляют собой алкил или замещенный-4 015942 алкил), алкильные фрагменты могут быть одинаковыми или различными, а также могут быть соединены вместе, образуя 3-7 членный цикл с атомом азота, к которому каждый их них присоединен. Соответственно подразумевается, что группа, представленная как -NRaRb, включает циклический амин, содержащий от 3 до 6 атомов углерода и необязательные дополнительные гетероатомы, такие как О, S и N,включая пиперидинил, пирролидинил, морфолинил, азетидинил и т.п., но не ограничиваясь ими. Термины "гало" или "галоген", сами по себе или как часть другого заместителя, означают, если не утверждается обратного, атомы фтора, хлора, брома или иода. Кроме того, подразумевается, что термины, такие как "галоалкил", включают моногалоалкилы и полигалоалкилы вплоть до максимально разрешенного числа галогенов. Например, подразумевается, что термин "C1-8 галоалкил" включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и т.п. Термины "гидрокси" и "гидроксил" относятся к группе -ОН. Термин "арил" обозначает, если не утверждается обратного, полиненасыщенную, ароматическую углеводородную группу, содержащую от 6 до 14 атомов углерода, которая может представлять собой одно ядро или несколько ядер (вплоть до трех ядер), которые конденсированы вместе или связаны ковалентно. Термин "гетероарил" относится к арильным группам (или ядрам), которые содержат от 1 до 5 гетероатомов, выбранных из О, S и N, в которых атомы азота и серы необязательно окислены, а атом(ы) азота необязательно кватернизован(ы). Гетероарильная группа может быть присоединена к остальной молекуле через гетероатом или через атом углерода и может содержать от 5 до 10 атомов углерода. Неограничивающие примеры арильных групп включают фенил, нафтил и бифенил, а неограничивающие примеры гетероарильных групп включают 1-пирролил, 2-пирролил, 3-пирролил, 1-пиразолил, 3 пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2 тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, бензопиразолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5 хиноксалинил, 3-хинолил и 6-хинолил. Если специально не указано, заместители для каждой из вышеупомянутых арильных и гетероарильных циклических систем выбраны из группы приемлемых заместителей, описанных ниже. Для краткости термин "арил", когда употребляется в сочетании с другими терминами (например,арилокси, арилтиокси, арилалкил), включает как арильное, так и гетероарильные ядра, как определено выше. Таким образом, подразумевается, что термин "арилалкил" включает те радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенилэтил, пиридилметил и т.п.). Термины "гетероцикл" или "гетероциклил" либо "гетероциклический" относятся к насыщенной или ненасыщенной неароматической циклической группе, содержащей по крайней мере один гетероатом серы, азота или кислорода. Каждый гетероцикл может быть присоединен по любому доступному кольцевому атому углерода или гетероатома. Каждый гетероцикл может иметь одно или несколько ядер. Когда присутствуют несколько ядер, они могут быть конденсированы вместе или связаны ковалентно. Каждый гетероцикл должен содержать по крайней мере один гетероатом (обычно от 1 до 5 гетероатомов), выбранных из азота, кислорода или серы. Предпочтительно эти группы содержат 1-10 атомов углерода, 0-5 атомов азота, 0-2 атомов серы и 0-2 атомов кислорода. Более предпочтительно эти группы содержат 0-3 атомов азота, 0-1 атомов серы и 0-1 атомов кислорода. Неограничивающие примеры гетероциклов и гетероарильных групп включают пиридин, пиримидин, пиразин, морфолин-3-он, пиперазин-2-он, пиридин-2-он, пиперидин, морфолин, пиперазин, изоксазол, изотиазол, пиразол, имидазол, оксазол, тиазол, изоксазолин, пиразолин, имидазолин, 1,2,3-триазол,1,2,4-триазол, 1,3,4-оксадиазол, 1,3,4-тиадиазол, 1,2,4-оксадиазол, 1,2,4-тиадиазол, пиразол-5-он, пирролидин-2,5-дион, имидазолидин-2,4-дион, пирролидин, пиррол, фуран, тиофен и т.п. Термин "гетероциклоалкил" относится к группе алкилен-гетероцикл, в которой и гетероцикл, и алкилен такие, как определено выше. Вышеупомянутые термины (например, "арил" и "гетероарил") в некоторых вариантах осуществления будут включать как замещенные, так и незамещенные формы обозначенных радикалов. Предпочтительные заместители для каждого типа радикалов предложены ниже. Для краткости термины арил и гетероарил будут относиться к замещенным или незамещенным формам, как предложено ниже. Заместители для арильной, гетероарильной и гетероциклической групп могут быть различны и обычно выбраны из галогена, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R',-OC(O)NR'R",-NR"C(O)R',-NR"C(O)R',-NR"C(O)2R',-NR'-C(O)NR"R"',-NH-C(NH2)=NH,-NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R", -NR'S(O)2R", -N3, перфтор(С 1 С 4)алкокси и перфтор(С 1-С 4)алкила, в количестве в пределах от нуля до общего числа допустимых валентностей кольцевой системы; и где R', R" и R"' независимо выбраны из водорода, C1-8 алкила,С 3-6 циклоалкила, С 2-8 алкенила, С 2-8 алкинила, незамещенных арила и гетероарила, (незамещенный арил)С 1-4 алкила и незамещенного арилокси-С 1-4 алкила. Другие подходящие заместители включают каждый из вышеупомянутых арильных заместителей, просоединенный к атому кольца алкиленовым мостиком из 14 атомов углерода. Эта группа заместителей также используется для описания заместителей для необязательно замещенного фенила.-5 015942 Два заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены на заместитель формулы -T-C(O)-(CH2)q-U-, в котором Т и U представляют собой независимо -NH-, -О-, -СН 2- или простую связь, a q представляет собой целое число от 0 до 2. Альтернативно, два заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены на заместитель формулы -A-(CH2R)r-B-, в котором А и В представляют собой независимо-СН 2-, -О-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR' или простую связь, а r представляет собой целое число от 1 до 3. Одна из простых связей сформированного таким образом нового кольца может быть необязательно замещена на двойную связь. Альтернативно, два заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены на заместитель формулы -(CH2)s-X-(CH2)t-, в котором s и t независимо представляют собой целые числа от 0 до 3, а X представляет собой -О-, -NR'-,-S-, -S(O), -S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и -S(O)2NR' выбран из водорода или незамещенного C1-6 алкила."Амино" относится к группе -NH2 и, если не указано иного, также относится к "замещенному амино"."Замещенный амино" относится к группе -NR'R", где R' и R" независимо выбираются из группы,состоящей из водорода, алкила, алкенила, алкинила, арила, циклоалкила, циклоалкенила, гетероарила,гетероцикла, -SO2-алкила, -SO2-алкенила, -SO2-циклоалкила, -SO2-циклоалкенила, -SO2-арила, -SO2 гетероарила, и в которой R' и R" необязательно соединены таким образом, чтобы вместе с азотом, к которому они присоединены, образовать гетероциклическую или замещенную гетероциклическую группу,при этом R' и R" не представляют собой водород одновременно, и в которой алкил, алкенил, алкинил,циклоалкил, циклоалкенил, арил, гетероарил и гетероцикл такие, как определено здесь. Когда R' представляет собой водород и R" представляет собой алкил, замещенная аминогруппа иногда упоминается здесь как алкиламино. Когда R' и R" представляют собой алкил, замещенная аминогруппа иногда упоминается здесь как диалкиламино. Когда ссылаются на монозамещенный амино, то это означает, что либоR', либо R" представляют собой водород, но не обе одновременно. Когда ссылаются на дизамещенный амино, что ни R', ни R" не представляют собой водород."Карбонил" относится к двухвалентной группе -С(О)-, которая тождественна группе -С(=О)-."Оксо" относится к атому (=O) или (-O-). Подразумевается, что термин "гетероатом", употребляемый в данном документе, включают кислород (О), азот (N), серу (S) и кремний (Si). Подразумевается, что термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получаются с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, присутствующих в описанных здесь соединениях. Когда соединения настоящего изобретения содержат относительно кислые функциональные группы, соли присоединения оснований могут быть получены при контакте нейтральной формы таких соединений с достаточным количеством желаемого основания. Примеры солей, произведенных из фармацевтически приемлемых неорганических оснований, включают алюминий, кальций, медь, железо(II), железо(III), литий, магний,марганец(III), марганец(II), калий, натрий, цинк и т.п. Соли, произведенные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и т.п., такие как аргинин, бетаин, кофеин,холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы,прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.п. Когда соединения настоящего изобретения содержат относительно основные функциональные группы, соли присоединения кислот могут быть получены при контакте нейтральной формы таких соединений с достаточным количеством желаемой кислоты либо чистой, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, произведенные из неорганических кислот, подобные хлоргидратам, гидробромидам, нитратам, карбонатам, бикарбонатам,фосфатам, гидрофосфатам, дигидрофосфатам, сульфатам, бисульфатам, гидроиодидам или фосфитам и т.п., а также соли, произведенные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная,фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, винная, метансульфоновая ктслоты и т.п. Также сюда включены соли аминокислот, такие как аргинаты и т.п., и соли органических кислот, подобных глюкуроновой и галактуроновой кислоте и т.п. (см., например, Berge, S.М., et al., "PharmaceuticalSalts", Journal of Pharmaceutical Science, 1977, 66, 1-19). Определенные специфические соединения настоящего изобретения содержат как основные, так и кислотные функциональные группы, что позволяет превращать эти соединения либо в соли присоединения оснований, либо в соли присоединения кислот. Нейтральные формы соединений могут быть регенерированы при контактировании соли с основанием или кислотой с выделением исходного соединения традиционными методами. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как-6 015942 растворимость в полярных растворителях, но в то же время соли эквивалентны исходной форме соединения в контексте применений настоящего изобретения. Кроме солевых форм настоящее изобретение предлагает соединения, представляющие собой эфирную форму. Например, в случае, когда соединения настоящего изобретения представляют собой карбоновую кислоту (содержат -СООН) или содержат спиртовую группу, тогда могут быть использованы фармацевтически приемлемые эфиры - производные карбоновой кислоты, такие как метиловый, этиловый или пивалоилоксиметиловый, или ацильные производные спиртов, такие как ацетаты или малеаты. Изобретение включает такие эфирные и ацильные группы, известные в области, которые модифицируют растворимость или гидролитические характеристики, позволяя применять их для замедленного высвобождения или как пролекарства. Определенные соединения настоящего изобретения могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. В целом, сольватированные формы эквивалентны несольватированным формам и подразумевается, что они охвачены рамками настоящего изобретения. Определенные соединения настоящего изобретения могут существовать в многочисленных кристаллических или аморфных формах. В целом, все физические формы эквивалентны для применения, рассматриваемого данным изобретением, и включены в рамки настоящего изобретения. Определенные соединения настоящего изобретения обладают ассиметрическими атомами углерода(оптическими центрами) или двойными связями; рацематы, диастереомеры, геометрические изомеры,региоизомеры и индивидуальные изомеры (например, индивидуальные энантиомеры) - подразумевается,что все они включены в рамки настоящего изобретения. Соединения настоящего изобретения могут также содержать неприродные соотношения атомных изотопов при одном или более атомов, составляющих такие соединения. Например, соединения могут быть радиомеченными радиоактивными изотопами, такими как, например, тритий (3 Н), иод-125 (125I) или углерод-14 (14 С). Подразумевается, что все изотопные вариации соединений настоящего изобретения, радиоактивные или нет, охвачены рамками настоящего изобретения. 2. Варианты осуществления изобретения. а. Соединения. В одном аспекте настоящее изобретение предлагает соединения, имеющие следующую формулу: где R1 выбран из группы, состоящей из галогена и -ССН;R1a представляет собой водород или С 1-4 алкил;R2 и R3 независимо выбираются из группы, состоящей из водорода, галогена, С 1-4 алкила, SR4a,S(O)R4a и S(O)2R4a;R4 представляет собой фрагмент, независимо выбранный из группы, состоящей из водорода, галогена, OR4a, SR4a, S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a, в которой каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, C1-8 алкила, C1-8 галоалкила, гидрокси, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила;R4b представляет собой водород, C1-4 алкил, необязательно замещенный от 1 до 2 заместителями, не-7 015942 зависимо выбранными из группы, состоящей из галогена, гидроксила, алкокси, гетероциклила, оксо,амино или карбоксила. Нижний индекс n представляет собой целое число от 0 до 2. в которой каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-8 алкила, C1-8 галоалкила, -NH-C(O)-C1-8 алкила,гидрокси, амино, оксо, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-C1-4 алкила. Структура, показанная выше какR7 выбран из группы, состоящей из водорода, С 1-4 алкила, циано, необязательно замещенного фенила и C(O)R9, в котором R9 представляет собой С 1-4 алкил или амино;R8 выбран из группы, состоящей из водорода и C1-4 алкила. Волнистая линия обозначает точку присоединения к остальной молекуле. Настоящее изобретение также рассматривает фармацевтически приемлемые соли и эфиры соединений формулы (I). С вышеуказанной формулой существует ряд частных вариантов осуществления изобретения. В одной группе вариантов осуществления R2, R3 и R6 представляют собой водород. В одной группе вариантов осуществления R2 выбран из группы, состоящей из водорода, C1-4 алкила, SR4a, S(O)R4a и S(O)2R4a. В одной группе вариантов осуществления R2 выбран из группы, состоящей из водорода, метила, -Sметила, -S(О)-метила и -S(О)2-метила. В одной группе вариантов осуществления R3 представляет собой водород или метил. В одной группе вариантов осуществления R6 представляет собой водород или фтор. В одной группе вариантов осуществления R4 выбран из группы, состоящей из водорода, галогена, OR4a,S(O)R4a, S(O)2R4a, NR4aR4b, CO2R4a, в которой каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, C1-8 алкила, C1-8 галоалкила, гидрокси, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила; и каждый из R4a или R4b представляет собой независимо водород или С 1-4 алкил, необязательно замещенный гидроксилом, алкокси или гетероциклилом, а волнистая линия обозначает точку присоединения к остальной молекуле. Нижний индекс n представляет собой 0, 1 и 2. В одном варианте осуществления R4 выбран из группы, состоящей из водорода, гидроксила, фтора,S(O)CH3, S(O)2CH3, NH(CH2)2OH, -C(O)2CH3, -(СН 2)2 ОСН 3, -ОСН 2 СН(ОН)СН 2 ОН, В другой группе вариантов осуществления R5 представляет собой необязательно замещенный от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, C1-8 алкила, C1-8 галоалкила, гидрокси, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила. В другом варианте осуществления изобретение рассматривает соединение, имеющее формулу и его фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления R5 представляет собой необязательно замещенный от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, C1-8 алкила, C1-8 галоалкила, гидрокси, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-C1-4 алкила; и нижний индекс n представляет собой 0, 1 или 2.-9 015942 В другом варианте осуществления изобретение предлагает соединение, имеющее формулу и его фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления R5 выбран из группы, состоящей из в которой каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, C1-8 алкила, -NH-C(O)-C1-8 алкила, C1-8 галоалкила,гидрокси, амино, оксо, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-С 1-4 алкила, и R8 представляет собой водород или C1-4 алкил. В другом варианте осуществления изобретение рассматривает соединения, имеющие формулу, выбранную из группы, состоящей из и их фармацевтически приемлемые соли и эфиры. В одной группе вариантов осуществления R5 представляет собой в котором R7 выбран из группы, состоящей из водорода, C1-4 алкила, циано, необязательно замещенного фенила и C(O)R9. R9 представляет собой C1-4 алкил или амино.- 11015942 В этих вариантах осуществления изобретение включает соединения, выбранные из и их фармацевтически приемлемые соли и эфиры. В одной группе вариантов осуществления Z выбран из группы, состоящей из и R1a представляет собой водород или метил. В другой группе вариантов осуществления Z представляет собой В другом варианте осуществления изобретение предлагает соединения, имеющие формулу и их фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления Z представляет собой В другой группе вариантов осуществления Z представляет собой где R1a представляет собой водород или метил. Изобретение рассматривает соединения, имеющие формулу и их фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления соединение имеет следующую формулу:- 12015942 где R1 выбран из группы, состоящей из водорода и -ССН;R2 и R3 независимо выбраны из группы, состоящей из водорода, галогена, С 1-4 алкила, SR4a, S(O)R4a и S(O)2R4a; aR4 выбран из группы, состоящей из водорода, галогена, OR4a, SR4a, S(O)R4a, S(O)2R4a, NR4aR4b,CO2R4a, в которых каждая из этих кольцевых систем необязательно замещена от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена, амино, оксо, C1-8 алкила, C1-8 галоалкила, гидрокси, C1-8 алкокси, гетероциклоалкила, гетероарила и гетероарил-C1-4 алкила;R4b представляет собой водород или С 1-4 алкил, необязательно замещенный от 1 до 2 заместителями,независимо выбранными из группы, состоящей из галогена, гидроксила, алкокси, гетероциклила, оксо,амино или карбоксила;R6 выбран из группы, состоящей из водорода, галогена и C1-8 алкила; нижний индекс n представляет собой целое число от 0 до 2; волнистая линия обозначает точку присоединения к остальной молекуле; и их фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления R1 представляет собой -ССН. В другом варианте осуществления соединение имеет формулу и изобретение рассматривает его фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления R1 представляет собой галоген. В другом варианте осуществления соединение выбрано из группы, состоящей из и его фармацевтически приемлемых солей и эфиров. В другой группе вариантов осуществления R4 представляет собой водород. В другом варианте осуществления соединение имеет формулу и его фармацевтически приемлемые соли и эфиры. В другой группе вариантов осуществления соединение изобретения представляет собой выделен- 14015942 ную и очищенную форму. В рамках настоящего изобретения среди соединений, представленных в примерах ниже, каждое представляет собой предпочтительный вариант осуществления, наряду со своими фармацевтически приемлемыми солями и эфирами. Предпочтительные примеры соединений формулы (I) включаютN-1-(4-(6-гидрокси-2-оксопиридин-1(2 Н)-ил)фенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2 карбоксамид. Все предпочтительные, более предпочтительные и наиболее предпочтительные соединения, перечисленные выше, представляют собой селективные ингибиторы фактора Ха. б. Композиции. Настоящее изобретение далее предлагает композиции, включающие одно или более соединение формулы (I) или их фармацевтически приемлемые соли и эфиры, и фармацевтически приемлемый носитель. Следует понимать, что соединения формулы (I) в настоящем изобретении могут быть модифицированы по функциональным группам, давая производные пролекарств, которые способны превращаться обратно в исходные соединения in vivo. Образцы таких пролекарств включают физиологически приемлемые и метаболически лабильные эфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры или пивалоилоксиметиловые эфиры, произведенные из гидроксильных групп соединения или карбамоильные фрагменты, произведенные из аминогруппы соединения. Кроме того, любые физиологически приемлемые эквиваленты соединений формулы (I), подобные метаболически лабильным эфирам или карбаматам и способные высвобождать исходные соединения формулы (I) in vivo,попадают под действие этого изобретения. Если в этих композициях используются фармацевтически приемлемые соли соединений данного изобретения, то эти соли предпочтительно представляют собой производные неорганических или органических кислот и оснований. К таким солям относятся следующие соли кислот: ацетаты, адипаты, альгинаты, аспартаты, бензоаты, бензолсульфонаты, бисульфаты, бутираты, цитраты, камфораты, камфорсульфонаты, циклопентанпропионаты, диглюконаты, додецилсульфаты, этансульфонаты, фумараты, лукогептаноаты, глицерофосфаты, гемисульфаты, гептаноаты, гексаноаты, гидрохлориды, гидробромиды,гидроиодиды, 2-гидроксиэтансульфонаты, лактаты, малеаты, метансульфонаты, 2-нафталинсульфонаты,никотинаты, оксалаты, памоаты, пектинаты, персульфаты, 3-фенилпропионаты, пикраты, пивалаты, пропионаты, сукцинаты, тартраты, тиоцианаты, толилаты и ундеканоаты. Соли оснований включают соли аммония, соли щелочных металлов, такие как натриевые и калиевые соли, соли щелочно-земельных металлов, такие как кальциевые и магниевые соли, соли органических оснований, такие как соли дициклогексиламина, N-метил-D-глюкамина, и соли с аминокислотами, такими как аргинин, лизин и т.д. Кроме того, основные азотсодержащие группы могут быть кватернизованы веществами, подобными низшим алкилгалидам, таким как метил-, этил-, пропил- и бутилхлориды, бромиды и иодиды; диалкилсульфатам, таким как диметил-, диэтилдибутилидиамилсульфаты, длинноцепочечным галидам, таким как децил-, лаурил-, миристил- и стеарилхлорилы, бромиды и иодиды; аралкилгалидам, таким как бензил- и фенетилбромиды, и другими. Таким образом получаются водо- или маслорастворимые или дисперсные продукты. Соединения, применяемые в композициях и способах данного изобретения, также могут быть модифицированы путем добавления подходящих функциональных групп для усиления определенных биологических свойств. Такие модификации известны в области и включают те, которые улучшают биологическое проникновение в данную биологическую систему (например, кровь, лимфатическую систему,центральную нервную систему и т.д.), улучшают пероральную доступность, увеличивают растворимость для того, чтобы позволить применение в виде инъекции, изменяют метаболизм и изменяют скорость выведения. Фармацевтические композиции изобретения могут производиться способами, хорошо известными в области, такими как обычное гранулирование, смешивание, растворение, инкапсулирование, лиофильная сушка или процессы эмульгирования и другие. Композиции могут производиться в разнообразных формах, включая гранулы, осадки или твердые частицы, порошки, включая лиофилизованные, высушенные на роторе или распылением порошки, аморфные порошки, таблетки, капсулы, сиропы, суппозитории,инъекции, эмульсии, эликсиры, суспензии или растворы. Составы могут необязательно содержать стабилизаторы, рН модификаторы, поверхностно-активные вещества, модификаторы биодоступности и комбинации этих добавок. Фармацевтические составы могут быть приготовлены в виде жидких суспензий или растворов с использованием стерильной жидкости, такой как масло, вода, спирт и их комбинация. Фармацевтически приемлемые поверхностно-активные вещества, суспендирующие вещества или эмульгирующие вещества могут быть добавлены для перорального или парентерального применения. Суспензии могут включать масла, такие как арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло и оливковое масло. Приготовление суспензий может также содержать эфиры жирных кислот, таких как этилолеат,изопропилмиристат, глицериды жирных кислот и глицериды ацетилированных жирных кислот. Составы- 17015942 суспензий также могут включать спирты, такие как этанол, изопропиловый спирт, гексадекановый спирт,глицерол и пропиленгликоль. Также в состав суспензии могут быть введены эфиры, такие как поли(этиленгликоль), углеводороды нефти, такие как минеральное масло и вазелин, и вода. Фармацевтически приемлемые носители, которые могут быть использованы в этих композициях,включают ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, неполные глицериды смесей насыщенных растительных жирных кислот, воду,соли или электролиты, такие как протаминсульфат, двухзамещенный фосфат натрия, дважды кислый фосфат калия, хлорид натрия, соли цинка, коллоидный оксид кремния, трисиликат магния, поливинилпирролидон, вещества, основанные на целлюлозе, полиэтиленгликоль, натриевую соль карбоксиметилцеллюлозы, полиакрилаты, воски, полиэтиленполиоксипропилен блок-сополимеры, полиэтиленгликоль и ланолин. В соответствии с предпочтительными вариантами осуществления композиции данного изобретения составляются для фармацевтического применения млекопитающему, предпочтительно человеку. Такие фармацевтические композиции изобретения могут назначаться перорально, парентерально, в виде спрея для ингаляции, местно, ректально, назально, трансбуккально, вагинально или через имплантированную емкость. Термин "парентерально", применительно к данному документу, включает подкожные, внутривенные, внутримышечные, внутрисуставные, интрасиновальные, надчревные, интратекальные, внутрипеченочные, вводимые внутрь пораженной ткани и внутричерепные инъекции или инфузионные процедуры. Предпочтительно композиции назначаются перорально или внутривенно. Составы изобретения могут быть составлены как для короткого действия, быстрого высвобождения или пролонгированного действия. Кроме того, соединения могут применяться локально, а не системно, как, например, назначение (например, инъекция) в виде состава с замедленным высвобождением. Стерильные формы для инъекций композиции данного изобретения могут представлять собой водную или масляную суспензию. Такие суспензии могут быть составлены в соответствии с протоколами,известными в области, применяя подходящие диспергирующие или увлажняющие вещества и суспендирующие вещества. Стерильный препарат для инъекций может также представлять собой стерильный раствор для инъекций или суспензию в нетоксичном, парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Среди приемлемых эксципиентов и растворителей, которые могут использоваться: вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используются в качестве растворителя или суспендирующей среды. С этой целью может быть использовано любое безвкусное нелетучее масло, включая синтетические моно- или диглицериды. При приготовлении инъекционных форм применяются жирные кислоты,такие как олеиновая кислота и ее глицеридные производные, а также натуральные, фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в виде своих полиоксиэтилированных производных. Такие масляные растворы или суспензии также могут содержать длинноцепочечный спирт в качестве разбавителя или диспергирующего вещества, как, например, карбоксиметилцеллюлозу или похожий диспергирующий агент, которые обычно применяются в составах фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Также для получения состава могут использоваться другие обычно применяемые поверхностно-активные вещества, такие как Tween,Span и другие эмульгирующие вещества, или вещества, увеличивающие биодоступность, которые обычно применяются при производстве фармацевтически приемлемых твердых веществ, жидкостей или других лекарственных форм. Соединения могут быть прописаны для парентерального применения путем инъекций, таких как, например, болюсные инъекции или продолженная инфузия. Стандартная лекарственная форма для инъекции может быть в ампулах или в многоразовых контейнерах. Фармацевтические композиции данного изобретения могут быть в любой перорально приемлемой лекарственной форме, включая капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения обычно используемые носители включают лактозу и кукурузный крахмал. Также обычнодобавляются смазывающие вещества, такие как стеарат магния. Для капсулированных лекарственных форм применяемые разбавители включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения требуются водные суспензии, активный ингредиент объединяют с эмульгирующими и суспендирующими веществами. При желании также могут быть добавлены определенные подсластители, ароматизаторы или красители. Альтернативно, фармацевтические композиции данного изобретения могут быть в форме суппозиториев для ректального применения. Они могут быть приготовлены смешиванием агента с подходящим нераздражающим эксципиентом, который представляет собой твердое вещество при комнатной температуре и жидкость при ректальной температуре, и таким образом будет расплавляться в прямой кишке и высвобождать лекарство. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции данного изобретения также могут быть в форме для местного применения, особенно когда мишень для лечения включает области или органы, легкодоступные для местного нанесения, включая болезни глаз, кожи или нижних отделов кишечника. Подходящие составы для местного применения могут быть легко получены для каждой из этих областей или органов.- 18015942 Для нижних отделов кишечника местное применение может достигаться использованием формы ректального суппозитория (см. выше) или подходящей клизмы. Также могут использоваться местные пластыри для трансдермального введения. Для местного нанесения фармацевтические композиции могут быть составлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одной или более основе. Основы для местного нанесения соединений данного изобретения включают минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен,полиоксипропиленовое соединение, эмульгирующий воск и воду, но не ограничивается ими. Альтернативно, фармацевтические композиции могут быть составлены в форме подходящего лосьона или крема,содержащего активные компоненты, суспендированные или растворенные в одной или более фармацевтически приемлемой основе. Подходящие основы включают минеральное масло, сорбитанмоностеарат,полисорбат 60, цетиловые эфиры, воск, цетиловый спирт, 2-октилдодеканол, бензиловый спирт и воду. В офтальмологии фармацевтические композиции могут быть составлены в виде тонкодисперсной суспензии в изотоническом стерильном физиологическом растворе с подобранным рН, с добавлением или без добавления консерванта, такого как бензилалконийхлорид. Альтернативно, для применения в офтальмологии фармацевтические композиции могут быть составлены в виде мази, такой как вазелин. Фармацевтические композиции данного изобретения также могут применяться в виде назального аэрозоля или ингаляции. Такие композиции приготавливаются в соответствии с методиками, известными в области фармацевтических составов, и могут применяться в виде растворов в физиологическом растворе с использованием бензилового спирта или других подходящих консервантов, ускорителей абсорбции для увеличения биодоступности, фтороуглеродов и/или других обычных растворяющих или диспергирующих веществ. Любая из вышеупомянутых лекарственных форм, содержащая действующую дозу, находится в границах рутинного эксперимента и попадает под действие изобретения. Терапевтическая действующая доза может варьироваться в зависимости от способа применения и лекарственной формы. Предпочтительное соединение или соединения изобретения представляют собой состав, показывающий высокий терапевтический индекс. Терапевтический индекс представляет собой соотношение доз, вызывающих токсический эффект и терапевтический эффект, который может быть выражен как соотношение LD50 иED50. LD50 представляет собой летальную дозу для 50% популяции, a ED50 представляет собой дозу, терапевтически эффективную для 50% популяции. LD50 и ED50 определяются стандартными фармацевтическими процедурами на культурах клеток животных или на экспериментальных животных. Кроме тех типичных лекарственных форм, которые описывались выше, специалистам в области известны фармацевтически приемлемые эксципиенты, носители и лекарственные формы, которые также включены в изобретение. Следует понимать, что специфические лекарственные формы и режим лечения для любого конкретного пациента будут зависеть от множества факторов, включающих активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол и режим питания пациента, а также время применения, скорость выведения, комбинации лекарств, мнение лечащего врача и тяжесть конкретного заболевания. Количество активного ингредиента (ингредиентов) в композиции также будет зависеть от конкретного соединения и других терапевтических веществ, если они присутствуют. в. Способы применения. Изобретение предлагает способы ингибирования или уменьшения активности фактора Ха, а также лечения или улучшения состояния при связанных с фактором Ха заболеваниях, симптомах, болезнях и нарушениях у нуждающихся пациентов (например, человека или не-человека). В одном варианте осуществления изобретение предлагает способы для профилактики и лечения заболеваний у млекопитающих,характеризующихся нежелательным тромбообразованием, включающие стадии применения млекопитающим терапевтически эффективного количества соединения настоящего изобретения. Такие заболевания включают острый коронарный синдром, инфаркт миокарда, нестабильную стенокардию, рефрактерную стенокардию, окклюзивный коронарный тромбоз, возникающий после тромболитической терапии или после коронарной ангиопластики, цереброваскулярный синдром, обусловленный тромбозом, эмболический инсульт, тромботический инсульт, преходящую ишемическую атаку, венозный тромбоз, тромбоз глубоких вен, эмболию легочной артерии, коагулопатию, генерализованный тромбогеморрагический синдром, тромбоцитопенический акроангиотромбоз, облитерирующий тромбангиит, тромботическую болезнь, связанную с тромбоцитопенией, вызванной гепарином, тромботические осложнения, связанные с экстракорпоральным кровообращением, тромботические осложнения, связанные с применением технических средств, таких как катетеризация сердца или других сосудов, внутриаортальный баллонный насос, коронарный стент или сердечный клапан, заболевания, требующие подгонки протезных устройств и т.п., но не ограничиваются ими."Лечение" в контексте изобретения означает частичное снятие симптомов, связанных с заболеванием или расстройством, или остановку дальнейшего прогрессирования или ухудшения этих симптомов,или предотвращение или профилактику болезни или расстройства. Термин "млекопитающее" включает организмы, которые экспрессируют фактор Ха. Примеры млекопитающих включают мышей, крыс, коров, овец, свиней, коз, лошадей, медведей, обезьян, собак, кошек- 19015942 и предпочтительно человека. Трансгенные организмы, которые экспрессируют фактор Ха, также включаются в это определение. Способы изобретения включают применение эффективного количества соединения, описанного здесь, млекопитающему или не-млекопитающему животному. Употребляемый здесь термин "эффективное количество" соединения или композиции изобретения включает такие количества, которые антагонизируют или ингибируют фактор Ха. Количества, которые антагонизируют или ингибируют фактор Ха,определяются, например, любым экспериментом, способным определять активность фактора Ха, включая тот, который описан ниже как модельный способ тестирования. Эффективные количества также могут включать такие количества, которые облегчают симптомы заболеваний, связанных с фактором Ха,при лечении посредством ингибирования фактора Ха. Соответственно "антагонисты фактора Ха" включают соединения, которые взаимодействуют с фактором Ха и модулируют, например, ингибируют или уменьшают способность второго соединения, например другого лиганда фактора Ха, взаимодействовать с фактором Ха. Соединения, связывающиеся с фактором Ха, предпочтительно представляют собой антагонисты фактора Ха. Понятие "соединение, связывающееся с фактором Ха" (например, показывающее связывающее сродство к рецептору) включает те соединения, которые взаимодействуют с фактором Ха,приводя к модулированию активности фактора Ха. Соединения, связывающиеся с фактором Ха, могут быть идентифицированы, применяя in vitro (например, клеточные и неклеточные) или in vivo методы. Описание метода in vitro дается ниже. Количество соединения, представленного в способах и композициях, описанных здесь, должно быть достаточным для того, чтобы вызвать заметное уменьшение тяжести заболевания, что может быть определено любым из анализов, описанных в примерах. Количество необходимого модулятора фактора Ха будет зависеть от эффективности модулятора для данного типа клеток и от продолжительности требуемого лечения заболевания. В определенных вариантах осуществления композиции изобретения могут, кроме того, включать другой терапевтический агент. Когда применяется второй агент, то второй агент может назначаться в виде отдельной лекарственной формы или в виде части единой лекарственной формы с соединением или композицией настоящего изобретения. Наряду с тем что одно или более соединений изобретения могут применяться в виде монотерапии для лечения заболевания, болезни или симптома, они также могут применяться в комбинированной терапии, при которой применение соединения или композиции изобретения (терапевтического агента) комбинируется с применением одного или более других терапевтических агентов для лечения того же и/или другого типа расстройств, симптомов или болезней. Комбинированная терапия включает назначение двух или более терапевтических агентов одновременно или последовательно. Агенты могут назначаться в любом порядке. Альтернативно, множественные терапевтические агенты могут объединяться в единую композицию, которая может быть назначена пациенту. Например, единая фармацевтическая композиция может включать соединение или его фармацевтически приемлемую соль и эфир в соответствии с формулой (I), другой терапевтический агент (например, метотрексат) или его фармацевтически приемлемую соль и эфир, и фармацевтически приемлемый эксципиент или носитель. Изобретение включает соединение, имеющее формулу (I), способ получения соединения изобретения, способ получения фармацевтической композиции по крайней мере из одного соединения изобретения и по крайней мере одного фармацевтически приемлемого носителя или эксципиента и способ применения одного или более соединений изобретения для лечения различных заболеваний, симптомов и расстройств (например, воспалительных, аутоиммунных, неврологических, нейродегенеративных, онкологических и кардиоваскулярных), таких как РА (ревматоидный артрит), остеоартрит, спастический колит (IBD - от англ. irritable bowel descease), астма, хроническое обструктивное заболевание легких(ХОЗЛ) и рассеянный склероз (MS - от англ. multiple sclerosis). Соединения изобретения и их фармацевтически приемлемые соли и/или нейтральные композиции могут быть включены в состав вместе с фармацевтически приемлемым эксципиентом или носителем, и полученная композиция может назначатьсяin vivo млекопитающим, таким как мужчины, женщины и животные, для лечения различных заболеваний, симптомов и болезней. Кроме того, соединения изобретения могут применяться для приготовления медикаментов, которые используются для лечения различных заболеваний, симптомов и болезней. г. Наборы. Еще в одном аспекте данного изобретения предложен набор, включающий отдельные контейнеры в единой упаковке, в которых фармацевтические соединения, композиции изобретения и/или их соли применяются в комбинации с фармацевтически приемлемыми носителями для лечения тех состояний, расстройств, симптомов и болезней, в которых играет роль фактор Ха. Примеры Исходные материалы и реагенты, применяемые для получения этих соединений, как правило, либо доступны из коммерческих источников, таких как Aldrich Chemical Co., либо их получают методами,известными специалистам в данной области, следуя процедурам, указанным в ссылках, таким как Fieser- 20015942 Исходные материалы и интермедиаты синтетических реакционных схем могут быть выделены и,при желании, очищены, используя стандартные методы, включающие фильтрование, перегонку, перекристаллизацию, хроматографию и т.п., но не ограничиваясь ими. Такие материалы могут быть охарактеризованы, используя стандартные методы, включая физические константы и спектральные данные. Если не указано иного, реакции, описываемые здесь, предпочтительно проводятся в инертной атмосфере при атмосферном давлении, при температуре реакции от примерно -78 до примерно 150 С, более предпочтительно от примерно 0 до примерно 125 С и наиболее предпочтительно и обычно при комнатной температуре (или температуре окружающей среды), например, от примерно 20 до примерно 75 С. Ссылаясь на примеры, следующие ниже, соединения настоящего изобретения были синтезированы с использованием методов, описанных здесь, или других методов, которые известны специалистам. Соединения и/или интермедиаты были охарактеризованы высокоэффективной жидкостной хроматографией (ВЭЖХ) с использованием хроматографической системы Waters Alliance с разделительным модулем 2695 (Milford, Mass.). Аналитические колонки представляли собой С-18 SpeedROD RP-18E Columns от Merck KGaA (Darmstadt, Germany). Альтернативно, характеризацию выполняли с использованием системы Waters Unity (UPLC) с колонками Waters Acquity UPLC ВЕН С-18 2,115 мм. Использовался градиент элюирования, обычно начиная с 5% ацетонитрила и 95% воды и продолжая до 95% ацетонитрила за период 5 мин для Alliancesystem и за 1 мин для системы Acquity system. Все растворители содержали 0,1% трифторуксусной кислоты (ТФУК). Соединения детектировали ультрафиолетовым (УФ) поглощением либо при 220 нм, либо при 254 нм. ВЭЖХ растворители были приобретены в EMD Chemicals, Inc. (Gibbstown, NJ). В некоторых случаях чистота оценивалась тонкослойной хроматографией (ТСХ) с использованием силикагелевых пластинок со стеклянной подложкой, таких как, например, пластинки EMD Silica Gel 60 2,57,5 см. Результаты ТСХ легко определялись визуально под ультрафиолетовым светом или с использованием хорошо известной йодной камеры и других стандартных методик. Масс-спектроскопический анализ выполнялся на одном из двух приборов Agilent 1100 серии ЖХМС со смесью ацетонитрил/вода в качестве подвижной фазы. Одна система использовала ТФУК в качестве модификатора и измеряла в режиме положительных ионов, а другая использовала либо муравьиную кислоту, либо ацетат аммония и измеряла в режиме как положительных, так и отрицательных ионов. Анализ ядерного магнитного резонанса (ЯМР) выполнялся для некоторых соединений на прибореVarian 400 MHz NMR (Palo Alto, Calif). Спектральный эталон представлял собой либо ТМС, либо известный химический сдвиг растворителя. Чистота некоторых соединений изобретения могла оцениваться элементным анализом (RobertsonMicrolit, Madison NJ.). Температуры плавления могли определяться на аппарате Laboratory Devices Mel-Temp apparatus(Holliston, Mass.). Препаративное разделение выполняли с использованием либо хроматографической системы Sq16,либо Sg100c и предварительно набитых колонок с силикагелем, приобретенных у Teledyne Isco, (Lincoln,NE). Альтернативно, соединения и интермедиаты очищались колоночной флэш-хроматографией с использованием силикагеля (230-400 меш) в качестве материала для набивки или методом ВЭЖХ с использованием С-18 колонки с обращенной фазой. Типичные растворители для систем Isco и колоночной флэш-хроматографии представляли собой дихлорметан, метанол, этилацетат, гексан, ацетон, водный гидроксиламин и триэтиламин. Типичные растворители, применяемые для ВЭЖХ на обращенной фазе,представляли собой различные концентрации ацетонитрила и воды с 0,1% трифторуксусной кислоты. В примерах использовались следующие сокращения: мкл = микролитр мкМ = микромолярный водн. = водный ВОР = бензотриазол-1-ил-окситрис(диметиламино)фосфоний гексафторфосфатIC50 = концентрация ингибитора, которая требуется для 50% ингибирования фермента in vitroK3PO4 = фосфат калия кг = килограмм М = молярныйmCPBA = м-хлорбензойная кислота МеОН = метанол мг = миллиграмм МГц = мегагерц мин = минута мл = миллилитр мм = миллиметр мМ = миллимолярный моль = миллимоль мОП/мин = единиц миллиоптической плотности в минутуTSC = тринатрийцитрат Общие способы Следующие синтетические реакционные схемы представляют собой простую иллюстрацию некоторых способов, которыми могут быть синтезированы соединения настоящего изобретения, и, опираясь на содержание данного раздела, специалистами в этой области могут быть сделаны и предложены разнообразные модификации этих синтетических реакционных схем. Схема I Схема I представляет общий синтетический способ получения соединений, имеющих формулу I-4. В соответствии со схемой I спирт I-1 превращают в амин I-2 в три стадии: (1) галогенирование, например, тионилхлоридом, (2) замещение галогена на азид, например, азидом натрия и (3) восстановление азида каталитическим гидрированием с образованием амина I-2. Амин I-2 затем сочетается с кислотой ZCOOH обычным способом образования амидной связи, таким как с использованием конденсирующих реагентов, подобных ВОР, с образованием соединения I-3, в котором Z представляет собой группу, определенную в данном документе. Замещение йодной группы в соединении I-3 на соответствующий R5 ос- 22015942 таток, например, в основных условиях, таких как с применением K2CO3, и в присутствии 8 гидроксихинолина и CuI приводит к целевому соединению I-4, в котором R5 такой, как определено здесь. Определенные R5 фрагменты соединения I-4 могут быть подвергнуты дальнейшим модификациям. Например, тиогруппа в примере 6 может быть окислена с образованием соответствующего сульфоксидного или сульфонового аналогов. Соединение I-1 может быть получено с использованием либо схемы I, либо схемы II ниже. Схема II Соединения, имеющие формулу II-7, могут быть получены в соответствии со схемой II. (1 НИмидазол-4-ил)метанол II-1 превращается в (1 Н-имидазол-4-ил)метанамин II-2 путем трехстадийной процедуры и сочетается с Z-COOH с образованием II-3, применяя условия, аналогичные тем, которые описаны выше. При этом селективное замещение 4-иодной группы в 1,4-дииод-2-фторбензоле на R5-H в основных условиях, таких как с использованием K2CO3, и в присутствии 8-гидроксихинолина и CuI дает соединение II-5. Селективное замещение второй йодной группы на соединение II-3 в аналогичных условиях дает соединение II-6. Соединение II-6 может быть также получено по линейной схеме, как иллюстрируется примером 4 ниже. Замещение фторной группы на R4-H дает целевой продукт II-7, в котором R4 такой, как определено здесь. Пример 1.(10). Схема 1 представляет синтетический способ получения соединения 10. Схема 2 представляет альтернативный способ синтеза соединения I-1. Схема 1 Стадия 1. Смесь 1,4-дииодбензола 1-1 (4,00 г, 12,1 ммоль), 4-(гидроксиметил)имидазола II-1 (1,20 г, 12,2 ммоль), 8-гидроксихинолина (0,176 г, 1,21 ммоль) и K2CO3 (1,69 г, 12,2 ммоль) в ДМСО (12 мл) дегазировали, а затем добавляли CuI (0,230 г, 1,21 ммоль). Смесь нагревали в запаянной трубке при 130 С в течение ночи. Добавили воду и EtOAc. Смесь отфильтровали. Органический слой отделили, затем использовали колонку с силикагелем, с которой элюировали 0-5% МеОН в CH2Cl2, получая 4 гидроксиметил-1-(4-иодфенил)имидазол I-1 (0,810 г). MS 301,2 (М+Н). Стадия 2. Соединение 4-гидроксиметил-1-(4-иодфенил)имидазол I-1 (0,810 г, 2,70 ммоль) растворили в SOCl2(6 мл). Раствор перемешивали при комнатной температуре 15 мин. Концентрировали в вакууме. Остаток разделили между EtOAc и 5% водн. NaHCO3. Органический слой отделили, высушили над Na2SO4, концентрировали в вакууме и получили 1-(4-иодфенил)-4-хлорметилимидазол 1-3 в виде твердого вещества(10 мл). К раствору добавили NaN3 (0,520 г, 8,00 ммоль). После перемешивания при комнатной температуре в течение ночи добавили воду и EtOAc. Органический слой отделили, высушили над Na2SO4, концентрировали в вакууме и получили 4-азидометил-1-(4-иодфенил)имидазол 1-4 в виде твердого вещества(0,725 г). MS 326,0 (М+Н). Стадия 4. Раствор 4-азидометил-1-(4-иодфенил)имидазола 1-4 (0,725 г, 2,23 ммоль) над Ra-Ni (50% водн. суспензия, 300 мг) в МеОН (12 мл) гидрировали под шариком с Н 2 в течение 3 ч. Смесь отфильтровали через целит. Фильтрат концентрировали в вакууме, получая 4-аминометил-1-(4-иодфенил)имидазол I-2 в виде твердого вещества (0,603 г). MS 300,0 (М+Н). Стадия 5. К смеси 5-хлортиофен-2-карбоновой кислоты 1-5 (0,346 г, 2,13 ммоль), 4-аминометил-1-(4 иодфенил)имидазола I-2, полученного выше, (0,578 г, 1,93 ммоль) и TEA (0,670 мл, 4,82 ммоль) в ДМФА(10 мл) добавили ВОР (1,03 г, 2,33 ммоль). Затем смесь перемешивали в течение ночи при комнатной температуре. Добавили воду и EtOAc. Органический слой отделили, промыли 5% NaHCO3, высушили над Na2SO4, концентрировали в вакууме и получили N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5 хлортиофен-2-карбоксамид-6 в виде твердого вещества (0,832 г), которое оказалось достаточно чистым для следующей реакции. MS 443,9 и 445,9 (М+Н, паттерн хлора). Стадия 6. Смесь N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 1-6, полученного выше (0,270 г, 0,609 ммоль), 2-гидроксипиридина 1-7 (0,115 г, 1,21 ммоль), 8-гидроксихинолина (0,041 г, 0,283 ммоль) и K2CO3 (0,333 г, 2,41 ммоль) в ДМСО (2 мл) дегазировали, а затем добавили CuI (0,058 г,0,305 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение 10 (0,080 г). MS 411,0 и 413,0 (М+Н, паттерн хлора); 1 НNaH (60%, 3,2 г, 80 ммоль) в колбе промыли гексаном. В колбу, охлажденную на ледяной бане, добавили раствор этаноламина (4,4 мл, 73 ммоль) в диоксане (40 мл). Смесь нагревали до кипения 10 мин до тех пор, пока не перестал выделяться Н 2. Густую мутную суспензию затем охладили на ледяной бане и добавили раствор этилхлорацетата (8,9 г, 73 ммоль) в диоксане (15 мл). Реакционную смесь нагревали до кипения 1 ч. Затем отфильтровали. Фильтрат концентрировали в вакууме, получая масло, которое очищали на короткой колонке с силикагелем, элюируя EtOAc/МеОН (95/5), получая 3-морфолинон в виде белого твердого вещества (1,9 г). Смесь N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 1-6, полученного в примере 1 (33 мг, 0,074 ммоль), 3-морфолинона, полученного выше (22 мг, 0,218 ммоль), 8 гидроксихинолина (7 мг, 0,048 ммоль) и K2CO3 (30 мг, 0,217 ммоль) в ДМСО (0,5 мл) дегазировали, а затем добавили CuI (14 мг, 0,073 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (3 мг). MS 417,0 и 419,0 (М+Н,паттерн хлора). Пример 3. К раствору глицинамида гидрохлорида (1,10 г, 10,0 ммоль) в 5 н. NaOH (6 мл) при комнатной температуре добавили глиоксаль (40% в Н 2 О, 1,5 мл, 13,1 ммоль). Раствор перемешивали при комнатной температуре в течение ночи. Продукт экстрагировали из водного раствора nBuOH и nBuOH экстракт концентрировали в вакууме, получая 2-гидроксипиразин в виде белого твердого вещества (0,20 г). Смесь N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 1-6, полученного в примере 1 (100 мг, 0,23 ммоль), 2-гидроксипиразина, полученного выше (43 мг, 0,45 ммоль), 8 гидроксихинолина (15 мг, 0,10 ммоль) и K2CO3 (123 мг, 0,89 ммоль) в ДМСО (1 мл) дегазировали, а затем добавили CuI (21 мг, 0,11 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (15 мг). MS 412,0 и 414,0 (М+Н,паттерн хлора). Пример 4. Смесь N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 1-6, полученного в примере 1 (100 мг, 0,23 ммоль), 3-гидроксипиридазина (43 мг, 0,45 ммоль), 8-гидроксихинолина (15 мг, 0,10 ммоль) и K2CO3 (123 мг, 0,89 ммоль) в ДМСО (1 мл) дегазировали, а затем добавили CuI (19 мг,0,10 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем смесь очищали с по- 25015942 мощью ВЭЖХ, получая названное соединение (15 мг). MS 412,0 и 414,0 (М+Н, паттерн хлора). Пример 5. Смесь N-1-(4-иодфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 1-6, полученного в примере 1 (100 мг, 0,22 ммоль), 2-гидрокси-6-метилпиридина (60 мг, 0,55 ммоль), 8 гидроксихинолина (20 мг, 0,14 ммоль) и K2CO3 (140 мг, 1,01 ммоль) в ДМСО (3 мл) дегазировали Ar, а затем добавили CuI (28 мг, 0,15 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (4 мг). MS 425,1 и 427,1 (М+Н,паттерн хлора). Пример 6.Ar, а затем добавили CuI (40 мг, 0,21 ммоль). Смесь нагревали до 110 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (58 мг). MS 433,1 и 435,0N-1-(4-(3-оксотиоморфолино)фенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2 карбоксамида, полученного в примере 6 (56 мг, 0,13 ммоль), в ацетоне (3 мл) при комнатной температуре добавили mCPBA (38 мг, 70-77%, 0,15 ммоль). Перемешивали при комнатной температуре 1 ч. ВЭЖХ показало образование сульфона и сульфоксида в соотношении 2:1. Раствор концентрировали в вакууме,остаток очищали с помощью ВЭЖХ, получая сульфон (6 мг) и сульфоксид (3 мг). MS 465,0 и 467,0Ar, а затем добавили CuI (20 мг, 0,11 ммоль). Смесь нагревали до 110 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (4 мг). MS 416,1 и 418,1(20 мг, 0,11 ммоль). Смесь нагревали до 110 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (5 мг). MS 402,1 и 404,1 (М+Н, Cl набор). Пример 10.Ar, а затем добавили CuI (20 мг, 0,11 ммоль). Смесь нагревали до 110 С в запаянной трубке в течение ночи. Затем смесь очищали с помощью ВЭЖХ, получая названное соединение (10 мг). MS 430,1 и 432,1 Смесь 2,5-дииодфторбензола II-4 (2,00 г, 5,75 ммоль), 2-гидроксипиридина 1-7 (0,546 г, 5,75 ммоль),8-гидроксихинолина (0,083 г, 0,57 ммоль) и K2CO3 (1,00 г, 7,25 ммоль) в ДМСО (10 мл) дегазировали, а затем добавили CuI (0,109 г, 0,57 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Добавили воду и EtOAc. Смесь отфильтровали. Органический слой отделили, затем использовали колонку с силикагелем, с которой элюировали 0-70% EtOAc в гексане, получая 1-иод-2-фтор-4-(2- 27015942 оксипиридин-1(2 Н)-ил)бензол 3-2 (0,820 г). MS 315,8 (М+Н). К суспензии 4-гидроксиметилимидазола II-1 (1,09 г, 11,1 ммоль) в CH3CN (12 мл) добавили SOCl2(5 мл). После перемешивания при комнатной температуре 30 мин суспензия стала прозрачной. После перемешивания еще 2 ч раствор концентрировали в вакууме, получая твердое вещество, которое затем растворили в ДМФА (15 мл). К раствору добавили NaN3 (2,16 г, 33,2 ммоль). После того как смесь перемешивали при комнатной температуре в течение ночи, добавили воду и EtOAc, а затем еще добавили 5% водн. NaHCO3. Органический слой отделили, высушили над Na2SO4, концентрировали в вакууме и получили 4-азидометилимидазол в виде твердого вещества (0,759 г). MS 124,1 (М+Н). Смесь 4-азидометилимидазола (0,759 г, 6,17 ммоль), полученного выше, и Ra-Ni (50% мутная суспензия в Н 2 О, 900 мг) в МеОН (15 мл) гидрировали под шариком с Н 2 в течение ночи. Затем смесь отфильтровали через целит. Фильтрат концентрировали в вакууме, получая 4-аминометилимидазол II-2(0,604 г). К раствору 5-хлортиофен-2-карбоновой кислоты 1-5 (1,10 г, 6,76 ммоль) и TEA (2,0 мл, 14,4 ммоль) в ДМФА (12 мл), добавили ВОР (3,30 г, 7,45 ммоль). После перемешивания 5 мин раствор добавили к соединению 4-аминометилимидазолу II-2, полученному выше (0,604 г, 6,22 ммоль) в круглодонной колбе. Смесь перемешивали при комнатной температуре в течение ночи. Очищали с помощью ВЭЖХ, получая N-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамид 3-1 (1,52 г). MS 242,0 и 244,0 (М+Н, паттерн хлора). Смесь N-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамида 3-1, полученного выше (0,940 г,2,64 ммоль), 1-иод-4-(2-оксопиридин-1(2 Н)-ил)-2-фторбензол 3-2, полученный выше (0,820 г, 2,60 ммоль), 8-гидроксихинолин (0,066 г, 0,45 ммоль) и K2CO3 (0,630 г, 4,56 ммоль) в ДМСО (8 мл) дегазировали Ar, а затем добавили CuI (0,90 г, 0,47 ммоль). Смесь нагревали до 130 С в запаянной трубке в течение ночи. Затем очищали с помощью ВЭЖХ, получая названное соединение (0,480 г). MS 429,0 и 431,0(М+Н, паттерн хлора). Альтернативно, в соответствии со схемой 4, 1-иод-4-(2-оксопиридин-1(2 Н)-ил)-2-фторбензол 3-2,полученный, как описано выше, обрабатывали 4-гидроксиметилимидазолом II-1 в присутствии 8 гидроксихинолина и K2CO3 в ДМСО. Полученную смесь дегазировали, а затем добавляли CuI, получая 4 гидроксиметил-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)имидазол 4-1. Соединение 4-1 обрабатывали тионилхлоридом, получая 4-хлорметил-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)имидазол, который затем обработали NaN3, получая 4-азидометил-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)имидазол 4-2. Азид 4-2 восстанавливали Раствор N-1-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен 2-карбоксамида (21), полученного в примере 11 (96 мг, 0,22 ммоль), и NaSMe (68 мг, 0,97 ммоль) в ДМСО (2 мл) нагревали до 80 С в течение 1 ч. Смесь очищали методом ВЭЖХ, получая N-1-(2(метилтио)-4-(2-оксопиридин-1(2 Н)-ил)фенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен-2-карбоксамид(70%, 12 мг, 0,049 ммоль). После перемешивания при комнатной температуре в течение 30 мин смесь очищали с помощью ВЭЖХ, получая сульфоксид (5 мг) и сульфон (3 мг). MS 473,0 и 475,0 (М+Н, паттерн хлора) для сульфоксида и 489,0 и 491,0 (М+Н, паттерн хлора) для сульфона. Пример 13.- 28015942 мл) нагревали до 150 С в течение 3 дней. Смесь очищали с помощью ВЭЖХ, получая названное соединение (25 мг). MS 512,0 и 514,0 (М+Н, паттерн хлора). Пример 14.mCPBA (70%, 32 мг, 0,13 ммоль). После перемешивания при комнатной температуре в течение 2 ч смесь была очищена с помощью ВЭЖХ, давая названное соединение (8 мг). MS 544,1 и 546,1 (М+Н, паттерн хлора). Пример 15. Раствор N-1-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен 2-карбоксамида (21), полученного в примере 11 (70 мг, 0,16 ммоль), и 2-оксопиперазина (565 мг, 5,65 ммоль) в ДМСО (1 мл) нагревали до 150 С в течение 2 дней. Смесь очищали с помощью ВЭЖХ, получая названное соединение (14 мг). MS 509,0 и 511,0 (М+Н, паттерн хлора). Пример 16. Раствор N-1-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен 2-карбоксамида (21), полученного в примере 11 (75 мг, 0,17 ммоль), и этаноламина (1,5 мл) в ДМСО (1 мл) нагревали до 150 С в течение ночи. Смесь очищали с помощью ВЭЖХ, получая названное соединение (13 мг). MS 470,0 и 472,0 (М+Н, паттерн хлора). Пример 17. Раствор N-1-(4-(2-оксопиридин-1(2 Н)-ил)-2-фторфенил)-1 Н-имидазол-4-ил)метил)-5-хлортиофен 2-карбоксамида (21), полученного в примере 11 (80 мг, 0,19 ммоль), и 5 н. водн. NaOH (0,5 мл, 2,5 ммоль) в ДМСО (1 мл) нагревали до 130 С в течение ночи. Смесь очищали с помощью ВЭЖХ, получая названное соединение (5 мг). MS 427,0 и 429,0 (М+Н, паттерн хлора). Пример 18.
МПК / Метки
МПК: C07D 409/14, C07D 417/14, C07D 413/14, C07D 401/14, A61P 9/00, A61K 31/4178
Метки: помощью, крови, замещенные, имидазолы, образцов, композиция, тромбообразования, способ, основе, лечения, нежелательного, профилактики, ингибирования, коагуляции
Код ссылки
<a href="https://eas.patents.su/30-15942-zameshhennye-imidazoly-kompoziciya-na-ih-osnove-sposob-profilaktiki-ili-lecheniya-nezhelatelnogo-tromboobrazovaniya-s-ih-pomoshhyu-i-sposob-ingibirovaniya-koagulyacii-obrazcov-krov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные имидазолы, композиция на их основе, способ профилактики или лечения нежелательного тромбообразования с их помощью и способ ингибирования коагуляции образцов крови</a>
Предыдущий патент: Способ получения полиэтилентерефталата
Следующий патент: Пептидное соединение с антимикробной активностью, полученное из bacillus clausii, и его применение
Случайный патент: Способ контроля помещения на основе индивидуальной гиперчувствительности лиц, находящихся в нем длительное время












