Феноксиуксусные кислоты в качестве активаторов ppar дельта
Номер патента: 15717
Опубликовано: 31.10.2011
Авторы: Могенсен Йохн Патрик, Поливка Зденек, Петтерссон Ингрид, Гавранек Мирослав, Пигера Павел, Сауерберг Пер
Формула / Реферат
1. Соединение общей формулы (I)
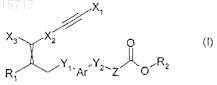
где ![]() представляет собой двойную связь либо с Е-, либо с Z-замещением;
представляет собой двойную связь либо с Е-, либо с Z-замещением;
X1 представляет собой C1-6-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из морфолино, пиперазино, пиперидино или пирролидино;
Х2 представляет собой фенилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена или C1-6-алкила, необязательно замещенного одним или несколькими атомами галогена;
Х3 представляет собой фенил, необязательно замещенный одним или несколькими атомами галогена;
Ar представляет собой фенилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена или C1-6-алкила;
Y1 представляет собой О или S;
Y2 представляет собой О или S;
Z представляет собой -(СН2)n-, где n равно 1;
R1 представляет собой водород;
R2 представляет собой водород или C1-6-алкил,
или его фармацевтически приемлемая соль или его фармацевтически приемлемый сольват либо любые таутомерные формы, стереоизомеры, смесь стереоизомеров, включающая рацемическую смесь, или полиморфы.
2. Соединение по п.1, где X1 представляет собой C1-6-алкил, замещенный морфолино.
3. Соединение по любому из предшествующих пунктов, где Х2 представляет собой фенилен.
4. Соединение по любому из предшествующих пунктов, где Х3 представляет собой фенил, замещенный одним атомом галогена.
5. Соединение по любому из предшествующих пунктов, где Ar представляет собой фенилен, необязательно замещенный метилом.
6. Соединение по любому из предшествующих пунктов, где Y1 представляет собой О.
7. Соединение по любому из предшествующих пунктов, где Y2 представляет собой О.
8. Соединение по любому из предшествующих пунктов, где R2 представляет собой водород.
9. Соединение по п.1, которое представляет собой
(Е)-[2-метил-4-[3-[4-[3-(морфолин-4-ил)пропинил]фенил]-3-фенилаллилокси]фенокси]уксусную кислоту;
(Е)-[4-[3-(4-хлорфенил)-3-[4-(3,3-диметилбутинил)фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Е)-[4-[3-(4-фторфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Е)-[4-[3-(4-хлорфенил)-3-[4-[3-(пирролидин-1-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Е)-[4-[3-(4-хлорфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Е)-[4-[3-(4-бромфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(2-метил-4-{(Z)-3-[4-(3-морфолин-4-ил-проп-1-инил)фенил]-3-фенилаллилокси}фенокси)уксусную кислоту
или его соль с фармацевтически приемлемой кислотой или основанием либо любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы.
10. Соединение по п.1, которое представляет собой
(Z)-[4-[3-(4-фторфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Z)-[4-[3-(4-хлорфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту;
(Z)-[4-[3-(4-хлорфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенил]пропионовую кислоту
или его соль с фармацевтически приемлемой кислотой или основанием либо любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы.
11. Соединение по п.1, которое представляет собой (Е)-[4-[3-(4-фторфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту или его соль с фармацевтически приемлемой кислотой или основанием либо любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы.
12. Соединение по п.1, которое представляет собой (Z)-[4-[3-(4-фторфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенокси]уксусную кислоту или его соль с фармацевтически приемлемой кислотой или основанием, или любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы.
13. Фармацевтическая композиция, включающая в качестве активного компонента по меньшей мере одно соединение по любому из пп.1-12 вместе с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
Текст
Дата публикации и выдачи патента Номер заявки Новые соединения общей формулы (I), применение этих соединений в виде фармацевтических композиций, фармацевтические композиции, включающие такие соединения, и способы лечения с применением таких соединений и композиций. Настоящие соединения являются активаторамиPPAR и должны быть пригодными для лечения состояний, опосредуемых PPAR.(CZ), Петтерссон Ингрид, Могенсен Йохн Патрик (DK) Медведев В.Н. (RU) 015717 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, к применению данных соединений в виде фармацевтических композиций, к фармацевтическим композициям, включающим в себя такие соединения, и способу лечения с применением данных соединений и композиций. Соединения являются активаторами рецепторов, активированных пролифератором пероксисомы (PPAR)-. Уровень техники Заболевание венечной артерии (CAD) является основной причиной смерти у пациентов с диабетом типа 2 и метаболическим синдромом (т.е. пациентов, которые относятся к категории "смертельного квартета": ослабленной толерантности к глюкозе, инсулинорезистентности, гипертриглицеридемии и/или ожирения). Гиполипидемические фибраты и антидиабетические тиазолидиндионы по отдельности проявляют умеренно эффективную, снижающую содержание триглицеридов активность, хотя они не являются ни сильнодействующими, ни эффективными средствами, достаточными для того, чтобы выбрать одну терапию для дислипидемии, часто наблюдаемой у пациентов с диабетом типа 2 или метаболическим синдромом. Тиазолидиндионы также сильно снижают уровни циркулирующей глюкозы на моделях животных и у людей с диабетом типа 2. Однако соединения класса фибратов не оказывают полезные действия на гликемию. Исследования по молекулярным действиям данных соединений показывают, что тиазолидиндионы и фибраты оказывают свое действие посредством явной активации факторов транскрипции семейства рецепторов, активированных пролифератором пероксисомы (PPAR), что приводит к повышенной и пониженной экспрессии специфических ферментов и аполипопротеинов соответственно, которые выполняют ключевые роли в регуляции содержания триглицеридов плазмы. Сначала были сообщения, что активация PPAR не принимает участие в модуляции уровней глюкозы или триглицеридов (Berger и сотрудники, J. Biol. Chem., 1999, vol. 274, p. 6718-6725). Позднее было обнаружено, что активация PPAR приводит к повышенным уровням HDLхолестерина у db/db-мышей (Leibowitz и сотрудники, FEBS letters, 2000, 473, 333-336). Кроме того, агонист PPAR при введении его дозы инсулинорезистентным ожиревшим макакам резус среднего возраста вызывал резкое доза-зависимое повышение содержания в сыворотке HDL-холестерина при снижении уровней LDL (липопротеида низкой плотности), триглицеридов при определении натощак и инсулина при определении натощак (Oliver и сотрудники, PNAS, 2001, 98, 5306-5311). В той же статье показано также, что активация PPAR повышала обратимый перенос холестерина, опосредуемый АТФсвязывающим кластером А 1, и индуцировала аполипопротеин А 1-специфичный отток холестерина. Участие PPAR в окислении жирных кислот в мышцах было далее доказано у PPAR-дефицитных мышей,Muoio и сотрудники (J. Biol. Chem., 2002, 277, 26089-26097) обнаружили, что высокие уровни PPAR в скелетной мышце могут возмещать дефицит PPAR. Помимо влияния на гомеостаз холестерина наблюдали, что обработка PPAR снижает содержание глюкозы и инсулина плазмы и улучшает чувствительность к инсулину у диабетических ob/ob-мышей и мышей с инсулинорезистентностью, вызванной кормом с высоким содержанием жира (PNAS, 2003, 100, 15924-15929). Взятые вместе, эти исследования позволяют предположить, что активация PPAR является полезной при лечении и профилактике диабета типа 2 и сердечно-сосудистых заболеваний и состояний, включающих в себя атеросклероз, гипертриглицеридемию и смешанную дислипидемию (WO 01/00603). Описано, что ряд соединений-активаторов PPAR являются полезными при лечении гипергликемии, гиперлипидемии и гиперхолестеринемии (WO 02/59098, WO 01/603, WO 01/25181, WO 02/14291,WO 01/79197, WO 99/4815, WO 97/28149, WO 98/27974, WO 97/28115, WO 97/27857, WO 97/28137, WO 97/27847 WO 2004093879, WO 2004092117, WO 2004080947, WO 2004080943, WO 2004073606, WO 2004063166, WO 2004063165, WO 2003072100, WO 2004060871, WO 2004005253, WO 2003097607, WO 2003035603, WO 2004000315, WO 2004000762, WO 2003074495, WO 2002070011, WO 2003084916, US 20040209936, WO 2003074050, WO 2003074051, WO 2003074052, JP 2003171275, WO 2003033493, WO 2003016291, WO 2002076957, WO 2002046154, WO 2002014291, WO 2001079197, WO 2003024395, WO 2002059098, WO 2002062774, WO 2002050048, WO 2002028434, WO 2001000603, WO 2001060807, WO 9728149, WO 2001034200, WO 9904815, WO 200125226, WO 2005097098, WO 2005097762 и WO 2005097763). Снижение содержания глюкозы в качестве единственного подхода не позволяет преодолеть проблему макрососудистых осложнений, связанных с диабетом типа 2 и метаболическим синдромом. Новые лечения диабета типа 2 и метаболического синдрома должны быть поэтому предназначены как для снижения явной гипертриглицеридемии, связанной с этими синдромами, так и для ослабления гипергликемии. Это указывает на то, что исследования соединений, проявляющих различную степень активацииPPAR, должны привести к открытию эффективно снижающих содержание триглицерида и/или холестерина, и/или глюкозы лекарственных средств, которые обладают огромным потенциалом при лечении таких заболеваний, как диабет типа 2, дислипидемии, синдром X (включая метаболический синдром, т.е. ослабленную толерантность к глюкозе, инсулинорезистентность, гипертриглицеридемию и/или ожирение), сердечно-сосудистые заболевания (включая атеросклероз) и гиперхолестеринемию.-1 015717 Определения Все ссылки, описанные здесь, включены во всей их полноте в описание в качестве ссылки."Замещенный" означает, что один или несколько атомов водорода заменены обозначенным заместителем. Предполагается, что включены только фармацевтически стабильные соединения. Когда приводятся примеры определений, это не означает, что определение ограничивается конкретными примерами. Настоящее изобретение включает в себя все изотопы атомов, имеющихся в настоящих соединениях. Изотопы включают в себя их атомы, имеющие такое же атомное число, но другие массовые числа. В качестве общего примера и без ограничения указанным изотопы водорода включают в себя тритий и дейтерий. Изотопы углерода включают в себя С-13 и С-14. Когда О или S перечислены в качестве заместителя, оксо и сульфо, соответственно имеется в виду,что атом углерода заменен либо О, либо S. Например, если алкил замещен О, то может быть образован простой эфир. Предпочтительно не образуется связь гетероатом-гетероатом, такая как O-O, O-S, O-N, S-S и S-N. Термин "С 1-6-алкил", применяемый здесь, отдельно или в комбинации, представляет собой неразветвленную или разветвленную насыщенную углеводородную цепь, имеющую указанное число атомов углерода. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метил, этил, н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил и тому подобное. Термин "С 1-6-алкилкарбонил", применяемый здесь, представляет собой "С 1-6-алкильную" группу,которая имеет значения, указанные выше, имеющую указанное число атомов углерода и связанную через карбонильную группу. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метилкарбонил, этилкарбонил, н-пропилкарбонил, изопропилкарбонил, бутилкарбонил, изобутилкарбонил, вторбутилкарбонил, трет-бутилкарбонил, н-пентилкарбонил, изопентилкарбонил, неопентилкарбонил, третпентилкарбонил, н-гексилкарбонил, изогексилкарбонил и тому подобное. Термин "C1-6-алкилксульфонил", применяемый здесь, относится к одновалентному заместителю,включающему в себя "C1-6-алкильную" группу, которая имеет значения, указанные выше, связанную через сульфонильную группу. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метилсульфонил, этилсульфонил, н-пропилсульфонил, изопропилсульфонил, н-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, н-пентилсульфонил, изопентилсульфонил, неопентилсульфонил, трет-пентилсульфонил, н-гексилсульфонил, изогексилсульфонил и тому подобное. Термин "С 1-6-алкиламидо", применяемый здесь, относится к ацильной группе, связанной через аминогруппу. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, ацетиламино, пропиониламино, бутириламино, изобутириламино, пивалоиламино, валериламино и тому подобное. Термин "С 3-6-циклоалкил", применяемый здесь, отдельно или в комбинации, представляет собой насыщенную моноциклическую углеводородную группу, имеющую указанное число атомов углерода. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, циклопропил,циклобутил, циклопентил, циклогексил и тому подобное. Термин "С 2-6-алкенил", применяемый здесь, относится к ненасыщенной разветвленной или неразветвленной углеводородной группе олефинового ряда, имеющий от 2 до указанного числа атомов углерода и по меньшей мере одну двойную связь. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, винил, 1-пропенил, 2-пропенил, аллил, изопропенил, 1,3-бутадиенил,1-бутенил, гексенил, пентенил и тому подобное. Термин "С 2-6-алкинил", применяемый здесь, относится к ненасыщенной разветвленной или неразветвленной углеводородной группе, имеющей от 2 до указанного числа атомов углерода и по меньшей мере одну тройную связь. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил и тому подобное. Термин "С 4-6-алкенинил", применяемый здесь, относится к ненасыщенной разветвленной или неразветвленной углеводородной группе, имеющей от 4 до указанного числа атомов углерода и как по меньшей мере одну двойную связь, так и по меньшей мере одну тройную связь. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, 1-пентен-4-инил, 3-пентен-1-инил,1,3-гексадиен-5-инил и тому подобное. Термин "C1-6-алкокси", применяемый здесь, отдельно или в комбинации, относится к неразветвленной или разветвленной конфигурации, связанной через кислород простой эфирной группы, имеющей свою свободную валентную связь от кислорода простой эфирной группы. Примерами неразветвленных алкоксигрупп являются метокси, этокси, пропокси, бутокси, пентокси, гексокси и тому подобное. Примерами разветвленных алкоксигрупп являются изопропокси, втор-бутокси, трет-бутокси, изопентилокси,изогексилокси и тому подобное. Термин "С 3-6-циклоалкокси", применяемый здесь, отдельно или в комбинации, относится к насы-2 015717 щенной моноциклической углеводородной группе, имеющей указанное число атомов углерода, связанной через кислород простой эфирной группы, имеющей свою свободную валентную связь от кислорода простой эфирной группы. Примерами циклоалкоксигрупп являются циклопропилокси, циклобутилокси,циклопентилокси, циклогексилокси и тому подобное. Термин "C1-6-алкилтио", применяемый здесь, отдельно или в комбинации, относится к неразветвленному или разветвленному одновалентному заместителю, включающему в себя "C1-6-алкильную" группу, которая имеет значения, указанные выше, связанную через двухвалентный атом серы, имеющему свою свободную валентную связь от атома серы и имеющему 1-6 атомов углерода. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метилтио, этилтио, пропилтио,бутилтио, пентилтио и тому подобное. Термин "С 3-6-циклоалкилтио", применяемый здесь, отдельно или в комбинации, относится к насыщенной моноциклической углеводородной группе, имеющей указанное число атомов углерода, связанной через двухвалентный атом серы, имеющей свою свободную валентную связь от атома серы. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, циклопропилтио, циклобутилтио, циклопентилтио, циклогексилтио и тому подобное. Термин "C1-6-алкилсульфинил", применяемый здесь, относится к одновалентному заместителю,включающему в себя неразветвленную или разветвленную С 1-6-алкильную группу, связанную через сульфинильную группу (-S(=O)-); такому как, например, метилсульфинил, этилсульфинил, изопропилсульфонил, бутилсульфинил, пентилсульфинил и тому подобное. Термин "С 3-6-циклоалкилсульфинил", применяемый здесь, относится к одновалентному заместителю, включающему в себя C3-6-циклоакильную группу, связанную через сульфинильную группу (-S(=O)-); такому как, например, циклопропилсульфинил, циклобутилсульфинил, циклопентилсульфинил, циклогексилсульфинил и тому подобное. Термин "C1-6-алкиламино", применяемый здесь, отдельно или в комбинации, относится к неразветвленному или разветвленному одновалентному заместителю, включающему в себя "C1-6-алкильную" группу, которая имеет значения, указанные выше, и связана через амино, имеющему свою свободную валентную связь от атома азота. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метиламино, этиламино, пропиламино, бутиламино, пентиламино и тому подобное. Термин "C1-6-алкиламинокарбонил", применяемый здесь, относится к одновалентному заместителю,включающему в себя C1-6-моноалкиламиногруппу, связанную через карбонильную группу, такому как,например, метиламинокарбонил, этиламинокарбонил, н-пропиламинокарбонил, изопропиламинокарбонил, н-бутиламинокарбонил, втор-бутиламинокарбонил, изобутиламинокарбонил, трет-бутиламинокарбонил, н-пентиламинокарбонил, 2-метилбутиламинокарбонил, 3-метилбутиламинокарбонил, н-гексиламинокарбонил, 4-метилпентиламинокарбонил, неопентиламинокарбонил, н-гексиламинокарбонил и 2,2 диметилпропиламинокарбонил и тому подобное. Термин "C3-6-циклоалкиламино", применяемый здесь отдельно или в комбинации, относится к насыщенной моноциклической углеводородной группе, имеющей указанное число атомов углерода, связанной через амино, имеющей свободную валентную связь от атома азота. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, циклопропиламино, циклобутиламино, циклопентиламино, циклогексиламино и тому подобное. Термин "C1-6-алкоксиС 1-6-алкил", применяемый здесь, отдельно или в комбинации, относится к"C1-6-алкильной" группе, значение которой указывается выше, которая присоединена к "C1-6-алкоксигруппе", значение которой указывается выше. Репрезентативные примеры его включают в себя, но не ограничиваются перечисленным, метоксиметил, этоксиметил, метоксиэтил, этоксиэтил и тому подобное. Имеется в виду, что термин "арил", применяемый здесь, включает в себя моноциклические, бициклические или полициклические карбоциклические ароматические кольца. Репрезентативными примерами являются фенил, нафтил (например, нафт-1-ил, нафт-2-ил), антрил(например, антр-1-ил, антр-9-ил), фенантрил (например, фенантр-1-ил, фенантр-9-ил) и тому подобное. Предполагается также, что арил включает в себя моноциклические, бициклические или полициклические карбоциклические ароматические кольца, замещенные карбоциклическими ароматическими кольцами. Репрезетативными примерами являются бифенил (например, бифенил-2-ил, бифенил-3-ил, бифенил-4 ил), фенилнафтил (например, 1-фенилнафт-2-ил, 2-фенилнафт-1-ил) и тому подобное. Предполагается также, что арил включает в себя частично насыщенные бициклические или полициклические карбоциклические кольца по меньшей мере с одной ненасыщенной частью (например, бензочастью). Репрезентативными примерами являются инданил (например, индан-1-ил, индан-5-ил), инденил (например, инден 1-ил, инден-5-ил), 1,2,3,4-тетрагидронафтил (например, 1,2,3,4-тетрагидронафт-1-ил, 1,2,3,4 тетрагидронафт-2-ил, 1,2,3,4-тетрагидронафт-6-ил), 1,2-дигидронафтил (например, 1,2-дигидронафт-1 ил, 1,2-дигидронафт-4-ил, 1,2-дигидронафт-6-ил), флуоренил (например, флуорен-1-ил, флуорен-4-ил,флуорен-9-ил) и тому подобное. Предполагается также, что арил включает в себя частично насыщенные бициклические или полициклические карбоциклические ароматические кольца, содержащие один или два мостика. Репрезентативными примерами являются бензонорборнил (например, бензонорборн-3-ил,-3 015717 бензонорборн-6-ил), 1,4-этано-1,2,3,4-тетрагидронафтил (например, 1,4-этано-1,2,3,4-тетрагидронафт-2 ил, 1,4-этано-1,2,3,4-тетрагидронафт-10-ил) и тому подобное. Предполагается также, что арил включает в себя частично насыщенные бициклические или полициклические карбоциклические ароматические кольца, содержащие один или несколько спироатомов. Репрезентативными примерами являются спиро[циклопентан-1,1'-индан]-4-ил, спиро[циклопентан-1,1'-инден]-4-ил, спиро[пиперидин-4,1'-индан]-1 ил, спиро[пиперидин-3,2'-индан]-1-ил, спиро[пиперидин-4,2'-индан]-1-ил, спиро[пиперидин-4,1'-индан]3'-ил, спиро[пирролидин-3,2'-индан]-1-ил, спиро[пирролидин-3,1'-(3',4'-дигидронафталин)]-1-ил, спиро[пиперидин-3,1'-(3',4'-дигидронафталин)]-1-ил,спиро[пиперидин-4,1'-(3',4'-дигидронафталин)]-1-ил,спиро[имидазолидин-4,2'-индан]-1-ил, спиро[пиперидин-4,1'-инден]-1-ил и тому подобное. Другими примерами "арила" являются фенил, нафтил, антраценил, фенантренил, азуленил, флуоренил, инденил и пенталенил. Термин "арилен", применяемый здесь, относится к двухвалентной ароматической моноциклической или двухвалентной ароматической конденсированной би- или трициклической углеводородной группе. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, фенилен, нафтилен и тому подобное. Термин "арилкарбонил", применяемый здесь, относится к радикалу арил-С(=O)-. Репрезентативными примерами являются бензоил, нафтилкарбонил, 4-фенилбензоил, антрилкарбонил, фенантрилкарбонил, азуленилкарбонил и тому подобное. Термин "гетероарилкарбонил", применяемый здесь, относится к радикалу гетероарил-С(=O)-. Репрезентативными примерами являются пиридинилкарбонил (например, пиридин-2-илкарбонил, пиридин-4-илкарбонил), хинолинилкарбонил(например, 2-(хинолин-2-ил)карбонил,1-(хинолин-2 ил)карбонил), имидазолилкарбонил (например, имидазол-2-илкарбонил, имидазол-5-илкарбонил) и тому подобное. Термин "арилсульфонил", применяемый здесь, относится к "арильной" группе, которая имеет значения, указанные выше, связанной через сульфонильную группу. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, фенилсульфонил, нафтилсульфонил, антраценилсульфонил, фенантренилсульфонил, азуленилсульфонил и тому подобное. Термин "ариламидо", применяемый здесь, относится к арилкарбонильной группе, связанной через аминогруппу. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, фенилкарбониламино, нафтилкарбониламино, антраценилкарбониламино, фенантренилкарбониламино, азуленилкарбониламино и тому подобное. Термин "галоген" означает атом фтора, хлора, брома или йода. Термин "пергалогенметил" означает трифторметил, трихлорметил, трибромметил или трийодметил. Термин "пергалогенметокси" означает трифторметокси, трихлорметокси, трибромметокси или трийодметокси. Термин "C1-6-диалкиламино", применяемый здесь, относится к аминогруппе, у которой два атома водорода независимо замещены неразветвленной или разветвленной насыщенной углеводородной цепью, имеющей указанное число атомов углерода. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, N,N-диметиламино, N-этил-N-метиламино, N,N-диэтиламино, N, N-дипропиламино (например, N,N-(проп-1-ил)2 амино, N,N-(проп-2-ил)2 амино, N,N-(проп-3-ил)2 амино, N-(бут-1-ил)-N-метиламино, N,N-(пент-1-ил)2 амино и тому подобное. Термин "ацил", применяемый здесь, относится к одновалентному заместителю, включающему в себя "C1-6-алкильную" группу, значение которой указывается выше, связанную через карбонильную группу. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, ацетил, пропионил, бутирил, изобутирил, пивалоил, валерил и тому подобное. Термин "гетероарил", применяемый здесь, отдельно или в комбинации, относится к одновалентному заместителю, включающему в себя 5-7-членную моноциклическую ароматическую систему или 8-10 членную бициклическую ароматическую систему, содержащую один или несколько гетероатомов, выбранных из атома азота, кислорода и серы. Примерами "гетероарила" являются пирролил (например,пиррол-1-ил, пиррол-2-ил, пиррол-3-ил), фуранил (например, фуран-2-ил, фуран-3-ил), тиенил (например, тиен-2-ил, тиен-3-ил), оксазолил (например, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил), тиазолил(например, 1,2,3,4-тетрагидрохиноксалинил, 5,6,7,8-тетрагидрохиноксалинил), спиро[изохинолин-3,1'циклогексан]-1-ил, спиро[пиперидин-4,1'-бензо[с]тиофен]-1-ил, спиро[пиперидин-4,1'-бензо[с]фуран]-1 ил, спиро[пиперидин-4,3'-бензо[с]фуран]-1-ил, спиро[пиперидин-4,3'-кумарин]-1-ил. Другими примерами "гетероарила" являются фурил, тиенил, пирролил, имидазолил, пиразолил,триазолил, пиридил, пиразинил, пиримидинил, пиридазинил, изотиазолил, изоксазолил, оксазолил, оксадиазолил, тиадиазолил, хинолил, изохинолил, хиназолинил, хиноксалинил, индолил, бензимидазолил,бензофуранил, бензотиенил, бензоксазолил, тетразолил, карбазолил, птеридинил и пуринил. Термин "гетероарилен", применяемый здесь, отдельно или в комбинации, относится к двухвалентной 5-7-членной моноциклической ароматической системе или 8-10-членной бициклической ароматической системе, содержащей один или несколько гетероатомов, выбранных из атома азота, кислорода и серы, например, фурилену, тиенилену, пирролилену, имидазолилену, пиразолилену, триазолилену, пиридилену, пиразинилену, пиримидинилену, пиридазинилену, изотиазолилену, изоксазолилену, оксазолилену, оксадиазолилену, тиадиазолилену, хинолилену, изохинолилену, хиназолинилену, хиноксалинилену,индолилену, бензимидазолилену, бензофуранилену, бензотиенилену, птеридинилену и пуринилену и тому подобному.-5 015717 Термин "гетероарилокси", применяемый здесь, отдельно или в комбинации, относится к гетероарилу, имеющему значения, указанные выше, связанному с атомом кислорода, имеющему свою свободную валентную связь от атома кислорода, например пирролилокси, имидазолилокси, пиразолилокси, триазолилокси, пиразинилокси, пиримидинилокси, пиридазинилокси, изотиазолилокси, изоксазолилокси, оксазолилокси, оксадиазолилокси, тиадиазолилокси, хинолинилокси, изохинолинилокси, хиназолинилокси,хиноксалинилокси, индолилокси, бензимидазолилокси, бензофуранилокси, птеридинилокси и пуринилокси и тому подобное. Термин "аралкил", применяемый здесь, относится к неразветвленной или разветвленной насыщенной углеродной цепи, содержащей 1-6 атомов углерода и замещенной ароматическим углеводородом. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, бензил, фенетил, 3 фенилпропил, 1-нафтилметил, 2-(1-нафтил)этил и тому подобное. Термин "арилокси", применяемый здесь, относится к фенокси, 1-нафтилокси, 2-нафтилокси и тому подобному. Термин "аралкокси", применяемый здесь, относится к C1-6-алкоксигруппе, замещенной ароматическим углеводородом, такой как бензилокси, фенетокси, 3-фенилпропокси, 1-нафтилметокси, 2-(1 нафтил)этокси и тому подобное. Термин "гетероаралкил", применяемый здесь, относится к неразветвленной или разветвленной насыщенной углеродной цепи, содержащей 1-6 атомов углерода и замещенной гетероарильной группой,такой как (2-фурил)метил, (3-фурил)метил), (2-тиенил)метил, (3-тиенил)метил, (2-пиридил)метил, 1 метил-1-(2-пиримидил)этил и тому подобное. Термин "гетероаралкокси", применяемый здесь, относится к гетероарилалкилу, имеющему значения, указанные здесь, связанному с атомом кислорода и имеющему свою свободную валентность от атома кислорода. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, (2 фурил)метил, (3-фурил)метил, (2-тиенил)метил, (3-тиенил)метил, (2-пиридил)метил, 1-метил-1-(2 пиримидил)этил, связанные с атомом кислорода, и тому подобное. Термин "арилтио", применяемый здесь, отдельно или в комбинации, относится к арильной группе,связанной через двухвалентный атом серы и имеющей свою свободную валентную связь от атома серы,причем арильная группа является необязательно моно- или полизамещенной C1-6-алкилом, галогеном,гидрокси или C1-6-алкокси. Репрезентативные примеры включают в себя, но не ограничиваются перечисленным, фенилтио, (4-метилфенил)тио, (2-хлорфенил)тио и тому подобное. Термин "гетероциклил" или "гетероцикл" означает моно-, би- или трициклическое кольцо, состоящее из атомов углерода и одного-трех гетероатомов, где гетероатом выбран из атома кислорода, азота и серы. Если присутствует атом серы, то он может быть в виде S, S(О) или S(O)2. Если присутствует атом азота, то он может быть в виде N, NH, замещенного N или N-оксида. Гетероцикл имеет насыщенное или частично насыщенное кольцо. 0-2 СН 2-группы гетероцикла могут быть заменены С(О). Гетероцикл может быть присоединен через атом углерода или азота, если только связывание через атом азота не приведет к образованию четвертичного атома азота. Если гетероцикл является бициклическим, то гетероатом(ы) может присутствовать в одном или обоих кольцах. Если гетероцикл является трициклическим, то гетероатом(ы) может присутствовать в одном, двух или всех трех из колец. Примерами "гетероцикла" являются азиридинил (например, азиридин-1-ил), азетидинил (например, азетидин-1-ил, азетидин-3-ил),оксетанил, пирролидинил (например, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил), имидазолидинил (например, имидазолидин-1-ил, имидазолидин-2-ил, имидазолидин-4-ил), оксазолидинил (например, оксазолидин-2-ил, оксазолидин-3-ил, оксазолидин-4-ил), тиазолидинил (например, тиазолидин-2-ил,тиазолидин-3-ил, тиазолидин-4-ил), изотиазолидинил, пиперидинил (например, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил), гомопиперидинил (например, гомопиперидин-1-ил, гомопиперидин-2-ил, гомопиперидин-3-ил, гомопиперидин-4-ил), пиперазинил (например, пиперазин-1-ил, пиперазин-2-ил), морфолинил (морфолин-2-ил, морфолин-3-ил, морфолин-4-ил), тиоморфолинил (тиоморфолин-2-ил, тиоморфолин-3-ил, тиоморфолин-4-ил), 1-оксотиоморфолинил, 1,1-диоксотиоморфолинил,тетрагидрофуранил (например, тетрагидрофуран-2-ил, тетрагидрофуран-3-ил), тетрагидротиенил, тетрагидро-1,1-диоксотиенил, тетрагидропиранил (например, 2-тетрагидропиранил), тетрагидротиопиранил(например, 2-тетрагидротиопиранил), 1,4-диоксанил, 1,3-диоксанил, октагидроиндолил (например, октагидроиндол-1-ил, октагидроиндол-2-ил, октагидроиндол-3-ил, октагидроиндол-5-ил), декагидрохинолинил (например, декагидрохинолин-1-ил, декагидрохинолин-2-ил, декагидрохинолин-3-ил, декагидрохинолин-4-ил, декагидрохинолин-6-ил), декагидрохиноксалинил (например, декагидрохиноксалин-1-ил,декагидрохиноксалин-2-ил,декагидрохиноксалин-6-ил),3-азабицикло[3.2.2]нонил,2-азабицикло[2.2.1]гептил, 3-азабицикло[3.1.0]гексил, 2,5-диазабицикло[2.2.1]гептил, атропинил, тропинил, хинуклидинил, 1,4-диазабицикло[2.2.2]октанил, 1,4-диоксаспиро[4.5]деканил (например, 1,4-диоксаспиро[4.5]декан-2-ил, 1,4-диоксаспиро[4.5]декан-7-ил), 1,4-диокса-8-азаспиро[4.5]деканил (например, 1,4 диокса-8-азаспиро[4.5]декан-2-ил, 1,4-диокса-8-азаспиро[4.5]декан-8-ил), 8-азаспиро[4.5]деканил (например, 8-азаспиро[4.5]декан-1-ил, 8-азаспиро[4.5]декан-8-ил), 2-азаспиро[5.5]ундеканил (например, 2 азаспиро[5.5]ундекан-2-ил), 2,8-диазаспиро[4.5]деканил (например, 2,8-диазаспиро[4.5]декан-2-ил,2,8-диазаспиро[4.5]декан-8-ил), 2,8-диазаспиро[5.5]ундеканил (например, 2,8-диазаспиро[5.5]ундекан-2-6 015717 ил, 1,3,8-триазаспиро[4.5]деканил (например, 1,3,8-триазаспиро[4.5]декан-1-ил, 1,3,8-триазаспиро[4.5]декан-3-ил и 1,3,8-триазаспиро[4.5]декан-8-ил). Другими примерами "гетероцикла" являются пирролидинил, пирролинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил,имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, оксазолидинил, оксазолин, изоксазолидинил, изоксазолин, тиоксазолидинил, тиоксазолин, изотиоксазолидинил, изотиоксазолин, триазолидинил, триазолинил, тетразолидинил, тетразолинил, тетрагидропиранил, дигидропиранил, пиран, пиперидинил, пиперазинил, гомопиперазинил, морфолино, тиоморфолино и 1,1-диоксотиоморфолино. Термин "пяти-восьмичленное кольцо", применяемый здесь, относится к насыщенной или ненасыщенной, замещенной или незамещенной углеводородной цепи или содержащей гетероатом углеводородной цепи, имеющей 3-6 атомов, где атом углерода в Ar, к которому они присоединены, и соседний атом углерода образуют пяти-восьмичленное кольцо. Некоторые из указанных выше терминов могут встречаться в структурных формулах более чем один раз и в таком случае каждый термин будет иметь значение, независимое от другого. Термин "необязательно замещенный", применяемый здесь, означает, что рассматриваемые группы являются либо незамещенными, либо замещенными одним или несколькими указанными заместителями. Когда рассматриваемые группы являются замещенными более чем одним заместителем, заместители могут быть одинаковыми или разными. Термин "пролекарство", применяемый здесь, включает в себя биогидролизуемые амиды и биогидролизуемые сложные эфиры и включает в себя также а) соединения, у которых биогидролизуемая функциональная группа такого пролекарства включена в соединение согласно настоящему изобретению, и b) соединения, которые могут быть окислены или восстановлены биологическим образом в данной функциональной группе с образованием лекарственных средств согласно настоящему изобретению. Примеры этих функциональных групп включают в себя 1,4-дигидропиридин, N-алкилкарбонил-1,4 дигидропиридин, 1,4-циклогексадиен, трет-бутил и тому подобное. Термин "лечение" охватывает лечение патологического состояния у млекопитающего, особенно у человека, и включает в себя (а) профилактику патологического состояния, появляющегося у млекопитающего, особенно, когда такое млекопитающее имеет предрасположение к патологическому состоянию,но которое еще у него не диагностировано; (b) подавление патологического состояния, например остановку или замедление его развития, и/или облегчение такого патологического состояния, например, посредством обратного развития самого патологического состояния или некоторых симптомов патологического состояния. Термин "фармацевтически приемлемый" определяют как подходящий для введения людям без нежелательных результатов. Предполагается, что термин "терапевтически эффективное количество" включает в себя количество соединения настоящего изобретения, которое является эффективным при введении его отдельно или в комбинации для активации глюкокиназы. Описание изобретения Настоящее изобретение относится к соединениям общей формулы (I) где представляет собой двойную связь либо с Е-, либо с Z-замещением;X1 представляет собой C1-6-алкил, необязательно замещенный одним или несколькими заместителями, выбранными из морфолино, пиперазино, пиперидино или пирролидино; Х 2 представляет собой фенилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена или C1-6-алкила, необязательно замещенного одним или несколькими атомами галогена; Х 3 представляет собой фенил, необязательно замещенный одним или несколькими атомами галогена;Ar представляет собой фенилен, необязательно замещенный одним или несколькими заместителями, выбранными из галогена или C1-6-алкила;R2 представляет собой водород или C1-6-алкил, или их фармацевтически приемлемым солям или их фармацевтически приемлемым сольватам либо любым таутомерным формам, стереоизомерам, смеси стереоизомеров, включающей в себя рацемическую смесь, или полиморфам.-7 015717 В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где X1 представляет собой C1-6-алкил, замещенный морфолино. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где Х 2 представляет собой фенилен. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где Х 3 представляет собой фенил, замещенный одним атомом галогена. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где Ar представляет собой фенилен, необязательно замещенный метилом. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где Y1 представляет собой О. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где Y2 представляет собой О. В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы (I), где R2 представляет собой водород. Примерами соединений изобретения являются(2-метил-4-(Z)-3-[4-(3-морфолин-4-ил-проп-1-инил)фенил]-3-фенилаллилоксифенокси)уксусная кислота или его соль с фармацевтически приемлемой кислотой или основанием либо любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы. Другими примерами соединений изобретения являются(Z)-[4-[3-(4-хлорфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]-2-метилфенил]пропионовая кислота или его соль с фармацевтически приемлемой кислотой или основанием либо любой оптический изомер или смесь оптических изомеров, включая рацемическую смесь, или любые таутомерные формы. Настоящее изобретение включает в себя также фармацевтически приемлемые соли настоящих соединений. Такие соли включают в себя фармацевтически приемлемые кислотно-аддитивные соли, фармацевтически приемлемые основно-аддитивные соли, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Кислотно-аддитивные соли включают в себя соли неорганических кислот, а также органических кислот. Репрезентативные примеры подходящих неорганических кислот включают в себя хлористо-водородную, бромисто-водородную, йодисто-водородную, фосфорную,серную, азотную кислоты и тому подобное. Репрезентативные примеры подходящих органических кислот включают в себя муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, молочную, малеиновую, яблочную, малоновую,миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую,этансульфоновую, винную, аскорбиновую, памоевую, бис-метиленсалициловую, этандисульфоновую,глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, паминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, сульфаты, нитраты, фосфаты, перхлораты, бораты, ацетаты, бензоаты, гидроксинафтоаты, глицерофосфаты, кетоглутараты и тому подобное. Следующие примеры фармацевтически приемлемых аддитивных солей неорганических или органических кислот включают в себя фармацевтически приемлемые соли, перечисленные в публикации J. Pharm. Sci., 1977, 66, 2, которая включена здесь в качестве ссылки. Примеры солей металлов включают в себя соли лития, натрия, калия, магния, цинка, кальция и тому подобное. Примеры аминов и органических аминов включают в себя аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, пропиламин, бутиламин, тетраметиламин, этаноламин, диэтаноламин, триэтаноламин,меглумин, этилендиамин, холин, N,N'-дибензилэтилендиамин, N-бензилфенилэтиламин, N-метил-Dглюкамин, гуанидин и тому подобное. Примеры катионных аминокислот включают в себя лизин, арги-8 015717 нин, гистидин и тому подобное. Фармацевтически приемлемые соли получают взаимодействием соединения формулы (I) с 1-4 экв. основания, такого как гидроксид натрия, метоксид натрия, гидрид натрия, трет-бутоксид калия, гидроксид кальция, гидроксид магния и тому подобное, в растворителях, таких как простой эфир, ТГФ, метанол, трет-бутанол, диоксан, изопропанол, этанол и так далее. Можно применять смесь растворителей. Можно также применять органические основания, такие как лизин, аргинин, диэтаноламин, холин, гуанидин и их производные и так далее. В альтернативном случае кислотно-аддитивные соли всегда, когда это применимо, получают обработкой кислотами, такими как хлористо-водородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, п-толуолсульфоновая кислота,метансульфоновая кислота, уксусная кислота, лимонная кислота, малеиновая кислота, салициловая кислота, гидроксинафтойная кислота, аскорбиновая кислота, пальмитиновая кислота, янтарная кислота,бензойная кислота, бензолсульфоновая кислота, винная кислота и тому подобное, в растворителях, таких как этилацетат, простой эфир, спирты, ацетон, ТГФ, диоксан и так далее. Можно также применять смесь растворителей. Стереоизомеры соединений, образующих часть данного изобретения, можно получить с применением реагентов в их индивидуальной энантиомерной форме в способе, когда он является применимым,или проведением реакции в присутствии реагентов или катализаторов в их индивидуальной энантиомерной форме, или разделением смеси стереоизомеров общепринятыми методами. Некоторые из предпочтительных методов включают в себя применение микробного разделения, ферментативного разделения,разделения диастереомерных солей, образованных с хиральными кислотами, такими как миндальная кислота, камфорасульфоновая кислота, винная кислота, молочная кислота и тому подобное, когда они являются пригодными, или с хиральными основаниями, такими как бруцин, (R)- или (S)-фенилэтиламин,алкалоиды хинного дерева и их производные и тому подобное. Обычно применяемые методы собраныJaques и сотрудниками в "Enantiomers, Racemates and Resolution" (Wiley Interscience, 1981). Более конкретно, соединение формулы (I) можно превратить в смесь 1:1 диастереомерных амидов обработкой хиральными аминами, аминокислотами, аминоспиртами, полученными из аминокислот; для превращения кислоты в амид можно применять общепринятые условия реакции; диастереомеры можно разделить либо фракционной кристаллизацией, либо хроматографией, и стереоизомеры соединения формулы (I) можно получить гидролизом чистого диастереомерного амида. Различные полиморфы соединения общей формулы (I), образующих часть данного изобретения,можно получить кристаллизацией соединения формулы (I) при различных условиях. Например, применением обычно применяемых для перекристаллизации различных растворителей или их смесей, кристаллизации при различных температурах; различных методов охлаждения, варьирующихся от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфы можно также получить нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением. Присутствие полиморфов можно определить ЯМР-спектроскопией твердой образца, ИК-спектроскопией,дифференциальной сканирующей калориметрией, порошковой рентгенографией или другими такими методиками. Соединения настоящего изобретения можно превращать в сольваты со стандартными растворителями с низкой молекулярной массой с применением методов, хорошо известных специалисту в данной области. Такие сольваты также рассматриваются как находящиеся в пределах объема настоящего изобретения. Примерами сольватов являются гидраты, которые способны образовывать настоящие соединения. Изобретение относится также к фармацевтическим композициям, включающим в себя в качестве активного ингредиента по меньшей мере одно соединение формулы (I) или любой его оптический или геометрический изомер либо таутомерную форму, включая их смеси, или его фармацевтически приемлемую соль вместе с одним или несколькими фармацевтически приемлемыми носителями или разбавителями. Фармацевтические композиции Соединения изобретения можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями или эксципиентами в виде дозы либо для однократного, либо многократного приема. Фармацевтические композиции согласно изобретению можно изготовить с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными адъювантами и эксципиентами согласно общепринятым методикам, таким как методики, описанные в Remington: The Science andPractice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Композиции можно изготовлять в общепринятых формах, например в виде капсул, таблеток, аэрозолей, растворов, суспензий, или в формах для местного применения. Типичные композиции включают в себя соединение формулы (I) или его фармацевтически приемлемую кислотно-аддитивную соль, ассоциированную с фармацевтически приемлемым эксципиентом,которым может быть носитель или разбавитель, или разбавленную носителем, или включенную в носитель, который может быть в форме капсулы, саше, бумаги или другого контейнера. При изготовлении композиций можно применять общепринятые методики изготовления фармацевтических композиций.-9 015717 Например, активное соединение обычно смешивают с носителем, или разбавляют носителем, или включают в носитель, который может быть в форме ампулы, капсулы, саше, бумаги или другого контейнера. Когда носитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует в качестве наполнителя, эксципиента или среды для активного соединения. Активное соединение может быть адсорбировано на гранулированном твердом контейнере, например в саше. Некоторыми примерами подходящих носителей являются вода, растворы солей, спирты, полиэтиленгликоли, полигидроксиэтоксилированное касторовое масло, арахисовое масло, оливковое масло, желатин, лактоза, сульфат кальция, сахароза, циклодекстрин, амилоза, стеарат магния, тальк, глутин, агар,пектин, аравийская камедь, стеариновая кислота или низшие алкиловые эфиры целлюлозы, кремниевая кислота, жирные кислоты, амины жирных кислот, моноглицериды и диглицериды жирных кислот, эфиры пентаэритрита и жирных кислот, полиоксиэтилен, гидроксиметилцеллюлоза и поливинилпирролидон. Аналогично этому, носитель или разбавитель может включать в себя любое вещество с замедленным высвобождением, известное в данной области, такое как глицерилмоностеарат или глицерилдистеарат,применяемый отдельно или в смеси с воском. Препараты могут включать в себя также увлажняющие агенты, эмульгирующие и суспендирующие агенты, консерванты, подслащивающие агенты или корригенты. Препараты изобретения могут быть изготовлены так, чтобы обеспечить быстрое, стойко поддерживаемое или задержанное высвобождение активного ингредиента после введения пациенту, с применением методик, хорошо известных в данной области. Фармацевтические композиции можно стерилизовать и смешать, если необходимо, с вспомогательными агентами, эмульгаторами, солью для влияния на осмотическое давление, буферами и/или окрашивающими веществами и тому подобное, которые не взаимодействуют вредным образом с активными соединениями. Путем введения может быть любой путь, который эффективно переносит активное соединение к подходящему или требуемому месту действия, например оральный, назальный, легочный, трансдермальный или парентеральный путь, например ректальный, путь, посредством применения препарата в виде депо, подкожный, внутривенный, внутриуретральный, внутримышечный, интраназальный путь, офтальмического раствора или мази, причем предпочтительным путем является пероральный путь. Если твердый носитель применяют для перорального введения, препарат может быть таблетирован,помещен в форме порошка или гранул в твердую желатиновую капсулу или он может быть в форме пастилки или лепешки. Если применяют жидкий носитель, препарат может быть в форме сиропа, эмульсии,мягкой желатиновой капсулы или стерильной инъецируемой жидкости, такой как водная или неводная жидкая суспензия или раствор. Для назального введения при аэрозольном применении препарат может содержать соединение формулы (I), растворенное или суспендированное в жидком носителе, в частности водном носителе. Носитель может содержать добавки, такие как солюбилизирующие агенты, например пропиленгликоль,поверхностно-активные вещества, агенты для усиления абсорбции, такие как лецитин (фосфатидилхолин) или циклодекстрин, или консерванты, такие как парабены. Для парантерального применения особенно подходящими являются инъецируемые растворы или суспензии, предпочтительно водные растворы с активным соединением, растворенным в полигидроксилированном касторовом масле. Таблетки, драже или капсулы, содержащие тальк и/или углеводный носитель или связывающее вещество или тому подобное, являются особенно подходящими для орального применения. Предпочтительные носители для таблеток, драже или капсул включают в себя лактозу, кукурузный крахмал и/или картофельный крахмал. Сироп или эликсир можно применять в случаях, когда применяют подслащивающий наполнитель. Типичная таблетка, которую можно получить общепринятыми методиками таблетирования, может содержать: сердцевина: Если необходимо, фармацевтическая композиция изобретения может включать в себя соединение формулы (I) в комбинации с дополнительными фармацевтически активными веществами, такие как вещества, описанные выше. Соединения изобретения можно вводить млекопитающему, особенно человеку, нуждающемуся в таком лечении, профилактике, устранении, ослаблении или уменьшении интенсивности симптомов заболеваний, связанных с регуляцией уровня сахара в крови. Такие млекопитающие включают в себя также животных, как домашних животных, например домашних питомцев, так и недомашних животных, таких как дикие животные. Соединения изобретения являются эффективными в пределах широкого диапазона доз. Типичная пероральная доза находится в диапазоне от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в день, предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг массы тела в день и более предпочтительно от приблизительно 0,05 до приблизительно 10 мг/кг массы тела в день, такую дозу вводят в виде одной или нескольких доз, например 1-3 доз. Точная доза может зависеть от частоты и способа введения, пола, возраста, массы и общего состояния подвергаемого лечению субъекта, природы и тяжести подвергаемого лечению состояния и любых сопутствующих заболеваний, подвергаемых лечению, и других факторов, очевидных специалисту в данной области. Препараты могут быть подходящим образом изготовлены в виде дозированной лекарственной формы способами, известными специалисту в данной области. Типичная дозированная лекарственная форма для перорального введения один или несколько раз в день, например 1-3 раза в день, может содержать от 0,05 до приблизительно 1000 мг, предпочтительно от приблизительно 0,1 до приблизительно 500 мг и более предпочтительно от приблизительно 0,5 до приблизительно 200 мг. Считается, что любой новый признак или комбинация признаков, описанных здесь, являются важными для данного изобретения. Примеры Нижеследующие примеры и общие методики относятся к промежуточным соединениям и конечным продуктам, указанным в описании и в схемах синтеза. Получение соединений настоящего изобретения описывается подробно с применением нижеследующих примеров. Иногда описываемая реакция не может быть применимой для каждого соединения, включенного в пределы описанного объема изобретения. Соединения, для которых это имеет место, может легко распознавать специалист в данной области. В этих случаях реакции можно удачно проводить общепринятыми модификациями, известными специалисту в данной области, то есть подходящих защитных групп, мешающих проведению реакции, заменой на другие общепринятые реагенты или общепринятой модификацией условий реакции. В альтернативном случае для получения соответствующих соединений изобретения могут быть пригодными другие реакции, описанные здесь, или, в противном случае, общепринятые реакции. Во всех препаративных способах все исходные вещества являются известными или их можно легко получить из известных исходных веществ. Структуры соединений подтверждают ядерным магнитным резонансом (ЯМР). Сдвиги ЯМР даны в частях на миллион (м.д.). Т.пл. является точкой плавления и указывается в С. Аббревиатуры, применяемые в примерах, имеют следующие значения: Общая методика (А) Стадия А. Реакция соединения формулы (II) где Х 3 имеет значения, указанные выше, с пропаргиловым спиртом с применением условий реакции Соногашира для получения соединения формулы (III)- 11015717 Стадия В. Сочетание соединения III с соединением галоген-Х 2-галоген с применением LiAlH4 с последующим прямым Pd-сочетанием для получения методикой в одном сосуде соединения формулы (IV) где Х 2 и Х 3 имеют значения, указанные выше. Стадия С. Реакция соединения формулы (IV), где Х 2 и Х 3 имеют значения, указанные выше, с соединением где Y1, Ar, Y2, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом, в условиях Митсунобу с применением такого реагента, как трифенилфосфин/диэтилазодикарбоксилат и тому подобное, для получения соединения формулы (VI) где Х 2, Х 3, Y1, Y2, Ar, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Стадия D. Реакция соединения формулы (VI), где Х 2, X3, Y1, Y2, Ar, Z и R2 имеют значения, указанные выше, с соединением формулы (VII) где X1 имеет значения, указанные выше, с применением условий реакции Соногашира для получения соединения формулы (I), где X1, X2, Х 3, Y1, Y2, Ar, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Общая методика (В) Стадия А. Превращение функциональной группы -ОН в соединении формулы (IV), где Х 2 и Х 3 имеют значения, указанные выше, в подходящую уходящую группу (L), такую как п-толуолсульфонат, метансульфонат, галоген (например, методами, согласно Houben-Weyl, Methoden der organischen Chemie, Alkohole III,6/1b, Thieme-Verlag 1984, 4th Ed., p. 927-939; Comprehensive Organic Transformations. A guide to functionalgroup preparations, VCH Publishers, 1989, 1st Ed., p. 353-363 и J. Org. Chem., vol. 36 (20), 3044-3045, 1971),трифлат(трифторметансульфонат) и тому подобное, для получения соединения формулы (VIII) где Х 2 и Х 3 имеют значения, указанные выше, и L представляет собой уходящую группу, такую как п-толуолсульфонат, метансульфонат, галоген, трифлат и тому подобное. Стадия В. Реакция соединения формулы (VIII)- 12015717 где L представляет собой уходящую группу, такую как п-толуолсульфонат, метансульфонат, галоген, трифлат и тому подобное и где где Х 2 и Х 3 имеют значения, указанные выше, с соединением формулы (V) где Y1, Ar, Y2, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом, для получения соединения формулы (VI) где Х 2, Х 3, Y1, Y2, Ar, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Общая методика (С) Стадия А. Реакция соединения формулы (IX) где Х 2, Х 3 и R1 имеют значения, указанные выше, с соединением формулы (VII) где X1 имеет значения, указанные выше, в условиях реакции Соногашира, для получения соединения формулы (X) где X1, Х 2, Х 3, Y1, Y2, Ar, Z, R1 и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Стадия В. Реакция соединения формулы (X) где Х 2, Х 3, Y1, Y2, Ar, Z, R1 и R2 имеют значения, указанные выше, с соединением формулы (VII) где X1 имеет значения, указанные выше, с применением условий реакции Соногашира для получения соединения формулы (I), где X1, X2, Х 3, Y1, Y2, Ar, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Общая методика (D) Стадия А. Химическим или ферментативным омылением соединения формулы (I), где X1, X2, Х 3, Y1, Y2, Ar, Z,R1 и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом, получают соединение формулы (I), где X1, X2, Х 3, Y1, Y2, Ar, Z, R1 и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом.- 13015717 Общая методика (Е) Стадия А. Реакция соединения формулы (XI) где X1, X2 и Х 3 имеют значения, указанные выше, по способу, подобному способу Хорнер-Эммонса,например, с (EtO)2PO(CHR1)COOR6 (где R6 представляет собой алкильную группу) в присутствии основания, такого как гидрид натрия, EtONa и тому подобное, для получения соединения формулы (XII) где X1, X2, X3, R1 и R6 имеют значения, указанные выше. Стадия В. Восстановление соединения формулы (XII), где X1, X2, Х 3, R1 и R6 имеют значения, указанные выше, подходящим реагентом, таким как гидрид диизобутилалюминия, для получения соединения формулы (XIII) где Х 1, Х 2, Х 3 и R1 имеют значения, указанные выше. Стадия С. Реакция соединения формулы (XIII), где Х 1, Х 2, Х 3 и R1 имеют значения, указанные выше, с соединением формулы V, где Y1, Ar, Y2, Z и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом, в условиях Мицунобу с применением реагента, такого как трифенилфосфин/диэтилазодикарбоксилат и тому подобное, для получения соединения формулы (I), где X1, X2, Х 3,Х 4, Y1, Y2, Ar, Z, R1 и R2 имеют значения, указанные выше, за исключением того, что R2 не является водородом. Пример 1. В атмосфере аргона 0,15 М раствор три-трет-бутилфосфина в циклогексане (12,0 мл, 18,0 ммоль) добавляют к перемешиваемой суспензии иодида меди(I) (350 мг, 1,8 ммоль) и дихлор(бисбензонитрил)палладия (350 мг, 0,9 ммоль) в тетрагидрофуране (100 мл) при температуре окружающей среды. Смесь перемешивают в течение 5 мин, добавляют N,N-диизопропиламин (4,5 мл, 30 ммоль),смесь перемешивают в течение следующих 5 мин и затем в течение 15 мин по каплям добавляют раствор 4-бромбензофенона (3,92 г, 15 ммоль) и фенилацетилена (2,30 г, 22,5 ммоль) в тетрагидрофуране (20 мл). Реакционную смесь перемешивают при температуре окружающей среды на протяжении ночи и затем разбавляют бензолом (200 мл). Раствор в бензоле промывают водой (280 мл) и 1,5 М водным раствором винной кислоты (30 мл); органический раствор сушат безводным сульфатом магния и потом упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексан/этилацетат, 95:5),получая при этом фенил-[4-(фенилэтинил)фенил]метанон. Выход: 4,11 г (97%).RF (SiO2, бензол) 0,55. 1 Н ЯМР-спектр (200 МГц, CDCl3, Н): 7,82-7,76 (м, 4 Н); 7,67-7,44 (м, 7 Н); 7,42-7,30 (м, 3 Н). Раствор триэтилфосфоноацетата (6,53 г, 29,1 ммоль) в сухом тетрагидрофуране (20 мл) добавляют по каплям к суспензии гидрида натрия (80% суспензия в масле, 873 мг, 29,1 ммоль; промытая три раза гексаном) в сухом тетрагидрофуране (50 мл) в атмосфере азота (20 мин). Когда выделение газа прекращается, суспензию нагревают для кипячения с обратным холодильником в течение 10 мин. Смеси дают- 14015717 возможность охладиться, по каплям добавляют раствор указанного выше кетона в сухом тетрагидрофуране (40 мл) и образовавшуюся реакционную смесь кипятят с обратным холодильником в течение 90 мин. Смеси дают возможность охладиться и выливают в 5% водный раствор лимонной кислоты(200 мл). Добавляют простой эфир (100 мл), органический слой отделяют и водный слой экстрагируют простым эфиром (50 мл). Объединенные органические растворы промывают 10% водным раствором гидрокарбоната натрия (50 мл), водой (250 мл) и сушат безводным сульфатом магния. Остаток, полученный упариванием органического раствора, очищают колоночной хроматографией (силикагель Флюка 60, гексан/этилацетат, 95:5), получая при этом смесь обоих изомеров (5,05 г). Продукт перекристаллизовывают из смеси н-гептан/бензол/этанол, получая при этом чистый этил-(Е)-3-фенил-3-[4(фенилэтинил)фенил]акрилат (конфигурацию устанавливают согласно эксперименту NOE (спектроскопия ядерного эффекта Оверхаузера. Выход (Е)-изомера: 2,25 г (44%). Т.пл. 86-88 С (н-гептан/бензол/этанол).(т, J=8,0 Гц, 3 Н). Маточный раствор после кристаллизации основной массы упаривают, получая при этом 2,45 г(48%) смеси обоих изомеров. В атмосфере аргона 1 М раствор диизобутилалюминийгидрида в тетрагидрофуране (5 мл, 5 ммоль) добавляют по каплям к охлажденному (-20 С) раствору указанного выше сложного (Е)-эфира (1,90 г; 5,39 ммоль) в сухом тетрагидрофуране (30 мл). Реакционной смеси дают возможность охладиться до-15 С, перемешивают при такой температуре в течение 30 мин и затем дают ей возможность нагреться до температуры окружающей среды и перемешивают на протяжении ночи. Смесь снова охлаждают до-10 С, добавляют метанол (5 мл) и затем 15% водную хлористо-водородную кислоту (7 мл) и смеси дают возможность нагреться до температуры окружающей среды. Смесь разбавляют эфиром (100 мл), органический слой промывают насыщенным раствором соли (30 мл), сушат безводным сульфатом магния и затем упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексан/этилацетат, 85:15), получая при этом кристаллический продукт, который перекристаллизовывают из смеси этанол/н-гептан (7:3, 10 мл) с получением (Е)-3-фенил-3-[4-(фенилэтинил)фенил]аллилового спирта. Выход: 655 мг (39%). Т.пл. 115-117 С.RF (SiO2, гексан/этилацетат, 85:15) 0,25. 1 Н ЯМР-спектр (200 МГц, CDCl3, Н): 7,62-7,18 (м, 14 Н); 6,27 (т, J=6,8 Гц, 1 Н); 4,27 (д, J=6,8 Гц,2 Н); 1,54 (ушир.с, 1 Н). В атмосфере азота к охлажденному смесью лед-вода раствору указанного выше гидроксипроизводного (470 мг, 1,51 ммоль) и трифенилфосфина (420 мг, 1,60 ммоль) в сухом метиленхлориде (20 мл) добавляют тетрабромметан (500 мг, 1,51 ммоль). Смесь перемешивают в течение 2 ч при охлаждении и в течение еще 2 ч при температуре окружающей среды, фильтруют через невысокий слой силикагеля и упаривают в вакууме. Остаток растворяют в тетрагидрофуране (19 мл), добавляют N,N-диизопропилэтиламин (233 мг, 1,80 ммоль) и затем раствор этил-(4-меркапто-2-метилфенокси)ацетата (404 мг,1,90 ммоль) в тетрагидрофуране (1 мл) и образовавшийся раствор перемешивают в течение 18 ч. Смесь упаривают в вакууме и остаток очищают колоночной хроматографией (силикагель Флюка 60, гексан/этилацетат, 95:5), получая при этом этил-(Е)-[2-метил-4-[3-фенил-3-[4-(фенилэтинил)фенил]аллилсульфанил]фенокси]ацетат в виде масла. Выход: 365 мг (47%).RF (SiO2, гексан/этилацетат, 9:1) 0,45. 1 Н ЯМР-спектр (200 МГц, ДМСО-d6, Н): 7,58-7,15 (м, 15 Н); 6,81 (д, 2 Н); 6,56 (д, 1 Н); 6,13 (д, 1 Н); 4,62 (с, 1 Н); 4,23 (кв, 2 Н); 3,52 (д, 2 Н); 2,22 (с, 3 Н); 1,25 (т, 3 Н). В атмосфере азота раствор моногидрата гидроксида лития (629 мг, 1,66 ммоль) в дистиллированной воде (10 мл) добавляют к охлажденному смесью лед-вода раствору указанного выше сложного эфира(350 мг, 1,11 ммоль) в смеси тетрагидрофурана (50 мл) и метанола (10 мл). Образовавшийся раствор перемешивают в течение 2 ч при охлаждении, добавляют 2 М водный раствор винной кислоты (2 мл) и образовавшийся раствор разбавляют водой (30 мл). Смесь экстрагируют простым эфиром (330 мл); собранные органические растворы промывают насыщенным раствором соли (30 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, хлороформ/метанол, 95:5), получая при этом указанную в заголовке кислоту. Выход: 250 мг (46%).- 15015717 Раствор L-лизина (64 мг, 0,438 ммоль) в воде (2 мл) добавляют к раствору указанной выше кислоты(226 мг, 0,461 ммоль) в тетрагидрофуране (30 мл). Смесь перемешивают в течение 1 ч, упаривают в вакууме и остаток три раза растирают с безводным простым эфиром, получая при этом L-лизинат указанной в заголовке кислоты. Выход: 190 мг (68%). 1 Н ЯМР-спектр (200 МГц, AcOH-d4, Н): 7,65-7,05 (м, 6 Н); 6,88 (м, 2 Н); 6,79 (д, 1 Н); 6,16 (ушир.п,1 Н); 4,72 (с, 2 Н); 4,05 (м, 1 Н); 3,53 (м, 2 Н); 3,08 (м, 2 Н); 2,18 (с, 3 Н); 1,95-1,40 (м, перекрывание,6 Н). Пример 2. Раствор 1,4-дибромбензола (23,6 г, 100,0 ммоль) в сухом тетрагидрофуране (100 мл) дегазируют и добавляют иодид меди(I) (570 мг, 3,0 ммоль), тетракис(трифенилфосфин)палладий (3,4 г, 3,0 ммоль) и диазобициклоундецен (18,2 г, 120,0 ммоль). Реакционный раствор снова дегазируют и по каплям в инертной атмосфере при 0 С добавляют пропаргиловый спирт (6,7 г, 120,0 ммоль). Реакционную смесь перемешивают при 0 С в течение 1 ч и затем 4 ч при 50 С. Раствор затем обрабатывают насыщенным раствором соли (20 мл) и подкисляют 2 М хлористо-водородной кислотой (20 мл). Органическую фазу отделяют и водную фазу экстрагируют простым эфиром (430 мл). Объединенные органические фазы сушат сульфатом магния и концентрируют в вакууме, получая при этом коричневое твердое вещество. Продукт очищают кристаллизацией из гексана, получая при этом желтоватый порошок 3-(4 бромфенил)проп-2-ин-1-ола. Выход: 10 г (49%). Т.пл.: 65-68 С (гексан).RF (гексан/этилацетат, 90:10): 0,10. Метоксид натрия (0,27 г, 0,5 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (12 мл, 12 ммоль). Смесь охлаждают до 0 С и медленно добавляют раствор 3-(4-бромфенил)проп-2-ин-1-ола (0,422 г, 2,0 ммоль) в тетрагидрофуране (50 мл). Реакционную смесь перемешивают при 0 С в течение 3 ч, добавляют этилацетат (2,6 мл, 30 ммоль) и смесь перемешивают в течение еще 10 мин без охлаждения. Добавляют йодбензол (2,7 г, 13 ммоль), безводный бромид цинка (1,4 г,6 ммоль) и комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,50 г, 0,5 ммоль) и из смеси откачивают воздух и помещают ее в атмосферу азота. Добавляют раствор три-трет-бутилфосфина в циклогексане (6,7 мл, 1 ммоль) и смесь нагревают при 60 С в течение 16 ч. Добавляют метанол (10 мл) и образовавшуюся смесь перемешивают в течение дополнительного 1 ч. Реакционную смесь выливают в воду, подкисляют хлористо-водородной кислотой и экстрагируют этилацетатом (3100 мл). Органические слои объединяют, сушат безводным сульфатом натрия, упаривают в вакууме и остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 98:2-70:30), получая при этом(д, J=4,8 Гц, 2 Н). Вышеуказанный аллиловый спирт (0,889 г, 3,0 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(0,770 г, 3,9 ммоль; см. ниже) и трифенилфосфин (1,30 г, 5 ммоль) растворяют в смеси безводного толуола (12 мл) и тетрагидрофурана (4 мл). Смесь охлаждают до 0 С, помещают в атмосферу азота и по каплям добавляют диизопропилазодикарбоксилат (0,85 г, 4,2 ммоль). Реакционную смесь перемешивают при 0 С в течение 3 ч и затем при 25 С в течение 16 ч. Растворители выпаривают в вакууме и остаток подвергают колоночной хроматографии (силикагель Флюка 60, гексаны/этилацетат, 98:2-90:10), получая при этом метил-(Е)-[4-[3-(4-бромфенил)-3-фенилаллилокси]-2-метилфенокси]ацетат. Выход: 0,70 г (50%).RF (SiO2, гексаны/этилацетат, 4:1) 0,50. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,45-7,35 (м, 5 Н); 7,20-7,11 (м, 4 Н); 6,70-6,55 (м, 3 Н); 6,23 (т,J=6,6 Гц, 1 Н); 4,58 (с, 2 Н); 4,51 (д, J=6,6 Гц, 2 Н); 3,80 (с, 3 Н); 2,24 (с, 3 Н). Сухой триэтиламин (8 мл), иодид меди(I) (29 мг, 0,152 ммоль) и тетракис(трифенилфосфин)палладий (68 мг, 0,059 ммоль) добавляют к дегазированному раствору вышеука- 16015717 занного сложного эфира (448 мг, 0,931 ммоль) и N-пропаргилморфолина (291 мг, 2,32 ммоль) в сухом тетрагидрофуране (18 мл). В атмосфере аргона образовавшуюся смесь нагревают при 50 С в течение 10 ч, охлаждают и затем упаривают в вакууме. Остаток растворяют в дихлорметане (20 мл); раствор промывают водой (310 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 4:1-1:1), получая при этом метил-(Е)-[2-метил-4-[3-[4-[3-(морфолин-4-ил)пропинил]фенил]-3-фенилаллилокси]фенокси]ацетат в виде масла. Выход: 138 мг (29%).RF (SiO2, гексаны/этилацетат, 1:1) 0,10. В атмосфере аргона раствор моногидрата гидроксида лития (16,9 мг, 0,404 ммоль) в дистиллированной воде (1 мл) добавляют к охлажденному смесью лед-вода раствору вышеуказанного сложного эфира (138 мг, 0,270 ммоль) в смеси тетрагидрофуран/метанол (5:1; 6 мл). Образовавшийся раствор перемешивают в течение 3 ч при охлаждении. Добавляют насыщенный водный раствор хлорида аммония(15 мл) и смесь экстрагируют простым эфиром (310 мл). Объединенные эфирные растворы сушат безводным сульфатом магния и выпаривают в вакууме, получая при этом указанную в заголовке кислоту в виде пены. Выход: 102 мг (76%). Т.пл.: - (пена).RF (SiO2, хлороформ/метанол, 9:1) 0,10. Раствор L-лизина (29,9 мг, 0,205 ммоль) в дистиллированной воде (0,5 мл) добавляют к раствору указанной выше кислоты (102 мг, 0,205 ммоль) в сухом тетрагидрофуране (7 мл). Образовавшийся раствор перемешивают в течение 10 мин, добавляют ацетонитрил (50 мл) и смесь перемешивают в течение 2 ч. Образованное твердое вещество отделяют фильтрованием, промывают простым эфиром (230 мл) и сушат, получая при этом L-лизинат указанной в заголовке кислоты. Выход: 55,8 мг (42%). Т.пл.: 162-180 С (аморфное вещество). 1 Н ЯМР-спектр (300 МГц, ДМСО-d6, Н): 7,48-7,15 (м, 9 Н); 6,61-6,50 (м, 3 Н); 6,34 (т, J=7,1 Гц, 1 Н); 4,42 (д, J=6, 4 Гц, 2 Н); 4,12 (с, 2 Н); 3,58 (м, 4 Н); 3,49 (с, 2 Н); 3,38-3,08 (м, 5 Н); 2,70 (ушир.с, 2 Н); 2,08 (с,3 Н); 1,16-1,75 (м, 6 Н). Метиловый эфир (4-гидрокси-2-метилфенокси)уксусной кислоты. Карбонат калия (34,4 г, 0,250 моль) и раствор метилбромацетата (16,1 мл, 0,175 моль) в бутаноне(20 мл) добавляют к раствору 4-гидрокси-3-метилацетофенона (25 г, 0,166 моль) в бутаноне (180 мл) и смесь кипятят с обратным холодильником в течение 1 ч. После охлаждения до температуры окружающей среды белый осадок отделяют фильтрованием и фильтрат упаривают в вакууме. Образовавшееся твердое вещество перекристаллизовывают растворением его в смеси гексаны/диэтиловый эфир/дихлорметан(120:120:50 мл) и концентрированием в вакууме. Метиловый эфир (4-ацетил-2-метилфенокси)уксусной кислоты отделяют фильтрованием и промывают гексанами (50 мл). Выход: 35,0 г (95%).RF (SiO2, гексаны/этилацетат, 1:1) 0,75. 1 Н ЯМР-спектр (200 МГц, CDCl3, Н): 7,80-7,76 (м, 2 Н); 6,70 (д, J=9,0 Гц, 1 Н); 4,74 (с, 2 Н); 3,82 (с,3 Н); 2,55 (с, 3 Н); 2,33 (с, 3 Н). К раствору указанного выше сложного эфира (33,0 г, 0,148 моль) и моногидрата п-толуолсульфоновой кислоты (0,281 г, 0,00148 моль) в дихлорметане (50 мл) добавляют раствор 3-хлорпероксибензойной кислоты (53,1 г, 0,237 моль; 77% в воде) в дихлорметане (300 мл, высушен над сульфатом магния перед добавлением). Смесь перемешивают при температуре окружающей среды в течение 20 ч,добавляют раствор сульфита натрия (1 М, 150 мл) и двухфазную смесь перемешивают в течение 20 мин. Затем добавляют раствор карбоната натрия (2 М, 150 мл) и гетерогенную смесь энергично перемешивают в течение следующих 10 мин. Органический слой отделяют и водный слой экстрагируют дихлорметаном (50 мл). Объединенные органические слои промывают 10% раствором карбоната натрия(2200 мл) и насыщенным раствором соли (300 мл). Органический раствор сушат безводным сульфатом магния, его выпаривание дает метиловый эфир (4-ацетокси-2-метилфенокси)уксусной кислоты в виде желтоватого твердого вещества. Выход: 32,9 г (93%).(с, 6 Н). Смесь указанного выше сложного эфира (32,9 г, 0,138 моль) и метоксида натрия (0,746 г,0,0138 моль) в безводном метаноле (250 мл) перемешивают в течение 24 ч. Смесь упаривают досуха и твердый остаток растворяют в этилацетате (200 мл). Мутную смесь фильтруют и фильтрат промывают насыщенным водным раствором гидрокарбоната натрия (2150 мл) и насыщенным раствором соли(200 мл). Органический раствор сушат над безводным сульфатом магния и упаривают в вакууме. Неочи- 17015717 щенный продукт перекристаллизовывают из смеси этилацетат/гексаны, получая при этом указанное в заголовке соединение в виде не совсем белых кристаллов. Выход: 24,0 г (89%). К дегазированному раствору 4-бромтолуола (4,27 г, 25 ммоль) в тетрагидрофуране (30 мл) добавляют в указанном порядке иодид меди(I) (143 мг, 0,75 моль), тетракис(трифенилфосфин)палладий(0,85 г, 7,5 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (4,55 г, 30 ммоль). Образовавшуюся смесь дегазируют еще раз, охлаждают на ледяной бане и на протяжении периода 10 мин добавляют раствор пропаргилового спирта (1,68 г, 30 ммоль) в тетрагидрофуране (5 мл). Реакционную смесь медленно нагревают до 55 С и затем перемешивают при такой температуре в течение 20 ч. Данную смесь затем охлаждают до температуры окружающей среды, разбавляют эфиром (150 мл) и водой (50 мл) и подкисляют 5% хлористо-водородной кислотой. Эфирный слой отделяют и водный слой экстрагируют эфиром (330 мл). Объединенные органические порции промывают 5% хлористо-водородной кислотой (230 мл), насыщенным водным раствором гидрокарбоната натрия (230 мл), сушат безводным сульфатом магния и выпаривают в вакууме. Остаток очищают колоночной флэш-хроматографией (силикагель Флюка 60, хлороформ), получая при этом 3-(4-метилфенил)проп-2-ин-1-ол в виде масла. Выход: 2,50 г (68%).RF (SiO2, хлороформ) 0,20. Метоксид натрия (12,5 мг, 0,225 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (5 мл, 5 ммоль) в атмосфере аргона. Смесь охлаждают до 0 С и на протяжении 10 мин добавляют раствор указанного выше гидроксипроизводного (730 мг, 5 ммоль) в тетрагидрофуране(12,5 мл). Реакционную смесь перемешивают при 0 С в течение 3 ч; добавляют сухой этилацетат(0,825 мл) и всю смесь перемешивают при температуре окружающей среды в течение 15 мин. Добавляют дегазированный раствор 1,4-дийодбензола (2,15 г, 6,5 ммоль) в сухом тетрагидрофуране (5 мл), безводный хлорид цинка (0,408 г, 3 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ(0,103 г, 0,1 ммоль) и три(2-фурил)фосфин (92,5 мг, 0,4 ммоль); смесь дегазируют и затем нагревают при 65 С в течение 20 ч в атмосфере азота. Суспензию охлаждают до температуры окружающей среды, добавляют метанол (2,5 мл) и смесь перемешивают в течение дополнительного 1 ч. Реакционную смесь разбавляют эфиром (50 мл) и добавляют насыщенный водный раствор хлорида аммония (1,25 мл). Смесь фильтруют через подушку силикагеля и подушку тщательно промывают эфиром (100 мл). Растворители выпаривают и остаток разделяют колоночной флэш-хроматографией (силикагель Флюка 60, гексаны/этилацетат, 4:1), получая при этом (Z)-3-(4-йодфенил)-3-(4-метилфенил)проп-2-ен-1-ол в виде отверждающегося масла. Выход: 610 мг (35%).RF (SiO2, гексаны/этилацетат, 3:1) 0,30. Указанный выше аллиловый спирт (420 мг, 1,2 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(0,259 мг, 1,32 ммоль; пример 2) и трифенилфосфин (378 мг, 1,44 ммоль) растворяют в смеси безводного толуола (20 мл) и тетрагидрофурана (7 мл). Раствор охлаждают до 0 С, помещают его в атмосферу азота и по каплям на протяжении 10 мин добавляют дегазированный раствор диизопропилазодикарбоксилата(0,28 мл, 1,44 ммоль) в безводном тетрагидрофуране (2,5 мл). Реакционной смеси дают возможность нагреться до температуры окружающей среды на бане и затем перемешивают в течение 48 ч. Растворители выпаривают в вакууме и остаток подвергают колоночной флэш-хроматографии (силикагель Флюка 60,гексаны/этилацетат, 4:1), получая при этом метил-(Z)-[4-[3-(4-йодфенил)-3-(4-метилфенил)аллилокси]-2 метилфенокси]ацетат в виде отверждающегося желтого масла. Выход: 520 мг (82%).RF (SiO2, гексаны/этилацетат, 3:1) 0,55. 1 Н ЯМР-спектр (300 МГц, CDCl3, ): 7,71 (д, 2 Н); 6,93-7,11 (м, 6 Н); 6,55-6,68 (м, 3 Н); 6,27 (т, J=7,1 Гц, 1 Н); 4,58 (с, 2 Н); 4,47 (д, J=6,6 Гц, 2 Н); 3,79 (с, 3 Н); 2,34 (с, 3 Н); 2,25 (с, 3 Н). Раствор вышеуказанного сложного эфира (480 мг, 0,908 ммоль) в смеси тетрагидрофурана (5 мл) и триэтиламина (5 мл) дегазируют и в атмосфере аргона добавляют N-пропаргилморфолин (237 мг,- 18015717 1,89 ммоль). Раствор охлаждают, добавляют тетракис(трифенилфосфин)палладий (84 мг, 0,073 ммоль) и иодид меди(I) (27,6 мг, 0,145 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 6 ч и затем оставляют на ночь. Смесь упаривают в вакууме; остаток растворяют в дихлорметане (20 мл) и образованный раствор промывают водой (210 мл). Органический раствор сушат безводным сульфатом магния и затем упаривают в вакууме. Остаток очищают колоночной флэшхроматографией (силикагель Флюка 60, гексаны/этилацетат, 1:1), получая при этом метил-(Z)-[2-метил 4-[3-(4-метилфенил)-3-[4-[3-(морфолин-4-ил)пропинил]фенил]аллилокси]фенокси]ацетат. Выход: 252 мг (53%).(т, J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,48 (д, J=6,7 Гц, 2 Н); 3,79 (с, 3 Н); 3,76-3,79 (м, 4 Н); 3,53 (с, 2 Н); 2,66 (м,4 Н); 2,33 (с, 3 Н); 2,24 (с, 3 Н). К раствору указанного выше сложного эфира (233 мг, 0,443 ммоль) в смеси тетрагидрофуран/метанол (5:1, 12 мл) при охлаждении до 0 С добавляют раствор моногидрата гидроксида лития(28 мг, 0,665 ммоль) в дистиллированной воде (2 мл). Раствор перемешивают в течение 1 ч при охлаждении и 1 ч при температуре окружающей среды. Раствор разбавляют простым эфиром (30 мл) и насыщенным раствором хлорида аммония (15 мл). Фазы разделяют; органический слой промывают водой(210 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток растирают с гексанами, получая при этом указанную в заголовке кислоту в виде рыжевато-коричневого твердого вещества. Выход: 114 мг (64%). Т.пл. 182-190 С.(25 мл) добавляют в указанном порядке иодид меди(I) (143 мг, 0,75 мл), тетракис(трифенилфосфин)палладий (0,85 г, 7,5 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (4,55 г, 30 ммоль). Образовавшуюся смесь дегазируют еще раз, охлаждают на ледяной бане и на протяжении периода 10 мин добавляют раствор пропаргилового спирта (1,68 г, 30 ммоль) в тетрагидрофуране (5 мл). Реакционную смесь медленно нагревают до 55 С и затем перемешивают при такой температуре в течение 3 ч и затем при температуре окружающей среды на протяжении ночи. Смесь разбавляют диэтиловым простым эфиром(100 мл), промывают водой (50 мл), 5% хлористо-водородной кислотой (35 мл) и насыщенным водным раствором гидрокарбоната натрия (30 мл). Органический раствор сушат безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, дихлорметан), получая при этом 3-(4-трифторметилфенил)проп-2-ин-1-ол. Выход: 4,25 г (90%).RF (SiO2, хлороформ) 0,25. Метоксид натрия (12,5 мг, 0,225 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (5 мл, 5 ммоль) в атмосфере аргона. Смесь охлаждают до 0 С и на протяжении 10 мин добавляют раствор указанного выше спирта (1,00 г, 5 ммоль) в тетрагидрофуране (12,5 мл). Реакционную смесь перемешивают при 0 С в течение 3 ч; добавляют сухой этилацетат (0,825 мл) и всю смесь перемешивают при температуре окружающей среды в течение 15 мин. Добавляют дегазированный раствор 1,4 дийодбензола (2,15 г, 6,5 ммоль) в сухом тетрагидрофуране (5 мл), безводный хлорид цинка (0,408 г,3 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,103 г, 0,1 ммоль) и три(2-фурил)фосфин (92,5 мг, 0,4 ммоль); смесь дегазируют и затем нагревают при 65 С в течение 15 ч в атмосфере азота. Суспензию охлаждают; добавляют метанол (2,5 мл) и смесь перемешивают в течение дополнительно 1 ч. Реакционную смесь разбавляют простым эфиром (50 мл) и добавляют насыщенный водный раствор хлорида аммония (1,25 мл). Смесь фильтруют через подушку силикагеля и подушку тщательно промывают простым эфиром (100 мл). Растворители выпаривают в вакууме и остаток очищают колоночной флэш-хроматографией (силикагель Флюка 60, гексаны/этилацетат, 5:1), получая при этомRF (SiO2, гексаны/этилацетат, 3:1) 0,35. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,73 (м, 2 Н); 7,54 (м, 2 Н); 7,33 (м, 2 Н); 6,90 (м, 2 Н); 6,30 (т,J=6,8 Гц, 1 Н); 4,24 (м, 2 Н). Указанный выше аллиловый спирт (810 мг, 2,0 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(431 мг, 2,2 ммоль; пример 2) и трифенилфосфин (630 мг, 2,4 ммоль) растворяют в смеси безводного толуола (32 мл) и тетрагидрофурана (12 мл). Смесь охлаждают до 0 С, помещают в атмосферу азота и по каплям в течение 10 мин добавляют дегазированный раствор диизопропилазодикарбоксилата (0,47 мл,2,4 ммоль) в безводном тетрагидрофуране (4 мл). Реакционной смеси дают возможность нагреться до температуры окружающей среды на бане и затем перемешивают в течение 48 ч. Растворители выпаривают в вакууме и остаток подвергают колоночной флэш-хроматографии (силикагель Флюка 60, гексаны/этилацетат, 85:15), получая при этом метил-(Z)-[4-[3-(4-йодфенил)-3-(4-трифторметилфенил)аллилокси]-2-метилфенокси]ацетат в виде отверждающегося масла. Выход: 880 мг (76%).RF (SiO2, гексаны/этилацетат, 3:1) 0,55. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,73 (д, J=10,5 Гц, 2 Н); 7,55 (д, J=10,5 Гц, 2 Н); 7,35 (д, J=10,5 Гц, 2 Н); 6,93 (д, J=10,5 Гц, 2 Н); 6,69-6,55 (м, 3 Н); 6,37 (т, J=7,1, 1 Н); 4,59 (с, 2 Н); 4,51 (д, 2 Н); 3,79 (с, 3 Н); 2,26 (с, 3 Н). Раствор указанного выше сложного эфира (375 мг, 0,644 ммоль) в смеси тетрагидрофурана (5 мл) и триэтиламина (5 мл) дегазируют и в атмосфере аргона добавляют 1-пропаргилпиразол (123 мг,1,16 ммоль). Раствор охлаждают; добавляют тетракис(трифенилфосфин)палладий (59,5 мг, 0,052 ммоль) и иодид меди(I) (19,6 мг, 0,103 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 48 ч. Смесь упаривают в вакууме и остаток очищают колоночной флэш-хроматографией(силикагель Флюка 60, гексаны/этилацетат, 7:3), получая при этом метил-(Е)-[2-метил-4-[3-[4-[3(пиразол-1-ил)проп-1-инил]фенил]-3-(4-трифторметилфенил)аллилокси]фенокси]ацетат. Выход: 340 мг (94%).(с, 3 Н). К раствору указанного выше сложного эфира (330 мг, 0,589 ммоль) в смеси тетрагидрофуран/метанол (3:5, 8 мл) при охлаждении до 0 С добавляют раствор моногидрата гидроксида лития (37 мг,0,883 ммоль) в дистиллированной воде (1 мл). Раствор перемешивают в течение 1 ч при охлаждении и 1 ч при температуре окружающей среды. Раствор разбавляют хлороформом (70 мл), водой (10 мл) и насыщенным водным раствором хлорида аммония (15 мл) и фазы разделяют. Органический слой промывают насыщенным раствором соли (10 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток растирают с гексанами, получая при этом указанную в заголовке кислоту в виде рыжеватокоричневого твердого вещества. Выход: 142 мг (44%). Т.пл. 123-125 С. Раствор метил-(Z)-[4-[3-(4-йодфенил)-3-(4-трифторметилфенил)аллилокси]-2-метилфенокси]ацетата (370 мг, 0,636 ммоль; пример 4) в смеси тетрагидрофурана (5 мл) и триэтиламина (5 мл) дегазируют и в атмосфере аргона добавляют 2-этинилпиридин (118 мг, 1,144 ммоль). Раствор охлаждают; добавляют тетракис(трифенилфосфин)палладий (59,0 мг, 0,051 ммоль) и иодид меди(I) (19,3 мг, 0,102 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 48 ч. Смесь упаривают в- 20015717 вакууме и остаток растворяют в дихлорметане (60 мл). Раствор промывают водой (220 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной флэш-хроматографией(силикагель Флюка 60, гексаны/этилацетат, 7:3), получая при этом метил-(Е)-[2-метил-4-[3-[4-(пиридин 2-илэтинил)фенил]-3-(4-трифторметилфенил)аллилокси]фенокси]ацетат. Выход: 344 мг (94%).RF (SiO2, гексаны/этилацетат, 65:35) 0,35. 1 Н ЯМР-спектр (300 МГц, CDCl3, H): 8,64 (ушир.с, 1 Н); 7,73-7,54 (м, 6 Н); 7,38-7,18 (м, 5 Н); 6,696,40 (м, 3 Н); 6,38 (т, J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,55 (д, J=6,7 Гц, 2 Н); 3,78 (с, 3 Н); 2,25 (с, 3 Н). К раствору указанного выше сложного эфира (330 мг, 0,575 ммоль) в смеси тетрагидрофуран/метанол (5:1, 18 мл) при охлаждении до 0 С добавляют раствор моногидрата гидроксида лития(48,3 мг, 1,15 ммоль) в дистиллированной воде (3 мл). Раствор перемешивают в течение 1 ч при охлаждении и 1 ч при температуре окружающей среды. Реакционную смесь подкисляют ледяной уксусной кислотой (66 мкл, 1,15 ммоль) и разбавляют хлороформом (50 мл); фазы разделяют и органический слой промывают водой (10 мл), насыщенным раствором соли (10 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток растирают с гексанами, получая при этом указанную в заголовке кислоту в виде твердого вещества. Выход: 255 мг (79%). Т.пл. 161-165 С. Метоксид натрия (0,02 г, 0,37 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (8 мл, 8 ммоль) в атмосфере азота. Смесь охлаждают до 0 С и на протяжении 30 мин добавляют раствор 3-(4-бромфенил)проп-2-ин-1-ола (1,69 г, 8,01 ммоль; получен, как описано в экспериментальной части синтеза соединения VFB-21041) в тетрагидрофуране (8 мл). Реакционную смесь перемешивают при 0 С в течение 3,5 ч; добавляют сухой этилацетат (2,40 мл, 24,6 ммоль) и всю смесь перемешивают при температуре окружающей среды в течение 15 мин. Добавляют дегазированный раствор 1-хлор-4-йодбензола (2,01 г, 8,43 ммоль) в сухом тетрагидрофуране (5 мл), безводный хлорид цинка(0,66 г, 4,84 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,18 г, 0,17 ммоль) и три-2-фурилфосфин (0,20 г, 0,86 ммоль); смесь дегазируют и затем нагревают при 65 С в течение 18 ч в атмосфере азота. Суспензию охлаждают; добавляют метанол (4 мл) и смесь перемешивают в течение дополнительно 1 ч. Реакционную смесь разбавляют простым эфиром (40 мл) и добавляют насыщенный водный раствор хлорида аммония (2 мл). Смесь фильтруют через подушку силикагеля и подушку тщательно промывают простым эфиром (100 мл). Растворители выпаривают и остаток разделяют колоночной флэш-хроматографией (силикагель Флюка 60, гексаны/этилацетат, 6:1), получая при этом (E)-[3-(4 бромфенил)-3-(4-хлорфенил)]аллиловый спирт в виде отверждающегося масла. Выход: 1,45 г (56%).RF (SiO2, гексаны/этилацетат, 4:1) 0,20. Вышеуказанный аллиловый спирт (1,45 г, 4,44 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(0,96 г, 4,89 ммоль; соединение VFB-21004) и трифенилфосфин (1,35 г, 5,15 ммоль) растворяют в смеси безводного толуола (75 мл) и тетрагидрофурана (25 мл). Смесь охлаждают до 0 С, помещают в атмосферу азота и по каплям в течение 15 мин добавляют дегазированный раствор диизопропилазодикарбоксилата (1,00 мл, 5,04 ммоль) в безводном тетрагидрофуране (10 мл). Реакционной смеси дают возможность нагреться до температуры окружающей среды на бане и затем перемешивают на протяжении ночи. Растворители выпаривают в вакууме и остаток подвергают колоночной флэш-хроматографии (силикагель Флюка 60, гексаны/этилацетат, 12:1), получая при этом метил-(Е)-[4-[3-(4-бромфенил)-3-(4 хлорфенил)аллилокси]-2-метилфенокси]ацетат в виде отверждающегося желтого масла. Выход: 1,94 г (87%).(12,1 мг, 0,064 ммоль) и 0,15 М раствор три(трет-бутил)фосфина в циклогексане (0,60 мл, 0,090 ммоль) добавляют к дегазированному раствору метил-(Е)-[4-[3-(4-бромфенил)-3-(4-хлорфенил)аллилокси]-2 метилфенокси]ацетата (383 мг, 0,763 ммоль), 4-этинилтолуола (115 мг, 0,990 ммоль) и диизопропиламина (0,50 мл, 3,57 ммоль) в сухом тетрагидрофуране (6 мл), в атмосфере азота реакционную смесь перемешивают при 60 С в течение 4 ч, охлаждают и упаривают в вакууме. Остаток очищают колоночной флэш-хроматографией (силикагель Флюка 60, гексаны/этилацетат, 12:1), получая при этом метил-(Z)-[4[3-(4-хлорфенил)-3-[4-(4-метилфенилэтинил)фенил]аллилокси]-2-метилфенокси]ацетат в виде коричневатого масла. Выход: 315 мг (77%).RF (SiO2, гексаны/этилацетат, 9:1) 0,10. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,45-7,37 (м, 6 Н); 7,23-7,13 (м, 6 Н); 6,69-6,55 (м, 3 Н); 6,35 (т,J=6,6 Гц, 1 Н); 4,59 (с, 2 Н); 4,50 (д, J=6,6 Гц, 2 Н); 3,79 (с, 3 Н); 2,37 (с, 3 Н); 2,25 (с, 3 Н). К раствору вышеуказанного сложного эфира (232 мг, 0,432 ммоль) в смеси тетрагидрофуран/метанол (5:1, 6 мл) при охлаждении (0 С) добавляют раствор моногидрата гидроксида лития (26 мг,0,620 ммоль) в дистиллированной воде (1 мл). Раствор перемешивают в течение 60 мин при охлаждении,добавляют ледяную уксусную кислоту (0,05 мл, 0,874 ммоль) и смесь перемешивают в течение дополнительных 10 мин. Раствор разбавляют простым эфиром (20 мл) и водой (15 мл); фазы разделяют и водную фазу экстрагируют эфиром (310 мл). Объединенные органические слои промывают водой (210 мл) и насыщенным раствором соли (210 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток растирают со смесью дихлорметан/гексаны (1:10, 11 мл), получая при этом указанную в заголовке кислоту в виде сероватого твердого вещества. Выход: 183 мг (81%). Т.пл. 157-175 С (аморфное вещество). Раствор 1-хлор-4-йодбензола (23,9 г, 100,0 ммоль) в сухом тетрагидрофуране (100 мл) дегазируют и добавляют иодид меди(I) (570 мг, 3,0 ммоль), тетракис(трифенилфосфин)палладий (3,4 г, 3,0 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (18,2 г, 120,0 ммоль). Реакционный раствор дегазируют снова и в инертной атмосфере при температуре окружающей среды добавляют пропаргиловый спирт (6,7 г,120,0 ммоль). Реакционную смесь перемешивают (сначала при охлаждении ледяной водой) в течение 24 ч, затем обрабатывают водой (20 мл) и подкисляют 2 М хлористо-водородной кислотой (20 мл). Органическую фазу отделяют и водную фазу экстрагируют эфиром (430 мл). Объединенные органические фазы сушат безводным сульфатом магния и концентрируют в вакууме, получая при этом коричневое твердое вещество. Остаток очищают колоночной хроматографией (силикагель Флюка 60, хлороформ),получая при этом 3-(4-хлорфенил)проп-2-ин-1-ол. Выход: 8,35 г (50%). Т.пл.: 75,5-77,5 С (гексан).RF (SiO2, гексан/этилацетат, 90:10): 0,10. Метоксид натрия (0,05 г, 0,9 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (20 мл, 20 ммоль). Смесь охлаждают до 0 С и медленно добавляют раствор вышеуказанного спирта (3,35 г, 20,1 ммоль) в тетрагидрофуране (30 мл). Реакционную смесь перемешивают при 0 С в течение 1,5 ч и при температуре окружающей среды в течение 1,5 ч. При 0 С добавляют этилацетат(6,6 г, 20 ммоль), безводный хлорид цинка (1,64 г, 12 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,41 г, 0,4 ммоль) и три(2-фурил)фосфин (0,37 г, 1,6 ммоль); из смеси выкачивают воздух и помещают ее в атмосферу азота. Реакционную смесь нагревают при 65 С в течение 16 ч и затем охлаждают. Добавляют метанол (10 мл) и смесь перемешивают дополнительно в течение 1 ч. Реакционную суспензию разбавляют простым эфиром (150 мл) и добавляют насыщенный водный раствор хлорида аммония (5 мл). Смесь фильтруют через подушку силикагеля и твердую фазу тщательно- 22015717 промывают простым эфиром. Растворители выпаривают в вакууме и остаток подвергают колоночной хроматографии (силикагель Флюка 60, бензол-хлороформ), получая при этом (Z)-[3-(4-хлорфенил)-3-(4 йодфенил)]аллиловый спирт в виде бледно-коричневого твердого вещества. Выход: 3,5 г (49%). Т.пл.: 79-84 С.RF (SiO2, хлороформ/эфир, 2:1) 0,40. 1 Н ЯМР-спектр (300 МГц, CDCl3, H): 7,71 (д, J=8,7 Гц, 2 Н); 7,26 (д, J=8,8 Гц, 2 Н); 7,15 (д, J=8,8 Гц,2 Н); 6,90 (д, J=8,7 Гц, 2 Н); 6,22 (т, J=6,9 Гц, 1 Н); 4,20 (д, J=6,9 Гц, 2 Н); 1,55 (с, 1 Н). Вышеуказанный аллиловый спирт (3,45 г, 9,7 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(50 мл) и тетрагидрофурана (25 мл). Смесь охлаждают до 0 С, выдерживают в атмосфере азота и по каплям добавляют диизопропилазодикарбоксилат (2,3 г, 10,8 ммоль). Реакционную смесь перемешивают при 0 С в течение 3 ч и затем при температуре окружающей среды в течение 16 ч. Растворители выпаривают в вакууме и остаток подвергают колоночной хроматографии (силикагель Флюка 60, бензол), получая при этом метил-(Z)-[4-[3-(4-хлорфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат в виде твердого вещества. Выход: 3,1 г (58%). Т.пл.: 89-92 С.RF (SiO2, хлороформ): 0,55. 1 Н ЯМР-спектр (300 МГц, CDCl3, H): 7,73 (д, J=8,4 Гц, 2 Н); 7,26 (д, J=8,7 Гц, 2 Н); 7,16 (д, J=8,7 Гц,2 Н); 6,93 (д, J=8,4 Гц, 2 Н); 6,68 (д, J=2,7 Гц, 1 Н); 6,63 (д, J=8,7 Гц, 1 Н); 6,57 (дд, J=8,7 и 2,7 Гц); 6,29 (т,J=6,7 Гц, 1 Н); 4,59 (с, 2 Н); 4,48 (д, J=6,7 Гц, 2 Н); 3,79 (с, 3 Н); 2,26 (с, 3 Н). трет-Бутилацетилен (220 мг, 2,7 ммоль) добавляют в атмосфере азота к дегазированному раствору метил-(Z)-[4-[3-(4-хлорфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетата (500 мг, 0,91 ммоль) в смеси тетрагидрофурана (8 мл) и триэтиламина (8 мл). Раствор охлаждают, добавляют тетракис(трифенилфосфин)палладий (96 мг, 0,083 ммоль) и иодид меди(I) (27,6 мг, 0,145 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 72 ч, разбавляют бензолом(100 мл) и промывают водой (250 мл). Органический раствор сушат безводным сульфатом магния и затем выпаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 1:1) и перекристаллизовывают из этанола, получая при этом метил-(Е)-[4-[3-(4 хлорфенил)-3-[4-(3,3-диметилбутинил)фенил]аллилокси]-2-метилфенокси]ацетат. Выход: 330 мг (72%). Т.пл.: 115-116,5 С (этанол).RF (CiO2, циклогексан/тетрагидрофуран, 9:1): 0,35. 1 Н ЯМР-спектр (300 МГц, CDCl3, H): 7,41 (д, J=8,4 Гц, 2 Н); 7,25 (д, J=8,7 Гц, 2 Н); 7,15 (д, J=8,7 Гц,2 Н); 7,09 (д, J=8,4 Гц, 2 Н); 6,66 (д, J=2,7 Гц, 1 Н); 6,61 (д, J=8,7 Гц, 1 Н); 6,55 (дд, J=8,7 и 2,7 Гц); 6,26 (т,J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,48 (д, J=6,7 Гц, 2 Н); 3,79 (с, 3 Н); 2,24 (с, 3 Н); 1,33 (с, 9 Н). Указанный выше сложный эфир (0,33 г, 0,656 ммоль) растворяют в смеси этанол/тетрагидрофуран(1:1, 30 мл); добавляют раствор моногидрата гидроксида лития (0,08 г, 1,9 ммоль) в воде (3 мл) и смесь выдерживают в течение 72 ч. Растворители выпаривают в вакууме; остаток разбавляют водой (25 мл) и подкисляют уксусной кислотой (0,5 мл). Продукт фильтруют и сушат на воздухе, получая при этом указанное в заголовке соединение. Выход: 0,30 г (94%). Т.пл.: 144-147 С.N,N-Диметилпропаргиламин (200 мг, 2,4 ммоль) добавляют в атмосфере азота к дегазированному раствору метил-(Z)-[4-[3-(4-йодфенил)-3-(4-хлорфенил]аллилокси]-2-метилфенокси]ацетата (500 мг,0,91 ммоль; пример 7) в смеси тетрагидрофурана (8 мл) и триэтиламина (8 мл). Раствор охлаждают, до- 23015717 бавляют тетракис(трифенилфосфин)палладий (96 мг, 0,083 ммоль) и иодид меди(I) (27,6 мг,0,145 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 48 ч,растворяют в бензоле (100 мл) и промывают водой (250 мл). Органический раствор сушат безводным карбонатом калия и затем упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, бензол-хлороформ/эфир, 2:1), получая при этом (E)-[4-[3-(4-хлорфенил)-3-[4-[3(диметиламино)пропинил]фенил]аллилокси]-2-метилфенокси]ацетат. Выход: 400 мг (87%).RF (SiO2, хлороформ/этанол, 9:1): 0,40. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,46 (д, J=8,1 Гц, 2 Н); 7,25 (д, J=8,7 Гц, 2 Н); 7,16 (д, J=8,7 Гц,2 Н); 7,12 (д, J=8,1 Гц, 2 Н); 6,66 (д, J=2,7 Гц, 1 Н); 6,62 (д, J=8,7 Гц, 1 Н); 6,56 (дд, J=8,7 и 2,7 Гц); 6,27 (т,J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,49 (д, J=6,7 Гц, 2 Н); 3,78 (с, 3 Н); 3,49 (с, 2 Н); 2,38 (с, 6 Н); 2,24 (с, 3 Н). Указанный выше сложный эфир (0,40 г, 0,794 ммоль) растворяют в этаноле (50 мл), добавляют раствор моногидрата гидроксида лития (0,10 г, 2,38 ммоль) в воде (4 мл) и смесь оставляют на 48 ч. Растворители выпаривают в вакууме; остаток разбавляют водой (25 мл), подкисляют уксусной кислотой(0,5 мл) и экстрагируют этилацетатом (250 мл). Органический раствор сушат безводным карбонатом калия и затем упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, хлороформ/этанол/аммиак, 1:1:0,05), получая при этом масло, которое растирают с гексаном, получая при этом указанное в заголовке соединение в виде аморфного твердого вещества. Выход: 0,34 г (87,5%). 2-Этинилпиридин (250 мг, 2,42 ммоль) добавляют в атмосфере азота к дегазированному раствору метил-(Z)-[4-[3-(4-хлорфенил)-3-(4-йодфенил]аллилокси]-2-метилфенокси]ацетата (500 мг, 0,91 ммоль; пример 7) в смеси тетрагидрофурана (8 мл) и триэтиламина (8 мл). Раствор охлаждают, добавляют тетракис(трифенилфосфин)палладий (96 мг, 0,083 ммоль) и иодид меди(I) (27,6 мг, 0,145 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 72 ч, разбавляют бензолом(100 мл) и промывают водой (250 мл). Органический раствор сушат безводным карбонатом калия и затем упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, бензолхлороформ/эфир, 2:1), получая при этом метил-(Е)-[4-[3-(4-хлорфенил)-3-[4-(пиридин-2-илэтинил)фенил]аллилокси]-2-метилфенокси]ацетат. Выход: 400 мг (84%).(д, J=7,8 Гц, 1 Н); 7,27 (м, 3 Н); 7,20 (м, 4 Н); 6,68 (д, J=2,7 Гц, 1 Н); 6,63 (д, J=8,8 Гц, 1 Н); 6,57 (дд, J=8,8 и 2,7 Гц); 6,30 (т, J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,51 (д, J=6,7 Гц, 2 Н); 3,78 (с, 3 Н); 2,25 (с, 3 Н). Указанный выше сложный эфир (0,30 г, 0,57 ммоль) растворяют в этаноле (30 мл), добавляют раствор моногидрата гидроксида лития (0,08 г, 1,9 ммоль) в воде (4 мл) и смесь оставляют на 72 ч. Растворители выпаривают в вакууме, остаток разбавляют водой (25 мл), подкисляют уксусной кислотой(0,5 мл) и экстрагируют хлороформом (250 мл). Органический раствор сушат безводным карбонатом калия и затем упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, этилацетат), получая при этом масло, которое растирают с гексаном, получая при этом указанное в заголовке соединение в виде аморфного твердого вещества. Выход: 0,25 г (86%). Раствор 4-фтор-1-йодбензола (11,0 г, 50,0 ммоль) в безводном тетрагидрофуране (90 мл) дегазируют и добавляют иодид меди(I) (0,29 г, 1,5 ммоль), тетракис(трифенилфосфин)палладий (1,75 г, 1,5 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (9,25 г, 60,0 ммоль). Реакционный раствор снова дегазируют и по каплям в инертной атмосфере при температуре окружающей среды добавляют пропаргиловый спирт (3,5 мл,60,0 ммоль). Полученную желтую суспензию перемешивают при температуре окружающей среды на протяжении ночи, затем обрабатывают насыщенным раствором соли (10 мл) и подкисляют 2 М хлористо-водородной кислотой до рН 2. Фазы разделяют и водную фазу экстрагируют эфиром (450 мл). Объединенные органические фазы промывают водой (330 мл) и насыщенным раствором соли(230 мл), сушат над безводным сульфатом магния и концентрируют в вакууме, получая при этом коричневое твердое вещество. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 90:10) и полученное бледно-желтое твердое вещество кристаллизуют из гексана, получая при этом 3-(4-фторфенил)проп-2-ин-1-ол в виде светло-желтых игл. Выход: 6,2 г (83%). Т.пл. 32-33 С (гексан).RF (гексаны/этилацетат, 80:20) 0,30. Метоксид натрия (0,05 г, 0,9 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (20 мл, 20 ммоль). Смесь охлаждают до 0 С и медленно добавляют раствор вышеуказанного спирта (3,0 г, 20,0 ммоль) в тетрагидрофуране (30 мл). Реакционную смесь перемешивают при 0 С в течение 3 ч, добавляют этилацетат (5,5 мл, 60,1 ммоль) и смесь перемешивают в течение дополнительных 10 мин без охлаждения. Добавляют 1,4-дийодбензол (6,3 г, 19,0 ммоль), безводный хлорид цинка (1,65 г,12,0 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,42 г, 0,4 ммоль); из смеси выкачивают воздух и помещают ее в атмосферу азота. Добавляют раствор три(2-фурил)фосфин (0,37 г,1,6 ммоль) и смесь нагревают при 50 С на протяжении ночи в атмосфере азота. Добавляют метанол(10 мл) и смесь перемешивают в течение дополнительного 1 ч. Реакционную смесь разбавляют простым эфиром (100 мл) и добавляют насыщенный водный раствор хлорида аммония (5 мл). Смесь фильтруют через подушку силикагеля, выпаривают в вакууме и остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 90:10), получая при этом (Z)-[3-(4-фторфенил)-3-(4 йодфенил)]аллиловый спирт. Выход: 3,1 г (43%).RF (SiO2, гексаны/этилацетат, 80:20) 0,25. Вышеуказанный аллиловый спирт (3,0 г, 8,5 ммоль) растворяют в безводном тетрагидрофуране(1,83 г, 9,3 ммоль; пример 2) и трифенилфосфин (2,7 г, 10,3 ммоль). Из смеси откачивают воздух и охлаждают ее до 0 С в атмосфере азота. По каплям на протяжении 30 мин добавляют дегазированный раствор диизопропилазодикарбоксилата (2,0 мл, 10,3 ммоль) в безводном тетрагидрофуране (20 мл) и реакционной смеси дают возможность нагреться до температуры окружающей среды и затем перемешивают на протяжении ночи. Растворители выпаривают в вакууме и остаток подвергают колоночной флэшхроматографии (силикагель Флюка 60, гексаны/этилацетат, 90:10), получая при этом метил-(Z)-[4-[3-(4 фторфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат в виде отверждающегося бледно-желтого масла. Выход: 3,0 г (67%).RF (SiO2, гексаны/этилацетат, 80:20) 0,55. Метил-(Z)-[4-[3-(4-фторфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат (400 мг, 0,75 ммоль) растворяют в безводном тетрагидрофуране (10 мл); добавляют безводный триэтиламин (20 мл) и раствор 4-пропаргилморфолина (190 мг, 1,51 ммоль) в безводном тетрагидрофуране (2 мл). Раствор дегазируют и в атмосфере азота добавляют иодид меди(I) (23 мг, 0,12 ммоль) и тетракис(трифенилфосфин)палладий(70 мг, 0,06 ммоль). Смесь перемешивают при температуре окружающей среды на протяжении ночи, образовавшуюся суспензию фильтруют через подушку силикагеля и силикагель тщательно промывают этилацетатом. Фильтрат промывают водой (230 мл) и насыщенным раствором соли (230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают с применением колоночной хроматографии (силикагель Флюка 60, хлороформ, насыщенный смесью аммиак/метанол, 99:1), получаяRF (SiO2, хлороформ, насыщенный смесью аммиак/метанол, 99:1): 0,15. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,46 (д, J=8,2 Гц, 2 Н); 7,23-7,13 (м, 4 Н); 6,98 (т, J=8,6 Гц, 2 Н); 6,68-6,55 (м, 3 Н); 6,24 (т, J=6,7 Гц, 1 Н); 4,58 (с, 2 Н); 4,49 (д, J=6,7 Гц, 2 Н); 3,79-3,75 (м, 5 Н); 3,54 (с, 2 Н); 2,68-2,56 (м, 6 Н); 2,25 (с, 3 Н). К раствору указанного выше сложного эфира (370 мг, 0,718 ммоль) в смеси тетрагидрофуран/метанол (5:2, 7 мл) добавляют раствор моногидрата гидроксида лития (70 мг, 1,44 ммоль) в дистиллированной воде (2,5 мл) и раствор перемешивают в течение 60 мин при температуре окружающей среды. Смесь нейтрализуют 2 М хлористо-водородной кислотой и разбавляют простым эфиром (50 мл) и водой (20 мл). Фазы разделяют и водный слой экстрагируют простым эфиром (215 мл). Объединенные органические слои промывают водой (215 мл) и насыщенным раствором соли (315 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток обрабатывают гексаном, получая при этом указанную в заголовке кислоту в виде коричневатых кристаллов. Выход: 260 мг (72%). Т.пл.: 145-171 С (аморфное соединение). Метил-(Z)-[4-[3-(4-фторфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат (400 мг, 0,75 ммоль,пример 10) растворяют в безводном тетрагидрофуране (10 мл); добавляют безводный триэтиламин (20 мл) и раствор 3-(метилсульфанил)пропина (130 мг, 1,51 ммоль) в безводном тетрагидрофуране (2 мл). Образовавшийся раствор дегазируют и в атмосфере азота добавляют иодид меди(I) (23 мг, 0,12 ммоль) и тетракис(трифенилфосфин)палладий (70 мг, 0,06 ммоль). Реакционную смесь перемешивают при температуре окружающей среды на протяжении ночи, образовавшуюся суспензию фильтруют через подушку силикагеля и силикагель тщательно промывают этилацетатом. Фильтрат выпаривают в вакууме; полученный остаток растворяют в дихлорметане и раствор промывают водой (230 мл) и насыщенным раствором соли (230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат, 90:10), получая при этом метил-(Е)[4-[3-(4-фторфенил)-3-[4-[3-(метилсульфанил)пропинил]фенил]аллилокси]-2-метилфенокси]ацетат в виде желтого масла. Выход: 310 мг (84%).(с, 3 Н); 2,25 (с, 3 Н). К раствору указанного выше сложного эфира (300 мг, 0,611 ммоль) в тетрагидрофуране (5 мл) и метаноле (2 мл) добавляют раствор моногидрата гидроксида лития (60 мг, 1,22 ммоль) в дистиллированной воде (2 мл). Раствор перемешивают в течение 60 мин при температуре окружающей среды и затем нейтрализуют 2 М хлористо-водородной кислотой. Смесь разбавляют простым эфиром (50 мл) и водой(20 мл); фазы разделяют и водный слой экстрагируют простым эфиром (215 мл). Объединенные органические слои промывают водой (215 мл) и насыщенным раствором соли (315 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток обрабатывают гексаном, получая при этом указанную в заголовке кислоту в виде коричневатых кристаллов. Выход: 260 мг (72%). Т.пл.: 145-171 С (аморфное соединение). Метил-(Z)-[4-[3-(4-фторфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат (400 мг, 0,75 ммоль; пример 10) растворяют в безводном тетрагидрофуране (10 мл). Добавляют безводный триэтиламин (20 мл) и раствор 2-этинилпиридина (155 мг, 1,50 ммоль) в безводном тетрагидрофуране (2 мл). Раствор дегазируют и добавляют иодид меди(I) (23 мг, 0,12 ммоль) и тетракис(трифенилфосфин)палладий (70 мг, 0,06 ммоль). Смесь перемешивают при температуре окружающей среды в атмосфере азота на протяжении ночи; образовавшуюся суспензию фильтруют через подушку силикагеля и силикагель тщательно промывают этилацетатом. Полученный фильтрат выпаривают в вакууме и остаток растворяют в этилацетате (50 мл). Раствор промывают водой (230 мл) и насыщенным раствором соли (230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают с применением колоночной хроматографии(силикагель Флюка 60, гексаны/этилацетат, 90:10), получая при этом метил-(Е)-[4-[3-(4-фторфенил)-3-[4[(пиридин-2-ил)этинил]фенил]аллилокси]-2-метилфенокси]ацетат в виде оранжевого масла. Выход: 310 мг (81%).RF (SiO2, гексаны/этилацетат, 80:20): 0,65. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 8,64 (д, J=4,4 Гц, 1 Н); 7,73-7,68 (м, 1 Н); 7,69-7,63 (д, J=8,3 Гц,2H); 7,55 (д, J=8,3 Гц, 1 Н); 7,25-7,19 (м, 5 Н); 6,97 (т, J=8,7 Гц, 2H); 6,69-6,56 (м, 3 Н); 6,26 (т, J=6,7 Гц,1 Н); 4,59 (с, 2H); 4,51 (д, J=6,7 Гц, 2 Н); 3,79 (с, 3 Н); 2,25 (с, 3 Н). К раствору указанного выше сложного эфира (300 мг, 0,591 ммоль) в смеси тетрагидрофуран/метанол (5:2, 7 мл) добавляют раствор моногидрата гидроксида лития (60 мг, 1,22 ммоль) в дистиллированной воде (2,0 мл) и реакционную смесь перемешивают в течение 60 мин при температуре окружающей среды. Раствор нейтрализуют 2 М хлористо-водородной кислотой и разбавляют простым эфиром (50 мл) и водой (20 мл). Фазы разделяют и водный слой экстрагируют простым эфиром (210 мл). Объединенные органические слои промывают водой (215 мл) и насыщенным раствором соли (315 мл),сушат над безводным сульфатом магния и упаривают в вакууме. Остаток обрабатывают смесью гексана и дихлорметана (10:1, 7 мл), получая при этом указанную в заголовке кислоту в виде коричневатых кристаллов. Выход: 240 мг (82%). Т.пл.: 90-95 С (аморфное вещество).(400 мг,0,75 ммоль; пример 10) растворяют в смеси безводного тетрагидрофурана (10 мл) и безводного триэтиламина (20 мл). Раствор дегазируют и в инертной атмосфере добавляют раствор N,N-диметилпропаргиламина (125 мг, 1,50 ммоль) в безводном тетрагидрофуране (2 мл). Образовавшийся раствор дегазируют еще раз, добавляют иодид меди(I) (23 мг, 0,12 ммоль) и тетракис(трифенилфосфин)палладий(70 мг, 0,06 ммоль) и смесь снова дегазируют. Реакционную смесь перемешивают при температуре окружающей среды на протяжении ночи и образовавшуюся суспензию фильтруют через подушку силикагеля. Силикагель тщательно промывают этилацетатом; фильтрат выпаривают в вакууме и остаток рас- 27015717 творяют в дихлорметане (50 мл). Раствор промывают водой (230 мл) и насыщенным раствором соли(230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, дихлорметан/метанол, 99:1), получая при этом метил-(Е)-[4[3-[4-[3-(диметиламино)пропинил]фенил]-3-(4-фторфенил)аллилокси]-2-метилфенокси]ацетат в виде желтого масла. Выход: 320 мг (87%).(с, 6 Н); 2,25 (с, 3 Н). К раствору указанного выше сложного эфира (300 мг, 0,615 ммоль) в тетрагидрофуране (5 мл) и метаноле (2 мл) добавляют раствор моногидрата гидроксида лития (60 мг, 1,22 ммоль) в дистиллированной воде (2 мл). Раствор перемешивают в течение 60 мин при температуре окружающей среды, нейтрализуют насыщенным водным раствором хлорида аммония (10 мл) и экстрагируют простым эфиром (330 мл) и дихлорметаном (330 мл). Объединенные органические экстракты промывают насыщенным водным раствором хлорида аммония (210 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток обрабатывают смесью гексаны/дихлорметан (10:1, 5 мл), получая при этом указанную в заголовке кислоту в виде желтоватых кристаллов. Выход: 165 мг (57%). Т.пл.: 115-143 С (аморфное вещество). Метил-(Z)-[4-[3-(4-фторфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат (400 мг, 0,75 ммоль; пример 10) растворяют в смеси безводного тетрагидрофурана (10 мл) и безводного триэтиламина (20 мл). Раствор дегазируют и в инертной атмосфере добавляют раствор 1-пропаргилпиразола (160 мг, 1,50 ммоль) в безводном тетрагидрофуране (2 мл). Образовавшийся раствор дегазируют и добавляют иодид меди(I) (23 мг, 0,12 ммоль) и тетракис(трифенилфосфин)палладий (70 мг, 0,06 ммоль) и смесь снова дегазируют. Реакционную смесь перемешивают при температуре окружающей среды на протяжении ночи; образовавшуюся суспензию фильтруют через подушку силикагеля. Силикагель тщательно промывают этилацетатом; фильтрат упаривают и остаток растворяют в дихлорметане (30 мл). Раствор промывают водой(230 мл) и насыщенным раствором соли (230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток очищают колоночной хроматографией (силикагель Флюка 60, гексаны/этилацетат,80:20), получая при этом метил-(Е)-[4-[3-(4-фторфенил)-3-[4-[3-(пиразол-1-ил)пропинил]фенил]аллилокси]-2-метилфенокси]ацетат в виде оранжевого масла. Выход: 270 мг (70%).RF (SiO2, хлороформ/метанол, 95:5): 0,55. 1 Н ЯМР-спектр (300 МГц, CDCl3, Н): 7,69 (д, J=2,3 Гц, 1 Н); 7,56 (д, J=1,7 Гц, 1 Н); 7,48 (д, J=8,2 Гц,2H); 7,22-7,14 (м, 4 Н); 6,98 (т, J=8,7 Гц, 2H); 6,67-6,54 (м, 3 Н); 6,32 (т, J=2,1 Гц, 1 Н); 6,25 (т, J=6,7 Гц,1 Н); 5,20 (с, 2H); 4,58 (с, 2H); 4,47 (д, J=6,7 Гц, 2H); 3,79 (с, 3 Н); 2,24 (с, 3 Н). К раствору указанного выше сложного эфира (250 мг, 0,615 ммоль) в тетрагидрофуране (5 мл) и метаноле (2 мл) добавляют раствор моногидрата гидроксида лития (50 мг, 1,22 ммоль) в дистиллированной воде (2 мл). Раствор перемешивают в течение 2 ч при температуре окружающей среды, нейтрализуют 2 М хлористо-водородной кислотой и разбавляют простым эфиром (30 мл) и водой (20 мл). Слои разделяют и водный слой экстрагируют простым эфиром (330 мл). Объединенные органические экстракты промывают водой (230 мл) и насыщенным раствором соли (230 мл), сушат над безводным сульфатом магния и упаривают в вакууме. Остаток обрабатывают смесью гексаны/дихлорметан (10:1, 5 мл), получая при этом указанную в заголовке кислоту в виде желтоватых кристаллов. Выход: 130 мг (53%). Т.пл.: 35-56 С (аморфное вещество). Раствор 1-хлор-4-йодбензола (23,9 г, 100,0 ммоль) в сухом тетрагидрофуране (100 мл) дегазируют и добавляют иодид меди(I) (570 мг, 3,0 ммоль), тетракис(трифенилфосфин)палладий (3,4 г, 3,0 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (18,2 г, 120,0 ммоль). Реакционный раствор снова дегазируют и в инертной атмосфере при температуре окружающей среды добавляют пропаргиловый спирт (6,7 г,120,0 ммоль). Реакционную смесь перемешивают (сначала при охлаждении ледяной водой) в течение 24 ч, затем обрабатывают водой (20 мл) и подкисляют 2 М хлористо-водородной кислотой (20 мл). Органическую фазу отделяют и водную фазу экстрагируют эфиром (430 мл). Объединенные органические фазы сушат безводным сульфатом магния и концентрируют в вакууме, получая при этом коричневое твердое вещество. Остаток очищают колоночной хроматографией (силикагель Флюка 60, хлороформ), получая при этом 3-(4-хлорфенил)проп-2-ин-1-ол. Выход: 8,35 г (50%). Т.пл.: 75,5-77,5 С (гексан).RF (SiO2, гексан/этилацетат, 90:10): 0,10. Метоксид натрия (0,05 г, 0,9 ммоль) добавляют к 1 М раствору литийалюминийгидрида в тетрагидрофуране (20 мл, 20 ммоль). Смесь охлаждают до 0 С и медленно добавляют раствор вышеуказанного спирта (3,35 г, 20,1 ммоль) в тетрагидрофуране (30 мл). Реакционную смесь перемешивают при 0 С в течение 1,5 ч и при температуре окружающей среды в течение 1,5 ч. При 0 С добавляют этилацетат(6,6 г, 20 ммоль), безводный хлорид цинка (1,64 г, 12 ммоль), комплекс трис-(дибензилиденацетон)дипалладийхлороформ (0,41 г, 0,4 ммоль) и три(2-фурил)фосфин (0,37 г, 1,6 ммоль); из смеси откачивают воздух и помещают ее в атмосферу азота. Реакционную смесь нагревают при 65 С в течение 16 ч и затем охлаждают. Добавляют метанол (10 мл) и смесь перемешивают в течение дополнительного 1 ч. Реакционную суспензию разбавляют простым эфиром (150 мл) и добавляют насыщенный водный раствор хлорида аммония (5 мл). Смесь фильтруют через подушку силикагеля и твердую фазу тщательно промывают простым эфиром. Растворители выпаривают в вакууме и остаток подвергают колоночной хроматографии(силикагель Флюка 60, бензол-хлороформ), получая при этом (Z)-[3-(4-хлорфенил)-3-(4 йодфенил)]аллиловый спирт в виде светло-коричневого твердого вещества. Выход: 3,5 г (49%). Т.пл.: 79-84 С.RF (SiO2, хлороформ/эфир, 2:1): 0,40. 1 Н ЯМР-спектр (300 МГц, CDCl3, H): 7,71 (д, J=8,7 Гц, 2H); 7,26 (д, J=8,8 Гц, 2H); 7,15 (д, J=8,8 Гц,2H); 6,90 (д, J=8,7 Гц, 2H); 6,22 (т, J=6,9 Гц, 1 Н); 4,20 (д, J=6, 9 Гц, 2H); 1,55 (с, 1 Н). Указанный выше аллиловый спирт (3,45 г, 9,7 ммоль), метил-(4-гидрокси-2-метилфенокси)ацетат(50 мл) и тетрагидрофурана (25 мл). Смесь охлаждают до 0 С, помещают в атмосферу азота и по каплям добавляют диизопропилазодикарбоксилат (2,3 г, 10,8 ммоль). Реакционную смесь перемешивают при 0 С в течение 3 ч и затем при температуре окружающей среды в течение 16 ч. Растворители выпаривают в вакууме и остаток подвергают колоночной хроматографии (силикагель Флюка 60, бензол), получая при этом метил-(Z)-[4-[3-(4-хлорфенил)-3-(4-йодфенил)аллилокси]-2-метилфенокси]ацетат в виде твердого вещества. Выход: 3,1 г (58%). Т.пл.: 89-92 С.
МПК / Метки
МПК: C07D 333/16, A61K 31/44, A61P 3/10, C07D 333/54, C07C 59/68, C07D 213/30, C07D 211/46, C07D 231/12, C07D 295/08, C07D 307/79, C07C 323/16
Метки: кислоты, активаторов, феноксиуксусные, качестве, дельта
Код ссылки
<a href="https://eas.patents.su/30-15717-fenoksiuksusnye-kisloty-v-kachestve-aktivatorov-ppar-delta.html" rel="bookmark" title="База патентов Евразийского Союза">Феноксиуксусные кислоты в качестве активаторов ppar дельта</a>
Предыдущий патент: Применение sdf-1 для лечения и/или профилактики неврологических заболеваний
Следующий патент: Суперпарамагнитные наночастицы на основе оксидов железа с модифицированной поверхностью, способ их получения и применение
Случайный патент: Способ повторной переработки пластмасс и способ получения материалов из пластмасс












