Устойчивые к спиртам лекарственные формы
Номер патента: 15615
Опубликовано: 31.10.2011
Авторы: Флайшер Вольфганг, Хан Удо, Спитцлай Кристоф, Мэннион Ричард О., Маккенна Уильям Х., Мохаммад Хассан, О`доннелл Эдвард П., Тамбер Харджит, Уолден Мелколм, Лойнер Кристиан, Пратер Дерек Аллен, Хэйз Джеффри Джерард, Уайтлок Стив, Данагер Хелен Кэтлин
Формула / Реферат
1. Состав с контролируемым высвобождением, устойчивый к экстракции спиртом, содержащий первый матричный материал, содержащий этилцеллюлозу в количестве от 5 до 60 вес.% матричного состава, второй матричный материал, выбранный из полимера метакрилата в количестве от 5 до 66 вес.% матричного состава, и соль опиоида.
2. Состав по п.1, отличающийся тем, что соль опиоида выбрана из опиоидных агонистов, опиоидных антагонистов в сочетании с опиоидными агонистами, которые обеспечивают обезболивающий эффект, и смешанных опиоидных агонистов/антагонистов, частичных опиоидных агонистов или их смесей в виде их фармацевтически приемлемых солей.
3. Состав по п.2, отличающийся тем, что соль опиоида выбрана из альфентанила, аллилпродина, альфапродина, анилеридина, бензилморфина, безитрамида, бупренорфина, буторфанола, клонитазена, кодеина, дезоморфина, декстроморамида, дезоцина, диампромида, диаморфона, дигидрокодеина, дигидроморфина, дименоксадола, димефептанола, диметилтиамбутена, диоксафетилбутирата, дипипанона, эптазоцина, этогептазина, этилметилтиамбутена, этилморфина, этонитазена, эторфина, дигидроэторфина, фентанила и производных, гидрокодона, гидроморфона, гидроксипетидина, изометадона, кетобмидона, леворфанола, левофенацилморфана, лофентанила, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, нарцеина, никоморфина, норлеворфанола, норметадона, налорфина, налбуфена, норморфина, норпипанона, опия, оксикодона, оксиморфона, папаверетума, пентазоцина, фенадоксона, феноморфана, феназоцина, феноперидина, пиминодина, пиритрамида, профептазина, промедола, проперидина, пропоксифена, суфентанила, тилидина, трамадола в виде их фармацевтически приемлемых солей и смесей любых из указанных веществ и т.п., предпочтительно из фармацевтически приемлемых солей любого вещества из кодеина, морфина, оксикодона, гидрокодона, гидроморфона или оксиморфона.
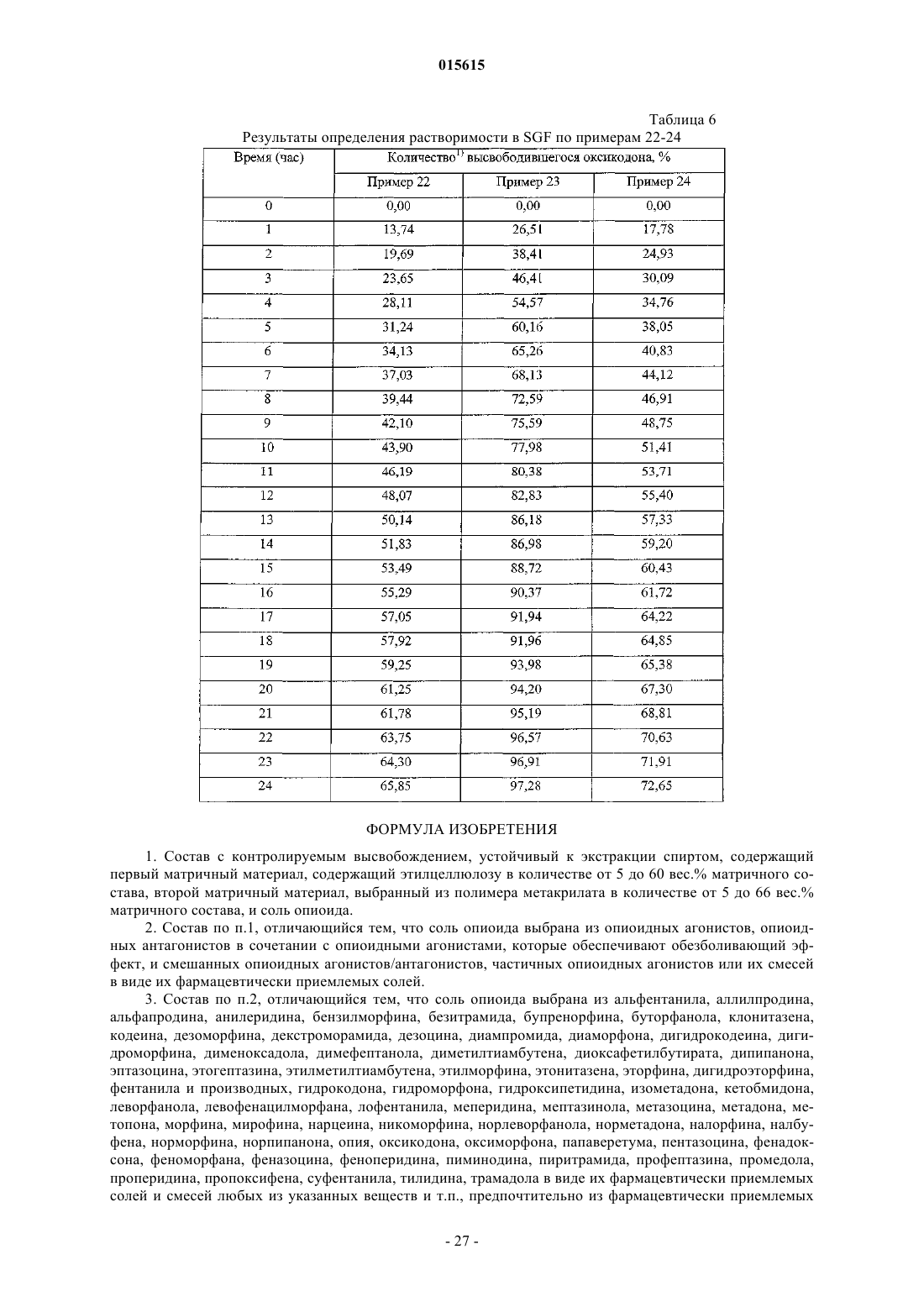
4. Состав по п.1, отличающийся тем, что соль опиоида представляет собой комбинацию соли опиоидного агониста и соли опиоидного антагониста, при этом комбинация обеспечивает анальгетический эффект и опиоидный антагонист выбран из группы, состоящей из налоксона, налтрексона и налорфина в виде их фармацевтически приемлемых солей.
5. Состав по п.1, отличающийся тем, что этилцеллюлоза содержится в количестве от 10 до 50 вес.%, наиболее предпочтительно от 20 до 45 вес.% в расчете на матричный материал или в количестве по меньшей мере 40 вес.%, по меньшей мере 45 вес.%, по меньшей мере 50 вес.%, по меньшей мере 55 вес.% или по меньшей мере 60 вес.% в расчете на матричный состав.
6. Состав по п.1, отличающийся тем, что полимер метакрилата содержится в количестве от 5 до 66 вес.%, предпочтительно от 15 до 50 вес.%, более предпочтительно от 20 до 45 вес.% и наиболее предпочтительно от 25 до 45 вес.% или в весовом количестве, равном по меньшей мере 5 вес.%, по меньшей мере 10 вес.%, по меньшей мере 15 вес.%, по меньшей мере 20 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав.
7. Состав по п.1, отличающийся тем, что второй матричный материал представляет собой нейтральный водонерастворимый сополимер этилакрилата с метилметакрилатом.
8. Состав по п.7, отличающийся тем, что нейтральный водонерастворимый сополимер этилакрилата с метилметакрилатом содержится в количестве от 5 до 66 вес.%, предпочтительно от 15 до 50 вес.%, более предпочтительно от 20 до 45 вес.% и наиболее предпочтительно от 25 до 45 вес.% или в весовом количестве, равном по меньшей мере 5 вес.%, по меньшей мере 10 вес.%, по меньшей мере 15 вес.%, по меньшей мере 20 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав.
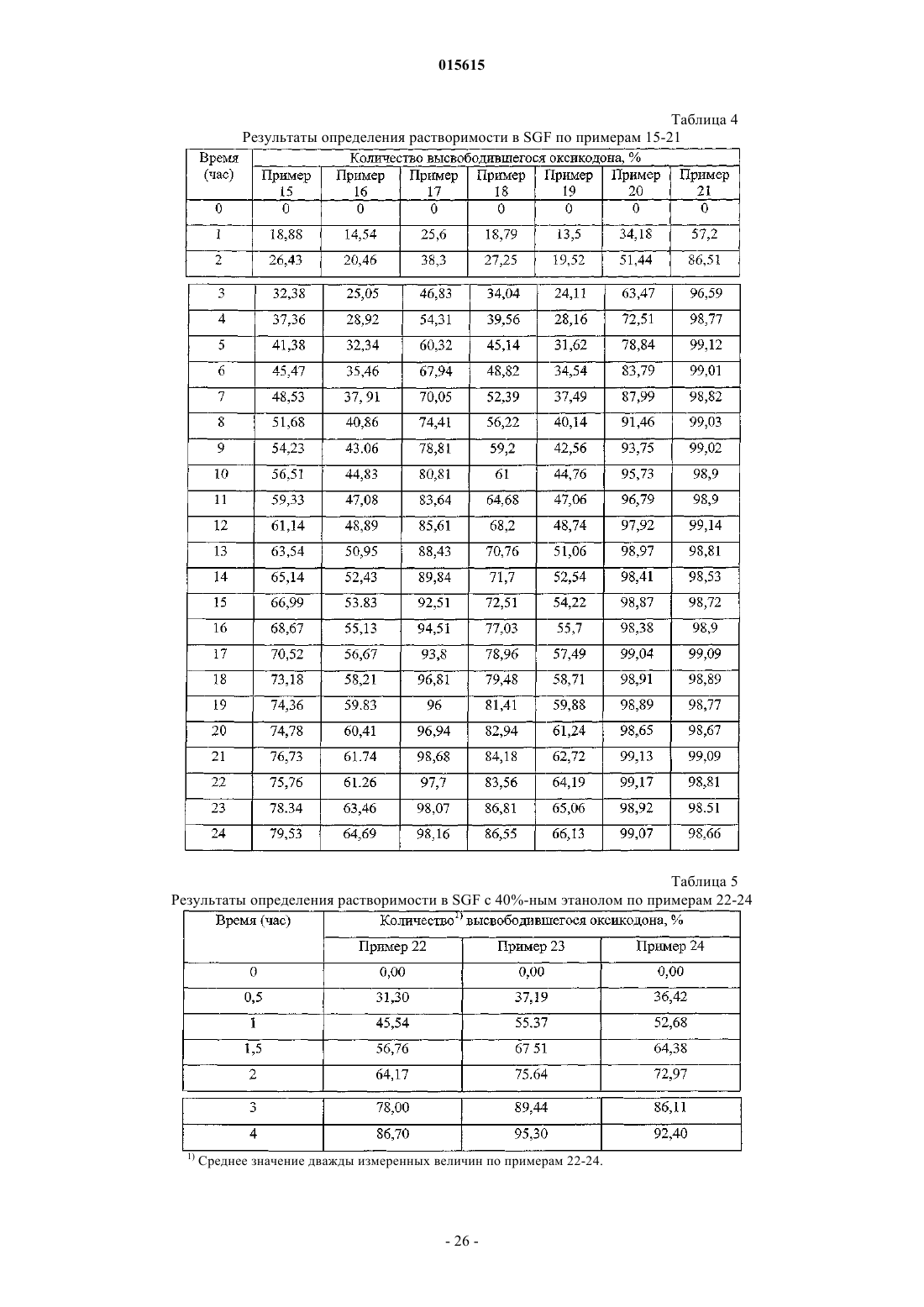
9. Состав по пп.2-8, отличающийся тем, что соль опиоида представляет собой оксикодона гидрохлорид или гидроморфона гидрохлорид.
10. Состав по любому из предыдущих пунктов, отличающийся тем, что в матричный материал включено по меньшей мере одно связующее, предпочтительно гидроксиалкилцеллюлоза.
11. Состав по п.10, отличающийся тем, что этилцеллюлоза соединена по меньшей мере с одним пластификатором.
12. Состав по пп.2-8, отличающийся тем, что соль опиоида представляет собой смесь оксикодона гидрохлорида и налоксона гидрохлорида, и они содержатся в отношении 2:1.
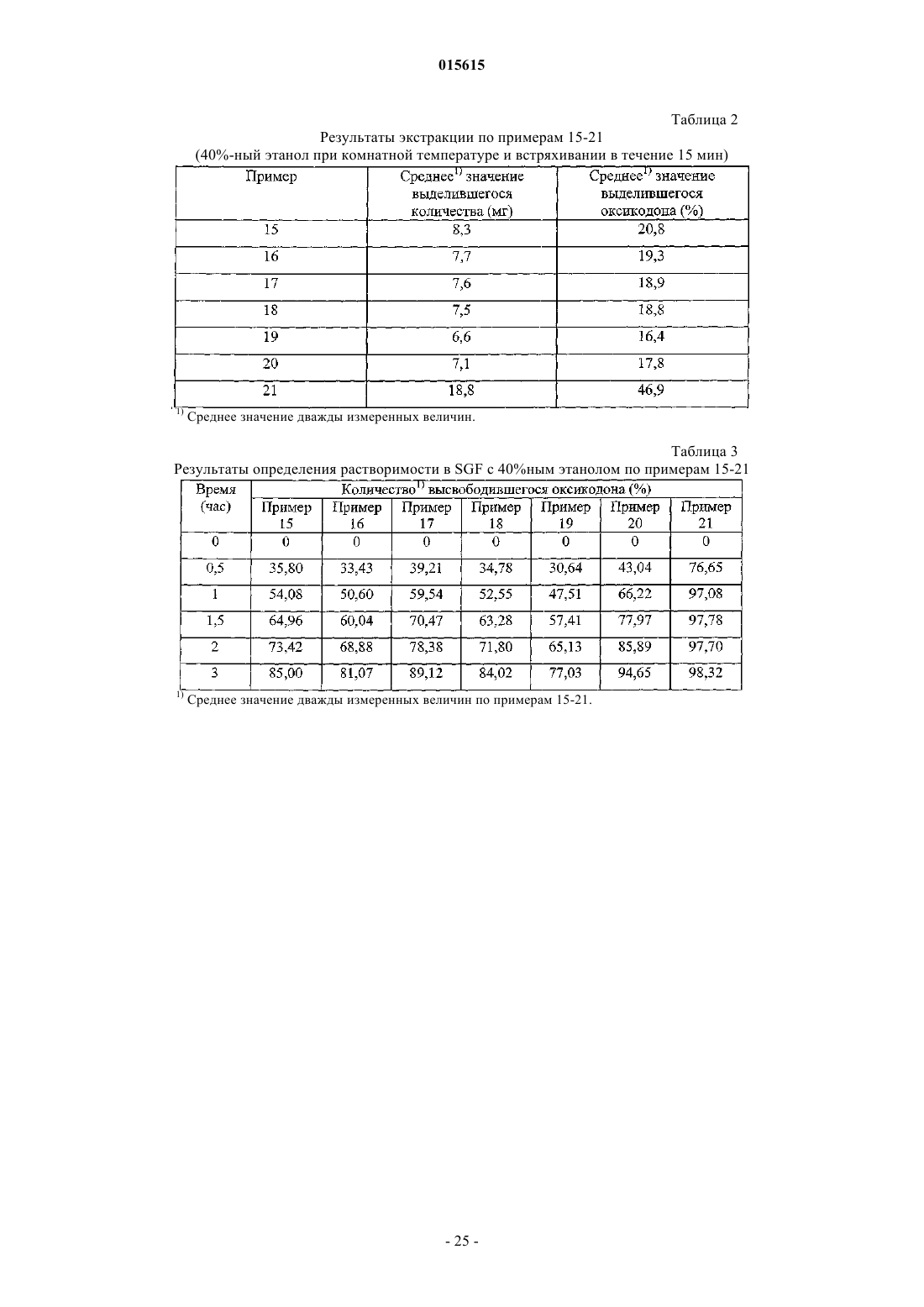
13. Состав по п.1, отличающийся тем, что после встряхивания в воде при комнатной температуре в течение около 15 мин высвобождает менее 15% соли опиоида.
14. Состав по п.10, отличающийся тем, что связующее содержится в количестве, равном по меньшей мере 1 вес.%, по меньшей мере 3 вес.% или по меньшей мере 5 вес.% в расчете на матричный состав.
15. Состав по п.14, отличающийся тем, что количество связующего составляет максимально 10 вес.% в расчете на матричный состав.
16. Состав по п.14 или 15, отличающийся тем, что связующее представляет собой гидроксиалкилцеллюлозу.
17. Состав по п.11, отличающийся тем, что пластификатор содержится в количестве, равном по меньшей мере 5 вес.%, по меньшей мере 15 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав.
18. Состав по п.17, отличающийся тем, что количество пластификатора составляет максимально 30 вес.% или максимально 40 вес.% в расчете на матричный состав.
19. Состав по п.17 или 18, отличающийся тем, что пластификатор имеет температуру плавления, равную по меньшей мере 80°С.
20. Состав по п.19, отличающийся тем, что пластификатор представляет собой гидрированное касторовое масло.
21. Состав по п.1, отличающийся тем, что матричный материал представляет собой прессованный гранулят.
22. Состав по п.1, отличающийся тем, что соль опиоида представляет собой гидроморфона гидрохлорид, который содержится в количестве 2, или 4, или 8, или 12, или 16, или 24, или 32, или 48, или 64 мг.
23. Состав по п.1, отличающийся тем, что соль опиоида представляет собой оксикодона гидрохлорид, который содержится в количестве 5, или 10, или 15, или 20, или 30, или 40, или 45, или 60, или 80, или 90, или 120, или 160 мг.
24. Способ лечения боли, включающий введение пациенту, нуждающемуся в этом, состава по любому из пп.1-23.
25. Способ удержания от злоупотребления опиоидным агонистом, включающий введение состава по любому из пп.1-23.
26. Способ изготовления состава по любому из пп.1-23, включающий экструдирование фармацевтически приемлемой соли опиоидного анальгетика и матричного материала.
27. Способ по п.26, отличающийся тем, что он включает резку экструдата на множество частиц, возможное прессование частиц с получением таблетки или наполнение частицами капсул.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента 015615 Область техники Данное изобретение относится к составам с контролируемым высвобождением, устойчивым к спиртовой экстракции, в частности к составам на основе синтетических наркотических препаратов(опиоидов), устойчивым к спиртовой экстракции. Уровень техники Фармацевтические препараты иногда становятся предметом злоупотребления. Например, конкретная доза опиоидного агониста может быть более активной при парентеральном введении по сравнению с той же дозой, введенной перорально. Некоторые составы могут быть изменены для того, чтобы приспособить опиоидный агонист, содержащийся в них, для запрещенного применения. Составы опиоидных агонистов с контролируемым высвобождением наркоманы иногда размалывают или подвергают экстракции при помощи растворителей (например, этанола) для того, чтобы вызвать немедленное высвобождение опиоида, содержащегося в них, при оральном или парентеральном применении. Лекарственные формы опиоидных агонистов с контролируемым высвобождением, которые могут выделять часть опиоида при действии этанола, могут также привести к тому, что пациент получает дозу быстрее, чем предполагалось, если пациент пренебрегает инструкциями по применению и употребляет алкоголь вместе с лекарственной формой. Компания Purdue Pharma L.Р. продает в настоящее время лекарственные формы оксикодона с пролонгируемым высвобождением, содержащие 10, 20, 40 и 80 мг оксикодона гидрохлорида, под торговым названием OxyContin. В патентах США 5266331, 5508042, 5549912 и 5656295 описаны составы на основе оксикодона с пролонгированным высвобождением.Purdue Pharma L.P. является поставщиком гидроморфона с пролонгированным высвобождением в виде лекарственных форм, содержащих 12, 16, 24 и 32 мг гидроморфона гидрохлорида, под торговым названием Palladone. В процессе разработки Palladone in vitro экстракция и изучение растворимости показали, что действие этанола на состав приводит к увеличению высвобождения гидроморфона по сравнению с высвобождением в воде. Последующие фармакокинетические исследования на здоровых людях показали, что совместное принятие этанола и капсул Palladone может привести к быстрому высвобождению и абсорбции гидроморфона из состава. В патентах США 5958452, 5965161, 5968551, 6294195, 6335033, 6706281 и 6743442 описаны составы на основе гидроморфона с пролонгированным высвобождением. В заявках США 2003/0118641 и 2005/0163856, Maloney et al., описан опиоидный состав, который использует ионообменную смолу в сочетании с гидрофобной матрицей, которая является устойчивой к экстракции опиоида обычными доступными растворителями. В заявке США 2004/0052731, Hirsh et al., описана фармацевтическая композиция, которая может быть специально использована для уменьшения возможности неправильного применения лекарств. Продолжает существовать необходимость в оральной лекарственной форме, содержащей опиоидный агонист, с пониженным высвобождением опиоида при действии спирта. Все источники, процитированные в данном изобретении, включая вышеуказанные патенты, заявки на патент и приоритетные документы, включены полностью в качестве ссылок в данное описание. Сущность изобретения Цель некоторых вариантов данного изобретения состоит в создании пероральной лекарственной формы с контролируемым высвобождением, содержащей опиоидный анальгетик, которая является устойчивой к обычным методам экстракции, в частности этанольными растворами, предназначенными для выделения опиоидного анальгетика для незаконного применения. Цель других вариантов изобретения заключается в создании пероральной лекарственной формы с контролируемым высвобождением, содержащей опиоидный анальгетик, которая является устойчивой к высвобождению опиоидного анальгетика при совместном введении с алкоголем. Еще одна цель данного изобретения состоит в создании пероральной лекарственной формы с контролируемым высвобождением, содержащей опиоидный анальгетик, которая обладает повышенной твердостью и устойчива к раздавливанию. Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую опиоидный анальгетик и материал с контролируемым высвобождением, при этом отношение количества опиоидного анальгетика, высвобожденного через 1 ч invitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, к количеству опиоидного анальгетика, высвободившегося через 1 ч in vitro растворения дозированной формы в 500 и/или 900 мл моделированной желудочной жидкости, не содержащей этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, составляет 2:1 или менее, либо менее чем примерно 2:1,5:1 или менее, либо менее чем 1,5:1 или 1:1 или менее, либо менее чем 1:1. Согласно некоторым вариантам нижний предел этого отношения равен 0,5:1 или 1:1.-1 015615 Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую опиоидный анальгетик и контролирующий высвобождение материал, при этом отношение количества опиоидного анальгетика, высвобожденного через 1 ч in vitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 30% этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, к количеству опиоидного анальгетика, высвободившегося через 1 ч in vitro растворения дозированной формы в 500 мл и/или 900 мл моделированной желудочной жидкости, не содержащей этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, составляет 4:1 или менее, либо менее чем 4:1, 3:1 или менее,либо менее чем примерно 3:1 или 2:1 или менее, либо менее чем примерно 2:1. По некоторым вариантам нижний предел этого отношения равен 0,5:1, или 1:1, или 1,7:1. Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую опиоидный анальгетик и контролирующий высвобождение материал, при этом отношение количества опиоидного анальгетика, высвобожденного через 1 ч in vitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 40% этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, к количеству опиоидного анальгетика, высвободившегося через 1 ч in vitro растворения дозированной формы в 500 и/или 900 мл моделированной желудочной жидкости, не содержащей этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, составляет 5:1 или менее, либо менее чем примерно 5:1, 4:1 или менее, либо менее чем примерно 4:1 или 3:1 или менее, либо менее чем примерно 3:1. По некоторым вариантам нижний предел этого отношения равен 0,5:1, или 1:1, или 2,6:1. Согласно некоторым вариантам данное изобретение направлено на лекарственную форму с контролируемым высвобождением, содержащую множество матриц, содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в материале с контролируемым высвобождением, при этом отношение количества гидроморфона или его фармацевтически приемлемой соли, высвободившихся через 1 ч in vitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, к количеству гидроморфона или его фармацевтически приемлемой соли, высвободившихся через 1 ч in vitro растворения дозированной формы в 500 и/или 900 мл моделированной желудочной жидкости, не содержащей этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, составляет менее 2:1. Более подробно, данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую множество полученных экструзией матриц, содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в алкилцеллюлозе. Данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую множество полученных экструзией матриц, содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в алкилцеллюлозе, при этом алкилцеллюлоза составляет по меньшей мере 50% вес./вес. от веса матриц. Данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую множество полученных экструзией матриц,содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в алкилцеллюлозе. Данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую множество полученных экструзией матриц,содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в алкилцеллюлозе, возможно в связующем и возможном пластификаторе. Данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую множество полученных экструзией матриц, содержащих терапевтически эффективное количество гидроморфона или его фармацевтически приемлемой соли, диспергированных в алкилцеллюлозе,при этом матрицы не содержат акрилового полимера. Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую фармацевтически приемлемую соль опиоидного анальгетика в материале с контролируемым высвобождением; при этом менее 25% соли опиоида высвобождается через 1 ч с момента начала in vitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus I (корзина) при перемешивании со скоростью 100 об/мин при температуре 37 С. Согласно некоторым вариантам более конкретно данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую множество матриц, содержащих фармацевтически приемлемую соль опиоидного анальгетика в материале с контролируемым высвобождением. Согласно некоторым таким вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую матрицу, содержащую фармацевтически приемлемую соль опиоидного анальгетика в фармацевтически приемлемом эксципиенте, и слой, содержащий материал, контролирующий высвобождение, расположенный, например, около матрицы. По некоторым таким вариантам данное изобретение предусматривает лекарственную форму с контролируемым высво-2 015615 бождением, содержащую множество матриц, содержащих фармацевтически приемлемую соль опиоидного анальгетика в фармацевтически приемлемом эксципиенте, и слой, содержащий материал, контролирующий высвобождение, расположенный около каждой из матриц. Согласно некоторым вариантам данное изобретение предусматривает применение водопроницаемого в небольшой степени термопластичного полимера для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к спиртовой экстракции опиоида, при этом указанный состав, содержащий термопластичный полимер с незначительной водопроницаемостью или гидрофобный полимер в качестве материала, контролирующего высвобождение, высвобождает меньшее количество опиоида при проведении экстракции спиртом по сравнению с тем же составом, в котором термопластичный полимер с незначительной водопроницаемостью или гидрофобный материал полностью или частично заменены другими матричными материалами. Согласно некоторым вариантам данное изобретение предусматривает применение водопроницаемого в небольшой степени термопластичного полимера для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к спиртовой экстракции опиоида, при этом этот состав через 15 мин встряхивания в 40%-ном этаноле при комнатной температуре в StuartScientific Flask Shaker Model SF1 при 500-600 колебаний/мин высвобождает менее 35% опиоида. Согласно некоторым таким вариантам указанный состав высвобождает менее 30%, более предпочтительно менее 25% соли опиоида или от 15 до 25% соли опиоида. Согласно некоторым вариантам данное изобретение предусматривает применение гидрофобного полимера в качестве материала матрицы с контролируемым высвобождением для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к экстракции спиртом, при этом менее 25% опиоида высвобождается через 1 ч с момента начала in vitro растворения лекарственной формы, содержащей указанный состав, в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus 1 (корзина), работающем при 100 об/мин при температуре 37 С. Согласно некоторым вариантам данное изобретение предусматривает применение гидрофобного полимера в качестве материала матрицы с контролируемым высвобождением для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к экстракции спиртом, при этом отношение количества опиоида, высвободившегося через 1 ч с момента начала in vitro растворения лекарственной формы, содержащей указанный состав, в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus 1 (корзина), работающем при 100 об/мин при температуре 37 С, к количеству опиоида, высвободившегося через 1 ч in vitro растворения лекарственной формы, содержащей указанный состав, в 900 и/или 500 мл моделированной желудочной жидкости, не содержащей этанола, в приборе USP Apparatus 1 (корзина) при 100 об/мин при температуре 37 С,составляет менее примерно 2:1. По некоторым вариантам данное изобретение предусматривает способ лечения боли, включающий введение пациенту, нуждающемуся в этом, дозированной формы, описанной в данном изобретении. По некоторым вариантам данное изобретение предусматривает способ удержания от злоупотребления опиоидным агонистом, включающий получение дозированной формы, описанной в данном изобретении. Составы, описанные здесь, предназначены для высвобождения лекарства в течение продолжительного периода времени с целью достижения терапевтического эффекта. По некоторым вариантам составы с контролируемым высвобождением обеспечивают терапевтический эффект в течение по меньшей мере 12 или 24 ч. Термин "контролируемое высвобождение", применяемый в отношении опиоидного агониста, в смысле данного изобретения обозначает высвобождение опиоида из состава со скоростью, которая обеспечивает большую длительность действия, чем единичная доза обычного (т.е. с немедленным высвобождением) состава. Например, пероральный состав с немедленным высвобождением может высвобождать лекарство в течение 1 ч, а пероральный состав с контролируемым высвобождением может высвобождать лекарство в течение 4-24 ч. Для целей данного изобретения термин "опиоидный анальгетик" взаимозаменяем с термином"опиоид" и включает один агонист или комбинацию более чем одного опиоидного агониста, а также включает применение смешанных агониста-антагониста; частичный агонист и комбинации опиоидного агониста и опиоидного антагониста, при этом комбинацию обеспечивает болеутоляющее действие; их стереоизомеры, их простые или сложные эфиры или смесь любых вышеперечисленных соединений. По некоторым вариантам изобретения термин "опиоидный агонист" и термин "опиоидный анальгетик" являются взаимозаменяемыми и включают один агонист или комбинацию более чем одного опиоидного агониста, а также включают применение смешанного агониста-антагониста, частичный агонист, его стереоизомеры, его простые и сложные эфиры или смесь любых указанных выше веществ.-3 015615 Данное изобретение охватывает применение любой фармацевтически приемлемой соли опиоида. Термин "соль опиоида" относится к фармацевтически приемлемой соли опиоида. Любой вариант изобретения, относящийся к опиоиду, относится также и к соли опиоида. Фармацевтически приемлемые соли включают, но без ограничения, соли металлов, такие как соль натрия, калиевая соль, цезиевая соль и т.п.; щелочно-земельных металлов, такие как кальциевая соль, магниевая соль и т.п.; соли органических аминов, такие как соль триэтиламина, соль пиридина,соль пиколина, соль этаноламина, соль триэтаноламина, соль дициклогексиламина, сольN,N'-дибензилэтилендиамина и т.п.; соли неорганических кислот, такие как гидрохлорид, гидробромид,сульфат, фосфат и т.п.; соли органических кислот, такие как формиат, ацетат, трифторацетат, малеат,тартрат и т.п.; сульфонаты, такие как метансульфонат, бензосульфонат, п-толуолсульфонат и т.п.; соли аминокислот, такие как аргинат, аспаргинат, глутамат и т.п. Опиоиды, применяемые по данному изобретению, могут содержать один или более асимметричных центров и могут образовывать энантиомеры, диастереомеры или другие стереоизомерные формы. Данное изобретение охватывает также применение всех таких возможных форм, а также их рацемических и разрешенных форм и смесей. Когда соединения содержат олефиновые двойные связи или другие центры геометрической асимметрии, они включают Е- и Z-геометрические изомеры. Данное изобретение охватывает также все таутомерные формы. Согласно некоторым вариантам матрица или множество матриц лекарственной формы, описанной в данном изобретении, состоят, по существу, из опиоидного анальгетика, диспергированного в алкилцеллюлозе; возможно, связующего и возможного пластификатора. По некоторым вариантам лекарственная форма, описанная в данном изобретении, не содержит акрилового полимера. Согласно некоторым из вариантов матрица или множество матриц лекарственной формы не содержат акрилового полимера. Используемый здесь термин "стереоизомеры" является общим для всех изомеров индивидуальных соединений, которые отличаются только ориентацией их атомов в пространстве. Он включает энантиомеры и изомеры соединений более чем с одним хиральным центром, которые не являются зеркальным отображением друг друга (диастереомеры). Термин "хиральный центр" относится к атому углерода, к которому присоединены четыре разные группы. Термин "энантиомер" или "энантиомеры" относится к соединению, которое не накладывается на свое зеркальное отражение и является оптически активным, при этом энантиомер вращает плоскость поляризованного света в одном направлении, а его зеркальное отражение вращает плоскость поляризованного света в противоположном направлении. Термин "рацемическая" относится к смеси равных частей энантиомеров, которая не обладает оптической активностью. Термин "разрешение" относится к разделению и концентрации или исчерпанию одной из двух энантиомерных форм молекулы. Термин "слой" означает материал, расположенный около субстрата (который может включать сам слой или один или несколько возможных промежуточных слоев, таких как, например, слой герметика),который может быть нанесен, например, в виде покрытия. Получение слоев субстратов можно осуществить известными способами, включая распыление, окунание или наслаивание. Термин "расположенный около" означает, что слой материала, расположенный около частицы, покрывает по меньшей мере часть частицы с промежуточным слоем или слоями между веществом и частицей или без них. По некоторым из вариантов материал покрывает в среднем по меньшей мере 50% площади поверхности частицы. Согласно другим вариантам этот материал полностью покрывает частицу. Термин "устойчивость к экстракции спиртом" в самом широком смысле относится к способности состава высвобождать меньше опиоида при действии на него раствора, содержащего этанол, чем сравнительный состав, с учетом того, что термин "устойчивость к экстракции спиртом" может быть альтернативно и дополнительно определен для конкретных вариантов изобретения. В смысле данного изобретения устойчивость к экстракции спиртом может быть определена различными методами, которые включают действие на состав раствора, содержащего этанол, как описано в данном изобретении. Термин "матричный состав с контролируемым высвобождением" относится к композиции, включающей материалы с контролируемым высвобождением и опиоид. Если не оговорено иное, этот термин относится к указанному составу в его целости. Термин "лекарственная форма с контролируемым высвобождением" относится к форме, включающей опиоид с контролируемым высвобождением, например в виде "матричного состава с контролируемым высвобождением" или в виде любой другой формы с контролируемым высвобождением. Если иное не оговорено, термин "лекарственная форма с контролируемым высвобождением" относится к указанной лекарственной форме в ее целости. Лекарственная форма может быть, например, в виде таблетки, содержащей сжатый матричный состав с контролируемым высвобождением, или в виде капсулы, содержащей матричный состав с контролируемым высвобождением в виде множества частиц.-4 015615 Устойчивость к экстракции спиртом может быть, например, определена при действии на состав моделированной желудочной жидкости (SGF) с 20% этанола. Обычно "900 мл моделированной желудочной жидкости (SGF), содержащей 20% этанола", получают смешением 800 мл SGF с 210 мл 95%-ного этанола/воды (что обеспечивает 200 мл этанола), затем отбирают 900 мл смеси. Влияние 10 мл воды в 95%ном этаноле будет минимальным в смеси SGF и этанола в 900 мл смеси. Устойчивость к экстракции этанолом может быть также определена с применением водного раствора, содержащего 40% этанола. Краткое описание чертежей Фиг. 1 отражает результаты in vitro растворения композиций А-F по примеру 5. На фиг. 2, 3 показаны результаты растворения по примеру 9. На фиг. 4 представлены результаты опыта по раздавливанию композиций по примеру 14 с применением Pill Crusher или Spoons. На фиг. 5 приведены результаты раздавливания по примеру 14 с применением Mortar and Pestle. Фиг. 6 отражает результаты испытания экстракции спиртом по примеру 14. Фиг. 7 представляет результаты испытания экстракции спиртом по примерам 15-21, описанные в примере 25. Фиг. 8 отражает профили растворения композиций в моделированной желудочной жидкости с 40% спирта по примерам 15-21, описанные в примере 25. На фиг. 9 представлены профили растворения в моделированной желудочной жидкости по примерам 15-20, описанные в примере 25. На фиг. 10 показаны профили растворения в моделированной желудочной жидкости с 40% спирта по примерам 22-24, описанные в примере 25. На фиг. 11 представлены профили растворения в моделированной желудочной жидкости по примерам 22-24, описанные в примере 25. Подробное описание Наркоманы иногда пытаются достичь состояния эйфории, манипулируя с лекарственными препаратами для ускорения начала его действия. Наиболее простой способ сделать это заключается в раздавливании лекарственной формы с получением мелкодисперсного порошка с целью достижения доступности активного ингредиента. Наркоманы жуют и/или проглатывают препарат, а наркоманы, использующие введение через нос, вдыхают раздавленный состав. При парентеральном или внутривенном применении раздавленное вещество иногда растворяют в воде при нагревании, отфильтровывают в шприц и осуществляют инъекцию. Помимо упомянутых методов "непосредственного манипулирования", более решительные наркоманы могут применять различные виды "химии на кухне", пытаясь полностью выделить активный ингредиент из матрацы состава. Один из методов включает одностадийную экстракцию в доступной среде,такой как вода или этанол или их смеси. Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую матрицу, содержащую фармацевтически приемлемую соль опиоидного анальгетика в материале с контролируемым высвобождением; при этом менее 25 или менее 20% соли опиоида высвобождает через 1 ч с начала in vitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus 1 (корзина) при 100 об/мин при температуре 37 С. Согласно некоторым таким вариантам при этих условиях растворения высвобождается по меньшей мере 5 или 10% опиоидного анальгетика. Более подробно, согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую множество матриц, содержащих фармацевтически приемлемую соль опиоидного анальгетика в материале с контролируемым высвобождением. По некоторым из таких вариантов данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, включающую матрицу, содержащую фармацевтически приемлемую соль опиоидного анальгетика в фармацевтически приемлемом эксципиенте, и слой, содержащий материал с контролируемым высвобождением, расположенный около матрицы. По некоторым из таких вариантов данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую множество матриц, содержащих фармацевтически приемлемую соль опиоидного анальгетика в фармацевтически приемлемом эксципиенте, и слой, содержащий материал с контролируемым высвобождением, расположенный около каждой из матриц. По некоторым из таких вариантов лекарственная форма с контролируемым высвобождением включает матричный состав с контролируемым высвобождением, который не содержит более 15 вес.%, предпочтительно который не содержит более 20 вес.% С 12-C36-алифатического спирта, выбранного из группы,состоящей из стеарилового спирта, цетилового спирта и цетостеарилового спирта. Согласно некоторым вариантам данное изобретение предусматривает лекарственную форму с контролируемым высвобождением, содержащую опиоидный анальгетик и материал, контролирующий высвобождение; при этом отношение количества опиоидного анальгетика, высвобожденного через 1 ч invitro растворения лекарственной формы в 500 и/или 900 мл моделированной желудочной жидкости с-5 015615 20% этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С к количеству опиоидного анальгетика, высвободившегося через 1 ч in vitro растворения дозированной формы в 500 и/или 900 мл моделированной желудочной жидкости, не содержащей этанола в приборе USP (корзина) при скорости 100 об/мин при температуре 37 С, составляет 2:1 или менее, либо менее чем примерно 2:1,5:1 или менее, либо менее чем 1,5:1 или 1:1 или менее, либо менее чем 1:1. Согласно некоторым вариантам нижний предел этого отношения равен 0,5:1 или 1:1. По некоторым таким вариантам лекарственная форма с контролируемым высвобождением содержит матричный состав с контролируемым высвобождением, который не содержит более 15 вес.%, предпочтительно который не содержит более 20 вес.% С 12-C36-алифатического спирта, выбранного из группы,состоящей из стеарилового спирта, цетилового спирта и цетостеарилового спирта. Согласно некоторым вариантам данное изобретение предусматривает применение водопроницаемого в небольшой степени термопластичного полимера для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к спиртовой экстракции опиоида, при этом этот состав через 15 мин встряхивания в 40%-ном этаноле при комнатной температуре в Stuart Scientific Flask Shaker Model SF1 при 500-600 колебаний/мин высвобождает менее 35% опиоида. Согласно некоторым таким вариантам указанный состав высвобождает менее 30%, более предпочтительно менее 25% соли опиоида или от 15 до 25% соли опиоида. Согласно некоторым вариантам данное изобретение предусматривает применение гидрофобного полимера в качестве материала матрицы с контролируемым высвобождением для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к экстракции спиртом, при этом менее 25% опиоида высвобождается через 1 ч с момента начала in vitro растворения лекарственной формы, содержащей указанный состав, в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus 1 (корзина), работающем при 100 об/мин при температуре 37 С. Согласно некоторым вариантам данное изобретение предусматривает применение гидрофобного полимера в качестве материала матрицы с контролируемым высвобождением для изготовления матричного состава с контролируемым высвобождением опиоида для придания устойчивости к экстракции спиртом, при этом отношение количества опиоида, высвободившегося через 1 ч с момента начала in vitro растворения лекарственной формы, содержащей указанный состав, в 500 и/или 900 мл моделированной желудочной жидкости с 20% этанола в приборе USP Apparatus 1 (корзина), работающем при 100 об/мин при температуре 37 С, к количеству опиоида, высвободившегося через 1 ч in vitro растворения лекарственной формы, содержащей указанный состав, в 900 и/или 500 мл моделированной желудочной жидкости, не содержащей этанола, в приборе USP Apparatus 1 (корзина) при 100 об/мин при температуре 37 С,составляет менее примерно 2:1. По любому из вариантов, описанных в данном изобретении, лекарственная форма может включать матрицу, содержащую опиоидный анальгетик и материал, контролирующий высвобождение; множество матриц, содержащих опиоидный анальгетик и материал, контролирующий высвобождение; матрицу,содержащую опиоидный анальгетик и фармацевтически приемлемый эксципиент, и слой, включающий материал с контролированным высвобождением, расположенный около матрицы, или множество матриц, содержащих опиоидный анальгетик и материал, контролирующий высвобождение, и слой, включающий материал с контролированным высвобождением, расположенный около каждой из матриц. Этот перечень не является исчерпывающим. Согласно некоторым вариантам лекарственная форма может включать опиоидный анальгетик в осмотическом ядре с полупроницаемой мембраной, окружающей ядро. Лекарственная форма может иметь проток для осмотической доставки опиоидного анальгетика при ее применении. По некоторым из вариантов данного изобретения материал с контролируемым высвобождением содержит гидрофобный материал, предпочтительно алкилцеллюлозу и наиболее предпочтительно этилцеллюлозу. Согласно некоторым вариантам материал с контролируемым высвобождением содержит растворимый в незначительной степени в воде проницаемый термопластичный полимер, предпочтительно алкилцеллюлозу и наиболее предпочтительно этилцеллюлозу. По некоторым вариантам изобретения вышеуказанный гидрофобный материал или указанный растворимый незначительно в воде проницаемый термопластичный полимер применяют для придания устойчивости к экстракции спиртом. Варианты, описанные ниже, предусматривают более подробное описание применения указанного гидрофобного материала или растворимого незначительно в воде проницаемого термопластичного материала для придания устойчивости к экстракции спиртом. По некоторым вариантам этилцеллюлоза содержится в количестве, равном по меньшей мере 40 вес.%, по меньшей мере 45 вес.%, по меньшей мере 55 вес.% или по меньшей мере 60 вес.% в расчете на вес матрицы или матриц. По другим вариантам этилцеллюлоза содержится в количестве, равном максимально 70 вес.%, максимально 80 вес.% или максимально 90 вес.% в расчете на матрицу или матрицы.-6 015615 Согласно некоторым вариантам данное изобретение предусматривает применение алкилцеллюлозы,предпочтительно этилцеллюлозы, в количестве от 5 до 60 вес.% в расчете на матричный состав с контролируемым высвобождением, предпочтительно от 10 до 50 вес.%, наиболее предпочтительно от 20 до 45 вес.% в расчете на матричный состав с контролируемым высвобождением. По некоторым вариантам данное изобретение предусматривает применение этилцеллюлозы в сочетании по меньшей мере со вторым матричным материалом с контролируемым высвобождением, выбранным из полиметакрилата, предпочтительно нейтральным нерастворимым в воде сополиэтилакрилатметилметакрилатом. По некоторым вариантам при наличии алкилцеллюлозы материал с контролируемым высвобождением дополнительно содержит полиметакрилат в количестве по меньшей мере 5%, по меньшей мере 10%, по меньшей мере 15%, по меньшей мере 20% или по меньшей мере 25% от веса матрицы или матриц. По другим вариантам полиметакрилат содержится в количестве максимум 30% или максимум 35% от веса матрицы или матриц. По некоторым вариантам при наличии алкилцеллюлозы, предпочтительно этилцеллюлозы, матричный состав дополнительно содержит полиметакрилат, предпочтительно нейтральный не растворимый в воде сополимер этилакрилата с метилакрилатом в количестве от 5 до 66 вес.%, предпочтительно от 15 до 50 вес.%, более предпочтительно от 20 до 45 вес.% и наиболее предпочтительно от 25 до 45 вес.% в расчете на матричный состав с контролируемым высвобождением. Согласно одному аспекту фармацевтический состав с контролируемым высвобождением можно получить и получают экструзией из расплава, он может включать нейтральный сополимер этилакрилата с метакрилатом и активный ингредиент. Каучукоподобные свойства этого полимера обеспечивают мультичастицы, которые обычно являются эластичными, прессуются без разрушения и предпочтительно являются упругими. В одной предпочтительной форме мультичастицы можно сжать рукой между двумя жесткими поверхностями, например монеты и поверхности стола, или между двумя ложками без разрушения. Мультичастицы могут быть деформированы, но не разрушены и не расколоты и могут в большой или меньшей степени идеально восстановить свою первоначальную форму. Каучукоподобные свойства придают устойчивость к манипулированию. Эта устойчивость очень важна для продуктов, содержащих опиоидные анальгетики или другие активные ингредиенты, которыми злоупотребляют. Устойчивость к манипулированию предпочтительными мультичастицами по изобретению может быть продемонстрирована путем встряхивания дозированного количества мультичастиц в воде и/или этаноле, например в 40%-ном этаноле. При этом испытании предпочтительные мультичастицы будут характеризоваться по меньшей мере одним из следующих свойств, касающихся высвобождения активного агента: 15 мин встряхивания в воде при комнатной температуре: выделяется менее 15%, менее 10% активного агента, предпочтительно менее 7,5% активного агента, более предпочтительно менее 5% активного агента, например 1,5-4% активного агента; 5 мин встряхивания в воде при 50 С с последующим встряхиванием при этой же температуре в течение 15 мин высвобождается менее 20% активного агента, предпочтительно менее 15% активного агента, более предпочтительно менее 12% активного агента, например 4-12% активного агента; 5 мин выдержки при 75 С с последующим встряхиванием при той же температуре в течение 15 мин: высвобождается менее 25% активного агента, предпочтительно менее 20% активного агента,более предпочтительно менее 15% активного агента, например 10-15% активного агента; 5 мин выдержки при 100 С с последующим встряхиванием при той же температуре в течение 15 мин: высвобождается менее 30% активного агента, предпочтительно менее 25% активного агента,более предпочтительно менее 20% активного агента, например 12-20% активного агента; 15 мин встряхивания в 40%-ном этаноле при комнатной температуре: высвобождается менее 35% активного агента, предпочтительно менее 30% активного агента, более предпочтительно менее 25% активного агента, например 15-20% активного агента. Или же устойчивость к незаконному манипулированию для предпочтительных мультичастиц по изобретению можно продемонстрировать путем размалывания мультичастиц в ступке пестиком, вращающимся со скоростью 24 об, продукт при этом был помещен в 900 мл воды на 45 мин при температуре 37 С. Затем количество экстрагированного активного агента можно определить методом ЖХВР и методом при помощи УФ, например, при длине волны 210 нм. При осуществлении этого метода мультичастицы проявляют следующие свойства: выделяется менее 12,5% активного агента, предпочтительно менее 10% активного агента, более предпочтительно менее 7,5% активного агента, например 2-7,5% активного агента.-7 015615 Кроме того, устойчивость к манипулированию предпочтительными мультичастицами по изобретению можно показать путем раздавливания мультичастиц между двумя ложками или в дробилке, такой как Pill Pulverizer, продаваемой Apex Healthcare Products, с последующим экстрагированием 2 мл воды,нагретой до кипения в ложке и отфильтрованной. Количество экстрагированного активного агента можно определить методом ЖХВР или методом с применением УФ, например, при длине волны 210 нм. При осуществлении этого метода предпочтительные мультичастицы по изобретению будут иметь следующие характеристики высвобождается менее 27,5% активного агента, предпочтительно менее 15% активного агента, более предпочтительно менее 5% активного агента, например 1-5% активного агента. Для придания указанной выше устойчивости данное изобретение предусматривает применение нейтрального сополимера этилакрилата с метакрилатом при получении фармацевтического состава с такой устойчивостью. Нейтральный сополимер этилакрилата с метилакрилатом можно вводить в состав вместе с активным ингредиентом. По некоторым вариантам данного изобретения лекарственная форма содержит также связующее в количестве по меньшей мере 1 вес.%, по меньшей мере 3 вес.% или по меньшей мере 5 вес.% в расчете на вес матрицы или матриц. По другим вариантам количество связующего равно максимум 7 вес.% или максимум 10 вес.% от веса матрицы или матриц. По некоторым вариантам связующее представляет собой гидроксиалкилцеллюлозу, такую как гидроксипропилцеллюлозу или гидроксипропилметилцеллюлозу. Согласно некоторым вариантам данного изобретения лекарственная форма содержит также пластификатор в количестве по меньшей мере 3%, по меньшей мере 5%, по меньшей мере 15% или по меньшей мере 25% от веса матрицы или матриц. По одному из вариантов количество пластификатора составляет максимум 30 или максимум 40% от веса матрицы или матриц. По некоторым из вариантов пластификатор имеет температуру плавления, равную по меньшей мере 80 С. Это помогает свести к минимуму растворение лекарственной формы в горячей воде, когда делается попытка извлечь опиоидный анальгетик, содержащийся в лекарственной форме. По некоторым вариантам пластификатором является гидрированное касторовое масло. Экстракция горячей водой проводится следующим образом помещают одну стандартную дозу каждого лекарства в две отдельные сцинтилляционные пробирки и обозначают их номерами 1 и 2. Добавляют в каждую пробирку по 10 мл растворителя для экстракции. Если это оговорено, помещают пробирки в водяную баню при определенной температуре (50, 75 или 100 С) на 5 мин. Помещают обе пробирки в лабораторный шейкер, пробирку 1 вынимают через 15 мин, а пробирку 2 - через 120 мин. Образцы, находящиеся при комнатной температуре, сразу помещают в шейкер. По некоторым вариантам отношение количества опиоидного анальгетика (вес.%), высвободившегося при 50 С через 120 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе с контролируемым высвобождением к количеству (вес.%) опиоидного анальгетика, высвободившегося при комнатной температуре через 120 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе с контролируемым высвобождением составляет 1,2 или менее, предпочтительно 1 или менее или 0,9 или менее. По некоторым вариантам отношение количества опиоидного анальгетика, высвободившегося при 75 С через 15 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе или лекарственной форме к количеству опиоидного анальгетика (вес.%), высвободившегося при комнатной температуре через 15 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе или лекарственной форме составляет 1,2 или менее, предпочтительно 1 или менее либо 0,9 или менее. По некоторым вариантам отношение количества (вес.%) опиоидного анальгетика, высвободившегося при 100 С через 15 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе или лекарственной форме к количеству опиоидного анальгетика (вес.%), высвободившегося при комнатной температуре через 15 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе или лекарственной форме составляет 1,3 или менее, предпочтительно 1,2 или менее либо 0,9 или менее. По некоторым вариантам отношение количества (вес.%) опиоидного анальгетика, высвободившегося при 100 С через 120 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе с контролируемым высвобождением или в лекарственной форме к количеству опиоидного анальгетика(вес.%), высвободившегося при комнатной температуре через 15 мин встряхивания, в расчете на общее количество опиоида в испытуемом составе или лекарственной форме составляет менее 2, предпочтительно 1,5 или менее, либо 1 или менее, либо 0,9 или менее. Согласно некоторым вариантам количество алкилцеллюлозы, предпочтительно этилцеллюлозы,меньше 20 вес.%, предпочтительно меньше 15 вес.%, наиболее предпочтительно меньше 10 вес.%, но больше 5 вес.% в расчете на вес матричного состава с контролируемым высвобождением. Более подробно, согласно некоторым таким вариантам алкилцеллюлоза, особенно этилцеллюлоза,предпочтительно применяется в виде частиц или водных дисперсий алкилцеллюлозы.-8 015615 В случае применения частиц этилцеллюлозы вязкость этилцеллюлозы находится в пределах от 3 до 110 сП для 5%-ного раствора в растворителе, состоящем из 80% толуола и 20% спирта, при температуре 25 С в вискозиметре Уббелоде. Предпочтительно, чтобы вязкость была равна 18-110 сП, более предпочтительно 41-49 сП. Подходящую этилцеллюлозу поставляет Dow Chemical Company под названием Ethocel Standard 45. Другой маркой этилцеллюлозы является Ethocel Standard 7. В случае применения дисперсий этилцеллюлозы предпочтительной является дисперсия этилцеллюлозы с вязкостью 20 сП, содержащая дибутилсебацинат, гидроокись аммония, олеиновую кислоту и коллоидную безводную двуокись кремния, доступная под маркой Surlease E-7-7050. Согласно некоторым вариантам данное изобретение предусматривает применение этилцеллюлозы в сочетании по меньшей мере с одним пластификатором или вторым матричным материалом с контролируемым высвобождением, выбранным из С 12-С 36 алифатического спирта или алифатической кислоты, в количествепо меньшей мере 5%, более предпочтительно по меньшей мере 10 вес.%, еще более предпочтительно по меньшей мере 15 вес.% и наиболее предпочтительно 20-25 вес.% в расчете на матричный состав с контролируемым высвобождением. По некоторым таким вариантам изобретения лекарственная форма может включать, кроме алкил(этил) целлюлозы и/или алифатического спирта, наполнители и добавки, такие как средства для гранулирования, смазочные вещества, красители, добавки, улучшающие текучесть и пластификаторы. В качестве наполнителей можно применять лактозу, глюкозу или сахарозу, крахмалы и их гидролизаты, микрокристаллическую целлюлозу, целлюлозу, сахарные спирты, такие как сорбит или маннит,полирастворимые соли кальция, такие как кислый фосфат кальция, дикальций- или трикальцийфосфат. Смазочными веществами могут быть стеарат магния и/или стеарат кальция. Можно также применять жиры, такие как гидрированное касторовое масло. Согласно некоторым таким вариантам особенно предпочтителен состав, который содержит этилцеллюлозу, стеариловый спирт, стеарат магния в качестве смазки, лактозу в качестве наполнителя и повидон в качестве добавки, способствующей гранулированию. Согласно некоторым таким вариантам данного изобретения матричный состав с контролируемым высвобождением не содержит нейтрального не растворимого в воде сополимера этилакрилата и/или сополимера (мет)акрилата с триметиламмоний метилакрилатхлоридом. По некоторым вариантам данного изобретения гидрофобный материал является энтеросолюбильным полимером. Примеры подходящих энтеросолюбильных полимеров включают ацетатфталат целлюлозы, гидроксипропилметилцеллюлозы фталат, поливинилацетатфталат, сополимер метакриловой кислоты, шеллак, гидроксипропилметилцеллюлозы сукцинат, ацетат-тримеллитат целлюлозы и любые их смеси. Лекарственная форма по изобретению может быть изготовлена путем экструзии или гранулирования согласно, например, патентам США 5266331, 5958452 и 5965161. По некоторым вариантам с применением алкилцеллюлозы, например этилцеллюлозы, в сочетании с алифатическими спиртами или жирными кислотами, как описано выше (т.е. С 12-С 36 алифатическими спиртами и соответствующими жирными кислотами), особенно предпочтительно получать фармацевтические составы или осуществлять предварительные стадии процесса с использованием экструзии. Согласно одному предпочтительному варианту фармацевтические составы получают путем экструзии из расплава в двухшнековых экструдерах с противовращением или с одинаковым вращением. Другой предпочтительный способ предусматривает экструзию в экструдерах с одним или несколькими шнеками. Эти экструдеры могут также включать пластицирующие элементы. Экструзия является широко используемым в фармацевтике процессом и хорошо известна специалистам. Специалист знает, что во время экструзии для получения продуктов с нужными характеристиками можно менять различные параметры, такие как скорость загрузки, скорость шнека, температуру в различных зонах экструдера (если это возможно), содержание воды и т.д. Указанные выше параметры зависят от конкретного типа применяемого экструдера. Во время экструзии температура в зонах нагрева, где получается расплав, может составлять от 40 до 120 С или от 40 до 160 С, предпочтительно от 50 до 100C или от 50 до 135 С, более предпочтительно от 50 до 90 С, еще более предпочтительно от 50 до 70 С и наиболее предпочтительно от 50 до 65 С, особенно если применяют экструдеры с двумя шнеками с противовращением (такие как Leistritz Micro 18 GGL). Специалисту хорошо известно, что не каждая зона должна быть нагрета. Может быть необходимым охлаждение до примерно 25 С, особенно за питателем, где смешиваются компоненты. Скорость шнека может колебаться от 100 до 500 об/мин, предпочтительно от 100 до 250 об/мин, более предпочтительно от 100 до 200 об/мин и наиболее предпочтительно она равняется примерно 150 об/мин, особенно если используются двухшнековые экструдеры с противовращением (например, Leistritz Micro 18 GGL). Геометрия и диаметр литьевого отверстия могут быть выбраны согласно требованиям. Диаметр литьевого отверстия обычных экструдеров обычно составляет от 1 до 10 мм, предпочтительно от 2 до 8 мм и наиболее предпочтительно от 3 до 5 мм. Отношение длины к диаметру шнека в экструдерах, используемых для изготовления препаратов по изобретению, обычно равно примерно 40:1.-9 015615 Обычно величины температур в зонах нагрева должны быть выбраны таким образом, чтобы эти температуры не разрушали фармацевтически активные соединения. Скорость подачи и скорость шнека выбирают так, чтобы фармацевтически активные соединения высвобождались из препаратов, полученных экструзией, пролонгированно, независимо и постоянно. Если, например, увеличена скорость подачи,скорость вращения шнека должна быть соответственно повышена, чтобы обеспечить то же замедление. Специалисту известно, что все указанные выше параметры зависят от специфических условий производства (типа экструдера, геометрии шнека, числа компонентов и т.д.) и может быть необходимо адаптировать их для того, чтобы препараты, полученные экструзией, обеспечивали нужное высвобождение. Согласно некоторым вариантам С 12-С 36 алифатический спирт или жирная кислота плавятся, этилцеллюлоза может быть растворена в указанном С 12-С 36 алифатическом спирте или жирной кислоте в процессе экструзии из расплава. Опиоидные агонисты по изобретению включают, но без ограничения, фармацевтически приемлемые соли алфентанила, аллилпродина, альфапродина, анилеридина, бензилморфина, безитрамида, бупреморфина, буторфанола, клонитазена, кодеина, десоморфина, декстроморамида, дезоцина, диампромида, диаморфона, дигидрокодеина, дигидроморфина, дименоксадола, димефептанола диметилтиамбутена, диоксафетилбутирата, дипипанона, эптазоцина, этогептазина, этилметилтиамбутена, этилморфина,этонизатена, эторфина, дигидроэторфина, фентанила и его производных, гидрокодона, гидроморфона,гидроксипетидина, изометадона, кетобемидона, леворфанола, левофенацилморфана, лофентанила, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, нарцеина, никоморфина,норлеворфанола, норметадона, налорфина, налбуфена, норморфина, норпипанона, опия, оксикодона,оксиморфона, папаверетума, пентазоцина, фенадоксона, феноморфана, феназоцина, феноперидина, пиминодина, пиритрамида, профептазина, промедола, проперидина, пропоксифена, суфентанила, тилидина,трамадола, их фармацевтически приемлемые соли, гидраты и сольваты, смеси этих любых веществ и т.п. Согласно некоторым вариантам количество опиоидного агониста в лекарственной форме может составлять примерно от 75 до 750 мг. Опиоидный антагонист или его фармацевтически приемлемые соли, применяемые в сочетании с опиоидными агонистами или их фармацевтически приемлемыми солями, описанными выше, может быть налоксоном, налтрексоном и налорфином или их фармацевтически приемлемыми солями. Предпочтительна комбинация гидрохлорида оксикодона и гидрохлорида налоксона в отношении 2:1. По некоторым вариантам опиоид выбирают из кодеина, морфина, оксикодона, гидрокодона, гидроморфона или оксиморфона или их фармацевтически приемлемых солей. Согласно некоторым другим вариантам в комбинации с опиоидами или вместо них можно применять другие терапевтически активные агенты. Примеры таких агентов включают антигистамины (например, дименгидринат, дифенгидрамин, хлорфенирамин и дексхлорфенирамина малеат), нестероидные противовоспалительные средства (например, напроксен, диклофенак, индометацин, ибупрофен, сулиндак), противорвотные средства (например, метоклопрамид, метилналтрексон), противоэпилептические средства (например, фенитоин, мепробамат и нитразепам), сосудорасширяющие средства (например,нифедипин, папаверин, дилтиазем и никардипин), противокашлевые средства и отхаркивающие средства(например, тетрациклин), противогеморроидальные средства, гипнотические, психотропные средства,средства от диареи, муколитики, седативные средства, противоотечные средства, слабительные, витамины, стимулянты (включая средства, подавляющие аппетит, такие как фенилпропаноламин), а также их фармацевтически приемлемые соли, гидраты и сольваты. Данное изобретение также предусматривает лекарственные формы с применением таких активных агентов, как, например, бензодиазепины, барбитураты или амфетамины. Они могут сочетаться с соответствующими антагонистами. Термин "бензодиазепины" относится к бензодиазепинам и лекарствам, которые являются производными бензодиазепина, которые способны подавлять центральную нервную систему. Бензодиазепины включают, но без ограничения, альпразолам, бромазепам, хлордиазепоксид, хлоразепат, диазепам, эстазолам, флуразепам, галазепам, кетазолам, лоразепам, нитразепам, оксазепам, празепам, квазепам, темазепам, триазолам, метилфенидат, а также их фармацевтически приемлемые соли, гидраты, сольваты и смеси. Антагонисты бензодиазепинов включают, но без ограничения, флумазенил, а также его фармацевтически приемлемые соли, гидраты и сольваты. Бербитураты относятся к седативно-снотворным средствам, являющимся производными барбитуровой кислоты (2,4,6-триоксогексагидропиримидина). Барбитураты включают, но без ограничения, амобарбитал, апробарбитал, бутабарбитал, бутальбитал, метогекситал, мефобарбитал, метарбитал, пентобарбитал, фенобарбитал, секобарбитал, а также их фармацевтически приемлемые соли, гидраты, сольва- 10015615 ты и смеси. Антагонисты барбитуратов, которые можно применять по изобретению, включают, но без ограничения, амфетамины, а также их фармацевтически приемлемые соли, гидраты и сольваты. Стимулянты относятся к лекарствам, которые стимулируют центральную нервную систему. Стимулянты включают, но без ограничения, амфетамины, такие как амфетамин, комплекс декстроамфетамина со смолой, декстроамфетамин, метамфетамин, метилфенидат, а также их фармацевтически приемлемые соли, гидраты, сольваты и смеси. Антагонисты стимулянтов включают, но без ограничения, бензодиазепины, а также их фармацевтически приемлемые соли, гидраты, сольваты, описанные выше. По некоторым вариантам опиоид является гидроморфона гидрохлоридом в количестве, например,2, 4, 8, 12, 16, 24, 32, 48 или 64 мг. Согласно другим вариантам опиоид является оксикодона гидрохлоридом в количестве, например, 5,10, 15, 20, 30, 40, 45, 60 или 80, 90, 120 или 160 мг. По некоторым вариантам при применении алкилцеллюлозы, например этилцеллюлозы, в сочетании с алифатическим спиртом оксикодона гидрохлорид, взятый в указанных количествах, применяется в сочетании с налоксона гидрохлоридом в отношении 2:1. Данное изобретение далее будет более подробно описано в примерах. Следует иметь в виду, что эти примеры только иллюстрируют изобретение, но не ограничивают его. Примеры осуществления изобретения Пример 1 (сравнительный). В примере 1 использован одобренный препарат Palladone (гидроморфона гидрохлорид с пролонгированным высвобождением), содержащий следующие ингредиенты:(поли(мет)акрилат с 5% триметиламмонийметакрилат хлорида). Состав готовили следующим образом. 1. Измельчали стеариловый спирт. 2. В V-смесителе смешивали гидроморфона HCl, этилцеллюлозу, Eudragit RSPO и измельченный стеариловый спирт. 3. Экструдировали смесь из (1), применяя экструдер ZSE-218, снабженный шнеками с противовращением и плитой толщиной 1 мм. С применением гранулятора разрезали нити, получая цилиндрические гранулы длиной около 1 мм и диаметром 1 мм. Пример 2.1. Композиция имеет состав: Условия переработки при получении образцов указаны ниже. Экструдер: Leistritz ZSE-27. Конфигурация шнеков: противовращение. Условие 1. Крутящий момент (%): 25. Давление в расплаве (ф/дюйм 2): 480 (3309 кПа). Скорость загрузки (кг/ч): 2,9. Скорость вращения шнека (об/мин): 90. Диаметр отверстия в плите (мм): 1,0 (плита с 8 отверстиями). Условие 2. Крутящий момент (%): 25. Давление в расплаве (ф/дюйм 2): 520.- 11015615 Скорость загрузки (кг/ч): 4,2. Скорость вращения шнека (об/мин): 90. Диаметр отверстия в плите (мм): 1,0 (плита с 8 отверстиями). Стадии переработки при изготовлении экструзией из расплава мультичастиц весом 12 мг на основе гидроморфона гидрохлорида. 1. Просеивание: этилцеллюлозу, гидроморфона гидрохлорид, гидроксипропилцеллюлозу и пальмитостеарат глицерина просеивали через сито 20 US меш (в указанном порядке). 2. Смешение: вещества, просеянные на стадии 1, загружали в V-смеситель объемом 8 кварт с усилителем и смешивали в течение 10 мин при комнатной температуре. 3. Экструзия: вещества, смешанные на стадии 2, помещали в двухшнековый экструдер, снабженный головкой, и перерабатывали с получением нитей диаметром 1 мм. Экструдер был с противовращением,температуры в зонах менялись от 15 до 125 С. 4. Охлаждение: нити охлаждали на конвейере при комнатной температуре. 5. Гранулирование: охлажденные нити разрезали на гранулы длиной около 1 мм с помощью гранулятора. 6. Просеивание: гранулы просеивали через сито 16 US меш и сито 20 US меш. Гранулы, остающиеся на сите 20 US меш, собирали. Пример 2.2. В примере 2.2 сравнивается влияние различных концентраций этанола в моделированной желудочной жидкости (500 мл в примере 1; 900 мл в примере 2.1) в приборе USP Apparatus 1 (корзина) при скорости 100 об/мин и температуре 37 С на растворение состава Palladone и состава по примеру 2.1, содержащего ту же концентрацию гидроморфона (19% вес./вес.). Состав Palladone содержит аммоний метакрилатный сополимер в качестве основного эксципиента, контролирующего скорость высвобождения, в то время как состав по примеру 2,1 содержит этилцеллюлозу. Результаты показаны ниже. Эти данные показывают, что состав по примеру 2.1 более устойчив к увеличению высвобождения лекарства в присутствии этанола. Например, в случае состава Palladone этанол в количестве 20% в SGF привел к увеличению количества выделяющегося через 1 ч гидроморфона в 8 раз по сравнению с количеством, выделившимся в SGF. Та же концентрация этанола приводит к увеличению количества гидроморфона, высвобождающегося из состава по примеру 2.1, содержащего этилцеллюлозу в качестве полимера, ограничивающего скорость высвобождения примерно в 1,5 раза. Пример 3. Пример 3.1. Состав композиции по примеру 3.1 приведен ниже. Вес скорректирован с учетом воды и примесей - 99,5% на основе данных анализа.- 12015615 Условия получения образцов указаны ниже. Экструдер: Leistritz ZSE-27. Конфигурация шнеков: противовращение. Условие 1 (температура в цилиндре 100 С). Крутящий момент (%): 46. Давление в расплаве (ф/дюйм 2): 2000 (13789 кПа). Скорость загрузки (кг/ч): 2,9. Скорость вращения шнека (об/мин): 90. Диаметр отверстия в плите (мм): 1,0 (8 отверстий). Условие 2 (температура в цилиндре 125 С). Крутящий момент (%): 25. Давление в расплаве (ф/дюйм 2): 690. Скорость загрузки (кг/ч): 2,9. Скорость вращения шнека (об/мин): 90. Диаметр отверстия в плите (мм): 1,0 (8 отверстий). Стадии переработки при получении мультичастиц гидроморфона HCl (12 мг) экструзией из расплава. 7. Просеивание: этилцеллюлозу, гидроморфона HCl, гидроксипропилцеллюлозу и гидрированное касторовое масло пропускали через сито 20 US меш (в указанном порядке). 8. Смешение: вещества со стадии 7 загружали в V-смеситель объемом 8 кварт с интенсификатором и перемешивали в течение 10 мин при комнатной температуре. 9. Экструзия: после стадии 8 вещества загружали в двухшнековый экструдер, снабженный головкой, и перерабатывали с получением нитей диаметром 1 мм. Экструдер был с противовращением, температуры в зонах (цилиндре) менялись от 15 до 125 С. 10. Охлаждение: нити охлаждали на конвейере при комнатной температуре. 11. Гранулирование: охлажденные нити разрезали на гранулы длиной примерно 1 мм, применяя гранулятор. 12. Просеивание: гранулы просеивали через сито 16 US меш и 20 US меш. Гранулы, оставшиеся на сите 20 US меш, собирали. Испытание - экстракция в воде при комнатной температуре и при повышенной температуре. Методика. Пример 3.2. В примере 3.2 приведено сравнение данных по устойчивости к экстракции горячей водой. В две стеклянные пробирки с наклеенными этикетками 1 и 2 помещали по одной стандартной дозе каждого лекарственного продукта. Добавляли 10 мл растворителя для экстракции в каждую пробирку. Если это было нужно, помещали пробирки в водяную баню с определенной температурой (50, 75 и 100 С) на 5 мин. Помещали обе пробирки в лабораторный ручной шейкер и вынимали пробирку 1 через 15 мин, а пробирку 2 через 2 ч. Образцы, испытывавшиеся при комнатной температуре, сразу помещали в шейкер. Условия приведены ниже. Результаты экстракции представлены ниже. Пример 4. В примере 4 получают составы, содержащие этилцеллюлозу и полиметакрилат. Пример 4.1. В примере 4.1 готовили следующие составы. Состав может состоять из комбинации следующих ингредиентов: лекарства, этилцеллюлозы, полиметакрилата и гидроксипропилцеллюлозы. Пример состава приведен ниже. 200 г твердых веществ из водной дисперсии, содержащей 40% твердых веществ. Перечень материалов, которые могут быть использованы в этом составе, может включать другие агенты, контролирующие высвобождение, такие как сополимеры метакриловой кислоты (Eudragits), и другие связующие на основе целлюлозы, такие как метилцеллюлоза (Methocel) или гидроксиэтилцеллюлоза (Natrosol). Способ изготовления является стандартным фармацевтическим процессом, используют мокрое гранулирование, сушку, размалывание и прессование. Способ гранулирования позволяет получить обычный гранулят (т.е. он похож на свободно текущие гранулы); однако при прессовании гранулята гранулы сплавляются вместе, образуя твердую таблетку, с которой трудно производить незаконные манипуляции. Способ изготовления: а) смешивали в сухом виде этилцеллюлозу, API (или высушенную распылением лактозу для плацебо) и гидроксипропилцеллюлозу в смесителе с низким/высоким сдвигом; б) во время смешения добавляли полиметакрилат (водную дисперсию) и продолжали смешение в смесителе с низким/высоким сдвигом до образования гранулята; в) высушивали мокрый гранулят в сушилке с псевдоожиженным слоем (или помещают его на полке в печи и сушат); г) в зависимости от того, что требуется, высушенный гранулят можно прессовать, применяя пресс для получения таблеток,просеять для получения фракции с определенным размером частиц для прессования или дальнейшего смешения (например, со смазочным агентом, дополнительным связующим),измельчить для уменьшения размера частиц (профиля с более однородным размером частиц), которые могут затем подвергаться прессованию, смешению с другими ингредиентами (например, со смазочным агентом, дополнительным связующим) или просеиванию для получения фракций с частицами опре- 14015615 деленного размера для прессования или дальнейшего смешения. Измельчение можно проводить в сортирующей мельнице (такой как мельница с вращающимся импеллером или с качающимся бруском); д) прессовали таблетки во вращающемся прессе с получением таблеток нужного веса. Следующие примеры 4.2-4.8 с применением этилцеллюлозы и полиметакрилата приведены ниже. Пример 4.2. Состав композиции по примеру 4.2 приведен ниже. 450 г твердых веществ из водной дисперсии, содержащей 40% твердых веществ. Способ получения таблеток гидроморфона HCl проводили следующим образом: е) смешивали в сухом виде этилцеллюлозу, гидроморфон HCl, микрокристаллическую целлюлозу и гидроксипропилцеллюлозу в смесителе с низким/высоким сдвигом; ж) во время смешения добавляли полиметакрилат (водную дисперсию) и продолжали смешение в смесителе с низким/высоким сдвигом до образования гранулята; з) высушивали мокрый гранулят в сушилке с псевдоожиженным слоем (или на полках в печи); и) измельчали высушенный гранулят в сортирующей мельнице (с вращающимся импеллером или с качающимся бруском); к) прессовали измельченный гранулят во вращающемся прессе с получением таблеток нужного веса. Таблетки имели вес 120 мг с дозой, равной 12 мг. Состав полученной таблетки указан ниже. Таблетки испытывали in vitro, используя прибор USP Apparatus 2 (лопастной) с моделированной желудочной жидкостью, с моделированной кишечной жидкостью, с 11% этанолом и 35% этанолом. Результаты испытаний приведены ниже.- 15015615 Примеры 4.3-4.5. Составы по примерам 4.3-4.5 приведены ниже. Количество твердых частиц из водной дисперсии, содержащей 40% твердых веществ. Таблетки гидроморфона HCl получали следующим образом: а) смешивали в сухом виде этилцеллюлозу, гидроморфон HCl и гидроксипропилцеллюлозу в смесителе с низким/высоким сдвигом; б) во время смешения добавляли полиметакрилат (водную дисперсию и продолжали смешение в смесителе с низким/высоким сдвигом до получения гранулята); в) высушивали мокрый гранулят в сушилке с псевдоожиженным слоем (или на полках в печи); г) измельчали высушенный гранулят в сортирующей мельнице (с вращающимся импеллером или с качающимся бруском); д) прессовали измельченный гранулят в прессе; е) отверждали таблетки в печи. Таблетки весом 102 мг содержали дозу, равную 12 мг, как показано ниже. Таблетки испытывали in vitro, используя USP Apparatus 2 (лопастный), 50 об/мин, при температуре 37 С, в 900 мл моделированной желудочной жидкости для оценки высвобождения лекарства. Данные получали на УФ-спектрометре при длине волны 280 нм. Результаты приведены ниже.- 16015615 Составы по примерам 4.6-4.8 приведены ниже. Количество твердых веществ в водной дисперсии, содержащей 40% твердых веществ. Таблетки оксикодона HCl получали следующим образом: а) смешивали в сухом виде этилцеллюлозу, оксикодона HCl и гидроксипропилцеллюлозу в смесителе с низким/высоким сдвигом; б) во время смешения добавляли полиметакрилат (водную дисперсию) и продолжали смешение в смесителе с низким/высоким сдвигом до образования гранулята; в) высушивали мокрый гранулят в сушилке с псевдоожиженным слоем (или на полках в печи); г) измельчали высушенный гранулят в сортирующей мельнице (с вращающимся импеллером или с качающимся бруском); д) прессовали измельченный гранулят в прессе для получения таблеток. Таблетки весом 100 мг содержали дозу, равную 10 мг. Таблетки испытывали in vitro, используя прибор USP Apparatus 2 (лопастный), 50 об/мин, при температуре 37 С в 900 мл моделированной желудочной жидкости для оценки скорости высвобождения. Данные получали на УФ-спектрометре при длине волны 230 нм. Кроме того, состав по примеру 4.8 испытывали в смеси 40% этанола/SGF для оценки влияния этанола на высвобождение лекарства. Результаты приведены ниже. Условия переработки указаны ниже. Экструдер: Leistritz ZSE 27. Конфигурация шнеков: противовращение Условия. Скорость подачи (кг/ч): 4,2. Скорость вращения шнека (об/мин): 90. Диаметр отверстия в плите (мм): 1,0 (8 отверстий). Получение мультичастиц весом 12 мг на основе гидроморфона HCl экструзией из расплава проводили следующим образом. 1. Просеивание: этилцеллюлозу, гидроморфона HCl и гидроксипропилцеллюлозу просеивали через сито 20 US меш. 2. Смешение: просеянные на стадии 1 вещества помещали в V-смеситель объемом 8 кварт с усилителем и перемешивали 10 мин при комнатной температуре до 135 С. 3. Экструзия: вещества, смешанные на стадии 2, помещали в двухшнековый экструдер, снабженный головкой, и перерабатывали в нити диаметром примерно 1 мм. Экструдер содержал шнеки с противовращением, температуры зон (в цилиндре) менялись от 15 до 135 С. 4. Охлаждение: нити охлаждали на конвейере при комнатной температуре. 5. Гранулирование: охлажденные нити разрезали, получая гранулы длиной примерно 1 мм, используя гранулятор. 6. Просеивание: гранулы просеивали через сито 16 US меш и через сито 20 US меш. Гранулы,оставшиеся на сите 20 US меш, собирали. Составы А, С и F испытывали in vitro, используя прибор USP Apparatus 1 (корзина), 100 об/мин, при температуре 37 С, в смеси этанола с различной концентрацией и 500 мл моделированной желудочной жидкости для определения влияния этанола на высвобождение лекарства. Результаты представлены ниже. Результаты, приведенные выше, показывают, что высвобождение гидроморфона из составов А, С иF оставалось неизменным при концентрациях этанола до (включая) 20% об./об. Это гораздо лучше, чем у состава (Palladone) по примеру 1, который характеризуется в 8 раз большим высвобождением гидроморфона в этих условиях. При концентрации этанола, равной 30 и 40%, количество высвободившегося из- 18015615 составов А, С и F лекарства увеличивалось, но это увеличение было ниже, чем при действии SGF на состав по примеру 1 (Palladone). Пример 6. Лекарственная форма на основе оксикодона/налоксона, содержащая 10 мг оксикодона гидрохлорида и 5 мг налоксона гидрохлорида. Рассчитано на основе ожидаемого содержания влаги. Количественный состав см. ниже. Пример 7. Лекарственная форма, содержащая 20 мг оксикодона гидрохлорида и 10 мг налоксона гидрохлорида. Рассчитано на основе ожидаемого содержания влаги. Количественный состав см. ниже.- 19015615 Пример 8. Лекарственная форма на основе оксикодона/налоксона, содержащая 40 мг оксикодона гидрохлорида и 20 мг налоксона гидрохлорида. Рассчитано на основе ожидаемого содержания влаги. Количественный состав см. ниже. Количественный состав пленки покрытия. Вышеописанные лекарственные формы получали экструзией из расплава. Оксикодона гидрохлорид и налоксона гидрохлорид смешивали с повидоном, стеариловым спиртом,этилцеллюлозой и лактозой, смесь помещали на сито для удаления агломератов, потом снова перемешивали. Смесь экструдировали из расплава, используя нагретый двухшнековый экструдер, с получением нитей, которые разрезали на гранулы. Гранулы смешивали с тальком и стеаратом магния, прессовали получая таблетки капсулообразной формы, на которые затем наносили пленочное покрытие. Пример 9. Определение растворимости. Прибор для определения растворимости в соответствии с USP basket/100 об/мин/900 мл среды для растворения, собирали, как описано в USP 23. Конкретные среды помещали в каждый сосуд при температуре бани, равной 37,0+0,5 С. Все этанольные среды готовили, помещая соответствующее количество этанола в моделированную согласно USP желудочную жидкость (SGF) без пепсина (т.е. 9 мл этанола и 891 мл SGF для среды, содержащей 1% этанола). По одной таблетке помещали в каждый сосуд. Образец вынимали из каждого сосуда четыре раза: через 10, 30, 60 и 120 мин. Использовали ЖХВР, образцы и (соответствующие) эталоны вводили в колонку для определения растворившихся количеств оксикодона HCl и налоксона HCl. Применяли 12 разных концентраций этанола: 0, 2, 4, 8, 12, 16, 20, 24, 28, 32, 36 и 40%. Результаты по определению растворимости состава по примеру 6. Результаты определения растворимости состава по примеру 7.- 21015615 Результаты определения растворимости состава по примеру 8. Результаты определения растворимости составов по примерам 6-8 показаны на фиг. 2 и 3. Фиг. 2 отражает результаты определения растворимости (%) оксикодона через 2 ч для состава по примеру 6(ОХ/N 10/5 PR), по примеру 7 (ОХ/N 20/10 PR) и по примеру 9 (ОХ/N 20/40 PR). На фиг. 3 отражены результаты определения растворимости (%) налоксона через 2 ч. При концентрации этанола между 0 и 20% количество высвободившегося активного вещества даже уменьшается, при концентрации этанола между 20 и 40% высвобождение является стабильным. Это отмечено для оксикодона гидрохлорида и налоксона гидрохлорида в случае всех трех лекарственных форм по примерам 6-8. Примеры 10-13. Составы композиций по примерам 10-13 приведены ниже.D = вес дисперсии.Eudragit RS PO: поли(мет)акрила с 5% триметиламмонийметакрилатхлорида.Eudragit RL PO: поли(мет)акрилат с 10% триметиламмонийметакрилатхлорида.Eudragit NE 40: 40%-ная дисперсия (% вес./вес), вода удалена выпариванием нейтрального сополи(этилакрилат-метилметакрилата). Получение мультичастиц составов в виде гранул по примерам 10-13 осуществляли следующим образом. Стадия 1. Оксикодон смешивали в течение 5 мин с этилцеллюлозой и/или Eudragit RS PO/RL PO и стеариловым спиртом в смесителе Oral с высоким сдвигом.- 22015615 Стадия 2. Медленно добавляли дисперсию Eudragit NE 40D при помощи шлангового насоса к смеси, полученной на стадии 1 в смесителе Gral 10, предварительно нагретом до 29 С в примерах 12 и 13,поддерживая процесс смешения/измельчения. Стадия 3. Добавление Eudragit NE 40D продолжали до образования гранул - добавление EudragitNE 40D тогда завершалось. Стадия 4. Добавление Eudragit NE 40D периодически прекращали для того, чтобы очистить стенки смесителя. Стадия 5. После завершения добавления Eudragit NE 40D осуществляли экструдирование мокрых гранул в обычном экструдере и затем сушили в сушилке с псевдоожиженным слоем при температуре около 44 С. Стадия 6. Высушенные гранулы охлаждали до комнатной температуры и собирали. Стадия 7. Затем с контролируемой скоростью загружали гранулы в экструдер Leistritz Micro 18,снабженный головкой (1 мм), конвейером и гранулятором и содержащий зоны нагрева при следующем давлении расплава. Скорость подачи составляла 2,0-2,6 кг/ч, скорость вращения шнека была равна 100-141 об/мин. Экструдированные нити удаляли из головки на конвейере и разрезали на цилиндрические мультичастицы. Гипотетически можно рассмотреть другую процедуру резки. Экструдат выходит из отверстий головки экструдера Leistritz. Можно применять вращающийся нож с двумя лезвиями для разрезания экструдата, когда он выходит под давлением и все еще в расплавленном состоянии из отверстий головки. Лезвия перемещаются над поверхностью головки и вдоль отверстий. По мере их расширения и охлаждения разрезанные частицы экструдата образуют округлую поверхность. Гипотетически, хотя в описанных выше примерах применяли экструдер Leistritz Micro 18, может быть предпочтительно использовать более мощный экструдер, например Leistritz Micro 27, для переработки материалов, требующих большего крутящего момента для переработки. Пример 14. Мультичастицы, полученные в примерах 10-13, испытывали для определения устойчивости к возможному незаконному манипулированию. 1) 400 мг мультичастиц, полученных в примерах 10-13, раздавливали между двумя ложками или в дробилке, такой как Pull Pulverizer, продаваемый Apex Healthcare Products, и затем обрабатывали 2 мл воды, нагретой в ложке до кипения, и отфильтровывали. Количества экстрагированного оксикодона определяли методом ЖХВР и УФ-детектирования при длине волны 210 нм, эти величины показаны на графике на фиг. 4 и ниже. Среднее значение дважды измеренных величин. 2) 400 мг мультичастиц, полученных в примерах 10-13, размалывали в ступке пестиком, вращающимся со скоростью 24 об, затем вещество помещали на 45 мин в 900 мл воды. Количество растворенного оксикодона определяли, как описано выше в 1), результаты приведены на фиг. 5 и ниже. Среднее значение дважды измеренных величин. 3) В каждой из серии экстракций а)-д) 400 мг мультичастиц, полученных по одному из примеров 10-13, обрабатывали следующим образом: мультичастицы помещали в растворитель, указанный ниже, в стеклянной колбе, которую затем нагревали (если нагревание указано) на водяной бане. Затем колбу встряхивали в течение указанного времени в шейкере Stuart Scientific Flask Shaker Model SF1(500-600 колебаний/мин). После экстракции количество растворенного оксикодона определяли методом,указанным в 1). а) Встряхивание в течение 15 мин в 10 мл воды при комнатной температуре. б) Нагревание в течение 5 мин в 10 мл воды при температуре 50 С с последующим встряхиванием в течение 15 мин. в) Нагревание в течение 5 мин в 10 мл воды при температуре 75 С с последующим встряхиванием в течение 15 мин. г) Нагревание в течение 5 мин в 10 мл воды при температуре 100 С с последующим встряхиванием в течение 15 мин. д) Встряхивание в течение 15 мин в 10 мл 40%-ного этанола при комнатной температуре. Результаты показаны на фиг. 6 и ниже. Примеры 15-24. Составы по примерам 15-24 приведены в табл. 1. Пример 25. Экстракция спиртом и профили растворения. 400 мг мультичастиц по одному из примеров 15-21 помещали в 10 мл 40%-ного этанола при комнатной температуре и встряхивали в течение 15 мин с применением Stuart Scientific Flask Shaker ModelSF1 (500-600 колебаний/мин). После завершения экстракции определяли количество растворенного оксикодона методом ЖХВР с УФ при длине волны, равной 206 нм. Результаты экстракции приведены в табл. 2 и на фиг. 7, Профили растворения определяли на приборе Ph. Eur. Basket Apparatus, 100 об/мин,37 С, в 900 мл SGF, возможно с 40% этанолом с применением ЖХВР с УФ при длине волны 206 нм. Результаты определения растворимости по примерам 15-21 в SGF с 40% этанолом приведены в табл. 3 и на фиг. 8. Профили растворения по примерам 15-21 в SGF приведены в табл. 4, а по примерам 15-20, также на фиг. 9. Результаты определения растворимости в SGF с 40% этанолом и в SGF по примерам 22-24 показаны в табл. 5 и 6 и на фиг. 10 и 11 соответственно. Таблица 1- 24015615 Таблица 2 Результаты экстракции по примерам 15-21(40%-ный этанол при комнатной температуре и встряхивании в течение 15 мин) Среднее значение дважды измеренных величин. Таблица 3 Результаты определения растворимости в SGF с 40%ным этанолом по примерам 15-21 Среднее значение дважды измеренных величин по примерам 15-21.- 25015615 Таблица 4 Результаты определения растворимости в SGF по примерам 15-21 Таблица 5 Результаты определения растворимости в SGF с 40%-ным этанолом по примерам 22-24 Среднее значение дважды измеренных величин по примерам 22-24.- 26015615 Таблица 6 Результаты определения растворимости в SGF по примерам 22-24 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Состав с контролируемым высвобождением, устойчивый к экстракции спиртом, содержащий первый матричный материал, содержащий этилцеллюлозу в количестве от 5 до 60 вес.% матричного состава, второй матричный материал, выбранный из полимера метакрилата в количестве от 5 до 66 вес.% матричного состава, и соль опиоида. 2. Состав по п.1, отличающийся тем, что соль опиоида выбрана из опиоидных агонистов, опиоидных антагонистов в сочетании с опиоидными агонистами, которые обеспечивают обезболивающий эффект, и смешанных опиоидных агонистов/антагонистов, частичных опиоидных агонистов или их смесей в виде их фармацевтически приемлемых солей. 3. Состав по п.2, отличающийся тем, что соль опиоида выбрана из альфентанила, аллилпродина,альфапродина, анилеридина, бензилморфина, безитрамида, бупренорфина, буторфанола, клонитазена,кодеина, дезоморфина, декстроморамида, дезоцина, диампромида, диаморфона, дигидрокодеина, дигидроморфина, дименоксадола, димефептанола, диметилтиамбутена, диоксафетилбутирата, дипипанона,эптазоцина, этогептазина, этилметилтиамбутена, этилморфина, этонитазена, эторфина, дигидроэторфина,фентанила и производных, гидрокодона, гидроморфона, гидроксипетидина, изометадона, кетобмидона,леворфанола, левофенацилморфана, лофентанила, меперидина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, нарцеина, никоморфина, норлеворфанола, норметадона, налорфина, налбуфена, норморфина, норпипанона, опия, оксикодона, оксиморфона, папаверетума, пентазоцина, фенадоксона, феноморфана, феназоцина, феноперидина, пиминодина, пиритрамида, профептазина, промедола,проперидина, пропоксифена, суфентанила, тилидина, трамадола в виде их фармацевтически приемлемых солей и смесей любых из указанных веществ и т.п., предпочтительно из фармацевтически приемлемых- 27015615 солей любого вещества из кодеина, морфина, оксикодона, гидрокодона, гидроморфона или оксиморфона. 4. Состав по п.1, отличающийся тем, что соль опиоида представляет собой комбинацию соли опиоидного агониста и соли опиоидного антагониста, при этом комбинация обеспечивает анальгетический эффект и опиоидный антагонист выбран из группы, состоящей из налоксона, налтрексона и налорфина в виде их фармацевтически приемлемых солей. 5. Состав по п.1, отличающийся тем, что этилцеллюлоза содержится в количестве от 10 до 50 вес.%,наиболее предпочтительно от 20 до 45 вес.% в расчете на матричный материал или в количестве по меньшей мере 40 вес.%, по меньшей мере 45 вес.%, по меньшей мере 50 вес.%, по меньшей мере 55 вес.% или по меньшей мере 60 вес.% в расчете на матричный состав. 6. Состав по п.1, отличающийся тем, что полимер метакрилата содержится в количестве от 5 до 66 вес.%, предпочтительно от 15 до 50 вес.%, более предпочтительно от 20 до 45 вес.% и наиболее предпочтительно от 25 до 45 вес.% или в весовом количестве, равном по меньшей мере 5 вес.%, по меньшей мере 10 вес.%, по меньшей мере 15 вес.%, по меньшей мере 20 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав. 7. Состав по п.1, отличающийся тем, что второй матричный материал представляет собой нейтральный водонерастворимый сополимер этилакрилата с метилметакрилатом. 8. Состав по п.7, отличающийся тем, что нейтральный водонерастворимый сополимер этилакрилата с метилметакрилатом содержится в количестве от 5 до 66 вес.%, предпочтительно от 15 до 50 вес.%, более предпочтительно от 20 до 45 вес.% и наиболее предпочтительно от 25 до 45 вес.% или в весовом количестве, равном по меньшей мере 5 вес.%, по меньшей мере 10 вес.%, по меньшей мере 15 вес.%, по меньшей мере 20 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав. 9. Состав по пп.2-8, отличающийся тем, что соль опиоида представляет собой оксикодона гидрохлорид или гидроморфона гидрохлорид. 10. Состав по любому из предыдущих пунктов, отличающийся тем, что в матричный материал включено по меньшей мере одно связующее, предпочтительно гидроксиалкилцеллюлоза. 11. Состав по п.10, отличающийся тем, что этилцеллюлоза соединена по меньшей мере с одним пластификатором. 12. Состав по пп.2-8, отличающийся тем, что соль опиоида представляет собой смесь оксикодона гидрохлорида и налоксона гидрохлорида, и они содержатся в отношении 2:1. 13. Состав по п.1, отличающийся тем, что после встряхивания в воде при комнатной температуре в течение около 15 мин высвобождает менее 15% соли опиоида. 14. Состав по п.10, отличающийся тем, что связующее содержится в количестве, равном по меньшей мере 1 вес.%, по меньшей мере 3 вес.% или по меньшей мере 5 вес.% в расчете на матричный состав. 15. Состав по п.14, отличающийся тем, что количество связующего составляет максимально 10 вес.% в расчете на матричный состав. 16. Состав по п.14 или 15, отличающийся тем, что связующее представляет собой гидроксиалкилцеллюлозу. 17. Состав по п.11, отличающийся тем, что пластификатор содержится в количестве, равном по меньшей мере 5 вес.%, по меньшей мере 15 вес.% или по меньшей мере 25 вес.% в расчете на матричный состав. 18. Состав по п.17, отличающийся тем, что количество пластификатора составляет максимально 30 вес.% или максимально 40 вес.% в расчете на матричный состав. 19. Состав по п.17 или 18, отличающийся тем, что пластификатор имеет температуру плавления,равную по меньшей мере 80 С. 20. Состав по п.19, отличающийся тем, что пластификатор представляет собой гидрированное касторовое масло. 21. Состав по п.1, отличающийся тем, что матричный материал представляет собой прессованный гранулят. 22. Состав по п.1, отличающийся тем, что соль опиоида представляет собой гидроморфона гидрохлорид, который содержится в количестве 2, или 4, или 8, или 12, или 16, или 24, или 32, или 48, или 64 мг. 23. Состав по п.1, отличающийся тем, что соль опиоида представляет собой оксикодона гидрохлорид, который содержится в количестве 5, или 10, или 15, или 20, или 30, или 40, или 45, или 60, или 80,или 90, или 120, или 160 мг. 24. Способ лечения боли, включающий введение пациенту, нуждающемуся в этом, состава по любому из пп.1-23. 25. Способ удержания от злоупотребления опиоидным агонистом, включающий введение состава по любому из пп.1-23. 26. Способ изготовления состава по любому из пп.1-23, включающий экструдирование фармацевтически приемлемой соли опиоидного анальгетика и матричного материала.- 28015615 27. Способ по п.26, отличающийся тем, что он включает резку экструдата на множество частиц,возможное прессование частиц с получением таблетки или наполнение частицами капсул.
МПК / Метки
Метки: формы, лекарственные, устойчивые, спиртам
Код ссылки
<a href="https://eas.patents.su/30-15615-ustojjchivye-k-spirtam-lekarstvennye-formy.html" rel="bookmark" title="База патентов Евразийского Союза">Устойчивые к спиртам лекарственные формы</a>