Антигенсвязывающие молекулы, обладающие повышенной аффинностью к связыванию с fс-рецептором и эффекторной функцией
Номер патента: 15009
Опубликовано: 29.04.2011
Авторы: Умана Пабло, Зутер Тобиас, Пюнтенер Урсула, Мёсснер Эккерхард, Брюнкер Петер, Феррара Клаудиа
Формула / Реферат
1. Сконструированное антитело типа II к CD20, обладающее повышенной ADCC без существенной потери способности индуцировать апоптоз клеток-мишеней, экспрессирующих CD20, содержащее гипервариабельный участок (CDR) B-Lyl антитела мыши, который выбран из группы, включающей CDR1 SEQ ID NO: 15, SEQ ID NO: 16 или SEQ ID NO: 17 тяжелой цепи; CDR2 SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 27 тяжелой цепи; CDR3 SEQ ID NO: 28 тяжелой цепи; CDR1 SEQ ID NO: 18 легкой цепи; CDR2 SEQ ID NO: 19 легкой цепи и CDR3 SEQ ID NO: 20 легкой цепи, причем антитело имеет Fc-область или область, эквивалентную Fc-области иммуноглобулина, с модифицированными олигосахаридами.
2. Антитело по п.1, где антитело включает CDR1 SEQ ID NO: 15, SEQ ID NO: 16 или SEQ ID NO: 17 тяжелой цепи; CDR2 SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 27 тяжелой цепи; CDR3 SEQ ID NO: 28 тяжелой цепи.
3. Антитело по п.2, дополнительно включающее CDR1, CDR2 и CDR3 легкой цепи, имеющие SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20 соответственно.
4. Антитело по п.1, где указанное антитело было сконструировано так, что имеет повышенное содержание бисекционных (разветвленных) комплексных олигосахаридов.
5. Антитело по п.1, где указанное антитело было сконструировано так, что имеет уменьшенное содержание остатков фукозы.
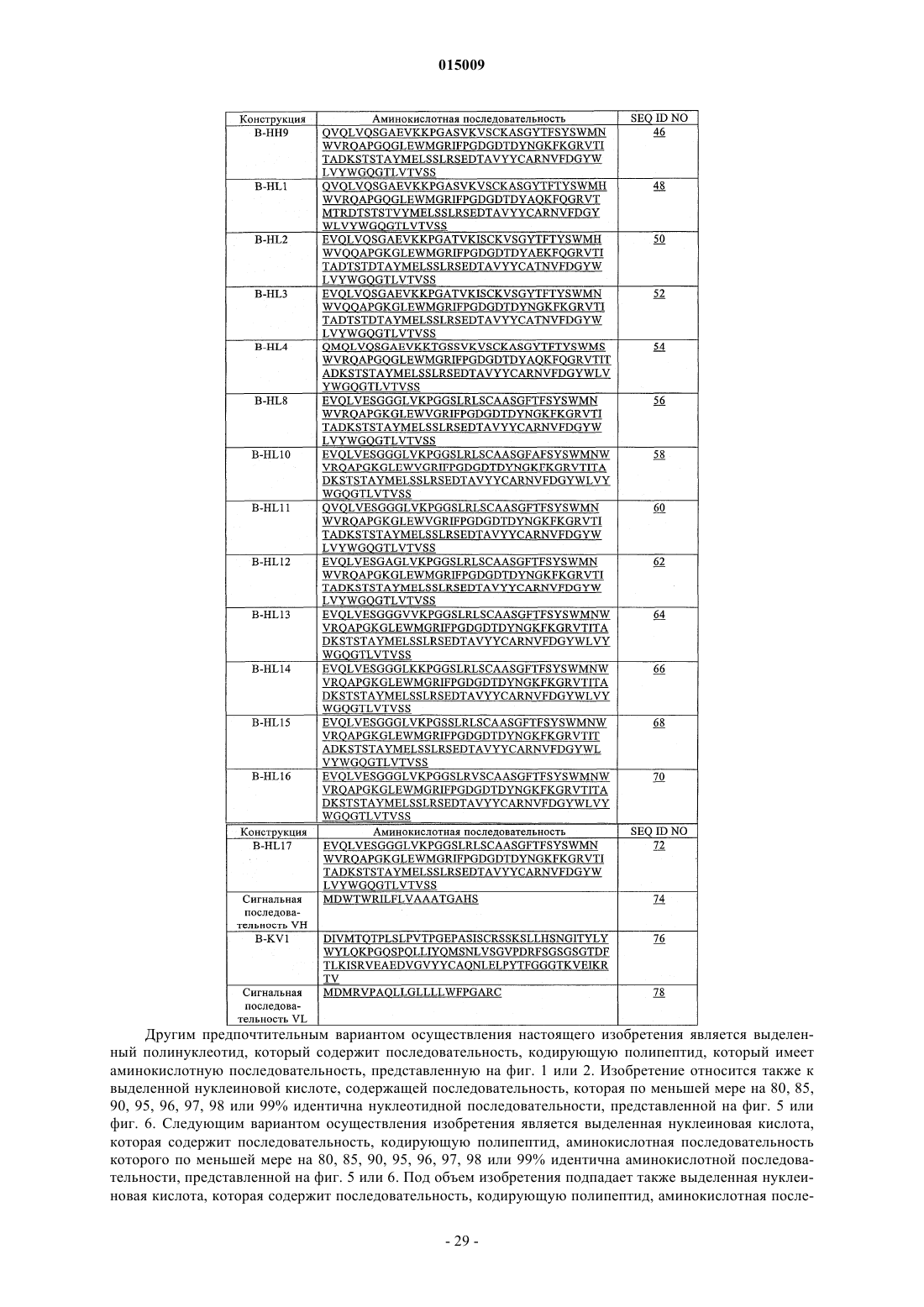
6. Антитело по п.1, включающее полипептид, который содержит последовательность вариабельной области тяжелой цепи, выбранную из последовательностей, включающих SEQ ID NO: 30; SEQ ID NO: 32; SEQ ID NO: 34; SEQ ID NO: 36; SEQ ID NO: 38; SEQ ID NO: 40; SEQ ID NO: 42; SEQ ID NO: 44; SEQ ID NO: 46; SEQ ID NO: 48; SEQ ID NO: 50; SEQ ID NO: 52; SEQ ID NO: 54; SEQ ID NO: 56; SEQ ID NO: 58; SEQ ID NO: 60; SEQ ID NO: 62; SEQ ID NO: 64; SEQ ID NO: 66; SEQ ID NO: 68; SEQ ID NO: 70 и SEQ ID NO: 72.
7. Антитело по п.3, где указанное антитело включает полипептид, который содержит последовательность вариабельной области легкой цепи SEQ ID NO: 76.
8. Антитело по п.1, где указанное антитело является гуманизированным антителом, включающим:
а) последовательность, содержащую CDR1 тяжелой цепи, который выбран из группы, включающей SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17; и
б) последовательность, содержащую CDR2 тяжелой цепи, который выбран из группы, включающей SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27; и
в) CDR3 SEQ ID NO: 28 тяжелой цепи.
9. Антитело по п.1, где указанное антитело является гуманизированным антителом, включающим последовательность, содержащую CDR1 SEQ ID NO: 18 легкой цепи; CDR2 SEQ ID NO: 19 легкой цепи и CDR3 SEQ ID NO: 20 легкой цепи.
10. Антитело по п.1, где указанное антитело включает первый выделенный полипептид, включающий последовательность гипервариабельного участка вариабельной области тяжелой цепи SEQ ID NO: 40 и второй выделенный полипептид, который включает последовательность гипервариабельного участка вариабельной области легкой цепи SEQ ID NO: 76.
11. Антитело по п.1, в котором по меньшей мере 20% олигосахаридов в Fc-области являются бисекционными (разветвленными) нефукозилированными.
12. Антитело по п.1, в котором по меньшей мере 50% олигосахаридов в Fc-области являются бисекционными (разветвленными) нефукозилированными.
13. Выделенный полинуклеотид, включающий последовательность, которая кодирует гипервариабельный участок вариабельной области тяжелой цепи по п.6, включающий последовательность, по меньшей мере на 80% идентичную последовательности, которая выбрана из группы, включающей SEQ ID NO: 29; SEQ ID NO: 31; SEQ ID NO: 33; SEQ ID NO: 35; SEQ ID NO: 37; SEQ ID NO: 39; SEQ ID NO: 41; SEQ ID NO: 43; SEQ ID NO: 45; SEQ ID NO: 47; SEQ ID NO: 49; SEQ ID NO: 51; SEQ ID NO: 53; SEQ ID NO: 55; SEQ ID NO: 57; SEQ ID NO: 59; SEQ ID NO: 61; SEQ ID NO: 63; SEQ ID NO: 65; SEQ ID NO: 67; SEQ ID NO: 69 и SEQ ID NO: 71.
14. Выделенный полинуклеотид по п.13, включающий последовательность, которая выбрана из группы, включающей SEQ ID NO: 29; SEQ ID NO: 31; SEQ ID NO: 33; SEQ ID NO: 35; SEQ ID NO: 37; SEQ ID NO: 39; SEQ ID NO: 41; SEQ ID NO: 43; SEQ ID NO: 45; SEQ ID NO: 47; SEQ ID NO: 49; SEQ ID NO: 51; SEQ ID NO: 53; SEQ ID NO: 55; SEQ ID NO: 57; SEQ ID NO: 59; SEQ ID NO: 61; SEQ ID NO: 63; SEQ ID NO: 65; SEQ ID NO: 67; SEQ ID NO: 69 и SEQ ID NO: 71.
15. Выделенный полинуклеотид по п.13, включающий последовательность, которая кодирует полипептид, имеющий последовательность, которая выбрана из группы, включающей SEQ ID NO: 30; SEQ ID NO: 32; SEQ ID NO: 34; SEQ ID NO: 36; SEQ ID NO: 38; SEQ ID NO: 40; SEQ ID NO: 42; SEQ ID NO: 44; SEQ ID NO: 46; SEQ ID NO: 48; SEQ ID NO: 50; SEQ ID NO: 52; SEQ ID NO: 54; SEQ ID NO: 56; SEQ ID NO: 58; SEQ ID NO: 60; SEQ ID NO: 62; SEQ ID NO: 64; SEQ ID NO: 66; SEQ ID NO: 68; SEQ ID NO: 70 и SEQ ID NO: 72, где указанный полипептид имеет консервативные замены аминокислот.
16. Выделенный полинуклеотид, включающий последовательность, кодирующую гипервариабельный участок вариабельной области легкой цепи по п.7, включающий последовательность, по меньшей мере на 80% идентичную SEQ ID NO: 75.
17. Полинуклеотид по п.16, включающий SEQ ID NO: 75.
18. Полинуклеотид по п.16, включающий последовательность, которая кодирует полипептид, имеющий последовательность SEQ ID NO: 76, где указанный полипептид имеет консервативные аминокислотные замены.
19. Гуманизированное антитело типа II к CD20, включающее вариабельную область B-Lyl антитела мыши, которая содержит CDR1 SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17 тяжелой цепи, CDR2 SEQ ID NO: 25, SEQ ID NO: 26 или SEQ ID NO: 27 тяжелой цепи и CDR3 SEQ ID NO: 28 тяжелой цепи, где указанное антитело способно индуцировать апоптоз при инкубировании с CD20-позитивными человеческими клетками по отношении к контролю при идентичных условиях с использование химерного IgG1 антитела С2В2, последовательность которого идентична последовательности ритуксимаба.
20. Антитело по п.19, содержащее CDR1, CDR2 и CDR3 тяжелой цепи, которые имеют последовательности SEQ ID NO: 16, SEQ ID NO: 26 и SEQ ID NO: 28 соответственно.
21. Антитело по п.19 или 20, дополнительное содержащее вариабельную область B-Lyl антитела мыши, содержащую CDR1, CDR2 и CDR3 легкой цепи, которые имеют последовательности SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20 соответственно.
22. Антитело по п.19, включающее вариабельную область тяжелой цепи, выбранную из группы, которая включает SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72.
23. Антитело по п.19, где указанное антитело включает вариабельную область тяжелой цепи SEQ ID NO: 40.
24. Антитело по п.21, где указанное антитело включает вариабельную область легкой цепи SEQ ID NO: 76.
25. Антитело по п.19, включающее полипептид, который содержит последовательность вариабельной области тяжелой цепи SEQ ID NO: 40, и полипептид, который содержит последовательность вариабельной области легкой цепи SEQ ID NO: 76.
26. Антитело по любому из пп.19-25, содержащее подвергнутую гликоинжинирингу Fc-область.
27. Антитело по п.26, которое имеет повышенное количество бисекционных (разветвленных) нефукозилированных олигосахаридов.
28. Антитело по п.26, которое имеет пониженное количество бисекционных (разветвленных) нефукозилированных олигосахаридов.
29. Антитело по п.26, которое обладает значительно более высокой степенью связывания с рецепторами FcgRIII по отношению к антителу, которое не повергалось гликоинжинирингу.
30. Антитело по п.26, указанное антитело обладает значительно более высокой степенью ADCC активности по отношению к антителу, которое не повергалось гликоинжинирингу.
31. Выделенный полинуклеотид, включающий последовательность, которая кодирует вариабельную область тяжелой цепи по п.22, где указанный полинуклеотид включает последовательность, имеющую по меньшей мере 80%-ную идентичность с последовательностями, выбранными из группы, включающей SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69 и SEQ ID NO: 71.
32. Выделенный полинуклеотид по п.31, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 29, SEQ ID NO: 31, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 37, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69 и SEQ ID NO: 71.
33. Выделенный полинуклеотид по п.31, где указанный полинуклеотид включает последовательность, кодирующую полипептид, который имеет аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72, где указанный полипептид имеет консервативные аминокислотные замены.
34. Выделенный полинуклеотид, включающий последовательность, которая кодирует вариабельную область легкой цепи по п.24, где указанный полинуклеотид включает последовательность, имеющую по меньшей 80%-ную идентичность с SEQ ID NO: 75.
35. Полинуклеотид по п.34, включающий SEQ ID NO: 75.
36. Полинуклеотид по п.34, включающий последовательность, которая кодирует полипептид, имеющий аминокислотную последовательность SEQ ID NO: 76, где указанный полипептид имеет консервативные аминокислотные замены.
37. Экспрессионный вектор, содержащий полинуклеотид по любому из пп.13-18 или 31-36.
38. Клетка-хозяин, содержащая экспрессионный вектор по п.37.
39. Клетка-хозяин, обеспечивающая экспрессию по меньшей мере одного полипептида, обладающего активностью b(1,4)-N-ацетилглюкозаминилтрансферазы III, в количестве, которое является достаточным для модификации олигосахаридов в Fc-области полипептида, продуцируемого клеткой-хозяином, где полипептид представляет собой антитело по любому из пп.6-10 или 26-30.
40. Клетка-хозяин по п.39, где указанное продуцируемое клеткой-хозяином антитело обладает в результате модификации повышенной аффинностью к связыванию с Fc-рецептором.
41. Клетка-хозяин по п.40, где указанный Fc-рецептор является FcgRIIIA рецептором.
42. Клетка-хозяин по п.39, где указанное продуцируемое клеткой-хозяином антитело проявляет в результате модификации повышенную эффекторную функцию.
43. Клетка-хозяин по п.42, где повышенная эффекторная функция представляет собой повышенную способность к непосредственной передаче сигнала, индуцирующего апоптоз.
44. Клетка-хозяин по п.39, содержащая по меньшей мере один встроенный путем трансфекции полинуклеотид, который кодирует полипептид по одному из пп.6-10 или 26-30, причем этот полинуклеотид содержит последовательность, кодирующую область, эквивалентную Fc-области человеческого иммуноглобулина.
45. Фармацевтическая композиция, содержащая антитело по любому из пп.1-12 или 19-30 и фармацевтически приемлемый носитель.
46. Способ лечения нарушения, которое можно лечить путем В-клеточного истощения, предусматривающий введение терапевтически эффективного количества антитела по одному из пп.1-12 или 19-30.
47. Способ по п.46, где указанное нарушение является злокачественным гематологическим или аутоиммунным заболеванием.
48. Способ по п.47, где указанным злокачественным гематологическим заболеванием является В-клеточный лимфолейкоз; неходжкинская лимфома или хронический В-клеточный лимфолейкоз.
49. Способ по п.46, где аутоиммунным заболеванием является ревматоидный артрит или волчанка.
50. Способ получения в клетке-хозяине антитела к CD20, которое имеет Fc-область с модифицированными олигосахаридами и модифицированной повышенной эффекторной функцией, заключающийся в том, что:
а) культивируют клетку-хозяин, сконструированную для обеспечения экспрессии, по меньшей мере, нуклеиновой кислоты, кодирующей полипептид, обладающий активностью b(1,4)-N-ацетилглюкозаминилтрансферазы III в условиях, позволяющих получить антитело и осуществить модификацию олигосахаридов, присутствующих в Fc-области антитела; и
б) выделяют антитело,
где указанное антитело является слитым белком, включающим полипептид, имеющий последовательность вариабельной области тяжелой цепи, выбранной из группы, включающей SEQ ID NO: 30, SEQ ID NO: 32, SEQ ID NO: 34, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70 и SEQ ID NO: 72, где Fc-область эквивалента Fc-области иммуноглобулина.
51. Способ по п.50, где указанные модифицированные олигосахариды имеют пониженное количество остатков фукозы по сравнению с немодифицированными олигосахаридами.
52. Способ по п.50, где антитело, продуцируемое клеткой-хозяином, имеет пониженное количество бисекционных (разветвленных) олигосахаридов в Fc-области.
53. Выделенный полинуклеотид, включающий последовательность, которая кодирует гипервариабельный участок вариабельной области тяжелой цепи SEQ ID NO: 39, и последовательность, которая кодирует гипервариабельный участок вариабельной области легкой цепи SEQ ID NO: 75.
54. Выделенный полинуклеотид, включающий последовательности, которые кодируют гипервариабельные участки вариабельной области тяжелой цепи SEQ ID NO: 6, SEQ ID NO: 22 и SEQ ID NO: 24.
55. Выделенный полинуклеотид по п.54, дополнительно включающий последовательности, которые кодируют гипервариабельные участки вариабельной области легкой цепи SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10.
Текст
АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ ПОВЫШЕННОЙ АФФИННОСТЬЮ К СВЯЗЫВАНИЮ С Fc-РЕЦЕПТОРОМ И ЭФФЕКТОРНОЙ ФУНКЦИЕЙ В изобретении описаны антигенсвязывающие молекулы (АСМ). В частности, в изобретении описаны рекомбинантные моноклональные антитела, включая химерные, приматизированные или гуманизированные антитела, специфические в отношении человеческого CD20. Кроме того, описаны молекулы нуклеиновых кислот, кодирующие такие АСМ, и векторы и клетки-хозяева, содержащие такие молекулы нуклеиновых кислот. Описаны также способы получения АСМ, предлагаемых в изобретении, и способы применения таких АСМ для лечения заболевания. Кроме того, описаны АСМ с модифицированным гликозилированием, обладающие улучшенными терапевтическими свойствами, включая антитела с повышенной способностью к связыванию с Fcрецептором и повышенной эффекторной функцией.(71)(73) Заявитель и патентовладелец: ГЛИКАРТ БИОТЕХНОЛОГИ АГ (CH) 015009 Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к антигенсвязывающим молекулам (АСМ). Конкретные варианты осуществления настоящего изобретения относятся к рекомбинантным моноклональным антителам,включая химерные, приматизированные или гуманизированные антитела, обладающие специфичностью в отношении человеческого CD20. Кроме того, настоящее изобретение относится к молекулам нуклеиновых кислот, которые кодируют такие АСМ, и векторам и клеткам-хозяевам, содержащим такие молекулы нуклеиновых кислот. Изобретение относится также к способам получения АСМ, предлагаемых в изобретении, и к способам применения таких АСМ для лечения заболевания. Кроме того, настоящее изобретение относится к АСМ с модифицированным гликозилированием, которые обладают улучшенными терапевтическими свойствами, включая антитела с повышенной способностью к связыванию с Fcрецептором и повышенной эффекторной функцией. Известный уровень техники Иммунная система и антитела к CD20 Иммунная система позвоночных, включая человека, состоит из многих органов и типов клеток, которые участвуют в точном и специфическом распознавании, связывании и разрушении проникших чужеродных микроорганизмов (антигенов). Решающее значение для правильного функционирования иммунной системы играют лимфоциты. Эти клетки продуцируются в тимусе, селезенке и костном мозге(взрослых особей) и составляют примерно 30% от общего количества лейкоцитов, присутствующих в кровеносной системе взрослого человека. Существует две основные субпопуляции лимфоцитов: Тклетки и В-клетки. Т-клетки ответственны за опосредуемый клетками иммунитет, в то время как Вклетки ответственны за производство антител (гуморальный иммунитет). Однако при создании типичного иммунного ответа Т-клетки и В-клетки функционируют независимо: Т-клетки активируются, когда Тклеточный рецептор связывается с фрагментами антигена, которые связаны с гликопротеинами главного комплекса гистосовместимости (ГКГ) на поверхности антигенпрезентирующей клетки; такая активация приводит к высвобождению биологических медиаторов (интерлейкинов), которые стимулируют Вклетки к дифференцировке и продуцированию антител (иммуноглобулинов) к антигену. Каждая В-клетка в организме-хозяине экспрессирует антитело одного конкретного типа и специфичности, а различные В-клетки экспрессируют антитела, специфические в отношении различных антигенов. В-клеточная пролиферация и продуцирование антител выступают в качестве реакции на чужеродный антиген, и то и другое, как правило, прекращается (или существенно уменьшается), после того как чужеродный антиген нейтрализован. Однако иногда пролиферация конкретной В-клетки может продолжаться без ограничения; такая пролиферация может приводить к раку, который называют В-клеточной лимфомой. Как Т-клетки, так и В-клетки содержат белки клеточной поверхности, которые можно использовать в качестве маркеров для дифференцировки и идентификации. Одним из таких маркеров человеческих В-клеток является связанный только с человеческими В-лимфоцитами дифференцировочный антиген Вр 35, который называют CD20. CD20 экспрессируется на ранней стадии развития пре-В-клеток и сохраняется до дифференцировки плазматических клеток. В частности, молекула CD20 необходима для регулирования стадии процесса активации, которая требуется для инициации клеточного цикла и дифференцировки, и, как правило, на неопластических (опухолевых) В-клетках имеет место высокий уровень ее экспрессии. Поскольку высокие уровни CD20 присутствуют на злокачественных В-клетках, т.е. на тех В-клетках, неограниченная пролиферация которых может приводить к В-клеточной лимфоме, то поверхностный антиген CD20 может являться кандидатом в качестве мишени для распознавания Вклеточных лимфом. По существу, процесс распознавания мишени можно обобщить следующим образом: антитела,специфические в отношении поверхностного антигена CD20 на В-клетках, вводят пациенту, например,путем инъекции. Эти антитела к CD20 специфически связываются с клеточным поверхностным антигеном CD20 (очевидно) как на здоровых, так и на злокачественных В-клетках; антитело к CD20, связанное с поверхностным антигеном CD20, может приводить к разрушению и истощению неопластических Вклеток. Кроме того, с антителом к CD20 можно конъюгировать химические агенты или радиоактивные метки, обладающие способностью разрушать опухоль, так чтобы осуществлять специфический перенос агента, например, к неопластическим В-клеткам. Независимо от подхода основной целью является разрушение опухоли: конкретный подход может определяться выбором конкретного применяемого антитела к CD20 и, таким образом, пригодные подходы для распознавания в качестве мишени антигена CD20 могут широко варьироваться. Неконъюгированные моноклональные антитела (МАт) можно применять в качестве лекарственных средств для лечения рака, о чем свидетельствует разрешение Департамента по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (US Food and Drug Administration) применения ритуксимаба (Rituxan; фирма IDEC Pharmaceuticals, Сан-Диего, шт. Калифорния и фирмаGenetech Inc., Сан-Франциско, шт. Калифорния) для лечения CD20-позитивной В-клеточной, низкозло-1 015009 качественной или фолликулярной неходжкинской лимфомы, трастузумаба (Herpceptin, фирма GenetechInc.) для лечения развитого рака молочной железы (Grillo-Lopez A.-J и др., Semin. Oncol., 26, 1999, cc. 6673; Goldenberg М.М., Clin. Ther., 21, 1999, cc. 309-318), гемтузумаба (Mylotarg, фирма Gentech/WyethAyerst) для лечения рецидива острого миелоидного лейкоза и алемтузумаба (САМРАТН, фирма Millenium Pharmaceuticals/Schering AG) для лечения В-клеточного хронического лимфолейкоза. Успешное применение этих продуктов обусловлено не только их эффективностью, но и их очень хорошими профилями безопасности (Grillo-Lopez A.-J и др., Semin. Oncol., 26, 1999, cc. 66-73; Goldenberg M.M., Clin.Ther., 21, 1999, cc. 309-318). В свете успехов, связанных с этими лекарственными средствами, в настоящее время существует большая потребность в достижении более высокой специфической активности антител по сравнению с той, которая, как правило, обеспечивается при лечении с использованием неконъюгированного МАт. Другим антителом, обладающим специфичностью в отношении человеческогоCD20, является мышиное моноклональное антитело В-Lyl (Poppema S. и Visser L., Biotest Bulletin, 3,1987, cc. 131-139). Результаты многочисленных исследований позволяют предположить, что зависящие от Fcрецептора механизмы оказывают существенное влияние на действие цитотоксичных антител на опухоли и указывают на то, что оптимальное антитело, действующее на опухоли, должно связываться предпочтительно с Fc-рецепторами-активаторами и в минимальной степени с партнером-ингибитором FcRIIB(Clynes R.A. и др., Nature Medicine, 6(4), 2000, cc. 443-446; Kalergis A.M. и Ravetch J.V., J. Exp. Med.,195(12), июнь 2002, cc. 1653-1659. Например, результаты по меньшей мере одного исследования позволяют, в частности, предположить, что FcRIIIa-рецептор имеет большое значение для эффективности терапии с использованием антител (Cartron G. и др., Blood, 99(3), февраль 202, cc. 754-757). В этом исследовании установлено, что пациенты, гомозиготные по FcRIIIa, дают лучшую реакцию на ритуксимаб, чем гетерозиготные пациенты. Авторы сделали вывод о том, что более высокая реакция обусловлена лучшим связыванием антитела с FcRIIIa in vivo, что приводит к более высокой антителообусловленной клеточнозависимой цитотоксичности (ADCC-активности) в отношении клеток лимфомы(Cartron G. и др., Blood, 99(3), февраль 202, cc. 754-757). Известны многочисленные попытки использовать в качестве мишени поверхностный антигенCD20) вводили путем внутривенной непрерывной инфузии пациентам с В-клеточной лимфомой. Было указано, что для истощения опухолевых клеток, присутствующих в кровотоке, необходимы очень высокие уровни ( 2 г) 1F5 и отмечено, что результаты оказывались кратковременными (Press и др., Monoclonal Antibody 1F5 (Anti-CD20) Serotherapy of Human B-Cell Lymphomas, Blood, 69/2, 1987, cc. 584-591). Потенциальной проблемой, связанной с этим подходом, является то, что у моноклональных антител из организма кроме человека (например у мышиных моноклональных антител), как правило, отсутствует человеческая эффекторная функция, т.е. они неспособны среди прочего опосредовать комплементзависимый лизис или лизировать человеческие клетки-мишени с помощью антителообусловленной клеточнозависимой токсичности или путем опосредованного Fc-рецептором фагоцитоза. Кроме того, моноклональные антитела из организма кроме человека могут распознаваться человеческим организмомхозяином как чужеродный белок; поэтому повторные инъекции таких чужеродных антител могут индуцировать иммунные ответы, приводящие к вредным реакциям гиперчувствительности. Для моноклональных антител, выведенных из организма мыши, это явление часто называют человеческим антимышиным гуморальным иммунным ответом или НАМА-ответом. Кроме того, эти чужеродные антитела могут быть атакованы иммунной системой хозяина, в результате чего они фактически оказываются нейтрализованными до того, как достигнут своей области-мишени. Другой известный из литературы подход к усилению способности мышиных моноклональных антител оказывать действие при лечении связанных с В-клетками заболеваний заключался в осуществлении конъюгации радиоактивной метки или токсина с антителом так, чтобы метка или токсин оказались локализованными в области опухоли. Например, опубликованы данные о том, что указанное выше антитело 1F5 метили с помощью йода-131 (131I) и оценивали его биораспределение в организме двух пациентов (см. Eary J.F. и др., Imaging and Treatment of B-Cell Lymphoma, J. Nuc. Med. 31/8, 1990, cc. 12571268; см. также Press O.W. и др., Treatment of Refractory Non-Hodgkin's Lymphoma with Radiolabeled MB-1(Anti-CD37) Antibody, J. Clin. Onc., 7/8, 1980, cc. 1027-1038 (указано, что у одного подвергавшегося лечению меченым с помощью 131IIF-5 пациента был достигнут частичный ответ); Goldenberg D.M. и др.,Targeting, Dosimetry and Radioimmunotherapy of B-Cell Lymphomas with Iodine-131-Labelled LL2 Monoclonal Antibody, J. Clin. One, 9/4, 1991 548-564 (указано, что у трех из восьми пациентов, которым делали несколько инъекций, развился НАМА-ответ); Appelbaum F.R., Radiolabeled Monoclonal Antibodies in-2 015009 ниже цитируется как Kaminski). Имеются данные о том, что осуществляли также конъюгацию токсинов (т.е. химиотерапевтических агентов, таких как доксорубицин или митомицин С) с антителами (см.,например опубликованную заявку РСТ WO 92/07466 (опубликованную 14 мая 1992. В качестве альтернативы конъюгированным антителам были разработаны химерные антитела, содержащие фрагменты антител из двух или большего количества различных видов (например, из организма мыши и человека). Например, у Lie A.Y. и др., Production of a Mouse-Human Chimeric MonoclonalAntibody to CD20 with Potent Fc-Dependent Biologic Activity, J. Immunol., 139/10, 1987, cc. 3521-3526, описано химерное мышиное/человеческое антитело к антигену CD20 (см. также публикацию РСТ WO 88/04936). Для лечения неходжкинской лимфомы был разрешен, например ритуксимаб (RITUXAN),представляющий собой химерное антитело к CD20. Поскольку при В-клеточных лимфомах происходит экспрессия CD20, то этот антиген может служить в качестве мишени для распознавания таких лимфом. По существу, процесс распознавания мишени можно обобщить следующим образом: антитела, специфические в отношении поверхностного антигена CD20 на В-клетках, вводят пациенту. Эти антитела к CD20 специфически связываются с антигеном CD20 (очевидно) как на здоровых, так и на злокачественных В-клетках, и антитело к CD20, связанное с поверхностным антигеном CD20, может приводить к разрушению и истощению онкогенных Вклеток. Кроме того, с антителом к CD20 можно непосредственно или косвенным образом связывать химические агенты, цитотоксины или радиоактивные агенты, так что осуществляется избирательный перенос агента к В-клеткам, экспрессирующим антиген CD20. В обоих указанных подходах основной целью является разрушение опухоли. Конкретный подход может определяться выбором конкретного применяемого антитела к CD20. Таким образом, очевидно, что пригодные подходы для распознавания в качестве мишени антигена CD20 могут широко варьироваться. Антитело ритуксимаб (RITUXAN) представляет собой созданное с помощью генной инженерии химерное моноклональное антитело к человеческому антигену CD20, содержащее человеческую гамма 1-типа и мышиную константную область. Это химерное антитело содержит человеческие константные области гамма 1-типа и в патенте US 5736137 (на имя Andersen и др.), выданном 17 апреля 1998 г., переуступленном IDEC Pharmaceuticals Corporation, обозначено как С 2 В 8. RITUXAN разрешен для применения при лечении пациентов с CD20-позитивной В-клеточной рецидивной или рефрактерной низкозлокачественной или фолликулярной неходжкинской лимфомой. Исследования механизма действия invitro позволили установить, что RITUXAN обладает человеческой комплементзависимой цитотоксичностью (CDC) (Reff и др., Blood, 83(2), 1994, cc. 435-445). Кроме того, было установлено, что он обладает выраженной активностью в анализах по оценке антитело-обусловленной клеточнозависимой цитотоксичностью (ADCC). Было установлено, что RITUXAN обладает антипролиферативной активностью в анализах с использованием включения тимидина и ограниченной способностью непосредственно индуцировать апоптоз, в то время как антитела к CD20 не обладают такими свойствами (Maloney и др., Blood,88(10), 1996, 637 а). Гликозилирование антител Компонент, представляющий собой олигосахарид, может оказывать существенное влияние на свойства, касающиеся эффективности гликопротеина, включая физическую стабильность, устойчивость к воздействию протеаз, взаимодействия с иммунной системой, фармакокинетические характеристики и специфическую биологическую активность. Такие свойства могут зависеть не только от присутствия или отсутствия олигосахаридов, но также и от их конкретных структур. Можно сделать некоторые общие выводы о связи структуры олигосахаридов и функцией гликопротеина. Например, некоторые олигосахаридные структуры опосредуют быстрый клиренс гликопротеина из кровотока в результате взаимодействий со специфическими связывающими углеводы белками, в то время как другие могут быть связаны с антителами и стимулировать нежелательные иммунные ответы (Jenkins и др., Nature Biotechnol., 14, 1996,cc. 975-981). Клетки млекопитающих являются предпочтительными хозяевами для производства имеющих терапевтическое значение гликопротеинов благодаря их способности гликозилировать белки с получением формы, наиболее совместимой с организмом человека (Cumming и др., Glycobiology, 1,1991, cc. 115-130;Jenkins и др., Nature Biotechnol., 14, 1996, cc. 975-981). Бактерии очень редко гликозилируют белки и подобно другим типам обычно применяемых хозяев, таких как дрожжи, гифомицеты, клетки насекомых и растений, создают схемы гликозилирования, приводящие к быстрому клиренсу из кровотока, нежелательным иммунным взаимодействиям и в некоторых конкретных случаях к пониженной биологической активности. Среди клеток млекопитающих в последние двадцать лет наиболее часто используют клетки яичника китайского хомячка (СНО). Помимо пригодной схемы гликозилирования эти клетки позволяют постоянно получать генетически стабильные высокопродуктивные клоны клеточных линий. Их можно культивировать до достижения высоких плотностей в простых биореакторах с использованием бессывороточных сред и их использование позволяет разрабатывать безопасные и воспроизводимые биологические процессы. К другим обычно применяемым клеткам животных относятся клетки почки детеныша хомячка (ВНК), клетки мышиной миеломы линий NS0 и SP2/0. В последние годы изучали методы произ-3 015009 водства с использованием трансгенных животных (Jenkins и др., Nature Biotechnol., 14, 1996, cc. 975-981). Все антитела содержат углеводные структуры в консервативных положениях в константных областях тяжелых цепей, причем каждый изотип несет различный набор N-связанных углеводных структур,которые различным образом влияют на сборку белка, его секрецию или функциональную активность(Wright А. и Morrison S.L., Trends Biotechn., 15, 1997, cc. 26-32). Структура присоединенных N-связанных углеводов в значительной степени варьируется в зависимости от уровня процессинга и может включать имеющие высокое содержание маннозы, многократно разветвленные, а также биантенные комплексные олигосахариды (Wright А. и Morrison S.L., Trends Biotechn., 15, 1997, cc. 26-32). Как правило, имеет место гетерогенный процессинг коровых олигосахаридных структур, присоединенных в конкретном сайте гликозилирования, в результате чего даже моноклональные антитела обладают множеством гликоформ. Аналогично этому было установлено, что основные различия в гликозилировании антител имеют место между клеточными линиями и даже для данной клеточной линии, выращенной в различных условиях культивирования, можно обнаружить небольшие различия (Lifely M.R. и др., Glycobiology, 5(8), 1995, cc. 813-822). Одним из путей достижения значительного повышения эффективности при сохранении простого процесса производства и возможности избежать значительных нежелательных побочных действий является усиление природных опосредуемых клеткой эффекторных функций моноклональных антител путем конструирования олигосахаридного компонента согласно методу, описанному у Umana Р. и др., NatureBiotechnol., 17, 1999, cc. 176-180 и в патенте US 6602684, полное содержание которых включены в настоящее описание в качестве ссылки. Антитела IgGl-типа, представляющие собой антитела, наиболее часто используемые в иммунотерапии рака, являются гликопротеинами, которые имеют консервативныйN-связанный сайт гликозилирования в положении Asn297 в каждом СН 2-домене. Два комплексных биантенных олигосахарида, которые присоединены к Asn297, размещаются между СН 2-доменами, образуя обширные контакты с каркасом полипептида и их наличие является существенным для способности антитела опосредовать эффекторные функции, такие как антителозависимая клеточно-обусловленная цитотоксичность (ADCC) (Lifely M.R. и др., Glycobiology, 5, 1995, cc. 813-822; Jefferis R. и др., Immunol. Rev.,163, 1998, сс. 59-76; Wright А. и Morrison S.L., Trends Biotechnol., 15, 1997, cc. 26-32). Ранее авторы настоящего изобретения установили, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) (l,4)-N-ацетилглюкозаминилтрансферазы III (GnTIII), гликозилтрансферазы,катализирующей образование бисекционных олигосахаридов, существенно повышает ADCC-активностьin vitro антинейробластомного химерного моноклонального антитела (chCE7), продуцируемого сконструированными клетками СНО (Umafia Р. и др., Nature Biotechnol., 17, 1999, cc. 176-180; и публикацию международной заявки на патент WO 99/54342, полные содержания которых включены в настоящее описание в качестве ссылки). Антитело chCE7 относится к большому классу неконъюгированных МАт, которые обладают высокой аффинностью и специфичностью в отношении опухоли, но имеют слишком малую эффективность для клинического применения при их продуцировании в стандартных клеточных линиях, в которых отсутствует фермент GnTIII (Umana Р. и др., Nature Biotechnol., 17, 1999, cc. 176-180). Это исследование было первым, в котором установлено, что существенные повышения ADCCактивности могут быть достигнуты путем конструирования продуцирующих антитело клеток, экспрессирующих GnTIII, что приводит также к увеличению содержания связанных с константной областью (Fc) бисекционных олигосахаридов, включая бисекционные нефукозилированные олигосахариды, превышающему уровни, присутствующие во встречающихся в естественных условиях антителах. Таким образом, сохраняется необходимость разработки улучшенных терапевтических подходов к использованию в качестве мишени для распознавания антигена CD20 для лечения В-клеточных лимфом у приматов, включая человека (но не ограничиваясь им). Краткое изложение сущности изобретения Принимая во внимание чрезвычайно большой терапевтический потенциал антигенсвязывающих молекул (АСМ), которые обладают специфичностью связывания, присущей мышиному антителу B-Lyl,и у которых с помощью генной инженерии сконструирована схема гликозилирования с целью повышения аффинности к связыванию с Fc-рецептором и повышения эффекторной функции, при создании настоящего изобретения был разработан способ получения таких АСМ. Этот способ среди прочего позволяет получать рекомбинантные химерные антитела или их химерные фрагменты. Эффективность этих АСМ дополнительно повышают путем конструирования профиля гликозилирования Fc-области антитела. Таким образом, одним из объектов изобретения является выделенный полинуклеотид, содержащий:SEQ ID NO: 23, (CDR VH-2); и SEQ ID NO: 24. Другим объектом изобретения является выделенный полинуклеотид, содержащий SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10, (CDR VL-1). В одном из вариантов осуществления изобретения любой из этих полинуклеотидов кодирует слитый полипептид. Следующим объектом изобретения является выделенный полинуклеотид, содержащий SEQ ID NO: 3. Еще одним объектом изобретения является выделенный полинуклеотид, содержащий SEQ ID NO: 4. Сле-4 015009 дующим объектом изобретения является выделенный полинуклеотид, содержащий последовательность,выбранную из ряда, включающего: SEQ ID NO: 29; SEQ ID NO: 31; SEQ ID NO: 33; SEQ ID NO: 35; SEQID NO: 63; SEQ ID NO: 65; SEQ ID NO: 67; SEQ ID NO: 69 и SEQ ID NO: 71. Еще одним объектом изобретения является выделенный полинуклеотид, содержащий SEQ ID NO: 75. В одном из вариантов осуществления изобретения такие полинуклеотиды кодируют слитые полипептиды. Кроме того, изобретение относится к выделенному полинуклеотиду, содержащему последовательность, которая идентична по меньшей мере на 80% SEQ ID NO: 3, где выделенный полинуклеотид кодирует слитый полипептид. Другим объектом изобретения является выделенный полинуклеотид, содержащий последовательность, которая идентична по меньшей мере на 80% SEQ ID NO: 4, где выделенный полинуклеотид кодирует слитый полипептид. Кроме того, изобретение относится к выделенному полинуклеотиду, содержащему последовательность, которая идентична по меньшей мере на 80% последовательности, выбранной из ряда, включающего: SEQ ID NO: 29; SEQ ID NO: 31; SEQ ID NO: 33; SEQ ID NO: 35; SEQ ID NO: 37; SEQ ID NO: 39; SEQID NO: 67; SEQ ID NO: 69 и SEQ ID NO: 71, где выделенный полинуклеотид кодирует слитый полипептид. Еще одним объектом изобретения является выделенный полинуклеотид, содержащий последовательность, которая идентична по меньшей мере на 80% SEQ ID NO: 75, где выделенный полинуклеотид кодирует слитый полипептид. Кроме того, изобретение относится к полинуклеотиду, содержащему SEQ ID NO: 11 (полная тяжелая цепь), или к полинуклеотидам, идентичным на 80, 85, 90, 95 или 99% SEQ ID NO: 11. Изобретение относится также к полинуклеотиду, содержащему SEQ ID NO: 12 (полная легкая цепь) или к полинуклеотидам, идентичным на 80, 85, 90, 95 или 99% SEQ ID NO: 12. Изобретение относится также к выделенному полинуклеотиду, кодирующему химерный полипептид, который имеет последовательность SEQ ID NO: 1. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, кодирующую полипептид, который имеет последовательность SEQ ID NO: 1; и последовательность, кодирующую полипептид, который имеет последовательность Fc-области антитела из видов животных кроме мыши или ее фрагмент. Изобретение относится также к выделенному полинуклеотиду, кодирующему химерный полипептид, который имеет последовательность, выбранную из ряда, включающего: SEQ ID NO: 30; SEQ ID NO: 32; SEQ ID NO: 34; SEQ IDNO: 62; SEQ ID NO: 64; SEQ ID NO: 66; SEQ ID NO: 68; SEQ ID NO: 70 и SEQ ID NO: 72. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, кодирующую полипептид, который имеет последовательность выбранную из ряда, включающего: SEQ ID NO: 30; SEQID NO: 58; SEQ ID NO: 60; SEQ ID NO: 62; SEQ ID NO: 64; SEQ ID NO: 66; SEQ ID NO: 68; SEQ ID NO: 70; и SEQ ID NO: 72; и последовательность, кодирующую полипептид, который имеет последовательность Fc-области антитела из видов животных кроме мыши или ее фрагмент. Еще одним объектом изобретения является выделенный полинуклеотид, кодирующий химерный полипептид, который имеет последовательность SEQ ID NO: 2. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, кодирующую полипептид, который имеет последовательность SEQ ID NO: 2; и последовательность, кодирующую полипептид, который имеет последовательность Fc-области антитела из видов животных кроме мыши или ее фрагмент. Еще одним объектом изобретения является выделенный полинуклеотид, кодирующий химерный полипептид, который имеет последовательность SEQ ID NO: 76. В одном из вариантов осуществления изобретения полинуклеотид содержит последовательность, кодирующую полипептид, который имеет последовательностьSEQ ID NO: 76; и последовательность, кодирующую полипептид, который имеет последовательность Fcобласти антитела из видов животных кроме мыши или ее фрагмент. Изобретение относится также к выделенному полинуклеотиду, содержащему последовательность,кодирующую полипептид, который содержит VH-область мышиного антитела B-Lyl, или ее функциональные варианты, и последовательность, кодирующую полипептид, который имеет последовательностьFc-области антитела из видов животных кроме мыши или ее фрагмент. Изобретение относится также к выделенному полинуклеотиду, содержащему последовательность, кодирующую полипептид, который содержит VL-область мышиного антитела B-Lyl, или ее функциональные варианты, и последовательность, кодирующую полипептид, который имеет последовательность Fc-области антитела из видов животных кроме мыши или ее фрагмент. Изобретение относится также к экспрессионному вектору, содержащему любой из описанных выше выделенных полинуклеотидов, и клетке-хозяину, содержащей такой экспрессионный вектор. Другим-5 015009 объектом изобретения является клетка-хозяин, содержащая любой из описанных выше выделенных полинуклеотидов. Одним из объектов изобретения является выделенный полипептид, содержащий: (а) последовательность, выбранную из ряда, включающего: SEQ ID NO: 15, SEQ ID NO: 16 и SEQ ID NO: 17, (CDR VH-1);(б) последовательность, выбранную из ряда, включающего: SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, (CDR VH-2); И SEQ ID NO: 28, где полипептид представляет собой слитый полипептид. Другим объектом изобретения является выделенный полипептид, содержащий SEQ ID NO: 18, SEQ ID NO: 19 и SEQID NO: 20, (CDR VL), где полипептид представляет собой слитый полипептид. Изобретение относится также к химерному полипептиду, содержащему последовательность SEQ IDNO: 1 или ее вариант. Кроме того, изобретение относится к химерному полипептиду, содержащему последовательность SEQ ID NO: 2 или ее вариант. В одном из вариантов осуществления изобретения любой из указанных полипептидов содержит, кроме того, человеческую Fc-область. Изобретение относится также к химерному полипептиду, который содержит последовательность, выбранную из ряда, включающего: SEQ ID NO: 30; SEQ ID NO: 32; SEQ ID NO: 34; SEQ ID NO: 36; SEQ ID NO: 38; SEQ ID NO: 40;SEQ ID NO: 68; SEQ ID NO: 70; и SEQ ID NO: 72, или ее вариант. Изобретение относится также к химерному полипептиду, содержащему последовательность SEQ ID NO: 76 или ее вариант. В одном из вариантов осуществления изобретения любой из указанных полипептидов содержит, кроме того, человеческуюFc-область. Другим объектом изобретения является полипептид, который содержит последовательность, выведенную из мышиного антитела B-Lyl, и последовательность, выведенную из гетерологичного полипептида, и антигенсвязывающая молекула, содержащая такой полипептид. В одном из вариантов осуществления изобретения антигенсвязывающая молекула представляет собой антитело. В предпочтительном варианте осуществления изобретения антитело является химерным. В другом предпочтительном варианте осуществления изобретения антитело представляет собой гуманизированное или приматизированное антитело. Еще одним объектом изобретения является выделенный полипептид, содержащий SEQ ID NO: 13 или ее вариант. Другим объектом изобретения является выделенный полипептид, содержащий SEQ IDNO: 14. Следующим объектом изобретения является АСМ, способная конкурировать с мышиным антителом B-Lyl за связывание с CD20, и которая является химерной. В одном из вариантов осуществления изобретения АСМ представляет собой антитело или его фрагмент. Еще в одном варианте осуществления изобретения АСМ представляет собой рекомбинантное антитело, содержащее VH-область, которая имеет аминокислотную последовательность, выбранную из ряда, включающего SEQ ID NO: 1; SEQ ID NO: 30;NO: 70 и SEQ ID NO: 72. В другом варианте осуществления изобретения АСМ представляет собой рекомбинантное антитело, содержащее VL-область, которая имеет аминокислотную последовательность,выбранную из ряда, включающего SEQ ID NO: 2 и SEQ ID NO: 76. В следующем варианте осуществления изобретения АСМ представляет собой рекомбинантное антитело, которое является приматизированным. Еще в одном варианте осуществления изобретения АСМ представляет собой рекомбинантное антитело, которое является гуманизированным. В другом варианте осуществления изобретения АСМ представляет собой рекомбинантное антитело, которое содержит человеческую Fc-область. Еще в одном варианте осуществления изобретения любая из указанных выше АСМ может быть конъюгирована с таким фрагментом, как токсин или радиоактивная метка. Кроме того, изобретение относится к АСМ, предлагаемой в настоящем изобретении, где АСМ несет модифицированные олигосахариды. В одном из вариантов осуществления изобретения модифицированные олигосахариды имеют пониженный уровень фукозилирования по сравнению с немодифицированными олигосахаридами. В других вариантах осуществления изобретения модифицированные олигосахариды являются гибридными или комплексными. Еще одном варианте осуществления изобретения АСМ имеет повышенное содержание нефукозилированных олигосахаридов или бисекционных нефукозилированных олигосахаридов в Fc-области указанной молекулы. В одном из вариантов осуществления изобретения бисекционные нефукозилированные олигосахариды являются гибридными. В другом варианте осуществления изобретения бисекционные нефукозилированные олигосахариды являются комплексными. В одном из вариантов осуществления изобретения по меньшей мере 20% олигосахаридов в Fcобласти указанного полипептида являются нефукозилированными или бисекционными нефукозилированными. В более предпочтительных вариантах осуществления изобретения по меньшей мере 30, 35, 40,45, 50, 55, 60, 65, 70 или 75% или более олигосахаридов в Fc-области указанного полипептида являются нефукозилированными или бисекционными нефукозилированными. Кроме того, изобретение относится к полинуклеотиду, кодирующему любую из указанных выше-6 015009 АСМ, и экспрессионным векторам и клеткам, содержащим такой полинуклеотид. Кроме того, изобретение относится к способу получения АСМ, способной конкурировать с мышиным антителом B-Lyl за связывание с CD20, и где АСМ является химерной; который заключается в том,что: (а) культивируют клетку-хозяина, содержащую полинуклеотид, который кодирует АСМ, предлагаемую в настоящем изобретении, в среде в условиях, позволяющих осуществлять экспрессию полинуклеотида, кодирующего АСМ; и (б) выделяют АСМ из полученной культуры. Другим объектом изобретения является фармацевтическая композиция, содержащая АСМ, предлагаемую в изобретении. Подразумевается, что фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель, адъювант или их комбинацию. Следующим объектом изобретения является способ лечения заболевания, которое поддается лечению с помощью В-клеточного истощения. Способ заключается в том, что человеку, нуждающемуся в этом, вводят терапевтически эффективное количество АСМ, предлагаемой в настоящем изобретении. В предпочтительном варианте осуществления изобретения заболевание лечат путем введения ACM, представляющей собой химерное антитело или химерный фрагмент антитела. Еще одним объектом изобретения является клетка-хозяин, сконструированная таким образом, чтобы экспрессировать по меньшей мере одну нуклеиновую кислоту, которая кодирует полипептид, обладающий GnTIII-активностью, в количестве, достаточном для модификации олигосахаридов в Fc-области АСМ, продуцируемой клеткой-хозяином, где АСМ способна конкурировать с мышиным антителом BLyl за связывание с CD20 и где АСМ является химерной. В одном из вариантов осуществления изобретения полипептид, обладающий GnTIII-активностью, представляет собой слитый полипептид. В другом варианте осуществления изобретения АСМ, продуцируемая клеткой-хозяином, представляет собой антитело или фрагмент антитела. Еще в одном варианте осуществления изобретения АСМ содержит область,эквивалентную Fc-области человеческого IgG. Изобретение относится также к выделенному полинуклеотиду, содержащему по меньшей мере один гипервариабельный участок мышиного антитела B-Lyl или его вариант или укороченную форму,которая содержит по меньшей мере определяющие специфичность остатки указанного гипервариабельного участка, где выделенный полинуклеотид кодирует слитый полипептид. Предпочтительно такой выделенный полинуклеотид кодирует слитый полипептид, представляющий собой антигенсвязывающую молекулу. В одном из вариантов осуществления изобретения полинуклеотид содержит три гипервариабельных участка мышиного антитела B-Lyl или их варианты или укороченные формы, которые содержат, по меньшей мере, определяющие специфичность остатки каждого из трех указанных гипервариабельных участков. В другом варианте осуществления изобретения полинуклеотид кодирует всю вариабельную область легкой или тяжелой цепи химерного (например гуманизированного) антитела. Кроме того, изобретение относится к полипептидам, кодируемым такими полинуклеотидами. Другой вариант осуществления изобретения относится к антигенсвязывающей молекуле, содержащей по меньшей мере один гипервариабельный участок мышиного антитела B-Lyl или его вариант или укороченную форму, которые содержат, по меньшей мере, определяющие специфичность остатки указанного гипервариабельного участка, и содержат последовательность, выведенную из гетерологичного полипептида. В одном из вариантов осуществления изобретения антигенсвязывающая молекула содержит три гипервариабельных участка мышиного антитела B-Lyl или их варианты или укороченные формы, которые содержат, по меньшей мере, определяющие специфичность остатки каждого из трех указанных гипервариабельных участков. В другом варианте осуществления изобретения антигенсвязывающая молекула содержит вариабельную область легкой или тяжелой цепи антитела. В одном предпочтительном варианте осуществления изобретения антигенсвязывающая молекула представляет собой химерное,например гуманизированное, антитело. Изобретение относится также к способам получения таких антигенсвязывающих молекул и к их применению для лечения заболеваний, включая В-клеточные лимфомы. Настоящее изобретение является первым известным случаем, когда антитело типа II к CD20 было сконструировано с целью усиления эффекторных функций, таких как ADCC, при сохранении выраженной способности индуцировать апоптоз. Таким образом, настоящее изобретение относится к сконструированному антителу типа II к CD20, которое в результате этого конструирования приобрело повышенную ADCC и при этом не утратило выраженной способности индуцировать апоптоз. В одном из вариантов осуществления изобретения антитела типа II к CD20 конструировали с целью изменения схемы гликозилирования в Fc-области. В конкретном варианте осуществления изобретения измененное гликозилирование представляет собой повышенное содержание бисекционных комплексных остатков в Fcобласти. В другом конкретном варианте осуществления изобретения измененное гликозилирование представляет собой пониженное содержание остатков фукозы в Fc-области. В другом варианте осуществления изобретения антитела типа II к CD20 конструируют с помощью полипептидов. Кроме того, изобретение относится к способам получения таких сконструированных антител типа II и способам применения таких антител для лечения различных связанных с В-клетками нарушений, включая В-клеточные лимфомы. Клетки-хозяева, предлагаемые в настоящем изобретении, можно выбирать из ряда, включающегоYO, клетку мышиной миеломы линии РЗХ 63, PER-клетку, PER.С 6-клетку или клетку гибридомы. В одном из вариантов осуществления изобретения клетка-хозяин, предлагаемая в изобретении, включает,кроме того, трансфектированный полинуклеотид, содержащий полинуклеотид, кодирующий VL-область мышиного антитела D-Lyl или ее варианты, и последовательность, кодирующую область, эквивалентнуюFc-области человеческого иммуноглобулина. В другом варианте осуществления изобретения клеткахозяин, предлагаемая в изобретении, включает, кроме того, трансфектированный полинуклеотид, содержащий полинуклеотид, кодирующий VH-область мышиного антитела D-Lyl или ее варианты, и последовательность, кодирующую область, эквивалентную Fc-области человеческого иммуноглобулина. Другим объектом изобретения является клетка-хозяин, продуцирующая АСМ, которая в результате модификации содержащихся в ней олигосахаридов обладает повышенной аффинностью к связыванию сFc-рецептором и/или повышенной эффекторной функцией. В одном из вариантов осуществления изобретения повышенная аффинность к связыванию представляет собой афинность к связыванию с Fcрецептором, прежде всего с FcRIIIA-рецептором. В контексте настоящего описания подразумевается,что эффекторную функцию можно выбирать из ряда, включающего (но не ограничиваясь ими) повышенную Fc-опосредованную клеточнозависимую цитотоксичность; повышенную способность к связыванию с NK-клетками; повышенную способность к связыванию с макрофагами, повышенную способность к связыванию с полиморфноядерными клетками; повышенную способность к связыванию с моноцитами; повышенную способность к прямой передаче сигналов, индуцирующих апоптоз; повышенное созревание дендритных клеток и повышенное Т-клеточное примирование. В другом варианте осуществления изобретения клетка-хозяин, предлагаемая в настоящем изобретении, содержит по меньшей мере одну нуклеиновую кислоту, которая кодирует полипептид, обладающийGNTIII-активностью, и которая функционально связана с конститутивным промоторным элементом. Следующим объектом изобретения является способ получения АСМ в клетке-хозяине, заключающийся в том, что: (а) культивируют клетку-хозяина, сконструированную таким образом, чтобы она экспрессировала по меньшей мере один полинуклеотид, который кодирует слитый полипептид, обладающий GNTIII-активностью, в условиях, которые позволяют осуществлять производство указанной АСМ и которые позволяют осуществлять модификацию олигосахаридов, присутствующих в Fc-области АСМ; и(б) выделяют указанную АСМ, где АСМ способна конкурировать с мышиным антителом B-Lyl за связывание с CD20 и где АСМ является химерной. В одном из вариантов осуществления изобретения полипептид, обладающий GNTIII-активностью, представляет собой слитый полипептид, который предпочтительно содержит каталитический домен GNTIII и домен локализации в комплексе Гольджи гетерологичного полипептида, присущего комплексу Гольджи, выбранный из ряда, включающего домен локализации маннозидазы II, домен локализации (1,2)-N-ацетилглюкозаминилтрансферазы I (GnTI), домен локализации маннозидазы I, домен локализации (1,2)-N-ацетилглюкозаминилтрансферазы II (GnTII) и домен локализации 1-6 коровой фукозилтрансферазы. Предпочтительно домен локализации в комплексе Гольджи представляет собой домен локализации маннозидазы II или GnTI. Другим объектом изобретения является способ модификации профиля гликозилирования АСМ,связывающейся с CD20, которая продуцируется клеткой-хозяином, заключающийся в том, что в клеткухозяина интродуцируют по меньшей мере одну нуклеиновую кислоту или экспрессионный вектор, предлагаемые в изобретении. В одном из вариантов осуществления изобретения АСМ представляет собой антитело или его фрагмент; предпочтительно содержащие Fc-область IgG. В альтернативном варианте полипептид представляет собой слитый белок, который содержит область, эквивалентную Fc-области человеческого IgG. Одним из объектов изобретения является рекомбинантное химерное антитело или его фрагмент,способные конкурировать с мышиным антителом В-Lyl за связывание с CD20 и имеющие пониженный уровень фукозилирования. Другим объектом настоящего изобретения является способ модификации гликозилирования рекомбинантного антитела или его фрагмента, предлагаемых в изобретении, путем использования слитого полипептида, обладающего GnTII-активностью и содержащего домен локализации в комплексе Гольджи гетерологичного присущего комплексу Гольджи полипептида. В одном из вариантов осуществления изобретения слитые полипептиды, предлагаемые в изобретении, содержат каталитический домен GnTIII. В другом варианте осуществления изобретения домен локализации в комплексе Гольджи выбран из ряда,включающего домен локализации маннозидазы II, домен локализации GnTI, домен локализации маннозидазы I, домен локализации GnTII и домен локализации 1-6 коровой фукозилтрансферазы. Предпочтительно домен локализации в комплексе Гольджи представляет собой домен локализации маннозидазы II или GnTI. В одном из вариантов осуществления изобретения способ, предлагаемый в изобретении, заключается в том, что получают рекомбинантное химерное антитело или его фрагмент, содержащие модифицированные олигосахариды, где модифицированные олигосахариды имеют пониженный уровень гликозилирования по сравнению с немодифицированными олигосахаридами. Согласно настоящему изобретению эти модифицированные олигосахариды могут быть гибридными или комплексными. Согласно другому-8 015009 варианту осуществления изобретения способ, предлагаемый в изобретении, заключается в том, что получают рекомбинантное химерное антитело или его фрагмент, имеющие повышенное содержание бисекционных нефукозилированных олигосахаридов в Fc-области указанного полипептида. В одном из вариантов осуществления изобретения бисекционные нефукозилированные олигосахариды являются гибридными. В другом варианте осуществления изобретения бисекционные нефукозилированные олигосахариды являются комплексными. Еще в одном варианте осуществления изобретения способ, предлагаемый в изобретении, заключается в том, что получают рекомбинантное химерное антитело или его фрагмент, в котором по меньшей мере 20% олигосахаридов в Fc-области указанного полипептида являются бисекционными нефукозилированными. В предпочтительном варианте осуществления изобретения по меньшей мере 30% олигосахаридов в Fc-области указанного полипептида являются бисекционными нефукозилированными. В другом предпочтительном варианте осуществления изобретения по меньшей мере 35% олигосахаридов в Fc-области указанного полипептида являются бисекционными нефукозилированными. Следующим объектом изобретения является рекомбинантное химерное антитело или его фрагмент,которые в результате модификации содержащихся в них олигосахаридов обладают повышенной аффинностью к связыванию с Fc-рецептором и/или повышенной эффекторной функцией. В одном из вариантов осуществления изобретения повышенная аффинность к связыванию представляет собой аффинность к связыванию с активирующим Fc-рецептором. В другом варианте осуществления изобретения Fcрецептор представляет собой активирующий Fc-рецептор, в частности, FcRIIA-рецептор. В контексте настоящего описания подразумевается, что эффекторную функцию можно выбирать из ряда, включающего (но не ограничиваясь ими) повышенную Fc-опосредованную клеточнозависимую цитотоксичность; повышенную способность к связыванию с NK-клетками; повышенную способность к связыванию с макрофагами, повышенную способность к связыванию с полиморфноядерными клетками; повышенную способность к связыванию с моноцитами; повышенную способность к непосредственной передаче сигналов,индуцирующих апоптоз; повышенное созревание дендритных клеток и повышенное Т-клеточное примирование. Другим объектом настоящего изобретения является фрагмент рекомбинантного химерного антитела, обладающий специфичностью к связыванию, свойственной мышиному антителу B-Lyl, и содержащий Fc-область, которая сконструирована с целью повышения эффекторной функции с помощью любого из способов, предлагаемых в настоящем изобретении. Следующим объектом настоящего изобретения является слитый белок, который содержит полипептид, имеющий последовательность SEQ ID NO: 1 и область, эквивалентную Fc-области иммуноглобулина, и который сконструирован с целью повышения эффекторной функции с помощью любого из способов, предлагаемых в настоящем изобретении. Еще одним объектом настоящего изобретения является слитый белок, который содержит полипептид, имеющий последовательность SEQ ID NO: 2 и область, эквивалентную Fc-области иммуноглобулина, и который сконструирован с целью повышения эффекторной функции с помощью любого из способов, предлагаемых в настоящем изобретении. Следующим объектом настоящего изобретения является фармацевтическая композиция, содержащая рекомбинантное химерное антитело, полученное с помощью любого из способов, предлагаемых в настоящем изобретении, и фармацевтически приемлемый носитель. Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая фрагмент рекомбинантного химерного антитела, полученный с помощью любого из способов, предлагаемых в настоящем изобретении, и фармацевтически приемлемый носитель. Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая слитый белок, полученный с помощью любого из способов, предлагаемых в настоящем изобретении, и фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу лечения заболевания, которое можно лечить с помощью В-клеточного истощения, заключающемуся в том, что человеку, нуждающемуся в этом, вводят терапевтически эффективное количество рекомбинантного химерного антитела или его фрагмента, полученного с помощью любого из способов, предлагаемых в настоящем изобретении. Краткое описание чертежей На чертежах показано: на фиг. 1 - нуклеотидная (SEQ ID NO: 3) и аминокислотная (SEQ ID NO: 1) последовательности VHобласти мышиного B-Lyl; на фиг. 2 - нуклеотидная (SEQ ID NO: 4) и аминокислотная (SEQ ID NO: 2) последовательности VLобласти мышиного B-Lyl; на фиг. 3 - связывание Rituximab (О) и ch-BLyl (А) с CD20 на клетках В-лимфомы линии Raji; на фиг. 4 - В-клеточное истощение, вызываемое Rituximab (О) и ch-BLyl (А) в цельной крови трех различных классов генотипа FcRIIIa-158V/F: (A) цельная кровь, полученная от F/F-донора, гомозиготная по рецептору с низкой аффинностью; (Б) цельная кровь, полученная от F/V-донора, гетерозиготная по обладающему аффинностью рецептору; (В) цельная кровь, полученная от V/V-донора, гомозиготная по рецептору с высокой аффинностью;-9 015009 на фиг. 5 - нуклеотидная (SEQ ID NO: 11) и аминокислотная (SEQ ID NO: 13) последовательности тяжелой цепи химерного антитела к CD20; на фиг. 6 - нуклеотидная (SEQ ID NO: 12) и аминокислотная (SEQ ID NO: 14) последовательности легкой цепи химерного антитела к CD20; на фиг. 7 - нуклеотидная и аминокислотная последовательности CDR мышиного антитела B-Lyl;(А) - предсказанные CDR VH-области, (Б) - предсказанные CDR VL-области; на фиг. 8 - MALDI-TOF-профиль химерного антитела B-Lyl, имеющего сконструированную схему гликозилирования; (А) - таблица, в которой представлены процентные содержания специфических пиков; (Б) - спектр химерного B-Lyl, имеющего сконструированную схему гликозилирования; (В) -спектр химерного B-Lyl, имеющего сконструированную схему гликозилирования, после обработки Endo-H; на фиг. 9 - данные о связывании различных гуманизированных антител к CD20 с В-клетками линииRaji. Различия между конструкцией В-НН 2 и конструкциями B-HL8 и B-HL11 сосредоточены в каркасных участках 1 и 2, причем все три CDR являются идентичными. B-HL8 и B-HL11 имеют последовательности FR1 и FR2, выведенные из человеческой вариабельной области тяжелой цепи VH3, в то время как полный каркасный участок В-НН 2 выведен из человеческой VH1. B-HL11 представляет собой производное B-HL8, имеющее одну мутацию GlulGln, где Gln представляет собой аминокислотный остаток в конструкции В-НН 2. Это означает, что замена GlulGln не изменяет аффинность или интенсивность к связыванию. В-НН 2 и B-HL8 различаются также 14 остатками FR, из которых один или несколько могут оказывать влияние на антигенсвязывающую способность рассматриваемого антитела; на фиг. 10 - данные о связывании гуманизированного антитела к CD20 BHL4-KV1 с клеткамимишенями линии Raji. Конструкция BHL4 получена из антитела В-НН 2 путем замены FR1 В-НН 2 соответствующим участком последовательности VH145 человеческой зародышевой линии. Эта конструкция характеризуется существенно более низкой антигенсвязывающей способностью несмотря на то, что она имеет отличные от исходной последовательности аминокислоты только в трех положениях в FR1. Эти остатки находятся в положениях 2, 14 и 30 (согласно нумерации Кэбота). Среди них наиболее сильное влияние, по-видимому, оказывает положение 30, поскольку оно является частью CDR1 согласно определению Хотиа (Chotia); на фиг. 11 - сравнительные данные о связывающей способности В-НН 1, В-НН 2, В-НН 3 и родительского антитела B-Lyl. Из представленных данных видно, что все Ат характеризуются близкими значениями EC50, но конструкция В-НН 1 связывается с более низкой интенсивностью/стехиометрией, чем варианты В-НН 2 и В-НН 3. В-НН 1 отличается от В-НН 2 и В-НН 3 своими частично человеческими участками CDR1 и CDR2 (согласно определению Кэбота), а также полиморфизмом Ala/Thr в положении 28(согласно нумерации Кэбота). Это указывает на то, что положение 28, полный CDR1 и/или полный CDR2 важны для взаимодействия антитело/антиген; на фиг. 12 - сравнительные данные для B-HL1, В-НН 1 и родительского антитела B-Lyl. Данные свидетельствуют о том, что конструкция B-HL1 совсем не обладает связывающей активностью, а связывающая интенсивность/стехиометрия В-НН 1 примерно в два раза меньше, чем B-Lyl. Как B-HL1, так и В-НН 1 сконструированы на основе акцепторных каркасов, выведенных из вариабельных областей человеческой тяжелой цепи VH1-класса. Среди других различий наиболее значительным является различие в положении 71 (согласно нумерации Кэбота) конструкции B-HL1, что свидетельствует о его возможном важном значении для связывания с антигеном; на фиг. 13 - флуороцитометрический анализ антигенсвязывающей способности антитела к CD20. Данные свидетельствуют о том, что конструкции B-HL2 и B-HL3 не обладают CD-20-связывающей активностью; на фиг. 14 - данные об апоптозе моноклональных клеток (MCL) линии Z-138, индуцируемом антителом к CD20; на фиг. 15 - данные об апоптозе, индуцируемом антителом к CD20. Детали анализа: высевали 5105 клеток/лунку в 24-луночные планшеты (5105 клеток/мл) в культуральную среду. В лунки добавляли 10 мг соответствующего Ат, ЗФР в качестве негативного контроля или 5 мМ камптотецин (СРТ) в качестве позитивного контроля. Образцы инкубировали в течение ночи (16 ч), окрашивали с помощью AnnVФИТЦ и анализировали с помощью FACS. Анализ осуществляли в 3-х повторностях. : вычитали сигнал, соответствующий только ЗФР (применение только ЗФР приводило к появлению 8 и 2% AnnV+ дляPR-1- и Z-138-клеток соответственно). Использовали следующие антитела: С 2 В 8 (химерное, не имеющее сконструированную схему гликозилирования; BHH2-KV1 (гуманизированное, не имеющее сконструированную схему гликозилирования). Примечание: в этом анализе не применяли какие-либо дополнительные эффекторные клетки, а только клетки-мишени плюс антитело или контроли; на фиг. 16 - данные об уничтожении клетки-мишени антителами к CD20 с помощью иммунокомпетентных эффекторных клеток. Детали анализа: В-клеточное истощение в цельной крови здоровых доноров осуществляли путем инкубации в течение ночи и анализировали в отношении CD19+/CD3+ с помощью FACS. ADCC оценивали с использованием РВМС в качестве эффекторов, инкубация в течение 4 ч, соотношение эффектора:мишени 25:1, уничтожение клеток-мишеней оценивали по удерживанию- 10015009 кальцеина по сравнению с лизисом с помощью детергента (100%) и с лизисом без Ат (0%). Применяемые антитела: С 2 В 8 (химерная, не имеющая сконструированную схему гликозилирования форма); BHH2KVl-wt (гуманизированная, не имеющая сконструированную схему гликозилирования форма BHH2KV1); BHH2-KV1-GE (гуманизированная, имеющая сконструированную схему гликозилирования форма антитела BHH2-KV1); на фиг. 17 - MALDI/TOF-MC-профиль выделившихся после обработки PNGaзойF Fcолигосахаридов (олигосахаридов из Fc-области) немодифицированного, не имеющего сконструированную схему гликозилирования гуманизированного IgGl B-lyl антитела к человеческому CD20, BHH2KV1; на фиг. 18 - MALDI/TOF-MC-профиль выделившихся после обработки PNGaзойF Fcолигосахаридов имеющего сконструированную схему гликозилирования гуманизированного IgGl B-lyl антитела к человеческому CD20, BHH2-KV1gl. Конструирование схемы гликозилирования осуществляли путем совместной экспрессии в клетках-хозяевах генов антител и гена, кодирующего фермент с каталитической активностью -1,4-N-ацетилглюкозаминилтрансферазы III (GnT-III); на фиг. 19 - MALDI/TOF-MC-профиль выделившихся после обработки PNGазойF Fcолигосахаридов имеющего сконструированную схему гликозилирования гуманизированного IgG1 B-lyl антитела к человеческому CD20, BHH2-KV1g2. Конструирование схемы гликозилирования осуществляли путем совместной экспрессии в клетках-хозяевах генов антител и генов, кодирующих фермент с каталитической активностью -l,4-N-ацетилглюкозаминилтрансферазы III (GnT-III) и кодирующих фермент с каталитической активностью -маннозидазы II комплекса Гольджи; на фиг. 20 - данные о связывании не имеющих сконструированную схему гликозилирования и имеющих сконструированную схему гликозилирования антител к человеческому FcIIIa-рецептору, находящемуся на поверхности рекомбинантных СНО-СD16-клеток; на фиг. 21 - данные об апоптозе не имеющих сконструированную Fc-область и имеющих сконструированную Fc-область антител к CD20 на моноклональных клетках линии Z-138. Детали анализа: высевали 5105 клеток/лунку в 24-луночные планшеты (5105 клеток/мл) в культуральной среде. В лунки добавляли 10 мг соответствующего Ат, ЗФР в качестве негативного контроля. Образцы инкубировали в течение ночи (16 ч), окрашивали с помощью AnnV-ФИТЦ и анализировали с помощью FACS. Анализ осуществляли в 3 повторностях. Применяемые Ат: С 2 В 8 = ритуксимаб (химерная не имеющая сконструированную схему гликозилирования форма, аналогичная поступающей в продажу форме; BHH2-KV1(гуманизированное не имеющее сконструированную схему гликозилирования (см. на фиг. 6 профиль гликозилирования); BHH2-KV1gl (гуманизированное имеющее сконструированную схему гликозилирования (см. на фиг. 7 профиль гликозилирования); BHH2-KV1g2 (гуманизированное не имеющее сконструированную схему гликозилирования (см. на фиг. 8 профиль гликозилирования). Примечание: в этом анализе не применяли какие-либо дополнительные эффекторные клетки, а только клетки-мишени плюс антитело или контроли. : Вычитали сигнал, соответствующий только ЗФР. Подробное описание изобретения Понятия, применяемые в контексте настоящего описания, соответствуют общепринятым в данной области, если не указано иное. В контексте настоящего описания понятие антитело относится к полным молекулам антител,включая моноклональные, поликлональные и мультиспецифические (например биспецифические) антитела, а также фрагменты антител, которые имеют Fc-область и сохраняют специфичность связывания, и к слитым белкам, которые включают область, эквивалентную Fc-области иммуноглобулина и которые сохраняют специфичность связывания. Под понятие подпадают гуманизированные, приматизированные и химерные антитела. В контексте настоящего описания понятие Fc-область относится к С-концевой области тяжелой цепи IgG. Хотя примыкающие к Fc-области участки тяжелой цепи IgG могут слегка различаться, Fcобласть тяжелой цепи человеческого IgG, как правило, представляет собой участок цепи от аминокислоты Cys226 до карбоксильного конца. В контексте настоящего описания понятие область, эквивалентная Fc-области иммуноглобулина относится к встречающимся в естественных условиях аллельным вариантам Fc-области иммуноглобулина, а также вариантам, имеющим изменения, которые получают в результате замен, добавлений или делеций, но которые не снижают в значительной степени способность иммуноглобулина опосредовать эффекторные функции (такие как антителозависимая клеточно-обусловленная цитотоксичность). Например, одну или несколько аминокислот можно изымать путем делеций из N-конца или С-конца Fc-области иммуноглобулина без существенного снижения биологической функции. Такие варианты можно отбирать согласно общим правилам, которые известны в данной области, так, чтобы оказывать минимальное воздействие на активность (см., например, Bowie J. U. и др., Science 247, 1990, cc. 1306-1310). В контексте настоящего описания понятие антигенсвязывающая молекула в наиболее широком смысле относится к молекуле, которая специфически связывает антигенную детерминанту. Более конкретно понятие антигенсвязывающая молекула, которая связывает CD20 обозначает молекулу, которая- 11015009 специфически связывается с находящимся на клеточной поверхности негликозилированным фосфопротеином с молекулярной массой 35000 Да, который обычно называют консервативным дифференцировочным антигеном человеческих В-лимфоцитов Вр 35, который, как правило, называют CD20. Понятие специфически связывается означает, что связывание является избирательным в отношении антигена и его можно отличать от нежелательных или неспецифических взаимодействий. В контексте настоящего описания понятия слитый и химерный касательно полипептидов, таких как АСМ относится к полипептидам, которые содержат аминокислотные последовательности, выведенные из двух или большего количества гетерологичных полипептидов, таких как фрагменты антител из различных видов. Для химерных АСМ, например, несвязывающие антиген компоненты можно получать из широкого разнообразия видов, включая приматов, таких как шимпанзе и люди. Константная область химерной АСМ наиболее предпочтительно является практически идентичной константной области встречающегося в естественных условиях человеческого антитела; вариабельная область химерного антитела наиболее предпочтительно практически идентична вариабельной области рекомбинантного антитела к CD20, которое имеет аминокислотную последовательность вариабельной области мышиного антитела B-Lyl. Гуманизированные антитела являются наиболее предпочтительной формой слитого или химерного антитела. В контексте настоящего описания понятие полипептид, обладающий GnTIII-активностью относится к полипептидам, которые обладают способностью катализировать добавление остатка Nацетилглюкозамина (GlcNAc) в -1-4-связи к -связанному маннозиду триманнозильного ядра Nсвязанных олигосахаридов. Понятие относится к слитым полипептидам, которые обладают ферментативной активностью подобной, но не обязательно идентичной, активности(1,4)-Nацетилглюкозаминилтрансферазы III, также известной под названием -1,4-маннозил-гликопротеин-4 бета-N-ацетилглюкозаминилтрансфераза (КФ 2.4.1.144) согласно номенклатуре Комитета Международного союза по биохимии и молекулярной биологии (Committee of the International Union of Biochemistryand Molecular Biology (NC-IUBMB, при оценке с помощью конкретного биологического анализа как в случае зависимости от дозы, так и без зависимости от дозы. В случае, когда существует зависимость от дозы, фермент не обязательно должен быть идентичен GnTIII, а скорее должен быть практически подобен в отношении зависимости данной активности от дозы по сравнению с GnTIII (т.е. полипептидкандидат должен обладать более высокой активностью или не более чем при мерно в 25 раз пониженной активностью, предпочтительно не более чем примерно в 10 раз пониженной активностью, и еще более предпочтительно не более чем примерно в 3 раза пониженной активностью по сравнению с GnTIII) В контексте настоящего описания понятие вариант (или аналог) относится к полипептиду, который отличается от конкретного указанного полипептида, предлагаемого в изобретении, наличием аминокислотных инсерций, делеций и замен, созданных например, с помощью метода рекомбинантной ДНК. Варианты АСМ, предлагаемые в настоящем изобретении, включают химерные, приматизированные или гуманизированные антигенсвязывающие молекулы, в которых один или несколько аминокислотных остатков модифицированы путем замены, добавления и/или делеций таким образом, что это не оказывает существенного воздействия на аффинность связывания с антигеном (например CD20). Для решения вопроса о том, какие аминокислотные остатки можно заменять, добавлять или удалять без снижения представляющих интерес видов активности, можно осуществлять сравнение последовательности конкретного полипептида с последовательностью гомологичных пептидов, и минимизируя количество замен в аминокислотной последовательности в областях высокой гомологии (консервативные области),или путем замены аминокислот консенсусной последовательностью. В другом случае рекомбинантные варианты, кодирующие эти же или подобные полипептиды, можно синтезировать или отбирать на основе избыточности генетического кода. Различные замены кодонов, такие как молчащие замены, которые приводят к получению различных сайтов рестрикции, можно интродуцировать с целью оптимизации клонирования в плазмидном или вирусном векторе или экспрессии в конкретной прокариотической или эукариотической системе. Мутации в полинуклеотидной последовательности могут проявляться в полипептиде или доменах других пептидов, добавленных к полипептиду для модификации свойств любого фрагмента полипептида с целью изменения характеристик, таких как аффинность к связыванию лиганда, внутрицепочечная аффинность или скорость расщепления/обновления. Предпочтительно аминокислотные замены являются результатом замены одной аминокислоты другой аминокислотой, которая имеет сходные структурные и/или химические свойства, т.е. консервативные аминокислотные замены. Консервативные аминокислотные замены можно создавать на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природы участвующих в этом остатков. Например, к неполярным (гидрофобным) аминокислотам относятся аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; к полярным нейтральным аминокислотам относятся глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; к положительно заряженным (основным) аминокислотам относятся аргинин, лизин и гистидин; и к отрицательно заряженным (кислотным) аминокислотам относятся аспарагинованя кислота и глутаминовая- 12015009 кислота. Инсерции или делеции предпочтительно затрагивают примерно 1-20 аминокислот, более предпочтительно 1-10 аминокислот. Приемлемую вариацию можно определять экспериментально, создавая систематически инсерции, делеции или замены аминокислот в полипептидной молекуле с помощью методов рекомбинантной ДНК и анализируя активность полученных рекомбинантных вариантов. В контексте настоящего описания понятие гуманизированный относится к антигенсвязывающей молекуле, полученной из антигенсвязывающей молекулы из организма кроме человека, например к мышиному антителу, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для людей. Это можно достигать с различных методов, которые включают (а) трансплантацию полных нечеловеческих вариабельных областей в человеческие константные области с получением химерных антител, (б) трансплантацию нечеловеческихCDR в человеческие каркасные и константные области с сохранением имеющих решающее значение остатков каркасного участка (например остатков, важных для сохранения хорошей аффинности к связыванию антигена или функций антитела) или без их сохранения, или (в) трансплантацию полных нечеловеческих вариабельных областей, но с их маскировкой участком, напоминающим человеческий, путем замены находящихся на поверхности остатков. Такие методы описаны у Jones и др., Morrison и др., Proc.Natl. Acad. Sci., 81, 1984, cc. 6851-6855; Morrison и Oi, Adv. Immunol., 44, 1988, cc. 65-92; Verhoeyen и др.,Science, 239, 1988, cc. 1534-1536; Padlan, Molec. Immun., 28, 1991, cc. 489-498; Padlan, Molec. Immun.,31(3), 1994, cc. 169-217, все указанные публикации полностью включены в настоящее описание в качестве ссылки. В каждой из вариабельных областей тяжелой и легкой цепи антитела присутствует 3 гипервариабельных участка или CDR (CDR1, CDR2 и CDR3), которые фланкированы четырьмя каркасными подобластями (участками) (т.е. FR1, FR2, FR3 и FR4) в каждой из вариабельных областей тяжелой и легкой цепи антитела: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. Обсуждение гуманизированных антител представлено среди прочего в US 6632927 и в опубликованной заявке на патент США 2003/0175269, оба документа полностью включены в настоящее описание в качестве ссылки. Аналогично этому, в контексте настоящего описания понятие приматизированный относится к антигенсвязывающей молекуле, полученной из антигенсвязывающей молекулы организма кроме примата, например, к мышиному антителу, которая сохраняет или практически сохраняет антигенсвязывающие свойства родительской молекулы, но которая является менее иммуногенной для приматов. В случае, когда в данной области применяют и/или являются приемлемыми два или более определений понятия, то в контексте настоящего описания подразумевается, что применяемое определение включает все такие значения, если специально не указано иное. Конкретным примером является применение понятия гипервариабельный участок (CDR) для описания не соприкасающихся антигенсвязывающих центров, присутствующих в полипептидах вариабельной области как тяжелой, так и легкой цепи. Этот конкретный участок описан у Kabat и др., Sequences Proteins of Immunological Interest, изд-воU.S. Dept. of Health and Human Services, (1983) и Chothia и др., J. Mol. Biol. 196, 1987, cc. 901-917, публикации включены в настоящее описание в качестве ссылки, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков, при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения к CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в табл. I. Точные номера остатков, которые образуют конкретный CDR, должны варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области легко могут определить, какие остатки входят в конкретный CDR, на основе данных о аминокислотной последовательности вариабельной области антитела. Таблица 1. Определения CDR Нумерация всех входящих в CDR остатков в табл. 1 дана в соответствии с нумерацией, предложенной Кэботом и др. (см. ниже). Кэбот и др. предложили также систему нумерации последовательностей вариабельных областей,которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему нумерации по Кэботу для последовательности любой вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие нумерация по Кэботу относится к системе нумерации, описанной у Kabat и др., Sequence of Proteins of Immunological Interest, изд-во US Dept. of Health and Human Ser- 13015009vices, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в АСМ даны в соответствии с системой нумерации по Кэботу. Нумерация в последовательностях,представленных в перечне последовательностей (т.е. SEQ ID NO: 1-SEQ ID NO: 78) не соответствует системе нумерации по Кэботу. В контексте настоящего описания понятие нуклеиновая кислота или полинуклеотид, имеющие нуклеотидную последовательность по меньшей мере например, на 95% идентичную нуклеотидной последовательности, предлагаемой в настоящем изобретении, с которой проводят сравнение (референспоследовательность) означает, что нуклеотидная последовательность полинуклеотида идентична референс-последовательности за исключением того, что полинуклеотидная последовательность может включать до пяти точковых мутаций на каждые 100 нуклеотидов нуклеотидной референс-последовательности. Другими словами, для получения полинуклеотида, имеющего нуклеотидную последовательность, идентичную по меньшей мере на 95% нуклеотидной референс-последовательности, можно изымать путем делеции или заменять другими нуклеотидами вплоть до 5% нуклеотидов референс-последовательности или вплоть до 5% от общего количества нуклеотидов в референс-последовательности можно встраивать в референс-последовательность. Эталонная последовательность может представлять собой полную последовательность, представленную на фиг. 24 или 25. С практической точки зрения определять, являются ли любая конкретная молекула нуклеиновой кислоты или полипептид по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентичными нуклеотидной последовательности или полипептидной последовательности, предлагаемой в настоящем изобретении, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения эталонной последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательности, можно использовать компьютерную программу FASTDB, основанную на алгоритме Brutlag и др., Соmр. Арр. Biosci. 6, 1990, cc. 237-245. При сравнительном анализе последовательностей как эталонная, так и анализируемая последовательности, обе представляют собой последовательности ДНК. Последовательности РНК можно сравнивать путем замены остатков U на Т. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами для расчета процента идентичности, используемыми в программе FASTDB сравнительного анализа последовательностей ДНК являются: матрица = унитарная, k-запись в базе данных = 4, штраф за несовпадение = 1, штраф за присоединение = 30, длина рандомизированной группы = 0, балл за срезание = 1,штраф за брешь = 5, штраф за размер бреши 0,05, размер окна = 500 или длина анализируемой нуклеотидной последовательности, если она короче. Если анализируемая последовательность короче эталонной последовательности вследствие наличия делеций на 5'- или 3'-конце, но не вследствие внутренних делеций, то результаты можно скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на 5'- и 3'-конце анализируемой последовательности при расчете процента идентичности. Для анализируемых последовательностей, укороченных на 5'- или 3'-концах по отношению к эталонной последовательности, процент идентичности корректируют путем вычисления количества оснований эталонной последовательности,расположенных за 5'- и 3'-концами анализируемой последовательности, которые не совпали/не проанализированы, в виде процента от общего количества оснований эталонной последовательности. Совпадают ли/проанализированы ли нуклеотиды, определяется результатами сравнительного анализа последовательностей с помощью программы FASTDB. Затем этот процент вычитают из процента идентичности,рассчитанного с помощью указанной выше программы FASTDB с использованием указанных заданных параметров, в результате чего получают окончательную оценку процента идентичности. Эту скорректированную оценку используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности рассчитывают только основания, расположенные за 5'- и 3'-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программыFASTDB, которые не совпадали/не проанализированы с эталонной последовательностью. Например, для определения процента идентичности анализируемую последовательность длиной 90 оснований сравнивают с эталонной последовательностью длиной 100 оснований. На 5'-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения/анализировать 10 первых оснований на 5'-конце. 10 неспаренных оснований представляют собой 10% последовательности (количество несовпавших оснований на 5'- и 3'концах/общее количество оснований в эталонной последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 оснований идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность длиной 90 оснований сравнивают с эталонной последовательностью длиной 100 оснований. В данном случае делеции представляют собой внутренние делеции, так что на 5'- или 3'-конце анализируемой последовательности не имеется оснований, которые не совпадали/не проанализированы с эталоном. В этом случае процент идентичности, рассчитанный с помощью- 14015009 программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что вручную осуществляют коррекцию только для оснований, которые не совпали/не проанализированы на 5'- и 3'-концах анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций. Подразумевается, что у полипептида, имеющего аминокислотную последовательность, по меньшей мере, например, на 95% "идентичную" эталонной аминокислотной последовательности, предлагаемой в настоящем изобретении, аминокислотная последовательность идентична эталонной последовательности за исключением того, что анализируемая последовательность полипептида может иметь вплоть до пяти аминокислотных изменений на каждые 100 аминокислот эталонной последовательности. Другими словами для того, чтобы получить полипептид, аминокислотная последовательность которого по меньшей мере на 95% идентична эталонной аминокислотной последовательности, можно встраивать, изымать путем делеции или заменять другой аминокислотой вплоть до 5% аминокислотных остатков анализируемой последовательности. Эти изменения по сравнению с референс-последовательностью могут иметь место в N- или С-концевых положениях эталонной аминокислотной последовательности или в любом положении между этими концами, в виде изменений, либо распределенных индивидуально между остатками референс-последовательности, либо в виде одной или нескольких непрерывных групп в референспоследовательности. С практической точки зрения определять, является ли любой конкретный полипептид по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентичным референс-полипептиду, можно с помощью известных широко используемых компьютерных программ. В качестве предпочтительного метода для определения наилучшего общего совпадения эталонной последовательности (последовательность, предлагаемая в настоящем изобретении) и анализируемой последовательности, который также обозначают как метод глобального сравнительного анализа последовательности, можно использовать компьютерную программу FASTDB, основанную на алгоритме Brutlag и др., Comp. Арр. Biosci. 6, 1990, cc. 237-245. При сравнительном анализе последовательностей как эталонная, так и анализируемая последовательности либо обе представляют собой нуклеотидные последовательности, либо обе представляют собой аминокислотные последовательности. Результатом указанного глобального сравнительного анализа последовательностей является процент идентичности. Предпочтительными параметрами, используемыми в программеFASTDB сравнительного анализа аминокислотных последовательностей для расчета процента идентичности являются: матрица=РАМ 0, k-запись в базе данных=2, штраф за несовпадение=1, штраф за присоединение =20, длина рандомизированной группы=0, балл за срезание=1, размер окна=длина последовательности, штраф за брешь=5, штраф за размер бреши 0,05, размер окна=500 или длина анализируемой аминокислотной последовательности, если она короче. Если анализируемая последовательность короче эталонной последовательности вследствие наличия делеций на N'- или С'-конце, но не вследствие внутренних делеций, то результаты можно скорректировать вручную. Это обусловлено тем, что программа FASTDB не учитывает укорочения на N'- и С'-конце при расчете процента идентичности. Для анализируемых последовательностей, укороченных на N'- или С'-концах по отношению к эталонной последовательности, процент идентичности корректируют путем вычисления количества остатков эталонной последовательности, выступающих за N'- и С'-концы анализируемой последовательности, которые не совпали/не проанализированы, в виде процента от общего количества оснований эталонной последовательности. Совпадают ли остатки при сравнительном анализе, определяется результатами сравнительного анализа последовательностей с помощью программыFASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью указанной выше программы FASTDB с использованием указанных параметров, в результате чего получают окончательную оценку процента идентичности. Эту скорректированную оценку используют для целей настоящего изобретения. Для целей ручной коррекции оценки процента идентичности рассчитывают только остатки, расположенные за N'- и С'-концами анализируемой последовательности, выявленные с помощью сравнительного анализа с использованием программы FASTDB, которые не совпадают при сравнительном анализе с эталонной последовательностью. Т.е. учитывают только положения эталонных остатков вне наиболее удаленных N- и С-концевых остатков анализируемой последовательности. Например, для определения процента идентичности анализируемую аминокислотную последовательность, содержащую 90 остатков, сравнивают с эталонной последовательностью, содержащей 100 остатков. На N'-конце анализируемой последовательности имеются делеции и поэтому сравнительный анализ с помощью FASTDB не позволяет устанавливать совпадения при сравнительном анализе для 10 первых остатков на N'-конце. 10 несовпавших остатков представляют собой 10% последовательности(количество несовпавших остатков на N'- и С'-концах/общее количество остатков в эталонной последовательности), таким образом, 10% вычитают из оценки процента идентичности, рассчитанного с помощью программы FASTDB. Если остальные 90 остатков идеально совпадают, то окончательный процент идентичности составляет 90%. В другом примере анализируемую последовательность, содержащую 90 остатков, сравнивают с эталонной последовательностью, содержащей 100 остатков. В данном случае делеции представляют собой внутренние делеции, так что на N'- или С'-конце анализируемой последовательности не имеется остатков, которые не совпадают при сравнительной анализе с эталоном. В этом- 15015009 случае процент идентичности, рассчитанный с помощью программы FASTDB, не корректируют вручную. Еще раз следует подчеркнуть, что вручную осуществляют коррекцию только для несовпавших/не проанализированных остатков на N'- и С'-концах анализируемой последовательности. Для целей настоящего изобретения не проводят никаких других коррекций. В контексте настоящего описания понятие нуклеиновая кислота, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, предлагаемой в изобретении, относится к полинуклеотиду, который гибридизуется при инкубации в течение ночи при 42 С в растворе, содержащем 50% формамида, 5SSC (750 мМ NaCl, 75 мМ цитрат натрия), 50 мМ фосфат натрия (рН 7,6), 5 раствор Денхардта, 10% сульфата декстрана и 20 мкг/мл недатурированной, гидродинамически фрагментированной ДНК из спермы лосося, с последующей отмывкой фильтров в 0,1SSC примерно при 65 С. В контексте настоящего описания понятие домен локализации в комплексе Гольджи относится к аминокислотной последовательности расположенного в комплексе Гольджи полипептида, который ответствен за заякоривание полипептида в области внутри комплекса Гольджи. Как правило, домены локализации содержат аминоконцевые хвосты фермента. В контексте настоящего описания понятие эффекторная функция относится к видам биологической активности, присущим Fc-области (нативная последовательность Fc-области или аминокислотная последовательность варианта Fc-области) антитела. Примерами эффекторных функций антитела являются (но не ограничиваясь ими) аффинность к связыванию с Fc-рецептором, антителозависимая клеточноопосредованная цитотоксичность (ADCC), антителозависимый клеточно-опосредованный фагоцитоз(ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, понижающая регуляция рецепторов клеточной поверхности и т.д. В контексте настоящего описания понятие конструкция, сконструированный (созданный),конструирование (создание) и сконструированная схема гликозилирования относятся к любой манипуляции, которой подвергают схему гликозилирования встречающегося в естественных условиях или рекомбинантного полипептида или его фрагмента. Конструирование схемы гликозилирования включает метаболическое конструирование механизма гликозилирования клетки, в том числе генетические манипуляции, касающиеся путей олигосахаридного синтеза, с целью получения измененного гликозилирования гликопротеинов, экспрессируемых в клетках. Кроме того, конструирование схемы гликозилирования включает воздействия мутаций и клеточного окружения на гликозилирование. В контексте настоящего описания понятие клетка-хозяин относится к любой клеточной системе,которую можно сконструировать для производства полипептидов и антигенсвязывающих молекул, предлагаемых в настоящем изобретении. Согласно одному из вариантов осуществления изобретения клеткухозяина конструируют так, чтобы с ее помощью получать антигенсвязывающую молекулу с модифицированными гликоформами. В предпочтительном варианте осуществления изобретения антигенсвязывающая молекула представляет собой антитело, фрагмент антитела или слитый белок. В конкретных вариантах осуществления изобретения клетки-хозяева подвергали дополнительным манипуляциям для экспрессии повышенных уровней одного или нескольких полипептидов, обладающих GnTIIIактивностью. Клетки-хозяева представляют собой культивируемые клетки, например культивируемые клетки млекопитающих, такие как СНО-клетки, ВНК-клетки, NSO-клетки, SP2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р 3 Х 63, PER-клетки, PER.С 6-клетки или клетки гибридомы, клетки дрожжей, клетки насекомых и растительные клетки, а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В контексте настоящего описания понятие Fc-зависимая клеточно-опосредованная цитотоксичность относится к антителозависимой клеточно-опосредованной цитотоксичности и клеточнозависимой, опосредованной растворимым слитым с Fc белком, который содержит человеческую Fc-область. Это представляет собой механизм иммунитета, приводящий к лизису меченных антителом клеток человеческими иммунокомпетентными эффекторными клетками, где: Понятие человеческие иммунокомпетентные эффекторные клетки означает популяцию лейкоцитов, несущих на поверхности Fc-рецепторы, с помощью которых они связываются с Fc-областью антител или слитыми с Fc белками и осуществляют эффекторные функции. Такая популяция может включать (но не ограничиваясь ими) периферические мононуклеарные клетки (РВМС) и/или естественные клеткикиллеры (NK). Понятие меченные антителом клетки относится к клеткам, которые связаны с антителами или слитыми с Fc белками. Антитела или слитые с Fc белки связываются с клетками-мишенями посредствомN-концевого по отношению к Fc-области фрагмента белка. В контексте настоящего описания понятие повышенная Fc-зависимая клеточно-опосредованная цитотоксичность относится к любому увеличению количества меченных антителом клеток, подвергнутых лизису в данный момент времени при данной концентрации антитела или слитого с Fc белка, в среде, окружающей клетки-мишени, с помощью указанного выше механизма Fc-опосредованной клеточ- 16015009 нозависимой цитотоксичности и/или снижению концентрации антитела или слитого с Fc белка в среде,окружающей клетки-мишени, необходимой для лизиса данного количества меченных антителом клеток в данный момент времени с помощью механизма Fc-опосредованной клеточнозависимой цитотоксичности. Понятие повышение уровня Fc-опосредованной клеточнозависимой цитотоксичности оценивают относительно клеточнозависимой цитотоксичности, опосредованной одним и тем же антителом или слитым с Fc белком, продуцированным в одном и том же типе клеток-хозяев, с использованием одних и тех же стандартных методов получения, очистки, приготовления композиций и хранения, которые хорошо известны специалистам в данной области, но которое не продуцировалось клеткой-хозяином, сконструированной для экспрессии гликозилтрансферазы GnTIII с помощью способов, представленных в настоящем описании. Понятие антитело, обладающее повышенной антителозависимой клеточно-опосредованной цитотоксичностью (ADCC) означает антитело, как оно определено выше, которое обладает повышеннойADCC при определении с помощью любого приемлемого метода, известного обычным специалистам в данной области. Один из приемлемых методов анализа in vitro ADCC заключается в том, что: 1) для анализа применяют клетки-мишени, для которых известно, что они экспрессируют антигенмишень, распознаваемый антигенсвязывающим центром антитела; 2) для анализа в качестве эффекторных клеток используют человеческие мононуклеарные клетки периферической крови (РВМС), выделенные из крови произвольно выбранных здоровых доноров; 3) анализ осуществляют с помощью следующего протокола:I) РВМС выделяют с помощью стандартных методов центрифугирования в градиенте плотности и суспендируют 5106 клеток/мл в RPMI-среде для культуры клеток;II) выращивают клетки-мишени с помощью стандартных методов культуры тканей, собирают на экспоненциальной фазе роста, когда жизнеспособность составляет более 90%, промывают в RPMI-среде для культуры клеток, меченной 100 мкКи 51Cr, дважды промывают с помощью среды для культуры клеток и ресуспендируют в среде для культуры клеток с плотностью 105 клеток/мл;III) переносят по 100 мкл указанной выше конечной суспензии клеток-мишеней в каждую лунку 96 луночного титрационного микропланшета;IV) готовят серийные разведения с концентрацией антител от 4000 до 0,04 нг/мл в среде для культуры клеток и добавляют 50 мкл образовавшихся растворов антител к клеткам-мишеням в 96-луночном титрационном микропланшете, оценивая в трех повторностях различные концентрации антител во всем указанном выше диапазоне концентраций;V) для создания контролей с максимальным высвобождением (MR) используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл 2 об.% водного раствора неионогенного детергента (Nonidet, фирма Sigma, Сент-Луис), вместо раствора антитела (указанного в п.IV, выше);VI) для создания контролей со спонтанным высвобождением (SR) используют 3 дополнительные лунки в планшете, которые содержат меченые клетки-мишени, с добавлением 50 мкл RPMI-среды для культуры клеток вместо раствора антитела (указанного в п.IV, выше);VII) затем 96-луночный титрационный микропланшет центрифугируют при 50g в течение 1 мин и инкубируют в течение 1 ч при 4 С;VIII) добавляют в каждую лунку по 50 мкл суспензии РВМС (указанной в п.I, выше), получая соотношение эффекторная клетка:клетка-мишень 25:1, и планшеты помещают в инкубатор в атмосферу 5% СО 2 и выдерживают при 37 С в течение 4 ч;IX) собирают бесклеточный супернатант из каждой лунки и количественно оценивают выделенную в процессе эксперимента радиоактивность (ER) с помощью счетчика гамма-лучей;X) рассчитывают процент специфического лизиса для каждой концентрации антитела согласно формуле (ER-MR)/(MR-SR)100, где ER обозначает среднюю радиоактивность, рассчитанную (см. п.IX,выше) для указанной концентрации антитела, MR означает среднюю радиоактивность, рассчитанную(см. п.IX, выше) для MR-контролей (см. п.V, выше), a SR означает среднюю радиоактивность, рассчитанную (см. п.IX, выше) для SR-контролей (см. п.VI, выше); 4) повышенную ADCC определяют либо как увеличение максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела, и/или как снижение концентрации антитела, необходимой для достижения 1/2 максимального процента специфического лизиса, обнаруженного для указанного выше диапазона концентраций антитела. Повышение ADCC оценивают относительно ADCC, опосредованной одним и тем же антителом, продуцированным в одном и том же типе клеток-хозяев, с использованием одних и тех же стандартных методов получения, очистки, приготовления композиций и хранения, которые хорошо известны специалистам в данной области, но которое не продуцировалось клеткой-хозяином, сконструированной для сверхэкспрессии GnTIII. Один из объектов настоящего изобретения относится к антигенсвязывающим молекулам, обладающим специфичностью связывания, соответствующей специфичности мышиного антитела B-Lyl, и он основан на установленном при создании изобретения факте, что их эффекторные функции можно усили- 17015009 вать путем изменения гликозилирования. Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула представляет собой химерное антитело. Предпочтительным вариантом осуществления изобретения является химерное антитело или его фрагмент, которые содержат CDR,представленные на фиг. 7. В частности, предпочтительным вариантом осуществления изобретения является выделенный полинуклеотид, который содержит: (а) последовательность, выбранную из ряда, включающего SEQ ID NO: 5, SEQ ID NO: 6 и SEQ ID NO: 7 (CDR VH-1); и (б) последовательность, выбранную из группы, включающей: SEQ ID NO: 21, SEQ ID NO: 22 и SEQ ID NO: 23 (CDR VH-2); и SEQ ID NO: 24. Другим предпочтительным вариантом осуществления изобретения является выделенный полинуклеотид,который содержит SEQ ID NO: 8, SEQ ID NO: 9 и SEQ ID NO: 10 (CDR VL). Согласно одному из вариантов осуществления изобретения все эти полинуклеотиды кодируют слитый полипептид. Согласно другому варианту осуществления изобретения антигенсвязывающая молекула содержитVH-область мышиного антитела B-Lyl, представленную на фиг. 1, или ее вариант; и немышиный полипептид. Следующим предпочтительным вариантом осуществления изобретения является антигенсвязывающая молекула, которая содержит VL-область мышиного антитела B-Lyl, представленную на фиг. 2,или ее вариант; и немышиный полипептид. Еще одним объектом изобретения являются антигенсвязывающие молекулы, которые содержат один или несколько укороченных CDR антитела BLy-1. Такие укороченные CDR должны содержать, как минимум, определяющие специфичность аминокислотные остатки данного CDR. Под определяющим специфичность остатком понимают остатки, которые непосредственно участвуют во взаимодействии с антигеном. В целом, только от 1/5 до 1/3 остатков в данном CDR принимает участие в связывании с антигеном. Определяющие специфичность остатки в каждом конкретном CDR можно идентифицировать,например, путем вычисления внутриатомных контактов на трехмерной модели структуры и определения вариабельности последовательности в данном положении остатков согласно методу, описанному у Padlan и др., FASEB J. 9(1), 1995, cc. 133-139, содержание публикации полностью включено в настоящее описание в качестве ссылки. Таким образом, изобретение относится также к выделенному полинуклеотиду, который содержит по меньшей мере один гипервариабельный участок мышиного антитела B-Lyl или его вариант или укороченную форму, которые содержат, по меньшей мере, определяющие специфичность остатки указанного гипервариабельного участка, где выделенный полинуклеотид кодирует слитый полипептид. Предпочтительно указанные выделенные полинуклеотиды кодируют слитый полипептид, который представляет собой антигенсвязывающую молекулу. Согласно одному из вариантов осуществления изобретения полинуклеотид несет три гипервариабельных участка мышиного антитела B-Lyl или их варианты или укороченные формы, содержащие, по меньшей мере, определяющие специфичность остатки каждого из трех гипервариабельных участков. Согласно другому варианту осуществления изобретения полинуклеотид кодирует полную вариабельную область легкой или тяжелой цепи химерного (например, гуманизированного) антитела. Изобретение относится также к полипептидам, кодируемым указанными полинуклеотидами. Следующим вариантом осуществления изобретения является антигенсвязывающая молекула, которая несет по меньшей мере один гипервариабельный участок мышиного антитела B-Lyl или его вариант или укороченную форму, которые содержат по меньшей мере определяющие специфичность остатки указанного гипервариабельного участка и которые содержат последовательность, выведенную из гетерологичного полипептида. Согласно одному из вариантов осуществления изобретения антигенсвязывающая молекула несет три гипервариабельных участка мышиного антитела B-Lyl или их варианты или укороченные формы, содержащие, по меньшей мере, определяющие специфичность остатки каждого из трех указанных гипервариабельных участков. Согласно другому варианту осуществления изобретения антигенсвязывающая молекула содержит вариабельную область легкой или тяжелой цепи антитела. Согласно одному из предпочтительных вариантов осуществления изобретения антигенсвязывающая молекула представляет собой химерное (например гуманизированное) антитело. Изобретение относится также к способам получения таких антигенсвязывающих молекул и к их применению для лечения заболевания,включая В-клеточные лимфомы. Известно несколько механизмов, которые обусловливают терапевтическую эффективность антител к CD20, включая антителозависимую клеточно-опосредованную цитотоксичность (ADCC), комплементзависимую цитотоксичность (CDC) и индукцию замедления роста или апоптоза. Например, большинство экспериментальных данных свидетельствует о том, что действие ритуксимаба обусловлено обычными эффекторными механизмами, которые оценивают путем анализов CDC и ADCC. Аналогично этому было установлено, что устойчивость различных клеток лимфомы к ритуксимабу in vivo является функцией их чувствительности к CDC in vitro. В противоположность этому для механизма действия in vivo другого антитела, рекомендованного для применения в терапии, такого как В 1, не требуется ни комплементзависимой, ни связанной с естественными клетками-киллерами (NK) активности. В большей степени эффективность В 1 in vivo является результатом его способности индуцировать выраженный апоптоз. В целом, моноклональные антитела к CD20 подразделяются на две различные категории на основе- 18015009 их механизма действия, обеспечивающего уничтожения клеток лимфомы. Антитела типа I к CD20 прежде всего используют комплемент для уничтожения клеток-мишеней, в то время как антитела типа II проявляют действие посредством других механизмов, прежде всего апоптоза. Ритуксимаб и 1F5 являются примерами антител типа I к CD20, а В 1 является примером антитела типа II (см., например, Cragg M.S. иGlennie M.J., Blood 103(7), апрель 2004, cc. 2738-2743; Teeling J.L. и др., Blood 104(6), сентябрь 2004, cc. 1793-1800), содержание публикаций полностью включено в настоящее описание в качестве ссылки. Настоящее изобретение является первым известным примером создания антитела типа II к CD20,которое обладает повышенными эффекторными функциями, такими как ADCC, сохраняя при этом способность индуцировать эффективный апоптоз. Таким образом, настоящее изобретение относится к сконструированному антителу типа II к CD20, которое обладает повышенной ADCC, что является результатом указанного конструирования, и не утрачивает выраженную способность индуцировать апоптоз. Согласно одному из вариантов осуществления изобретения конструировали антитела типа II к CD20, которые имели измененную схему гликозилирования в Fc-области. Согласно конкретному варианту осуществления изобретения измененное гликозилирование предусматривает повышенный уровень бисекционных комплексных остатков в Fc-области. Согласно другому конкретному варианту осуществления изобретения измененное гликозилирование предусматривает также и понижение уровня остатков фукозы вFc-области (см. опубликованную заявку на патент США 20040093621 на имя фирмы Shitara и др., содержание которой полностью включено в настоящее описание в качестве ссылки. В другом варианте осуществления изобретения антитела типа II к CD20 создают с помощью метода конструирования полипептидов, который изложен в US 6737056 на имя Presta или в опубликованной заявке на патент США 20040185045 (на имя Macrogenics) или в опубликованной заявке на патент США 20040132101 (на имяXencor), содержание каждой из которых полностью включено в настоящее описание в качестве ссылки. Изобретение относится также к способам получения таких сконструированных антител типа II и к способам применения таких антител для лечения различных В-клеточных нарушений, включая В-клеточные лимфомы. Химерные мышиные /человеческие антитела являются известными (см., например, Morrison S. L. и др., PNAS II, ноябрь 1984 г., cc. 6851-6854; опубликованный европейский патент 173494; Boulianna G.L и др., Nature 312, декабрь 1984 г., с. 642; Neubeiger M. S. и др., Nature 314, март 1985 г., с. 268; опубликованный европейский патент 125023; Tan и др., J. Immunol. 135, ноябрь 1985 г., с. 8564; Sun L. К и др., Hybridoma 5(1), 1986, с. 517; Sahagan и др., J. Immunol. 137, 1986, cc. 1066-1074). Общие сведения приведены у Muron, Nature 312, декабрь 1984 г., с. 597; Dickson, Genetic Engineering News 5(3), март 1985 г.; Marx, Science 229, август 1985 г., с. 455; и Morrison, Science 229, сентябрь 1985 г., cc. 1202-1207. Robinson с соавторами в опубликованной заявке РСТ WO/88104936 описали химерное антитело, которое несет человеческую константную область и мышиную вариабельную область, обладающее специфичностью в отношении эпитопа CD20; мышиный фрагмент химерного антитела по данным Robinson выведен из мышиного моноклонального антитела 2 Н 7 (гамма 2b, каппа). Несмотря на то, что в указанной ссылке это химерное антитело рассматривается в качестве основного кандидата для лечения В-клеточных нарушений, специалисты в данной области могут рассматривать его только как гипотетичное при определении того, справедливо ли оно для конкретного антитела, прежде всего из-за того, что в ссылке отсутствуют какие-либо данные, подтверждающие утверждение о наличии терапевтической эффективности, и,что является важным, результаты, полученные с использованием высших млекопитающих, таких как приматы или люди. Методологии получения химерных антител известны в данной области. Например, легкую и тяжелую цепи можно экспрессировать по отдельности, используя, например легкую цепь иммуноглобулина и тяжелую цепь иммуноглобулина в различных плазмидных векторах или в одном (например, полицистронном) векторе. Затем их можно очищать и собирать in vitro с получением полных антител; методы осуществления такой сборки известны (см., например, Scharff M., Harvey Lectures 69, 1974, с. 125). Параметры реакций in vitro для получения антител в виде IgG из восстановленных выделенных легких и тяжелых цепей также описаны в литературе (см., например, Sears и др., Biochem. 16(9), 1977, cc. 20162025). Согласно особенно предпочтительному варианту осуществления изобретения химерная АСМ,предлагаемая в настоящем изобретении, представляет собой гуманизированное антитело. Методы гуманизации антител, полученных из организма кроме человека, известны в данной области. Например, гуманизированные АСМ, предлагаемые в настоящем изобретении, можно получать с помощью методов,описанных в US 5225539 на имя Winter, US 6180370 на имя Queen и др. или US 6632927 на имя Adair и др., полное содержание которых включено в настоящее описание в качестве ссылки. Предпочтительно гуманизированное антитело несет один или несколько интродуцированных аминокислотных остатков из источника кроме человека. Эти аминокислотные остатки из источника кроме человека часто называют импортными остатками, которые, как правило, получают из импортной вариабельной области. Гуманизацию, как правило, осуществляют с помощью метода, описанного у Winter с сотрудниками (Jones и др., Nature, 321, 1986, cc. 522-525; Riechmann и др., Nature, 332, 1988, cc. 323-327; Verhoeyen и др.,- 19015009Science, 239, 1988, cc. 1534-1536), путем замены последовательностей гипервариабельных участков на соответствующие последовательности человеческого антитела. Таким образом,такие гуманизированные антитела являются химерными антителами (US 4816567), в которых область, существенно меньшая по сравнению с интактной человеческой вариабельной областью, заменена на соответствующую последовательность из видов кроме человека. На практике гуманизированные антитела представляют собой типичные человеческие антитела, в которых некоторые остатки гипервариабельного участка и, вероятно, некоторые остатки FR-участка заменены остатками из аналогичных сайтов антител грызунов. Предлагаемые в изобретении гуманизированные антитела к CD20 должны содержать константные области человеческого иммуноглобулина. Выбор человеческих вариабельных областей как легкой, так и тяжелой цепи, применяемых для создания гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому методу наилучшего подбора последовательность вариабельной области антитела грызунов подвергают скринингу с использованием полной библиотеки известных последовательностей человеческих вариабельных областей. Затем человеческую последовательность, наиболее сходную с последовательностью грызунов, отбирают в качестве человеческого каркасного участка (FR) для создания гуманизированного антитела (Sims и др., J. Immunol., 151, 1993, с. 2296; Chothia и др., J. Mol. Biol., 196, 1987, с. 901). Другой метод выбора последовательности человеческого каркасного участка заключается в сравнении последовательности каждой индивидуальной подобласти полного каркасного участка грызунов (т.е. FR1, FR2,FR3 и FR4) или определенной комбинации индивидуальных подобластей (например, FR1 и FR2) и библиотеки известных последовательностей человеческих вариабельных областей, которые соответствуют указанной каркасной подобласти (например, с использованием нумерации по Кэботу), и выборе человеческой последовательности для каждой подобласти или комбинации, которая является наиболее сходной с последовательностью грызунов (Leung, заявка на патент США 2003/0040606 А 1, опубликованная 27 февраля 2003 г.). Еще один метод основан на применении конкретного каркасного участка, выведенного из консенсусной последовательности всех человеческих антител конкретной подгруппы легких и тяжелых цепей. Один и тот же каркасный участок можно применять для нескольких различных гуманизированных антител (Carter и др., Proc. Natl. Acad. Sci. USA, 89, 1992, с. 4285; Presta и др., J. Immunol., 151,1993, c. 2623). Также важно, чтобы антитела, будучи гуманизированными, сохраняли их высокую аффинность к антигену и другие ценные биологические свойства. Для решения этой задачи согласно предпочтительному способу гуманизированные антитела получают с помощью процесса анализа родительских последовательностей и различных концептуальных (схематических) гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов доступны и хорошо известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и отображают вероятные трехмерные конформационные структуры выбранных в качестве перспективных (кандидатов) последовательностей иммуноглобулинов. Оценка этих изображений позволяет проанализировать вероятную роль остатков в проявлении функции последовательности иммуноглобулина-кандидата, т.е. анализ остатков, которые влияют на способность иммуноглобулина-кандидата связываться с антигеном. Таким методом можно отбирать остатки FR-участка и объединять остатки, полученные из реципиента, и импортные последовательности так, чтобы получать требуемые характеристики антитела, такие как повышенная аффинность к антигену(ам)-мишени(ям). В целом, остатки гиперварибельных участков непосредственно и в наибольшей степени оказывают воздействие на связывание антигена. Согласно другому варианту осуществления изобретения антигенсвязывающие молекулы, предлагаемые в настоящем изобретении, конструируют так, чтобы они обладали повышенной аффинностью к связыванию, например, с использованием методов, описанных в опубликованной заявке на патент США 2004/0132066 на имя Balint и др., полное содержание которой включено в настоящее описание в качестве ссылки. Согласно одному из вариантов осуществления изобретения антигенсвязывающие молекулы, предлагаемые в настоящем изобретении, конъюгируют с дополнительным фрагментом, таким как радиоактивная метка или токсин. Такие конъюгированные АСМ можно получать многочисленными методами,хорошо известными в данной области. Различные радионуклиды можно применять согласно настоящему изобретению, и специалисты в данной области могут легко определить, какой радионуклид является наиболее пригодным в различных ситуациях. Например, 131 йод представляет собой хорошо известный радионуклид, применяемый для целенаправленной иммунотерапии. Однако клиническая применимость 131 йода может быть ограничена несколькими факторами, которые включают восьмидневный физический период полураспада; дегалогенизация йодированного антитела как в крови, так и в областях опухоли; и характеристики испускания (например, высокий уровень гамма-компонента), что может оказаться не оптимальным для локализованного отложения дозы в опухоли. С появлением более эффективных хелатирующих агентов возможность присоединения к белкам хелатирующих групп металлов повысила возможность использования других ра- 20015009 дионуклидов, таких как 111 индий и 90 иттрий. 90 Иттрий обладает рядом преимуществ при радиоиммунотерапевтическом применении: 64-ч период полураспада 90 иттрия является достаточным для накопления антитела опухолью и, например, в отличие от 131 иода, 90 иттрий испускает только бета-лучи высокой энергии без накопления гамма-излучения при его распаде на участке ткани, диаметром 100-1000 клеток. Кроме того, минимальное количество проникающей радиации позволяет вводить антитела, меченные иттрием, амбулаторным больным. Кроме того, для уничтожения клетки не требуется интернализация меченого антитела, и местное испускание ионизирующего излучения должно быть летальным для примыкающих опухолевых клеток, лишенных антигена-мишени. Эффективные однократные дозы (т.е. терапевтически эффективные количества) меченных с помощью 90 иттрия антител к CD20 составляют от примерно 5 и до примерно 75 мКи, более предпочтительно от примерно 10 до примерно 40 мКи. Эффективные однократные неаблятивные дозы (при использовании которых не требуется трансплантация костного мозга) меченных с помощью 131 йода антител к CD20 составляют от примерно 5 и до примерно 70 мКи, более предпочтительно от примерно 5 и до примерно 40 мКи. Эффективные однократные аблятивные дозы (т.е. при применении которых может потребоваться аутологичная трансплантация костного мозга) меченых с помощью 131 йода антител к CD20 составляют от примерно 30 и до примерно 600 мКи, более предпочтительно от примерно 50 и менее чем примерно 500 мКи. С учетом того, что химерное антитело к CD20 обладает более продолжительным периодом полужизни в кровотоке по сравнению с мышиными антителами, эффективные однократные неаблятивные дозы (при использовании которых не требуется трансплантация костного мозга) меченных с помощью йода химерных антител к CD20 составляют от примерно 5 и до примерно 40 мКи, более предпочтительно менее чем примерно 30 мКи. Критерии визуализации, например, в случае использования в качестве метки 111 индия, как правило, составляют менее примерно 5 мКи. При лечении с использованием радиоактивно меченных антител к CD20 можно использовать как однократную терапевтическую обработку, так и несколько обработок. Из-за присутствия радионуклидного компонента предпочтительно, чтобы перед лечением периферические стволовые клетки (PSC) или клетки костного мозга (ВМ) были собраны с целью оценки их способности к выживанию в присутствии потенциально смертельной для костного мозга токсичности радиации. ВМ и/или PSC выделяют стандартными методами и затем очищают и замораживают для возможной реинфузии. Кроме того, наиболее предпочтительно перед лечением проводить диагностическое дозиметрическое исследование пациента с помощью диагностического меченого антитела (например, с помощью индия), целью которого является гарантия того, что терапевтическое меченое антитело (например, с помощью иттрия) не концентрируется в излишнем количестве в любом здоровом органе или ткани. Предпочтительным вариантом осуществления настоящего изобретения является выделенный полинуклеотид, содержащий последовательность, которая кодирует полипептид, имеющий аминокислотную последовательность, которая представлена ниже в табл. 3. Изобретение относится также к выделенной нуклеиновой кислоте, содержащей последовательность, которая по меньшей мере на 80, 85, 90, 95, 96,97, 98 или 99% идентична нуклеотидной последовательности, которая представлена ниже в табл. 2. Следующим вариантом осуществления изобретения является выделенная нуклеиновая кислота, содержащая последовательность, которая кодирует полипептид, аминокислотная последовательность которого по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентична аминокислотной последовательности,представленной в табл. 3. Под объем изобретения подпадает также выделенная нуклеиновая кислота,содержащая последовательность, которая кодирует полипептид, имеющий аминокислотную последовательность любой из представленной в табл. 3 конструкции с консервативными аминокислотными заменами. Другим предпочтительным вариантом осуществления настоящего изобретения является выделенный полинуклеотид, который содержит последовательность, кодирующую полипептид, который имеет аминокислотную последовательность, представленную на фиг. 1 или 2. Изобретение относится также к выделенной нуклеиновой кислоте, содержащей последовательность, которая по меньшей мере на 80, 85,90, 95, 96, 97, 98 или 99% идентична нуклеотидной последовательности, представленной на фиг. 5 или фиг. 6. Следующим вариантом осуществления изобретения является выделенная нуклеиновая кислота,которая содержит последовательность, кодирующую полипептид, аминокислотная последовательность которого по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентична аминокислотной последовательности, представленной на фиг. 5 или 6. Под объем изобретения подпадает также выделенная нуклеиновая кислота, которая содержит последовательность, кодирующую полипептид, аминокислотная после- 29
МПК / Метки
МПК: C07K 16/28, A61K 39/395
Метки: эффекторной, молекулы, обладающие, fс-рецептором, связыванию, функцией, антигенсвязывающие, повышенной, аффинностью
Код ссылки
<a href="https://eas.patents.su/30-15009-antigensvyazyvayushhie-molekuly-obladayushhie-povyshennojj-affinnostyu-k-svyazyvaniyu-s-fs-receptorom-i-effektornojj-funkciejj.html" rel="bookmark" title="База патентов Евразийского Союза">Антигенсвязывающие молекулы, обладающие повышенной аффинностью к связыванию с fс-рецептором и эффекторной функцией</a>
Предыдущий патент: Станция статического зондирования грунтов и датчик глубины погружения для станции статического зондирования грунтов
Следующий патент: Лекарственные средства, применяемые при аритмии и сердечной недостаточности
Случайный патент: Способ и устройство для цифрового нанесения покрытия на текстильный материал