Неинвазивный способ выявления переходно-клеточной карциномы мочевого пузыря in vitro
Номер патента: 13927
Опубликовано: 30.08.2010
Авторы: Мартинес Мартинес Антонио, Солоага Вильоч Ана, Эскуредо Гарсиа-Галдеано Кепа, Симон Буэла Лауреано, Кастрильо Диес Хосе Луис, Рамос Родригес Инма
Формула / Реферат
1. Неинвазивный способ in vitro, который включает:
а) выявление и количественную оценку, по меньшей мере, биомаркера АРОА1 (SEQ ID 41), присутствующего в тестируемом образце мочи индивидуума, и
б) сравнение уровня экспрессии, полученного в а) в тестируемом образце мочи, с соответствующим стандартным значением в нормальной моче, где вариации в измеренном уровне, полученном в а), по сравнению с соответствующим стандартным значением в нормальной моче являются индикатором переходно-клеточной карциномы мочевого пузыря.
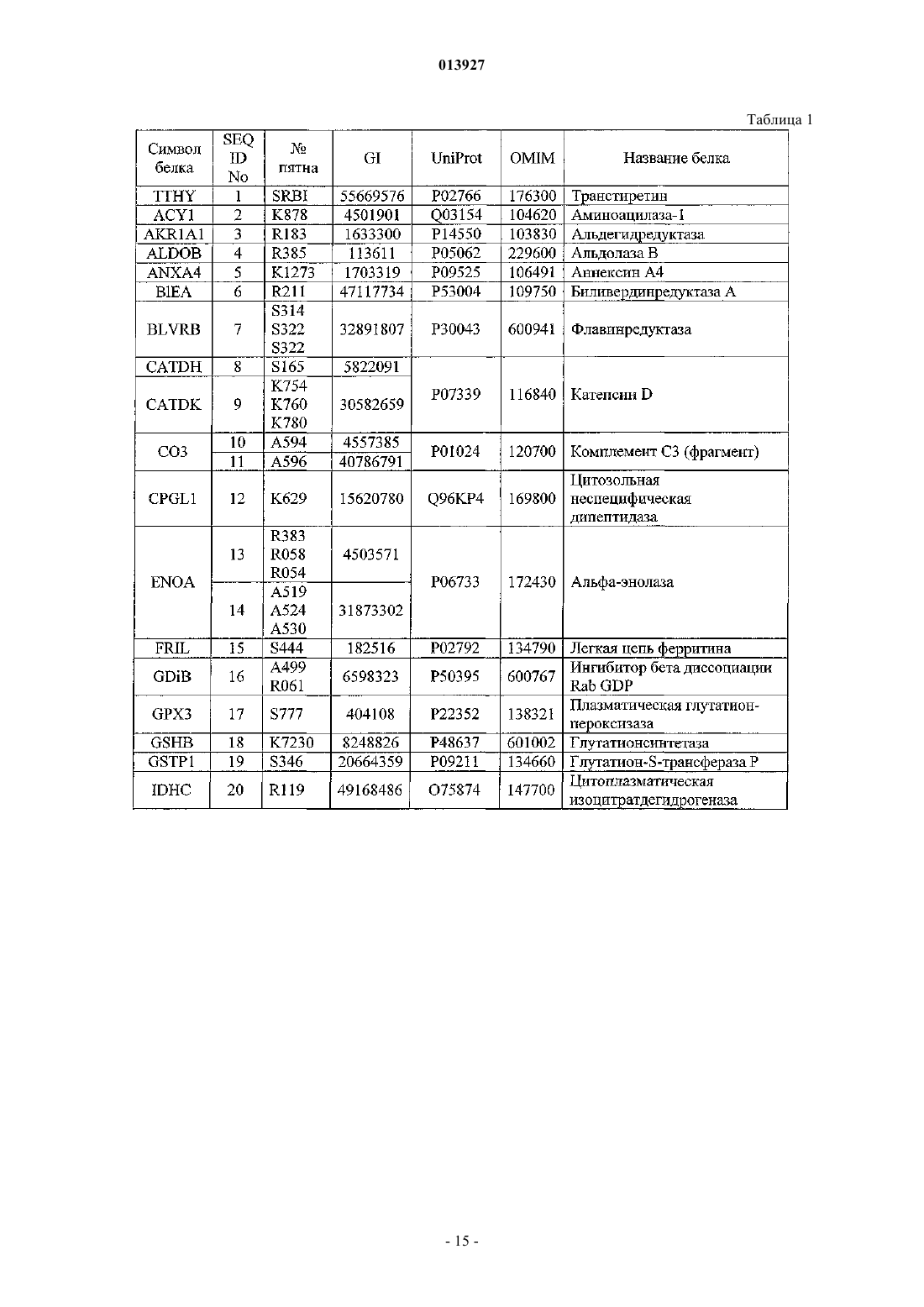
2. Способ по п.1, в котором указанный биомаркер представляет собой АРОА1 (SEQ ID 41) и один или более биомаркеров, выбранных из группы, состоящей из TTHY (SEQ ID 1), ACY1 (SEQ ID 2), AKR1A1 (SEQ ID 3), ALDOB (SEQ ID 4), ANXA4 (SEQ ID 5), BIEA (SEQ ID 6), BLVRB (SEQ ID 7), CATD H (SEQ ID 8), CATD K (SEQ ID 9), CO3 (SEQ ID 10, SEQ ID 11), CPGL1 (SEQ ID 12), ENOA (SEQ ID 13, SEQ ID 14), FRIL (SEQ ID 15), GDIB (SEQ ID 16), GPX3 (SEQ ID 17), GSHB (SEQ ID 18), GSTP1 (SEQ ID 19), IDHC (SEQ ID 20), LMAN2 (SEQ ID 21), LY6G6E (SEQ ID 22), MASP2 (SEQ ID 23), NADC (SEQ ID 24), NAPSA (SEQ ID 25), PA2G4 (SEQ ID 26), PARK7 (SEQ ID 27), PCBP1 (SEQ ID 28), PDC6I (SEQ ID 29), PPAL (SEQ ID 30), PRDX2 (SEQ ID 31), PTD012 (SEQ ID 32), QPCT (SEQ ID 33), SBP1 (SEQ ID 34), STIP1 (SEQ ID 35), TALDO (SEQ ID 36), WDR1 (SEQ ID 37), AMY (SEQ ID 38, SEQ ID 39, SEQ ID 40), GSN40 (SEQ ID 42), GSN80 (SEQ ID 43) и RETBP (SEQ ID 44), или их транскрипционного или посттрансляционного варианта.
3. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку АРОА1 и одного или более биомаркеров, выбранных из TTHY, AMY, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта.
4. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку АРОА1 и одного или более биомаркеров, выбранных из AMY, GSN40, GSN80, TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB, CATD H, CATD K, СO3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, STIP1, TALDO и WDR1, или их транскрипционного или посттрансляционного варианта.
5. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку АРОА1 и одного или более биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, GSTP1, IDHC, MASP2, PRDX2, AMY, GSN40, GSN80 и RETBP или их транскрипционного или посттрансляционного варианта.
6. Способ по любому из пп.1-5, где стадия а) включает выявление и количественную оценку по меньшей мере трех биомаркеров, выбранных из группы, определенной в п.1.
7. Способ по любому из пп.1-5, где стадия а) включает выявление и количественную оценку по меньшей мере четырех биомаркеров, выбранных из группы, определенной в п.1.
8. Способ по любому из пп.1-5, где стадия а) включает выявление и количественную оценку по меньшей мере пяти биомаркеров, выбранных из группы, определенной в п.1.
9. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку биомаркеров АРОА1, GSN40 и TTHY или их соответствующих транскрипционных или посттрансляционных вариантов.
10. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку биомаркеров АРОА1, GSN40, GSN80 и TTHY или их соответствующих транскрипционных или посттрансляционных вариантов.
11. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку биомаркеров AMY, APOA1, GSN40, GSN80 и TTHY или их соответствующих транскрипционных или посттрансляционных вариантов.
12. Способ по п.1 или 2, где стадия а) включает выявление и количественную оценку биомаркеров AMY, APOA1, CATD K, ENOA, IDHC, PRDX2 и TTHY или их соответствующих транскрипционных или посттрансляционных вариантов.
13. Способ по любому из пп.1-12, который применяют для выявления присутствия переходно-клеточной карциномы мочевого пузыря, для определения стадии или тяжести этой формы рака, для оценки отсутствия заболевания после хирургической резекции, для установления диагноза и/или прогноза этой формы рака и/или для мониторинга эффекта лечения, применяемого к индивидууму, страдающему от названной формы рака.
14. Способ по любому из пп.1-13, в котором анализируемый образец мочи получают от индивидуума, который предварительно не был диагностирован как страдающий от переходно-клеточной карциномы мочевого пузыря.
15. Способ по любому из пп.1-13, в котором анализируемый образец мочи получают от индивидуума, который предварительно был диагностирован как страдающий от переходно-клеточной карциномы мочевого пузыря.
16. Способ по любому из пп.1-13, в котором анализируемый образец мочи получают от индивидуума, который получает лечение против переходно-клеточной карциномы мочевого пузыря.
17. Способ по любому из пп.1-13, характеризующийся тем, что выявление и количественная оценка биомаркеров включает первую стадию, на которой белковый экстракт образца мочи помещают в контакт с композицией, состоящей по меньшей мере из двух антител, специфичных по отношению к одному или более эпитопов биомаркеров по п.1, и вторую стадию, на которой проводят количественную оценку полученных комплексов антитело-белок.
18. Способ по п.17, характеризующийся тем, что названные антитела имеют человеческое происхождение, являются гуманизированными или имеют нечеловеческое происхождение и выбраны из моноклональных или поликлональных антител, интактных или рекомбинантных фрагментов антител, комбител и Fab или scFv фрагментов антител.
19. Способ по п.17 или 18, характеризующийся тем, что для выявления и количественной оценки полученных комплексов применяют методы, выбранные из Вестерн-блот анализа, ELISA (иммуноферментного анализа на сорбенте), RIA (радиоиммуноанализа), конкурентного EIA (конкурентного иммуноферментного анализа), DAS-ELISA (метода сэндвич-ELISA с двумя антителами), иммуноцитохимических и иммуногистохимических методов, методов, основанных на применении биочипов или белковых микроматриц, которые включают специфические антитела, методов, основанных на преципитации коллоидного золота в таких форматах, как погружаемые индикаторы; или методов аффинной хроматографии, анализа связывания лигандов или анализа связывания лектинов.
20. Способ по любому из пп.1-19, где способ применяют для мониторинга эффективности фармакологического или хирургического лечения, применяемого к индивидууму, страдающему от переходно-клеточной карциномы мочевого пузыря.
21. Способ по любому из пп.1-20, где способ применяют для определения прогрессии заболевания, когда измеренный уровень, полученный в а), сравнивают в различных образцах мочи, полученных от одного и того же пациента в различные времена развития переходно-клеточной карциномы мочевого пузыря.
22. Применение in vitro, по меньшей мере, пептидной последовательности, происходящей из биомаркера АРОА1 (SEQ ID 41), в моче для выявления присутствия переходно-клеточной карциномы мочевого пузыря путем анализа мочи, для определения стадии или тяжести этой формы рака, для оценки отсутствия заболевания после хирургической резекции, для установления диагноза и/или прогноза этой формы рака и/или для мониторинга эффекта лечения, применяемого к индивидууму, страдающему от названной формы рака.
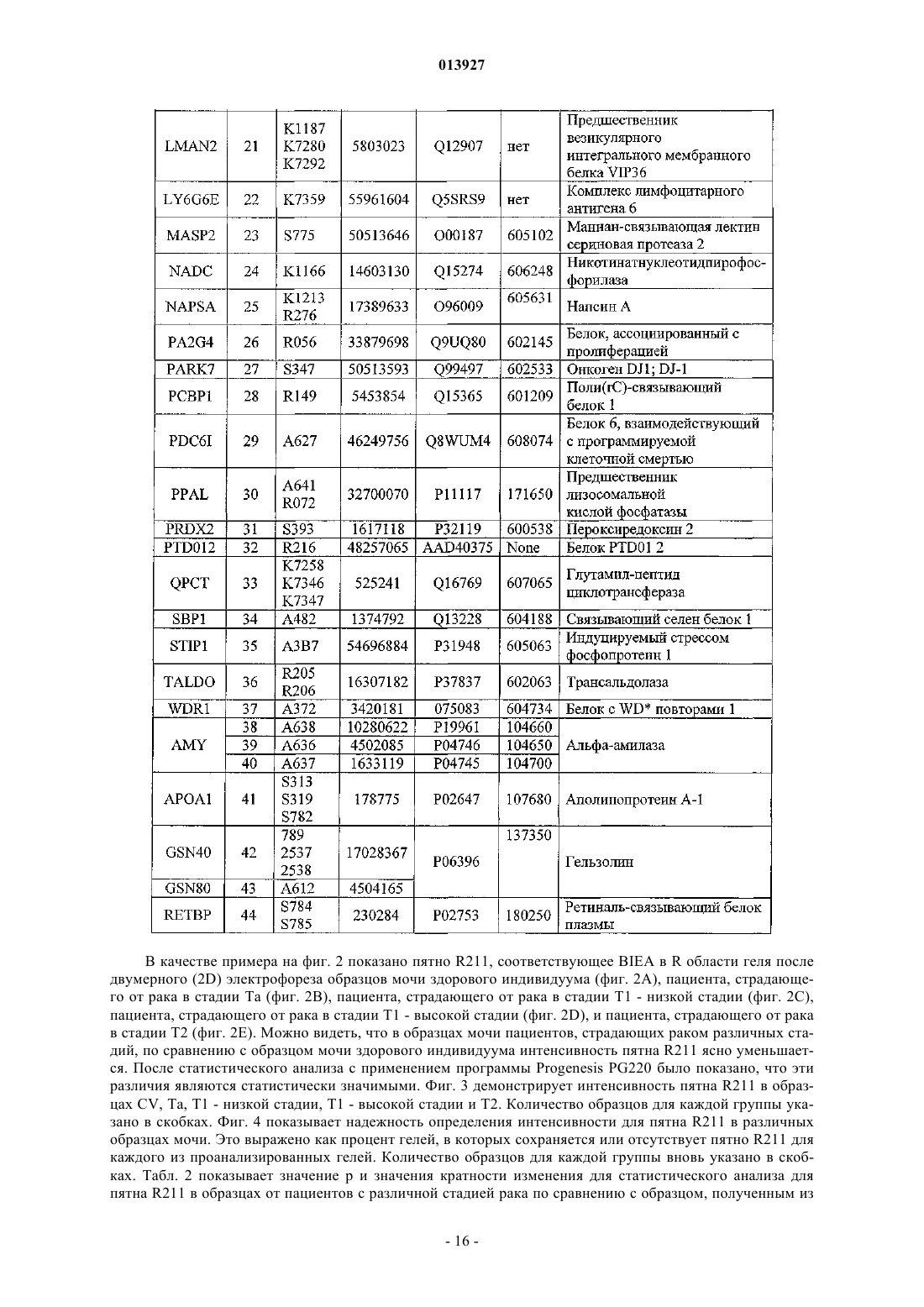
23. Применение по п.22, где пептидная последовательность происходит из биомаркера АРОА1 (SEQ ID 41) и одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY (SEQ ID 1), ACY1 (SEQ ID 2), AKR1A1 (SEQ ID 3), ALDOB (SEQ ID 4), ANXA4 (SEQ ID 5), BIEA (SEQ ID 6), BLVRB (SEQ ID 7), CATD H (SEQ ID 8), CATD K (SEQ ID 9), CO3 (SEQ ID 10, SEQ ID 11), CPGL1 (SEQ ID 12), ENOA (SEQ ID 13, SEQ ID 14), FRIL (SEQ ID 15), GDIB (SEQ ID 16), GPX3 (SEQ ID 17), GSHB (SEQ ID 18), GSTP1 (SEQ ID 19), IDHC (SEQ ID 20), LMAN2 (SEQ ID 21), LY6G6E (SEQ ID 22), MASP2 (SEQ ID 23), NADC (SEQ ID 24), NAPSA (SEQ ID 25), PA2G4 (SEQ ID 26), PARK7 (SEQ ID 27), PCBP1 (SEQ ID 28), PDC6I (SEQ ID 29), PPAL (SEQ ID 30), PRDX2 (SEQ ID 31), PTD012 (SEQ ID 32), QPCT (SEQ ID 33), SBP1 (SEQ ID 34), STIP1 (SEQ ID 35), TALDO (SEQ ID 36), WDR1 (SEQ ID 37), AMY (SEQ ID 38, SEQ ID 39, SEQ ID 40), GSN40 (SEQ ID 42), GSN80 (SEQ ID 43) и RETBP (SEQ ID 44), или их транскрипционного или посттрансляционного варианта.
24. Применение по п.22 или 23 пептидной последовательности, происходящей из биомаркера АРОА1 (SEQ ID 41), и одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из группы TTHY, AMY, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта.
25. Применение по п.22 или 23 пептидной последовательности, происходящей из биомаркера АРОА1 (SEQ ID 41), и одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из AMY, GSN40 и GSN80, TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB, CATD H, CATD K, CO3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL PRDX2, PTD012, QPCT, SBP1, STIP1, TALDO и WDR1, или их транскрипционного или посттрансляционного варианта.
26. Применение по п.22 или 23 пептидной последовательности, происходящей из биомаркера АРОА1 (SEQ ID 41), и одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, GSTP1, IDHC, MASP2, PRDX2, AMY, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта.
27. Применение по любому из пп.22-26, где вариации в измеренном уровне АРОА1 (SEQ ID 41) и одного или более биомаркеров в тестируемом образце мочи в сравнении с соответствующими стандартными значениями в нормальной моче являются индикатором переходно-клеточной карциномы мочевого пузыря.
28. Применение по любому из пп.22-26 по меньшей мере трех пептидных последовательностей.
29. Применение по любому из пп.22-26 по меньшей мере четырех пептидных последовательностей.
30. Применение по любому из пп.22-26 по меньшей мере пяти пептидных последовательностей.
31. Применение по п.22 или 23 пептидных последовательностей, происходящих из АРОА1, GSN40 и TTHY, или их соответствующих транскрипционных или посттрансляционных вариантов.
32. Применение по п.22 или 23 пептидных последовательностей, происходящих из АРОА1, GSN40, GSN80 и TTHY, или их соответствующих транскрипционных или посттрансляционных вариантов.
33. Применение по п.22 или 23 пептидных последовательностей, происходящих из AMY, APOA1, GSN40, GSN80 и TTHY, или их соответствующих транскрипционных или посттрансляционных вариантов.
34. Применение по п.22 или 23 пептидных последовательностей, происходящих из AMY, APOA1, CATD H, ENOA, IDHC, PRDX2 и TTHY, или их соответствующих транскрипционных или посттрансляционных вариантов.
35. Применение, по меньшей мере, нуклеотидной или пептидной последовательности, происходящей из АРОА1, в способах скрининга, идентификации, разработки и/или оценки эффективности терапевтических агентов для лечения переходно-клеточной карциномы мочевого пузыря.
36. Применение по п.35, где нуклеотидная или пептидная последовательность происходит из АРОА1 и одной или более нуклеотидных или пептидных последовательностей, происходящих из одного или более биомаркеров, выбранных из группы, как определено по п.2, по одной или в любом сочетании, в способах скрининга, идентификации, разработки и/или оценки эффективности терапевтических агентов для лечения переходно-клеточной карциномы мочевого пузыря.
37. Набор реактивов для осуществления способа, как определено в любом из пп.1-21, включающий: 1) антитело, которое специфически распознает АРОА1, и 2) носитель в подходящей упаковке.
38. Набор реактивов по п.37, в котором антитело специфически распознает АРОА1 и одно или более антител, которые независимо специфически распознают один или более биомаркеров по п.2.
39. Набор реактивов по п.37 или 38, который применяется для выявления присутствия переходно-клеточной карциномы мочевого пузыря, для определения стадии или тяжести этой формы рака, для оценки отсутствия заболевания после хирургической резекции, для установления диагноза и/или прогноза этой формы рака, и/или для мониторинга эффекта лечения, применяемого к индивидууму, страдающему от названной формы рака.
40. Набор реактивов по любому из пп.37-39, включающий биочип.
41. Набор реактивов по п.40, где биочип включает антитела для выявления биомаркеров, выбранных из группы, как определено по п.1.
Текст
НЕИНВАЗИВНЫЙ СПОСОБ ВЫЯВЛЕНИЯ ПЕРЕХОДНО-КЛЕТОЧНОЙ КАРЦИНОМЫ МОЧЕВОГО ПУЗЫРЯ IN VITRO Настоящее изобретение относится к неинвазивному способу выявления in vitro переходноклеточной карциномы мочевого пузыря у индивидуума путем анализа мочи для определения стадии или тяжести этой формы рака или для мониторинга эффекта лечения, данного индивидууму, страдающему от этой формы рака. Солоага Вильоч Ана, Кастрильо Диес Хосе Луис, Рамос Родригес Инма, Эскуредо Гарсиа-Галдеано Кепа, Мартинес Мартинес Антонио, Симон Буэла Лауреано (ES) 013927 Область техники, к которой относится изобретение Настоящее изобретение относится к неинвазивному способу выявления в моче индивидуума in vitro клеток переходно-клеточной карциномы мочевого пузыря путем анализа мочи, а также к применению пептидных последовательностей, происходящих из выбранных белков, и к набору реактивов для осуществления данного способа. Сведения о предшествующем уровне техники Рак мочевого пузыря является наиболее распространенным видом рака мочевыводящего тракта; это также четвертая по распространенности форма рака у мужчин и восьмая из наиболее часто встречающихся форм рака у женщин. Рак мочевого пузыря включает широкий спектр опухолей различных гистологических типов, включая переходно-клеточную карциному мочевого пузыря (ПККМП, 90%), чешуйчато-клеточную карциному (7%), аденокарциному (2%) и недифференцированную карциному (1%). Степень и стадия развития опухоли являются наилучшими прогностическими индикаторами ПККМП. Опухоли мочевого пузыря классифицируются цитоморфологически от G1 (низкая стадия развития) до G3 (высокая стадия развития) с уменьшением степени дифференциации и увеличением агрессивности заболевания в соответствии с классификацией Всемирной организации здравоохранения (ВОЗ). По отношению к стадии развития или инвазивности ПККМП классифицируется как поверхностнопапиллярная (Та и Т 1), мышечно-инвазивная (Т 2-Т 4) или необычная карцинома in situ или карцинома insitu (TIS). Опухоли низкой стадии развития обычно ограничиваются слизистой оболочкой или проникают в поверхностные слои (стадия Та и T1). Большинство опухолей высокой стадии развития обнаруживаются по меньшей мере в Т 1 стадии (захватывающие lamina propria). Приблизительно в 75% случаев диагностируемый рак мочевого пузыря является поверхностным. В остальных 25% диагностируемых случаев рака мочевого пузыря в момент постановки диагноза опухоль распространяется на мышцу. Пациенты с поверхностной ПККМП имеют хороший прогноз, но 70% риск рецидивов. Несмотря на этот высокий риск, для опухолей Та характерна тенденция оставаться опухолями низкой стадии развития, лишь 1015% этих опухолей будут прогрессировать с распространением на мышцы в течение 2 лет. Однако процент опухолей в стадии Т 1, которые прогрессируют до стадии Т 2, является более высоким (30-50%). В настоящее время наилучшей установленной системой диагностики рака мочевого пузыря у индивидуумов является либо цистоскопия и трансуретральная биопсия, либо резекция, причем оба способа диагностики являются инвазивными. Гибкие цитоскопы делают метод менее агрессивным, но он остается инвазивным и крайне неприятным, все еще требуя некоторой формы анестезии. Преобладающим неинвазивным методом диагностики ПККМП является идентификация неопластических клеток в моче путем их морфологического исследования. Таким образом, в настоящее время для мониторинга пациентов с диагностированным и подвергнутым лечению раком мочевого пузыря используются цитологические методы. Хотя цитологическое исследование мочи позволяет обнаружить insitu опухоли, которые не обнаруживаются цитоскопически, а также опухоли, расположенные в верхней части мочевого пузыря или в верхней части мочевыводящего тракта (в мочеточнике, почечной лоханке и почке), в нескольких исследованиях было показано, что цитологический метод диагностики рака мочевого пузыря характеризуется крайне низкой чувствительностью: он не выявляет до 50% опухолей. Признаки, выявляемые при цитологическом исследовании, едва уловимы, и рак можно перепутать с реактивными или дегенеративными процессами. Для цитологических исследований необходим специалист и индивидуальная оценка данных, что замедляет получение результатов и вводит дополнительный субъективный фактор и противоречивость в конечные результаты. Как это ни странно, но в настоящее время нет высокочувствительного и специфического неинвазивного способа, подходящего для диагностики рака мочевого пузыря (Boman H. et al., J Urol 2002, 167:80-83). Было предпринято много попыток улучшить неинвазивное выявление рака. Недавние успехи в определении экспрессии белков раковых клеток, достигнутые с применением протеомных технологий,двумерного электрофореза с высоким разрешением и масс-спектрометрии, сделали возможным идентификацию белков-кандидатов на роль маркеров опухоли рака мочевого пузыря, таких как белок ядерного матрикса NMP22 (Soioway M.S. et al., J Urol 1996, 156:363-367), гиалуроновая кислота и гиалуронидаза(Pham Н.Т. et al., Cancer Res 1997, 57:778-783), комплексы базальной мембраны (ВТА, Pode D. et al., JUrol 1999, 161:443-446), раково-эмбриональный антиген (СЕА, Halim A.B. et al., Int J Biol Markers, 1992; 7:234-239), уроплакин II (Wu X.R. et al., Cancer Res 1998; 58:1291-1297), фактор рассеивания/фактор роста гепатоцитов (SF/HGF, Gohji K. et al., J Clin Oncol 2000; 18:2963-2971), белки семейства кератина/цитокератина, подобные цитокератину 20 (Buchumensky V. et al., J Urol 1998, 160:1971-1974), цитокератину 18 (Sanchez-Carbayo M. et al., Clin Cancer Res 2000, 6:3585-3594), белок опухоли груди 8-KaMemon А. А. и соавт. (Cancer Detect Prev 2005, 29:249-255) идентифицировали в клеточных линиях рака мочевого пузыря и в образцах, взятых из опухоли при биопсии, семь дифференциально экспрессируемых белков. Однако в этом случае для сравнения не использовался контроль. Langbein, S. и соавт.(Technol Cancer Res Treat 2006, 67-71) раскрывают, каков белковый профиль в образцах биопсии, взятых у пациентов с раком мочевого пузыря (данные получены с применением двумерного электрофореза в полиакриламидном геле (PAGE) и метода SELDI-TOF масс-спектрометрии).Rasmussen Н.Н. и соавт. (J Urol 1996, 155:2113-2119) раскрывают базу данных белков, представленных в значительных количествах в моче пациентов с раком мочевого пузыря. Celis J.E. и соавт. (Electrophoresis 1999, 300-309) описывают базу данных белков образцов, взятых при биопсии у пациентов с раком мочевого пузыря. Тем не менее, ни в одной из этих работ не были идентифицированы маркеры этой формы рака, поскольку авторы не обнаружили количественных различий в профиле белков образцов,взятых у здоровых людей, по сравнению с образцами, взятыми из опухолей. Кроме того, в клинических испытаниях было доказано, что отсутствует маркер, предсказывающий прогноз и степень развития рака мочевого пузыря (Miyake H. et al., J Urol 2002, 167:1282-1287). Сущность, изобретения Настоящее изобретение обеспечивает высокочувствительный, эффективный и быстрый неинвазивный метод in vitro, касающийся белков, ассоциированных с ПККМП. Оно дополнительно относится к способу диагностики, прогнозирования развития и мониторинга ПККМП путем анализа образцов мочи. Удивительно, но настоящее изобретение обеспечивает биомаркеры рака мочевого пузыря для определения ПККМП путем анализа мочи. Предпочтительное воплощение изобретения относится к 40 биомаркерам для выявления ПККМП путем анализа мочи, что имеет важное значение для обнаружения, диагностики, прогнозирования развития и мониторинга ПККМП. Аминоацилаза-1 (ACY1) - это цитозольный гомодимерный, связывающий цинк фермент, который катализирует гидролиз ацилированных L-аминокислот до L-аминокислот и ацильной группы. Было постулировано, что этот фермент функционирует в катаболизме ацилированных аминокислот и их сборе для повторного использования. ACY1 был отнесен к хромосоме 3 р 21.1, области, которая является гомозиготной при мелкоклеточном раке легких (МКРЛ). Сообщалось также, что его экспрессия снижается или не обнаруживается в клеточных линиях и опухолях МКРЛ. ACY1 представляет собой первый член нового семейства ферментов, связывающих цинк. Альдегидредуктаза (AKR1A1) принадлежит к семейству альдо/кето редуктаз, она вовлечена в восстановление биогенных и ксенобиотических альдегидов и представлена практически в каждой ткани. Альдолаза В (ALDOB), называемая также альдолазой фруктозо-1-фосфата, синтезируется в печени,почках и в мозге. Она нужна для распада фруктозы. Альфа-амилаза (AMY) карциноидная, панкреатическая альфа-амилаза и альфа-амилаза 1 А принадлежат к семейству 13 гликозилгидролаз и гидролизует 1,4-альфа-гликозидную связь в олигосахарах и полисахаридах, катализируя, таким образом, первую стадию переваривания крахмала и гликогена, попадающих в организм с пищей. Геном человека имеет кластер, состоящий из нескольких амилазных генов,которые экспрессируются на высоком уровне в слюнных железах или в поджелудочной железе. Аннексин IV (ANXA4) принадлежит к семейству аннексинов - кальцийзависимых фосфолипидсвязывающих белков. Хотя их функции еще не окончательно определены, несколько членов семейства аннексинов вовлечены в события, ассоциированные с мембраной, происходящие при экзо- и эндоцитозе.ANXA4 экспрессируется почти исключительно в клетках эпителия. Аполипопротеин А-1 (АРОА 1) принадлежит к семейству аполипопротеинов А 1/А 4/Е и участвует в обратном транспорте холестерина из тканей в печень для последующей экскреции, облегчая выход холестерина из тканей и действуя как кофактор для лецитин-холестеролацилтрансферазы (LCAT). Биливердинредуктаза A (BIEA) принадлежит к семейству gfo/idh/moca и подсемейству биливердинредуктазы. Она восстанавливает гамма-метеновый мостик открытой формы тетрапиррола, биливердина IX альфа, до билирубина с сопутствующим окислением НАДН или НАДФН. Флавинредуктаза (BLVRB) катализирует транспорт электронов от восстановленных пиридиновых нуклеотидов к флавинам, а также к метиленовой сини, пирролохинолинхинону, рибофлавину или метгемоглобину. BLVRB, возможно, играет роль в защите клеток от окислительного повреждения или в регуляции метаболизма железа. В печени этот фермент превращает биливердин в билирубин. Он экспрессируется преимущественно в печени и эритроцитах, и в меньших количествах в сердце, легких, надпочечниках и головном мозге. Катепсин D (CATD) представляет собой кислую протеазу, которая принадлежит к семейству пептидаз А 1 и активирует внутриклеточный распад белков. Этот фермент вовлечен в патогенез нескольких заболеваний, таких как рак мочевого пузыря (Ozer E., et al., Urology 1999, 54:50-5 and loachim E., et al.,Anticancer Res 2002, 22:3383-8), рак груди и возможно болезнь Альцгеймера. Катепсин D синтезируется как неактивный предшественник с молекулярной массой 52 кДа, образованный из двух полипептидов,имеющих молекулярную массу 14 кДа (CATD Н), и одного полипептида с молекулярной массой 34 кДа(CATD K). Неактивный пептид активируется за счет протеолиза N-концевой части, приводящего к появлению энзиматически активного белка с молекулярной массой 48 кДа. Предшественник комплемента С 3 (СО 3) играет центральную роль в активации системы комплемента. Его процессинг, осуществляемый С 3 конвертазой, является центральной реакцией в обоих путях активации комплемента. СО 3 был отнесен к урогенитальным опухолям (Dunzendorfer U., et al., Eur Urol-2 013927 1980, 6:232-6). Цитозольная неспецифическая дипептидаза (CPGL1) принадлежит к семейству пептидаз М 20 А и известна также как тканевая карнозиназа и пептидаза А. Она является в большей степени неспецифической дипептидазой, нежели селективной карнозиназой. Альфа-энолаза (ENOA) является мультифункциональным ферментом, который играет важную роль как в гликолизе, так и в других различных процессах, таких как контроль роста, толерантность к гипоксии и аллергические ответы. Она может также функционировать в пределах внутримышечной и околоклеточной фибринолитической системы, что обусловлено способностью этого фермента служить рецептором и активатором плазминогена на поверхности нескольких типов клеток, таких как лейкоциты и нейроны. Энолаза млекопитающих состоит из 3 изозимных субъединиц, альфа, бета и гамма, которые могут образовывать гомо- или гетеродимеры, являющиеся специфичными по отношению к типу клеток и к этапу развития. ENOA взаимодействует с PLG в нейрональной плазматической мембране и облегчает ее активацию. Этот фермент применяется в качестве диагностического маркера для многих опухолей и, в гетеродимерной форме (альфа/гамма) как маркер гипоксического повреждения мозга после остановки сердца. Он также имеет отношение к раку мочевого пузыря (Iczkowski K.A., et al., Histopathology 1999,35:150-6). Легкая цепь ферритина (FRIL) принадлежит к семейству ферритинов и является основным белком,запасающим железо у прокариот и эукариот. Ферритин состоит из 24 субъединиц тяжелых и легких цепей. Вариации в субъединичном составе ферритина могут влиять на поглощение и освобождение железа в различных тканях. Основная функция ферритина - это хранение железа в растворимом и нетоксичном состоянии. Бета-ингибиотр диссоциации Rab-ГДФ (GDIB) принадлежит к семейству rab gdi и регулирует реакцию ГДФ/ГТФ обмена у членов семейства rab, малых ГТФ-связывающих белков суперсемейства ras, которые вовлечены в везикулярный транспорт молекул между клеточными органеллами. GDIB экспрессируется повсеместно. Плазматическая глутатион-пероксидаза (GPX3) принадлежит к семейству глутатионпероксидаз и катализирует восстановление перекиси водорода, органических гидроперекисей и липидпероксидов восстановленным глутатионом, обеспечивая защиту клеток от окислительного повреждения. Было показано, что глутатионпероксидаза плазмы крови человека является ферментом, содержащим селен. Экспрессия GPX3, по-видимому, является тканеспецифичной. Глутатионсинтетаза (GSHB) является важной для осуществления различных биологических функций, включая защиту клеток от окислительного повреждения свободными радикалами, детоксикацию ксенобиотиков и мембранный транспорт. Гельзолин (GSN40 и GSN80) - это кальций-регулируемый, актин-модулирующий белок, который связывается с плюс-концами мономеров актина или актиновых филаментов, предотвращая обмен мономеров (блокировка концов или кэпирование). Он может облегчать сборку мономеров в филаменты (нуклеация), а также разъединять существующие филаменты. Кроме того, этот белок связывает с актином и фибронектином. Он был отнесен к раку мочевого пузыря, хотя он не был описан как биомаркер: это означает, что уровень его экспрессии не сравнивался и не определялся количественно у здоровых индивидуумов по сравнению с пациентами, больными раком (Rasmussen, H.H. et al., J Urol 1996, 155:2113-2119;Haga K. Hokkaido Igaku Zasshi 2003, 78:29-37; Cells A. et al., Electrophoresis 1999, 20:355-61). Глутатион-S-трансфераза (GSTP1) принадлежит к семейству ферментов, которые играют важную роль в детоксикации, катализируя конъюгацию многих гидрофобных и электрофильных соединений с восстановленным глутатионом. Цитоплазматическая изоцитрадегидрогеназа (IDHC) принадлежит к семейству изоцитрат- и изопропилмалатдегидрогеназ и катализирует окислительное декарбоксилирование изоцитрата с образованием альфа-кетоглутарата. Предшественник везикулярного интегрального мембранного белка VIP36 (LMAN2) играет важную роль как внутриклеточный лектин в осуществлении начальных путей секреции. Он взаимодействует с Nацетил-D-галактозамином и гликанами, обогащенными маннозой, а также может взаимодействовать с Освязанными гликанами. Этот белок вовлечен в транспорт и сортировку гликопротеинов, несущих гликаны, обогащенные маннозой. Комплекс 6 лимфоцитарного антигена, локус 6 G6E (LY6G6E), принадлежит к суперсемейству лимфоцитарного антигена 6. Члены этого семейства представляют собой обогащенные цистеином и в основном заякоренные через GPI белки клеточной поверхности, которые играют установленную или предполагаемую роль в отношении иммунитета. Его специфическая функция неизвестна. Предшественник маннан-связывающего лектина-сериновой протеазы 2 (MASP2) принадлежит к семейству пептидазs1 и является трипсиновой протеазой, которая, по-видимому, играет важную роль в инициации пути активации комплемента через лектин, связывающий маннозу (MBL). После активации он расщепляет С 4,что приводит к получению С 4 А и С 4 В. Никотинатнуклеотидпирофосфорилаза (NADC) принадлежит к семейству nadC/mod. Она является интермедиатом в пути синтеза de novo НАД из триптофана. Этот фермент действует как мощный эндогенный эксайтотоксин за счет гиперстимуляции N-метил-D-аспартатного (NMDA) рецептора в нейроне.-3 013927 Повышение уровня NADC в мозге связывали с патогенезом нейродегенеративных расстройств, таких как эпилепсия, болезнь Альцгеймера и болезнь Хантингтона. Этот маркер пока что не относили к раку. Напсин A (NAPSA) принадлежит к семейству al пептидаз и имеет высокий уровень экспрессии в почках, средний - в легких и низкий - в селезенке и жировой ткани. Он может быть вовлечен в процессинг предшественников сурфактанта пневмоцитов. Белок, ассоциированный с пролиферацией 2G4 (PA2G4), является белком, связывающимся с одноцепочечной ДНК, который изменяет локализацию в ядре специфично по отношению к клеточному циклу. Он принадлежит к семейству пептидаз m24 с. Поскольку белок экспрессируется в ответ на стимуляцию митогеном, он может принадлежать к большому семейству регуляторных белков клеточного цикла или белков репликации, которые поддерживают активность клеточного цикла пролиферирующих клеток. Онкоген DJ1 (PARK7) в больших количествах экспрессируется в поджелудочной железе, почке,скелетной мышце, печени, семенниках и сердце, действуя как позитивный регулятор транскрипции, зависящей от рецептора для андрогена. Он может функционировать как редокс-чувствительный шаперон и как сенсор окислительного стресса. Он предотвращает агрегацию SNCA и защищает нейроны от окислительного стресса и клеточной смерти. Поли(rc)-связывающий белок 1 (РСРВ 1) представляет собой белок, связывающий одноцепочечную нуклеиновую кислоту, который связывается предпочтительно с олиго-dC. Он может курсировать между ядром и цитоплазмой. В значительных количествах он экспрессируется в скелетной мышце, тимусе и лейкоцитах периферической крови, в то время как низкий уровень экспрессии наблюдается в простате,селезенке, семенниках, яичниках, тонком кишечнике, сердце, печени, надпочечниках и щитовидной железе. Белок 6, связанный с программируемой клеточной смертью (PDC6I), экспрессируется в мозге,сердце, плаценте, легких, почках, поджелудочной железе, печени, скелетной мышце и улитке органа слуха, и может играть определенную роль в регуляции как апоптоза, так и пролиферации клеток. Это белок взаимодействует с PDCD6/ALG-2 и SH3KBP1. Предшественник лизосомальной кислой фосфатазы (PPAL) принадлежит к семейству гистидиновых кислых фосфатаз и осуществляет гидролиз моноэфиров ортофосфата до спиртов и фосфата. Пероксиредоксин 2 (PRDX2) является членом семейства ahpc/tsa, он вовлечен в процессы редокс-регуляции клетки. Он восстанавливает пероксиды с использованием восстанавливающих эквивалентов, обеспечиваемых системой тиоредоксина. Он не способен получать электроны от глутаредоксина. Этот белок может играть важную роль в уничтожении пероксидов, генерируемых в процессе обмена веществ. Он может участвовать в сигнальном каскаде, обеспечиваемом ростовыми факторами и альфа-фактором некроза опухоли, регулируя внутриклеточную концентрацию Н 2 О 2. Он усиливает клеточную активность природных киллеров (NK). Глутамил-пептидциклотрансфераза (QPCT) ответственна за биосинтез пироглутамилпептидов. Она имеет склонность к гидролизу пептидной связи, в которой кислые остатки и триптофанил находятся рядом с N-концевой глутаминовой кислотой. Ретинол-связывающий белок плазмы (RETBP) принадлежит к семейству липокалина и является специфическим переносчиком ретинола (витамина А в виде спирта) в крови. Он доставляет ретинол от места хранения в печени к периферическим тканям. В плазме комплекс RBP-ретинол взаимодействует с транстиретином, который предотвращает его потерю при фильтрации через почечные клубочки. Дефицит витамина А блокирует секрецию связывающего белка посттрансляционно, что приводит к неправильной доставке и запасанию его в эпидермальных клетках. Белок, связывающий селен (SBP1), принадлежит к семейству белков, связывающих селен. Селен является незаменимым пищевым компонентом, который обладает мощными антикарценогенными свойствами; дефицит селена может вызывать определенные нейрологические заболевания. Было высказано предположение, что эффекты селена по предотвращению рака и нейрологических заболеваний могут быть опосредованы белками, связывающими селен. Индуцированный стрессом фосфопротеин 1 (STIP1) является адапторным белком, который опосредует ассоциацию молекулярных шаперонов HSC70 и HSP90 (HSPCA и HSPCB). Трансальдолаза (TALDO) принадлежит к семейству трансальдолаз и является ключевым ферментом в неокислительном пентозо-фосфатном пути, обеспечивая получение рибозо-5-фосфата для синтеза нуклеиновых кислот и НАДФН для биосинтеза липидов. Этот метаболический путь может также поддерживать глутатион в восстановленном состоянии и, таким образом, защищать сульфгидрильные группы и целостность клетки от радикалов кислорода. Транстиретин (TTHY, ранее преальбумин) является одним из 3 белков, обнаруживаемых в крови позвоночных животных и связывающих тироидные гормоны. Он производится в печени и циркулирует в кровеносном русле, где связывает ретинол и тироксин. Содержащий WD повторы белок 1 (WDR1) принадлежит к семейству aipl с wd-повторами и индуцирует разборку актиновых филаментов в сочетании с белками семейства ADF/кофилин. Рак может быть обнаружен путем анализа характера экспрессии по меньшей мере одного биомаркера рака мочевого пузыря в тестируемом образце мочи. Таким образом, выявление по меньшей мере-4 013927 одного дифференциально экспрессируемого белка в анализируемом образце мочи по сравнению с нормальной мочой является индикатором ПККМП. Образцы мочи по составу очень различаются. Следовательно, чтобы учесть различия в общей концентрации белка и устранить отклонения, наблюдаемые от образца к образцу, необходима нормализация. Для нормализации уровня сигнальных белков можно использовать уровень экспрессии контрольного белка, содержание которого в моче всегда постоянно. В литературе есть много примеров таких невариабельных белков. В настоящем изобретении было показано, что невариабельным белком является трансферрин. Репрезентативные белки рака мочевого пузыря или биомаркеры, идентифицированные в настоящем изобретении, включают, но не ограничиваются этим, TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA,BLVRB, CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, ШНС, LMAN2,LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1,STIP1, TALDO, WDR1, AMY, APOA1, GSN40, GSN80 и RETBP (называются здесь также как 40 биомаркеров рака мочевого пузыря). Один аспект настоящего изобретения относится к неинвазивному способу in vitro, который включает: а) выявление и количественную оценку одного или более биомаркеров, представленных в образце тестируемой мочи, взятом у индивидуума; и b) сравнение данных об экспрессии, полученных в а) в тестируемом образце мочи, по сравнению со стандартным значением в нормальной моче, где вариации, полученные в измеренном уровне а), по сравнению с соответствующим стандартным значением в нормальной моче являются индикаторами ГЖКМХТ. Этот способ может быть адаптирован для скрининга, проводимого с целью выявления присутствия ПККМП, определения стадии и тяжести этого вида рака. Кроме того, этот способ может также применяться для оценки отсутствия болезни после хирургической резекции, для установления диагноза и/или прогноза этой формы рака и/или для мониторинга эффекта лечения, применяемого для индивидуума, который страдает от названной формы рака. Другой аспект настоящего изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, представленных в моче, для определения присутствия ПККМП путем анализа мочи, для выявления стадии или тяжести этой формы рака, для оценки отсутствия заболевания после хирургической резекции, для установления диагноза и/или прогноза этой формы рака и/или для наблюдения за эффектом лечения, применяемого для индивидуума, страдающего от названной формы рака. Другой аспект настоящего изобретения относится к применению одной или более нуклеотидных или пептидных последовательностей, происходящих из 40 биомаркеров рака мочевого пузыря или транскрипционного или посттрансляционного варианта этого по одному или в любом сочетании в способах скрининга, идентификации, разработки или оценки эффективности терапевтических агентов для лечения ПККМП. Дополнительно изобретение обеспечивает антитела, направленные против таких биомаркеров рака. Эти антитела могут быть обеспечены в различных формах, как подходящих для определенного применения, включая, к примеру, растворимую форму, форму, иммобилизованную на субстрате, или в комбинации с фармацевтическим приемлемым носителем. Другой аспект изобретения относится к набору реактивов для осуществления предварительно определенного способа, включая: 1) по меньшей мере одно антитело, которое специфически распознает один биомаркер рака в моче, и 2) растворитель в подходящей упаковке. Другой аспект изобретения относится к контрольному профилю экспрессии белков при ПККМП,включающему профиль экспрессии одного или более биомаркеров рака мочевого пузыря. Можно определить различные контрольные профили экспрессии белков при ПККМП и соотнести их с различными стадиями развития болезни. Для целей настоящего изобретения могут применять следующие определения. Термин "рак" относится к заболеванию, которое обычно характеризуется аномальным или нерегулируемым ростом клеток, способных проникать в прилегающие ткани и распространяться в отдаленные органы. Термин "карцинома" относится к ткани, возникающей вследствие аномального или нерегулируемого роста клеток. Термин "переходно-клеточная карцинома мочевого пузыря" или его сокращение"ПККМП" относится к любому злокачественному пролиферативному расстройству в клетках эпителия мочевого пузыря. Термин "опухоль" относится к любой аномальной массе ткани, возникающей вследствие неопластического процесса, независимо от того, является ли она доброкачественной (нераковой) или злокачественной (раковой). Термин "белки рака мочевого пузыря или биомаркеры" относится к белкам, дифференциально экспрессируемым при ПККМП, то есть к белкам, которые различным образом экспрессируются в клетках мочи здорового индивидуума по сравнению с клетками мочи пациента с ПККМП. В настоящем изобретении группа белков, состоящая из дифференциально экспрессируемых белков, включает как 40 биомаркеров, выбранных из группы, включающей как TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB,CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, STIP1,-5 013927TALDO, WDR1, AMY, APOA1, GSN40, GSN80 и RETBP, так и любой белок из образца мочи, концентрация которого изменяется, по меньшей мере в два раза по сравнению с двумя различными образцами мочи: одним, полученным от здорового индивидуума, и вторым, полученным от пациента с ПККМП,количественное определение проводится с помощью программ анализа изображения, к примеру программы Progenesis PG220. Биомаркеры рака мочевого пузыря, как описано здесь, могут быть любой длины и, кроме того, включать дополнительные последовательности, происходящие из нативного белка и/или гетерологачных последовательностей, транскрипционных или посттранскрипционных вариантов, а также любой последовательностью, которая имеет по меньшей мере 95% идентичность с описанными последовательностями, где идентичность определяется как процент остатков, которые идентичны при сравнении между двумя последовательностями. Специалисты поймут, что эти другие части или варианты также могут быть полезными при лечении и диагностике рака. Термин "детектирование одного или более биомаркеров" означает определение существования одного или более биомаркеров, где термин "количественное определение одного или более маркеров" означает выражение присутствия одного или более биомаркеров в виде значения (например, значения интенсивности). Термин показатель ПККМП означает, что вариации, обнаруженные при измерении одного или более биомаркеров в тестируемом образце мочи, по сравнению с соответствующим стандартным значением служат доказательством наличия ПККМП. Термин "вариация" относится к изменению уровня экспрессии белка. Термин "дифференциально экспрессируемый белок" относится к белку, экспрессия которого изменяется (снижается или возрастает) в моче пациента с ПККМП по сравнению со здоровым индивидуумом. Термин "экспрессируемый обратным образом" относится к двум дифференциально экспрессируемым белкам, характер экспрессии которых является противоположным (это означает, что в образце один характеризуется сверхэкспрессией, а экспрессия другого подавлена, и наоборот). Термин "белковый экстракт" соответствует супернатанту, полученному после центрифугирования образца мочи. Термин "индивидуум" относится ко всем видам животных, классифицируемых как млекопитающие,и включает, но не ограничивается этим, домашних животных и животных, разводимых на фермах, приматов и людей, и предпочтительно относится к мужчине или женщине любого возраста и расы. Термин"здоровый индивидуум" относится к индивидууму, который не страдает от ПККМП, и может включать пациентов, у которых имеются другие урологические заболевания. Термин "предварительно диагностированный" относится к индивидууму, который уже был диагностирован как пациент, имеющий ПККМП. Термин "предварительно не диагностированный" относится к индивидууму, которому никогда ранее не был присвоен диагноз ПККМП (диагностика de novo диагностика). Термин "стандартное значение, характерное для нормальной мочи" относится к количественному определению среднего уровня экспрессии одного или более биомаркеров, обнаруживаемых в единственных образцах мочи индивидуумов, которые известны, как не страдающие от ПККМП. Термин "диагноз" ПККМП относится к процессу идентификации или определения природы и причины ПККМП путем оценки одного или более маркеров ПККМП. Термин "прогноз" относится к вероятному исходу или курсу заболевания, что является шансом выздоровления или рецидива. Термин "мониторинг" означает оценку отсутствия или присутствия ПККМП у индивидуума во времени. Термин "лечение" относится к любому процессу, действию, применению или чему-то подобному, где индивидуумом является субъект медицины, на которого направлены действия с целью улучшения его состояния прямым или непрямым способом. Термин "специфичность" относится к способности теста исключить присутствие заболевания, когда его действительно нет. Специфичность выражается как количество здоровых индивидуумов, для которых произведено правильное негативное тестирование (эта группа называется истинно-негативными пациентами), разделенное на сумму количества истинно негативных и количества здоровых индивидуумов,для которых был получен неправильный позитивный результат (эта группа называется ложнопозитивными). Термин "чувствительность" относится к способности теста обнаруживать заболевание,когда оно действительно присутствует. Чувствительность выражается как количество больных пациентов, которым соответствует правильный позитивный тест (эта группа называется истинно-позитивными),деленное на сумму истинно-позитивных и больных пациентов, для которых был дан неправильный негативный тест (эта группа называется ложно-негативными). Термин "надежность" относится к способности численного метода обеспечивать правильный результат, невзирая на вариабельности в индивидуальных образцах. Термин "ген" относится к области молекулярной цепи дезоксирибонуклеотидов, которая кодирует белок и может представлять часть кодирующей последовательности или полную кодирующую последовательность. Термин "белок" относится по меньшей мере к одной молекулярной цепи аминокислот, связанных межмолекулярно через ковалентные либо нековалентные связи. Термин включает все формы посттрансляционных модификаций белка, например гликозилирование, фосфорилирование или ацетилирование. Термины "пептид" и "полипептид" относятся к молекулярным цепям аминокислот, которые представляют фрагмент белка. Термины "белок" или "пептид" являются взаимозаменяемыми.-6 013927 Термин "антитело" относится к белку с Y-подобной формой (известному как иммуноглобулин) на поверхности В-клеток, который секретируется в кровь или лимфу в ответ на антигенный стимул, такой как экзогенный белок, бактерия, вирус, паразит или трансплантируемый орган, и который проявляет специфическую связывающую активность по отношению к молекуле-мишени, называемой "антиген". Область связывания молекулы антигена на иммуноглобулине может быть разделена либо на F(ab')2, либо на Fab фрагменты. Термин "антитело" включает моноклональные или поликлональные антитела, включая интактные антитела и их фрагменты; он включает антитела человека, гуманизированные антитела и антитела, вырабатываемые не человеком. Антитело "не человеческого происхождения" представляет собой антитело, которое производится иным видом животного, нежели Homo sapiens. "Гуманизированное антитело" представляет собой антитело, произведенное генно-инженерным способом, в котором минимальная мышиная часть мышиного антитела соединена с антителом человека. В основном гуманизированные антитела представляют собой на 5-10% мышиные антитела и на 90-95% человеческие. "Человеческое антитело" - это антитело, происходящее из трансгенных мышей, несущих гены человеческих антител, или из человеческих клеток. "Моноклональные антитела" являются гомогенными, высокоспецифичными популяциями антитела, направленного против единственного антигенного участка или "детерминанты" молекулы-мишени. Термин "поликлональные антитела" включает гетерогенные популяции антител, которые направлены против различных антигенных детерминант молекулы-мишени. Термин"специфическое антитело" относится к антителу, произведенному против специфического белка (в нашем случае против определенного маркера рака мочевого пузыря). Термин "комплекс антитело-белок" относится к комплексу, образованному антигеном со специфическим по отношению к нему антителом. Термин "комбитело" (комбинаторное антитело) относится к антителу, экспонированному на нитчатых фагах, что позволяет проводить прямой скрининг кДНК библиотек для экспрессии реактивных поверхностных антигенов клетки без необходимости продукции антитела и его очистки с применением бактериальных или эукариотических клеточных систем. Термин "рекомбинантное антитело Fab" относится к рекомбинантному антителу, которое включает только Fab фрагмент, которое является моновалентным и полезным, когда антитело имеет очень высокое сродство к антигену. Если последовательность белка известна, они могут быть получены рекомбинантно. Термин "фрагмент антитела ScFv" относится к одной цепи вариабельного фрагмента (scFv), которая может быть экспрессирована в бактериальных культурах. Термин "эпитоп" относится к антигенной детерминанте белка, которая является аминокислотной последовательностью белка, которую распознает специфическое антитело. Такие эпитопы могут заключать в себе участок с соседними аминокислотами (линейный эпитоп) или несоседние аминокислоты, которые сближены друг с другом за счет трехмерного сворачивания полипептидной цепи (прерывистые эпитопы). Термин "твердая фаза" относится к неводному матриксу, с которым может быть связано антитело. Примеры материалов для твердой фазы включают, но не ограничиваются этим, стекло, полисахариды (например, агароза), полиакриламид, полистирен, поливиниловый спирт и силиконы. Примерами твердофазных форм являются ячейка планшета или колонка для очистки. Термин "погружаемый индикатор" относится к устройству, погруженному в жидкость для выполнения некоторых типов анализа, в результате которых можно определить или измерить количественно некоторые свойства жидкости (химические, физические и т.д.). Этот тип погружаемого индикатора приготавливается обычно из бумаги или картона и пропитывается реагентами, изменение окраски которых указывает на свойство жидкости. Термин "растворитель" относится к механизму или устройству, с помощью которого что-либо переносится или проводится. Термин "упаковка" относится к емкости и упаковке перед продажей, применяемых с первичной целью облегчить покупку и применение продукта. Термин "биочип" относится к набору миниатюрных участков тестирования (микроматрицы), расположенных на твердом субстрате, что позволяет выполнять много анализов одновременно, чтобы достичь более высокой пропускной способности и скорости. В одном воплощении изобретения первая стадия способа оценки рака мочевого пузыря включает измерение одного из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA,BLVRB, CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2,LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1,STIP1, TALDO, WDR1, AMY, APQA1, GSN40, GSN80 и RETBP (называемых также 40 биомаркерами рака мочевого пузыря), или их транскрипционного или посттранскрипционного варианта в тестируемом образце мочи, полученном от индивидуума. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB,CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, STIP1,TALDO и WDR1, или их транскрипционного или посттранскрипционного варианта в тестируемом образце мочи, полученном от индивидуума. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение по меньшей мере двух биомаркеров или их транскрипционного или посттрансляционного варианта этого в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря-7 013927 включает измерение по меньшей мере трех биомаркеров или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение по меньшей мере четырех биомаркеров или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение по меньшей мере пяти биомаркеров или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ANXA4, BIEA, BLVRB, CATD H,CATD K, СО 3, CPQL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LY6G6E, MASP2, NADC,NAPS A, PA2G4, PARK7, РСВР 1, PRDX2, PTDQ12, QPCT, SBP1, STIP1, AMY, APQA1, GSN40, GSN80 иRETBP, или транскрипционного или их посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ANXA4, BIEA, BLVRB, CATD H,CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LY6G6E, MASP2, NADC,NAPSA, PA2G4, PARK7, PCBP1, PRDX2, PTD012, QPCT, SBP1 и STIP1, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, FRIL, GSHB, GSTP1,IDCH, MASP2, PRDX2, AMY, APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, FRIL, GSHB, GSTP1,IDCH, MASP2 и PRDX2, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, AMY, APOA1, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение АРОА 1 и RETBP, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, APOA1 и GSN40, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, APOA1 и ENOA, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение АРОА 1, GSN40 и TTHY, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеCATD K, GSN80 и IDHC, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, APOA1, GSN40 и IDHC, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAPQA1, GSN4Q, GSN80 и TTHY, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеCATD H, ENOA, GSTP1 и PRDX2, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеCATD K, ENOA, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, CATD K, ENOA, IDHC и PRDX2, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, APOA1, GSN40, GSN80 и TTHY, или транскрипционного или их посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеCATD H, ENOA, GSTP1, MASP2, PRDX2 и TTHY, или их транскрипционного или посттрансляционного-8 013927 варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерениеAMY, APOA1, CATD K, ENOA, IDHC, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из AMY, APOA1, GSN40, GSN80, или их транскрипционного или посттрансляционного варианта и одного или более биомаркеров, выбранных из TTHY, ACY1,AKR1A1, ALDOB, ANXA4, BIEA, BLVRB, CATD H, CATD K, C03, CPGL1, ENOA, FRIL, GDIB, GPX3,GSHB, GSTP1, IDHC, LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL,PRDX2, PTD012, QPCT, SBP1, STIP1, TALDO, WDR1 и RETBP, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из AMY, APOA1, GSN40, GSN80, или их транскрипционного или посттрансляционного варианта и одного или более биомаркеров, выбранных из TTHY, ACY1,AKR1A1, ALDOB, ANXA4, BIEA, BLVRB, CATD Н, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3,GSHB, GSTP1, IDHC, LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL,PRDX2, PTD012, QPCT, SBP1, ST1P1, TALDO и WDR1, или их транскрипционного или посттрансляционного варианта в тестируемом образце мочи. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из CATD H, CATD K, ENOA, GSHB, GSTP1, IDHC, PRDX2 иTTHY, или их транскрипционного или посттрансляционного варианта и одного или более биомаркеров,выбранных из ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB, СО 3, CPGL1, FRIL, GDIB, GPX3,LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PTD012, QPCT, SBP1,STIP1, TALDO, WDR1, AMY, APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта. В другом воплощении первая стадия способа оценки рака мочевого пузыря включает измерение одного или более биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, GSTP1, IDHC, MASP2,PRDX2, AMY, APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта. Другое воплощение относится к неинвазивному способу in vitro, который включает количественное определение одного или более соотношений между двумя различными биомаркерами, выбранными из 40 биомаркеров, или их транскрипционного или посттрансляционного варианта, в тестируемом образце мочи, взятом у индивидуума, и сравнение измерения, полученного в тестируемом образце, с соответствующим стандартным значением в нормальной моче, при этом изменения являются индикатором присутствия ПККМП. В другом воплощении способ позволяет определить прогрессию заболевания, когда сравниваются один и тот же белок или белки из различных образцов, полученных от одного и того же пациента в различные времена при развитии ПККМП. В другом воплощении могут применяться один или более биомаркеров изобретения для мониторинга эффективности фармакологического или хирургического лечения. В другом воплощении образец, который анализируется, получен от индивидуума, у которого предварительно не диагностирована ПККМП. В другом воплощении образец, который анализируется, получен от индивидуума, у которого предварительно диагностирована ПККМП. В другом воплощении образец, который анализируется, получен от индивидуума, получающего в настоящее время лечение против ПККМП. В другом воплощении способ включает получение экстракта белков образца. Измерение обычно включает методы спектрометрии или иммунного анализа. Спектрометрия - это обычно масс-спектрометрия с применением метода усиленной поверхностью лазерной десорбции/ионизации (SELDI) или масс-спектрометрия с применением метода опосредованной матриксом лазерной десорбции/ионизации (MALDI). Иммуноанализ включает методы Вестерн-блот, ELISA (иммуноферментный анализ на сорбенте), RIA (радиоиммуноанализ), конкурентный EIA (конкурентный иммуноферментный анализ), DAS-ELISA (сэндвич-ELISA с двумя антителами), иммуноцитохимические или иммуногистохимические методы, методы, основанные на применении биочипов или микрорядов белков,которые включают специфические антитела, анализы, основанный на преципитации коллоидного золота в таких форматах как погружаемые индикаторы, или методы аффинной хроматографии, анализы со связыванием лигандов или со связыванием лектинов. В другом воплощении способ выявления рака включает контакт образца мочи с молекулой, которая специфически связывается с биомаркером рака мочевого пузыря, и количественная оценка этого связывания. В другом воплощении выявление и количественная оценка белков включает первую стадию, в которой белковый экстракт образца контактирует с композицией одного или более специфических антител-9 013927 против одного или более эпитопов белка или белков, и вторую стадию, в которой комплексы, образованные антителами и белками, оцениваются количественно. В другом воплощении специфические антитела, которые применяются для выявления белков, являются белками человека, либо представляют собой гуманизированные или негуманизированные антитела, которые выбираются из моноклональных или поликлональных антител, интактных или рекомбинированных фрагментов антител, комбител и Fab или scFv фрагментов антител. Другое воплощение относится к применению одной или более пептидных последовательностей,происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB,CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, ST1P1,TALDO, WDR1, AMY, APOA1, GSN4Q, GSN80 и RETBP, или их транскрипционных или посттрансляционных вариантов, причем биомаркеры присутствуют в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4,BIEA, BLVRB, CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC,LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012,QPCT, SBP1, STIP1, TALDO и WDR1, или их транскрипционного или посттрансляционного варианта,причем биомаркеры присутствуют в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров рака, где изменения в измерении этих биомаркеров в тестируемом образце мочи по сравнению с соответствующим стандартным значением в нормальной моче является индикатором ППК. В другом воплощении применяется по меньшей мере два биомаркера, представленных в моче, или их транскрипционный или посттрансляционный вариант, в другом воплощении применяются по меньшей мере три биомаркера, представленных в моче, или их транскрипционный или посттрансляционный вариант. В другом воплощении применяется по меньшей мере четыре биомаркера, представленных в моче, или их транскрипционный или посттрансляционный вариант. В другом воплощении применяется по меньшей мере пять биомаркеров, представленных в моче, или их транскрипционный или посттрансляционный вариант. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ANXA4, BIEA,BLVRB, CATD H, CATD K, СО 3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PRDX2, PTD012, QPCT, SBP1, STIP1, AMY, APOA1,GSN40, G3N8Q и RETBP, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ANXA4, BIEA,BLVRB, CATD H, CATD K, C03, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PRDX2, PTD012, QPCT, SBP1 и STIP1, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, FRIL,GSHB, GSTP1, IDCH, MASP2, PRDX2, AMY, APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, CATD H, CATD K, ENOA, FRIL,GSHB, GSTP1, IDCH, MASP2 и PRDX2, или их транскрипционного или посттрансляционного варианта,причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, AMY, APOA1, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из АРОА 1 и RETBP, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из AMY, APOA1 и GSN40, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из АРОА 1 и ENOA, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из АРОА 1, GSN40 и TTHY, или их транскрипци- 10013927 онного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из CATD K, GSN80 и IDHC, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из АРОА 1, GSN40, GSN80 и TTHY, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из AMY, APOA1, GSN40 и IDHC, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из CATD H, ENOA, GSTP1 и PRDX2, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из CATD K, ENOA, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из AMY, CATD K, ENOA, IDHC и PRDX2, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из AMY, АРОА 1, GSN40, GSN80 и TTHY, или их транскрипционного или посттрансляционного варианта этого, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из CATD H, ENOA, GSTP1, MASP2, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из AMY, APOA1, CATD K, ENOA, IDHC, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из AMY, АРОА 1, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта, и одной или более пептидных последовательностей,происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB,CATD H, CATD K, СО 3 CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, РСВР 1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, STIP1,TALDO, WDR1 и RETBP, или их транскрипционного или посттрансляционного варианта, причем биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из AMY, АРОА 1, GSN40 и GSN80, или их транскрипционного или посттрансляционного варианта, и одной или более пептидных последовательностей,происходящих из биомаркеров, выбранных из TTHY, ACY1, AKR1A1, ALDOB, ANXA4, BIEA, BLVRB,CATD H, CATD K, CO3, CPGL1, ENOA, FRIL, GDIB, GPX3, GSHB, GSTP1, IDHC, LMAN2, LY6G6E,MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PRDX2, PTD012, QPCT, SBP1, STIP1,TALDO и WDR1, или их транскрипционного или посттрансляционного варианта, где биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из CATD H, CATD K, ENOA, GSHB, GSTP1,IDHC, PRDX2 и TTHY, или их транскрипционного или посттрансляционного варианта, и одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из ACY1, AKR1A1,ALDOB, ANXA4, BIEA, BLVRB, СО 3, CPGL1, FRIL, GDIB, GPX3, LMAN2, LY6G6E, MASP2, NADC,NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PTD012, QPCT, SBP1, STIP1, TALDO, WDR1, AMY,APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта, где биомаркеры представлены в моче. Другое воплощение изобретения относится к применению одной или более пептидных последовательностей, происходящих из биомаркеров, выбранных из TTHY, CATD Н, CATD K, ENOA, GSTP1,IDHC, MASP2, PRDX2, AMY, APOA1, GSN40, GSN80 и RETBP, или их транскрипционного или посттрансляционного варианта, где биомаркеры представлены в моче. Другое воплощение относится к набору реактивов для осуществления способа, как это определено предварительно, включая: 1) любую комбинацию антител, которая специфически распознает один или более из этих белков, и 2) растворитель в подходящей упаковке, набор реактивов, применяемый для выявления присутствия ППК, для определения стадии или тяжести этой формы рака, для оценки отсутствия заболевания после хирургической резекции, для установления диагноза и/или прогноза этой формы рака- 11013927 и/или для мониторинга эффекта лечения, получаемого индивидуумом, страдающим от названного рака. Набор реактивов может включать контейнер для хранения по меньшей мере одного агента, который связывается с биомаркером, представленным в образце мочи; и инструкции для применения по меньшей мере одного агента для определения статуса ПККМП. Такие наборы могут включать растворитель, упаковку или контейнер, который разделен на части для получения одного или более контейнеров, таких как пузырьки, пробирки и подобное, каждый контейнер(ы) включает один или более раздельных элементов,которые применяются в способе. Например, контейнер(ы) может включать зонд, который помечен или может быть помечен и обнаружен в дальнейшем. Этот зонд может быть антителом или полинуклеотидом, специфичным по отношению к белку рака мочевого пузыря или гену рака мочевого пузыря соответственно. Альтернативно набор может включать масс-спектрометрический (MS) зонд. Этот набор реактивов может включать также контейнеры, содержащие нуклеотид(ы) для амплификации или сайленсинга последовательности нуклеиновой кислоты-мишени, и/или контейнер, включающий репортерную молекулу для выявления метки, такую как биотин-связывающий белок, например, авидин или стрептавидин,связанные с обнаруживаемой меткой, например, ферментативной, флуоресцентной или радиоизотопной меткой. Набор реактивов может включать всю или часть аминокислотной последовательности биомаркеров рака мочевого пузыря или молекулу нуклеиновой кислоты, которая кодирует такие аминокислотные последовательности. Типично набор изобретения будет включать контейнер, описанный выше, и один или более других контейнеров, включающий материалы, желательные с коммерческой точки зрения или точки зрения пользователя, включая буферы, растворители, фильтры, иглы, шприцы и вставленную в упаковку инструкцию для применения. Кроме того, на контейнере должна быть этикетка, показывающая,что композиция предназначена для специфического терапевтического или нетерапевтического применения, и может также содержать указания для применения, как те, что описаны выше. Указания и другая информация может быть также включена во вкладыш, который содержится в наборе реактивов. Другое воплощение относится к набору реактивов для осуществления способа, как это определено предварительно, включающему биочип. Другое воплощение относится к набору реактивов для осуществления способа, как это определено предварительно, включающему биочип, где биочип включает антитела для детектирования одного или более биомаркеров, выбранных из 40 биомаркеров рака мочевого пузыря, или их транскрипционного или посттрансляционного варианта. Существует широкий ряд иммунологических анализов, полезных для детектирования и/или количественной оценки образования специфических комплексов антиген-антитело; ранее было описаны многочисленные системы анализа, основанные на конкурентных и неконкурентных способах определения связывания белков, и большое число этих способов доступно коммерчески. Следовательно, белки могут быть, определены количественно с помощью антител, таких, к примеру, как моноклональные антитела,поликлональные антитела, или интактные или рекомбинантные фрагменты этого, комбитела и Fab илиscFv фрагменты антител, специфичных по отношению к белкам. Эти антитела могут быть человеческими, гуманизированными или антителами животных. С другой стороны, они могут быть помечены или оставаться немечеными, и могут применяться в широком ряду систем анализа. Молекулы маркеров, которые могут применяться с целью мечения антител, включают радионуклиды, ферменты, флуорофоры,хемолюминисцентные реагенты, субстраты или кофакторы ферментов, ингибиторы ферментов, частицы,красители и производные. Чем выше специфичность связывания антитела, тем более низкие концентрации антигена могут быть обнаружены. Существует широкое разнообразие систем анализов, хорошо известных специалистам, которые могут применяться в настоящем изобретении, в которых используются немеченые антитела (первичные антитела) и меченые антитела (вторичные антитела); эти методы включают, но не ограничиваются этим,Вестерн-блот или Вестерн-перенос, ELISA (иммуноферментный анализ на сорбенте), RIA (радиоиммуноанализ), конкурентный EIA (конкурентный иммуноферментный анализ), DAS-ELISA (сэндвич-ELISA с двумя антителами), иммуноцитохимические и иммуногистохимические методы, методы, основанные на применении биочипов или белковых рядов, которые включают специфические антитела или коллоидную преципитацию в таких форматах, как погружаемый индикатор. Другие пути выявления и/или количественного определения белков включают методы аффинной хроматографии, системы анализа со связыванием лигандов или лектинов. Предпочтительными воплощениями этого аспекта изобретения являются белковые микроряды и сэндвич- ELISA с двумя антителами (DAS-ELISA). В этих системах иммуноанализа может применяться любое антитело или комбинация антител, которые специфичны по отношению к одному или более эпитопам 40 белков изобретения. В примере одного из многих возможных форматов этого анализа моноклональное или поликлональное антитело или фрагмент этого антитела или комбинация этих антител, которые распознают один или более эпитопов из 40 белков изобретения, прикрепляются к поверхности твердофазной подложки, помещаются в контакт с анализируемым образцом и инкубируются определенное время в подходящих условиях для образования комплексов антигенантитело. После промывания в подходящих условиях для удаления неспецифических комплексов, индикаторный реагент, состоящий из моноклонального или поликлонального антитела, или фрагмент этого антитела, или комбинация этого, которая распознает один или более эпитопов 40 белков изобретения,- 12013927 связанный с молекулой, генерирующей сигнал, инкубируется с комплексами антиген-антитело в подходящих условиях (нужное время при подходящей температуре). Детектируется присутствие в анализируемом образце одного или более белков, выбранных из 40 белков изобретения, и количественно измеряется генерируемый сигнал. Для того чтобы предотвратить вариации сигнала, обусловленные различиями в общей концентрации белка в разных образцах, все измерения нормализуются. Как указано выше, способ изобретения включает мониторинг стадии развития карциномы мочевого пузыря путем количественного измерения дифференциально экспрессируемых растворимых белков в образце мочи с помощью специфических антител. Как будет ясно для специалистов, возможно применение любых способов идентификации и количественной оценки этих белков. В описании, которое следует ниже, раскрыт общий способ получения и анализа общего содержания белка в образце мочи человека (называемый здесь образцом). Способ включает обработку образцов,применение двумерно электрофореза для разделения белков образца, выбор дифференциально экспрессируемых белков путем анализа изображений и статистический анализ различных образцов, и применение одного или более из дифференциально экспрессируемых белков изобретения для получения антител,специфических по отношению к белкам, которые применяются как маркеры рака мочевого пузыря. Для идентификации дифференциально экспрессируемых белков на различных стадиях развития рака мочевого пузыря и во время прогрессии рака мочевого пузыря был выполнен сравнительный протеомный анализ образцов, полученных из здоровых индивидуумов (контроль) и пациентов, у которых была диагностирована ПККМП (стадия Та, низкая стадия Т 1, высокая стадия Т 1 и Т 2). Среди всех пациентов,для которых была характерна дифференциальная экспрессия, концентрация 40 белков изменялась более чем в два раза повторяющимся образом. Они были идентифицированы методом отпечатка пальцев по массе пептидов с применением масс-спектрометрии и путем поиска в базе данных. Сведения, подтверждающие возможность осуществления изобретения Настоящее изобретение будет дополнительно проиллюстрировано следующими примерами. Эти примеры даются лишь для иллюстрации и не должны истолковываться как лимитирующие изобретение.I. Идентификация дифференциально экспрессируемых белков. Для идентификации с применением протеомного подхода белков, экспрессируемых дифференциально при развитии рака мочевого пузыря, было проведено сравнение профиля белков в моче здоровых пациентов с таковыми, у которых был диагностирован рак мочевого пузыря ранних и поздних стадий. Были собраны образцы мочи (всего 150) у здоровых индивидуумов и у пациентов с переходноклеточным раком мочевого пузыря, посещающих отделение урологии госпиталей, принадлежащих к сети здравоохранения Испании. Эти образцы были классифицированы следующим образом.a) Отсутствие карциномы (63 образца), включая контрольные пациенты (CV, 32 образца): пациенты, которые имели рак мочевого пузыря и перенесли операцию по резекции опухоли и находились на стадии контроля (цитоскопия показала отсутствие других осложнений). Пациенты с другими заболеваниями урологического тракта (31 образец, включая среди других доброкачественную гиперплазию простаты, рак простаты);b) ПККМП (87 образцов): диагностированные пациенты, находящиеся на различных стадиях развития болезни, включая Та (21 образец),Т 1 - низкая стадия (29 образцов),Т 1 - высокая стадия (19 образцов),Т 2 - (18 образцов). Группа образцов ПККМП сопровождалась также биопсией, которая играла ключевую роль в классификации опухоли по стадиям развития рака мочевого пузыря. А. Обработка образцов и разделение белков. Образцы мочи замораживали при температуре -80 С и доставляли в лабораторию в сухом льду, без перерыва в охлаждении. Образцы сохраняли при -80 С до тех пор, пока они не подвергались обработке. Образцы были очень гетерогенными, от светло-желтого цвета до красного со сгустками крови, прозрачные или включающие ткани в виде суспензии. Общий объем также очень различался, составляя от 5 до 100 мл. Концентрация белка образцов была в ряду от 20 мкг/мл до 2 мг/мл (средняя концентрация составляла 150 мкг/мл). Для получения белка образцы размораживали на льду и центрифугировали при 2000g в течение 5 мин при 4 С. Супернатант использовали для определения концентрации белка. Был рассчитан объем мочи, необходимый для осаждения 100 мкг белка из расчета, что эффективность преципитации белка 15% (вес/объем) трихлоруксусной кислоты (ТСА) составляет 75%. Остающийся объем мочи вновь замораживали при -80 С и хранили для проведения дополнительного двумерного электрофореза (если это было необходимо). ТСА и мочу смешивали и оставляли на 1 ч на льду, а затем центрифугировали в режиме 16000g 20 мин при 4 С с получением осадка преципитированных белков. Этот осадок промывали ацетоном, хранили при -20 С и высушивали путем испарения растворителя. Для выполнения экспериментов с двумерным электрофорезом в одном направлении проводили изо- 13013927 электрофокусирование (IEF), где белки разделяли в соответствии с их зарядом (pI); во втором направлении проводили ЭФ в ПААГ, где белки разделяли в соответствии с их молекулярной массой. Для проведения разделения в первом направлении высушенный осадок белков ресуспендировали в 450 мкл буфера для регидратации (мочевина 7 М, тиомочевина 2 М, CHAPS 2%, буфер IPG 2%, бромфеноловый синий 0,002%) в течение 1 ч при комнатной температуре. Буфер IPG (Amersham, кат.17-600-88) применяли так, что рН IEF изменялся в ряду 3-10. Для проведения IEF использовалась изоэлектрофокусирующая система Ettan IPGphor Isoelectric Focusing System (Amersham) в соответствии с инструкцией производителя. IEF было выполнено в иммобилизованных градиентах рН, называемых полосками IPG, которые были получены от фирмы Amersham (кат.17-6002-45). Солюбилизированные белки фокусировали на полосках в первом направлении через 16 ч активной регидратации геля при 30 В. Затем напряжение увеличивали до 8000 В, сила тока никогда не превышала 50 мкА на гель. IEF заканчивали, когда напряжение достигало 90000 В/ч. Для второго направления в лаборатории полимеризовали 12,5% акриламид в виде пластины 2620 см с использованием Ettan DALT Gel Caster для двенадцати гелей от фирмы Amersham. Белки на гелях разгоняли в вертикальной системе большого формата для двенадцати гелей (Ettan DALT twelve LargeFormat Vertical System) в соответствии с инструкцией производителя до тех пор, пока фронт электрофореза не выходил из геля. Гели окрашивали с применением набора реактивов для окрашивания нитратом серебра (Amersham, 17-1150-01), следуя инструкции производителя. Затем гели высушивали и хранили для последующего анализа изображений белковых пятен (фиг. 1 А). Белки из некоторых образцов мочи разделяли с помощью двумерного электрофореза более одного раза. В. Анализ белковых пятен на гелях. Каждый гель был сканирован для получения карты пятен для анализа изображения. Для анализа файлов с изображениями применяли программное обеспечение Progenesis PG220 от фирмы NonlinearDynamics (UK) с разрешением 300 dpi (точек на дюйм) и 8 бит/канал. Для увеличения разрешения анализ был выполнен в дискретных областях гелей. Для каждой области, названной А (фиг. 1 В), K (фиг. 1 С), R(фиг. 1D) и S (фиг. 1E), были отобраны лучшие гели и сканированы для анализа изображения. ПрограммаProgenesis PG220 трансформировала информацию плоского изображения в трехмерное, где интенсивность каждого пятна коррелировала с его объемом и с относительным количеством соответствующего белка в моче у индивидуума. С помощью программы для работы с таблицами была получена интенсивность каждого пятна на каждом геле. Эти необработанные данные были основой для последующего статистического анализа. Для выполнения статистического анализа каждого индивидуального пятна и сравнения его интенсивности в двух различных группах (например, CV и Та), для этого блока данных должно быть доказано нормальное распределение. Для сравнения пятен, принадлежащим двум группам, был применен t-тест Стюдента и получено значение р: это была теоретическая ошибка отнесения пятна к одной или другой подгруппе. Были отобраны только пятна со значениями р 0,05. Кратность изменения или среднее соотношение этих пятен было рассчитано как соотнесенное к 1) общему объему пятен образца, которое представляет собой теоретическое общее содержание белка, или к 2) к константно экспрессируемому белку,количество которого постоянно в каждом образце, или к 3) второму дифференциально экспрессируемому белку того же образца. Во внимание было также принято значение n или количество образцов. Для 40 белков была продемонстрирована статистическая значимость и надежность кратности их изменения при сравнении образцов мочи контрольных пациентов с образцами мочи от пациентов с диагностированным переходно-клеточным раком мочевого пузыря. Идентификация этих пятен была проведена методом масс-спектроскопии MALDI-TOF (опосредованная матриксом лазерная десорбционно/ионизационная времяпролетная спектроскопия). Те образцы мочи, двумерный электрофорез которых показал статистически значимые пятна, были вновь подвергнуты двумерному электрофорезу, и пятна были вырезаны из геля. Белки были подвергнуты перевариванию и проанализированы с помощью MALDI-TOF спектрометра. Метод отпечатка пальцев по массе пептидов позволил идентифицировать 40 белков, которые представляют собой TTHY, ACY1, AKR1A1, ALDOB,ANXA4, B1EA, BLVRB, CATD H, CATD K, СО 3, CPGL1, ENOAT FRIL, GDIB, GPX3, GSHB, GSTP1,IDHC, LMAN2, LY6G6E, MASP2, NADC, NAPSA, PA2G4, PARK7, PCBP1, PDC6I, PPAL, PRDX2,PTD012, QPCT, SBP1, STIP1, TALDO, WDR1, AMY, APOA1, GSN40, GSN80 и RTBP (см. табл. 1). Таким образом, эти 40 белков, которые, как было доказано, дифференциально экспрессируются у пациентов с диагностированной ПККМП, были идентифицированы как биологические маркеры со значением, существенным для диагностики, прогноза, мониторинга и лечения заболевания. В качестве примера на фиг. 2 показано пятно R211, соответствующее BIEA в R области геля после двумерного (2D) электрофореза образцов мочи здорового индивидуума (фиг. 2 А), пациента, страдающего от рака в стадии Та (фиг. 2 В), пациента, страдающего от рака в стадии Т 1 - низкой стадии (фиг. 2 С),пациента, страдающего от рака в стадии Т 1 - высокой стадии (фиг. 2D), и пациента, страдающего от рака в стадии Т 2 (фиг. 2 Е). Можно видеть, что в образцах мочи пациентов, страдающих раком различных стадий, по сравнению с образцом мочи здорового индивидуума интенсивность пятна R211 ясно уменьшается. После статистического анализа с применением программы Progenesis PG220 было показано, что эти различия являются статистически значимыми. Фиг. 3 демонстрирует интенсивность пятна R211 в образцах CV, Та, Т 1 - низкой стадии, Т 1 - высокой стадии и Т 2. Количество образцов для каждой группы указано в скобках. Фиг. 4 показывает надежность определения интенсивности для пятна R211 в различных образцах мочи. Это выражено как процент гелей, в которых сохраняется или отсутствует пятно R211 для каждого из проанализированных гелей. Количество образцов для каждой группы вновь указано в скобках. Табл. 2 показывает значение р и значения кратности изменения для статистического анализа для пятна R211 в образцах от пациентов с различной стадией рака по сравнению с образцом, полученным из- 16013927 индивидуума, не страдающего раком (CV). Для каждого индивидуального геля кратность изменения пятна R211 была нормализована по отношению к общему объему пятен (TSV) для каждого индивидуального геля. Таблица 2II. Получение антител для белков, обнаруженных в образцах мочи. Доступные поликлональные и/или моноклональные антитела (либо коммерчески доступные, либо полученные вследствие иммунизации по соответствующим протоколам) были тестированы для проверки реактивности и чувствительности с применением метода, который в основном используется для получения стандартной кривой ("доза-ответ") для белка, за которым проводится наблюдение. А. Протоколы иммунизации. 1. Поликлональные антитела. Поликлональная антисыворотка против данного белка может быть получена с применением стандартных методов, таких как те, что раскрыты в многочисленных пособиях, доступных в отрасли и известных квалифицированному специалисту. В этом примере иммунизировали белых новозеландских кроликов-самцов белковыми препаратами сначала с полным адъювантом Фрейнда (Gibco, Grand island,N.Y.), а затем каждый месяц белком с неполным адъювантом на протяжении трех месяцев. Сыворотка кролика и сыворотка мышей до слияния используется как поликлональная антисыворотка, с помощью стандартного Вестерн-блота было показано, что она реагирует с белковыми препаратами. 2. Получение рекомбинантных белков. Белки, обнаруженные в гелях в количестве, недостаточном для иммунизации, клонировали и экспрессировали в E.coli с применением клонирующего вектора рЕТ 28b(+). Неочищенный экстракт был получен, как описано предварительно (Boronat A., et al., J, Bacterial. 1981, 147:181-85) и подвергнут разделению методом SDS-PAGE. Рекомбинантные белки вырезали из геля и освобождали от акриламида. Для получения антител против рекомбинантных белков, полученные из геля белки прямо применяли для иммунизации кроликов, как описано выше. В. Вестерн-блот эксперименты. Образцы белков (20 мкг общего белка) смешивали с буфером для образцов для ПААГЭ с SDS, к которому добавляли 5% -меркаптоэтанол и инкубировали при 100 С в течение 5 мин до нанесения на 6% полиакриламидный гель. После электрофореза белки переносили на нитроцеллюлозные мембраны. Белки разгоняли на двух гелях и с обоими гелями проводили блотирование. Одна мембрана была обработана антителами против одного или более из выбранных 40 белков изобретения (Santa Cruz Biotech. Inc., SantaCruz, CA, USA), тогда как вторая мембрана - антителом против актина (Amersham, Little Chalfont, UK) как контрольного белка. В заключение мембраны были обработаны вторичным антителом, конъюгированным с пероксидазой (Amersham) и хемилюминесцентный сигнал обнаруживали с использованиемECL системы (Amersham) и хемилюминесцентной пленки с высоким разрешением (Hyperfiim ECL, Amersham),III. Повторная оценка образцов мочи в экспериментах с Вестерн-блоттингом. Несколько биомаркеров было тестировано на 40 слепых образцах мочи, включающих:a) отсутствие карциномы (12 образцов),b) ПККМП, включая: Та (8 образцов), Т 1 - низкая стадия (6 образцов), Т 1 - высокая стадия (6 образцов) и Т 2 (8 образцов). Полученные значения чувствительности, специфичности и точности показаны в табл. 3. Значения чувствительности, специфичности и точности были рассчитаны с применением следующих формул: Например, биомаркер AMY демонстрирует чувствительность 89% и специфичность 75% для значения точности 85%. Методом биномиальной логистической регрессии из полученных в этих экспериментах данных можно получить различные комбинации биомаркеров, что в целом увеличивает чувствительность и специфичность диагностического способа, как показано в табл. 4. Таблица 4 Перечень фигур Фиг. 1 - двумерный (2D) гель электрофорез, полученный в результате разделения белков образца мочи и показывающий четыре различных исследованных области А, K, R и S (фиг. 1 А), область А (фиг. 1 В), область K (фиг. 1 С), область R (фиг. 1D) и область S (фиг. 1E). Фиг. 2 - пятно R211, соответствующее BIEA в области R двумерного гель электрофореза, полученного в результате разделения белков образца мочи здорового индивидуума (фиг. 2 А), пациента, страдающего от рака в стадии Та (фиг. 2 В), пациента, страдающего от рака в стадии Т 1 - низкая стадия (T1LG, фиг. 2 С), пациента, страдающего от рака в стадии Т 1 - высокая стадия (T1-HG, фиг. 2D), и пациента,страдающего от рака в стадии Т 2 (фиг. 2 Е). Фиг. 3 - интенсивность пятна R211 в образце CV, Та, Т 1 - низкая стадия (T1-LG), Т 1 - высокая ста- 18013927 дия (T1-HG) и Т 2. Количество образцов для каждой группы указано в скобках. Фиг. 4 - устойчивость измерения интенсивности для пятна R211 в различных образцах мочи. Это выражено как процент гелей, на которых сохраняется присутствие или отсутствие пятна R211 в каждом из анализируемых гелей. Количество образцов для каждой группы указано в скобках. Перечень последовательностей
МПК / Метки
МПК: G01N 33/68, G01N 33/574
Метки: vitro, переходно-клеточной, карциномы, мочевого, способ, выявления, неинвазивный, пузыря
Код ссылки
<a href="https://eas.patents.su/30-13927-neinvazivnyjj-sposob-vyyavleniya-perehodno-kletochnojj-karcinomy-mochevogo-puzyrya-in-vitro.html" rel="bookmark" title="База патентов Евразийского Союза">Неинвазивный способ выявления переходно-клеточной карциномы мочевого пузыря in vitro</a>
Предыдущий патент: Промотор дифференциации и кератинизации эпидермальной клетки и функциональный напиток/питание для ускорения кератинизации эпидермиса
Следующий патент: Применение пираклостробина в качестве сафенера для тритиконазола при борьбе с вредными грибами
Случайный патент: Разделительный сосуд