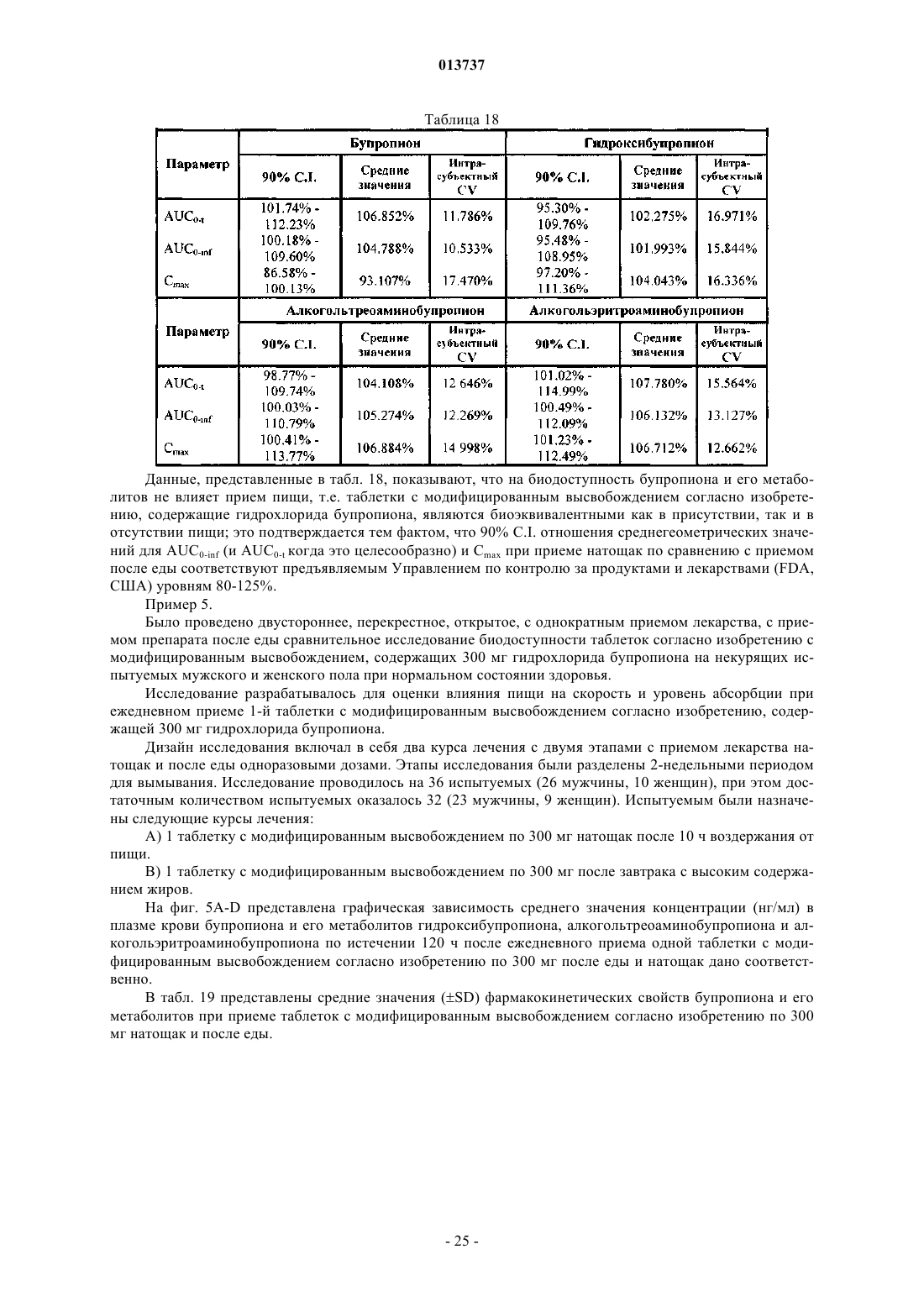
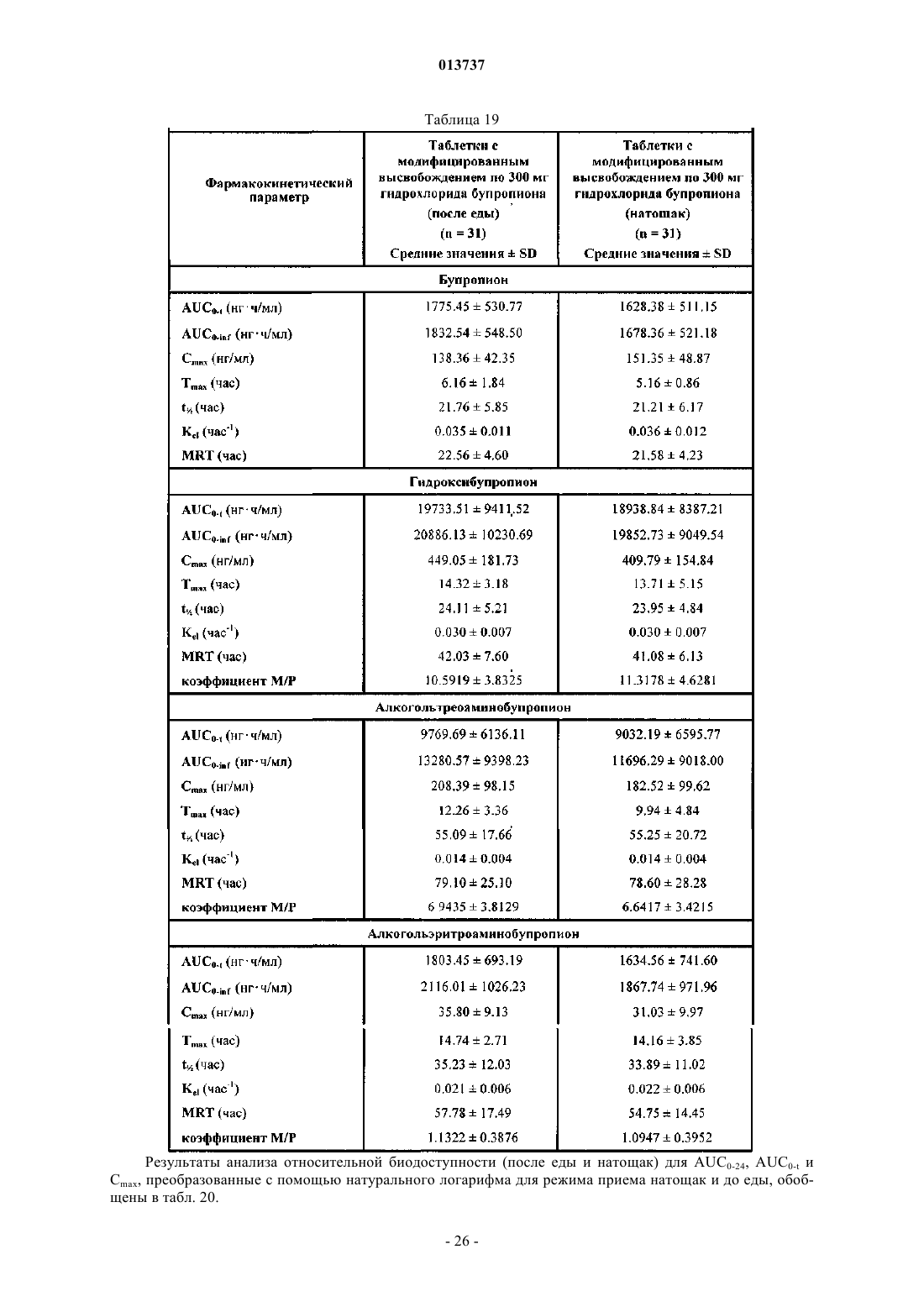
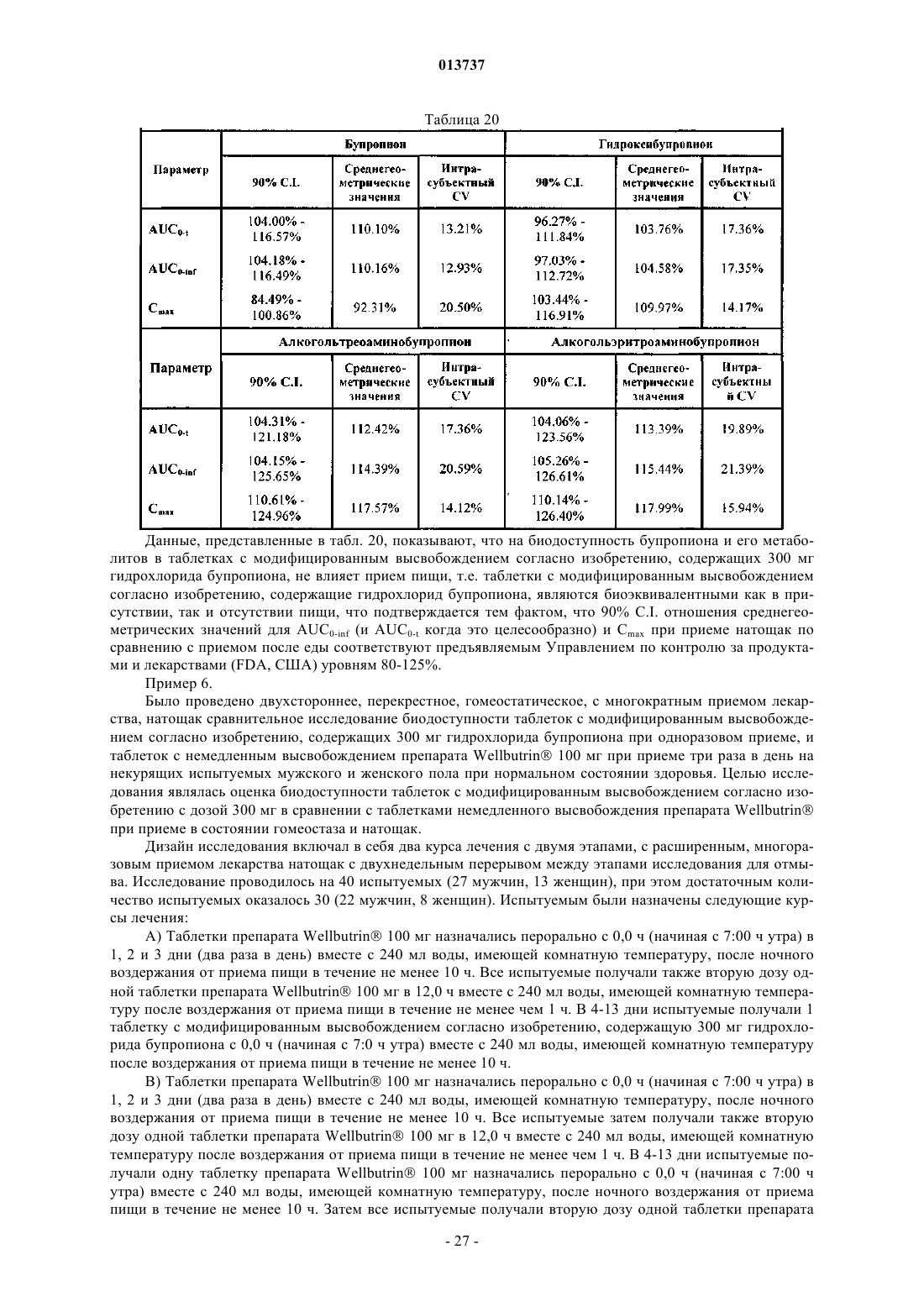
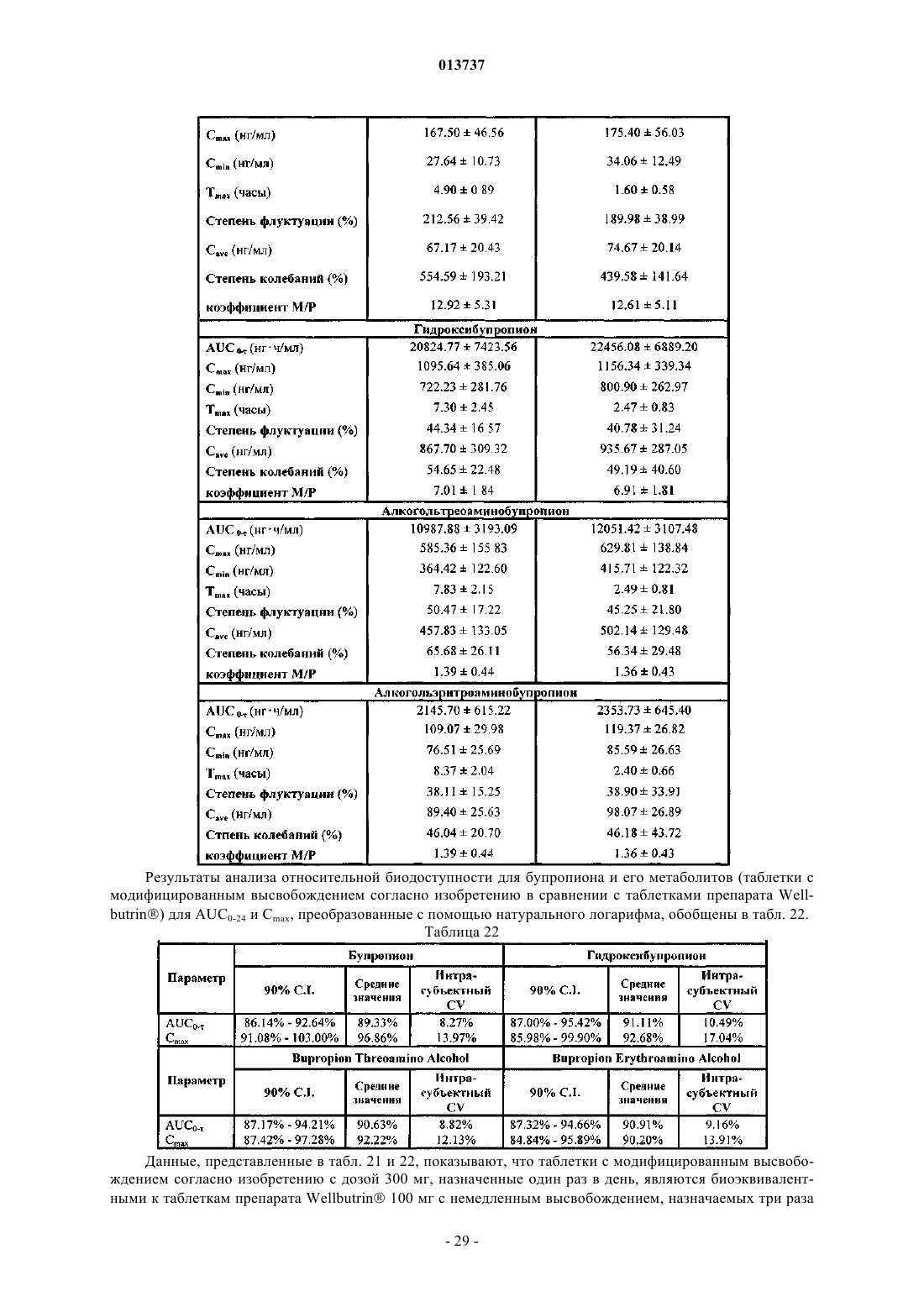
Таблетки с модифицированным высвобождением гидрохлорида бупропиона
Номер патента: 13737
Опубликовано: 30.06.2010
Авторы: Обереггер Вернер, Жу Фанг, Маес Пол, Эрадири Окпо
Формула / Реферат
1. Таблетка с модифицированным высвобождением, состоящая из:
(i) ядра, содержащего эффективное количество фармацевтически приемлемой соли бупропиона, связующего вещества и смазочного вещества,
(ii) первой оболочки с контролируемым высвобождением, нанесенной на указанное ядро, где указанная первая оболочка с контролируемым высвобождением содержит полимер, образующий не растворимую в воде водопроницаемую пленку, пластификатор и водорастворимый полимер, и
(iii) водонепроницаемого слоя, нанесенного на указанную первую оболочку с контролируемым высвобождением, где указанный водонепроницаемый слой содержит энтеросолюбильный полимер и усилитель проницаемости,
отличающаяся тем, что таблетка с модифицированным высвобождением является биоэквивалентом таблеток WellbutrinÒ или ZybanÒ/WellbutrinÒSR в течение 24 ч при назначении указанной таблетки с модифицированным высвобождением для однократного приема в день при лечении бупропионом пациента, нуждающегося в таком лечении, при этом более чем 10% фармацевтически приемлемой соли бупропиона высвобождается в течение одного часа в 0,1N HCl или менее чем 75% фармацевтически приемлемой соли бупропиона высвобождается в буферный раствор с рН 6,8 в течение 45 мин, причем в первой оболочке соотношение полимера, образующего не растворимую в воде водопроницаемую пленку, к водорастворимому полимеру составляет от примерно 3:4 до примерно 5:3, а в водонепроницаемом слое усилитель проницаемости присутствует в количестве примерно от 20 до примерно 40% от сухой массы водонепроницаемого слоя.
2. Таблетка с модифицированным высвобождением по п.1, отличающаяся тем, что указанная таблетка имеет свойство растворяться таким образом, что по истечении приблизительно 2 ч высвобождается не более чем около 20% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 4 ч высвобождается примерно от 15 до 45% фармацевтически приемлемой соли бупропиона, по истечении около 8 ч высвобождается примерно от 40 до 90% фармацевтически приемлемой соли бупропиона и по истечении приблизительно 16 ч высвобождается не менее чем 80% фармацевтически приемлемой соли бупропиона.
3. Таблетка с модифицированным высвобождением по п.2, отличающаяся тем, что указанная таблетка имеет свойство растворяться таким образом, что по истечении приблизительно 2 ч высвобождается примерно от 2 до 18% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 4 ч высвобождается примерно от 21 до 37% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 8 ч высвобождается примерно от 60 до 85% фармацевтически приемлемой соли бупропиона, и по истечении приблизительно 16 ч высвобождается не менее чем 93% фармацевтически приемлемой соли бупропиона в 900 мл 0,1N HCl при 75 об./мин и температуре 37°С.
4. Таблетка с модифицированным высвобождением по п.3, отличающаяся тем, что указанная таблетка имеет свойство растворяться таким образом, что по истечении приблизительно 2 ч высвобождается примерно от 4 до 8% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 4 ч высвобождается примерно от 28 до 34% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 8 ч высвобождается примерно от 68 до 74% фармацевтически приемлемой соли бупропиона, и по истечении приблизительно 16 ч высвобождаются не менее чем 96% фармацевтически приемлемой соли бупропиона в 900 мл 0,1N HCl при 75 об./мин и температуре 37°С.
5. Таблетка с модифицированным высвобождением по п.4, отличающаяся тем, что указанная таблетка имеет свойство растворяться таким образом, что по истечении приблизительно 2 ч высвобождается примерно 5% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 4 ч высвобождается примерно от 32% фармацевтически приемлемой соли бупропиона, по истечении приблизительно 8 ч высвобождается примерно 74% фармацевтически приемлемой соли бупропиона и по истечении приблизительно 16 ч высвобождается не менее чем 99% фармацевтически приемлемой соли бупропиона в 900 мл 0,1N HCl при 75 об./мин и температуре 37°С.
6. Таблетка с модифицированным высвобождением по пп.1-5, отличающаяся тем, что указанной фармацевтически приемлемой солью бупропиона является гидрохлорид бупропиона.
7. Таблетка с модифицированным высвобождением по пп.1-6, отличающаяся тем, что указанная фармацевтически приемлемая соль бупропиона содержится в количестве не менее чем около 94 мас.% ядра.
8. Таблетка с модифицированным высвобождением по пп.1-7, отличающаяся тем, что указанное связующее вещество содержится в количестве примерно от 1 до 6 мас.% от сухой массы ядра.
9. Таблетка с модифицированным высвобождением по п.8, отличающаяся тем, что указанное связующее вещество содержится в количестве примерно 3 мас.% от сухой массы ядра.
10. Таблетка с модифицированным высвобождением по пп.1-9, отличающаяся тем, что указанное связующее вещество выбирается из группы, состоящей из модифицированного крахмала, желатина, поливинилпирролидона, производных целлюлозы, поливинилового спирта и любой их комбинации.
11. Таблетка с модифицированным высвобождением по п.10, отличающаяся тем, что указанным связующим веществом является поливиниловый спирт.
12. Таблетка с модифицированным высвобождением по пп.1-11, отличающаяся тем, что указанное смазывающее вещество содержится в количестве примерно от 1 до 6 мас.% от сухой массы ядра.
13. Таблетка с модифицированным высвобождением по п.12, отличающаяся тем, что указанное смазывающее вещество содержится в количестве примерно 3 мас.% от сухой массы ядра.
14. Таблетка с модифицированным высвобождением по пп.1-13, отличающаяся тем, что указанное смазывающее вещество выбирается из группы, состоящей из глицерилбехената, стеариновой кислоты, гидрированных растительных масел и любой их комбинации.
15. Таблетка с модифицированным высвобождением по п.14, отличающаяся тем, что указанным смазывающим веществом является глицерилбехенат.
16. Таблетка с модифицированным высвобождением по пп.1-15, отличающаяся тем, что указанный полимер, образующий не растворимую в воде водопроницаемую пленку, содержится в количестве примерно от 35 до 60 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
17. Таблетка с модифицированным высвобождением по п.16, отличающаяся тем, что указанный полимер, образующий не растворимую в воде водопроницаемую пленку, содержится в количестве примерно 50 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
18. Таблетка с модифицированным высвобождением по п.16, отличающаяся тем, что указанный полимер, образующий не растворимую в воде водопроницаемую пленку, содержится в количестве примерно 45 мас.% от сухой массы таблетки.
19. Таблетка с модифицированным высвобождением по пп.1-18, отличающаяся тем, что указанный полимер, образующий не растворимую в воде водопроницаемую пленку, выбирается из группы, состоящей из простого эфира целлюлозы, сложного эфира целлюлозы, поливинилового спирта и любой их комбинации.
20. Таблетка с модифицированным высвобождением по п.19, отличающаяся тем, что указанным полимером, образующим не растворимую в воде водопроницаемую пленку, является простой эфир целлюлозы.
21. Таблетка с модифицированным высвобождением по п.20, отличающаяся тем, что указанный простой эфир целлюлозы выбирается из группы, состоящей из этилцеллюлозы PR100, этилцеллюлозы PR20 и любой их комбинации.
22. Таблетка с модифицированным высвобождением по п.21, отличающаяся тем, что указанным простым эфиром целлюлозы является этилцеллюлоза PR100.
23. Таблетка с модифицированным высвобождением по любому из пп.1-22, отличающаяся тем, что указанный пластификатор содержится в количестве примерно от 6 до 30 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
24. Таблетка с модифицированным высвобождением по п.23, отличающаяся тем, что указанный пластификатор содержится в количестве около 12 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
25. Таблетка с модифицированным высвобождением по пп.1-24, отличающаяся тем, что указанный пластификатор выбирается из группы, состоящей из полиолов, сложных органических эфиров, масел/глицеридов и любой их комбинации.
26. Таблетка с модифицированным высвобождением по п.25, отличающаяся тем, что указанным пластификатором является полиол.
27. Таблетка с модифицированным высвобождением по п.26, отличающаяся тем, что указанным полиолом является полиэтиленгликоль 1450.
28. Таблетка с модифицированным высвобождением по любому из пп.1-27, отличающаяся тем, что указанный водорастворимый полимер содержится в количестве от примерно 25 до примерно 50 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
29. Таблетка с модифицированным высвобождением по п.28, отличающаяся тем, что указанный водорастворимый полимер содержится в количестве примерно 43 мас.% от сухой массы указанной оболочки с контролируемым высвобождением.
30. Таблетка с модифицированным высвобождением по пп.1-29, отличающаяся тем, что указанный водорастворимый полимер выбирается из группы, состоящей из поливинилпирролидона, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы и любой их комбинации.
31. Таблетка с модифицированным высвобождением по п.30, отличающаяся тем, что указанным водорастворимым полимером является поливинилпирролидон.
32. Таблетка с модифицированным высвобождением по любому из пп.1-31, отличающаяся тем, что отношение полимера, образующего не растворимую в воде водопроницаемую пленку, к пластификатору и водорастворимому полимеру составляет примерно от 3:1:4 до примерно 5:1:3.
33. Таблетка с модифицированным высвобождением по п.32, отличающаяся тем, что отношение полимера, образующего не растворимую в воде водопроницаемую пленку, к пластификатору и водорастворимому полимеру составляет примерно 4:1:3.
34. Таблетка с модифицированным высвобождением по любому из пп.1-31, отличающаяся тем, что отношение полимера, образующего не растворимую в воде водопроницаемую пленку, к пластификатору и водорастворимому полимеру составляет примерно от 7:2:6 до примерно 19:5:18.
35. Таблетка с модифицированным высвобождением по п.34, отличающаяся тем, что отношение полимера, образующего не растворимую в воде водопроницаемую пленку, к пластификатору и водорастворимому полимеру составляет примерно 13:4:12.
36. Таблетка с модифицированным высвобождением по пп.1-35, отличающаяся тем, что дополнительная масса после нанесения оболочки с контролируемым высвобождением составляет от примерно 3 до примерно 30 мас.% от сухой массы ядра.
37. Таблетка с модифицированным высвобождением по п.36, отличающаяся тем, что дополнительная масса после нанесения оболочки с контролируемым высвобождением составляет от примерно 13 до примерно 16 мас.% от сухой массы ядра.
38. Таблетка с модифицированным высвобождением по п.36, отличающаяся тем, что дополнительная масса после нанесения оболочки с контролируемым высвобождением составляет от примерно 8 до примерно 10 мас.% от сухой массы ядра.
39. Таблетка с модифицированным высвобождением по п.37, отличающаяся тем, что дополнительная масса после нанесения оболочки с контролируемым высвобождением составляет примерно 15 мас.% от сухой массы ядра.
40. Таблетка с модифицированным высвобождением по п.38, отличающаяся тем, что дополнительная масса после нанесения оболочки с контролируемым высвобождением составляет примерно 9 мас.% от сухой массы ядра.
41. Таблетка с модифицированным высвобождением по пп.1-40, отличающаяся тем, что указанный энтеросолюбильный полимер содержится в количестве от примерно 30 до примерно 90 мас.% от сухой массы водонепроницаемого слоя.
42. Таблетка с модифицированным высвобождением по п.41, отличающаяся тем, что указанный энтеросолюбильный полимер содержится в количестве примерно 66 мас.% от сухой массы водонепроницаемого слоя.
43. Таблетка с модифицированным высвобождением по пп.1-40, отличающаяся тем, что содержит около 150 мг указанной фармацевтически приемлемой соли бупропиона, и количество указанного энтеросолюбильного полимера изменяется от 1 до 3 мас.% от сухой массы таблетки и составляет от 55 до 70 мас.% от сухой массы водонепроницаемого слоя.
44. Таблетка с модифицированным высвобождением по пп.1-40, отличающаяся тем, что содержит около 300 мг указанной фармацевтически приемлемой соли бупропиона, и количество указанного энтеросолюбильного полимера изменяется от 1,5 до 3,0 мас.% от сухой массы таблетки и составляет от 30 до 90 мас.% от сухой массы водонепроницаемого слоя.
45. Таблетка с модифицированным высвобождением по пп.1-44, отличающаяся тем, что энтеросолюбильным полимером является полимер акриловой кислоты.
46. Таблетка с модифицированным высвобождением по п.45, отличающаяся тем, что энтеросолюбильным полимером является сополимер метакриловой кислоты типа С.
47. Таблетка с модифицированным высвобождением по п.46, отличающаяся тем, что полимером является EudragitÒ L30D-55.
48. Таблетка с модифицированным высвобождением по пп.1-47, отличающаяся тем, что водонепроницаемый слой дополнительно содержит пластификатор, при этом указанный пластификатор содержится в количестве от примерно 1 до примерно 30 мас.% от сухой массы водонепроницаемого слоя.
49. Таблетка с модифицированным высвобождением по п.48, отличающаяся тем, что указанный пластификатор содержится в количестве примерно 10 мас.% от сухой массы водонепроницаемого слоя.
50. Таблетка с модифицированным высвобождением по пп.1-49, отличающаяся тем, что водонепроницаемый слой дополнительно содержит пластификатор, при этом указанный пластификатор выбирается из группы, состоящей из полиолов, сложных органических эфиров, масел/глицеридов и любой их комбинации.
51. Таблетка с модифицированным высвобождением по п.50, отличающаяся тем, что указанный пластификатор представляет собой комбинацию сложного органического эфира и полиола.
52. Таблетка с модифицированным высвобождением по п.51, отличающаяся тем, что указанная комбинация пластификаторов берется в пропорции примерно 1 часть сложного органического эфира и примерно 2 части полиола.
53. Таблетка с модифицированным высвобождением по п.52, отличающаяся тем, что указанным сложным органическим эфиром является триэтилцитрат, а указанным полиолом является полиэтиленгликоль 1450.
54. Таблетка с модифицированным высвобождением по пп.1-53, отличающаяся тем, что указанный усилитель проницаемости содержится в количестве примерно 25 мас.% от сухой массы водонепроницаемого слоя.
55. Таблетка с модифицированным высвобождением по пп.1-54, отличающаяся тем, что указанный усилитель проницаемости выбирается из группы, состоящей из диоксида кремния, коллоидного кремния, лактозы, гидрофильных полимеров, хлорида натрия, оксида алюминия, коллоидного оксида алюминия, кремнезема, микрокристаллической целлюлозы и любой их комбинации.
56. Таблетка с модифицированным высвобождением по п.55, отличающаяся тем, что указанным усилителем проницаемости является диоксид кремния.
57. Таблетка с модифицированным высвобождением по любому из пп.1-56, отличающаяся тем, что отношение указанного энтеросолюбильного полимера к пластификатору и усилителю проницаемости составляет примерно 13:2:5.
58. Таблетка с модифицированным высвобождением по любому из пп.1-57, отличающаяся тем, что дополнительная масса после нанесения водонепроницаемого слоя не превышает примерно 6 мас.% от сухой массы таблетки.
59. Таблетка с модифицированным высвобождением по п.58, отличающаяся тем, что дополнительная масса после нанесения водонепроницаемого слоя не превышает примерно 2,5 мас.% от сухой массы таблетки.
60. Таблетка с модифицированным высвобождением по п.1, отличающаяся тем, что состоит из:
(i) ядра, содержащего эффективное количество гидрохлорида бупропиона, поливинилового спирта, глицерилбехената, где количество указанного гидрохлорида бупропиона составляет по меньшей мере примерно 94 мас.% от сухой массы ядра, количество указанного поливинилового спирта составляет примерно 3 мас.% от сухой массы ядра, и количество указанного глицерилбехената составляет примерно 3 мас.% от сухой массы ядра;
(ii) оболочки с контролируемым высвобождением, нанесенной на указанное ядро, указанная оболочка с контролируемым высвобождением содержит этилцеллюлозу PR 100, полиэтиленгликоль 1450 и поливинилпирролидон, где количество указанной этилцеллюлозы PR 100 составляет от примерно 45 до примерно 50 мас.% от сухой массы оболочки с контролируемым высвобождением, количество указанного полиэтиленгликоля 1450 составляет примерно 12 мас.% от сухой массы оболочки с контролируемым высвобождением, и количество указанного поливинилпирролидона составляет от примерно 25 до примерно 50 мас.% от сухой массы оболочки с контролируемым высвобождением, при этом количество наносимой указанной оболочки с контролируемым высвобождением составляет от примерно 9 до примерно 15 мас.% от сухой массы ядра таблетки, и
(iii) водонепроницаемого слоя, нанесенного на указанную оболочку с контролируемым высвобождением, указанный водонепроницаемый слой содержит сополимер метакриловой кислоты, полиэтиленгликоль 1450, триэтилцитрат и диоксид кремния, где количество указанного сополимера метакриловой кислоты составляет примерно 66 мас.% от сухой массы указанного водонепроницаемого слоя, количество указанных полиэтиленгликоля 1450 и триэтилцитрата составляет примерно 10 мас.% от сухой массы указанного водонепроницаемого слоя при соотношении 1 часть триэтилцитрата на 2 части полиэтиленгликоля 1450, и количество указанного диоксида кремния составляет примерно 25 мас.% от сухой массы указанного водонепроницаемого слоя, при этом количество наносимого указанного водонепроницаемого слоя не превышает примерно 2,5 мас.% от сухой массы таблетки.
61. Таблетка с модифицированным высвобождением по п.1, отличающаяся тем, что состоит из:
(i) ядра, содержащего эффективное количество гидрохлорида бупропиона, связующего вещества, смазочного материала и необязательно других традиционных наполнителей;
(ii) оболочки с контролируемым высвобождением, нанесенной на указанное ядро, где оболочка содержит полимер, образующий не растворимую в воде водопроницаемую пленку, пластификатор и водорастворимый полимер, и
(iii) водонепроницаемого слоя, нанесенного на указанную оболочку с контролируемым высвобождением, указанный водонепроницаемый слой содержит сополимер метакриловой кислоты, полиэтиленгликоль 1450, триэтилцитрат и диоксид кремния, при этом количество указанного сополимера метакриловой кислоты составляет примерно 66 мас.% от сухой массы указанного водонепроницаемого слоя, количество указанных полиэтиленгликоля 1450 и триэтилцитрата составляет примерно 10 мас.% от сухой массы указанного водонепроницаемого слоя при соотношении 1 часть триэтилцитрата на 2 части полиэтиленгликоля 1450, и количество указанного диоксида кремния составляет примерно 25 мас.% от сухой массы указанного водонепроницаемого слоя, при этом количество наносимого указанного водонепроницаемого слоя не превышает примерно 2,5 мас.% от сухой массы таблетки.
62. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением обеспечивает Cmax бупропиона в плазме крови в течение от примерно 3 до примерно 8 ч (Tmax) после приема при назначении натощак.
63. Таблетка с модифицированным высвобождением по п.62, отличающаяся тем, что указанная таблетка с модифицированным высвобождением обеспечивает Cmax бупропиона в плазме крови в течение примерно 5 ч (Tmax) после приема таблетки с модифицированным высвобождением при назначении натощак.
64. Таблетка с модифицированным высвобождением по п.63, отличающаяся тем, что указанная таблетка с модифицированным высвобождением обеспечивает Cmax бупропиона в плазме крови в количестве от примерно 60 до примерно 280 нг/мл в течение примерно 5 ч (Tmax) после приема один раз в день указанной таблетки с модифицированным высвобождением, содержащей 300 мг гидрохлорида бупропиона или 2 указанных таблеток с модифицированным высвобождением, содержащих по 150 мг гидрохлорида бупропиона, при назначении натощак.
65. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка гидрохлорида бупропиона с модифицированным высвобождением назначается один раз в день одной дозой, содержащей 300 мг указанной таблетки с модифицированным высвобождением гидрохлорида бупропиона или двумя дозами, содержащими по 150 мг указанной таблетки с модифицированным высвобождением гидрохлорида бупропиона, и является биоэквивалентом таблеток WellbutrinÒ или ZybanÒ/WellbutrinÒSR в течение 24 ч при приеме натощак.
66. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением показывает AUC(0-t) для бупропиона от примерно 800 до примерно 2850 нг×ч./мл после приема натощак один раз в день указанной таблетки с модифицированным высвобождением гидрохлорида бупропиона, содержащей 300 мг гидрохлорида бупропиона, или после приема натощак один раз в день 2 указанных таблеток с модифицированным высвобождением гидрохлорида бупропиона, содержащих по 150 мг гидрохлорида бупропиона.
67. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением показывает AUC(0-inf) для бупропиона от примерно 840 до примерно 3000 нг×ч/мл после приема натощак один раз в день указанной таблетки с модифицированным высвобождением гидрохлорида бупропиона, содержащей 300 мг гидрохлорида бупропиона, или после приема натощак один раз в день 2 указанных таблеток с модифицированным высвобождением гидрохлорида бупропиона, содержащих по 150 мг гидрохлорида бупропиона.
68. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением назначается пациенту один раз в день 2 доз по 150 мг или одной дозы по 300 мг в случае необходимости такого назначения для приема натощак и является биоэквивалентом ZybanÒ/WellbutrinÒSR.
69. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением назначается пациенту один раз в день 2 доз по 150 мг или одной дозы по 300 мг в случае необходимости такого назначения для приема натощак и является биоэквивалентом таблеток WellbutrinÒ или ZybanÒ/WellbutrinÒSR в течение 24 ч, когда указанная таблетка с модифицированным высвобождением назначается пациенту по схеме лечения бупропионом один раз в день в случае необходимости такого назначения и не оказывает воздействия на приём пищи.
70. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением является биоэквивалентом таблеток WellbutrinÒ или ZybanÒ/WellbutrinÒSR в течение 24 ч, когда указанная таблетка с модифицированным высвобождением назначается пациенту по схеме лечения бупропионом один раз в день в случае необходимости такого назначения натощак или на полный желудок.
71. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением назначается пациенту один раз в день одной дозой по 300 мг в случае необходимости такого назначения для приема натощак и является биоэквивалентом таблеток WellbutrinÒ, назначаемых по одной 300 мг таблетке (три раза в день) в стабильном состоянии.
72. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением назначается пациенту один раз в день одной дозой по 300 мг в случае необходимости такого назначения для приема натощак и является биоэквивалентом таблеток ZybanÒ, назначаемых одной 150 мг таблеткой (два раза в день) в стабильном состоянии.
73. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что содержание влаги в указанной таблетке с модифицированным высвобождением, хранящейся в открытом лотке около 10 дней при 40±2°С и относительной влажности примерно 75±5%, не более чем около 0,4%.
74. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что указанная таблетка с модифицированным высвобождением содержит по меньшей мере примерно 95% неразложившегося гидрохлорида бупропиона после хранения в течение 12 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
75. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 97% неразложившегося гидрохлорида бупропиона после хранения в течение 12 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
76. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 98% неразложившегося гидрохлорида бупропиона после хранения в течение 12 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
77. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 99% неразложившегося гидрохлорида бупропиона после хранения в течение 12 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
78. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 95% неразложившегося гидрохлорида бупропиона после хранения в течение 18 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
79. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 97% неразложившегося гидрохлорида бупропиона после хранения в течение 18 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
80. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 98% неразложившегося гидрохлорида бупропиона после хранения в течение 18 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
81. Таблетка по п.74, отличающаяся тем, что указанная таблетка содержит по меньшей мере примерно 99% неразложившегося гидрохлорида бупропиона после хранения в течение 18 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
82. Таблетка с модифицированным высвобождением по п.61, отличающаяся тем, что содержание влаги в указанной таблетке с модифицированным высвобождением, хранящейся около 6 месяцев при 40±2°С и относительной влажности примерно 75±5%, не более чем около 1,0%.
83. Таблетка с модифицированным высвобождением по любому из пп.7, 17, 23, 28, 33, 39, 42, 49, 54, 57, 59 или 73-82, отличающаяся тем, что указанная таблетка содержит 150 мг гидрохлорида бупропиона.
84. Таблетка с модифицированным высвобождением по любому из пп.7, 18, 23, 29, 35, 40, 42, 49, 54, 57, 59 или 73-82, отличающаяся тем, что указанная таблетка содержит 300 мг гидрохлорида бупропиона.
85. Таблетка с модифицированным высвобождением по п.1, отличающаяся тем, что состоит из:
(i) ядра, содержащего примерно 150 мг гидрохлорида бупропиона, примерно 5,3 мг поливинилового спирта, примерно 4,7 мг глицерилбехената;
(ii) оболочки с контролируемым высвобождением, нанесенной на указанное ядро, указанная оболочка с контролируемым высвобождением содержит примерно 12 мг этилцеллюлозы PR100, примерно 3 мг полиэтиленгликоля 1450 и примерно 9 мг поливинилпирролидона, при этом на указанное ядро нанесено примерно 24 мг оболочки с контролируемым высвобождением; и
(iii) водонепроницаемого слоя, нанесенного на указанную оболочку с контролируемым высвобождением, указанный водонепроницаемый слой содержит примерно 4,6 мг сополимера метакриловой кислоты, примерно 0,46 мг полиэтиленгликоля 1450, примерно 0,23 мг триэтилцитрата и примерно 1,72 мг диоксида кремния, при этом на ядро с оболочкой с контролируемым высвобождением нанесено примерно 7 мг водонепроницаемого слоя;
указанная таблетка с модифицированным высвобождением является биоэквивалентом таблеток WellbutrinÒ или ZybanÒ/WellbutrinÒSR в течение 24 ч, когда указанная таблетка с модифицированным высвобождением назначается пациенту по схеме лечения бупропионом один раз в день в случае необходимости такого назначения и имеет свойство растворяться таким образом, что по истечении приблизительно 2 ч высвобождается примерно 5% гидрохлорида бупропиона, по истечении приблизительно 4 ч высвобождается примерно 32% гидрохлорида бупропиона, по истечении приблизительно 8 ч высвобождается примерно 74% гидрохлорида бупропиона и по истечении примерно 16 ч высвобождается не менее чем примерно 99% гидрохлорида бупропиона в 0,1N HCl при 75 об./мин при температуре 37°С.
86. Таблетка с модифицированным высвобождением по любому из пп.1-59, отличающаяся тем, что не оказывает воздействия на приём пищи.
87. Таблетка с модифицированным высвобождением по любому из пп.1-59 или 86, отличающаяся тем, что указанная таблетка содержит по меньшей мере 95% неразложившегося гидрохлорида бупропиона после хранения в течение 18 месяцев при температуре примерно 25±2°С и относительной влажности примерно 60±5%.
88. Таблетка с модифицированным высвобождением по любому из пп.1-59, отличающаяся тем, что назначенная пациенту по леченой схеме бупропионом один раз в день в случае необходимости лечения обеспечивает Cmax бупропиона в количестве от примерно 60 до примерно 280 нг/мл в течение от 3 до 8 ч (Tmax) и AUC(0-inf)для бупропиона от примерно 800 до примерно 2850 нг×ч/мл.
89. Таблетка с модифицированным высвобождением по п.88, отличающаяся тем, что содержит 300 мг дозу.
90. Таблетка с модифицированным высвобождением по п.88, отличающаяся тем, что содержит 2´150 мг дозу, назначаемую один раз в день.
91. Таблетка с модифицированным высвобождением по любому из пп.1-59, отличающаяся тем, что ядро дополнительно содержит другие традиционные наполнители.
92. Применение таблетки с модифицированным высвобождением по любому из пп.1-91 в производстве лекарственного препарата для лечения депрессии.
93. Применение таблетки с модифицированным высвобождением п.92, отличающееся тем, что указанная таблетка с модифицированным высвобождением содержит 300 мг дозу.
94. Применение таблетки с модифицированным высвобождением п.92, отличающееся тем, что указанная таблетка с модифицированным высвобождением содержит 150 мг дозу.
Текст
013737 Настоящее изобретение относится к таблеткам с модифицированным высвобождением используемых в фармакологии солей бупропиона, в частности гидрохлорида бупропиона. Бупропион является антидепрессантом, химически не относящимся к трициклическим, тетрациклическим селективным ингибиторам обратного захвата серотонина (selective serotonin re-uptake inhibitors(SSRIs) или другим известным антидепрессантам. Лекарство напоминает психостимулятор в связи с его нейрохимическими и поведенческими свойствами, однако он не оказывает надежного (устойчивого) воздействия аналогично стимулирующему на человеческий организм в клинических дозах. Его структура очень напоминает диэтилпропион и он относится к группе фенилэтиламинов. Он обозначается как гидрохлорид -1-(3-хлорофенил)-2-[(1,1-диметилэтил)амино]-1-пропанона и под родовым наименованием гидрохлорид амфебутамона. Гидрохлорид бупропиона поступает в продажу в виде лекарственных препаратов с быстрым высвобождением (Wellbutrin) и замедленным высвобождением (Wellbutrin SR иZyban). Оба лекарственных препарата (Wellbutrin SR и Zyban) химически и фармакологически идентичны. Нейрохимический механизм антидепрессивного действия бупропиона недостаточно хорошо изучен. Бупропион не угнетает моноаминооксидазу. Бупропион воздействует на химические вещества в мозге, используемые нервами для передачи сигналов друг другу. Данные химические веществапередатчики сигналов называются нейромедиаторами. Нейромедиаторы, высвобождаемые нервами, снова поглощаются высвободившими их нервами для повторного использования (так называемое повторное поглощение). Многие специалисты уверены в том, что депрессия вызывается количественным дисбалансом высвобожденных нейромедиаторов. Считается, что бупропион действует за счет ингибирования повторного поглощения нейромедиаторов допамина, серотонина и норепинефрина, в результате чего повышается количество допамина, серотонина и норепинефрина, способных передавать сигналы другим нервам. Соответственно, бупропион уникален по своему воздействию на допамин, которое отличается от избирательного действия ингибиторов, поглощающих серотонин (например, пароксетин (Paxil), флуоксетин (Prozac), сертралин (Zoloft или трициклические антидепрессанты или (ТЦА - TCAs) (например, амитриптилин (Elavil), имипрамин (Tofranil), дезипрамин (Norpramin.Wellbutrin и Wellbutrin SR используются для лечения депрессии. Zyban одобрен в качестве средства, помогающего пациентам, которые хотят бросить курить. Wellbutrin, лекарственный препарат бупропиона быстрого высвобождения, назначается три раза в день, предпочтительно с промежутками времени между приемами шесть и более часов. Для пациентов, которым ежедневно необходимо получать 300 мг бупропиона, одна доза не должна превышать 150 мг. Это требует назначения таблеток по крайней мере 4 раза в день с промежутками между приемами не менее чем 4 ч. Результатом действия лекарственного препарата быстрого высвобождения является высвобождение 75% бупропиона в растворяющую среду примерно через 45 мин, при этом одним из сильных побочных эффектов бупропиона были случаи припадков, которые в свою очередь прямо связаны с быстрым высвобождением бупропиона в систему. В связи с этим, продукты быстрого высвобождения были разработаны таким образом, чтобы избежать возможных припадков. Дозировка продуктов быстрого высвобождения составляется с таким расчетом, чтобы в день назначалось два приема. В целом, соблюдение больным режима и схемы лечения - это одна из проблем, связанных с препаратами, лечение которыми осуществляется по многократной схеме, и эта проблема особенно остро стоит в случаях с людьми, находящимися в подавленном состоянии. Несмотря на то, что лекарственные формы с быстрым высвобождением упростили схему приема лекарств и обеспечили более точное соблюдение больным режима и схемы лечения, еще имеются резервы для дальнейшего упрощения схемы приема лекарств и повышения соблюдения больным режима и схемы лечебного приема лекарств. Разработка утвержденной лекарственной формы бупропиона с модифицированным высвобождением для ежедневного приема могло бы стать значительным достижением фармакопеи. Таблетки бупропиона замедленного действия известны из уровня техники. В патенте США 4687660 дано описание таблетки, состоящей из ядра и оболочки, ядро которой содержит гидрохлорид бупропиона с инертным(и) наполнителем(ями) и, как вариант, веществом, улучшающим осмотическое давление крови, а оболочка содержит нерастворимый в воде, образующий водопроницаемую пленку полимер (такой как ацетат целлюлозы), вещество, образующее поры, (такие как мелкодисперсные лактоза и углекислый натрий) и, как вариант, так называемое вещество, способствующее водопроницаемости (такое как полиэтиленгликоль), и, опять же, как вариант, пластификатор. В патентах США 5358970 и 5427798 описаны лекарственные препараты с замедленным высвобождением бупропиона, основанные на матричной технологии. Термин матрица относится к таблетке,в которой лекарство внедряется в наполнитель таким образом, что образуется неразделимая основа, именуемая матрицей. Распространение лекарства происходит через эту основу. Поскольку гидрохлорид бупропиона не стабилен, продукт, описываемый в вышеуказанных патентах, требует наличия стабилизатора для достижения достаточной стабильности. Таким стабилизатором является кислотное соединение,преимущественно гидрохлорид цистеина. Основным недостатком матричных систем является то, что они, в основном, проявляют высвобождение первой степени. То есть, сначала растворяются частицы ле-1 013737 карственного средства, находящиеся на поверхности таблетки, что способствует быстрому высвобождению лекарственного средства. Затем постепенно растворяются частицы лекарственного средства с более удаленных расстояний от поверхности таблетки и, благодаря диффузии, высвобождаются через поры на внешнюю поверхность таблетки. Таким образом, диффузионное расстояние лекарственного средства увеличивается по мере высвобождения лекарственного средства. Предпочтительно, чтобы достижение нулевой или близко к нулевой степени высвобождения достигалось раньше чем первая степень высвобождения. Система с нулевой степенью высвобождения обеспечивает постоянную скорость высвобождения лекарственного средства в течение определенного периода времени. Она используется для лекарственных средств с коротким периодом полураспада с тем, чтобы постоянные уровни кровяного давления поддерживались небольшими дозами активных соединений лекарственного средства. В описании патента США 6589553 и в международной публикацииWO 02/062299 описан состав ежедневной одноразовой пилюли двух видов с покрытием, каждый из которых высвобождает гидрохлорид бупропиона при разном значении рН. Один вид имеет покрытие, которое высвобождает лекарственное средство при рН 4,8 и ниже. Предполагается, что высвобождение лекарственного средства из данного вида пилюли должно происходить в верхней части желудочно-кишечного тракта. Другой вид пилюли имеет покрытие, которое высвобождает лекарственное средство при рН примерно 7 и выше. Предполагается, что высвобождение гидрохлорида бупропиона из данного вида пилюли должно происходить в нижней части желудочно-кишечного тракта. В одном примере показано, что относительная биодоступность бупропиона в Zyban составляет всего 40% для параметра Cmax (максимум или пик концентрации лекарственного вещества в крови) и только 80% для параметра AUC0-inf (площадь под кривой изменения концентрации вещества в плазме или сыворотке крови во времени). В другом примере относительная биодоступность бупропиона в Zyban составляла всего 48 и 59% для параметров Cmax и AUC0-inf соответственно. В документах, описанных ниже, описаны активные безоболочные драже третьего вида, в которых заявлено модифицированное и улучшенное высвобождение гидрохлорида бупропиона. Исходя из графика зависимости средняя концентрация плазмы - время, представленного на фиг. 3 и 4 указанных документов не ясно, даст ли внедрение активных безоболочных драже ежедневную одноразовую биоэквивалентный состав (эталонным продуктом является Zyban). Кроме того, ни в одном из представленных документов не содержится данных о стабильности лекарственного средства. Патент США 6033686 описывает таблетку с контролируемым высвобождением, не содержащую стабилизатор, а также вещество, способствующее образованию пор, которая представляет собой ядро,состоящее преимущественно из гидрохлорида бупропиона, связки и смягчителя, а также оболочки из водонерастворимой, водопроницаемой полимерной пленки, пластификатора и водорастворимого полимера. Лекарственное средство, основанное на патенте США 6033686, применяется дважды в день. В патентах США 6096341 и 6143327 описаны лекарственные средства с замедленным высвобождением гидрохлорида бупропиона. Патент 6096341 относится к таблетке с контролируемым высвобождением, не содержащей стабилизатор и порообразующее вещество, и состоящей из ядра, содержащего преимущественно гидрохлорид бупропиона, связующего вещества и смягчителя, а также оболочки, содержащей преимущественно не растворимую в воде водопроницаемую полимерную пленку,пластификатор и водорастворимый полимер. Патент 6143327 относится к таблетке с контролируемым высвобождением, не содержащей стабилизатор и порообразующее вещество, и состоящей из ядра, содержащего преимущественно гидрохлорид бупропиона, связующего вещества и смягчителя, а также оболочки, содержащей преимущественно не растворимую в воде водопроницаемую полимерную пленку,пластификатор и водорастворимый полимер и второй оболочки, состоящей преимущественно из метакрилового полимера и пластификатора. Однако лекарственный состав, описанный в патенте 6143327,не соответствует требованиям стандартов FDA (Управление по контролю за продуктами и лекарствами США) для биоэквивалентности (см. пример 8 документа). В настоящее время не существует утвержденной имеющейся в торговле стабильной лекарственной формы бупропиона для одноразового ежедневного приема. Соответственно, существует необходимость в стабильной биоэквивалентной лекарственной форме бупропиона одноразового ежедневного приема или ее фармацевтически приемлемой соли. Определения Под лекарственными формами с модифицированным высвобождением в фармакопее США (USP) понимают формы, высвобождающие характеристики которых относительно периода действия и/или места выбираются таким образом, чтобы достичь терапевтических или благоприятных целей, которые не достигаются при использовании традиционных форм. Лекарственное средство с длительным высвобождением позволяет в два раза сократить прием лекарства или улучшить соблюдение пациентом режима приема лекарств или лечебное действие лекарства. В фармакопее США (USP) считается, что термины контролируемое высвобождение, длительное высвобождение и замедленное высвобождение заменяемы термином пролонгированное высвобождение. Соответственно термины модифицированное высвобождение, контролируемое высвобождение, длительное высвобождение, пролонгированное высвобождение и замедленное высвобождение взаимозаменяемы в данном описании.-2 013737 Термин фармацевтически приемлемая соль бупропиона включает в себя соли, физиологически переносимые пациентом. Такие соли обычно получают из неорганических кислот или щелочей и/или органических кислот и щелочей. Примеры таких кислот и щелочей хорошо известны специалистам в этой области. Изобретение, в частности, предусматривает использование гидрохлорида бупропиона, несмотря на то, что использование других фармацевтически приемлемых солей находится в рамках данного изобретения. Используемый в данном документе термин эффективное количество означает фармацевтически эффективное количество. Фармацевтически эффективное количество означает количество фармацевтически приемлемых солей бупропиона, достаточное для того, чтобы вызвать заметную биологическую реакцию при его назначении пациенту. Особенно будет полезным то, что точная лечебная доза зависит от возраста и состояния здоровья пациента, а также характера заболевания и окончательного решения лечащего врача. Используемый в данном документе термин водонепроницаемый слой означает слой, препятствующий или замедляющий поглощение влаги. Известно, что гидрохлорид бупропиона является высоко гигроскопичным и, как таковой, относительно нестабильным и подверженным разложению с течением времени в условиях повышенной влажности. Соотношение компонентов водонепроницаемого слоя и количества водонепроницаемого слоя, используемого в оболочке с контрольным высвобождением таково, что водонепроницаемый слой не соответствует определению и требованию фармакопеи США (USP) к энтеросолюбильной оболочке. Желательно, чтобы водонепроницаемый слой состоял из энтеросолюбильного и/или акрилового полимера, предпочтительно из акрилового полимера, необязательно из пластификатора, и усилителя проницаемости. Усилитель проницаемости представляет собой гидрофильное вещество, позволяющее проникать воде без физического нарушения покрытия. Водонепроницаемый слой может дополнительно содержать другие традиционные инертные наполнители, которые могут улучшать действие лекарственного средства с модифицированным высвобождением, описываемого в данной заявке. В настоящей заявке под общим количеством примесей понимают все продукты распада гидрохлорида бупропиона. Продукты распада включают вещества, указанные на стр. 281 Фармакопеи США(USP, 26-е издание), а также все другие продукты, которые могут отмечаться как пики на хроматограмме во время анализа. Таблетки с модифицированным высвобождением в соответствии с настоящим изобретением, являются биоэквивалентными по отношению к таблеткам Wellbutrin или Zyban/WellbutrinSR. Термин биоэквивалентность означает отсутствие существенных различий в скорости и количестве, с которыми активный ингредиент или активная часть фармацевтических эквивалентов или фармацевтических альтернатив становится доступными в зоне действия лекарственного средства, применяемого в такой же молярной дозе при аналогичных условиях в соответствующем дизайне исследовании. В тех случаях, когда имеется различие в скорости (например, при использовании лекарственных средств с пролонгированным высвобождением), определенные фармацевтические эквиваленты или альтернативы могут считаться биоэквивалентными, если не существует различий в количестве, в котором активный ингредиент или часть каждого продукта становится доступной в зоне действия лекарственного средства. Это имеет место только в том случае, если различие в скорости, с которой активный ингредиент или часть каждого продукта становится доступной в зоне действия лекарственного средства, предписывается и указывается на этикетке и не является существенным для получения эффективных концентраций лекарственного средства в организме при постоянном использовании, и считается с медицинской точки зрения не существенным в отношении лекарственного средства. Настоящее изобретение относится к таблеткам с модифицированным высвобождением фармацевтически приемлемой соли бупропиона, преимущественно гидрохлорида бупропиона. Преимущество таблеток с модифицированным высвобождением в соответствии с настоящим изобретением перед известными из уровня техники и имеющимися в продаже таблетками Wellbutrin или Zyban/Wellbutrin SR заключается в том, что таблетки с модифицированным высвобождением позволяют довести прием лекарственного средства до одного раза в день, при этом являются биоэквивалентными по отношению к имеющимся в продаже таблеткам, и не зависят от влияния приема пищи. В соответствии с одним аспектом настоящего изобретения представлена таблетка с модифицированным высвобождением, которая состоит (i) из ядра, содержащего эффективное количество фармацевтически приемлемой соли бупропиона, связующего вещества, смазывающего вещества; (ii) оболочки с контролируемым высвобождением, которая окружает указанное ядро; и (iii) водонепроницаемого слоя,покрывающего указанную оболочку с контрольным высвобождением, причем таблетка с модифицированным высвобождением является биологическим эквивалентом со следующими свойствами растворимости: по истечении около 2 ч высвобождается не более чем примерно 20%, предпочтительно примерно от 2 до 18%, более предпочтительно примерно от 4 до 8%, и самое предпочтительное около 5% содержания гидрохлорида бупропиона; по истечении примерно 4 ч высвобождается примерно от 15 до 45%,предпочтительно примерно от 21 до 37%, более предпочтительно примерно от 28 до 34%, и самое предпочтительное примерно 32% содержания гидрохлорида бупропиона; по истечении примерно 8 ч высво-3 013737 бождается примерно от 40 до 90%, предпочтительно примерно от 60 до 85%, более предпочтительно примерно от 68 до 74%, и самое предпочтительное примерно 74% содержания гидрохлорида бупропиона; и по истечении примерно 16 ч высвобождается не менее чем около 80%, предпочтительно не менее чем около 93%, более предпочтительно не менее чем около 96%, и самое предпочтительное не менее чем около 99% содержания гидрохлорида бупропиона. В одном воплощении водонепроницаемый слой не функционирует как энтеросолюбильная оболочка как это определено тестом фармакопею США (USP), поэтому оболочка таблетки должно иметь энетросолюбильный слой, и при помещении в 0,1N HCl на один час, общее количество высвобождаемого лекарственного средства не должно превышать 10% и не менее, чем 75% лекарственного средства должно высвободиться в течение 45 мин в условиях буферного раствора с рН 6,8. В одном воплощении настоящего изобретения фармацевтически приемлемая соль бупропиона составляет не менее 94% сухой массы ядра. Предпочтительно, чтобы таблетка с модифицированным высвобождением содержала примерно от 50 до 450 мг гидрохлорида бупропиона. Более предпочтительно,чтобы таблетки в соответствии с изобретением содержали примерно 150 или 300 мг гидрохлорида бупропиона. В другом воплощении настоящего изобретения количество связующего вещества составляет примерно от 1 до 6%, более предпочтительно примерно 3% сухой массы ядра. Связующим веществом предпочтительно является поливиниловый спирт. В другом воплощении настоящего изобретения количество смазывающего вещества составляет предпочтительно примерно от 1 до 6% и более предпочтительно примерно 3% сухой массы ядра. Смазывающие вещества, используемые для таблеток в настоящем изобретении, могут отбираться из группы,состоящей из глицерил бехената, стеариновой кислоты, гидрированного растительного масла и любого их соединения. Предпочтительным смазывающим веществом является глицерил бехенат. В другом воплощении настоящего изобретения оболочка с контролируемым высвобождением состоит в основном из водорастворимого водопроницаемого полимера, образующего пленку, при этом его количество может варьироваться примерно от 35 до 60% сухой массы оболочки с контролируемым высвобождением. Предпочтительно, чтобы количество водорастворимого водопроницаемого полимера,образующего пленку, составляло примерно 50% сухой массы оболочки с контролируемым высвобождением для дозы в 150 мг и примерно 45% сухой массы оболочки с контролируемым высвобождением при дозе в 300 мг. Водорастворимые водопроницаемые полимеры, образующие пленку, могут отбираться из группы, состоящей из простых эфиров целлюлозы, сложных эфиров целлюлозы, поливинилового спирта,а также любого их соединения. Предпочтительными водорастворимыми водопроницаемыми полимерами, образующие пленку, является этилцеллюлоза, которая может отбираться из группы, состоящей из этилцеллюлозы PR100, этилцеллюлозы PR20 и любой их комбинации. Предпочтительным водорастворимым водопроницаемым полимером является этилцеллюлоза PR100. В другом воплощении настоящего изобретения количество пластификатора составляет примерно от 6 до 30%, при этом более предпочтительно примерно 12% сухой массы оболочки с контролируемым высвобождением. Пластификаторы, используемые в таблетках настоящего изобретения, могут отбираться из группы, состоящей из полиолов (многоатомных спиртов), сложных органических эфиров, масел/глицеридов и любой их комбинации. Предпочтительным пластификатором является полиэтилен гликоль 1450. В другом воплощении настоящего изобретения количество водорастворимого может изменяться примерно от 25 до 50% сухой массы оболочки с контролируемым высвобождением. Предпочтительно,чтобы количество водорастворимого полимера составляло примерно 43% сухой массы оболочки с контролируемым высвобождением. Водорастворимый полимер может отбираться из группы, состоящей из поливинилпирролидона, гидроксипропилметилцеллюлозы, и любой их комбинации. Предпочтительным водорастворимым полимером является поливинилпирролидон. В другом воплощении настоящего изобретения соотношение нерастворимого в воде полимера, образующего водопроницаемую пленку, к пластификатору и к водорастворимому полимеру для таблетки с модифицированным высвобождением гидрохлорида бупропиона с дозой 150 мг может изменяться примерно от 3:1:4 до 5:1:3 с предпочтительным соотношением 4:1:3. В другом воплощении настоящего изобретения соотношение не растворимого в воде полимера, образующего водопроницаемую пленку, к пластификатору и к водорастворимому полимеру для таблетки с модифицированным высвобождением гидрохлорида бупропиона с дозой 300 мг может изменяться примерно от 7:2:6 до 19:5:18 с предпочтительным соотношением 13:4:12. В другом воплощении настоящего изобретения дополнительная масса таблетки с контролируемым высвобождением после ее покрытия оболочкой может изменяться от 3 до примерно 30% сухой массы ядра таблетки. Для таблетки с модифицированным высвобождением с дозой в 150 мг, дополнительная масса может изменяться примерно от 13 до 16% сухой массы ядра таблетки, при этом предпочтительная дополнительная масса составляет примерно 15% сухой массы ядра таблетки. Для таблетки с модифицированным высвобождением с дозой в 300 мг, дополнительная масса после покрытия оболочкой с контролируемым высвобождением может изменяться примерно от 8 до 10% сухой массы ядра таблетки, пред-4 013737 почтительная дополнительная масса составляет 9%. В другом воплощении настоящего изобретения изолирующий слой состоит из энтеросолюбильного и/или акрилового полимера, пластификатора и вещества, способствующего проникновению внутрь с соотношением примерно 3:2:5. Энтеросолюбильный и/или акриловый полимер, предпочтительно акриловый полимер, который в свою очередь является сополимером метакриловой кислоты, поступает в торговлю под названием Eudragit L 30 D-55. Несмотря на то, что количество сополимера метакриловой кислоты может изменяться примерно от 30 до 90% сухой массы изолирующего слоя, предпочтительно,чтобы количество сополимера метакриловой кислоты составляло примерно 66% сухой массы изолирующего слоя. В другом воплощении настоящего изобретения пластификатор может отбираться из группы, состоящей из полиолов, сложных органических эфиров, масел/глицеридов и любой их комбинации. Предпочтительным пластификатором, используемым в изолирующем слое, является комбинация из многоатомного спирта и сложного органического эфира. Предпочтительным многоатомным спиртом в соединении является полиэтиленгликоль 1450 с триэтилцитратом, предпочтительным является сложный органический эфир. Предпочтительное соотношение сложного органического эфира и многоатомного спирта- 1:2. Предпочтительно, чтобы пластификатор составлял примерно от 1 до 30% и более, предпочтительно примерно 10% сухой массы изолирующего слоя. В другом воплощении настоящего изобретения веществом, способствующим проникновению внутрь, является гидрофильное вещество, которое может отбираться из группы, состоящей из диоксида кремния, коллоидального кремния, лактобиозы, гидрофильных полимеров, хлористого натрия, оксида алюминия, коллоидного оксида алюминия, кремнезема, микрокристаллической целлюлозы. Веществом,способствующим проникновению внутрь, является предпочтительно двуоксид кремния, который составляет примерно от 20 до 40% и более предпочтительно примерно 25% от сухой массы изолирующего слоя. В другом воплощении настоящего изобретения после применения изолирующего слоя дополнительная масса составляет не более 6%, и предпочтительно не более примерно 2,5% сухой массы таблетки с модифицированным высвобождением с дозами 150 и 300 мг. В другом воплощении настоящего изобретения таблетки с модифицированным высвобождением обеспечивают устойчивый состав гидрохлорида бупропиона, в котором не менее чем примерно 95% и предпочтительно примерно 97,5 и даже 98,5 или даже 99% гидрохлорида бупропиона остаются устойчивыми после 12 месяцев при температуре хранения 25 С 2 С при относительной влажности 60%5%. В другом воплощении настоящего изобретения таблетки с модифицированным высвобождением обеспечивают устойчивый состав гидрохлорида бупропиона, в котором не менее чем примерно 95% и предпочтительно примерно 97,5 и даже 98,5 или даже 99% гидрохлорида бупропиона остаются устойчивыми после 18 месяцев при температуре хранения 25 С 2 С при относительной влажности 60%5%. В другом воплощении настоящего изобретения таблетки с модифицированным высвобождением являются биоэквивалентами таблеток Wellbutrin или Zyban/Wellbutrin SR и не подвержены влиянию приема пищи. В другом воплощении настоящего изобретения изолирующий слой существенно препятствует или задерживает проникновение влаги в таблетку, тем самым увеличивая устойчивость гидрохлорида бупропиона. Краткое описание рисунков (чертежей) Настоящее изобретение более подробно представлено на следующих чертежах, где фиг. 1 А является графиком, иллюстрирующим три различные кривые скорости растворения таблеток с модифицированным высвобождением, содержащих 150 мг гидрохлорида бупропиона согласно изобретению. фиг. 1 В является графиком, иллюстрирующим три различные кривые скорости растворения таблеток с модифицированным высвобождением, содержащих 300 мг гидрохлорида бупропиона согласно изобретению; фиг. 2 А является графиком, иллюстрирующим результаты статистического анализа коэффициентов относительной чувствительности (RRF), скорректированных с общим содержанием примесей в таблетках с модифицированным высвобождением, содержащих 150 мг гидрохлорида бупропиона, хранящихся при температуре 25 С 2 С (относительная влажность 60%5%) во флаконах из высокоплотного полиэтилена (HDPE, 7ct, 40cc и 30ct, 100 сс) согласно изобретению; фиг. 2 В является графиком, иллюстрирующим результаты статистического анализа коэффициентов относительной чувствительности (RRF), скорректированных с общим содержанием примесей в таблетках с модифицированным высвобождением, содержащих 300 мг гидрохлорида бупропиона, хранящихся при температуре 25 С 2 С (относительная влажность 60%5%) во флаконах из высоко плотного полиэтилена (HDPE, 7ct, 40cc и 30ct, 100 сс) согласно изобретению; фиг. 3 А является графиком, иллюстрирующим средние концентрации бупропиона в плазме после применения в исследованиях при дозе эквивалентной 2150 мг (один раз в день) и 1300 мг (один раз в-5 013737 день) в таблетках с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 3 В является графиком, иллюстрирующим средние концентрации гидроксибупропиона в плазме после применения в исследованиях при дозе эквивалентной 2150 мг (один раз в день) и 1300 мг(один раз в день) в таблетках с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 3 С является графиком, иллюстрирующим средние концентрации алкогольтреоаминобупропиона в плазме после применения в исследованиях при дозе эквивалентной 2150 мг (один раз в день) и 1300 мг (один раз в день) в таблетках с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 3D является графиком, иллюстрирующим средние концентрации алкогольэритроаминобупропиона в плазме после применения в исследованиях при дозе эквивалентной 2150 мг (один раз в день) и 1300 мг (один раз в день) в таблетках с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 4 А является графиком, иллюстрирующим воздействие пищи на средние концентрации бупропиона в плазме после приема одной дозы в 150 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона гидрохлорида согласно изобретению; фиг. 4 В является графиком, на котором сравниваются средние концентрации бупропиона в плазме,представленные на фиг. 4 А, со средними значения концентрации бупропиона после одного приема дозы в 150 мг таблетки Zyban; фиг. 4 С является графиком, на котором сравниваются средние концентрации гидроксиабупропиона в плазме после применения одной дозы в 150 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению со средними концентрациями гидроксибупропиона в плазме после приема одной дозы в 150 мг таблетки Zyban; фиг. 4D является графиком, на котором сравниваются средние концентрации алкогольтреоаминобупропиона в плазме после применения одной дозы в 150 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению со средними концентрациями гидроксибупропиона в плазме после приема одной дозы в 150 мг таблетки Zyban; фиг. 4 Е является графиком, на котором сравниваются средние концентрации алкогольэритроаминобупропиона в плазме после применения одной дозы в 150 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению со средними концентрациями гидроксибупропиона в плазме после приема одной дозы в 150 мг таблетки Zyban; фиг. 5 А является графиком, на котором сравнивается воздействие пищи на средние концентрации бупропиона в плазме после приема одной дней дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 5 В является кривой, на которой сравнивается воздействие пищи на средние концентрации гидроксибупропиона в плазме после приема одной дней дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 5 С является графиком, на котором сравнивается воздействие пищи на средние концентрации алкогольтреоаминобупропиона в плазме после приема одной дней дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 5D является графиком, на котором сравнивается воздействие пищи на средние концентрации алкогольтреоаминобупропиона в плазме после приема одной дней дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 6 А является графиком, иллюстрирующим средние концентрации бупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 6 В является графиком, на котором сравниваются средние концентрации бупропиона в стабилизированной плазме крови, представленные на фиг. 5 А со средними концентрациями бупропиона в стабилизированной плазме крови после многократного приема натощак таблеток Wellbutrin; фиг. 6 С является графиком, на котором сравниваются средние концентрации гидроксибупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями гидроксибупро пиона в стабилизированной плазме крови после многократного приема натощак таблеток Wellbutrin; фиг. 6D является графиком, на котором сравниваются средние концентрации алкогольтреоаминобупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями алкогольтреоаминобупропионав стабилизированной плазме крови после многократного приема натощак таблеток Wellbutrin; фиг. 6 Е является графиком, на котором сравниваются средние концентрации алкогольэритроамино-6 013737 бупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями алкогольэритроаминобупропиона в стабилизированной плазме крови после многократного приема натощак таблеток Wellbutrin; фиг. 7 А является графиком, иллюстрирующим средние концентрации бупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению; фиг. 7 В является графиком, на котором сравниваются средние концентрации бупропиона в стабилизированной плазме крови, представленные на фиг. 7 А со средними концентрациями бупропиона в стабилизированной плазме крови после многократного приема натощак общей дозы в 150 мг (два раза в день) Zyban; фиг. 7 С является графиком, на котором сравниваются средние концентрации гидроксибупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями гидроксибупропиона в стабилизированной плазме крови после многократного приема натощак общей дозы в 150 мг таблеток (два раза в день) Zyban; фиг. 7D является графиком, на котором сравниваются средние концентрации алкогольтреоаминобупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями алкогольтреоаминобупропиона в стабилизированной плазме крови после многократного приема натощак общей дозы в 150 мг таблеток (два раза в день) Zyban; фиг. 7 Е является графиком, на котором сравниваются средние концентрации алкогольэритроаминобупропиона в стабилизированной плазме крови после многократного приема натощак общей дневной дозы в 300 мг таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению, со средними концентрациями алкогольэритроаминобупропиона в стабилизированной плазме крови после многократного приема натощак общей дозы в 150 мг таблеток (два раза в день) Zyban. Описываемое в настоящем документе изобретение относится к таблетке с модифицированным высвобождением, которая представляет собой ядро, содержащее фармацевтически приемлемую соль бупропиона, стандартный наполнитель, связующее вещество и смазывающее вещество, и покрытое оболочкой с контролируемым высвобождением, которая контролирует высвобождение фармацевтически приемлемой соли бупропиона, которая, в свою очередь, покрыта водонепроницаемым слоем. Таблетка с модифицированным высвобождением согласно изобретению является биоэквивалентом. 1. Ядро Ядро таблетки с модифицированным высвобождением содержит эффективное количество фармацевтически приемлемой соли бупропиона, связующее вещество и смазывающее вещество, а также может содержать другие стандартные инертные наполнители. Количество активного лекарственного средства в таблетке может изменяться примерно от 50 до 90% сухой массы таблетки, предпочтительно примерно от 70 до 90% сухой массы таблетки. Фармацевтически приемлемой солью бупропиона предпочтительно является гидрохлорид бупропиона. Таблетка содержит такое количество гидрохлорида бупропиона, которое может изменяться примерно от 50 до 450 мг. Предпочтительно, чтобы таблетка содержала 150 или 300 мг гидрохлорида бупропиона. В таблетке с дозой в 150 мг гидрохлорида бупропиона содержится около 78% сухой массы таблетки. Для дозы в 300 мг, количество гидрохлорида бупропиона составляет примерно 83% сухой массы таблетки. Как для дозы в 150 мг, так и для дозы в 300 мг в таблетках изобретения гидрохлорида бупропиона с модифицированным высвобождением гидрохлорида бупропиона содержится около 94% сухой массы ядра для каждой дозы. Связующее вещество (называемое также адгезивом) добавляют в заправочную массу лекарственного средства для обеспечения того, чтобы готовые гранулы и таблетки имели требуемую механическую прочность. Связующее вещество может добавляться к лекарственному средству различными способами:(1) в виде сухого порошка, смешанного с другими ингредиентами до влажной агломерации, (2) в виде раствора, используемого в качестве агломерирующей жидкости в процессе влажной агломерации, называемого связующим раствором, а также в виде (3) сухого порошка, смешиваемого с другими ингредиентами до уплотнения (прессования). В данном случае связующее вещество называется сухим связующим веществом. Связующие растворы обычно считаются самыми эффективными, и поэтому это самый распространенный способ включения связующего вещества в гранулы. Здесь связующее вещество используется в виде связующего раствора. Неограниченное количество примеров связующих веществ, которые могут быть использованы для ядра, включают вещества растворимые в воде, такие как модифицированный крахмал, желатин, поливинилпирролидон, производные целлюлозы (такие, например, как гидроксипропилметилцеллюлоза (НРМС) и гидроксипропилцеллюлоза (НРС, а также поливиниловый спирт. Количество связующего вещества может изменяться примерно от 0,5 до 15% сухой массы таблетки,предпочтительно примерно от 1 до 6% сухой массы таблетки, самое предпочтительное примерно от 3%-7 013737 сухой массы таблетки. Как для таблетки с дозой в 150 мг, так и для таблетки с дозой в 300 мг количество связующего вещества может быть примерно от 1 до 6% сухой массы каждого ядра и более предпочтительно примерно 3 сухой массы каждого ядра. Предпочтительным связующим веществом является поливиниловый спирт. Смазывающие вещества добавляются в фармацевтический состав таблеток для обеспечения наименьшего трения твердой массы со стенкой матрицы при формировании и выпуске таблеток. Повышенное трение при таблетировании может привести к целому ряду проблем, включая неодинаковое качество таблеток (разрушение прессованной порошковой заготовки или даже раздробление таблеток во время выпуска, а также образование вертикальных царапин по краям таблетки), и даже может вызвать остановку производства. Соответственно, смазывающие вещества добавляются в составы почти всех таблеток, в том числе и в состав таблеток гидрохлорида бупропиона, описываемого здесь. Неограниченное количество примеров смазывающих веществ, которые могут быть использованы для ядра, включает глицерилбехенат, стеариновую кислоту, гидрированные растительные масла (такие как гидрированное хлопковое масло (Sterotex), гидрированное соевое масло (Sterotex HM) и гидрированное соевое масло и гидрированное касторовое масло (Sterotex К), стеариновый спирт, лейцин и полиэтиленгликоль (молекулярный вес 4000 и выше). Смазывающим веществом предпочтительно является глицерилбехенат. Количество смазывающего вещества может изменяться примерно от 1 до 5% сухой массы таблетки, предпочтительно примерно от 2 до 3% массы сухой таблетки, и самое предпочтительное примерно 2,5% сухой массы таблетки. Для таблеток с модифицированным высвобождением согласно изобретению с дозами в 150 и 300 мг количество смазывающего вещества составляет примерно 2,5% сухой массы таблетки и предпочтительно примерно от 1 до 6% сухой массы ядра и более предпочтительно примерно 3% сухой массы ядра для обеих доз. На данном этапе состав ядра обеспечивает немедленное 100%-ное растворение гидрохлорида бупропиона в течение 1 ч (данные не приводятся). Идеально ядро состоит только из эффективного фармацевтического количества фармацевтически приемлемой соли бупропиона, связующего вещества, предпочтительно поливинилового спирта, и смазывающего вещества, предпочтительно, глицерилбехената. Однако, в случае необходимости, в состав ядра могут быть добавлены вспомогательные инертные наполнители, соответствующие целям изобретения. Вспомогательные инертные наполнители могут добавляться для облегчения изготовления препарата и/или улучшения переносимости пациентом дозы гидрохлорида бупропиона с модифицированным высвобождением, описываемой в настоящем изобретении. Вспомогательные инертные наполнители хорошо известны квалифицированным специалистам и с ними можно ознакомиться в соответствующей литературе, например в Руководстве по фармацевтическим наполнителям. Неограниченное количество примеров таких наполнителей включает лактозу, высушенную распылением, сорбитол, маннитол, а также любое производное целлюлозы. Предпочтительно, чтобы гранулы, прессуемые для образования ядра таблетки с модифицированным высвобождением согласно изобретению, описываемого в настоящем документе, изготавливались по технологии влажного гранулирования. В сущности, при влажном гранулировании происходит измельчение вещества (активного лекарственного средства) в тонкий порошок и увлажнение порошка раствором связующего вещества и последующим высушиванием гранулята. Для формирования гранул, которые затем прессуются в ядра таблеток, сначала гранулируется гидрохлорид бупропиона, предпочтительно, со связующим раствором, в грануляторе, желательно, но не обязательно, в грануляторе с кипящим слоем,который производится компаниями Glatt (Германия) или Aeromatic (Швейцария). Связующим веществом предпочтительно является поливиниловый спирт, который сначала растворяется или диспергируется в приемлемом растворителе, предпочтительно в воде. Затем связующий раствор напыляется на лекарственное средство в грануляторе, предпочтительно грануляторе с кипящим слоем. В качестве альтернативы, грануляция может также осуществляться в обычной мешалке или мешалке с большими сдвиговыми усилиями. В случае необходимости, вспомогательные инертные наполнители, такие как, например, заполняющее вещество, могут смешиваться с гидрохлоридом бупропиона на стадии гранулирования. Сформированные гранулы затем высушивают и просеивают перед добавлениемсмазывающего вещества. Предпочтительно, чтобы высушенные гранулы просеивались через сито с отверстиями размером в 1,4 мм. Просеянные гранулы затем смешиваются со смазывающим веществом и, если это необходимо,с любыми другими вспомогательными инертными наполнителями, которые могут способствовать улучшению процесса изготовления таблеток с модифицированным высвобождением согласно изобретению. Смешивание гранул со смазывающим веществом и, если это необходимо, со вспомогательными инертными наполнителями, такими, например, как глидант, может осуществляться в воронкообразном смесителе или любом другом приемлемом смесителе. Глиданты улучшают сыпучесть порошка. Это особенно важно при получении таблеток на высоких скоростях производства и при направленном прессовании. Однако в связи с высокими требованиями к адекватности потока глидант часто также добавляется при стадии гранулирования до таблетирования. Смешанные гранулы затем прессуются в таблетки и считаются ядром таблеток. Ядра таблеток могут получаться при использовании стандартных способов и оборудования, хорошо известных квалифицированным специалистам. В идеальном варианте, но не обязатель-8 013737 но, ядра таблеток получаются с помощью роторного пресса (называемого также многопрофильным прессом), оснащенным соответствующими штамповальными прессами. 2. Покрытия таблеток Ядра таблеток покрываются в два этапа. Оболочки с контролируемым высвобождением наносится непосредственно на поверхность ядра таблетки, ее назначение контролировать высвобождение фармацевтически приемлемой соли бупропиона. Водонепроницаемый слой наносится непосредственно на поверхность оболочки с контролируемым высвобождением для предотвращения или задержания поглощения влаги. 2.1. Оболочка с контролируемым высвобождением Оболочка с контролируемым высвобождением является полупроницаемой оболочкой, содержащей полимер, который образует не растворимую в воду водопроницаемую пленку, пластификатора и полимера, растворимого в воде. Неограниченные примеры полимеров, образующих не растворимую в воду водопроницаемую пленку, и используемых в оболочках с контролируемым высвобождением включают простые эфиры целлюлозы, сложные эфиры целлюлозы и поливиниловый спирт. Предпочтительными полимерами, образующими не растворимую в воду водопроницаемую пленку, являются этилцеллюлозы, которые могут отбираться из группы, состоящей из этилцеллюлозы PR100, этилцеллюлозы PR20 и любой их комбинации. Этилцеллюлоза PR 100 является предпочтительным полимером, образующим не растворимую в воду водопроницаемую пленку. Количество полимера, образующего не растворимую в воде водопроницаемую пленку, может изменяться примерно от 1 до 8% сухой массы таблетки, предпочтительно примерно от 2 до 6% сухой массы таблетки. Для таблеток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг количество полимера, образующего не растворимую в воде водопроницаемую пленку, может изменяться примерно от 3 до 6% сухой массы таблетки,предпочтительно примерно 6,3% сухой массы таблетки. Что касается самой оболочки с контролируемым высвобождением, количество полимера, образующего не растворимую в воде водопроницаемую пленку,может изменяться примерно от 35 до 60% сухой массы оболочки с контролируемым высвобождением,предпочтительно примерно 50% сухой массы оболочки с контролируемым высвобождением. Для таблеток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг количество полимера, образующего не растворимую в воде водопроницаемую пленку, может изменяться примерно от 2 до 5% сухой массы таблетки, предпочтительно примерно 3,6% сухой массы таблетки. Что касается самой оболочки с контролируемым высвобождением, то количество полимера, образующего не растворимую в воде водопроницаемую пленку, составляет примерно 45% сухой массы оболочки с контролируемым высвобождением. Обычно пластификаторы добавляются в состав пленочного покрытия для изменения физических свойств полимера с целью более широкого его применения. Количество и вид пластификатора обеспечивают твердость таблетки и даже могут влиять на свойства ее растворимости и разложения, а также физические и химические свойства. Одним из важнейших свойств пластификаторов является их способность делать оболочку эластичной и многослойной, уменьшая тем самым хрупкость оболочки. Множество примеров пластификаторов, используемых в оболочке с контролируемым высвобождением, описанных в данном описании изобретения, включает сложные спирты, такие как полиэтиленгликоль различного молекулярного веса, сложные органические эфиры, такие как диэтилфталат или триэтилцитрат, а также масла/глицериды, такие как фракционированное кокосовое масло. Количество пластификатора в оболочке с контролируемым высвобождением может изменяться примерно от 0,5 до 2% сухой массы таблетки. Предпочтительным пластификатором является полиэтиленгликоль. Для таблеток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг количество пластификатора в оболочке с контролируемым высвобождением может изменяться примерно от 1 до 1,5% сухой массы таблетки, предпочтительное количество пластификатора составляет примерно 1,5% сухой массы таблетки. Для таблеток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг количество пластификатора может изменяться примерно от 0,5 до 2% сухой массы таблетки. Как для лекарственных форм с дозами 150 мг так и для 300 мг, количество пластификатора может изменяться примерно от 6 до 30% сухой массы покрытия с контролируемым высвобождением, более предпочтительное количество составляет примерно 12% сухой массы покрытия с контролируемым высвобождением. Неограниченное количество примеров водорастворимых полимеров, используемых в оболочке с контролируемым высвобождением включают поливинилпирролидон, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу. Предпочтительным растворимым полимером является поливинилпирролидон, количество которого может изменяться примерно от 1,5 до 6% сухой массы таблетки. Что касается самой оболочки с контролируемым высвобождением, количество водорастворимого полимера может изменяться примерно от 25 до 55% сухой массы оболочки с контролируемым высвобождением. Для таблеток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг количество водорастворимого полимера может изменяться примерно от 3 до 5% сухой массы таблетки или примерно от 25 до 50% сухой массы оболочки с контролируемым высвобождением. Для таб-9 013737 леток с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг количество водорастворимого полимера может изменяться примерно от 2 до 5% сухой массы таблетки и составлять примерно 43% сухой массы оболочки с контролируемым высвобождением. Соотношение полимер, образующий не растворимую в воде водопроницаемую пленку: пластификатор: водорастворимый полимер для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг, описанной в данном изобретении, может изменяться примерно от 3:1:4 до 5:1:3. Предпочтительным соотношением является соотношение 4:1:3. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг,описанной в данном документе, соотношение полимера, образующего не растворимую в воде водонепроницаемую пленку, к пластификатору и водорастворимому полимеру может изменяться примерно от 7:2:6 до 19:5:18. Предпочтительным является соотношение примерно 13:4:12. Обычно процедура приготовления и нанесения оболочки с контролируемым высвобождением состоит в следующем. Полимер, образующий не растворимую в воде водопроницаемую пленку, предпочтительно этилцеллюлоза, и пластификатор, предпочтительно полиэтиленгликоль 1450, растворяют в органическом растворителе, таком как смесь этилового и изоприлового спирта. Затем добавляют пластификатор, предпочтительно поливинилпирролидон, до получения однородной смеси. Полученный раствор оболочки с контролируемым высвобождением напыляют на ядра таблеток с помощью устройства для нанесения оболочек, аппарата с кипящим слоем или любого иного приемлемого известного устройства для нанесения оболочек до получения необходимого увеличения массы. Затем ядра таблеток, покрытые оболочкой с контролируемым высвобождением, высушивают до стадии нанесения водонепроницаемого слоя. Квалифицированный специалист в данной области понимает, что контролирование проницаемости обеспечивает контроль высвобождения гидрохлорида бупропиона и/или количество оболочки, наносимой на ядра таблеток. Проницаемость оболочки с контролируемым высвобождением можно изменять,изменяя соотношение полимера, образующего не растворимую в воде водопроницаемую пленку, к водорастворимому полимеру и/или количество оболочки, наносимой на ядро таблетки. Более ускоренное высвобождение обычно достигается при наличии большего количества полимера, образующего не растворимую в воде водопроницаемую пленку. Добавление других наполнителей в ядро таблетки также может изменять проницаемость оболочки с контролируемым высвобождением. Например, если необходимо,чтобы ядро таблетки содержало порообразователь, количество пластификатора в оболочке с контролируемым высвобождением должно быть увеличено для того, чтобы ядро было пластичным, поскольку давление, оказываемое порообразователем на менее пластичную оболочку, может привести к разрушению оболочки. Кроме того, соотношение полимера, образующего не растворимую в воде водопроницаемую пленку, и водорастворимого полимера также должно меняться в зависимости от того, требуются ли свойства ускоренного или замедленного растворения и/или высвобождения. В зависимости от свойств растворения или реального высвобождения, масса, полученная после покрытия ядра таблетки оболочкой с контролируемым высвобождением, может меняться примерно от 3 до 30% сухой массы ядра таблетки. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг дополнительная масса может изменяться примерно от 13 до 16% сухой массы ядра таблетки, предпочтительная дополнительная масса составляет примерно 15% сухой массы ядра таблетки. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг дополнительная масса может изменяться примерно от 8 до 10% сухой массы ядра таблетки, предпочтительная дополнительная масса составляет примерно 9% сухой массы ядра таблетки. 2.2. Водонепроницаемый слой Водонепроницаемый слой наносится непосредственно на оболочку с контролируемым высвобождением и состоит из энтеросолюбильного полимера и/или акрилового полимера, усилителя проницаемости и необязательно пластификатора. Предпочтительным энтеросолюбильным полимером является акриловый полимер. Преимущественно акриловым полимером является сополимер метакриловой кислоты типа С [поли(метакриловая кислота, метилметакрилат) 1:1], известное под торговым наименованиемEudragit (например, Eudragit L30D-55). Количество сополимера метакриловой кислоты может изменяться примерно от 1 до 3% сухой массы таблетки и примерно от 55 до 70% сухой массы водонепроницаемого слоя. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг количество сополимера метакриловой кислоты может изменяться примерно от 2 до 3% сухой массы таблетки, предпочтительное количество сополимера метакриловой кислоты составляет примерно 2% сухой массы таблетки. Что касается самого водонепроницаемого слоя, предпочтительное количество сополимера метакриловой кислоты составляет примерно от 30 до 90% сухой массы водонепроницаемого слоя и более, предпочтительное количество составляет примерно 66% сухой массы водонепроницаемого слоя. Для таблетки с модифицированным высвобождением согласно изобретению с дозой бупропиона гидрохлорида 300 мг количество сополимера метакриловой кислоты может изменяться примерно от 1,5 до 3% сухой массы таблетки, предпочтительное количество сополимера метакриловой кислоты составляет примерно 2% сухой массы таблетки. Что касается самого слоя, предпоч- 10013737 тительное количество сополимера метакриловой кислоты составляет примерно от 30 до 90% сухой массы водонепроницаемого слоя и более, предпочтительное количество составляет примерно 66% сухой массы водонепроницаемого слоя для таблетки с модифицированным высвобождением согласно изобретению с дозой 300 мг. Из уровня техники известно, что сополимеры метакриловой кислоты имеют склонность становиться хрупкими и поэтому испытывают необходимость в пластификаторе. Неограниченное количество примеров пластификаторов, используемых в оболочке с контролируемым высвобождением и описываемых в настоящем документе, включают сложные спирты, такие как полиэтиленгликоли с различным молекулярным весом, сложные органические эфиры, такие как диэтилфталат или триэтилцитрат, а также масла/глицериды, такие как фракционированное кокосовое или касторовое масло. Предпочтительный пластификатор состоит из комбинации триэтилцитрата и полиэтиленгликоля 1450. Соотношение триэтилцитрата и полиэтиленгликоля 1450 составляет примерно 1:2. Количество пластификатора может изменяться примерно от 0,2 до 0,5%, предпочтительно примерно от 0,2 до 0,4% сухой массы таблетки. Количество пластификатора составляет примерно 0,35% сухой массы таблетки с дозой 150 мг и примерно от 0,2 до 0,4% сухой массы таблетки с дозой 300 мг. Что касается самого водонепроницаемого слоя, предпочтительное количество пластификатора составляет примерно от 1 до 30% сухой массы водонепроницаемого слоя и более, предпочтительное количество примерно 10% сухой массы водонепроницаемого слоя как для таблетки согласно изобретению с дозой гидрохлорида бупропиона 150 мг, так и для таблетки согласно изобретению с дозой гидрохлорида бупропиона 300 мг. Фармацевтам известно, что в зависимости от целевого назначения, наполнители, используемые в таблетках, подразделяются на несколько групп. Однако один наполнитель может влиять на свойства лекарственного средства или таблетки в целом различными способами, при этом многие вещества, используемые в лекарственных формах в виде таблетки могут описываться как многофункциональные. Например, полиэтиленгликоль 1450, используемый в соединениях пластификатора для водонепроницаемого слоя, служит не только увеличению гидрофильности водонепроницаемого слоя, он действует также и как глидант. Дополнительно к действию полиэтиленгликоля 1450 ингибитор проникновения также действует как глидант и также увеличивает гидрофильность водонепроницаемого слоя. Ингибитор проникновения является гидрофильным веществом и может отбираться из группы, состоящей из двуоксида кремния, коллоидного кремния, лактозы, гидрофильных полимеров, хлористого натрия, оксида алюминия, коллоидного оксида алюминия, кремнезема, микрокристаллической целлюлозы и любых их комбинаций. Предпочтительным ингибитором проникновения является двуоксид кремния. Количество ингибитора проникновения может изменяться примерно от 0,5 до 1% сухой массы таблетки, что составляет примерно 25% сухой массы водонепроницаемого слоя. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 150 мг количество ингибитора проникновения составляет примерно 0,9% сухой массы таблетки и примерно от 20 до 40%, предпочтительно примерно 25% сухой массы водонепроницаемого слоя. Для таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона 300 мг количество ингибитора проникновения может изменяться примерно от 0,5 до 1% сухой массы таблетки и примерно от 20 до 40%, предпочтительно примерно 25% сухой массы водонепроницаемого слоя. Соотношение сополимера метакриловой кислоты к пластификатору и к ингибитору проникновения составляет, преимущественно, примерно 13:2:5. Обычно процедура приготовления и наложения водонепроницаемого слоя состоит в следующем. Пластификатор, предпочтительно комбинация полиэтиленгликоля 1450 и триэтилцитрата, сначала добавляют в воду, затем смесь доводят до состояния однородности. Сополимер метакриловой кислоты,предпочтительно Eudragit L30D-55, просеивают и добавляют в смесь пластификатора, после этого смесь доводят до однородности. В отдельном сосуде растворяют в воде усилитель проницаемости, предпочтительно двуоксид кремния, до получения однородной смеси. Затем смесь пластификатора и сополимера метакриловой кислоты соединяют с усилителем проницаемости и смесь доводят до однородности. Полученный раствор водонепроницаемого слоя затем напыляют на ядро таблетки, покрытое оболочкой с контролируемым высвобождением, с помощью устройства для нанесения покрытия, аппарата с кипящим слоем или любого иного приемлемого и широко известного устройства для нанесения покрытий до получения необходимой массы. Таблетки, покрытые водонепроницаемым слоем, затем высушиваются до стадии их упаковки. Водонепроницаемый слой наносится на ядро таблетки, имеющей оболочку с контролируемым высвобождением таким образом, чтобы увеличение массы не превышало примерно 6% и предпочтительно составляло не более чем примерно 2,5% сухой массы таблетки с модифицированным высвобождением согласно изобретению с дозой гидрохлорида бупропиона в 150 мг и дозой 300 мг. Количество водонепроницаемого слоя, наносимого на таблетку с модифицированным высвобождением гидрохлорида бупропиона, описываемую в данном документе, не должно быть стойким в отношении желудочного сока и влиять на свойства лекарства, характеризующие его высвобождение. Водонепроницаемый слой, описываемый здесь, не функционирует как энтеросолюбильная оболоч- 11013737 ка. Несмотря на то, что описывается и используется сополимер метакриловой кислоты Eudragit L30D55 в составе энтеросолюбильной оболочки, его свойства зависят от количества используемого материала. Хорошо известно, что энтеросолюбильная оболочка применяется в тех случаях, когда лекарственное средство может быть разрушено или деактивировано желудочным соком или когда лекарственное средство может раздражать слизистую оболочку желудка. Для того чтобы энтеросолюбильная оболочка соответствовала предъявляемым требованиям, тест, описанный в Фармакопее США (USP, методика А или В), предусматривает, чтобы после нахождения в течение 2 ч в кислой среде (0,1N HCl) ни одно из значений по крайней мере в шести экспериментах, не превышало 10% растворенного активного лекарственного средства и не менее, чем 75% растворенного в течение 45 мин в среде с рН 6,8. Несмотря на то что гидрохлорид бупропиона не подвергается негативному воздействию кислотной среды, и слизистая оболочка желудка не раздражается, водонепроницаемый слой не соответствует данному требованию в силу следующих причин: (1) для получения энтеросолюбильной целостности с пленкой, содержащейEudragit L30D-55, рекомендуется дополнительная масса примерно от 6 до 8% от сухой массы полимера на одну дозу. Количество твердого Eudragit L30D-55, вводимого в ядро таблетки, имеющей оболочку с контролируемым высвобождением, не должно превышать 6%, предпочтительно не более чем 2,5%. (2) если требуется энтеросолюбильная целостность, испытание конечного продукта на растворимость (т.е. водонепроницаемого слоя, покрывающего ядра таблеток) в течение в 2 ч не предусматривают максимальный уровень 20%. И (3) анализ конечного продукта, содержащего два слоя оболочки, показывает,что продукт не соответствует всем требованиям теста, предъявляемым к продукту, содержащему энтеросолюбильную оболочку, как указывается в методиках испытаний Фармакопеи США (USP). Поскольку водонепроницаемый слой наносится непосредственно на оболочку с контролируемым высвобождением,тесты проводились для определения того, функционирует ли водонепроницаемый слой, наносимый непосредственно на ядро таблетки с немедленным высвобождением, в качестве энтеросолюбильной оболочки. Результаты тестов показывают, что по истечении 1 ч более 40% гидрохлорида бупропиона высвобождается из ядра таблетки в кислой среде 0,1 N HCl и, следовательно, данный водонепроницаемый слой не соответствует определению Фармакопеи США (USP) для энтеросолюбильной оболочки (см. пример 2). Функционирование водонепроницаемого слоя подтверждается также при определении содержании влаги с помощью метода Карла Фишера (KF) отдельно для ядра таблетки, имеющей оболочку с контролируемым высвобождением и ядра таблетки с водонепроницаемым слоем в ускоренном режиме (40 С 2 С при относительной влажности 75%5%) в открытой стеклянной чашке в течение 10 дней (см. пример 2). Результаты показывают, что содержание влаги в ядре таблетки, имеющей оболочку с контролируемым высвобождением выше, чем в ядре таблетки с водонепроницаемым слоем. В целом, указанные данные устанавливают функционирование водонепроницаемого слоя в качестве оболочки, которая существенно препятствует поглощению влаги или задерживает ее, а не в качестве энтеросолюбильной оболочки, как указывается в Фармакопеи США (USP). Таблетка согласно изобретению предусматривает пролонгированное высвобождение гидрохлорида бупропиона, несмотря на то что в ее составе нет никакого порообразующего вещества. Вышеуказанный состав предусматривает также стабильность гидрохлорида бупропиона, при которой по истечении около 2 ч, высвобождается не более чем примерно 20%, предпочтительно примерно от 2 до 18%, более предпочтительно примерно от 4 до 8% и самое предпочтительное около 5% содержания гидрохлорида бупропиона, по истечении примерно 4 ч, высвобождается примерно от 20 до 45%, предпочтительно примерно от 21 до 37%, более предпочтительно примерно от 28 до 34% и самое предпочтительное примерно 32% содержания гидрохлорида бупропиона, по истечении примерно 8 ч высвобождается примерно от 40 до 90%, предпочтительно примерно от 60 до 85%, более предпочтительно примерно от 68 до 74%, и самое предпочтительное примерно 74% содержания гидрохлорида бупропиона высвобождается, и по истечении примерно 16 ч высвобождается не менее чем около 80%, предпочтительно не менее чем около 93%,более предпочтительно не менее чем около 96%, и самое предпочтительное не менее чем около 99% содержания гидрохлорида бупропиона. Факт положительного воздействия на стабильность описываемого в данном изобретении состава таблетки с модифицированным высвобождением гидрохлорида бупропиона подтверждается испытаниями, проведенных с целью оценки общего количества примесей в формах с дозами 150 и 300 мг в течение 6 месяцев в ускоренном режиме (40 С 2 С при относительной влажности 75%5%) и в течение 12 и 18 месяцев длительной стабильности при 25 С 2 С и при относительной влажности 60%5%. Результаты тестов на стабильность показали сниженные значения (относительно Wellbutrin SR) общего количества примесей в таблетках. В 7 подсчетах (флаконы емкостью 40 см 3) и в 30 подсчетах (флаконы емкостью 100 см 3) из полиэтилена повышенной плотности (HDPE) для таблеток с модифицированным высвобождением согласно изобретению с дозами 150 и 300 мг, например, общее количество примесей не должно было превышать примерно 2,5% от массы гидрохлорида бупропиона, содержащегося в таблетке, предпочтительно не более чем примерно 1,5%, и, самое предпочтительное, не более чем примерно 0,6% в течение не менее 12 месяцев долгосрочной стабильности при температуре 25 С 2 С и относительной влажности 60%5%.- 12013737 При 18-месячной стабилизации при температуре 25 С 2 С и относительной влажности 60%5%, общее количество примесей не должно превышать примерно 2,5% от массы гидрохлорида бупропиона в таблетке, предпочтительно не более чем примерно 1,5%, и самое предпочтительное не более чем примерно 0,7% от массы гидрохлорида бупропиона, содержащегося в таблетке. Таким образом, таблетка с модифицированным высвобождением гидрохлорида бупропиона в соответствии с настоящим изобретением содержит не менее чем около 95% весового соотношения и, более предпочтительно, около 98% или даже не менее чем около 99% неразложившегося гидрохлорида бупропиона после хранения в течение 12 или 18 месяцев долгосрочной стабилизации при влажности и температуре, которые обычно приняты в аптеках и медицинских кабинетах, то есть при комнатной температуре и влажности 35-60%. Таким образом, например, при использовании таблетки в фармацевтических препаратах гидрохлорид бупропиона сохраняет не менее 95% своей активности и предпочтительно не менее 98% или даже 99% своей активности хранения таблетки в течение одного года при комнатной температуре (15-25 С) и влажности 3560%. Например, если первоначально таблетка содержит 300 мг гидрохлорида бупропиона (количество,указанное на этикетке) при приготовлении, то после хранения ее в течение одного года в таблетке будет сохраняться не менее 285 мг гидрохлорида бупропиона и, предпочтительно, не менее 294 мг или более. Содержание влаги, определяемой в тесте Карла Фишера, и общее количество примесей в таблетке гидрохлориде бупропиона согласно изобретению с дозой 150 мг при хранении в ускоренном режиме в течение не менее чем 6 месяцев в 7 подсчетах (флаконы из HDPE емкостью 40 см 3) не должны быть более чем 1%. Содержание влаги, определяемой в тесте Карла Фишера, флаконы такой же конфигурации и таблетки для дозы 300 мг, которые хранятся при таком же ускоренном режиме, не должно превышать 1% и общее количество примесей не должно превышать примерно 0,6% в течение по крайней мере 6 месяцев. Таблетки с дозой 150 мг, которые хранились во флаконе из HDPE емкостью 100 см 3 в 30 подсчетах,содержание влаги, определяемой в тесте Карла Фишера, не должно превышать 1% и общее количество примесей не должно превышать примерно 1,2% при хранении в ускоренном режиме в течение по крайней мере 6 месяцев. Содержание влаги, определяемой в тесте Карла Фишера, в таблетках с дозой 300 мг,которые хранились при таких же условиях в течение такого же срока должно быть не более 1% и общее количество примесей не должно превышать примерно 0,8%. При хранении в открытой стеклянной чашке, содержание влаги, определяемой в тесте Карла Фишера, в таблетке с модифицированным высвобождением согласно изобретению с дозой 300 мг не должно превышать примерно 0,8% после хранения в течение 3 дней и предпочтительно не более чем 0,45% после хранения в течение 10 дней ускоренного режима. При хранении в плотно притертых стеклянных флаконах содержание влаги, определяемой в тесте Карала Фишера, не должно превышать 0,45% после хранения в течение 3 дней и предпочтительно не более чем 0,4% после хранения в течение 10 дней. Следующие примеры иллюстрируют настоящее изобретение, при этом их целью не является ограничение объема изобретения. Пример 1. 1. Составы таблетки с модифицированным высвобождением Были приготовлены три различных состава для ядра таблеток с модифицированным высвобождением, содержащих дозы 150 и 300 мг гидрохлорида бупропиона как показано в табл. 1. Таблица 1 Значения мг/% представляют процентное соотношение массы ингредиента к сухой массе таблетки поливиниловый спирт 3 глицерилбехенат (Compritol 888 АТО) 4 испарившаяся во время сушки 2- 13013737 Сначала нагрели воду до температуры 605 С. Затем в воде растворили связующее вещество (поливиниловый спирт) до однородности, а раствор пропустили через сито с ячейками 0,7 мм и затем охладили до температуры не выше 30 С. В верхнюю камеру распыления устройства с кипящим слоем, например установку с кипящим слоем фирмы Glatt GPCG1, поместили гидрохлорид бупропиона. На гидрохлорид бупропиона напылили связующий раствор (т.е. раствор поливинилового спирта) при технологических характеристиках, приведенных в табл. 2: Таблица 2 После завершения грануляции гранулы высушивают и охлаждают до температуры не более чем примерно 35 С. Гранулы гидрохлорида бупропиона затем просеивают (сортируют) на сите с ячейками размером 1,4 мм. Смазывающее вещество (глицерилбехенат) вместе с отсортированными гранулами смешивают в воронкообразном смесителе до получения однородной смеси. Полученную смесь с помощью роторной таблеточной машины (фирмы Manesty Unipress) прессуют в таблетки со средней твердостью примерно от 8Sc до 25Sc и средней толщиной примерно от 3,9 до 4,5 мм для ядра таблеток с дозой 150 мг; и средней твердостью примерно от 12Sc до 33Sc, и средней толщиной примерно от 4,8 до 5,4 мм для ядра таблеток с дозой 300 мг. Хрупкость ядра таблеток для обеих доз не превышает 0,8%. Затем ядра таблеток покрывают оболочкой с контролируемым высвобождением, имеющей состав, указанный в табл. 3: Таблица 3 Значения мг/% представляют процентное соотношение масса ингредиента к сухой массе таблетки этилцеллюлоза 100 (Ethocel) 3 поливинилпирролидон (Kollidon 90F) 4 полиэтиленгликоль 1450 (Carbowax) 5 испаряющийся при сушке Пластификатор (полиэтиленгликоль 1450), а затем полимер, образующий не растворимую в воде водопроницаемую пленку (этиленцеллюлоза 100), добавляют в часть смеси денатурированного этилового спирта и изопропилового спирта. После смешения в вышеуказанную смесь постепенно добавляют водорастворимый полимер, чтобы не допустить образования крупных частиц или слипания. Раствор размешивают до получения однородности. Оставшуюся часть денатурированного этилового спирта и изопропилового спирта добавляют в смесь для оболочки до получения однородного раствора. Раствор для оболочки пропускают через смеситель (гомогенизатор) DeBee Homogenizer (размер форсунки 7, при технологическом давлении (на допасти) 85002000 фунтов/дюйм 2 и встречном давлении (сопротивлении 2- 14013737 потока) 1000250 фунтов/дюйм 2). Затем однородный раствор для оболочки напыляют на ядро таблетки в установке для нанесения покрытий (О'Нага 36 Side Vent) при технологических характеристиках, указанных в табл. 4. Таблица 4 Раствор для оболочки с контролируемым высвобождением наносят на ядра таблеток до тех пор, пока дополнительная масса не составит примерно 24 мг (масса сырого покрытия может колебаться от 22 до примерно 26 мг) и около 29 мг (масса сырого покрытия колеблется от 27 до 31 мг) для ядер таблеток с дозами 150 и 300 мг соответственно. При достижении указанной дополнительной массы, нанесение оболочки останавливают и ядра таблеток с нанесенной оболочкой высушивают при температуре всасываемого воздуха примерно 352 С и при скорости вращения чаши около 2 об./мин. Затем высушенные и охлажденные ядра таблеток покрываются водонепроницаемым слоем, имеющим состав как указано в табл. 5. Таблица 5 Значения мг/% представляют процентное соотношение веса ингредиента и сухого веса таблетки 2 поли(метакриловая кислота, метилметакрилат) 1:1 (Eudragit L 30 D-55) 3D=Полиэтиленгликоль 1450 (Carbowax), Е=Триэтилцитрат 4 двуоксид кремния (Syloid 244) 5 испарившаяся во время сушки Смесь пластификаторов, предпочтительно полиэтиленгликоля 1450 и триэтилцитрата, растворяют в части очищенной воды до получения однородной смеси. Пока готовится раствор пластификатора, сополимер метакриловой кислоты, предпочтительно Eudragit L 30 D-55, пропускают через сито с размером ячеек 0,3 мм в отдельную емкость. Затем раствор пластификатора добавляют в сополимер метакриловой кислоты и перемешивают до получения однородной смеси. Пока сополимер метакриловой кислоты смешивается с раствором пластификатора, в оставшейся части воды растворяют ингибитор проникновения,- 15013737 предпочтительно двуоксид кремния, и смешивают в мешалке с большими сдвиговыми усилиями до получения однородной суспензии. Окончательный раствор водонепроницаемого слоя получают при смешении раствора ингибитора проникновения со смесью сополимера метакриловой кислоты и пластификатора. Гомогенизированный раствор водонепроницаемого слоя затем наносят на ядра таблеток с контролируемым высвобождением в чаше для нанесения оболочки при технологических характеристиках, указанных в табл. 6. Таблица 6 Водонепроницаемый слой наносится до получения дополнительной массы около 7 мг (для таблетки с сырым покрытием масса колеблется примерно от 6,3 до 7,7 мг) и около 10,5 мг (для таблетки с сырым покрытием масса колеблется примерно от 9,5 до 11,5 мг) таблеток с модифицированным высвобождением с дозой 150 и 300 мг соответственно. По достижении желаемой массы нанесение покрытия заканчивается, и покрытые таблетки сушатся при температуре всасываемого воздуха около 352 С при скорости вращения чаши около 2 об./мин. Наконец, покрытые таблетки маркируют с помощью пригодных черных красителей, например, черных чернил Opacode S-1-8090, с использованием установки для нанесения маркировки на таблетки(Print International). График растворения для каждой дозы в 150 и 300 мг определялся в соответствии со следующими условиями растворения: Среда: 900 ml, 0,1N HCl Метод: Аппарат I типа USP (доза 150 мг)/Аппарат USP II типа USP (доза 300 мг), при скорости 75 об./мин и температуре 37 С Результаты приведены в табл. 7 как средний процент высвобождения всего гидрохлорида бупропиона, содержащегося в покрытых таблетках. Средние значения растворения для трех различных таблеток с дозой гидрохлорида бупропиона 150 и 300 мг представлены на фиг. 1 А и 1 В соответственно. Составы С и С для форм с дозой 150 и 300 мг были выбраны для всех последующих тестов и производства. 2. Стабильность составов таблеток с модифицированным высвобождением Состав не содержат стабилизатор. Для определения стабильности гидрохлорида бупропиона в отсутствие стабилизатора были проведены тесты на стабильность как в режиме ускорения в течение 6 месяцев при температуре 40 С 2 С при относительной влажности 75%5%, так и при долгосрочном режиме в течение 12 и 18 месяцев при температуре 25 С 2 С (относительная влажность 60%5%). В конце указанного периода таблетки анализировались на примеси, связанные с разложением гидрохлорида бупропиона с помощью HPLC (жидкостная хроматография высокого разрешения). Продукты разложения содержали указанные в перечне Фармакопеи США (USP, 26-е издание, стр. 281), а также любые другие пики, отмеченные на хроматограмме. Данные анализа на стабильность как в ускоренном, так и долгосрочном режиме для форм с дозой 150 и 300 мг показаны в табл. 8, 9 и 10: Таблица 8 значения влажности и примесей получены из, примерно, трех партий содержание влаги в тесте Карла Фишера (%) 3 общее количество примесей, получаемое при разрушении гидрохлорида бупропиона - % от количества гидрохлорида бупропиона перед проведением анализа 2 Данные по стабильности в течение 48 месяцев были определены методом статистического анализа убывания для каждой дозы, содержащейся в таблетках с модифицированным высвобождением. Кривые убывания представлены на фиг. 2 А и 2 В. Управляемые данными спецификации были получены при оценке уровня верхнего доверительного интервала, спроецированного на 48 месяцев. Пример 2. 1. Водонепроницаемый слой не является энтеросолюбильной оболочкой Целью данного исследования было показать, что таблетки с модифицированным высвобождением гидрохлорида бупропиона согласно изобретению не покрыты энтеросолюбильной оболочкой. В состав таблетки с модифицированным высвобождением входит ядро таблетки, которое содержит гидрохлорид бупропиона, связующее вещество и смазывающее вещество. Ядро таблетки покрыто оболочкой с контролируемым высвобождением, которая контролирует высвобождение гидрохлорида бупропиона. На ядро таблеток, имеющих оболочку с контролируемым высвобождением, затем наносится водонепроницаемый слой, который значительно препятствует поглощению влаги или задерживает влагу. Высвобождение лекарственного средства измерялось спектрофотометрическим способом в процессе двухэтапного растворения в условиях растворения энтереосолюбильной оболочки согласно методике В (USP, Basket, скорость 75 об./мин) для оценки целостности таблетки. Результаты испытаний приводятся в табл. 11 и 12: Таблица 11 При низких значениях рН (0,1N HCl), высвобождается около 7% гидрохлорида бупропиона в течение 2 ч, однако при рН 6,8 высвобождается около 21% гидрохлорида бупропиона в течение 1 ч. Следовательно, таблетка с модифицированным высвобождением согласно изобретению не соответствует требованиям Фармакопеи США (USP) для таблетки с энтереосолюбильной оболочкой, т.е. после нахождения в течение 2 ч в кислой среде (0,1N HCl) отдельные значения не превышали 10% растворенного активного- 18013737 лекарственного средства и не менее 75% растворенного в течение 45 мин в буферном растворе с рН 6,8. Далее показано функционирование водонепроницаемого слоя в качестве не энтереосолюбильной оболочки при нанесении водонепроницаемого слоя непосредственно на ядро таблетки с дозой 150 мг. Данные, приведенные в табл. 13, показывают, что растворение (в первые два часа в кислой среде) не соответствует требованиям Фармакопеи США (USP) для таблетки с энтереосолюбильной оболочкой. Среда: 900 мл 0,1NHCl Метод: Аппарат I типа, USP скорость 75 об./мин и температура 37 С Таблица 13 Буферный тест не проводился из-за высокого высвобождения в кислой среде. 2. Действие водонепроницаемого слоя для существенного препятствования или задержки поглощение влаги. Действие водонепроницаемого слоя в качестве покрытия, которое существенно препятствует или задерживает поглощение влаги, было подтверждено посредством определения содержания влаги в тесте Карла Фишера как в ядрах таблеток, имеющих оболочку с контролируемым высвобождением, так и в ядрах таблеток, имеющий водонепроницаемый слой для доз 300 мг. Приготовление состава описывается в примере 1. Таблетки с соответствующим покрытием отдельно помещались в открытую стеклянную чашку в режиме ускоренных испытаний (40 С 2 С, относительная влажность 75%5%) на 10 дней. Как показано в табл. 14, содержание влаги в ядрах таблеток, имеющих оболочку с контролируемым высвобождением, выше, чем в ядрах таблеток, покрытых водонепроницаемым слоем слоем. Таблица 14 Данные, представленные в табл. 13 и 14, показывают, что водонепроницаемый слой не функционирует как энтереосолюбильная оболочка, как это определяется Фармакопеей США (USP). Наоборот, данные показывают, что водонепроницаемый слой функционирует как оболочка, которая существенно препятствует или задерживает поглощение влаги. Пример 3. Целью настоящего исследования являлось изучение в ускоренном режиме эквивалентности активности доз таблеток модифицированного высвобождения гидрохлорида бупропиона для 150 и 300 мг. Было проведено двустороннее, перекрестное, открытое, с однократным приемом лекарства натощак исследование эквивалентности активности таблеток с модифицированным высвобождением согласно изобретению, содержащих две различные дозы гидрохлорида бупропиона (150 и 300 мг). Таблетки с модифицированным высвобождением согласно изобретению назначались один раз в день некурящим испытуемым мужского и женского пола при нормальном состоянии здоровья. Дизайн исследования включал в себя два курса лечения с двумя этапами с приемом лекарства натощак одноразовыми дозами. Периоды исследования были разделены 3-недельными периодами для вымывания. Исследование проводилось на 36 испытуемых (19 мужчин, 17 женщин), при этом достаточным количеством испытуемых оказалось 35 (19 мужчин, 16 женщин). Испытуемым были назначены следующие курсы лечения: А) Ежедневно 2 таблетки с модифицированным высвобождением согласно изобретению по 150 мг гидрохлорида бупропиона для приема внутрь с водой (240 мл), имеющей комнатную температуру, с последующим воздержанием от приема пищи в течение не менее 10 ч. В) Ежедневно 1 таблетка с модифицированным высвобождением согласно изобретению, содержащая 300 мг гидрохлорида бупропиона для приема внутрь с водой (240 мл), имеющей комнатную температуру, с последующим воздержанием от приема пищи в течение не менее 10 ч. На фиг. 3A-D представлена графическая зависимость среднего значения концентрации в плазме крови бупропиона и его метаболитов гидроксибупропиона, алкогольтреоаминобупропиона и алкогольэритроаминобупропиона соответственно по истечении 120 ч после приема 2 таблеток по 150 мг и 1 таб- 19013737 летки по 300 мг ежедневно. В табл. 15a-d представлены средние значения (SD) фармакокинетических свойств бупропиона при ежедневном приеме 2 таблеток по 150 мг или 1 таблетки по 300 мг: Таблица 15 а (Бупропион)AUC - площадь под кривой изменения концентрации вещества в плазме или сыворотке крови во времени;Cmax - максимум или пик концентрации вещества в плазме или сыворотке крови;Tmax - время достижения максимальной концентрации. Таблица 15b (Гидроксибупропион) Результаты анализа относительной биодоступности для бупропиона и его метаболитов при ежедневном приеме 2 таблеток по 150 мг в сравнении с ежедневным приемом 1 таблетки по 300 мг дляAUC0-inf, AUC0-t и Cmax, преобразованные с помощью натурального логарифма, в ускоренном режиме обобщены в табл. 16. Данные показывают, что в терминах фармакокинетических свойств бупропиона и его метаболитов ежедневный прием 2 таблеток с модифицированным высвобождением согласно изобретению по 150 мг эквивалентен ежедневному приему 1-й таблетки по 300 мг. Пример 4. Было проведено четырехстороннее, перекрестное, открытое, с однократным приемом лекарства натощак и после еды сравнительное исследование биодоступности таблеток с модифицированным высвобождением согласно изобретению, содержащих 150 мг гидрохлорида бупропиона, как описано здесь в примере 1, и таблеток препарата Zyban, содержащих 150 мг на некурящих испытуемых мужского и женского пола при нормальном состоянии здоровья. Целью исследования являлась оценка скорости и уровня абсорбции бупропиона при приеме после еды и натощак таблеток с модифицированным высвобождением, содержащих 150 мг гидрохлорида бупропиона, как описано здесь в примере 1. Параллельно проводилась оценка скорости и уровня абсорбции бупропиона при приеме таблеток, содержащих 150 мг препарата Zyban. Дизайн исследования включал в себя два курса лечения с двумя этапами с приемом лекарства натощак и после еды одноразовыми дозами. Этапы исследования были разделены 2-недельным периодом для вымывания. Исследование проводилось на 35 испытуемых (24 мужчины, 11 женщин), при этом достаточным количеством испытуемых оказалось 32 (22 мужчины, 10 женщин). Испытуемым были назначены следующие курсы лечения:A) ежедневно таблетки с модифицированным высвобождением согласно изобретению по 150 мг гидрохлорида бупропиона натощак;B) ежедневно таблетки с модифицированным высвобождением согласно изобретению по 150 мг гидрохлорида бупропиона после еды;D) ежедневно таблетки Zyban по 150 мг после еды. На фиг. 4 А-Е представлена графическая зависимость среднего значения концентрации (нг/мл) в плазме крови бупропиона и его метаболитов гидроксибупропиона, алкогольтреоаминобупропиона и алкогольэритроаминобупропиона по истечении 72 ч после приема 1 таблетки с модифицированным высвобождением согласно изобретению по 150 мг и 1 таблетки по 300 мг ежедневно и 1 таблетки препаратаZyban 150 мг ежедневно. В табл. 17 представлены средние значения (SD) фармакокинетических свойств бупропиона и его метаболитов при ежедневном приеме 2 таблеток с модифицированным высвобождением согласно изобретению по 150 мг или ранее известных таблеток лекарственного препаратаn=31 выражается как среднеарифметическое значениеSD (%CV) Результаты анализа относительной биодоступности для бупропиона и его метаболитов (при приеме таблеток с модифицированным высвобождением натощак и после еды) для AUC0-inf, AUC0-t и Cmax (нг/мл), преобразованные с помощью натурального логарифма для режима приема натощак и до еды, обобщены в табл. 18: Данные, представленные в табл. 18, показывают, что на биодоступность бупропиона и его метаболитов не влияет прием пищи, т.е. таблетки с модифицированным высвобождением согласно изобретению, содержащие гидрохлорида бупропиона, являются биоэквивалентными как в присутствии, так и в отсутствии пищи; это подтверждается тем фактом, что 90% C.I. отношения среднегеометрических значений для AUC0-inf (и AUC0-t когда это целесообразно) и Cmax при приеме натощак по сравнению с приемом после еды соответствуют предъявляемым Управлением по контролю за продуктами и лекарствами (FDA,США) уровням 80-125%. Пример 5. Было проведено двустороннее, перекрестное, открытое, с однократным приемом лекарства, с приемом препарата после еды сравнительное исследование биодоступности таблеток согласно изобретению с модифицированным высвобождением, содержащих 300 мг гидрохлорида бупропиона на некурящих испытуемых мужского и женского пола при нормальном состоянии здоровья. Исследование разрабатывалось для оценки влияния пищи на скорость и уровень абсорбции при ежедневном приеме 1-й таблетки с модифицированным высвобождением согласно изобретению, содержащей 300 мг гидрохлорида бупропиона. Дизайн исследования включал в себя два курса лечения с двумя этапами с приемом лекарства натощак и после еды одноразовыми дозами. Этапы исследования были разделены 2-недельными периодом для вымывания. Исследование проводилось на 36 испытуемых (26 мужчины, 10 женщин), при этом достаточным количеством испытуемых оказалось 32 (23 мужчины, 9 женщин). Испытуемым были назначены следующие курсы лечения: А) 1 таблетку с модифицированным высвобождением по 300 мг натощак после 10 ч воздержания от пищи. В) 1 таблетку с модифицированным высвобождением по 300 мг после завтрака с высоким содержанием жиров. На фиг. 5A-D представлена графическая зависимость среднего значения концентрации (нг/мл) в плазме крови бупропиона и его метаболитов гидроксибупропиона, алкогольтреоаминобупропиона и алкогольэритроаминобупропиона по истечении 120 ч после ежедневного приема одной таблетки с модифицированным высвобождением согласно изобретению по 300 мг после еды и натощак дано соответственно. В табл. 19 представлены средние значения (SD) фармакокинетических свойств бупропиона и его метаболитов при приеме таблеток с модифицированным высвобождением согласно изобретению по 300 мг натощак и после еды. Результаты анализа относительной биодоступности (после еды и натощак) для AUC0-24, AUC0-t иCmax, преобразованные с помощью натурального логарифма для режима приема натощак и до еды, обобщены в табл. 20. Данные, представленные в табл. 20, показывают, что на биодоступность бупропиона и его метаболитов в таблетках с модифицированным высвобождением согласно изобретению, содержащих 300 мг гидрохлорида бупропиона, не влияет прием пищи, т.е. таблетки с модифицированным высвобождением согласно изобретению, содержащие гидрохлорид бупропиона, являются биоэквивалентными как в присутствии, так и отсутствии пищи, что подтверждается тем фактом, что 90% C.I. отношения среднегеометрических значений для AUC0-inf (и AUC0-t когда это целесообразно) и Cmax при приеме натощак по сравнению с приемом после еды соответствуют предъявляемым Управлением по контролю за продуктами и лекарствами (FDA, США) уровням 80-125%. Пример 6. Было проведено двухстороннее, перекрестное, гомеостатическое, с многократным приемом лекарства, натощак сравнительное исследование биодоступности таблеток с модифицированным высвобождением согласно изобретению, содержащих 300 мг гидрохлорида бупропиона при одноразовом приеме, и таблеток с немедленным высвобождением препарата Wellbutrin 100 мг при приеме три раза в день на некурящих испытуемых мужского и женского пола при нормальном состоянии здоровья. Целью исследования являлась оценка биодоступности таблеток с модифицированным высвобождением согласно изобретению с дозой 300 мг в сравнении с таблетками немедленного высвобождения препарата Wellbutrin при приеме в состоянии гомеостаза и натощак. Дизайн исследования включал в себя два курса лечения с двумя этапами, с расширенным, многоразовым приемом лекарства натощак с двухнедельным перерывом между этапами исследования для отмыва. Исследование проводилось на 40 испытуемых (27 мужчин, 13 женщин), при этом достаточным количество испытуемых оказалось 30 (22 мужчин, 8 женщин). Испытуемым были назначены следующие курсы лечения:A) Таблетки препарата Wellbutrin 100 мг назначались перорально с 0,0 ч (начиная с 7:00 ч утра) в 1, 2 и 3 дни (два раза в день) вместе с 240 мл воды, имеющей комнатную температуру, после ночного воздержания от приема пищи в течение не менее 10 ч. Все испытуемые получали также вторую дозу одной таблетки препарата Wellbutrin 100 мг в 12,0 ч вместе с 240 мл воды, имеющей комнатную температуру после воздержания от приема пищи в течение не менее чем 1 ч. В 4-13 дни испытуемые получали 1 таблетку с модифицированным высвобождением согласно изобретению, содержащую 300 мг гидрохлорида бупропиона с 0,0 ч (начиная с 7:0 ч утра) вместе с 240 мл воды, имеющей комнатную температуру после воздержания от приема пищи в течение не менее 10 ч.B) Таблетки препарата Wellbutrin 100 мг назначались перорально с 0,0 ч (начиная с 7:00 ч утра) в 1, 2 и 3 дни (два раза в день) вместе с 240 мл воды, имеющей комнатную температуру, после ночного воздержания от приема пищи в течение не менее 10 ч. Все испытуемые затем получали также вторую дозу одной таблетки препарата Wellbutrin 100 мг в 12,0 ч вместе с 240 мл воды, имеющей комнатную температуру после воздержания от приема пищи в течение не менее чем 1 ч. В 4-13 дни испытуемые получали одну таблетку препарата Wellbutrin 100 мг назначались перорально с 0,0 ч (начиная с 7:00 ч утра) вместе с 240 мл воды, имеющей комнатную температуру, после ночного воздержания от приема пищи в течение не менее 10 ч. Затем все испытуемые получали вторую дозу одной таблетки препаратаWellbutrin 100 мг в 6,0 ч вместе с 240 мл воды, имеющей комнатную температуру после воздержания от приема пищи в течение не менее чем 1 ч. Кроме того, все испытуемые получали третью дозу одной таблетки препарата Wellbutrin 100 мг в 12,0 ч вместе с 240 мл воды, имеющей комнатную температуру после воздержания от приема пищи в течение не менее чем 1 ч. На фиг. 6 А-Е представлена графическая зависимость среднего значения концентрации (нг/мл) в плазме крови бупропиона и его метаболитов гидроксибупропиона, алкогольтреоаминобупропиона и алкогольэритроаминобупропиона по истечении периода испытаний после ежедневного приема одной таблетки с модифицированным высвобождением согласно изобретению 300 мг и трех таблеток по 100 мг препарата Wellbutrin соответственно. В табл. 21 представлены средние значения (SD) фармакокинетических свойств бупропиона при одноразовом ежедневном приеме таблеток с модифицированным высвобождением согласно изобретению по 300 мг или при приеме таблеток препарата Wellbutrin по 100 мг три раза в день. Таблица 21 Результаты анализа относительной биодоступности для бупропиона и его метаболитов (таблетки с модифицированным высвобождением согласно изобретению в сравнении с таблетками препарата Wellbutrin) для AUC0-24 и Cmax, преобразованные с помощью натурального логарифма, обобщены в табл. 22. Таблица 22 Данные, представленные в табл. 21 и 22, показывают, что таблетки с модифицированным высвобождением согласно изобретению с дозой 300 мг, назначенные один раз в день, являются биоэквивалентными к таблеткам препарата Wellbutrin 100 мг с немедленным высвобождением, назначаемых три раза- 29013737 в день. Пример 7. Было проведено двухстороннее, гомеостатическое, перекрестное, открытое, с многократным приемом лекарства натощак сравнительное исследование биодоступности таблеток с модифицированным высвобождением согласно изобретению, содержащих 300 мг гидрохлорида бупропиона, и таблеток ранее известного препарата Zyban 150 мг на некурящих испытуемых мужского и женского пола при нормальном состоянии здоровья. Целью исследования являлось сравнение биодоступности таблеток с модифицированным высвобождением согласно изобретению с дозой 300 мг при приеме ежедневно и таблеток ранее известного препарата Zyban с дозой 150 мг при приеме два раза в день. Дизайн исследования включал в себя два курса лечения с двумя этапами и с многократным перекрестным приемом лекарств. Перерыв между этапами исследования для отмыва составлял 2 недели. Исследование проводилось на 54 испытуемых (40 мужчин, 14 женщин), при этом достаточным количеством испытуемых оказалось 49 (37 мужчин, 12 женщин). Испытуемым были назначены таблетки препаратаZyban 150 мг в первые 1-3 дня исследования. В течение последующих 4-17 дней назначались: А) ежедневно таблетки с модифицированным высвобождением согламно изобретению, содержащих 300 мг гидрохлорида бупропиона. В) таблетки Zyban 150 мг два раза в день. На фиг. 7 А-Е представлена графическая зависимость среднего значения концентрации (нг/мл) в плазме крови бупропиона и его метаболитов гидроксибупропиона, алкогольтреоаминобупропиона и алкогольэритроаминобупропиона по истечении периода испытаний после ежедневного приема одной таблетки с модифицированным высвобождением согласно изобретению по 300 мг и двух таблеток препарата Zyban 150 мг (два раза в день) натощак соответственно. В табл. 23 представлены средние значения (SD) фармакокинетических свойств бупропиона при одноразовом ежедневном приеме таблеток с модифицированным высвобождением согласно изобретению по 300 мг или при приеме таблетки ранее известного препарата Zyban 150 мг два раза в день Таблица 23
МПК / Метки
МПК: A61K 9/32, A61K 9/22, A61K 9/36, A61P 25/00
Метки: таблетки, гидрохлорида, высвобождением, модифицированным, бупропиона
Код ссылки
<a href="https://eas.patents.su/30-13737-tabletki-s-modificirovannym-vysvobozhdeniem-gidrohlorida-bupropiona.html" rel="bookmark" title="База патентов Евразийского Союза">Таблетки с модифицированным высвобождением гидрохлорида бупропиона</a>