Композиция в виде гранул с модифицированным и немедленным высвобождением мемантина
Номер патента: 13474
Опубликовано: 30.04.2010
Авторы: Мани Нарасимхан, Растоги Сунил К., Периклоу Антониа, Чхеттри Анил, Рао Ниранджан, Дедия Махендра Г.
Формула / Реферат
1. Пероральная лекарственная форма с немедленным высвобождением, содержащая множество гранул, причем каждая гранула включает
ядро диаметром, составляющим от приблизительно 1 до приблизительно 1000 мкм, и активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы,
причем указанная пероральная лекарственная форма имеет скорость растворения активного ингредиента, составляющую более чем приблизительно 80% в пределах приблизительно первых 60 мин после поступления лекарственной формы в среду применения.
2. Пероральная лекарственная форма по п.1, для которой скорость растворения активного ингредиента составляет более чем приблизительно 80% в пределах приблизительно первых 15 мин после поступления лекарственной формы в среду применения.
3. Пероральная лекарственная форма по п.1, в которой активный ингредиент включает мемантина гидрохлорид.
4. Пероральная лекарственная форма по п.1, в которой ядро включает частицы сахара, USP, в диапазоне от приблизительно 100 до приблизительного 950 мг/г указанной лекарственной формы.
5. Пероральная лекарственная форма по п.1, дополнительно содержащая полимерное связующее вещество, нанесенное на ядро.
6. Пероральная лекарственная форма по п.5, в которой полимерное связующее вещество выбирают из группы, состоящей из повидона, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы и их комбинаций.
7. Пероральная лекарственная форма по п.5, дополнительно содержащая герметизирующий покровный слой, нанесенный на полимерное связующее вещество.
8. Пероральная лекарственная форма по п.7, в которой герметизирующий покровный слой выбирают из группы, состоящей из НРМС (OpadryÒ), HPC, EudragitÒ RL, EudragitÒ E100, EudragitÒ E 12,5, EudragitÒ E PO, EudragitÒ NE и их смесей.
9. Пероральная лекарственная форма по п.1, в которой ядро включает сахарную сферу или микрокристаллическую целлюлозную сферу в диапазоне 620-930 мг/г лекарственной формы и каждая гранула, кроме того, содержит

10. Пероральная лекарственная форма по п.1, в которой ядро включает сахарную сферу или микрокристаллическую целлюлозную сферу в диапазоне 500-950 мг/г лекарственной формы, активный ингредиент включает мемантин или его соль в диапазоне приблизительно 15-300 мг/г лекарственной формы и каждая гранула, кроме того, содержит
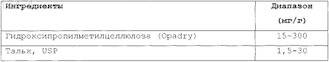
11. Пероральная лекарственная форма с модифицированным высвобождением, содержащая множество гранул, при этом каждая гранула включает
ядро диаметром, составляющим от приблизительно 1 до приблизительно 1000 мкм,
активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, и
модифицирующий высвобождение полимерный слой,
причем указанная пероральная лекарственная форма имеет скорость растворения активного ингредиента, составляющую от приблизительно 70 до приблизительно 80% в пределах от приблизительно 4 до приблизительно 24 ч после поступления лекарственной формы в среду применения.
12. Пероральная лекарственная форма по п.11, которая имеет скорость растворения активного ингредиента, составляющую от приблизительно 10 до приблизительно 50% в пределах приблизительно 1 ч.
13. Пероральная лекарственная форма по п.11, в которой активный ингредиент включает мемантина гидрохлорид.
14. Пероральная лекарственная форма по п.11, в которой полимер, модифицирующий высвобождение, выбирают из группы, состоящей из этилцеллюлозы (SureleaseÒ), метакрилата (EudragitÒ), сополимера метакриловой кислоты типа С (Acryl-EzeÒ) и их смесей.
15. Пероральная лекарственная форма по п.11, дополнительно содержащая промежуточный герметизирующий покровный слой над активным ингредиентом.
16. Пероральная лекарственная форма по п.11, дополнительно содержащая верхний покровный слой, нанесенный на слой полимера, модифицирующего высвобождение.
17. Пероральная лекарственная форма по п.16, в которой верхний покровный слой выбирают из группы, состоящей из НРМС (OpadryÒ), HPC, EudragitÒ RL, EudragitÒ E100, EudragitÒ E 12,5, EudragitÒ E PO, EudragitÒ NE и их смесей.
18. Пероральная лекарственная форма по п.11, в которой ядро включает сахарную сферу или микрокристаллическую целлюлозную сферу в диапазоне 500-900 мг/г лекарственной формы, активный ингредиент включает мемантин или его соль в диапазоне приблизительно 15-350 мг/г лекарственной формы и каждая гранула, кроме того, содержит

19. Комбинированная лекарственная форма, содержащая компонент с немедленным высвобождением и компонент с модифицированным высвобождением,
причем компонент с немедленным высвобождением включает первое множество гранул, при этом каждая гранула содержит ядро диаметром, составляющим от приблизительно 1 до приблизительно 1000 мкм, и первый активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, где указанная пероральная лекарственная форма имеет скорость растворения активного ингредиента, составляющую более чем приблизительно 80% в пределах приблизительно первых 60 мин после поступления лекарственной формы в среду применения, и
причем компонент с модифицированным высвобождением включает второе множество гранул, при этом каждая гранула содержит ядро диаметром, составляющим от приблизительно 1 до приблизительно 1000 мкм, второй активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы и модифицирующий высвобождение полимерный слой, причем от приблизительно 70 до приблизительно 80% второго активного ингредиента растворяется в пределах от приблизительно 4 до приблизительно 24 ч после поступления лекарственной формы в среду применения.
20. Комбинированная лекарственная форма по п.19, включающая от приблизительно 2,5 до приблизительно 100 мг мемантина.
21. Способ лечения состояния, выбранного из группы, состоящей из болезни Альцгеймера, аутизма и невропатической боли, включающий введение нуждающемуся в этом больному пероральной лекарственной формы по п.1.
22. Способ лечения состояния, выбранного из группы, состоящей из болезни Альцгеймера, аутизма и невропатической боли, включающий введение нуждающемуся в этом больному пероральной лекарственной формы по п.11.
23. Способ лечения состояния, выбранного из группы, состоящей из болезни Альцгеймера, аутизма и невропатической боли, включающий введение нуждающемуся в этом больному пероральной лекарственной формы по п.19.
Текст
013474 Область техники Настоящее изобретение относится к фармацевтическим пероральным лекарственным формам, проявляющим профиль модифицированного и/или немедленного высвобождения. Изобретение особенно подходит для принимаемых один раз в день перорально, фармацевтических лекарственных форм, в которых активным ингредиентом является мемантин, высвобождающих терапевтически эффективное количество мемантина на протяжении запланированного периода времени. Уровень техники Можно создать твердые пероральные лекарственные композиции или препараты, проявляющие различные профили высвобождения, такие как профиль модифицированного высвобождения (USP XXV,CDER, FDA, Rockville, MD), профиль длительного высвобождения, о котором упоминается в руководствах Управления по пищевым продуктам и лекарственным средствам (FDA) ("Extended Release OralAdministration, CDER, September 1997, page 17), или профиль немедленного высвобождения, о котором упоминается в руководствах FDA ("Dissolution Testing of Immediate Release Solid Oral Dosage Forms, issued 8/1997, Section IV-A). В руководстве по проверке растворения для профилей с модифицированным высвобождением материал растворяется на протяжении периода времени, и его растворение измеряют через установленные интервалы во время этого периода. Рекомендуются минимум три момента времени, которые, как правило, охватывают раннюю, среднюю и позднюю стадии профиля растворения. Последнее измерение должно быть не ранее чем момент времени, в который растворяется по крайней мере 80% лекарственного средства (Guidance for Industry, "Extended Release Oral Dosage Forms: Development, Evaluation, and Application of In Vitro/In Vivo Correlations", Food and Drug Administration, CDER, September 1997, page 17). Важно соответствующее взятие образцов, например, через 1, 2 и 4 ч и после этого через каждые два часа до тех пор, пока произойдет высвобождение 80% лекарственного средства (Guidance for Industry, SUPAC-MR: Modified Release Solid Oral Dosage Forms", Food and Drug Administration, CDER, September 1997, page 6). Предпочтительным аппаратом для растворения является аппарат I (бакет-ротор) или аппарат II (лопастной ротор) USP, используемые при определенных скоростях вращения, например при 100 об/мин для бакет-ротора и 50-75 об/мин для лопастного ротора (Guidance for Industry, "Extended ReleaseDrug Administration, CDER, September 1997, page 4). Лекарственные формы с модифицированным высвобождением делают возможным высвобождение активного ингредиента на протяжении длительного периода времени в попытке сохранить терапевтически эффективные уровни в плазме на протяжении также длительных интервалов времени, улучшить схемы дозирования и/или модифицировать другие фармакокинетические свойства активного ингредиента, например, задержать начало высвобождения или изменить условия, при которых происходит высвобождение. В руководствах по проверке растворения материалы, которые растворяются в растворе по крайней мере на 80% в первые 30-60 мин, квалифицируют в качестве профилей немедленного высвобождения("Dissolution Testing of Immediate Release Solid Oral Dosage Forms", issued 8/1997, Section IV-A). Следовательно, твердые пероральные лекарственные формы с немедленным высвобождением делают возможным высвобождение большей части, или всего, активного ингредиента на протяжении короткого периода времени, такого как 60 мин или меньше, и делают возможным быстрое всасывание лекарственного средства. Профиль многофазного высвобождения (т.е. композицию, содержащую компонент с немедленным высвобождением и по крайней мере один компонент с модифицированным высвобождением) можно использовать для достижения одной или нескольких комбинаций скоростей высвобождения с достижением более специфических терапевтический целей, например, когда часть лекарственного средства высвобождается немедленно, а затем оставшаяся часть высвобождается в течение длительного времени. Однако модуляция скорости высвобождения активного ингредиента не гарантирует с неизбежностью,что будут последовательно достигнуты длящиеся подолгу эффективные уровневые концентрации в крови, или что фармакологическое действие будет основано только на высвобождении лекарственного средства, или что не будут прогнозироваться фармакологические неблагоприятные результаты. Различные технологии приготовления использовались для обеспечения композиции из растворимых лекарственных средств с непрерывным высвобождением. Во многих таких композициях содержащие лекарственное средство или несущие лекарственное средство частицы покрывают одним или несколькими замедляющими высвобождение слоями или оболочками или диспергируют в сплошной матрице, такой как полимерная матрица. Покровный слой или матрица включает относительно нерастворимый материал или материалы, а высвобождение лекарственного средства контролируется с помощью устойчивости или проницаемости покровного слоя или матрицы в отношении диффузии лекарственного средства через них. Высвобождение лекарственного средства из таких композиций побуждается диффузией в композицию, например, градиентом концентрации лекарственного средства, являющегося результатом проникновения, например, желудочного сока. Можно использовать один или несколько образующих оболочку полимеров для обеспечения непре-1 013474 рывного высвобождения активного вещества посредством контролирования его скорости диффузии через оболочечный(ые) барьер(ы). Однако такой подход может быть рискованным для таблеток, если во время приема внутрь пероральной лекарственной формы оболочка преждевременно разорвется, например, при жевании, расщеплении или истирании, высвобождая таким образом чрезмерное количество активного ингредиента, которое может привести к нежелательным эффектам от чрезмерного высвобождения лекарственного средства в одной дозе и к неспособности лекарственной формы оставаться эффективной в течение требуемой продолжительности. Этого можно избежать, используя, например, композиции в виде гранул, которые не будут подвергаться похожим механическим повреждениям благодаря их небольшой геометрической форме. В подходе контролирования высвобождения с помощью матрицы используются липофильные вещества, например, высшие спирты, парафины или нерастворимые термопластичные материалы. Высвобождение контролируется посредством скорости диффузии активного ингредиента в окружающую среду и, если сама матрица является разрушаемой, посредством скорости ее разрушения. Одним из недостатков является то, что на практике часто не достигают полного высвобождения лекарственного средства из матричной таблетки. Другой недостаток заключается в том, что пропорциональность дозе лекарственных форм не легко достигается, поэтому для различных активностей требуются различные композиции. Таким образом, матричная композиция для приготовления 5-мг лекарственной формы в виде таблетки с замедленным высвобождением может отличаться от матричной композиции для приготовления 60-мг лекарственной формы в виде таблетки с замедленным высвобождением. Патентом США 5382601 обеспечиваются твердые фармацевтические лекарственные формы, содержащие мемантин, которые проявляют профиль длительного двухфазного высвобождения, при этом часть лекарственного средства высвобождается немедленно, с последующим замедленным высвобождением оставшейся части. Матрица такой препаративной формы содержит и растворимую в воде, и не растворимую в воде соль казеина, предпочтительно казеинат натрия и кальция. Однако казеин обладает неприятным вкусом, он связан с обострением некоторых побочных эффектов, раскрытых в патенте США 6413556, и проявляет нестабильность при различных рН. Другим недостатком казеина является возможность заражения бычьим губчатым энцефалитом, поскольку казеин представляет собой происходящий от животного молочный белок. Главный способ приготовления модифицированного высвобождения антагонистов N-метил-Dаспартата-рецептора (NMDA-рецептора) описан в патенте США 6194000. Этот способ включает приготовление компонента с немедленным высвобождением и компонента с модифицированным высвобождением, которые включают в конечную композицию. В этом патенте раскрыта таблетка, состоящая из покрытого ядра, при этом покрытием является любое подходящее покрытие, в котором используются системы, основанные на органических растворителях. В патенте не раскрыто, каким образом скорости высвобождения влияют на Tmax (время достижения максимальной концентрации в плазме), а также в нем не говорится, каким образом этот способ приведет к пропорциональным дозе композициям. В патентах США 5382601 и 6194000 описывается профиль длительного двухфазного высвобождения, включающий компонент с немедленным высвобождением. В настоящее время применяется режим дозирования мемантина дважды в день с использованием таблеток с немедленным высвобождением. Такой режим не является оптимальным, поскольку соблюдение больным режима и схемы лечения уменьшается по мере того, как увеличивается частота приема лекарственного средства. Кроме того, после приема перорально мемантин полностью всасывается (абсолютная биодоступность, составляющая приблизительно 100%). Следовательно, прием таблетки с немедленным высвобождением может привести к большей частоте неблагоприятных фармакологических результатов благодаря высокой скорости всасывания. В руководствах по использованию мемантина для лечения болезни Альцгеймера рекомендуется назначать мемантин в начальной дозе, составляющей 5 мг/день, и увеличивать дозу до 20 мг/день посредством увеличений каждую неделю дозы на 5 мг. Композиции с модифицированным высвобождением могут снять некоторые беспокойства, связанные с использованием мемантина. Есть существующая и продолжительная необходимость в принимаемой один раз в день композиции с модифицированным и/или немедленным высвобождением, содержащей мемантин или фармацевтически приемлемую соль мемантина, с надежным всасыванием на протяжении запланированного периода времени. Соответственно, настоящим изобретением обеспечиваются фармацевтические лекарственные формы с модифицированным и немедленным высвобождением, содержащие мемантин, которые проявляют профиль повышенного высвобождения и обеспечивают надежное всасывание. Сущность изобретения В соответствии с настоящим изобретением было обнаружено, что мемантин и его соли, в том числе соль хлористоводородной кислоты, а также другие его фармацевтически приемлемые соли, можно приготовить в виде форм с модифицированным высвобождением с надежным всасыванием и, следовательно, улучшенной переносимостью и в виде форм с немедленным высвобождением с пропорциональной дозе биодоступностью.-2 013474 Настоящим изобретением обеспечиваются пероральные лекарственные формы, включающие мемантин или его соль, которые содержат от 2,5 до 100 мг мемантина или его соли и обеспечивают in vivo профиль в плазме со средним Tmax, составляющим приблизительно 5 или более часов, средней Cmax, составляющей менее чем приблизительно 100 нг/мл, и средней AUC0-, составляющей более чем приблизительно 250 нгч/мл. В некоторых вариантах осуществления пероральные лекарственные формы обеспечивают Cmax, составляющую менее чем приблизительно 75 нг/мл, предпочтительно менее чем приблизительно 50 нг/мл. В других вариантах осуществления пероральные лекарственные формы обеспечивают среднюю AUC0-, составляющую более чем приблизительно 500 нгч/мл, предпочтительно более чем приблизительно 1000 нгч/мл и более предпочтительно более чем приблизительно 2500 нгч/мл. В соответствии с другими вариантами осуществления настоящим изобретением обеспечивается пероральная лекарственная форма, содержащая от 2,5 до 100 мг мемантина или его соли, которая имеет скорость растворения активного ингредиента, составляющую от приблизительно 70% до приблизительно 80% в пределах от приблизительно 4 ч до приблизительно 24 часов, и Cmax, составляющую менее чем приблизительно 100 нг/мл, обеспечивает терапевтическое действие на протяжении приблизительно 24 ч при назначении нуждающемуся в этом больному и обеспечивает сниженную частоту неблагоприятных результатов. В некоторых вариантах осуществления настоящим изобретением обеспечиваются пероральные лекарственные формы, содержащие множество гранул, причем каждая гранула включает ядро диаметром,составляющим от приблизительно 1 мкм до приблизительно 1000 мкм, и активный ингредиент, включающий мемантин и его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, причем лекарственные формы включают менее чем приблизительно 2,5% аддукта и имеют скорость растворения активного ингредиента, составляющую более чем приблизительно 80% в пределах приблизительно первых 60 минут после поступления лекарственных форм в среду применения. В дополнительных иллюстративных вариантах осуществления настоящего изобретения каждую гранулу можно также охарактеризовать в качестве гранулы, включающей инертное ядро, смесь мемантина в качестве активного ингредиента и являющегося полимером связующего вещества, нанесенную на ядро. В иллюстративных вариантах осуществления настоящего изобретения такая пероральная лекарственная форма в виде гранулы с немедленным высвобождением может содержать множество гранул, при этом каждая гранула включает инертное ядро диаметром в интервале от приблизительно 1 мкм до приблизительно 1000 мкм и смесь мемантина в качестве активного ингредиента и являющегося полимером связующего вещества, нанесенную на указанное инертное ядро, при этом лекарственная форма содержит мемантин в диапазоне от приблизительно 15 до приблизительного 350 мг/г указанной лекарственной формы, проявляющей менее чем 2,5% аддукта и имеющей скорость растворения, составляющую более чем приблизительно 80% в пределах приблизительно первых 60 мин после поступления указанной лекарственной формы в среду применения. В других вариантах осуществления настоящим изобретением обеспечиваются пероральные лекарственные формы, содержащие множество гранул, при этом каждая гранула включает ядро диаметром,составляющим от приблизительно 1 мкм до приблизительно 1000 мкм, активный ингредиент, включающий мемантин и его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, и модифицирующий высвобождение полимерный слой, причем лекарственная форма имеет скорость растворения активного ингредиента, составляющую от приблизительно 70% до приблизительно 80% в пределах от приблизительно 4 ч до приблизительно 24 ч, и Cmax, составляющую менее чем приблизительно 100 нг/мл. В дополнительных иллюстративных вариантах осуществления настоящего изобретения каждую гранулу можно также охарактеризовать в качестве гранулы, включающей инертное ядро,смесь мемантина в качестве активного ингредиента и являющегося полимером связующего вещества,нанесенную на ядро. В иллюстративных вариантах осуществления настоящего изобретения такая лекарственная форма в виде гранулы с модифицированным высвобождением может содержать множество гранул, при этом каждая гранула включает инертное ядро диаметром в интервале от приблизительно 1 мкм до приблизительно 1000 мкм, смесь мемантина в качестве активного ингредиента и являющегося полимером связующего вещества, нанесенную на указанное инертное ядро, при этом лекарственная форма содержит мемантин в диапазоне от приблизительно 15 до приблизительного 350 мг/г указанной лекарственной формы, вспомогательный герметизирующий покровный слой, нанесенный на покрытие из связующего мемантин вещества, и модифицирующий высвобождение полимерный слой, нанесенный на герметизирующий покровный слой, причем лекарственная форма имеет скорость растворения, составляющую от приблизительно 70% до приблизительно 80% в пределах от приблизительно 6 ч до приблизительно 12 ч,и Cmax, составляющую менее чем приблизительно 60 нг/мл. В дополнительных вариантах осуществления настоящим изобретением обеспечиваются комбинированные лекарственные формы, содержащие компонент с немедленным высвобождением и компонент с модифицированным высвобождением, причем компонент с немедленным высвобождением включает первое множество гранул, при этом каждая гранула содержит первый активный ингредиент, включаю-3 013474 щий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, причем приблизительно 80% первого активного ингредиента растворяется в пределах приблизительно первых 60 мин после поступления лекарственной формы в среду применения, а компонент с модифицированным высвобождением включает второе множество гранул, при этом каждая гранула содержит второй активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, причем от приблизительно 70% до приблизительно 80% второго активного ингредиента растворяется в пределах от приблизительно 4 ч до приблизительно 24 ч после поступления лекарственной формы в среду применения. Краткое описание чертежей На фиг. 1 демонстрируется скорость растворения содержащих мемантина HCl НВ-гранул, приготовленных с использованием следующих целлюлозных связующих веществ: гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы (Opadry, Colorcon, PA) и поливинилпирролидона (повидона). В частности, на фиг. 1 демонстрируется стабильность скорости растворения содержащих мемантина HCl НВ (немедленного высвобождения) гранул, 171 мг/г, приготовленных с использованием повидона в качестве связующего вещества. Образцы измеряли при 40 С, 75% относительной влажности, сохраняли в индукционном герметизированном контейнере с сиккативом в течение трех месяцев. Также демонстрируется стабильность скорости растворения содержащих мемантина HCl НВгранул, 157 мг/г, приготовленных с использованием НРМС (Opadry) в качестве связующего вещества. Растворение представлено как процент лекарственного вещества, высвободившегося на протяжении времени (в минутах). НВ-гранулы являются стабильными и могут быть приготовлены с использованием различных связующих веществ. На фиг. 2 демонстрируется стабильность скорости растворения содержащих мемантина HCl НВгранул, 142 мг/г, после нагревания гранул при 50 С. Гранулы готовили с использованием НРМС в качестве связующего вещества и модифицирующего высвобождение полимерного покрытия, Surelease(Colorcon, PA). Растворение представлено как процент лекарственного вещества, высвободившегося на протяжении времени (в часах). На фиг. 3 демонстрируется стабильность скорости растворения содержащих мемантина HCl МВгранул, 159 мг/г (с высвобождением 3), и содержащих мемантина HCl МВ-гранул, 163 мг/г (с высвобождением 1). Гранулы готовили с использованием PVP в качестве связующего вещества, а модифицирующее высвобождение полимерное покрытие представляло собой Surelease (Colorcon, PA). Гранулы с высвобождением 3 покрывали с приростом на 6% (в весовом отношении), а гранулы с высвобождением 1 покрывали с приростом на 3% (в весовом отношении). Обе партии впоследствии покрывали верхним слоем Opadry. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). На фиг. 4 демонстрируется сравнение скоростей растворения содержащих мемантина HCl НВ- и МВ-гранул. МВ-гранулы, 163 мг/г (В 1), готовили с использованием PVP, а модифицирующим высвобождение полимером являлся Surelease в количестве приблизительно 3% по весу. Представлен график зависимости растворения, в виде процента растворенного лекарственного средства, от времени (в часах). На фиг. 5 демонстрируется стабильность скорости растворения содержащих мемантина HCl МВгранул, 163 мг/г (В 1), причем вначале готовили гранулы с немедленным высвобождением с использованием PVP, а покрытие модифицирующим высвобождение полимером Surelease осуществляли в количестве приблизительно 3% по весу в расчете на вес НВ-гранул. Также демонстрируются содержащие мемантина HCl гранулы с модифицированным высвобождением, 159 мг/г (В 3), причем вначале были приготовлены гранулы с немедленным высвобождением с использованием PVP, a покрытие модифицирующим высвобождение полимером Surelease осуществляли в количестве приблизительно 6% по весу в расчете на вес НВ-гранул. Представлен график зависимости растворения, в виде процента растворенного лекарственного средства, от времени (в часах). Гранулы хранили в течение 1 и 3 месяцев при 40 С/75% относительной влажности в белых HDPE-колбах. Представлены данные за 3 месяца. На фиг. 6 демонстрируется стабильность скорости растворения содержащих мемантина HCl МВгранул, 144 мг/г (В 4), причем вначале готовили гранулы с немедленным высвобождением с использованием гидроксипропилметилцеллюлозы (Opadry) в качестве связующего вещества для загрузки лекарственного вещества, модифицирующими высвобождение полимерами являлись сополимеры метакрилата аммония - Eudragit RS и RL в соотношении 95:5. Общий прирост в отношении Eudragit составил 6%(в весовом отношении). Гранулы хранили при 40 С/75% относительной влажности в белых HDPEколбах. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). Большие величины f2 (50), полученные при сравнении скорости растворения первоначальных образцов со скоростью растворения образцов после хранения, указывают на отличную стабильность растворения. Эта композиция идентична композиции, использованной при фармакокинетическом исследовании. Представлены данные за 3 месяца. На фиг. 7 демонстрируется стабильность скорости растворения содержащих мемантина HCl гранул,136 мг/г (В 5), и содержащих мемантина HCl гранул, 123 мг/г, причем гранулы с немедленным высвобо-4 013474 ждением готовили с использованием гидроксипропилметилцеллюлозы (Opadry) в качестве связующего вещества для загрузки лекарственного вещества, а модифицирующими высвобождение полимерами являлись сополимеры метакрилата аммония - Eudragit RS и RL в соотношении 95:5. Общий прирост в отношении Eudragit составил 10% (в весовом отношении) и 20% (в весовом отношении) для В 5- и В 6 гранул соответственно. Гранулы хранили при 40 С/75% относительной влажности в белых HDPEколбах. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). Большие величины f2 (50), полученные при сравнении скорости растворения первоначальных образцов со скоростью растворения образцов после хранения, указывают на отличную стабильность растворения. Представлены данные за 3 месяца. На фиг. 8 демонстрируются скорости растворения гранул с модифицированным высвобождением В 3 (биосостав), приготовленных с дозовыми активностями 25, 40 и 60 мг с целью проверки, достигается ли пропорциональность дозе. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). Содержащие мемантина HCl гранулы, 159 мг/г (В 3), готовили с использованием повидона в качестве связующего вещества для загрузки лекарственного вещества, а модифицирующим высвобождение полимером являлась этилцеллюлоза (Surelease). На фиг. 9 демонстрируются профили растворения композиций, содержащих множество гранул (В 1 и В 3) в различных соотношениях. Содержащие мемантина HCl гранулы с высвобождением 1, 163 мг/г, и содержащие мемантина HCl гранулы с высвобождением 3, 159 мг/г, готовили с использованием повидона в качестве связующего вещества для загрузки лекарственного вещества, а модифицирующим высвобождение полимером являлась этилцеллюлоза (Surelease). Также демонстрируются профили растворения композиций, содержащих множество гранул (В 4, В 5 и В 6) в различных соотношениях. Данные показывают, что при объединении гранул, имеющих различные характеристики высвобождения, в различных соотношениях, тем не менее, достигаются схожие профили растворения. Содержащие мемантина HCl гранулы с высвобождением 4, 144 мг/г, содержащие мемантина HCl гранулы с высвобождением 5, 136 мг/г, и содержащие мемантина HCl гранулы с высвобождением 6, 123 мг/г, готовили с использованием гидроксипропилметилцеллюлозы (Opadry) в качестве связующего вещества для загрузки лекарственного вещества, а модифицирующими высвобождение полимерами являлись сополимеры метакрилата аммония - Eudragit RS и RL в соотношении 95:5. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). На фиг. 10 демонстрируется стабильность скорости растворения лекарственной формы в виде капсулы, включающей содержащие мемантина HCl МВ-гранулы, 40 мг, включающей два типа гранул (соотношение В 1:В 3=2:38), и лекарственной формы в виде капсулы, состоящей из содержащих мемантинаHCl МВ-гранул, 40 мг, включающей два типа гранул (В 1 и В 3). Исследование стабильности проводили с помощью проверки растворения после хранения гранул при 25 С/60% относительной влажности в белыхHDPE-колбах. Также демонстрируется стабильность скорости растворения лекарственной формы в виде капсулы, состоящей из содержащих мемантина HCl МВ-гранул, включающей комбинацию гранул В 4, В 5 и В 6. Соотношение гранул В 4:В 5:В 6 составляло 8:35:57, а активность комбинированной дозы составляла 40 мг. Исследование стабильности проводили с помощью растворения после хранения гранул при 25 С/60% относительной влажности в белых HDPE-колбах. Растворение представлено как процент лекарственного средства, растворенного на протяжении времени (в часах). На фиг. 11 А демонстрируются величины концентраций мемантина в плазме крови при обработках А, Б, В и Г. Представлен профиль концентрации мемантина в плазме в нг/мл в зависимости от времени (в часах). На фиг. 11 В демонстрируется часть профиля концентрации мемантина в плазме фиг. 11 А в зависимости от укороченного времени (в часах). На фиг. 11 А используется расширенный масштаб по абциссе по сравнению с фиг. 11 В. На фиг. 12 демонстрируются профили растворения 40-мг капсул, содержащих множество гранул(соотношение В 1:В 3=10:30) или (соотношение В 1:В 3=2:38) в различных средах для биорелевантного растворения с различными значениями рН [симулирующих кишечный сок в сытом (FeSSIF) и голодном состояниях (FaSSIF)]. Эти графики указывают на то, что профили растворения являются рНнезависимыми. Представлен график зависимости растворения, процента растворенного лекарственного средства, от времени (в часах). На фиг. 13 демонстрируется скорость растворения содержащих мемантина HCl МВ-гранул, 92 мг/г,при двух различных рН: 1,2 и 5,6. Гранулы с немедленным высвобождением готовили с использованием гидроксипропилметилцеллюлозы (Opadry) в качестве связующего вещества для загрузки лекарственного вещества, а модифицирующим высвобождение полимером являлся сополимер метакриловой кислоты типа С, NF (Acryl-Eze). Общий прирост в отношении Acryl-Eze составил 30% (в весовом отношении). Исследование стабильности проводили после хранения гранул при 40 С/75% относительной влажности в белых HDPE-колбах. Представлен график зависимости растворения, процента растворенного вещества,от времени (в часах).-5 013474 Подробное описание изобретения В соответствии с настоящим изобретением обеспечиваются пероральные лекарственные формы для введения мемантина или одной из его фармацевтически приемлемых солей, предпочтительно его соли хлористоводородной кислоты, причем композиция включает мемантин в виде твердых пероральных лекарственных форм. В частности, фармацевтические композиции настоящего изобретения направлены на композиции с немедленным и/или модифицированным высвобождением, содержащие мемантин или одну из его фармацевтически приемлемых солей. Содержащие мемантин композиции с немедленным и модифицированным высвобождением раскрыты в заявках на патент США 11/155319 (опубликованной как US2006/000299) и 11/155330(опубликованной как US2006/0051416), раскрытие которых полностью включено сюда посредством ссылки. Настоящим изобретением обеспечиваются пероральные лекарственные формы, включающие мемантин или его соль, которые содержат от 2,5 до 100 мг мемантина или его соли и обеспечивают in vivo профиль в плазме со средним Tmax составляющим приблизительно 8 или более часов, средней Cmax, составляющей менее чем приблизительно 100 нг/мл, и средней AUC0-, составляющей более чем приблизительно 250 нгч/мл. В соответствии с некоторыми вариантами осуществления настоящим изобретением обеспечивается пероральная лекарственная форма, включающая мемантин или его соль, которая содержит от 2,5 до 50 мг мемантина или его соли и обеспечивает in vivo профиль в плазме со средним Tmax, составляющим приблизительно 5 или более часов, средней Cmax, составляющей менее чем приблизительно 50 нг/мл, и средней AUC0-, составляющей более чем приблизительно 250 нгч/мл. В некоторых вариантах осуществления настоящего изобретения пероральные лекарственные формы обеспечивают Cmax, составляющую менее чем приблизительно 75 нг/мл, предпочтительно менее чем приблизительно 50 нг/мл. В других вариантах осуществления пероральные лекарственные формы обеспечивают среднюю AUC0-, составляющую более чем приблизительно 500 нгч/мл, предпочтительно более чем приблизительно 1000 нгч/мл. В соответствии с другими вариантами осуществления настоящим изобретением обеспечивается пероральная лекарственная форма, содержащая от 2,5 до 100 мг мемантина или его соли, которая имеет скорость растворения активного ингредиента, составляющую от приблизительно 70% до приблизительно 80% в пределах от приблизительно 4 ч до приблизительно 24 ч, и Cmax, составляющую менее чем приблизительно 100 нг/мл, и обеспечивает сниженную частоту неблагоприятных результатов. Мемантин (1-амино-3,5-диметиладамантан), который является аналогом 1-аминоциклогексана(описанного, например, в патентах США 4122193, 4273774 и 5061703), представляет собой систематически активный, неконкурентный антагонист NMDA-рецептора, обладающий от низкой до умеренной степенью сродства к рецептору, сильной зависимостью от разницы потенциалов и быстрой кинетикой блокирования/разблокирования. Эти фармакологические особенности делают возможным то, что мемантин блокирует непрерывную активацию рецептора при патологических условиях и быстро покидаетNMDA-путь во время нормальной физиологической активации этого пути. Мемантин и его фармацевтически приемлемые соли (например, соль хлористоводородной кислоты, М.м. 215,77) разрешены в США для лечения болезни Альцгеймера. В настоящее время добиваются разрешения использовать мемантин для лечения симптома невропатической боли (в отношении которой мемантин продемонстрировал активность в in vitro моделях), а вне США в настоящее время разрешен мемантин в виде пероральной композиции для лечения болезни Альцгеймера и болезни Паркинсона. В соответствии с настоящим изобретением мемантин предпочтительно используется в форме фармацевтически приемлемой соли. Подходящие соли соединения включают, но не ограничиваются перечисленным, кислотно-аддитивные соли, такие как образованные хлористо-водородной кислотой, метилсульфокислотой, бромисто-водородной, иодисто-водородной, перхлорной, серной, азотной, фосфорной,уксусной, пропионовой, гликолевой, молочной, пирувиновой, малоновой, янтарной, малеиновой, фумаровой, тартаровой, лимонной, бензойной, угольной, коричной, манделовой кислотой, метансульфоновой,этансульфоновой, гидроксиэтансульфоновой, бензенсульфоновой, п-толуолсульфоновой кислотой, циклогексансульфаминовой, салициловой, п-аминосалициловой, 2-феноксибензойной и 2-ацетоксибензойной кислотой. В предпочтительном варианте осуществления соль представляет собой мемантина гидрохлорид (C12H21NHCl, М.м. 215,77). Термин "соли" может также включать аддитивные соли свободных кислот или свободных оснований. Все из таких солей (или другие схожие соли) можно приготовить традиционным способом. Приемлемыми являются все из таких солей при условии, что они не являются токсичными и, по существу, не блокируют желаемую фармакологическую активность. Кроме того, можно использовать любую форму мемантина в виде соли и свободного основания, в том числе, полиморфы, гидраты и сольваты, а также аморфные формы мемантина. Считают, что термин"мемантин", применяемый ниже в настоящем описании и формуле изобретения, охватывает и его форму свободного основания, и его фармацевтически приемлемые соли. В предпочтительных вариантах осуществления настоящего изобретения активный ингредиент представляет собой мемантина гидрохлорид.-6 013474 В некоторых вариантах осуществления настоящим изобретением обеспечиваются пероральные лекарственные формы, содержащие множество гранул, причем каждая гранула включает ядро диаметром,составляющим от приблизительно 1 мкм до приблизительно 1000 мкм, и ядро включает активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, причем лекарственные формы включают менее чем приблизительно 2,5% аддукта и имеют скорость растворения активного ингредиента, составляющую более чем приблизительно 80% в пределах приблизительно первых 60 мин после поступления лекарственных форм в среду применения. В предпочтительных вариантах осуществления настоящего изобретения скорость растворения составляет более чем приблизительно 80% в пределах 30 мин. В некоторых вариантах осуществления настоящего изобретения пероральные лекарственные формы включают множество гранул, причем каждая гранула включает ядро и активный ингредиент, включающий мемантин. Подходящая форма мемантина в виде гранул с немедленным высвобождением (НВ-гранул) может просто быть частицами мемантина, примешанными к растворимым соединениям, например сахарам (например, сахарозе, манниту и т.п.), полимерам (например, полиэтиленгликолю, гидроксипропилцеллюлозе, гидроксипропилметилцеллюлозе и т.п), поверхностно-активным веществам (лаурилсульфату натрия, кремофорам,твинам, спанам, плуроникам и т.п.), нерастворимым способствующим скольжению веществам (микрокристаллической целлюлозе, фосфату кальция, тальку, пирогенному кремнезему и т.п.), материалу для покрытия(примерами подходящих материалов для покрытия являются полиэтиленгликоль, гидроксипропилметилцеллюлоза, воск, жирные кислоты и т.п.), дисперсиям в подходящем веществе (примерами являются воск, полимеры, фармацевтически приемлемые масла, растворимые агенты и т.п.) или их комбинациям. В соответствии с некоторыми вариантами осуществления предполагаемое в настоящем изобретении ядро включает, но не ограничивается перечисленным, сахарные сферы (совершенные затравочные кристаллы), микрокристаллическую целлюлозу или маннит. Предпочтительно ядро представляет собой сахарные сферы, USP (Paulaur Cranbury, NJ). Размер частиц ядра находится в диапазоне от приблизительно 1 мкм до приблизительно 1000 мкм, предпочтительно в диапазоне от приблизительно 300 мкм до приблизительно 900 мкм, а более предпочтительно в пределах диапазона от приблизительно 450 мкм до приблизительно 825 мкм. В иллюстративных вариантах осуществления настоящего изобретения во избежание взаимодействия между ядром и активным ингредиентом ядро можно покрыть. Например, подходящие материалы для покрытия включают, но не ограничиваются перечисленным, полиэтиленгликоль,гидроксипропилметилцеллюлозу, воск, жирные кислоты и т.п. В одном варианте осуществления настоящего изобретения сферы представляют собой часть лекарственной формы, находящуюся в диапазоне от приблизительно 100 мг/г до приблизительно 950 мг/г,предпочтительно от приблизительно 550 мг/г до приблизительно 850 мг/г. В другом варианте осуществления настоящего изобретения сферы представляют собой часть лекарственной формы, находящуюся в диапазоне от приблизительно 620 мг/г до приблизительно 930 мг/г, предпочтительно от приблизительно 700 мг/г до приблизительно 850 мг/г. Доля гранулы будет зависеть от количества дополнительных составных частей, при их наличии, используемых в лекарственной форме. Ядро покрывают мемантином, предпочтительно мемантина гидрохлоридом. В одном варианте осуществления настоящего изобретения мемантина гидрохлорид присутствует в количестве от приблизительно 15 мг/г до приблизительно 350 мг/г, предпочтительно от приблизительно 50 мг/г до приблизительно 300 мг/г в расчете на вес целой НВ-гранулы. В других вариантах осуществления настоящего изобретения мемантин присутствует в количестве от приблизительно 15 мг/г до приблизительно 300 мг/г,предпочтительно от приблизительно 25 мг/г до приблизительно 250 мг/г. В предпочтительном варианте осуществления настоящего изобретения мемантина гидрохлорид добавляют к смеси связующего вещества и способствующего скольжению вещества до покрытия ядра мемантином. Способствующее скольжению вещество можно выбрать, не ограничиваясь перечисленным, из микрокристаллической целлюлозы, фосфата кальция, талька, пирогенного кремнезема. Способствующее скольжению вещество можно использовать в количествах, находящихся в диапазонах от 1,5 мг/г до приблизительно 35 мг/г, предпочтительно от приблизительно 1,5 мг/г до приблизительно 30 мг/г, более предпочтительно от приблизительно 2,5 мг/г до приблизительно 25 мг/г. В другом варианте осуществления настоящего изобретения предпочтительный диапазон способствующего скольжению вещества составляет от приблизительно 5 мг/г до приблизительно 30 мг/г. Связующее вещество можно выбрать, не ограничиваясь перечисленным, из повидона (PVP), гидроксипропилметилцеллюлозы (НРМС, Opadry), гидроксипропилцеллюлозы (НРС) или их комбинаций. В варианте осуществления, в котором связующим веществом является НРМС, связующее вещество присутствует в количестве, находящемся в диапазоне от приблизительно 15 мг/г до приблизительно 30 мг/г,предпочтительно от приблизительно 15 мг/г до приблизительно 25 мг/г. В другом варианте осуществления настоящего изобретения, в котором связующим веществом является повидон, связующее вещество присутствует в количестве, находящемся в диапазоне от приблизительно 1,5 мг/г до приблизительно 35 мг/г, предпочтительно от приблизительно 5 мг/г до приблизительно 30 мг/г. В следующей таблице представлен один иллюстративный вариант осуществления настоящего изобретения. Смесь активного ингредиента и связующего вещества/воды/способствующего скольжению вещества можно приготовить перемешиванием, например, с помощью мешалки, в течение по крайней мере 15 мин, предпочтительно по крайней мере 30 мин, более предпочтительно по крайней мере одного часа. Компоненты можно также объединить способами, включающими гомогенизацию, перемешивание, растворение и выпаривание, или используя суспензии. Смесь активный ингредиент/связующее вещество/неактивные вещества можно нанести на ядро,приготовить в виде сырой массы и экструдировать, гранулировать или подвергнуть распылительной сушке. В одном варианте осуществления изобретения сахарные сферы предварительно нагревают до температуры, находящейся в диапазоне от приблизительно 40 С до приблизительно 55 С, до использования в смеси. Ядро можно необязательно покрыть герметизирующим слоем в количестве от приблизительно 2% (в весовом отношении) до приблизительно 10% (в весовом отношении) до применения активного слоя лекарственного вещества. Герметизирующим слоем может быть любое применимое покрытие,которое может отделить активные ингредиенты от ядра, например, полимерные покрытия, такие какEudragit, HPMC, НРС или их комбинации. По этой причине для композиций настоящего изобретения также важна стабильность растворения (т.е. сохранение профиля растворения после воздействия повышенных температур). В одном варианте осуществления настоящего изобретения сахарные сферы покрывают с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, известной в данной области техники, например, Glatt Powder Coater and Granulator, GPCG3 (Ramsey, NY). Условия покрытия, такие как скорость потока воздуха, скорость распыления и давление при распылении, как правило, контролируются, поскольку они известны квалифицированным в данной области специалистам и принимаются ими во внимание. Температура продукта может находиться в диапазоне от приблизительно 43 С до приблизительно 51 С. Скорость потока воздуха может находиться в пределах от приблизительно 5 до приблизительно 9 м/с. Скорость распыления может находиться в пределах от приблизительно 9 до приблизительно 42 г/мин. Давление при распылении предпочтительно находится в интервале от приблизительно 1,5 до приблизительно 2,0 бар. Гранулы затем сушат в псевдоожиженном слое машины для нанесения покрытия при температуре, находящейся в диапазоне от приблизительно 45 С до приблизительно 50 С, в течение по крайней мере 5 мин, предпочтительно по крайней мере 15 мин, более предпочтительно по крайней мере 30 мин. Квалифицированный в данной области специалист признает, что можно также использовать много запасных рабочих условий и различные типы оборудования. После образования НВ-гранул в виде ядер, содержащих нанесенное слоем лекарственное средство,гранулы можно необязательно дополнительно покрыть герметизирующим слоем. Герметизирующим слоем может быть полимер или комбинация полимеров, которые можно разработать так, чтобы они были рН-зависимыми или независимыми. В предпочтительном варианте осуществления настоящего изобретения полимер для герметизирующего слоя выбирают, не ограничиваясь перечисленным, из НРМС (Opadry, Colorcon, PA), НРС, Eudragit RL, Eudragit E100, Eudragit E 12,5, Eudragit E PO, Eudragit NE(например, NE 30D или NE 40D) и комбинаций из двух или нескольких вышеупомянутых полимеров. Эти полимеры являются нерастворимыми в водной среде, но проявляют рН-независимое набухание при контакте с водными жидкостями. В другом варианте осуществления настоящего изобретения НВгранулы покрывают рН-зависимыми полимерами, растворимыми при рН предпочтительно выше 5. В композициях в виде НВ-гранул герметизирующий слой присутствует в количествах, находящихся в диа-8 013474 пазоне от приблизительно 0% (в весовом отношении) до приблизительно 40% (в весовом отношении),предпочтительно от приблизительно 0% (в весовом отношении) до приблизительно 10% (в весовом отношении), более предпочтительно от приблизительно 0% в весовом отношении до приблизительно 3% (в весовом отношении). В альтернативном случае с эстетической целью для использования или для стабильности НВ-ядра можно покрыть быстро разрушающимся или растворяющимся слоем. Подходящими материалами являются поливинилпирролидон, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, полиметакрилаты, содержащие свободные аминогруппы, при этом каждый из них может быть с пластификаторами или без них и с агентом против склеивания или наполнителем или без него. Как правило, считают, что добавление приблизительно 3% от веса ядра в качестве покровного материала обеспечит непрерывное покрытие для этого интервала размеров. В следующей таблице (табл. 2) демонстрируется иллюстративный вариант осуществления настоящего изобретения с компонентами, используемыми в композиции в виде покрытых гранул. Таблица 2 В других вариантах осуществления настоящим изобретением обеспечивается пероральная лекарственная форма, содержащая множество гранул, при этом каждая гранула включает ядро диаметром, составляющим от приблизительно 1 мкм до приблизительно 1000 мкм, причем ядро содержит активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г лекарственной формы, и модифицирующий высвобождение полимерный слой, причем лекарственная форма имеет скорость растворения активного ингредиента, составляющую от приблизительно 70% до приблизительно 80% в пределах от приблизительно 4 ч до приблизительно 24 ч, и Cmax, составляющую менее чем приблизительно 100 нг/мл. Гранулы с модифицированным высвобождением (МВ-гранулы) настоящего изобретения можно готовить первоначально, как описано для НВ-гранул, с ядром, слоем активного ингредиента и герметизирующим слоем. НВ-гранулы можно затем покрыть МВ-компонентом в форме дисперсии модифицирующего высвобождение полимера и предпочтительно дополнительным верхним слоем полимера с эстетической целью, для использования или стабильности. Конечная лекарственная форма, такая как капсула,может содержать различное количество гранул в зависимости от желаемой дозы композиции. Дисперсию полимера готовят перемешиванием воды с полимером, выбираемым, не ограничиваясь перечисленным, из этилцеллюлозы (Surelease, Colorcon, PA), метакрилата (Eudragit, Rohm Pharma,NJ) и сополимера метакриловой кислоты типа С (Acryl-Eze, Indianapolis, IN). В одном варианте осуществления дисперсию перемешивают в течение по крайней мере 15 мин, предпочтительно в течение по крайней мере 30 мин. Поскольку связующие вещества и матричные полимеры имеют различную стабильность растворения, композиции из связующих веществ и полимеров выбирают, в частности, из комбинаций, которые уменьшают или исключают нестабильность растворения. В зависимости от того, какое связующее вещество используют, предпочтительными являются дисперсии конкретного полимера. В одном варианте осуществления, когда связующим веществом является повидон, полимером для покрытия является этилцеллюлоза. В другом варианте осуществления, когда связующим веществом является НРМС, полимером является метакрилат или метакриловая кислота. Когда в качестве полимера используется метакрилат, к полимеру добавляют триэтилцитрат. После применения псевдоожижителя гранулы еще раз высушивают. Конкретные количества различных компонентов представлены в табл. 3-7. Гранулы или таблетки предпочтительно покрывают последним верхним слоем. Верхним слоем может быть полимер, выбираемый, не ограничиваясь перечисленным, из НРМС (Opadry, Colorcon, PA),НРС, Eudragit RL, Eudragit E 100, Eudragit E 12,5, Eudragit E PO, Eudragit NE и их смесей. В табл. 3-7 демонстрируются иллюстративные варианты осуществления настоящего изобретения. Очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Таблица 4 а. МВ-гранулы с Surelease 6%/PVD Очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Таблица 4 в. МВ-гранулы с Surelease 10%/PVD очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Таблица 4 д. МВ-гранулы с Surelease 9%/PVD Очищенную воду удаляют во время процесса.Содержит 25% (в весовом отношении) твердых веществ. Содержит 30% (в весовом отношении) твердых веществ.Очищенную воду удаляют во время процесса. Содержит 30% (в весовом отношении) твердых веществ. 1 Очищенную воду удаляют во время процесса. Содержит 30% (в весовом отношении) твердых веществ.Очищенную воду удаляют во время процесса. Очищенную воду удаляют во время процесса.При увеличении вдвое требуемого количества, увеличение веса покрытия таблетки составит приблизительно 3%. Растворение лекарственного средства из МВ-гранул происходит при проникновении увеличивающей объем среды и диффузии лекарственного средства через полимерный слой, что в свою очередь контролируется свойствами полимера: проницаемостью и набуханием. Гранулы с модифицированным высвобождением имеют, по существу, биоэквивалентную AUS по сравнению с лекарственной формой в виде таблетки с немедленным высвобождением и Cmax, составляющую по крайней мере 25% относительно таблетки с немедленным высвобождением (табл. 8). Гранула с модифицированным высвобождением демонстрирует хорошую переносимость, и ее можно назначать в широком диапазоне доз. Cmax (максимальная концентрация в плазме) составляет менее чем приблизительно 85% Cmax таблеток с немедленным высвобождением при назначении в виде единичной дозы. AUS (площадь под кривой, мера биодоступности) находится в пределах интервала от 75% до 130% таблеток с немедленным высвобождением при назначении в виде единичной дозы. Этот интервал считают биоэквивалентным. Все гранулы из композиции с модифицированным высвобождением не высвобождаются немедленно. Это важно для предотвращения дозового демпинга и уменьшения неблагоприятных результатов. В композиции с виде гранул с модифицированным высвобождением среднее Tmax (время достижения максимальной концентрации в плазме) находится в диапазоне от приблизительно 5 до приблизительно 48 ч,предпочтительно от приблизительно 5 до приблизительно 36 ч. Гранулы имеют скорость высвобожденияin vitro, составляющую более чем от приблизительно 70% до приблизительно 80% в течение от приблизительно 6 до приблизительно 12 ч. Предпочтительно композиции имеют скорость высвобождения, составляющую от приблизительно 30% до приблизительно 60% в течение от приблизительно 2 до приблизительно 6 ч. Более предпочтительно композиции имеют скорость высвобождения, составляющую от приблизительно 10% до приблизительно 50% в пределах первого часа после поступления в среду применения, за которым следует длительное высвобождение; более предпочтительно композиции имеют скорость высвобождения, составляющую от приблизительно 10% до приблизительно 35% в пределах первого часа. В других вариантах осуществления настоящим изобретением обеспечивается комбинированная лекарственная форма, содержащая компонент с немедленным высвобождением и компонент с модифицированным высвобождением, причем компонент с немедленным высвобождением включает первое множество гранул, при этом каждая гранула содержит первый активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г указанной лекарственной формы, причем приблизительно 80% первого активного ингредиента растворяется в пределах приблизительно первых 60 мин после поступления лекарственной формы в среду применения, а компонент с модифицированным высвобождением включает второе множество гранул, при этом каждая гранула содержит второй активный ингредиент, включающий мемантин или его соль в диапазоне от приблизительно 15 до приблизительно 350 мг/г указанной лекарственной формы, причем от приблизительно 70% до приблизительно 80% второго активного ингредиента растворяется в пределах от приблизительно 4 ч до приблизительно 24 ч после поступления лекарственной формы в среду применения. Комбинированную лекарственную форму можно скомбинировать в единичную лекарственную- 16013474 форму, имеющую одно- или многофазный профиль. Активный ингредиент, например, мемантина гидрохлорид, в композиции может быть представлен в количестве, измеряемом в мг на дозу, находящемся в диапазоне от приблизительно 2,5 мг до приблизительно 100 мг на дозу. Предпочтительно дозы содержат от 2,5 мг до 80 мг активного ингредиента. В других вариантах осуществления дозами являются 3, 6, 7, 14,20, 21, 28 или 60 мг. Композиции, включающие НВ- и МВ-компоненты, могут включать количество мемантина в форме с немедленным высвобождением, составляющее приблизительно от 5% до 90% композиции настоящего изобретения, предпочтительно от 10 до 60%. Количество мемантина с немедленным высвобождением,составляющее приблизительно от 15 до 50%, является особенно предпочтительным. Формы с контролируемым высвобождением мемантина могут включать остаток активного ингредиента. В результате конечной композицией обеспечивается количество мемантина для немедленного высвобождения после приема и дополнительное количество для непрерывного/модифицированного высвобождения. Композиция настоящего изобретения может проявлять более одного пика на кривой концентрация в плазме/время при любом интервале доз в зависимости от конкретных использованных активных ингредиентов, относительных количеств НВ- и МВ-компонентов и способности МВ-компонента растворяться. Таким образом, можно достичь того, что композиции будут иметь профили специфического высвобождения. Композиции, включающие НВ- и МВ-компоненты, могут включать любые твердые пероральные лекарственные формы, известные в данной области техники. Предпочтительные твердые лекарственные формы, используемые в настоящем изобретении, включают гранулы. Гранулы пропорциональны дозе,т.е. можно использовать одни и те же пропорции гранул различных типов для различных доз без значительного изменения процента высвобождаемого на протяжении времени лекарственного средства. Например, 40-мг доза будет доставлять вдвое больше лекарственного средства по сравнению с 20-мг дозой с одной и той же биодоступностью. Различные дозы получают путем использования различных количеств гранул. Гранулы также делают возможным разнообразие профилей растворения посредством перемешивания одного или нескольких типов гранул с различными способностями растворяться или использования многослойных покрытий, в виде нанесения на полимерный слой дополнительного слоя лекарственного средства и последующих покрытий с получением унитарных гранул, о чем осведомлен квалифицированный в данной области специалист. Гранулы также делают возможным загрузку лекарственного средства в широком интервале. Например, гранулы мемантина можно нагрузить на гранулы в количестве, составляющем до 500 мг/г лекарственной формы. Квалифицированный в данной области специалист признает, что более высокая загрузка лекарственного средства делает возможным более маленький размер капсулы. Увеличение времени достижения максимальной концентрации в плазме (Tmax) по сравнению с таблеткой с немедленным высвобождением связано со скоростью высвобождения лекарственного средства в среду применения. Скорость высвобождения лекарственного средства зависит от многих факторов, в том числе композиции твердых лекарственных форм и способностей растворяться. Используя различные композиции, содержащие или унитарные гранулы, или комбинацию множества типов гранул, можно скомбинировать их индивидуальные скорости высвобождения для достижения желаемых профилей высвобождения в плазму. Гранулы с различными характеристиками высвобождения можно получить посредством выбора модифицирующего высвобождение полимера, а также комбинации модифицирующего высвобождение полимера и связующего вещества для придания получаемым в результате гранулам различных характеристик высвобождения. При желании можно также использовать верхние слои, такие как энтеросолюбильные покрытия. Гранулы или смесь гранул можно использовать, например, в суспензиях, заполнить в капсулы,спрессовать в таблетки или заполнить в саше. Один или несколько типов гранул с модифицированным высвобождением можно смешать вместе и включить в капсулы или посыпать на продукты питания субъекта. Пероральная твердая лекарственная форма в соответствии с настоящим изобретением может представлять собой любую из этих форм. Предпочтительно лекарственная форма представляет собой капсулу. В одном варианте осуществления настоящего изобретения гранулы помещают в капсулы с использованием аппарата для включения лекарственного средства в капсулы. Могут потребоваться различные размеры капсул для соответствия активности и весу при заполнении целевой композиции. Размер капсул находится в интервале от 0 до 5 для веса при заполнении, находящегося в интервале от приблизительно 15 мг до приблизительно 630 мг. Размеры частиц компонентов НВ- и МВ-гранул в лекарственной форме зависят от применяемого для их приготовления метода. Размеры частиц компонентов находятся в интервале от субмикрон до 500 мкм для порошковых методов (смеси, распылительная сушка, дисперсии и т.п.), от 5 до 1700 мкм для методов покрытия (Wurster, распыление сверху, распыление снизу, распылительная сушка, экструзия,наслоение и т.п.), от 1 до 40 мм для методов таблетирования. В соответствии с настоящим изобретением обеспечены пероральные лекарственные формы для назначения человеку мемантина или одной из его фармацевтически приемлемых солей, предпочтительно его соли HCl. Пероральные лекарственные формы настоящего изобретения пригодны для лечения нару- 17013474 шений центральной нервной системы, в том числе, но не ограничиваясь перечисленным, болезни Альцгеймера, болезни Паркинсона, деменции AIDS (патенты США 5506231, 5061703 и 5614560; см. такжеParsons et al., Neuropharmacology 1999 Jun/ 38(6):735-67), невропатической боли (патент США 5334618), церебральной ишемии (патент США 5061703), эпилепсии, глаукомы, печеночной энцефалопатии, рассеянного склероза, удара, депрессии (патент США 6479553), поздней дискинезии, малярии,вируса Борна, гепатита С (патенты США 6034134 и 6071966). Дополнительные патологии, для лечения которых подходит мемантин, раскрыты в патентах США 5614560 и 6444702. Особый интерес представляет способность обеспечивать непрерывное ослабление боли. Соответственно настоящим изобретением, кроме того, обеспечивается способ терапевтического или профилактического лечения нарушений центральной нервной системы у субъекта, являющегося человеком или животным, включающий назначение нуждающемуся в таком лечении субъекту композиции в соответствии с настоящим изобретением в количестве, эффективном для лечения нарушения центральной нервной системы. Определения Для целей настоящего изобретения термины "замедленное высвобождение" или "модифицированное высвобождение" означают, что высвобождение терапевтически активного агента происходит на протяжении длительного периода времени, что приводит к более низким максимальным концентрациям в плазме и/или направлено на увеличение Tmax по сравнению с "немедленным высвобождением". Например, композиции с модифицированным высвобождением могут иметь среднее Tmax, составляющее приблизительно 5 или более часов. Термин "требование к растворению" означает скорость растворения гранул, полученную при проверке с использованием оборудования и методики, указанных в USP XXV, и проведении в соответствии с индивидуальными официальными монографиями USP XXV для конкретного(ых) терапевтически активного(ых) агента(ов). Используемый здесь термин "образование аддукта" относится к образованию соединения при использовании конкретного состава композиции с помощью твердофазной реакции. В отношении соединения общий термин "аддукт", также называемый продукт присоединения, является результатом прямого соединения двух или более различных соединений. Например, в настоящем изобретении образование продукта присоединения лактозы (или других восстанавливающих сахаров) может происходить при использовании составов, содержащих лактозу (или другие восстанавливающие сахара). Образование такого аддукта уменьшает эффективность продукта и увеличивает риски других побочных эффектов. Термин "терапевтически эффективное количество" означает количество соединения, которое при назначении млекопитающему для лечения состояния или нарушения является достаточным для осуществления лечения (как определено ниже). "Терапевтически эффективное количество" изменяется в зависимости от соединения, заболевания и его тяжести и возраста, веса, физического состояния и восприимчивости подвергаемого лечению млекопитающего. В соответствии с настоящим изобретением, в одном варианте осуществления, терапевтически эффективное количество мемантина представляет собой количество, эффективное для лечения нарушений центральной нервной системы, в том числе болезни Альцгеймера и болезни Паркинсона. В другом варианте осуществления терапевтически эффективное количество представляет собой количество, эффективное для лечения невропатической боли или других болезненных состояний, таких как висцеральная повышенная чувствительность. Другие применения включают, но не ограничиваются перечисленным, лечение деменции, депрессии и невропатической боли. Количество лекарственного средства, эффективное в отношении фармакологического действия, и, следовательно, активность капсулы зависят от самого заболевания, например, при болезни Альцгеймера больному первоначально дают 5-мг дозу, а затем дозу постепенно увеличивают до 10 мг дважды в день. Дополнительные дозы, оцененные в клинических испытаниях, включают 40 мг/день. В настоящем изобретении, например, при лечении болезни Альцгеймера с помощью твердой лекарственной формы с модифицированным высвобождением, больному первоначально дают 2,5 мг, а затем дозу постепенно увеличивают до 80 мг, более предпочтительно, когда больному первоначально дают от 7 мг до 33 мг один раз в день. Кроме того, увеличение лекарственной НВ-формы осуществляют в приблизительно 4-5 шагов. Увеличение формы с модифицированным высвобождением можно осуществить в 3-4 шага благодаря ее лучшей переносимости. Термин "фармацевтически приемлемый" означает биологически или фармакологически совместимый при использовании in vivo для животных или человека, а предпочтительно означает утвержденный регулирующим агентством федерального или государственного правительства или внесенный в списки Фармакопеи США (USP) или других обычно признаваемых Фармакопеей для использования для животных и особенно человека. Используемый термин "лечить" во всех его глагольных формах означает уменьшение или облегчение у субъекта по крайней мере одного симптома заболевания, включающего, например, боль, болезнь Альцгеймера, сосудистую деменцию или болезнь Паркинсона. Термин "лечить" может означать уменьшение или облегчение интенсивности и/или продолжительности проявления заболевания, испытываемого субъектом в ответ на данный раздражитель (например, давления, повреждения тканей, простуды, температуры и т.п.). Например, в отношении деменции термин "лечить" может означать уменьшение или- 18013474 ослабления снижения познавательных способностей (таких как снижение памяти и/или ориентации) или снижения общего функционирования (активностей каждодневной жизни, ADL) или замедление или реверсирование прогрессирующего ухудшения в ADL и познании. В пределах значения настоящего изобретения термин "лечить" также означает задержку, отсрочку начала (т.е. период до клинического проявления заболевания) и/или уменьшение риска развития или ухудшения заболевания. Используемый здесь термин "предохранять" означает предупреждение начала или лечение, или и то, и другое, если соответствует, развития или продолжения, или усугубления заболевания у субъекта. В пределах значения настоящего изобретения деменция ассоциируется с нарушением центральной нервной системы, в том числе, без ограничений, нейродегенеративными заболеваниями, такими как болезнь Альцгеймера (AD),болезнь Дауна и цереброваскулярная деменция (VaD). Термин "лечение" означает акт "лечения", как определено выше. Используемый здесь термин "пропорциональный дозе" относится к отношению между дозой лекарственного средства и его биодоступностью. Например, пропорциональность дозе существует, если вдвое большее количество одной и той же композиции будет доставлять вдвое большее количество лекарственного средства и обеспечивать одну и ту же биодоступность (например, AUC) по сравнению с одной дозой лекарственной формы. Пропорциональность дозе настоящего изобретения применяется к широкому диапазону доз, детально здесь обсуждаемых. Термин "приблизительно" означает в пределах приемлемого диапазона ошибок для конкретной величины, определяемой специалистом со средней квалификацией в данной области техники, которая отчасти зависит от того, каким образом величина измеряется или определяется, т.е. от ограничений измерительной системы. Например, "приблизительно" может означать в пределах 1 или более 1 стандартных отклонений, в практике в данной области техники. В альтернативном случае "приблизительно" в отношении композиций может означать плюс или минус диапазон, составляющий до 20%, предпочтительно до 10%, более предпочтительно до 5%. В альтернативном случае, в частности в отношении биологических систем или процессов, данный термин может означать в пределах порядка величины, предпочтительно в пределах 5-порядка, а более предпочтительно в пределах 2-порядка величины. В отношении представленных в заявке и формуле изобретения конкретных величин, если не указано иное, термин"приблизительно" означает в пределах приемлемого диапазона ошибок для конкретной величины. Например, при указании периода времени, например, в часах, более применимыми являются присутствующие величины (20%). Таким образом, 6 ч могут являться, например, 4,8 ч, 5,5 ч, 6,5 ч, 7,2 ч, а также обычными 6 ч. Термин "поступление в среду применения" означает контактирование композиции настоящего изобретения с желудочным или кишечным соком больного, которому она назначается, или с жидкостью,предназначенной для симулирования желудочного сока. Используемый здесь термин "среда применения" относится к желудку или другому отделу желудочно-кишечного тракта, предназначенного в качестве места в траектории главного поглощения лекарственного средства. Используемый здесь термин "коэффициент схожести" или коэффициент f2 относится к одному из методов сравнения профилей растворения двух различных продуктов (Multisource Pharmaceutical Products: Guidelines on Registration Requirements to establish Interchangeability, Quality Assurance and Safety:Medicines, Essential Drugs and Medicines Policy, World Health Organization, 1211 Geneva 27, Switzerland). При этом модельном независимом математическом подходе сравнивают профили растворения двух продуктов: проверяемого и эталонного (или две активности, или продукты одного и того же производителя до и после утверждения). Проверки рекомендуется проводить при одних и тех же условиях проверки. Моменты времени растворения для обоих профилей должны быть одними и теми же, например, для продуктов с немедленным высвобождением, например, 10, 15, 30, 45, 60 мин, а для продуктов с длительным высвобождением, например, 1, 2, 3, 5 и 8 ч. Только один момент времени следует принимать во внимание после растворения на 85% эталонного продукта. Коэффициент f2, составляющий 50 или больше (50100), гарантирует тождественность или эквивалентность двух кривых и, следовательно, характеристик двух продуктов. Коэффициент схожести f2 следует вычислять, используя уравнение: где Rt и Tt представляют собой кумулятивный процент лекарственного средства, растворенного в каждый выбранный момент времени n компаторных продуктов (эталонного и проверяемого, соответственно). Для продуктов, которые растворяются очень быстро, т.е. растворяются более чем на 85% в течение 15 мин или меньше, в сравнении профилей нет необходимости. Для гранулированных капсул с продолжительным высвобождением, когда активность отличается только количеством гранул, содержащих активную составляющую, сравнение профилей растворения (f250) при одном из рекомендуемых условий проверки является достаточным для отказов от биологических требований. Тогда как для таблеток с продолжительным высвобождением, когда продукт в виде лекарственного средства находится в одной и той же лекарственной форме с различной активностью и пропорционально схож по своим активным и неактивным ингредиентам, и имеет один и тот же механизм высвобождения лекарственного средства,более низкой активности можно предоставить отказ от биологических требований, если он проявляет- 19013474 схожие профили растворения, f250, в трех буферах с разными рН (между рН 1,2 и 7,5) при использовании рекомендуемого метода проверки. Используемый здесь термин "стабильность растворения" относится к схожести профилей растворения (коэффициент схожести больше 50 по сравнению с первоначальным), полученных в различные периоды хранения при различных температурных условиях и условиях влажности. Термин "по существу та же самая стабильность растворения" означает, что коэффициент схожестиf2 больше 50 по сравнению с эталонным профилем растворения. Примеры Следующие примеры являются только иллюстрацией настоящего изобретения и не должны никоим образом рассматриваться в качестве ограничивающих объем настоящего изобретения, поскольку при прочтении настоящего описания квалифицированным в данной области специалистам станет очевидным множество вариаций и эквивалентов, которые охватываются настоящим изобретением. Пример 1. Приготовление форм (не MB) в виде нагруженных мемантина HCl гранул. В настоящем примере описывается общий способ разработки нагруженных мемантина гидрохлоридом гранул с немедленным высвобождением, используя в качестве связующего вещества повидон. 1. Приготовление суспензии мемантина HCl (связующее вещество - повидон). Повидон USP перемешивают с водой, используя мешалку, до его полного растворения. В емкость с раствором повидона добавляют мемантина HCl и перемешивают в течение по крайней мере 15 мин. Добавляют тальк USP, и перемешивание продолжают в течение по крайней мере получаса. 2. Нанесение в виде покрытия суспензии мемантина HCl, содержащей повидон. Покрыть предварительно нагретые сахарные сферы USP слоем суспензии мемантина HCl с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, такой как GPCG3(Glatt Fluid. Air, Ramsey, NY). Нанесение покрытия осуществляют при следующих параметрах способа(для размера партии = 1-3 кг): температура продукта = 43-51 С; скорость потока воздуха = 5-9 м/с; скорость распыления = 9-42 г/мин; давление при распылении = 1,5-2,0 бар. Покрытые гранулы сушат в течение 5 мин в псевдоожиженном слое. Затем гранулы выгружают и хранят в подходящих контейнерах. Гранулы покрывают слоем лекарственного вещества в виде суспензии. Количество твердых веществ, т.е. привес к ядру, зависит от твердых веществ в составе. Пример 2. Приготовление форм в виде нагруженных мемантина HCl гранул. В настоящем примере описывается общий способ разработки нагруженных мемантина гидрохлоридом гранул с немедленным высвобождением, используя в качестве связующего вещества НРМС. 1. Приготовление суспензии мемантина HCl (связующее вещество - НРМС (Opadry, Colorcon,PA. Гидроксипропилметилцеллюлозу (Opadry) перемешивают с водой, используя мешалку, до ее полного растворения с образованием раствора Opadry. В емкость с раствором Opadry добавляют мемантина HCl и перемешивают в течение по крайней мере 15 мин. Добавляют тальк USP, и перемешивание продолжают в течение по крайней мере получаса. 2. Приготовление раствора для герметизирующего покровного слоя и раствора для верхнего слоя. Гидроксипропилметилцеллюлозу (Opadry) перемешивают с водой, используя мешалку, до ее полного растворения с образованием 7% (в весовом отношении) раствора. 3. Нанесение в виде покрытия суспензии мемантина HCl, содержащей Opadry. Сахарные сферы, USP, покрывают слоем суспензии мемантина HCl с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, такой как GPCG3 (Glatt Fluid Air, Ramsey,NY). Это осуществляют при следующих параметрах способа (для размера партии=1-3 кг): температура продукта = 43-51 С; скорость потока воздуха = 5-9 м/с; скорость распыления = 9-42 г/мин; давление при распылении = 1,5-2,0 бар. Сушат покрытые гранулы при температуре на входе 45-50 С в псевдоожиженном слое в течение 530 мин. Гранулы покрывают слоем лекарственного вещества в виде суспензии. Количество твердых веществ, т.е. привес к ядру, зависит от твердых веществ в составе. Пример 3. Приготовление лекарственных форм в виде гранул с модифицированным высвобождением мемантина HCl. В настоящем примере описывается общий способ разработки гранул с модифицированным высвобождением мемантина гидрохлорида, используя водную этилцеллюлозную суспензию. 1. Нагруженные лекарственным веществом гранулы готовят в соответствии с примером 1 или 2. 2. Приготовление этилцеллюлозной суспензии (Surelease, Colorcon, PA) Перемешать с водой Surelease, используя мешалку, в течение по крайней мере 15 мин с образова- 20013474 нием 15% (в весовом отношении) дисперсии. 3. Покрытие полимером Surelease. Нагруженные лекарственным веществом гранулы покрывают этилцеллюлозной суспензией (Surelease) с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, такой как GPCG3 производства Glatt Fluid Air (Ramsey, NY). Это осуществляют при следующих параметрах способа (для размера партии = 1-3 кг): температура продукта = 38-45 С; скорость потока воздуха = 5-9 м/с; скорость распыления = 15-22 г/мин; давление при распылении = 1,0-2,0 бар; прирост целевого продукта = 3% (в весовом отношении). Покрытые гранулы сушат при температуре на входе 45-50 С в псевдоожиженном слое в течение 5 мин. Пример 4. Приготовление лекарственных форм в виде гранул с модифицированным высвобождением мемантина HCl. В настоящем примере описывается способ разработки гранул с модифицированным высвобождением мемантина гидрохлорида, используя дисперсии Eudragit (Rhom Pharma, NJ). 1. Нагруженные лекарственным веществом гранулы готовят в соответствии с примером 1 или 2. 2. Приготовление дисперсии Eudragit RS/RL.Eudragit RS 30D и RL 30D, которые представляют собой 30% (в весовом отношении) водные дисперсии, взвешивают и объединяют в соотношении 95 к 5 в подходящей емкости для перемешивания и перемешивают в течение периода, составляющего 15 мин, используя механическую мешалку. КEudragit-смеси добавляют триэтилцитрат (ТЕС) и перемешивают в течение 15 мин с получением гомогенной дисперсии. Тальк, USP, взвешивают и медленно добавляют к очищенной воде в другой подходящей емкости для перемешивания и перемешивают в течение по крайней мере 30 мин с получением гомогенной дисперсии. Дисперсию талька добавляют к смеси Eudragit/TEC и перемешивают в течение по крайней мере 30 мин с получением гомогенной дисперсии. Дисперсию пропускают через сетчатый фильтр 60 (250 мкм). 3. Полимерное покрытие с использованием дисперсии Eudragit RS/RL. Нагруженные лекарственным веществом гранулы покрывают дисперсией Eudragit RS/RL с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, такой как GPCG3 производства Glatt Fluid Air (Ramsey, NY). Покрытие осуществляют при следующих параметрах способа(для размера партии=1-3 кг): температура продукта = 22-27 С; скорость потока воздуха = 5-9 м/с; скорость распыления = 15-22 г/мин; давление при распылении = 1,0-2,0 бар; прирост целевого продукта = 6% (в весовом отношении). Покрытые полимером гранулы сушат при температуре на входе 22-30 С в псевдоожиженном слое в течение 30 мин. Пример 5. Приготовление лекарственных форм в виде гранул с модифицированным высвобождением мемантина HCl. В настоящем примере описывается способ разработки гранул с модифицированным высвобождением мемантина гидрохлорида, используя дисперсии сополимера метакриловой кислоты. 1. Нагруженные лекарственным веществом гранулы готовили в соответствии с примером 1 или 2. 2. Приготовление дисперсии сополимера метакриловой кислоты типа С (Acryl-Eze).Acryl-Eze перемешивали с водой, используя мешалку, в течение по крайней мере 30 мин. 3. Полимерное покрытие с использованием дисперсии сополимера метакриловой кислоты типа С(Acryl-Eze). Нагруженные лекарственным веществом гранулы покрывают дисперсией сополимера метакриловой кислоты типа С (Acryl-Eze) с помощью машины для нанесения покрытия с использованием псевдоожиженного слоя, такой как GPCG3 производства Glatt Fluid Air (Ramsey, NY). Покрытие осуществляют при следующих параметрах способа (для размера партии = 1-3 кг): Температура продукта = 26-34 С; скорость потока воздуха = 5-9 м/с; скорость распыления = 15-22 г/мин; давление при распылении = 1,0-2,0 бар; прирост целевого продукта = 30% (в весовом отношении). Покрытые полимером гранулы сушат при температуре на входе 45-50 С в псевдоожиженном слое в течение 5-30 мин. Скорости растворения демонстрируются на фиг. 13. Пример 6. Покрытие герметизирующим слоем и верхним слоем лекарственных форм в виде гранул- 21013474 с модифицированным высвобождением мемантина гидрохлорида. В настоящем примере описывается способ покрытия герметизирующим слоем и верхним слоем гранул с модифицированным высвобождением мемантина гидрохлорида. 1. Нагруженные лекарственным веществом гранулы готовили в соответствии с одним или несколькими примерами 1-6. 2. Покрытие герметизирующим слоем и верхним слоем. Нагруженные лекарственным веществом гранулы можно затем покрыть герметизирующим слоем из гидроксипропилметилцеллюлозы при следующих параметрах способа (для размера партии=1-3 кг): температура продукта=43-51 С; скорость потока воздуха=5-9 м/с; скорость распыления=9-16 г/мин; давление при распылении=1,0-2 г 0 бар. Также покрытые полимером гранулы можно затем покрыть верхним слоем из гидроксипропилметилцеллюлозы (Opadry) с получением прироста, составляющего 2% (в весовом отношении). Покрытые гранулы сушат при температуре на входе 45-50 С в псевдоожиженном слое в течение 5-30 мин. Пример 7. Приготовление содержащих мемантина HCl гранул с использованием повидона USP. В настоящем примере демонстрируются приготовления гранул с немедленным высвобождением мемантина HCl с использованием в качестве связующего вещества повидона USP при 100 мг/г и 171 мг/г. Таблица 9 Очищенную воду удаляют во время процесса. Способ приготовления этих гранул включает следующие стадии: 1. Приготовление суспензии мемантина HCl (связующее вещество - повидон); 2. Нанесение в виде покрытия суспензии мемантина HCl, содержащей повидон. Данные по растворению этих гранул представлены на фиг. 1. Представленное на фиг. 4 сравнение растворения НВ-гранул с растворением гранул с высвобождением 1 показывает коэффициент схожестиf2, составляющий только приблизительно 26, что означает, что профили высвобождения существенно различаются, демонстрируя, что модифицированное высвобождение достигается при уровне покрытия 3%. Пример 8. Приготовление содержащих мемантина HCl гранул с использованием Opadry прозрачного. В настоящем примере демонстрируется приготовление гранул с немедленным высвобождением мемантина HCl гидрохлорида с использованием в качестве связующего вещества Opadry прозрачного Очищенную воду удаляют во время процесса. Способ приготовления этих гранул включает следующие стадии: 1. Приготовление суспензии мемантина HCl (связующее вещество - НРМС (Opadry; 2. Приготовление раствора для герметизирующего покровного слоя; 3. Нанесение в виде покрытия суспензии мемантина HCl, содержащей Opadry, и герметизирующего слоя. Данные по растворению этих гранул представлены на фиг. 1. На фиг. 1 большие величины f2 (50),полученные при сравнении растворения первоначальных образцов с растворением образцов после хранения, указывают на хорошую стабильность растворения. Пример 9. Приготовление гранул с высвобождением мемантина HCl (высвобождением 1 и 3). В настоящем примере демонстрируется приготовление гранул с немедленным высвобождением мемантина HCl с использованием 3% Surelease с PVP и 6% Surelease с PVP. Способ приготовления этих гранул включает следующие стадии: 1. Приготовление суспензии мемантина HCl (связующее вещество - повидон); 2. Приготовление этилцеллюлозной дисперсии (Surelease); 3. Приготовление раствора для верхнего слоя; 4. Нанесение в виде покрытия суспензии мемантина HCl, содержащей повидон; 5. Покрытие полимером Surelease; и 6. Покрытие верхним слоем. Очищенную воду удаляют во время процесса. Содержит 25% (в весовом отношении) твердых веществ. Требуемая скорость модифицированного высвобождения достигается и, по существу, не меняется после нагревания гранул при 50 С (см. фиг. 2). На фиг. 4 представлено сравнение растворения НВ-гранул с растворением гранул с высвобождением 1. На фиг. 5 представлены данные по стабильности растворения. Большие величины f2 (50), полученные при сравнении скорости растворения первоначальных образцов со скоростью растворения образцов после хранения, указывают на отличную стабильность растворения. Таблица 12. Гранулы с высвобождением 3 мемантина HCl, Surelease 6% с PVP Очищенную воду удаляют во время процесса. Содержит 25% (в весовом отношении) твердых веществ. На фиг. 5 предоставлены данные по растворению этих гранул. На фиг. 5 также иллюстрируется эффект нагревания в печи этих гранул. Данные демонстрируют отсутствие существенного изменения скорости растворения после нагревания гранул в течение короткого промежутка времени при 40 и 50 С. На фиг. 3 демонстрируется стабильность скорости растворения. Также гранулы с модифицированным высвобождением с различными уровнями Surelease, прироста, можно приготовить с использованием 171 мг/г или 100 мг/г НВ-гранул. Пример 10. Приготовление гранул с модифицированным высвобождением мемантина HCl (высвобождением 4, 5 и 6). В настоящем примере демонстрируется приготовление гранул с немедленным высвобождением мемантина HCl с использованием Eudragit/HPMC при 6, 10 и 20% (в весовом отношении) Eudragit. Способ приготовления гранул с Eudragit/HPMC включает следующие стадии: 1. Приготовление суспензии мемантина HCl (связующее вещество - НРМС (Opadry; 2. Приготовление раствора для герметизирующего слоя; 3. Приготовление дисперсии Eudragit RS/RL; 4. Приготовление раствора для верхнего слоя; 5. Нанесение в виде покрытия суспензии мемантина HCl, содержащей Opadry; 6. Покрытие герметизирующим слоем; 7. Полимерное покрытие с использованием дисперсии Eudragit RS/RL; и 8. Покрытие верхним слоем. Таблица 13. Гранулы с высвобождением 4, Eudragit 6% (в весовом отношении)/НРМС 1 Содержит 30% (в весовом отношении) твердых веществ. 1 Очищенную воду удаляют во время процесса. Таблица 14. Гранулы с высвобождением 5 мемантина HCl, Eudragit 10% (в весовом отношении)/НРМС Содержит 30% (в весовом отношении) твердых веществ. 1 Очищенную воду удаляют во время процесса.- 26013474 Данные по стабильности растворения этих гранул представлены на фиг. 3 и 9. Таблица 15. Гранулы с высвобождением 6 мемантина HCl, Eudragit 20% (в весовом отношении)/НРМС Содержит 30% (в весовом отношении) твердых веществ. Очищенную воду удаляют во время процесса. В этом примере в качестве связующего вещества использовали НРМС, а в качестве модифицирующего высвобождение полимера - Eudragit. Также не демонстрируется существенная разница в скорости растворения после нагревания в течение коротких промежутков времени при 50 С. На фиг. 6 и 7 представлены данные по стабильности растворения. Пример 11. Приготовление гранул с модифицированным высвобождением мемантина HCl. В настоящем примере демонстрируется приготовление гранул с модифицированным высвобождением мемантина HCl с использованием полимера Acryl-Eze. Очищенную воду удаляют во время процесса. Способ приготовления этих гранул включает следующие стадии: 1. Приготовление суспензии мемантина HCl (связующее вещество - НРМС (Opadry; 2. Приготовление раствора для герметизирующего слоя; 3. Приготовление дисперсии Acryl-Eze; 4. Нанесение в виде покрытия суспензии мемантина HCl, содержащей Opadry; 6. Покрытие герметизирующим слоем; 7. Полимерное покрытие с использованием дисперсии Acryl-Eze. На фиг. 13 демонстрируются скорости растворения. Пример 12. Приготовление унитарных капсул с модифицированным высвобождением. В настоящем примере демонстрируется приготовление пропорциональных дозе унитарных капсул на основе гранул, приготовленных в соответствии с примером 9, особенно гранул с высвобождением 3. Представленные ниже гранулы включают 2,5-, 7-, 14-, 21-, 28-, 40-, 80- и 100-мг композиции. Таблица 17 Приготовьте аппарат для включения лекарственного вещества в капсулы (MG-2 Futura, NJ) для капсул соответствующего размера. Заполните капсулы содержащими мемантина HCl МВ-гранулами, с высвобождением 3. В табл. 9 представлены вес при заполнении и размер капсул для всех активностей. Про- 28013474 верьте вес всех индивидуальных капсул, используя оборудование для контроля веса. Кроме того, можно приготовить МВ-гранулы с использованием различных НВ-гранул и уровней покрытий. На фиг. 8 представлены данные по растворению для активностей в 25, 40 и 60 мг. Пример 13. Приготовление капсул с множеством гранул с модифицированным высвобождением (40 мг). В настоящем примере демонстрируется приготовление капсул с использованием гранул с высвобождением 1 и высвобождением 3 в различных соотношениях. Приготовьте аппарат для включения лекарственного вещества в капсулы для капсул соответствующего размера. Заполните капсулы содержащими мемантина HCl МВ-гранулами, например, гранулами с высвобождением 1 и высвобождением 3. Ниже представлен вес при заполнении для различных дозовых соотношений. Проверьте вес всех индивидуальных капсул, используя оборудование для контроля веса. Таблица 18 На фиг. 10 представлены данные по растворению этих капсул. Как показано на фиг. 10, большие величины f2 (50), полученные при сравнении скорости растворения первоначального образца со скоростью растворения образца после хранения, указывают на отличную стабильность растворения. На фиг. 11 представлены величины концентрации мемантина в плазме крови. В табл. 19-21 демонстрируются композиции индивидуальных капсул с гранулами, нагруженными мемантином и Surelease, и применимые диапазоны веса гранул, которые можно использовать. Таблица 19. Капсулы профиля 1 (медленного) с множеством гранул с примерной активностью 40 мг Пример 14. Приготовление капсул с множеством гранул (40 мг). В настоящем примере демонстрируется приготовление капсул с гранулами с высвобождением 4,высвобождением 5 и высвобождением 6 в различных соотношениях. Приготовьте аппарат для включения лекарственного вещества в капсулы для капсул соответствующего размера. Заполните капсулы содержащими мемантина HCl МВ-гранулами, например, гранулами с высвобождением 4, высвобождением 5 и высвобождением 6. Ниже представлен вес при заполнении для различных дозовых соотношений. Проверьте вес всех индивидуальных капсул, используя оборудование для контроля веса.
МПК / Метки
МПК: A61K 31/13, A61K 9/54
Метки: композиция, высвобождением, мемантина, виде, модифицированным, гранул, немедленным
Код ссылки
<a href="https://eas.patents.su/30-13474-kompoziciya-v-vide-granul-s-modificirovannym-i-nemedlennym-vysvobozhdeniem-memantina.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция в виде гранул с модифицированным и немедленным высвобождением мемантина</a>
Предыдущий патент: Способ получения трициклического кетона
Следующий патент: Макроциклические ингибиторы вируса гепатита с
Случайный патент: Крепированный лентой впитывающий лист с варьирующейся локальной основной массой, полученный с использованием перфорированной полимерной ленты












