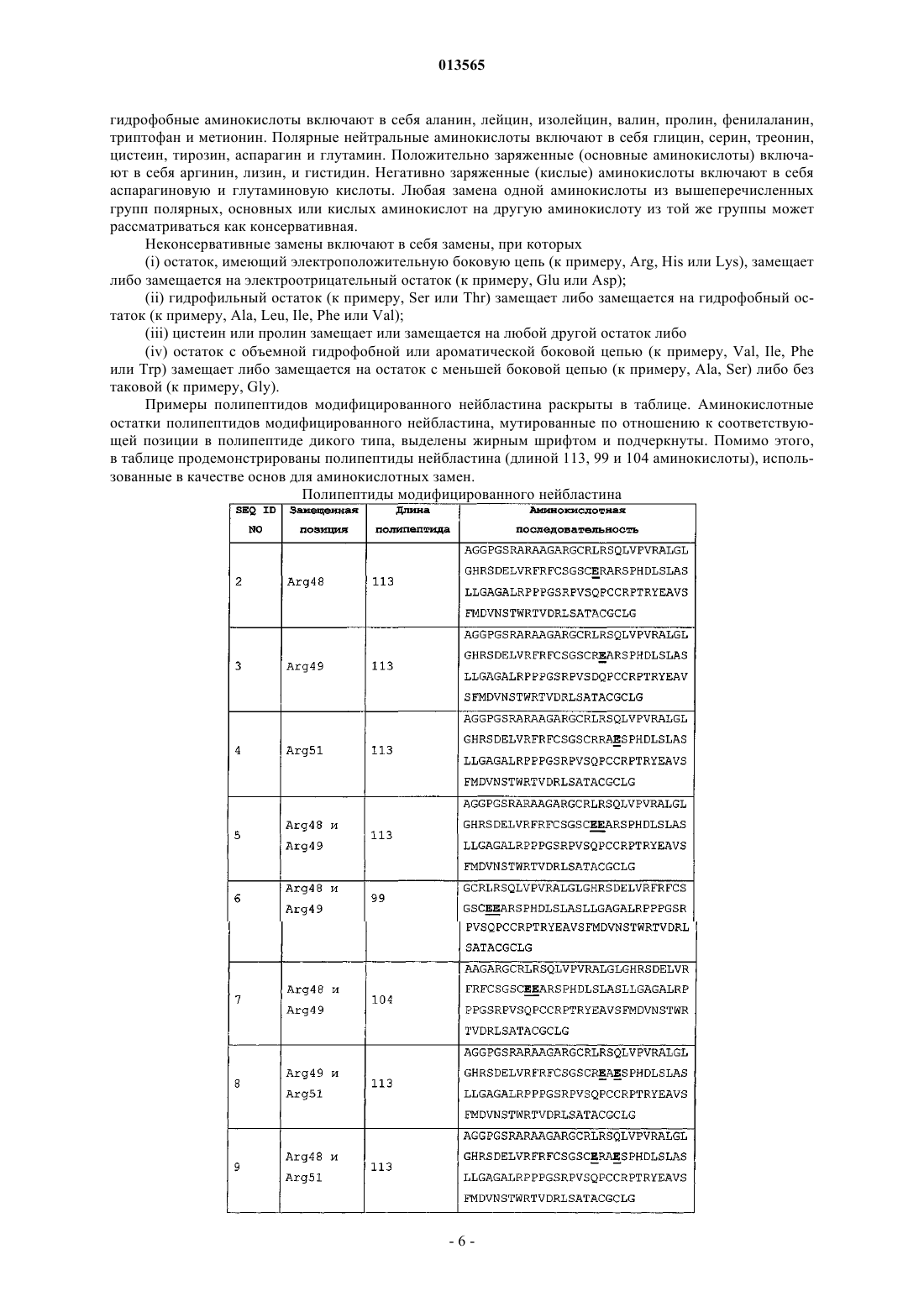
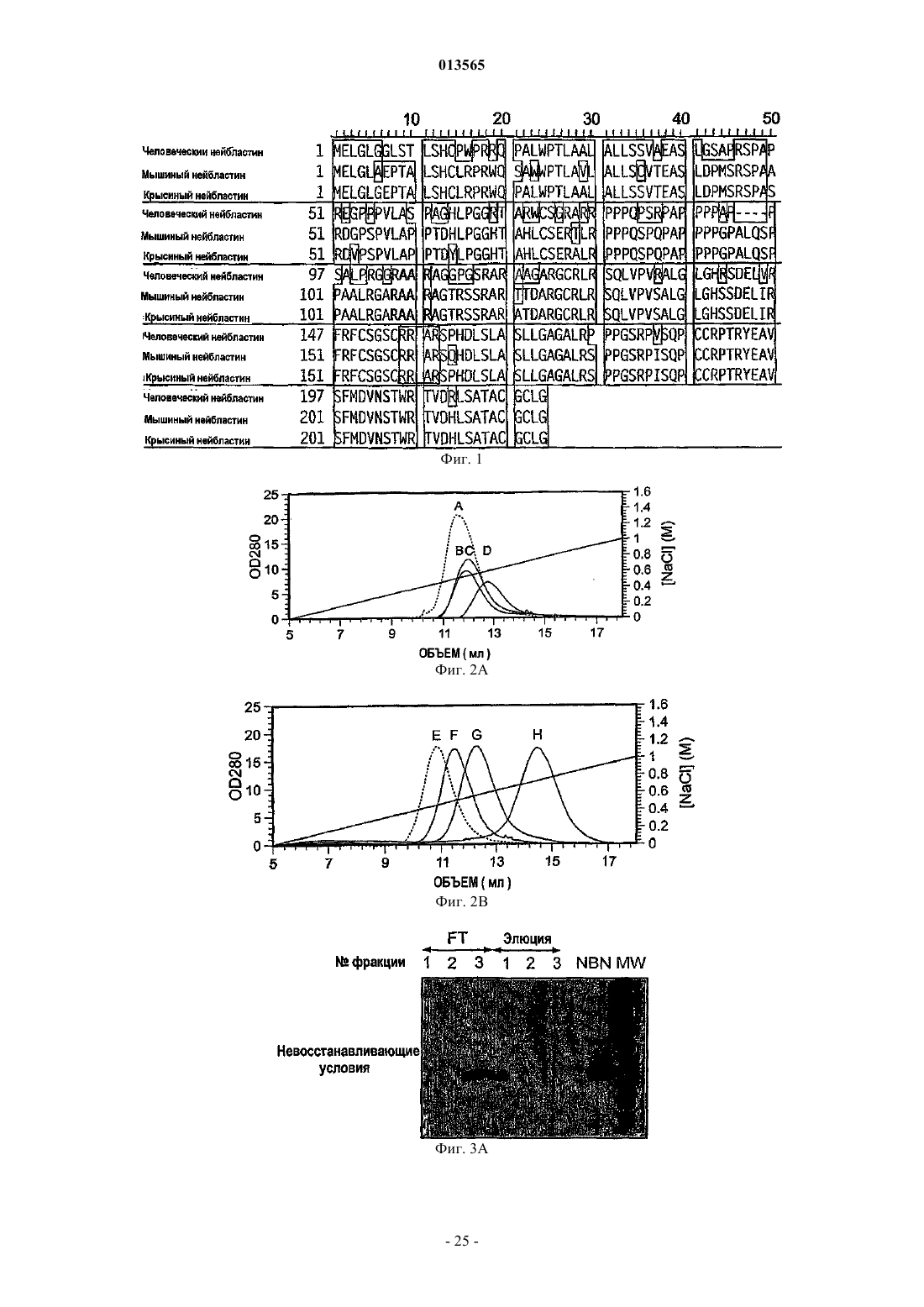
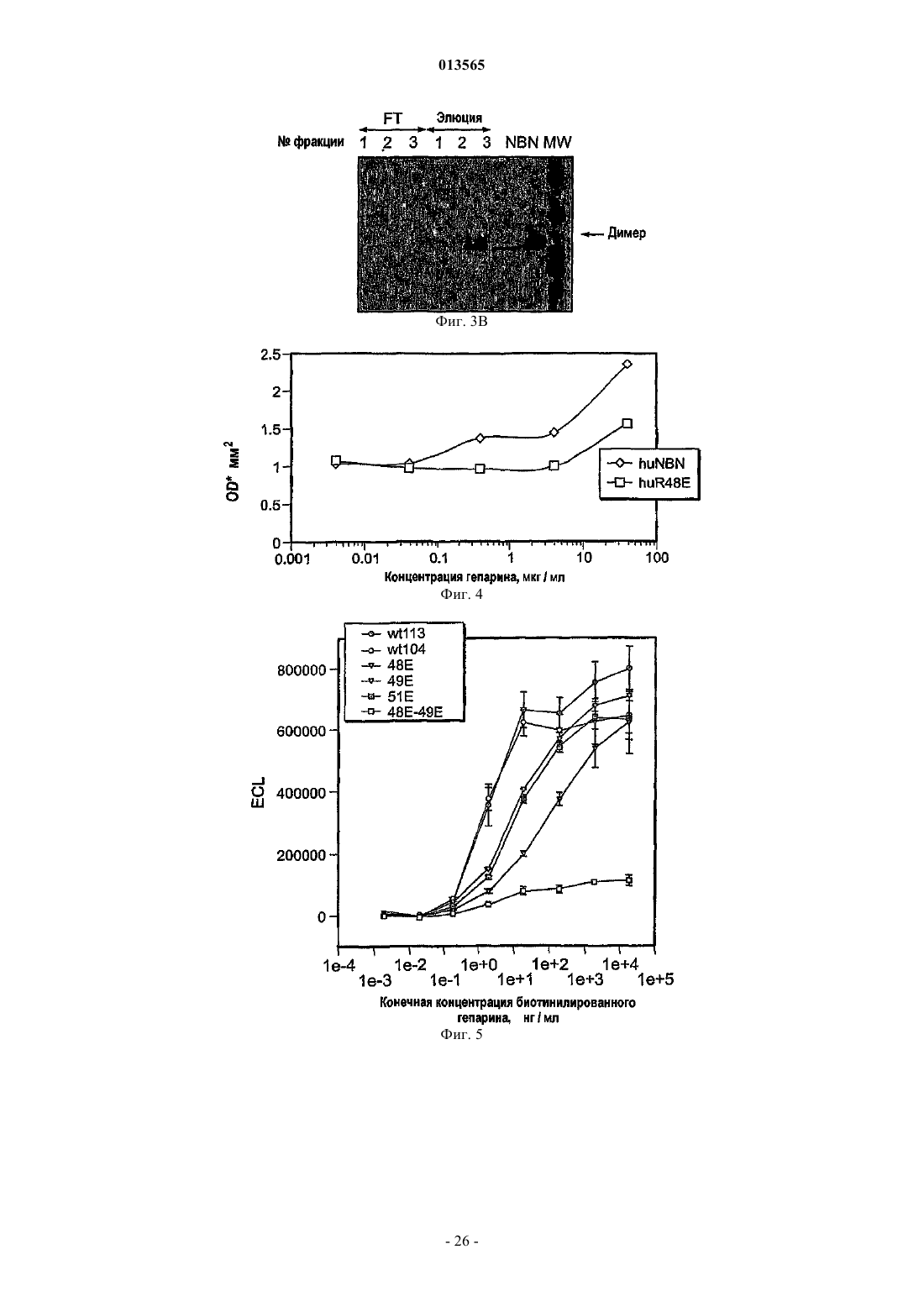
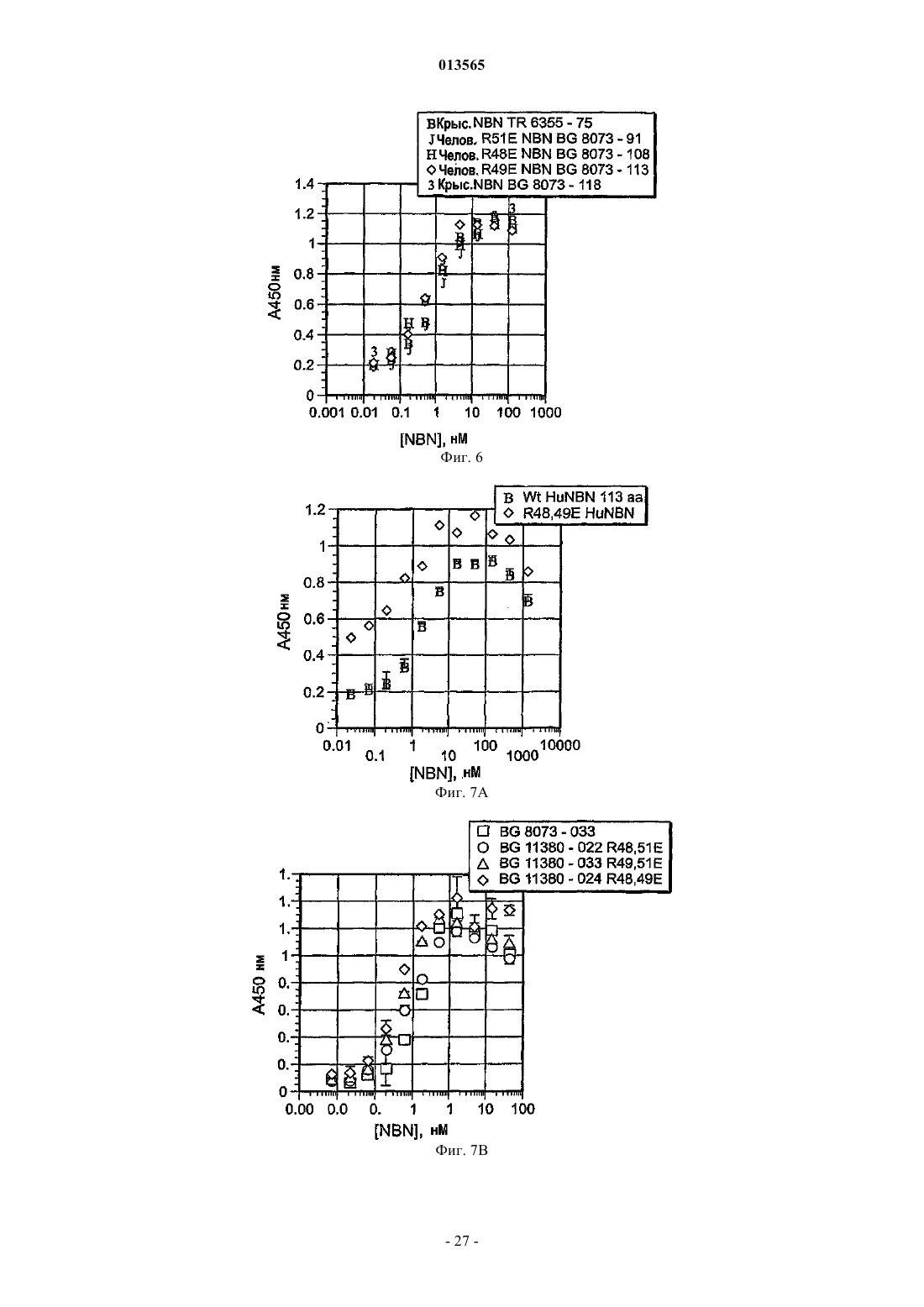
Варианты полипептидов нейбластина, способы их получения и их применение
Номер патента: 13565
Опубликовано: 30.06.2010
Авторы: Сильвиан Лаура, Россомандо Энтони, Пепински Р.Блэйк
Формула / Реферат
1. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 последовательности SEQ ID NO:1, где аминокислотная последовательность содержит замещенную аминокислоту, отличную от аргинина в положении 48 и в положении 49 аминокислотной последовательности SEQ ID NO:1; причем указанный вариант полипептида после димеризации связывается с комплексом, содержащим GFRa3 и RET, и где указанный вариант полипептида обладает значительно меньшей способностью связывать гепарин по сравнению с полипептидом нейбластина дикого типа с аминокислотной последовательностью SEQ ID NO:1.
2. Вариант полипептида по п.1, где остаток аргинина в положении 48 и остаток аргинина в положении 49 аминокислотной последовательности SEQ ID NO:1 замещены неконсервативными аминокислотными остатками.
3. Вариант полипептида по п.1, где остаток аргинина в положении 48 и остаток аргинина в положении 49 аминокислотной последовательности SEQ ID NO:1 замещены глутаминовой кислотой.
4. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
5. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность, которая по крайней мере на 95% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
6. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность, которая по крайней мере на 98% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
7. Вариант полипептида нейбластина, содержащий аминокислоты 15-113 последовательности SEQ ID NO:5.
8. Вариант полипептида нейбластина, содержащий аминокислоты 10-113 последовательности SEQ ID NO:5.
9. Вариант полипептида нейбластина, содержащий аминокислотную последовательность SEQ ID NO:5.
10. Вариант полипептида нейбластина, состоящий из аминокислот 15-113 последовательности SEQ ID NO:5.
11. Вариант полипептида нейбластина, состоящий из аминокислот 10-113 последовательности SEQ ID NO:5.
12. Вариант полипептида нейбластина, состоящий из аминокислотной последовательности SEQ ID NO:5 или SEQ ID NO:7.
13. Димер, содержащий два любых варианта полипептида нейбластина по любому из пп.1-12.
14. Конъюгат, содержащий вариант полипептида нейбластина по любому из пп.1-12, который связан с неприродным полимером.
15. Конъюгат по п.14, в котором неприродный полимер представляет собой полиалкиленгликоль.
16. Конъюгат по п.15, в котором полиалкиленгликоль представляет собой полиэтиленгликоль.
17. Конъюгат по любому из пп.14-16, в котором неприродный полимер связан с вариантом полипептида нейбластина на его аминоконце.
18. Конъюгат по любому из пп.14-16, в котором неприродный полимер связан с вариантом полипептида нейбластина по внутреннему сайту для конъюгирования полимера.
19. Слитый белок, содержащий вариант полипептида нейбластина по любому из пп.1-12 и гетерологичную аминокислотную последовательность.
20. Фармацевтическая композиция, содержащая вариант полипептида нейбластина по любому из пп.1-12, димер по п.13, конъюгат по любому из пп.14-18 или слитый белок по п.19, а также фармацевтически приемлемый носитель или эксципиент.
21. Нуклеиновая кислота, содержащая последовательность, кодирующую вариант полипептида нейбластина по любому из пп.1-12.
22. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.21.
23. Клетка, содержащая экспрессирующий вектор по п.22.
24. Способ получения варианта полипептида нейбластина, включающий
получение клетки по п.23 и
культивирование клетки в условиях, способствующих экспрессии нуклеиновой кислоты, кодирующей вариант полипептида нейбластина.
25. Способ лечения или предотвращения заболевания или нарушения нервной системы у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13, конъюгата по любому из пп.14-18 или слитого белка по п.19.
26. Способ лечения нейропатической боли у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13, конъюгата по любому из пп.14-18 или слитого белка по п.19.
27. Способ активации рецептора RET у млекопитающего, включающий введение млекопитающему эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13, конъюгата по любому из пп.14-18 или слитого белка по п.19.
28. Способ по любому из пп.25-27, в котором млекопитающее является человеком.
29. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 последовательности SEQ ID NO:1, которая содержит по крайней мере одну замещенную аминокислоту по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из
аминокислоты, отличной от серина в положении 20 SEQ ID NO:1;
аминокислоты, отличной от глутамина в положении 21 SEQ ID NO:1;
аминокислоты, отличной от гистидина в положении 32 SEQ ID NO:1;
аминокислоты, отличной от аргинина в положении 33 SEQ ID NO:1;
аминокислоты, отличной от аргинина в положении 39 SEQ ID NO:1;
аминокислоты, отличной от серина в положении 46 SEQ ID NO:1;
аминокислоты, отличной от аргинина в положении 68 SEQ ID NO:1;
аминокислоты, отличной от глицина в положении 72 SEQ ID NO:1;
аминокислоты, отличной от серина в положении 73 SEQ ID NO:1; и
аминокислоты, отличной от валина в положении 94 SEQ ID NO:1,
причем указанный полипептид после димеризации связывается с комплексом, содержащим GFRa3 и RET.
30. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
31. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 95% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
32. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 98% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
33. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную последовательности SEQ ID NO:1, которая содержит по крайней мере одну замещенную аминокислоту по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из
аминокислоты, отличной от аргинина в положении 7 SEQ ID NO:1;
аминокислоты, отличной от аргинина в положении 9 SEQ ID NO:1; и
аминокислоты, отличной от аргинина в положении 14 SEQ ID NO:1,
причем указанный полипептид после димеризации связывается с комплексом, содержащим GFRa3 и RET.
34. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 7 SEQ ID NO:1.
35. Вариант полипептида по п.34, где указанная аминокислота представляет собой неконсервативную аминокислоту.
36. Вариант полипептида по п.34, где указанная аминокислота представляет собой глутаминовую кислоту.
37. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 9 SEQ ID NO:1.
38. Вариант полипептида по п.37, где указанная аминокислота представляет собой неконсервативную аминокислоту.
39. Вариант полипептида по п.37, где указанная аминокислота представляет собой глутаминовую кислоту.
40. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 14 SEQ ID NO:1.
41. Вариант полипептида по п.40, где указанная аминокислота представляет собой неконсервативную аминокислоту.
42. Вариант полипептида по п.40, где указанная аминокислота представляет собой глутаминовую кислоту.
43. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична последовательности SEQ ID NO:1.
44. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 95% идентична последовательности SEQ ID NO:1.
45. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 98% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.
46. Димер, содержащий два любых варианта полипептида нейбластина по любому из пп.29-45.
47. Конъюгат, содержащий вариант полипептида нейбластина по любому из пп.29-45 и неприродный полимер.
48. Слитый белок, содержащий вариант полипептида нейбластина по любому из пп.29-45 и гетерологичную аминокислотную последовательность.
49. Фармацевтическая композиция, содержащая вариант полипептида нейбластина по любому из пп.29-45, димер по п.46, конъюгат по п.47 или слитый белок по п.48, а также фармацевтически приемлемый носитель или эксципиент.
50. Нуклеиновая кислота, содержащая последовательность, кодирующую вариант полипептида нейбластина по любому из пп.29-45.
51. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.50.
52. Клетка, содержащая экспрессирующий вектор по п.51.
53. Способ получения варианта полипептида нейбластина, включающий
получение клетки по п.52 и
культивирование клетки в условиях, способствующих экспрессии нуклеиновой кислоты, кодирующей вариант полипептида нейбластина.
54. Способ лечения или предотвращения заболевания или нарушения нервной системы у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции по п.49.
55. Способ лечения нейропатической боли у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции по п.49.
56. Способ активации рецептора RET у млекопитающего, включающий введение млекопитающему эффективного количества варианта полипептида нейбластина по любому из пп.29-45, димера по п.46, конъюгата по п.47, слитого белка по п.48 или фармацевтической композиции по п.49.
Текст
013565 Перекрестная ссылка на родственные заявки Заявка на данное изобретение испрашивает приоритет предварительной заявки 60/602825,зарегистрированной 19 августа 2004 г., и предварительной заявки 60/694067, зарегистрированной 24 июня 2005 г. Содержание каждой из вышеуказанных предварительных заявок включено в данное описание посредством ссылки во всей своей полноте. Область техники Изобретение относится к химии белков, молекулярной биологии и нейробиологии. Предшествующий уровень техники Нейбластин, также известный как артемин и эновин, представляет собой гомодимерный секретируемый белок массой 24 кДа, обеспечивающий выживание нейронов периферической и центральной нервной системы, таких как допаминэргические нейроны (Baudet et al., 2000, Development, 127:4335;Rosenblad et al., 2000, Mol. Cell Neurosci., 15 (2):199; GenBank AF120274). Ген, кодирующий нейбластин,был проклонирован и отсеквенирован (Roseblad et al., 2000, Mol. Cell Neurosci., 15 (2):199; Baloh et al.,Neuron, 21:1291). Нейбластин является членом семейства лигандов, полученного из глиальной клеточной линии нейротрофического фактора (GDNF). На клеточном уровне члены семейства GDNF активируют рецепторную тирозинкиназу RET. RET ассоциируется с корецептором - рецептором семейства GDNF-альфа(GFRalpha), связанным с гликозилфосфатидилинозитолом (GPI) мембранным белком, обеспечивающим лигандную специфичность для RET. Известны четыре рецептора GFRalpha (GFRalpha 1-4). Нейбластин связывается с GFRalpha3 и RET, формируя трехкомпонентный сигнальный комплекс (Baudet et al., 2000,Development, 127:4335; Baloh et al., 1998, Neuron, 21:1291), локализующийся преимущественно на ноцицептивных сенсорных нейронах (Orozco et al., 2001, Eur. J. Neurosci., 13 (11):2177). Данные нейроны детектируют боль и повреждения. Таким образом, нейбластин потенциально может быть применен для лечения нейропатии, в особенности для лечения нейропатической боли. Нейбластин и другие члены семейства GDNF входят в суперсемейство трансформирующего фактора роста-бета (TGF-бета) и, таким образом, характеризуются наличием семи консервативных остатков цистеина со сходным расположением, формирующих структуру цистеинового узла (Saarma, 1999,Microsci. Res. Tech., 45:292). Каждый мономер содержит две дисульфидные связи, формирующие закрытую петлевую структуру, охватывающую третью дисульфидную связь и таким образом формирующую структуру тугого узла. Седьмой цистеин в каждом из мономеров формирует межмолекулярную дисульфидную связь, ковалентно связывая мономеры и формируя конечный димерный продукт (Rattenholl et al.,2000, J. Mol. Biol., 305:523). Члены семейства TGF-бета синтезируются в виде про-пробелков, секретируемых в виде зрелого гомодимера после отщепления сигнального пептида и про-домена (см., к примеру, Rattenholl et al., 2000, J.Mol. Biol., 305:523; Fairlie et al., 2001, J. Biol. Chem., 276 (20):16911). Как сигнальный пептид, так и про-домен обеспечивают правильную секрецию членов семейства TGF-бета (Rattenholl et al., 2000, J.Mol. Biol., 305:523; Rattenholl et al., 2001, Eur. J. Biochem., 268:3296). Краткое изложение сущности изобретения Изобретение основано, по крайней мере отчасти, на открытии связывания нейбластина с сульфатом гепарина, и определенные аминокислотные остатки полипептида нейбластина обеспечивают данное связывание. Замещение определенных аминокислотных остатков приводило к снижению связывания полученного модифицированного нейбластина с гепарином, а также к увеличению биоактивности и биодоступности модифицированных полипептидов. В одном из аспектов данное изобретение относится к полипептиду, содержащему аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 в последовательностиSEQ ID NO:1, где аминокислотная последовательность полипептида содержит по крайней мере одну аминокислотную замену по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из:(i) аминокислоты, отличной от аргинина в положении, соответствующем позиции 48 в SEQ ID NO:1(к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота);(ii) аминокислоты, отличной от аргинина в положении, соответствующем позиции 49 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота); и(iii) аминокислоты, отличной от аргинина в положении, соответствующем позиции 51 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота). После димеризации полипептид связывается с комплексом, содержащим GFRalpha3 и RET. В некоторых воплощениях аминокислотная последовательность содержит аминокислоты, отличные от аргинина в позициях 48 и 49 в SEQ ID NO:1. К примеру, остатки аргинина в позициях 48 и 49 вSEQ ID NO:1 могут быть замещены на неконсервативные аминокислотные остатки (например, глутаминовую кислоту).-1 013565 В некоторых воплощениях аминокислотная последовательность по крайней мере на 90%, по крайней мере на 95% или по крайней мере на 98% идентична аминокислотам 15-113 в последовательностиSEQ ID NO:2, аминокислоты 15-113 в последовательности SEQ ID NO:3, аминокислоты 15-113 в последовательности SEQ ID NO:4, аминокислоты 15-113 в последовательности SEQ ID NO:5,аминокислоты 15-113 в последовательности SEQ ID NO:8 или аминокислоты 15-113 в последовательности SEQ ID NO:9. В некоторых воплощениях полипептид содержит аминокислоты 10-113 в последовательностиSEQ ID NO:9. В некоторых воплощениях полипептид содержит аминокислотную последовательность,приведенную в SEQ ID NO:2, аминокислотную последовательность, приведенную в SEQ ID NO:3,аминокислотную последовательность, приведенную в SEQ ID NO:4, аминокислотную последовательность, приведенную в SEQ ID NO:5, аминокислотную последовательность, приведенную в SEQ ID NO:8,или аминокислотную последовательность, приведенную в SEQ ID NO:9. Также раскрывается полипептид, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 в последовательности SEQ ID NO:1, где аминокислотная последовательность полипептида содержит по крайней мере одну аминокислотную замену по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из:(i) аминокислоты, отличной от серина в положении, соответствующем позиции 20 в SEQ ID NO:1(к примеру, серин замещается на неконсервативный аминокислотный остаток);(ii) аминокислоты, отличной от глутамина в положении, соответствующем позиции 21 вSEQ ID NO:1 (к примеру, глутамин замещается на неконсервативный аминокислотный остаток);(iii) аминокислоты, отличной от гистидина в положении, соответствующем позиции 32 вSEQ ID NO:1 (к примеру, гистидин замещается на неконсервативный аминокислотный остаток);(iv) аминокислоты, отличной от аргинина в положении, соответствующем позиции 33 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток);(v) аминокислоты, отличной от аргинина в положении, соответствующем позиции 39 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток);(vi) аминокислоты, отличной от серина в положении, соответствующем позиции 46 в SEQ ID NO:1(к примеру, серин замещается на неконсервативный аминокислотный остаток);(vii) аминокислоты, отличной от аргинина в положении, соответствующем позиции 68 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток);(viii) аминокислоты, отличной от глицина в положении, соответствующем позиции 72 вSEQ ID NO:1 (к примеру, глицин замещается на неконсервативный аминокислотный остаток);(ix) аминокислоты, отличной от серина в положении, соответствующем позиции 73 в SEQ ID NO:1(к примеру, серин замещается на неконсервативный аминокислотный остаток); и(х) аминокислоты, отличной от валина в положении, соответствующем позиции 94 в SEQ ID NO:1(к примеру, валин замещается на неконсервативный аминокислотный остаток). После димеризации полипептид связывается с комплексом, содержащим GFRalpha3 и RET. В некоторых воплощениях аминокислотная последовательность по крайней мере на 90%, по крайней мере на 95% или по крайней мере на 98% идентична аминокислотам 15-113 в последовательности SEQ ID NO:1. Также раскрывается полипептид, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 в последовательности SEQ ID NO:1, где аминокислотная последовательность содержит по крайней мере одну аминокислотную замену по сравнению с(i) аминокислоты, отличной от аргинина в положении, соответствующем позиции 7 в SEQ ID NO:1(к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота);(ii) аминокислоты, отличной от аргинина в положении, соответствующем позиции 9 в SEQ ID NO:1(к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота); и(iii) аминокислоты, отличной от аргинина в положении, соответствующем позиции 14 вSEQ ID NO:1 (к примеру, аргинин замещается на неконсервативный аминокислотный остаток, такой как глутаминовая кислота). После димеризации полипептид связывается с комплексом, содержащимGFRalpha3 и RET. В некоторых воплощениях аминокислотная последовательность по крайней мере на 90%, по крайней мере на 95% или по крайней мере на 98% идентична аминокислотам 15-113 в последовательности-2 013565 Изобретение также относится к конъюгатам, содержащим описанный в настоящем тексте полипептид, конъюгированный с неприродным полимером. Примером подобного полимера может служить водорастворимый синтетический полимер, такой как полиалкиленгликоль (к примеру, полиэтиленгликоль). Изобретение также относится к слитым белкам, содержащим описанный в настоящем тексте полипептид и гетерологичную аминокислотную последовательность. Изобретение также относится к димеру, содержащему два полипептида, конъюгата или слитых белка, описанных в настоящем тексте. Изобретение также относится к фармацевтической композиции, содержащей описанный в настоящем тексте полипептид, димер, конъюгат или слитый белок и фармацевтически приемлемый носитель или эксципиент. Также раскрывается нуклеиновая кислота, содержащая последовательность, кодирующую описанный в настоящем тексте полипептид, содержащий нуклеиновую кислоту экспрессионный вектор и клетка, содержащая экспрессионный вектор. Также раскрывается способ получения полипептида, включающий в себя следующие этапы:(i) подготовка клетки, содержащей экспрессионный вектор, в свою очередь содержащий нуклеиновую кислоту, кодирующую описанный в настоящем тексте полипептид; и(ii) культивирование клетки в условиях, способствующих экспрессии нуклеиновой кислоты. Изобретение также относится к способу лечения или профилактики заболевания нервной системы у млекопитающих, предполагающему введение млекопитающему терапевтически эффективных количеств описанных в настоящем тексте полипептида, димера, конъюгата, слитого белка или фармацевтической композиции. Изобретение также относится к способу лечения нейропатической боли у млекопитающих, предполагающему введение млекопитающему терапевтически эффективных количеств описанных в настоящем тексте полипептида, димера, конъюгата, слитого белка или фармацевтической композиции. Изобретение также относится к способу активации рецептора RET у млекопитающих, предполагающему введение млекопитающему эффективных количеств описанных в настоящем тексте полипептида, димера, конъюгата, слитого белка или фармацевтической композиции. Преимущество описанных в настоящем тексте выбранных вариантов полипептида нейбластина заключается в сниженной по сравнению с нейбластином дикого типа способности связывать гепарин. Снижение связывания с гепарином приводит к снижению клиренса модифицированных полипептидов invivo. Неожиданно было найдено, что вариант полипептида нейбластина, имеющий замещенные аминокислотные остатки в позициях 48 и 49, обладает значительно меньшей способностью связывать гепарин и значительно большей эффективностью и биодоступностью по сравнению с мутантными полипептидами, несущими одну аминокислотную замену, и/или нейбластином дикого типа. К примеру, было найдено, что двойной мутант демонстрирует приблизительно 185-кратное увеличение сывороточной экспозиции (serum exposure) по сравнению с нейбластином дикого типа. Помимо этого, было найдено, что данный двойной мутант демонстрирует более чем 5-кратное повышение уровня экспрессии in vitro по сравнению с нейбластином дикого типа, за счет чего облегчается получение белка в больших количествах. Преимущества и неожиданные возможности нейбластина позволяют использовать его для лечения индивидов с использованием меньших доз белка и/или удлиненными интервалами между введениями(по сравнению с белком дикого типа). Все технические и научные термины, встречающиеся в данном тексте, используются в тех значениях, в каких они обычно понимаются специалистами в данной области, если не указано иное. Хотя материалы и методы, сходные или эквивалентные описанным в данном тексте, могут быть использованы в практической реализации или тестировании настоящего изобретения, поясняющие материалы и методы приведены ниже. Все публикации, патентные заявки, патенты и другие упомянутые в данном тексте ссылки полностью включены в данный текст посредством ссылок. В случае конфликта будет использоваться настоящее описание, включая определения. Материалы, методы и примеры носят только иллюстративный характер и не являются ограничивающими. Другие особенности и преимущества настоящего изобретения станут очевидны из нижеследующего детального описания и формулы изобретения. Краткое описание чертежей На фиг. 1 изображено выравнивание пре-про-полипептидов нейбластина дикого типа человека(SEQ ID NO:10), мыши (SEQ ID NO:11) и крысы (SEQ ID NO:12). Левая и правая вертикальные линии обозначают старт зрелых аминокислотных форм длиной в 113 и 104 аминокислоты соответственно. Гепаринсвязывающий домен RRXR заключен в рамку. На фиг. 2 А изображен катионный элюционный профиль нейбластина дикого типа (пик D) и трех мутантов с замещением Arg на Glu (пики А, В и С; наклонная линия представляет собой теоретическую концентрацию хлорида натрия для каждого из элюированных с колонки объемов). Данные представлены в виде показателей OD280 для различных проб.-3 013565 На фиг. 2 В изображен элюционный профиль (колонка с гепарин-сефарозой) нейбластина дикого типа (пик Н) и трех мутантов с замещением Arg на Glu (пики Е, F и G; наклонная линия представляет собой теоретическую концентрацию хлорида натрия для каждого из элюированных с колонки объемов). Данные представлены в виде показателей OD280 для различных проб. На фиг. 3A, 3B изображены фотографии SDS/PAGE-электрофоретических гелей нейбластина дикого типа после анионной хроматографии в присутствии (2 А) и в отсутствии (2 В) гепарина. На фиг. 4 изображена диаграмма, описывающая результаты анализа связывания на клетках CHO. После SDS-PAGE-электрофореза и денситометрии значения OD нейбластина дикого типа и Arg48Eмутанта были соотнесены с концентрациями гепарина в каждой пробе. На фиг. 5 приведена диаграмма, описывающая результаты ELISA-теста на связывание гепарина с использованием человеческого NBN113 дикого типа, человеческого NBN140 дикого типа, а также мутантов Arg48E, Arg49E, Arg51E и Arg48, 49E. На фиг. 6 приведена диаграмма, описывающая результаты KIRA-анализа крысиного NBN113 дикого типа, Arg51E, Arg48E, Arg49E и крысиного NBN113. На фиг. 7 А приведена диаграмма, описывающая результаты KIRA-анализа человеческого нейбластина дикого типа, а также мутантного человеческого нейбластина (113-аминокислотная форма) Arg48,49E. На фиг. 7 В приведена диаграмма, описывающая результаты KIRA-анализа человеческого нейбластина дикого типа, а также мутантных форм человеческого нейбластина Arg48, 49E (104-аминокислотная форма), Arg48, 51E (113-аминокислотная форма) и Arg49, 51E (113-аминокислотная форма). На фиг. 8 приведена диаграмма, описывающая результаты анализа тройного комплекса, проведенного с использованием человеческого нейбластина дикого типа, а также мутантных форм нейбластинаArg48E, Arg49E, Arg51E, Arg48, 49E и Arg48, 49, 51E. На фиг. 9 приведена диаграмма, описывающая результаты анализа тройного комплекса, проведенного с использованием нейбластина дикого типа, а также мутантных форм нейбластина Arg48E, Arg49E,Arg51E, Arg48, 49E и Arg48, 49, 51E. На фиг. 10 приведена диаграмма, описывающая результаты фармакокинетического анализа нейбластина дикого типа и Arg48, 49E после одной подкожной болюсной инъекции в количестве 7 мг/кг (концентрации нейбластина в плазме определяли при помощи ELISA-теста для детекции нейбластина). На фиг. 11 приведена диаграмма, описывающая результаты фармакокинетического анализа нейбластина дикого типа и Arg48, 49E после одной внутривенной болюсной инъекции в количестве 1 мг/кг(концентрации нейбластина в плазме определяли при помощи ELISA-теста для детекции нейбластина). На фиг. 12 приведена диаграмма, описывающая результаты фармакокинетического анализа 2 Х 10K ПЭГилированного Arg48, 49E после одной подкожной болюсной инъекции в количестве 7 мг/кг (приведенные данные экстраполированы на 1 мг/кг), а также после внутривенного введения 1 мг/кг (концентрации нейбластина в плазме определяли при помощи ELISA-теста для детекции нейбластина). На фиг. 13 приведена диаграмма относительных уровней экспрессии нейбластина в СНО-клетках,трансфицированных плазмидами, кодирующими нейбластин дикого типа или Arg48, 49E. На фиг. 14 приведена диаграмма относительных уровней экспрессии нейбластина в лидирующих линиях СНО-клеток, трансфицированных двойными мутантами Arg48, 49E или нейбластином дикого типа. Подробное описание изобретения Настоящее изобретение относится к вариантам полипептида нейбластина, содержащим аминокислотные замены в определенных позициях. Согласно раскрытому в сопроводительных примерах было найдено, что определенные остатки полипептида нейбластина дикого типа важны для связывания с гепарином. Поскольку считается, что связывание с гепарином влияет на клиренс нейбластина in vivo, авторы ожидали, что замена одного или нескольких подобных остатков приведет к снижению связывания с гепарином и в соответствии с этим - к увеличению сывороточной экспозиции модифицированного полипептида. Полипептиды модифицированного нейбластина. Зрелый человеческий нейбластин дикого типа состоит из 113 аминокислот и имеет следующую аминокислотную последовательность: В настоящем изобретении раскрыты полипептиды с замещением одного или более определенных аминокислотных остатков в полипептиде нейбластина. Авторы ожидали, что мутации одного или более из подобных аминокислотных остатков должны привести к снижению или полному отсутствию связывания полученных вариантов полипептида нейбластинина с гепарином (по сравнению с нейбластином дикого типа). По сравнению с SEQ ID NO:1 вариант полипептида нейбластина содержит замену (i) остатка аргинина в одной или более из следующих позиций: 48, 49 или 51, и/или (ii) одного или более остаткаSer 46, Ser 73, GIy 72, Arg 39, Gln 21, Ser 20, Arg 68, Arg 33, His 32, Val 94, Arg 7, Arg 9 или Arg 14. В на-4 013565 стоящем тексте любое упоминание номера аминокислотной позиции в последовательности нейбластина относится к нумерации аминокислотных остатков в последовательности SEQ ID NO:1, если не указано иное. Аминокислотный остаток в последовательности нейбластина, предназначенный для замещения (к примеру, остаток аргинина в позиции 48, 49 и/или 51), может быть замещен неконсервативным аминокислотным остатком (к примеру, глутаминовой кислотой) либо консервативным аминокислотным остатком. Согласно детализированному в сопроводительных примерах замещение Arg48, Arg 49 и/или Arg 51 на неконсервативную аминокислоту может привести к получению варианта полипептида нейбластина со сниженной гепаринсвязывающей активностью, однако сохраненной (либо даже повышенной) биологической активностью нейбластина. Примеры аминокислот, которые могут быть использованы для замены идентифицированных аминокислотных остатков (к примеру, остатка аргинина в позиции 48, 49 и/или 51), включают в себя глутаминовую кислоту, аспарагиновую кислоту и аланин. После димеризации биологически активный вариант полипептида нейбластина связывается с трехкомпонентным комплексом, содержащим GFRalpha3 и RET. Любой метод детекции связывания этого комплекса может быть использован для изучения биологической активности варианта полипептида нейбластина. Примеры аналитических методов детекции способности вариантов полипептида нейбластина связывать трехкомпонентный комплекс описаны в WO 00/01815 и примере 7. Вариант полипептида нейбластина также может быть проанализирован на способность к запуску нейбластинового сигнального каскада. К примеру, анализ активации рецепторной киназы (KIRA), описанный в примере 6, может быть использован для анализа способности варианта полилептида нейбластина индуцировать аутофосфорилирование RET (см. также Sadick et al., 1996, Anal. Biochem., 235(2):207). Помимо идентифицированных специфических аминокислотных замен, вариант полипептида нейбластина также может содержать одну или более добавочных аминокислот, одну или более аминокислотную замену и/или делецию в других аминокислотных позициях в соответствии с описанным в нижеследующих разделах. Помимо одной или более аминокислотных замен, описанных в настоящем тексте, варианты полипептида нейбластина могут иметь различную длину. Несмотря на то что зрелый полипептид человеческого нейбластина состоит из 113 С-концевых аминокислот пре-про-нейбластина, не все из 113 аминокислот необходимы для достижения достаточной биологической активности. Возможно концевое укорочение. Таким образом, модифицированный полипептид нейбластина может содержать одну или более из описанных в настоящем тексте аминокислотных замен в контексте 99, 100, 101, 102, 103, 104, 105, 106,107, 108, 109, 110, 111, 112 или 113 С-концевых аминокислот в последовательности SEQ ID NO:1 (т.е. длина полипептида составляет 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 или 113 аминокислот). Помимо одной или более аминокислотных замен, описанных в настоящем тексте (и необязательно описанного выше укорочения), варианты полипептида нейбластина могут отличаться по аминокислотной последовательности. В частности, некоторые аминокислотные замены могут быть введены в последовательность нейбластина без сколь-нибудь значимой потери биологической активности нейбластина. В типичных воплощениях полипептид (i) содержит одну или более из описанных в настоящем тексте аминокислотных замен и (ii) по крайней мере на 70, 80, 85, 90, 95, 98 или 99% идентичен последовательности SEQ ID NO:1 (либо на 70, 80, 85, 90, 95, 98 или 99% идентичен аминокислотам 15-113 в последовательности SEQ ID NO:1). Вариант полипептида нейбластина, последовательность которого отличается отSEQ ID NO:1 (либо отличается от аминокислот 15-113 SEQ ID NO:1), может содержать одну или более замену консервативных аминокислот, одну или более замену неконсервативных аминокислот и/или одну или более делецию или инсерцию. На фиг. 1 изображено выравнивание последовательностей пре-про-полипептида нейбластина человека, мыши и крысы. Вертикальные линии на фиг. 1 обозначают старт зрелой 113-аминокислотной формы (левая вертикальная линия) и 104-аминокислотной формы (правая вертикальная линия) нейбластина. Гепаринсвязывающий мотив RRXR заключен в рамку. Данное выравнивание природных биоактивных форм нейбластина выявляет специфические типичные остатки (т.е. неконсервативные у человека, мыши и крысы), которые могут быть замещены без элиминирования биоактивности. Процент идентичности между аминокислотными последовательностями может быть рассчитан при помощи программы BLAST 2.0. Сравнение последовательностей может быть проведено при помощи безразрывного выравнивания с параметрами по умолчанию (матрица - Blossom 62, оценка значимости разрыва в гомологии = 11, оценка значимости разрыва в гомологии на один остаток = 1 и соотношение лямбда = 0,85). Математический алгоритм, используемый в программе BLAST, описан в публикацииAltschul et al., 1997, Nucleic Acids Research, 25:3389-3402. Консервативная замена представляет собой замену одной аминокислоты на другую со схожими характеристиками. Консервативные замены включают в себя замены, произведенные в пределах следующих групп: валин, аланин и глицин; лейцин, валин и изолейцин; аспарагиновая и глутаминовая кислоты; аспарагин и глутамин; серин, цистеин и треонин; лизин и аргинин; фенилаланин и тирозин. Неполярные-5 013565 гидрофобные аминокислоты включают в себя аланин, лейцин, изолейцин, валин, пролин, фенилаланин,триптофан и метионин. Полярные нейтральные аминокислоты включают в себя глицин, серин, треонин,цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные аминокислоты) включают в себя аргинин, лизин, и гистидин. Негативно заряженные (кислые) аминокислоты включают в себя аспарагиновую и глутаминовую кислоты. Любая замена одной аминокислоты из вышеперечисленных групп полярных, основных или кислых аминокислот на другую аминокислоту из той же группы может рассматриваться как консервативная. Неконсервативные замены включают в себя замены, при которых(i) остаток, имеющий электроположительную боковую цепь (к примеру, Arg, His или Lys), замещает либо замещается на электроотрицательный остаток (к примеру, Glu или Asp);(ii) гидрофильный остаток (к примеру, Ser или Thr) замещает либо замещается на гидрофобный остаток (к примеру, Ala, Leu, Ile, Phe или Val);(iii) цистеин или пролин замещает или замещается на любой другой остаток либо(iv) остаток с объемной гидрофобной или ароматической боковой цепью (к примеру, Val, Ile, Phe или Trp) замещает либо замещается на остаток с меньшей боковой цепью (к примеру, Ala, Ser) либо без таковой (к примеру, Gly). Примеры полипептидов модифицированного нейбластина раскрыты в таблице. Аминокислотные остатки полипептидов модифицированного нейбластина, мутированные по отношению к соответствующей позиции в полипептиде дикого типа, выделены жирным шрифтом и подчеркнуты. Помимо этого,в таблице продемонстрированы полипептиды нейбластина (длиной 113, 99 и 104 аминокислоты), использованные в качестве основ для аминокислотных замен. Полипептиды модифицированного нейбластина-6 013565 Варианты полипептида нейбластина могут быть необязательно связаны с полимером (к примеру, с полиалкиленгликолем, таким как полиэтиленгликоль). В некоторых воплощениях полимер связан с полипептидом по сайту, соответствующему N-концу полипептида нейбластина. В некоторых воплощениях вариант полипептида нейбластина содержит по крайней мере одну аминокислотную замену по сравнению с последовательностью SEQ ID NO:1 (либо по сравнению с аминокислотами 15-113 в последовательности SEQ ID NO:1), предоставляющую полученному полипептиду внутренний сайт для конъюгирования полимера. В некоторых воплощениях полимер связан с вариантом полипептида нейбластина по остатку в позиции (нумерация в соответствии с последовательностью SEQ ID NO:1), выбранной из группы, содержащей позицию 14, позицию 39, позицию 68 и позицию 95. Примеры модификаций нейбластина, содержащих внутренний сайт для конъюгации с полимером, описаны в WO 02/060929 и WO 04/069176 (содержание которых включено в данное описание посредством ссылки). Помимо вышеописанных аминокислотных замен в варианте полипептида нейбластина, полипептид также может необязательно содержать гетерологичные аминокислотные последовательности. Термин"гетерологичная" в отношении аминокислотной последовательности относится к последовательности,происходящей из источника, отличающегося от данной конкретной клетки-хозяина, либо в случае происхождения этой клетки является модифицированной по отношению к изначальной форме. Примеры гетерологичных последовательностей включают в себя гетерологичные сигнальные последовательности(к примеру, сигнальная последовательность нативного крысиного альбумина, модифицированная крысиная сигнальная последовательность либо сигнальная последовательность человеческого гормона роста),либо последовательности, используемые для очистки варианта полипептида нейбластина (к примеру,гистидиновый тэг). Полипептиды нейбластина могут быть выделены при помощи известных в данной области способов. Природные полипептиды нейбластина могут быть выделены из клеточных или тканевых источников при помощи стандартных методов очистки белков. Альтернативно, мутированные полипептиды нейбластина могут быть синтезированы при помощи стандартных методов пептидного синтеза. Синтез коротких аминокислотных последовательностей широко известен в данной области. См., к примеру, Stewart, etal., Solid Phase Peptide Synthesis (2nd ed., 1984). В некоторых воплощениях варианты полипептида нейбластина могут быть получены при помощи технологии рекомбинантной ДНК. К примеру, молекула нуклеиновой кислоты, кодирующая вариант полипептида нейбластина, может быть вставлена в вектор, к примеру экспрессионный вектор, и нуклеиновая кислота может быть введена в клетку. Подходящие клетки включают в себя клетки млекопитающих (такие как человеческие клетки или клетки СНО), клетки грибов, дрожжей, насекомых или бактерий. В случае экспрессии в рекомбинантной клетке последняя предпочтительно культивируется в условиях, способствующих экспрессии варианта полипептида нейбластина. Вариант полипептида нейбластина может быть при необходимости получен из клеточной суспензии. Используемый в настоящем тексте термин "получен" означает, что мутантный полипептид очищается от компонентов клеток или культуральной среды, в которых он находился до процесса выделения. Процесс получения может включать в себя один или более этапов рефолдинга или очистки. Варианты полипипептида нейбластина могут быть сконструированы любыми известными в данной области методами. Одним из подобных методов является сайт-направленный мутагенез, при котором определенный нуклеотид (или при желании - небольшое число определенных нуклеотидов) замещается с целью изменения соответствующей аминокислоты (или при желании - небольшого числа соответствующих аминокислотных остатков) в кодируемом полипептиде модифицированного нейбластина. Множество наборов для сайт-направленного мутагенеза являются коммерчески доступными. Один из подобных наборов - "Transformer Site Directed Mutagenesis Kit" (Clontech Laboratories, Palo Alto, CA). Фармацевтические композиции. Варианты полипептида нейбластина могут быть включены в фармацевтическую композицию, содержащую терапевтически эффективное количество полипептида и один или более адъювантов, наполнителей, носителей и/или разбавителей. Приемлемые разбавители, носители и наполнители обычно не оказывают негативных эффектов на гомеостаз реципиента (к примеру, на электролитный баланс). Приемлемые носители включают в себя биосовместимые, инертные или биоабсорбируемые соли, буферные агенты, олиго- или полисахариды, полимеры, агенты, увеличивающие вязкость, консерванты и т.д. Примером носителя может служить физиологический раствор соли (0,15 М NaCl, pH 7,0-7,4). Другими примерами носителя могут служить 50 мМ фосфата и 100 мМ NaCl. Дальнейшие воплощения по применению и введению фармацевтических композиций могут быть найдены, к примеру, в книге "REMINGTON'S PHARMACEUTICAL SCIENCES" (Maack Publishing Co., Easton, Pa.). Введение фармацевтической композиции, содержащей вариант полипептида нейбластина, может быть системным или местным. Фармацевтические композиции могут быть приготовлены таким образом,чтобы быть применимыми для парентерального и/или непарентерального введения. Характерные способы введения включают в себя подкожное, внутривенное, внутримышечное, чрескожное, внутрибрюшинное, интратекальное, пероральное, ректальное, буккальное, топическое, интраназальное, офтальмическое, внутрисуставное, внутриартериальное, субарахноидальное, лимфатическое, вагинальное и внутри-7 013565 уретральное введение. Композиции, пригодные для парентерального введения, содержат стерильный водный препарат варианта полипептида нейбластина, предпочтительно изотонический с кровью реципиента (к примеру, физиологический раствор соли). Композиции могут быть приготовлены в виде форм для однократного либо многократного введения. Типичная композиция согласно настоящему изобретению содержит описанный в настоящем тексте вариант полипептида нейбластина и следующие буферные компоненты: сукцинат натрия (к примеру,10 мМ); NaCl (к примеру, 75 мМ) и L-аргинин (к примеру, 100 мМ). Композиции, пригодные для перорального введения, могут быть приготовлены в виде дискретных дозировочных единиц, таких как капсулы, крахмальные капсулы, таблетки или пастилки, содержащих заданное количество варианта полипептида нейбластина; либо подобные композиции могут быть приготовлены в виде суспензии в водной или неводной жидкости - в виде сиропа, эликсира, эмульсии либо иного жидкого лекарства. Терапевтически эффективные количества фармацевтической композиции могут быть введены индивиду, нуждающемуся в подобном лечении, в дозировочном режиме, установленном специалистом в данной области. К примеру, композиция может быть введена индивиду, например, системно в дозировке от 0,01 до 1000 мкг/кг массы тела индивида в расчете на одну дозу. В другом примере дозировка составляет от 1 до 1000 мкг/кг массы тела индивида в расчете на одну дозу. В другом примере дозировка составляет от 1 до 30 мкг/кг массы тела индивида в расчете на одну дозу, к примеру от 3 до 10 мкг/кг массы тела индивида в расчете на одну дозу. Для оптимизации терапевтической эффективности вначале вариант полипетид нейбластина вводится в различных дозировочных режимах. Единица и режим дозировки зависят от факторов, включающих в себя, к примеру, вид млекопитающего, иммунный статус и массу тела млекопитающего. В типичном случае уровни белка в тканях подвергаются мониторингу при помощи подходящих скрининговых методов в рамках процедуры клинического тестирования, к примеру определения эффективности режима лечения. Определение частоты введения варианта полипептида нейбластина находится в рамках компетенции и клинической экспертизы врачей-клиницистов. В типичном случае режим введения определяется в клинических испытаниях, определяющих оптимальные параметры введения. Тем не менее в реальной практике допустимо варьирование определенных режимов в соответствии с возрастом, здоровьем, весом,полом и медицинским статусом индивида. Частота введения также может варьироваться в зависимости от типа нейропатии - острой либо хронической. Помимо этого, частота введения также может варьироваться в зависимости от цели введения - профилактической или терапевтической. Способы лечения. Варианты полипептида нейбластина применимы для регулировки метаболизма, дифференцировки и выживания нерва или нейрональной клетки. В частности, варианты полипептида нейбластина могут быть применены для лечения или частичного облегчения симптомов нарушения/расстройства или заболевания живого существа, к примеру человека, в случае, если данное нарушение/расстройство или заболевание отвечает на лечение нейротрофическим агентом. Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы в лечении нарушений, характеризующихся повреждением сенсорных нейронов или ганглиозных клеток сетчатки, в том числе ганглиозных нейронов заднего корешка спинного мозга, либо нейронов любой из нижеследующих тканей: коленчатый, каменистый и нодозный ганглий; вестибуло-акустический комплекс восьмого черепно-мозгового нерва; вентролатеральный полюс челюстной доли тройничного ганглия, тройничное мезенцефалическое ядро. В некоторых воплощениях воздействие может оказываться на сенсорные нейроны и/или нейроны автономной нервной системы. В частности, может быть оказано воздействие на ноцицептивные и механорецептивные нейроны, в частности на А-дельта волокна, С-волокна и А-бета волокна. Помимо этого,воздействие может оказываться на симпатические и парасимпатические нейроны автономной нервной системы. В некоторых воплощениях лечебное воздействие может оказываться при заболеваниях моторных нейронов, таких как боковой амиотрофический склероз (БАС) и спинальная мускульная атрофия. В других воплощениях варианты полипептида нейбластина могут быть использованы для улучшения восстановления нервов после повреждения в результате травмы. Альтернативно либо помимо этого, может быть использован "канал направления нерва" с матрицей, содержащей конъюгированные с полимером варианты полипептида нейбластина, либо слитые продукты или конъюгаты вариантов полипептида нейбластина. Подобные каналы направления нервов раскрыты, к примеру, в патенте США 5834029. В некоторых воплощениях варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы для лечения различных заболеваний глаза, в том числе характеризующихся потерей фоторецепторов сетчатки у пациентов, страдающих дистрофией желтого пятна, пигментным ретинитом, глаукомой и другими подобными заболеваниями.-8 013565 В некоторых воплощениях варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы для лечения: нейропатической боли, тактильной аллодинии,потери болевой чувствительности, ассоциированной с нейропатией, вирусных инфекций и вирусассоциированной нейропатии, боли, ассоциированной с диабетической нейропатией, и заболеваний нервной системы. Данные способы лечения детально описаны в нижеследующих подразделах. 1. Лечение нейропатической боли. Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы в способах лечения нейропатической боли у индивида, включающих в себя введение индивиду эффективного количества варианта полипептида нейбластина в виде монотерапии либо вместе с эффективным количеством обезболивающего препарата,выбранного из группы, состоящей из опиатов, антиаритмических препаратов, топических анальгетиков,местных анальгетиков, антиконвульсантов, антидепрессантов, кортикостероидов и нестероидных противовоспалительных препаратов (НСПВП). В одном из воплощений обезболивающим препаратом является антиконвульсант. В другом воплощении обезболивающим препаратом является габапентин 1-аминометил)циклогексануксусная кислота) либо прегабалин (S-(+)-4-амино-3-(2-метилпропил)бутановая кислота). Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы в лечении нейропатической боли, ассоциированной с периферическими нейропатиями. Среди периферических нейропатий, в лечении которых могут применяться варианты полипептида нейбластина, можно отметить нейропатии, ассоциированные с травмой, к примеру вызванные физическим повреждением или болезненным состоянием, физические повреждения головного или спинного мозга, инсульт, ассоциированный с повреждением головного мозга, и неврологические нарушения, связанные с нейродегенерацией. Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы в лечении множества нейропатий, включающих в себя:(с) токсин-индуцированные нейропатии (включающие в себя, но не ограниченные нейропатиями,индуцированными интоксикацией алкоголем, витамином В 6, гексакарбоновой интоксикацией, интоксикацией амиодароном, хлорамфениколом, дисульфирамом, изониазидом, золотом, литием, метронидазолом, мизонидазолом, нитрофурантоином);(d) нейропатии, в том числе нейропатическая боль, индуцированные лекарственными препаратами(такими как противоопухолевые агенты, в особенности выбранные из группы, состоящей из таксола, таксотера, цисплатина, нокодазола, винкристина, виндезина и винбластина; а также такими как противовирусные препараты, в особенности выбранные из группы, состоящей из ddI, DDC, d4T, фоскарнета, дапзона, метронидазола и изониазида);(е) нейропатии, индуцированные дефицитом витаминов (включая, без ограничений, дефицит витамина В 12, дефицит витамина В 6, дефицит витамина Е);(m) инфекционные и вирусные нейропатии (включающие, без ограничений, нейропатии, ассоциированные с лепрой, болезнью Лайма, нейропатические боли, ассоциированные с вирусной инфекцией, в частности с инфицированием вирусом, выбранным из группы, содержащей герпесвирус (к примеру,herpes zoster, инфекция которого может приводить к постгерпетической невралгии), вирус иммунодефицита человека (ВИЧ) и папилломавирус);(n) аутоиммунные нейропатии (включающие, без ограничений, синдром Гийена-Барре, хроническую воспалительную демиелинизирующую нейропатию, моноклональную гаммапатию неизвестной этиологии и полинейропатию;(о) невралгию тройничного нерва и синдромы защемления (включающие, без ограничения, синдром запястного канала) и(р) другие синдромы, сопровождающиеся нейропатической болью, в том числе посттравматическую невралгию, фантомные боли в ампутированных конечностях, боли при рассеянном склерозе, комплексные синдромы региональной боли (включающие, без ограничений, рефлекторную симпатическую дистрофию, каузалгию), боли при онкологических заболеваниях, нейропатии при васкулите/ангиопатии,-9 013565 ишиалгию. Нейропатическая боль может проявляться в виде аллодинии, гиперальгезии, в виде спонтанных или фантомных болей. 2. Лечение тактильной аллодинии. Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы при лечении тактильной аллодинии у индивида. В типичном случае термин "тактильная аллодиния" относится к состоянию индивида, при котором боль провоцируется стимуляцией кожи (к примеру, прикосновением), в норме не вызывающей боли. В некоторых воплощениях тактильная аллодиния может лечиться путем введения индивиду фармацевтически эффективных количеств варианта полипептида нейбластина. В родственном воплощении тактильная аллодиния может лечиться путем введения индивиду фармацевтически эффективных количеств варианта полипептида нейбластина в виде монотерапии либо вместе с эффективным количеством обезболивающего препарата, выбранного из группы, состоящей из опиатов, антиаритмических препаратов, топических анальгетиков, местных анальгетиков, антиконвульсантов, антидепрессантов, кортикостероидов и нестероидных противовоспалительных препаратов (НСПВП). В одном из воплощений обезболивающим препаратом является антиконвульсант. В другом воплощении обезболивающим препаратом является габапентин 1-аминометил)циклогексануксусная кислота либо прегабалин (S-(+)-4-амино-3-(2 метилпропил)бутановая кислота). В некоторых воплощениях вариант полипептида нейбластина вводится совместно с терапевтическим агентом, включающим, без ограничений, противоопухолевый препарат или противовирусный агент. Противораковые агенты включают в себя, без ограничений, таксол, таксотер, цисплатин, нокодазол, винкристин, виндезин и винбластин. Противовирусные агенты включают в себя, без ограничений,ddI, DDC, d4T, фоскарнет, дапзон, метронидазол и изониазид. 3. Лечение снижения потери болевой чувствительности. В другом воплощении раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы в способах лечения потери болевой чувствительности у индивида, страдающего нейропатией. В одном воплощении нейропатией является диабетическая нейропатия. В некоторых воплощениях потеря болевой чувствительности представляет собой потерю температурной болевой чувствительности. Данные способы включают в себя как профилактическое, так и терапевтическое лечение. При профилактическом лечении вариант полипептида нейбластина вводится индивиду, входящему в группу высокого риска по развитию потери болевой чувствительности (в отношении подобного индивида ожидается, что у последнего - ранняя стадия нейропатии). В этом случае лечение вариантом полипептида нейбластина служит в качестве превентивного лечения у пациентов высокого риска. При терапевтическом лечении вариант полипептида нейбластина вводится индивиду, страдающему потерей болевой чувствительности в результате нейропатии (в отношении подобного индивида ожидается, что у последнего - поздняя стадия нейропатии). В этом случае лечение вариантом полипептида нейбластина служит для восстановления у индивида адекватной болевой чувствительности. 4. Лечение вирусных инфекций и вирус-ассоциированных нейропатий. Рассмотрено профилактическое лечение инфекционных и вирусных нейропатий. Профилактическое лечение показано в случае диагностированной вирусной инфекции до появления нейропатической боли. В ходе лечения вариант полипептида нейбластина вводится для предотвращения появления нейропатической боли, в том числе, без ограничений, нейропатической боли, ассоциированной с лепрой, болезнью Лайма, нейропатической боли, ассоциированной с вирусной инфекцией, в частности с вирусом, выбранным из группы, содержащей герпесвирус (и более конкретно, herpes zoster, инфекция которым может приводить к постгерпетической невралгии), вирус иммунодефицита человека(ВИЧ) и папилломавирус. В альтернативном воплощении вариант полипептида нейбластина вводится для уменьшения нейропатической боли в случае ее появления. Симптомы острой вирусной инфекции часто включают в себя появление сыпи. Другие симптомы включают в себя, к примеру, развитие персистирующей боли в пораженной области тела, что является распространенным последствием инфекции вирусом herpes zoster (опоясывающий лишай). Постгерпетическая невралгия может длиться несколько месяцев и более, а также может появиться спустя несколько месяцев после исчезновения сыпи и других подобных симптомов. 5. Лечение боли при диабетической нейропатии. Рассмотрено профилактическое лечение боли при диабетической нейропатии. Профилактическое лечение диабетических нейропатий должно быть назначено после первичного диагноза диабета или ассоциированных с диабетом симптомов и до появления нейропатической боли. Профилактическое лечение боли при диабетической нейропатии может быть также назначено после отнесения индивида к группе риска по развитию диабета или ассоциированных с диабетом симптомов. В ходе лечения вариант полипептида нейбластина вводится для предотвращения появления нейропатической боли. В альтернативном воплощении вариант полипептида нейбластина вводится для уменьшения нейропатической боли в случае ее появления.- 10013565 6. Лечение нарушений нервной системы. Раскрытые в настоящем тексте варианты полипептида нейбластина (и содержащие их фармацевтические композиции) могут быть использованы для лечения или предотвращения нарушения нервной системы у индивида (такого как человек) путем введения индивиду, нуждающемуся в подобном лечении,терапевтически эффективного количества варианта полипептида нейбластина, фармацевтической композиции, содержащей вариант полипептида. нейбластина, либо комплекса, включающего стабильный водорастворимый конъюгат варианта полипептида нейбластина, связанного с полиалкиленовым фрагментом, таким как ПЭГ. Нарушением нервной системы может быть нарушение периферической нервной системы, такое как периферическая нейропатия или нейропатический болевой синдром. Люди являются предпочтительными субъектами для проведения лечения. Вариант полипептида нейбластина может быть применен для лечения нейронального дефекта,включая, без ограничений, повреждения и травмы нейронов. Периферические нервы, подвергающиеся травме, включают, без ограничений, нервы спинного мозга. Варианты полипептида нейбластина могут быть использованы для лечения нейродегенеративных заболеваний, к примеру ишемических поражений нейронов коры головного мозга; нейропатии, к примеру периферической нейропатии, болезни Альцгеймера, болезни Хантингтона, болезни Паркинсона, бокового амиотрофического селероза (БАС). Подобные варианты полипептида нейбластина могут быть использованы для лечения нарушений памяти, к примеру, ассоциированных с деменцией. Ниже следуют примеры практических воплощений изобретения. Данные примеры не должны быть интерпретированы как каким-либо образом ограничивающие спектр практических воплощений изобретения. Примеры Пример 1. Конструирование и синтез вариантов полипептида нейбластина. Человеческий нейбластин был получен в виде кристалла, и анализ его структуры выявил триаду сульфат-ионов, связывающихся со следующими четырьмя аминокислотными остатками нейбластина в тесной близости друг к другу: Arg 14, Arg 48, Arg 49 и Arg 51. На основании их взаимного расположения,а также на основании присутствия данной триады было предположено, что данный регион нейбластина может быть потенциальным гепарин-связывающим сайтом. Далее, решенная ранее структура гепаринсульфата была протестирована in silico на связывание с нейбластином в области сульфатной триады последнего. Гепаринсульфат связывался точно в области сульфатной триады нейбластина, что говорит о потенциальной гепарин-связывающей функции данного региона нейбластина. Данные, полученные в результате анализа кристаллической структуры нейбластина, также выявили наличие следующих аминокислотных остатков, предоставляющих дополнительные сайты связывания для триады сульфат-ионов либо для одного или более из трех других сульфат-ионов, связывающихся с нейбластином: Ser 46, Ser 73, Gly 72, Arg 39, Gln 21, Ser 20, Arg 68, Arg 33, His 32 и Val 94. Помимо сульфат-связывающих сайтов нейбластина, выявленных в ходе анализа кристаллической структуры, нейбластин также содержит консенсусную последовательность гепаринсульфат-связывающего сайта(GPGSRAR) - с 3 по 9 аминокислотный остаток на N-конце. В кристаллической структуре данный регион был неструктурирован, однако он может быть структурирован в результате связывания с гликозаминогликанами. Данный регион, вероятно, пространственно близок к трехсульфатному кластеру, наблюдаемому в кристалле (Arg 14 относится к гепарин-связывающему сайту, локализованному главным образом в шарнирном участке белка). Для изучения биологической значимости потенциального гепарин-связывающего домена, было выполнено замещение трех индивидуальных аминокислотных остатков в зрелом 113-аминокислотном нейбластине человека (SEQ ID NO:1). Остатки аргинина в каждой из позиций 48 (модификация "Arg 48E";SEQ ID NO:2), 49 (модификация "Arg 49E"; SEQ ID NO:3) и 51 (модификация "Arg 51E"; SEQ ID NO:4) были замещены на глутамат (т.е. были получены три различных модифицированных конструкта с одной аминокислотной заменой - каждый) с целью замены остатка, заряженного таким образом, что он притягивает сульфат-ион, на остаток, заряженный таким образом, что он отталкивает сульфат-ион, а также с целью потенциальной стабилизации окружающих остатков аргинина. Белки были подвергнуты рефолдингу и выделены из телец включения Е.coli (см. патент WO 04/069176). Каждый из вариантов нейбластина был подвергнут анализу для верификации структурной целостности и наличия правильной аминокислотной замены. Все три мутанта были структурно сопоставимы с человеческим нейбластином дикого типа. Пример 2. Катионная хроматография и хроматография на гепарин-сефарозе. Варианты полипептида нейбластина были подвергнуты дальнейшему биохимическому анализу для выяснения влияния каждой из мутаций на связывание с гепарином. Были использованы катионная хроматография и хроматография на гепарин-сефарозе. Поскольку человеческий нейбластин дикого типа является основным белком с наблюдаемой pI 11,31, нейбластин эффективно связывается с катионными смолами. Единичная замена аргинина на глутамат приводила к снижению наблюдаемой pI до 10,88. Однако авторы не ожидали от подобного сниже- 11013565 ния pI значительного влияния ни на связывание с катионной смолой, ни на элюционный профиль мутантов по сравнению с контролем дикого типа. Каждый из мутантов (вместе с контрольным нейбластином дикого типа) был подвергнут катионной хроматографии. Пробы были помещены на смолу в буфере, содержащем 5 мМ фосфата, рН 6,5 и 150 мМ хлорида натрия, после чего была проведена элюция линейным градиентом соли, начиная со 150 мМ и заканчивая 1 М хлорида натрия. Нейбластин дикого типа элюировался при 800 мМ хлорида натрия(фиг. 2 А; пик D), в то время как каждый из мутантов элюировался при концентрации соли в районе 500 мМ, что отражает их сниженное значение pI. Arg 49E и Arg 51E (фиг. 2 А; пики В и С) элюировались при несколько более высокой концентрации соли, нежели была необходима для элюции Arg 48E(фиг. 2 А; пик А) (520 против 490 мМ соответственно). Данное различие может отражать более доступную поверхность Arg 48 и ее больший вклад в катионное связывание по сравнению с другими остатками аргинина, замещенными в других мутантах. Для выяснения эффекта замен Arg на Glu на связывание с гепарином каждый из трех мутантов(вместе с контрольным нейбластином дикого типа) был подвергнут хроматографии на гепарин-сефарозе(фиг. 2 В). Условия связывания со смолой и элюции были аналогичны таковым для катионной хроматографии. Однако элюционный профиль значительно отличался от такового, полученного при катионной хроматографии. Нейбластин дикого типа элюировался при концентрации хлорида натрия около 720 мМ(фиг. 2 В; пик Н), в то время как Arg 51E, Arg 49E и Arg 48E элюировались при 570 мМ (фиг. 2 В; пик G),510 мМ (фиг. 2 В; пик F) и 570 мМ (фиг. 2 В; пик Е) хлорида натрия соответственно. Замена Arg 48E оказывала в особенности сильное влияние на связывание с гепарином. В целом, данные хроматографические профили указывают на то, что каждая из мутаций снижает наблюдаемую аффинность связывания нейбластина с гепарином. Пример 3. Анионная хроматография. При стандартных условиях - рН 6,5 и концентрации хлорида натрия 150 мМ - нейбластин не связывается с анионными смолами. Напротив, гепаринсульфат в данных условиях связывается с анионными смолами. В случае, когда нейбластин был смешан с 16 кДа-гепаринсульфатом в молярном соотношении 1:1 и помещен на анионный матрикс при вышеуказанных условиях, нейбластин связывался и элюировался 600 мМ хлоридом натрия (фиг. 3B, дорожки "FT"), что указывает на то, что нейбластин связывается с анионным матриксом опосредованно за счет связывания с гепаринсульфатом. В отсутствие гепарина нейбластин не связывался с анионной смолой (фиг. 3A, дорожки "FT") и нейбластин не детектировался во фракции, элюированной 600 мМ хлоридом натрия (фиг. 3A, дорожки "Элюция"). Полученные данные предоставляют еще одно доказательство способности нейбластина связывать гепарин. Пример 4. Исследования связывания клеток яичника китайского хомячка. Ранее было показано, что нейбластин неспецифично связывается с поверхностью клеток яичников китайского хомячка (СНО-клетки). Анализ связывания нейбластина с СНО-клетками проводился с целью определения, является ли это связывание опосредованным, по крайней мере отчасти, связыванием нейбластина с молекулами гепаринсульфата на поверхности клеток. Человеческий нейбластин дикого типа (40 мкг) либо Arg 48E-мутант смешивали с СНО-клетками (106 клеток) при плотности последних,обеспечивающей полное связывание обеих форм гепарина, вместе с увеличивающимися количествами 16 кДа-гепаринсульфата и инкубировали при 37 С 4 ч. После инкубации клетки осаждали центрифугированием и несвязывавшийся нейбластин в супернатанте определяли SDS/PAGE-анализом. После денситометрической количественной оценки полосы белка полученные значения оптической плотности соотносили с соответствующими концентрациями гепаринсульфата в каждой из проб (фиг. 4). При двух наименьших концентрациях гепарина количества идентифицированных в супернатантах мутантного нейбластина и нейбластина дикого типа были равны. Однако при увеличении концентрации гепарина до 0,5 мкг/мл и выше количество идентифицированного в супернатанте нейбластина дикого типа было выше, нежели таковое Arg 48 Е-мутанта. Данное наблюдение указывает на то, что гепарин в супернатанте может конкурировать с гепарином, связанным с клеточной поверхностью, за связывание с нейбластином дикого типа (т.е. связывание гепарина в супернатанте с нейбластином приводит к удалению последнего с клеточной поверхности), в то время как гепарин не может столь же легко конкурировать за связывание с Arg 48 Е-мутантом. При наибольшей концентрации гепарина (50 мкг/мл) Arg 48 Емутант начинает элюироваться с клеточной поверхности, что указывает на то, что ионные взаимодействия между гепарином и Arg48 Е-мутантом могут быть причиной явления, лежащего в основе данного наблюдения. Пример 5. Связывание нейбластина дикого типа и вариантов полипептида нейбластина с гепарином. С целью дальнейшего изучения роли идентифицированной аргининовой триады в качестве гепарин-связывающего сайта нейбластина был разработан основанный на методе ELISA тест на связывание с гепарином. Краткое описание: моноклональные антитела к нейбластину иммобилизовали в лунках 96-луночных планшет, после чего планшеты промывали и добавляли одну из форм нейбластина. После- 12013565 этого добавляли биотинилированный гепарин, вновь промывали и комплексы гепарина с нейбластином детектировали при помощи конъюгата стрептавидина с пероксидазой хрена и хемилюминесцентного субстрата. Данный ELISA-тест на связывание с гепарином использовали для сравнения 113-аминокислотной формы (SEQ ID NO:1) и 104-аминокислотной формы (аминокислоты 10-113 в последовательности SEQ ID NO:1) человеческого нейбластина дикого типа с вариантами полипептида нейбластина, содержащими единичные аминокислотные замены (Arg 48E, Arg 49E и Arg 51E;SEQ ID NO:2-4), а также с полипептидом, содержащим двойную замену (Arg 48, 49E; SEQ ID NO:5). Обе формы нейбластина дикого типа связывались с гепарином с ЕС 501 нг/мл гепарина (фиг. 5).Arg 49E и Arg 51E связывались менее эффективно с наблюдаемой ЕС 5010 нг/мл, однако максимальное связывание оставалось таким же (фиг. 5). Среди трех единичных точечных мутаций Arg 48E оказывала наиболее яркий эффект на связывание с гепарином, с наблюдаемой ЕС 50100 нг/мл, однако максимальное связывание с гепарином все еще достигало значений, идентичных таковым для немодифицированных форм нейбластина (фиг. 5). Таким образом, Arg 48 Е-мутант связывал гепарин в 100 раз менее эффективно по сравнению с немодифицированными формами нейбластина и в 10 раз менее эффективно по сравнению с другими мутантами с единичными заменами. В случае двойного замещения Arg 48 и Arg 49 на глутамат гепарин-связывающая активность оказывалась почти полностью элиминированной, с семикратным снижением максимального связывания с гепарином, однако значение ЕС 50 оставалось в пределах, характерных для мутантов с единичными заменами. Данные результаты указывают на то, что Arg 48 играет важную роль в связывании гепарина возможно в силу центральной локализации предполагаемого гепарин-связывающего сайта. Пример 6. Анализ активации киназного рецептора нейбластином дикого типа и вариантами полипептида нейбластина с мутациями в гепарин-связывающем сайте. Для определения влияния мутаций в гепарин-связывающем сайте на сигнальный путь через рецептор нейбластина в клеточном анализе мутантные формы нейбластина и нейбластин дикого типа были исследованы при помощи анализа активации киназного рецептора (KIRA-анализа). Все мутанты с единичным замещением Arg на Glu в данном анализе демонстрировали идентичную немодифицированному контролю KIRA-активность, что указывает на структурное сходство с полипептидом дикого типа и способность активировать рецептор нейбластина и ассоциированный сигнальный каскад (фиг. 6). Более того, полученные данные указывают на то, что для активации рецептора не требуется связывание с гепарином. Двойной мутант Arg 48, 49E (SEQ ID NO:5; 113-аминокислотная форма) в KIRA-анализе демонстрировал сдвиг наблюдаемой ЕС 50 приблизительно на порядок влево с повышением максимальной активации рецептора по сравнению с контрольным человеческим нейбластином дикого типа (фиг. 7 А). Подобный же эффект повышения активности по сравнению с контрольным человеческим нейбластином дикого типа демонстрировал двойной мутант Arg 48, 49E (SEQ ID NO:7; 104-аминокислотная форма)(фиг. 7 В). Каждый из двойных мутантов Arg 48, 51E и Arg 49, 51E (SEQ ID NO:9 и SEQ ID NO:8 соответственно; 113-аминокислотные формы) демонстрировал KIRA-активность, схожую с немодифицированным контрольным нейбластином. Пример 7. Анализ тройного комплекса. Человеческий нейбластин дикого типа и каждый из мутантов в гепарин-связывающем сайте были проанализированы при помощи двух несколько различающихся протоколов. В первом протоколе компоненты рецептора нейбластина (GFRalpha3 и RET) комбинировали с нейбластином в единый пул и добавляли в лунки планшеты для ELISA с иммобилизованными антителами (фиг. 8). Во втором протоколе данные компоненты последовательно добавляли в лунки планшеты для ELISA в следующей последовательности: GFRalpha3, нейбластин и RET (фиг. 9). В эксперименте по протоколу, предусматривающему пулирование реагентов, максимальное связывание было достигнуто как с Arg 48E, так и с Arg 48, 49E,что указывает на то, что данные формы нейбластина обладают наивысшей аффинностью к своему рецептору. Нейбластин дикого типа связывался с аффинностью, схожей с таковой Arg 49E-мутанта, в то время как Arg 51E и тройной мутант (с замещенными на глутамат аминокислотными остатками Arg 48, 49 и 51) демонстрировали наихудшее связывание с рецептором. В эксперименте по протоколу, предусматривающему последовательное добавление компонентов,наилучшее связывание с рецептором демонстрировал Arg 48E. В то же время при данных условиях двойной мутант связывался с рецептором слабо с аффинностью, близкой к таковой Arg 51E-мутанта. Arg 49E и нейбластин дикого типа демонстрировали аффинность к рецептору, промежуточную между наблюдаемыми максимумом и минимумом связывания. Тройной мутант в данных условиях не связывался. В целом полученные данные указывают на то, что Arg 48 оказывает наибольшее влияние на аффинность связывания нейбластина с его рецептором.- 13013565 Пример 8. Исследование кругового дихроизма в ближнем и дальнем УФ-диапазонах. Для дальнейшего изучения эффектов двойного мутирования на вторичную и третичную структуры были изучены спектры кругового дихроизма двойного Arg 48, 49-мутанта в ближнем и дальнем УФ-диапазонах. Хотя незначительные отличия во вторичной и третичной структурах этих полипептидов были детектированы, конформация двойного мутанта была очень близка к таковой нейбластина дикого типа. Пример 9. Фармакокинетический анализ Arg 48, 49 Е-двойного мутанта человеческого нейбластина. Человеческий нейбластин демонстрирует неудовлетворительную фармакокинетику (ФК) при введении крысам внутривенно (в/в) или подкожно (п/к) с общей биодоступностью менее 1%. Клиренс за счет связывания с гепарином может быть одной из причин столь низкой биодоступности. Для ответа на вопрос, является ли клиренс за счет связывания с гепарином участником быстрого процесса выведения человеческого нейбластина из организма крысы, Arg 48, 49 Е-двойной мутант (вместе с контролем дикого типа) были изучены в ФК-анализе. Обе формы вводили отдельно крысам в дозировке 7 мг/кг п/к. Пробы сывороток крови собирали начиная с 1 ч и заканчивая 96-м и анализировали на нейбластин (фиг. 10). Наблюдаемая площадь под кривой (AUC) для нейбластина дикого типа составляла 109, в то время как наблюдаемая площадь под кривой (AUC) для двойного мутанта составляла 20145. Это соответствует 185-кратному увеличениюAUC двойного мутанта (по сравнению с нейбластином дикого типа) и значительному увеличению сывороточной экспозиции. Нейбластин дикого типа и двойной мутант нейбластина также были изучены в ФК-анализе в условиях в/в введения (1 мг/кг). Начальная концентрация двойного мутанта в плазме была приблизительно в 6 раз выше (ромбы) таковой контроля дикого типа (квадраты) спустя 5 мин после инъекции, однако в течение 1 ч быстро сравнивалась с концентрацией полипептида дикого типа (фиг. 11). Полученные данные указывают на то, что двойное мутирование увеличивает сывороточную экспозицию, однако не оказывает эффекта на общую скорость выведения. Вместе с результатами ФК-анализа в условиях п/к введения полученные данные указывают на то,что связывание с гепарином в особенности релевантно в условиях подкожного введения, что, возможно,приводит к подобию эффекта депо. Как только нейбластин поступает в циркуляцию, скорость выведения молекул дикого типа и двойного мутанта приблизительно одинаковы. Для изучения скорости выведения нейбластина из циркуляции в организме крысы двойная мутантная форма нейбластина, а также нейбластин дикого типа были подвергнуты ПЭГилированию 10 кДа ПЭГ с использованием основанной на SPA конъюгационной химии. Поскольку нейбластин представляет собой гомодимер без нативных остатков лизина, 10 кДа фрагменты специфично метят N-конец каждого из мономеров. 2 Х 10K ПЭГилированный человеческий нейбластин с двойным мутированием был очищен до гомогенности и проанализирован с использованием структурных и биологических методов до ФК-анализа. 2X10K ПЭГилированный Arg 48, 49 Е-двойной мутант вводили крысам в/в (1 мг/кг) или п/к(7 мг/кг) и в разные временные точки собирали сыворотку для анализа. После в/в введения концентрация 2X10K ПЭГилированного двойного мутанта достигала теоретической Cmax=10 мкг/мл (ромбы) с типичными альфа- и бета-фазами (фиг. 12). П/к введение ПЭГилированного двойного мутанта демонстрировало Cmax=40 мкг/мл спустя 24 ч после инъекции (фиг. 12). После поступления препарата в циркуляцию наблюдаемая скорость клиренса соответствовала таковой при в/в введении. Биодоступность данного конструкта составляла приблизительно 10% по сравнению с менее чем 1% неПЭГилированного или ПЭГилированного человеческого нейбластина дикого типа. Пример 10. Экспрессия мутантного нейбластина со сниженной гепарин-связывающей активностью в клетках яичника китайского хомячка. Плазмидные конструкты, кодирующие человеческие мутантный нейбластин и нейбластин дикого типа, экспрессировали в СНО-клетках и количества секретируемого растворимого белка измеряли методом ELISA. Использованные в данных экспериментах плазмидные конструкты кодируют слитый белок,содержащий сигнальную последовательность человеческого гормона роста (SigPep) (с включением интрона в плазмиду или без него), соединенную с (i) 104 С-концевыми аминокислотами человеческого нейбластина дикого типа, либо (ii) Arg 48, 49 Е-двойной мутант double mutant (104-аминокислотная форма). Ниже следуют последовательности слитых белков нейбластина, использованных в данных экспериментах. Последовательности нейбластина напечатаны прописными буквами. Последовательности сигнального пептида человеческого гормона роста напечатаны строчными буквами. Соединения последовательностей сигнального пептида и нейбластина отмечено значком " ". Аминокислоты в позициях 48 и 49 подчеркнуты. СНО-клетки трансфицировали плазмидами, кодирующими каждую из вышеупомянутых форм нейбластина, и культивировали в 384-луночных планшетах. Спустя несколько недель, растущие клетки пересаживали в свежие 96-луночные планшеты. Для определения титра растворимого нейбластина культуральную среду анализировали методом ELISA и определяли данные кумулятивного поглощения (среднее значение и величину ошибки, соответствующую одному стандартному отклонению), соответствующие каждой из протестированных плазмид. По сравнению с плазмидами, кодирующими нейбластин дикого типа, трансфекция СНО-клеток плазмидами, кодирующими Arg 48, 49E-двойной мутант, приводила к значительному увеличению числа клеточных линий, демонстрирующих высокую экспрессию рекомбинантного белка (фиг. 13). Лидирующие клеточные линии из каждой трансфекции дополнительно подращивали. Фиксированное число клеток культивировали на протяжении 3 дней, после чего определяли общее число клеток, их жизнеспособность и титр нейбластина. Титры нейбластина, экспрессированного в лидирующих клеточных линиях, содержащих Arg 48, 49 Е-двойной мутант, были приблизительно в 5 раз выше таковых в лидирующих клеточных линиях, экспрессирующих нейбластин дикого типа. Другие воплощения. Хотя изобретение было описано в комплексе с его детализированным описанием, вышеупомянутое описание носит иллюстративный характер и не предполагает ограничения объема данного изобретения,который определен объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации включены в объем притязаний нижеследующей формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 последовательности SEQ ID NO:1, где аминокислотная последовательность содержит замещенную аминокислоту, отличную от аргинина в положении 48 и в положении 49 аминокислотной последовательности SEQ ID NO:1; причем указанный вариант полипептида после димеризации связывается с комплексом, содержащим GFR3 и RET, и где указанный вариант полипептида обладает значительно меньшей способностью связывать гепарин по сравнению с полипептидом нейбластина дикого типа с аминокислотной последовательностью SEQ ID NO:1. 2. Вариант полипептида по п.1, где остаток аргинина в положении 48 и остаток аргинина в положении 49 аминокислотной последовательности SEQ ID NO:1 замещены неконсервативными аминокислотными остатками. 3. Вариант полипептида по п.1, где остаток аргинина в положении 48 и остаток аргинина в положении 49 аминокислотной последовательности SEQ ID NO:1 замещены глутаминовой кислотой. 4. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность,которая по крайней мере на 90% идентична аминокислотам 15-113 последовательности SEQ ID NO:1. 5. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность,которая по крайней мере на 95% идентична аминокислотам 15-113 последовательности SEQ ID NO:1. 6. Вариант полипептида по любому из пп.1-3, содержащий аминокислотную последовательность,которая по крайней мере на 98% идентична аминокислотам 15-113 последовательности SEQ ID NO:1. 7. Вариант полипептида нейбластина, содержащий аминокислоты 15-113 последовательностиSEQ ID NO:5. 10. Вариант полипептида нейбластина, состоящий из аминокислот 15-113 последовательности SEQID NO:5. 11. Вариант полипептида нейбластина, состоящий из аминокислот 10-113 последовательностиSEQ ID NO:5. 12. Вариант полипептида нейбластина, состоящий из аминокислотной последовательностиSEQ ID NO:5 или SEQ ID NO:7. 13. Димер, содержащий два любых варианта полипептида нейбластина по любому из пп.1-12. 14. Конъюгат, содержащий вариант полипептида нейбластина по любому из пп.1-12, который связан с неприродным полимером. 15. Конъюгат по п.14, в котором неприродный полимер представляет собой полиалкиленгликоль. 16. Конъюгат по п.15, в котором полиалкиленгликоль представляет собой полиэтиленгликоль. 17. Конъюгат по любому из пп.14-16, в котором неприродный полимер связан с вариантом полипептида нейбластина на его аминоконце. 18. Конъюгат по любому из пп.14-16, в котором неприродный полимер связан с вариантом полипептида нейбластина по внутреннему сайту для конъюгирования полимера. 19. Слитый белок, содержащий вариант полипептида нейбластина по любому из пп.1-12 и гетерологичную аминокислотную последовательность. 20. Фармацевтическая композиция, содержащая вариант полипептида нейбластина по любому из пп.1-12, димер по п.13, конъюгат по любому из пп.14-18 или слитый белок по п.19, а также фармацевтически приемлемый носитель или эксципиент. 21. Нуклеиновая кислота, содержащая последовательность, кодирующую вариант полипептида нейбластина по любому из пп.1-12. 22. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.21. 23. Клетка, содержащая экспрессирующий вектор по п.22. 24. Способ получения варианта полипептида нейбластина, включающий получение клетки по п.23 и культивирование клетки в условиях, способствующих экспрессии нуклеиновой кислоты, кодирующей вариант полипептида нейбластина. 25. Способ лечения или предотвращения заболевания или нарушения нервной системы у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13, конъюгата по любому из пп.14-18 или слитого белка по п.19. 26. Способ лечения нейропатической боли у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13, конъюгата по любому из пп.14-18 или слитого белка по п.19. 27. Способ активации рецептора RET у млекопитающего, включающий введение млекопитающему эффективного количества варианта полипептида нейбластина по любому из пп.1-12, димера по п.13,конъюгата по любому из пп.14-18 или слитого белка по п.19. 28. Способ по любому из пп.25-27, в котором млекопитающее является человеком. 29. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную аминокислотам 15-113 последовательности SEQ ID NO:1, которая содержит по крайней мере одну замещенную аминокислоту по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из аминокислоты, отличной от серина в положении 20 SEQ ID NO:1; аминокислоты, отличной от глутамина в положении 21 SEQ ID NO:1; аминокислоты, отличной от гистидина в положении 32 SEQ ID NO:1; аминокислоты, отличной от аргинина в положении 33 SEQ ID NO:1; аминокислоты, отличной от аргинина в положении 39 SEQ ID NO:1; аминокислоты, отличной от серина в положении 46 SEQ ID NO:1; аминокислоты, отличной от аргинина в положении 68 SEQ ID NO:1; аминокислоты, отличной от глицина в положении 72 SEQ ID NO:1; аминокислоты, отличной от серина в положении 73 SEQ ID NO:1; и аминокислоты, отличной от валина в положении 94 SEQ ID NO:1,причем указанный полипептид после димеризации связывается с комплексом, содержащим GFR3 и RET. 30. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична аминокислотам 15-113 последовательности SEQ ID NO:1. 31. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 95% идентична аминокислотам 15-113 последовательности SEQ ID NO:1.- 23013565 32. Вариант полипептида по п.29, содержащий аминокислотную последовательность, которая по крайней мере на 98% идентична аминокислотам 15-113 последовательности SEQ ID NO:1. 33. Вариант полипептида нейбластина, содержащий аминокислотную последовательность, по крайней мере на 80% идентичную последовательности SEQ ID NO:1, которая содержит по крайней мере одну замещенную аминокислоту по сравнению с SEQ ID NO:1, выбранную из группы, состоящей из аминокислоты, отличной от аргинина в положении 7 SEQ ID NO:1; аминокислоты, отличной от аргинина в положении 9 SEQ ID NO:1; и аминокислоты, отличной от аргинина в положении 14 SEQ ID NO:1,причем указанный полипептид после димеризации связывается с комплексом, содержащим GFR3 и RET. 34. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 7SEQ ID NO:1. 35. Вариант полипептида по п.34, где указанная аминокислота представляет собой неконсервативную аминокислоту. 36. Вариант полипептида по п.34, где указанная аминокислота представляет собой глутаминовую кислоту. 37. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 9SEQ ID NO:1. 38. Вариант полипептида по п.37, где указанная аминокислота представляет собой неконсервативную аминокислоту. 39. Вариант полипептида по п.37, где указанная аминокислота представляет собой глутаминовую кислоту. 40. Вариант полипептида по п.33, содержащий отличную от аргинина аминокислоту в положении 14 SEQ ID NO:1. 41. Вариант полипептида по п.40, где указанная аминокислота представляет собой неконсервативную аминокислоту. 42. Вариант полипептида по п.40, где указанная аминокислота представляет собой глутаминовую кислоту. 43. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 90% идентична последовательности SEQ ID NO:1. 44. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 95% идентична последовательности SEQ ID NO:1. 45. Вариант полипептида по любому из пп.33-42, содержащий аминокислотную последовательность, которая по крайней мере на 98% идентична аминокислотам 15-113 последовательностиSEQ ID NO:1. 46. Димер, содержащий два любых варианта полипептида нейбластина по любому из пп.29-45. 47. Конъюгат, содержащий вариант полипептида нейбластина по любому из пп.29-45 и неприродный полимер. 48. Слитый белок, содержащий вариант полипептида нейбластина по любому из пп.29-45 и гетерологичную аминокислотную последовательность. 49. Фармацевтическая композиция, содержащая вариант полипептида нейбластина по любому из пп.29-45, димер по п.46, конъюгат по п.47 или слитый белок по п.48, а также фармацевтически приемлемый носитель или эксципиент. 50. Нуклеиновая кислота, содержащая последовательность, кодирующую вариант полипептида нейбластина по любому из пп.29-45. 51. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.50. 52. Клетка, содержащая экспрессирующий вектор по п.51. 53. Способ получения варианта полипептида нейбластина, включающий получение клетки по п.52 и культивирование клетки в условиях, способствующих экспрессии нуклеиновой кислоты, кодирующей вариант полипептида нейбластина. 54. Способ лечения или предотвращения заболевания или нарушения нервной системы у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции по п.49. 55. Способ лечения нейропатической боли у млекопитающего, включающий введение млекопитающему терапевтически эффективного количества фармацевтической композиции по п.49. 56. Способ активации рецептора RET у млекопитающего, включающий введение млекопитающему эффективного количества варианта полипептида нейбластина по любому из пп.29-45, димера по п.46,конъюгата по п.47, слитого белка по п.48 или фармацевтической композиции по п.49.
МПК / Метки
МПК: A61P 25/00, C07K 14/495, A61K 38/17
Метки: применение, варианты, полипептидов, способы, нейбластина, получения
Код ссылки
<a href="https://eas.patents.su/30-13565-varianty-polipeptidov-nejjblastina-sposoby-ih-polucheniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Варианты полипептидов нейбластина, способы их получения и их применение</a>
Предыдущий патент: Гуманизированный иммуноглобулин и содержащая его фармацевтическая композиция
Следующий патент: Микроорганизм для детоксикации фумонизинов, а также его применение, способ детоксикации фумонизинов и кормовая добавка, содержащая этот микроорганизм
Случайный патент: Снижение закупориваний потока