Способ получения трициклического кетона
Формула / Реферат
1. Способ получения трициклического кетона (k), описываемого приведенной ниже формулой, для синтеза аналогов камптотецина
где Me означает метильную группу, Pr означает пропильную группу и t-Bu означает трет-бутильную группу,
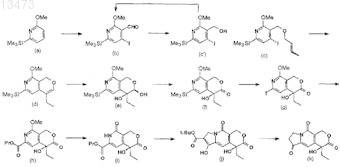
при этом способ предусматривает стадию (1) смешивания указанного выше соединения (а), соединения, описываемого формулой (I)
где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом, равным от 1 до 3,
и литиирующего реагента и последующее смешивание с йодирующим реагентом с получением соединения (b).
2. Способ получения трициклического кетона (k) по п.1, дополнительно предусматривающий стадию (2) смешивания и перемешивания в растворителе по меньшей мере одного типа палладиевого катализатора, выбранного из группы, включающей хлорид палладия(II), ацетат палладия(II), палладий на угле, гидроксид палладия на угле, бис-(ацетонитрил)палладий(II)дихлорид, бис-(бензонитрил)палладий(II)дихлорид и бис-(дибензилиденацетон)палладий(0), соединения (с), основания и четвертичной аммониевой соли с получением соединения (d).
3. Способ получения трициклического кетона (k) по п.1 или 2, в котором на стадии (1) используется соединение, описываемое формулой (I), где n равно 2.
4. Способ получения трициклического кетона (k) по любому из пп.1-3, в котором на стадии (1) литиирующим реагентом является н-бутиллитий.
5. Способ получения трициклического кетона (k) по любому из пп.2-4, в котором на стадии (2) растворителем является содержащий воду растворитель.
6. Способ получения трициклического кетона (k) по любому из пп.2-5, в котором на стадии (2) растворителем является смесь органического растворителя из группы нитрилов с водой.
7. Способ получения трициклического кетона (k) по любому из пп.2-6, в котором на стадии (2) растворителем является смесь органического растворителя из группы простых эфиров, органического растворителя из группы нитрилов и воды.
8. Применение трициклического кетона (k), полученного способом по любому из пп.1-7, для получения аналогов камптотецина.
9. Способ синтеза аналогов камптотецина, причем этот способ включает реакцию трициклического кетона (k), полученного способом по любому из пп.1-7, с 2'-амино-5'-гидроксипропиофеноном.
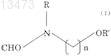
10. Способ получения формилированного производного метоксипиридина реакцией производного метоксипиридина с соединением (алкоксиалкилформамидом), описываемым формулой (I)
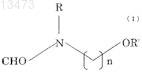
где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом, равным от 1 до 3.
11. Способ получения формилированного производного метоксипиридина по п.10, в котором используется соединение, описываемое формулой (I), где n равно 2.
12. Способ получения формилированного производного метоксипиридина по п.10 или 11, который проводят в присутствии н-бутиллития.
13. Способ получения формилированного производного метоксипиридина, который является способом получения соединения, описываемого формулой (II)
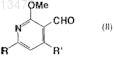
где R означает галоген, атом водорода или триметилсилильную группу и R' означает галоген, алкильную, триметилсилильную или тиоалкильную группу,
и в орто-положении к формильной группе, введенной с помощью способа получения по любому из пп.10-12, содержится электрофильный заместитель.
14. Алкоксиалкилформамид, описываемый формулой (I)
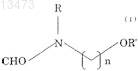
где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом, равным от 1 до 3, но исключая соединение, в котором n равно 1 и R и R' оба означают метил, соединение, в котором n равно 1, R означает метил и R' означает этил, и соединение, в котором n равно 2 и R и R' оба означают этил.
Текст
013473 Область техники Настоящее изобретение относится к способу получения промежуточного продукта, использующегося для синтеза камптотецинов, обладающих противоопухолевой активностью, и к новому формилирующему реагенту, применяющемуся в методике синтеза. Точнее, оно относится к способу асимметрического синтеза соединения, которое является исходным веществом для получения разных производных камптотецина и содержит трициклический кетонный фрагмент, соответствующий кольцевому фрагментуCDE в каркасе камптотецинов. Предшествующий уровень техники Камптотецин (далее обозначается КПТ), выделяемый из коры, корней, плодов, листьев и т.п. Camptotheca acuminata, произрастающего в Китае, является пентациклическим алкалоидом и известно, что он обладает противоопухолевой активностью, обусловленной ингибированием синтеза нуклеиновой кислоты. С другой стороны, имеются данные о том, что производные камптотецина приводят к побочным эффектам, таким как диарея (Gan to Kagakuryoho (CancerChemotherapy), 17, p. 115-120, 1990) и нарушения органов пищеварения; поэтому для снижения токсичности, усиления воздействия и т.п. исследованы производные разных типов. Авторы настоящего изобретения уже сообщали об обладающем пониженной по сравнению с КПТ токсичностью соединении, тригидрате 7-этил-10-[4-(1-пиперидино)-1-пиперидино]карбонилоксикамптотецингидрохлорида (далее обозначается КПТ-11), которое является растворимым в воде полусинтетическим производным КПТ и в настоящее время широко применяется в качестве противоопухолевого средства (родовое название иринотекана гидрохлорид). Камптотецины, такие как КПТ-11, можно получить химической модификацией КПТ, выделенного из природных материалов. Однако поскольку количество КПТ, получаемого из природного материала, такого как Camptothecaacuminata, являющегося сырьем, чрезвычайно мало, понятно, что вследствие все большей потребности в КПТ-11 будет трудно получить достаточное количество КПТ. Кроме того, исследованы методики полного синтеза, но в настоящее время они неэффективны. Авторы настоящего изобретения синтезировали 4-йод-2-метокси-6-триметилсилилпиридин-3 карбальдегид (далее называемый соединением (b, который является промежуточным продуктом для синтеза трициклического кетонного фрагмента, соответствующего циклическому кольцевому фрагментуCDE в КПТ, по приведенной ниже схеме (патентная публикация 1) однако существует возможность того, что в будущем может оказаться затруднительным приобретение 2(диметиламино)этилхлорида, который является исходным веществом для получения N-метил-N-[2(диметиламино)этил]формамида (FLM), использующегося в этой методике, поскольку он может служить исходным веществом для изготовления химического оружия. С другой стороны, описаны аналоги алкоксиалкилформамида (формула I), применяющиеся в качестве формилирующих реагентов, соответствующих настоящему изобретению (патентные публикации 2 и 3), но их использовали только в качестве исходных веществ для получения 6-аминопенициллановой кислоты или описывали, как побочный продукт электрохимического синтеза производного бутантетракарбоновой кислоты, и совсем не описано их применение в качестве формилирующих реагентов. Патентная публикация 1: WO 02/066416. Патентная публикация 2: JP, В, 51-8955. Патентная публикация 3: JP, А, 2004-514786. Раскрытие изобретения Задачи, решаемые изобретением. Задачей настоящего изобретения является эффективное получение КПТ, который является исходным веществом для иринотекана гидрохлорида и различных типов производных камптотецина и аналогов камптотецина, таких как 7-этил-10-гидроксикамптотецин (SN-38), который является важным промежуточным продуктом для синтеза иринотекана гидрохлорида с помощью практически применимой методики полного синтеза. Средства решения задач. Для решения указанных выше задач и с целью улучшения способа получения авторы настоящего изобретения разработали новые формилирующие реагенты для производного метоксипиридина, применяющегося при получении (S)-4-этил-3,4,6,7,8,10-гексагидро-4-гидрокси-1 Н-пирано[3,4-f]индолизин 3,6,10-триона (далее называемого соединением (k, который соответствует кольцевому фрагменту CDE в каркасе КПТ, и установили, что применение формилирующих реагентов позволяет провести форматирование производного метоксипиридина и последующее йодирование с высоким выходом, и таким обра-1 013473 зом было осуществлено настоящее изобретение. Таким образом, настоящее изобретение относится к способу получения трициклического кетона (k),описываемого приведенной ниже формулой, предназначенного для синтеза аналогов камптотецина где Me означает метильную группу, Pr означает пропильную группу и t-Bu означает трет-бутильную группу,причем способ включает стадию (1) смешивания указанного выше 2-метокси-6-(триметилсилил)пиридина (далее называемого соединением (а, соединения, описываемого приведенной ниже формулой где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом,равным от 1 до 3,и литиирующего реагента и последующее смешивание с йодирующим реагентом с получением соединения (b). Кроме того, настоящее изобретение относится к способу получения трициклического кетона (k),способ дополнительно включает стадию (2) смешивания и перемешивания в растворителе по меньшей мере одного типа палладиевого катализатора, выбранного из группы, включающей хлорид палладия(II),ацетат палладия(II), палладий на угле, гидроксид палладия на угле, бис-(ацетонитрил)палладий(II)дихлорид, бис-(бензонитрил)палладий(II)дихлорид и бис-(дибензилиденацетон)палладий(0), 3-(2 бутенилоксиметил)-4-йод-2-метокси-6-(триметилсилил)пиридина (далее называемого соединением (с,основания и четвертичной аммониевой соли с получением 4-этил-8-метокси-6-триметилсилил-1 Нпирано[3,4-с]пиридина (далее называемого соединением (d. Настоящее изобретение относится к способу получения трициклического кетона (k), в котором на стадии (1) используется соединение, описываемое формулой (I), где n равно 2. Кроме того, настоящее изобретение относится к способу получения трициклического кетона (k), в котором на стадии (1) литиирующим реагентом является н-бутиллитий. Кроме того, настоящее изобретение относится к способу получения трициклического кетона (k), в котором на стадии (2) растворителем является содержащий воду растворитель. Настоящее изобретение также относится к способу получения трициклического кетона (k), в котором на стадии (2) растворителем является смесь органического растворителя из группы нитрилов с водой. Кроме того, настоящее изобретение относится к способу получения трициклического кетона (k), в котором на стадии (2) растворителем является смесь органического растворителя из группы простых эфиров, органического растворителя из группы нитрилов и воды. Настоящее изобретение относится к применению трициклического кетона (k), полученного указанным выше способом, для получения аналогов камптотецина. Кроме того, настоящее изобретение относится к способу синтеза аналогов камптотецина, при этом способ включает реакцию трициклического кетона (k), полученного указанным выше способом, с 2'амино-5'-гидроксипропиофеноном. Кроме того, настоящее изобретение относится к способу получения формилированных производных метоксипиридина по реакции производных метоксипиридина с соединением (алкоксиалкилформа-2 013473 мидом), описываемым формулой (I) где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом,равным от 1 до 3. Настоящее изобретение относится к способу получения формилированных производных метоксипиридина, в котором используется соединение формулы (I), в котором n равно 2. Кроме того, настоящее изобретение относится к способу получения формилированных производных метоксипиридина, который проводят в присутствии н-бутиллития. Кроме того, настоящее изобретение относится к способу получения формилированных производных метоксипиридина, который является способом получения соединения, описываемого формулой (II) где R означает галоген, атом водорода или триметилсилильную группу и R' означает галоген, алкильную,триметилсилильную или тиоалкильную группу,и в орто-положении к формильной группе, введенной с помощью указанного выше способа получения,содержится электрофильный заместитель. Кроме того, настоящее изобретение относится к алкоксиалкилформамидам, описываемым формулой (I) где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом,равным от 1 до 3, но исключая соединение, в котором n равно 1 и R и R' оба означают метил, и соединение, в котором n равно 2 и R и R' оба означают этил. Результаты применения изобретения. Можно не только эффективно использовать алкоксиалкилформамиды [формула (I)], соответствующие настоящему изобретению, в качестве формилирующих реагентов для производного метоксипиридина, но и можно эффективно получить трициклический кетон (k), как промежуточный продукт аналогов камптотецина. Кроме того, путем применения настоящего изобретения можно эффективно увеличить отношение эндо/экзо для соединения (d), которое является промежуточным продуктом для получения трициклического кетона (k). Путем выбора в качестве палладиевого катализатора для способа по меньшей мере одного соединения из группы, включающей хлорид палладия(II), ацетат палладия(II), палладий на угле,гидроксид палладия на угле, бис-(ацетонитрил)палладий(II)дихлорид, бис-(бензонитрил)палладий(II)дихлорид и бис-(дибензилиденацетон)палладий(0), можно увеличить отношение эндо/экзо и выход. Наилучший вариант осуществления изобретения. Получение трициклического кетона (k) проводят по указанной ниже схеме синтеза. В приведенных формулах Me означает метильную группу, Pr означает пропильную группу и t-Bu-3 013473 означает трет-бутильную группу. Соединение (а), которое является исходным веществом в указанной выше схеме синтеза, можно синтезировать по схеме Curran (Josien, Н.; Ko, S.В.; Bom, D.; Curran, D.Р.,Chem. Eur. J. 1998, 4, 67-83, "A General Synthetic Approach to the (20S)-Camptothecin Family of AntitumorAgents by a Regiocontrolled Cascade Radical Cyclization of Aryl Isonitriles"), путем химической модификации аналогов соединения (а) или путем выделения и очистки из различных типов природных материалов и т.п., или можно использовать сам природный материал, содержащий соединение (а). Предпочтительный способ синтеза трициклического кетона (k) по указанной выше схеме синтеза включает стадию (i) или стадии (i) и (iv) из числа указанных ниже стадий:(i) стадия синтеза соединения (b) путем смешивания 2-метокси-6-триметилсилилпиридина (соединение (а с литиирующим реагентом, алкоксиалкилформамидом [формула (I)] и с йодирующим реагентом,(ii) стадия синтеза соединения (с) путем смешивания соединения (b) с кротиловым спиртом, триэтилсиланом и кислотой с проведением реакции в смеси без растворителя,(iii) стадия получения соединения (b) путем смешивания 4-йод-3-гидроксиметил-2-метокси-6(триметилсилил)пиридина (далее называемого соединением (с', который является побочным продуктом на стадии (ii), с окислительным реагентом и в некоторых случаях с основанием,(iv) стадия синтеза соединения (d) путем смешивания и перемешивания соединения (с) в присутствии палладиевого катализатора, основания и четвертичной аммониевой соли в растворителе,(v) стадия синтеза (S)-4-этил-3,4-дигидро-8-метокси-6-триметилсилил-1 Н-пирано[3,4-с]пиридин 3,4-диола (далее называемого соединением (е из соединения (d) с использованием осмиевого катализатора, вспомогательного окислительного реагента, основания, асимметрического реагента и метансульфонамида,(vi) стадия синтеза (S)-4-этил-3,4-дигидро-4-гидрокси-8-метокси-6-триметилсилил-1 Н-пирано[3,4 с]пиридин-3-она (далее называемого соединением (f путем смешивания соединения (е) с основанием и йодом и нагревания смеси с обратным холодильником в смеси спирт-вода,(vii) стадия синтеза (S)-4-этил-3,4-дигидро-4-гидрокси-6-йод-8-метокси-1 Н-пирано[3,4-с]пиридин 3-она (далее называемого соединением (g путем смешивания соединения (f) с десилилирующимйодирующим реагентом,(viii) стадия химической очистки соединения (g) путем прибавления водного раствора щелочи, такого как раствор гидроксида натрия, для подщелачивания раствора, промывки органическим растворителем, таким как хлороформ, последующего подкисления водного слоя и экстракции органическим растворителем, таким как хлороформ,(ix) стадия получения оптически чистого соединения (g) путем растворения соединения (g) в высокополярном растворителе, таком как хлороформ, прибавления низкополярного растворителя, такого как н-гексан, отфильтровывания полученного осадка и концентрирования фильтрата,(х) стадия получения пропилового эфира (S)-4-этил-3,4-дигидро-4-гидрокси-8-метокси-3-оксо-1 Нпирано[3,4-с]пиридин-6-карбоновой кислоты (далее называемого соединением (h путем смешивания соединения (g) с палладиевым катализатором и основанием и проведения реакции смеси с 1-пропанолом в атмосфере монооксида углерода,(xi) стадия синтеза пропилового эфира (S)-4-этил-3,4,7,8-тетрагидро-4-гидрокси-3,8-диоксо-1 Нпирано[3,4-с]пиридин-6-карбоновой кислоты (далее называемого соединением (i по реакции соединения (h) с деметилирующим реагентом при комнатной температуре, и(xii) стадия синтеза 1,1-диметилового эфира (S)-4-этил-3,4,8,10-тетрагидро-4,6-дигидрокси-3,10 диоксо-1 Н-пирано[3,4-f]индолизин-7-карбоновой кислоты (далее называемого соединением (j по реакции соединения (i) с трет-бутилакрилатом и основанием. Соединение (f) можно синтезировать из соединения (j) по указанной выше схеме Curran. Кроме того, (xiii) на стадии получения SN-38 из соединения (k) и 2'-амино-5'гидроксипропиофенона соединение SN-38 предпочтительно можно получить по реакции в атмосфере инертного газа. Указанные выше 13 стадий обсуждены подробнее ниже. На стадии (i) соединение (а) растворяют в растворителе и литиирующий реагент, формилирующий реагент и йодирующий реагент прибавляют к раствору и его перемешивают и получают соединение (b). В качестве растворителя можно использовать тетрагидрофуран (ТГФ), диэтиловый эфир, толуол, гексан,гептан и т.п. и с точки зрения растворимости и реакционной способности особенно предпочтительным является ТГФ. В качестве литиирующего реагента с успехом можно использовать любой, если его обычно используют. Конкретные примеры литиирующего реагента включают н-бутиллитий, s-бутиллитий, третбутиллитий, диизопропиламид лития (LDA) и бис-(триметилсилил)амид лития (LiHMDS), и в особенности с точки зрения легкости применения и реакционной способности предпочтительно можно использовать н-бутиллитий. Количество литиирующего реагента можно определить в соответствии с реагентом и в случае, если используют н-бутиллитий, оно составляет от 0,5 до 10 экв. в расчете на 1 экв. соединения (а), предпочти-4 013473 тельно от 1 до 5 экв. Температура реакции литиирования является постоянной и находится в диапазоне от -78 до 25 С,предпочтительно от -78 до 0 С, особенно предпочтительно от -30 до 0 С. Конкретные примеры формилирующего реагента, применяющегося в настоящем изобретении,включают N-метоксиметил-N-метилформамид (FMM), N-метоксиэтил-N-метилформамид (FMO), Nэтоксиэтил-N-метилформамид (FEO), N-метоксиэтил-N-этилформамид (FEA), N-этоксиэтил-Nэтилформамид (FEE) и N-этоксипропил-N-метилформамид (FEP) и с учетом последующего йодирования предпочтительно можно использовать FMO, FEO, FEA или FEE. Количество формилирующего реагента, в случае, если используют FEO, составляет от 1 до 10 экв. в расчете на 1 экв. соединения (а), предпочтительно от 1 до 3 экв. Температура реакции формилирования является постоянной и находится в диапазоне от -78 до 25 С, предпочтительно от -78 до 0 С, особенно предпочтительно от -30 до 0 С. В качестве йодирующего реагента можно использовать йод, N-йодсукцинимид (NIS), 1,2-дийодэтан и т.п. и с точки зрения экономичности и реакционной способности йод является особенно предпочтительным. Количество йодирующего реагента составляет от 1 до 10 экв. в расчете на 1 экв. соединения (а),предпочтительно от 1 до 5 экв. Температура реакции йодирования находится в диапазоне от -78 до 25 С, предпочтительно от -78 до 0 С. Реакцию можно проводить при постоянной температуре или можно проводить при повышении температуры в этих диапазонах. На стадии (ii) соединение (с) получают путем прибавления кротилового спирта, триэтилсилана и кислоты к соединению (b) и перемешивания без использования растворителя. Количество кротилового спирта составляет от 1 до 10 экв. в расчете на 1 экв. соединения (b), предпочтительно от 2 до 5 экв. Количество триэтилсилана составляет от 1 до 10 экв. в расчете на 1 экв. соединения (b), предпочтительно от 1 до 4 экв. В качестве кислоты можно использовать трифторуксусную кислоту (ТФК), серную кислоту, метансульфоновую кислоту, хлористо-водородную кислоту и т.п., и с точки зрения реакционной способности ТФК является особенно предпочтительной. Количество кислоты в случае, если используют ТФК, составляет от 1 до 20 экв. в расчете на 1 экв. соединения (b), предпочтительно от 5 до 15 экв. На стадии (iii) соединение (b) получают путем растворения соединения (с'), которое является побочным продуктом стадии (ii), в растворителе, прибавления окислительного реагента и в некоторых случаях основания и перемешивания. В качестве растворителя предпочтительно можно использовать любой, если его обычно используют. Примеры такого растворителя включают дихлорметан, хлороформ, ацетонитрил, толуол и н-гексан, и с точки зрения реакционной способности толуол и н-гексан являются особенно предпочтительными. Примеры окислительного реагента включают диоксид марганца, реагент Десса-Мартина (перйодинан Десса-Мартина), реагент Джонса (Na2Cr2O7-H2SO4), РСС, PDC, ДМСО-оксалилхлорид-триэтиламин(окисление по Сверну) и ТЕМРО-гипохлорит (TEMPO - 2,2,6,6-тетраметил-1-пиперидинилоксил); ТЕМРО-гипохлорит является особенно предпочтительным и ТЕМРО-гипохлорит натрия является более предпочтительным. Количество окислительного реагента, например, в случае ТЕМРО-гипохлорита натрия, для TEMPO составляет от 0,001 до 0,1 экв. в расчете на 1 экв. соединения (с'), предпочтительно от 0,005 до 0,02 экв. Гипохлорит натрия используют в количестве, составляющем от 1 до 5 экв., предпочтительно от 1 до 2 экв. В качестве основания предпочтительно можно использовать любое, если его обычно используют. Примеры такого основания включают гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат кальция, гидроксид натрия, гидроксид калия, гидроксид кальция и триэтиламин, и гидрокарбонат натрия является особенно предпочтительным. Количество основания, например, в случае гидрокарбоната натрия, гидрокарбонат натрия составляет от 1 до 10 экв. в расчете на 1 экв. соединения (с'), предпочтительно от 2 до 4 экв. Температура реакции в случае, если ТЕМРО-гипохлорит натрия используют в качестве окислительного реагента, находится в диапазоне от -20 до 30 С и для существенного подавления побочной реакции она предпочтительно равна от -20 до 10 С. Кроме того, длительность проведения реакции в случае, если ТЕМРО-гипохлорит натрия используют в качестве окислительного реагента, находится в диапазоне от 0,1 до 10 ч, предпочтительно от 0,5 до 5 ч. На стадии (iv) соединение (d) получают путем растворения соединения (с) в растворителе, прибавления палладиевого катализатора, основания и четвертичной аммониевой соли и нагревания с обратным холодильником. В качестве растворителя можно использовать растворитель из группы нитрилов, такой как ацетонитрил или пропионитрил, растворитель из группы простых эфиров, такой как тетрагидрофуран (ТГФ),-5 013473 диизопропиловый эфир (ИПЭ), диэтиловый эфир или 1,2-диметоксиэтан, толуол, воду и т.п. В особенности с точки зрения реакционной способности предпочтительно использовать смесь, в которой объединены любой растворитель из группы простых эфиров, растворитель из группы нитрилов и вода, еще более предпочтительной является смесь ИПЭ, ацетонитрила и воды и смесь ацетонитрила и воды. В качестве палладиевого катализатора предпочтительно можно использовать хлорид палладия(II),ацетат палладия(II), палладий на угле, гидроксид палладия на угле, бис-(ацетонитрил)палладий(II)дихлорид, бис-(бензонитрил)палладий(II)дихлорид, бис-(дибензилиденацетон)палладий(0) и т.п., и с точки зрения реакционной способности хлорид палладия(II) является особенно предпочтительным. Количество палладиевого катализатора составляет от 0,01 до 1 экв. в расчете на 1 экв. соединения(с), предпочтительно от 0,05 до 0,2 экв. В качестве основания предпочтительно можно использовать любое, если его обычно используют. Примеры такого основания включают карбонат натрия, карбонат калия, карбонат кальция, карбонат цезия, триэтиламин (ТЭА), N,N-диизопропилэтиламин (ДИПЭА), гидроксид натрия и гидроксид калия и особенно предпочтительно можно использовать ТЭА и ДИПЭА. Количество основания, например, в случае ТЭА составляет от 1 до 20 экв. в расчете на 1 экв. соединения (с), предпочтительно от 5 до 10 экв. В качестве четвертичной аммониевой соли предпочтительно можно использовать любую, если ее обычно используют. Примеры таких четвертичных аммониевых солей включают тетрабутиламмонийгалогенид и бензилтриэтиламмонийгалогенид, и тетрабутиламмонийбромид является особенно предпочтительным. Количество четвертичной аммониевой соли, например, в случае тетрабутиламмонийбромида составляет от 0,1 до 3 экв. в расчете на 1 экв. соединения (с), предпочтительно от 0,5 до 1,5 экв. Кроме того, длительность проведения реакции в случае, если используют смесь ацетонитрила, ИПЭ и воды, находится в диапазоне от 0,1 до 10 ч, предпочтительно от 0,5 до 5 ч. На стадии (v) соединение (е) получают путем растворения соединения (d) в смеси спирта с водой,прибавления осмиевого катализатора, вспомогательного окислительного реагента, асимметрического реагента, основания и метансульфонамида, и перемешивания. Конкретные примеры спирта включают метанол, этанол, 1-пропанол, 2-пропанол (IPA), 1-бутанол,2-бутанол и трет-бутиловый спирт. С точки зрения реакционной способности трет-бутиловый спирт является особенно предпочтительным. В качестве осмиевого катализатора предпочтительно можно использовать тетраоксид осмия,осмат(VI) калия и т.п., и с точки зрения легкости применения осмат(VI) калия является особенно предпочтительным. Количество осмиевого катализатора составляет от 0,001 до 0,1 экв. в расчете на 1 экв. соединения(d), предпочтительно от 0,002 до 0,01 экв. В качестве вспомогательного окислительного реагента предпочтительно можно использовать гексацианоферрат(III) калия, 4-метилморфолин-N-оксид (NMO) и т.п., и с точки зрения реакционной способности гексацианоферрат(III) калия является особенно предпочтительным. Количество вспомогательного окислительного реагента, например, в случае гексацианоферрата(III) калия составляет от 1 до 10 экв. в расчете на 1 экв. соединения (d), предпочтительно от 2 до 5 экв. Конкретные примеры асимметрического реагента включают (DHQD)2PYR, (DHQD)2PHAL и(DHQD)2AQN, и с точки зрения выхода оптически чистого соединения (DHQD)2PYR является особенно предпочтительным. Количество асимметрического реагента, например, в случае (DHQD)2PYR составляет от 0,005 до 0,1 экв. в расчете на 1 экв. соединения (d), предпочтительно от 0,01 до 0,05 экв. В качестве основания можно использовать карбонат натрия, карбонат калия, карбонат кальция, карбонат цезия, гидроксид натрия, гидроксид калия и т.п., и с точки зрения реакционной способности карбонат калия является особенно предпочтительным. Количество основания, например, в случае карбоната калия составляет от 1 до 20 экв. в расчете на 1 экв. соединения (d), предпочтительно от 4 до 10 экв. Количество метансульфонамида составляет от 0,1 до 5 экв. в расчете на 1 экв. соединения (d), предпочтительно от 0,5 до 2 экв. Температура реакции находится в диапазоне от -20 до 30 С, предпочтительно от -10 до 10 С. На стадии (vi) соединение (f) получают путем растворения соединения (е) в растворителе, прибавления основания и йода и нагревания с обратным холодильником. Примеры растворителя включают метанол, этанол, 1-пропанол, 2-пропанол (IPA) и воду, и с точки зрения реакционной способности смесь метанола и воды является особенно предпочтительной. В качестве основания предпочтительно можно использовать обычно применяющиеся основания. Примеры такого основания включают карбонат натрия, карбонат калия, карбонат кальция, карбонат цезия, гидроксид натрия и особенно предпочтительными являются гидроксид калия и карбонат кальция. Количество основания, например, в случае карбоната кальция составляет от 1 до 10 экв. в расчете-6 013473 на 1 экв. соединения (е), предпочтительно от 2 до 5 экв. Количество йода составляет от 1 до 10 экв. в расчете на 1 экв. соединения (е), предпочтительно от 3 до 5 экв. Кроме того, длительность проведения реакции находится в диапазоне от 0,5 до 20 ч, более предпочтительно от 1 до 5 ч. На стадии (vii) соединение (g) получают путем растворения соединения (f) в растворителе и проведения реакции в присутствии комплекса йод-трифторацетат серебра (далее обозначается, как I2CF3COOAg) или комплекса N-хлорсукцинимид-йодид натрия (далее обозначается, как NCS-NaI). В качестве растворителя в случае I2-CF3COOAg подходящими являются дихлорметан, тетрахлорид углерода, хлороформ и т.п. и особенно предпочтительным является дихлорметан. В случае NCS-NaI можно использовать уксусную кислоту, ацетонитрил и т.п., и с точки зрения реакционной способности уксусная кислота является особенно предпочтительной. При использовании I2-CF3COOAg количество I2 составляет от 1 до 10 экв. в расчете на 1 экв. соединения (f), предпочтительно от 2 до 4 экв. Количество CF3COOAg составляет от 1 до 10 экв., предпочтительно от 2 до 4 экв. При использовании NCS-NaI количество NCS составляет от 1 до 20 экв. в расчете на 1 экв. соединения (f), предпочтительно от 5 до 8 экв. Количество NaI составляет от 1 до 20 экв., предпочтительно от 5 до 8 экв. Температура реакции в случае, если используют I2-CF3COOAg, составляет от 10 до 60 С, предпочтительно от 20 до 40 С. В случае если используют NCS-NaI, она составляет от 20 С до температуры кипения, предпочтительно от 50 до 80 С. Кроме того, длительность проведения реакции находится в диапазоне от 5 до 48 ч, предпочтительно от 15 до 24 ч. На стадии (viii), например, после прибавления к соединению (g) щелочного растворителя, такого как 0,2 н. водный раствор гидроксида натрия, и перемешивания соединение (g) переходит в форму с раскрытым лактонным кольцом (соединение (I где Me означает метильную группу, Et означает этильную группу, X означает щелочной металл или щелочно-земельный металл и n равно 1 или 2,и растворяется в водном растворе щелочи. Если этот раствор промыть органическим растворителем, то нейтральные и щелочные вещества переходят в органический слой. После отделения органического слоя водный слой подкисляют кислотой и экстрагируют органическим растворителем и получают обладающее высокой чистотой соединение (g). Концентрация щелочного растворителя находится в диапазоне от 0,01 до 5 н., предпочтительно от 0,1 до 1 н. Еще более предпочтительно от 0,2 до 0,5 н. Примеры основания включают гидроксид калия, гидроксид кальция, гидроксид натрия, карбонат калия и карбонат натрия, и гидроксид натрия является особенно предпочтительным. В качестве органического растворителя предпочтительно можно использовать любой, если его обычно используют. Примеры такого растворителя включают дихлорметан, хлороформ, этилацетат, толуол, диэтиловый эфир и диизопропиловый эфир, и дихлорметан и хлороформ являются особенно предпочтительными. Примеры кислоты включают хлористо-водородную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, фосфорную кислоту и трифторуксусную кислоту, хлористо-водородная кислота является особенно предпочтительной. На стадии (ix), когда соединение (g) растворяют в высокополярном растворителе и прибавляют низкополярный растворитель, осаждаются кристаллы. Кристаллы отфильтровывают и фильтрат концентрируют и сушат при пониженном давлении. Полученные кристаллы являются рацемическими и оптически более чистое соединение (g) получают в качестве остатка. В качестве высокополярного растворителя можно использовать хлороформ, дихлорметан, этилацетат, метанол, этанол, пропанол и т.п., хлороформ является особенно предпочтительным. Количество высокополярного растворителя, например в случае хлороформа, находится в диапазоне от 0,5 до 10 мл в расчете на 1 г соединения (g), предпочтительно от 1 до 5 мл, особенно предпочтительно от 3 до 5 мл. Примеры низкополярного растворителя включают н-гексан, н-гептан и диэтиловый эфир и н-гексан является особенно предпочтительным. Отношение высокополярный растворитель:низкополярный растворитель, например в случае смеси хлороформ:н-гексан, находится в диапазоне от 10:1 до 1:20, предпочтительно от 5:1 до 1:5.-7 013473 Температура кристаллизации предпочтительно не превышает 30 С, особенно предпочтительно, если она составляет от 0 до 30 С. На стадии (х) соединение (h) получают путем растворения соединения (g) в 1-пропаноле, прибавления палладиевого катализатора и основания и проведения реакции в атмосфере газообразного монооксида углерода. В качестве палладиевого катализатора предпочтительно можно использовать ацетат палладия(II),тетракис(трифенилфосфин)палладий(0), дихлор-бис-(трифенилфосфин)палладий(II), хлорид палладия(II) и т.п. и с точки зрения реакционной способности ацетат палладия(II) является особенно предпочтительным. Количество палладиевого катализатора составляет от 0,005 до 0,5 экв. в расчете на 1 экв. соединения (g), предпочтительно от 0,01 до 0,1 экв. В качестве основания предпочтительно можно использовать любое, если его обычно используют. Примеры такого основания включают карбонат натрия, карбонат калия, карбонат кальция, карбонат цезия, триэтиламин (ТЭА), N,N-диизопропилэтиламин (ДИПЭА), гидроксид натрия и гидроксид калия, и особенно предпочтительно применять карбонат калия, ТЭА и ДИПЭА. Количество основания, например,в случае карбоната калия составляет от 1 до 20 экв. в расчете на 1 экв. соединения (g), предпочтительно от 4 до 10 экв. Температура реакции находится в диапазоне от 20 С до температуры кипения, предпочтительно от 50 С до температуры кипения. На стадии (xi) соединение (i) получают путем растворения соединения (h) в растворителе, прибавления деметилирующего реагента и проведения реакции при комнатной температуре. В качестве растворителя можно использовать ацетонитрил, хлороформ, дихлорметан, толуол и т.п.,и ацетонитрил является особенно предпочтительным. Конкретные примеры деметилирующего реагента включают комплекс хлор-триметилсилан-йодид натрия, йодтриметилсилан, йодисто-водородную кислоту и бромисто-водородную кислоту и с точки зрения реакционной способности комплекс хлортриметилсилан-йодид натрия является особенно предпочтительным. При использовании деметилирующего реагента, например, в случае комплекса хлортриметилсиланйодид натрия, содержание и хлортриметилсилана, и йодида натрия находится в диапазоне от 1 до 10 экв. в расчете на 1 экв. соединения (h), предпочтительно от 2 до 5 экв. На стадии (xii) соединение (i) растворяют в растворителе, прибавляют основание и перемешивают в атмосфере инертного газа. К полученной смеси по каплям прибавляют трет-бутилакрилат и перемешивают в атмосфере инертного газа и получают соединение (j). В качестве растворителя предпочтительно можно использовать диметил-сульфоксид (ДМСО), N,Nдиметилформамид (ДМФ), N,N-диметилацетамид (ДМА) и т.п., с точки зрения реакционной способности ДМСО является особенно предпочтительным. В качестве основания можно использовать карбонат калия, карбонат натрия, гидроксид натрия,гидроксид калия и т.п., и карбонат калия является особенно предпочтительным. Количество прибавленного основания, например в случае карбоната калия, составляет от 1 до 20 экв. в расчете на 1 экв. соединения (i), предпочтительно от 2 до 5 экв. В качестве инертного газа можно использовать "благородный" газ, такой как аргон, гелий, неон,криптон, ксенон или радон, или любой газ, который обладает низкой реакционной способностью, и с точки зрения экономичности предпочтительными являются аргон и азот. Количество трет-бутилакрилата составляет от 1 до 20 экв. в расчете на 1 экв. соединения (i), предпочтительно от 8 до 12 экв. Температура реакции находится в диапазоне от 20 до 80 С, предпочтительно от 40 до 60 С. Кроме того, длительность проведения реакции составляет от 5 до 48 ч и для предотвращения разложения образовавшегося соединения (j) особенно предпочтительно менее 24 ч. Соединение (k) можно синтезировать по указанной выше схеме Curran из соединения (j). На стадии (xiii) SN-38 получают путем растворения соединения (k) и 2'-амино-5'-пропиофенона в растворителе, прибавления кислоты и нагревания и перемешивания в атмосфере инертного газа. В качестве растворителя можно использовать толуол, уксусную кислоту и т.п., и смесь толуола и уксусной кислоты является особенно предпочтительной. В качестве инертного газа можно использовать благородный газ, такой как аргон, гелий, неон,криптон, ксенон или радон, или любой газ, который обладает низкой реакционной способностью, и с точки зрения экономичности предпочтительными являются аргон и азот. В качестве кислоты можно использовать толуолсульфоновую кислоту, метансульфоновую кислоту,трифторуксусную кислоту и т.п., и с точки зрения реакционной способности толуолсульфоновая кислота является особенно предпочтительной. Количество кислоты, например, в случае толуолсульфоновой кислоты составляет от 1 до 100 мг в расчете на 1 г соединения (k), предпочтительно от 10 до 30 мг. Количество 2'-амино-5'-пропиофенона составляет от 1 до 3 экв. в расчете на 1 экв. соединения (k),-8 013473 предпочтительно от 1 до 1,5 экв. Температура реакции находится в диапазоне от 50 С до температуры флегмы (reflux temperature),предпочтительно в диапазоне от 80 С до температуры флегмы. Алкоксиалкилформамид [формула (I)], соответствующий настоящему изобретению, пригоден не только для формилирования соединения (а), его также можно использовать для формилирования обычных производных метоксипиридина и формилированные производные метоксипиридина можно получить с высоким выходом. Примеры производных метоксипиридина,которые можно формилировать алкоксиалкилформамидом [формула (I)], соответствующим настоящему изобретению, в дополнение к соединению (а) включают 2-метоксипиридин, 2-хлор-6-метоксипиридин, 2-алкил-6-метоксипиридин, 2 метокси-5-(триметилсилил)пиридин, 5-хлор-2-метоксипиридин и 5-алкил-2-метоксипиридин. В этом случае термин "алкил" означает низший алкил, содержащий от 1 до 5 атомов углерода. Кроме того, после формилирования производного метоксипиридина с помощью алкоксиалкилформамида [формула (I)], соответствующего настоящему изобретению, с помощью различных типов электрофилов можно селективно ввести заместитель в орто-положение к введенной формильной группе. Примеры электрофилов в дополнение к йоду включают метилйодид, хлортриметилсилан, гексахлорэтан, тетрабромметан и диметилдисульфид. Ниже настоящее изобретение дополнительно подробно иллюстрируется с помощью примеров, но настоящее изобретение не ограничивается ими. Примеры Пример 1. Синтез соединения (b) из соединения (а) исследован с использованием алкоксиалкилформамидов[формула (I)], соответствующих настоящему изобретению. В сосуде для проведения реакций, заполненном азотом или аргоном, соединение (а) (1,00 г,5,52 ммоль) растворяют в сухом тетрагидрофуране (примерно 13 мл) и охлаждают до температуры, равной примерно от -30 до -15 С. К полученному раствору по каплям прибавляют н-бутиллитий (1,6 моль/л раствор в н-гексане; 4,8 мл, 7,73 ммоль, 1,4 экв.) и перемешивают при такой же температуре в течение 1 ч. Затем по каплям прибавляют алкоксиалкилформамид (1,2 экв.), указанный в табл. 2, и смесь перемешивают при такой же температуре в течение 2 ч. Часть реакционной смеси отбирают, реакцию останавливают водой и затем экстрагируют этилацетатом. Часть оставшегося органического слоя инжектируют в прибор для ВЭЖХ (высокоэффективная жидкостная хроматография) и следят за протеканием реакции. Условия проведения ВЭЖХ являются такими же, как в методике количественного определения содержания соединения (b). н-Бутиллитий (1,6 моль/л раствор в н-гексане; 7,0 мл, 11,0 ммоль, 2,0 экв.) по каплям прибавляют к полученной смеси и перемешивают при температуре, равной примерно от -30 до -15 С в течение 3 ч. Затем раствор йода (3,64 г, 14,4 ммоль, 2,6 экв.) в сухом тетрагидрофуране (5,5 мл) по каплям прибавляют при температуре, равной примерно от -60 до -45 С, и смесь перемешивают при такой же температуре в течение 30 мин. К полученной смеси прибавляют водный раствор сульфита натрия (количество, необходимое для устранения обусловленной йодом окраски) и н-гексан (необходимое количество) и перемешивают, затем органический слой отделяют и концентрируют досуха и полученный остаток анализируют с помощью ВЭЖХ. Результаты приведены в табл. 1. Методика количественного определения содержания соединения (b). Примерно 20 мг исследуемого образца точно отвешивают и растворяют в ацетонитриле с доведением объема точно до 100 мл и таким образом получают раствор образца. Примерно 20 мг стандартного соединения (b) (очищенный на колонке продукт известной чистоты) точно отвешивают и растворяют в ацетонитриле с доведением объема точно до 100 мл и таким образом получают раствор стандарта. По 10 мкл растворов образца и стандарта исследуют с помощью жидкостной хроматографии в соответствии с требованиями общей методики исследования Фармакопеи Японии при указанных ниже условиях. Измеряют площади пиков РМ, полученных для растворов образца и стандарта, и содержание определяют по приведенной ниже формуле. Содержание (%) соединения (b)=AtWsP/(AsWt),At - площадь пика РМ, полученного для раствора образца;As - площадь пика РМ, полученного для раствора стандарта;Wt - масса образца исследуемого РМ (мг);Ws - масса образца стандарта РМ (мг); Р - чистота стандарта РМ (%). Условия проведения ВЭЖХ. Колонка: Inertsil ODS-2, 4,6 мм (внутренний диаметр)150 мм. Подвижная фаза: MeCN-0,01 моль/л KH2PO4 смесь (5:1). Длина волны, при которой проводят измерения: 254 нм. Скорость потока: примерно 1 мл/мин. Температура, при которой проводят измерения: постоянная температура, равная примерно 40 С. Таблица 1 Площадь пика, % по данным ВЭЖХ. Рассчитано по данным количественного определения с помощью ВЭЖХ. 3) Расчет не проведен. В приведенной выше табл. 1 FLM в опыте 1 означает N-метил-N-[2-(диметиламино)этил]формамид,который обычно используют в качестве формилирующего реагента, и аббревиатуры для реагентов, использованных в опытах от 2 до 7, обозначают алкоксиалкилформамиды, указанные в приведенной ниже табл. 2. Таблица 2 Алкоксиалкилформамиды 2) Из полученных результатов ясно, что алкоксиалкилформамиды, соответствующие настоящему изобретению, можно эффективно использовать в качестве формилирующего реагента и их эффективность не хуже, чем у обычно использующегося FLM. Пример 2. Исследована реакция с алкоксиалкилформамидом [формула (I)] при температуре, равной примерно от -15 до 0 С. н-Бутиллитий (1,6 М в н-гексане, 4,8 мл, 5,521,4 ммоль) в атмосфере аргона при температуре от-15 до 0 С (эту температуру поддерживают во время реакции) по каплям прибавляют к раствору 2 метокси-6-(триметилсилил)пиридина (МТР, 1,00 г, 5,52 ммоль) в сухом ТГФ (13,2 мл), перемешивают в течение 1 ч и затем по каплям прибавляют раствор FEO (0,868 г, 5,521,2 ммоль) в сухом ТГФ (1 мл) и перемешивают в течение 1 ч. Затем по каплям прибавляют н-бутиллитий (1,6 М в н-гексане, 7,0 мл,5,522,0 ммоль) и перемешивают в течение 1 ч и затем по каплям прибавляют раствор йода (3,64 г,5,522,6 ммоль) в сухом ТГФ (5,5 мл) и перемешивают в течение 30 мин. После повышения температуры до комнатной температуры прибавляют 10% Na2SO4 (количество, необходимое для удаления йода) и перемешивают в течение 10 мин и затем прибавляют воду, рассол и н-гексан (50 мл). Органический слой отделяют, сушат над Na2SO4, фильтруют и затем концентрируют досуха (40 С, 15 мм рт.ст.). Остаток(1,80 г, прозрачная желтая жидкость) количественно исследуют с помощью ВЭЖХ и определяют содержание (59,8%) и выход (58%) РМ. Количественное определение с помощью ВЭЖХ проводят по тем же- 10013473 методикам и при тех же условиях, что и в примере 1. 1 Н-ЯМР (400 МГц, CDCl3) : 0,30 (9 Н, s, ТМС (тетраметилсилан, 4,05 (3 Н, s, СН 3 О), 7,67 (1 Н, s,пиридин-Н), 10,19 (1 Н, s, CHO). ИК (инфракрасная спектроскопия) (пленка жидкости) (см-1): 2955, 1697 (СНО), 1551, 1512, 1331,1250, 1022, 837. ИЭ-МС (масс-спектроскопия с ионизацией электрораспылением) (m/z): 335 [М]+, 320 (100%). При использовании алкоксиалкилформамидов [формула (I)] выходы такого же порядка, что и в примере 1, получают при температуре реакции, равной от -15 до 0 С, которая ближе к комнатной температуре. Пример 3. Исследовано, можно ли после формилирования алкоксиалкилформамидом, соответствующим настоящему изобретению, ввести в производные метоксипиридина другие заместители при использовании не йода, а других электрофилов. Реакционные процессы описаны следующим образом. Синтез 2-метокси-4-метил-6-(триметилсилил)пиридин-3-карбальдегида (Ме-МТРС). н-Бутиллитий (1,6 М в н-гексане, 2,8 мл, 2,761,6 ммоль) в атмосфере аргона при температуре от-15 до 0 С по каплям прибавляют к раствору 2-метокси-6-(триметилсилил)пиридина (МТР, 0,500 г,2,76 ммоль) в сухом ТГФ (6,6 мл) и перемешивают при такой же температуре в течение 1 ч и затем при такой же температуре по каплям прибавляют раствор FEO (0,434 г, 2,761,2 ммоль) в сухом ТГФ (3 мл) и перемешивают при такой же температуре в течение 1 ч. Затем при такой же температуре по каплям прибавляют н-бутиллитий (1,6 М в н-гексане, 2,4 мл, 2,761,4 ммоль) и перемешивают при такой же температуре в течение 2 ч и затем охлаждают примерно до -70 С и одной порцией прибавляют раствор метилйодида (515 мкл, 2,763,0 ммоль) в сухом ТГФ (3 мл) и перемешивают при температуре, равной примерно -70 С, в течение 1 ч. Температуру повышают до комнатной температуры, затем прибавляют воду,рассол и н-гексан (50 мл). Органический слой отделяют, сушат над Na2SO4, фильтруют и затем концентрируют досуха. Остаток очищают с помощью хроматографии среднего давления на колонке с силикагелем (н-гексан:этилацетат=500:1), необходимые фракции объединяют и концентрируют досуха и получают Ме-МТРС (0,331 г, 1,48 ммоль, 54%) в виде желтоватой прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 0,30 (9 Н, s, ТМС), 2,56 (3 Н, s, СН 3), 4,05 (3 Н, s, СН 3 О), 6,97 (1H, s,ароматический Н), 10,54 (1 Н, s, CHO). ИК (пленка жидкости) (см-1): 2955, 1670 (СНО), 1547, 1339, 1245, 1092, 841. ИЭ-МС (m/z): 223 [М]+,208 (100%). Синтез 2-метокси-4,6-бис-(триметилсилил)пиридин-3-карбальдегида (ТМС-МТРС). н-Бутиллитий (1,6 М в н-гексане, 2,8 мл, 2,761,6 ммоль) в атмосфере аргона при температуре от-15 до 0 С (эту температуру поддерживают во время реакции) по каплям прибавляют к раствору 2 метокси-6-(триметилсилил)пиридина (МТР, 0,500 г, 2,76 ммоль) в сухом ТГФ (6,6 мл) и перемешивают в течение 1 ч и затем по каплям прибавляют раствор FEO (0,434 г, 2,761,2 ммоль) в сухом ТГФ (2 мл) и перемешивают в течение 1 ч. Затем по каплям прибавляют н-бутиллитий (1,6 М в н-гексане, 2,4 мл,2,761,4 ммоль) и перемешивают в течение 1 ч и затем по каплям прибавляют раствор хлортриметилсилана (697 мкл, 2,762,0 ммоль) в сухом ТГФ (3 мл) и перемешивают в течение 1 ч. Температуру повышают до комнатной температуры, затем прибавляют воду, рассол и н-гексан (50 мл). Органический слой отделяют, сушат над Na2SO4, фильтруют и затем концентрируют досуха. Остаток очищают с помощью хроматографии среднего давления на колонке с силикагелем (н-гексан) и необходимые фракции объединяют и концентрируют досуха. ТМС-МТРС (0,305 г, 1,08 ммоль, 39%) получают в виде бесцветной прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 0,30 (9 Н, s, ТМС), 0,31 (9 Н, s, ТМС), 4,06 (3 Н, s, СН 3 О), 7,37 (1 Н, d,J=0,7 Гц, ароматический Н), 10,48 (1 Н, d, J=0,7 Гц, СНО). ИК (пленка жидкости) (см-1): 2955, 1690 (СНО), 1512, 1323, 1250, 841. ИЭ-МС (m/z): 281 [М]+, 266(100%). Синтез 2-метокси-6-триметилсилил-4-(метилтио)пиридин-3-карбальдегида (MeS-MTPC). Проводят процедуру и последующую обработку, аналогичную использованным для синтеза МеМТРС (вместо метилйодида используют диметилдисульфид, 735 мкл, 2,763,0 ммоль). Остаток очищают с помощью хроматографии среднего давления на колонке с силикагелем (после элюирования примесей с помощью н-гексана и смеси н-гексан:этилацетат=500:1), необходимые фракции объединяют и концентрируют досуха и MeS-MTPC (0,384 г, 1,70 ммоль, 62%) получают в виде желтоватого твердого вещества. Н-ЯМР (400 МГц, CDCl3) : 0,31 (9 Н, s, ТМС), 2,44 (3 Н, s, MeS), 4,01 (3 Н, s, MeO), 7,03 (1 Н, s, ароматический Н), 10,50 (1H, s, СНО). ИК (KBr) (см-1): 2959, 1666 (СНО), 1555, 1504, 1339, 1246, 1038, 837. ИЭ-МС (m/z): 255 [М]+, 240. Синтез 4-хлор-2-метокси-6-(триметилсилил)пиридин-3-карбальдегида (Cl-МТРС). Проводят процедуру и последующую обработку, аналогичную использованным для синтеза МеМТРС (вместо метилйодида используют гексахлорэтан, 1,96 г, 2,763,0 ммоль). Остаток очищают с помощью хроматографии среднего давления на колонке с силикагелем (н-гексаннгексан:этилацетат=500:1250:1), необходимые фракции объединяют и концентрируют досуха и CIMTPC (0,285 г, 1,17 ммоль, 42%) получают в виде бледно-желтой прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 0,31 (9 Н, s, ТМС), 4,08 (3 Н, s, MeO), 7,17 (1 Н, s, ароматический Н),10,46 (1 Н, s, СНО). ИК (пленка жидкости) (см-1): 2955, 1701 (СНО), 1562, 1531, 1339, 1250, 1034, 841. ИЭ-МС (m/z): 245, 243 [М]+ (100%). Синтез 4-бром-2-метокси-6-(триметилсилил)пиридин-3-карбальдегида (Br-МТРС). Проводят процедуру и последующую обработку, аналогичную использованным для синтеза МеМТРС (вместо метилйодида используют тетрабромид углерода, 2,74 г, 2,763,0 ммоль). Остаток очищают с помощью хроматографии среднего давления на колонке с силикагелем (н-гексан:этилацетат=500:1),необходимые фракции объединяют и концентрируют досуха и Br-МТРС (0,499 г, 1,73 ммоль, 63%) получают в виде коричневой прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 0,31 (9 Н, s, ТМС), 4,07 (3 Н, s, МеО), 7,36 (1 Н, s, ароматический Н),10,37 (1 Н, s, СНО). ИК (пленка жидкости) (см-1): 2955, 1701 (СНО), 1558, 1524, 1339, 1250, 1026, 841. ИЭ-МС (m/z): 289, 287 [М]+, 274, 272, 197, 182 (100%). Синтез 4-йод-2-метоксипиридин-3-карбальдегида (DeTMS-PM). трет-Бутиллитий (1,5 М в н-пентане, 6,9 мл, 9,161,1 ммоль) по каплям прибавляют к раствору 2 метоксипиридина (1,00 г, 9,16 ммоль) в сухом ТГФ (7,5 мл) при температуре от -75 до -60 С и перемешивают при такой же температуре в течение 1 ч. При такой же температуре по каплям прибавляют раствор FEO (1,44 г, 9,161,2 ммоль) в сухом ТГФ (10 мл) и перемешивают в течение 30 мин. Температуру повышают примерно до -23 С, прибавляют диметиловый эфир этиленгликоля (ДМЭ, квалификации "для органического синтеза", 7,5 мл) и затем при температуре от -15 до -25 С по каплям прибавляют нбутиллитий (1,6 М в н-гексане, 9,9 мл, 9,161,7 ммоль) и перемешивают при температуре, равной примерно -23 С, в течение 2 ч. Смесь охлаждают примерно до -70 С, одной порцией прибавляют раствор йода (4,42 г, 9,161,9 ммоль) в ДМЭ (10 мл) и перемешивают при температуре, равной примерно -70 С, в течение 30 мин. Температуру повышают до комнатной температуры, прибавляют 10% Na2SO3 (количество, необходимое для удаления йода) и перемешивают в течение 10 мин, затем прибавляют воду, рассол и этилацетат (50 мл). Органический слой отделяют, сушат над Na2SO4, фильтруют и затем концентрируют досуха. Остаток (коричневое твердое вещество) растворяют в хлороформе и очищают с помощью хроматографии среднего давления на колонке с силикагелем (н-гексан:этилацетат=1000:1 (100:1. Необходимые фракции концентрируют досуха и DeTMS-PM (1,31 г, 4,98 ммоль, 54%) получают в виде желтого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) : 4,05 (3 Н, s, МеО), 7,54 (1 Н, d, J=5,4 Гц, ароматический Н), 7,85 (1 Н, d,J=5,4 Гц, ароматический Н), 10,21 (1 Н, s, CHO). ИК (KBr) (см-1): 2943, 1697 (СНО), 1543, 1458, 1362, 1015. ИЭ-МС (m/z): 263 [М]+ (100%). Синтез 6-хлор-4-йод-2-метоксипиридин-3-карбальдегида (6Cl-PM). трет-Бутиллитий (1,5 М в н-пентане, 5,2 мл, 6,971,1 ммоль) по каплям прибавляют к раствору 6 хлор-2-метоксипиридина (1,00 г, 6,97 ммоль) в сухом ТГФ (7,5 мл) при температуре от -75 до -60 С и перемешивают при такой же температуре в течение 1 ч. При такой же температуре по каплям прибавляют раствор FEO (1,10 г, 6,971,2 ммоль) в сухом ТГФ (10 мл) и перемешивают в течение 30 мин. Температуру повышают примерно до -23 С, прибавляют диметиловый эфир этиленгликоля (ДМЭ, квалификации "для органического синтеза", 7,5 мл) и затем при температуре от -15 до -25 С по каплям прибавляют н-бутиллитий (1,6 М в н-гексане, 7,5 мл, 6,971,7 ммоль) и перемешивают при температуре, равной примерно -23 С, в течение 2 ч. Смесь охлаждают примерно до -70 С и одной порцией прибавляют раствор йода (3,36 г, 6,971,9 ммоль) в ДМЭ (10 мл) и перемешивают при температуре, равной примерно -70 С, в течение 30 мин. Температуру повышают до комнатной температуры, прибавляют 10% Na2SO3 (количество, необходимое для исчезновения йодного окрашивания) и перемешивают в течение 10 мин, затем прибавляют воду, рассол и этилацетат (50 мл). Органический слой отделяют, сушат над Na2SO4, фильтруют и затем концентрируют досуха. Остаток (коричневое твердое вещество) растворяют в хлороформе и очищают с помощью хроматографии среднего давления на колонке с силикагелем (нгексан:этилацетат=500:1). Необходимые фракции концентрируют досуха и 6Cl-PM (1,17 г, 3,95 ммоль,57%) получают в виде желтого твердого вещества. 1 Н-ЯМР (400 МГц, CDCl3) : 4,07 (3 Н, s, МеО), 7,58 (1 Н, d, J=0,5 Гц, ароматический Н), 10,16 (1 Н,- 12013473d, J=0,5 Гц, СНО). ИК (KBr) (см-1): 2951, 1690 (СНО), 1539, 1350, 1261, 1007. ИЭ-МС (m/z): 299, 297 [М]+ (100%). В положение 4 (R') пиридинового кольца можно ввести алкильную группу, силильную группу, другой галоген, атом серы и т.п. В случае проведения синтеза других соединений, для которых известно, что они являются промежуточными продуктами синтеза каркаса КПТ (R=Н, R'=I и R=Cl, R'=I), искомые соединения получают с выходами, близкими к выходу при синтезе соединения (b). Полученные выше результаты показывают, что алкоксиалкилформамиды [формула (I)] обладают универсальной способностью формилировать и вводить заместители в орто-положение к формильной группе. Пример 4. На стадии получения соединения (d) из соединения (с) в качестве побочного продукта образуется экзо-форма (d'). Чтобы повысить соотношение продуктов эндо:экзо проведено тщательное исследование условий проведения реакции. Соединение (с) (0,30 г, 0,767 ммоль) растворяют в растворителе (6,1 мл), указанном в табл. 3, при комнатной температуре прибавляют N,N-диизопропилэтиламин (1,04 мл, 6,14 ммоль, 8,0 экв.) и ацетат палладия (17 мг, 0,077 ммоль) с прибавлением или без прибавления тетрабутиламмонийбромида (0,25 г,0,767 ммоль) и нагревают с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры, прибавляют 10% Na2SO3 (4,8 мл) и н-гексан (50 мл) и затем собирают органические слои(из 3 слоев отбирают верхний и средний). Органические слои дополнительно промывают с помощью 1 н.HCl (6,1 мл) и затем водой (20 мл 2) и затем сушат над безводным Na2SO4, фильтруют и концентрируют досуха при пониженном давлении. Остаток анализируют с помощью ВЭЖХ и определяют соотношение эндо/экзо и выход. Выход и соотношение эндо/экзо приведены в табл. 3. 1 Н-ЯМР (400 МГц, CDCl3) : 0,26 (9 Н, s, ТМС), 1,12 (3 Н, t, J=7,3 Гц, СН 2 СН 3), 2,31 (2 Н, dq, J=1,0,7,3 Гц, СН 2 СН 3), 3,94 (3 Н, s, ОСН 3), 5,00 (2 Н, s, OCH2), 6,51 (1 Н, t, J=1,0 Гц, ОСН=), 6,83 (1 Н, s, пиридинН). ИК (пленка жидкости) (см-1): 2963, 1634, 1583, 1342, 835. ИЭ-МС (m/z): 263 [М+], 248 (100%). Условия для определения соотношения геометрических изомеров соединения d (ВЭЖХ). Детектор: UV спектрометр (254 нм). Колонка: Inertsil ODS-2, 5 мкм, 4,6 мм (внутренний диаметр)250 мм. Температура колонки: постоянная температура, равная примерно 40 С. Подвижная фаза: смесь ацетонитрил/0,01 моль/л дигидрофосфат калия (5:1). Скорость потока: примерно 1 мл/мин. Длительность определения: примерно 50 мин. Инжектируемый объем: 10 мкл, 10 мг/10 мл (ацетонитрил). Методика количественного определения содержания соединения d. Примерно 20 мг исследуемого образца точно отвешивают и растворяют в ацетонитриле с доведением объема точно до 50 мл и таким образом получают раствор образца. Примерно 20 мг стандартного соединения (d) (очищенный на колонке продукт известной чистоты) точно отвешивают и растворяют в ацетонитриле с доведением объема точно до 50 мл и таким образом получают раствор стандарта. По 10 мкл растворов образца и стандарта исследуют с помощью жидкостной хроматографии в соответствии с требованиями общей методики исследования Фармакопеи Японии при условиях, необходимых для определения соотношения геометрическим изомеров соединения (d). Измеряют площади пиков соединения(d), полученных для растворов образца и стандарта и содержание определяют по приведенной ниже формуле. Содержание (%) соединения (d)=AtWsP/(AsWt)At - площадь пика соединения d, полученного для раствора образца.As - площадь пика соединения d, полученного для раствора стандарта.Wt - масса образца исследуемого соединения (d) (мг).Ws - масса образца стандарта соединения (d) (мг). Р - чистота стандарта соединения (d) (%). Соотношение получено путем коррекции площади, полученной с помощью ВЭЖХ, по интенсивности пика (254 нм). 2) Эндо-форма, количественное определение с помощью ВЭЖХ. Число в скобках - выход соединения (с) (площадь, % по данным ВЭЖХ). В случае если содержится четвертичная аммониевая соль, реакция ускоряется, и соотношение продуктов также улучшается (опыт 1 по сравнению с опытом 2 и опыт 14 по сравнению с опытом 15). Наличие воды также приводит к эффективному стимулированию реакции (опыт 2 по сравнению с опытом 15 и опыт 3 по сравнению с опытом 10). В случае объединения органических растворителей из группы простых эфиров и группы нитрилов(опыты 10, 11, 12 и 15) селективность заметно улучшается и выход является лучшим, чем в случаях, когда их используют по отдельности (опыты 4, 5 и 6) или в других комбинациях (опыты 7 и 9). Смесь хлороформ-ацетонитрил-вода приводит к хорошему соотношению эндо:экзо, но в качестве побочных продуктов образуются другие примеси и выход является средним. Пример 5. Затем исследовано соотношение растворителей (ИПЭ-MeCN-вода). Условия проведения реакции являются такими же, как в примере 4. Результаты приведены в табл. 4; в случае, если соотношение растворителей меняется, не происходит значительного изменения соотношения эндо/экзо. Поэтому возможно проведение реакции при различных соотношениях растворителей. Таблица 4 Соотношение получено путем коррекции площади, полученной с помощью ВЭЖХ, по интенсивности пика (254 нм). 2) Эндо-форма, количественное определение с помощью ВЭЖХ. Пример 6. Затем был проведен эксперимент по замене растворителя, катализатора и основания. Соединение (с) (0,30 г, 0,767 ммоль) растворяют в растворителе (6,1 мл), указанном в табл. 5, при комнатной температуре прибавляют тетрабутиламмонийбромид (0,25 г, 0,767 ммоль), основание- 14013473 охлаждают до комнатной температуры и фильтруют, к раствору прибавляют 10% Na2SO3 (4,8 мл) и нгексан (50 мл) и затем собирают органические слои (из 3 слоев отбирают верхний и средний). Органические слои дополнительно промывают с помощью 1 н. HCl (6,1 мл) и затем водой (20 мл 2) и затем сушат над безводным Na2SO4, фильтруют и концентрируют досуха при пониженном давлении. Остаток анализируют с помощью ВЭЖХ и определяют соотношение эндо/экзо и выход. Результаты приведены в табл. 5. В случае если растворителем является смесь ацетонитрил-вода, катализатором является хлорид палладия(II) и основанием является триэтиламин, получаются очень хорошие результаты (опыт 8) и для выхода (93%), и для соотношения эндо/экзо (29,8:1). Соотношение эндо/экзо скорректировано по отношению интенсивностей пиков в ВЭЖХ (254 нм). Таблица 5 Нагревание с обратным холодильником. а) 9:1, b) 4:3, с) 4:3:1, d) 7:1, е) ВЭЖХ (с коррекцией по отношениям интенсивностей пиков), f) 4 экв. Пример 7. Затем был проведен эксперимент по замене катализатора и основания. Соединение (с) (0,30 г, 0,767 ммоль) растворяют в смеси диизопропиловый эфир-ацетонитрил-вода(4:3:1, 6,1 мл), при комнатной температуре прибавляют тетрабутиламмонийбромид (0,25 г, 0,767 ммоль),триэтиламин (0,85 мл, 6,14 ммоль, 8 экв.) или карбонат калия (0,212 г, 1,53 ммоль, 4 экв.) и катализатор,указанный в табл. 5 (0,077 ммоль), и нагревают с обратным холодильником. Реакционную смесь охлаждают до комнатной температуры и фильтруют, прибавляют 10% Na2SO3 (4,8 мл) и н-гексан (50 мл) и затем собирают органические слои (из 3 слоев отбирают верхний и средний). Органические слои дополнительно промывают с помощью 1 н. HCl (6,1 мл), затем водой (20 мл 2), сушат над безводным Na2SO4,фильтруют и концентрируют досуха при пониженном давлении. Остаток анализируют с помощью ВЭЖХ и определяют соотношение эндо/экзо и выход. Результаты приведены в табл. 6. Таблица 6 Соотношение получено путем коррекции площади, полученной с помощью ВЭЖХ, по интенсив- 15013473 ности пика (254 нм). 2) Эндо-форма, число в скобках - выход соединения (с) (площадь, % по данным ВЭЖХ). Использование триэтиламина в качестве основания приводит к увеличению соотношения эндо:экзо(опыт 15 в табл. 3 по сравнению с опытом 1 в табл. 6). Катализаторы в опытах 5-8 приводят к дополнительному улучшению селективности и соединение (d) получают с хорошим выходом. Как указано выше, при использовании смеси (растворитель из группы простых эфиров) - вода или смеси (растворитель из группы простых эфиров) - (растворитель из группы нитрилов) - вода в качестве растворителя, триэтиламина в качестве основания и хлорида палладия(II), ацетата палладия(II), палладия на угле, гидроксида палладия на угле, бис-(ацетонитрил)палладия(II) хлорида, бис-(бензонитрил)палладия(II) хлорида или бис-(дибензилиденацетон)палладия(0) в качестве катализатора в присутствии четвертичной аммониевой соли, соединение (d) получают с лучшим соотношением эндо:экзо и более высоким выходом, чем в сравнительном примере [табл. 5] при известных из литературы условиях. Сравнительный пример. Сообщают, что использование комплекса Вилкинсона при внутримолекулярной реакции Хека аналога соединения (С) приводит к улучшению соотношения эндо:экзо (Bankston, D.; Fang, F.; Huie, E.; Xie,S., J. Org. Chem. 1999, 64, 3461-3466). Для соединения (С) (опыт 1) использованы описанные условия и исследованы условия проведения реакции, такие как количество прибавляемого комплекса Вилкинсона,однако не обнаружено ни увеличения соотношения эндо/экзо, ни повышения выхода. Таблица 7(Температура прибавленного реагента)(Температура проведения реакции). 5) Соотношение получено путем коррекции площади, полученной с помощью ВЭЖХ, по интенсивности пика (254 нм). 6) Эндо-форма. Способы получения и методы анализа соединений, использованных в приведенных выше примерах,проиллюстрированы ниже. Синтез N-этоксиэтил-N-метилбензиламина (BnEO). Методика 1. NaH (предварительно промытый гексаном, 8,78 г, 0,3051,2 моль) при комнатной температуре в атмосфере аргона прибавляют к раствору N-метилбензиламина (39 мл, 0,305 моль) в сухом ТГФ (300 мл). После перемешивания при комнатной температуре в течение 30 мин по каплям прибавляют раствор бромэтилэтилового эфира (51 мл, 0,3051,5 моль) в сухом ТГФ (100 мл) и затем нагревают с обратным холодильником в атмосфере аргона в течение 24 ч. После охлаждения до комнатной температуры для растворения нерастворенных веществ осторожно прибавляют воду (350 мл), затем прибавляют этилацетат (350 мл). Органический слой отделяют, дополнительно промывают рассолом (200 мл) и затем концентрируют досуха. Поскольку нерастворимые вещества осаждены в остаточной фракции, их отфильтровывают и промывают этилацетатом и фильтрат повторно концентрируют досуха. Остаток очищают с помощью перегонки в вакууме (собирают фракцию при давлении от 1,0 до 1,1 кПа и температуре от 95 до 110 С) и получают BnEO (49,73 г, 0,257 моль, 84%) в виде бесцветной прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 1,21 (3 Н, t, J=7,1 Гц, СН 3), 2,27 (3 Н, s, CH3), 2,62 (2 Н, t, J=6,1 Гц, СН 2),3,49 (2 Н, квартет, J=7,1 Гц, СН 2), 3,57 (2 Н, s, CH2), 3,57 (2 Н, t, J=6,1 Гц, СН 2), 7,22-7,34 (5 Н, m, ароматический Н). ИК (пленка жидкости) (см-1): 3028, 2866, 1454, 1111 (эфир), 737 (монозамещенный бензол), 698(монозамещенный бензол). ИЭ-МС (m/z): 193 [М]+, 134 (100%). Методика 2. Бромэтилэтиловый эфир (1,3 мл, 7,761,3 ммоль) при комнатной температуре прибавляют к раствору N-метилбензиламина (1,0 мл, 7,76 ммоль) в метаноле (5 мл) и нагревают с обратным холодильником в течение 18 ч. После охлаждения до комнатной температуры остаток, полученный путем концентрирования досуха, смешивают с водой и насыщенным раствором NaHCO3 до щелочной реакции (по индикаторной бумаге для определения рН) и экстрагируют хлороформом (2 раза). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и затем концентрируют досуха. Оста 2)- 16013473 ток очищают с помощью хроматографии среднего давления на колонке с силикагелем (нгексан:этилацетат=4:1), искомую фракцию концентрируют досуха и получают BnEO (0,907 г, 4,69 ммоль,61%) в виде бледно-желтой прозрачной жидкости. Синтез N-этоксиэтил-N-метилформамида (FEO). 10% Pd-C (производства компании Kawaken Fine Chemicals, Co. Ltd., M, сухой, влажность 1,7%,2,24 г) и муравьиную кислоту (43 мл, 0,2235 моль) в атмосфере аргона прибавляют к раствору BnEO(43,11 г, 0,223 моль) в метаноле (430 мл) и нагревают с обратным холодильником в течение 90 мин. После охлаждения до комнатной температуры Pd-C удаляют фильтрованием через слой целита, промывают метанолом и фильтрат концентрируют досуха. К остатку прибавляют толуол (430 мл) и нагревают с обратным холодильником в течение 20 ч, образующуюся в качестве побочного продукта воду удаляют с помощью ловушки Дина-Штарка. После охлаждения до комнатной температуры прибавляют K2CO3(90 г, 0,2233 моль) и перемешивают при комнатной температуре в течение 3 ч. Нерастворимые вещества удаляют фильтрованием, промывают толуолом и затем фильтрат концентрируют досуха. Остаток очищают с помощью перегонки в вакууме с помощью фракционирующей колонки Vigreux (15 см) (собирают фракцию при давлении от 0,5 до 0,7 кПа и температуре от 78 до 80 С) и получают FEO (24,36 г, 0,186 моль, 83%) в виде бесцветной прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 1,18, 1,19 (3 Н, все t, все J=7,1 Гц, СН 3), 2,92, 3,04 (3 Н, все s, СН 3), 3,363,57 (6 Н, m, СН 23), 8,06 (1 Н, s, CHO). ИК (пленка жидкости) (см-1): 2974, 2866, 1678 (СНО), 1396, 1119 (эфир). ИЭ-МС (m/z): 131 [M+], 85,72 (100%). Синтез N-метоксиэтил-N-метилбензиламина (BnMO). Синтез BnMO проводят аналогично синтезу BnEO (методика 2) с использованием Nметилбензиламина (15 мл, 0,116 моль), бромэтилметилового эфира (12 мл, 0,1161,1 ммоль) и этанола(200 мл) в качестве растворителя. BnMO (12,09 г, 67,46 ммоль, выход 58%) получают в виде бледножелтой прозрачной жидкости. Очистку проводят на колонке среднего давления с силикагелем (этилацетат). 1 Н-ЯМР (400 МГц, CDCl3) : 2,27 (3 Н, s, СН 3), 2,61 (2 Н, t, J=5,9 Гц, СН 2), 3,34 (3 Н, s, СН 3), 3,52 (2 Н,t, J=5,9 Гц, СН 2), 3,56 (2 Н, s, СН 2), 7,22-7,33 (5 Н, m, ароматический Н). ИК (пленка жидкости) (см-1): 3028, 2874, 1454, 1119 (эфир), 737 (монозамещенный бензол), 698(монозамещенный бензол). ИЭ-МС (m/z):179 [M]+, 134, 91 (100%). Синтез N-метоксиэтил-N-метилформамида (FMO). Синтез FMO проводят аналогично синтезу FEO с использованием BnMO (10,00 г, 55,79 ммоль).FMO (3,60 г, 30,70 ммоль, выход 55%) получают в виде бесцветной прозрачной жидкости. (При очистке с помощью перегонки в вакууме собирают фракцию при давлении 4,2 кПа и температуре от 47 до 54 С.) 1 Н-ЯМР (400 МГц, CDCl3) : 2,86, 2,98 (3 Н, все s, СН 3), 3,00, 3,00 (3 Н, все s, СН 3), 3,34-3,52 (4 Н, m,CH2CH2), 8,00, 8,01 (1 Н, все s, СНО). ИК (пленка жидкости) (см-1): 2928, 2878, 1674 (СНО), 1396, 1119 (эфир). ИЭ-МС (m/z): 117 [M]+,85, 72 (100%). Синтез N-этил-N-метоксиэтилбензиламина (BnEA). Синтез BnEA проводят аналогично синтезу BnEO (методика 2) с использованием Nэтилбензиламина (15 мл, 0,101 моль), бромэтилметилового эфира (0,1011,2 моль) и этанола (100 мл) в качестве растворителя. BnEA (9,17 г, 47,46 ммоль, выход 47%) получают в виде желто-оранжевой прозрачной жидкости [очистку проводят с помощью хроматографии среднего давления на колонке с силикагелем (н-гексан:этилацетат=3:2)]. 1 Н-ЯМР (400 МГц, CDCl3) : 1,07 (3 Н, t, J=7,1 Гц, СН 3), 2,59 (2 Н, квартет, J=7,1 Гц, СН 2), 2,68 (2 Н, t,J=6,3 Гц, СН 2), 3,33 (3 Н, s, СН 3), 3,48 (2 Н, t, J=6,3 Гц, СН 2), 3,65 (2 Н, s, СН 2), 7,22-7,38 (5 Н, m, ароматический Н). ИК (пленка жидкости) (см-1): 3028, 2970, 2812, 1454, 1123 (эфир), 733 (монозамещенный бензол),698 (монозамещенный бензол). ИЭ-МС (m/z): 193 [М]+, 148 (100%). Синтез N-этил-N-метоксиэтилформамида (FEA). Синтез FEA проводят аналогично синтезу FEO с использованием BnEA (5,57 г, 28,82 ммоль). FEA(2,45 г, 18,66 ммоль, выход 65%) получают в виде бесцветной прозрачной жидкости (при очистке с помощью перегонки в вакууме собирают фракцию при давлении от 0,9 до 1,0 кПа и температуре от 85 до 86 С). 1 Н-ЯМР (400 МГц,CDCl3) : 1,14, 1,19 (3 Н, все t, все J=7,1 Гц, СН 3), 3,34, 3,35 (3 Н, все s, СН 3), 3,373,55 (6 Н, m, СН 23), 8,03, 8,10 (5 Н, m, ароматический Н). ИК (пленка жидкости) (см-1): 2936, 2878, 1670 (СНО), 1431, 1119 (эфир). ИЭ-МС (m/z): 131 [M]+,99, 86 (100%). Синтез N-этоксиэтил-N-этилбензиламина (BnEE). Синтез FEA проводят аналогично синтезу BnEO (методика 2) с использованием N-этилбензиламина(15 мл, 0,101 моль), бромэтилэтилового эфира (17 мл, 0,1011,5 моль) и этанола (100 мл) в качестве рас- 17013473 творителя. BnEE (12,79 г, 61,69 ммоль, выход 61%) получают в виде бледно-желтой прозрачной жидкости [очистку проводят с помощью хроматографии среднего давления на колонке с силикагелем (этилацетат:н-гексан=4:1)]. 1 Н-ЯМР (400 МГц, CDCl3) : 1,08 (3 Н, t, J=7,1 Гц, СН 3), 1,21 (3 Н, t, J=7,1 Гц, СН 3), 2,61 (2 Н, квартет,J=7,1 Гц, СН 2), 2,71 (2 Н, t, J=6,6 Гц, СН 2), 3,49 (2 Н, квартет, J=7,1 Гц, СН 2), 3,54 (2 Н, t, J=6,6 Гц, СН 2),3,67 (2 Н, s, CH2), 7,24-7,38 (5 Н, m, ароматический Н). ИК (пленка жидкости) (см-1): 3028, 2970, 1454, 1115 (эфир), 733 (монозамещенный бензол), 698(монозамещенный бензол). ИЭ-МС (m/z): 207[M]+, 148 (100%). Синтез N-этоксиэтил-N-этилформамида (FEE). Синтез FEE проводят аналогично синтезу FEO с использованием BnEE (10,00 г, 48,23 ммоль). FEE(4,80 г, 33,03 ммоль, выход 68%) получают в виде бесцветной прозрачной жидкости (при очистке с помощью перегонки в вакууме собирают фракцию при давлении от 0,8 до 0,9 кПа и температуре от 91 до 92 С). 1 Н-ЯМР (400 МГц, CDCl3) : 1,13, 1,17, 1,17, 1,19 (6 Н, все t, J=7,1 Гц, СН 32), 3,34-3,56 (8 Н, m,СН 24), 8,03, 8,09 (1 Н, все s, CHO). ИК (пленка жидкости) (см-1): 2974, 2870, 1674 (СНО), 1431, 1119 (эфир). ИЭ-МС (m/z): 145 [М]+, 99,86 (100%). Синтез N-метоксиметил-N-метилформамида (FMM).NaH (предварительно промытый н-гексаном, 6,71 г, 0,2541,1 моль) в атмосфере аргона при охлаждении в бане со льдом прибавляют к раствору N-метилформамида (15,00 г, 0,254 моль) в сухом ТГФ(150 мл) и перемешивают в течение 30 мин. В атмосфере аргона при такой же температуре по каплям прибавляют раствор хлорметилметилового эфира (24,54 г, 0,2541,2 моль) в сухом ТГФ (20 мл) и затем перемешивают в течение 2 ч и после этого перемешивают при комнатной температуре в течение 3 ч. После охлаждения в бане со льдом к реакционной смеси прибавляют н-гексан (100 мл) и перемешивают в течение 1 ч и затем нерастворимое вещество удаляют фильтрованием через слой целита. Остаток, полученный путем концентрирования фильтрата досуха (40 С, 15 мм рт.ст.), очищают с помощью перегонки в вакууме (собирают фракцию при давлении 1,6 кПа и температуре от 66 до 68 С) и получают FMM(7,90 г, 76,61 ммоль, 30%) в виде бесцветной прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 2,92, 2,98 (3 Н, все s, СН 3), 3,25, 3,29 (3 Н, все s, СН 3), 4,63, 4,77 (2 Н, все(100%). Синтез N-этоксипропил-N-метилформамида (FEP). Муравьиную кислоту (9,4 мл, 0,2081,2 моль) при комнатной температуре прибавляют к раствору 3-этоксипропиламина (25 мл, 0,208 моль) в толуоле (250 мл) и нагревают с обратным холодильником в течение 17 ч и образующуюся в качестве побочного продукта воду удаляют с помощью ловушки ДинаШтарка. После охлаждения до комнатной температуры прибавляют K2CO3 (14 г, 0,2080,5 моль) и перемешивают в течение 90 мин. Нерастворимое вещество удаляют фильтрованием, промывают толуолом и фильтрат концентрируют досуха. Остаток очищают с помощью перегонки в вакууме с помощью фракционирующей колонки Vigreux (15 см) (собирают фракцию при давлении 0,6 кПа и температуре от 114 до 115 С) и получают N-(3-этоксипропил)формамид (21,79 г, 0,166 моль, 80%) в виде бесцветной прозрачной жидкости.NaH (предварительно промытый н-гексаном, 2,01 г, 76,241,1 ммоль) в атмосфере аргона при охлаждении в бане со льдом прибавляют к раствору N-(3-этоксипропил)формамида (10,00 г, 76,24 ммоль) в сухом ТГФ (100 мл) и перемешивают в течение 30 мин. В атмосфере аргона при охлаждении в бане со льдом к реакционной смеси по каплям прибавляют раствор метилйодида (5,7 мл, 76,241,2 ммоль) в сухом ТГФ (10 мл) и затем перемешивают в течение 30 мин, и дополнительно перемешивают при комнатной температуре в течение 90 мин. Дополнительно прибавляют NaH (предварительно промытый нгексаном, 0,20 г, 76,240,1 ммоль) и перемешивают при комнатной температуре в течение 1 ч. После охлаждения в бане со льдом к реакционной смеси прибавляют н-гексан (100 мл) и перемешивают в течение 1 ч и затем нерастворимое вещество удаляют фильтрованием через слой целита. Остаток, полученный путем концентрирования фильтрата досуха, очищают с помощью перегонки в вакууме (собирают фракцию при давлении 0,6 кПа и температуре 91 С) и получают FEP (4,17 г, 28,68 ммоль, 38%) в виде бледножелтой прозрачной жидкости. 1 Н-ЯМР (400 МГц, CDCl3) : 1,19, 1,20 (3 Н, все t, все J=7,1 Гц, СН 3), 1,78-2,30 (2 Н, m, СН 2), 2,86,2,96 (3 Н, все s, СН 3), 3,45-3,50 (6 Н, m, СН 23), 8,03, 8,09 (1 Н, все s, CHO). ИК (пленка жидкости) (см-1): 2932, 2862, 1678 (СНО), 1397, 1111 (эфир). ИЭ-МС (m/z): 145 [М]+,116, 101, 72 (100%).- 18013473 Промышленное применение С помощью способа синтеза, соответствующего настоящему изобретению, можно синтезировать трициклические кетоны высокой чистоты в короткий период времени и путем использования этих промежуточных продуктов можно эффективно и на практике выполнить полный синтез аналогов КПТ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения трициклического кетона (k), описываемого приведенной ниже формулой, для синтеза аналогов камптотецина где Me означает метильную группу, Pr означает пропильную группу и t-Bu означает трет-бутильную группу,при этом способ предусматривает стадию (1) смешивания указанного выше соединения (а), соединения,описываемого формулой (I) где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом,равным от 1 до 3,и литиирующего реагента и последующее смешивание с йодирующим реагентом с получением соединения (b). 2. Способ получения трициклического кетона (k) по п.1, дополнительно предусматривающий стадию (2) смешивания и перемешивания в растворителе по меньшей мере одного типа палладиевого катализатора, выбранного из группы, включающей хлорид палладия(II), ацетат палладия(II), палладий на угле, гидроксид палладия на угле, бис-(ацетонитрил)палладий(II)дихлорид, бис-(бензонитрил)палладий(II)дихлорид и бис-(дибензилиденацетон)палладий(0), соединения (с), основания и четвертичной аммониевой соли с получением соединения (d). 3. Способ получения трициклического кетона (k) по п.1 или 2, в котором на стадии (1) используется соединение, описываемое формулой (I), где n равно 2. 4. Способ получения трициклического кетона (k) по любому из пп.1-3, в котором на стадии (1) литиирующим реагентом является н-бутиллитий. 5. Способ получения трициклического кетона (k) по любому из пп.2-4, в котором на стадии (2) растворителем является содержащий воду растворитель. 6. Способ получения трициклического кетона (k) по любому из пп.2-5, в котором на стадии (2) растворителем является смесь органического растворителя из группы нитрилов с водой. 7. Способ получения трициклического кетона (k) по любому из пп.2-6, в котором на стадии (2) растворителем является смесь органического растворителя из группы простых эфиров, органического растворителя из группы нитрилов и воды. 8. Применение трициклического кетона (k), полученного способом по любому из пп.1-7, для получения аналогов камптотецина. 9. Способ синтеза аналогов камптотецина, причем этот способ включает реакцию трициклического кетона (k), полученного способом по любому из пп.1-7, с 2'-амино-5'-гидроксипропиофеноном. 10. Способ получения формилированного производного метоксипиридина реакцией производного метоксипиридина с соединением (алкоксиалкилформамидом), описываемым формулой (I) где R и R' независимо означают алкил, содержащий 1 или 2 атома углерода, и n является целым числом,равным от 1 до 3. 11. Способ получения формилированного производного метоксипиридина по п.10, в котором используется соединение, описываемое формулой (I), где n равно 2. 12. Способ получения формилированного производного метоксипиридина по п.10 или 11, который проводят в присутствии н-бутиллития. 13. Способ получения формилированного производного метоксипиридина, который является способом получения соединения, описываемого формулой (II) где R означает галоген, атом водорода или триметилсилильную группу и R' означает галоген, алкильную,триметилсилильную или тиоалкильную группу,и в орто-положении к формильной группе, введенной с помощью способа получения по любому из пп.10-12, содержится электрофильный заместитель. 14. Алкоксиалкилформамид, описываемый формулой (I)
МПК / Метки
МПК: C07F 7/10, C07D 491/147, C07B 61/00, C07D 213/64, C07C 233/18, C07D 213/70
Метки: трициклического, способ, кетона, получения
Код ссылки
<a href="https://eas.patents.su/21-13473-sposob-polucheniya-triciklicheskogo-ketona.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения трициклического кетона</a>












