Гибридный белок антитела l19 к фибронектину ed-b и интерлейкина 12
Формула / Реферат
1. Конъюгат, включающий гетеродимер IL12, содержащий первую и вторую субъединицы, в котором и первая и вторая субъединицы связаны с молекулой антитела, лишенной Fc-фрагмента.
2. Конъюгат по п.1, отличающийся тем, что первая и вторая субъединицы гетеродимерного белка ковалентно связаны дисульфидной связью.
3. Конъюгат по п.1 или 2, отличающийся тем, что молекула антитела представляет собой одноцепочечное антитело Fv (scFv).
4. Конъюгат по п.1 или 2, отличающийся тем, что молекула антитела является молекулой антитела с единственным доменом (dAb).
5. Конъюгат по любому из пп.1-4, отличающийся тем, что первая субъединица конъюгирована с молекулой антитела в качестве первого гибридного белка и вторая субъединица конъюгирована с молекулой антитела в качестве второго гибридного белка.
6. Конъюгат по любому из пп.1-5, отличающийся тем, что конъюгат имеет молекулярную массу 250000 или меньше.
7. Конъюгат по п.6, отличающийся тем, что конъюгат имеет молекулярную массу 150000 или меньше.
8. Конъюгат по п.7, отличающийся тем, что конъюгат имеет молекулярную массу 120000 или меньше.
9. Конъюгат по любому из пп.1-8, отличающийся тем, что две молекулы антитела идентичны.
10. Конъюгат по любому из пп.1-9, включающий гетеродимер IL12 человека, конъюгированный с двумя молекулами антител, лишенных Fc-фрагментов, и расположенный между ними; причем
гетеродимер IL12 имеет первую и вторую субъединицы;
первая субъединица конъюгирована с молекулой антитела, лишенной Fc-фрагмента, в качестве первого гибридного белка и
вторая субъединица конъюгирована с молекулой антитела, лишенной Fc-фрагмента, в качестве второго гибридного белка.
11. Конъюгат по п.10, отличающийся тем, что первый гибридный белок имеет последовательность аминокислот, показанную в SEQ ID NO: 1.
12. Конъюгат по п.10 или 11, отличающийся тем, что второй гибридный белок имеет последовательность аминокислот, показанную в SEQ ID NO: 2.
13. Конъюгат по любому из пп.1-10, отличающийся тем, что одна или две молекулы антитела специфично связываются с компонентами внеклеточного матрикса, связанными с ростом новообразований и/или ангиогенезом.
14. Конъюгат по п.13, отличающийся тем, что компонент представляет собой фибронектин ED-B.
15. Конъюгат по п.14, отличающийся тем, что молекула антитела представляет собой антитело scFv(L19), вариабельная область тяжелой цепи которого включает последовательности аминокислот SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, a вариабельная область легкой цепи которого включает последовательности аминокислот SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30.
16. Конъюгат по п.15, отличающийся тем, что молекула антитела представляет собой антитело scFv(L19), имеющее последовательность аминокислот, показанную в SEQ ID NO: 5.
17. Конъюгат по п.13, отличающийся тем, что компонент матрикса представляет собой изоформу тенасцина-С.
18. Конъюгат по п.17, отличающийся тем, что молекула антитела представляет собой антитело scFv(TN11), имеющее последовательность аминокислот, показанную в SEQ ID NO: 21.
19. Способ получения конъюгата по любому из пп.5-18, включающий
экспрессию первого и второго гибридных белков и
конъюгирование первой и второй субъединиц с образованием гетеродимера IL12.
20. Способ по п.19, включающий экспрессию первого и второго гибридных белков в клетке, содержащей нуклеиновую кислоту, кодирующую оба гибридных белка.
21. Способ по п.19 или 20, включающий дополнительно введение конъюгата в в фармацевтическую композицию.
22. Композиция, содержащая
первую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, который содержит молекулу антитела, лишенную Fc-фрагмента, и субъединицу р40 интерлейкина IL12; и
вторую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, который содержит молекулу антитела, лишенную Fc-фрагмента, и субъединицу р35 интерлейкина IL12.
23. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой scFv.
24. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой dAb.
25. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой антитело, описанное в любом из пп.13-18.
26. Композиция по любому из пп.22-25, отличающаяся тем, что первая и вторая молекулы нуклеиновой кислоты являются первым и вторым векторами.
27. Клетка-хозяин, содержащая первую и вторую молекулы нуклеиновой кислоты, определенные согласно любому из пп.22-26.
28. Фармацевтическая композиция, содержащая конъюгат по любому из пп.1-18.
29. Конъюгат согласно любому из пп.1-18 для применения в лечении людей или животных путем терапии.
30. Применение конюъюгата по любому из пп.11-18 в производстве лекарственного препарата для ингибирования ангиогенеза и/или роста новообразований у пациента.
31. Применение конъюгата по п.30, отличающееся тем, что лекарственный препарат применяют для лечения опухоли, ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации и ангиомы.
32. Способ ингибирования роста новообразования и/или ангиогенеза у пациента, включающий введение пациенту конъюгата по любому из пп.11-18.
33. Способ по п.32, включающий лечение опухоли, ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации или ангиомы путем ингибирования ангиогенеза.
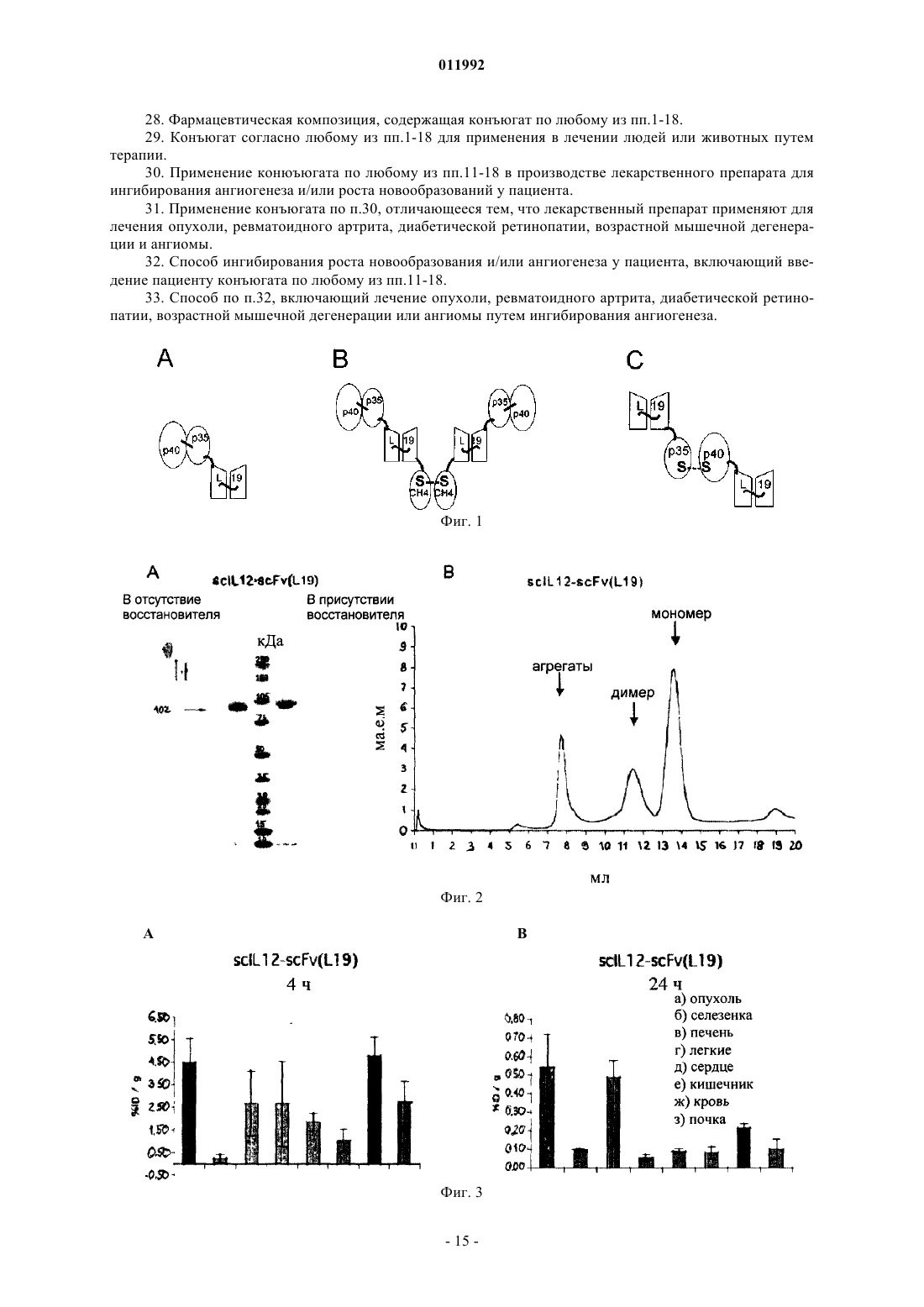
Текст
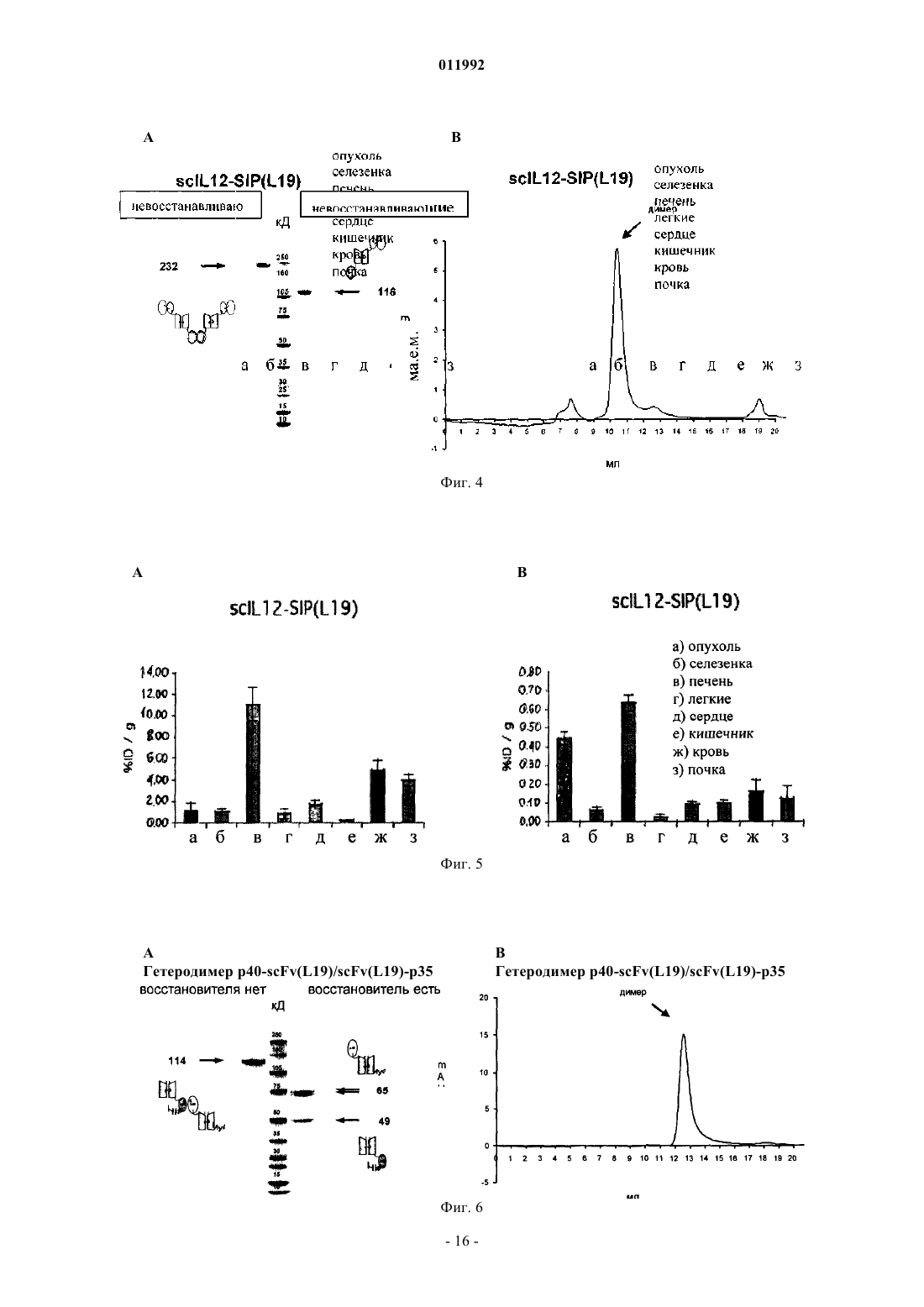
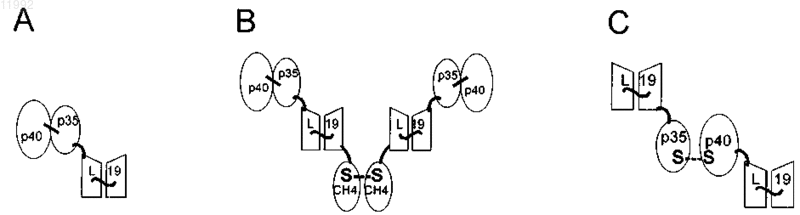
011992 Область техники Настоящее изобретение относится к способам избирательной доставки лекарств к желаемому местуin vivo путем создания конъюгатов лекарственных препаратов с селективно связывающими специфические молекулы агентами. Настоящее изобретение относится, в частности, к применению конъюгатов интерлейкина IL12 и молекул антител для терапевтических целей, таких как подавление патологического ангиогенеза, включая лечение рака и других опухолей, лечение ревматоидного артрита, диабетической ретинопатии, возрастной дегенерации макулы и ангиом. Предшествующий уровень техники Гетеродимерный цитокин интерлейкин-12 (IL12) является ключевым медиатором врожденного и клеточного иммунитета с сильным противоопухолевым и противометастазным действием [4-6]. На данный момент (весна 2005) он проходит вторую фазу клинических испытаний в качестве кандидата для лечения рака и инфекционных заболеваний. IL12 действует, главным образом, на Т-клетки и NK-клетки(естественные киллеры), стимулируя их активность и секрецию гамма-интерферона (IFN-) [7]. Однако,как и в случае многих других цитокинов, применение рекомбинантного человеческого IL12 связано с серьезной токсичностью, даже при столь низких дозах, как 1 мкг/кг/день [8, 9], что препятствует его применению в качестве противоракового препарата. Избирательную доставку IL12 в микроокружение опухоли можно применять для увеличения терапевтического индекса цитокина. Ученые из Lexigen описали гибридизацию цитокинов, таких как, например, IL2 и IL12, и иммуноглобулинов для специфической доставки цитокинов [17, 49-51]. Тем не менее, авторы настоящего изобретения полагают, что для подобного подхода существуют ограничения. По мнению авторов настоящего изобретения, гибридные белки типа IgG-цитокин, в действительности, являются многофункциональными белками, причем в дополнение к связыванию антигена и активности цитокина такие гибридные белки на основе IgG могут активировать комплемент и взаимодействовать с рецепторами к Fc. По нашему мнению, это является нежелательным свойством гибридных белков типа IgG-цитокин, поскольку цитокин может оказаться вблизи клеток, несущих рецепторы к Fc (таких, как макрофаги, нейтрофилы и клетки-естественные киллеры), препятствуя, таким образом, избирательному действию на опухоль и вызывая неспецифическую активацию клеток. Авторы настоящего изобретения полагают, что более приемлемым является применение вместо полноразмерного иммуноглобулина молекулы антитела, лишеннойFc-фрагмента, такой как одноцепочечный фрагмент антитела Fv (scFv). Подробное описание Ранее нами было продемонстрировано на моделях рака, что терапевтический потенциал IL12 можно значительно повысить путем конъюгирования с одноцепочечным полипептидом, который последовательно кодирует субъединицы р 40 и р 35 цитокина IL12 мыши ("scIL12") и одноцепочечный фрагмент Fv антитела L19 человека ("scFv(L19)"). Было показано, что ScFv(L19) обладает способностью к избирательной доставке в опухоль у больных раком пациентов [16]. L19 специфическим образом связывает домен ED-B изоформы фибронектина B-FN, которая является одним из наиболее хорошо известных маркеров ангиогенеза [14, 25]. ED-B - дополнительный домен, состоящий из 91 аминокислот, который был обнаружен в изоформе B-FN и является одинаковым для мыши, крысы, кролика, собаки и человека. BFN накапливается вокруг неоваскулярных структур в агрессивных опухолях и других тканях, где идет ангиогенез, таких как эндометрий в стадии пролиферации и некоторые структуры глаза при патологических состояниях, но не обнаруживается в нормальных тканях взрослых людей [1-3]. Гибридный белок scIL12-scFv(L19) демонстрирует терапевтический индекс значительно более высокий, чем scIL12, соединенный с scFv мыши несоответствующей антигенной специфичности, и чем рекомбинантный IL12 мыши. Эти эксперименты ясно показали потенциал применения гибридных белков с цитокинами на основе антител в качестве средства увеличения терапевтического потенциала IL12 [15]. Перспективы применения этих результатов в терапии весьма значительны. Избирательная доставка IL12 к кровеносным сосудам опухоли, например, с применением L19 является терапевтически эффективной по ряду причин. Во-первых, новообразованная сосудистая сеть опухоли более доступна для вводимых внутривенным путем терапевтических препаратов, чем опухолевые клетки, что помогает избежать проблем, связанных с внутренней гипертензией солидных опухолей [10]. Во-вторых, ангиогенез (рост новых капилляров из предшествующих кровеносных сосудов) является характерной особенностью большинства агрессивных солидных опухолей [11]. Ожидается, что избирательная доставка IL12 в новообразованную сосудистую сеть будет обеспечивать иммунотерапию множества различных типов опухолей. В-третьих, IL12 демонстрирует подавляющую ангиогенез активность,обусловленную нижестоящим медиатором IP-10 [12, 13]. Авторами настоящего изобретения была тщательно изучена способность к опухолеспецифической доставке для белка scIL12-scFv(L19), а также для белка scFv(L19), гибридизованного с другим противоопухолевым цитокином IL2 ("scFv(L19)-IL2") [18]. ScFv(L19)-IL2 демонстрирует отличную опухолеспецифическую доставку у мышей с опухолью с отношением концентраций в опухоли/в крови и в опухоли/во внутренних органах порядка 30:1 через 24 ч после внутривенной инъекции. Опухолеспецифичность scIL12-scFv(L19) на тех же животных моделях была, напротив, более умеренной: отношения кон-1 011992 центраций в опухоли/в крови и в опухоли/во внутренних органах обычно были ниже 10:1 спустя 24 ч, а отношения в опухоли/в печени в опухоли/в селезенке еще ниже [15]. Данные результаты по опухолеспецифичности были, тем не менее, выше по сравнению с гибридным белком scIL12-scFv(HyHEL10), специфичным по отношению к лизоциму куриного яйца, но способного к антигенспецифическому распознованию в организме мыши. Было показано, что способность к избирательной доставке scFv(L19) в опухоль улучшается, еслиscFv(L19) димеризован через СН 4-домен IgE человека, при этом возникает структура мини-антитела,называемого также "small immune protein" (небольшой иммуногенный белок) или SIP. Способности к избирательной доставке SIP(L19) в опухоль были описаны ранее [21]. Настоящее изобретение основывается на работе, в которой авторы настоящего изобретения сравнивали способности к избирательной доставке в опухоль трех конъюгатов IL12 и scFv(L19), каждый из которых имел отличный от других тип цитокина и/или антитела, и обнаружили, что способность к избирательной доставке белка scIL12-scFv(L19) в опухоль может быть улучшена путем изменения типа конъюгата. Первый тип конъюгатов, который мы протестировали, представлял собой scIL12-scFv(L19), изображенный на фиг. 1 А. Это конъюгат продемонстрировал умеренную способность к избирательной доставке в опухоль, соответствующую данным, известным из уровня техники. В другом типе исследований упоминавшийся выше димерный конструкт SIP(L19) применяли для создания гомодимера scIL12-SIP(L19), показанного на фиг. 1 В. Несмотря на известные из уровня техники данные о том, что опухолеспецифичность связывания L19 может быть улучшена при помощи типаSIP, мы, тем не менее, не наблюдали повышенного накопления в опухоли этого конъюгата. Другой тип конъюгатов представлял собой гетеродимер субъединиц р 40 и р 35 интерлейкина IL12, в котором каждая субъединица была гибридизована с scFv(L19), образуя гетеродимер scFv(L19)-p35/p40scFv(L19), как показано на фиг. 1 С. При данном гетеродимерном типе конъюгатов мы достигли заметного улучшения накопления конъюгата в опухоли. Таким образом, мы обнаружили, что новый тип гибридного белка антитело-IL12, состоящий из двух фрагментов scFv, образующих гетеродимер через субъединицы р 40 и р 35 интерлейкина IL12, полностью сохраняет активность IL12 и демонстрирует отличную способность к опухолеспецифичной доставке. Эти результаты имеют значимое терапевтическое приложение для улучшения избирательной доставки IL12 в опухоли и другие районы патологического ангиогенеза, например, для лечения ревматоидного артрита, диабетической ретинопатии, возрастной дегенерации макулы и ангиом. Применимость этого изобретения распространяется не только на конъюгаты IL12 с scFv(L19), но и на конъюгаты других специфично связывающих элементов с другими лекарственными средствами и веществами. Например, можно создать конъюгаты специфично связывающими элементами, отличными от scFv(L19), связанных с субъединицами IL12, таких как другие фрагменты антител, специфичных к ассоциированным с опухолями антигенам, например изоформам тенасцина-С, и применять их для доставки в опухоли и терапии рака. Более широкие приложения включают также ряд других применений, включая избирательную доставку веществ in vivo, способы диагностики, а также профилактику и лечение болезней и других патологических состояний. Различные аспекты изобретения относятся к новым типам конъюгатов, способам их получения,нуклеиновым кислотам, кодирующим конъюгаты или их компоненты, фармацевтическим композициям,содержащим конъюгаты, и применению конъюгатов в качестве способа лечения. В одном из аспектов настоящее изобретение является конъюгатом, включающим белок, имеющий первую и вторую субъединицы, при этом и первая, и вторая субъединицы конъюгированы со специфично связывающим элементом. Белок обычно представляет собой димер, преимущественно гетеродимер, и обычно включает в себя биологически активный агент или лекарственное средство, обычно представляющие собой терапевтический или диагностический агент. Таким образом, конъюгат имеет имеет следующее строение:[специфично связывающий элемент]-[первая субъединица]-[вторая субъединица]-[специфично связывающий элемент] Специфично связывающие элементы обычно представляют собой молекулу антитела, преимущественно одноцепочечного Fv (scFv). Молекулы одноцепочечных Fv антител (scFv) особенно предпочтительны в настоящем изобретении благодаря их небольшому размеру, который обеспечивает физиологические и терапевтические преимущества для применения конъюгатов in vivo. Кроме того, у scFv отсутствует Fc-фрагмент, что, возможно, уменьшает антиидиотипические реакции, а также минимизирует нежелательные свойства, связанные с активацией комплемента и взаимодействиями с рецепторами к Fc, которые могут препятствовать опухолеспецифичной доставке и вызывать неспецифическую активацию клеток. Таким образом, наиболее предпочтительный тип конъюгата:[ScFv]-[первая субъединица]-[вторая субъединица]-[ScFv] Кроме того, специфично связывающий элемент может представлять собой антитело с единственным доменом и/или фрагмент антитела. Специфично связывающие элементы и молекулы антитела более подробно описаны ниже.-2 011992 Конъюгат может состоять из или может включать в себя гибридный белок, то есть полипептид, который является продуктом трансляции гибрида двух или более генов или нуклеиновых кислот, кодирующих последовательности, в одной открытой рамке считывания (open reading frame, ORF). Гибридизованные продукты экспрессии двух генов или открытых рамок считывания могут быть соединены линкерным пептидом (коротким, от 2 до 20, предпочтительно от 2 до 15 остатков аминокислот). В одном способе реализации настоящего изобретения линкерный пептид представляет собой последовательность из 6 аминокислот GSADGG (SEQ ID NO: 15). Гибридный белок белок может включать сигнальную последовательность пептида, расположенную обычно в направлении к 5'-концу от специфично связывающего элемента и субъединицы. В конъюгатах согласно настоящему изобретению первая и вторая субъединицы обычно связаны,например они могут быть ковалентно связаны, например одной или более дисульфидными связями. Белок может представлять собой олигомер (например, димер, предпочтительно гетеродимер) и может встречаться в природе в форме олигомера, и, следовательно, первая и вторая субъединицы в конъюгате могут соединяться друг с другом естественным путем. Следовательно, настоящее изобретение допускает применение и сохранение в конъюгате естественной формы белка. Это позволяет избежать необходимости создания или применения одноцепочечного варианта лекарства и максимизирует возможность того,что лекарственное средство в конъюгате полностью сохранит свою активность. Кроме того, конъюгирование субъединиц между собой обеспечивает легкость сборки и объединения конъюгата, обеспечивая ассоциацию (например, димеризацию) первой и второй субъединиц с образованием олигомера. Таким образом, обычно и первая, и вторая субъединицы могут быть конъюгированы со специфично связывающим элементом, образуя пару структур из специфично связывающего элемента и субъединицы (например, гетеродимеров), которые соединяются через субъединицы. В преимущественном способе реализации настоящего изобретения первая субъединица соединена со специфично связывающим элементом как первый гибридный белок, а вторая субъединица конъюгирована со специфично связывающим элементом как второй гибридный белок. Конъюгат преимущественно имеет молекулярную массу 250 кДа или менее, более предпочтительно 200, 150, 125, 120 или 115 кДа или менее (то есть молекулярная масса равна или меньше 250000, 200000,150000, 125000, 120000 или 115000). Это может быть фактически измеренная молекулярная масса (с гликозилированием или без него) или оценочное значение, основанное, например, на ожидаемой молекулярной массе конъюгата (с гликозилированием или обычно без него). Сравнительно небольшой размер конъюгата увеличивает его способность проникать в ткани и достигать места назначения (например,районы ангиогенеза, опухоли или заболевания). Таким образом увеличивается терапевтическая эффективность и уменьшается требуемая дозировка, но сохраняется возможность достичь мультивалентного(обычно двухвалентного) связывания конъюгата с мишенью. В общих чертах, белок и специфично связывающий элемент выбирают в соответствии с предполагаемым применением конъюгата. В преимущественном способе реализации настоящего изобретения белок представляет собой интерлейкин IL12. Как обсуждалось выше, IL12 подходит для лечения рака, поскольку он ингибирует рост и метастазирование опухоли, а также для лечения других состояний, связанных с патологическим ангиогенезом. Один или оба специфично связывающих элемента в конъюгате могут избирательно связывать маркер, ассоциированный с ростом новообразования (особенно опухоли) и/или ангиогенезом, например маркер, расположенный в участке роста новообразования и/или ангиогенеза. Маркерами роста новообразования и/или ангиогенеза могут служить компоненты внеклеточного матрикса, поскольку внеклеточный матрикс претерпевает изменения в ходе этих процессов. Одним из примеров таких маркеров является изоформа B-FN фибронектина, которая, как было сказано выше, содержит дополнительный домен ED-B. Специфично связывающий элемент согласно настоящему изобретению преимущественно связывается с доменом ED-B изоформы B-FN фибронектина. Специфично связывающий элемент может иметь последовательность аминокислот, включающую последовательности VH CDR1 (гипервариабельный участок 1 вариабельной области тяжелой цепи, SEQ IDCDR1 (гипервариабельный участок 1 вариабельной области легкой цепи SEQ ID NO: 28), VL CDR2 (SEQID NO: 29) и/или VL CDR 3 (SEQ ID NO: 30) L19. Например, специфично связывающий элемент может представлять собой scFv, имеющий домен VH (вариабельная область тяжелой цепи) с последовательностью аминокислот, включающей VH CDR1, VH CDR2 и/или VH CDR3 L19, и домен VL (вариабельная область легкой цепи) с последовательностью аминокислот, включающей VL CDR1, VL CDR2 и/или VLCDR3 L19. Специфично связывающий элемент может включать в себя домен VH, имеющий последовательность аминокислот с по меньшей мере 60, 65, 70, 75, 80, 85, 90, 95 или 100% степенью идентичности последовательности с последовательностью аминокислот области L19 VH, которая задана в SEQ ID NO: 22, и/или включает домен VL, имеющий последовательность аминокислот с по меньшей мере 60, 65, 70,75, 80, 85, 90, 95 или 100% степенью идентичности последовательности с последовательностью аминокислот области L19 VL (вариабельная область легкой цепи антитела), которая задана в SEQ ID NO: 23. Предпочтительным специфично связывающим элементом является scFv(L19), включающий домен L19-3 011992 изобретения специфично связывающий элемент scFv(L19) имеет последовательность аминокислот SEQID NO: 5 (фиг. 10). Другим примером подобного маркера может служить тенасцин-С (TnC), который существует в нескольких изоформах. В тканях новообразований TnC, содержащий дополнительные домены, экспрессируется более широко, чем в нормальных тканях, в особенности изоформы, содержащие домен С (cTN-C)[33]. Таким образом, специфично связывающий элемент конъюгата в соответствии с настоящим изобретением может специфично связывать изоформы тенасцина-С, ассоциированные с тканями новообразований, в частности cTN-C. Специфично связывающий элемент может представлять собой одноцепочечное антитело (scFv) TN11, которое имеет последовательность, приведенную в SEQ ID NO: 21 (фиг. 11) [33]. Специфично связывающий элемент конъюгата в соответствии с настоящим изобретением может,кроме того, связываться с другими антигенами, ассоциированными с опухолями, то есть с антигенами,более распространенными в микроокружении опухоли (например, на клетках опухоли), чем в нормальном микроокружении клеток (например, на неопухолевых клетках). Обычно два специфично связывающих элемента конъюгата идентичны, или по меньшей мере оба специфичны к одной и той же мишени, антигену или эпитопу. В наиболее предпочтительном способе реализации настоящего изобретения конъюгат включает гетеродимер IL12 человека, гибридизованный с двумя специфично связывающими элементами, предпочтительно scFv(L19); где гетеродимер содержит первую субъединицу (обычно р 40) и вторую субъединицу (обычно р 35); первая субъединица или р 40 конъюгирована с первым специфично связывающим элементом в качестве первого гибридного белка; вторая субъединица или р 35 конъюгирована со вторым специфично связывающим элементом в качестве второго гибридного белка. Как упоминалось выше, первая и вторая субъединицы обычно ковалентно связаны, например дисульфидными связями. Первая субъединица или р 40 предпочтительно присоединена к N-концу специфично связывающего элемента, то есть в гибридном белке эта субъединица находится по отношению к связывающему агенту ближе к N-концу, а в нуклеиновой кислоте, его кодирующей, ближе к 5'-концу. В такой форме N-конец р 40 может быть свободен (не присоединен ни к чему), что, как предполагают, максимизирует его активность. Вторая субъединица или р 35 предпочтительно присоединена к С-концу специфично связывающего элемента, то есть в гибридном белке эта субъединица находится по отношению к связывающему агенту ближе к С-концу, а в нуклеиновой кислоте, его кодирующей, ближе к 3'-концу. Такая конструкция может повысить экспрессию гибридного белка, поскольку специфично связывающий элемент, особенно с сигнальным пептидом на N-конце, может легко экспрессироваться и, таким образом, обеспечивает эффективную экспрессию гибридного белка. Первый гибридный белок предпочтительно имеет последовательность аминокислот p40-scFv(L19),которая указана в SEQ ID NO: 1. Второй гибридный белок преимущественно имеет аминокислотыscFv(L19)-p35, которые указаны в SEQ ID NO: 2. Конъюгаты согласно настоящему изобретению могут быть получены любым доступным способом,например при помощи рекомбинантных технологий, включая экспрессию всего конъюгата или его части в форме гибридного белка. Например, конъюгат может быть получен способом, включающим экспрессию первого гибридного белка, включающего первую субъединицу и специфично связывающий элемент; экспрессию второго гибридного белка, включающего вторую субъединицу и специфично связывающий элемент; и конъюгирование первой и второй субъединиц друг с другом. Обычно способ включает в себя очистку первого и второго гибридных белков после экспрессии. Обычно экспрессию осуществляют в клетке-хозяине, содержащей кодирующие гибридный белок нуклеиновые кислоты, такой как культивируемые эукариотические клетки, например клетки линий HEK или CHO, или бактериальные клетки, такие как Escherichia coli. Следовательно, экспрессия может включать в себя культивирование такой клетки-хозяина. Если первый и второй гибридные белки экспрессируются в одной и той же клетке (например, клетка котрансфецирована и/или содержит нуклеиновые кислоты, кодирующие оба гибридных белка), образование гетеродимеров или олигомеров субъединиц может происходить непосредственно в клетке или в течение очистки гибридных белков от клеток. В других случаях первый и второй гибридные белки можно экспрессировать раздельно (например, в разных клетках) и затем объединять (смешивать) таким образом, чтобы первые и вторые субъединицы образовывали гетеродимеры или соединялись иным образом. Конъюгирование субъединиц между собой может быть активным либо пассивным процессом. Конъюгирование может включать применение таких условий или помещение первого и второго гибридных белков в такие условия, при которых первая и вторая субъединицы конъюгируют друг с другом (например, ассоцирируют или олигомеризуются/гетеродимеризуются). Конъюгирование может включать-4 011992 образование между субъединицами дисульфидных связей или образование других ковалентных связей. Конъюгирование путем образования дисульфидных связей может происходить в невосстанавливающих условиях, и, следовательно, объединение может включать помещение первого и второго гибридных белков в невосстановливающие условия. Пригодные способы экспрессии гибридных белков и производство конъюгатов в соответствии с настоящим изобретением подробно приведены в нижеследующих примерах. В качестве следующего этапа способ может включать введение конъюгата в фармацевтическую композицию. В общем случае, это подразумевает очистку конъюгата и смешивание его с физиологически приемлемым носителем. Фармацевтические композиции более подробно описываются ниже. Молекулы нуклеиновых кислот, кодирующие конъюгаты и их части (например, кодирующие гибридные белки), также являются частью настоящего изобретения. Согласно одному аспекту настоящего изобретения предложена композиция, включающая первую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, причем гибридный белок включает специфично связывающий элемент и первую субъединицу белка; и вторую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, причем гибридный белок включает специфично связывающий элемент и вторую субъединицу белка. Молекула нуклеиновой кислоты может кодировать пептидный линкер между специфично связывающим элементом и субъединицей таким образом, что в гибридном белке специфично связывающий элемент и субъединица соединены линкером. Отдельные гибридные белки, субъединицы, специфично связывающие элементы и линкеры, которые могут быть в ней закодированы, более подробно описаны далее в тексте. В предпочтительном способе реализации настоящего изобретения первая и вторая субъединицы, соответственно, являются субъединицами гетеродимера IL12 (обычно субъединицы р 40 и р 35),а предпочтительным специфично связывающим элементом является scFv, в особенности scFv(L19). В одном способе реализации настоящего изобретения первая молекула нуклеиновой кислоты кодирует последовательность аминокислот IL12p40-scFv(L19), которая указана в SEQ ID NO: 1, и/или вторая молекула нуклеиновой кислоты кодирует последовательность аминокислот scFv(L19)-IL12p35, которая указана в SEQ ID NO: 2. Молекула нуклеиновой кислоты может представлять собой вектор, например плазмиду, пригодную для экспрессии последовательности нуклеотидов. Таким образом, первая и вторая молекулы нуклеиновой кислоты могут быть первым и вторым векторами. Последовательность нуклеотидов обычно функционально связана с регуляторным элементом, таким как промотор транскрипции. Первая и вторая молекулы нуклеиновой кислоты могут содержаться в клетке-хозяине, которая может представлять собой клетку, котрансфецированную молекулами нуклеиновой кислоты, или дочернюю клетку такой клетки. Клетки, в частности эукариотические клетки, такие как клетки линий HEK иCHO, или бактериальные клетки, такие как Escherichia coli, содержащие указанные молекулы нуклеиновой кислоты, также являются частью настоящего изобретения. После экспрессии с молекулы нуклеиновой кислоты гибридные белки могут быть объединены через субъединицы с целью образования конъюгатов согласно настоящему изобретению, как описано в другом месте данного текста. Конъюгаты согласно настоящему изобретению можно применять в способах лечения человека или животных, таких как способы лечения (которые могут включить профилактическое лечения) заболеваний или расстройств у пациента (обычно пациента-человека), включающих введение пациенту конъюгатов. Состояния, которые можно лечить с применением конъюгатов, включают рак, другие опухоли и неопластические состояния. Конъюгаты можно применять для подавления ангиогенеза, включая терапию рака, и, следовательно, для лечения ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации, ангиом и опухолей, включая рак. Лечение может включать профилактическое применение. Конъюгаты также можно вводить в способах диагностики, например выявления и диагностирования ангиогенеза, который может быть связан с любым из указанных выше состояний. Другие болезни и состояния также можно диагностировать и лечить в соответствии с природой белкового терапевтического или диагностического агента, входящего в конъюгат, и специфичности связывающего элемента. Соответственно, дальнейшие аспекты настоящего изобретения обеспечивают способы лечения,включающие введение конъюгатов согласно настоящему изобретению, фармацевтических композиций,содержащих такие конъюгаты, и применение таких конъюгатов в производстве медикаментов для лечения состояния или заболевания, например в способе получения медикамента или фармацевтической композиции, включающем получение лекарственной формы конъюгата с физиологически приемлемым носителем или наполнителем. В соответствии с настоящим изобретением предусмотренные им композиции можно вводить пациентам. Введение предпочтительно проводить в "терапевтически эффективном количестве", достаточном для демонстрации пользы для пациента. Такая польза может представлять собой снижение выраженно-5 011992 сти по меньшей мере одного симптома. Фактически вводимое количество, уровень и продолжительность назначения будут зависеть от природы и степени тяжести того состояния, которое лечат. Предписания по лечению, например решения о дозировке и т.п., находятся в пределах ответственности врачей общей практики и других врачей. Подходящие дозы антител хорошо известны в данной области [26, 27]. Конъюгаты согласно настоящему изобретению, включая содержащие антигенсвязывающий домен антитела, можно вводить нуждающемуся в лечении любым подходящим путем, обычно путем инъекции в кровоток и/или непосредственно в место, которое требует медицинского вмешательства, например в опухоль или сосудистую сеть опухоли. Точная доза и частота введения будут зависеть от ряда показателей, пути введения, размера и положения области, подвергающейся лечению (например, опухоли), точной природы антитела (например, молекула scFv) и природы любой обнаруживаемой метки или другой молекулы, содержащейся в конъюгате. Композицию можно применять отдельно или в комбинации с другими средствами лечения, либо одновременно, либо последовательно, в зависимости от состояния, которое лечат. Другие средства лечения могут включать введение соответствующих доз обезболивающих средств, таких как нестероидные противовоспалительные препараты (например, аспирин, парацетамол, ибупрофен или кетопрофен) или опиаты, как, например, морфий, или противорвотных. Таким образом, фармацевтические композиции согласно настоящему изобретению и для применения в соответствии с настоящим изобретением могут включать, в дополнение к активному компоненту(конъюгату), фармацевтически приемлемый наполнитель, носитель, буфер, стабилизатор или другие материалы, хорошо известные специалистам в данной области. Такие материалы должны быть нетоксичными и не должны снижать эффективность активного компонента. Точная природа носителя или другого материала будет зависеть от пути введения, который может представлять собой пероральное введение или введение путем инъекции, например внутривенно. Для внутривенной инъекции или инъекции в очаг поражения активный компонент должен быть в форме соответствующего водного раствора для парентерального введения, который не является пирогенным и имеет подходящие рН, изотоничность и стабильность. В конъюгатах, относящихся к настоящему изобретению, белок обычно содержит первую и вторую полипептидные субъединицы, полученные рекомбинатным путем. Субъединицы могут быть гликозилированы, степень и природу гликозилирования можно контролировать путем выбора подходящей клеткихозяина для экспрессии субъединиц. Белок может включать биологически активный агент, то есть агент,который влияет на структуру или функционирование организма того индивидуума, которому его вводят. Обычно белок включает диагностический или терапевтический агент. Например, он может включать вещество, используемое в диагностике, профилактике или лечении болезни или патологического состояния. Белок может содержать маркер или метящий агент, например, для диагностики. В рамках настоящего изобретения, белок обычно включает терапевтическое вещество, применяемое для лечения или профилактики патологического состояния, в частности ангиогенеза, например в терапии рака и других опухолей, лечении ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации и ангиом. Он может содержать, например, токсин, фермент или иммуномедиатор, такой как цитокин. Белок может быть нативным или рекомбинантным интерлейкином-12 (IL12). IL12, применяемый в настоящем изобретении, может иметь происхождение от любого животного, например человека, грызуна(крыса, мышь), лошади, коровы, свиньи, овцы, собаки и т.д. Для введения людям предпочтительными являются конъюгаты IL12 человека. В естественных условиях IL12 существует в виде гетеродимерного белка, состоящего из субъединицы массой 40 кДа (р 40) и субъединицы массой 35 кДа (р 35). Фактическая молекулярная масса субъединиц может различаться, например, если экспрессия происходит в организме разных видов животных, и зависит от того, гликозилирован ли белок, а также от характера гликозилирования. Следовательно, термины "р 40" и "р 35" не подразумевают, что субъединицы имеют молекулярную массу, строго равную 40 и 35 кДа, соответственно. Вместо этого, эти термины используются для того,чтобы идентифицировать и различать две субъединицы гетеродимера IL12, которые можно более точно описать, исходя из их последовательностей аминокислот. Гетеродимер IL12 имеет в своем составе первую и вторую полипептидные субъединицы, идентичные или гомологичные субъединицам р 40 и р 35 интерлейкина человека IL12, соответственно. Обычно первая субъединица IL12 включает последовательность аминокислот, которая имеет по меньшей мере 60, 65, 70, 75, 80, 85, 90, 95 или 100% совпадения последовательности с последовательностью аминокислот субъединицы р 40 IL12 человека, которая указана в SEQ ID NO: 3. Обычно вторая субъединица IL12 включает последовательность аминокислот,которая имеет по меньшей мере 60, 65, 70, 75, 80, 85, 90, 95 или 100% совпадения последовательности с последовательностью аминокислот субъединицы р 35 IL12 человека, которая указана в SEQ ID NO: 4.IL12 в составе конъюгатов согласно настоящему изобретению сохраняет биологическую активностьIL12, например способность действовать в качестве фактора роста для активированных Т- и NK-клеток,усиливать цитотоксическую активность клеток-киллероактивированных лимфокинами NK-клеток, стимулировать выработку IFN- мононуклерами периферической крови, ингибировать ангиогенез (например, через нижестоящий медиатор IP-10) и/или ингибировать рост и/или метастазирование опухоли. Специфично связывающий элемент является элементом пары молекул, которые обладают специфичностью связывания по отношению друг к другу. Элементы специфически связывающейся пары мо-6 011992 гут быть естественного происхождения или могут быть целиком или частично синтезированы. Один элемент такой пары молекул имеет на своей поверхности область, или полость, которая специфически связывается и, соответственно, является комплементарной, пространственной или поляризованной структуре части другого элемента такой пары молекул. Таким образом, элементы пары обладают свойством специфически связываться друг с другом. Специфично связывающий элемент обычно включает молекулу, имеющую антигенсвязывающий сайт. Например, специфически связывающий элемент может быть молекулой антитела или белком другой природы, который имеет антигенсвязывающий сайт. Антигенсвязывающий сайт может быть получен путем размещения определяющих комплементарность участков (complementarity-determining regions,CDR или гипервариабельных участков) на каркасном белке, не являющемся антителом, таком как фибронектин или цитохром В и т.п. [29, 30, 31], либо путем случайного изменения или мутирования остатков аминокислот петлевого домена каркасного белка с целью придать белку специфичность к желаемой мишени. Каркасы для создания новых связывающих сайтов подробно описаны [31]. Были обнаружены каркасные белки для имитации антител [32], включая белки (имитаторы антител), которые имеют в своем составе домен фибронектина типа III, содержащий по меньшей мере одну петлю случайной последовательности. Подходящим каркасом, в который можно внедрить один или более CDR, например наборHCDR, может быть любой белок с доменом, относящимся к суперсемейству иммуноглобулинов. Каркасный белок может быть белком человека либо другим белком. Преимущество белка, не являющегося антителом, состоит в том, что он может обеспечивать антигенсвязывающий сайт в каркасной молекуле, которая меньше размером и/или легче синтезируется, чем,по меньшей мере, некоторые молекулы антител. Небольшой размер специфически связывающего элемента может обеспечивать полезные физиологические свойства, такие как способность проходить в клетки, проникать глубоко в ткани, или достигать мишеней в пределах других структур, или связываться внутри полостей белка антигена-мишени. Применение антигенсвязывающего сайта в каркасном белке, не являющемся антителом, рассмотрено в [34]. Обычно такие белки имеют стабильный остов и одну или более вариабельную петлю, причем последовательность аминокислот петли (петель) специально или случайно изменена с целью создать антигенсвязывающий сайт, обладающий специфичностью связывания по отношению к антигену-мишени. Такие белки включают IgG-связывающие домены белка А стрептококка S. aureus, трансферрин, тетранектин, фибронектин (например, 10-й домен фибронектина типа III) и липокалины. Другие подходы включают синтетические белки "микротела" ("Microbodies", Selecore GmbH), основанные на применении циклотидов - небольших белков с внутримолекулярными дисульфидными связями. Хотя, как было отмечено, CDR могут входить в состав каркасов, таких как фибронектин или цитохром В [29, 30, 31], структура, несущая один CDR или набор CDR в настоящем изобретении, предпочтительно соответствует последовательности тяжелой или легкой цепи антитела или их существенной части,в которой один CDR или набор CDR расположен в положении, соответствующем одному CDR или набору CDR на встречающихся в природе вариабельных доменах антител VH и VL (тяжелой и легкой цепей),кодируемых перегруппированными генами иммуноглобулинов. Структуры и положения вариабельных доменов иммуноглобулинов можно определить, обратившись к Kabat et al. [35], и они могут быть обновлены благодаря тому, что теперь доступны в интернете (http://immuno.bme.nwu.edu или поиск слова "Kabat" при помощи любой поисковой системы). Молекула антитела представляет собой природный либо полученный частично или полностью путем синтеза иммуноглобулин. Этот термин также включает любой полипептид или белок, содержащий антигенсвязывающий сайт антитела. Возможно применение моноклональных и других антител, а также применение технологии рекомбинантных ДНК для получения других антител или химерных молекул, которые сохраняют специфичность исходного антитела. Такие способы могут включать введение ДНК, кодирующей вариабельный участок или CDR иммуноглобулина, в константные области или константные области плюс каркасная область другого иммуноглобулина [37, 38, 39]. Гибридому или другую клетку, продуцирующую антитело, можно подвергнуть генетической мутации или другим изменениям, которые могут или изменить, или не изменить специфичность связывания продуцируемых антител. Поскольку антитела могут быть модифицированы рядом способов, подразумевается, что термин"молекула антитела" охватывает любой специфично связывающий элемент или вещество, содержащее антигенсвязывающий сайт антитела с необходимой специфичностью. Таким образом, этот термин охватывает фрагменты и производные антител, включая любой полипептид, имеющий антигенсвязывающий сайт антитела, независимо от того, является ли он природным или получен целиком или частично синтетическим путем. Следовательно, химерные молекулы, включающие антигенсвязывающий сайт антитела или его эквивалент, гибридизованный с другим полипептидом, также включены в это определение. Клонирование и экспрессия химерных антител хорошо известны [40, 41]. Дальнейшие методики, доступные в области создания антител, дают возможность выделять антитела человека и гуманизированные антитела. Например, можно создать гибридомы человека, как это было описано ранее [36]. Метод фагового дисплея и другие признанные способы создания специфично связы-7 011992 вающих элементов описаны достаточно подробно [36, 42]. Для выделения антител человека можно использовать трансгенных мышей, у которых гены антител мыши инактивированы и функционально заменены генами антител человека, а другие компоненты иммунной системы оставлены интактными [43]. Синтетические молекулы антител можно получить путем экспрессии генов, из синтезированных олигонуклеотидов, собранных в подходящих векторах экспрессии [44, 45]. Показано, что фрагменты целого антитела могут выполнить функцию связывания антигенов. Фрагменты антитела предпочтительны для конъюгатов согласно настоящему изобретению благодаря их небольшому размеру и минимальному взаимодействию с другими молекулами и рецепторами (например,рецепторами к Fc). Особенно предпочтительны одноцепочечные молекулы Fv (scFv), в которых доменVH и домен VL связаны пептидным линкером, который позволяет доменам соединиться между собой с образованием антигенсвязывающего сайта [46, 47]. scFv могут быть стабилизированы путем внедрения дисульфидных мостиков, связывающих домены VH и VL [48]. Другим небольшим антигенсвязывающим фрагментом антитела является dAb (domain antibody, доменное антитело), т.е. вариабельный участок тяжелый или легкой цепи антитела [28]. dAb тяжелой цепи(VH dAb) в природе встречаются у мозоленогих (например, верблюд и ламы) и могут быть получены путем иммунизации мозоленогих антигеном-мишенью, изоляции антигенспецифических В-клеток и прямого клонирования генов dAb из отдельных В-клеток. dAb также можно получать в культурах клеток. Их небольшой размер, хорошая растворимость и устойчивость к температуре делают их особенно подходящими с точки зрения физиологии и удобными для селекции и созревания аффинности. Однодоменные специфично связывающие элементы, в особенности однодоменные антитела, такие как dAb, можно применять в изобретении; они являются коммерчески доступными, например, от производителей Domantis, Phylos, Pieris и Affibody. Антигенсвязывающий сайт является частью молекулы, которая связывается с целым целевым антигеном или его частью и комплементарна им. В молекуле антитела она называется антигенсвязывающим сайтом и включает в себя ту часть антитела, которая специфично связывается с целым целевым антигеном или его частью и комплементарна им. В случае, если антиген большой, антитело может связаться только с отдельной частью антигена, которая называется эпитопом. Антигенсвязывающий сайт антитела может быть образован одним или более вариабельными доменами антитела. Антигенсвязывающий сайт антитела предпочтительно включает вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH). Термин "специфичный" относится к ситуации, в которой один элемент специфично связывающейся пары не демонстрирует сколько-нибудь значительного связывания с другими молекулами, отличающимися от от своего партнера (партнеров) по специфическому связыванию. Этот термин также применим для случая, когда, например, антигенсвязывающий сайт специфичен к конкретному эпитопу, который присутствует на ряде антигенов, в каковом случае специфично связывающий элемент, несущий антигенсвязывающий сайт, будет способен связываться с различными антигенами, несущими данный эпитоп.L19 является рекомбинантным антителом человека, специфичным в отношении домена ED-B изоформы B-FN фибронектина. Данное антитело и его последовательность были описаны ранее [20]. Одиночная цепь Fv антитела L19 также была описана ранее и является предпочтительной для создания конъюгатов согласно настоящему изобретению. ScFv(L19) представляет собой scFv, которое включает в себя домен L19 VH и домен L19 VL, причем VH и VL соединены в единую полипептидную цепь последовательностью пептидного линкера. Домен VH (вариабельная область тяжелой цепи) содержит последовательности VH CDR1, CDR2 и CDR3, домен VL (вариабельная область легкой цепи) содержит последовательности VL CDR1, CDR2 и CDR3, как показано на фиг. 10. Последовательности CDR L19 приведены ниже: Домен VH может иметь последовательность аминокислот, которая указана в SEQ ID NO: 22, доменVL может иметь последовательность аминокислот, которая указана в SEQ ID NO: 23 (фиг. 10). ДоменыVH и VL обычно соединены пептидным линкером, таким как, например, линкер из 12 аминокислот,имеющий последовательность SEQ ID NO: 24 (фиг. 10). Предпочтительно scFv(L19) имеет последовательность аминокислот, которая указана в SEQ ID NO: 5. Краткое описание фигур На фиг. 1 показано: (A) scIL12-scFv(L19); (В) гомодимер scIL12-SIP(LI9); (С) гетеродимер p40scFv(L19)/scFv(L19)-р 35.-8 011992 На фиг. 2 показано: (А) электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDSPAGE, ПААГ-ДСН) гибридного белка scIL12-scFv(L19) в восстанавливающих и невосстанавливающих условиях; (В) профиль гель-фильтрации гибридного белка scIL12-scFv (L19) в нативном состоянии, выявивший димеры. На фиг. 3 показана избирательная доставка scIL12-scFv(L19) in vivo, которую оценивали в экспериментах по биораспределению. Накопление выражено в % от введенной дозы на грамм ткани (%ID/г) спустя (А) 4 ч и (В) 24 ч после инъекции. Представлены следующие ткани (слева направо): опухоль, селезенка, печень, легкое, сердце, кишечник, кровь и почка. На фиг. 4 показано: (А) электрофорез в ПААГ-ДСН гибридного белка scIL12-SIP (L19) в восстанавливающих и невосстанавливающих условиях; (В) профиль гель-фильтрации гибридного белка scIL12-SIP(LI9) в естественных условиях, показывающий, что белок является димером. На фиг. 5 показана избирательность доставки in vivo scIL12-SIP(L19), которую оценивали в экспериментах по биораспределению. Накопление выражено в % от введенной дозы на грамм ткани (%ID/г) спустя (А) 4 ч и (В) 24 ч после инъекции. Представлены следующие ткани (слева направо): опухоль, селезенка, печень, легкое, сердце, кишечник, кровь и почка. На фиг. 6 показано: (А) электрофорез в ПААГ-ДСН гибридного белка р 40-scFv(L19)/scFv(L19)-p35 в восстанавливающих и невосстанавливающих условиях; (В) показывает профиль гель-фильтрации гибридного белка p40-scFv(L19)/scFv(L19)-p35 в естественных условиях, показывающий, что белок является димером. На фиг. 7 показана избирательность доставки in vivo p40-scFv(L19)/scFv(p35 L19), которую оценивали в экспериментах по биораспределению. Накопление выражено в % от введенной дозы на грамм ткани (%ID/г) спустя (А) 4 ч и (В) 24 ч после инъекции. Представлены следующие ткани (слева направо): опухоль, селезенка, печень, легкое, сердце, кишечник, кровь и почка. На фиг. 8 показана последовательность аминокислот SEQ ID NO: 1. Последовательность содержит, от N-конца к С-концу:(v) myc; т.е. сигнальный пептид-р 40 человека-линкер-L19-myc. В кодирующей последовательности нуклеиновой кислоты, которую мы использовали, после метки myc следовали три стоп-кодона. На фиг. 9 показана последовательность аминокислот SEQ ID NO: 2. Последовательность содержит, от N-конца к С-концу:(v) метку из 6 остатков His; т.е. сигнальный пептид-L19-линкер-р 35 человека-6His. В кодирующей последовательности нуклеиновой кислоты, которую мы использовали, после метки из 6 остатков гистидина следовали три стопкодона. На фиг. 10 показана последовательность аминокислот scFv(L19) (SEQ ID NO: 5). Домены VH и VL показаны отдельно (SEQ ID NO: 22 и SEQ ID NO: 23, соответственно). Последовательности CDR1, 2 и 3 как в домене VH, так и в домене VL выделены подчеркиванием. Домены VH и VL разделены последовательностью пептидного линкера из 12 аминокислот (SEQ ID NO: 24). На фиг. 11 показана последовательность аминокислот антитенасцин-С scFv TN11 (SEQ ID NO: 21). Аспекты и примеры реализации настоящего изобретения далее будут пояснены в нижеследующей экспериментальной части. Примеры Далее мы описываем получение и свойства трех различных типов конъюгатов IL12-L19, демонстрируя заметное преимущество одного из типов для заявленной в настоящем изобретении избирательной доставки in vivo. Три типа конъюгатов, как показано на фиг. 1 А, В и С, соответственно, представляют собой scIL12scFv(L19), гомодимер scIL12-SIP (L19) и гетеродимер р 40-scFv(L19)/scFv(L19)-p35. Конъюгат scIL12-scFv(L19), изображенный на фиг. 1 А, представляет собой гибридный белок,включающий scIL12 и scFv(L19). Этот конъюгат моновалентен, поскольку имеет единственный антигенсвязывающий сайт scFv на молекулу. Гомодимер scIL12-SIP (L19), изображенный на фиг. 1 В, представляет собой гомодимер двух гибридных белков, каждый из которых содержит, соответственно, scIL12, scFv(L19) и домен СН 4 иммуно-9 011992 глобулина IgE человека. Конъюгат димеризуется посредством дисульфидных связей между двумя доменами СН 4, образуя, таким образом, структуру мини-антитела или SIP. Такой конъюгат двухвалентен благодаря наличию двух антигенсвязывающих сайтов scFv(L19) на молекулу. Гетеродимер p40-scFv(L19)/scFv(L19)-p35, изображенный на фиг. 1 С, представляет собой гетеродимер двух гибридных белков. Первый гибридный белок содержит субъединицу р 40 интерлейкина человека IL12, присоединенную к N-концу scFv(L19) посредством линкера из 6 аминокислот: GSADGG (SEQID NO: 15). Второй гибридный белок содержит scFv(LI9), присоедненный к N-концу субъединиц р 35 интерлейкина человека IL12 посредством линкера из 6 аминокислот: GSADGG (SEQ ID NO: 15). Два гибридных белка образуют гетеродимер p40-scFv(L19)/scFv(L19)-p35 посредством дисульфидной связи между субъединицами р 40 и р 35. Такой конъюгат двухвалентен благодаря наличию двух антигенсвязывающих сайтов scFv(L19) на молекулу.scIL12-scFv(L19) без метки FLAG. Поскольку исходный гибридный белок клонировали с меткой FLAG на С-конце ("scIL12-scFv(L19)FLAG"), как было описано в [15], мы должны рассмотреть возможность того, что содержащая тирозин метка FLAG может искажать результаты экспериментов по биораспределению. В случае, если в белке остатки тирозина снабжены радиоактивными метками, незащищенный тирозин метки FLAG может также быть помечен радиоактивным иодом. Метка FLAG может далее подвернуться протеолизу in vivo. Для лучшего изучения свойства селективной доставки в опухоли этого слитого белка мы осуществляли клонирование и экспрессию гибридного белка scIL12-scFv(L19) без метки FLAG. Клонирование и экспрессия scIL12-scFv(L19). Фрагмент ДНК белка scIL12-scFv(L19) амплифицировали с использованием в качестве матрицы вектора рСН 33, содержащего ген scIL12-scFv(L19)-FLAG [15]. Полимеразную цепную реакцию (ПЦР) провели с праймером sp40backEco (5' ccg gaattc atg tgt cct cag aag cta acc atc 3') (SEQ ID NO: 6), который присоединяется к последовательности внутренней секреции р 40 и содержит сайт рестрикции для эндонуклеазы EcoR1 на 5'-конце, и праймером L19stopNotfor (5' ttt tcc ttt t gcggccgc cta tca tca ttt gat ttc cac cttggt ccc 3') (SEQ ID NO: 7), добавляющим 3 стоп-кодона и сайт рестрикции для эндонуклеазы Not1 на 3'конце гибридного белка scIL12-L19, что приводит к удалению метки FLAG. Фрагмент ДНК клонировали в вектор экспрессии для клеткок млекопитающих pcDNA3.1(+) (Invitrogen, Basel, Switzerland) при помощи сайтов рестрикции EcoR1 и Not1 вектора. Клетки HEK 293 трансфецировали вектором, стабильно трасфецированные клетки отбирали в присутствии G418 (500 мкг/мл). Проводили скрининг клонов устойчивых к G418 клеток путем твердофазного ИФА для определения экспрессии гибридного белка, в качестве антигена использовали рекомбинантной домен ED-B фибронектина человека. Гибридный белок очищали от культуральной среды клеток методом аффинной хроматографии на колонках с антигеном, как описано в [19, 20], и обессоливали путем диализа в течение ночи при 4 С. Гибридный белок замораживали в аликвотах при -20 С. Затем исследовали размер гибридного белка scIL12-scFv (L19) методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (ПААГ-ДСН) в восстанавливающих и невосстанавливающих условиях и в естественных условиях путем гель-фильтрации методом быстрой жидкостной хроматографии белков (FPLC) на колонке Superdex S-200 (Amersham Pharmacia Biotech) (фиг. 2). Было показано, что, в отличие от исходного мономерного scIL12-scFv(L19)-FLAG, около одной трети гибридного белка IL12-L19 является димером. Описание scIL12-scFv(L19). Избирательность доставки scIL12-scFv(L19) без метки FLAG in vivo оценивали в экспериментах по биораспределению. Фракцию мономера гибридного белка очищали путем гель-фильтрации методомFPLC на колонке Superdex S-200. После очистки фракцию немедленно метили радиоактивным иодом и вводили путем инъекции иммунокомпетентным мышам линии 129SvEv, имеющим мышиную тератокарциному F9. Мышей умерщвляли спустя 4 и 24 ч после инъекции, внутренние органы взвешивали и измеряли их радиоактивность. Накопление в представленных органах и опухоли выражали в % от введенной дозы на грамм ткани (%ID/г) (фиг. 3). Спустя 24 ч накопления метки в опухоли не наблюдалось. Соответственно, был сделан вывод о том, что метка FLAG не искажала результаты по биораспределению. Гомодимер scIL12-SIP(L19). Было показано, что способность scFv(L19) к избирательной доставке в опухоль улучшается, еслиscFv(L19) димеризован посредством СН 4-домена IgE человека с образованием структуры мини-антитела,также называемого "small immune protein" (небольшой иммуногенный белок) или SIP. СпособностьSIP(L19) к избирательной доставке в опухоль была описана в литературе ранее [21]. Соответственно, мы создали гомодимер scIL12-SIP(L19) для того, чтобы определеить, может ли такой тип конъюгата также улучшить избирательную доставку IL12 в опухоли. Мы создали гибридный белок scIL12-SIP(L19) путем присоединения домена СН 4 иммуноглобулинаIgE человека к С-концу гибридного белка scIL12-scFv(L19)-FLAG [22]. Клонирование и экспрессия гомодимера scIL12-L19-SIP. Присоеденение домена СН 4 к С-концу фрагмента scIL12-L19 осуществляли за один раунд ПЦР путем встраивания ПЦР-фрагмента в вектор, уже содержащий домен СН 4.- 10011992 Фрагмент scIL12-scFv(L19) амплифицировали с вектора рСН 33, содержащего ген scIL12-scFv(L19)FLAG [15]. Сайты рестрикции был изменены при помощи праймера sp40backHind (5'ccgta aagctt atg tgtcct cag aag cta acc atc 3') (SEQ ID NO: 8), который присоединяется к 5'-концу последовательности секреции р 40 и изменяет сайт рестрикции EcoR1 на сайт рестрикции HindIII, и праймера L19forAge1Bsp (5' tgtFLAG и вводя сайт рестрикции Age1, который обеспечивает липкие концы при расщеплении ферментомBspE1. После лигирования сайт рестрикции Age1/BspE1 становится не доступен для расщепления BspE1. Этот этап необходим, поскольку последовательность scIL12 содержит сайт рестрикции BspE1. Затем фрагмент клонировали с использованием эндонуклеаз HindIII и BspE1 в вектор экспрессии в клетках млекопитающих pcDNA3.1(+), уже содержащий домен СН 4 с сайтом рестрикции BspE1 на своем 5'-конце [21]. Процедуры трансфекции, экспрессии и очистки для scIL12-SIP (L19) выполняли так же, как описано выше для гибридного белка scIL12-scFv(L19). Размер гибридного белка IL12-SIP(L19) также анализировали методом электрофореза в ПААГ-ДСН в восстанавливающих и невосстанавливающих условиях и в естественных условиях путем гель-фильтрации методом FPLC на колонках Superdex S-200 (фиг. 4). Характеристика гомодимера scIL12-SIP(L19). Белок scIL12-SIP(L19) очищали на второй стадии после гель-фильтрации на колонках Superdex S200, фракцию димера немедленно после отбора метили радиоактивным иодом. Помеченный белок вводили путем инъекции иммунокомпетентным мышам линии 129SvEv, имеющим мышиную тератокарциному F9. Мышей умерщвляли спустя 4 и 24 ч после инъекции, внутренние органы взвешивали и измеряли их радиоактивность. Накопление в представленных органах и опухоли выражали в % от введенной дозы на грамм ткани (%ID/г) (фиг. 5). Хотя белок scIL12-SIP(L19) продемонстрировал улучшение связывания с ED-B в анализе BIAcore, повышенного накопления в опухоли не наблюдалось, накопление в опухоли оставалось низким. Гетеродимер p40-scFv(L19)scFv(L19)-p35. Гетеродимер p40-scFv(L19)/scFv(L19)-p35 состоит из двух субъединиц. Первая содержит фрагментscFv(L19), присоединенный к N-концу субъединицы р 35 IL12 (scFv(L19)-p35). Во второй субъединица р 40 интерлейкина IL12 присоединена к N-концу scFv(L19) (p40-scFv(L19. Затем гибридные белки образуют гетеродимер р 40-scFv(L19)/scFv(L19)-p35 посредством дисульфидных связей между р 40 и р 35. Ожидается, что такой гетеродимерный гибридный белковый конъюгат антитело-цитокин имеет в негликозилированном состоянии размер 114 кДа. Поскольку существуют другие состояния гликозилирования, молекулярная масса конъюгата может варьировать в зависимости от вида, в котором он экспрессируется, из-за других рисунков гликозилирования. Теоретический размер гибридного белка, рассчитанный на основании длины последовательности ДНК без посттрансляционного гликозилирования, составляет 65 кДа для р 40-L19, 49 кДа для L19-р 35 и 114 кДа для гетеродимера p40-L19/L19-р 35. Клонирование и экспрессия p40-scFv(L19)/scFv(L19)-p35. Две субъединицы p40-scFv(L19) и scFv(L19)-p35 раздельно клонировали в два разных вектора, первый из которых содержал для детекции метку myc, а второй содержал для детекции гистидиновую метку. Фрагмент p40-scFv(L19)-myc получали путем ПЦР с использованием в качестве матрицы вектора рСН 33, содержащего ген, кодирующий белок scIL12-scFv(L19)-FLAG [15], и вектора pLB, содержащего ген, кодирующий фрагмент SIP(L19) [21]. Первый фрагмент А, содержащий половину структуры р 40,создали с применением рСН 33 в качестве матрицы. ПЦР проводили с первым праймером HindSp40back(5' ccc aagctt atg tgt cct cag aag cta acc atc 3') (SEQ ID NO: 10), который присоединялся к последовательности секреции субъединицы р 40 интерлейкина IL12, вводя сайт рестрикции для эндонуклеазы HindIII в ее 5'-конец, и со вторым праймером Sp40HaLifor (5' acc tcc atc agc gct tcc gga tcg gac cct gca gg 3') (SEQ IDNO: 11), который присоединяется к 3'-концу р 40 и добавляет часть линкера (GSADGG) для соединения со вторым фрагментом В. Данный фрагмент В, привносящий структуру scFv(L19), получили в 2 раундах ПЦР с использованием матрицы pLB, с первым праймером LinkL19back (5' gga agc gct gat gga ggt gag gtgcag ctg ttg gag tc 3') (SEQ ID NO: 12), который присоединяется к 5'-концу scFvL19 и добавляет часть линкера (GSADGG) (SEQ ID NO: 15), и вторым праймером L19mycstoBamfor (5' att cag atc ctc ttc tga gat gagttt ttg ttc ttt gat ttc cac ctt ggt ccc ttg 3') (SEQ ID NO: 13), который присоединяется к 3'-концу scFv(L19) и добавляет С-концевую метку myc. Во втором раунде ПЦР синтез этого фрагмента закончили с использованием праймера LinkL19back и третьего праймера mycstoBamfor (5' cgc ggatcc cta tca tca att cag atc ctc ttctga gat gag ttt 3') (SEQ ID NO: 14), который добавляет 3 стоп-кодона и сайт рестрикции BamH1 на 5'-конец фрагмента В. Проводили сборку путем ПЦР с применением обоих фрагментов с праймерамиHindSp40back и mycstoBamfor с целью присоединить фрагмент р 40 к N-концу фрагмента антителаscFv(L19) гибким линкером GSADGG и получить фрагмент p40-GSADGG-L19-myc. Затем с помощью сайтов рестрикции HindIII и BamH1 фрагмент клонировали в вектор экспрессии в клетках млекопитающих pcDNA3.1+/Hygro, позволяющий использовать для селекции устойчивость к гигромицину. Вектором трансфецировали клетки линии СНО и отобрали стабильно трасфецированные клетки в присутствии гигромицина (500 мкг/мл). Проводили скрининг положительных клонов путем твердофазного ИФА с применением рекомбинантного домена ED-B в качестве антитела и анти-myc антитела для детекции. Гибридный белок очищали от культуральной среды культуры клеток методом аффинной хроматографии- 11011992 на колонках с антигеном, как описано в [19, 20], и обессоливали диализом в течение ночи при 4 С. Гибридный белок аликвотировали и заморозили при -20 С. Анализ размера методом электрофореза в ПААГДСН показал, что приблизительно 50% белка являются мономерами в двух разных состояниях гликозилирования и около 50% представляют собой гомодимеры [23]. Фрагмент scFv(L19)-p35-His получали путем сборки в реакции ПЦР с применением в качестве матрицы тех же плазмид рСН 33 и pLB. Первый фрагмент С, соответствующий структуре scFv(L19), создали на основе матрицы pLB с первым праймером EcoLonSL19back (5' ccg gaattc gct tgt cga cca tgg gct g 3')(SEQ ID NO: 16), который присоединяется к последовательности секреции scFvL19 и вводит сайт рестрикции для эндонуклеазы EcoR1 в 5'-конец этой последовательности, и вторым праймером L19HaLiforscFv(L19) и добавляет часть линкера (GSADGG). Второй фрагмент D, содержащий структуру р 35, получили в 2 раундах ПЦР с матрицей рСН 33 при помощи первого праймера HaLip35back (5' gga agc gct gatgga ggt agg gtc att cca gtc tct gga 3') (SEQ ID NO: 18), который присоединяется к 5'-концу зрелой субъединицы р 35 и добавляет часть линкера (GSADGG) к ее 5'-концу, и второго праймера p35hisfor (5' gtg atg gtgatg atg atg ggc gga get cag ata gcc 3') (SEQ ID NO: 19), который присоединяется к 3'-концу субъединицы р 35, добавляя к ней гистидиновую метку. Во втором раунде ПЦР при помощи праймера HaLip35back и третьего праймера p35hisstoNotIfor (5' ttt tcc ttt t gcggccgc eta tca tca gtg atg gtg atg atg atg ggc 3') (SEQ IDNO: 20) на 3'-конец фрагмента D добавляли 3 стоп-кодона и сайт рестрикции Not1. Затем субъединицу цитокина р 35 далее присоединяли к С-концу фрагмента scFv(L19) посредством ПЦР с использованием праймеров EcoLonSL19back и p35hisstoNotIfor, дающих в результате L19-GSADGG-p35-his. С помощью сайтов рестрикции EcoR1 и Not1 фрагмент затем клонировали в вектор экспрессии в клетках млекопитающих, позволяющий использовать для селекции устойчивость к неомицину. Этим вектором трансфецировали клетки HEK 293, стабильно трасфецированные клетки отбирали в присутствии G418 (500 мкг/мл). Проводили скрининг трасфецированных клеток для обнаружения устойчивых клонов, экспрессирующих гибридный белок, путем твердофазного ИФА, с применением рекомбинантного ED-B в качестве антигена и антигистидинового антитела для детекции. Гибридный белок очищали от культуральной среды культуры клеток методом аффинной хроматографии на колонках с антигеном, как описано в [19, 20], и обессоливали путем диализа в течение ночи при 4 С. Анализ методом электрофореза ПААГ-ДСН показал, что экспрессия очень слабая. Также было показано, что белок состоял из мономеров, димеров и олигомеров более высокого порядка. Затем клетки HEK 293 подвергали котрансфекции одновременно двумя векторами, кодирующимиscFv(L19)-p35 и p40-scFv(L19). Селекцию (отбор) стабильно трансфецированных клеток, которые содержат оба гибридных белка, проводили в присутствии G418 (500 мкг/мл) и гигромицина (500 мкг/мл). Выявляли клетки, экспрессирующие оба гибридных белка. Скрининг проводили путем твердофазного ИФА с использованием рекомбинантного EDB в качестве антигена и антигистидинового и анти-myc антител для детекции. Гибридный белок очищали на первой стадии путем аффинной хроматографии на колонке с антигеном ED-B, как описано в [19, 20], и обессоливали путем диализа в течение ночи при 4 С. Затем эту первую фракцию подвергали второй стадии очистки на колонках HisTrap HP 1 мл Ni2+ (AmershamBiosciences), на которй удаляли свободные фрагменты p40-scFv(L19), не связанные в гетеродимер (р 40scFv(L19)/scFv(L19)-p35). Для хранения к белку добавляли 0,1% Tween 80, а затем замораживали в аликвотах при -80 С. Анализ размера белка методом электрофореза в ПААГ-ДСН в невосстанавливающих условиях показал, что белок является димером в двух состояниях гликозилирования, а в восстанавливающих условиях представляет собой два разных мономера различных размеров, причем мономеры p40L19, видимо, существуют в двух различных состояниях гликозилирования. Гель-фильтрация на колонкахSuperdex S-200 показала, что в естественных условиях белок является чистым димером (фиг. 6). Характеристика p40-scFv(L19)/scFv(L19)-p35. Правильность фолдинга (складывания) гибридного белка и правильное образование дисульфидных связей определяли по активности IL12 в очищенном гетеродимерном белке. Активность IL-12 определяли путем анализа пролиферации Т-клеток [24]. Вкратце, мононуклеары периферической крови (МПК) человека культивировали в течение 3 дней с митогеном (фитогемагглютинин (ФГА) и IL-2), а затем инкубировали с серией разбавлений либо других слитых гибридных белков,либо коммерчески доступного рекомбинантного IL-12 мыши в качестве стандарта (RD Systems EuropeLtd., Abingdon, United Kingdom). Затем измерили пролиферацию Т-клеток по включению 3 Н-тимидина. Эксперименты по биораспределению проводили на белке p40-scFv(L19)/scFv(L19)-р 35, который очищали путем гель-фильтрации в модифицированной FPLC (быстрая жидкостная хроматография белков) на колонках Superdex S-200 и метили радиоактивным иодом. Меченый белок вводили путем инъекции иммунокомпетентным мышам линии 129SvEv, имеющим мышиную тератокарциному F9. Мышей умерщвляли спустя 4 и 24 ч после инъекции, органы взвешивали и измеряли их радиоактивность. Накопление в представленных органах и опухоли выражали в % от введенной дозы на грамм ткани (%ID/г). При использовании конъюгатов гетеродимерного типа достигали накопления в опухоли почти 10% метки спустя 24 ч (фиг. 7).- 12011992 Использованная литература Содержание каждого упомянутого в тексте источника включено в настоящую заявку путем ссылки. 1. Viti, F., et al., Cancer Res, 1999. 59 (2): p. 347-52. 2. Birchler, M., et al., Nat. Biotechnol., 1999. 17 (10): p. 984-8. 3. Nilsson, F., et al., Cancer Res., 2001. 61 (2): p. 711-6. 4. Tsung, K., et al., J. Immunol., 1997. 158 (7): p. 3359-65. 5. Brunda, M.J., et al., J. Exp. Med., 1993. 178 (4): p. 1223-30. 6. Rodolfo, M. and M.P. Colombo, Methods, 1999. 19 (1): p. 114-20. 7. Nastala, C.L., et al., J. Immunol., 1994. 153 (4): p. 1697-706. 8. Atkins, M.B., et al., Clin. Cancer Res., 1997. 3 (3): p. 409-17. 9. Car, B.D., et al., Toxicol. Pathol., 1999. 27 (1): p. 58-63. 10. Jain, R.K.a.B.L.T., Cancer Res., 1988. 48: p. 7022-32. 11. Folkman, J., Nat. Med., 1995. 1 (1): p. 27-31. 12. Voest, E.E., et al., J. Natl. Cancer Inst., 1995. 87 (8): p. 581-6. 13. Duda, D.G., et al., Cancer Res., 2000. 60 (4): p. 1111-6. 14. Neri, D., and Melkko, S., US Patent Application US 10/382,107. 15. Halin, C., et al., Nat. Biotechnol., 2002. 20 (3): p. 264-9. 16. Santimaria, M., et al., Clin. Cancer Res., 2003. 9 (2): p. 571-9. 17. Gillies, S., US 6838260. 2005. 18. Carnemolla, В., et al., Blood, 2002. 99 (5): p. 1659-65. 19. Neri, D., et al., Nat. Biotechnol., 1996. 14: p. 485-490. 20. Tarli, L., et al., Blood, 1999. 94 (1): p. 192-8. 21. Borsi, L., et al., Int. J. Cancer, 2002. 102 (1): p. 75-85. 22. Li, E., et al., Protein Eng., 1997.10 (6): p. 731-6. 23. Trinchieri, G., Nat. Rev. Immunol., 2003. 3 (2): p. 133-46. 24. Gately, M.K., R. Chizzonite, and H.D. Presky, Current Protocols in Immunology, 1995. 6.16.1-6.16.15Health and Human Services. 1987. 36. Kontermann, R.Dubel, S., Antibody Engineering, Springer-Verlag New York, LLC; 2001, ISBN: 3540413545. 37. EP-A-184187. 38. GB2188638A. 39. EP-A-239400. 40. EP-A-0120694. 41. ЕР-А-0125023. 42. Заявка на международный патент WO92/01047. 43. Mendez, M. et al., (1997) Nature Genet., 15 (2): 146-156. 44. Knappik, et al., J. Mol. Biol. (2000) 296, 57-86. 45. Krebs, et al., Journal of Immunological Methods, 254, 2001, 67-84. 46. Bird, et al., Science, 242, 423-426, 1988. 47. Huston, et al., PNAS USA, 85, 5879-5883, 1988. 48. Reiter, Y. et al., Nature Biotech., 14, 1239-1245, 1996. 49. Ko, et al., J. Immunother. 27 (3): 232-9, May-Jun. 2004. 50. King, D.M., et al., J. Clin. Oncol. 2004 Nov. 15; 22 (22): 4463-73. Epub. 2004, Oct. 13. 51. Neal, Z.C., et al., Clin. Cancer Res. 2004 Jul. 15; 10 (14): 4839-47. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат, включающий гетеродимер IL12, содержащий первую и вторую субъединицы, в котором и первая и вторая субъединицы связаны с молекулой антитела, лишенной Fc-фрагмента. 2. Конъюгат по п.1, отличающийся тем, что первая и вторая субъединицы гетеродимерного белка- 13011992 ковалентно связаны дисульфидной связью. 3. Конъюгат по п.1 или 2, отличающийся тем, что молекула антитела представляет собой одноцепочечное антитело Fv (scFv). 4. Конъюгат по п.1 или 2, отличающийся тем, что молекула антитела является молекулой антитела с единственным доменом (dAb). 5. Конъюгат по любому из пп.1-4, отличающийся тем, что первая субъединица конъюгирована с молекулой антитела в качестве первого гибридного белка и вторая субъединица конъюгирована с молекулой антитела в качестве второго гибридного белка. 6. Конъюгат по любому из пп.1-5, отличающийся тем, что конъюгат имеет молекулярную массу 250000 или меньше. 7. Конъюгат по п.6, отличающийся тем, что конъюгат имеет молекулярную массу 150000 или меньше. 8. Конъюгат по п.7, отличающийся тем, что конъюгат имеет молекулярную массу 120000 или меньше. 9. Конъюгат по любому из пп.1-8, отличающийся тем, что две молекулы антитела идентичны. 10. Конъюгат по любому из пп.1-9, включающий гетеродимер IL12 человека, конъюгированный с двумя молекулами антител, лишенных Fc-фрагментов, и расположенный между ними; причем гетеродимер IL12 имеет первую и вторую субъединицы; первая субъединица конъюгирована с молекулой антитела, лишенной Fc-фрагмента, в качестве первого гибридного белка и вторая субъединица конъюгирована с молекулой антитела, лишенной Fc-фрагмента, в качестве второго гибридного белка. 11. Конъюгат по п.10, отличающийся тем, что первый гибридный белок имеет последовательность аминокислот, показанную в SEQ ID NO: 1. 12. Конъюгат по п.10 или 11, отличающийся тем, что второй гибридный белок имеет последовательность аминокислот, показанную в SEQ ID NO: 2. 13. Конъюгат по любому из пп.1-10, отличающийся тем, что одна или две молекулы антитела специфично связываются с компонентами внеклеточного матрикса, связанными с ростом новообразований и/или ангиогенезом. 14. Конъюгат по п.13, отличающийся тем, что компонент представляет собой фибронектин ED-B. 15. Конъюгат по п.14, отличающийся тем, что молекула антитела представляет собой антителоscFv(L19), вариабельная область тяжелой цепи которого включает последовательности аминокислот SEQID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27, a вариабельная область легкой цепи которого включает последовательности аминокислот SEQ ID NO: 28, SEQ ID NO: 29 и SEQ ID NO: 30. 16. Конъюгат по п.15, отличающийся тем, что молекула антитела представляет собой антителоscFv(L19), имеющее последовательность аминокислот, показанную в SEQ ID NO: 5. 17. Конъюгат по п.13, отличающийся тем, что компонент матрикса представляет собой изоформу тенасцина-С. 18. Конъюгат по п.17, отличающийся тем, что молекула антитела представляет собой антителоscFv(TN11), имеющее последовательность аминокислот, показанную в SEQ ID NO: 21. 19. Способ получения конъюгата по любому из пп.5-18, включающий экспрессию первого и второго гибридных белков и конъюгирование первой и второй субъединиц с образованием гетеродимера IL12. 20. Способ по п.19, включающий экспрессию первого и второго гибридных белков в клетке, содержащей нуклеиновую кислоту, кодирующую оба гибридных белка. 21. Способ по п.19 или 20, включающий дополнительно введение конъюгата в в фармацевтическую композицию. 22. Композиция, содержащая первую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, который содержит молекулу антитела, лишенную Fc-фрагмента, и субъединицу р 40 интерлейкина IL12; и вторую молекулу нуклеиновой кислоты, включающую последовательность нуклеотидов, кодирующую гибридный белок, который содержит молекулу антитела, лишенную Fc-фрагмента, и субъединицу р 35 интерлейкина IL12. 23. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой scFv. 24. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой dAb. 25. Композиция по п.22, отличающаяся тем, что молекула антитела представляет собой антитело,описанное в любом из пп.13-18. 26. Композиция по любому из пп.22-25, отличающаяся тем, что первая и вторая молекулы нуклеиновой кислоты являются первым и вторым векторами. 27. Клетка-хозяин, содержащая первую и вторую молекулы нуклеиновой кислоты, определенные согласно любому из пп.22-26.- 14011992 28. Фармацевтическая композиция, содержащая конъюгат по любому из пп.1-18. 29. Конъюгат согласно любому из пп.1-18 для применения в лечении людей или животных путем терапии. 30. Применение конюъюгата по любому из пп.11-18 в производстве лекарственного препарата для ингибирования ангиогенеза и/или роста новообразований у пациента. 31. Применение конъюгата по п.30, отличающееся тем, что лекарственный препарат применяют для лечения опухоли, ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации и ангиомы. 32. Способ ингибирования роста новообразования и/или ангиогенеза у пациента, включающий введение пациенту конъюгата по любому из пп.11-18. 33. Способ по п.32, включающий лечение опухоли, ревматоидного артрита, диабетической ретинопатии, возрастной мышечной дегенерации или ангиомы путем ингибирования ангиогенеза.
МПК / Метки
МПК: A61P 19/02, A61K 47/48, A61P 35/00, C07K 14/54
Метки: гибридный, антитела, белок, интерлейкина, фибронектину
Код ссылки
<a href="https://eas.patents.su/30-11992-gibridnyjj-belok-antitela-l19-k-fibronektinu-ed-b-i-interlejjkina-12.html" rel="bookmark" title="База патентов Евразийского Союза">Гибридный белок антитела l19 к фибронектину ed-b и интерлейкина 12</a>