Антитела против α vβ6
Номер патента: 11853
Опубликовано: 30.06.2009
Авторы: Саймон Кеннет Дж., Леоне Дайан Р., Шеппард Дин, Вейнреб Пол Х., Вайолетт Шелия М.
Формула / Реферат
1. Моноклональное антитело, которое (а) специфически связывается с avb6 и (b) ингибирует связывание avb6 с ассоциированным с латентностью пептидом (LAP) при значении IC50, меньшем, чем таковое у антитела 10D5, причем указанное моноклональное антитело содержит те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой, выбранной из группы, состоящей из гибридомы 6.1А8, АТСС РТА-3647, гибридомы 6.3G9, АТСС РТА-3649, гибридомы 6.8G6, АТСС РТА-3645, гибридомы 6.2В1, АТСС РТА-3646, 7.1G10, АТСС РТА-3898, 7.7G5, АТСС РТА-3899 и 7.1G5, АТСС РТА-3900.
2. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.1А8, АТСС РТА-3647.
3. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.3G9, АТСС РТА-3649.
4. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.8G6, АТСС РТА-3645.
5. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.2В1, АТСС РТА-3646.
6. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 7.1G10, АТСС РТА-3898.
7. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 7.7G5, АТСС РТА-3899.
8. Моноклональное антитело по п.1, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 7.1G5, АТСС РТА-3900.
9. Антитело по п.1, где связывание между антителом и avb6 зависит от двухвалентного катиона.
10. Антитело по п.9, где двухвалентный катион представляет собой Са2+, Mg2+ или Mn2+.
11. Антитело по п.1, где его связывание с avb6 не зависит от двухвалентного катиона.
12. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 1, 4 и 7, соответственно.
13. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 3, 5 и 8, соответственно.
14. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 3, 6 и 9, соответственно.
15. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 2, 46 и 47, соответственно.
16. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 49, 51 и 53, соответственно.
17. Антитело по п.1, в котором определяющие комплементарность области (CDR) тяжелой цепи имеют, по существу, аминокислотные последовательности SEQ ID NO: 50, 52 и 54, соответственно.
18. Антитело по п.1, содержащее последовательность вариабельного домена тяжелой цепи, представляющую собой любую из последовательностей SEQ ID NO: 19-36 и 61, 62.
19. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 19 и последовательность вариабельного домена легкой цепи SEQ ID NO: 37.
20. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 20 или 21 и последовательность вариабельного домена легкой цепи SEQ ID NO: 38.
21. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 22 и последовательность вариабельного домена легкой цепи SEQ ID NO: 43.
22. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 23 и последовательность вариабельного домена легкой цепи SEQ ID NO: 44.
23. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 24 и последовательность вариабельного домена легкой цепи SEQ ID NO: 45.
24. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 25 или 26 и последовательность вариабельного домена легкой цепи SEQ ID NO: 42.
25. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 27, 28 или 29 и последовательность вариабельного домена легкой цепи SEQ ID NO: 39.
26. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 34 или 35 и последовательность вариабельного домена легкой цепи SEQ ID NO: 40.
27. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 36 и последовательность вариабельного домена легкой цепи SEQ ID NO: 41.
28. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 61 и последовательность вариабельного домена легкой цепи SEQ ID NO: 63.
29. Антитело по п.18, содержащее последовательность вариабельного домена тяжелой цепи SEQ ID NO: 62 и последовательность вариабельного домена легкой цепи SEQ ID NO: 64.
30. Моноклональное антитело, которое специфически связывается с avb6, но не ингибирует связывание avb6 с ассоциированным с латентностью пептидом (LAP), причем указанное моноклональное антитело содержит те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой, выбранной из группы, состоящей из гибридомы 6.2А1, АТСС РТА-3896 и гибридомы 6.2Е5, АТСС РТА-3897.
31. Антитело по п.30, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.2А1, АТСС РТА-3896.
32. Антитело по п.30, содержащее те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.2Е5, АТСС РТА-3897.
33. Композиция для профилактики или лечения у млекопитающего заболевания, опосредованного avb6, содержащая антитело по любому из пп.1-32 и фармацевтически приемлемый носитель.
34. Композиция по п.33, в которой антитело конъюгировано с цитотоксическим средством.
35. Композиция по п.33, в которой антитело представляет собой катионзависимое антитело.
36. Способ лечения субъекта, характеризующегося наличием заболевания или риском наличия заболевания, опосредованного avb6, предусматривающий введение указанному субъекту композиции по п.33, причем указанный способ облегчает течение заболевания или отсрочивает его начало.
37. Способ по п.36, где субъектом является человек.
38. Способ по п.36, где заболевание представляет собой фиброз.
39. Способ по п.38, где фиброз представляет собой склеродермию, рубцы, фиброз печени, фиброз почек или фиброз легких.
40. Способ по п.36, где заболевание представляет собой псориаз.
41. Способ по п.36, где заболевание представляет сосющ рак.
42. Способ по п.41, где рак представляет собой эпителиальный рак.
43. Способ по п.41, где рак представляет собой рак ротовой полости, кожи, шейки матки, яичников, глотки, гортани, пищевода, легких, молочной железы, почек или колоректальный рак.
44. Способ по п.36, где заболевание представляет собой синдром Альпорта или атрезию желчного протока.
45. Способ по п.36, где заболевание представляет собой острое повреждение легкого.
46. Способ детекции avb6 в образце ткани млекопитающего, предусматривающий обеспечение контакта образца ткани с антителом по п.1 или 30, при этом наличие avb6 в образце детектируется в том случае, если указанное антитело связывается с указанным образцом ткани.
47. Способ по п.46, где антитело выбрано из группы, состоящей из антитела 6.2А1, АТСС РТА-3896 и 6.2Е5, АТСС РТА-3897.
48. Гибридома 6.1А8, АТСС РТА-3647, продуцирующая моноклональное антитело по п.1.
49. Гибридома 6.2В10, АТСС РТА-3648, продуцирующая моноклональное антитело по п.1.
50. Гибридома 6.3G9, АТСС РТА-3649, продуцирующая моноклональное антитело по п.1.
51. Гибридома 6.8G6, АТСС РТА-3645, продуцирующая моноклональное антитело по п.1.
52. Гибридома 6.2В1, АТСС РТА-3646, продуцирующая моноклональное антитело по п.1.
53. Гибридома 6.2А1, АТСС РТА-3896, продуцирующая моноклональное антитело по п.1.
54. Гибридома 6.2Е5, АТСС РТА-3897, продуцирующая моноклональное антитело по п.1.
55. Гибридома 7.1G10, АТСС РТА-3898, продуцирующая моноклональное антитело по п.1.
56. Гибридома 7.7G5, АТСС РТА-3899, продуцирующая моноклональное антитело по п.1.
57. Гибридома 7.1С5, АТСС РТА-3900, продуцирующая моноклональное антитело по п.1.
58. Выделенная нуклеиновая кислота, кодирующая последовательности SEQ ID NO: 19-45 и 61-64 вариабельных доменов легкой и тяжелой цепей антитела по п.1.
59. Моноклональное антитело, которое: (а) специфически связывается с avb6 и (b) ингибирует связывание avb6 с ассоциированным с латентностью пептидом (LAP) при значении IC50, большем, чем таковое у антитела 10D5, причем указанное моноклональное антитело содержит те же самые определяющие комплементарность области (CDR) тяжелой цепи и легкой цепи, что и антитело, продуцируемое гибридомой 6.2В10, АТСС РТА-3648, или области CDR имеют аминокислотную мутацию, такую, что участок гликозилирования элиминирован.
60. Применение композиции по п.33 для получения лекарственного средства для лечения заболевания, опосредованного avb6, где указанное средство облегчает течение заболевания или отсрочивает его начало.
61. Применение по п.60, где субъектом является человек.
62. Применение композиции по п.60, где заболевание представляет собой фиброз.
63. Применение композиции по п.62, где фиброз представляет собой склеродермию, рубцы, фиброз печени, фиброз почек или фиброз легких.
64. Применение по п.60, где заболевание представляет собой псориаз.
65. Применение по п.60, где заболевание представляет собой рак.
66. Применение по п.65, где рак представляет собой рак ротовой полости, кожи, шейки матки, яичников, глотки, гортани, пищевода, легких, молочной железы, почек или колоректальный рак.
67. Применение по п.60, где заболевание представляет собой синдром Альпорта или атрезию желчного протока.
68. Применение по п.60, где заболевание представляет собой острое повреждение легкого.
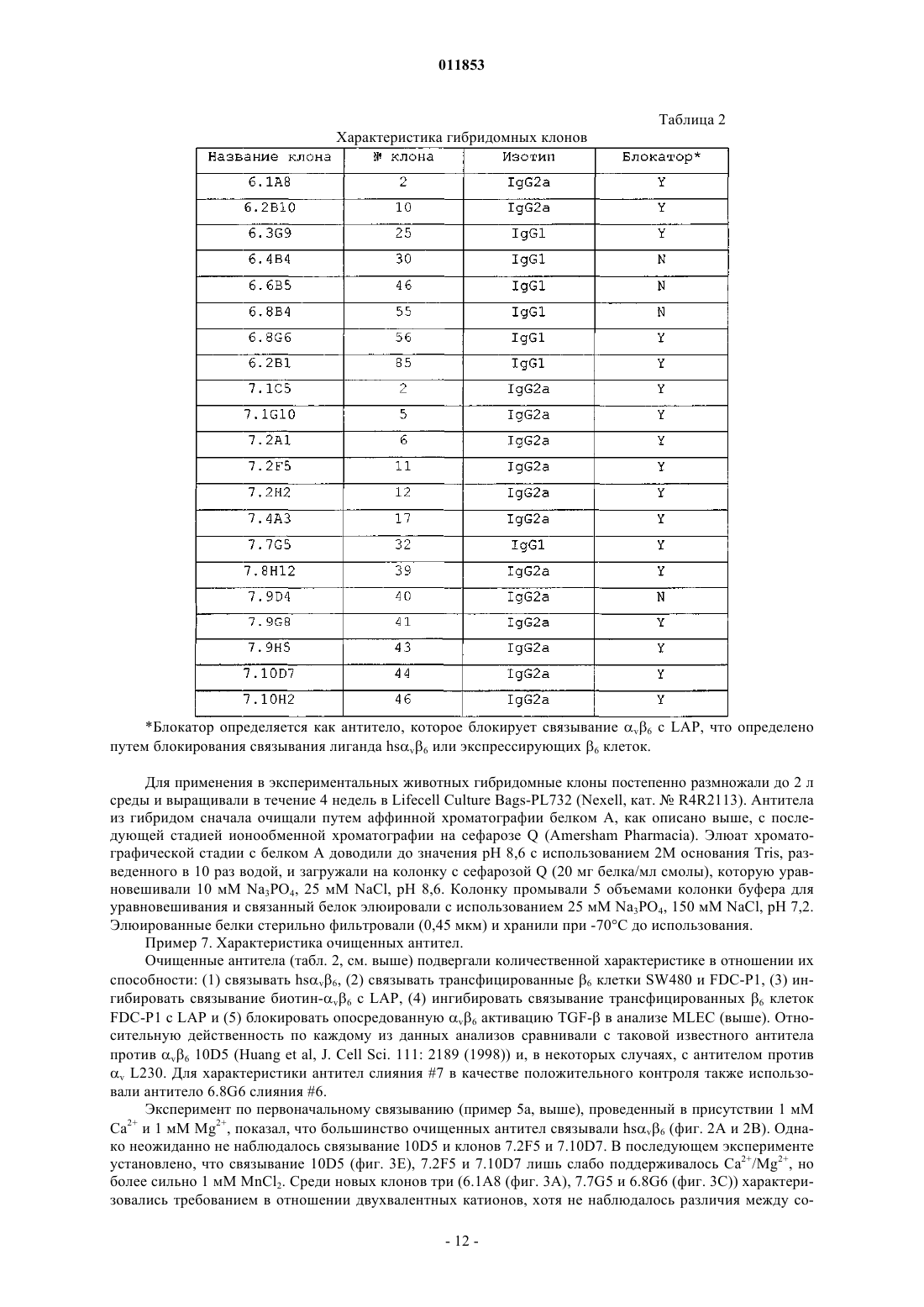
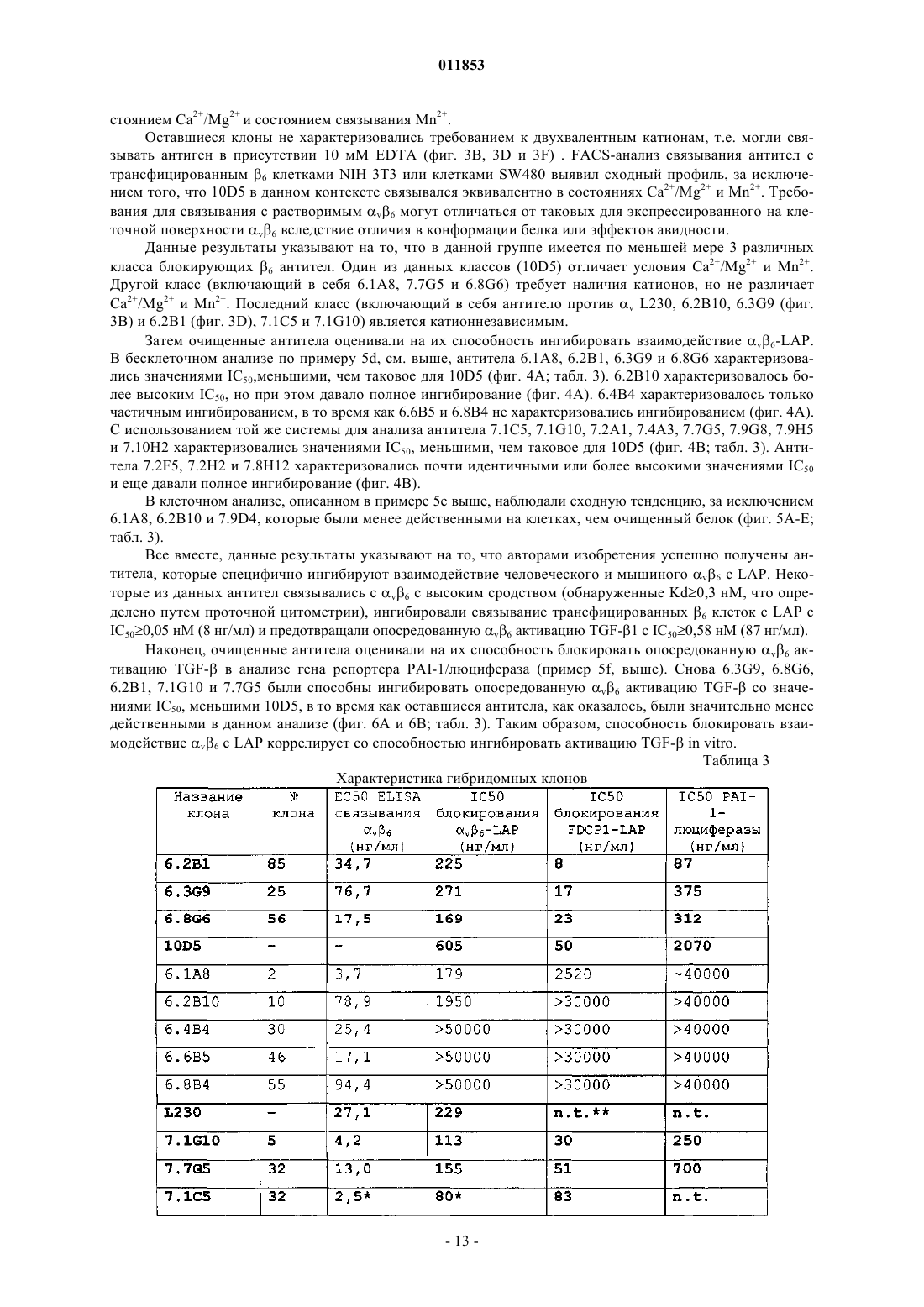
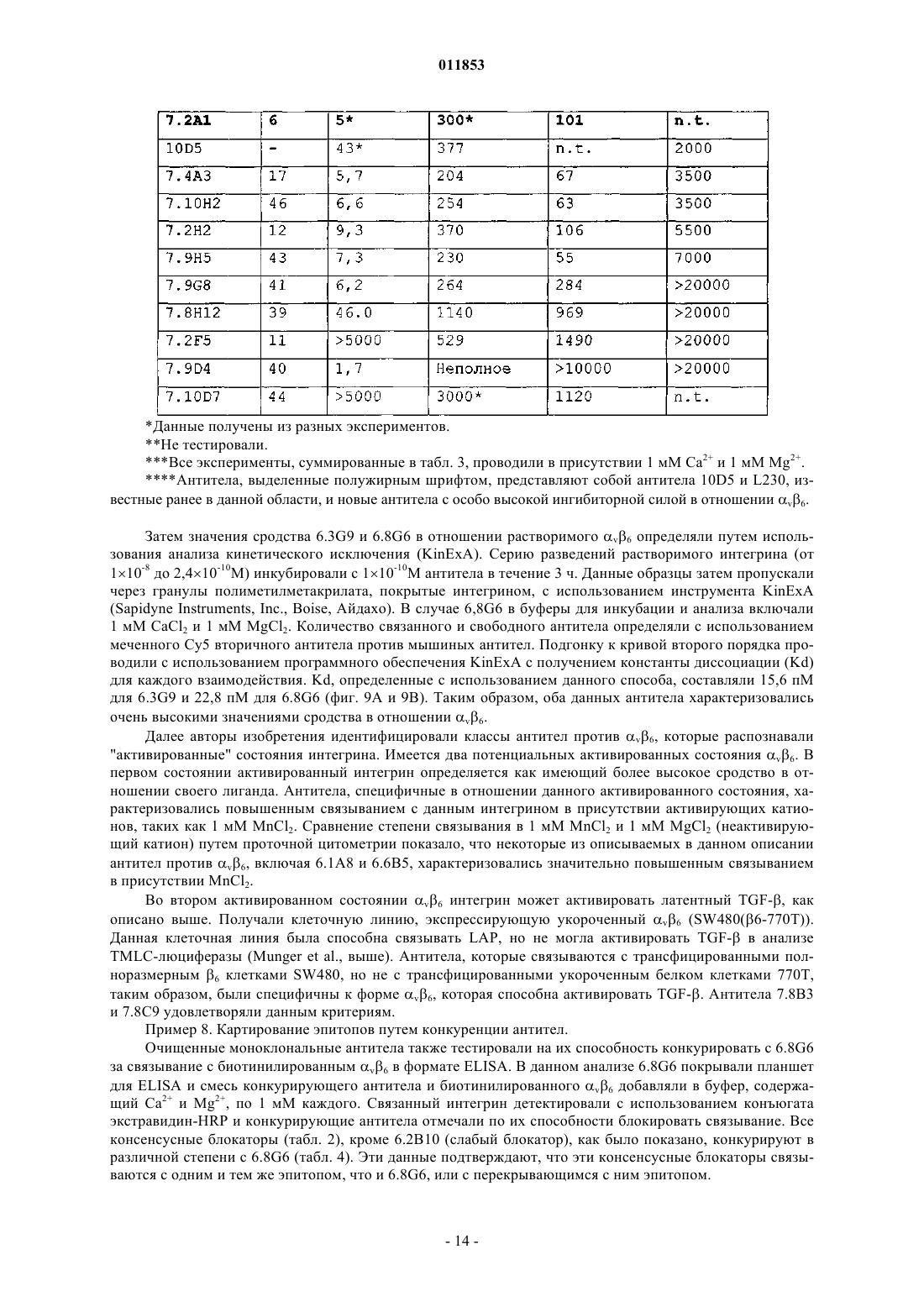
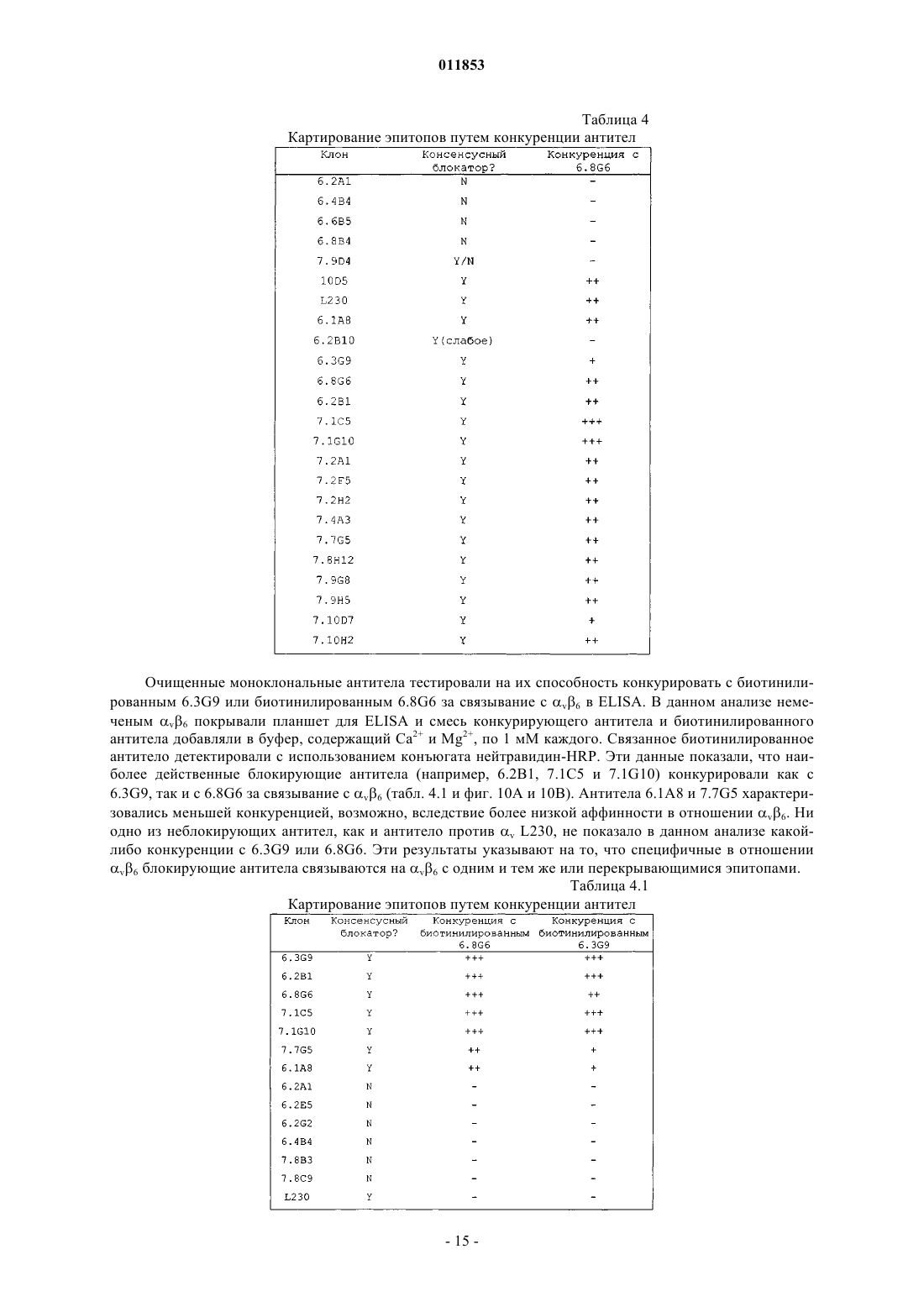
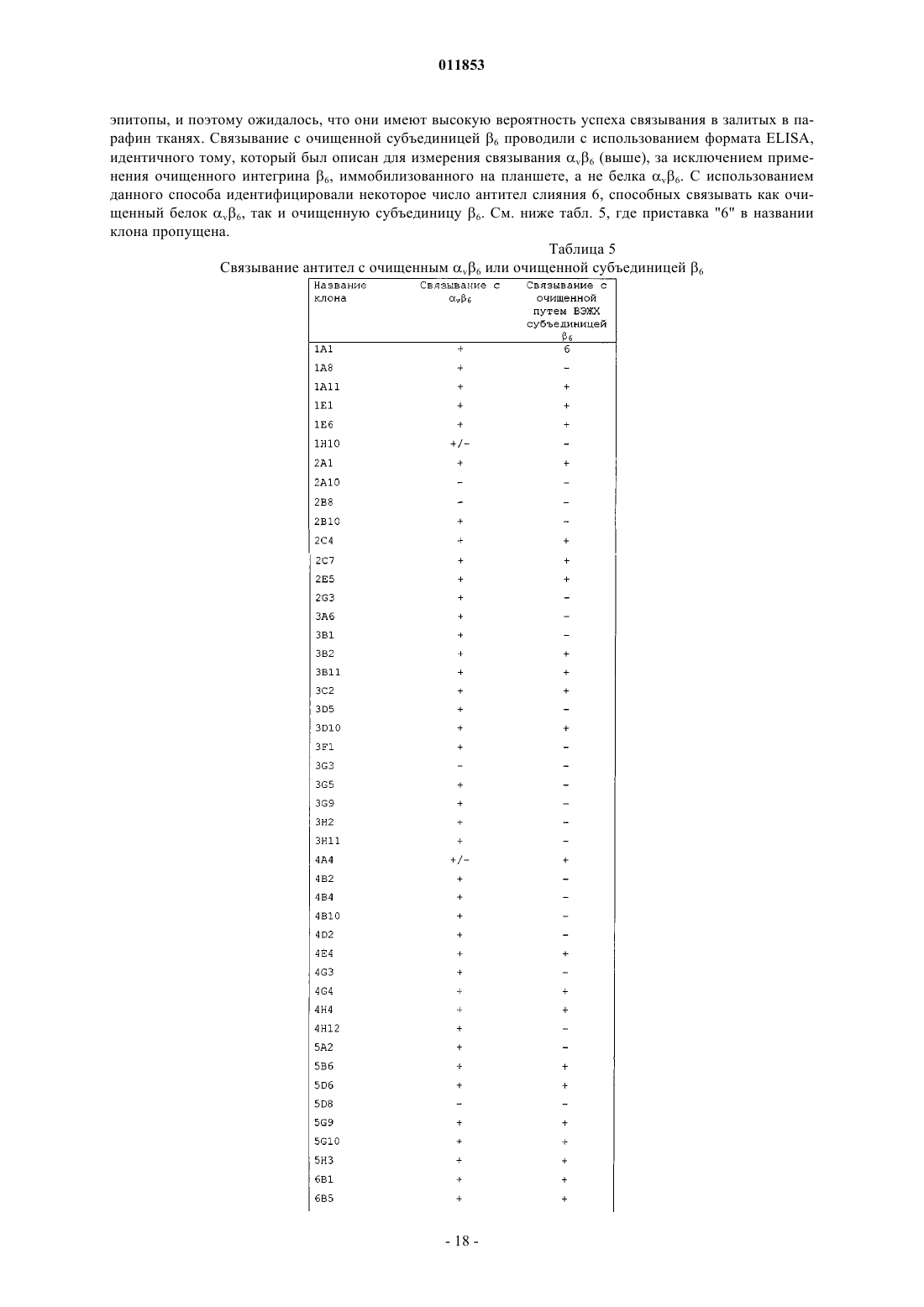
Текст
011853 Область изобретения Изобретение относится, в общем, к области молекулярной биологии, и конкретно к антителам против v6-интегринов. Предпосылки изобретения Интегрины представляют собой надсемейство рецепторов клеточной поверхности, которые опосредуют адгезию клетка-клетка и клетка-матрикс. Данные белки, как известно, обеспечивают заякоривание,а также сигналы клеточного роста, миграции и дифференцировки во время развития и восстановления ткани. Интегрины также вовлечены в обратную дифференцировку и инвазию клеток, особенно когда клетки теряют свою специализированную форму и становятся метастазирующими раковыми клетками. Интегрины представляют собой гетеродимерные белки, составленные из двух нековалентно связанных субъединиц,и . Специфичность связывания интегринами диктуется комбинацией некоторых из 18 различных -цепей с некоторыми из 8 различных -цепей. v6-Интегрин может связываться с некоторым количеством лигандов, включая фибронектин, тенасцин, витронектин и недавно идентифицированный ассоциированный с латентностью пептид "LAP", пептид из 278 аминокислот, синтезированный в виде части белка-предшественника TGF- (Munger et al., Cell 96 (3): 319-328 (1999. LAP отщепляется от зрелой формы TGF- в виде N-концевого пептида во время секреции, но остается нековалентно ассоциированным с TGF- для поддержания его латентного состояния. Данный комплекс не может связываться с рецептором TGF- и поэтому не активен биологически. v6-Интегрин может связываться непосредственно с RGD-мотивом, содержащимся внутри LAP, что приводит к высвобождению LAP и активации TGF-. Поскольку связывание v6 с LAP может иметь значение при переходе TGF- в его активное состояние, блокирование данного связывания может приводить к ингибированию v6-опосредованной активации TGF- и ассоциированной фиброзной патологии. Сущность изобретения Данное изобретение основывается на открытии и характеристике высокоаффинных антител противv6, включая идентификацию и анализ ключевых аминокислотных остатков в областях, определяющих комплементарность (CDR) таких антител. Данное изобретение относится моноклональному антителу, которое: (а) специфически связывается с v6; (b) ингибирует связывание v6 с его лигандом, таким как LAP, фибронектин, витронектин и тенасцин, со значением IC50, меньшим, чем у антитела 10D5 (публикация заявки на выдачу международного патента WO 99/07405); (с) блокирует активацию TGF-; (d) содержит определенные аминокислотные последовательности в CDR (например, такие, как показано на фиг. 7 А и 7 В), которые обеспечивают специфичность связывания с v6; (e) специфически связывается с субъединицей 6 и/или (f) распознаетv6 в процедурах иммунного окрашивания, таких как иммунное окрашивание залитых в парафин тканей. Было обнаружено, что антитела, которые связываются с v6, могут быть разделены на биофизически различные классы и субклассы. Один из классов антител проявляет способность блокировать связывание лиганда (например, LAP) с v6 (блокаторы). Данный класс антител может далее разделяться на субклассы катионзависимых блокаторов и катионнезависимых блокаторов. Некоторые из катионзависимых блокаторов содержат пептидную последовательность аргинин-глицин-аспартат (RGD), а катионнезависимые блокаторы не содержат RGD-последовательность. Другой класс антител проявляет способность связываться с v6 и при этом не блокирует связывания v6 с лигандом (неблокирующие антитела). Соответственно, в некоторых осуществлениях данного изобретения некоторые антитела согласно изобретению являются катионзависимыми двухвалентными в плане связывания v6, в то время как другие являются катионнезависимыми двухвалентными в плане связывания v6. Типовыми катионами являются Са 2+, Mg2+ и Mn2+. В некоторых осуществлениях антитело содержит те же полипептидные последовательности легких и тяжелых цепей, что и антитело, продуцируемое гибридомой 6.1 А 8, 6.3G9, 6.8G6, 6.2 В 1, 6.2 В 10, 6.2 А 1,6.2 Е 5, 7.1G10, 7.7G5 или 7.1 С 5. В некоторых осуществлениях антитела содержат тяжелую цепь, области, определяющие комплементарность, (CDR) 1, 2 и 3 которой состоят, по существу (т.е., за исключением некоторых консервативных вариаций), из последовательностей SEQ ID NO: 1, 4 и 7, соответственно, и/или легкую цепь, CDR 1,2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 10, 13 и 15, соответственно. В некоторых осуществлениях антитела содержат тяжелую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 3, 5 и 8, соответственно, и/или легкую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 11, 14 и 17, соответственно. В некоторых осуществлениях антитела содержат тяжелую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 3, 6 и 9, соответственно, и/или легкую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 12, 14 и 18, соответственно. В некоторых осуществлениях антитела содержат тяжелую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 2, 46 и 47, соответственно, и/или легкую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 48, 13 и 16, соответственно.-1 011853 В некоторых осуществлениях антитела содержат тяжелую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 49, 51 и 53, соответственно, и/или легкую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 55, 57 и 59, соответственно. В некоторых осуществлениях антитела содержат тяжелую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 50, 52 и 54, соответственно, и/или легкую цепь, CDR 1, 2 и 3 которой состоят, по существу, из последовательностей SEQ ID NO: 56, 58 и 60, соответственно. В некоторых осуществлениях антитела содержат последовательность вариабельного домена тяжелой цепи, любую из SEQ ID NO: 19-36 и 61-62. В некоторых осуществлениях антитела содержат последовательности вариабельных доменов тяжелой и легкой цепей: В некоторых осуществлениях антитела специфически связываются с v6, но не ингибируют связывание с пептидом, ассоциированным с латентностью (LAP). По меньшей мере, некоторые из данных антител способны связываться с v6 в залитых в парафин срезах тканей и поэтому могут использоваться для диагностических целей. Типовые антитела включают в себя 6.2 А 1 и 6.2 Е 5. Данное изобретение также относится к антителам, которые связываются с теми же эпитопами, что и любое из описанных выше антител. Данное изобретение также относится к композициям, включающим в себя одно или несколько антител согласно изобретению и фармацевтически приемлемый носитель. В некоторых из данных композиций антитела конъюгируют с цитотоксическим агентом (т.е. с агентом, который ослабляет жизнеспособность и/или функции клетки), таким как токсин или радионуклид. Антитела в данных композициях могут быть катионзависимыми антителами. Композиции могут вводиться субъекту (например, млекопитающему, такому как человек), страдающему от заболевания, опосредованного v6, или при риске такого заболевания, для лечения (например, облегчения, смягчения, снижения, предотвращения, отложения приступа) заболевания. Неограничивающие примеры таких заболеваний охватывают фиброз (например,склеродермию, рубцы, фиброз печени, фиброз легких и фиброз почек); псориаз; злокачественные опухоли (например, эпителиальный рак; рак ротовой полости, кожи, шейки матки, яичников, глотки, гортани,пищевода, легких, молочной железы, почки или колоректальный рак); синдром Альпорта; острые и хронические повреждения легкого, печени, почек и других внутренних органов и склероз легкого, печени,почек и других внутренних органов. Риски возникновения таких заболеваний могут быть результатом генетической предрасположенности; некоторых жизненных привычек, таких как курение и алкоголизм; воздействия загрязнителей окружающей среды, таких как асбест; физиологических состояний, таких как диабет, инфекция вирусным гепатитом (например, инфекция вирусным гепатитом С), аутоиммунные заболевания; и медицинских процедур, таких как радиационная терапия. Данное изобретение также относится к способам детекции v6 в образце ткани от млекопитающего(например, человека), охватывающим контактирование образца ткани с антителом по изобретению, таким как 6.2 А 1 и 6.2 Е 5. Данное изобретение также относится к клеткам гибридом 6.1 А 8, 6.2 В 10, 6.3G9, 6.8G6, 6.2 В 1, 6.2 А 1,6.2 Е 5, 7.1G10, 7.7G5 и 7.1 С 5; выделенным нуклеиновым кислотам, включающим в себя кодирующую последовательность, любую из SEQ ID NO: 19-45 и 61-64; выделенным полипептидам, включающим в себя аминокислотную последовательность, любую из SEQ ID NO: 19-45 и 61-64. Антитело согласно изобретению относится к полноразмерному антителу, например антителу,включающему в себя две тяжелые цепи и две легкие цепи, или к антигенсвязывающему фрагменту полноразмерного антитела, такому как Fab-фрагмент, Fab'-фрагмент, F(ab')2-фрагмент или F(v)-фрагмент. Антитело согласно изобретению может быть мышиным антителом, или его гомологом, или полноразмерным человеческим антителом. Антитело согласно изобретению также может быть гуманизированным антителом, химерным антителом или одноцепочечным антителом. Антитело согласно изобретению может-2 011853 относиться к любому изотипу и субтипу, например к IgA (например, IgA1 и IgA2), IgG (например, IgG1,IgG2, IgG3 и IgG4), IgE, IgD, IgM, где легкие цепи иммуноглобулина могут быть типа каппа или лямбда. В некоторых осуществлениях антитело согласно изобретению может включать в себя мутацию (например, делецию, замену или добавление) в одной или нескольких (например, 2, 3, 4, 5 или 6) конкретных позициях в тяжелой цепи, так что эффекторная функция антитела (например, способность антитела связываться с Fc-рецептором или с фактором комплемента) изменена без влияния на антигенсвязывающую активность антитела. В других осуществлениях антитело согласно изобретению может содержать мутацию в аминокислотном остатке, который представляет собой участок гликозилирования, так что участок гликозилирования элиминируется. Такое антитело может обладать предпочтительным для клиники снижением эффекторных функций или других нежелательных функций при сохранении его антигенсвязывающей активности. Мутация участка гликозилирования также может быть благоприятной для разработки способа (например, экспрессии и очистки белка). В других осуществлениях тяжелые или легкие цепи могут содержать мутации, которые повышают сродство или эффективность. Некоторые из гибридом слияния 6 и слияния 7 поместили на хранение в American Type CultureCollection ("ATCC"; P.O. Box 1549, Manassas, VA 20108, США) по Будапештскому соглашению. Гибридомные клоны 6.1 А 8, 6.2 В 10, 6.3G9, 6.8G6 и 6.2 В 1 поместили на хранение 16 августа 2001 г., и они имеют инвентарные номера АТСС РТА-3647, -3648, -3649, -3645 и -3646, соответственно. Гибридомные клоны 6.2 А 1, 6.2 Е 5, 7.1G10, 7.7G5 и 7.1 С 5 поместили на хранение 5 декабря 2001 г., и они имеют инвентарные номера АТСС РТА-3896, -3897, -3898, -3899 и -3900, соответственно. См. табл. 1 ниже. Антитела согласно изобретению могут использоваться для лечения любого нежелательного для клиники состояния или заболевания (обсуждающегося в данном описании), которое опосредовано связыванием v6 с его лигандом, таким как LAP и фибронектин. Данные антитела могут быть более эффективными за счет более высокого сродства или авидности и зависимости или независимости связывания лиганда от катионов по сравнению с ранее известными антителами против v6. В дополнение к терапевтическим применениям антител согласно изобретению, особенно блокаторов, класс неблокирующих антител может использоваться для диагностических целей, таких как анализы связывания антител, иммуноферментные сорбционные анализы (ELISA), иммуногистохимия и т.п. Другие свойства или преимущества изобретения будут ясны из дальнейшего подробного описания,фигур и формулы изобретения. Краткое описание фигур Фиг. 1 А и 1 В представляют собой гистограммы, на которых показаны результаты анализа по захвату клеток, в котором определяли способность различных моноклональных антител ("mAb") против v6 связывать трансфицированные 6 клетки FDC-P1 (в качестве контроля - нетрансфицированные клетки). Фиг. 2 А представляет собой график, на котором показаны результаты анализов ELISA, в которых определяли способность различных очищенных моноклональных антител против v6 "слияния 6" связывать растворимый рекомбинантный v6 человека ("hsv6"). Данные антитела получали путем иммунизации мышей 6-/- растворимым укороченным человеческим v6. Числа в подписи к фигуре, справа,указывают на номера клонов. Соответствующие названия клонов см. в табл. 2. Фиг. 2 В представляет собой график, на котором показаны результаты анализов ELISA, в которых определяли способность различных очищенных моноклональных антител против v6 "слияния 7" связывать растворимый рекомбинантный hsv6. Данные антитела получали путем иммунизации мышейv6-/- трансфицированными 6 клетками NIH 3 Т 3 (слияние 7). Фиг. 3 А-F представляют собой графики, на которых показана дифференциальная зависимость от катионов связывания различных моноклональных антител против v6 с hsv6. Фиг. 4 А и 4 В представляют собой графики, на которых показано, что моноклональные антитела слияния 6 и слияния 7, соответственно, ингибируют связывание биотин-hsv6 с LAP. Фиг. 5 А-Е представляют собой графики, на которых показано, что моноклональные антитела согласно изобретению ингибируют связывание трансфицированных 6 клеток FDC-P1 с LAP. На фиг. 5 А и 5 В показаны результаты, полученные с антителами слияния 6. На фиг. 5 С-Е показаны результаты, полученные с антителами слияния 7. Фиг. 6 А и 6 В представляют собой графики, на которых показано, что антитела слияния 6 и слияния 7, соответственно, ингибируют опосредованную v6 активацию TGF-, с использованием анализа с использованием гена-репортера PAI-1-люциферазы для мониторинга активации TGF-. Фиг. 7 А отображает аминокислотные последовательности вариабельных доменов тяжелых цепей моноклональных антител против v6 6.1A8, 6.8G6 (субклоны А и В), 7.7G5, 6.2 В 1, 6.3G9, 6.2 В 10 (субклоны А и В), 6.2G2, 6.2 А 1, 6.4 В 4 (субклоны А, В и С), 7.10 Н 2, 7.9 Н 5, 7.4 А 3 (субклоны А и В), 7.1 С 5(субклоны А и В) и 7.1G10. Антитела 6.1 А 8, 6.8G6 и 7.7G5 являются катионзависимыми в плане связывания с v6, в то время как антитела 6.2 В 1, 6.2 А 1, 6.3G9, 6.2 В 10, 6.4 В 4, 7.1 С 5 и 7.1G10 являются катионнезависимыми (см. ниже). Номера сносок означают позиции аминокислотных остатков. CDR находятся в больших прямоугольниках, в то время как малые прямоугольники содержат показанные курсивом-3 011853 аминокислоты, характеризующиеся полиморфизмом в различных клонах конкретного антитела. На фиг. 7 В отображены аминокислотные последовательности вариабельных доменов легких цепей моноклональных антител против v6 6.1 А 8, 6.8G6, 6.4 В 4, 6.2 А 1, 7.1 С 5, 7.1G10, 6.2 В 10, 7.7G5, 6.2 В 1 и 6.3G9. Фиг. 8 представляет собой график рассеяния, на котором показана экспрессия v6 в срезах ткани рака молочной железы человека и плоскоклеточной карциномы человека. Нормальные ткани человека характеризуются лишь незначительными уровнями экспрессии v6. Фиг. 9 А и 9 В представляют собой графики кривых второго порядка, изображающие связывающие активности в растворе двух антител против v6 6.8G6 и 6.3G9, соответственно, в отношении растворимого v6. Фиг. 10 А и 10 В представляют собой гистограммы, на которых демонстрируется способность очищенных моноклональных антител конкурировать с биотинилированным 6.3G9 и биотинилированным 6.8G6, соответственно, за связывание с v6. Фиг. 11 представляет собой диаграмму, на которой показан процент окрашивания гладкомышечного актина в почках от животных UUO, подвергшихся лечению mAb против v6. На фиг. 12 показаны экспрессия v6 в опухолевых клеточных линиях путем FACS-анализа (правая сторона фигуры) и ингибирование связывания лиганда LAP опухолевыми клеточными линиями за счетmAb 6.3G9 и 6.4 В 4 (левая сторона фигуры). Фиг. 13 представляет собой диаграмму, на которой демонстрируется ингибирование связывания тремя опухолевыми клеточными линиями лиганда LAP за счет mAb против v6 6.3G9, 6.8G6 и 6.4 В 4. Связывание mAb сравнивали с общим связыванием без добавления тестовых mAb (ТВ) и неспецифическим связыванием лишь с контролем BSA (NSB). Фиг. 14 А и 14 В представляют собой графики, на которых показаны эффекты mAb против v6 6.3G9 и 6.4 В 4, соответственно, после периода исследования длительностью 33 суток в отношении опухолей, возникших вследствие имплантированных подкожно клеток Detroit 562. Фиг. 15 А-С представляют собой графики, на которых показаны эффекты mAb против v6 при индуцированном блеомицином фиброзе легких. (А) Обработка антителами с использованием mAb 6.3G9 начиналась на сутки 0 с момента введения блеомицина, и за ней следили в течение периода 30 суток;(В) обработка антителами с использованием mAb 6.3G9 начиналась на сутки 15 после обработки блеомицином, и за ней следили в течение периода 30 суток; (С) обработка антителами с использованием mAb 6.3G9, 6.8G6 и 6.4 В 4 начиналась на сутки 15 после обработки блеомицином, и за ней следили в течение продленного периода 60 суток. На фиг. 15 А и 15 В диаграммы слева представляют собой мкг гидроксипролина/легкое, в то время как диаграммы справа показывают процентное повышение по гидроксипролину по сравнению с обработанными солевым раствором мышами (без блеомицина). На фиг. 15 С на графике показано содержание гидроксипролина на легкое. Подробное описание изобретения Данное изобретение относится к классам и субклассам антител, которые специфичны в отношении интегрина v6. Антитела по меньшей мере одного класса (блокаторы) способны блокировать связывание v6 с LAP или предотвращать активацию TGF-. Далее описаны различные способы получения антител согласно изобретению. Способы, известные в данной области, но не описанные конкретно в данном описании, также входят в объем данного изобретения. Например, антитела согласно изобретению могут также идентифицироваться с использованием библиотек антител на основе фагового дисплея, таких как описанные Smith, Science 228: 1315-7 (1985); в патентах США 5565332, 5733743, 6291650 и 6303313. Дополнительные антитела согласно изобретению могут быть получены путем связывания идентифицированных в данном описании тяжелых цепей с неродственной легкой цепью, например с легкой цепью, идентифицированной по технологии фагового дисплея. Антитела не относящихся к человеку гибридом Моноклональные антитела согласно изобретению могут генерироваться путем хорошо известной гибридомной технологии. Для ее осуществления 6-/- животных (например, мышей, крыс или кроликов) иммунизируют очищенными или неочищенными препаратами v6, клетками, трансфицированными конструкциями кДНК, кодирующими v, 6 или оба антигена, клетками, которые конститутивно экспрессируют v6, и т.п. Антиген может доставляться в виде очищенного белка, белка, экспрессированного на клетках, фрагментов белка или его пептидов или в виде голой ДНК или вирусных векторов, кодирующих белок, фрагмент белка или пептид. Сыворотки иммунизированных животных затем тестируют на наличие антител против v6. Из тест-позитивных животных выделяют В-клетки и гибридомы получают с использованием данных В-клеток. Антитела, секретируемые гибридомами, подвергают скринингу на их способность специфически связываться v6 (например, связываться с трансфицированными 6 клетками и не связываться с нетрансфицированными исходными клетками) и на любые другие требуемые свойства, например на наличие требуемых консенсусных последовательностей CDR, на ингибирование (или отсутствие ингибирова-4 011853 ния в случае неблокирующих антител) связывания LAP и v6 со значением IC50 ниже такового у известного антитела против v6 10D5 или на ингибирование активации TGF-. Гибридомные клетки, тест-позитивные в анализах по скринингу, культивируют в питательной среде в условиях, которые обеспечивают секрецию клетками моноклональных антител в культуральную среду. Затем приведенную к должным условиям культуральную надосадочную жидкость собирают и очищают содержащиеся в надосадочной жидкости антитела. Альтернативно, требуемое антитело может продуцироваться путем инъекции гибридомных клеток в брюшную полость неиммунизированного животного(например, мыши). Гибридомные клетки пролиферируют в брюшной полости, секретируя антитело, которое накапливается в виде асцитной жидкости. Затем антитело может быть собрано путем отбора шприцом асцитной жидкости из брюшной полости. Моноклональные антитела также могут генерироваться путем выделения кодирующих антитела кДНК из требуемых гибридом, трансфекции клеток хозяина-млекопитающего (например, клеток СНО или NSO) данными кДНК, культивирования трансфицированных клеток хозяина и получения антитела из культуральной среды. Химерные антитела Моноклональные антитела согласно изобретению также могут генерироваться путем конструирования родственного гибридомного (например, мышиного, крысиного или кроличьего) антитела. Например, родственное антитело может быть изменено путем технологии рекомбинантной ДНК,так что целые области шарнира и/или константные области тяжелых и легких цепей или их части замещают соответствующими компонентами антитела из другого вида (например, человека). В общем, вариабельные домены сконструированного антитела остаются идентичными или, по существу, идентичными в отношении вариабельных доменов родственного антитела. Такое сконструированное антитело называют химерным антителом, и оно менее антигенно, чем родственное антитело при введении субъекту вида, из которого происходят области шарнира и/или константные области (например, человека). Способы получение химерных антител хорошо известны в данной области. Химерные антитела, относящиеся к настоящему изобретению, могут содержать вариабельный домен тяжелой цепи, имеющий последовательность, идентичную (или, по существу, идентичную) любой изSEQ ID NO: 19-36, и/или вариабельный домен тяжелой цепи, имеющий последовательность, идентичную(или, по существу, идентичную) любой из SEQ ID NO: 37-45. Предпочтительные константные области человека включают в себя те, что происходят от IgG1 и IgG4. Полностью человеческие антитела Моноклональные антитела согласно изобретению также включают в себя полностью человеческие антитела. Они могут быть получены с использованием примированных in vitro человеческих спленоцитов, как описано Boerner et al., J. Immunol. 147: 86-95 (1991), или с использованием библиотек антител фагового дисплея, как описано, например, в патенте США 6300064. В некоторые другие способы получения полностью человеческих антител вовлечено применение не относящихся к человеку животных, которые содержат инактивированные эндогенные локусы Ig и являются трансгенными по неперестроенным генам тяжелых цепей и легких цепей человеческих антител. Таких трансгенных животных можно иммунизировать v6, и затем из происходящих оттуда В-клеток получают гибридомы. Данные способы описаны, например, в различных публикациях/патентах GenPharm/MedarexGreen et al., Nature Genetics 7: 13-21 (1994); и Mendez et al., 15 (2): 146-56 (1997; в различных публикациях/патентах Kirin (Япония), касающихся "трансомных" мышей (например, ЕР 843961 и Tomizuka et al.,Nature Genetics 16: 133-1443 (1997. Гуманизированные антитела Моноклональные антитела согласно изобретению также включают в себя гуманизированные версии родственных антител против v6, происходящие из других видов. Гуманизированное антитело представляет собой антитело, продуцируемое по технологии рекомбинантной ДНК, где некоторые или все аминокислоты тяжелой или легкой цепи человеческого иммуноглобулина, которые не требуются для связывания антитела (например, константные области и каркасные области вариабельных доменов), используют для замещения соответствующих аминокислот из легкой или тяжелой цепи родственного, не относящегося к человеку антитела. Например, гуманизированная версия мышиного антитела к данному антигену имеет в обеих его тяжелых и легких цепях: (1) константные области человеческого антитела;(2) каркасные области из вариабельных доменов человеческого антитела и (3) CDR из мышиного антитела. При необходимости один или несколько остатков в каркасных областях человека могут заменяться остатками из соответствующих позиций мышиного антитела, так что сохраняется сродство связывания гуманизированного антитела с антигеном. Данное изменение иногда называют "обратная мутация". Гуманизированные антитела обычно реже вызывают иммунный ответ у людей по сравнению с химерными человеческими антителами, поскольку первые содержат заметно меньше не относящихся к человеку компонентов.-5 011853 Способы получения гуманизированных антител описаны, например, в Winter, ЕР 239400; Jones etal., Proc. Natl. Acad. Sci. USA 86: 3833 (1989). В общем, трансплантация мышиных (или других, не относящихся к человеку) CDR на антитело человека достигается следующим образом. кДНК, кодирующие вариабельные домены легких и тяжелых цепей, выделяют из гибридомы. Последовательности ДНК вариабельных доменов, включая CDR, определяют путем секвенирования. ДНК, кодирующие CDR, переносят в соответствующие области кодирующей последовательности вариабельных доменов легких и тяжелых цепей человеческого антитела путем сайт-специфического мутагенеза. Затем добавляют сегменты генов человеческих константных областей требуемого изотипа (например, 1 для СН и k для CL). Гуманизированные тяжелые и легкие цепи совместно экспрессируют в клетках хозяина-млекопитающего (например, клетках СНО или NSO) для получения растворимого гуманизированного антитела. Для облегчения крупномасштабной продукции антител часто требуется продуцировать такие гуманизированные антитела в биореакторах, содержащих экспрессирующие антитела клетки, или получать трансгенных млекопитающих (например, коз, коров или овец), которые экспрессируют данное антитело в молоке (см.,например, патент США 5827690). Иногда прямой перенос CDR в каркас антител человека приводит к потере сродства связывания антигена полученного в результате антитела. Это происходит потому, что в некоторых родственных антителах некоторые аминокислоты в каркасных областях взаимодействуют с CDR и так влияют на общее сродство связывания антителом. В таких случаях критичным является введение "обратных мутаций" (см. выше) в каркасные области акцепторного антитела для сохранения антигенсвязывающей активности родственного антитела. Общий подход к получению обратных мутаций известен в данной области. Например, у Queen et al.Inc.) описан подход, в который вовлечены две ключевые стадии. Во-первых, каркасные V-области человека выбирают путем компьютерного анализа для оптимальной гомологии белковой последовательности в отношении каркаса V-области родственного мышиного антитела. Затем на компьютере моделируют третичную структуру мышиной V-области для визуализации аминокислотных остатков каркаса, которые,вероятно, взаимодействуют с мышиными CDR, и данные мышиные аминокислотные остатки затем накладывают на гомологичный каркас человека. По данному двухстадийному подходу имеется несколько критериев для конструирования гуманизированных антител. Первым критерием является применение в качестве человеческой акцепторной части каркаса конкретного человеческого иммуноглобулина, который обычно гомологичен не относящемуся к человеку донорному иммуноглобулину, или применение консенсусного каркаса из многих человеческих антител. Вторым критерием является применение донорной аминокислоты вместо акцепторной,если человеческий акцепторный остаток не является обычным, а донорный остаток является типичным для последовательностей человека в положении конкретного остатка каркаса. Третьим критерием является применение донорного аминокислотного остатка каркаса, а не акцепторного, в положениях, непосредственно прилегающих к CDR. Также можно использовать другой подход, описанный, например, Tempest, Biotechnology 9: 266-271(1991). По данному подходу каркасы V-области, происходящие из тяжелых и легких цепей NEWM и REI,соответственно, используются для трансплантации CDR без радикального введения мышиных остатков. Преимущество применения данного подхода состоит в том, что трехмерные структуры вариабельных областей NEWM и REI известны из данных рентгеновской кристаллографии и, таким образом, могут легко моделироваться конкретные взаимодействия между CDR и остатками каркаса V-области. Другие фрагменты Моноклональные антитела согласно изобретению могут далее включать в себя другие фрагменты для выполнения требуемых функций. Например, антитела могут включать в себя фрагмент токсина (например, столбнячного токсина или рицина) или радионуклида (например, 111In или 90Y) для уничтожения клеток, пораженных данными антителами (см., например, патент США 6307026). Антитела могут включать в себя фрагмент (например, биотин, флуоресцентные фрагменты, радиоактивные фрагменты, гистидиновую метку или другие пептидные метки) для простого выделения или детекции. Антитела могут также включать в себя фрагмент, который может продлевать их период полужизни в сыворотке, например фрагмент полиэтиленгликоля (PEG). Состояния заболевания и модели животных Антитела согласно изобретению могут использоваться при лечении, включая профилактику, опосредованных v6 заболеваний. Например, данные антитела могут использоваться для лечения фиброза(например, фиброза легких, острого повреждения легких, фиброза почек, фиброза печени, синдрома Альпорта и склеродермии) путем блокирования активации TGF- или блокирования связывания v6 с любыми другими лигандами, такими как фибронектин, витронектин и тенасцин. Новизна данного подхода включает в себя следующее: (1) при нем блокируется активация TGF-, а не связывание TGF- с его-6 011853 рецептором, (2) при нем может ингибироваться TGF- местно (т.е. в участках положительной регуляцииv6), а не системно, и (3) при нем ингибируется связывание v6 c лигандом. Кроме заболеваний или состояний фиброза, антитела согласно изобретению могут использоваться при лечении злокачественных опухолей или метастазов злокачественных опухолей (включая рост и инвазию опухоли), особенно эпителиальных раков. Подмножество эпителиальных раков включает в себя плоскоклеточную карциному, например рак головы и шеи, ротовой полости, молочной железы, легких, предстательной железы, шейки матки, глотки, толстой кишки, поджелудочной железы и яичников. Исследования авторов изобретения с использованием новых моноклональных антител против v6 продемонстрировали, что v6 высокоэкспрессирован во многих эпителиальных раках, особенно в наиболее выраженном участке опухолей. Новые антитела также могут использоваться в отношении многих других заболеваний, опосредованныхv6, включая псориаз. Способы лечения согласно данному изобретению эффективны в отношении субъектов, являющихся людьми и животными, пораженных данными состояниями. Субъекты-животные, к которым может применяться данное изобретение, охватывают как домашних животных, так и скот, который держат в качестве любимцев или для коммерческих целей. Примерами являются собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи и козы. Эффективность антител согласно изобретению может тестироваться на различных экспериментальных животных. Модели фиброза легких на мышах включают в себя индуцированный блеомицином (Pittet et(Franko et al., Rad. Res. 140: 347-355 (1994. У обработанных блеомицином мышей экспрессия v6 повышается в эпителиальных альвеолярных клетках легких. Но 6-нокаут-мыши защищены от индуцированного блеомицином повреждения и фиброза. Модели фиброза почек на мышах включают в себя COL4A3-/- мышей (см., например, Cosgrove etal., Amer. J. Path. 157: 1649-1659 (2000), мышей с индуцированным адриамицином повреждением (Wanget al., Kidney International 58: 1797-1804 (2000); Deman et al., Nephrol. Dial. Transplant. 16: 147-150 (2001,мышей db/db (Ziyadeh et al., PNAS USA 97: 8015-8020 (2000 и мышей с односторонней закупоркой мочеточника (Fogo et al., Lab. Investigation 81: 189A (2001); и Fogo et al., Journal of the American Society ofNephrology 12: 819A (2001. Во всех этих моделях у мышей развиваются повреждение и фиброз почек,что может прогрессировать в почечную недостаточность. v6 положительно регулируется в эпителиальной выкладке восходящих и нисходящих трубочек почек COL4A3-/- мышей, обработанных адриамицином мышей и мышей, которые претерпевают одностороннюю закупорку мочеточника. Вероятно, что экспрессия v6 также возрастает при различных моделях повреждения почек. Моноклональные антитела против v6 также могут тестироваться на предмет их способности ингибировать рост, прогрессирование и метастазирование опухоли в таких моделях на животных, как стандартные модели опухолевого роста in vivo и модели метастазирования. См., например, Rockwell et al., J.Natl. Cancer Inst. 49: 735 (1972); Guy et al., Mol. Cell Biol. 12: 954 (1992); Wyckoff et al., Cancer Res. 60: 2504 (2000); и Oft et al., Curr. Biol. 8: 1243 (1998). Значимые лиганды v6 при раке могут включать в себяS44-S51 (2001, фибронектин и витронектин. Эффективность способов лечения согласно изобретению можно измерять некоторым количеством доступных диагностических инструментов, включая физическую оценку, тесты крови, измерения протеинурии, уровня креатинина и клиренса креатинина, тесты функции легких, уровни азота плазмы крови и мочи (BUN), наблюдение и подсчет рубцов или фиброзных очагов повреждения, отложение внеклеточного матрикса, такого как коллаген, гладкомышечный актин и фибронектин, тесты функции почек,ультразвуковое исследование, магнитно-резонансные снимки (MRI) и КТ-сканирование. Фармацевтические композиции Фармацевтические композиции согласно изобретению включают в себя одно или несколько антител согласно настоящему изобретению или их фармацевтически приемлемые производные, необязательно с любым фармацевтически приемлемым носителем. Используемый в данном описании термин "носитель" включает в себя известные приемлемые адъюванты и носители. Согласно изобретению фармацевтические композиции могут быть в виде стерильных препаратов для инъекций, например стерильной водной или масляной суспензии для инъекций. Данная суспензия может составляться по способам, известным в данной области, с использованием подходящих диспергирующих, увлажняющих и суспендирующих средств. Фармацевтические композиции согласно изобретению могут вводиться путем перорального, местного, внутривенного, подкожного, внутрибрюшинного, внутримышечного, интрамедуллярного, внутрисуставного, интрасиновиального, внутригрудинного, интратекального, внутрипеченочного или внутричерепного введения, в зависимости от требований, или непосредственно местно в участках воспаления или опухолевого роста. Фармацевтические композиции согласно изобретению могут также вводиться путем ингаляции, например посредством применения распылителя, ингалятора сухого порошка или ингалятора с отмеряемой дозой.-7 011853 Дозировка и мощность дозы антител согласно изобретению, эффективные для продукции требуемых эффектов, зависят от различных факторов, таких как природа подлежащего лечению заболевания,размер субъекта, цель лечения, конкретная используемая фармацевтическая композиция и решение лечащего врача. Уровни дозировки составляют примерно от 0,001 до 100 мг/кг массы тела в сутки, например примерно от 0,1 до 50 мг/кг массы тела в сутки подлежащего использованию соединения активного ингредиента. Например, антитело согласно изобретению вводят в дозе, изменяющейся от примерно 0,01 до примерно 20 мг/кг массы тела/сутки, например изменяющейся от примерно 0,1 до примерно 10 мг/кг массы тела/сутки, и с интервалами от 1 до 14 суток. В другом осуществлении антитело вводят в дозе от примерно 0,3 до примерно 1 мг/кг массы тела при внутрибрюшинном введении. Еще в одном осуществлении антитело вводят в дозе от примерно 5 до примерно 12,5 мг/кг массы тела при внутривенном введении. В одном из осуществлений композицию антитела вводят в количестве, эффективном для обеспечения уровня антитела в плазме, равного по меньшей мере 1 мг/мл. Способы диагностики Антитела согласно изобретению могут использоваться для диагностики состояний заболевания, ассоциированных с измененными уровнями экспрессии v6. Образец ткани из субъекта, такой как биопсия ткани, образец жидкости организма или лаваж (например, альвеолярный лаваж), может тестироваться в анализе захвата антигена, ELISA, иммуногистохимическом анализе и т.п. с использованием антител. Образец ткани из нормального субъекта используют в качестве контроля. При воплощении настоящего изобретения будут использоваться, кроме указанных иначе случаев,общепринятые способы клеточной биологии, культуры клеток, молекулярной биологии, микробиологии,рекомбинантной ДНК, белковой химии и иммунологии, которые относятся к данной профессиональной области. Такие способы описаны в литературе. См., например, Molecular Cloning: A Laboratory Manual,2nd edition (Sambrook et al., Eds.), 1989; Oligonucleotide Synthesis, (M.J. Gait, Ed.), 1984; патент США 4683195, выданный Mullis et al.; Nucleic Acid Hybridization, (B.D. Hames and S.J. Higgins), 1984; Transcription(D.M. Weir and C.C. Blackwell, Eds.), 1986; Manipulating the Mouse Embryo, 1986. Кроме случаев, где оговорено иначе, все используемые в данном описании технические и научные термины имеют значения, сходные с теми, которые понимаются обычным специалистом в данной области, к которой относится данное изобретение. Типовые способы и материалы описаны ниже, хотя способы и материалы, сходные или эквивалентные описанным в данном описании, также могут использоваться при воплощении настоящего изобретения. Все публикации или другие ссылки, приведенные в данном описании, включены во всей своей полноте в качестве ссылки. В случае конфликта для контроля будет служить следующая спецификация, включающая в себя определения. Материалы, способы и примеры являются лишь иллюстративными и не подразумеваются как ограничивающие. В пределах данного описания слово "включать в себя" или такие его варианты, как "включает в себя" или "включающий в себя",как это понимается, подразумевает включение установленного объекта и группы объектов, но не исключение любого другого объекта или группы объектов. Примеры Следующие примеры предназначены для иллюстрации способов и материалов настоящего изобретения. Подходящие модификации и адаптации описанных условий и параметров, обычно встречающихся в области применения антител, которые очевидны специалистам в данной области, находятся в пределах существа и объема настоящего изобретения. В следующих примерах получают 6-/- мышей, как это описано у Huang et al., в J. Cell Biol. 133: 921(1996). Рекомбинантный LAP человека приобретали у RD Systems (Minneapolis, Миннесота). Антитело 10D5 приобретали у Chemicon (Temecula, Калифорния). Гибридому L230 приобретали в АТСС и секретируемое антитело очищали из надосадочной жидкости насыщенных культур путем аффинной хроматографии на иммобилизированном белке А. Определение изотипа антител проводили с использованием набора ISOSTRIP (Roche Diagnostics) в соответствии с инструкциями производителя. Трансфицированную 6 клеточную линию SW480 получали, как описано у Weinacker et al., в J. Biol. Chem. 269: 6940-6948 (1994). Пример 1. Получение трансфицированных 6 стабильных клеточных линий. Трансфицированные 6 клетки NIH 3 Т 3 и FDC-P1 получали путем электропорации родительских клеточных линий ДНК-конструкциями, содержащими полноразмерную мышиную кДНК 6 и селективный маркер неомицин. Стабильно трансфицированные клетки отбирали путем пассирования клеток в культуральной среде, содержащей G418, в течение 14 суток с последующей сортировкой активированных флуоресценцией клеток (FACS) для выделения клеток, экспрессирующих наивысший уровень поверхностного 6. Трансфицированные клетки FDC-P1 культивировали в DMEM, дополненной 4 мМ Lглутамина, доведенной до содержания 1,5 г/л бикарбоната натрия, 4,5 г/л глюкозы и 1,0 мМ пирувата-8 011853 натрия, 10% FBS, 2,5% добавки для культуры мышиного IL-3 и 1,5 мг/мл активного G418. Трансфицированные клетки NIH 3T3 культивировали в DMEM, дополненной 10% FBS, 2 мМ L-глутамина, пенициллином/стрептомицином и 1 мг/мл активного G418. Пример 2. Очистка растворимого v6. Белок v6 очищали, по существу, как описано выше Weinacker, выше. Культивировали клеточную линию СНО, экспрессирующую hsv6, и полученную в результате надосадочную жидкость собирали центрифугированием. Интегрин очищали путем аффинной хроматографии с использованием антитела против v L230. Очищенное L230 перекрестно связывали с активированной CNBr сефарозой 4 В (Sigma) в отношении 4,8 мг антитела/мл смолы. Надосадочную жидкость v6 загружали в отношении 0,5 мг антитела/мл смолы на аффинную колонку с L230 и колонку промывали 10 объемами колонки с использованием каждый раз: (1) 50 мМ Tris-Cl, рН 7,5, 1 М NaCl, 1 мМ MgCl2; (2) 50 мМ Tris-Cl, рН 7,5, 50 мМ NaCl,1 мМ MgCl2; и (3) 10 мМ Na3PO4, рН 7,0. Hsv6 элюировали 100 мМ глицина, рН 2,5 в 1:10 объема 1 МNa3PO4, рН 8,0. Белок диализовали против нескольких смен забуференного фосфатом солевого раствора(PBS) и хранили при -20 С. Пример 3. Иммунизация 6-/- мышей. 6-/- мышей иммунизировали путем внутрибрюшинной инъекции (IP) 25 мкг очищенного рекомбинантного человеческого v6, эмульгированного в полном адъюванте Фрейнда (CFA) при объемном соотношении 1:1 в общем объеме 200 мкл. Альтернативно, 6-/- мышей иммунизировали путем внутрибрюшинной инъекции с 4106 трансфицированными 6 клетками NIH 3 Т 3, ресуспендированными в 100 мклPBS, дополненного 1 мг/мл CaCl2 и 1 мг/мл MgCl2, и тем же мышам делали инъекции в прилегающий участок 100 мкл CFA. Через 2 и 4 недели после первой иммунизации мышей сходным образом стимулировали теми же реагентами, за исключением того, что, вместо CFA, использовали неполный адъювант Фрейнда. Мышей забивали через 7 суток после окончательной стимуляции и определяли титры против 6 путем связывания сыворотки с очищенным рекомбинантным человеческим v6 или с трансфицированными 6 клетками. В случае иммунизации мышей очищенным рекомбинантным человеческим v6 мышей оставляли в покое на 3 месяца и повторно иммунизировали тем же антигеном, смешанным сImmunEasy (Qiagen). За 3 суток до выделения селезенок для слияния гибридом мышей иммунизировали 12,5 мкг очищенного рекомбинантного белка v6 человека путем внутрибрюшинной и внутривенной инъекций. В сутки слияния животных фиксировали, извлекали их селезенки и гомогенизировали их в суспензию единичных клеток. Спленоциты иммортализовали путем слияния с подлежащим селекции лекарственным средством клеточным партнером по слиянию. Пример 4. Скрининг гибридом. Две группы антител генерировали путем иммунизации 6-/- мышей. Один набор антител генерировали путем иммунизации растворимым человеческим укороченным v6 (слияние 6). Другой набор антител генерировали путем иммунизации мышиными трансфицированными 6 клетками NIH 3 Т 3 (слияние 7). Скрининг антител против v6 проводили с использованием как основанных на клетках, так и бесклеточных анализов связывания и функциональных анализов, как это описано ниже. Начальная селекция позитивных клонов основывалась на связывании очищенного hsv6 и трансфицированных 6 человеческих и мышиных клеток (нетрансфицированные клетки в качестве контроля). Выбранные клоны размножали и конечные культуры повторно оценивали на предмет связывания с трансфицированными 6 и с нетрансфицированными клетками в анализе захвата клеток (пример 5b, см. ниже) (репрезентативные примеры показаны на фиг. 1 А и 1 В, где приставки "6." или "7." названий mAb, которые обозначают слияние 6 и слияние 7, соответственно, пропущены; см. также табл. 2 ниже). Некоторые антитела связываются преимущественно с трансфицированными 6 клетками, в то время как другие связываются с трансфицированными и с нетрансфицированными клетками, и это указывает на то, что лишь подмножество антител имеет предпочтение в отношении 6 (фиг. 1 А и 1 В). Дальнейший отбор основывался на способности антител блокировать связывание биотинилированного hsv6 и трансфицированных 6 мышиных клеток с LAP. Выбранные клоны субклонировали с использованием FACS и хранили замороженными до использования. Моноклональные антитела подвергали скринингу на специфичность связывания с v6, основываясь на их способности связывать трансфицированные 6 клетки и отсутствии связывания ими нетрансфицированных исходных клеток. Далее подтверждали, что моноклональные антитела представляют собой средства специфического связывания v6 и не связываются с другими v-интегринами и неспецифическими интегринами (т.е. не относящимися к v интегринами, которые связываются с содержащимиRGD лигандами), основываясь на их неспособности связываться с клеточными линиями, экспрессирующими v3, v8, 51, v1 или 51. Они включали в себя стабильные трансфицированные клетки, а также нетрансфицированные клеточные линии JY, K562, SW480, NIH3T3 и FDCP1. Некоторые из антител, которые были депонированы в АТСС, перечислены ниже в табл. 1. Пример 5. Анализы по скринингу и характеристике. а. ELISA v6. 96-луночный планшет для микротитрования (Corning COSTAR EASY-WASH) покрывали 50 мкл/лунка 5 мкг/мл hsv6 при 4 С в течение ночи. Планшет промывали буфером для промывки (0,1% TWEEN-20 вPBS) 4 раза в автоматическом устройстве для промывки планшетов. Затем добавляли 180 мкл/лунка 3%BSA в TBS и инкубировали в течение 1 ч при 25 С для блокирования неспецифического связывания. Планшет промывали, как описано выше, и добавляли разведения гибридомной надосадочной жидкости(для анализов по скринингу) или очищенного антитела (для характеристики) в TBS, содержащем 1 мг/млBSA, 1 мМ CaCl2 и 1 мМ MgCl2 (50 мкл/лунка). Планшет инкубировали в течение 1 ч при 25 С, промывали и затем инкубировали в течение 1 ч с 50 мкл/лунка конъюгированного с пероксидазой антитела козы против мышиных IgG+A+M (Cappel). Связанное антитело детектировали с использованием 3,3',5,5'тетраметилбензидина (ТМВ). Связывание выявляли по поглощению, измеряемому при 450 нм.b. Анализ захвата клеток. 96-луночный планшет для микротитрования покрывали 50 мкл/лунка раствора вторичного антитела(антитело осла против IgG мыши (Jackson Immunoresearch); 5 мкг/мл, растворенного в 50 мМ бикарбонате натрия, рН 9,2) при 4 С в течение ночи. Планшеты промывали дважды 100 мкл/лунка буфера для анализа (RPMI+2% BSA) и затем блокировали 100 мкл/лунка буфера для анализа при 37 С в течение 1 ч. Для клеток FDC-P1 и трансфицированных 6 клеток FDC-P1 планшеты блокировали антителами против мышиных Ig (Jackson ImmunoResearch; 20 мкг/мл) в течение 10 мин при комнатной температуре для снижения неспецифического связывания вторичным антителом Fc-рецепторов (пропускается для других клеточных типов). В то время, как планшеты блокировали, клетки метили 2 мкМ флуоресцентной меткой(Calcein-AM, Molecular Probes) в буфере для анализа при концентрации 5106 клеток/мл. Клетки инкубировали с меткой в буфере для анализа при осторожном смешивании на водяной бане при 37 С в течение 15 мин, собирали центрифугированием и ресуспендировали в буфере для анализа до 5106 клеток/мл. После стадии блокирования буфер отбрасывали путем вытряхивания планшета и в планшет добавляли 25 мкл/лунка надосадочной жидкости или очищенного антитела. После 15 мин инкубации при 37 С добавляли 25 мкл/лунка меченых клеток и планшет инкубировали в течение 1 ч при 37 С. Планшет промывали 3-5 раз буфером для анализа (100 мкл/лунка) и фиксировали флуоресценцию, испускаемую захваченными клетками на планшете. Процент связывания определяли путем сравнения флуоресценции перед конечной стадией промывки (т.е. общего числа добавленных клеток) с таковой после промывки (т.е. связавшихся клеток).c. FACS. Клетки собирали путем трипсинизации, 1 раз отмывали PBS и затем ресуспендировали в буфере для FACS (1X PBS, 2% FBS, 0,1% NaN3, 1 мМ CaCl2 и 1 мМ MgCl2). Затем 0,2105 клеток инкубировали на льду в течение 1 ч в буфере FACS, содержащем гибридомную надосадочную жидкость в общем объеме 100 мкл. После инкубации клетки отмывали 2 раза ледяным буфером для FACS, ресуспендировали в 100 мкл буфера для FACS, содержащего 5 мкг/мл антитела осла против мышиных IgG PE (Jackson ImmunoResearch) и инкубировали на льду в течение 30 мин. Клетки затем дважды промывали ледяным буфером для FACS и ресуспендировали в 200 мкл буфера для FACS. За связыванием меченного РЕ вторичного антитела следили путем проточной цитометрии.d. Связывание биотин-hsv6 с LAP. 96-луночные планшеты для микротитрования (Corning COSTAR EASY-WASH) покрывали 0,3 мкг/мл- 10011853 рекомбинантного человеческого LAP (RD Systems, кат. номер 246-LP), разведенного в PBS (50 мкл/лунка) при 4 С в течение ночи. После того, как раствор для покрытия был удален, планшеты блокировали 180 мкл/лунка 3% BSA/TBS при 25 С в течение 1 ч. В отдельном 96-луночном круглодонном планшете 60 мкл/лунка 2 маточного раствора (0,5 мкг/мл (1,25 нМ) биотинин-v6, 2 мМ CaCl2 и 2 мМ MgCl2 вTBS, содержащем 1 мг/мл BSA) совмещали с 60 мкл/лунка 2 маточного раствора гибридомной надосадочной жидкости (для скрининга) или очищенного антитела (также в TBS, содержащем 1 мг/мл BSA) и инкубировали при 25 С в течение 1 ч. После 4-кратной промывки покрытого LAP планшета буфером для промывки (0,1% TWEEN-20 в PBS) в автоматическом устройстве для промывки планшетов 100 мкл смеси антитело-v6 переносили в планшет и инкубировали в течение 1 ч при 25 С. Планшет промывали,как указано выше, и инкубировали с 50 мкл/лунка разведения 1:1000 конъюгата экстравидин-пероксидаза хрена (Sigma) в TBS (1 мг/мл BSA) в течение 1 ч при 25 С. Связанный белок детектировали с использованием субстрата ТМВ.e. Адгезия клеток 6-FDC-P1 к LAP. 96-луночный планшет для микротитрования покрывали 50 мкл/лунка 0,5 мкг/мл рекомбинантного человеческого LAP (RD Systems), разведенного в 50 мМ бикарбоната натрия, рН 9,2, при 4 С в течение ночи. Планшет дважды промывали PBS (100 мкл/лунка) и блокировали 1% BSA в PBS (100 мкл/лунка) в течение 1 ч при 25 С. Планшет промывали дважды 100 мкл/лунка буфера для анализа (полный TBS плюс 1 мМ CaCl2 и 1 мМ MgCl2). Далее к отдельным лункам планшета добавляли 25 мкл гибридомной надосадочной жидкости (или очищенного антитела) и 25 мкл клеток 6-FDC-P1 (5106 клеток/мл, помеченныхCalcein AM, как описано выше). Планшет инкубировали при 25 С в течение 1 ч и затем промывали 4-6 раз буфером для анализа (100 мкл/лунка). Фиксировали флуоресценцию, испускаемую клетками, захваченными на планшет. Процент связывания определяли путем сравнения сигнала флуоресценции перед конечной стадией промывки (т.е. общего числа добавленных клеток) с таковым после промывки (т.е. связавшихся клеток).f. Биоанализ TGF-. Используемый в данном описании биоанализ TGF- представлял собой вариант анализа в совместной культуре с эпителиальными клетками легких норки (MLEC) с PAI-1-люциферазой, описанный Abe etal., в Anal. Biochem. 216: 276-284 (1994), где трансфицированные 6 клетки совместно культивировали с репортерными клетками для мониторинга активации TGF- за счет v6 (Munger, выше). Это количественный биоанализ TGF-, основанный на его способности индуцировать экспрессию ингибитора активатора плазминогена-1 (PAI-1). В данном анализе клетки MLEC стабильно трансфицированы экпрессирующей конструкцией, содержащей укороченный промотор PAI-1, слитый с геном-репортером люциферазы светлячка. Воздействие трансфицированных клеток MLEC на активный TGF- (от 0,2 до 30 пМ) приводит к зависимому от дозы повышению люциферазной активности в клеточных лизатах. Для проведения данного анализа клетки TMLC (линия эпителиальных клеток легких норки Mv 1 Lu) трансфицировали конструкцией PAI-1-люцифераза. Трансфицированные клетки выращивали вDMEM+10% FBS с L-Gln, пен./стреп. и 200 мкг/мл G418. Клетки SW480, трансфицированные конструкцией интегрина 6 (клетки "6-SW480" или "SW480 6"), выращивали в DMEM+10% FBS с L-Gln и пен./стреп. Клетки поднимали с флаконов посредством PBS+5 мМ EDTA, промывали в PBS+0,5% BSA,подсчитывали в гемоцитометре и помещали в 96-луночные планшеты. Клетки SW480-6 помещали в количестве 4104 клеток/лунка в буфере для промывки. Моноклональные антитела разбавляли DMEM(бессывороточной), добавляли к клеткам SW480-6 и предварительно инкубировали в течение 20 мин при комнатной температуре. Затем добавляли клетки TMLC в количестве 2104 клеток/лунка до конечного объема 100 мкл. Планшеты инкубировали в течение 20 ч в увлажненной, обогащенной СО 2 атмосфере инкубатора. Надосадочную жидкость с планшетов отбрасывали и заменяли 100 мкл PBS+1 мМ Са 2+ и 1 мМ Mg2+. Клетки в планшетах затем лизировали и уровень люциферазной активности детектировали посредством набора Packard LUCLITE для реакций светового типа (6016911) и люминометра для микропланшетов TROPIX. Пример 6. Очистка антител. 8 гибридомных клонов из слияния 6 (обозначенных приставкой "6") и 14 гибридомных клонов из слияния 7 (обозначенных приставкой "7") выбирали для дальнейшего размножения и характеристики(табл. 2). Получали культуру малого масштаба (150 мл) каждой гибридомы и надосадочную жидкость собирали путем центрифугирования. Антитела очищали из данных образцов надосадочной жидкости с использованием аффинной хроматографии белком А. Для антител изотипа IgG2a надосадочную жидкость загружали непосредственно на Protein A Sepharose 4 Fast Flow (Amersham Pharmacia Biotech, AB, Упсала,Швеция) (1 мл осажденного объема). Колонку промывали PBS и фракцию IgG элюировали с использованием 25 мМ фосфорной кислоты, 100 мМ NaCl, рН 2,8, в 1:20 объема 0,5 М Na3PO4, pH 8,6. Для мышиных антител IgGl надосадочную жидкость доводили перед загрузкой до рН 8,9, используя 1,5 М глицин,3 М NaCl, и колонку промывали 25 мМ Na3PO4, 3 М NaCl, pH 8,6, перед элюированием. Данные препараты использовали для описанной в данном описании биохимической характеристики in vitro. Блокатор определяется как антитело, которое блокирует связывание v6 с LAP, что определено путем блокирования связывания лиганда hsv6 или экспрессирующих 6 клеток. Для применения в экспериментальных животных гибридомные клоны постепенно размножали до 2 л среды и выращивали в течение 4 недель в Lifecell Culture Bags-PL732 (Nexell, кат.R4R2113). Антитела из гибридом сначала очищали путем аффинной хроматографии белком А, как описано выше, с последующей стадией ионообменной хроматографии на сефарозе Q (Amersham Pharmacia). Элюат хроматографической стадии с белком А доводили до значения рН 8,6 с использованием 2 М основания Tris, разведенного в 10 раз водой, и загружали на колонку с сефарозой Q (20 мг белка/мл смолы), которую уравновешивали 10 мМ Na3PO4, 25 мМ NaCl, рН 8,6. Колонку промывали 5 объемами колонки буфера для уравновешивания и связанный белок элюировали с использованием 25 мМ Na3PO4, 150 мМ NaCl, рН 7,2. Элюированные белки стерильно фильтровали (0,45 мкм) и хранили при -70 С до использования. Пример 7. Характеристика очищенных антител. Очищенные антитела (табл. 2, см. выше) подвергали количественной характеристике в отношении их способности: (1) связывать hsv6, (2) связывать трансфицированные 6 клетки SW480 и FDC-P1, (3) ингибировать связывание биотин-v6 с LAP, (4) ингибировать связывание трансфицированных 6 клетокFDC-P1 с LAP и (5) блокировать опосредованную v6 активацию TGF- в анализе MLEC (выше). Относительную действенность по каждому из данных анализов сравнивали с таковой известного антитела против v6 10D5 (Huang et al, J. Cell Sci. 111: 2189 (1998 и, в некоторых случаях, с антителом противv L230. Для характеристики антител слияния 7 в качестве положительного контроля также использовали антитело 6.8G6 слияния 6. Эксперимент по первоначальному связыванию (пример 5 а, выше), проведенный в присутствии 1 мМ Са 2+ и 1 мМ Mg2+, показал, что большинство очищенных антител связывали hsv6 (фиг. 2 А и 2 В). Однако неожиданно не наблюдалось связывание 10D5 и клонов 7.2F5 и 7.10D7. В последующем эксперименте установлено, что связывание 10D5 (фиг. 3 Е), 7.2F5 и 7.10D7 лишь слабо поддерживалось Ca2+/Mg2+, но более сильно 1 мМ MnCl2. Среди новых клонов три (6.1 А 8 (фиг. 3 А), 7.7G5 и 6.8G6 (фиг. 3 С характеризовались требованием в отношении двухвалентных катионов, хотя не наблюдалось различия между со- 12011853 стоянием Ca2+/Mg2+ и состоянием связывания Mn2+. Оставшиеся клоны не характеризовались требованием к двухвалентным катионам, т.е. могли связывать антиген в присутствии 10 мМ EDTA (фиг. 3 В, 3D и 3F) . FACS-анализ связывания антител с трансфицированным 6 клетками NIH 3 Т 3 или клетками SW480 выявил сходный профиль, за исключением того, что 10D5 в данном контексте связывался эквивалентно в состояниях Ca2+/Mg2+ и Mn2+. Требования для связывания с растворимым v6 могут отличаться от таковых для экспрессированного на клеточной поверхности v6 вследствие отличия в конформации белка или эффектов авидности. Данные результаты указывают на то, что в данной группе имеется по меньшей мере 3 различных класса блокирующих 6 антител. Один из данных классов (10D5) отличает условия Ca2+/Mg2+ и Mn2+. Другой класс (включающий в себя 6.1 А 8, 7.7G5 и 6.8G6) требует наличия катионов, но не различаетCa2+/Mg2+ и Mn2+. Последний класс (включающий в себя антитело против v L230, 6.2 В 10, 6.3G9 (фиг. 3 В) и 6.2 В 1 (фиг. 3D), 7.1 С 5 и 7.1G10) является катионнезависимым. Затем очищенные антитела оценивали на их способность ингибировать взаимодействие v6-LAP. В бесклеточном анализе по примеру 5d, см. выше, антитела 6.1 А 8, 6.2 В 1, 6.3G9 и 6.8G6 характеризовались значениями IC50,меньшими, чем таковое для 10D5 (фиг. 4 А; табл. 3). 6.2 В 10 характеризовалось более высоким IC50, но при этом давало полное ингибирование (фиг. 4 А). 6.4 В 4 характеризовалось только частичным ингибированием, в то время как 6.6 В 5 и 6.8 В 4 не характеризовались ингибированием (фиг. 4 А). С использованием той же системы для анализа антитела 7.1 С 5, 7.1G10, 7.2 А 1, 7.4 А 3, 7.7G5, 7.9G8, 7.9 Н 5 и 7.10 Н 2 характеризовались значениями IC50, меньшими, чем таковое для 10D5 (фиг. 4 В; табл. 3). Антитела 7.2F5, 7.2 Н 2 и 7.8 Н 12 характеризовались почти идентичными или более высокими значениями IC50 и еще давали полное ингибирование (фиг. 4 В). В клеточном анализе, описанном в примере 5 е выше, наблюдали сходную тенденцию, за исключением 6.1 А 8, 6.2 В 10 и 7.9D4, которые были менее действенными на клетках, чем очищенный белок (фиг. 5 А-Е; табл. 3). Все вместе, данные результаты указывают на то, что авторами изобретения успешно получены антитела, которые специфично ингибируют взаимодействие человеческого и мышиного v6 с LAP. Некоторые из данных антител связывались с v6 c высоким сродством (обнаруженные Kd0,3 нМ, что определено путем проточной цитометрии), ингибировали связывание трансфицированных 6 клеток с LAP сIC500,05 нМ (8 нг/мл) и предотвращали опосредованную v6 активацию TGF-1 с IC500,58 нМ (87 нг/мл). Наконец, очищенные антитела оценивали на их способность блокировать опосредованную v6 активацию TGF- в анализе гена репортера PAI-1/люцифераза (пример 5f, выше). Снова 6.3G9, 6.8G6,6.2 В 1, 7.1G10 и 7.7G5 были способны ингибировать опосредованную v6 активацию TGF- со значениями IC50, меньшими 10D5, в то время как оставшиеся антитела, как оказалось, были значительно менее действенными в данном анализе (фиг. 6 А и 6 В; табл. 3). Таким образом, способность блокировать взаимодействие v6 c LAP коррелирует со способностью ингибировать активацию TGF- in vitro. Таблица 3 Характеристика гибридомных клонов Данные получены из разных экспериментов. Не тестировали. Все эксперименты, суммированные в табл. 3, проводили в присутствии 1 мМ Са 2+ и 1 мМ Mg2+. Антитела, выделенные полужирным шрифтом, представляют собой антитела 10D5 и L230, известные ранее в данной области, и новые антитела с особо высокой ингибиторной силой в отношении v6. Затем значения сродства 6.3G9 и 6.8G6 в отношении растворимого v6 определяли путем использования анализа кинетического исключения (KinExA). Серию разведений растворимого интегрина (от 110-8 до 2,410-10 М) инкубировали с 110-10 М антитела в течение 3 ч. Данные образцы затем пропускали через гранулы полиметилметакрилата, покрытые интегрином, с использованием инструмента KinExA(Sapidyne Instruments, Inc., Boise, Айдахо). В случае 6,8G6 в буферы для инкубации и анализа включали 1 мМ CaCl2 и 1 мМ MgCl2. Количество связанного и свободного антитела определяли с использованием меченного Cy5 вторичного антитела против мышиных антител. Подгонку к кривой второго порядка проводили с использованием программного обеспечения KinExA с получением константы диссоциации (Kd) для каждого взаимодействия. Kd, определенные с использованием данного способа, составляли 15,6 пМ для 6.3G9 и 22,8 пМ для 6.8G6 (фиг. 9 А и 9 В). Таким образом, оба данных антитела характеризовались очень высокими значениями сродства в отношении v6. Далее авторы изобретения идентифицировали классы антител против v6, которые распознавали"активированные" состояния интегрина. Имеется два потенциальных активированных состояния v6. В первом состоянии активированный интегрин определяется как имеющий более высокое сродство в отношении своего лиганда. Антитела, специфичные в отношении данного активированного состояния, характеризовались повышенным связыванием с данным интегрином в присутствии активирующих катионов, таких как 1 мМ MnCl2. Сравнение степени связывания в 1 мМ MnCl2 и 1 мМ MgCl2 (неактивирующий катион) путем проточной цитометрии показало, что некоторые из описываемых в данном описании антител против v6, включая 6.1 А 8 и 6.6 В 5, характеризовались значительно повышенным связыванием в присутствии MnCl2. Во втором активированном состоянии v6 интегрин может активировать латентный TGF-, как описано выше. Получали клеточную линию, экспрессирующую укороченный v6 (SW480(6-770 Т. Данная клеточная линия была способна связывать LAP, но не могла активировать TGF- в анализеTMLC-люциферазы (Munger et al., выше). Антитела, которые связываются с трансфицированными полноразмерным 6 клетками SW480, но не с трансфицированными укороченным белком клетками 770 Т,таким образом, были специфичны к форме v6, которая способна активировать TGF-. Антитела 7.8 В 3 и 7.8 С 9 удовлетворяли данным критериям. Пример 8. Картирование эпитопов путем конкуренции антител. Очищенные моноклональные антитела также тестировали на их способность конкурировать с 6.8G6 за связывание с биотинилированным v6 в формате ELISA. В данном анализе 6.8G6 покрывали планшет для ELISA и смесь конкурирующего антитела и биотинилированного v6 добавляли в буфер, содержащий Ca2+ и Mg2+, по 1 мМ каждого. Связанный интегрин детектировали с использованием конъюгата экстравидин-HRP и конкурирующие антитела отмечали по их способности блокировать связывание. Все консенсусные блокаторы (табл. 2), кроме 6.2 В 10 (слабый блокатор), как было показано, конкурируют в различной степени с 6.8G6 (табл. 4). Эти данные подтверждают, что эти консенсусные блокаторы связываются с одним и тем же эпитопом, что и 6.8G6, или с перекрывающимся с ним эпитопом.- 14011853 Таблица 4 Картирование эпитопов путем конкуренции антител Очищенные моноклональные антитела тестировали на их способность конкурировать с биотинилированным 6.3G9 или биотинилированным 6.8G6 за связывание с v6 в ELISA. В данном анализе немеченым v6 покрывали планшет для ELISA и смесь конкурирующего антитела и биотинилированного антитела добавляли в буфер, содержащий Ca2+ и Mg2+, по 1 мМ каждого. Связанное биотинилированное антитело детектировали с использованием конъюгата нейтравидин-HRP. Эти данные показали, что наиболее действенные блокирующие антитела (например, 6.2 В 1, 7.1 С 5 и 7.1G10) конкурировали как с 6.3G9, так и с 6.8G6 за связывание с v6 (табл. 4.1 и фиг. 10 А и 10 В). Антитела 6.1 А 8 и 7.7G5 характеризовались меньшей конкуренцией, возможно, вследствие более низкой аффинности в отношении v6. Ни одно из неблокирующих антител, как и антитело против v L230, не показало в данном анализе какойлибо конкуренции с 6.3G9 или 6.8G6. Эти результаты указывают на то, что специфичные в отношенииv6 блокирующие антитела связываются на v6 c одним и тем же или перекрывающимися эпитопами. Таблица 4.1 Картирование эпитопов путем конкуренции антител- 15011853 Пример 9. Последовательности CDR. Выделяли кДНК некоторых из очищенных моноклональных антител и определяли их последовательность с использованием стандартных способов, описанных в Coligan et al. (eds), Current Protocols inImmunology, Wiley, Media, PA (2001). Предсказанные аминокислотные последовательности показаны на фиг. 7 А и 7 В. Аминокислотные последовательности CDR тяжелых цепей антител с высоким сродством связывания 6.8G6, 6.1 А 8, 6.2 В 1, 6.3G9 и 6.2 А 1 и неблокирующего антитела 6.2G2 сравнивают следующим образом (тире означают пропуски). В SEQ ID NO: 7 "R" полужирным шрифтом (двенадцатый остаток) указывает на то, что данный остаток является предметом полиморфизма и может представлять собой, например, Q. Аминокислотные последовательности CDR легких цепей данных четырех антител с высоким сродством связывания и неблокирующего антитела 6.2G2 сравнивают следующим образом.- 16011853 Как показано на фиг. 7 А и 7 В, mAb, которые входят в состав класса двухвалентных катионзависимых антител (например, 6.1 А 8 и 6.8G6), как кажется, содержат очень сходные аминокислотные последовательности внутри CDR, в то время как двухвалентные катионнезависимые mAb (например, 6.2 В 1 и 6.3G9) содержат другой набор мотивов в своих CDR. Действенность и специфичность моноклональных антител против v6 может тонко управляться различными аминокислотными остатками. В случае 6.1 А 8 и 6.8G6 аминокислотные последовательности вариабельных доменов очень сходны и содержат 10 различий аминокислот в тяжелой цепи, три из которых консервативны, и 11 различий аминокислот в легкой цепи. При этом данные антитела характеризуются тем, что имеют примерно 100-кратное различие в активности при анализах in vitro. Различия аминокислот распределены по вариабельным доменам полипептидной цепи, и данные остатки могут действовать поодиночке или синергически с остатками той же цепи или партнерской цепи, воздействуя на действенность антител. В тяжелой цепи 7 остатков расположены так, что они, вероятно, находятся в близком соседстве к v6 или играют активную роль в его связывании.RGD-Мотив был обнаружен в некотором количестве связывающих интегрины белков (лигандов). Данный мотив, как было показано, опосредовал их взаимодействие с интегринами путем непосредственного контакта со связывающим карманом на интегрине. Поскольку RGD сам по себе довольно обычен в связывающих интегрины белках, фланкирующие остатки по сторонам от данного мотива должны играть роль в придании взаимодействию интегрин-лиганд специфичности связывания. В 6.1 А 8 и 6.8G6 один такой фланкирующий остаток находится в положении 101 в тяжелой цепи внутри CDR3. Данный аминокислотный остаток фланкирует RGD-мотив и может располагаться в участке распознавания антигена,что вносит вклад в действенность и специфичность связывания. Другие различающиеся остатки в пределах одних и тех же CDR тяжелой цепи 6.1 А 8 и 6.8G6 включают в себя те, что находятся в положении 33 (CDR1); в положениях 52, 57 и 65 (CDR2) и в положении 115 (CDR3). Другое различие в тяжелой цепи находится в положении 4 в каркасном участке 1, который близок к N-концу. Данный остаток, как предсказано путем кристаллографических моделей, находится вследствие фолдинга вблизи CDR антитела и может играть важную роль в связывании v6. Три оставшихся различия между 6.1 А 8 и 6.8G6 представляют собой консервативные различия в положениях 20(каркасный участок 1), 44 (каркасный участок 2) и 82 (каркасный участок 3). Аминокислотные последовательности катионнезависимых антител также высоко гомологичны. Они могут подразделяться на два класса: те, что конкурируют с RGD-содержащим антителом 6.8G6 (т.е. 6.2 В 1, 6.3G9, 7.10 Н 2, 7.9 Н 5, 7.1 С 5, 7.1G10 и 7.4 А 3); и те, что не конкурируют с ним (т.е. 6.2 А 1, 6.2 В 10 и 6.4 В 4). Класс конкурирующих с 6.8G6 антител содержит мотив FXY в CDR3 тяжелой цепи, тогда как класс не конкурирующих антител не содержит его. Это различие указывает на то, что мотив FXY важен для опосредования катионнезависимого связывания v6. Кроме того, содержащий FXY класс антител,возможно, связывается с эпитопом на v6, который перекрывается с RGD-связывающим карманом, хотя и отличается от него. Антитела 6.2 В 10 и 6.4 В 4 не содержат мотив FXY и являются слабыми блокаторамиv6. Они, как было показано, связываются с частью v6, подобной I-домену, и определяют еще один эпитоп, с которым связываются антитела против v6. Интересно, что моноклональное антитело 6.2 А 1 принадлежит к катионнезависимому классу, но не содержит RGD-последовательности, как другие катионнезависимые mAb. Моноклональное антитело 7.7G5 относится к катионзависимому классу. Однако последовательность легкой цепи 7.7G5 высоко гомологична катионнезависимому, связывающему I-домен антителу 6.2 В 10. Тяжелая цепь 7.7G5 также сходна с катионнезависимыми антителами в CDR1. При этом егоCDR2 и CDR3 ближе к таковым катионзависимого класса. Данное наблюдение указывает на то, что конкретные CDR наделяют антитело специфичностью. Это особенно верно для CDR3 тяжелой цепи, по-видимому, вследствие высокой степени изменчивости в пределах данной части антитела. Фактически, 2 из 3 катионзависимых и 7 из 9 катионнезависимых антител содержат последовательности CDR3 тяжелой цепи, которые, вероятно, играют важную роль в распознавании v6. Примечательно, что 7.7G5 не содержит мотива RGD, но содержит мотив XGD в CDR2 его тяжелой цепи. Данный мотив XGD может функционировать сходным с RGD образом и обеспечивать сродство/специфичность связывания 7.7G5. Указанные выше наблюдения последовательностей и сделанные из них выводы обеспечивают основу для рационального конструирования конкретных аминокислотных последовательностей вариабельных областей, которые приносят конкретные свойства связывания. Пример 10. Диагностические антитела. Антитела, которые могут детектировать экспрессию v6 в залитых в парафин срезах тканей или других образцах тканей, могут использоваться в качестве диагностических средств. Данные диагностические средства могут использоваться, например, для детекции положительной регуляции v6 в срезах тканей при таких заболеваниях, как злокачественная опухоль или фиброз. Для идентификации антител, которые детектируют v6 в залитых в парафин тканях, авторы изобретения сначала подвергали панель антител скринингу на связывание очищенной путем ВЭЖХ субъединицы 6. Антитела, которые связывают данную субъединицу, вероятно, распознают линейные пептидные- 17011853 эпитопы, и поэтому ожидалось, что они имеют высокую вероятность успеха связывания в залитых в парафин тканях. Связывание с очищенной субъединицей 6 проводили с использованием формата ELISA,идентичного тому, который был описан для измерения связывания v6 (выше), за исключением применения очищенного интегрина 6, иммобилизованного на планшете, а не белка v6. С использованием данного способа идентифицировали некоторое число антител слияния 6, способных связывать как очищенный белок v6, так и очищенную субъединицу 6. См. ниже табл. 5, где приставка "6" в названии клона пропущена. Таблица 5 Связывание антител с очищенным v6 или очищенной субъединицей 6 Как показано выше, некоторые антитела связывались с очищенной субъединицей . Они с высокой вероятностью будут связывать денатурированный v6 и, таким образом, могут использоваться при детекции v6 в залитых в парафин срезах тканей. Оба типа антител использовали для окрашивания денатурированных, залитых в парафин трансфицированных в трансфицированных 6 клеток SW480 и нетрансфицированных исходных клеток, и данные показаны в табл. 6. Для окрашивания залитых в парафин тканей или клеток предметные стекла с тканью вначале депарафинизировали путем инкубации в следующих растворах: (1) ксилол, 5 мин, дважды; (2) 100% этанол, 2 мин,дважды; (3) 95% этанол, 2 мин, дважды; (4) 50% этанол, 2 мин, единожды; и (5) дистиллированная вода,2 мин, 1 раз. Затем предметные стекла инкубировали в растворе, состоящем из 200 мл метанола и 3 мл 30%-ной Н 2 О 2, в течение 15 мин для блокирования эндогенной пероксидазы. Предметные стекла ополаскивали дважды в PBS в течение 2 мин каждый раз. Срезы парафина на предметных стеклах затем демаскировали посредством пепсина (Zymed 00-3009) в течение 5 мин при 37 С. Предметные стекла опять дважды ополаскивали в PBS в течение 2 мин каждый раз. Затем ткань на предметных стеклах блокировали авидином и затем биотином (Vector SP-2001; Vector Laboratories, Burlingame, Калифорния), по 10 мин каждым при комнатной температуре с описанной выше промывкой между всеми инкубациями. После испарения блокирующего раствора с предметных стекол первичное антитело (культуральная надосадочная жидкость гибридомы), разведенное в PBS/0,1% BSA, наносили на предметные стекла и инкубировали в течение ночи при 4 С. На следующий день предметные стекла ополаскивали в PBS, как описано выше. В это время получали раствор комплекса авидин-биотин-пероксидаза хрена (реагент ABC) следующим образом: 1 мл PBS смешивали с 20 мкл раствора А (1:50) и 20 мкл раствора В (1:50) из набора Vector PK-6102 и смесь инкубировали перед использованием в течение 30 мин при комнатной температуре. В течение этого времени предметные стекла инкубировали в течение 30 мин при комнатной температуре с биотинилированным антителом против мышиных антител (1:200) из набора Vector с 15 мкл/мл нормальной сыворотки. Предметные стекла ополаскивали 2 раза в PBS, 2 мин каждый раз. Затем описанный выше реагент ABC наносили на предметные стекла и инкубировали в течение 30 мин при комнатной температуре. Предметные стекла ополаскивали опять, как описано выше. Затем субстрат (Vector SK-4100), 100 мкл DAB (3,3'-диаминобензидин), наносили на предметные стекла и инкубировали в течение 5 мин при комнатной температуре. DAB получали следующим образом: к 5 мл H2O добавляли 2 капли маточного раствора буфера(Buffer Stock Solution), хорошо смешивали; затем добавляли 4 капли маточного раствора DAB, хорошо перемешивали и затем добавляли 2 капли раствора Н 2 О 2, хорошо смешивали. Затем предметные стекла ополаскивали водой в течение 2 мин. После чего сигнал DAB усиливали для всех предметных стекол с тканью следующим образом: промывали парафиновые срезы в 0,05 М бикарбоната натрия, рН 9,6, в течение 10 мин; удаляли избыток буфера; наносили усиливающий раствор для DAB на 15 с и затем быстро ополаскивали водой в течение 1 мин для остановки реакции. Затем предметные стекла окрашивали в гематоксилине Майера (обратное окрашивание ядра) в течение 1 мин. Предметные стекла ополаскивали в текущей воде в течение 1 мин и затем погружали в PBS на 1 мин, так что гематоксилин становился голубым. Затем предметные стекла опять ополаскивали в текущей воде в течение 1 мин, обезвоживали и очищали следующим образом: погружали в (1) 95% этанол на 1 мин, дважды; (2) в 100% этанол на 1 мин,дважды; и (3) в ксилол на 2 мин, дважды. Затем на предметные стекла помещали покровные стекла с использованием Permount. Результаты указывали на то, что антитела слияния 61 А 1, 2 С 4, 3 В 2, 3 В 11, 5D6, 5G9, 5 НЗ, 6D12, 7 С 7,9 В 5, 9 В 7, 9D11, 9F5, 10 Е 4, 10 Н 11, 6 Н 8, 7 А 5, 7G9, 9 А 3, 2 А 1, 2 Е 5, 4 Е 4, 4 Н 4, 8 В 4, 2G2 и 4 Е 6, из которых все могли связываться с очищенной субъединицей 6 (табл. 5), действительно, сильно окрашивали погруженные в парафин трансфицированные 6 клетки SW480, в то время как не окрашивали нетрансфицированные исходные клетки (табл. 6).v6 обычно экспрессирован в здоровых тканях взрослых на незаметных или низких уровнях. Однако экспрессия v6 положительно регулируется при повреждении, фиброзе или злокачественной опухоли (см., например, Thomas et al. J. Invest. Dermatology 117: 67-73 (2001); Brunton et al., Neoplasia 3: 215226 (2001); Agrez et al., Int. J. Cancer 81: 90-97 (1999); Breuss, J. Cell Science 108: 2241-2251 (1995. Таким образом, антитела, которые специфически связываются с v6, экспрессированным в залитых в парафин тканях, могут использоваться в стандартных способах иммуногистохимии для детекции экспрессии v6 для диагностики фиброза, злокачественной опухоли и любых других заболеваний, в которых v6 положительно регулируется. Как описано выше, некоторые антитела согласно настоящему изобретению связываются с очищенным ВЭЖХ интегрином 6 и залитыми в парафин и фиксированными трансфицированными 6 клетками. Данные антитела, как было показано, также связываются с репрезентативными тканями плоскоклеточного рака и рака молочной железы при иммунном окрашивании. См., например, фиг. 8, где моноклональное антитело 6.2 А 1 использовали для того, чтобы показать относительное окрашивание залитых парафином тканей карциномы молочной железы и плоскоклеточной карциномы. Таким образом, данные новые антитела могут использоваться в качестве диагностических инструментов. Пример 12. Эффекты блокирующих mAb против v6 у мышей Альпорта. Мыши с нокаутом коллагена 4A3 (COL4A3) (Альпорт) были установлены в качестве модели in vivo фиброза почек, и их использовали для тестирования терапевтических эффектов фармакологических средств (выше). Авторы изобретения тестировали mAb 6.8G6 (катионзависимое) и 6.3G9 (катионнезависимое) у мышей Альпорта для определения того, будут ли они ингибировать фиброз, обычно наблюдаемый у мышей Альпорт в возрасте 7 недель. Как показано выше, эти два антитела, как обнаружено, ингибируют связывание v6 с LAP и ингибируют активацию TGF- в биоанализе. Антитело 1 Е 6 применяли в качестве отрицательного контроля. Мышам Альпорт в возрасте 3 недель вводили 3 раза в неделю внутрибрюшинные инъекции с одним из следующих антител: (1) 6.8G6, 4 мг/кг (7 мышей); (2) 6.3G9, 4 мг/кг (4 мыши) и (3) 1 Е 6, 1 мг/кг (6 мышей). Инъекции продолжали в течение 4 недель. Затем мышей забивали и извлекали их почки. Залитые в парафин срезы почек получали, как описано выше, и затем окрашивали с целью детекции гладкомышечного актина, маркера миобластов и отложения матрикса при фиброзе почек. Авторы изобретения обнаружили значимое снижение окрашивания гладкомышечного актина в интерстициальных и гломерулярных областях почек из мышей Альпорта, обработанных mAb 6.8G6 или 6.3G9, по сравнению с мышами, обработанными 1 Е 6. На фиг. 11 А и 11 В показана точечная диаграмма окрашивания гладкомышечного актина в гломерулярных и интерстициальных областях почки Альпорта. Имело место значимо сниженное окрашивание гладкомышечного актина в почках мышей Альпорта, обработанных 6.8G6 и 6.3G9, по сравнению с мышами отрицательного контроля, обработанными 1 Е 6. Пример 13. Эффективность mAb против v6 при профилактике нефросклероза, индуцированного односторонней закупоркой мочеточника. Авторы изобретения применяли другую модель прогрессии фиброза почек на мышах для тестирования противофиброзной эффективности 6.8G6 и 6.3G9. В данной модели на мышах мочеточник животного лигируют, что приводит к односторонней закупорке мочеточника (UUO). UUO вызывает прогрессирующий нефросклероз без быстрого развития почечной недостаточности у мышей, поскольку незакупоренная почка может относительно нормально поддерживать функцию почек. В то время как закупоренная почка претерпевает быстрый общий фиброз, незакупоренная почка претерпевает адаптивную гипертрофию. Данное исследование подвергает морфометрическому количественному анализу воздействие обработки антителами против v6 на индуцированный UUO фиброз почек. Использовали мышей-самцовC57BL в возрасте 8-12 недель, без вирусных антигенов, массой 25,50,2 г (Jackson Laboratories, Bar Harbor,Мэн). Перед началом исследования мышам давали возможность акклиматизироваться в течение 7 суток. Мыши имели свободный доступ к рассеянному стандартному мышиному корму и стерильной воде во время периода акклиматизации и эксперимента. Периодически измеряли массу тела как часть мониторинга здоровья животных. Результаты показывали, что соответствующие по возрасту неоперированные мыши прибавляли примерно 10% массы тела в течение периода двухнедельного исследования. МышиUUO теряли примерно 9% массы тела на сутки 2, но постепенно компенсировали потерю массы на сутки 14. Данный профиль изменения массы, как оказалось, не зависел от терапевтической обработки. Для индукции фиброза почек левый мочеточник асептически выделяли путем лапаротомии левее срединной линии под анестезией кетамином:ксилазином (100:10 мг/кг подкожно). Две плотные, закупоривающие лигатуры шелка 6-0 налагали на мочеточник на уровне нижнего края почки и мочеточник пересекали между лигатурами. Брюшную стенку закрывали швом Vicryl 4-0, а кожу закрывали нейлоном 4-0. Животным давали возможность восстановиться на электрогрелке и давали подкожно 0,05 мг/кг бупренорфина 2 раза в сутки на сутки 0 и 1. Процедура была адаптирована по Ma et al., Kidney Int. 53 (4): 937-944 (1998).- 22011853 Затем мышей подразделяли на следующие исследуемые группы. Число животных. Все животные, кроме группы 5, получали дозу 2 раза в неделю, начиная с суток до хирургического вмешательства. Затем животных подвергали эвтаназии диоксидом углерода на 10 сутки после лигирования и подвергали диссекции. У мышей UUO почечная лоханка и мочеточник были заметно вздуты и полны жидкостью над закупоривающей лигатурой. Степень вздутия и степень оставшейся массы почечной ткани варьировали в группах обработки. Группа 2 характеризовалась вздутием, примерно вполовину большим по сравнению с группами отрицательного контроля. Лигированные почки были бледного цвета. Противоположные почки были ярко-красными и увеличенными примерно на треть. Далее, обе почки (левая лигированная, правая нелигированная) животных удаляли и рассекали поперечно через центр почечной лоханки. Половину каждой почки помещали в 10% нейтрально забуференный формалин для окрашивания фиксированной ткани. Другую половину каждой почки помещали в 15% сахарозу, затем в 30% сахарозу для иммуногистохимического окрашивания. Фиксированные формалином срезы почки подвергали иммунному окрашиванию на выявление миофибробластов (гладкомышечного актина), маркеров фиброза. Снимки делали с использованием стандартизованных условий освещения и настроек экспозиции цифровой камеры, откорректированных для фона, и с калибровкой удаленными стандартами. Снимки протяженных полей, покрывающих срез целой почки, получали от каждого животного для количественного анализа. Гладкомышечный актин выражали как процент от общей площади ткани в пределах измеренных полей. Они включали в себя всю корковую и медуллярную ткань из среза, за исключением почечного сосочка. В итоге, мыши, обработанные 6.3G9 и 6.8G6, характеризовались существенным снижением фиброза. Пример 14. Эффективность блокирования mAb против v6 индуцированного блеомицином фиброза легких у мышей. Индуцированный блеомицином фиброз легких у мышей принимали в качестве модели фиброза легких in vivo и применяли для тестирования терапевтических эффектов фармакологических средств. Воспаление обычно видно через 5-15 суток после обработки блеомицином. У мышей линии 129 степень фиброза легких прогрессивно возрастает в течение периода не более 60 суток после обработки блеомицином. Накопление матрикса обычно становится выявляемым примерно на 15 сутки. В данном примереmAb 6.3G9 вводили внутрибрюшинной инъекцией в концентрации 4 мг/кг/доза мышам с индуцируемым блеомицином фиброзом легких, начиная с суток 0 или с суток 15, по 3 раза в неделю. Фиброз легких индуцировали на сутки 0 путем введения единственной внутритрахейной дозы блеомицина в концентрации 0,03 ед./кг в 50 мкл стерильного солевого раствора. Животных забивали на сутки 30 и оценивали степень фиброза легких. Антитело 1 Е 6 использовали в качестве отрицательного контроля. От каждого животного забирали легкие и измеряли содержание гидроксипролина в качестве индекса отложения коллагена в легких, как описано в Munger et al., выше. Как показано на фиг. 15 А, обработка 6.3G9, начавшаяся на сутки 0, значимо ингибировала индуцированное блеомицином повышение содержание гидроксипролина в легких. Важно то, что обработка 6.3G9 была, по меньшей мере, столь же эффективной, когда начиналась через 15 суток после введения блеомицина, в момент, когда уже началось отложение коллагена. Авторы изобретения оценивали эффекты 6.3G9, катионзависимого 6.8G6 и неблокирующего антитела 6.4 В 4 по ингибированию более существенных степеней фиброза легких в продленном протоколе индуцированного блеомицином фиброза (длится 60 суток). Для этого авторы изобретения начинали обработку антителами через 15 суток после введения блеомицина (сутки 15). Затем легкие отбирали на сутки 60 для определения содержания гидроксипролина. Как показано на фиг. 15 С, обработка 6.8G6 значимо ингибировала индуцируемый блеомицином фиброз (более 70% снижения в содержании гиброкси- 23011853 пролина по сравнению с животными, обработанными блеомицином и солевым раствором). Обработка 6.3G9 также показала тенденцию к защитному эффекту, но данные результаты не достигали статистической значимости (фиг. 15 С). В итоге, как катионзависимые, так и катионнезависимые антитела, блокирующие v6, снижали фиброз легких у мышей, обработанных блеомицином. Более того, данное вмешательство было эффективным, даже когда обработка антителами не начиналась после первоначального приступа фиброза. Пример 15. Положительная регуляция v6 в псориазных очагах повреждения у человека. Для определения того, вовлечен ли v6 в псориаз, оценивали экспрессию v6 в биопсиях кожи с очагами повреждения и без них от 5 пациентов с псориазом и 4 нормальных субъектов. С использованием иммунного окрашивания mAb 6.2A1 авторы изобретения обнаружили значимое повышение экспрессии v6 в псориазных очагах повреждения по сравнению с неповрежденной кожей пациентов с псориазом и нормальными контрольными субъектами. Таким образом, положительная регуляция v6 в псориазных очагах повреждения указывает на диагностическое и терапевтическое приложения использования антител против v6. Пример 16. Положительная регуляция v6 у мыши и человека с заболеванием желчного протока. Как описывалось ранее, экспрессия v6 имела отношение к повреждению ткани. В данном исследовании экспрессию v6 исследовали в печени мыши и человека, поврежденной заболеванием желчного протока. Повреждение печени у мышей индуцировали путем лигирования желчного протока. См., например,George et al., PNAS 96: 12719-24 (1999); George et al., Am J Pathol 156: 115-24 (2000). С использованиемmAb 6.2G2 авторы изобретения обнаружили, что экспрессия v6 значительно повышалась на сутки 9, 14 и 16 после лигирования желчного протока. Сходным образом, срезы печени человека от пациентов с заболеванием желчного протока характеризовались положительной регуляцией экспрессии v6, что определено путем иммуногистохимии с использованием mAb 6.2G2. Повышенную экспрессию v6 наблюдали, например, в образцах печени от мужчины в возрасте 44 лет с острым холестазом, мужчины в возрасте 59 лет после пересадки, с острой закупоркой желчного протока, мужчины в возрасте 22 лет с атрезией желчного протока и мужчины в возрасте 24 лет с хронической закупоркой желчного протока. В итоге, новые антитела против v6 являются полезными в качестве средства диагностики и терапии заболеваний печени. Пример 17. Положительная регуляция v6 при различных злокачественных опухолях человека. Интегрин v6 обычно экспрессирован в тканях здоровых взрослых людей на уровнях от незначительных до низких. Различные опухолевые ткани человека оценивали на предмет экспрессии v6 с использованием антитела 6.2 А 1 и способов, в основном, описанных в данном описании. Результаты показывали, что экспрессия интегрина v6 значимо повышенно регулировалась при некоторых эпителиальных раках человека. Примечательно, что имммуногистология выявила особо выраженную экспрессиюv6 на краях опухолевых островков при многих эпителиальных раках. Для дальнейшего исследования экспрессии v6 в эпителиальных раковых клетках клетки Детройт 562 (карцинома глотки) и клеткиSCC-14 (плоскоклеточная карцинома языка), а также клетки SW480 6 (см. выше) окрашивали 6.3G9 и 6.4 В 4 и анализировали путем проточной цитометрии. На правой стороне фиг. 12 показана экспрессия v6 в разных опухолевых клеточных линиях, на что указывает связывание 6.3G9 при сортировке активированных флуоресценцией клеток (FACS). Закрашенный пик представляет собой связывание 6.3G9, в то время как незакрашенный пик представляет собой фоновое связывание одного вторичного mAb. График линии на левой стороне фиг. 12 показывает ингибирование связывания опухолевых клеточных линий с лигандом LAP за счет повышающихся концентраций 6.3G9 или 6.4 В 4. 6.4 В 4 был существенно менее мощным ингибитором связывания v6 с LAP по сравнению с 6.3G9 (10-кратного IC50 для Детройт 562, 30-кратного IC50 для SW480 6 и 100-кратного IC50 для SCC-14). Это согласуется с предыдущими результатами, полученными in vitro, которые указывают на то, что 6.3G9 представляет собой мощное блокирующее mAb, а 6.4 В 4 представляет собой слабое блокирующее mAb. Эти данные также согласуются с малозначительной ингибирующей активностью 6.4 В 4 в детройтской модели ксенотрансплантата (фиг. 14 В). На фиг. 13 далее показано относительное ингибирование связывания опухолевых клеточных линий с LAP различными mAb против v6. Как 6.3G9, так и 6.8G6 характеризовались эквивалентной ингибирующей активностью (в соответствии со всеми предыдущими данными), в то время как 6.4 В 4 было существенно менее мощным ингибитором связывания v6 с LAP. Пример 18. Эффекты блокирующих mAb против v6 на модели ксенотрансплантата опухоли человека. Животные с иммунодефицитом (например, голые мыши и SCID-мыши), которым пересаживали ксенотрансплантат опухоли человека, были приняты в качестве подходящей модельной системы in vivo для тестирования терапевтических эффектов противораковых средств (см., например, van Weerden et al.,Prostate 43 (4): 263-71 (2000); Bankert et al., Front. Biosci. 7: c. 44-62 (2002. Таким образом, блокирующие- 24011853 моноклональные антитела против v6 по настоящему изобретению могут тестироваться in vivo на модели ксенотранспланатата на их способность ингибировать опухолевый рост. В данном эксперименте авторы изобретения тестировали способность некоторых из новых антител против v6 ингибировать опухолевый рост у бестимусных голых самок мышей, которым пересаживали ксенотранспланат рака глотки человека (клеточная линия Детройт 562). Для этого клетки Детройт 562 (АТСС) пассировали in vitro в минимально необходимой среде (Eagle) с 2 мМ L-глутамином и BSS Эрла, доведенной до содержания 1,5 г/л бикарбоната натрия, 0,1 мМ заменимых аминокислот и 1,0 мМ пирувата натрия, и 10% фетальной сыворотки крупного рогатого скота, без антибиотиков. Примерно 5106 клеток/0,2 мл среды (без сыворотки) имплантировали подкожно голым мышам в правый бок. Через 3-4 суток начались измерения размера опухоли и продолжились до достижения опухолями размеров примерно 5 мм (в длину) на 5 мм (в ширину). Мышей разделяли случайным образом и подвергали внутрибрюшинной инъекции тестируемыми антителами или контрольными растворами на сутки 1, с последующими 3 инъекциями еженедельно в течение периода 33 суток. Тестируемые антитела и контрольные растворы представляли собой: (1) 6.3G9, 1 мг/кг, 10 мышей; (2) 6.3G9, 4 мг/кг, 10 мышей;(3) 6.3G9, 10 мг/кг, 10 мышей; (4) 6.4 В 4, 1 мг/кг, 10 мышей; (5) 6.4 В 4, 4 мг/кг, 10 мышей; (6) 6.4 В 4, 10 мг/кг,10 мышей; и (7) раствор носителя (PBS), 0,2 мл/на мышь, 30 мышей. Кроме того, 10 мышам подкожно вводили цис-платину в дозе 2 мг/кг в качестве химиотерапевтического контроля. Инъекции цис-платиной проводили на сутки 1 и затем каждые 2 суток, в общем, за 6 введений. В конце периода 33 суток измеряли массы животных и размеры опухолей, оценивали экспрессию v6 путем иммуногистологии и измеряли уровни антител против v6 в сыворотке. Иммуногистологическое окрашивание показало, что имплантированные опухолевые клетки сильно экспрессировали v6 in vivo. Данные по массе опухоли далее показали, что блокирующее mAb 6.3G9 эффективно ингибировало опухолевый рост во всех трех тестируемых концентрациях (фиг. 14 А). Слабо блокирующее mAb 6.4B4, наоборот, не ингибировало опухолевый рост (фиг. 14 В). В сумме блокирующие антитела ингибировали опухолевый рост у обработанных мышей на 40-50%. Слабо блокирующее антитело против v6, наоборот, не ингибировало опухолевый рост. Пример 19. Интернализация антител против v6. Антитела, которые интернализуются клетками, имеют преимущество для некоторых клинических приложений, таких как злокачественные опухоли, поскольку данные антитела могут затем конъюгироваться с токсинами, радиоактивными соединениями или другими противораковыми средствами для селективного нацеливания и ингибирования роста раковых клеток. Способность антител против v6 интернализоваться исследовали в клетках SW480 6 (см. выше) и SCC-14. Клетки разделяли 1:5 и высевали на 4-камерные стеклянные предметные стекла для инкубации в течение ночи при 37 С, 5% СО 2. На следующие сутки mAb 6.8G6, 6.1 А 8, 6.3G9, 7.1 С 5, 6.4 В 4, 10D5 и 8 В 3 разбавляли до конечной концентрации 20 мкг/мл. mAb или только среду добавляли в подходящие лунки. Временной курс интернализации длился от 0 до 48 ч. Включенные в исследование временные отрезки составляли 0, 5, 10 и 30 мин и 1, 4, 24 и 48 ч. Вторичное антитело (антитело против мышиных антителAlexa 594) добавляли в качестве отрицательного контроля. Интернализацию останавливали после каждого временного отрезка путем удаления антитела и промывки слоя клеток буфером. Агглютинин зародыша пшеницы Аlеха-488 добавляли в течение 20 мин при 18 С для окрашивания внешней границы клеток зеленой флуоресценцией. После промывки клеток добавляли раствор Cytofix/Cytoperm на 20 мин при 18 С для фиксации и обеспечения проницаемости клеток. Клетки опять промывали и добавляли вторичное антитело против мышиных антител Alexa 594(красная флуоресценция) на 20 мин при 18 С для мечения связанного или интернализованного мышиного антитела против v6. Клетки затем промывали и фиксировали путем добавления 2% параформальдегида и оценивали путем конфокальной микроскопии. Затем снимали изображения путем объектива LeitzPlan-Apochromatic 63 (1,32 числовая апертура, масляная иммерсия) (Leica) с цифровым увеличением 2. Каждая рамка представляла собой один оптический срез от среднего среза клеток, которые наблюдали на предмет интернализации при всех условиях. В ядре окрашивания не наблюдалось. Интернализацию наблюдали для катионзависимых mAb (содержащих RGD миметиков лиганда),таких как 6.8G6 и 6.1 А 8. Для катионнезависимых mAb, таких как 6.3G9, 7.1 С 5 и 6.4 В 4, интернализации не наблюдалось.
МПК / Метки
МПК: A61P 35/00, C12N 5/12, A61K 39/395, C07K 16/28
Метки: vβ6, alpha, антитела, против
Код ссылки
<a href="https://eas.patents.su/30-11853-antitela-protiv-alpha-vbeta6.html" rel="bookmark" title="База патентов Евразийского Союза">Антитела против α vβ6</a>
Предыдущий патент: Способ и станок для изготовления дубликатов ключа
Следующий патент: Применение хлорида натрия, препарат на его основе, устройство для удерживания препарата и способ изготовления лекарства
Случайный патент: Дифференциальный датчик давления