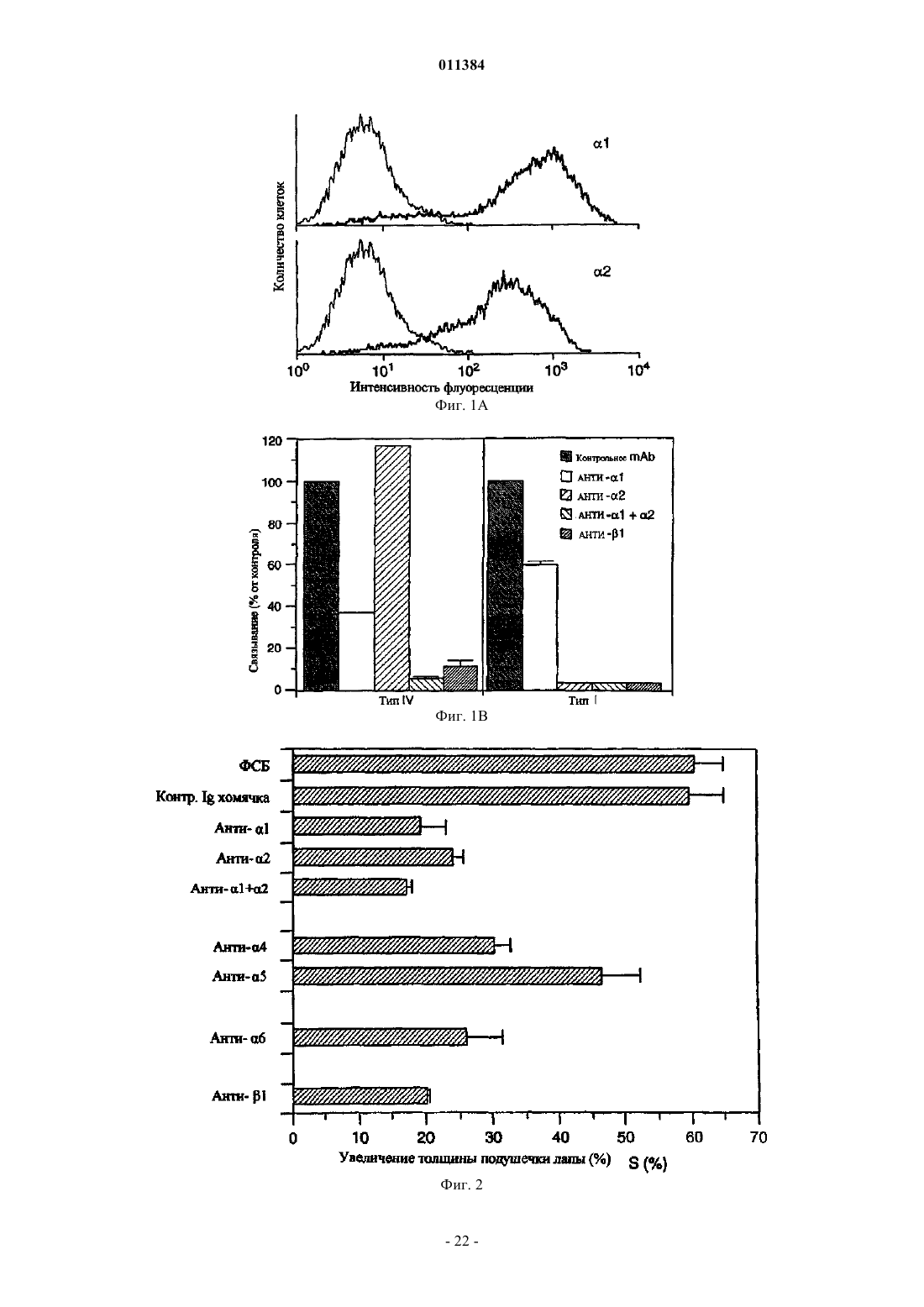
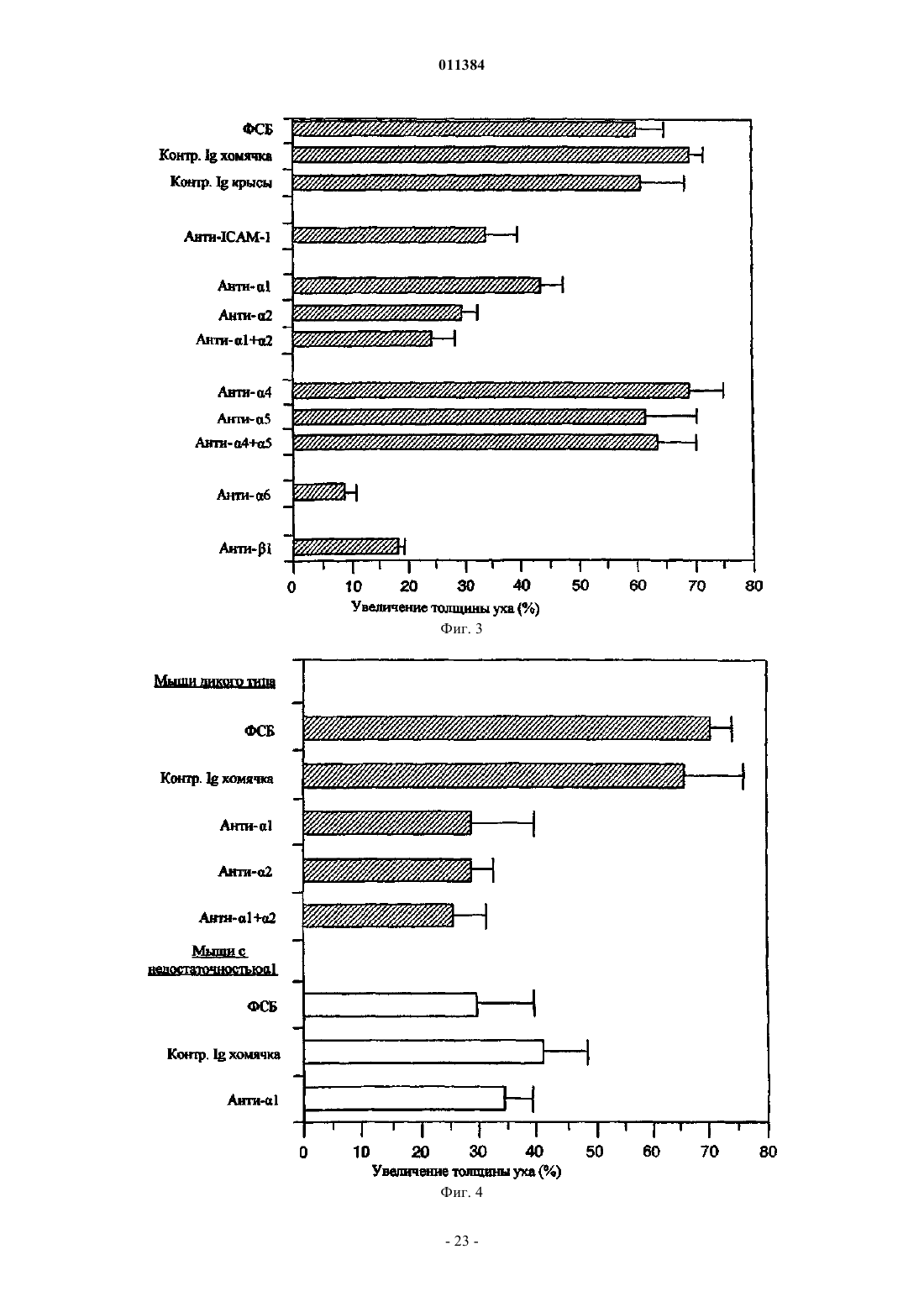
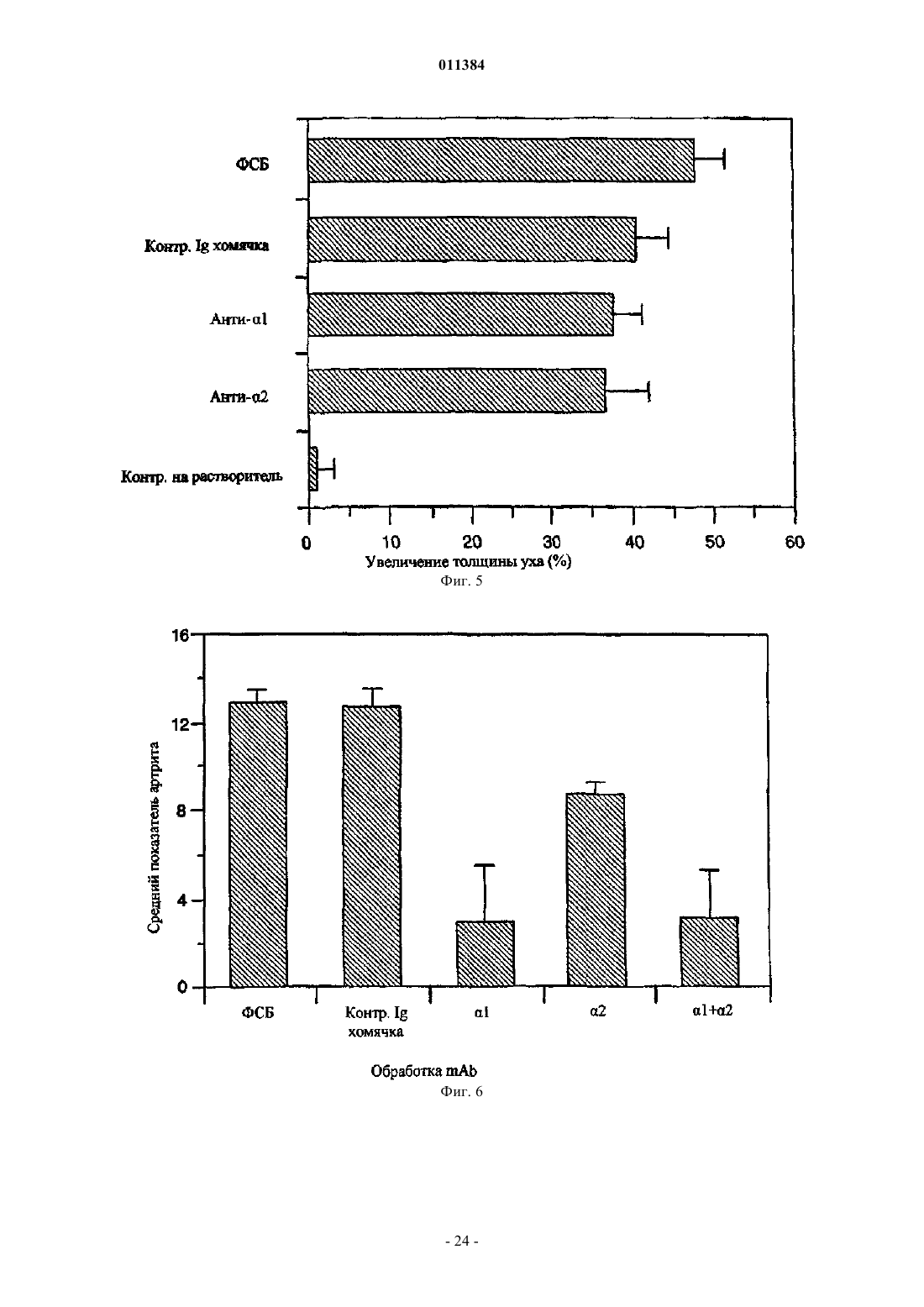
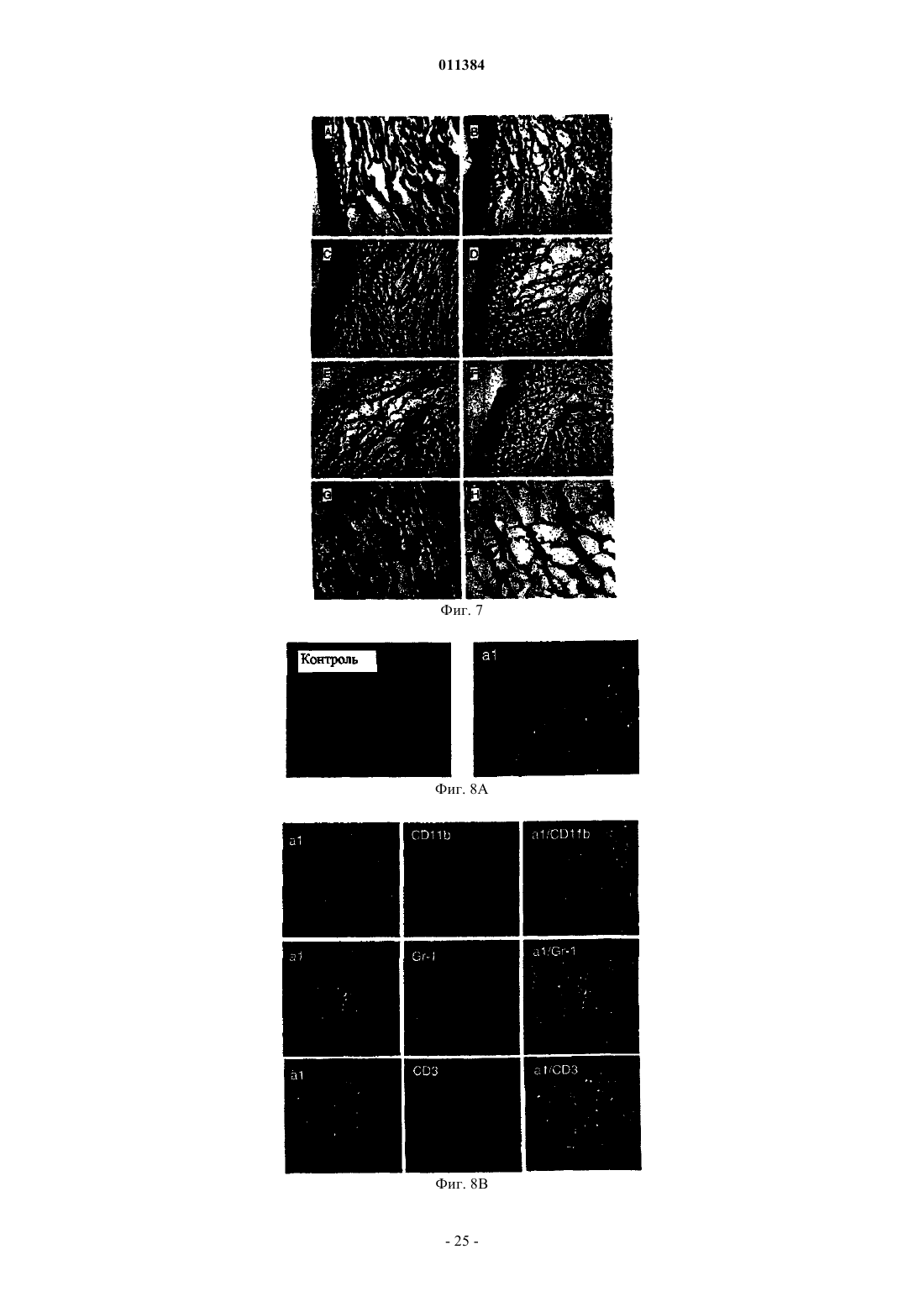
Способ лечения воспалительного заболевания
Номер патента: 11384
Опубликовано: 27.02.2009
Авторы: Готвэлс Филип, Котелянский Виктор, Лобб Рой, Де Фужеролль Антонин
Формула / Реферат
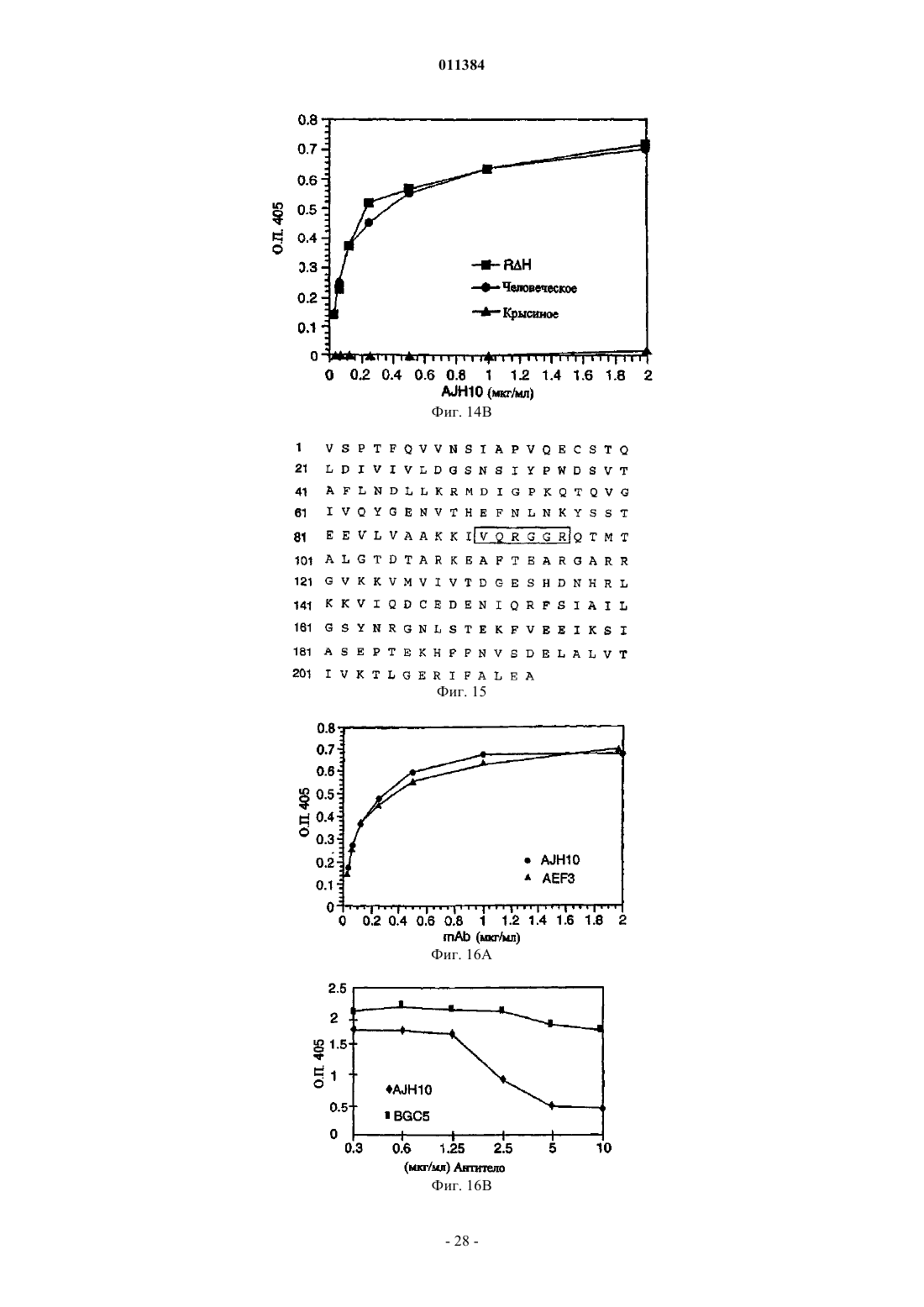
1. Способ лечения воспалительного заболевания, включающий введение индивидууму, страдающему воспалительным заболеванием, антитела или его фрагмента, взаимодействующего с эпитопом, против "очень позднего антигена" (VLA-1), где указанный эпитоп содержит аминокислотные остатки 91-96, показанные на фиг. 15 (SEQ ID NO: 8).
2. Способ по п.1, в котором воспалительным заболеванием является атеросклероз.
3. Способ по п.1 или 2, в котором антитело является моноклональным.
4. Способ по любому из пп.1-3, в котором субъектом является человек.
Текст
011384 Известный уровень техники Интегрины являются комплексами белков клеточной поверхности, которые образуют большой класс молекул клеточной поверхности, опосредующих адгезию клеток друг к другу и к их окружению. Клетки нуждаются в адгезии друг к другу и к другим молекулам в их окружении при многих физиологических процессах и при процессах развития. Примеры включают создание тканей и органов и поддержание их целостности. Воспалительные заболевания находятся среди данных физиологических процессов. Одна из ключевых стадий воспалительного процесса включает выход клеток из кровеносных сосудов в ткани по направлению к месту инфекции. Роль адгезивных молекул в данном процессе часто разбивается на три этапа, включающих первоначальное "перекатывание" лейкоцитов по воспаленному эндотелию, за которым следует стойкое прикрепление, приводящее к трансэндотелиальной миграции лейкоцитов в воспаленные ткани (Hynes, R.O. 1992, Cell 69: 11-25; Springer, T.A. 1992, Cell 76: 301-314). Дополнительная критическая стадия воспалительного каскада, та, что не изучалась интенсивно, возникает в периферических тканях, в которых инфильтрирующие клетки, а также клетки-резиденты, которым необходимо мигрировать к месту воспаления, узнают чужеродный антиген и подвергаются клеточной активации для выполнения своих эффекторных функций. Для прямой оценки важности интерстициальных адгезивных взаимодействий в воспалении независимо от роли, которую играют адгезивные взаимодействия в рекрутировании лейкоцитов, заявители сконцентрировались на важности адгезивных молекул семейства интегринов и их фрагментов и их роли в животных моделях воспаления, особенно артрита. Краткое изложение существа изобретения В настоящем изобретении предлагается способ лечения воспалительных заболеваний у субъекта. Конкретно, в изобретении предлагается способ лечения артрита. Более конкретно, в изобретении предлагается способ лечения артрита у субъекта, включающий введение субъекту фармацевтической композиции, включающей эффективное количество антитела, блокирующего функцию 11, или фрагмента указанного антитела, где антитело, блокирующее функцию 11, или его фрагмент способны связываться с эпитопом домена 1-I антигена "очень поздней активации" (VLA-1) семейства интегринов, включающим аминокислотные остатки 91-96 фиг. 15, Val-Gln-ArgGly-Gly-Arg. Антитело к интегрину может быть выбрано из группы, состоящей из антитела человека, химерного антитела, антитела, приближенного к человеческому, и их фрагментов. Антитело к интегрину может быть моноклональным или поликлональным антителом. В изобретении дополнительно предлагается способ лечения воспалительных заболеваний у субъекта, который является человеком или животным. Вся литература, цитированная в предыдущем разделе, а также литература, цитирование которой включено в последующее раскрытие изобретения, включена в данное описание в качестве ссылки. Описание фигур Фиг. 1. Связывающие коллаген интегрины 11 и 21 на активированных лейкоцитах. А. Анализ с помощью проточной цитометрии экспрессии интегринов 1 и 21 на спленоцитах, активированных ИЛ-2 (d 11). Клетки метили либо анти-1 mAb, анти-2 mAb, либо несвязывающим контрольным mAb(серые линии) с последующей обработкой меченными ФИТЦ антителами к иммуноглобулинам хомячка. В. Эффект анти-1 и анти-2 mAb на адгезию лейкоцитов к коллагену. 105 спленоцитов, активированных ИЛ-2, обрабатывали указанными mAb в течение 15 мин перед посевом в планшеты, покрытые коллагеном либо типа IV, либо типа I, в течение 1 ч при 37 С. Адгезию рассчитывали, как продемонстрировано в примере 1, и выражали как % адгезии по отношению к клеткам, обработанным контрольнымиmAb. Определение адгезии осуществляли в трех параллелях и выполняли по меньшей мере в 3 независимых экспериментах. Представлен один показательный пример. Фиг. 2. Эффект mAb к интегрину на эффекторную фазу гиперчувствительности замедленного типа. Мышам, сенсибилизированным эритроцитами барана, вводили в.б. указанные mAb за 1 ч до повторного введения эритроцитов барана. Толщину подушечек лап измеряли через 20 ч после повторного введения антигена и результаты представляли как % увеличения толщины подушечек лап SEM (ст.ош.), как проиллюстрировано в примере 2. Эти данные представляют сумму 8 экспериментов с n=79 (ФСБ), 68 (контрольные Ig хомяка), 68 (анти-1), 29 (анти-а 2), 18 (анти-1+анти-2), 45 (анти-4), 18 (анти-5), 20 (анти-6) и 10 (анти-1). Использованные mAb представляли собой На 4/8 (контрольные Ig хомяка группы 2), На 31/8 (анти-1), На 1/29 (анти-2), PS/2 (анти-4), 5 Н 10-27 (анти-5), GoH3 (анти-6) и НМ 1-1 (анти-1). Фиг. 3. Эффект mAb к интегрину на эффекторную фазу контактной гиперчувствительности. Мышам, сенсибилизированным ФИТЦ, вводили в.б. указанные mAb за 4 ч до повторного нанесения ФИТЦ. Толщину ушей измеряли исходно и через 24 ч и результаты представляли как % увеличения толщины ушей SEM, как проиллюстрировано в примере 3. Эти данные представляют сумму 9 экспериментов сn=74 (ФСБ), 60 (контрольные Ig хомяка), 26 (анти-ICAM-1), 44 (анти-1), 44 (анти-2), 38 (анти 1+анти-2), 36 (анти-4), 16 (анти-5), 26 (анти-4+анти-5), 24 (анти-6) и 22 (анти-1). Использованные mAb хомяка представляли собой На 4/8 (контрольные Ig хомяка группы 2), На 31/8 (анти-1),-1 011384 На 1/29 (анти-2), НМ 1-1 (анти-1), 3 Е 2 (анти-ICAM-1); использованные mAb крысы представляли собой R35-95 и R35-38 (контрольные IgG2a крысы и IgG2b крысы, соответственно), PS/2 (анти-4), 5 Н 1027 (анти-5), GoH3 (анти-6). Фиг. 4. Ответы контактной гиперчувствительности у 1-дефицитных мышей в сравнении с мышами дикого типа. Мышам, сенсибилизированным ФИТЦ, вводили в.б. указанные mAb за 4 ч до повторного нанесения ФИТЦ. Толщину ушей измеряли исходно и через 24 ч и результаты представляли как % увеличения толщины ушей SEM, как проиллюстрировано в примере 4. Использовали группы из 4-5 мышей на состояние и все эксперименты выполняли, как минимум, 3 раза. Представлен один показательный пример. Фиг. 5. Эффект анти-1 и анти-2 mAb на неспецифическое воспаление, вызванное кротоновым маслом. Мышам вводили в.б. указанные mAb за 4 ч до нанесения кротонового масла на уши. Толщину ушей измеряли исходно и через 24 ч и результаты представляли как % увеличения толщины ушей SEM,как проиллюстрировано в примере 5. Использовали группы из 4-5 мышей на состояние и все эксперименты выполняли, как минимум, 3 раза. Представлен один показательный пример. Фиг. 6. Эффект анти- 1 и 2 mAb при артрите, индуцированном mAb к коллагену. Мышам вводили в.б. mAb к коллагену в день 0 с последующим введением ЛПС в день 3. Мышам вводили в.б. указанные mAb каждый 3-й день, начиная с дня 0. Клинически артрит выявлялся через 2-3 дня после введения ЛПС и продолжался в течение нескольких недель. Каждую конечность оценивали по шкале от 0 до 4 каждый 3-й день, как проиллюстрировано в примере 6, и результаты представляли как средний показатель артрита между 9 и 15 днями (SEM) для всех четырех конечностей. Эти данные представляют собой сумму из 4 экспериментов, причем каждый эксперимент включал группы из 3-4 мышей на условие. Фиг. 7. Введение анти-1 или анти-2 mAb тормозит инфильтрацию лейкоцитов в подушечки лап при ответе DTH (гиперчувствительности замедленного типа). Эксперимент выполняли, как описано в фиг. 2. Подушечки лап иссекали через 20 ч после повторного введения антигена и срезы ткани окрашивали гематоксилином и эозином. Срезы ткани были из подушечек лап либо инъецированных повторно мышей (А), либо мышей, сенсибилизированных эритроцитами барана и повторно инъецированных данным антителом (В-Н). Мышей за 1 ч до повторного введения обрабатывали либо ФСБ (В), контрольнымиIg хомяка (С, G), анти-1 (D), анти-2 (Е), либо сочетанием анти-1 и анти-2 mAb (F, Н). Увеличение: 100 (A-F), 400 (G-H). Фиг. 8. 11 экспрессируются на лейкоцитах, инфильтрирующихся в подушечки лап, в течение ответа DTH. Иммуногистохимическое окрашивание инфильтрирующих лейкоцитов из необработанной воспаленной подушечки лапы через 20 ч после повторного введения антигена. А. Серийные срезы, окрашенные непосредственно Alexa488-конъюгированными контрольными mAb и анти-1 mAb. В. Двойное иммунофлуоресцентное окрашивание Alexa488-конъюгированными анти-1 mAb и фикоэритрин (РЕ)конъюгированными mAb, специфичными для клеточных линий. Применяемые РЕ-конъюгированныеmAb были специфичны для гранулоцитов/моноцитов (анти-CD11b), нейтрофилов (анти-LyG/Gr-1) и Тлимфоцитов (анти-CD3). Увеличение: 400. Фиг. 9. Эффект анти-1 и 2 mAb при артрите, индуцированном mAb к коллагену. А. Профилактическая обработка мышей либо анти-1, либо анти-2 mAb снижает показатель артрита. Мышей обрабатывали mAb к коллагену в день 0 с последующим введением ЛПС в день 3. Артрит выявлялся на 6-й день и продолжался в течение нескольких недель. Мышам вводили указанные mAb каждый 3-й день,начиная с дня 0. Каждую конечность оценивали, снимая показатель по шкале от 0 до 4 каждый 3-й день. Результаты представляли как средний показатель артрита между 9 и 15 днями (SEM) для всех четырех конечностей (максимальный показатель 16). Использовали группы из 4 мышей на состояние; показано среднее из 12 экспериментов. В. 1-дефицитные мыши имеют сниженный показатель артрита, сравнимый с таковым мышей дикого типа, обработанных анти-1 mAb. Подробности экспериментов и снятие показателей очерчены выше. Применяли группы из 4 мышей на состояние; показано среднее из 2 экспериментов. Фиг. 10. Эффект обработки анти-1 mAb на иммунопатологию пораженных артритом суставов. Обработка анти-1 mAb снижает инфильтрацию лейкоцитов, адгезию клеток к поверхности суставов и разрушение хряща, о чем свидетельствует потеря протеогликанов. Задние конечности нормальных мышей (A-D) или мышей с артритом (8-й день), либо получавших контрольные Ig хомяка (Е-Н), либо обработанных анти-1 mAb. (I-L). Конечности фотографировали (А, Е, I), иссекали и срезы тканей окрашивали либо гематоксилином/эозином (В-С, F-G, J-K), либо толуидином синим для определения протеогликанов (D, H, L). Увеличение: 16 (В, F, J); 160 (С, G, K); 200 (D, H, L). Фиг. 11. Развитие артрита задерживается в отсутствие лимфоцитов, и ингибирование артрита анти 1 mAb наступает в отсутствие лимфоцитов. Мышей дикого типа В 6,129 или мышей В 6,129, дефицитных по RAG-1, обрабатывали mAb к коллагену в день 0 с последующим введением ЛПС в день 3. Артрит выявлялся на 6 день и продолжался в течение нескольких недель. Мышам вводили указанные mAb каждый 3-й день, начиная с дня 0. Каждую конечность оценивали, снимая показатель по шкале от 0 до 4 ка-2 011384 ждый 3-й день. Результаты представляли как средний показатель артрита на конечность (максимальный показатель 4). Использовали группы из 4 мышей на состояние. Фиг. 12. Ингибирование артрита в зависимости от дозы анти-1 mAb. Мышей дикого типа Balb/с обрабатывали новыми mAb к коллагену в день 0 с последующим введением ЛПС в день 3. Артрит выявлялся на 6-й день и продолжался в течение нескольких недель. Мышам вводили в.б. указанную дозу либо На 4/8 (контрольный изотип), или На 31/8 (анти-1) mAb каждый 3-й день, начиная с дня 0. Каждую конечность оценивали, снимая показатель по шкале от 0 до 4 каждый 3-й день. Результаты представляли как средний показатель артрита на конечность (максимальный показатель 4). Использовали группы из 4 мышей на состояние. Фиг. 13. Терапевтическое лечение анти-1 mAb может снижать показатель артрита. Мышей дикого типа Balb/c обрабатывали mAb к коллагену в день 0 с последующим введением ЛПС в день 3. Артрит выявлялся на 6-й день и продолжался в течение нескольких недель. Мышам вводили в.б. mAb (250 мкг) или гибридный Ig белок (200 мкг) каждый 3-й день, начиная с дня 4. Мыши получали либо mAb (контрольный изотип На 4/8 или анти-1 На 31/8), либо гибридный Ig белок (контрольный изотип Ig или TNFR55-Ig), либо сочетание обоих (250 мкг На 31/8 и 200 мкг TNF-R55-Ig). Каждую конечность оценивали,снимая показатель по шкале от 0 до 4 каждый 3-й день. Результаты представляли как средний показатель артрита на конечность (максимальный показатель 4). Использовали группы из 4 мышей на состояние. Фиг. 14. Локализация эпитопа для блокирующих mAb к 1-I домену. А. Аминокислотная последовательность 1-I домена крысы (вверху) и человека (внизу). Остатки, которые включают мотив MIDAS(сайт адгезии, зависимый от иона металла), отмечены жирным шрифтом. Аминокислоты человека, которые замещали соответствующие остатки крысы (RH), показаны ниже последовательности крысы в рамке. Для ясности нумерация остатков в тексте относится к данной фигуре. В. Увеличивающиеся концентрации mAb AJH10 (АТСС NO. PTA-3580) связывались с лунками, покрытыми 30 мкг/мл 1-I домена человека (кружки), крысы (треугольники) или RH (квадраты). Показанные данные представляют 3 эксперимента. Фиг. 15. Аминокислотная последовательность 1-I домена человека. Аминокислотная последовательность эпитопа для блокирующих mAb к 1-I домену включает аминокислоты 91-96, показанные в рамке на данной фигуре, (SEQ ID NO: 8). Фиг. 16. Идентификация блокирующего антитела к 1-I домену. А. Увеличивающиеся концентрации mAb AEF3 (треугольники) или AJH10 (АТСС NO. РТА-3580) (кружки) связывали с планшетами,покрытыми 30 мкг/мл 1-I доменом. В. 1-I домен обрабатывали увеличивающимися концентрациямиmAb AJH10 (АТСС NO. РТА-3580) (ромбы) или mAb BGC5 (квадраты) и давали связываться с планшетами, покрытыми коллагеном IV (2 мкг/мл). С. Клетки K562-1 обрабатывали увеличивающимися концентрациями mAb AEF3 (треугольники) или AJH10 (АТСС NO. РТА-3580) (кружки) и давали связываться с планшетами, покрытыми коллагеном IV (5 мкг/мл). 45-50% клеток, добавленных в каждую лунку,прикреплялись к коллагену IV. Показанные данные представляют 3 независимых эксперимента. Фиг. 17. Видовая перекрестная реактивность блокирующих mAb. А. Детергентные лизаты из(1) гладкой мышцы сосуда овцы, (2) клеток лейкоза человека K562-1 или (3) очищенный RAH GST-I домен; (4) GST-1 I домен крысы; (5) GST-1 I домен человека разделяли с помощью электрофореза в 10-20% ДСН-ПААГ в невосстанавливающих условиях и проводили иммуноблоттинг с блокирующими функцию mAb AJH10 (АТСС NO. РТА-3580). Слева показаны маркеры молекулярной массы; невосстановленный интегрин 11 мигрирует с Мг 180 кДа; GST-I домен мигрирует с Мг 45 кДа. В. Клетки гладких мышц сосуда кролика инкубировали либо с mAb AJH10 (АТСС NO. РТА-3580) (низ), либо с контрольными IgG мыши (верх) и анализировали с помощью лазерного анализатора клеток по интенсивности (FACS). Фиг. 18. 1-I домен связывает коллаген. А. Увеличивающиеся концентрации 1-I домена человека связывали с планшетами, предварительно покрытыми 1 мкг/мл коллагена I (квадраты) или коллагена IV(кружки). Представленные величины скорректированы на фоновое связывание с БСА. В. 2 мкг/мл 1-I домена человека смешивали с увеличивающимися концентрациями антитела 5E8D9 к интегрину 1 человека (квадраты) или антитела A2IIE10 к интегрину 2 человека (кружки) и затем давали связываться с планшетами, предварительно покрытыми 1 мкг/мл коллагена IV. С. Планшеты покрывали 1 мкг/мл коллагена IV или 3% БСА. Затем 1-I домену (2 мкг/мл) давали взаимодействовать с покрытыми планшетами в присутствии 1 мМ Mn2+, 1 мМ Mg2+ или 5 мМ ЭДТА. Показанные данные представляют 3 независимых эксперимента. Подробное описание изобретения Открытием настоящего изобретения является то, что антитело к интегрину и его фрагменту, особенно к 1-интегриновой субъединице, может блокировать взаимодействие провоспалительных лейкоцитов с компонентами внеклеточного матрикса, включая, но не ограничиваясь ими, коллагены, ламинин и фибронектин. При отсутствии намерений ограничивать изобретение любым единственным механизмом действия, предполагается, что нарушение взаимодействия между интегрином, а также его фрагмен-3 011384 том и окружающим матриксом может снижать экспрессию провоспалительных цитокинов. Дополнительно предполагается, что антитела к интегринам и их фрагментам могут быть модуляторами эффекторных фаз воспалительных ответов путем действия на уровне антиген-специфичной Т-клетки. Кроме того, предполагается, что антитела к интегринам и их фрагментам могут действовать с помощью нарушения миграции клеток в тканях и/или влиять на клеточное примирование и активацию внутри тканей. Данное открытие иллюстрирует важность адгезивных молекул семейства интегринов, особенно 11, в окружении периферических тканей при состояниях, относящихся к воспалению. Оно также распространяется на роль семейства интегринов и их фрагментов в воспалении после прикрепления лейкоцитов и их выхода на поверхность эндотелия в результате освещения важности обогащения матриксом окружения периферических тканей для иммунных ответов, и оно выдвигает периферические ткани как новую точку приложения терапии, основанной на адгезии. Способы настоящего изобретения рассматривают применение антител к интегринам, где рассматриваемые интегрины включают молекулы, которые включают -цепь, включающую, но не ограничивающуюся 1, 2, 3, 4, 5, 6, 7, 8, нековалентно связанную с -цепью, включающей, но не ограничивающейся 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, V, L, M, X, D, E, IIb. Примеры различных интегринов, рассматриваемых для применения в исследовании, включают, но не ограничиваются этим: Способы настоящего изобретения также охватывают применение антител к фрагментам интегринов, включая, например, антитела к одной -цепи, включающей, но не ограничивающейся 1, 2, 3, 4,5, 6, 7, 8, также как к одной -цепи, включающей, но не ограничивающейся 1, 2, 3, 4, 5, 6,7, 8, 9, 10, V, L, M, X, D, E, IIb. Кроме того, способы настоящего изобретения дополнительно охватывают применение антител к фрагментам интегринов, включая, например, антитела к домену I -цепи, включая, но не ограничиваясь этим, домен I 11 (Briesewitz et al., 1993, J. Biol. Chem. 268: 2989); 21 (Takada and Hemler, 1989, J. Cell Biol. 109: 397), L2 (Larson et al., 1989, J. Cell Biol. 108: 703), М 2 (Corbi et al., 1988, J. Biol. Chem. 263: 12403), X2 (Corbi et al., 1987, EMBO J. 6: 4023), D2(Grayson et al., 1988, J. Exp. Med. 188: 2187), E7 (Shaw et al., 1994, J. Biol. Chem. 269: 6016). В предпочтительном осуществлении антигенная детерминанта 1-I домена включает аминокислотную последовательность из по меньшей мере 6 расположенных подряд аминокислот, где последовательность из расположенных подряд аминокислот найдена в последовательности фиг. 15. Более того, в предпочтительном осуществлении смежная последовательность из расположенных подряд аминокислот представляет собойVal-Gln-Arg-Gly-Gly-Arg. Способы получения интегринов для применения в настоящем изобретении известны специалистам в данной области техники (см., например, Springer et al. 1990, Nature 346: 425-434). Осуществления настоящего изобретения дополнительно включают поликлональные и монокло-4 011384 нальные антитела к интегрину. Предпочтительные осуществления настоящего изобретения включают моноклональное антитело, такое как моноклональное антитело к 1. Антитело, блокирующее функцию 11, в данном случае относится к антителу, которое взаимодействует с доменом 1-I, конкретно с эпитопом, формируемым аминокислотами 91-96 фиг. 15, и блокирует функцию 11, что проверяется, например, по его способности ингибировать K562-1-зависимую адгезию к коллагену IV (см. пример 15). Предпочтительные антитела и гомологи для лечения, в частности для лечения человека, включают гомологи антител человека, гомологи антител, приближенные к человеческим, химерные гомологи антител, фрагменты антител Fab, Fab', F(ab')2 и F(v) и мономеры или димеры тяжелых или легких цепей антитела или их смеси. Таким образом, моноклональные антитела к молекуле интегрина и ее фрагменту представляют собой предпочтительный связывающий агент в способе изобретения. Используемый термин "гомолог антитела" включает интактные антитела, состоящие из легких и тяжелых цепей иммуноглобулинов, связанных дисульфидными мостиками. Термин "гомолог антитела" также предназначен для охвата белка, включающего один или более полипептидов, выбранных из легких цепей иммуноглобулинов, тяжелых цепей иммуноглобулинов и их антигенсвязывающих фрагментов,которые способны взаимодействовать с одним или более антигенами (т.е. 1, 2, 6 или альфа-I доменом, содержащим субъединицы интегринов). Полипептидные компоненты гомолога антитела, состоящие из более чем одного полипептида, могут необязательно быть связаны с помощью дисульфидного мостика или других ковалентных связей. В связи с этим, следовательно, "гомологи антител" включают интактные иммуноглобулины типовIgA, IgG, IgE, IgD, IgM (так же, как и их подтипы), где легкие цепи иммуноглобулинов могут быть типа каппа или лямбда."Гомологи антител" также включают части интактных антител, которые сохраняют антигенсвязывающую специфичность, например Fab-фрагменты, Fab'-фрагменты, F(ab')2-фрагменты, F(v)-фрагменты,мономеры или димеры тяжелых цепей, мономеры или димеры легких цепей, димеры, состоящие из одной тяжелой и одной легкой цепей и т.п. Таким образом, антигенсвязывающие фрагменты, так же, как полноразмерные димерные или тримерные полипептиды, происходящие из описанных выше антител,полезны сами по себе. Используемый термин "гомолог антитела, приближенный к человеческому," представляет собой гомолог антитела, полученный с помощью метода рекомбинантной ДНК, в котором некоторые или все аминокислоты легкой или тяжелой цепи иммуноглобулина человека, которые не требуются для связывания антигена, замещены соответствующими аминокислотами легкой или тяжелой цепи иммуноглобулина млекопитающего, не являющегося человеком. Используемый термин "химерный гомолог антитела" представляет собой гомолог антитела, полученный с помощью метода рекомбинантной ДНК, в котором все или часть шарнирной и константной области легкой цепи, тяжелой цепи или обеих цепей иммуноглобулина замещены соответствующими областями от легкой или тяжелой цепи другого иммуноглобулина. В другом варианте изобретение характеризует вариант химерной молекулы, которая включает: (1) часть-мишень для интегрина; (2) необязательно второй пептид, например такой, который увеличивает растворимость или время жизни in vivo части-мишени для интегрина, например член суперсемейства иммуноглобулинов или его фрагмент или часть, например часть или фрагмент IgG, например константную область тяжелой цепи IgG1 человека,например СН 2 и СН 3 шарнирные области; и часть токсина. Химерная молекула может быть применена для лечения субъекта, например человека, при риске нарушения, относящегося к пролиферации эпителиальных клеток, таких как волосяные фолликулы и т.п. Используемый термин "гомолог антитела человека" представляет собой гомолог антитела, полученный с помощью метода рекомбинантной ДНК, в котором все аминокислоты легкой или тяжелой цепи иммуноглобулина происходят из человеческого источника. Используемый термин "воспалительное заболевание" включает, но не ограничивается ими, такие состояния, как состояния, связанные с кожей, такие как псориаз, экзема, ожог и дерматит. Другие воспалительные заболевания, предназначаемые для лечения с помощью способов настоящего изобретения,включают, но не ограничиваются ими, лечение астмы, бронхита, менструальных спазмов, тендинита,бурсита и лечение боли и головной боли или в качестве жаропонижающего при лечении лихорадки. Способы изобретения также могли бы быть полезны для лечения желудочно-кишечных нарушений, таких как воспалительное заболевание кишечника, болезнь Крона, гастрит, синдром раздраженного кишечника и язвенный колит и для профилактики рака толстой кишки. Способы изобретения должны быть полезны для лечения воспалительных нарушений при таких заболеваниях, как сосудистые заболевания, головные боли при мигрени, нодозный периартериит, тиреоидит, апластическая анемия, болезнь Ходжкина, ревматоидная лихорадка, диабет типа I, псевдопаралитическая миастения, множественный склероз, саркоидоз,нефротический синдром, синдром Бехчета, полимиозит, гингивит, гиперчувствительность, конъюнктивит,отеки после ушиба, ишемия миокарда и т.п. Способы изобретения также полезны для лечения аллергического ринита, синдрома респираторного дистресса, синдрома эндотоксического шока и атеросклероза.-5 011384 В предпочтительном осуществлении способы изобретения полезны для лечения артрита, включая,например, ревматоидный артрит и остеоартрит."Эффективное количество" представляет собой количество, достаточное для благоприятных или желаемых клинических результатов. Эффективное количество может быть введено за 1 или более раз. В плане лечения воспалительного заболевания "эффективное количество" антитела к интегрину представляет собой количество, достаточное для смягчения, улучшения, стабилизации, обратного развития, замедления или отсрочки прогрессии состояния, относящегося к воспалению, в соответствии с клинически приемлемыми стандартами для нарушений, подвергаемых лечению, или для косметических целей. Определение и измерение показателей эффективности может быть осуществлено с помощью большого числа доступных диагностических способов, включая, но не ограничиваясь этим, например, медицинский осмотр, включая анализы крови, легочные функциональные тесты и рентген грудной клетки; сканирование с помощью СТ (компьютерной томографии); бронхоскопию; бронхоальвеолярный лаваж; биопсию легких и сканирование с помощью СТ. Технология получения моноклональных антител, включая, например, моноклональные антитела к интегрину, хорошо известна. См., например, Mendrick et al. 1995, Lab. Invest. 72: 367-375 (mAb к анти 11 и анти-21 мыши); Sormenberg et al. 1987, J. Biol. Chem. 262: 10376-10383 (mAb к анти-61 мыши);Chem. 269: 28708-15 (mAb к V8 человека); Bossy et al. 1991, EMBO J. 10: 2375-85 (поликлональная антисыворотка к 81 человека); Camper et al. 1998, J. Biol. Chem. 273: 20383-20389 (поликлональная антисыворотка к 101 человека). В общем виде, иммортализованную клеточную линию (обычно клетки миеломы) сливают с лимфоцитами (обычно спленоцитами) от млекопитающего, иммунизированного целыми клетками, экспрессирующими данный антиген, например интегрин, и супернатанты культур полученных гибридомных клеток проверяют на наличие антител к антигену. См., в общем смысле, Kohler et al., 1975, Nature 265: 295467, "Continuous Cultures of Fused Cells Secreting Antibody of Predefined Specificity". Иммунизация может быть осуществлена с помощью стандартных процедур. Единица дозы и схема введения зависят от вида иммунизируемого млекопитающего, его иммунного статуса, веса тела млекопитающего и т.п. Обычно у иммунизированного млекопитающего берут кровь и сыворотку от каждого образца крови тестируют на конкретные антитела с применением соответствующих способов скрининга. Например, антитела к интегрину могут быть идентифицированы с помощью иммунопреципитации меченных 125I лизатов клеток, экспрессирующих интегрин. Антитела, включая, например, антитела к интегрину, могут также быть идентифицированы с помощью проточной цитометрии, например, путем измерения флуоресцентного окрашивания клеток, экспрессирующих антитело, проинкубированных с антителом, которое, как считается, узнает молекулы интегрина. Лимфоциты, применяемые при получении гибридомных клеток, обычно выделяют из иммунизированных млекопитающих, чьи сыворотки уже протестированы как позитивные на присутствие антител к интегрину с применением таких способов скрининга. Обычно иммортализованная клеточная линия (например, миеломная клеточная линия) происходит из тех же видов млекопитающих, что и лимфоциты. Предпочтительными иммортализованными клеточными линиями являются мышиные миеломные клеточные линии, которые чувствительны к культуральной среде, содержащей гипоксантин, аминоптерин и тимидин (ГАТ-среда). Обычно ГАТ-чувствительные мышиные миеломные клетки сливают с мышиными спленоцитами, применяя полиэтиленгликоль с молекулярной массой 1500 ("ПЭГ 1500"). Гибридомные клетки, полученные после слияния, затем отбирают с применением ГАТ-среды, которая уничтожает неслитые и непродуктивно слитые миеломные клетки (неслитые спленоциты умирают через несколько дней, потому что они не трансформированы). Гибридомы,продуцирующие желаемое антитело, определяют путем скрининга культуральных супернатантов гибридом. Например, гибридомы, полученные для продукции антител к интегрину, могут быть проверены путем тестирования гибридомного культурального супернатанта на секретируемые антитела, обладающие способностью взаимодействовать с рекомбинантной клеточной линией, экспрессирующей интегрин. Для получения гомологов антител, включая, например, гомологи антител к интегрину, которые-6 011384 представляют собой интактные иммуноглобулины, гибридомные клетки, которые протестированы как позитивные в таких тестах скрининга, культивируют в питательной среде в условиях и в течение времени, достаточных для секреции гибридомными клетками моноклональных антител в культуральную среду. Способы культивирования тканей и культуральные среды, которые подходят для гибридомных клеток, хорошо известны. Полученный в результате супернатант гибридомной культуры может быть собран,и антитела к интегрину необязательно могут быть дополнительно очищены с помощью хорошо известных способов. В противоположном варианте желаемое антитело может быть получено путем введения гибридомных клеток в брюшную полость неиммунизированной мыши. Гибридомные клетки пролиферируют в брюшной полости, секретируя антитело, которое аккумулируется в виде асцитной жидкости. Антитело может быть собрано путем удаления асцитной жидкости из брюшной полости с помощью шприца. Полностью человеческие гомологи моноклонального антитела против, например, интегринов представляют собой другой предпочтительный связывающий агент, который может блокировать антигены в способе изобретения. В своей интактной форме они могут быть получены с применением примированных in vitro спленоцитов человека, как описано Boerner et al., 1991, J. Immunol. 147: 86-95, "Production ofAntigen-specific Human Monoclonal Antibodies from In Vitro-Primed Human Splenocytes". В противоположном варианте они могут быть получены с помощью спектрального клонирования,как описано Persson et al., 1991, Proc. Nat. Acad. Sci. USA 88: 2432-2436, "Generation of diverse highaffinity human monoclonal antibodies by repertoire cloning" и Huang and Stollar, 1991, J. Immunol. Methods 141: 227-236, "Construction of representative immunoglobulin variable region cDNA libraries from humanprepapration of human monoclonal antibodies and their use") описывает получение моноклональных антител человека из В-клеток человека. В соответствии с данным способом В-клетки человека, продуцирующие антитела, иммортализуют с помощью заражения вирусом Эпштейна-Барра или его производным, которое экспрессирует ядерный антиген 2 вируса Эпштейна-Барра (EBNA2). Функция EBNA2, которая необходима для иммортализации, впоследствии выключается, что ведет к увеличению продукции антитела. Еще в одном способе получения полностью человеческих антител патент Соединенных Штатов 5789650 (4 авг. 1998, "Transgenic non-human animals for producing heterologous antibodies") описывает трансгенных животных, не являющихся человеком, способных продуцировать гетерологичные антитела и трансгенных животных, не являющихся человеком, имеющих инактивированные гены эндогенных иммуноглобулинов. Гены эндогенных иммуноглобулинов подавляют с помощью антисмысловых полинуклеотидов и/или с помощью антисыворотки, направленной против эндогенных иммуноглобулинов. Гетерологичные антитела кодируются генами иммуноглобулинов, которые в норме не присутствуют в геноме данных видов животных, не являющихся человеком. Один или более трансгенов, содержащих последовательности неаранжированных гетерологичных тяжелых цепей иммуноглобулина человека, вводят животному, не являющемуся человеком, формируя в результате этого трансгенное животное, способное функционально реаранжировывать последовательности трансгенного иммуноглобулина и продуцировать спектр антител различных изотипов, кодируемых генами иммуноглобулинов человека. Такие гетерологичные антитела человека продуцируются в В-клетках, которые после этого иммортализуют, например, с помощью слияния с иммортализующей клеточной линией, такой как миелома, или путем воздействия на такие В-клетки с помощью других способов для иммортализации клеточной линии, способной продуцировать моноклональный гетерологичный гомолог полностью человеческого антитела. Еще один предпочтительный связывающий агент, который может блокировать антигены интегрина или его фрагментов в способе изобретения, представляет собой гомолог антитела, приближенного к человеческому, обладающий способностью связывать белок интегрин или его фрагменты. После ранних способов получения химерных антител в патенте ЕР 0239400 (Winter et al.) описан новый подход, при котором антитела изменяют путем замещения их участков, определяющих комплементарность (CDRs),от одного вида участками от другого вида. Данный процесс может быть применен, например, для замещения CDR из доменов вариабельных областей тяжелой и легкой цепей Ig человека альтернативнымиCDR из доменов вариабельных областей мыши. Данные измененные вариабельные области Ig можно затем комбинировать с константными области Ig человека для создания антител, которые являются полностью человеческими, за исключением замещенных мышиных CDR. Можно предсказать, что такиеCDR-замещенные антитела менее вероятно вызовут иммунный ответ у человека по сравнению с химерными антителами, поскольку CDR-замещенные антитела содержат значительно меньше компонентов, не являющихся человеческими. Способ получения моноклональных антител, приближенных к человеческим, путем "трансплантации" CDR назван "реконструирование" (Riechmann et al., 1988, Nature 332: 323327, "Reshaping human antibodies for therapy"; Verhoeyen et al., 1988, Science 239: 1534-1536, "Reshaping ofhuman antibodies using CDR-grafting in Monoclonal Antibodies"). Обычно участки, определяющие комплементарность (CDR), антитела мыши пересаживают в соответствующие участки антитела человека, так как CDR (три в тяжелых цепях антитела, три в легких цепях) являются участками антитела мыши, которые связывают специфический антиген. ТрансплантацияCDR достигается с помощью генной инженерии, в результате чего определяют последовательности ДНКCDR с помощью клонирования сегментов генов вариабельных (V) областей тяжелой и легкой цепей мыши и затем перемещают соответствующие V-области человека с помощью сайт-направленного мутагенеза. На конечной стадии процесса добавляют сегменты гена константной области человека желаемого изотипа (обычно гамма I для СН и каппа для CL) и гены тяжелой и легкой цепей, приближенных к человеческим, коэкспрессируют в клетках млекопитающих для получения растворимого антитела, приближенного к человеческому. Перенос данных CDR в антитело человека придает данному антителу антигенсвязывающие свойства природного мышиного антитела. Шесть CDR в антителе мыши структурно монтируются в каркасные участки V-области. Причина успешности трансплантации CDR заключается в том, что каркасные участки между антителами мыши и человека могут иметь очень сходные 3D структуры со сходными точками прикрепления CDR, так что CDR могут быть взаимно заменены. Такие гомологи антител, приближенные к человеческим, могут быть получены, например, как у Jones et al., 1986, Nature 321: 522-525, "Replacingreaction". Несмотря на это, определенные аминокислоты в каркасных участках, как предполагается, взаимодействуют с CDR и влияют на общую антигенсвязывающую аффинность. Прямой перенос CDR из антитела мыши для получения антитела, приближенного к человеческому, без каких-либо модификаций каркаса V-области человека часто ведет к частичной или полной потере связывающей аффинности. В ряде случаев, по-видимому, критическим является изменение остатков в каркасных участках акцепторного антитела для получения связывающей активности.interleukin 2 receptor" и патентная заявка WO 90/07861 (Protein Design Labs Inc.) описали получение антитела, приближенного к человеческому, которое содержит модифицированные остатки в каркасных участках акцепторного антитела, путем сочетания CDR mAb мыши (анти-Тас) с каркасом иммуноглобулина человека и константными областями. Они продемонстрировали одно решение проблемы потери связывающей аффинности, которая часто возникает в результате прямого переноса CDR без каких-либо модификаций остатков каркаса V-области человека; данное решение включает две ключевые стадии. Вопервых, каркасные участки V-области человека выбирают с помощью компьютерного анализа для оптимальной гомологии последовательности белка каркасные участки V-области природного мышиного антитела, в данном случае анти-Тас Mab. На второй стадии с помощью компьютера моделируется третичная структура V-области мыши для того, чтобы визуализировать аминокислотные остатки каркасного участка,которые, скорее всего, взаимодействуют с мышиными CDR, и данные мышиные аминокислотные остатки затем накладывают на гомологичный каскадный участок человека. Их подход к применению гомологичных каркасных участков человека с предполагаемыми контактирующими остатками мыши привел к получению антител, приближенных к человеческим, с величинами связывающей аффинности, сходными с природным антителом мыши, что показано в отношении антител, специфичных для рецептора интерлейкина 2 (Queen et al., 1989, выше), а также для антител, специфичных для вируса герпеса простого (HSV)(Co. et al., 1991, Proc. Nat. Acad. Sci. USA 88: 2869-2873, "Humanized antibodies for antiviral therapy"). В соответствии с описанным выше двухступенчатым подходом в заявке WO90/07861 Queen et al. выделяют несколько критериев для конструирования иммуноглобулинов, приближенных к человеческим. Первым критерием является применение в качестве человеческого акцептора каркаса от конкретного иммуноглобулина человека, который обычно гомологичен иммуноглобулину-донору не от человека, который приближают к человеческому, или применение консенсусного каркаса от многих антител человека. Вторым критерием является применение донорской аминокислоты, предпочтительнее акцепторной, если остаток акцептора человека является необычным, а донорский остаток типичен для последовательностей человека в конкретном остатке каркаса. Третьим критерием является применение остатка аминокислоты донорского каркаса, предпочтительнее акцепторного, в положениях, непосредственно прилегающих к CDR. Можно использовать другой подход (см. Tempest, 1991, Biotechnology 9: 266-271, "Reshaping a humanmonoclonal antibody to inhibit human respiratory syncytial virus infection in vivo") и применять в качестве стандарта рамки V-области, которые происходят от NEWM и REI тяжелой и легкой цепей, соответственно, для трансплантации CDR без радикального введения мышиных остатков. Преимущество применения подхода Tempest et al., 1991 для конструирования антител, приближенных к человеческим, на основеNEWM и REI состоит в том, что 3-мерные структуры вариабельных районов NEWM и REI известны из рентгеноструктурной кристаллографии и, таким образом, можно смоделировать специфические взаимодействия между CDRs и остатками рамки V-области. Лечение субъектов является эффективным как для человека, так и для животных, страдающих от данных состояний. Субъекты-животные, к которым применимо изобретение, включают как домашних животных, так и домашний скот, которых разводят либо в качестве комнатных животных, либо для коммерче-8 011384 ских целей. Примерами являются собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи и козы. В способах изобретения антитела, включая, например, анти-VLA-1 антитело, могут быть введены парентерально. Применяемый здесь термин "парентеральный" включает подкожный, внутривенный,внутримышечный, внутрисуставный, внутрисиновиальный, внутригрудинный, внутриоболочечный,внутрипеченочный, внутриочаговый и внутричерепной способы введения или инфузии. Фармацевтические композиции данного изобретения включают любое из соединений настоящего изобретения или их фармацевтически приемлемые производные совместно с фармацевтически приемлемым носителем. Применяемый здесь термин "носитель" включает известные приемлемые адъюванты и носители. В соответствии с данным изобретением фармацевтические композиции могут быть в форме стерильных препаратов для инъекций, например стерильной водной или маслянистой суспензии для инъекций. Данная суспензия может быть составлена в соответствии со способами, известными в данной области техники, с применением подходящих диспергирующих и увлажняющих агентов, а также суспендирующих агентов. Фармацевтические композиции настоящего изобретения можно давать перорально. При пероральном приеме их можно вводить в любой лекарственной форме, приемлемой для перорального введения,включая, но не ограничиваясь этим, капсулы, таблетки, водные суспензии или растворы. Для местного применения фармацевтические композиции могут быть составлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителей. Фармацевтические композиции настоящего изобретения можно также вводить с помощью интраназального аэрозоля или ингаляции при использовании распылителя, ингалятора сухого порошка или ингалятора с фиксированными дозировками. Дозировка и величина доз соединений настоящего изобретения, эффективных для оказания желаемых эффектов, должны зависеть от множества факторов, таких как природа ингибитора, размер субъекта, цель лечения, природа патологии, подвергаемой лечению, конкретной применяемой фармацевтической композиции и заключения лечащего врача. Применим уровень доз активного ингредиента между приблизительно 0,001 и приблизительно 100 мг/кг массы тела в день, предпочтительно между приблизительно 0,1 и приблизительно 50 мг/кг массы тела в день. Более предпочтительно, чтобы гомологи антител вводили в интервале доз между приблизительно 0,1 и приблизительно 20 мг/кг массы тела/день,предпочтительно в интервале между приблизительно 0,1 и приблизительно 10 мг/кг массы тела/день с интервалами каждые 1-14 дней. В другом предпочтительном осуществлении антитело вводят в дозе от приблизительно 0,3 до 1 мг/кг при в.б. введении. В другом предпочтительном осуществлении антитело вводят в дозе от приблизительно 5 до 12,5 мг/кг при в.в. введении. Предпочтительно композицию антител вводят в количестве, эффективном для обеспечения уровня антитела в плазме по меньшей мере 1 мкг/мл. Специалисты в данной области техники могут легко протестировать, имеет ли антагонист изобретения подразумеваемый эффект. Например, клетки, содержащиеся в образце эпителия индивидуума, тестируют на присутствие агента in vitro (или ex vivo) с применением второго реагента для обнаружения введенного агента. Например, это может быть антитело, меченное флуорохромом, специфичное для введенного агента, который затем измеряют путем стандартного анализа с помощью FACS (лазерный анализатор клеток по интенсивности флуоресценции). В противоположном варианте присутствие введенного агента определяют in vitro (или ex vivo) по отсутствию способности или сниженной способности клеток индивидуума связывать тот же агент, который сам был промечен (например, с помощью флуорохрома). Предпочтительная дозировка должна вызывать определяемое покрытие огромного большинства сж-позитивных клеток. В случае гомолога антитела предпочтительно, чтобы покрытие поддерживалось в течение периода 1-14 дней. Практика настоящего изобретения, если не указано иначе, должна применять традиционные способы клеточной биологии, культивирования клеток, молекулярной биологии, микробиологии, техники рекомбинантной ДНК, белковой химии и иммунологии, которые известны специалистам в данной области техники. Такие способы описаны в литературе. См., например, Molecular Cloning: A Laboratory Manual,2nd edition (Sambrook, Fritsch and Maniatis, eds.), Cold Spring Harbor Laboratory Press, 1989; DNA Cloning,Volumes I and II (D.N. Glover, ed), 1985; Oligonucleotide Synthesis, (M.J. Gait, ed.), 1984; патент США No. 4683195Embryo, Cold Spring Harbor Laboratory Press, 1986. Следующие примеры предлагаются для иллюстрации настоящего изобретения и не должны толковаться как ограничивающие его.-9 011384 Примеры Химические реактивы Флуоресцеина изотиоцианат (ФИТЦ) приобретен у Sigma Chemical Co. (St. Louis, MO). Кротоновое масло приобретено у ICN Biochemicals (Aurora, OH). Цельную кровь овец в растворе Alsevers получали от East Acres Biologicals (Southbridge, MA). Коллаген типа I из хвоста крысы и коллаген типа IV мыши приобретали у Collaborative Research Inc. (Bedford, MA) и Gibco (Gaithersburg, MD), соответственно. Мышей-самок линии Balb/c в возрасте 6-8 недель приобретали у Taconic (Germantown, NY), а мыши на основе Balb/c с недостаточностью 11 интегрина были описаны ранее (3). Пример 1. Моноклональные антитела. Блокирующие функциональную активность антигенов мыши mAb получали в форме без азида и с низким содержанием эндотоксинов: На 31/8 (антитело хомячка к CD49a; интегрин 1) (Mendrick et al. 1995, Lab. Invest. 72: 367-375), Ha1/29 (антитело хомячка к CD49b; интегрин 21 (Mendrick et al. 1995,Lab. Invest. 72: 367-375; Mendrick, D.L. and D.M. Kelly 1993, Lab. Invest. 69: 690-702), контрольное mAb хомячка группы II Ha4/8 (антитело хомячка к KLH) (Mendrick, D.L. and D.M. Kelly 1993, Lab. Invest. 69: 690-702), и PS/2 (антитело крысы к CD49d; цепь 41 интегрина) (Miyake et al. 1991, J. Exp. Med. 173: 599-607). Кроме того, следующие блокирующие функциональную активность антигенов мыши mAb были приобретены в форме препаратов без азида и с низким содержанием эндотоксинов у Pharmingen (SanDiego, CA): HM1-1 (антитело хомячка к CD29; 1 цепь интегрина) (Noto et al. 1995, Int. Immunol. 7: 835-842),Ha2/5 (антитело хомячка к CD29; 1 цепь интегрина) (Mendrick, D.L. and D.M. Kelly 1993, Lab. Invest. 69: 690-702), 3E2 (антитело хомячка к CD54; ICAM-1) (Scheynius et al. 1993, J. Immunol. 150: 655-663), 5H1027 (антитело крысы к CD49e; интегрин 5) (Kinashi, Т., and Т.A. Springer. 1994, Blood Cells. 20: 25-44),GoH3 (антитело крысы к CD49f; интегрин 6) (Sonnenberg et al. 1987, J. Biol. Chem. 262: 10376-10383) и изотипные контрольные mAb крысы R35-95 (IgG2a крысы) и R35-38 (IgG2b крысы). Исследование адгезии. Спленоциты от мышей Balb/c культивировали в присутствии 20 нг/мл ИЛ-2 в течение 7-12 дней. Адгезию клеток к коллагену типа I и типа IV определяли, как описано ранее (Gotwals et al. 1996, J. Clin. Invest. 97: 2469-2477). Вкратце, 96-луночные планшеты Maxisorp (Nunc, Napierville, IL) покрывали либо 10 мкг/мл коллагена типа IV, либо 5 мкг/мл коллагена типа I, и неспецифические сайты блокировали 1% БСА. Активированные ИЛ-2 спленоциты метили 2 мкМ BCECF [2',7'-бис(карбоксиэтил)-5(6)карбоксилфлуоресцинпента-ацетоксиметиловым эфиром] (Molecular Probes, Eugene, OR) и инкубировали с 10 мкг/мл указанных mAb в течение 15 мин. После этого в покрытые лунки добавляли 105 клеток в 0,25% БСА в средеRPMI и инкубировали в течение 60 мин при 37 С. Несвязавшиеся клетки удаляли трехкратной промывкой с помощью 0,25% БСА в RPMI. Адгезию количественно определяли с помощью флуоресцентного планшетного ридера CytoFluor 2350 (Millipore, Bedford, MA). Измеряли отношение связавшихся клеток к добавленным клеткам и рассчитывали процент (нормализованный к 100%) адгезии относительно клеток,обработанных контрольным mAb. Вычитали фоновые величины, обусловленные адгезией к лункам, покрытым одним БСА. Экспрессия и функциональная блокада 11 и 21 на активированных лейкоцитах. Принимая во внимание ключевую роль лейкоцитов в воспалении, заявители решили проверить,способны ли mAb к 1 и 2 блокировать адгезию лейкоцитов к коллагенам. Для получения лейкоцитов,экспрессирующих высокий уровень как 1, так и 2, Т-клетки мыши стимулировали in vitro ИЛ-2 в течение 7-12 дней. Данные клетки экспрессировали как 1, так и 2 на высоком уровне (фиг. 1 А) и хорошо связывались с поверхностями, покрытыми как коллагеном типа IV, так и коллагеном типа I (фиг. 1 В). Адгезия к коллагену типа IV частично подавлялась одним mAb к 1, но не подавлялась одним mAb к 2. Напртив, адгезия к коллагену типа I полностью подавлялась mAb к 2, а одно mAb к 1 вызывало лишь частичное ингибирование. Оба mAb к 1, а также сочетание mAb к 2 и 1 полностью ингибировали адгезию к коллагену типов I и IV. Показав, что интегрины 11 и 21 экспрессируются на активированных Т-клетках и что mAb к 1 и 2 способны функционально блокировать адгезию лейкоцитов к коллагенам, заявители применили эти mAb для исследования роли данных интегринов in vivo на животных моделях воспалительных расстройств. Пример 2. Ингибирование ответов DTH под действием mAb к интегринам. Индуцированные эритроцитами барана ответы гиперчувствительности замедленного типа (DTH) применяли в адаптированном варианте ранее опубликованной процедуры (Hurtrel et al. 1992, Cell. Immunol. 142: 252-263). Вкратце, мышей иммунизировали п/к со спины 2107 эритроцитов барана в 100 мкл ФСБ в день 0. Мышам давали на день 5 инъекцию 1108 эритроцитов барана в 25 мкл ФСБ п/к в подушечку правой задней лапы. Толщину подушечки лапы измеряли с помощью инженерного кронциркуля (Mitutoyo/MTI,Paramus, NJ) через 20 ч после повторного введения антигена и рассчитывали набухание подушечки лапы. Результаты выражали в виде среднего процента увеличения толщины подушечки SEM и рассчитывали- 10011384 как % увеличения=[1-(толщина подушечки правой лапы через 20 ч после повторного введения антигена/толщина подушечки неинъецированной левой лапы через 20 ч после повторного введения антигена)]100%. Для блокирования эффекторной фазы индуцированного эритроцитами барана ответа DTH за 1 ч до повторного введения антигена на день 5 в/бр вводили терапевтическое или контрольное mAb (100 мкг),которые получали в соответствии со способами, описанными в примере 1.DTH, индуцированная эритроцитами барана, является хорошо охарактеризованной моделью воспаления in vivo, и в частности псориаза, которую применяли для демонстрации значения множества цитокинов и адгезивных молекул для воспаления (Tedder et al. 1995, J. Exp. Med. 181: 2259-2264, Terashita etal. 1996, J. Immunol. 156: 4638-4643). Сенсибилизированные эритроцитами барана мыши получали mAb к интегринам за 1 ч до повторного введения антигена в подушечку лапы и оценивали воспаление через 20 ч по результатам измерения увеличенной толщины подушечки лапы. У мышей, получавших ФСБ и контрольный Ig хомячка, показано увеличение толщины подушечки лапы на 60-70% через 20 ч после повторного введения антигена (фиг. 2). По сравнению с обработкой контрольным Ig хомячка mAb к 1 или 2 вызывали 68 и 60% ингибирование толщины подушечки лапы, соответственно. Сочетание mAb к 1 и 2 приводило к ингибированию на 71%, что свидетельствует о низком аддитивном эффекте по сравнению с mAb к 1 или 2, взятыми по отдельности. Лечение другими mAb к интегринам было также эффективно в отношении ингибирования эффекторного ответа DTH. Степень ингибирования, наблюдавшаяся при лечении различными mAb, составляла 49% (анти-4), 23% (анти-5) и 57% (анти-6). Наконец, блокада с помощью mAb общей для интегринов субъединицы 1 (mAb HMBI-1) тормозила эффекторный ответ DTH на 67%. Пример 3. Ингибирование с помощью mAb к интегринам эффекторных ответов CHS. Контактную гиперчувствительность (CHS) к ФИТЦ оценивали, как описано ранее (Gaspari et al. 1991, In Current Protocols in Immunology. J.E. Coligan, A.M. Kruisbeek, D.H. Margulies, E.M. Shevach, andW. Strober, editors. John WileySons, New York. Section 4.2:1). Вкратце, мышей сенсибилизировали окраской 100 мкл 0,5% ФИТЦ в смеси 1:1 ацетон/дибутилфталат, наносимой на обритую спину в день 0. Через 10 дней животным повторно наносили 5 мкл 0,5% ФИТЦ на обе стороны каждого уха. Ответ набухания ушей определяли по толщине уха, измеренной с помощью инженерного кронциркуля (Mitutoyo/MTI,Paramus, NJ) во время повторного нанесения антигена (день 10) и через 24 ч и результаты выражали в виде среднего процента увеличения исходной толщины уха SEM. Увеличение толщины уха рассчитывали как % увеличения=[1-(толщина уха через 24 ч после повторного нанесения антигена/толщина уха в момент повторного нанесения антигена)]100%. Для блокирования эффекторной фазы ответа CHS за 4 ч до повторного нанесения антигена на день 10 в/бр вводили терапевтическое или контрольное mAb (250 мкг). В качестве негативных контролей (увеличение толщины уха никогда не превышало 2%) служили мыши,сенсибилизированные антигеном, на уши которых повторно наносили только носитель (контроль на носитель), или мыши, уши которых обрабатывали ФИТЦ без предварительной сенсибилизации (контроль на раздражение). Принимая во внимание, что CHS по механизмам отлична от DTH и включает иные эффекторные клетки, заявители исследовали действие mAb к интегринам на эффекторную фазу ответа CHS. Мышей сенсибилизировали гаптеном с помощью ФИТЦ, наносимого на их обритую спину, с последующим через 10 дней нанесением ФИТЦ на ухо, вызывающим на следующий день воспалительный ответ. У сенсибилизированных ФИТЦ мышей наблюдалось 60-70% увеличение толщины через 24 ч после повторного нанесения антигена (фиг. 3). В соответствии с опубликованными данными (Scheynius et al. J. Immunol. 150: 655-663) обработка mAb к ICAM-1 приводила к 51% ингибированию набухания уха. По сравнению с контрольным mAb хомячка обработка мышей mAb к 1 или 2 за 4 ч до повторного нанесения антигена приводила к 37 и 57% ингибированию набухания уха, соответственно (фиг. 3). Сочетание mAb к 1 и 2 приводило к слегка более сильному ингибированию набухания уха (65%). Обработка другими mAb к 1 интегринам показала, что, в то время как mAb к 4 и 5 не вызывали ингибирования индуцированного ФИТЦ эффекторного ответа CHS по сравнению с контрольным mAb крысы, обработка mAb к 6 приводила к 86% ингибированию эффекторных ответов. Наконец, блокада с помощью mAb общей субъединицы 1 интегринов ингибировала эффекторные ответы CHS на 74%. Сходные результаты в отношенииCHS были получены с применением разных линий мышей (C57/BL6, 129/Sv) и другого сенсибилизирующего агента (оксазолона) (данные не показаны). Сходно с результатами, наблюдавшимися в моделиDTH, индуцированной эритроцитами барана, гистологический анализ воспаленных ушей показал, что как образование отека, так и лейкоцитариал инфильтрация ингибировались обработкой mAb к 1 и 2. В соответствии с данными о том, что 11 и 21 могут экспрессироваться на активированных ИЛ 2 спленоцитах, анализ лимфатических узлов сенсибилизированных антигеном (ФИТЦ или оксазолоном) мышей выявил экспрессию 11 и 21 исключительно на CD44hi-LFA-1hi-активированных CD4+ иCD8+Т-клетках (результаты не показаны). Обработка мышей mAb к 1 и 2 не приводила к исчезновению данных клеток, поскольку не изменялось количество наблюдаемых в ответ на сенсибилизацию ан- 11011384 тигеном активированных Т-клеток в селезенке и лимфатических узлах в модели CHS. Кроме того, эффекторные клетки не подавлялись и функционально, поскольку продолжительная обработка сенсибилизированных антигеном мышей с помощью mAb к 1 и 2 (дни 10-16) не влияла на воспалительный ответ мышей, которым повторно наносили антиген на день 20 (результаты не показаны). Пример 4. Эффекторные ответы CHS снижены у мышей с недостаточностью 11. Для того, чтобы исключить вероятность того, что ингибиторное действие 11 в эффекторном ответе CHS, вызванной ФИТЦ, опосредовалось mAb, были проведены эксперименты на мышах дикого типа и мышах с недостаточностью 11-интегрина (фиг. 4). Ингибирование с помощью mAb эффекторной фазы у мышей дикого типа соответствовало предыдущим результатам с 56% ингибированием толщины уха, наблюдаемым с mAb к 1,56% - с mAb к 2 и 62% - с сочетанием mAb к 1 и 2. Эффекторная фаза CHS была значительно уменьшена у необработанных мышей с недостаточностью 11 по сравнению с необработанными мышами дикого типа (увеличение толщины уха на 30% против 71%, соответственно). Как и ожидалось, степень набухания уха у необработанных мышей с недостаточностью 11 равнялась степени набухания уха, наблюдаемой у мышей дикого типа, обработанных mAb к 1. Наконец, блокада 21 с помощьюmAb у мышей с недостаточностью 11 приводила лишь к слабому усилению ингибирования набухания уха, что соответствует результатам, наблюдавшимся у мышей дикого типа, обработанных сочетаниемmAb к 1 и 2. Пример 5. Для дальнейшего исключения возможности того, что ингибиторное действие mAb к интегринам,наблюдаемое в обеих моделях воспаления, DTH и CHS, обусловлено общим противовоспалительным действием, опосредуемым mAb к 1 и 2, исследовали эффект данных mAb на вызывающий раздражение дерматит. Для оценки вызывающего раздражение дерматита мышей красили 5 мкл 0,8% кротонового масла в ацетоне с обеих сторон каждого уха. Лечебные или контрольные антитела давали за 4 ч до нанесения раздражителя. Набухание уха измеряли через 24 ч, как описано выше, и сравнивали с толщиной уха до нанесения кротонового масла. Результаты выражали в виде процента увеличения исходной толщины ухаSEM, как описано выше. В качестве отрицательного контроля служили мыши, крашенные одним ацетоном (контроль на носитель). Было обнаружено, что через 24 ч после обработки кротоновым маслом толщина уха мышей значительно возрастает (48%) по сравнению с мышами, получавшими только носитель (ацетон). Токсичное набухание уха, вызванное кротоновым маслом, не изменялось существенно у мышей, предварительно обработанных mAb к 1 или 2, по сравнению с животными, обработанными ФСБ или контрольнымmAb (фиг. 5). Гистологическое исследование ушей, обработанных кротоновым маслом, показало отсутствие различий в количестве или типе инфильтровавшихся клеток или образования отека у мышей, обработанных mAb к 1 или 2, по сравнению с мышами, обработанными контрольным mAb, или мышами,обработанными ФСБ (результаты не показаны). Пример 6. Ингибирование артрита с помощью 11 и 21. Поскольку 11 активно экспрессируется на клетках, инфильтровавшихся в синовиальную жидкость больных артритом, заявители решили проверить, будут ли mAb к 1 или 2 оказывать ингибирующее действие в ранее описанной ускоренной модели артрита (Terato et al. 1992, J. Immunol. 148: 21032108; Terato et al. 1995, Autoimmunity. 22: 137-147). Наборы Arthrogen-CIA Antibody приобретали у Stratagene (La Jolla, CA) и артрит индуцировали с помощью широко принятого протокола (Terato et al. 1992, J. Immunol. 148: 2103-2108; Terato et al. 1995,Autoimmunity. 22: 137-147). Вкратце, артрит индуцировали с помощью в/бр введения смеси 4 mAb к коллагену типа II (по 1 мг каждого) в день 0 с последующим в/бр введением 50 мкг ЛПС в день 3. На протяжении последующих 3-4 дней у мышей развивалось набухание запястий, лодыжек и пальцев. Лечебное или контрольное mAb (250 мкг) вводили в/бр за 4 ч до инъекции mAb к коллагену в день 0 и еще раз за 4 ч до введения ЛПС в день 3 с последующим продолжением введения на каждый 3-й день на протяжении эксперимента. Начиная с дня 3, мышей оценивали на предмет развития артрита. Тяжесть артрита в каждой лапе оценивали с помощью четырехбальной системы. 0=норма; 1=легкое покраснение, слабое набухание лодыжки или запястья; 2=умеренное набухание лодыжки или запястья; 3=сильное набухание,включая некоторые пальцы, лодыжку и стопу; 4=максимальное воспаление. Тяжелый артрит у мышей линии Balb/c развивался в пределах 72 ч после введения ЛПС и сохранялся на протяжении более 3 недель. Ни изолированное введение mAb к коллагену, ни изолированное введение ЛПС не индуцировало артрит. У мышей, получавших контрольное mAb, наблюдался такой же тяжелый артрит, как и мышей, обработанных ФСБ (фиг. 6). Напротив, обработка одним mAb к 1 приводила к значительному снижению (78%) артрита, причем данное снижение сохранялось на протяжении всего эксперимента. Обработка одним mAb к 2 также оказывала благоприятное действие, выражающее- 12011384 ся в снижении показателя артрита на 32% по сравнению с мышами, обработанными контрольным mAb. Сочетание mAb к 1 и 2 давало степень ингибирования, сходную с наблюдавшейся при применении одного mAb к 1. Пример 7. Гистологический анализ эффекта обработки с помощью mAb к 1 и 2 на воспалительный клеточный инфильтрат. Последующий гистологический анализ индуцированного эритроцитами барана ответа DTH подтвердил способность обработки с помощью mAb к 1 и 2 модулировать вызванный воспалительный ответ (фиг. 7). В подушечке лапы мыши, сенсибилизированной эритроцитами барана, но не инъецированной повторно (фиг. 7, панель А), воспалительный клеточный инфильтрат практически не обнаруживался по сравнению с подушечкой лапы той же мыши, повторно инъецированной эритроцитами барана(фиг. 7, панель В). Обработка сенсибилизированных эритроцитами барана мышей с помощью mAb к 1 и 2, взятыми либо по отдельности, либо в сочетании, значительно снижала количество данных инфильтровавшихся клеток, обнаруживаемых в подушечках лап мышей, повторно инъецированных эритроцитами барана, по сравнению с мышами, обработанными контрольным mAb (фиг. 7, панель C-F). Более детальное изучение инфильтровавшихся клеток показало, что большинство клеток составляют нейтрофилы при небольшом количестве присутствующих моноцитов и лимфоцитов, и подтвердило, что обработка mAb к 1 и 2 значительно снижает количество данных клеток (фиг. 7, панель G-H). Пример 8. Иммуногистохимическое выявление экспрессирующих 1 клеток в воспалительном клеточном инфильтрате. Иммуногистохимию проводили для более точного определения природы инфильтровавшихся клеток и определения того, экспрессируют ли они связывающие коллаген интегрины (фиг. 8). Инфильтровавшиеся клетки из воспаленной подушечки лапы необработанной мыши исследовали на предмет экспрессии интегрина 11 и маркеров клеточной линии (фиг. 8). Было обнаружено, что интегрин 11 экспрессируется многими инфильтрованными лейкоцитами (фиг. 8 А). Для установления природы инфильтровавшихся клеток и распределения экспрессии 11 применяли двойную иммуногистохимию(фиг. 8 В). С помощью маркеров клеточных линий было обнаружено, что инфильтрат состоит, главным образом, из гранулоцит/моноцитов (Мас-1+), причем многие из данных клеток являются нейтрофилами(Grl+), наряду с меньшим количеством Т-лимфоцитов (CD3+) (фиг. 8 В). Экспрессия интегрина 11 была обнаружена среди всех трех подтипов клеток, причем 1 экспрессировался на подтипе Мас-1+-гранулоцит/моноцитов, подтипе Crl+-нейтрофилов и большинстве инфильтровавшихся CD3+ Т-лимфоцитов(фиг. 8 В). Детальный иммуногистохимический анализ показал, что, хотя обработка mAb к 1 и 2 вызывала снижение количества инфильтровавшихся клеток, изменений клеточного состава инфильтрата не наблюдалось (результаты не показаны). Иммуногистохимическая окраска mAb с ФИТЦ против хомячка подтвердила способность mAb к 1 и 2 локализоваться в воспаленной подушечке лапы (результаты не показаны). Пример 9. Подавление артрита с помощью mAb к 11 и 21 у мышей с недостаточностью 1. Поскольку 11 активно экспрессируется на клетках, инфильтрующихся в синовиальную жидкость больных артритом, заявители решили проверить, будут ли mAb к 1 или 2 оказывать ингибиторное действие в ранее описанной ускоренной модели артрита (Terato et al. 1992, J. Immunol. 148: 2103-2108;Terato et al. 1995, Autoimmunity 22: 137-147). Данная модель включает введение мышам смеси mAb к коллагену типа II с последующим введением ЛПС, в результате чего в течение последующих 3-7 дней развивается артрит. Мыши получали данное mAb на каждый 3-й день, начиная с дня 0, и развитие артрита оценивалось на каждый 3-й день. У всех мышей в течение 72 ч после инъекции ЛПС развивался тяжелый артрит, который сохранялся на протяжении более 3 недель. Введение mAb к коллагену или ЛПС по отдельности не индуцировало артрит. У мышей, получавших контрольное антитело, наблюдался артрит такой же степени тяжести, как и у мышей, получавших ФСБ (фиг. 9 А). Напротив, обработка одним mAb к 1 вызывала значительное снижение (79% и выше) артрита, причем этот эффект сохранялся на протяжении всего эксперимента. Обработка одним mAb к 2 также оказывала благоприятное действие, что выражалось в снижении показателя артрита на 37% по сравнению с мышами, обработанными контрольным mAb. Сочетание mAb к 1 и 2 вызывало ту же степень ингибирования, что и обработка однимmAb к 1. Снижение показателя артрита при обработке mAb к 1 наблюдалось у всех мышей и выгодно отличалось от наблюдавшегося при использовании нескольких других основанных на применении mAb способов лечения артрита, таких как применение растворимого Ig-гибридного белка к рецептору дляImmunol. 142: 326-337) (фиг. 9). В соответствии с основанными на mAb данными, свидетельствующими о важной роли 11 при артрите, у необработанных мышей с недостаточностью 1 наблюдалось значительное снижение показателя артрита по сравнению с мышами дикого типа (фиг. 9 В).- 13011384 Пример 10. Влияние обработки с помощью mAb к 1 на иммунопатологию пораженных артритом суставов. Суставы от мышей дикого типа с артритом (день 8), получавших либо контрольное mAb, либо mAb к 1, визуально и гистологически сравнивали с суставами нормальной необработанной мыши (фиг. 10). На визуальном уровне суставы мышей, обработанных контрольным mAb, проявляли покраснение и набухание всей стопы, включая пальцы, в то время как у мышей, обработанных mAb к 1, не наблюдались или наблюдались лишь слабые признаки воспаления суставов или пальцев. Гистологическое исследование показало серьезные изменения в пораженных артритом суставах, обработанных контрольным mAb, с обильной инфильтрацией в синовиальную ткань клеток воспаления, адгезией клеток к поверхности сустава и выраженным разрушением хряща, судя по потере протеогликанов (фиг. 10). В соответствии с предшествующими сообщениями (Terato et al. 1992, J. Immunol. 148: 2103-2108; Terato et al. 1995, Autoimmunity. 22: 137-147) большинство инфильтрующихся клеток при данной модели составляют нейтрофилы. Обработка мышей с помощью mAb к 1 резко снижала количество воспалительного инфильтрата и степень разрушения хряща (фиг. 10). Пример 11. Развитие артрита задерживается в отсутствие лимфоцитов, а ингибирование артрита под действиемmAb к 1 происходит в отсутствие лимфоцитов. Для определения того, какие типы клеток могли бы быть важны для модели артрита, индуцированного mAb к коллагену, заявители сравнили способность мышей дикого типа линии В 6-129 и мышей линии В 6-129 с недостаточностью RAG-1 к развитию артрита (фиг. 11). Генетическая делеция гена RAG-1 (гена 1, активирующего рекомбинацию) приводит к полной потере зрелых Т- и В-лимфоцитов (Mombaerts et al. 1992, Cell 68: 869-877). Артрит развивался как у мышей дикого типа, так и мышей с дефектом RAG-1, хотя кинетика индукции у дефектных по RAG-1 мышей была значительно более медленной (фиг. 11). Данные результаты позволяют предполагать, что,хотя лимфоциты участвуют в данной модели артрита, они не являются необходимыми для развития и прогрессии заболевания. В опубликованных сообщениях, в которых исследовали влияние недостаточности RAG-1 у мышей в других моделях артрита, также было обнаружено, что утрата Т- и В-лимфоцитов задерживает начало артрита (Plows et al. 1999, J. Immunol. 162: 1018-1023). Обработка как мышей дикого типа, так и мышей, дефектных по RAG-1, с помощью mAb к 1 полностью подавляла артрит (фиг. 11). Данные результаты показывают, что эффективность mAb к 1 в данной модели не зависит от присутствия лимфоцитов и что, как это предполагалось на основании предыдущих экспериментов (фиг. 9), эффективность mAb к 1 в предотвращении заболевания может быть обусловлена его действием на другие экспрессирующие 1 клетки, такие как макрофаги и нейтрофилы. Пример 12. Ингибирование артрита в зависимости от дозы mAb к 1. Основываясь на ярко выраженном действии обработки mAb к 1 в предотвращении артрита, заявители расширили данные исследования для включения анализа зависимости от дозы (фиг. 12). Вводили различные дозы mAb в/бр на каждый 3-й день, начиная с дня 0. В соответствии с предыдущими результатами доза 250 мкг mAb к 1 вызывала почти полное предотвращение артрита. Более низкая доза 100 мкгmAb к 1 была частично эффективной в предотвращении артрита в данной модели, тогда как более низкие дозы не оказывали заметного действия на показатель артрита (фиг. 12). Пример 13. Лечебная обработка mAb к 1 может снижать показатель артрита. Основываясь на эффективностиmAb к 1 в предотвращении артрита, заявители попытались лечить мышей, находящихся на пути к развитию заболевания. Артрит индуцировали у мышей с помощью введения смеси mAb к коллагену типа II в день 0 с последующим введением ЛПС в день 3. Затем мышей обрабатывали либо mAb к 1, либо растворимым гибридным Ig-белком к TNF-рецептору, начиная с дня 4. Прогрессия артрита полностью блокировалась у мышей, получавших, начиная с дня 4, mAb к 1, по сравнению с мышами, получавшими,начиная с дня 4, контрольное mAb хомячка (фиг. 13). Степень ингибирования, наблюдавшаяся при лечебном введении mAb к 1, была полной и была равной той, которая наблюдалась при профилактической обработке с помощью mAb к 1 (начинавшейся в день 0) (фиг. 13). Для сравнения обработка гибридным Ig-белком к TNF-рецептору, начиная с дня 4, приводила к снижению показателя артрита лишь на 60-70% по сравнению с контрольным гибридным Ig-белком (фиг. 13). Совместная обработка с помощьюmAb к 1 и гибридного Ig-белка к TNF-рецептору была эффективной при полном подавлении показателя артрита, что не удивительно, имея в виду полную эффективность обработки одним mAb к 1 в подавлении артрита. Вместе взятые, данные результаты показывают, что лечебная обработка с помощью mAb к 1 эффективна в снижении показателя артрита и выгодно отличается по сравнению с лечебной обработкой антагонистом TNF. Пример 14. Клонирование и мутагенез 1-I домена. Последовательности домена I интегрина 11 человека и крысы амплифицировали с полноразмерных- 14011384 кДНК (Kern, et al. (1994) J. Biol. Chem. 269, 22811-22816; Ignatius et al. (1990) J. Cell Biol. 111, 709-720) с помощью полимеразной цепной реакции (ПУР) (ПУР CORE Kit; Boehringer Mannheim, GmbH Германия) с применением либо человеческих специфических (5'-CAGGATCCGTCAGCCCCACATTTCAA-3' [прямого]; 5'-TCCTCGAGGGCTTGCAGGGCAAATAT-3' [обратного]) или крысиных специфических (5'CAGGATCCGTCAGTCCTACATTTCAA-3' [прямого]; 5'-TCCTCGAGCGCTTCCAAAGCGAATAT-3' [обратного]) праймеров. Полученные амплифицированные ПЦР-продукты очищали, лигировали в pGEX4t-i(Pharmacia) и применяли для трансформации компетентных клеток DH5 (Life Technologies). Резистентные к ампициллину колонии подвергали скринингу на предмет экспрессии гибридного белка глутатионS-трансфераза-домен I с Мг 45 кДа. Последовательности вставок плазмидной ДНК клонов, отобранных для последующей характеристики, были подтверждены с помощью секвенирования ДНК. Гибридный крыса/человек 1-I домен (RH) создавали (MORPH Mutagenesis kit; 5 prime-3 prime) путем замены остатков крысы G92, R93, Q94 и L97 (фиг. 14) на соответствующие остатки человека, V, Q,R и R, соответственно. Клоны, несущие домен RH I, идентифицировали по утрате диагностического сайта рестрикции для фермента Stu 1, а вставки подтверждали секвенированием ДНК. Аминокислотная последовательность человеческого 1-I домена показана на фиг. 15. Пример 15. Создание mAb, специфичных к 1-I домену. Моноклональные антитела зарекомендовали себя в качестве очень полезных зондов при изучении взаимоотношений между структурой и функцией субъединиц интегринов. Например, mAb активно применяли для изучения областей субъединицы 1, связанных с активированной конформацией (Qu, A., andLeahy, D.J. (1996) Structure 4, 931-942). Таким образом, для выявления потенциальных зондов на конформационные изменения 1-I домена заявители создали панель mAb к 1-I домену человека. Создание моноклональных антител к 1-I домену. Самок Robertsonian мышей (Jackson Labs) иммунизировали внутрибрюшинно (в/бр) 25 мкг очищенного 11 человека (Edwards et al. (1995) J. Biol. Chem. 270, 12635-12640), эмульгированного с полным адъювантом Фрейнда (Life Technologies). Их реиммунизировали трижды в/бр введением 25 мкг 11,эмульгированного в неполном адъюванте Фрейнда (Life Technologies). Мышь с наибольшим титром к 1-I домену реиммунизировали в/бр введением 100 мкг 11 за 3 дня до слияния и внутривенным введением 50 мкг 11 за 1 день до слияния. Клетки селезенки сливали с миеломными клетками FL653 в соотношении 1:6 и помещали в количестве по 100000 и 33000 на лунку в 96-луночные планшеты для культуры ткани. Супернатанты оценивали на предмет связывания интегрина 11 с помощью одноцветного FACS. Перед анализом FACS супернатанты инкубировали с нетрансфицированными клетками K562 для удаления IgG, которые связываются исключительно с субъединицей . Затем 3-5104 клеток K562, трансфицированных субъединицей 1 интегринов (K562-1) и суспендированных в буфере FACS (1% фетальная телячья сыворотка (FCS) в ФСБ, содержащем 0,5% NaN3), инкубировали с супернатантом в течение 45 мин при 4 С, промывали и инкубировали с антимышиным IgG, конъюгированным с фикоэритрином. После двукратной промывки буфером FACS клетки анализировали в Becton Dickinson Flow Cytometer. Супернатанты полученных гибридом подвергали скринингу на предмет связывания с 1-I доменом. Вкратце, лунки 96-луночного планшета (Nunc) покрывали в течение ночи при 4 С 50 мкл человеческого домена 1-I GST-гибрида, 30 мкг/мл в ФСБ. Планшеты промывали ФСБ, блокировали 1% БСА в ФСБ и инкубировали супернатант гибридом с 1-I доменом при комнатной температуре в течение 1 ч. После тщательной промывки ФСБ, содержащим 0,03% Твин 20, добавляли еще на час связанный с щелочной фосфатазой антимышиный IgG (Jackson ImmunoResearch). После окончательной промывки добавляли на 30 мин при комнатной температуре 1 мг/мл паранитрофенилфосфата (pNPP) в 0,1 М глицине, 1 мМ ZnCl2 и 1 мМ MgCl2 и считывали планшет при О.П. 405. Отобранные супернатанты тестировали на их способность ингибировать зависимую от K562-1 адгезию к коллагену IV. Клетки K562-1 метили с помощью 2 мМ 2',7'-(бис-2-карбоксиэтил-5 и 6)карбоксифлуоресцеинпентаацетоксиметилового эфира (BCECF; Molecular Probes) в DMEM, содержащей 0,25% БСА,при 37 С в течение 30 мин. Меченые клетки промывали буфером для связывания (10 мМ Hepes, pH 7,4; 0,9% NaCl и 2% глюкоза) и ресуспендировали в буфере для связывания плюс 5 мМ MgCl2 при конечной концентрации 1106 клеток/мл. 50 мкл супернатанта инкубировали с равным объемом 2105 клетокK562-1 в лунках 96-луночного планшета. Планшет затем центрифугировали и супернатанты удаляли. Клетки ресуспендировали в буфере для связывания, переносили в лунки покрытого коллагеном планшета и инкубировали в течение 1 ч при 37 С. После инкубации несвязавшиеся клетки удаляли трехкратной промывкой буфером для связывания. Прикрепленные клетки анализировали с помощью Cytofluor (Millipore). Заявители сначала идентифицировали 19 гибридом, супернатанты которых связывались с клеткамиK562 лейкоза человека, экспрессирующими интегрин 11 (K562-1), и с 1-I доменом. Иммуноглобулины каждой из данных гибридом очищали и тестировали на способность блокировать связывание с коллагеном IV либо K562-1, либо 1-I домена. MAb разделялись на два класса: те, которые блокируют,- 15011384 и те, которые не блокируют функцию 11. Например, в то время как mAb, продуцированные клонамиmAb AJH10 ингибировали зависимую от 1-I домена (фиг. 16 В) или K562-1 (фиг. 16 С) адгезию к коллагену IV. Секвенирование районов, определяющих комплиментарность. Для установления клонального происхождения данной панели mAb заявители амплифицировали с помощью ПЦР и секвенировали CDR 12 из 19 антител (результаты не показаны). 2 мкг мРНК, выделенной из 107 гибридомных клеток (FastTrack mRNA isolation kit, Invitrogen), подвергали обратной транскрипции (Ready-To-Go You Prime First Strand Kit, Pharmacia Biotech) с помощью 25 пМ каждого из следующих праймеров: тяжелой цепи VH1FOR-2 (Michishita et al. (1993) Cell 72, 857867); легкой цепи, VK4FOR, который определяет четыре раздельных олигонуклеотида (Kern et al. (1994)J. Biol. Chem. 269, 22811-22816). Для каждой гибридомы легкая и тяжелая цепи амплифицировались в четырех независимых реакциях ПЦР с применением различных сочетаний следующих олигонуклеотидов: 1) тяжелая цепь: VH1FR1K (Kamata et al. (1995) J. Biol. Chem. 270, 12531-12535), VH1BACK,VH1BACK (Baldwin et al. (1998) Structure 6, 923-935), VHfr1a, VHfr1b, VHfr1e, VHfr1f, VHfr1g (Ignatius et al.(QIAquick, Qiagen) и прямо секвенировали с применением различных перечисленных олигонуклеотидов в ABI 377 Sequencer. Последовательности из клонов, продуцирующих блокирующих функцию mAb, были, практически,идентичными на протяжении всех областей, определяющих комплиментарность (CDR), и вставочных рамочных областей, что позволяет предполагать клональное родство данных гибридом. Пример 16. Иммуноблоттинг и анализ FACS. Последовательности вариабельных областей неблокирующих антител заметно отличались от клонально родственного семейства последовательностей, обнаруженных в блокирующих антителах. Поскольку блокирующие антитела, по-видимому, происходят от единого клона, для последующей характеристики заявители выбрали один клон (AJH10). Иммуноблоттинг. Вырезанный из аорты овцы слой гладкомышечных клеток и клетки K562-1 экстрагировали 1% Тритоном Х-100 в 50 мМ Hepes, рН 7,5, 150 мМ NaCl, 10 мМ фенилметилсульфонилфторида (PMSF),20 мкг/мл апротина, 10 мкг/мл лейпептина, 10 мМ этилендиаминтетрауксусная кислота (EDTA). Образцы подвергали электрофорезу в 4-20% градиенте DCH-ПААГ и переносили электроблоттингом на нитроцеллюлозные мембраны. Отпечатки блокировали 5% сухим молоком в TBS; промывали TBS, содержащим 0,03% Твин-20, и инкубировали с антителами в блокирующем буфере, седержащем 0,05% NaN3, в течение 2 ч. После этого отпечатки промывали, как указано выше, инкубировали с пероксидазой хрена,конъюгированной с антимышиным IgG, в течение 1 ч, вновь промывали и затем обрабатывали реактивомECL (Amersham). Отпечатки затем экспонировали на фотопленку (Kodak) в течение 30-60 с и проявляли. Анализ с помощью иммуноблоттинга (фиг. 17 А) и FACS (фиг. 17 В) показывает, что AJH10 взаимодействует с интегрином 11 человека, кролика и овцы, но не крысы, что позволяет предполагать, что блокирующие mAb связываются с эволюционно консервативным, линейным эпитопом. НеблокирующиеmAb были неэффективны при иммуноблоттинге и не взаимодействовали с видами, отличными от человека. Пример 17. Связывание 1-I домена с коллагеном является зависимым от двухвалентных катионов.A. Очистка 1-I доменов. 1-I домены экспрессировали в Е. coli в виде GST-(глутатион-S-трансферазы)гибридных белков,содержащих сайт расщепления тромбином в месте соединения последовательностей. Осветленный супернатант из клеток, лизированных в ФСБ, наносили на колонку глутатион-сефарозы 4 В (Pharmacia),которую интенсивно промывали ФСБ. Гибридный белок домен 1-I GST элюировали 50 мМ Трис-HCl,рН 8,0, 5 мМ глутатиона (восстановленного). Для изучения денатурации домен I расщепляли тромбином в 50 мМ Трис, рН 7,5, и очищали от партнера GST по гибриду. Добавляли DTT до 2 мМ и образец наносили на колонку глутатион-сефарозы 4 В. Незадержанные фракции и промывочные фракции объединяли и наносили на колонку Q-сефарозы FF (Pharmacia). Домен 1-I элюировали 50 мМ Трис-HCl, рН 7,5, 10 мМ 2-меркаптоэтанола, 75 мМ NaCl. Очищенный 1-I домен обладал предсказанной массой (Lee et al. (1995)Structure 3, 1333-1340, 871 Да), по данным масс-спектрометрии с электрораспылением-ионизацией (ESIMS), двигался в виде одной полосы при электрофорезе в DCH-ПААГ, а белок элюировался в виде единственного пика соответствующего размера при исключающей по размеру хроматографии на колонке суперозы 6 FPLC (Pharmacia).B. Функциональный анализ. 96-Луночные планшеты покрывали в течение ночи при 4 С 1 мкг/мл коллагена IV (Sigma) или коллагена типа I (Collabortive Biomedical), промывали буфером с тритоном (0,1% Тритон Х-100; 1 мМMnCl2; 25 мМ Трис-HCl; 150 мМ NaCl) и блокировали 3% бычьим сывороточным альбумином (БСА) в 25 мМ Трис-HCl; 150 мМ NaCl (TBS). Последовательные разведения гибридного белка домена 1-I GST в TBS, содержащем 1 мМ MnCl2 и 3% БСА, инкубировали в покрытых планшетах при комнатной температуре в течение 1 ч и промывали буфером с Тритоном. Связанный 1-I домен определяли последовательным добавлением 10 мкг/мл биотинилированного поликлонального антитела к GST (Pharmacia);ExtrAvidin-пероксидазы хрена (Sigma), разведенного 1:3000 в TBS, содержащем 1 мМ MnCl2 и 3% БСА,и 1-Step ABTS (2,2'-азин-ди[3-этилбензтиазолинсульфоната]; Pierce). Планшет считывали при О.П. 405 на микропланшетном ридере (Molecular Devices). Результаты. 1-I Домены человека и крысы (95% идентичность с человеческим) экспрессировали в Е. coli в виде гибридных белков с GST и очищали на глутатион-сефарозе. Оба белка проверяли на предмет связывания с коллагеном I и IV с применением описанного ранее варианта анализа, основанного на ИФА (Qu, A., andLeahy, D.J. (1995) Proc. Natl. Acad. Sci. USA 92, 10277-10281). 1-I Домен человека связывает коллагенIV с большей эффективностью, чем коллаген I (фиг. 18 А). Антитело, специфичное в отношении 1-I домена, но не антитело, специфичное в отношении 2-I домена (фиг. 18 В), подавляло связывание с обоими лигандами (результаты для коллагена I не показаны). И Mn2+, и Mg2+ стимулировали связывание, а ЭДТА снижала связывание до фонового уровня (фиг. 18 С). Не было обнаружено заметных различий в связывании лиганда между 1-I доменами человека и крысы, что свидетельствует о том, что видовые различия в последовательностях не имеют функционального значения (результаты не показаны). Таким образом,для эффективного связывания лиганда 1-I доменом необходим, в частности, катион. Пример 18. Остатки катионзависимого эпитопа рядом с мотивом MIDAS. Для картирования эпитопа для mAb, блокирующих функцию 11, заявители использовали наблюдение, что AJH10 распознает последовательности 1-I домена человека, но не крысы. Последовательности человека и крысы различаются лишь по 12 аминокислотам, 4 из которых находятся в кассете из 6 аминокислот (а.к. 92-97, фиг. 14 А) рядом с существенным треонином (фиг. 14 А, а.к. 98) в мотивеMIDAS. Для проверки гипотезы, что 6 аминокислотных остатков, Val-Gln-Arg-Gly-Gly-Arg, составляют эпитоп для блокирующих mAb, заявители сконструировали гибридный домен I (RH), заменив остатки крысы G92, R93, Q94 и L97 на соответствующие остатки человека, V, Q, R и R, соответственно. AJH10,наряду со всеми mAb, блокирующими функцию, узнает гибридный домен I (RH; фиг. 14 В). Для ориентации данных остатков относительно домена MIDAS в третичной структуре 1-I домена заявители смоделировали 1-I домен с применением координат кристаллической структуры 2-I домена. Гомологичную модель 1-I домена человека строили, используя рентгеновскую кристаллическую структуру 2-I домена человека (Ward et al. (1989) Nature 341, 544-546). Модель строили с применением модуля гомологичного моделирования Insight II (версия 2.3.5; Biosym Technologies). ПрограммуCHARMM (Clackson et al. (1991) Nature 352, 624-628) применяли с установкой 22 всех параметров водорода с зависимой от расстояния диэлектрической константой двукратного расстояния между атомами. Заявители сначала прошли 1000 этапов наиболее быстрой минимизации со взвешенными по массе гармоническими ограничениями позиционирования по 1 ккал/(моль 2) для всех атомов 1-I домена. Минимизацию продолжали с помощью еще 1000 этапов грубого приближения и 5000 этапов Adopted-BasisNewton Raphson с ограничениями 0,1 ккал/(моль 2) для С- атомов домена 1-I для того, чтобы избежать существенных отклонений от рентгеновской кристаллической структуры a2-I домена. Последовательности 11 и 21 интегринов проявляют 51% идентичность без вставок и делеций,что позволяет предполагать, что общая структура двух доменов I должна быть сходной. Предсказывается, что сайт координации с металлом в 1-I домене и 2-I домене является одинаковым, а остатки, которые составляют эпитоп для блокирующих mAb, находятся в петле между спиралью 3 и спиралью 4,которая содержит треонин в мотиве MIDAS, важном для связывания катиона. Модель 1-I домена предсказывает, что амидный азот Q92 (фиг. 14 А) образует связь с карбонильной группой I33, остатком, соседствующим с S32. Таким образом, содержащая эпитоп петля может играть функциональную роль в стабилизации области MIDAS. Хотя представленное выше изобретение было описано несколько подробно с целью иллюстрации и примера для ясности понимания, для специалистов должно быть очевидно, что на практике будут осуществляться определенные изменения и модификации. Следовательно, описание и примеры не должны ограничивать объем изобретения, который описан прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения воспалительного заболевания, включающий введение индивидууму, страдающе- 17011384 му воспалительным заболеванием, антитела или его фрагмента, взаимодействующего с эпитопом, против"очень позднего антигена" (VLA-1), где указанный эпитоп содержит аминокислотные остатки 91-96, показанные на фиг. 15 (SEQ ID NO: 8). 2. Способ по п.1, в котором воспалительным заболеванием является атеросклероз. 3. Способ по п.1 или 2, в котором антитело является моноклональным. 4. Способ по любому из пп.1-3, в котором субъектом является человек. Перечень последовательностей
МПК / Метки
МПК: A61K 39/395, A61P 19/02, C07K 16/28, A61P 37/06
Метки: воспалительного, способ, заболевания, лечения
Код ссылки
<a href="https://eas.patents.su/30-11384-sposob-lecheniya-vospalitelnogo-zabolevaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения воспалительного заболевания</a>
Предыдущий патент: Вентильная электрическая машина с регулируемым возбуждением
Следующий патент: Антагонисты рецептора pgd2 для лечения воспалительных заболеваний
Случайный патент: Соединения, модулирующие активность toll-подобных рецепторов