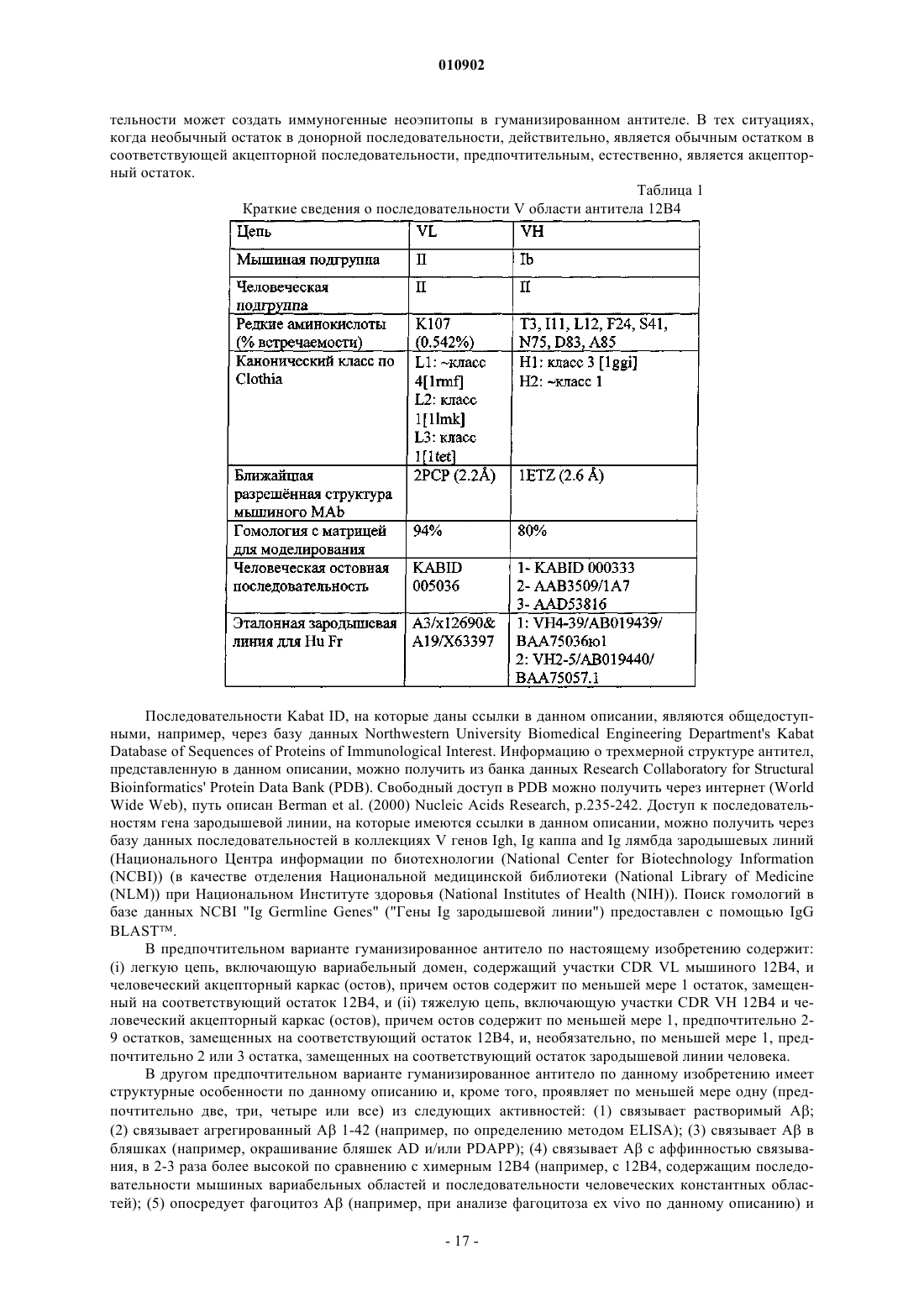
Гуманизированный иммуноглобулин, распознающий бета-амилоидный пептид, фармацевтическая композиция и способ получения иммуноглобулина
Формула / Реферат
1. Гуманизированный иммуноглобулин, который специфически связывается с бета-амилоидным пептидом (Ab), или его антигенсвязывающий фрагмент, содержащий:
(i) легкую цепь, содержащую три гипервариабельных участка (CDRs) последовательности вариабельной области легкой цепи иммуноглобулина 12В4, изображенной как SEQ ID NO: 2, и вариабельную каркасную область последовательности легкой цепи человеческого акцепторного иммуноглобулина; и
(ii) тяжелую цепь, содержащую по меньшей мере один гипервариабельный участок (CDR) последовательности вариабельной области тяжелой цепи иммуноглобулина 12В4, изображенной как SEQ ID NO: 4, и вариабельную каркасную область тяжелой цепи человеческого акцепторного иммуноглобулина.
2. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по п.1, у которого CDRs легкой цепи имеют следующие аминокислотные последовательности:
CDR1: Arg Ser Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu (остатки 24-39 SEQ ID NO: 2),
CDR2: Lys Val Ser Asn Arg Phe Ser (остатки 55-61 SEQ ID NO: 2),
CDR3: Phe Gln Gly Ser His Val Pro Leu Thr (остатки 94-102 SEQ ID NO: 2).
3. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по п.1 или 2, содержащий один, два или три CDRs тяжелой цепи, имеющих следующие аминокислотные последовательности:
CDR1: Thr Asn Gly Met Gly Val Ser (остатки 31-37 SEQ ID NO: 4),
CDR2: His Ile Tyr Trp Asp Glu Asp Lys Arg Tyr Asn Pro Ser Leu Lys Ser (остатки 52-67 SEQ ID NO: 4),
CDR3: Arg Arg Ile Ile Tyr Asp Val Glu Asp Tyr Phe Asp Tyr (остатки 100-112 SEQ ID NO: 4).
4. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, в котором по меньшей мере один аминокислотный остаток каркасной области легкой и тяжелой цепей замещен на соответствующий аминокислотный остаток последовательности вариабельной области легкой или тяжелой цепи антитела мыши 12В4, причем указанный остаток выбран из группы, состоящей из:
(а) остатка, способного взаимодействовать с антигеном;
(б) остатка, который непосредственно связывается нековалентной связью с антигеном;
(в) остатка, проксимального к сайту связывания с антигеном;
(г) остатка, прилегающего к CDR;
(д) остатка, взаимодействующего с CDR;
(е) остатка, расположенного в пределах 6 Е от остатка CDR;
(ж) канонического остатка;
(з) остатка из верньер-зоны;
(и) остатка межцепочечной укладки;
(к) редкого (минорного) остатка;
(л) остатка, способного влиять на конформацию или функцию вариабельной области легкой цепи, как показано анализом трехмерной модели вариабельной области; и
(м) остатка сайта гликозилирования на поверхности структурной модели.
5. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по п.4, в котором остаток, взаимодействующий с CDR, идентифицируют моделированием легкой цепи антитела мыши 12В4 на основе разрешенной структуры легкой цепи мышиного иммуноглобулина, последовательность которой по меньшей мере на 90% идентична последовательности легкой цепи 12В4.
6. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по п.4, в котором остаток, взаимодействующий с CDR, идентифицируют моделированием тяжелой цепи 12В4 на основе разрешенной структуры тяжелой цепи мышиного иммуноглобулина, последовательность которой по меньшей мере на 90% идентична последовательности тяжелой цепи 12В4.
7. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-3, в котором гипервариабельные участки (CDR) и остаток каркасного участка вариабельной области L2 (нумерация по Kabat) получены из легкой цепи моноклонального антитела 12В4.
8. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-3, в котором гипервариабельные участки (CDR) и остатки каркасного участка вариабельной области Н2, Н24, Н27, Н29, Н48, Н49, Н67, Н71 и Н78 (нумерация по Kabat) получены из тяжелой цепи моноклонального антитела 12В4.
9. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-3, в котором гипервариабельные участки (CDR) и остатки каркасного участка вариабельной области Н24, Н27, Н29 и Н71 (нумерация по Kabat) взяты из тяжелой цепи моноклонального антитела мыши 12В4.
10. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-3, в котором гипервариабельные участки (CDRs) и остатки каркасного участка вариабельной области Н24, Н27, Н29, Н48, Н71 и Н78 (нумерация по Kabat) получены из тяжелой цепи моноклонального антитела мыши 12В4.
11. Гуманизированный иммуноглобулин по любому из предшествующих пунктов, который содержит область Fc с измененной эффекторной функцией.
12. Фрагмент иммуноглобулина по любому из предшествующих пунктов, который представляет собой Fab-фрагмент.
13. Иммуноглобулин или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, в котором изотип тяжелой цепи представляет собой гамма 1.
14. Иммуноглобулин или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, который: (i) связывается с растворимым бета-амилоидным пептидом (Ab) и агрегированным бета-амилоидным пептидом (Ab); (ii) связывается с эпитопом в остатках 3-7 бета-амилоидного пептида (Ab); (iii) опосредует фагоцитоз бета-амилоидного пептида (Ab); (iv) проникает через гематоэнцефалический барьер в организме субъекта; (v) уменьшает содержание (нагрузку) бляшек бета-амилоидного пептида (Ab).
15. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, в котором вариабельная область легкой цепи представлена остатками 1-112 SEQ ID NO: 6.
16. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из предшествующих пунктов, в котором вариабельная область тяжелой цепи является такой, как представлена остатками 1-123 SEQ ID NO: 4, SEQ ID NO: 8, остатками 1-123 SEQ ID NO: 10 или остатками 1-123 SEQ ID NO: 12.
17. Гумманизированный иммуноглобулин по п.15 или 16, который содержит по меньшей мере одну консервативную аминокислотную замену, при этом сохраняет способность непосредственно специфически связываться с бета-амилоидным пептидом (Ab) с аффинностью связывания по меньшей мере 107 М-1.
18. Гуманизированный иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-17, в котором по меньшей мере один остаток каркасной области легкой или тяжелой цепи замещен соответствующим аминокислотным остатком из последовательности вариабельной области легкой или тяжелой цепи антитела мыши 12В4.
19. Фармацевтическая композиция, содержащая иммуноглобулин или его антигенсвязывающий фрагмент по любому из пп.1-17 и фармацевтический носитель.
20. Молекула выделенной нуклеиновой кислоты, выбранная из группы, состоящей из: (i) молекулы нуклеиновой кислоты, кодирующей тяжелую цепь гуманизированного иммуноглобулина или его антигенсвязывающего фрагмента по любому из пп.1-18; (ii) молекулы нуклеиновой кислоты, кодирующей легкую цепь гуманизированного иммуноглобулина или антигенсвязывающего фрагмента по любому из пп.1-18; (iii) молекулы нуклеиновой кислоты, кодирующей иммуноглобулин или антигенсвязывающий фрагмент по любому из пп.1-18; или (iv) молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 3, SEQ ID NO: 7, SEQ ID NO: 9 или SEQ ID NO: 11.
21. Вектор, содержащий молекулу нуклеиновой кислоты по п.20.
22. Клетка-хозяин, содержащая молекулу нуклеиновой кислоты по п.20.
23. Способ получения иммуноглобулина или его антигенсвязывающего фрагмента по любому из пп.1-18, заключающийся в культивировании клетки-хозяина по п.22 в условиях, обеспечивающих продуцирование иммуноглобулина или его фрагмента, и выделеэшш иммуноглобулина или его фрагмента из клетки-хозяина или культуральной среды.
Текст
010902 Предпосылки создания изобретения Болезнь Альцгеймера (AD) представляет собой прогрессирующее заболевание, приводящее к старческой деменции. См., в целом, Selkoe, TINS 16:403; Hardy et al., международная заявка WO 92/13069;Selkoe, J. Neuropathol. Exp. Neurol. 53: 438 (1994); Duff et al., Nature 373: 476 (1995); Games et al., Nature 373: 523 (1995). Вообще говоря, это заболевание делится на два типа: с поздним (позже 65 лет) началом и с ранним началом, которое развивается в пресенильный период, т.е. между 35 и 60 годами. При любом типе заболевания патология одинакова, но аномалии обычно более тяжелы и обширны в случаях, начинающихся в более раннем возрасте. Заболевание характеризуют по меньшей мере два типа поражения мозга: нейрофибриллярные клубки и сенильные бляшки. Нейрофибриллярные клубки представляют собой внутриклеточные отложения связывающегося с микротрубочками тау-белка, состоящего из двух нитей, попарно скрученных друг с другом. Сенильные бляшки (например, амилоидные бляшки) представляют собой участки дезорганизованного нейропиля до 150 мкм с внеклеточными амилоидными отложениями в центре, видимые под микроскопом при исследовании срезов тканей мозга. Аккумуляция амилоидных бляшек в тканях мозга связано также с синдромом Дауна и другими когнитивными нарушениями. Основным составляющим бляшек является белок, называемый A- или -амилоидный белок. Aбелок представляет собой состоящий из 39-43 аминокислот размером 4 кДа внутренний фрагмент более протяженного трансмембранного гликопротеина, называемого белком-предшественником амилоидного белка (АРР). Вследствие протеолитического процессинга АРР при участии различных секретаз A первоначально обнаружен как в короткой форме протяженностью 40 аминокислот, так и в длинной форме протяженностью от 42-43 аминокислот. Часть гидрофобного трансмембранного домена АРР обнаружена на карбоксильном конце A, и она может быть ответственна за способность A объединяться в виде бляшек, в особенности в случае длинной формы. Накопление амилоидных бляшек в мозгу, в конечном счете, приводит к некрозу нейронных клеток. Физические симптомы, обусловленные такого рода деградацией нервной системы, характеризуют болезнь Альцгеймера. Некоторые мутации АРР белка коррелируют с наличием болезни Альцгеймера. См., например,Goate et al., Nature 349: 704 (1991) (валин 717 в изолейцин); Chartier Harlan et al., Nature 353: 844 (1991) (валин 717 в глицин); Murrell et al., Science 254: 97 (1991) (валин 717 в фенилаланин); Mullan et al., Nature Genet. 1: 345 (1992) (двойная мутация с заменой пары лизин 595-метионин 596 на пару аспарагин 595-лейцин 596). Полагают, что такие мутации вызывают болезнь Альцгеймера за счет повышения или изменения процессинга АРР в A, в частности процессинга АРР в повышенные количества длинной формы A (т.е. A142 и A1-43). Полагают, что мутации в других генах, таких как гены пресенилинов, PS1 и PS2, опосредованно влияют на процессинг АРР, при котором образуются повышенные количества длинной формы A(см. Hardy, TINS 20: 154 (1997). Для определения значения амилоидных бляшек для болезни Альцгеймера успешно применялись мышиные модели (Games et al., см. выше, Johnson-Wood et al., Proc. Natl. Acad. Sci. USA 94: 1550 (1997. В частности, когда трансгенным мышам PDAPP (клетки которых экспрессируют мутантную форму человеческого АРР и у которых болезнь Альцгеймера развивается в раннем возрасте) инъецируют длинную форму A, у них наблюдается как замедление развития болезни Альцгеймера, так и повышение титра антител к белку A (Scheme et al., Nature 400, 173 (1999. Вышеописанные наблюдения показывают,что белок A, в частности его длинная форма, является элементом, вызывающим болезнь Альцгеймера. Следовательно, существует необходимость в новых лекарственных средствах и реагентах для лечения болезни Альцгеймера, в частности в лекарственных средствах и реагентах, способных вызывать терапевтический эффект при введении в физиологических (например, нетоксических) дозах. Сущность изобретения Настоящее изобретение включает новые иммунологические реагенты, в частности терапевтические антительные реагенты для предупреждения и лечения заболевания с амилоидной (амилоидогенной) этиологией (например, болезни Альцгеймера). В основе данного изобретения, по меньшей мере, частично лежит идентификация и характеристика моноклонального антитела, которое специфически связывается с пептидом A и эффективно уменьшает "бляшечную нагрузку" и/или нейритную дистрофию, обусловленные амилоидными нарушениями. Структурный и функциональный анализ этого антитела позволяет создать различные гуманизированные антитела для профилактических и/или терапевтических целей. В частности, данное изобретение охватывает гуманизацию вариабельных областей этого антитела и,соответственно, включает цепи гуманизированного иммуноглобулина или антитела, интактные гуманизированные иммуноглобулины или антитела и функциональные фрагменты иммуноглобулина или антитела, в особенности антигенсвязывающие фрагменты характеристичных (заявляемых) антител. Основный объектом является гуманизированный иммуноглобулин, который специфически связывается с бета-амилоидным пептидом (A), или его антигенсвязывающий фрагмент, содержащий:(i) легкую цепь, содержащую три гипервариабельных участка (CDRs) последовательности вариабельной области легкой цепи иммуноглобулина 12 В 4, изображенной как SEQ ID NO: 2, и вариабельную каркасную область последовательности легкой цепи человеческого акцепторного иммуноглобулина; и(ii) тяжелую цепь, содержащую по меньшей мере один гипервариабельный участок (CDR) последовательности вариабельной области тяжелой цепи иммуноглобулина 12 В 4, изображенной как SEQ ID NO: 4,и вариабельную каркасную область тяжелой цепи человеческого акцепторного иммуноглобулина. Предлагается также способ, фармацевтическая композиция, содержащая указанный иммуноглобулин. Краткое описание фигур На фиг. 1 А-В показан сравнительный анализ первичной структуры аминокислотных последовательностей легкой цепи антител: мышиного 12 В 4 (зрелый пептид, SEQ ID NO: 2), гуманизированногоKabat ID 005036 (зрелый пептид, SEQ ID NO: 32) и зародышевой линии А 19 (Х 63397, зрелый пептид,SEQ ID NO: 30). Участки CDR показаны стрелками и обведены. Единичная обратная мутация остаток человеческой последовательностиостаток мышиной последовательности показан звездочкой. Значение закрашенных остатков представлено в подписях к фигурам. Нумерация идет от первого метионина,не нумерация по Kabat. На фиг. 2 А-В показан сравнительный анализ первичной структуры аминокислотных последовательностей тяжелой цепи антител: мышиного 12 В 4 (зрелый пептид, SEQ ID NO: 4), Kabat ID 000333(зрелый пептид, SEQ ID NO: 34) и зародышевой линии антител VH4-39 и VH4-61 (зрелый пептид, SEQID NOs: 38 и 36, соответственно). Пояснения те же, что и для фиг. 1. Нумерация идет от первого метионина, не нумерация по Kabat. На фиг. 3 А-D изображены нуклеотидная и аминокислотная последовательность гуманизированного 12B4VLv1 в сравнении с химерным 12B4VL (последовательность вариабельной области идентична последовательности вариабельной области мышиной 12B4VL, SEQ ID NOs: 1 и 2, соответственно); последовательности зародышевой линии (SEQ ID NOs: 29 и 30, соответственно) и Kabid ID 005036 (SEQ IDNOs: 31 и 32, соответственно); На фиг. 4A-D изображены нуклеотидная и аминокислотная последовательность гуманизированного 12B4VHv1 в сравнении с химерным 12B4VH (последовательность вариабельной области идентична последовательности вариабельной области мышиной 12B4VH, SEQ ID NOs: 3 и 4, соответственно); KabatID 000333 (SEQ ID NOs: 33 и 34, соответственно) и последовательности зародышевой линии VH4-61(SEQ ID NOs: 35 и 36, соответственно). На фиг. 5 графически показаны результаты двух независимых экспериментов по определению методом ELISA связывания химерного 12 В 4, 3D6 и химерного 3D6 с A (панели А и В, соответственно). На фиг. 6 графически показаны полученные методом конкурентного ELISA связывания результаты,подтверждающие функциональную активность 12 В 4 и химерного 12 В 4 по сравнению с 3D6 и химерным 3D6 и 10D5. Химерный 12 В 4 (незакрашенные треугольники) конкурирует с равной активностью со своей небиотинилированной мышиной копией (перевернутые незакрашенные треугольники) за связывание биотинилированного мышиного 12 В 4 с A 1-42. На фиг. 7 графически изображены результаты ex vivo анализа фагоцитов, в котором изучается способность химерного 12 В 4, 3D6 и человеческого IgG1 опосредовать усвоение микроглией белка A на участках PDAPP мозга. На фиг. 8 графически изображены результаты двух независимых ex vivo анализов фагоцитов (панели А и В, соответственно), в которых изучается способность химерного 12 В 4, гуманизированного 3D6 и человеческого IgG1 опосредовать усвоение микроглией белка A на участках AD мозга. На фиг. 9 схематически показана репрезентация PCR-опосредованной сборки гуманизированного 12 В 4, вариант 1. На фиг. 9 А показана сборка участков VL. На фиг. 9 В показана сборка участков VH. Подробное описание изобретения Настоящее изобретение охватывает новые иммунологические реагенты и способы предупреждения или лечения болезни Альцгеймера или других амилоидогенных заболеваний. Основой данного изобретения, по меньшей мере, частично является определение характеристик моноклонального иммуноглобулина, 12 В 4, эффективно связывающего бета-амилоидный белок (A) (например, связывающего растворимый и/или агрегированный A), опосредующего фагоцитоз (например, агрегированного A), снижающего содержание (нагрузку) бляшек и/или уменьшающего нейритную дистрофию (например, у больного). Дополнительным основанием для данного изобретения являются определение и структурная характеристика первичной и вторичной структуры вариабельной легкой и тяжелой цепи иммуноглобулина 12 В 4 и идентификация остатков, важных для активности и иммуногенности. Изобретением охватываются иммуноглобулины, которые включают вариабельную легкую и/или вариабельную тяжелую цепь моноклонального иммуноглобулина 12 В 4, представленного в данном описании, в том числе предпочтительные иммуноглобулины, например терапевтические иммуноглобулины,которые включают гуманизированную вариабельную легкую и/или гуманизированную вариабельную тяжелую цепь. Предпочтительные вариабельная легкая и/или вариабельная тяжелая цепи включают гипервариабельный участок (CDR) моноклонального иммуноглобулина (например, иммуноглобулина донора) и вариабельные области каркаса, в основном (главным образом), человеческого акцепторного иммуноглобулина. Выражение "в основном (главным образом), человеческого акцепторного иммуноглобулина" обозначает, что основную часть или ключевые остатки скелета берут из человеческой акцепторной-2 010902 последовательности, допуская, однако, замену остатков в определенных положениях на остатки, выбранные с целью увеличения активности гуманизированного иммуноглобулина (например, изменения активности таким образом, чтобы наиболее точно имитировать активность донорного иммуноглобулина), или с целью понижения иммуногенности гуманизированного иммуноглобулина. В одном варианте изобретение включает легкую или тяжелую цепь гуманизированного иммуноглобулина, которая содержит гипервариабельный участок (CDR) вариабельной области 12 В 4 (т.е. содержит один, два или три CDR-участка последовательности вариабельной области легкой цепи, изображенной как SEQ ID NO: 2, или содержит один, два или три CDR-участка последовательности вариабельной области тяжелой цепи, изображенной как SEQ ID NO: 4) и включает вариабельную область скелета последовательности легкой или тяжелой цепи, главным образом, человеческого акцепторного иммуноглобулина, при условии, что по меньшей мере один остаток фрагмента скелета претерпевает обратную мутацию в соответствующий остаток мышиной последовательности, при этом указанная обратная мутация практически не влияет на способность цепи управлять А-связыванием. В другом варианте данное изобретение включает легкую или тяжелую цепь гуманизированного иммуноглобулина, которая содержит гипервариабельные участки (CDR) вариабельной области 12 В 4(например, содержит один, два или три CDR-участка последовательности вариабельной области легкой цепи, изображенной как SEQ ID NO: 2, и/или содержит один, два или три CDR-участка последовательности вариабельной области тяжелой цепи, изображенной как SEQ ID NO: 4) и включает вариабельную область скелета последовательности легкой или тяжелой цепи, главным образом, человеческого акцепторного иммуноглобулина, при условии, что по меньшей мере один остаток фрагмента скелета замещается на соответствующий аминокислотный остаток последовательности вариабельной области легкой или тяжелой цепи мышиного 12 В 4, при этом фрагмент каркаса выбирают из группы, состоящей из: (а) остатка, который непосредственно связывается нековалентной связью с антигеном; (б) остатка, прилегающего к CDR; (в) остатка, взаимодействующего с CDR (например, идентифицированного путем моделирования легкой и тяжелой цепи на разрешенной структуре гомологичной цепи известного иммуноглобулина); и (г) остатка, находящегося на границе раздела (интерфейс) VL-VH. В другом варианте данное изобретение включает легкую или тяжелую цепь гуманизированного иммуноглобулина, которая содержит участки CDR вариабельной области 12 В 4 и вариабельные области каркаса последовательности легкой или тяжелой цепи человеческого акцепторного иммуноглобулина при условии, что по меньшей мере один остаток каркаса заменяется на соответствующий аминокислотный остаток последовательности вариабельной области легкой или тяжелой цепи мышиного 12 В 4, где остаток каркаса представляет собой остаток (фрагмент), способный влиять на конформацию вариабельной области легкой цепи или функционировать как фрагмент, идентифицированный с помощью анализа трехмерной модели вариабельной области, например фрагмент (остаток), способный взаимодействовать с антигеном, остаток, проксимальный к сайту связывания антигена, остаток, способный взаимодействовать с CDR, остаток, прилегающий к CDR, остаток в пределах 6 от остатка CDR, твердо установленный(канонический) остаток, остаток в верньер-зоне, остаток межцепной упаковки, необычный остаток или остаток сайта гликозилирования на поверхности структурной модели. В другом варианте изобретение включает, помимо замен, описанных выше, замену по меньшей мере одного минорного остатка человеческого каркаса. Например, минорный остаток может быть заменен на аминокислотный остаток, общий для последовательностей человеческой вариабельной цепи в этом положении. Или же минорный остаток может быть заменен на соответствующий аминокислотный остаток гомологичной последовательности вариабельной цепи зародышевой линии. В другом варианте данное изобретение включает гуманизированный иммуноглобулин, который содержит легкую цепь и тяжелую цепь, описанные выше, или антигенсвязывающий фрагмент указанного иммуноглобулина. В приведенном в виде примера варианте изобретения гуманизированный иммуноглобулин связывается (например, специфически связывается) с бета-амилоидным пептидом (A) с аффинностью связывания по меньшей мере 107, 108 или 109 М-1. В другом варианте изобретения иммуноглобулин или антигенсвязывающий фрагмент включает тяжелую цепь, имеющую изотип 1. В другом варианте изобретения иммуноглобулин или антигенсвязывающий фрагмент связывается (например, специфически связывается) как с растворимым бета-амилоидным белком (A), так и с агрегированным A. В другом варианте изобретения иммуноглобулин или антигенсвязывающий фрагмент опосредует фагоцитоз (например, индуцирует фагоцитоз) бета-амилоидного белка (A). Еще в одном варианте изобретения иммуноглобулин или антигенсвязывающий фрагмент проникает через гематоэнцефалический барьер субъекта. Еще в одном варианте изобретения иммуноглобулин или антигенсвязывающий фрагмент уменьшает как содержание (нагрузку) бета-амилоидного белка (A), так и нейритную дистрофию у субъекта. В другом варианте изобретение включает химерные иммуноглобулины, содержащие вариабельные области 12 В 4 (например, последовательности вариабельной области, изображенные как SEQ ID NO: 2 или SEQ ID NO: 4). Еще в одном варианте изобретения иммуноглобулин или его антигенсвязывающий фрагмент дополнительно включает константные области IgG1. Иммуноглобулины, представленные в данном описании, особенно пригодны для использования в-3 010902 терапевтических методах, имеющих целью предупреждение или лечение амилоидогенных заболеваний. В одном варианте настоящее изобретение охватывает способ предупреждения или лечения амилоидогенного заболевания (например, болезни Альцгеймера), который включает введение больному эффективной дозы представленного в данном описании гуманизированного иммуноглобулина. В другом варианте изобретение охватывает фармацевтические композиции, которые включают гуманизированный иммуноглобулин по данному описанию и фармацевтический носитель. Кроме того, охватываются молекулы выделенных нуклеиновых кислот, векторы и клетки-хозяева для продуцирования иммуноглобулинов или фрагментов иммуноглобулинов или цепей по данному описанию, а также способы продуцирования указанных иммуноглобулинов, фрагментов иммуноглобулинов или цепей иммуноглобулинов. Настоящее изобретение включает далее способ идентификации остатков 12 В 4, подлежащих замене при продуцировании гуманизированного 12 В 4 иммуноглобулина, соответственно. Например, способ идентификации остатков вариабельной области скелета, подлежащих замене, включает моделирование трехмерной структуры вариабельной области 12 В 4 на разрешенной структуре гомологичного иммуноглобулина и анализ указанной модели с целью определения остатков, способных влиять на конформацию или функцию вариабельной области иммуноглобулина 12 В 4, чтобы идентифицировать остатки,подлежащие замене. Данное изобретение далее включает применение последовательности вариабельной области, изображенной как SEQ ID NO: 2 или SEQ ID NO: 4, или какой-либо ее части для создания трехмерного изображения иммуноглобулина 12 В 4, цепи иммуноглобулина 12 В 4 или ее домена. Далее данное изобретение охватывает иммуноглобулины с измененной эффекторной функцией, такой как способность связываться с эффекторными молекулами, например с комплементом или рецептором рецепторной клетки. В частности, иммуноглобулин по данному изобретению содержит измененную константную область, например Fc область, при этом по меньшей мере один аминокислотный остаток в области Fc замещен другим остатком или боковой цепью. В одном варианте изобретения модифицированный иммуноглобулин является представителем класса IgG, содержит такую замену по меньшей мере одного аминокислотного остатка в Fc области, что иммуноглобулин имеет измененную эффекторную функцию, например, по сравнению с немодифированным иммуноглобулином. В конкретных вариантах изобретения иммуноглобулин по изобретению имеет эффекторную функцию, измененную таким образом, что он становится менее иммуногенным (например, не вызывает нежелательной активности эффекторных клеток, лизиса или связывания комплемента), обладает свойствами повышенного клиренса амилоида и/или имеет желательный период полужизни. Для лучшего понимания данного изобретения полезно перед его описанием дать определения некоторых терминов, используемых далее по всему описанию. Термин "иммуноглобулин" или "антитело" (применяемые в данном описании как синонимы) относятся к белку, имеющему основную четырехцепную полипептидную структуру, состоящую из двух тяжелых и двух легких цепей, причем указанные цепи стабилизированы, например, межцепными дисульфидными связями, которые способны специфически связываться с антигеном. Термин "одноцепочечный иммуноглобулин" или "одноцепочечное антитело" (применяемые как синонимы в данном описании) относится к белку, имеющему двухцепочечную полипептидную структуру, состоящую из тяжелой и легкой цепей, причем указанные цепи стабилизированы, например, межцепными пептидными линкерами, который обладает способностью специфически связываться с антигеном. Термин "домен" относится к глобулярной области (участку) тяжелой или легкой цепи полипептида, содержащей пептидные петли (например, содержащие 3-4-пептидные петли), стабилизированные, например, с помощью -складки и/или внутрицепной дисульфидной связи. Кроме того, домены в данном описании определяются как "константные" или "вариабельные" в зависимости от относительного отсутствия изменения внутри доменов различных представителей класса в случае "константной" области или от значительного изменения внутри областей различных представителей класса в случае "вариабельной "области. В технике часто, вместо термина "домены" антитела или полипептида, используют в качестве синонима термин "области" антитела или полипептида. Понятие "константные" домены легкой цепи антитела можно выразить взаимозаменяемо как "константные области легкой цепи", "константные домены легкой цепи", "CL"-области или"CL"-домены. Понятие "константные" области тяжелой цепи выражается взаимозаменяемо как "константные области тяжелой цепи", "константные домены тяжелой цепи", "СН"-области или "СН"-домены. Понятие "вариабельные" области легкой цепи антитела выражается взаимозаменяемо как "вариабельные области легкой цепи", "вариабельные домены легкой цепи", "VL"-области или "VL"-домены. Понятие"вариабельные" области тяжелой цепи антитела выражается взаимозаменяемо как "вариабельные области тяжелой цепи", "вариабельные домены тяжелой цепи", "VH"-области или "VH"-домены. Термин "область" может также относиться к части или участку цепи антитела и/или к домену цепи антитела (например, части или участку тяжелой или легкой цепи или к части или участку константного или вариабельного домена по определению в данном описании), а также к более дискретным частям или участкам указанных цепей или доменов. Например, легкие и тяжелые цепи или вариабельные домены легкой и тяжелой цепи включают "гипервариабельные участки", или "CDR", вкрапленные в "остовные(каркасные, скелетные) области", или "FR", по определению в данном описании. Иммуноглобулины или антитела могут существовать в мономерной или полимерной форме, напри-4 010902 мер антитела IgM, которые существуют в пентамерной форме, и/или антитела IgA, которые существуют в мономерной, димерной или мультимерной форме. Термин "фрагмент" относится к части или участку антитела или цепи антитела, содержащим меньшее число аминокислотных остатков по сравнению с интактным или полным антителом или интактной или полной цепью антитела. Фрагменты можно получать химической или ферментативной обработкой интактного или полного антитела или цепи антитела. Фрагменты можно также получать методами рекомбинантной ДНК. Примеры фрагментов включают фрагменты Fab, Fab', F(ab')2, Fabc и/или Fv. Термин "антигенсвязывающий фрагмент" относится к полипептидному фрагменту иммуноглобулина или антитела, который связывается с антигеном или конкурирует с интактным антителом (т.е. с интактным антителом, из которого они образованы) за связывание с антигеном (специфическое связывание). Термин "конформация" относится к третичной структуре белка или полипептида (например, антитела, цепи антитела, его области или участку). Например, выражение "конформация легкой (или тяжелой) цепи" относится к третичной структуре вариабельной области легкой (или тяжелой) цепи, а выражение "конформация антитела" или "конформация фрагмента антитела" относится к третичной структуре антитела или его фрагмента."Специфическое связывание"антитела означает, что антитело проявляет заметное сродство к антигену или предпочтительному эпитопу и предпочтительно не проявляет ощутимой перекрестной реактивности. "Заметное, ощутимое" или предпочтительное связывание включает связывание с величиной аффинности по меньшей мере 106, 107, 108, 109 или 1010 М-1. Более предпочтительной является аффинность выше 107 М-1, предпочтительно выше 108 М-1. Предполагается, что значения, промежуточные между значениями, представленными выше, также входят в объем настоящего изобретения, и предпочтительная аффинность связывания может быть указана в виде интервала величин аффинности, например 106-1010 М-1,предпочтительно 107-1010 М-1, более предпочтительно, 108-1010 М-1. Антитело, которое "не проявляет заметной перекрестной реактивности", представляет собой такое антитело, которое не связывается ощутимо (заметно, в значительной степени) с нежелательным организмом (например, нежелательным белковым телом). Например, антитело, которое специфически связывается с A, в заметной степени (ощутимо) связывает A, но не реагирует в значительной степени с не-A-белками или пептидами (например, с не-A-белками или пептидами, входящими в состав бляшек). Антитело против предпочтительного эпитопа не будет, например, в заметной степени перекрестно реагировать с отдаленными эпитопами того же белка или пептида. Специфическое связывание можно определять любыми признанными в технике способами определения такого связывания. Предпочтительно специфическое связывание определяют методом Scatchard (Скэтчарда) и/или методами конкурентного связывания. Связывающие фрагменты получают методами рекомбинантной ДНК или ферментативным или химическим расщеплением интактных иммуноглобулинов. Связывающие фрагменты включают Fab, Fab',F(ab')2, Fabc, Fv, одиночные цепи и одноцепочечные антитела. Понятно, что иммуноглобулин или антитело, иные, нежели "биспецифические" или "бифункциональные" иммуноглобулины или антитела, имеют каждый из своих идентичных сайтов связывания. "Биспецифическое" или "бифункциональное антитело" представляет собой искусственное гибридное антитело, имеющее две различные пары тяжелой/легкой цепей и два различных сайта связывания. Биспецифические антитела можно получать различными способами, включая слияние гибридом или сшивание фрагментов Fab'. См., например, SongsivilaiLachmann, Clin. Exp. Immunol. 79: 315- 321 (1990); Kostelny et al., J. Immunol. 148, 1547-1553 (1992). Термин "гуманизированный иммуноглобулин" или "гуманизированное антитело" относится к иммуноглобулину или антителу, которое содержит по меньшей мере одну гуманизированную цепь иммуноглобулина или антитела (т.е. по меньшей мере одну гуманизированную легкую или тяжелую цепь). Термин "гуманизированная цепь иммуноглобулина" или "гуманизированная цепь антитела" (т.е. "гуманизированная легкая цепь иммуноглобулина" или "гуманизированная тяжелая цепь иммуноглобулина") относится к цепи иммуноглобулина или антитела (т.е. к легкой или тяжелой цепи, соответственно), содержащей вариабельную область, которая включает вариабельный остовной участок, главным образом,человеческого иммуноглобулина или антитела и гипервариабельные участки (CDR) (например по меньшей мере один CDR, предпочтительно два CDR, более предпочтительно три CDR), главным образом,нечеловеческого иммуноглобулина или антитела и дополнительно включает константные области (например по меньшей мере одну константную область или ее часть в случае легкой цепи и предпочтительно три константные области в случае тяжелой цепи). Термин "гуманизированная вариабельная область (участок)" (например, "гуманизированная вариабельная область легкой цепи" или "гуманизированная вариабельная область тяжелой цепи") относится к вариабельной области, которая включает вариабельную остовную область, главным образом, человеческого иммуноглобулина или антитела и гипервариабельные участки (CDR), главным образом, нечеловеческого иммуноглобулина или антитела. Выражение "главным образом (в основном, практически, в значительной степени), человеческого иммуноглобулина или антитела" или "главным образом (и т.д.), человеческий" означает, что при сравнении первичной структуры с аминокислотной последовательностью человеческого иммуноглобулина или-5 010902 антитела идентичность области с последовательностью человеческой остовной или константной области составляет по меньшей мере 80-90%, предпочтительно 90-95%, более предпочтительно 95-99% (т.е. локальная идентичность последовательности), допуская, например, консервативные замены, замены согласованной последовательности, замены зародышевой линии, обратные мутации и т.п. Введение консервативных замен, замен согласованной последовательности, замен зародышевой линии, обратных мутаций и т.п. часто называют "оптимизацией" гуманизированного антитела или цепи. Выражение "главным образом (в основном, и т.д.), нечеловеческого иммуноглобулина или антитела" или "главным образом (в основном, и т.д.), нечеловеческий" означает наличие последовательности иммуноглобулина или антитела,по меньшей степени на 80-95%, предпочтительно на 90-95%, более предпочтительно на 96-99% идентичной последовательности из иного организма, нежели человек, например иного млекопитающего, нежели человек (не человека). Соответственно, все области или остатки гуманизированного иммуноглобулина или антитела или иммунизированной цепи иммуноглобулина или антитела, за исключением, возможно, CDR, практически идентичны соответствующим областям или остаткам одной или более последовательностей нативного человеческого иммуноглобулина. Термин "соответствующая область" или "соответствующий остаток" относится к области или остатку во второй аминокислотной или нуклеотидной последовательности, которая(ый) занимает то же самое (т.е. эквивалентное) положение, что и область или остаток в первой аминокислотной или нуклеотидной последовательности, когда проводят сравнение первичных структур первой и второй последовательностей при оптимальном их взаимном расположении. Термин "значительная (заметная) идентичность" означает, что две полипептидные последовательности при оптимальном способе сравнения первичных структур, например, с помощью программ GAP или BESTFIT с применением весов гэпов по умолчанию идентичны по меньшей мере на 50-60%, предпочтительно на 60-70%, более предпочтительно, когда последовательности идентичны по меньшей мере на 70-80%, еще более предпочтительна идентичность последовательностей по меньшей мере 80-90%,еще более предпочтительна идентичность последовательностей по меньшей мере 90-95%, и еще более предпочтительно, когда последовательности идентичны по меньшей мере на 95% или более (например,последовательности идентичны на 99% или более). Термин "практическая идентичность" означает, что две полипептидные последовательности при оптимальном способе сравнения первичных структур, например, с помощью программ GAP или BESTFIT с применением весов гэпов по умолчанию идентичны по меньшей мере на 80-90%, предпочтительно последовательности идентичны по меньшей мере на 90-95% и более предпочтительно, когда последовательности идентичны по меньшей мере на 95% или более (например, последовательности идентичны на 99% или более). При сравнении последовательностей обычно одна последовательность является эталонной, с которой сравнивают испытуемые последовательности. При использовании алгоритма сравнения последовательностей испытуемую и эталонную последовательности вводят в компьютер, если требуется,устанавливают координаты субпоследовательностей и устанавливают параметры алгоритма сравнения последовательностей. Затем, используя алгоритм сравнения последовательностей, вычисляют процент идентичности последовательностей для испытуемой(ых) последовательности(ей) с эталонной последовательностью на основе введенных параметров программы. Оптимальный сравнительный анализ первичной структуры последовательностей можно осуществлять, например, при использовании локального алгоритма гомологий SmithWaterman, Adv. Appl.Biol. 48: 443 (1970), метода поиска подобия по PearsonLipman, Proc. Natl. Acad. Sci. USA 85: 2444(1988), компьютерной реализацией этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в программном обеспечении Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) и с помощью визуального наблюдения (см., в целом, Ausubel et al., Current Protocols in Molecular Biology). Одним примером алгоритма, пригодного для определения процента идентичности последовательностей и подобия последовательностей, является алгоритм BLAST, описанный в Altschul et al., J. Mol. Biol. 215: 403 (1990). Программное обеспечение для осуществления анализа BLAST является общедоступным с помощью National Center for Biotechnology Information (через интернет-сервер National Institutes of HealthNCBI). Как правило, для проведения сравнения последовательностей можно использовать параметры программы по умолчанию, хотя можно также применять специальные (приспособленные) параметры(настроить). Для аминокислотных последовательностей программа BLASTP по умолчанию использует разрядность (W) 3, ожидание (Е) 10 и оценочную матрицу BLOSUM62 (см. HenikoffHenikoff, Proc.Natl Acad. Sci. USA 89: 10915 (1989. Предпочтительно положения остатков, которые не являются идентичными, различаются консервативными аминокислотными заменами. В целях классификации аминокислотных замен, как консервативных, так и неконсервативных, аминокислоты группируют следующим образом: группа I (гидрофобные боковые цепи): leu, met, ala, val, leu, ile; группа II (нейтральные гидрофильные боковые цепи): cys, ser,thr; группа III (кислые боковые цепи): asp, glu; группа IV (основные боковые цепи): asn, gln, his, lys, arg; группа V (остатки, влияющие на ориентацию цепи): gly, pro; и группа VI (ароматические боковые цепи):trp, tyr, phe. Консервативные замены включают замены на аминокислоты того же класса. Неконсервативные-6 010902 замены представляют собой замену представителя одного из этих классов на представитель другого класса. Предпочтительно гуманизированные иммуноглобулины или антитела связывают антиген с аффинностью, в 3, 4 или 5 раз большей аффинности соответствующего нечеловеческого антитела. Например,если величина аффинности связывания нечеловеческого антитела составляет 109 М-1, гуманизированное антитело будет иметь аффинность связывания по меньшей мере 3109 М-1, 4109 М-1 или 109 М-1. При описании свойств связывания цепи иммуноглобулина или антитела можно основываться на ее способности "контролировать (управлять, направлять) связывание с антигеном (например, с A)". Говорят, что цепь "контролирует связывание с антигеном", когда она сообщает интактному иммуноглобулину или антителу (или его антигенсвязывающему фрагменту) свойство специфического связывания или аффинность связывания. Говорят, что мутация (например, обратная мутация) существенно (практически) влияет на способность тяжелой или легкой цепи контролировать (направлять и т.д.) связывание с антигеном,если она влияет (например, уменьшает) на аффинность связывания интактного иммуноглобулина или антитела (или его антигенсвязывающего фрагмента), содержащего указанную цепь, по меньшей мере, на порядок по сравнению с аффинностью связывания антитела (или его антигенсвязывающего фрагмента),содержащего эквивалентную цепь, в которой отсутствует указанная мутация. Мутация "практически не влияет (например, в сторону понижения) на способность цепи контролировать (направлять и т.п.) связывание с антигеном", если она влияет (например, в сторону понижения) на аффинность связывания интактного иммуноглобулина или антитела (или его антигенсвязывающего фрагмента), содержащего указанную цепь, только в 2, 3 или 4 раза по сравнению с аффинностью связывания антитела (или его антигенсвязывающего фрагмента), содержащего эквивалентную цепь, не содержащую указанной мутации. Термин "химерный иммуноглобулин" или "химерное антитело" относится к иммуноглобулину или к антителу, легкая и тяжелая цепи которого образованы из первых видов, а константные области образованы из второго вида. Химерные иммуноглобулины или антитела можно конструировать, например, методами генной инженерии (рекомбинантной ДНК) из сегментов генов иммуноглобулина, принадлежащих к различным видам. Предполагается, что термины "гуманизированный иммуноглобулин" или "гуманизированное антитело" не охватывают химерные иммуноглобулины или антитела по нижеприведенному описанию. Хотя гуманизированные иммуноглобулины или антитела являются химерными по своей конструкции (т.е. содержат области из более чем одного вида белка), они имеют дополнительные характерные особенности (т.е. вариабельные области, содержащие донорные CDR остатки и акцепторные остовные остатки), не обнаруживаемые в химерных иммуноглобулинах или антителах по данному описанию."Антиген" представляет собой объект (например, белковый объект или пептид), с которым специфически связывается антитело. Термин "эпитоп" или "антигенная детерминанта" относится к сайту антигена, с которым специфически связывается иммуноглобулин или антитело (или его антигенсвязывающий фрагмент). Эпитопы могут быть образованы как из смежных аминокислот, так и несмежных аминокислот, накладывающихся друг на друга при трехмерной (третичной) укладке белка. Эпитопы, образованные из соседних аминокислот, как правило, сохраняются при обработке денатурирующим растворителем, тогда как эпитопы,образованные при третичной укладке, как правило, утрачиваются под действием денатурирующих растворителей. Эпитоп, как правило, содержит по меньшей мере 3-15 аминокислот в единственной (уникальной) пространственной конформации. Способы определения пространственной конформации эпитопов включают, например, рентгеноструктурный анализ и двухмерный ядерный магнитный резонанс. См.,например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66, G.E. Morris, Ed. (1996). Антитела, которые распознают один и тот же эпитоп, можно идентифицировать простым иммуноанализом, показывающим способность одного антитела блокировать связывание другого антитела с антигеном-мишенью, т.е. методом конкурентного связывания. Конкурентное связывание определяют таким методом анализа, при котором испытуемый иммуноглобулин ингибирует специфическое связывание эталонного антитела с общим антигеном, таким как A. Известно много методов анализа конкурентного связывания (конкурентно-связывающего анализа): твердофазный прямой или непрямой радиоиммуноанализ (РИА, RIA), твердофазный прямой или непрямой иммуноферментный анализ (ИФА, EIA), конкурентный иммуноферментный сэндвич-анализ (см. Stahli et al., Methods in Enzymology 9: 242 (1983; твердофазный прямой иммуноферментный анализ (EIA) с применением биотина-авидина (см. Kirkland etal., J. Immunol. 137: 3614 (1986; твердофазный прямой анализ с мечением, твердофазный прямой сэндвич-анализ с меткой (см. Harlow and Lane, Antibodies: A Laboratory Manual., Cold Spring Harbor Press(1988; твердофазный прямой радиоиммуноанализ (RIA) с меткой I125 (см. Morel et al., Mol. Immunol. 25(1): 7 (1988; твердофазный прямой иммуноферментный анализ (EIA) с применением биотина-авидина(Cheung et al., Virology 176: 546 (1990 и прямой радиоиммуноанализ (RIA) с меткой (Moldenhauer et al.,Scand. J. Immunol. 32: 77 (1990. Как правило, такой анализ включает использование очищенного антигена, связанного с твердой поверхностью, или клеток с каким-либо антигеном, немеченого испытуемого иммуноглобулина и меченого эталонного иммуноглобулина. Конкурентное торможение измеряют, определяя количество метки, связанной с твердой поверхностью или клетками в присутствии испытуемого-7 010902 иммуноглобулина. Обычно испытуемый иммуноглобулин присутствует в избытке. И обычно, когда конкурентное антитело присутствует в избытке, оно тормозит специфическое связывание эталонного антитела с общим антигеном по меньшей мере на 50-55%, 55-60%, 60-65%. 65-70%, 70-75% или более. Эпитоп также распознается иммунокомпетентными клетками, например В-клетками и/или Т-клетками. Клеточное распознавание эпитопа можно определить in vitro методами анализа, в которых измеряют антигензависимую пролиферацию, такими как включение 3 Н-тимидина, секреция цитокинов, секреция антитела или антигензависимый цитолиз (анализ цитотоксических Т-лимфоцитов). Примеры эпитопов или антигенных детерминант можно обнаружить в человеческом амилоидном белке-предшественнике (АРР), но предпочтительно их находят в А-пептиде АРР. Существует много изоформ АРР, например АРР 695, АРР 751 и АРР 770. Аминокислотам в молекуле АРР даются номера в соответствии с последовательностью изоформы АРР 770 (см., например, GenBank Accession No. P05067). Пептид A (также в данном описании называемый бета-амилоидный пептид и А-бета) представляет собой внутренний фрагмент АРР (размером примерно 4 кДа), состоящий из 39-43 аминокислот (A39, А 40,А 41, А 42 и А 43). А 40, например, состоит из остатков 672-711 АРР, а A42 состоит из остатков 673713 АРР. В результате протеолитического процессинга АРР различными секретазами in vivo или in situ,A обнаруживается как в "короткой форме" протяженностью в 40 аминокислот, так и в "длинной форме" протяженностью в 42-43 аминокислоты. Предпочтительные эпитопы или антигенные детерминанты по данному описанию локализованы на N-конце A-пептида и включают остатки 1-10 пептида A, предпочтительно остатки 1-3, 1-4, 1-5, 1-6, 1-7 или 3-7 пептида A42. Дополнительные эпитопы или антигенные детерминанты включают остатки 2-4, 5, 6, 7 или 8 пептида A, остатки 3-5, 6, 7, 8 или 9 пептида A или остатки 4-7, 8, 9 или 10 пептида A42. Когда говорят, что антитело связывается с эпитопом в указанных остатках, таких как A 3-7, подразумевают, что это антитело специфически связывается с полипептидом, содержащим указанные остатки (т.е. A 3-7 в данном примере). Такое антитело не обязательно контактирует с каждым остатком в A 3-7. Не обязательно каждая единичная замена или делеция в A 37 заметно влияет на аффинность связывания. Термин "амилоидное заболевание" включает любое заболевание, ассоциируемое с (или вызываемое) образованием или отложением нерастворимых амилоидных фибрилл. Примеры амилоидных заболеваний включают, но без ограничения, системный амилоидоз, болезнь Альцгеймера, диабет у взрослых,болезнь Паркинсона, болезнь Гентингтона (Хантингтона), лобно-височную деменцию и вызванные прионами трансмиссивные губчатые энцефалопатии (куру и болезнь Крейтцфельдта (Кройцфельдта)-Якоба у человека и скрепи и BSE у овец и крупного рогатого скота, соответственно). Различные амилоидные заболевания определяют или отличают по характеру полипептидного компонента отлагающихся фибрилл. Например, у субъектов или пациентов с болезнью Альцгеймера -амилоидный белок (например,дикого типа, вариант или усеченный -амилоидный белок) является отличительным полипептидным компонентом амилоидного отложения. Следовательно, болезнь Альцгеймера является примером "заболевания, характеризуемого отложениями белка A, или "заболевания, обусловленного отложениями белка A, например, в мозгу субъекта или пациента. Термины "-амилоидный белок", "-амилоидный пептид", "-амилоид", "A и "пептид A используют в данном описании взаимозаменяемо в качестве синонимов."Иммуногенный агент" или "иммуноген" способен индуцировать аутоиммунологическую реакцию организма при введении млекопитающему, не обязательно в сочетании с адъювантом. Термин "лечение" по данному описанию определяется как применение терапевтического агента в выделенных тканях или клеточной линии пациента или введение терапевтического агента в выделенные ткани или клеточную линию пациента, у которого наблюдается заболевание, симптомы заболевания или предрасположенность к заболеванию, с целью лечения, излечения, ослабления, облегчения, изменения,исправления, уменьшения, достижения положительной динамики в течении заболевания, симптомов заболевания или предрасположенности к заболеванию или влияния на заболевание, симптомы заболевания или предрасположенность к заболеванию. Термин "эффективная доза" или "эффективная дозировка" определяется как количество, достаточное для достижения или по меньшей мере частичного достижения заданного эффекта. Термин "терапевтически эффективная доза" определяется как количество, достаточное для излечения или по меньшей мере частичного прекращения заболевания и его осложнений у больного, уже страдающего этим заболеванием. Количество, эффективное для такого применения, зависит от тяжести инфекции и общего состояния иммунной системы больного. Термин "пациент, больной" включает человека и других млекопитающих, которые получают профилактическое или терапевтическое лечение. Термин "растворимый" или "диссоциированный" A относится к неагрегированному или дезагрегированному A-полипептиду. Термин "нерастворимый" A относится к агрегированному A-полипептиду, включая мономерный растворимый, а также олигомерный растворимый A-полипептид (например,растворимые A-димеры, тримеры и т.п.). Термин "нерастворимый" A относится к агрегированномуA-полипептиду, например к A, ассоциированному за счет нековалентных связей. Полагают, что A(например, A42) агрегирует, по меньшей мере частично, благодаря присутствию гидрофобных остатков на С-конце пептида (часть трансмембранного домена АРР). Растворимый A можно обнаружить in vivo в биологических жидкостях, таких как спинно-мозговая жидкость (ликвор) и/или сыворотка. Или же растворимый А можно получить, растворяя лиофилизированный пептид в чистом ДМСО под действием ультразвука. Образовавшийся раствор центрифугируют (например, при 14000 g, 4C, 10 мин) для удаления нерастворимых частиц. Термин "эффекторная функция" относится к активности, которая наблюдается в Fc области антитела (например, IgG антитела) и включает, например, способность антитела связываться с эффекторными молекулами, такими как комплемент и/или рецепторы Fc, которые могут контролировать некоторые иммунные функции антитела, такие как активность эффекторных клеток, лизис, опосредованная комплементом активность, клиренс антитела и период полужизни антитела. Термин "эффекторная молекула" относится к молекуле, способной связываться с Fc-областью антитела (например, IgG антитела), включая, но без ограничения, белок комплемента или Fc-рецептор. Термин "эффекторная клетка" относится к клетке, способной связываться с Fc-участком антитела(например, IgG антитела), как правило, с помощью Fc-рецептора, экспрессируемого на поверхности эффекторной клетки, включая, но без ограничения, лимфоциты, например антигенпрезентирующие клетки и Т-клетки. Термин "Fc-область (участок)" относится к С-концевой области IgG антитела, в частности к С-концевой области тяжелой (тяжелых) цепи (цепей) IgG антитела. Хотя границы области Fc и тяжелой цепиIgG могут немного меняться, Fc-область, как правило, определяют как область, заполняющую пространство от аминокислотного остатка Cys226 до карбоксильного конца тяжелой (тяжелых) цепи (цепей) IgG. Если не указано иначе, термин "нумерация по Kabat" определяется как нумерация остатков, например, в тяжелой цепи IgG антитела с применением EU индекса, как указано в Kabat et al. (Sequences ofProteins of Immunological Interest, 5th Ed. National Institutes of Health, Bethesda, MD, (1991, специально введенного в данное описание в качестве ссылки. Термин "Fc-рецептор" или "FcR" относится к рецептору, который связывается с Fc-областью антитела. Типичные Fc-рецепторы, которые связываются с Fc-областью антитела (например, IgG антитела),включают, но без ограничения, рецепторы для подклассов FcRI, FcRII и FcRIII, включая аллельные варианты и формы этих рецепторов с альтернативной утратой при сплайсинге. Обзор рецепторов Fc дан в Ravetch and Kinet, Ann. Rev. Immunol 9: 457-92 (1991); Capel et al. Immunomethods 4: 25-34 (1994); и deHaas et al. J. Lab. Clin. Med. 126: 330-41 (1995). Иммунологические и терапевтические реагенты Иммунологические и терапевтические реагенты по изобретению содержат иммуногены или антитела или их функциональные или антигенсвязывающие фрагменты по данному описанию или состоят из них. Известно, что основная структурная единица антитела состоит из четырех субъединиц (тетрамер). Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара содержит одну"легкую" (около 25 кДа) и одну "тяжелую" (около 50-70 кДа) цепь. Аминоконцевой участок каждой цепи включает вариабельную область (домен) протяженностью около 100-110 или более аминокислот, главным образом, ответственных за распознавание антигена. Карбоксиконцевой участок каждой цепи определяет константную область, в первую очередь, отвечающую за эффекторную функцию. Легкие цепи классифицируют либо как каппа , либо как лямбда , и их протяженность составляет около 230 остатков. Тяжелые цепи классифицируют как гамма , мю , альфа , дельтаили эпсилон , их протяженность составляет около 450-600 остатков, и они определяют изотип антитела какIgG, IgM, IgA, IgD и IgE, соответственно. Как тяжелая, так и легкая цепи скручиваются (укладываются) в домены (области). Термин "домен", "область" относится к глобулярной области белка, например иммуноглобулина или антитела. Домены иммуноглобулина или антитела включают, например, три или четыре пептидные петли, стабилизированные за счет -складки и межцепной дисульфидной связи. Интактные легкие цепи имеют, например, два домена (VL и CL), а интактные тяжелые цепи содержат, например, четыре или пять доменов (VH, CH1, CH2 и CH3). Внутри легкой и тяжелой цепей вариабельные и константные области соединяются областью "J",содержащей около 12 или более аминокислот, при этом тяжелая цепь также содержит область "D", состоящую примерно из 10 аминокислот (см., в целом, Fundamental Immunology (Paul, W., ed., 2nd ed. RavenPress, N.Y. (1989), Ch. 7, вводимую в качестве ссылки во всей полноте для всех целей). Вариабельные области каждой пары "легкая/тяжелая цепь" образуют сайт связывания антитела. Таким образом, интактное антитело имеет два сайта связывания. Два сайта связывания одинаковы, за исключением бифункциональных или биспецифических антител. Все цепи имеют одинаковую общую структуру, состоящую из относительно консервативных остовных областей (FR), соединенных тремя гипервариабельными участками, также называемыми CDR. Природные цепи или цепи, полученные методом рекомбинантной ДНК, можно экспрессировать при участии лидерной последовательности, которая удаляется в результате клеточного процессинга, и в результате получают цепь зрелого белка. Цепи-9 010902 зрелого белка с неприродной (искусственной) лидерной последовательностью можно также получать методами рекомбинантной ДНК, например, с целью повышения секреции или изменения процессинга конкретной интересующей цепи.CDR-участки двух зрелых цепей каждой пары выравнивают по остовным областям, делающим возможным связывание со специфическим эпитопом. От N-конца до С-конца как легкая, так и тяжелая цепи содержат домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. "FR4" в технике также называют областьюD/J вариабельного домена тяжелой цепи и областью J вариабельного домена легкой цепи. Отнесение аминокислот к каждому домену делают в соответствии с определениями Kabat, Sequences of Proteins ofImmunological Interest (National Institutes of Health, Bethesda, MD, 1987 and 1991). Альтернативное определение структуры предложено Chothia et al., J. Mol. Biol. 196: 901 (1987); Nature 342: 878 (1989); and J.Mol. Biol. 186: 651 (1989) (далее в данном описании вместе цитируемые как "Chothia et al." и вводимые ссылкой во всей полноте с любой целью). Антитела к A Терапевтические агенты по изобретению включают антитела, которые специфически связываются сA или другими компонентами амилоидных бляшек. Предпочтительные антитела являются моноклональными. Некоторые такие антитела специфически связываются с агрегированной формой A, не связываясь с растворимой формой. Некоторые антитела специфически связываются с растворимой формой,не связываясь с агрегированной формой. Некоторые антитела связываются как с агрегированной, так и с растворимой формами. Антитела, используемые для терапевтических целей, предпочтительно имеют интактную константную область или по меньшей мере часть константной области, достаточную для взаимодействия с рецептором Fc. Предпочтительными антителами являются такие антитела, которые эффективно стимулируют Fc-опосредованный фагоцитоз A в бляшках. Предпочтительным является человеческий изотип IgG1, так как он имеет наивысшую среди человеческих изотипов аффинность к рецептору FcRI фагоцитов (например, в макрофагах, расположенных в мозгу, или микроглии). Человеческий IgG1 является эквивалентом мышиного IgG2a, последний, следовательно, пригоден для испытанияin vivo на животных (например, мышиных) моделях болезни Альцгеймера. Также можно использовать биспецифические фрагменты Fab, у которых одно плечо антитела специфично в отношении A, а другое - в отношении рецептора Fc. Предпочтительные антитела связываются с А с аффинностью связывания,более высокой, чем (или равной) примерно 106-1010 M-1 (включая промежуточные значения). Моноклональные антитела связываются со специфическим эпитопом в A, который может представлять собой конформационный или неконформационный эпитоп. Профилактическую и терапевтическую эффективность антител можно проверять, используя методики работы с трансгенными животными моделями, описанные примерах. Предпочтительные моноклональные антитела связываются с эпитопом в пределах остатков 1-10 A (первый N-концевой остаток природного A обозначен 1), более предпочтительно с эпитопом в пределах остатков 3-7 A. В некоторых методах используют множественные моноклональные антитела, обладающие специфичностью связывания с различными эпитопами, например антитело, специфическое к эпитопу, находящемуся в остатках 3-7 A, можно вводить вместе с антителом, специфическим к эпитопу, расположенному вне остатков 3-7 A. Такие антитела можно вводить последовательно или одновременно. Можно также использовать (например, вводить или вводить совместно) антитела к амилоидным компонентам, иным, нежели A. Эпитопную специфичность антитела можно определить, например, создавая библиотеку фагового дисплея, в которой различные члены библиотека выявляют различные последовательности A. Затем с помощью библиотеки фагового дисплея выбирают ее представители, специфически связывающиеся с испытуемым антителом. Выделяют семейство последовательностей. Как правило, такое семейство содержит общую ядерную последовательность и фланкирующие последовательности различной протяженности у различных ее членов. Наиболее короткая ядерная последовательность, проявляющая специфичность связывания с антителом, определяет эпитоп, связанный антителом. Антитела также можно испытывать на эпитопную специфичность методом конкурентного связывания при использовании антитела,эпитопная специфичность которого определена. Например, антитела, которые конкурируют с антителом 12 В 4 за связывание с A, связываются с тем же или аналогичным эпитопом, что и 12 В 4, т.е. находящимся в границах остатков A 3-7. Скрининг антител на эпитопную специфичность помогает прогнозировать терапевтическую эффективность. Например, антитело, для которого определено связывание с эпитопом внутри остатков 1-7 белка A, по-видимому, эффективно предупреждает и лечит болезнь Альцгеймера в соответствии с методологией по данному изобретению. Антитела, которые специфически связываются с предпочтительным сегментом A, не связываясь с другими областями A, имеют ряд преимуществ в сравнении с моноклональными антителами, связывающимися с другими областями, или с поликлональными сыворотками против интактного A. Вопервых, при равных весовых дозах дозы антител, которые специфически связываются с предпочтительными сегментами, содержат более высокие молярные дозы антител, эффективно очищающих от амилоидных бляшек. Во-вторых, антитела, специфически связывающиеся с предпочтительными сегментами,- 10010902 могут инициировать очищение от амилоидных отложений, не вызывая такой реакции очищения у интактного полипептида APP, тем самым, уменьшая возможные побочные эффекты. Получение нечеловеческих антител Настоящее изобретение охватывает нечеловеческие антитела, например антитела, специфические в отношении предпочтительных A эпитопов по изобретению. Такие антитела можно использовать для приготовления различных терапевтических композиций по изобретению, или предпочтительно они предоставляют гипервариабельные участки с целью получения гуманизированных или химерных антител(подробно описанных ниже). Получать нечеловеческие моноклональные антитела можно, например, иммунизируя животное пептидом A. Получение нечеловеческих моноклональных антител, например мышиных, морских свинок, приматов, кроличьих или крысиных, можно осуществлять, например, иммунизацией животных с помощью A. Также можно использовать более протяженный полипептид, содержащий A, или иммуногенный фрагмент A, или антиидиотипические антитела к антителу к A (HarlowLane, см. выше (вводится в качестве ссылки для любых целей. Такой иммуноген можно получать из природного источника пептидным синтезом или рекомбинантной экспрессией. Необязательно, иммуноген можно вводить в виде слитого белка или в виде полученного иным способом комплекса с белкомносителем, как описано ниже. Необязательно, иммуноген можно вводить с адъювантом. Термин "адъювант" относится к соединению, которое при введении в сочетании с антигеном усиливает иммунный ответ на антиген, но при индивидуальном введении не вызывает иммунного ответа на антиген. Адъюванты могут усиливать иммунный ответ по нескольким механизмам, включая рекрутинг лимфоцитов, стимуляцию В- и/или Т-клеток и стимуляцию макрофагов. Некоторые типы адъювантов можно использовать, как описано ниже. Для иммунизации лабораторных животных предпочтительным является полный адъювант Фрейнда с последующим неполным адъювантом. Для получения поликлональных антител обычно используются кролики или морские свинки. Препарат поликлональных антител, например, для пассивной защиты можно приготовить следующим образом. 125 нетрансгенных мышей иммунизируют, вводя 100 мкг A 1-42 плюс адъювант CFA/IFA, и умерщвляют через 4-5 месяцев. У иммунизированных мышей берут кровь. IgG отделяют от других компонентов крови. Антитело, специфическое в отношении иммуногена, можно частично очистить аффинной хроматографией. В среднем, от мыши получают около 0,5-1 мг иммуногенспецифического антитела, а всего получают 60-120 мг. Для получения моноклональных антител, как правило, используют мышей. Можно приготовить моноклональные антитела против фрагмента, инъецируя фрагмент или более протяженную форму A мыши, получая гибридомы и подвергая гибридомы скринингу на антитело, которое специфически связывается с A. Необязательно, антитела подвергают скринингу на связывание со специфической областью заданного фрагмента A в отсутствие связывания с другими неперекрывающимися фрагментамиA. Последний скрининг можно осуществлять, определяя связывание антитела с коллекцией делетированных мутантов пептида A и выясняя, какие из делетированных мутантов связываются с антителом. Связывание можно оценивать, например, вестерн-блоттингом или методом ELISA. Наименьший фрагмент, у которого обнаружено специфическое связывание с антителом, определяют как эпитоп к антителу. Или же эпитопную специфичность можно определять конкурентным анализом, в котором испытуемое и эталонное антитела конкурируют за связывание с A. Если испытуемое и эталонное антитела конкурируют, тогда они связываются с тем же самым эпитопом или с теми же самыми эпитопами достаточно проксимально, так что связывание одного антитела мешает связыванию другого антитела. Предпочтительным изотипом для таких антител является мышиный изотип IgG2a или эквивалентный изотип в других видах. Мышиный изотип IgG2a является эквивалентным человеческому изотипу IgG1 (например,человеческому IgG1). Химерные и гуманизированные антитела Настоящее изобретение также охватывает химерные и/или гуманизированные антитела (т.е. химерные и/или гуманизированные иммуноглобулины), специфические в отношении бета-амилоидного пептида. Химерные и/или гуманизированные антитела имеют одинаковую или аналогичную специфичность и аффинность связывания, что и мышиное или другое нечеловеческое антитело, которое предоставляет исходный материал для конструкции химерного или гуманизированного антитела. Получение химерных антител Термин "химерное антитело" относится к антителу, гены легкой и тяжелой цепей которого созданы обычно методом рекомбинантной ДНК из сегментов гена иммуноглобулина, принадлежащих к разным видам. Например, вариабельные (V) сегменты генов мышиного моноклонального антитела могут быть соединены с человеческими константными (С) сегментами, такими как IgG1 и IgG4. Предпочтительным является человеческий изотип IgG1. Таким образом, типичное химерное антитело представляет собой гибридный белок, состоящий из V или антигенсвязывающего домена мышиного антитела и С или эффекторного домена человеческого антитела. Получение гуманизированных антител Термин "гуманизированное антитело" относится к антителу, содержащему по меньшей мере одну- 11010902 цепь, включающую остатки остова вариабельной области, главным образом, цепи человеческого антитела (называемого акцепторный иммуноглобулин или акцепторное антитело), и по меньшей мере один гипервариабельный участок, главным образом, мышиного антитела (называемого донорный иммуноглобулин или донорное антитело). См. Queen et al., Proc. Natl. Acad. Sci. USA 86: 10029- 10033 (1989), патенты США 5530101, 5585089, 5693761, 5693762, Selick et al., международная заявка WO 90/07861, и Winter,патент США 5225539 (вводимые в качестве ссылок во всей полноте для любых целей). Константная(ые) область(и), если таковая(ые) имее(ю)тся, берут, также в основном или полностью, из человеческого иммуноглобулина. Наиболее вероятно, что замена мышиных CDR на остов человеческой вариабельной области приводит к сохранению их корректной пространственной ориентации, если каркас человеческой вариабельной области принимает ту же конформацию, что и остов мышиной вариабельной области, из которой взятыCDR, или сходную с ней. Этого достигают, получая человеческие вариабельные области из человеческих антител, остовные последовательности которых в высокой степени идентичны вариабельным областям мышиного каркаса, из которых взяты CDR. Вариабельные остовные области тяжелой и легкой цепей могут быть взяты из одной и той же последовательности или из разных последовательностей человеческого антитела. Последовательности человеческого антитела могут представлять собой последовательности природных человеческих антител или согласованные последовательности нескольких человеческих антител. См. Kettleborough et al., Protein Engineering 4: 773 (1991); Kolbinger et al., Protein Engineering 6: 971(1993) и Carter et al., международная заявка WO 92/22653. После идентификации гипервариабельных участков мышиного донорного иммуноглобулина и соответствующих человеческих акцепторных иммуноглобулинов следующей стадией является определение, какие остатки, если только есть такие остатки, из этих компонентов следует заместить для оптимизации свойств образующегося в результате гуманизированного антитела. Как правило, замена человеческих аминокислотных остатков на мышиные должна быть сведена к минимуму, так как введение мышиных остатков повышает риск того, что антитело вызовет у людей реакцию антитела человека на антитело козы (НАМА). Мониторинг НАМА ответа у конкретного больного или в ходе клинических испытаний можно осуществлять признанными в технике методами определения иммунного ответа. У больных, которым вводят гуманизированные антитела, можно оценивать иммуногенность в начале и в ходе проведения указанной терапии. НАМА-ответ измеряют, например, определяя антитела к гуманизированному терапевтическому реагенту в образцах сыворотки крови больных известным специалисту в данной области техники методом, включая технологию резонанса на длине волны поверхностного плазмона(BIACORE) и/или твердофазный ELISA анализ. Некоторые аминокислоты остова вариабельной области человеческой последовательности выбирают для замены, исходя из их возможного влияния на конформацию CDR и/или связывание с антигеном. Неестественное наложение мышиных CDR участков на человеческую вариабельную область может привести к неестественным конформационным затруднениям, которые, если не корректировать с применением аминокислотных замен, приводят к утрате аффинности связывания. Селекцию аминокислотных остатков для замены частично осуществляют с помощью компьютерного моделирования. Компьютерные аппаратные средства и программное обеспечение для получения трехмерного изображения молекул иммуноглобулина представлены в данном описании. В целом, молекулярные модели получают, исходя из решенных структур иммуноглобулиновых цепей или их доменов. Сравнивают аминокислотные последовательности модельных цепей с цепями или доменами решенных трехмерных структур на предмет нахождения сходства между ними, и цепь(и) или домен(ы) с наибольшим сходством последовательностей выбирается(ются) в качестве отправной точки для построения молекулярной модели. Для моделирования выбирают цепи или модели, последовательности которых идентичны по меньшей мере на 50%, и предпочтительно для моделирования выбирают цепи или модели, последовательности которых идентичны по меньшей мере на 60, 70, 80, 90% или более. Решенные (расшифрованные) исходные структуры модифицируют, чтобы учесть (сделать поправку на) различия между действительными аминокислотами в моделируемых цепях или доменах иммуноглобулина и аминокислотами в исходной структуре. Затем модифицированные структуры собирают в составной иммуноглобулин. Наконец, модель уточняют по минимуму энергии и проверяют, чтобы все атомы находились на соответствующем расстоянии друг от друга и чтобы длины связей и углы не выходили за допустимые с точки зрения химии пределы. Селекцию аминокислотных остатков для замены можно также проводить частично, изучая характеристики аминокислот, занимающих конкретное местоположение, или эмпирически, наблюдая на опыте эффекты замены или мутагенеза конкретной аминокислоты. Например, если в остове мышиной вариабельной области и в остове выбираемой человеческой вариабельной области аминокислоты различаются,человеческую остовную аминокислоту обычно следует заменить эквивалентной остовной аминокислотой мышиного антитела, когда логично ожидать, что аминокислота:(1) непосредственно связывается с антигеном нековалентной связью,(2) прилегает к CDR-участку,(3) иным образом взаимодействует с CDR-участком (например, находится на расстоянии около 3-6- 12010902 от участка CDR, как определено компьютерным моделированием) или(4) участвует в VL-VH интерфейсе. Остатки, которые "непосредственно связываются с антигеном нековалентной связью", включают аминокислоты в положениях в остовных областях, где имеется высокая вероятность взаимодействия с аминокислотами антигена в соответствии с установленными химическими взаимодействиями, такими,например, как водородная связь, взаимодействие Ван дер Ваальса, гидрофобные взаимодействия и т.п.CDR и остовные области определяются по Kabat et al. или Clothia et al., см. выше. Когда остовные остатки, по определению Kabat et al., см выше, составляют остатки структурной петли, по определениюClothia et al., см. выше, аминокислоты мышиного антитела можно отбирать для замены в гуманизированное антитело. Остатки, которые "прилегают к CDR-участку", включают аминокислотные остатки в положениях, непосредственно прилегающих к одному или более CDR в первичной последовательности гуманизированной цепи иммуноглобулина, например в положениях, непосредственно прилегающих кCDR по определению Kabat или CDR по определению Clothia (см., например, Clothia and Lesk, JMB 196: 901 (1987. По-видимому, эти аминокислоты в особенности взаимодействуют с аминокислотами в областях CDR и, будучи выбраны из акцептора, деформируют CDR и снижают аффинность. Помимо этого,прилегающие аминокислоты могут взаимодействовать непосредственно с антигеном (Amit et al., Science,233: 747 (1986), вводится в данное описание в качестве ссылки), и выбор этих аминокислот из донора может быть желательным для сохранения всех связей (контактов) антигена, благодаря которым оригинальное антитело обладает аффинностью. Остатки, которые "иным образом взаимодействуют с CDR-участком (областью)", включают такие остатки, для которых с помощью анализа вторичной структуры определена ориентация, подходящая для того, чтобы влиять на участок (область) CDR. В одном варианте изобретения остатки, которые "иным образом взаимодействуют с CDR-участком", определяют, анализируя трехмерную модель донорного иммуноглобулина (например, компьютерную модель). Трехмерная модель, как правило, оригинального(первоначального) донорного антитела, показывает, что некоторые аминокислоты вне участков CDR расположены близ участков CDR и имеют хорошую возможность взаимодействовать с аминокислотами участков CDR за счет водородных связей, сил Ван дер Ваальса, гидрофобного взаимодействия и т.д. В этих аминокислотных положениях можно выбрать, скорее, аминокислоту донорного иммуноглобулина,нежели аминокислоту акцепторного иммуноглобулина. Аминокислоты, соответствующие этому критерию, как правило, содержат атом в боковой цепи в пределах примерно 3 от некоего атома в областиCDR и должны иметь некий атом, который мог бы взаимодействовать с атомами CDR за счет известных химических взаимодействий, таких как перечисленные выше. В случае атомов, которые могут образовывать водородную связь, 3- это расстояние, измеренное между их ядрами, но в случае атомов, которые не образуют связь, 3- это расстояние, измеренное между их ван-дер-ваальсовыми поверхностями. Следовательно, в последнем случае расстояние между ядрами составляет около 6(3 плюс сумма ван-дер-ваальсовых радиусов) для атомов, рассматриваемых как способные взаимодействовать. Во многих случаях расстояние между ядрами составляет от 4 или 5 до 6 . При определении, может ли аминокислота взаимодействовать с участками CDR, предпочтительно не рассматривать последние 8 аминокислот тяжелой цепи CDR2 как часть CDR, так как с точки зрения структуры эти 8 аминокислот ведут себя, скорее, как часть каркаса. Аминокислоты, которые способны взаимодействовать с аминокислотами в CDR, можно идентифицировать еще одним способом. Доступную для растворителя площадь поверхности каждой остовной аминокислоты вычисляют двумя путями: (1) в интактном антителе и (2) в гипотетической молекуле, состоящей из антитела, у которого удалены его CDR. Значительная разница между этими значениями, около 10 кв. или более, показывает, что доступ остовной аминокислоты к растворителю, по меньшей мере,частично блокирован участками CDR и, следовательно, у аминокислоты есть контакт с областями CDR. Площадь поверхности аминокислоты, доступную для растворителя, можно вычислить, исходя из трехмерной модели антитела, используя алгоритмы, известные в технике (например, Connolly, J. Appl. Cryst. 16: 548 (1983) и Lee and Richards, J. Mol. Biol. 55: 379 (1971), каждая из этих статей вводится в данное описание в качестве ссылки). Остовные аминокислоты могут также иногда взаимодействовать с участками CDR опосредованно, влияя на конформацию другой остовной аминокислоты, которая, в свою очередь, контактирует с CDR. Известно, что аминокислоты в некоторых положениях в каркасе способны взаимодействовать с участками CDR во многих антителах (Clothia and Lesk, см. выше; Clothia et al., см. выше, и Tramontano etal., J. Mol. Biol. 215: 175 (1990), каждый из этих документов вводится в данное описание в качестве ссылки). Следует заметить, известно, что аминокислоты в положениях 2, 48, 64 и 71 легкой цепи и 26-30, 71 и 94 тяжелой цепи (нумерация по Kabat) способны взаимодействовать с участками CDR многих антител. Аминокислоты в положениях 35 легкой цепи и 93 и 103 тяжелой цепи, по-видимому, также взаимодействуют с участками CDR. Во всех перечисленных положениях в гуманизированном иммуноглобулине предпочтительно, чтобы осуществлялся выбор, скорее, донорной аминокислоты, нежели акцепторной аминокислоты (когда они различаются). С другой стороны, некоторые остатки, способные взаимодействовать с участком CDR, такие как первые 5 аминокислот легкой цепи, иногда можно выбирать из акцеп- 13010902 торного иммуноглобулина без утраты аффинности в гуманизированном иммуноглобулине. Остатки, которые "участвуют в VL-VH интерфейсе", или "остатки упаковки" включают эти остатки на границе раздела (интерфейс) между VL и VH по определению, например, Novotny and Haber, Proc.Natl. Acad. Sci. USA, 82: 4592-16 (1985) или Clothia et al., см. выше. В целом, необычные остатки упаковки следует оставлять в гуманизированном антителе, если они отличаются от остатков в каркасах человеческих антител. Как правило, заменяются одна или более аминокислот, удовлетворяющих вышеприведенным критериям. В некоторых вариантах изобретения заменяются все или большинство аминокислот, удовлетворяющих вышеприведенным критериям. Иногда, когда имеется некоторая неясность, удовлетворяет ли конкретная аминокислота вышеуказанным критериям, получают альтернативные варианты иммуноглобулинов, один из которых содержит эту конкретную замену, а другие нет. Полученные таким образом альтернативные варианты иммуноглобулинов можно испытывать любым представленным в данном описании методом анализа заданной активности и выбирают предпочтительный иммуноглобулин. Обычно участки CDR в гуманизированных антителах практически идентичны, и более обычно идентичны соответствующим участкам CDR донорного антитела. Хотя обычно это нежелательно, иногда возможно сделать одну или более консервативных аминокислотных замен остатков CDR, не влияя заметно на аффинность связывания образующегося в результате гуманизированного иммуноглобулина. Под консервативными заменами понимают такие комбинации, как gly, ala, val, ile, leu; asp, glu; asn, gln;ser, thr; lys, arg; и phe, tyr. Дополнительными кандидатами на замену являются акцепторные человеческие остовные аминокислоты, необычные или "редкие" (минорные) для человеческого иммуноглобулина в этом положении. Эти аминокислоты могут быть заменены на аминокислоты, находящиеся в эквивалентном положении мышиного донорного антитела или в эквивалентных положениях более типичных человеческих иммуноглобулинов. Например, замена может быть желательной, когда аминокислота в человеческой остовной области акцепторного иммуноглобулина является редкой (минорной) для этого положения, а соответствующая аминокислота в донорном иммуноглобулине обычна для этого положения в последовательностях человеческого иммуноглобулина; или когда аминокислота в акцепторном иммуноглобулине является минорной для этого положения и соответствующая аминокислота в донорном иммуноглобулине также является редкой по сравнению с другими человеческими последовательностями. Эти критерии помогают гарантировать, что атипическая аминокислота каркаса человеческой последовательности не разрушит структуру антитела. Кроме того, замена необычной человеческой акцепторной аминокислоты на аминокислоту донорного антитела, которая случайно оказывается типичной для человеческих антител,может сделать гуманизированное антитело менее иммуногенным. Термин "редкий (минорный)", применяемый в данном описании, показывает, что аминокислота в данном положении встречается в репрезентативной выборке последовательностей примерно менее чем в 20%, но обычно примерно менее чем в 10% последовательностей; а термин "обычный, общий", применяемый в данном описании, указывает, что аминокислота в данном положении встречается в репрезентативной выборке последовательностей примерно более чем в 25%, но обычно примерно более чем в 50% последовательностей. Например, все человеческие последовательности вариабельной области легкой и тяжелой цепи делят, соответственно, на "подгруппы" последовательностей, которые особенно гомологичны друг другу и содержат одинаковые аминокислоты в определенных важных положениях (Kabat etal., см. выше). При решении вопроса, является ли аминокислота в человеческой акцепторной последовательности "редкой, минорной" или "обычной" в человеческих последовательностях, часто предпочтительно рассматривать только человеческие последовательности в той же подгруппе, что и акцепторная последовательность. Дополнительными кандидатами на замену являются акцепторные человеческие остовные аминокислоты, которые идентифицируют как часть участка CDR по альтернативному определению Clothia etal., см. выше. Дополнительными кандидатами на замену являются акцепторные человеческие остовные аминокислоты, которые идентифицируют как часть участка CDR при определениях AbM и/или контактов (соединений). Дополнительными кандидатами на замену являются акцепторные человеческие остовные остатки,которые соответствуют редкому или необычному донорному остовному остатку. Редкие или необычные донорные остовные остатки представляют собой такие остатки, которые являются редкими или необычными (по данному описанию) для мышиных антител в этом положении. Для мышиных антител подгруппу можно определить по Kabat и положения остатков, которые отличаются от консенсусных, идентифицируют. Эти донорспецифические различия могут указать на соматические мутации в мышиной последовательности, которые повышают активность. Сохраняют необычные остатки, которые прогнозируемо влияют на связывание, тогда как остатки, которые, как показывает прогноз, не являются важными для связывания, можно заменить. Дополнительными кандидатами на замену являются остатки незародышевой линии в акцепторной остовной области. Например, когда цепь акцепторного антитела (например, цепь человеческого антитела, в значительной степени идентичную цепи донорного антитела) выравнивают с цепью антитела заро- 14010902 дышевой линии (аналогичным образом в значительной степени идентичной донорной цепи), остатки, не соответствующие каркасу акцепторной цепи и каркасу цепи зародышевой линии, можно заменить на соответствующие остатки из последовательности зародышевой линии. Иные, нежели специфические аминокислотные замены, обсуждаемые выше, остовные области гуманизированных иммуноглобулинов обычно практически идентичны, и более обычно идентичны остовным областям человеческих антител, из которых они образованы. Конечно, многие аминокислоты остовной области вносят малый непосредственный вклад или не вносят никакого непосредственного вклада в специфичность или в аффинность антитела. Таким образом, многие отдельные консервативные замены остовных остатков могут допускаться без заметного изменения специфичности или аффинности получающегося в результате гуманизированного иммуноглобулина. Так, в одном варианте изобретения вариабельная остовная область гуманизированного иммуноглобулина по меньшей мере на 85% идентична последовательности человеческой вариабельной остовной последовательности или консенсусу таких последовательностей. В другом варианте изобретения вариабельная остовная область гуманизированного иммуноглобулина по меньшей мере на 90%, предпочтительно на 95%, еще более предпочтительно на 96-99% идентична последовательности человеческой вариабельной остовной последовательности или консенсусу таких последовательностей. Однако, в целом, такие замены нежелательны. Предпочтительно, когда гуманизированные антитела проявляют специфическую аффинность в отношении антигена, составляющую по меньшей мере 107-1010 М-1. Обычно верхний предел аффинности связывания гуманизированных антител с антигеном в 3, 4 или 5 раз больше верхнего предела аффинности связывания донорного иммуноглобулина. Часто нижний предел аффинности связывания также в 3, 4 или 5 раз больше нижнего предела аффинности связывания донорного иммуноглобулина. Или же аффинность связывания можно сравнить с аффинностью связывания гуманизированного антитела, не содержащего замен (например, антитела, содержащего донорные участки CDR и акцепторные FR, но не содержащего замены FR). В таких примерах предпочтительное связывание оптимизированного антитела(с заменами) по меньшей мере в 2-3 или в 3-4 раза больше, чем связывание незамещенного антитела. С целью сравнения можно определять активность различных антител, например, с помощью BIACORE(т.е. резонанса на длине волны поверхностного плазмона с применением немеченых реагентов) или анализами конкурентного связывания. Получение гуманизированных антител 12 В 4 Предпочтительный вариант настоящего изобретения включает гуманизированное антитело к N-концу A, в частности, для применения в терапевтических и/или диагностических методах по данному описанию. Особенно предпочтительным исходным материалом для получения гуманизированных антител является 12 В 4. 12 В 4 специфично в отношении N-конца A и, как было показано, опосредует фагоцитоз(например, индуцирует фагоцитоз) амилоидных бляшек. Клонирование и секвенирование кДНК, кодирующей вариабельные области тяжелой и легкой цепи антитела 12 В 4, описано в примере I. Соответствующие последовательности человеческого акцепторного антитела определяют с помощью компьютерного сравнения аминокислотных последовательностей вариабельных областей мышиного антитела с последовательностями известных человеческих антител. Сравнение осуществляют отдельно для тяжелой и для легкой цепей, но принципы этого сравнения одинаковы. В частности, вариабельные домены человеческих антител, в которых наблюдается высокая степень идентичности остовных последовательностей с мышиными VL и VH остовными областями, идентифицируют по запросу к базе данныхKabat, используя NCBI BLAST (доступ через интернет-сервер National Institutes of Health NCBI), с соответствующими мышиными остовными последовательностями. В одном варианте изобретения выбирают акцепторные последовательности, более чем на 50% идентичные мышиным донорным последовательностям. Предпочтительно выбирают последовательности акцепторных антител с идентичностью 60, 70, 80,90% или более. Компьютерное сравнение 12 В 4 показало, что последовательность легкой цепи 12 В 4 имеет наибольшую степень идентичности человеческим легким цепям подтипа каппа II и что у последовательностей тяжелых цепей 12 В 4 наиболее высокая степень идентичности человеческим тяжелым цепям подтипа II, по определению Kabat et al., см. выше. Таким образом, легкие и тяжелые человеческие остовные области предпочтительно получают из человеческих антител этих подтипов или из консенсусных (согласованных) последовательностей таких подтипов. Предпочтительные человеческие вариабельные области легкой цепи, которые наиболее идентичны соответствующей области 12 В 4, получены из антитела,имеющего по Kabat ID номер 005036. Предпочтительные человеческие вариабельные области тяжелой цепи, которые наиболее идентичны соответствующей области 12 В 4, получены из антитела, имеющего поKabat ID номер 000333, антитела, имеющего регистрационный номер в Genbank ААВ 35009, и антитела,имеющего регистрационный номер в Genbank AAD53816, причем предпочтительным является антитело,имеющее по Kabat ID номер 005036. Затем остатки для замены выбираются следующим образом. Если в вариабельной остовной области 12 В 4 и в эквивалентной человеческой вариабельной остовной области аминокислоты различаются, человеческую остовную аминокислоту обычно следует заменить эквивалентной остовной аминокислотой(1) непосредственно связывается с антигеном нековалентной связью,(2) прилегает к CDR-участку, является частью участка CDR по альтернативному определению,предложенному Clothia et al., см. выше, или другим способом взаимодействует с участком CDR (например, в пределах примерно 3 от участка CDR), или(3) участвует в VL-VH интерфейсе. Компьютерное моделирование вариабельных областей тяжелой и легкой цепей антитела 12 В 4 и гуманизация антитела 12 В 4 описаны в примере V. Коротко говоря, трехмерную модель создают на основе наиболее близких решенных структур мышиного антитела для тяжелой и легкой цепей. Модель далее уточняют с помощью нескольких стадий минимизации энергии для выявления нежелательных атомных контактов и оптимизации электростатических и ван-дер-ваальсовых взаимодействий. Информация о трехмерной структуре антител, представленных в данном описании, является общедоступной, ее можно получить в банке данных Research Collaboratory for Structural Bioinformatics' ProteinData Bank (PDB). Свободный доступ в PDB можно получить через World Wide Web (сеть интернет), иPDB описан Berman et al. (2000) Nucleic Acids Research, 28: 235. Компьютерное моделирование позволяет идентифицировать CDR-взаимодействующие участки. Компьютерное моделирование структуры 12 В 4 может, в свою очередь, служить отправной точкой для прогнозирования трехмерной структуры антитела,содержащего гипервариабельные участки 12 В 4, замещаемые в человеческих остовных структурах. Можно конструировать дополнительные модели, представляющие структуру, получающуюся по мере введения дополнительных аминокислотных замен. В целом, желательна замена одной, большинства или всех аминокислот, удовлетворяющих вышеуказанным критериям. Соответственно, гуманизированные антитела по настоящему изобретению обычно содержат замену остовного остатка человеческой легкой цепи соответствующим остатком 12 В 4 по меньшей мере в 1, 2, 3 или более выбранных положений. Гуманизированные антитела также обычно содержат замену остовного остатка человеческой тяжелой цепи соответствующим остатком 12 В 4 по меньшей мере в 1, 2, 3 или более выбранных положений. Однако иногда, когда имеется некоторая неясность, соответствует ли конкретная аминокислота вышеуказанным критериям, получают альтернативные варианты иммуноглобулинов, один из которых содержит эту конкретную замену, а другие нет. В примерах, в которых замена на остаток мышиной последовательности вводит остаток, редкий (минорный) для конкретного положения человеческого иммуноглобулина, желательным может быть тестирование антитела на активность с конкретной заменой и без нее. Если активность (например, аффинность связывания и/или специфичность связывания) с заменой и без замены примерно одинакова, может быть предпочтительным антитело без замены, так как полагают,что оно вызывает менее сильный НАМА-ответ по данному описанию. Другими кандидатами для замены являются человеческие остовные аминокислоты, необычные в данном положении для иммуноглобулинов. Эти аминокислоты могут быть заменены аминокислотами,находящимися в эквивалентном положении более типичных человеческих иммуноглобулинов. Или же аминокислоты в эквивалентных положениях в мышином 12 В 4 можно вводить в человеческие остовные области, когда такие аминокислоты являются типичными для человеческого иммуноглобулина в эквивалентных положениях. Другие кандидаты для замены представляют собой остатки незародышевой линии, расположенные в остовной области. Проведенное компьютерное сравнение 12 В 4 с известными последовательностями зародышевой линии показывает, что можно идентифицировать последовательности зародышевой линии с наибольшей степенью идентичности последовательностей тяжелой или легкой цепи. Совмещение (выравнивание) последовательностей остовной области и последовательности зародышевой линии выявляет,какие остатки можно выбрать для замены на соответствующие остатки зародышевой линии. Остатки выбранного акцепторного каркаса легкой цепи, не совпадающие с остатками одной из этих последовательностей зародышевой линии, можно выбирать для замены на соответствующий остаток зародышевой линии. В табл. 1 суммированы результаты анализа последовательностей областей VH и VL антитела 12 В 4. Представлены дополнительные мышиные и человеческие структуры, которые можно использовать для компьютерного моделирования антитела 12 В 4 и дополнительных человеческих антител, а также последовательности зародышевой линии, которые можно использовать при выборе аминокислотных замен. Редкие (минорные) остатки мышиных последовательностей также представлены в табл. 1. Редкие остатки мышиных последовательностей идентифицируют, сравнивая донорные VL и/или VH последовательности с последовательностями других членов подгруппы, к которой принадлежат донорные последовательности VL и/или VH (по Kabat), и определяют положения остатков, которые отличаются от консенсуса. Эти донорспецифические различия могут указывать на соматические мутации, которые повышают активность. Необычные или редкие остатки, расположенные рядом с сайтом связывания, вероятно, могут контактировать с антигеном, тогда желательно сохранить остаток мышиной последовательности. Однако, если необычный остаток мышиной последовательности не является важным для связывания, предпочтительно использовать соответствующий акцепторный остаток, так как остаток мышиной последова- 16010902 тельности может создать иммуногенные неоэпитопы в гуманизированном антителе. В тех ситуациях,когда необычный остаток в донорной последовательности, действительно, является обычным остатком в соответствующей акцепторной последовательности, предпочтительным, естественно, является акцепторный остаток. Таблица 1 Краткие сведения о последовательности V области антитела 12 В 4 Последовательности Kabat ID, на которые даны ссылки в данном описании, являются общедоступными, например, через базу данных Northwestern University Biomedical Engineering Department's KabatDatabase of Sequences of Proteins of Immunological Interest. Информацию о трехмерной структуре антител,представленную в данном описании, можно получить из банка данных Research Collaboratory for StructuralBioinformatics' Protein Data Bank (PDB). Свободный доступ в PDB можно получить через интернет (WorldWide Web), путь описан Berman et al. (2000) Nucleic Acids Research, p.235-242. Доступ к последовательностям гена зародышевой линии, на которые имеются ссылки в данном описании, можно получить через базу данных последовательностей в коллекциях V генов Igh, Ig каппа and Ig лямбда зародышевых линий(Национального Центра информации по биотехнологии (National Center for Biotechnology Information(NCBI (в качестве отделения Национальной медицинской библиотеки (National Library of Medicine(NLM при Национальном Институте здоровья (National Institutes of Health (NIH. Поиск гомологий в базе данных NCBI "Ig Germline Genes" ("Гены Ig зародышевой линии") предоставлен с помощью IgGBLAST. В предпочтительном варианте гуманизированное антитело по настоящему изобретению содержит:(i) легкую цепь, включающую вариабельный домен, содержащий участки CDR VL мышиного 12 В 4, и человеческий акцепторный каркас (остов), причем остов содержит по меньшей мере 1 остаток, замещенный на соответствующий остаток 12 В 4, и (ii) тяжелую цепь, включающую участки CDR VH 12B4 и человеческий акцепторный каркас (остов), причем остов содержит по меньшей мере 1, предпочтительно 29 остатков, замещенных на соответствующий остаток 12 В 4, и, необязательно, по меньшей мере 1, предпочтительно 2 или 3 остатка, замещенных на соответствующий остаток зародышевой линии человека. В другом предпочтительном варианте гуманизированное антитело по данному изобретению имеет структурные особенности по данному описанию и, кроме того, проявляет по меньшей мере одну (предпочтительно две, три, четыре или все) из следующих активностей: (1) связывает растворимый A;(2) связывает агрегированный A 1-42 (например, по определению методом ELISA); (3) связывает A в бляшках (например, окрашивание бляшек AD и/или PDAPP); (4) связывает A с аффинностью связывания, в 2-3 раза более высокой по сравнению с химерным 12 В 4 (например, с 12 В 4, содержащим последовательности мышиных вариабельных областей и последовательности человеческих константных областей); (5) опосредует фагоцитоз A (например, при анализе фагоцитоза ex vivo по данному описанию) и(6) преодолевает гематоэнцефалический барьер (например, демонстрирует кратковременную локализацию в мозгу, например, на животной модели PDAPP по данному описанию). В другом предпочтительном варианте гуманизированное антитело по данному изобретению имеет структурные особенности по данному описанию, связывает A до такой степени или с аффинностью,достаточной для проявления по меньшей мере одного из следующих in vivo эффектов: (1) уменьшение содержания A бляшек; (2) предупреждение образования бляшек; (3) снижение уровней растворимогоA; (4) уменьшение нейритной патологии, обусловленной амилоидным нарушением; (5) смягчение или ослабление по меньшей мере одного физиологического симптома, обусловленного амилоидным нарушением; и/или (6) улучшение когнитивной функции. В другом предпочтительном варианте гуманизированное антитело по данному изобретению имеет структурные особенности по данному описанию и специфически связывается с эпитопом, содержащим остатки 3-7 A. В другом предпочтительном варианте гуманизированное антитело по данному изобретению имеет структурные особенности по данному описанию, связывается с N-концевым эпитопом A (например,связывается с эпитопом, расположенном в аминокислотах 3-7 A) и способно уменьшать: (1) уровни A пептида; (2) содержание (нагрузку) А бляшек и (3) нейритную нагрузку или нейритную дистрофию,обусловленную амилоидным нарушением. Описанные выше типы активности можно определять, используя любой из множества методов анализа по данному описанию, или известных из уровня техники (например, методы анализа связывания,методы анализа фагоцитов и т.д.). Активности можно анализировать либо in vivo (например, используя методы анализа с мечеными компонентами и/или методы анализа изображения), или in vitro (например,используя образцы или препараты, полученные от субъекта). Активности можно анализировать либо непосредственно, либо опосредованно. В некоторых предпочтительных вариантах изобретения анализируют неврологические конечные показатели (точки) (например, амилоидную нагрузку, нейритную нагрузку и т.д.). Такие конечные показатели можно анализировать на живых объектах (например, на животных моделях болезни Альцгеймера или у человека, например, проходящего курс иммунотерапии), используя неинвазивные методы обнаружения. Или же такие конечные показатели можно анализировать в субъектах после смерти. Анализ таких конечных показателей на животных моделях и/или у человека после смерти применим для оценки эффективности различных агентов (например, гуманизированных антител),которые следует использовать для подобного иммунотерапевтического применения. В другом предпочтительном варианте изобретения поведенческие и неврологические параметры можно оценивать как индикаторы вышеописанных типов нейропатологической активности или конечных точек (показателей). Получение вариабельных областей Сделанный умозрительный выбор CDR и остовных компонентов гуманизированных иммуноглобулинов позволяет применять многие методы получения таких иммуноглобулинов. Вследствие вырожденности кода ряд нуклеотидных последовательностей кодирует каждую аминокислотную последовательность иммуноглобулина. Нужные нуклеотидные последовательности можно получать de novo твердофазным синтезом ДНК или ПЦР (PCR) мутагенезом ранее полученного варианта заданного полинуклеотида. Опосредованный олигонуклеотидами мутагенез является предпочтительным методом получения вариантов ДНК с заменами, делециями и инсерциями, кодирующей целевой полипептид. См. Alderman etal., DNA 2: 183 (1983). Короче говоря, ДНК, кодирующую целевой полипептид, изменяют гибридизацией олигонуклеотида, кодирующего заданную мутацию, с однонитевой ДНК-матрицей. После гибридизации используют ДНК-полимеразу для синтеза полной второй комплементарной нити матрицы, которая вводит олигонуклеотидный праймер и кодирует выбранное изменение в ДНК, кодирующей целевой полипептид. Отбор константных областей Вариабельные сегменты антител, получение которых описано выше (например, вариабельные области тяжелой и легкой цепи химерных или гуманизированных антител), как правило, связываются, по меньшей мере, с участком константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Человеческие последовательности ДНК константной области можно выделить, применяя хорошо известные методы, из ряда человеческих клеток, но предпочтительно иммортализованных Вклеток (Kabat et al., см. выше, и Liu et al., международная заявка WO87/02671) (каждый из источников вводится ссылкой во всей полноте для любых целей). Обычно антитело содержит константные области как легкой, так и тяжелой цепей. Константная область тяжелой цепи обычно включает участки СН 1,шарнирный, СН 2, CH3 и СН 4. Антитела по данному описанию включают антитела, содержащие все типы константных областей, включая IgM, IgG, IgD, IgA и IgE, и любой изотип, включая IgG1, IgG2, IgG3 иIgG4. Когда требуется, чтобы антитело (например, гуманизированное антитело) проявляло цитотоксическую активность, константный домен обычно представляет собой константный домен фиксации комплемента и класса, как правило, IgG1. Предпочтительным изотипом является изотип IgG1. Константные области легкой цепи могут быть лямбда или каппа. Гуманизированное антитело может содержать последовательности более чем одного класса или изотипа. Антитела могут экспрессировать в виде тетрамеров,- 18010902 содержащих две легкие и две тяжелые цепи, в виде отдельных тяжелых цепей, легких цепей, как Fab,Fab', F(ab')2 и Fv, или в виде одноцепных антител, в которых вариабельные домены тяжелой и легкой цепей связаны через спейсер. Экспрессия рекомбинантных антител Химерные и гуманизированные антитела получают обычно рекомбинантной экспрессией. Нуклеиновые кислоты, кодирующие вариабельные области легкой и тяжелой цепей, необязательно связанные с константными областями, встраивают в векторы экспрессии. Легкую и тяжелую цепи можно клонировать в один и тот же вектор экспрессии или в разные векторы экспрессии. Сегменты ДНК, кодирующие цепи иммуноглобулина, функционально связаны с регуляторными последовательностями в векторе(ах) экспрессии, который(е) обеспечивае(ю)т экспрессию полипептидов иммуноглобулина. Последовательности, контролирующие экспрессию, включают, но без ограничения, промоторы (например, ассоциируемые с природными или гетерологичные промоторы), сигнальные последовательности, энхансерные элементы и последовательности терминации транскрипции. Предпочтительно последовательности, контролирующие экспрессию, представляют собой эукариотические промоторные системы в векторах, способных трансформировать или трансфецировать эукариотические клетки-хозяева. Когда вектор внедрен в подходящий хозяин, хозяин выдерживают в условиях, пригодных для экспрессии нуклеотидных последовательностей на высоком уровне и для сбора и очистки перекрестно реагирующих антител. Эти векторы экспрессии обычно реплицируются в организмах-хозяевах либо в виде эписом, либо как неотъемлемая часть хромосомной ДНК хозяина. Обычно векторы экспрессии содержат селективные маркеры (например, устойчивости к ампициллину, устойчивости к гигромицину, устойчивости к тетрациклину, устойчивости к канамицину или устойчивости к неомицину) для того, чтобы можно было обнаруживать клетки, трансформированные при использовании заданных ДНК последовательностей (см.,например, Itakura et al., патент США 4704362). Е. coli представляет собой один из прокариотических хозяев, особенно пригодный для клонирования полинуклеотидов (например, последовательностей ДНК) по данному изобретению. Другие хозяева микробного происхождения, пригодные для использования, включают бациллы, такие как Bacillus subtilis, и другие энтеробактерии, такие как Salmonella, Serratia и различные виды Pseudomonas. В этих хозяевахпрокариотах можно также получать векторы экспрессии, которые, как правило, содержат последовательности, контролирующие экспрессию, совместимые с клетками-хозяевами (например, ориджин репликации). Кроме этого, может присутствовать любое количество различных хорошо известных промоторов,таких как промоторная система лактозы, промоторная система триптофана (trp), промоторная система бета-лактамазы или промоторная система фага лямбда. Как правило, промоторы контролируют экспрессию, необязательно при участии оператора, и имеют сайты связывания рибосом и т.п. для инициации и завершения транскрипции и трансляции. Другие микробы, такие как дрожжи, также применяют для экспрессии. Предпочтительным хозяином среди клеток дрожжей являются Saccharomyces с подходящими векторами, содержащими последовательности, контролирующие экспрессию (например, промоторы), ориджин репликации, терминирующие последовательности и т.п., по желанию. Типичные промоторы включают 3-фосфоглицераткиназу и другие гликолитические ферменты. Индуцибельные промоторы векторов дрожжей включают, наряду с другими, промоторы алкогольдегидрогеназы, изоцитохром С и ферменты, отвечающие за утилизацию мальтозы и галактозы. Помимо микроорганизмов, для экспрессии и продуцирования полипептидов по данному изобретению(например, полинуклеотидов, кодирующих иммуноглобулины или их фрагменты) можно также использовать клеточные культуры тканей млекопитающих. См. Winnacker, From Genes to Clones, VCH Publishers,N.Y., N.Y. (1987). На самом деле, предпочтительными являются эукариотные клетки, так как в технике получен ряд подходящих линий клеток-хозяев, способных секретировать гетерологичные белки (например, интактные иммуноглобулины), эти линии клеток-хозяев включают СНО клеточные линии, различные клеточные линии Cos, клетки HeLa, предпочтительно клеточные линии миеломы или трансформированные В-клетки или гибридомы. Предпочтительно эти клетки являются нечеловеческими клетками. Векторы экспрессии в этих клетках могут включать последовательности, контролирующие экспрессию,такие как ориджин репликации, промотор, энхансер (Queen et al., Immunol. Rev. 89: 49 (1986, и необходимые сайты информации о процессинге, такие как сайты связывания рибосом, сайты сплайсинга РНК,сайты полиаденилирования и последовательности терминации транскрипции. Предпочтительными последовательностями, контролирующими экспрессию, являются промоторы генов иммуноглобулина,SV40, аденовируса, вируса бычьей папилломы, цитомегаловируса и т.п. См. Со et al., J. Immunol. 148: 1149 (1992). Или же последовательности, кодирующие антитело, можно встраивать в трансгены для внедрения в геном трансгенного животного и последующей экспрессии в молоке трансгенного животного (см., например, Deboer et al., патент США 5741957, Rosen, патент США 5304489, и Meade et al., патент США 5849992). Подходящие трансгены включают последовательности, кодирующие легкую и/или тяжелую цепь при функциональном связывании с промотором и энхансером специфического гена молочной железы, такого как казеин или бета-лактоглобулин.- 19010902 Векторы, содержащие полинуклеотидные последовательности, представляющие интерес (например,кодирующие последовательности тяжелой и легкой цепей и контролирующие экспрессию), можно перенести в клетку-хозяин хорошо известными методами, которые меняются в зависимости от типа клеткихозяина. Например, в прокариотных клетках обычно используют трансфекцию с хлоридом кальция, тогда как кальций-фосфатный метод, электропорацию, липофекцию, бомбардировку микрочастицами или вирусную трансфекцию можно использовать для других клеток-хозяев (см., в целом, Sambrook et al., MolecularCloning: A Laboratory Manual (Cold Spring Harbor Press, 2nd ed., 1989) (вводится ссылкой во всей полноте для всех целей). Другие методы, применяемые для трансформации клеток млекопитающих, включают применение полибрена, слияние протопластов, липосомы, электропорацию и микроинъекции (Sambrooket al., см. выше, в целом). С целью получения трансгенных животных можно вводить трансгены в виде микроинъекций в оплодотворенные ооциты или можно внедрять в геном эмбриональных стволовых клеток, а ядра таких клеток переносить в безъядерные (энуклированные) ооциты. Когда тяжелую и легкую цепи клонируют в раздельные векторы экспрессии, векторы котрансфецируют, достигая экспрессии и упорядоченной структуры интактных иммуноглобулинов. После экспрессии целые антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулина по данному изобретению можно очищать стандартными методами, известными в технике, включая осаждение сульфатом аммония, аффинную колоночную хроматографию, колоночную хроматографию, ВЭЖХ,гель-электрофорез и т.п. (см., в целом, Scopes, Protein Purification (Springer-Verlag, N.Y., (1982. Для фармацевтических целей предпочтительными являются практически чистые иммуноглобулины с гомогенностью по меньшей мере около 90-95%, а наиболее предпочтительной является гомогенность 98-99% или выше. Фрагменты антител В объем настоящего изобретения также включены фрагменты антител. В одном варианте изобретения предлагаются фрагменты нечеловеческих и/или химерных антител. В другом варианте изобретения охватываются фрагменты гуманизированных антител. Как правило, эти фрагменты проявляют специфическое связывание с антигеном с аффинностью по меньшей мере 107, а более обычно 108 или 109 М-1. Фрагменты гуманизированных антител включают отдельные тяжелые цепи, легкие цепи, Fab, Fab',F(ab')2, Fabc и Fv. Фрагменты получают методом рекомбинантной ДНК или ферментативной или химической фрагментацией молекулы интактных иммуноглобулинов. Испытание терапевтической активности антител на животных моделях В группах 7-9-месячных мышей PDAPP каждой мыши инъецируют 0,5 мг поликлональных антител против A или специфических моноклональных антител против A в PBS. Все препараты антител очищают, чтобы они имели низкие уровни эндотоксинов. Можно получать моноклональные антитела против фрагмента, инъецируя фрагмент или более протяженную форму A мышам, получая гибридомы и проводя скрининг гибридом на антитело, которое специфически связывается с заданным фрагментом A, не связываясь с другими неперекрывающимися фрагментами A. Мышам инъецируют внутрибрюшинно (интраперитонеально) количество, необходимое, чтобы поддерживать в течение 4 месяцев в кровотоке концентрации антитела, измеряемые титром ELISA, более чем 1/1000, по определению методом ELISA, относительно A 42 или другого иммуногена. Осуществляют перманентный контроль титров и мышей умерщвляют по окончании 6-месячного периода инъекций. Гистохимические исследования, определение уровней A и токсикологические исследования осуществляют post mortem. В каждой группе по 10 мышей. Скрининг антител на активность очищения Данное изобретение также охватывает способы скрининга антитела на активность очищения от амилоидного отложения, или любого другого антигена, или ассоциированного биологического объекта,которое требует активности очищения. Для скрининга на активность против амилоидного отложения образец ткани мозга больного болезнью Альцгеймера или животная модель с характерной для болезни Альцгеймера патологией контактирует с фагоцитами, несущими рецептор Fc, такими как микроглия(микроглиоциты), и испытуемым антителом в среде in vitro. Фагоциты могут быть первичной культурой или клеточной линией и могут быть мышиного (например, клетки BV-2 или С 8-В 4) или человеческого(например, THP-1 клетки) происхождения. В некоторых методах компоненты объединяют в микроскопический препарат для упрощения контроля под микроскопом. В некоторых методах многократные реакции осуществляют параллельно в лунках микротитрационного планшета. В таком формате отдельный миниатюрный микроскопический препарат может быть заключен в отдельных лунках, или можно осуществлять детектирование в немикроскопическом формате, например обнаружение A методом ELISA. Предпочтительно делают серийные измерения количества амилоидного отложения в in vitro реакционной смеси, начиная с исходного (базового) значения перед началом реакции, и одно или более измерений делают в ходе реакции. Антиген можно обнаруживать по окрашиванию, например, антителом к A или к другому компоненту амилоидных бляшек, содержащим флуоресцентную метку. Антитело, используемое для окрашивания, может быть или не быть тем же самым, что и антитело, проверяемое на активность очищения (выведения). Уменьшение амилоидных отложений относительно базовой линии в ходе реак- 20010902 ции указывает, что испытуемое соединение обладает активностью очищения. По-видимому, такие антитела пригодны для предупреждения или лечения болезни Альцгеймера и других амилоидных заболеваний. Антитела, особенно пригодные для предупреждения или лечения болезни Альцгеймера и других амилоидных заболеваний, включают антитела, способные очищать как от компактных, так и диффузных амилоидных бляшек, например антитело 12 В 4 по данному изобретению или его химерные или гуманизированные версии. Аналогичные методы можно применять для скрининга антител на активность при выведении других типов органических объектов. Этот метод анализа можно применять для обнаружения активности выведения в отношении практически любого рода биологического объекта. Как правило,биологический объект играет некоторую роль в заболевании человека или животного. Биологический объект может быть представлен в виде тканевого образца или в выделенной (изолированной форме). Если он находится в виде тканевого образца, тканевый образец предпочтительно представляет собой нефиксированный тканевый образец, чтобы к компонентам тканевого образца был свободный доступ и чтобы избежать при фиксировании случайного нарушения конформации компонентов. Примеры тканевых образцов, которые можно анализировать этим методом, включают опухолевые ткани, предраковые ткани, ткани, содержащие доброкачественные новообразования, такие как бородавки или родимые пятна,ткани, инфицированные патогенными микроорганизмами, воспалительные инфильтраты, ткани с патологией межклеточного вещества (например, фибринозный перикардит), ткани, несущие аберрантные антигены, и рубцовые ткани. Примеры изолированных биологических объектов, которые можно использовать, включают A, вирусные антигены или вирусы, протеоглиганы, антигены или другие патогенные микроорганизмы, опухолевые антигены и адгезивные молекулы. Такие антигены можно получать из природных источников и, наряду с другими методами, рекомбинантной экспрессией или химическим синтезом. Образец ткани или выделенный биологический объект контактирует в среде с фагоцитами,несущими рецепторы Fc, такими как моноциты или микроглия, и испытуемым антителом. Антитело может быть специфично в отношении испытываемого биологического объекта или антигена, ассоциированного с объектом. В последнем случае осуществляют компенсаторный фагоцитоз испытуемого объекта либо биологического организма (объекта) при использовании антигена. Обычно, хотя и не обязательно, антитело и биологический объект (иногда с ассоциированным антителом) контактируют друг с другом перед добавлением к фагоцитам. Затем проводят мониторинг концентрации биологического объекта и/или ассоциированного антигена, остающегося (если они остаются) в среде. Уменьшение количества или концентрации антигена или ассоциированного биологического объекта в среде указывает на то, что антитело обладает активностью очищения (выведения) в отношении антигена и/или ассоциированного биологического объекта в сочетании с фагоцитами (см., например, пример IV). Химерные/гуманизированные антитела с измененной эффекторной функцией Для вышеописанных антител по изобретению, содержащих константную область (Fc-область), также может быть желательным изменять эффекторную функцию молекулы. Как правило, эффекторная функция антитела присуща Fc-области молекулы, которая может опосредовать связывание с различными эффекторными молекулами, например белками комплемента или рецепторами Fc. Связывание комплемента с Fc играет важную роль, например, в опсонизации и лизисе клеточных патогенов и активации воспалительных реакций. Связывание антитела с Fc-рецепторами, например, на поверхности эффекторных клеток может стимулировать ряд важных и разнообразных биологических реакций, включая, например, поглощение и деструкцию покрытых иммуноглобулиновой пленкой патогенов или частиц, клиренс иммунных комплексов, лизис покрытых иммуноглобулиновой пленкой клеток-мишеней клеткамикиллерами (т.е. антитело-обусловленная клеточно-опосредованная цитотоксичность, или ADCC), выброс воспалительных медиаторов, перенос антител через плаценту и регуляцию продукции иммуноглобулина. Соответственно, в зависимости от конкретного применения в терапии или диагностике могут быть желательны вышеуказанные иммунные функции или только выбранные иммунные функции. Изменяя область Fc антитела, осуществляют различные аспекты эффекторной функции молекулы, включая активацию или подавление различных реакций иммунной системы, для достижения благотворного воздействия при диагностике и в терапии. Можно получать такие антитела по изобретению, которые реагируют только с некоторыми типамиFc-рецепторов, например антитела по изобретению можно модифицировать таким образом, чтобы они связывались только с определенными Fc-рецепторами или, если требуется, чтобы совершенно отсутствовало Fc-рецепторное связывание, путем делеции или изменения сайта связывания Fc-рецептора, расположенного в Fc-области антитела. Другие желательные изменения Fc-области антитела по изобретению перечислены ниже. Как правило, для указания, какой(ие) аминокислотный(ые) остаток (остатки) Fc-области (например, IgG антитела) изменяют (например, заменой аминокислоты) для достижения желаемого изменения эффекторной функции, используют нумерацию Kabat. Систему нумерации также применяют для сравнения антител разных видов с тем, чтобы заданную эффекторную функцию, наблюдаемую, например, в мышином антителе, можно было затем методично воссоздать (конструировать) в человеческом, гуманизированном или химерном антителе по данному изобретению. Например, наблюдали, что антитела (например, IgG антитела) можно объединять в группы, в которых обнаруживается прочное, промежуточное или слабое связывание с Fc-рецептором (например, Fc- 21010902 рецептором на человеческих моноцитах (FcRI. Сайт связывания моноцита в шарнирно-связанной области (Leu234-Ser239) определяют путем сравнения аминокислотных последовательностей в этих группах с различной аффинностью. Помимо этого, человеческий FcRI рецептор связывает человеческийIgG1 и мышиный IgG2a как мономер, но связывание IgG2b в 100 раз слабее. Сравнение последовательности этих белков в шарнирно-связанной области показывает, что последовательность с 234 по 238 остаток, т.е. Leu-Leu-Gly-Gly- Pro, обеспечивающая прочное связывание, в мышином гамма 2b превращается в (становится) Leu-Glu-Gly-Gly-Pro, т.е. обеспечивающую слабое связывание. Таким образом, соответствующее изменение в шарнирной последовательности человеческого антитела можно осуществить, если желательно пониженное FcI рецепторное связывание. Понятно, что для достижения таких же или подобных результатов можно сделать другие изменения. Например, аффинность FcI связывания можно изменить, замещая специфичный остаток на остаток, имеющий в боковой цепи неподходящую функциональную группу, или вводя заряженную функциональную группу (например, Glu или Asp) или, например, ароматический неполярный остаток (например, Phe, Tyr или Trp). Эти изменения могут аналогично применяться к мышиным, человеческим и крысиным системам при наличии гомологий последовательностей в различных иммуноглобулинах. Было показано, что в случае человеческого FcRI рецептора изменение Leu235 на Glu нарушает взаимодействие мутанта и рецептора. Таким образом, сайт связывания этого рецептора можно "включать" или "выключать" с помощью таких мутаций. Мутации в прилегающих или близких сайтах в области шарнирного связывания (например, замена остатков 234, 236 или 237 на Ala) указывают на то, что изменения в остатках 234, 235, 236 и 237, по меньшей мере, влияют на аффинность связывания с FcRI рецептором. Таким образом, антитела по изобретению могут также содержать измененную Fc-область с измененной аффинностью связывания в отношении FcRI по сравнению с немодифицированным антителом. Такое антитело обычно содержит модификацию (изменение) в остатке аминокислоты в положении 234, 235, 236 или 237. Аналогично можно изменять аффинность в отношении других Fc-рецепторов, чтобы разными способами регулировать иммунный ответ. Еще один пример: можно менять литические свойства антител IgG путем связывания Cl компонента комплемента. Первый компонент системы комплемента, Cl, содержит три белка, известных как Clq, Clr и Cls, которые связаны вместе прочной связью. Было показано, что Clq отвечает за связывание комплекса, состоящего из трех белков, с антителом. Следовательно, Clq-связывающую активность антитела можно изменять, создавая антитела с измененным СН 2 доменом, в котором по меньшей мере один из аминокислотных остатков 318, 320 и 322 тяжелой цепи заменен на остаток с отличной боковой цепью. Нумерация остатков в тяжелой цепи представляет собой нумерацию по EU индексу (см. Kabat et al., см. выше). Другие подходящие изменения с целью получения различий, например, ослабление или отмену специфического Clq-связывания с антителом, включают замену любого из остатков 318 (Glu), 320 (Lys) и 322 (Lys) на Ala. Помимо этого, при проведении мутаций этих остатков было показано, что Clq-связывание сохраняется до тех пор, пока остаток 318 содержит боковую цепь, способную связываться водородной связью, а оба остатка, 320 и 322, содержат положительно заряженную боковую цепь. Активность Clq-связывания можно отменить, заменяя любой из трех специфичных остатков на остаток с неподходящей (неприсущей) функциональностью в его боковой цепи. Нет необходимости заменять ионные остатки только на Ala, чтобы отменить Clq связывание. Для отмены Clq связывания вместо любого из трех остатков можно также использовать другие алкилзамещенные неионные остатки, такие как Phe, Tyr, Trp и Pro. Кроме того, для отмены Clq связывания, вместо остатков 320 и 322, но не 318,можно также использовать такие полярные неионные остатки, как Ser, Thr, Cys и Met. Также отмечают, что боковые цепи ионных или неионных полярных остатков могут образовывать водородную связь аналогично остаткам Glu. Следовательно, замена остатка 318 (Glu) на полярный остаток может модифицировать, но не отменить Clq-связывающую активность. Известно также, что замена остатка 297 (Asn) на Ala вызывает исчезновение литической активности и в то же время лишь слабое уменьшение (примерно в 3 раза слабее) аффинности в отношении Clq. Это изменение нарушает сайт гликозилирования, и исчезает углевод, необходимый для активации комплемента. Любая другая замена в этом сайте также нарушает сайт гликозилирования. Изобретение также включает антитело с измененной эффекторной функцией, при этом антитело содержит модифицированный шарнирный участок (область). Модифицированная шарнирная область может содержать полную шарнирную область антитела класса или подкласса, отличного от класса или подкласса домена СН 1. Например, константный домен (СН 1) антитела класса IgG можно присоединить к шарнирной области антитела класса IgG4. Или же новая шарнирная область может содержать часть природного шарнира или чередующиеся элементы (единицы), в которых каждый элемент взят из природной шарнирной области. В одном примере природную шарнирную область изменяют, заменяя один или более цистеиновых остатков на нейтральный остаток, такой как аланин, или заменяя соответствующим об- 22010902 разом расположенные остатки на цистеин. Такие замены проводят, используя известные в химии белков химические методы, и предпочтительно методы рекомбинантной ДНК по данному описанию. В одном варианте изобретения число цистеиновых остатков в шарнирной области антитела уменьшают, например, до 1 цистеинового остатка. Преимущество этой модификации состоит в том, что она упрощает сборку антитела, например биспецифических молекул антитела и молекул антитела, в которыхFc-участок заменен на молекулу-эффектор или молекулу-репортер (контрольную, молекулу сравнения),так как необходимо лишь, чтобы образовалась одна дисульфидная связь. Эта модификация также создает специфическую мишень для присоединение шарнирной области либо к другой шарнирной области, либо к эффекторной или репортерной (контрольной) молекуле либо непосредственно, либо опосредованно,например химическими методами. И, напротив, число цистеиновых остатков в шарнирной области антитела увеличивают, например, по меньшей мере на 1 остаток по сравнению с обычно встречающимся числом цистеиновых остатков. Увеличение числа цистеиновых остатков можно использовать для стабилизации взаимодействия между прилегающими шарнирными областями. Другое преимущество этой модификации состоит в том, что она облегчает использование тиольных групп цистеина для присоединения эффекторных или репортерных молекул, например радиоактивной метки, к измененному антителу. Следовательно, данное изобретение охватывает обмен шарнирными областями между классами антител, в частности IgG классами, и/или увеличение или уменьшение числа цистеиновых остатков в шарнирной области с целью обретения или изменения эффекторной функции (см., например, патент США 5677425, который специально вводится в данное описание). Определение эффекторной функции измененного антитела проводят методами анализа по данному описанию или другими признанными в технике методами. Важно отметить, что полученное в результате антитело можно анализировать одним или более методов для оценки любого изменения биологической активности в сравнении с исходным антителом. Например, способность антитела с измененной Fc-областью связываться с комплементом или рецепторамиFc можно оценивать методами анализа по данному описанию, а также любыми известными в технике методами анализа. Получение антител по изобретению проводят любым подходящим методом, включая методы по данному описанию, а также методами, известными специалистам в данной области техники. Соответствующую аминокислотную (белковую) последовательность, например образующую часть релевантного константного домена или целый релевантный константный домен, например Fc-область, т.е. СН 2 и/илиCH3 домен(ы), антитела и включающую соответствующим образом измененный(е) (замененный(е остаток (остатки), можно синтезировать, а затем химическим методом ввести в нужное место в молекулы антитела. Предпочтительно для получения измененного антитела используют методы рекомбинантной ДНК. Предпочтительные методы включают, например, получение подходящих праймеров для применения в полимеразной цепной реакции (ПЦР), таких как последовательность ДНК, кодирующая по меньшей мере часть тяжелой цепи IgG, например Fc или константная область (например, СН 2 и/или CH3), изменяется по одному или более остатков. Затем сегмент можно функционально связать с остальной частью антитела, например с вариабельной областью антитела и нужными регуляторными элементами для экспрессии в клетке. Настоящее изобретение также включает векторы, применяемые для трансформации клеточной линии, векторы, применяемые для продуцирования трансформирующих векторов, клеточные линии,трансформированные трансформирующими векторами, клеточные линии, трансформированные препаративными векторами, и методы их получения. Предпочтительно клеточная линия, трансформированная таким образом, чтобы продуцировать антитело с измененной Fc-областью (т.е. измененной эффекторной функцией), представляет собой иммортализованную клеточную линию (например, СНО-клетку). Хотя клеточная линия, используемая для получения антитела с измененной областью Fc, является предпочтительно клеточной линией млекопитающего, в качестве альтернативы можно использовать любую другую подходящую клеточную линию, такую как клеточная линия бактерий или клеточная линия дрожжей. Нуклеиновые кислоты, кодирующие иммунологические и терапевтические агенты Иммунные реакции против амилоидных отложений можно также стимулировать, вводя нуклеиновые кислоты, кодирующие антитела и компоненты их цепей, применяемые для пассивной иммунизации. Такими нуклеиновыми кислотами могут быть ДНК или РНК. Сегмент нуклеиновой кислоты, кодирующий иммуноген, как правило, связан с регуляторными элементами, такими как промотор и энхансер, которые делают возможной экспрессию сегмента ДНК в предполагаемой клетке-мишени больного. Что касается контроля экспрессии в гемоцитах, желательной для индукции иммунного ответа, для этого пригодны промоторный и энхансерный элементы генов легкой или тяжелой цепи генов иммуноглобулина или ранний промотор и энхансер основного интермедиата CMV. Связанные регуляторные элементы и кодирующие последовательности часто клонируют в вектор. Для введения двухцепочечных антител можно клонировать две цепи в один и тот же вектор или в разные векторы.- 23010902 Пригодными являются многие вирусные векторные системы, включая ретровирусные системы (см.,например, Lawrie and Tumin, Cur. Opin. Genet. Develop. 3: 102-109 (1993; аденовирусные векторы (см.,например, Bett et al., J. Virol. 67: 5911 (1993; аденоассоциированные вирусные векторы (см., например,Zhou et al., J. Exp. Med. 179: 1867 (1994, вирусные векторы семейства поксвирусов, включая вирус коровьей оспы и вирусы оспы птиц, вирусные векторы рода альфа-вирусов, такие как полученные при использовании Синдбис вируса и вируса лесов Семлики (см., например, Dubensky et al., J. Virol. 70: 508(1996, венесуэльский вирус энцефалита лошадей (см. Johnston et al., патент США 5643576) и рабдовирусы, такие как вирус везикулярного стоматита (см. Rose, 6168943) и вирусы папилломы (Ohe et al., HumanAcids. Res. 24, 2630-2622 (1996. ДНК, кодирующая иммуноген, или содержащий ее вектор могут быть упакованы в липосомы. Соответствующие липиды и родственные аналоги описаны в Eppstein et al., патент США 5208036, Feigner etal., патент США 5264618, Rose, патент США 5279833, и Epand et al., патент США 5283185. Векторы и ДНК, кодирующие иммуноген, могут также адсорбироваться или ассоциироваться с конкретными носителями, примеры которых включают полимеры метилметакрилата и полилактиды и сополимеры лактидов с гликолидами (см., например, McGee et al., J. Micro Encap. (1996. Векторы генной терапии или "оголенные" (депротеинизированные) полинуклеотиды (например,ДНК) могут доставляться in vivo путем введения отдельному пациенту, как правило, путем системного введения (например, внутривенной, внутрибрюшинной (интраперитонеальной), назальной, желудочной,внутрикожной, внутримышечной, подкожной или интракраниальной инфузией) или путем местного введения (см., например, Anderson et al., патент США 5399346). Термин "оголенный (депротеинизированный) полинуклеотид" относится к полинуклеотиду, находящемуся не в виде комплекса с коллоидными материалами. "Оголенные" полинуклеотиды иногда клонируют в плазмидный вектор. Такие векторы могут дополнительно включать вспомогательные (способствующие) агенты, такие как бупивацин(Werner et al., патент США 5593970). ДНК можно также вводить, применяя генную пушку. XiaoBrandsma, см. выше. ДНК, кодирующая иммуноген, осаждается на поверхности микроскопических металлических гранул. "Микроснаряды" ускоряются за счет ударной волны или за счет расширения газообразного гелия и проникают в ткани на глубину нескольких слоев клеток. Подходящим является, например, устройство доставки гена (Gene Delivery Device) Accel, выпускаемое Agricetus, Inc. Middleton WI. Или же депротеинизированная ДНК может проникать в кровоток через кожу при нанесении на кожу пятен ДНК с одновременным химическим или механическим раздражением (см. Howell et al., международная заявка WO 95/05853). В дополнительном варианте векторы, кодирующие иммуногены, можно доставлять ex vivo к клеткам, таким как клетки, взятые у отдельного пациента (например, лимфоциты, аспираты костного мозга,биопсия тканей), или универсальные донорные гемопоэтические стволовые клетки, с последующей повторной имплантацией клеток больному, как правило, после отбора клеток, в которые внедрен вектор. Методы профилактики и лечения Настоящее изобретение относится, наряду с остальным, к лечению болезни Альцгеймера и других амилоидных заболеваний с помощью терапевтических иммунологических реагентов (например, гуманизированных иммуноглобулинов) к специфическим эпитопам в A в условиях, которые вызывают благотворную терапевтическую реакцию у больного (например, индукцию фагоцитоза А, уменьшение содержания ("нагрузки") бляшек, ингибирование образования бляшек, уменьшение нейритной дистрофии,улучшение когнитивной функции и/или реверсию, лечение или предупреждение когнитивного заболевания), например, в отношении предупреждения или лечения амилоидного заболевания. Изобретение также относится к применению охватываемых им иммунологических реагентов (например, гуманизированных иммуноглобулинов) для производства лекарственного препарата для лечения и предупреждения амилоидного заболевания. В одном аспекте данное изобретение охватывает способы предупреждения или лечения заболевания, обусловленного амилоидными отложениями A в тканях мозга больного. Такие заболевания включают болезнь Альцгеймера, синдром Дауна и ухудшение когнитивной функции. Последнее может наблюдаться наряду с другими признаками амилоидного заболевания или в их отсутствие. Некоторые способы по изобретению охватывают применение эффективной дозы антитела, которое специфически связывается с компонентом амилоидных отложений у больного. Такие методы особенно пригодны для лечения болезни Альцгеймера у человека. Приведенные в качестве примеров методы включают введение эффективной дозы антитела, которое связывается с A. Предпочтительные способы включают введение эффективной дозы антитела, которое специфически связывается с эпитопом внутри остатков 1-10 A,например таких антител, которые специфически связываются с эпитопом внутри остатков 1-3 A, антител, которые специфически связываются с эпитопом внутри остатков 1-4 A, антител, которые специфически связываются с эпитопом внутри остатков 1-5 A, антител, которые специфически связываются с эпитопом внутри остатков 1-6 A, антител, которые специфически связываются с эпитопом внутри остатков 1-7 A, или антител, которые специфически связываются с эпитопом внутри остатков 3-7 A. Еще- 24010902 в одном аспекте данное изобретение охватывает применение антител, которые связываются с эпитопом,содержащим свободный N-концевой остаток A. Еще в одном аспекте данное изобретение включает применение антител, которые связываются с эпитопом внутри остатков 1-10 A, причем остаток 1 и/или остаток 7 A представляет собой аспарагиновую кислоту. Еще в одном аспекте данное изобретение включает применение антител, которые специфически связываются с пептидом A, не связываясь с полноразмерным амилоидным белком-предшественником (АРР). Еще в одном аспекте изобретения изотип антитела представляет собой человеческий IgG1. Еще в одном аспекте данное изобретение включает применение антител, которые связываются с амилоидными отложениями у больного и индуцируют реакцию выведения (клиринга) компонентов амилоидных отложений. Например, на такую реакцию выведения может влиять фагоцитоз, опосредуемый рецептором Fc. Терапевтические агенты по изобретению, как правило, являются практически очищенными от нежелательных примесей. Это означает, что агент, как правило, имеет чистоту по крайней мере 50 вес.%, а также практически не содержит вредных белков и примесей. Иногда агенты имеют чистоту по меньшей мере около 80 вес.%, и более предпочтительно чистоту по меньшей мере 90 или около 95 вес.%. Однако с помощью обычных методов очистки белков можно получать гомогенные белки с чистотой по меньшей мере 99 вес.%. Эти способы можно применять как в отношении бессимптомных больных, так и в отношении больных с симптомами заболевания. Антитела, используемые в этих методах, могут быть человеческими,гуманизированными, химерными или нечеловеческими антителами или их фрагментами (например, антигенсвязывающими фрагментами) и могут быть моноклональными или поликлональными, как показано в данном описании. Еще в одном аспекте данное изобретение включает применение антител человека,иммунизированного пептидом A, причем этот человек может быть больным, который подлежит лечению с применением антитела. В другом аспекте изобретение охватывает применение фармацевтической композиции, содержащей антитело и фармацевтический носитель. Или же антитело можно вводить больному, вводя полинуклеотид, кодирующий по меньшей мере одну цепь антитела. Полинуклеотид экспрессирует, продуцируя в организме больного цепь антитела. Необязательно, полинуклеотиды кодируют тяжелую и легкую цепи антитела. Полинуклеотид экспрессирует, продуцируя в организме больного тяжелую и легкую цепи антитела. В примерах вариантов изобретения осуществляют постоянный контроль уровня вводимого антитела в крови больного. Таким образом, данное изобретение восполняет давно существующую потребность в лечебной схеме для предупреждения или ослабления клинической невропатологии и, у некоторых больных, ослабления познавательных способностей, обусловленных болезнью Альцгеймера. Больные, подлежащие лечению Больные, подлежащие лечению, включают людей с повышенным риском заболевания, но без проявления симптомов, а также больных с наблюдаемыми симптомами. Что касается болезни Альцгеймера,фактически, любой человек находится в состоянии повышенного риска заболеть болезнью Альцгеймера,если он или она живет достаточно долго. Следовательно, способы по настоящему изобретению можно применять для профилактики целой популяции, и нет необходимости в какой-либо оценке повышенного риска для подлежащего профилактике пациента. Способы по настоящему изобретению особенно применимы для людей с заведомым повышенным риском заболевания болезнью Альцгеймера. В эту категорию входят пациенты, имеющие родственников, болеющих (болевших) этим заболеванием, и те, у которых повышенный риск заболеть обнаружен анализом генетических и биохимических маркеров. Генетические маркеры повышенного риска заболевания болезнью Альцгеймера включают мутации в гене АРР, в частности мутации в положении 717 и в положениях 670 и 671, называемые мутациями Hardy и Swedish(шведская), соответственно (Hardy, см. выше). Другими маркерами повышенного риска являются мутации в пресенильных генах, PS1 и PS2, и АроЕ 4, семейный анамнез относительно AD, гиперхолистеринемия или атеросклероз. Больных болезнью Альцгеймера можно узнать по характерной деменции, а также по наличию вышеописанных факторов повышенного риска. Помимо этого, имеется ряд диагностических методов идентификации людей с AD. Эти методы включают определение уровней CSF тау и А 42. Повышенные уровни тау и пониженные уровни описанного А 42 определяют наличие AD. Диагноз "болезнь Альцгеймера" можно также установить с помощью критерия ADRDA, как обсуждается в разделе "Примеры". У бессимптомных больных лечение можно начинать в любом возрасте (например, в 10, 20, 30 лет). Обычно, однако, нет необходимости начинать лечение до достижения пациентом 40, 50, 60 или 70 лет. Лечение, как правило, включает многократные дозы в течение некоторого периода времени. Лечение можно контролировать, определяя уровни антител во времени. Если реакция ослабевает, показана бустерная доза. У больных с возможным синдромом Дауна лечение можно начинать в предродовой период,вводя терапевтический агент матери, или вскоре после рождения. Схемы лечения и дозировки В профилактических целях фармацевтические композиции или лекарственные вещества вводят- 25010902 больному, восприимчивому к болезни Альцгеймера, или с повышенным риском заболевания ею, в количестве, достаточном для ликвидации или уменьшения риска, уменьшения тяжести или задержки начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, присутствующие в ходе развития заболевания. В терапевтических целях композиции или лекарственные вещества вводят больному, у которого подозревают такое заболевание или уже страдающему этим заболеванием, в количестве, достаточном для лечения или, по меньшей мере, частичного прекращения симптомов заболевания (биохимических, гистологических и/или поведенческих), включая его осложнения и промежуточные патологические фенотипы в ходе развития заболевания. В некоторых способах введение агента уменьшает или ликвидирует ухудшение познавательной функции у больных, у которых еще не проявилась патология, характерная для болезни Альцгеймера. Количество, позволяющее адекватно выполнять терапевтическое или профилактическое лечение, называют терапевтически или профилактически эффективной дозой. Как по профилактической, так и по терапевтической схемам агенты обычно вводят в виде нескольких доз до достижения удовлетворительного иммунного ответа. Термин "иммунный ответ (иммунная реакция)"или "иммунологический ответ (или иммунологическая реакция)" включает развитие гуморального (опосредуемого антителом) и/или клеточного (опосредуемого антигенспецифическими Т-клетками или другими продуктами секреции) ответа, направленного против антигена в реципиенте. Такой ответ может быть активным ответом, т.е. индуцированным введением иммуногена, или пассивным ответом, т.е. индуцированным введением иммуноглобулина, или антитела, или примированных Т-клеток. Как правило, иммунный ответ контролируют и, когда он начинает ослабевать, дают многократные дозы. Эффективные дозы композиций по данному изобретению для лечения вышеописанных состояний меняются в зависимости от многих различных; факторов, включая способ применения, нацеленный сайт,физическое состояние больного, вне зависимости от того, человек это или животное, другие вводимые лекарственные вещества, то, является ли лечение профилактическим или терапевтическим. Обычно пациентом является человек, но можно также лечить иных млекопитающих, нежели человек, включая трансгенных млекопитающих. Чтобы достичь оптимальной безопасности и эффективности, нужно определять титр лечебной дозы. Для пассивной иммунизации антителом интервалы доз составляют около 0,0001-100 мг/кг и более обычно 0,01-5 мг/кг веса тела хозяина (например, 0,02, 0,25, 0,5, 0,75, 1, 2 мг/кг и т.д.) веса тела хозяина. Например, дозы могут составлять 1 или 10 мг/кг веса тела или быть в пределах 1-10 мг/кг, предпочтительно по меньшей мере 1 мг/кг. Дозы, имеющие значение в пределах вышеприведенных интервалов,также входят в объем настоящего изобретения. Дозы субъектам можно вводить ежедневно, через день,еженедельно или по любой другой схеме, определяемой эмпирическим путем. Пример лечения включает введение в виде многократных доз в течение длительного периода, например по меньшей мере в течение 6 месяцев. Другие примеры схемы лечения включают введение 1 раз каждые 2 недели или 1 раз в месяц каждые 3-6 месяцев. Примерные схемы применения лекарственных препаратов включают введение 1-10 или 15 мг/кг ежедневно, 30 мг/кг через день или 60 мг/кг еженедельно. В некоторых способах одновременно вводят два или более моноклональных антител с различной специфичностью связывания, в этом случае вводимая доза каждого антитела находится в указанных интервалах. Антитело обычно вводят многократно. Интервалы между однократными дозами могут составлять неделю, месяц или год. Интервалы также могут быть нерегулярными, по показаниям измерения уровней антител к A в крови пациента. В некоторых методах дозы корректируют для достижения концентрации антитела в плазме, равной 1-1000 мкг/мл и, в некоторых методах, 25-300 мкг/мл. Или же антитело можно вводить в виде препарата пролонгированного действия, в этом случае требуется менее частое введение. Доза и частота введения меняются в зависимости от полупериода существования (периода полужизни) антитела в организме больного. В целом, гуманизированные антитела имеют самый продолжительный полупериод существования, затем идут химерные антитела и нечеловеческие антитела. Доза и частота введения могут меняться в зависимости от того, является ли лечение профилактическим или терапевтическим. В случае применения в профилактических целях композиции, содержащие антитела по данному изобретению или их смесь (коктейль), вводят пациенту еще не в стадии болезни с целью повысить сопротивляемость его организма. Такое количество называют "эффективная профилактическая доза". При таком применении точные количества также зависят от состояния здоровья и общего иммунитета пациента, но, в целом, находятся в пределах 0,1-25 мг на дозу, главным образом, 0,5-2,5 мг на дозу. Относительно низкую дозу вводят через сравнительно продолжительные интервалы в течение продолжительного периода времени. Некоторые пациенты продолжают получать лечение до конца жизни. При применении в терапевтических целях иногда требуются относительно высокие дозы (например, около 1-200 мг антитела на дозу, при этом наиболее употребительными являются дозы 5-25 мг) через сравнительно короткие интервалы до тех пор, пока развитие болезни не замедлится или не прекратится, и предпочтительно до тех пор, пока у больного не будет наблюдаться частичное или полное ослабление симптомов заболевания. Затем больному можно вводить препарат по профилактической схеме. Интервалы доз нуклеиновых кислот, кодирующих антитела, составляют около 10 нг-1 г, 100 нг-100 мг,- 26010902 1 мкг-10 мг или 30-300 мкг ДНК на одного пациента. Дозы инфицирующих вирусных векторов варьируются от 10 до 100 или более вирионов на дозу. С целью профилактики и/или лечения терапевтические агенты можно вводить парентерально, местно, внутривенно, перорально, подкожно, внутриартериально,интракраниально (внутримозговым способом), внутрибрюшинно (интраперитонеально), назально или внутримышечно. Наиболее обычным способом применения иммуногенного агента является подкожный,хотя другие способы могут оказаться равно эффективными. Следующим наиболее употребительным способом является внутримышечная инъекция. Эти инъекции наиболее часто делают в мышцы руки или ноги. В некоторых способах агенты инъецируют непосредственно в конкретную ткань, в которой аккумулируются отложения, примером является интракраниальная инъекция. Внутримышечная инъекция или внутривенная инфузия предпочтительны для введения антитела. В некоторых способах конкретные терапевтические антитела инъецируют непосредственно в череп. В некоторых способах антитела вводят в виде композиции пролонгированного действия или в виде устройства, такого как устройствоMedipad. Агенты по изобретению можно необязательно вводить в комбинации с другими агентами, которые,по меньшей мере, частично эффективны при лечении амилоидного заболевания. В случае болезни Альцгеймера и синдрома Дауна, при которых в мозгу образуются амилоидные отложения, агенты по изобретению можно также вводить в сочетании с другими агентами, которые повышают способность проникать через гематоэнцефалический барьер. Агенты по изобретению можно также вводить в комбинации с другими агентами, которые повышают доступ терапевтического агента к клетке-мишени или к тканимишени, например, с липосомами. При совместном применении таких агентов может повышаться доза терапевтического агента (например, терапевтического антитела или цепи антитела), необходимого для достижения заданного эффекта. Фармацевтические композиции Агенты по изобретению часто применяют в виде фармацевтических композиций, содержащих активный терапевтический агент и ряд других фармацевтически приемлемых компонентов. См. Remington'sPharmaceutical Science (15th ed., Mack Publishing Company, Easton, Pennsylvania (1980. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Композиции также могут включать, в зависимости от требуемой рецептуры, фармацевтически приемлемые нетоксические носители или разбавители, которые называют наполнителями, обычно применяемые для приготовления фармацевтических композиций для введения животному или человеку. Разбавитель выбирают таким образом, чтобы не влиять на биологическую активность комбинации. Примерами таких разбавителей (растворителей) являются дистиллированная вода, физиологический раствор с фосфатным буфером(забуференный фосфатом), растворы Рингера, раствор декстрозы и раствор Хэнка (Hank). Помимо этого,фармацевтическая композиция или препарат может также включать другие носители, адъюванты или нетоксические, нетерапевтические, неиммуногенные стабилизаторы и т.п. Фармацевтические композиции могут также включать большие медленно метаболизирующиеся макромолекулы, такие как белки,полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (такие, как латекс с сефарозой (ТМ), агарозой, целлюлозой и т.п.), полимерные аминокислоты, сополимеры аминокислот и липидные агрегаты (такие, как капельки масла или липосомы). Помимо этого, эти носители могут действовать как иммуностимулирующие агенты (т.е. адъюванты). Для парентерального введения агенты по изобретению можно вводить в инъецируемой лекарственной форме в виде раствора или суспензии вещества в физиологически приемлемом разбавителе с фармацевтическим носителем, который может быть стерильной жидкостью, такой как вода, масла, физиологический раствор, глицерин или этанол. Кроме этого, в композиции могут присутствовать вспомогательные вещества, такие как смачивающие вещества или эмульгаторы, поверхностно-активные вещества, рНбуферизующие вещества и т.п. Другими компонентами фармацевтических композиций являются вещества, полученные из нефти, вещества животного, растительного или синтетического происхождения, например арахисовое масло, соевое масло и минеральное масло. В целом, предпочтительными жидкими носителями, особенно для инъецируемых растворов, являются гликоли, такие как пропиленгликоль или полиэтиленгликоль. Антитела можно вводить в форме депо-инъекций или имлантатов препаратов, которые можно готовить таким образом, чтобы сделать возможным пролонгированное выделение активного ингредиента. Примерная композиция содержит 5 мг/мл моноклонального антитела в водном буфере, состоящем из 50 мМ L-гистидина, 150 мМ NaCl, рН которого с помощью HCl доводят до 6,0. Как правило, композиции готовят в виде инъецируемых препаратов, либо в виде жидких растворов,либо в виде суспензий; также можно готовить твердые формы для растворения или суспендирования в жидких носителях перед инъекцией. Препарат можно также эмульгировать или инкапсулировать в липосомы или микрочастицы, такие как полилактидные, полигликолидные или сополимерные микрочастицы,с целью повышенного адъювантного эффекта, как обсуждалось выше (см. Langer, Science 249: 1527(1990) и Hanes, Advanced Drug Delivery Reviews 28: 97 (1997. Агенты по данному изобретению можно вводить в форме депо-инъекции (инъекции вещества замедленного всасывания) или имплантированного препарата, которые можно приготовить таким образом, чтобы выделение активного ингредиента было пролонгированным или происходило в пульсовом режиме.- 27010902 Дополнительные препараты, пригодные для других способов введения, включают препараты для перорального, назального и легочного введения, суппозитории и трансдермальные пластыри. Связующие и носители для суппозиториев включают, например, полиалкиленгликоли или триглицериды; такие суппозитории можно готовить из смесей, содержащих активный ингредиент в пределах 0,5-10%, предпочтительно 1-2%. Пероральные препараты включают эксципиенты, такие как маннит, лактоза, крахмал, стеарат магния, сахариннатрий, целлюлоза и карбонат магния фармацевтической степени чистоты. Эти композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, препаратов пролонгированного действия или порошков и содержат 10-95% активного ингредиента, предпочтительно 25-70%. Местное применение может осуществляться с помощью трансдермальной (чрескожной) или интрадермальной (внутрикожной) доставки. Местное введение можно облегчить путем совместного введения агента с холерогеном или его производными или субъединицами после детоксикации или с другими аналогичными бактериальными токсинами (см. Glenn et al., Nature 391, 851 (1998. Совместное введение можно осуществлять, применяя компоненты в виде смеси или в виде связанных молекул, полученных химическим методом сшивания или экспрессией в виде слитого белка. Или же трансдермальную доставку можно осуществлять, используя кожный пластырь или трансферосомы (Paul et al., Eur. J. Immunol. 25: 3521 (1995); Cevc et al., Biochem. Biophys. Acta 1368: 201-15 (1998. Мониторинг курса лечения Данное изобретение охватывает способы мониторинга в ходе лечения больных, страдающих восприимчивостью к болезни Альцгеймера, т.е. мониторинга курса лечения, проводимого в отношении пациента. Эти способы применимы для контроля как терапевтического лечения пациентов с симптомами,так и профилактического лечения бессимптомных пациентов. В частности, способы применимы для мониторинга пассивной иммунизации (например, измерения уровня вводимого антитела). Некоторые способы включают определение базового (исходного) значения, например уровня антитела или профиля (характеристик) пациента, перед введением дозы агента и сравнение их со значением для профиля или уровня после лечения. Значительное увеличение (т.е. больше, чем обычный предел экспериментальной ошибки при повторных измерениях того же образца, выраженный как стандартная девиация от среднего значения при измерениях) величины уровня или профиля является показателем положительного результата лечения (т.е. что введение агента достигло желаемого ответа). Если величина иммунного ответа меняется незначительно или уменьшается, это является показателем отрицательного результата. В других методах контрольное значение (т.е. среднее и стандартное отклонение, средняя и стандартная девиация) уровня или профиля определяют для контрольной популяции. Как правило, пациенты из контрольной популяции ранее не получали лечения. Затем измеренные значения уровня или профиля у больного после введения терапевтического агента сравнивают с контрольным значением. Значительное увеличение относительно контрольного значения (например, более одного стандартного отклонения от среднего) указывает на положительный или удовлетворительный результат лечения. Отсутствие достаточного увеличения или понижение сигнализирует об отрицательном или неудовлетворительном результате лечения. Введение агента, как правило, продолжается, пока уровень повышается относительно контрольного значения. Как и ранее, достижение плато относительно контрольных значений является показателем того, что лечение можно прекратить или уменьшить дозу и/или частоту. В других способах контрольное значение уровня или профиля (например, среднее плюс стандартное отклонение) определяют у контрольной группы пациентов, которые не подвергались ранее лечению терапевтическим агентом и у которых в ответ на лечение наблюдается плато в значениях уровней или профилей. Измеренные значения уровней или профилей пациента сравнивают с контрольным значением. Если измеренный уровень у пациента незначительно отличается (например, более одного стандартного отклонения) от контрольного значения, лечение можно прекратить. Если уровень у больного значительно ниже контрольного значения, продолжение применения агента является оправданным. Если уровень у больного продолжает оставаться ниже контрольного значения, тогда больному может быть показано другое лечение. В других способах у пациента, который в настоящее время не получает лечения, но проходил курс лечения ранее, контролируют уровень антител или профили с целью определения, требуется ли возобновление лечения. Измеренный уровень или профиль больного можно сравнить со значением, полученным у больного ранее, после предыдущего курса лечения. Значительное уменьшение относительно предыдущего измерения (т.е. больше, чем обычный предел ошибки при повторных измерениях того же образца (той же выборки указывает на то, что лечение можно возобновить. Или же значение, измеренное у больного, можно сравнивать с контрольным значением (среднее плюс стандартное отклонение), определяемым в группе пациентов после проведения курса лечения. Или же измеренное значение можно сравнивать с контрольным значением в популяции профилактически пролеченных пациентов, у которых по-прежнему отсутствуют симптомы заболевания, или в популяции терапевтически пролеченных пациентов, у которых наблюдается уменьшение интенсивности симптомов заболевания. Во всех этих случаях значительное уменьшение относительно контрольного уровня (т.е. более стандартного отклонения) является показателем того, что лечение пациента следует возобновить. Лабораторным образцом ткани для анализа обычно является кровь, плазма, сыворотка, слизь или- 28010902 цереброспинальная жидкость (ликвор) пациента. В образце анализируют, например, уровни или профили антител к пептиду A, например уровни или профили гуманизированных антител. Методы ELISA для обнаружения антител, специфических в отношении A, описаны в разделе "Примеры". В некоторых методах уровень или профиль вводимого антитела определяют, применяя анализ очищения (выведения,клиринга), например анализ фагоцитов in vitro, как представлено в данном описании. В таких методах анализируемый образец ткани пациента контактирует с амилоидными отложениями (например, мышиPDAPP) и фагоцитами, несущими рецепторы Fc. Проводят мониторинг последующего выведения амилоидного отложения (очищения от амилоидного отложения). Наличие и величина реакции очищения указывают на присутствие и уровень антител, эффективных для очищения от A в тканевом образце испытуемого пациента. На кривой концентрации антитела сразу после пассивной иммунизации обычно имеется пик с последующим экспоненциальным спадом. Без дополнительной дозы спад приближается к уровням до начала лечения в течение периода от нескольких дней до нескольких месяцев в зависимости от полупериода существования вводимого антитела. В некоторых методах перед введением делают базовое (начальное) измерение антитела к A у больного, второе измерение делают вскоре после введения для определения максимального уровня антител и одно или более дополнительных измерений делают с перерывами для контроля падения уровней антител. Когда уровень антитела падает до базовой линии или до более низкого, чем предварительно определенное пиковое, базового значения (например, 50, 25 или 10%), предпринимают введение дополнительной дозы. В некоторых методах максимальное (пик) значение или последующие измеряемые уровни, более низкие, чем базовые, сравнивают с определенными ранее стандартными уровнями с целью найти наиболее подходящую схему профилактического или терапевтического лечения других пациентов. Если измеренный уровень антитела значительно ниже, чем стандартный уровень (например, ниже, чем среднее значение минус стандартное отклонение от эталонного значения в группе пациентов, которым лечение помогло), то показано дополнительное введение дозы антитела. Другие методы включают мониторинг, в ходе лечения, любого общепризнанного в технике физиологического симптома (например, физического или ментального симптома), на который обычно опираются исследователи или врачи при диагностике или мониторинге амилоидных заболеваний (например,болезни Альцгеймера). Например, можно контролировать когнитивное ухудшение (ослабление умственной деятельности). Последнее является симптомом болезни Альцгеймера и синдрома Дауна, но встречается также при отсутствии других признаков любого из этих заболеваний. Например, когнитивное ухудшение в течение курса лечения можно контролировать, определяя балл больного в "мини-экзамене", определяющем его умственное состояние (Mini-Mental State Exam) в соответствии с принятыми нормами. Наборы Данное изобретение охватывает далее наборы для осуществления описанных выше методов мониторинга. Как правило, такие наборы содержат агент, который специфически связывается с антителом кA. Набор может также содержать метку (реагент для мечения). Для обнаружения антител к A метка,как правило, находится в виде меченых антиидиотипических антител. Для обнаружения антител агент может поставляться в виде предварительно связанного с твердой фазой (иммобилизованного на твердой фазе), такой, например, как лунки микротитрационного планшета. Наборы также обычно содержат документацию с сопроводительными инструкциями по применению набора. Документация может также включать таблицу или другую соответствующую схему корреляции уровней определяемой метки с уровнями антител к A. Термин "документация" относится к любому написанному или зарегистрированному материалу, который к этому прилагается или иным образом сопровождает набор в ходе производства,транспорта, продажи или применения. Например, термин "документация, сопроводительные материалы" охватывает листовки, брошюры, упаковочные материалы, инструкции, аудио- и видеокассеты, компьютерные диски, а также инструкции, напечатанные непосредственно на наборах. Данное изобретение также включает диагностические наборы, например наборы для исследования,обнаружения и/или диагностики (например, для визуализации in vivo). Такие наборы обычно содержат антитело для связывания с эпитопом A, предпочтительно внутри остатков 1-10. Предпочтительно антитело метят или в набор включают вторичный реагент для мечения. Предпочтительно в набор включают вкладыш или этикетку с инструкциями по соответствующему применению, например по осуществлению визуализации in vivo. Примеры антител представлены в данном описании.In vivo визуализация Данное изобретение охватывает способы in vivo визуализации амилоидных отложений у больных. Такие способы применимы для диагностики или подтверждения диагноза болезни Альцгеймера или восприимчивости к ней. Например, можно использовать эти методы в отношении больного с симптомами деменции. Если у больного наблюдаются аномальные амилоидные отложения, он, по-видимому, страдает болезнью Альцгеймера. Эти способы могут также использоваться для бессимптомных пациентов. Наличие аномальных отложений амилоида указывает на предрасположенность к будущему симптомному заболеванию. Способы по изобретению также применимы для мониторинга развития заболевания и/или- 29010902 реакции на лечение больных, у которых ранее была диагностирована болезнь Альцгеймера. Эти методы осуществляют путем введения пациенту реагента, такого как антитело, которое связывается с A, и последующего обнаружения агента после его связывания. Предпочтительные антитела связываются с отложениями A в организме пациента, не связываясь с полноразмерным полипептидом АРР. Антитела, связывающиеся с эпитопом A в аминокислотах 1-10, являются особенно предпочтительными. В некоторых методах антитела связываются с эпитопом, находящимся в аминокислотных остатках 7-10 полипептида A. Такие антитела обычно связываются, не вызывая заметной реакции очищения. В других методах антитело связывается с эпитопом во фрагменте, содержащем аминокислоты 1-7A. Такие антитела обычно связываются с A и индуцируют клиринг A. Однако реакцию очищения(клиринг) можно избежать, используя фрагменты антитела, у которых отсутствует полноразмерная константная область, такие как Fabs. В некоторых методах одно и то же антитело может служить как в качестве терапевтического, так и в качестве диагностического реагента. В целом, антитела, связывающиеся с эпитопами, С-концевыми к остатку 10 A, не показывают такого сильного сигнала, как антитела, связывающиеся с эпитопами внутри остатков 1-10, по-видимому, потому, что С-концевые эпитопы в амилоидных отложениях недоступны. Соответственно, такие антитела являются менее предпочтительными. Диагностические реагенты можно вводить пациенту внутривенной инъекцией или непосредственно в мозг с помощью интракраниальной инъекции, или просверливая отверстие в черепе. Доза реагента должна быть в тех же пределах, что и для целей терапии. Обычно реагент является меченым, хотя в некоторых методах первичный реагент с аффинностью к A является немеченым, и применяют вторичный реагент с меткой для связывания с первичным реагентом. Выбор метки зависит от способа обнаружения. Например, для оптического обнаружения применима флуоресцентная метка. Применение парамагнитных меток применимо для томографического обнаружения без хирургического вмешательства. Радиоактивные метки могут также обнаруживаться с помощью PET или SPECT. Диагностику осуществляют, сравнивая количество, величину и/или интенсивность меченых локусов с соответствующими базовыми значениями. Базовые значения (базовая линия) могут представлять собой средние уровни в популяции не болеющих людей. Базовые значения могут также представлять собой предыдущие значения уровней у того же пациента. Например, базовые значения можно определять у пациента перед началом лечения и затем измеряемые значения затем можно сравнивать с базовыми. Уменьшение значений относительно базовой линии свидетельствует о положительной реакции на лечение. Настоящее изобретение более полно описывается представленными далее не ограничивающими его объем примерами. Примеры Следующие последовательности применяются в разделе "Примеры" для названия нуклеотидных и аминокислотных последовательностей вариабельной области цепи иммуноглобулина.
МПК / Метки
МПК: C07K 16/00, C07H 21/04, A61K 39/395, C12P 21/00
Метки: иммуноглобулин, иммуноглобулина, гуманизированный, получения, композиция, способ, распознающий, фармацевтическая, бета-амилоидный, пептид
Код ссылки
<a href="https://eas.patents.su/30-10902-gumanizirovannyjj-immunoglobulin-raspoznayushhijj-beta-amiloidnyjj-peptid-farmacevticheskaya-kompoziciya-i-sposob-polucheniya-immunoglobulina.html" rel="bookmark" title="База патентов Евразийского Союза">Гуманизированный иммуноглобулин, распознающий бета-амилоидный пептид, фармацевтическая композиция и способ получения иммуноглобулина</a>
Предыдущий патент: Устройство для электрогидравлического воздействия на призабойную зону скважины
Следующий патент: Фосфолипазы, нуклеиновые кислоты, кодирующие их, и способы их получения и применения
Случайный патент: Новая кристаллическая форма производного пиридазино [4,5-в] индола