Способы, наборы и композиции для разработки и применения моноклональных антител, специфичных к антигенам с низкой иммуногенностью
Номер патента: 10506
Опубликовано: 30.10.2008
Авторы: Киселев Всеволод Иванович, Свешников Петр Георгиевич
Формула / Реферат
1. Способ получения моноклональных антител, специфичных к антигену с низкой иммуногенностью, включающий в себя:
a) химическое конъюгирование антигена с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток;
e) скрининг гибридом в отношении специфичности к нативному антигену.
2. Способ по п.1, в котором молекулой-носителем является HSP70.
3. Способ по п.1, в котором животное имеет интактную иммунную систему.
4. Способ по п.1, в котором животное является млекопитающим.
5. Способ по п.1, в котором В-клетки собирают из асцита.
6. Способ по п.1, в котором В-клетки собирают из лимфатических узлов.
7. Способ по п.1, в котором В-клетки собирают из крови.
8. Способ по п.1, в котором В-клетки собирают из селезенки.
9. Способ по п.1, в котором гибридому создают с использованием иммортализованной клетки мыши.
10. Способ по п.9, в котором иммортализованной клеткой мыши является клетка миеломы мыши.
11. Способ по п.1, в котором гибридому создают с использованием иммортализованной клетки человека.
12. Способ по п.1, в котором гибридому создают с использованием иммортализованной клетки крысы.
13. Способ по п.1, в котором скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа "сэндвич", иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа.
14. Композиция, содержащая моноклональное антитело, специфичное к антигену с низкой иммуногенностью, полученное в результате:
a) химического конъюгирования антигена с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизации животного конъюгированным антигеном;
c) сбора В-клеток от животного;
d) создания гибридомы из собранных В-клеток и
e) скрининга гибридом в отношении специфичности к нативному антигену.
15. Композиция по п.14, где молекулой-носителем является HSP70.
16. Композиция по п.14, где животное имеет интактную иммунную систему.
17. Композиция по п.14, где животное является млекопитающим.
18. Композиция по п.14, где В-клетки собирают из асцита.
19. Композиция по п.14, где В-клетки собирают из лимфатических узлов.
20. Композиция по п.14, где В-клетки собирают из крови.
21. Композиция по п.14, где В-клетки собирают из селезенки.
22. Композиция по п.14, где гибридому создают с использованием клеток миеломы мыши.
23. Композиция по п.14, где гибридому создают с использованием иммортализованной клетки человека.
24. Композиция по п.14, где гибридому создают с использованием иммортализованной клетки крысы.
25. Композиция по п.14, где скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа "сэндвич", иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа.
26. Способ получения моноклональных антител, специфичных к онкобелку Е7, включающий в себя:
a) химическое конъюгирование онкобелка Е7 с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток и
e) скрининг гибридом в отношении специфичности к нативному онкобелку Е7.
27. Способ по п.26, в котором химическое конъюгирование включает в себя:
a) создание плазмиды с нуклеотидной последовательностью, кодирующей онкобелок Е7, и нуклеотидной последовательностью, кодирующей HSP70 и
b) трансфекцию клетки-хозяина плазмидой, при которой клетка-хозяин транскрибирует нуклеотидные последовательности в конъюгированный онкобелок Е7.
28. Способ по п.27, в котором нуклеотидной последовательностью, кодирующей онкобелок Е7, является последовательность SEQ ID NO: 1.
29. Способ по п.27, в котором нуклеотидной последовательностью, кодирующей онкобелок Е7, является последовательность SEQ ID NO: 3.
30. Способ по п.27, в котором нуклеотидной последовательностью, кодирующей HSP70, является последовательность SEQ ID NO: 5.
31. Способ по п.27, в котором клеткой-хозяином является Е. coli.
32. Способ по п.26, в котором молекулой-носителем является HSP70.
33. Способ по п.26, в котором животное имеет интактную иммунную систему.
34. Способ по п.26, в котором животное является млекопитающим.
35. Способ по п.34, в котором животное является мышью.
36. Способ по п.26, в котором В-клетки собирают из асцита.
37. Способ по п.26, в котором В-клетки собирают из лимфатических узлов.
38. Способ по п.26, в котором В-клетки собирают из крови.
39. Способ по п.26, в котором В-клетки собирают из селезенки.
40. Способ по п.26, в котором гибридому создают с использованием иммортализованной клетки мыши.
41. Способ по п.40, в котором иммортализованной клеткой мыши является клетка миеломы мыши.
42. Способ по п.41, в котором клетка миеломы мыши представляет собой клетку миеломы Sp2/0-Ag14.
43. Способ по п.26, в котором гибридому создают с использованием иммортализованной клетки человека.
44. Способ по п.26, в котором гибридому создают с использованием иммортализованной клетки крысы.
45. Способ по п.26, в котором скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа "сэндвич", иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа.
46. Композиция, содержащая моноклональные антитела, специфичные к онкобелку Е7, полученные способом, включающим в себя:
a) химическое конъюгирование онкобелка Е7 с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток и
e) скрининг гибридом в отношении специфичности к нативному онкобелку Е7.
47. Композиция по п.46, где химическое конъюгирование включает в себя:
a) создание плазмиды с нуклеотидной последовательностью, кодирующей онкобелок Е7, и нуклеотидной последовательностью, кодирующей HSP70; и
b) трансфекцию клетки-хозяина плазмидой, при которой клетка-хозяин транскрибирует нуклеотидные последовательности в конъюгированный онкобелок Е7.
48. Композиция по п.47, где нуклеотидной последовательностью, кодирующей онкобелок Е7, является последовательность SEQ ID NO: 1.
49. Композиция по п.47, где нуклеотидной последовательностью, кодирующей онкобелок Е7, является последовательность SEQ ID NO: 3.
50. Композиция по п.47, где нуклеотидной последовательностью, кодирующей HSP70, является последовательность SEQ ID NO: 5.
51. Композиция по п.47, где клеткой-хозяином является Е. coli.
52. Композиция по п.46, где молекулой-носителем является HSP70.
53. Композиция по п.46, где животное имеет интактную иммунную систему.
54. Композиция по п.46, где животное является млекопитающим.
55. Композиция по п.54, где животное является мышью.
56. Композиция по п.46, где В-клетки собирают из асцита.
57. Композиция по п.46, где В-клетки собирают из лимфатических узлов.
58. Композиция по п.46, где В-клетки собирают из крови.
59. Композиция по п.46, где В-клетки собирают из селезенки.
60. Композиция по п.46, где гибридому создают с использованием иммортализованной клетки мыши.
61. Композиция по п.60, где иммортализованной клеткой мыши является клетка миеломы мыши.
62. Композиция по п.61, где клетка миеломы мыши представляет собой клетку миеломы Sp2/0-Ag14.
63. Композиция по п.46, где гибридому создают с использованием иммортализованной клетки человека.
64. Композиция по п.46, где гибридому создают с использованием иммортализованной клетки крысы.
65. Композиция по п.46, где скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа "сэндвич", иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа.
66. Способ выявления цервикальной интраэпителиальной неоплазии, включающий в себя:
a) получение образца эпителиальных клеток шейки матки и
b) скрининг образца в отношении наличия онкобелка Е7 с использованием моноклональных антител по п.46.
67. Способ по п.66, в котором способ скрининга в отношении наличия онкобелка Е7 выбран из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа "сэндвич", иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа.
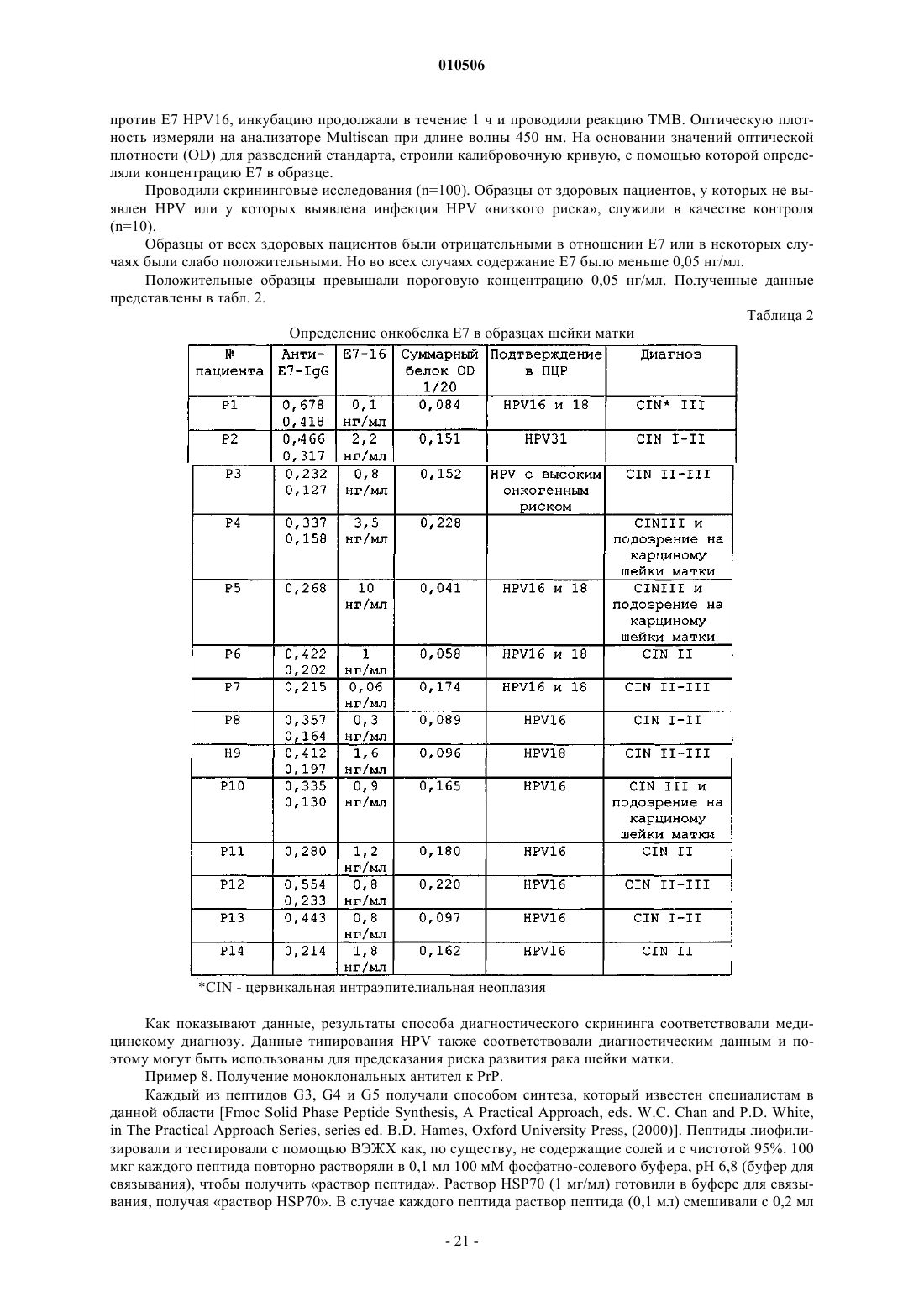
68. Способ по п.66, в котором содержание онкобелка Е7 равно или выше 0,05 нг/мл.
69. Способ по п.66, в котором моноклональные антитела содержат по меньшей мере два изотипа иммуноглобулина.
70. Способ по п.69, в котором одним изотипом иммуноглобулина является изотип IgG2a.
71. Способ по п.69, в котором одним изотипом иммуноглобулина является изотип IgG2b.
72. Способ по п.69, в котором один изотип иммуноглобулина обладает специфичностью к антигенной детерминанте, отличной от антигенной детерминанты в случае второго изотипа иммуноглобулина.
73. Набор для определения того, существует ли риск развития у субъекта цервикальной интраэпителиальной неоплазии, содержащий:
a) по меньшей мере один реагент, который специфично выявляет онкобелок Е7, где реагент представляет собой моноклональные антитела по п.46; и
b) инструкции по определению того, существует ли повышенный риск развития у субъекта цервикальной интраэпителиальной неоплазии.
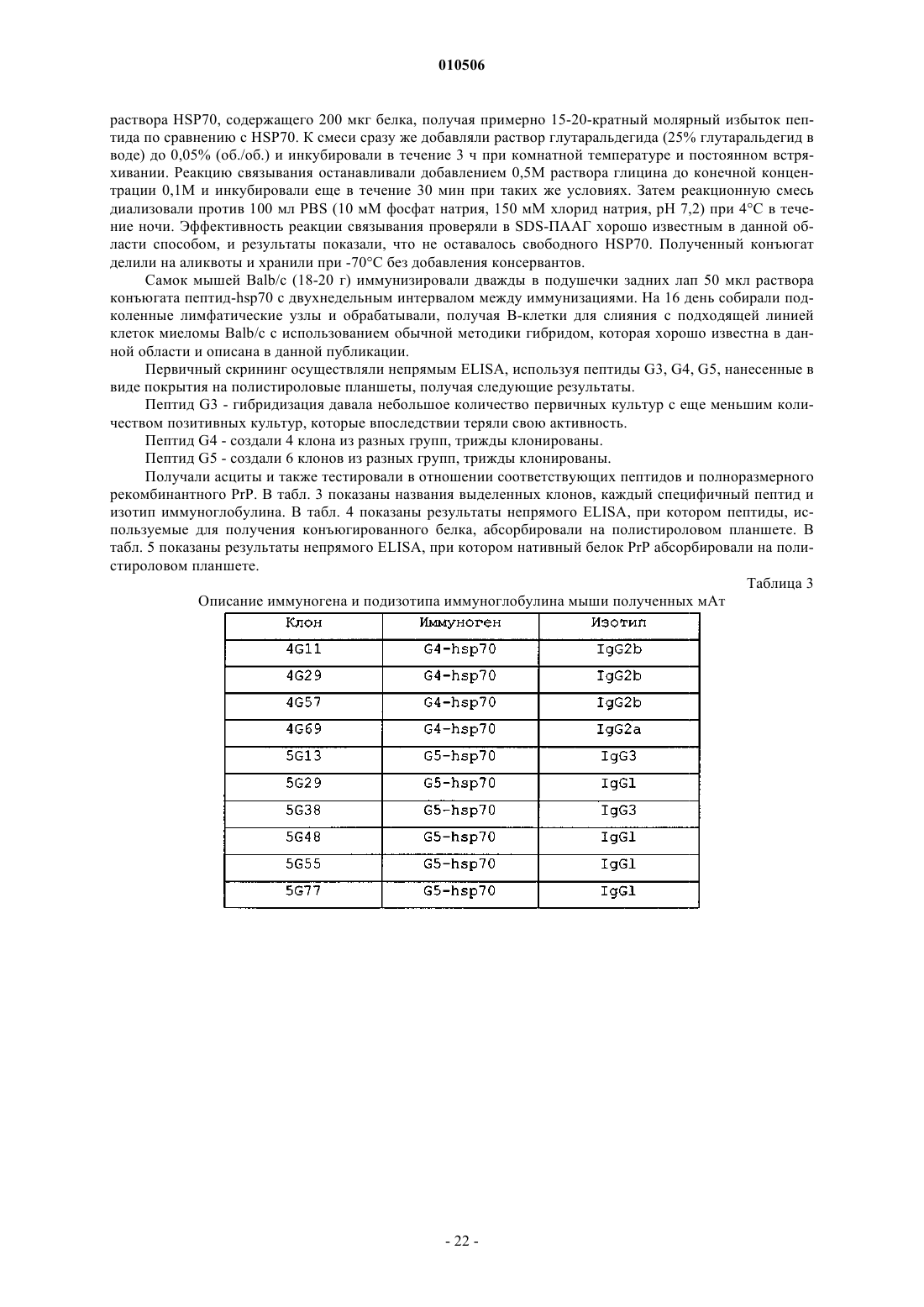
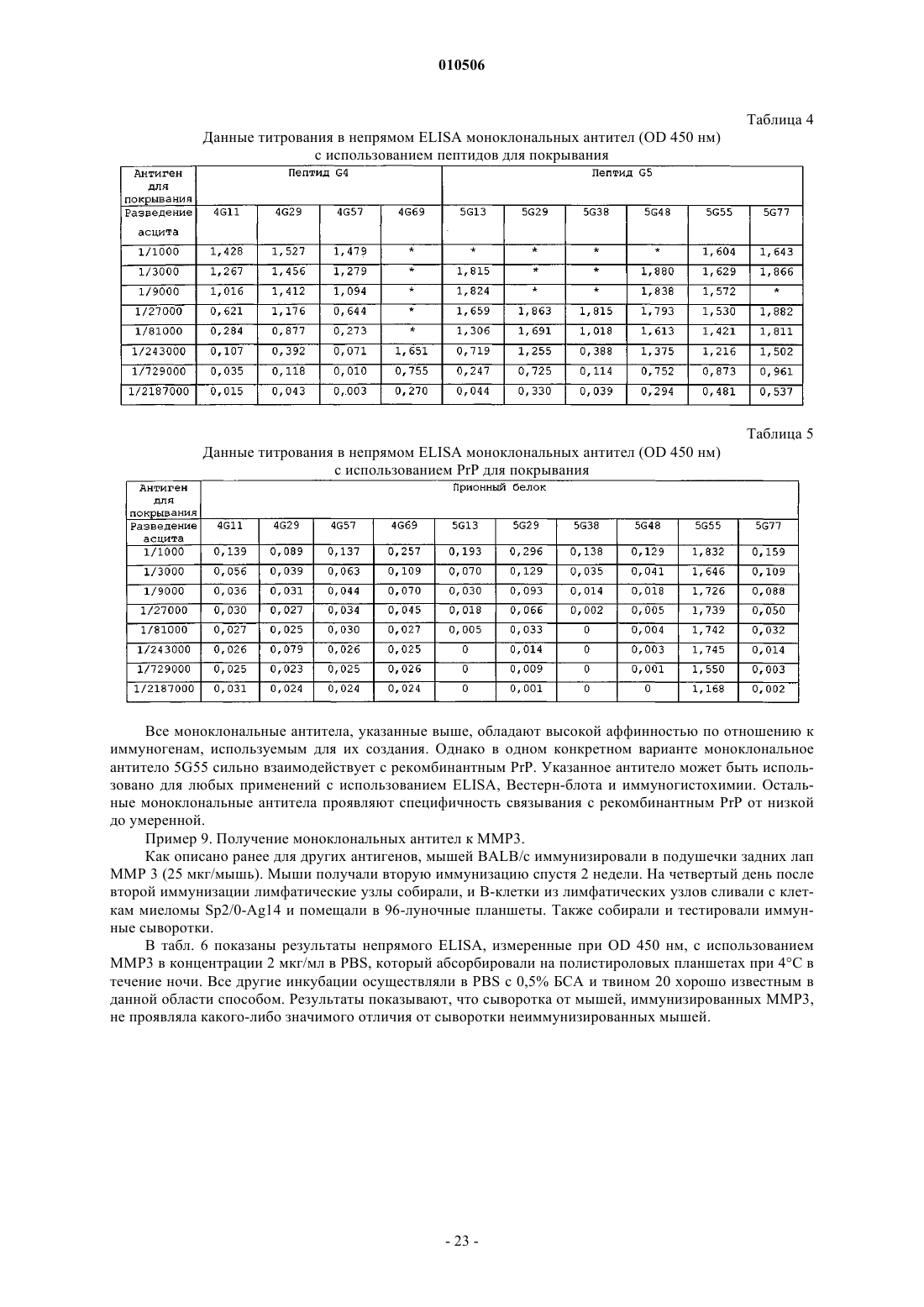
74. Способ получения моноклональных антител, специфичных к пептиду прионного белка, включающий в себя:
a) химическое конъюгирование пептида прионного белка с молекулой-носителем, представляющей собой HSP70, где пептид прионного белка выбран из группы, состоящей из SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 9;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток и
e) скрининг гибридом в отношении специфичности к нативному прионному белку.
75. Способ по п.74, в котором конъюгирование осуществляют химически с использованием глутаральдегида.
76. Способ по п.74, в котором пептид прионного белка имеет последовательность SEQ ID NO: 6.
77. Способ по п.74, в котором пептид прионного белка имеет последовательность SEQ ID NO: 7.
78. Способ по п.74, в котором пептид прионного белка имеет последовательность SEQ ID NO: 9.
79. Способ по п.74, в котором животное является мышью.
80. Способ по п.74, в котором скрининг осуществляют, используя твердофазный иммуноферментный анализ.
81. Набор для определения того, существует ли риск развития у субъекта губчатой энцефалопатии, содержащий:
a) по меньшей мере один реагент, который специфично выявляет прионный белок, где реагент представляет собой моноклональные антитела, полученные способом по п.74; и
b) инструкции по определению того, существует ли повышенный риск развития у субъекта губчатой энцефалопатии.
82. Способ получения моноклональных антител, специфичных к гиалуроновой кислоте, включающий в себя:
a) химическое конъюгирование гиалуроновой кислоты с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток и
e) скрининг гибридом в отношении специфичности к нативной гиалуроновой кислоте.
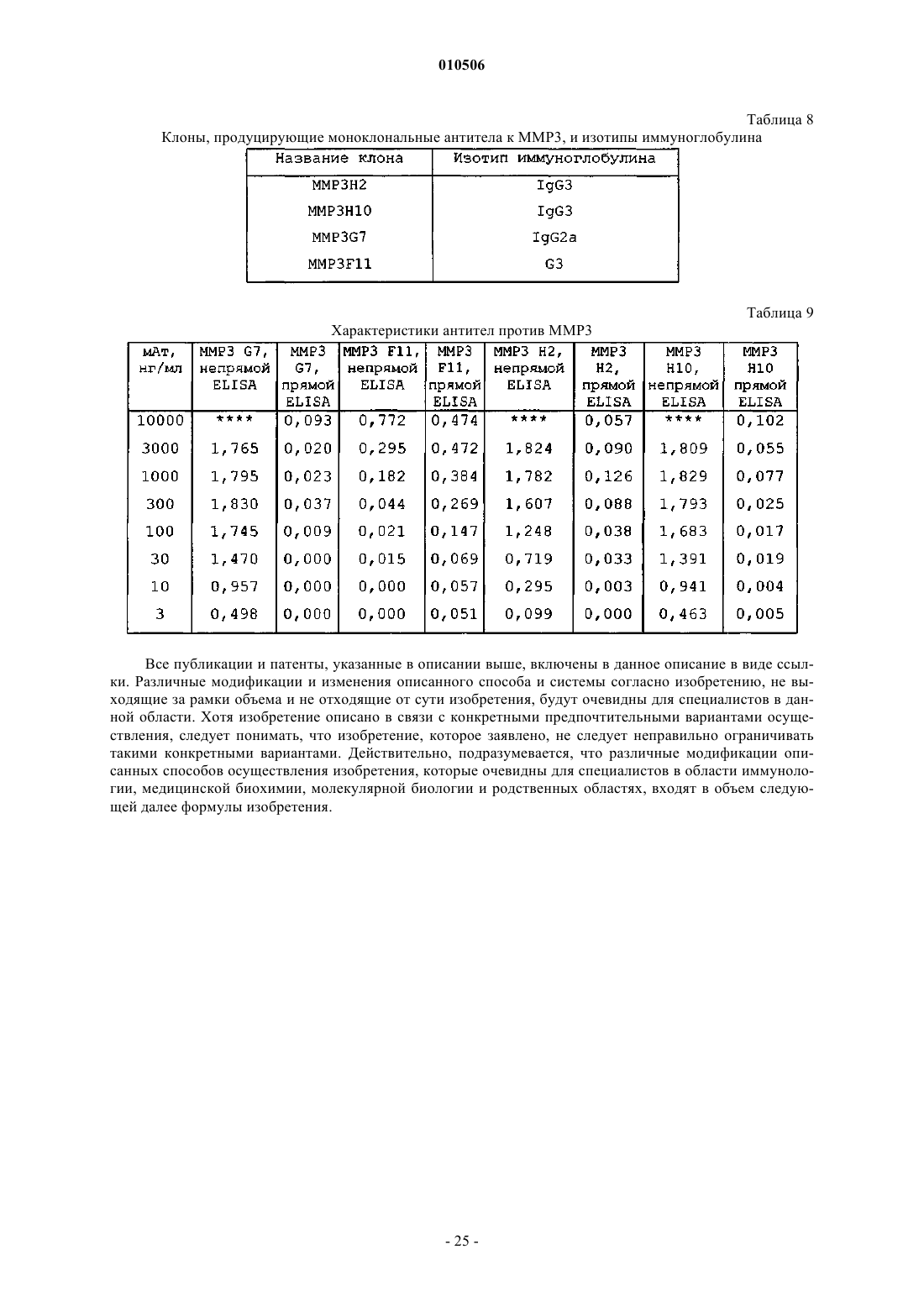
83. Способ получения моноклональных антител, специфичных к металлопротеазе 3 матрикса, включающий в себя:
a) химическое конъюгирование металлопротеазы 3 матрикса с молекулой-носителем, представляющей собой белок теплового шока;
b) иммунизацию животного конъюгированным антигеном;
c) сбор В-клеток от животного;
d) создание гибридомы из собранных В-клеток и
e) скрининг гибридом в отношении специфичности к нативной металлопротеазе 3 матрикса.
84. Способ по п.83, в котором конъюгирование осуществляют химически с использованием глутаральдегида.
85. Способ по п.83, в котором молекулой-носителем является HSP70.
86. Способ по п.83, в котором животное является мышью.
87. Способ по п.83, в котором скрининг осуществляют с использованием твердофазного иммуноферментного анализа.
Текст
010506 Область техники, к которой относится изобретение Способы и композиции согласно изобретению относятся к области медицинской биохимии и, в общем, связаны с разработкой и применением моноклональных антител, специфичных к антигенам, обычно обладающим низкой иммуногенностью. Уровень техники Иммунная система имеет две ветви, адаптивный и врожденный ответы. Две указанных ветви иммунной системы работают вместе, осуществляя борьбу с чужеродным вторжением. Любое вещество,способное вызвать адаптивный иммунный ответ, называют антигеном. Чужеродные молекулы могут действовать в качестве антигенов и стимулировать иммунный ответ, приводя к продукции антител. Однако некоторые молекулы не стимулируют иммунного ответа. В прошлом это преодолевали, используя адъювант, подобный полному адъюванту Фрейнда, чтобы активировать врожденную иммунную систему. Однако несмотря на использование адъювантов, еще остается много молекул, которые не вызывают иммунного ответа, приводящего к продукции антиген-специфичных антител. В частности, многие антигены из природных источников часто не вызывают достаточного и специфичного к молекулам иммунного ответа. Во многих случаях используют химический синтез и рекомбинантную технологию для получения антигена. Однако указанные синтетически полученные антигены часто не имеют такой же третичной структуры, как нативная молекула. При выработке антител к синтетическим антигенам антитела не узнают нативную молекулу. Настоящее изобретение относится к новым способам и композициям, которые позволяют получать антиген-специфичные антитела к антигенам, которые обычно неспособны вызвать адекватный и специфичный иммунный ответ. Указанные антитела могут быть использованы в случае многих различных применений, таких как, без ограничения, терапевтическое лечение заболевания (такого как, без ограничения, злокачественная опухоль, вирусные инфекции и т.д.), иммунодиагностика, иммунохимия, иммуногистология, иммуноцитология, иммуноаффинная хроматография и геномные и белковые исследования. Сущность изобретения Настоящее изобретение относится к способам получения моноклональных антител, специфичных к антигену с низкой иммуногенностью, включающим в себя химическое конъюгирование антигена с молекулой-носителем, иммунизацию животного конъюгированным антигеном, сбор В-клеток от животного,создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности к нативному антигену. В одном варианте молекулой-носителем является HSP70. В другом варианте животное обладает интактной иммунной системой. В еще одном варианте животным является млекопитающее. В следующих вариантах В-клетки собирают из асцита, селезенки, лимфатических узлов или крови, либо по отдельности, либо в комбинации. В следующих вариантах создают гибридому, используя иммортализованную клетку, такую как, без ограничения, клетка миеломы мышей, иммортализованная клетка человека или иммортализованная клетка крысы. В других вариантах скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа сэндвич, иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестернблота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа. Настоящее изобретение также относится к композициям, содержащим моноклональное антитело,специфичное к антигену с низкой иммуногенностью, полученное посредством химического конъюгирования антигена с молекулой-носителем, иммунизации животного конъюгированным антигеном, сбора Вклеток из организма животного, создания гибридомы из собранных В-клеток и скрининга гибридом в отношении специфичности к нативному антигену. В конкретном варианте молекулой-носителем является HSP70. В другом варианте животное имеет интактную иммунную систему. В еще одном варианте животное является млекопитающим. В следующих вариантах В-клетки собирают из асцита, селезенки,лимфатических узлов или крови, либо по отдельности, либо в комбинации. В следующих вариантах гибридому создают, используя иммортализованную клетку, такую как, без ограничения, клетка миеломы мышей, иммортализованная клетка человека или иммортализованная клетка крысы. В других вариантах скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа сэндвич, иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа. Настоящее изобретение, кроме того, относится к способам получения моноклональных антител,специфичных к онкобелку Е 7, включающим в себя химическое конъюгирование онкобелка Е 7 с молекулой-носителем, иммунизацию животного конъюгированным антигеном, сбор В-клеток из организма животного, создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности-1 010506 к нативному онкобелку Е 7. В другом варианте химическое конъюгирование заключается в создании плазмиды с олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, и олигонуклеотидной последовательностью, кодирующей HSP70; и трансфекции клетки-хозяина плазмидой, при этом клеткахозяин транскрибирует олигонуклеотидные последовательности в конъюгированный онкобелок Е 7. В еще одном варианте олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, является последовательность SEQ ID NO: 1. В следующем варианте олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, является последовательность SEQ ID NO:3. В еще одном варианте олигонуклеотидной последовательностью, кодирующей HSP70, является последовательность SEQ ID NO:5. В других вариантах клеткой-хозяином является Е. coli. В одном варианте молекулой-носителем являетсяHSP70. В другом варианте животное обладает интактной иммунной системой. В еще одном варианте животное является млекопитающим. В следующих вариантах В-клетки собирают из асцита, селезенки,лимфатических узлов или крови либо по отдельности, либо в комбинации. В следующих вариантах гибридому создают, используя иммортализованную клетку, такую как, без ограничения, клетка миеломы мышей, иммортализованная клетка человека или иммортализованная клетка крысы. В конкретном варианте клеткой миеломы мышей является клетка миеломы Sp2/0-Ag14. В других вариантах скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа сэндвич, иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа. Настоящее изобретение, кроме того, относится к композициям, содержащим моноклональное антитело, специфичное к онкобелку Е 7, получаемое способом, включающим в себя химическое конъюгирование онкобелка Е 7 с молекулой-носителем, иммунизацию животного конъюгированным антигеном,сбор В-клеток из организма животного, создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности к нативному онкобелку Е 7. В другом варианте химическое конъюгирование заключается в создании плазмиды с олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, и олигонуклеотидной последовательностью, кодирующей HSP70; и трансфекции клеткихозяина плазмидой, при этом клетка-хозяин транскрибирует олигонуклеотидные последовательности в конъюгированный онкобелок Е 7. В еще одном варианте олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, является последовательность SEQ ID NO:1. В следующем варианте олигонуклеотидной последовательностью, кодирующей онкобелок Е 7, является последовательность SEQ ID NO:3. В еще одном варианте олигонуклеотидной последовательностью, кодирующей HSP70, является последовательность SEQ ID NO:5. В других вариантах клеткой-хозяином является Е. coli. В одном варианте молекулой-носителем является HSP70. В другом варианте животное обладает интактной иммунной системой. В еще одном варианте животное является млекопитающим. В следующих вариантах В-клетки собирают из асцита, селезенки, лимфатических узлов или крови, либо по отдельности, либо в комбинации. В следующих вариантах гибридому создают, используя иммортализованную клетку, такую как, без ограничения, клетка миеломы мышей, иммортализованная клетка человека или иммортализованная клетка крысы. В конкретном варианте клеткой миеломы мышей является клетка миеломы Sp2/0-Ag14. В других вариантах скрининг в отношении специфичности осуществляют способом, выбранным из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа сэндвич,иммунорадиометрического анализа, реакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа. Настоящее изобретение также относится к способам применения моноклональных антител, специфичных к онкобелку Е 7, для выявления цервикальной интраэпителиальной неоплазии, включающим в себя получение образца эпителиальных клеток шейки матки и скрининг образца в отношении присутствия онкобелка Е 7. В конкретных вариантах способ скрининга в отношении присутствия онкобелка Е 7 выбран из группы, состоящей из радиоиммуноанализа, твердофазного иммуноферментного анализа, иммуноанализа типа сэндвич, иммунорадиометрического анализа, редакции диффузионной преципитации в геле, иммунодиффузионного анализа, иммуноанализа in situ, Вестерн-блота, реакции преципитации, анализа агглютинации, анализа фиксации комплемента, иммунофлуоресцентного анализа, анализа белка А, анализа визуализации вируса, анализа модулирования биологической активности и иммуноэлектрофоретического анализа. В другом варианте количество онкобелка Е 7 равно или выше 0,05 нг/мл. В следующих вариантах моноклональные антитела содержат по меньшей мере два изотипа иммуноглобулина. В следующих вариантах одним изотипом иммуноглобулина является IgG2a, а другим - IgG2b. В еще одном варианте один изотип иммуноглобулина обладает специфичностью к антигенной детерминанте, отличной от детерминанты, к которой специфичен второй изотип иммуноглобулина. Настоящее изобретение, кроме того, относится к наборам для определения того, существует ли риск развития у субъекта цервикальной интраэпителиальной неоплазии, содержащим по меньшей мере один-2 010506 реагент, который специфично выявляет онкобелок Е 7, и инструкции по определению того, существует ли повышенный риск развития у субъекта цервикальной интраэпителиальной неоплазии. В одном варианте реагентом являются моноклональные антитела, специфичные к онкобелку Е 7. Настоящее изобретение также относится к способам получения моноклональных антител, специфичных к прионному белку, включающим в себя химическое конъюгирование прионного белка с молекулой-носителем, иммунизацию животного конъюгированным антигеном, сбор В-клеток из организма животного, создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности к нативному прионному белку. В конкретных вариантах конъюгирование осуществляют химически,используя глютаральдегид. В других вариантах молекулой-носителем является HSP70. В другом варианте животным является мышь. В следующем варианте скрининг осуществляют, используя твердофазный иммуноферментный анализ. Настоящее изобретение также относится к наборам для определения того, существует ли риск развития у субъекта губчатой энцефалопатии, содержащим по меньшей мере один реагент, который специфично выявляет прионный белок, и инструкции по определению того, существует ли повышенный риск развития у субъекта губчатой энцефалопатии. Настоящее изобретение также относится к способам получения моноклональных антител, специфичных к гиалуроновой кислоте, включающим в себя химическое конъюгирование гиалуроновой кислоты с молекулой-носителем, иммунизацию животного конъюгированным антигеном, сбор В-клеток из организма животного, создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности к нативной гиалуроновой кислоте. Настоящее изобретение, кроме того, относится к способам получения моноклональных антител,специфичных к металлопротеазе 3 матрикса, включающим в себя конъюгирование металлопротеазы 3 матрикса с молекулой-носителем, иммунизацию животного конъюгированным антигеном, сбор В-клеток из организма животного, создание гибридомы из собранных В-клеток и скрининг гибридом в отношении специфичности к нативной металлопротеазе 3 матрикса. В конкретном варианте конъюгирование осуществляют химически, используя глютаральдегид. В другом варианте молекулой-носителем являетсяHSP70. В еще одном варианте животным является мышь. В еще одном варианте скрининг осуществляют,используя твердофазный иммуноферментный анализ. Описание чертежей На фиг. 1 показано, как HSP70 способствует презентации антигенов; на фиг. 2 изображена блок-схема, показывающая патологию, обусловленную вирусом папилломы человека. CIN означает цервикальную интраэпителиальную неоплазию. HSV означает вирус простого герпеса. HLA означает человеческий лейкоцитарный антиген; на фиг. 3 показаны последовательности праймеров для амплификации гена Е 7 с использованием ПЦР (SEQ ID NO: 14-17); на фиг. 4 показана олигонуклеотидная (SEQ ID NO: 1) и аминокислотная (SEQ ID NO: 2) последовательности для онкобелка клона Е 7 из HPV16 с сайтами рестрикции EcoRI и BamHI; на фиг. 5 показана олигонуклеотидная (SEQ ID NO: 3) и аминокислотная (SEQ ID NO: 4) последовательности для онкобелка клона Е 7 из HPV18 с сайтами рестрикции EcoRI и BamHI; на фиг. 6 показана конструкция положения, в котором ген Е 7 HPV16 и альтернативно ген Е 7 HPV18 встраивали в сайт EcoRI-BamHI в плазмиде pBluescipt SK (+) (Stratagene) (SEQ ID NO: 18); на фиг. 7 показана картина электрофореза в геле, демонстрирующая изолированные полосы онкобелка Е 7 из лизатов Е. coli, трансфицированных генами Е 7 HPV16 и Е 7 HPV18; на фиг. 8 показаны матрицы ДНК (SEQ ID NO: 19-22), используемые для ПЦР-амплификации ДНК,содержащей гены Е 7. Матрицы основаны на плазмидных ДНК рНЕ 716 и рНЕ 718, которые содержат гены Е 7 HPV; на фиг. 9 показана схематичная диаграмма структуры плазмиды PQE30-E716-dnaK; на фиг. 10 показана олигонуклеотидная последовательность плазмиды pQE30-dnaK (SEQ ID NO: 5); на фиг. 11 показана калибровочная кривая для количественного определения онкобелка Е 7 HPV16 в оптимальных условиях. Подробное описание изобретения Определения. Чтобы облегчить понимание изобретения, ниже определен ряд терминов. В используемом в данном описании смысле термин химически конъюгированный или химическое конъюгирование относится к связыванию антигена с молекулой-носителем. Указанное связывание можно осуществлять на генетическом уровне с использованием рекомбинантной технологии, при этом может быть получен гибридный белок, содержащий аминокислотные последовательности или их части как антигена, так и молекулы-носителя. Указанный гибридный белок получают с помощью олигонуклеотидной последовательности, кодирующей как антиген, так и молекулу-носитель, или их части. Указанное связывание также включает ковалентные связи, образуемые между антигеном и белком-носителем с использованием других химических реакций, таких как, без ограничения, реакции с использованием глутаральдегида. Ковалентные связи также могут быть образованы с использованием третьей молекулы, обра-3 010506 зующей мостик между антигеном и молекулой-носителем. Указанные перекрестно связывающие агенты способны взаимодействовать с группами, такими как, без ограничения, первичные амины, сульфгидрилы, карбонилы, углеводы или карбоновые кислоты, на антигене и молекуле-носителе. Химическое конъюгирование также включает нековалентное связывание между антигеном и молекулой-носителем. В используемом в данном описании смысле термин молекула-носитель относится к любой молекуле, которая химически конъюгирована с представляющим интерес антигеном, которая делает возможным иммунный ответ, приводящий к антителам, специфичным к нативному антигену. В используемом в данном описании смысле термины нативный, природный, нативный антиген или природный антиген относятся к антигену, который встречается в природе. Что касается изобретения, то нативные антигены обладают низкой иммуногенностью. Низкая иммуногенность относится к неспособности природной молекулы вызывать сильный иммунный ответ, приводящий к продукции высокоаффинных антител. Термин антиген, представляющий интерес антиген или конкретные молекулы, такие как, без ограничения, онкобелок Е 7, прионный белок, металлопротеаза 3 матрикса, гиалуроновая кислота, включают целую молекулу или любые их части, которые сохраняют отличительные антигенные признаки, специфичные для нативного антигена. В используемом в данном описании смысле термин интактная иммунная система относится к животному с функциональной иммунной системой, способной к формированию иммунного ответа на чужеродный антиген. Иммунный ответ включает в себя способность создавать В-клетки, которые секретируют антитела. В используемом в данном описании смысле аминокислотная последовательность относится к аминокислотной последовательности встречающейся в природе молекулы белка, аминокислотная последовательность и подобные термины, такие как полипептид или белок не означают ограничение аминокислотной последовательности полной, нативной аминокислотной последовательностью, связанной с указанной белковой молекулой. В используемом в данном описании смысле термины молекула нуклеиновой кислоты, кодирующая, последовательность ДНК, кодирующая и ДНК, кодирующая относятся к порядку или последовательности дезоксирибонуклеотидов вдоль нити дезоксирибонуклеиновой кислоты. Порядок указанных дезоксирибонуклеотидов определяет порядок аминокислот вдоль цепи полипептида (белка). Таким образом, последовательность ДНК кодирует аминокислотную последовательность. Говорят, что молекулы ДНК имеют 5'-концы и 3'-концы, поскольку мононуклеотиды подвергаются взаимодействию с образованием олигонуклеотидов или полинуклеотидов таким образом, что 5'фосфат пентозного цикла одного мононуклеотида связывается с 3'-кислородом своего соседа в одном направлении посредством фосфодиэфирной связи. Поэтому конец олигонуклеотидов или полинуклеотида назван 5'-концом, если его 5'-фосфат не связан с 3'-кислородом пентозного цикла мононуклеотида, и 3'-концом, если его 3'-кислород не связан с 5'-фосфатом пентозного цикла следующего мононуклеотида. В используемом в данном описании смысле также можно говорить, что последовательность нуклеиновой кислоты, даже в том случае если она является внутренней по отношению к более крупному олигонуклеотиду или полинуклеотиду, имеет 5'- и 3'-концы. В любой линейной или кольцевой молекуле ДНК дискретные элементы называют расположенными выше или 5'-элементами или расположенными ниже или 3'-элементами. Указанная терминология отражает тот факт, что транскрипция происходит от 5'к 3'-концу вдоль нити ДНК. Промоторные и энхансерные элементы, которые управляют транскрипцией связанного гена, обычно расположены с 5'-стороны или выше кодирующей области. Однако энхансерные элементы могут оказывать свое влияние даже в том случае, когда они расположены с 3'-стороны от промоторного элемента и кодирующей области. Сигналы терминации транскрипции и полиаденилирования расположены с 3'-стороны или ниже кодирующей области. В используемом в данном описании смысле термины олигонуклеотид, имеющий нуклеотидную последовательность, кодирующую и полинуклеотид, имеющий нуклеотидную последовательность,кодирующую означает последовательность нуклеиновой кислоты, содержащую кодирующую область гена, или другими словами последовательность нуклеиновой кислоты, которая кодирует продукт гена. Кодирующая область может присутствовать в форме кДНК, геномной ДНК или РНК. Если она присутствует в форме ДНК, то олигонуклеотид или полинуклеотид может быть однонитевым (т.е. в виде смысловой нити) или двунитевым. Подходящие регуляторные, такие как энхансеры/промоторы, точки сплайсинга, сигналы полиаденилирования и т.д., могут быть при необходимости размещены в тесной близости с кодирующей областью гена, чтобы обеспечить возможность правильной инициации транскрипции и/или точного процессинга первичного транскрипта РНК. Альтернативно, кодирующая область, используемая в экспрессирующих векторах согласно настоящему изобретению, может содержать эндогенные энхансеры/промоторы, точки сплайсинга, последовательности вставок, сигналы полиаденилирования и т.д., или комбинацию как эндогенных, так и экзогенных регуляторных элементов. В используемом в данном описании смысле термин регуляторный элемент относится к генетическому элементу, который контролирует определенный аспект экспрессии последовательностей нуклеиновой кислоты. Например, промотор является регуляторным элементом, который способствует инициации транскрипции оперативно связанной кодирующей области. Другие регуляторные элементы включа-4 010506 ют сигналы сплайсинга, сигналы полиаденилирования, сигналы терминации и т.д. Амплификация является особым случаем репликации нуклеиновой кислоты при наличии матричной специфичности. Амплификацию необходимо отличать от репликации на неспецифичной матрице(т.е. репликации, которая зависит от матрицы, но не зависит от специфичной матрицы). Матричная специфичность в данном случае отличается от точности репликации (т.е. синтеза правильной полинуклеотидной последовательности) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Матричную специфичность часто описывают термином специфичность мишени. Последовательности-мишени являются мишенями в том смысле, что их необходимо отсортировать от других нуклеиновых кислот. Способы амплификации разработаны главным образом для указанной сортировки. Матричной специфичности достигают в случае большинства способов амплификации посредством подбора фермента. Ферментами для амплификации являются ферменты, которые в тех условиях, при которых их используют, будут подвергать обработке только специфичные последовательности нуклеиновой кислоты в гетерогенной смеси нуклеиновых кислот. Например, в случае репликазы Q специфичной матрицей для репликазы является РНК MDV-1 [D.L. Kacian et al., Proc. Natl. Acad. Sci USA, 69: 3038(1972)]. Другие нуклеиновые кислоты не будут реплицироваться указанным ферментом амплификации. Подобным образом, в случае РНК-полимеразы Т 7 указанный фермент для амплификации обладает строгой специфичностью к своим собственным промоторам [Chamberlin et al., Nature, 228: 227 (1970)]. В случае ДНК-лигазы Т 4 фермент не будет лигировать два олигонуклеотида или полинуклеотида, когда существует ошибочное спаривание между олигонуклеотидным или полинуклеотидным субстратом и матрицей в месте лигирования [D.Y. Wu и R.B. Wallace, Genomics, 4: 560 (1989)]. Наконец обнаружено, что полимеразы Taq и Pfu в силу их способности функционировать при высокой температуре проявляют высокую специфичность к последовательностям, ограниченным и таким образом определяемым праймерами; высокая температура приводит к термодинамическим условиям, которые благоприятствуют гибридизации праймера с последовательностями-мишенями и отсутствию гибридизации с последовательностями, не являющимися мишенями [Н.А. Erlich (ed.), PCR Technology, Stockton Press (1989)]. В используемом в данном описании смысле термин амплифицируемая нуклеиновая кислота используют по отношению к нуклеиновым кислотам, которые могут быть амплифицированы любым способом амплификации. Подразумевается, что амплифицируемая нуклеиновая кислота, как правило, будет содержать матрицу образца. В используемом в данном описании смысле термин матрица образца относится к нуклеиновой кислоте, происходящей из образца, который анализируют в отношении наличия мишени (определенной ниже). Напротив, термин фоновая матрица используют по отношению к другой нуклеиновой кислоте, отличной от матрицы образца, которая может присутствовать и может не присутствовать в образце. Фоновая матрица наиболее часто является случайной. Она может быть результатом привносимых примесей или может быть следствием присутствия примесей нуклеиновой кислоты, от которых необходимо очистить образец. Например, нуклеиновые кислоты из других организмов, отличных от выявляемых организмов, могут присутствовать в виде фона в тестируемом образце. В используемом в данном описании смысле термин праймер относится к олигонуклеотиду, либо встречающемуся в природе как в очищенном продукте рестрикционного расщепления, либо полученному синтетически, который способен действовать в качестве точки инициации синтеза в случае его помещения в условия, при которых индуцируется синтез продукта удлинения праймера, который является комплементарным нити нуклеиновой кислоты (например, в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящей температуре и значении рН). Предпочтительно праймер является однонитевым для максимальной эффективности амплификации, но альтернативно может быть двунитевым. Если праймер является двунитевым, то его сначала обрабатывают, чтобы разделить его нити перед применением для получения продуктов элонгации. Предпочтительно праймер является олигодезоксирибонуклеотидом. Праймер должен иметь достаточную длину, чтобы праймировать синтез продуктов элонгации в присутствии индуцирующего агента. Точные длины праймеров будут зависеть от многих факторов, включая температуру, источник праймера и применение способа. В используемом в данном описании смысле термин зонд относится к олигонуклеотиду (т.е. к последовательности нуклеотидов), либо встречающемуся в природе, как, например, в очищенном продукте рестрикционного расщепления, или полученному синтетически, рекомбинантно или посредством ПЦРамплификации, который способен гибридизоваться с другим представляющим интерес олигонуклеотидом. Зонд может быть однонитевым или двунитевым. Зонды применимы для выявления, идентификации и выделения конкретных последовательностей гена. Предполагается, что любой зонд, используемый в настоящем изобретении, будет мечен любой репортерной молекулой, так что он может быть выявлен в любой системе регистрации, включая, без ограничения, ферментную (например, ELISA, а также основанные на ферментах гистохимические анализы), флуоресцентную, радиоактивную и люминесцентную системы. Не подразумевается, что настоящее изобретение ограничено какой-либо конкретной системой регистрации или меткой. В используемом в данном описании смысле термин мишень при использовании в отношении по-5 010506 лимеразной цепной реакции относится к области нуклеиновой кислоты, ограниченной праймерами, используемыми для полимеразной цепной реакции. Таким образом, мишень пытаются отсортировать от других последовательностей нуклеиновой кислоты. Участок определяют как область нуклеиновой кислоты в последовательности-мишени. В используемом в данном описании смысле термин полимеразная цепная реакция (ПЦР) относится к способу K.В. Mullis, описанному в патентах США 4683195, 4683202 и 4965188, тем самым включенным в виде ссылки, в которых описан способ увеличения концентрации участка последовательности-мишени в смеси геномной ДНК без клонирования или очистки. Указанный способ амплификации последовательности-мишени заключается во введении большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую требуемую последовательность-мишень, с последующей точной последовательностью температурных циклов в присутствии ДНК-полимеразы. Два праймера являются комплементарными их соответствующим им нитям двунитевой последовательности-мишени. Для осуществления амплификации смесь денатурируют и затем праймеры отжигают с комплементарными им последовательностями в молекуле-мишени. После отжига праймеры удлиняют полимеразой так, чтобы образовать новую пару комплементарных нитей. Стадии денатурации, отжига праймеров и полимеразного удлинения можно повторять много раз (т.е. денатурация, отжиг и удлинения составляют один цикл), чтобы получить высокую концентрацию амплифицированного участка требуемой последовательности-мишени. Длину амплифицированного участка требуемой последовательности-мишени определяют относительным положением праймеров по отношению друг к другу, и, следовательно, указанная длина является регулируемым параметром. Так как процесс является повторяющимся, то способ называют полимеразной цепной реакцией (в дальнейшем ПЦР). Поскольку требуемые амплифицированные участки последовательности-мишени становятся преобладающими последовательностями (в смысле концентрации) в смеси, то говорят, что они ПЦР-амплифицированы. С помощью ПЦР можно амплифицировать одну копию специфичной последовательности-мишени в геномной ДНК до уровня, регистрируемого несколькими разными способами (например, гибридизацией с меченым зондом; включением биотинилированных праймеров с последующей регистрацией конъюгата авидин-фермент; включением 32 Р-меченых дезоксинуклеотидтрифосфатов, таких как dCTP илиdATP, в амплифицированный участок). Кроме геномной ДНК можно амплифицировать любую олигонуклеотидную или полинуклеотидную последовательность с использованием подходящего набора молекул праймеров. В частности, амплифицированные участки, созданные способом ПЦР, сами по себе являются эффективными матрицами для последующих ПЦР-амплификаций. В используемом в данном описании смысле термины продукт ПЦР фрагмент ПЦР и продукт амплификации относятся к полученной в результате смеси соединений после завершения в ПЦР двух или более циклов стадий денатурации, отжига и удлинения. Указанные термины охватывают случай,когда амплифицированы один или несколько участков одной или нескольких последовательностеймишеней. В используемом в данном описании смысле термин реагенты для амплификации относится к таким реагентам (дезоксирибонуклеотидтрифосфатам, буферу и т.д.), которые необходимы для амплификации, за исключением праймеров, матрицы нуклеиновой кислоты и фермента для амплификации. Обычно реагенты для амплификации вместе с другими компонентами реакции помещают и хранят в реакционном сосуде (пробирке, микролунке и т.д.). В используемом в данном описании смысле термины эндонуклеазы рестрикции и ферменты рестрикции относятся к бактериальным ферментам, каждый из которых разрезает двунитевую ДНК в конкретной нуклеотидной последовательности или вблизи нее. В используемом в данном описании смысле термин рекомбинантная молекула ДНК относится к молекуле ДНК, которая состоит из фрагментов ДНК, связанных вместе с помощью способов молекулярной биологии. Термин Вестерн-блот относится к анализу белка(ов) (или полипептидов), иммобилизованных на подложке, такой как нитроцеллюлоза или мембрана. Белки разгоняют в акриламидных гелях, чтобы разделить белки, затем переносят белок из геля на твердую подложку, такую как нитроцеллюлоза или нейлоновая мембрана. Затем иммобилизованные белки подвергают воздействию антител с реактивностью против представляющего интерес антигена. Связывание антител можно регистрировать различными способами, включая применение радиоактивно меченых антител. Термин антигенная детерминанта в используемом в данном описании смысле относится к такой части антигена, которая осуществляет контактирование с конкретным антителом (т.е. эпитоп). В том случае, когда используют белок или фрагмент белка или химический остаток для иммунизации животного-хозяина, многочисленные области антигена могут индуцировать продукцию антител, которые специфично связываются с данной областью или трехмерной структурой белка; указанные области или структуры называют антигенными детерминантами. Антигенная детерминанта может конкурировать с интактным антигеном (т.е. иммуногеном, используемым для того, чтобы вызвать иммунный ответ) за связывание с антителом. В используемом в данном описании смысле термин вектор используют по отношению к молеку-6 010506 лам нуклеиновых кислот, которые переносят участок(ки) ДНК из одной клетки в другую. Термин носитель иногда используют взаимозаменяемо с термином вектор. Термин экспрессирующий вектор в используемом в данном описании смысле относится к рекомбинантной молекуле ДНК, содержащей требуемую кодирующую последовательность и подходящие последовательности нуклеиновой кислоты, необходимые для экспрессии оперативно связанной кодирующей последовательности в конкретном организме-хозяине. Последовательности нуклеиновой кислоты,необходимые для экспрессии в прокариотах, обычно содержат промотор, оператор (необязательный) и сайт связывания рибосомы, часто вместе с другими последовательностями. Известно, что эукариотические клетки используют промоторы, энхансеры и сигналы терминации и полиаденилирования. В используемом в данном описании смысле термин клетка-хозяин относится к любой эукариотической или прокариотической клетке (например, бактериальным клеткам, таким как Е. coli, дрожжевым клеткам, клеткам млекопитающих, клеткам птиц, клеткам амфибий, клеткам растений, клеткам рыб и клеткам насекомых), локализованной либо in vitro, либо in vivo. Например, клетки-хозяева могут находиться в трансгенном животном. Термин трансфекция в используемом в данном описании смысле относится к внедрению чужеродной ДНК в эукариотические клетки. Трансфекцию можно осуществить различными способами, известными в данной области, включая копреципитацию ДНК с использованием фосфата кальция, опосредованную DEAE-декстраном трансфекцию, опосредованную полибреном трансфекцию, электропорацию, микроинъекцию, слияние липосом, липофекцию, слияние протопластов, ретровирусную инфекцию и биолистику.I. Некоторые антигены, обладающие низкой иммуногенностью. Существует много низкомолекулярных соединений, которые не способны независимо вызывать иммунный ответ из-за их небольшого размера. В одном варианте гаптен может быть конъюгирован с белком-носителем (таким как, без ограничения, бычий сывороточный альбумин, яичный альбумин или гемоцианин морского блюдечка замочная скважина), и полученный конъюгат используют для иммунизации. В таких вариантах возникает множество проблем. Например, первичный иммунный ответ может быть направлен к белку-носителю, а не к молекуле гаптена, и это необходимо выяснить при тестировании сывороток от иммунизированных животных и надосадков гибридом. Тестирование должно выявлять, являются ли антитела специфичными к гаптену или к конъюгату в целом. Другая проблема может заключаться в изменениях трехмерной структуры (конформации) гаптена,которые могут происходить во время конъюгирования с носителем. Это может приводить к тому, что антитела являются специфичными к гаптену в конъюгате, но неспособны узнавать свободную молекулу гаптена. В таких случаях можно пробовать различные варианты конъюгирования так, чтобы разные функциональные группы гаптена были экспонированы на поверхности носителя. В еще одном варианте можно использовать иммунизацию иммунными комплексами, когда представляющий интерес антиген является либо консервативным низко иммуногенным белком, либо является минорной антигенной детерминантой, в которой уже имеется очень низкое процентное содержание всех специфичных антител, направленных к ней во время иммунного ответа. В первом случае компонентом иммунного комплекса в виде антитела могут быть моноклональные антитела с неудовлетворительной аффинностью, полученные ранее после обычной иммунизации. Во втором случае используют моноклональные антитела против сильных антигенных детерминант. Примером успешного применения указанного способа является продукция антител против эритропоэтина человека, интерфероновии иммуноглобулинов близкородственных видов (такие как, без ограничения, моноклональные антитела крыс против IgG мыши). См. табл. 1. В других вариантах некоторые антигены имеют очень высокую степень консервативности и неспособны вызывать какой-либо заметный иммунный ответ, несмотря на их белковую природу и достаточную молекулярную массу (например, но не ограничивая указанным, гемоглобин, некоторые ферменты). В указанных конкретных вариантах антигены могут быть конъюгированы с белком теплового шока (таким как, без ограничения, белок теплового шока 70 кД, иначе известный как HSP70). См. табл. 1, указан в виде АРР-конъюгата. Данные показывают, что HSP70 способствует презентации пептидных фрагментов посредством экспонирования их определенным образом (см. фиг. 1). Конъюгирование белков и пептидов с HSP70 обычно приводит к резкой интенсификации продукции антител против указанных белков и пептидов. В других конкретных вариантах наблюдали полное подавление иммунного ответа в случае конъюгирования HSP70-интерферон .II. Применение HSP для повышения иммуногенности. Способы, предлагаемые в данном описании, включают новое применение белка теплового шока в качестве носителя для презентации представляющего интерес антигена, чтобы получить антигенспецифичные антитела к антигенам, которые обычно не вызывают адекватного иммунного ответа по отношению к нативной молекуле. В клетках в ходе развития появились многие механизмы, помогающие им выжить в непредсказуемом и опасном мире. Одним из таких механизмов является ответ теплового шока, который развивается в результате воздействия на клетки необычно высоких температур (напри-7 010506 мер, без ограничения, в случае заболевания с высокой температурой) и других стрессов, включая гипоксию, лишение питательных веществ, радикалы кислорода, метаболический распад, вирусную инфекцию,фагоцитоз и трансформацию. Указанный ответ теплового шока включает в себя продуцирование белков теплового шока (HSP). Одним семейством таких белков являются белки HSP70. Обнаружено, что представители семейства белков HSP70 функционируют в цитозоле, митохондриях, а также эндоплазматическом ретикулуме клеток. Каждый из белков HSP70 работает с небольшой группой связанных белков,когда они помогают другим белкам подвергаться фолдингу. HSP70 и связанные с ним белки имеют тенденцию связываться с гидрофобными аминокислотами на поверхности белка, где они гидролизуют АТФ,часто связываясь и высвобождая свой белок при каждом цикле гидролиза АТФ. Указанные повторяющиеся циклы, например, помогают белку-мишени подвергаться фолдингу. Некоторые из указанных белков теплового шока помогают стабилизировать и репарировать частично денатурированные клеточные белки. Указанные HSP также действуют как молекулярные шапероны. В качестве шаперонов HSP помогают превращению расплавленной глобулярной формы белка в правильно уложенную конечную компактную конформацию белка, защищающая функциональные белки от деградации, перенося аномальные белки в области деградации, перенося белки между разными компартментами клетки, способствуя сборке белковых мультимеров или помогая презентации антигенов с молекулами главного комплекса гистосовместимости (МНС) на поверхности антигенпрезентирующих клеток. Показано, что иммунная система дает сильный ответ на белки теплового шока микробов, таких как бактерии, паразиты и грибы. Присутствие чужеродного HSP запускает немедленный и мощный иммунный ответ организма. [Murray, P., Young, R., J. Bacteriol. 174: 4193-4196 (1992)]. HSP70 является основной мишенью иммунного ответа на многие разные патогены, включая бактерии, грибы, гельминты и паразитические простейшие. [Young, R.A., and Elliot, T.J., Cell, 59:5-8 (1989); Kaufmann, S.H., Immunol. Today, 11:129-136, (1990); Young, D.B., et al, Stress proteins and infectious diseases, p. 131-165 in Stress proteins(1990); Young, R.A., Ann. Rev. Immunol., 8:401-420(1990)]. Иммунизация различными HSP патогенов индуцирует сильный иммунный ответ и обеспечивает защиту от заболеваний, вызванных такими патогенами. [Suzue, K. and Young, R.A., J. Immunol., 156: 873-876 (1996)]. Применение HSP в качестве носителей вакцины, основанной на сильном иммунном ответе организма, началось в начале 1990-х годов. [Udono, H. and Srivastava, Р.K., J. Exp. Med, 178:1391-1396, (1993);Udono, H., et al, Proc. Natl, Acad. Sci. USA, 91:3077-3081, (1994); Suto, R. and Srivastava, P.K., Science,269:1585-1588, (1995); Blachere, N.E., et al, J. Exp. Med, 186:1315-1322, (1997); Tamura, Y.P., et al., Science,278:117-120, (1997); Nair, S., et al, J. Immunol., 162:6426-6432 (1999)]. Посредством химического конъюгирования [Lussow, A.R., et al, Eur. J. Immunol. 21:2297-2302 (1991); Barrios, C, et al, Eur. J. Immunol.,22:1365-1372, (1992); and Perraut, R., et al, Clin. Exp. Immunol., 93:382-386 (1993); Suzue, K. and Young,R.A., J. Immunol., I, 156:873-876, (1996); Suzue, K., et al, Proc. Natl Acad. Sci. USA, 94:13146-13151, (1997);Rico, A.I., et al, Infect. Immun., 66:347-352, (1998), включенные в данное описание в виде ссылки] антигенов с HSP70 можно создавать сильные и подходящие по параметрам иммуногены, которые вызывают ограниченные классом I МНС ответы цитотоксических Т-клеток CD8+, достаточные для того, чтобы опосредовать отторжение опухолей, экспрессирующих слитый партнер. Такой же клеточный аппарат используют в настоящем изобретении, чтобы создать антиген-специфичные антитела, специфичные к нативному неконъюгированному антигену. См. фиг. 1. В предшествующем уровне техники описано применение HSP70 для стимуляции иммунного ответа,при этом стимулирующую активность оценивали в соответствии со степенью индукции клеточного и гуморального иммунитета. Однако существует значительное различие между индукцией образования антител и продукции моноклональных антител. Присутствие антител в сыворотке не всегда приводит к продукции высокоаффинных моноклональных антител, которые способны узнавать природные молекулы. В конкретном варианте при продукции моноклональных антител к онкобелкам Е 7 образование антител наблюдали после иммунизации мышей очищенным рекомбинантным белком, однако, при тестировании ни один из клонов не узнавал природный Е 7 в лизатах клеточных линий, содержащих геном HPV. Иммунная система, по-видимому, распознает некоторые детерминанты рекомбинантных белков, которые не существуют в нормальных белках. Другими словами, полученные антитела взаимодействовали с антигеном, используемым для иммунизации, но не взаимодействовали с природным белком. Настоящее изобретение не ограничено каким-либо конкретным механизмом, однако, предполагается, что трехмерная белковая структура рекомбинантных белков отличалась от трехмерной структуры природных белков. Следовательно, иммунной системе могли быть презентированы неприродные антигенные детерминанты. Чтобы преодолеть указанную проблему, в настоящем изобретении используют природный механизм презентации антигена (с использованием гибридных белков, содержащих представляющий интерес белок или антиген, конъюгированный с белками теплового шока), чтобы презентировать иммунной системе детерминанты с природной конформацией. В конкретных вариантах это осуществляют с использованием HSP70. В указанных конкретных вариантах представляющий интерес антиген конъюгируют с HSP70 или-8 010506 любой частью HSP70, которая обеспечивает возможность того, чтобы представляющий интерес антиген был иммуногенным. Конъюгирование можно осуществлять химическим способом. [Lussow, A.R., et al.,Eur. J. Immunol. 21:2297-2302 (1991); Barrios, C, et al., Eur. J. Immunol, 22:1365-1372, (1992); and Perraut,R., et al., Clin. Exp. Immunol., 93:382-386 (1993); Suzue, K. and Young, R.A., J. Immunol. I, 156:873-876,(1996); Suzue, K., et al., Proc. Natl. Acad. Sci. USA, 94:13146-13151, (1997); Rico, A.I., et al., Infect. Immun.,66:347-352, (1998)]. Антигеном может быть любой белок, пептид, нуклеотидная последовательность или химический остаток. HSP70 может быть из любого источника, включая, но не ограничивая указанным,млекопитающих, рептилий, амфибий, рыб, птиц, насекомых, бактерии, грибы, гельминты, простейшие,вирусы и растения. После того как представляющий интерес антиген конъюгируют с молекулой HSP70, конъюгат вводят в чужеродную интактную иммунную систему, способную процессировать конъюгат и вызывать иммунный ответ на иммунизацию конъюгатом. Можно иммунизировать любое животное, и животное не ограничено млекопитающими, и обычные лабораторные примеры включают крысу, мышь, хомячка, песчанку, морскую свинку, кролика, собаку, обезьяну, цыпленка, козу, овцу, свинью, верблюда, корову, лошадь и кошку.III. Иммунизация. Эффективность иммунизации непосредственно определяет, могут ли продуцироваться высокоаффинные моноклональные антитела. Различные способы хорошо известны в данной области и используются для повышения эффективности иммунизации, некоторые из них описаны в данной публикации. А. Выбор субъекта для иммунизации. В конкретных вариантах имеется три обычных типа гибридомных систем: мыши, крысы и человека. Мышиную гибридому используют наиболее широко, а человеческую гибридому используют меньше всего. Изобретение никоим образом не ограничено указанными примерами. Любое животное с интактной иммунной системой может быть использовано в качестве источника В-клеток для гибридизации с миеломой или любой другой иммортализованной клеткой, включая, без ограничения, иммортализованные клетки человека и иммортализованные клетки крысы, чтобы создать гибридому. Линию мышей BALB/c наиболее часто используют для иммунизации мышей; все линии миеломы мышей происходят из указанной линии. В случае антигенов с низкой иммуногенностью можно иммунизировать мышей другой линии. Такие мыши могут продуцировать более сильный иммунный ответ на некоторые антигены по сравнению с BALB/c. Потомство первого поколения, полученное при скрещивании BALB/c и линии, используемой для иммунизации, можно использовать для выращивания асцита для получения гибридом. В других вариантах используют крыс, в литературе настойчиво рекомендуется линия LOU/C, но вполне удовлетворительные результаты получали в случае крыс линии WISTAR. В. Схемы иммунизации мышей. 1. Схема кратковременной иммунизации. В конкретных вариантах антиген вводят дважды с 2-недельным интервалом в подушечки задних лап мышей Balb/c. В следующих вариантах количество антигена обычно находится в пределах от 5 до 200 мкг на мышь (но не ограничено указанными пределами) в зависимости от его доступности и иммуногенности. В случае токсичных антигенов доза может быть уменьшена до 0,1 мкг. Для первого введения антигена (раунда иммунизации) раствор антигена обычно имеет пределы 50-200 мкг в объеме (но не ограничен указанными конкретными пределами при условии, что достигается иммунный ответ) и антиген комбинируют с адъювантом, таким как полный адъювант Фрейнда (CFA). CFA широко известен в данной области и используется в виде минерального масла с суспензией убитых микобактерий. Также можно использовать другие адъюванты, такие как, без ограничения, минеральные гели (например, гидроксид алюминия) и поверхностно-активные вещества (например, лизолецитин, плюрониловые полиолы,полианионы, пептиды, масляные эмульсии, гемоцианины морского блюдечка замочная скважина, динитрофенол и потенциальные человеческие адъюванты, такие как BCG (бацилла Кальметта-Герена) иCorynebacterium parvum). Энергичное смешивание раствора антигена с CFA дает тонкодисперсную эмульсию для замедления и продления проникновения антигена в ткань. Второй раунд иммунизации осуществляют как первый, но используя неполный адъювант Фрейнда (IFA), который не содержит микобактерий. В следующих вариантах в случае антигенов с низкой иммуногенностью полезно иммунизировать группу животных разными дозами антигена и использовать разные схемы иммунизации. В конкретном варианте на третий или четвертый день после второго раунда иммунизации берут образцы крови и анализируют в отношении содержания в них антител против определенного антигена. Для анализа обычно отбирают животных с наиболее высоким титром. Однако существуют исключения, такие как белкитоксины, используемые в качестве антигенов. Указанные типы антигенов могут давать высокий титр специфичных антител, но это также сочетается с высоким процентом гибели В-лимфоцитов под действием токсина. В указанных случаях необходимо отбирать животных, которые не имеют самого высокого титра и/или необходимо сосредоточить внимание на жизнеспособности клеток для слияния. На четвертый день после второго раунда иммунизации животное умерщвляют и клетки подколенных лимфатиче-9 010506 ских узлов сливают с клетками миеломы. Также можно использовать другие лимфатические узлы животного. 2. Схемы длительной иммунизации. В другом варианте, когда схема кратковременной иммунизации не эффективна, можно попытаться использовать различные типы длительных схем. В данном случае животных обычно иммунизируют с интервалом 2-4 недели либо внутрибрюшинно, либо подкожно (альтернативно, но реже внутривенно или перорально). CFA используют для первого раунда иммунизации и IFA используют для следующего раунда. На 10-14 день после каждого раунда иммунизации (начиная со второго раунда) кровь от иммунизированных животных тестируют в отношении содержания специфичных антител хорошо известными в данной области способами. Если титр антител достиг требуемого уровня, то проводят последний раунд иммунизации антигеном (называемый бустер-иммунизацией) внутривенно без адъювантов. В предпочтительных вариантах дают 1/10 исходной дозы. Вследствие бустер-иммунизации избирательно стимулируются клоны, продуцирующие антитела с высокой аффинностью к антигену. Затем собирают В-клетки, которые секретируют антитело, специфичное к нативному антигену, и проводят скрининг в отношении активности способами, известными специалистам в данной области и как описано в данной публикации. [Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring HarborLaboratory Press, New York, (1988)]. Некоторые из таких способов скрининга включают, но не ограничены указанным, радиоиммуноанализ, ELISA (твердофазный иммуноферментный анализ), иммуноанализ типа сэндвич, иммунорадиометрический анализ, реакцию диффузионной преципитации в геле, иммунодиффузионный анализ, иммуноанализ in situ (например, с использованием коллоидного золота, ферментных или радиоизотопных меток), Вестерн-блот, реакции преципитации, анализ агглютинации (например, анализы агглютинации в геле, анализы гемагглютинации и т.д.), анализ фиксации комплемента,иммунофлуоресцентный анализ, анализ белка А, анализ визуализации вируса, анализ модулирования биологической активности и иммуноэлектрофоретический анализ и т.д. После идентификации клона с титром антител, по меньшей мере равным 1:1000, создают гибридому способами, известными специалистам в данной области и как описано в данной публикации. [HarlowAcad. Sci. USA, 80:2026-2030 (1983)]. Затем полученные моноклональные антитела можно использовать для терапии заболевания (такого как, без ограничения, злокачественная опухоль, вирусные инфекции и т.д.), иммунодиагностики, иммунохимии, иммуногистологии, иммуноцитологии, иммуноаффинной хроматографии и геномных и белковых исследований. В табл. 1 представлены конкретные варианты применения способов согласно изобретению для создания высокоаффинных моноклональных антител к белкам, которые обычно обладают низкой иммуногенностью. Указанные варианты являются только некоторыми примерами и никоим образом не являются ограничивающими. В первой колонке слева указан представляющий интерес антиген. Во второй колонке указан иммуноген, который используют для иммунизации животного с интактной иммунной системой. В данной колонке АРР относится к способам, описанным в данной публикации, при которых представляющий интерес антиген химически конъюгируют с HSP70. Также в данной колонке KLH-конъюгат означает конъюгат с гемоцианином морского блюдечка замочная скважина, а не с HSP70. В третьей колонке показано количество клонов, получаемых в результате иммунизации, и в четвертой колонке показано количество клонов, которые способны связываться с нативным представляющим интерес антигеном. В пятой колонке указан количественный способ, используемый для выяснения того, являются ли моноклональные антитела специфичными к представляющему интерес антигену. ELISA используют для обозначения твердофазного иммуноферментного анализа. WB используют для обозначения Вестернблота. IF используют для обозначения иммунофлуоресценции. IAC используют для обозначения иммуноаффинной хроматографии. В последней колонке дано краткое пояснение того, почему антигены не вызывают сильного иммунного ответа без конъюгации.- 10010506 Таблица 1 Мышиные моноклональные антитела, полученные с использованием способа на основе адъювантного полипептида (АРР)IV. Моноклональные антитела для выявления вируса папилломы человека/рака шейки матки. В одном варианте изобретения использовали предлагаемый в изобретении способ разработки моноклональных антител, специфичных к онкобелкам Е 6 и Е 7 вируса папилломы человека (HPV). Разработка специфичных моноклональных антител к указанным онкобелкам была очень трудной, поскольку природные онкобелки Е 6 и Е 7 трудно очищать вследствие их низкой концентрации, а рекомбинантные белки имеют тенденцию к неправильному фолдингу и агрегируют. Кроме того, онкобелки Е 6 и Е 7 обладают иммуносупрессирующей активностью. Антитела, полученные с использованием рекомбинантных онкобелков Е 6 и Е 7 в качестве иммунизирующего агента, не обладают высокими аффинностями по отношению к нативным белкам Е 6 и Е 7. Вследствие этого использовали новый способ, чтобы создать антитела, которые затем можно использовать для многих применений, которые описаны в данной публикации. А. Предпосылка рака шейки матки. Цервикальная карцинома занимает второе место среди наиболее распространенных злокачественных опухолей у женщин. Показана корреляция между инвазивным раком шейки матки и HPV на основании эпидемиологических и вирусологических исследований (фиг. 2). Сходная корреляция также обнаружена между HPV и неоплазией наружных половых органов и ануса, а также инвазивной карциномой матки [Kiselev, V.I, et al., Interrelationship of Sexually Transmitted Viral Infections and Oncological Illnessesof the Urogenital Tract In Sexually Transmitted Diseases: Vaccines, Prevention, and Control, (ed.) D.I. Bernstein. Academic Press, London, Herald of Dermatology, No. 6:20-23 (2000)]. Цитологические исследования (общеизвестные как мазки-отпечатки по Папаниколау) все еще представляют собой основной лабораторный диагностический способ выявления атипичных многоядерных клеток. Указанный способ использовали для ранней диагностики рака шейки матки в течение многих лет. Однако указанные способы не выявляют более 30% всех носителей HPV и не могут предсказать риск развития более серьезного заболевания. При исследовании структуры дезоксирибонуклеиновой кислоты (ДНК) HPV, включая исследование девяти иммуногенных белков, которые кодируются ДНК наряду с исследованием закономерностей репликации вирусов, иммортализации и трансформации эпителиальных клеток разработан способ скрининга, основа которого заключалась в выявлении биохимических, иммунологических и генетических параметров, которые имеют отклонения от нормальных значений в случае наличия патологии. Не всегда можно интерпретировать указанный тип данных, чтобы сделать ранний диагноз для оценки риска развития рака шейки матки или предсказания эффективности лечения. Это обусловлено тем, что используемые способы измерения также не имеют требуемой чувствительности и/или специфичности, измеряемые параметры непосредственно не отражают процесс дегенерации клетки или измерения отражают процесс непропорционально. Описаны способы диагностики рака шейки матки посредством измерения титров антител, специфичных к белкам HPV, в сыворотке пациентов с использованием ферментных иммуноанализов (которые включают ELISA, но не ограничены указанным) и иммунорадиометрических анализов [см. европейские патенты 386734, 375555, 406542 и 523391]. Однако указанный способ не соответствовал ожиданиям,так как не было выявлено надежной корреляции между титром антител и раком шейки матки.- 13010506 Также существуют способы диагностики и предсказания развития рака шейки матки, основанные на типировании и количественном определении уровней ДНК HPV в образце, подвергаемом исследованию с использованием полимеразной цепной реакции (ПЦР). [V.I. Kiselev, et al., The Polymerase ChainReaction During the Diagnosis of Urogenital Infections: A Handbook for Physicians, Moscow, 2000; международный патент (WO)00506645; и патент США 5679509]. Однако применение указанных способов привело к преувеличенной в значительной степени диагностике, так как инфекция HPV является кратковременной в природе, примерно в 80% всех случаев может завершаться спонтанным выздоровлением, а также элиминацией вируса. См. фиг. 2. Тем не менее,положительный результат в отношении ДНК HPV в большинстве случаев надежно предсказывает развитие рака шейки матки. Новое решение, предлагаемое настоящим изобретением, заключается в способе ранней диагностики рака шейки матки и определения риска развития на основании количественного иммунологического измерения онкобелков Е 6 и Е 7 HPV в биопсийном образце клеток, а не в сыворотке пациента [ЕР 1253924, А 61K 38/18, 08.02.2001]. В конкретном варианте белки Е 6 и Е 7 служили в качестве маркеров HPV, и их выявляли в депарафинизированных образцах ткани с помощью способа иммунофлуоресценции и с использованием цифровых компьютерных технологий (для количественного определения), чтобы проанализировать многомерно представляемые образцы. Когда содержание белка Е 6 или Е 7 в образцах биопсии превышало нормальные значения в контроле более чем на 54%, делали заключение о существовании повышенного риска развития рака шейки матки. Также предположили, что могут быть использованы другие биохимические маркеры, такие как, без ограничения, рецептор эпидермального фактора роста и инсулиноподобный фактор роста. В еще одном варианте разрабатывали способ скрининга, который был проще и дешевле и который мог быть легко стандартизован вследствие высокого уровня совместимости отбора образцов и анализа. Указанный способ скрининга имеет чувствительность, которая соответствует чувствительности ранее описанного варианта осуществления иммунофлуоресценции. Указанный способ скрининга можно использовать для ранней диагностики рака шейки матки на основании цитологических образцов с использованием онкобелка Е 7 HPV в качестве маркера. Возможность применения любого из диагностических способов зависит от использования высокоаффинных моноклональных антител, специфичных для онкобелков Е 6 или Е 7. Ниже описано, как получали указанные антитела.B. Разработка моноклональных антител к Е 6 и Е 7. Существует пороговое увеличение синтеза белка Е 7 HPV в реакции на процесс дегенерации эпителиальных клеток, которому предшествует интеграция вирусной ДНК в ДНК клетки. В конкретном варианте ген Е 7 выделяли из образцов, взятых у человека, и клонировали, затем экспрессировали в Escherichia coli. Затем рекомбинантный белок Е 7, выделенный из бактериальных клеток, использовали для иммунизации мышей. Однако в большинстве случаев антитела, продуцируемые при иммунизации рекомбинантными белками, не взаимодействовали с природным белком, так как они узнавали другие детерминанты. Чтобы преодолеть указанную проблему, использовали описанный выше способ, при котором белок Е 7 конъюгировали с HSP70 и затем использовали в качестве антигена для иммунизации. В конкретных вариантах получали два типа высоко чувствительных моноклональных антител против белка Е 7 природного происхождения, которые перекрестно реагировали с двумя типами HPV повышенного риска (HPV16 и HPV18). Указанная перекрестная реактивность позволяла выявлять 80-85% всех пациентов с неоплазией, связанной с HPV. Применение в паре указанных двух типов моноклональных антител, которые взаимодействуют с разными антигенными детерминантами белка Е 7, усиливает специфичность и обеспечивает отсутствие фона при диагностическом скрининге.C. Способы скрининга HPV. В конкретном варианте способ ранней и доклинической диагностики рака шейки матки заключается в количественном иммунологическом определении онкобелка вируса папилломы человека (HPV) у пациента в биопсийном образце клеток. Биопсийный образец клеток лизируют и надосадок клеточного лизата анализируют в отношении белка Е 7 HPV, используя пару моноклональных антител. В конкретном варианте пары моноклональных антител относятся к подизотипам IgG2a и IgG2b, и они узнают различные антигенные детерминанты белка Е 7. В конкретном варианте антитела IgG2a 716-321, 716-325, 716332 и 716-343 связываются по меньшей мере с одной антигенной детерминантой Е 7. В другом варианте антитела IgG2b 716-281 и 716-288 связываются по меньшей мере с одной другой антигенной детерминантой Е 7. В другом варианте одну из двух групп антител конъюгируют с ферментной меткой, которая известна специалистам в данной области [см. Harlow and Lane, Antibodies: A Laboratory Manual, ColdSpring Harbor Laboratory Press, New York, (1988)]. Затем указанные антитела используют в твердофазном иммуноферментном анализе (ELISA), также хорошо известном специалистам в данной области. В конкретном варианте, когда концентрация белка Е 7 в образце равна или выше 0,05 нанограмм (нг) в миллилитре (мл), диагностику ранней стадии рака шейки матки или риска его развития осуществляют с определенностью. В других конкретных вариантах условия осуществления количественного анализа оп- 14010506 тимизировали с помощью изменения концентрации антител для покрывания полистироловых планшетов,разбавления конъюгата, состава буферного раствора и времени и температуры инкубации в случаеELISA, который хорошо известен в данной области. В предпочтительном варианте использовали антитело 716-281, специфичное к одной антигенной детерминанте онкобелка Е 7, для первичного связывания белка, и антитело 715-332, специфичное к другой антигенной детерминанте Е 7, конъюгировали с ферментной меткой. В еще одном варианте используемые моноклональные антитела специфичны к Е 7 HPV16, но также перекрестно реагируют с Е 7HPV18. HPV16 и HPV18 являются двумя наиболее распространенными типами HPV высокого риска. В следующем варианте в том случае, когда образец является позитивным в отношении белка Е 7 при использовании способа скрининга на основе ELISA, осуществляют типирование HPV. Тип HPV можно определить различными способами, включая использование полимеразной цепной реакции и гибридизации ДНК in situ, но не ограничивая указанным.V. Моноклональные антитела, специфичные к прионному белку. В другом варианте изобретения предлагаемый в изобретении способ применяли для разработки моноклональных антител против прионного белка (PrP). В общем, предполагают, что возможной причиной губчатой энцефалопатии (BSE, коровьего бешенства) является конформационный переход нормального прионного белка в патогенную изоформу. По мере того как патогенная изоформа PrP накапливается, происходит последующая деградация нейронов. Моноклональные антитела к указанному белку могут быть применимы в качестве диагностического средства для BSE. Основная трудность в получении моноклональных антител к указанному белку заключается в высоко консервативной структуре PrP. Множественные иммунизации мышей Balb/c полноразмерным рекомбинантным бычьим PrP как в нативной, так и в денатурированной формах не вызывали ни достаточного иммунного ответа, ни образования первичных позитивных клонов. Чтобы получить моноклональное антитело к PrP осуществляли конформационный анализ молекулы PrP и выбрали три аминокислотных последовательности. Указанные три пептидных последовательности были из N-концевой части, из середины молекулы и из С-концевой части бычьего PrP:G4: 226-242 ITQYQRESQAYYQRGAS (17 ак) (SEQ ID NO: 9) В конкретных вариантах указанные три пептида химически конъюгировали с HSP70 и затем использовали для иммунизации мышей Balb/c, используя способы, приведенные в данном описании. После завершения режима иммунизации собирали подколенные лимфатические узлы (также можно использовать другие лимфатические узлы, асцит, кровь или селезенку) для получения клонов, продуцирующих антитела, специфичные к PrP. Гибридомы получали, как известно в данной области и описано в данной публикации, и проводили скрининг гибридом в отношении продукции высокоаффинных моноклональных антител. Моноклональные антитела с высокой аффинностью идентифицировали, используя иммуноанализы, которые хорошо известны в данной области, такие как, без ограничения, ELISA. Затем полученные моноклональные антитела могут быть использованы для лечения заболевания, иммунодиагностики, иммунохимии, иммуногистологии, иммуноцитологии, иммуноаффинной хроматографии и геномных и белковых исследований.VI. Моноклональные антитела, специфичные к гиалуроновой кислоте. В другом варианте изобретения предлагаемый в изобретении способ применяют для создания моноклональных антител к гиалуроновой кислоте. Гиалуроновая кислота является высокомолекулярным полимером, состоящим из повторяющихся димерных единиц глюкуроновой кислоты и Nацетилглюкозамина, который образует сердцевину сложных агрегатов протеогликана, обнаруживаемых во внеклеточном матриксе. Гиалуроновая кислота играет важную роль в заболеваниях соединительной ткани человека, таких как, без ограничения, симптоматический остеоартрит коленного сустава. Количественное определение гиалуроновой кислоты и продуктов ее деградации считается важным диагностическим параметром, который можно получить с использованием моноклональных антител, специфичных к гиалуроновой кислоте. Вследствие небелковой природы полимера и его идентичности у многих разных видов в диапазоне от бактерий до млекопитающих очень трудно создать высокоаффинные антитела изотипов IgG1, IgG2a,IgG2b. В конкретном варианте гиалуроновую кислоту конъюгировали с HSP70 для иммунизации и моноклональные антитела получали, как описано для PrP. См. пример 9. Скрининг моноклональных антител осуществляли, используя ELISA с биотинилированной гиалуроновой кислотой и стрептавидиномпероксидазой хрена в качестве второго реагента для реакции окрашивания. Указанный тип ELISA хорошо известен в данной области. [Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring HarborLaboratory Press, New York, (1988)]. В результате получили три генетически стабильных линии клеток гибридом, HU.D3 - IgG2a; HU.D9 IgG1, HU.E3 - IgG3, каждая из которых секретирует высокоаффинные моноклональные антитела (IgG1 иIgG2a) против гиалуроновой кислоты. Затем указанные моноклональные антитела могут быть использо- 15010506 ваны для лечения заболевания, иммунодиагностики, иммунохимии, иммуногистологии, иммуноцитологии, иммуноаффинной хроматографии и геномных и белковых исследований.VII. Моноклональные антитела, специфичные к металлопротеазе 3 матрикса. В другом варианте осуществления изобретения предлагаемый в изобретении способ применяют для создания моноклональных антител к металлопротеазе 3 матрикса (ММР 3). Белки семейства металлопротеаз матрикса (ММР) вовлечены в разрушение внеклеточного матрикса в ходе нормальных физиологических процессов, таких как эмбриональное развитие, репродукция и ремоделирование тканей, а также в патологические процессы, такие как артрит и метастазы. Большинство ММР секретируются в виде неактивных пробелков, которые активируются при расщеплении внеклеточными протеазами. ММР 3 является ферментом, который разрушает фибронектин, ламинин, коллагены III, IV, IX и X, и протеогликаны хряща. Считают, что фермент вовлечен в заживление ран, прогрессирование атеросклероза и инициацию опухолей. Сообщается, что ММР 3 вовлечен в ревматоидный артрит и некоторые формы злокачественной опухоли. Указанные моноклональные антитела затем могут быть применены для лечения заболевания,иммунодиагностики, иммунохимии, иммуногистологии, иммуноцитологии, иммуноаффинной хроматографии и геномных и белковых исследований.VIII. Наборы для анализа риска заболевания с использованием моноклональных антител. В настоящем изобретении также предлагаются диагностические наборы. В некоторых вариантах наборы применимы для определения того, существует ли риск развития у субъекта заболевания или состояния, например, без ограничения, рака шейки матки, губчатой энцефалопатии, заболеваний соединительной ткани, артрита и метастазов. Природа и применение набора будут зависеть от специфичности моноклонального антитела, предоставленного в наборе. Диагностические наборы получают множеством способов. В некоторых вариантах наборы содержат по меньшей мере одно моноклональное антитело,которое создано с применением способов согласно изобретению, к антигену, обычно имеющему низкую иммуногенность. В предпочтительных вариантах наборы содержат реагенты для проведения ELISA или другого сходного иммуноанализа, которые хорошо известны в данной области. В некоторых вариантах набор содержит инструкции по определению того, существует ли риск развития у субъекта заболевания или состояния. В предпочтительных вариантах в инструкции указано, что риск развития заболевания или состояния определяют, выявляя наличие или отсутствие представляющего интерес антигена, такого как онкобелок Е 7, PrP, MMP3 или гиалуроновая кислота, но не ограничивая указанным. В некоторых вариантах наборы содержат вспомогательные реагенты, такие как буферные агенты, реагенты, стабилизирующие нуклеиновые кислоты, реагенты, стабилизирующие белки, и системы, формирующие сигнал(например, системы, генерирующие флуоресценцию, такие как системы Fret). Набор для тестирования может быть упакован любым подходящим способом, обычно в виде элементов в одной емкости или, при необходимости, в разных емкостях вместе с листочком инструкций по осуществлению тестирования. В некоторых вариантах наборы также предпочтительно содержат образец позитивного контроля. Примеры Следующие примеры предлагаются для того, чтобы продемонстрировать и дополнительно проиллюстрировать некоторые предпочтительные варианты осуществления и аспекты настоящего изобретения, и их не следует рассматривать, как ограничивающие объем изобретения. В описании экспериментов, которое следует далее, использованы следующие сокращения: М (молярный); мкМ (микромолярный); мМ (миллимолярный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); мкг (микрограммы); нг (нанограммы); л(литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); С (градусы по Цельсию); мин (минуты); с (секунды); % (процент); т.п.о. (тысяч пар оснований); п.о. (пар оснований); ПЦР (полимеразная цепная реакция); а/к (аминокислота). Пример 1. Выявление и типирование вируса папилломы человека (HPV).A. Сбор клинического материала. Клинические образцы получали и транспортировали хорошо известным в данной области способом. Использовали стерильный одноразовый зонд, чтобы взять соскоб клинических образцов эпителиальных клеток шейки матки. Зонд промывали 500 мкл физиологического раствора (0,83% NaCl), чтобы извлечь клетки из зонда и раствор собирали в пробирку Эппендорфа с крышкой объемом 1,5 мл, затем образец хранили вплоть до использования обычно при 4 С до пяти дней и при температуре от -10 доB. Очистка ДНК. Способы экстракции ДНК хорошо известны в данной области, и способы очистки ДНК для настоящего изобретения не ограничены указанным конкретным примером. Если образец был заморожен, то его подвергают оттаиванию хорошо известным в данной области способом и затем центрифугируют при 10000 об./мин в течение 1 мин. На дне образуется осадок, а надосадок отбрасывают. В пробирку добавляют 100 мкл физиологического раствора и осадок гомогенизируют. Добавляют 500 мкл лизирующего раствора и встряхивают в течение 10 с. Затем образец и пробирку инкубируют при 65 С. Лизирующий раствор содержит 6 М тиоцианат гуанидина (Sigma, USA), 10 мМ EDTA (Sigma, USA), 1% тритон X-100(Sigma, USA), 10 мМ трис-HCl, pH 7,3 (Sigma, USA), 1% 2 меркаптоэтанол (Biochemical, England). До- 16010506 бавляют 20 мкл гомогенизирующего сорбента (Silica, Sigma, USA) и встряхивают в течение 10 мин при 50-100 об./мин. Образец и пробирку центрифугируют при 10000 об./мин в течение 1 мин и надосадок отбрасывают. Добавляют 500 мкл раствора для промывки и пробирку встряхивают до тех пор, пока осадок не смешивается с раствором, и снова центрифугируют при 10000 об./мин в течение 1 мин, снова отбрасывая надосадок. Раствор для промывки содержит 4 М тиоцианат гуанидина (Sigma, USA), 10 мМEDTA (Sigma, USA). В пробирку добавляют 1 мл 70% этанола и хорошо встряхивают и центрифугируют при 10000 об./мин в течение 1 мин, отбрасывая надосадок. Указанную промывку этанолом повторяют. Затем пробирки открывают и дают возможность осадку высохнуть в течение 5-10 мин при 55 С. В пробирку добавляют 100 мкл не содержащей нуклеаз воды (Promega, USA) и инкубируют в течение 5 мин при 55 С. Затем образцы используют для полимеразной цепной реакции. Образцы можно хранить при 4 С до недели или при -20 до шести месяцев. С. Полимеразная цепная реакция (ПЦР) для типирования HPV. Реакции ПЦР осуществляли в 25 мкл раствора, содержащего 5 мкл матрицы ДНК, 67 мМ трис-HCl(рН 8,8), 16,6 мМ (NH4)2SO4, 1,5 мМ MgCl2, 100 мМ dATP, dCTP, dTTP и dGTP, 10 пмоль каждого праймера и 1 единицу Taq-полимеразы (5 единиц/мкл; Promega, USA). Использовали способ горячего старта,который хорошо известен в данной области. Условия температурных циклов: 94 С в течение 3 мин и затем 40 циклов при 94 С в течение 30 с, 65 С в течение 30 с и 72 С в течение 30 с. В таблице ниже показаны тип HPV и праймеры, используемые для амплификации ДНК указанных типов HPV. Продукты амплификации анализировали в 1,5% агарозных гелях и фотографировали в УФ-свете(254 нм). Пример 2. Конструирование рекомбинантных плазмид, которые кодируют синтез онкобелков Е 7 типов HPV16 и HPV18. Биопсийные образцы ткани шейки матки пациентов, у которых диагностирована цервикальная дисплазия, служили в качестве источника гена Е 7. Клинические образцы исследовали в отношении присутствия HPV и типировали, используя способ полимеразной цепной реакции, описанный в данной публикации. Гены Е 7 типов HPV16 и HPV18 амплифицировали способом ПЦР с использованием геноспецифичных праймеров [фрагмент длиной 303 пары оснований (п.о.) для HPV16 и фрагмент длиной 324 п.о. для HPV18] (SEQ ID NO: 14-17) (см. фиг. 3), после этого указанные гены клонировали в сайтах EcoRIBamHI в плазмиде pBluescipt SK (+) (Stratagene). Определение олигонуклеотидных последовательностей клонированных генов показало полное соответствие данным GenBank (например, номер доступа в GenBank: AF 125673 для HPV16 и AY262282 для HPV18) (см. фиг. 4 и 5, SEQ ID NO: 1 и 3). Затем в гены включали последовательности терминации трансляции вблизи 3'-концов. Полученные в результате генетические конструкции, рНЕ 716 и рНЕ 718, представлены на фиг. 6 для HPV16 и HPV18(SEQ ID NO: 18). Синтез белков Е 7 типов HPV16 и HPV18 в клетках Е. coli. Плазмида рНЕ 716 кодирует белок Е 7-16 [Met(His)6-GluPheIle-E716-GlySer [111 аминокислотных остатков (а/к), 12,5 килодальтон (кД) и изоэлектрическая точка (ИЭТ) 4,6]. А плазмида рНЕ 718 кодирует белок Е 7-18 [Met(His)6-GluPheSer-E718-GlySer (117 а/к, 13,5 кД и ИЭТ 5,4]. Необходимо отметить,что при осуществлении электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDSПААГ) [Laemmli, U.K., Nature, 227: 680-685 (1970)] указанный белок имеет аномальную подвижность(примерно 21 кД), что соответствует библиографическим данным [Jeon, J.-H., et al., Experimental and Molecular Medicine, 34: 496-499, (2002)]. Штамм BL21 (DE3) E. coli (Stratagen, USA) использовали для экспрессии полученных в результате генов. Трансфекцию осуществляли хорошо известным в данной области способом. После обработки ультразвуком онкобелок Е 7 HPV16 и онкобелок Е 7 HPV18 выявляли в растворимой фракции клеточных белков; поэтому хроматографической анализ на Ni-IIIA-агарозе осуществляли в нативных условиях без добавления мочевины (фиг. 7). Более конкретно, клетки Е. coli штамма BL21 (DE3) трансформировали с использованием плазмид рНЕ 716 и рНЕ 718. Клетки инкубировали в течение ночи при 37 С в среде Луриа-Бертани (LB) с добавлением ампициллина (100 мкг/мл) и глюкозы (0,2%). Затем клетки разбавляли 1:25 свежей средой LB с ампициллином и инкубировали в течение 2-3 ч до достижения плотности клеток значения оптической- 17010506 плотности OD600=0,5. Оптическую плотность измеряли на анализаторе Multiscan при длине волны 600 нм. Затем к культуре добавляли изопропилD-тиогалактопиранозид (IPTG) до концентрации 0,2 мМ до общего объема 50 мл и инкубировали еще в течение 3 ч. Затем культуры центрифугировали при 5000 об./мин в течение 10 мин и надосадок отбрасывали. Осадок ресуспендировали в 1 мл трис-HCl 20 мМ, рН 8, 0,3M NaCl, 0,1% тритоне Х-100 и обрабатывали ультразвуком в течение 15 с. Затем культуры центрифугировали при 10000 об./мин в течение 10 мин. Осадок промывали трис-HCl 20 мМ, рН 8, 0,3M NaCl,0,1% тритон Х-100 (0,5 мл). Осадок гомогенизировали и ресуспендировали в 5 мл буфера А (10 мМ трисHCl, рН 8, 6 М мочевина, 0,4 М NaCl, 10 мМ -меркаптоэтанол, 5 мМ имидазол). Затем образец инкубировали при комнатной температуре в течение 1 ч при встряхивании. Затем образец центрифугировали при 10000 об./мин в течение 10 мин. Осадок отбрасывали. Колонку с IDA-агарозой (1 мл) промывали раствором NiSO4, затем колонку уравновешивали буфером А. Надосадок наносили на колонку с 5 мл буфера А и затем 10 мл буфера В (буфер А с 10 мМ имидазолом). Элюирование осуществляли буфером С (10 мМ трис-HCl, рН 8, 2 М мочевина, 0,4 М NaCl, 10 мМ -меркаптоэтанол, 0,3 М имидазол) фракциями по 0,5 мл. Обычно белок Е 7 из HPV16 и HPV18 элюировался во фракциях 1-3. Фракции, содержащие белок,объединяли и диализовали против 100-кратного объема от объединенных фракций буфера, содержащего 10 мМ трис-HCl, рН 8, 150 мМ NaCl. Пример 3. Экспрессия гибридного белка, состоящего из пептида Е 7 HPV типа 16 (18) и DnaK(HSP70) М. tuberculosis. Использовали ПЦР для амплификации гена Е 7 вируса папилломы человека типов 16 и 18. Плазмидные ДНК рНЕ 716 и рНЕ 718, содержащие гены Е 7 вируса папилломы человека (HPV) типа 16 и 18,использовали в качестве матрицы для ПЦР-амплификации фрагментов, содержащих гены Е 7 (SEQ IDNO: 19-22). См. фиг. 8. Кодон инициации находится в рамке с последовательностью, кодирующей метку 6HIS, и стоп-кодон отсутствует. Белок DnaK экспрессировали, используя клонированные фрагменты ДНК, содержащие гены Е 7, трансфицированные в рекомбинантном векторе, основанном на pQE30. Рекомбинантный вектор pQE30-dnaK-Y конструировали ранее и использовали в качестве основной плазмиды (фиг. 9), обеспечивающей экспрессию слитого белка 6HIS-dnaK. Нуклеотидная последовательность PQE30-dnaK (SEQ ID NO: 5) показана на фиг. 10. Чтобы создать указанный вектор, ПЦРфрагменты, содержащие гены Е 7, расщепляли BamHI и BglII и клонировали в BamHI-сайте pQE30-dnaKY. Рекомбинанты, несущие вставки в правильной ориентации, идентифицировали, используя рестрикционный анализ, который хорошо известен в данной области. Рекомбинантные плазмиды pQE30-E716dnaK и pQE30-E718-dnaK обеспечивали экспрессию гибридных белков 6HIS-E7 (тип 16)-dnaK и 6HIS-E7(тип 18)-dnaK соответственно. Экспрессию осуществляли посредством трансфекции клеток Е. coli DLT1270 плазмидами pQE30E716-dnaK и pQE30-E718-dnaK в отдельных культурах и инкубации в течение ночи. (Клетки DLT1270 получали интегрированием гена lac1 в E.coli штамма DH10B с использованием Р 1-трансдукции. DH10B имел следующий генотип: 10 В (ara D139 D (ara, leu) 7697 D (lac) X 74 galU galK rpsL deoR f80 lacZ(LB), который разбавляли в 100 раз и инкубировали при 37 С при встряхивании вплоть до достижения плотности, измеряемой по оптической плотности, OD600=0,5. Затем добавляли изопропилDтиогалактопиранозид (IPTG) до концентрации 0,1 мМ и культуру выращивали, как указано выше, еще в течение 2 ч. Как хорошо известно в данной области, IPTG индуцирует ген lacZ и его используют для селекции клеток, трансфицированных представляющей интерес плазмидой. В SDS-ПААГ наблюдали синтез гибридных белков ожидаемой молекулярной массы. Пример 4. Выделение рекомбинантного белка HSP70 из Е. coli.A. Буферные растворы. Буферные растворы не готовили заранее. Буфер А готовили перед процедурой выделения и использовали в пределах одного часа. Матричный раствор 50 мМ K2HPO4, рН 7, можно приготовить заранее, но его необходимо использовать в течение трех дней. Матричный раствор 10 PBS также можно приготовить заранее. Хранение буферных растворов и хроматографические способы необходимо проводить при комнатной температуре. Буфер А содержит 25 мМ N-(2-гидроксиэтил)пиперазин-N'-(2-этансульфоновой кислоты)B. Подготовка хелатирующей колонки. Промывают колонку 110 см деионизованной водой, выгоняя пузырьки из нижнего фильтра, оставляя слой воды на уровне примерно 1 см от нижнего фильтра. Измеряют необходимое количество хелати- 18010506 рующей сефарозы CL-6B (Amersham Pharmacia Biotech), чтобы получить объем 5 мл. Используя пипетку,колонку загружают сефарозным гелем. Колонку промывают 5 объемами деионизованной воды со скоростью 3 мл/мин. Затем колонку промывают 10 объемами раствора ZnCl2 (концентрация 1 мг/мл (ICN со скоростью 3 мл/мин. Затем колонку промывают 10 объемами деионизованной воды со скоростью 3 мл/мин. Колонку соединяют с УФ-детектором (280 нм). Затем колонку промывают 10 объемами воды со скоростью 3 мл/мин. Теперь колонка готова для выделения белка из клеток Е. coli, выращенных в 500 мл культуральной среды.D. Подготовка Е. coli. Операции проводят при 4 С как можно быстрее. Сначала 5 раз промывают 1 г Е. coli (влажная биомасса) 2 объемами PBS, центрифугируя при 5000 об./мин в течение 15 с в каждом цикле и затем ресуспендируя бактериальные клетки. После последней промывки клетки разбавляют в 5 мл PBS. Затем клетки обрабатывают ультразвуком (20 кГц, 50-60 Вт) 6 раз по 30 с. Полученный в результате раствор центрифугируют при 12000 об./мин в течение 10 мин. Осадок отбрасывают, а надосадок наносят на колонку.E. Разделение белка. После нанесения надосадка колонку промывают 10 объемами колонки буфера А. Затем 5 объемами буфера В. Белковые фракции элюируют 5 мл буфера С и собирают.F. Диализ белка, извлеченного с колонки. Объединенные фракции помещают в диализный мешок и диализуют в течение 30 мин против 200 объемов PBS при 0 С и постоянном перемешивании. Через 30 мин раствор заменяют свежими 200 объемами PBS при 0 С также с постоянным перемешиванием. Затем фракции диализуют в течение ночи в 5 лPBS при 4 С. Концентрацию белка определяют способами количественного определения по Бредфорду или Лоури, которые хорошо известны в данной области [Harlow and Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, New York, (1988)]. Раствор замораживают при -70 С и лиофилизируют. Пример 5. Получение мышиных моноклональных антител против рекомбинантных белков Е 7HPV16 и HPV18 Е 7. Мышей Balb/c [10 самок массой 16-18 г] дважды иммунизировали в подушечки задней лапы с двухнедельным интервалом между иммунизациями, используя высоко очищенный Е 7 HPV16 и Е 7HPV18. Препараты Е 7 HPV16 и Е 7 HPV18 лизатов рекомбинантных Е. coli очищали, используя одностадийную металлохелатную хроматографию. Первую иммунизацию проводили 20 мкг белка, разбавленного в 20 мкл фосфатно-солевого буфера (PBS), смешанного с равным объемом полного адъюванта Фрейнда. Вторую иммунизацию также проводили 20 мкг белка, разбавленного в 20 мкл PBS, но смешивали с равным объемом неполного адъюванта Фрейнда. На четвертый день после второй иммунизации лимфоциты из подколенных лимфатических узлов гибридизовали с клетками миеломы Sp2/0-Ag14 (американская коллекция типов культур (АТСС) CRL 1581; АТСС CRL 8287; европейская коллекция культур клеток 85072401; культуры клеток человека и животных DSMZ АСС 146), используя полиэтиленгликоль (ПЭГ) 4000. Гибридомы инкубировали в среде, содержащей гипоксантин-аминоптерин-тимидин(HAT), две недели при 37 С с 5% СО 2. Выжившие при селекции гибридомы подвергали скринингу,используя непрямой ELISA. Позитивные культуры клонировали дважды, используя способ лимитирующих разведений [см. Campbell, A.M., Monoclonal Antibody and Immunosensor Technology in LaboratoryTechniques in Biochemistry and Molecular Biology, vol. 23(1991)]. ELISA осуществляли посредством абсорбции рекомбинантных белков Е 7 HPV16 и HPV18 на полистироловых планшетах в концентрации 2 мкг/мл при инкубации планшетов в течение 1 ч при 37 С, затем планшеты 3 раза промывали PBS, в планшеты добавляли 50 мкл надосадков культур тканей и инкубировали в течение 1 ч при 37 С. Моноклональные антитела, которые связываются с иммобилизованным антигеном, регистрировали, используя антитело козы против иммуноглобулина G (IgG) [H+L] мыши, конъюгированное с пероксидазой, в течение периода времени, равного 1 ч, при 37 С. Раствор тетраметилбензидина (ТМВ), который содержал пероксид водорода, служил в качестве субстрата. Оптическую плотность измеряли при 450 нм. Получили группу гибридом для белка Е 7 HPV16, которые продуцировали антитела 716-281 и 716-288 (IgG2b), а также антитела 716-321, 716-325, 716-332 и 716-343 (IgG2a), которые в равной мере хорошо взаимодействовали с Е 7 HPV16 и HPV18 в непрямом ELISA (см. табл. 2).- 19010506 Таблица 2 Значения оптической плотности при 450 нм в непрямом ELISA при титровании моноклональных антител с использованием иммобилизованных белков Е 7 HPV16 и HPV18 Пример 6. Оптимизация условий осуществления иммуноферментного анализа для количественного определения белков Е 7 HPV16 и HPV18 с использованием моноклональных антител. Моноклональные антитела против Е 7 HPV16 собирали из асцитов мышей и очищали на аффинной колонке с белком G-сефарозой (чистота более 95%). Антитела метили пероксидазой хрена, используя способ на основе периодата. Все парные комбинации моноклональных антител выбирали по аффинности к антигену Е 7 HPV16, используя ELISA. Чтобы получить пары моноклональных антител, один член пары моноклональных антител иммобилизовали на полистироловом планшете. Семь двукратных разведений белка Е 7 HPV16, находящихся в пределах концентраций 0,039-5,0 нг/мл, добавляли к моноклональному антителу, иммобилизованному на планшете. Образованные иммунные комплексы регистрировали добавлением второго члена пары моноклональных антител, конъюгированного с пероксидазой, с использованием тетраметилбензидина, служащего в качестве субстрата. Все тестированные пары моноклональных антител обладали способностью образовывать тройной комплекс (сэндвич) - иммобилизованное антитело - Е 7 - конъюгированное антитело - что свидетельствует об олигомерном состоянии белка Е 7HPV16 в растворе даже в пределах концентраций 10-12-10-9 моль (М). Несмотря на тот факт, что все комбинации моноклональных антител работали, пары идентичных антител или антител, которые относились к одному и тому же изотипу иммуноглобулина, проявляли более низкий уровень чувствительности (значение оптической плотности, связанное с фиксированной концентрацией Е 7 HPV16, и наклон калибровочной кривой), чем пары моноклональных антител разных изотипов. В отношении чувствительности и отсутствия фона наилучшие результаты получали в том случае, когда моноклональные антитела 716-281 связывали с планшетом, а моноклональные антитела 716-332 использовали в качестве конъюгата с пероксидазой. Анализ с использованием указанной пары моноклональных антител оптимизировали, варьируя концентрацию антител для абсорбции, разбавление конъюгата, состав буферного раствора и время, и температуру на всех стадиях ELISA. Калибровочная кривая для количественного определения Е 7 HPV16 в оптимальных условиях представлена на фиг. 11. Моноклональные антитела 716-288 абсорбировали из 0,1 М раствора карбонатного буфера с рН 9,6 и концентрацией 5 мкг/мл. Рабочее разведение содержащего пероксидазу конъюгата мАт 716-332 составляло 1/5000 в фосфатно-солевом буфере (PBS), который содержал 0,2% бычьего сывороточного альбумина (БСА) и 0,05% твина 20. Субстрат представлял собой тетраметилбензидин (ТМВ). Концентрация белка указана вдоль оси x в нг/мл. Оптическая плотность при 450 нм показана вдоль оси y. Экспериментальная ошибка для трех независимых измерений показана на данной кривой. Из фигуры видно, что калибровочная кривая является почти линейной в диапазоне концентраций антигена 0,039-5,0 нг/мл, а также характеризуется полным отсутствием фона. Наличие Е 7HPV16 можно определить уже при 40 пг на мл, что является достаточным для определения уровня экспрессии Е 7 HPV16 в трансфицированных клетках и клинических образцах (см. фиг. 11). Пример 7. Измерение онкобелка Е 7 в образцах шейки матки. Образец из соскоба шейки матки помещали в 1 мл физиологического раствора (0,83% NaCl) и три раза подвергали замораживанию и оттаиванию. Затем образец центрифугировали в микроцентрифуге(Eppendorf) в течение 10 мин при 10000 об./мин. Надосадок разбавляли 1:1 (об./об.) в PBS-AT (PBS, который содержит 0,2% БСА и 0,1% твина), после этого 200 мкл вносили в лунку планшета, в которой предварительно связывали моноклональные антитела против Е 7 HPV16 в концентрации 5 мкг/мл, и титровали двукратным серийным разведением на 4 лунки. В том же самом планшете очищенный рекомбинантный белок Е 7 HPV16 титровали от 4 нг/мл до 0,062 нг/мл в качестве стандарта. После одночасовой инкубации и промывки вносили меченые пероксидазой конъюгированные моноклональные антитела- 20010506 против Е 7 HPV16, инкубацию продолжали в течение 1 ч и проводили реакцию ТМВ. Оптическую плотность измеряли на анализаторе Multiscan при длине волны 450 нм. На основании значений оптической плотности (OD) для разведений стандарта, строили калибровочную кривую, с помощью которой определяли концентрацию Е 7 в образце. Проводили скрининговые исследования (n=100). Образцы от здоровых пациентов, у которых не выявлен HPV или у которых выявлена инфекция HPV низкого риска, служили в качестве контроля(n=10). Образцы от всех здоровых пациентов были отрицательными в отношении Е 7 или в некоторых случаях были слабо положительными. Но во всех случаях содержание Е 7 было меньше 0,05 нг/мл. Положительные образцы превышали пороговую концентрацию 0,05 нг/мл. Полученные данные представлены в табл. 2. Таблица 2 Определение онкобелка Е 7 в образцах шейки маткиCIN - цервикальная интраэпителиальная неоплазия Как показывают данные, результаты способа диагностического скрининга соответствовали медицинскому диагнозу. Данные типирования HPV также соответствовали диагностическим данным и поэтому могут быть использованы для предсказания риска развития рака шейки матки. Пример 8. Получение моноклональных антител к PrP. Каждый из пептидов G3, G4 и G5 получали способом синтеза, который известен специалистам в данной области [Fmoc Solid Phase Peptide Synthesis, A Practical Approach, eds. W.C. Chan and P.D. White,in The Practical Approach Series, series ed. B.D. Hames, Oxford University Press, (2000)]. Пептиды лиофилизировали и тестировали с помощью ВЭЖХ как, по существу, не содержащие солей и с чистотой 95%. 100 мкг каждого пептида повторно растворяли в 0,1 мл 100 мМ фосфатно-солевого буфера, рН 6,8 (буфер для связывания), чтобы получить раствор пептида. Раствор HSP70 (1 мг/мл) готовили в буфере для связывания, получая раствор HSP70. В случае каждого пептида раствор пептида (0,1 мл) смешивали с 0,2 мл- 21010506 раствора HSP70, содержащего 200 мкг белка, получая примерно 15-20-кратный молярный избыток пептида по сравнению с HSP70. К смеси сразу же добавляли раствор глутаральдегида (25% глутаральдегид в воде) до 0,05% (об./об.) и инкубировали в течение 3 ч при комнатной температуре и постоянном встряхивании. Реакцию связывания останавливали добавлением 0,5 М раствора глицина до конечной концентрации 0,1 М и инкубировали еще в течение 30 мин при таких же условиях. Затем реакционную смесь диализовали против 100 мл PBS (10 мМ фосфат натрия, 150 мМ хлорид натрия, рН 7,2) при 4 С в течение ночи. Эффективность реакции связывания проверяли в SDS-ПААГ хорошо известным в данной области способом, и результаты показали, что не оставалось свободного HSP70. Полученный конъюгат делили на аликвоты и хранили при -70 С без добавления консервантов. Самок мышей Balb/c (18-20 г) иммунизировали дважды в подушечки задних лап 50 мкл раствора конъюгата пептид-hsp70 с двухнедельным интервалом между иммунизациями. На 16 день собирали подколенные лимфатические узлы и обрабатывали, получая В-клетки для слияния с подходящей линией клеток миеломы Balb/c с использованием обычной методики гибридом, которая хорошо известна в данной области и описана в данной публикации. Первичный скрининг осуществляли непрямым ELISA, используя пептиды G3, G4, G5, нанесенные в виде покрытия на полистироловые планшеты, получая следующие результаты. Пептид G3 - гибридизация давала небольшое количество первичных культур с еще меньшим количеством позитивных культур, которые впоследствии теряли свою активность. Пептид G4 - создали 4 клона из разных групп, трижды клонированы. Пептид G5 - создали 6 клонов из разных групп, трижды клонированы. Получали асциты и также тестировали в отношении соответствующих пептидов и полноразмерного рекомбинантного PrP. В табл. 3 показаны названия выделенных клонов, каждый специфичный пептид и изотип иммуноглобулина. В табл. 4 показаны результаты непрямого ELISA, при котором пептиды, используемые для получения конъюгированного белка, абсорбировали на полистироловом планшете. В табл. 5 показаны результаты непрямого ELISA, при котором нативный белок PrP абсорбировали на полистироловом планшете. Таблица 3 Описание иммуногена и подизотипа иммуноглобулина мыши полученных мАт- 22010506 Таблица 4 Данные титрования в непрямом ELISA моноклональных антител (OD 450 нм) с использованием пептидов для покрывания Все моноклональные антитела, указанные выше, обладают высокой аффинностью по отношению к иммуногенам, используемым для их создания. Однако в одном конкретном варианте моноклональное антитело 5G55 сильно взаимодействует с рекомбинантным PrP. Указанное антитело может быть использовано для любых применений с использованием ELISA, Вестерн-блота и иммуногистохимии. Остальные моноклональные антитела проявляют специфичность связывания с рекомбинантным PrP от низкой до умеренной. Пример 9. Получение моноклональных антител к ММР 3. Как описано ранее для других антигенов, мышей BALB/c иммунизировали в подушечки задних лап ММР 3 (25 мкг/мышь). Мыши получали вторую иммунизацию спустя 2 недели. На четвертый день после второй иммунизации лимфатические узлы собирали, и В-клетки из лимфатических узлов сливали с клеткам миеломы Sp2/0-Ag14 и помещали в 96-луночные планшеты. Также собирали и тестировали иммунные сыворотки. В табл. 6 показаны результаты непрямого ELISA, измеренные при OD 450 нм, с использованием ММР 3 в концентрации 2 мкг/мл в PBS, который абсорбировали на полистироловых планшетах при 4 С в течение ночи. Все другие инкубации осуществляли в PBS с 0,5% БСА и твином 20 хорошо известным в данной области способом. Результаты показывают, что сыворотка от мышей, иммунизированных ММР 3,не проявляла какого-либо значимого отличия от сыворотки неиммунизированных мышей.- 23010506 Таблица 6 Непрямой ELISA, измеренный при OD 450 нм с использованием неконъюгированной ММР 3 Все первичные клоны также тестировали непрямым ELISA с использованием ММР 3 и прямымELISA с использованием меченого биотином ММР 3. Положительные клоны не образовывались при использовании неконъюгированного ММР 3. Затем ММР 3 конъюгировали с HSP70, используя тот же способ, который описан выше для PrP, с использованием глутаральдегида. Затем конъюгированный ММР 3 (50 мкг/мышь) использовали для иммунизации мышей Balb/c, как описано ранее. На четвертый день после второй иммунизации собирали лимфатические узлы и обрабатывали хорошо известным в данной области способом. Выделенные В-клетки сливали с клетками миеломы sp 2/0 и помещали в 96-луночные планшеты. Также собирали и тестировали иммунные сыворотки. Результаты показаны в табл. 7. В табл. 7 показаны результаты непрямого ELISA, измеренные при OD 450 нм с использованием ММР 3 в концентрации 2 мкг/мл PBS, который абсорбировали на полистироловых планшетах при 4 С в течение ночи. Все другие инкубации проводили в PBS с 0,5% бычьего сывороточного альбумина (БСА") и твином 20 хорошо известным в данной области способом. Результаты показывают, что сыворотка мышей, иммунизированных конъюгированным MMP3-HSP70, обладает значительной аффинностью к ММР 3 по сравнению с сывороткой неиммунных мышей. Таблица 7 Непрямой ELISA, измеренный при OD 450 нм с использованием конъюгированного ММР 3 Все первичные клоны также тестировали непрямым ELISA, используя ММР 3 (2 мкг/мл), и прямымELISA с использованием меченого биотином ММР 3 (500 нг/мл). Выявили восемь положительных клонов непрямым ELISA и 6 положительных клонов прямым ELISA. Все положительные клоны клонировали,четыре из них имели стабильную продукцию антител и были клонированы 2-3 раза. В табл. 8 указаны клоны и изотипы иммуноглобулина. В табл. 9 показаны результаты непрямого ELISA с использованием 1 мкг/мл ММР 3, абсорбированного на планшете, и прямого ELISA с использованием 0,5 мкг/мл ММР 3 биотин. Результаты показывают, что клоны имеют высокую аффинность к ММР 3.- 24010506 Таблица 8 Клоны, продуцирующие моноклональные антитела к ММР 3, и изотипы иммуноглобулина Таблица 9 Характеристики антител против ММР 3 Все публикации и патенты, указанные в описании выше, включены в данное описание в виде ссылки. Различные модификации и изменения описанного способа и системы согласно изобретению, не выходящие за рамки объема и не отходящие от сути изобретения, будут очевидны для специалистов в данной области. Хотя изобретение описано в связи с конкретными предпочтительными вариантами осуществления, следует понимать, что изобретение, которое заявлено, не следует неправильно ограничивать такими конкретными вариантами. Действительно, подразумевается, что различные модификации описанных способов осуществления изобретения, которые очевидны для специалистов в области иммунологии, медицинской биохимии, молекулярной биологии и родственных областях, входят в объем следующей далее формулы изобретения.
МПК / Метки
МПК: G01N 33/574, C07K 16/40, A61K 39/385, C07K 16/44, C07K 16/08, C07K 16/00, G01N 33/53
Метки: способы, моноклональных, антигенам, композиции, низкой, антител, применения, специфичных, иммуногенностью, наборы, разработки
Код ссылки
<a href="https://eas.patents.su/30-10506-sposoby-nabory-i-kompozicii-dlya-razrabotki-i-primeneniya-monoklonalnyh-antitel-specifichnyh-k-antigenam-s-nizkojj-immunogennostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Способы, наборы и композиции для разработки и применения моноклональных антител, специфичных к антигенам с низкой иммуногенностью</a>
Предыдущий патент: Высокопроизводительный водный буровой раствор и его применение
Следующий патент: Композиция, содержащая частицы меламина
Случайный патент: Система одновременного забивания гвоздей в плоские поверхности, предназначенная для машин для забивания гвоздей с последующим расклепыванием их концов