Способы лечения острого миелоидного лейкоза и миелодиспластического синдрома
Номер патента: 22915
Опубликовано: 31.03.2016
Авторы: Колата Анна, Эриксон-Миллер Конни Л., Гевирц Алан М.
Формула / Реферат
1. Способ лечения пациента с диагнозом острого миелоидного лейкоза, включающий введение фармацевтической композиции, содержащей 3'-{N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразин}-5'-фтор-2'-гидроксибифенил-3-карбоновую кислоту (соединение А) или ее производное и фармацевтический носитель, указанному человеку, где указанная фармацевтическая композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у указанного человека.
2. Способ по п.1, где указанную фармацевтическую композицию вводят указанному человеку до, во время или после введения химиотерапевтического средства.
3. Способ по п.2, где указанную фармацевтическую композицию вводят указанному человеку парентерально.
4. Способ лечения человека с диагнозом миелодиспластического синдрома, включающий введение фармацевтической композиции, содержащей соединение А или его производное и фармацевтический носитель, указанному человеку, где указанная фармацевтическая композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у указанного человека.
5. Способ по п.4, где указанную фармацевтическую композицию вводят указанному человеку до, во время или после введения химиотерапевтического средства.
6. Способ по п.5, где указанную фармацевтическую композицию вводят указанному человеку парентерально.
Текст
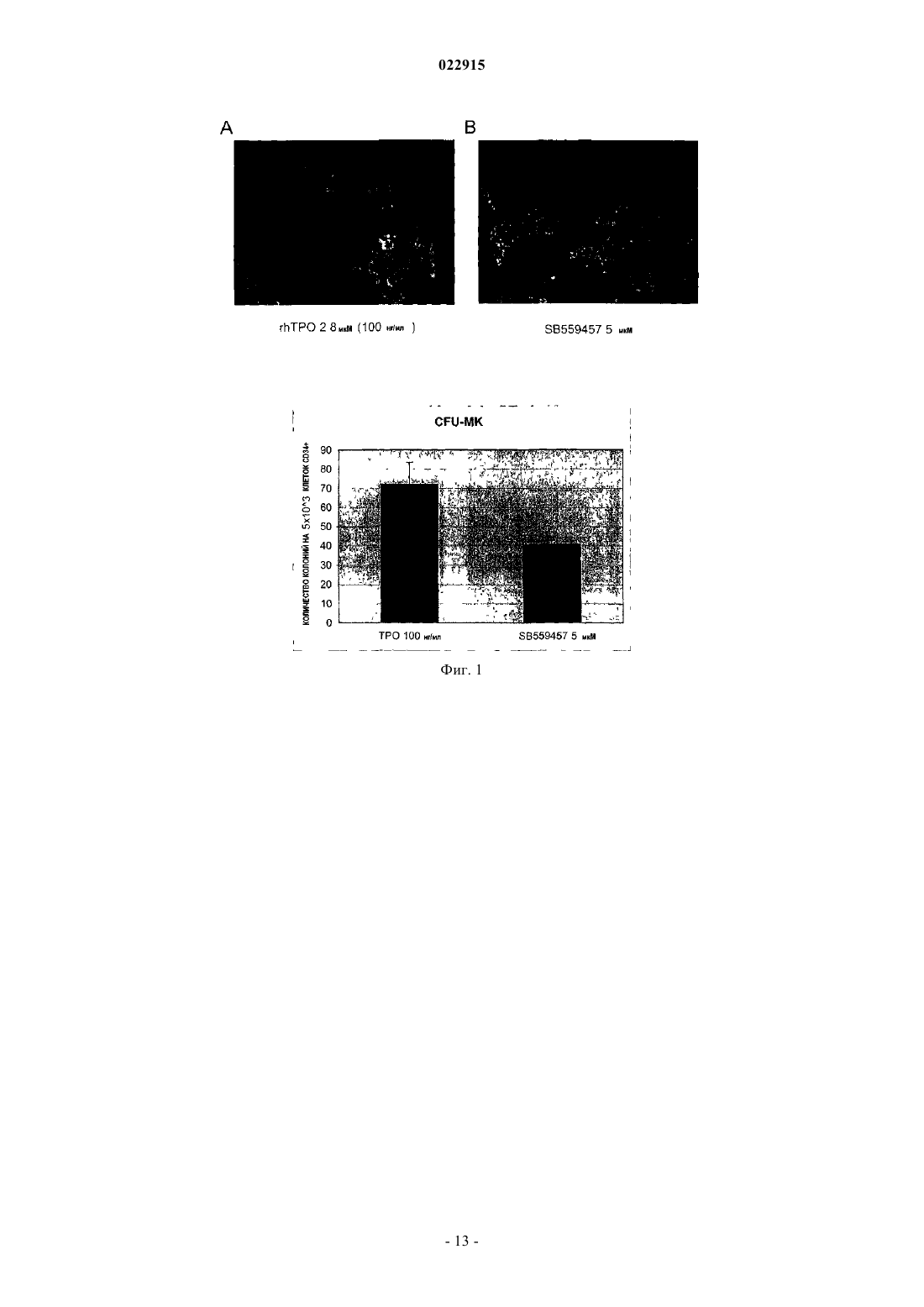
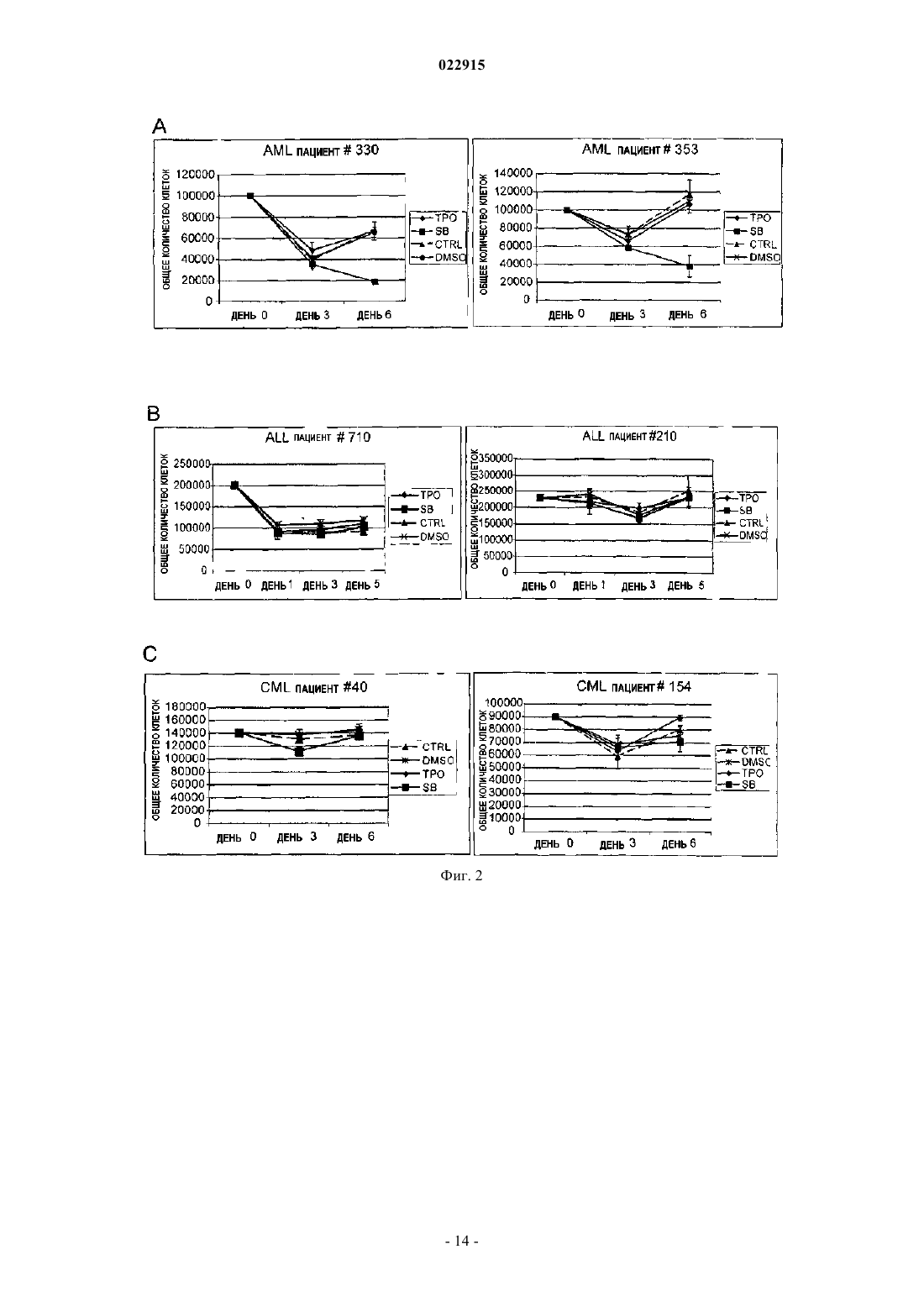
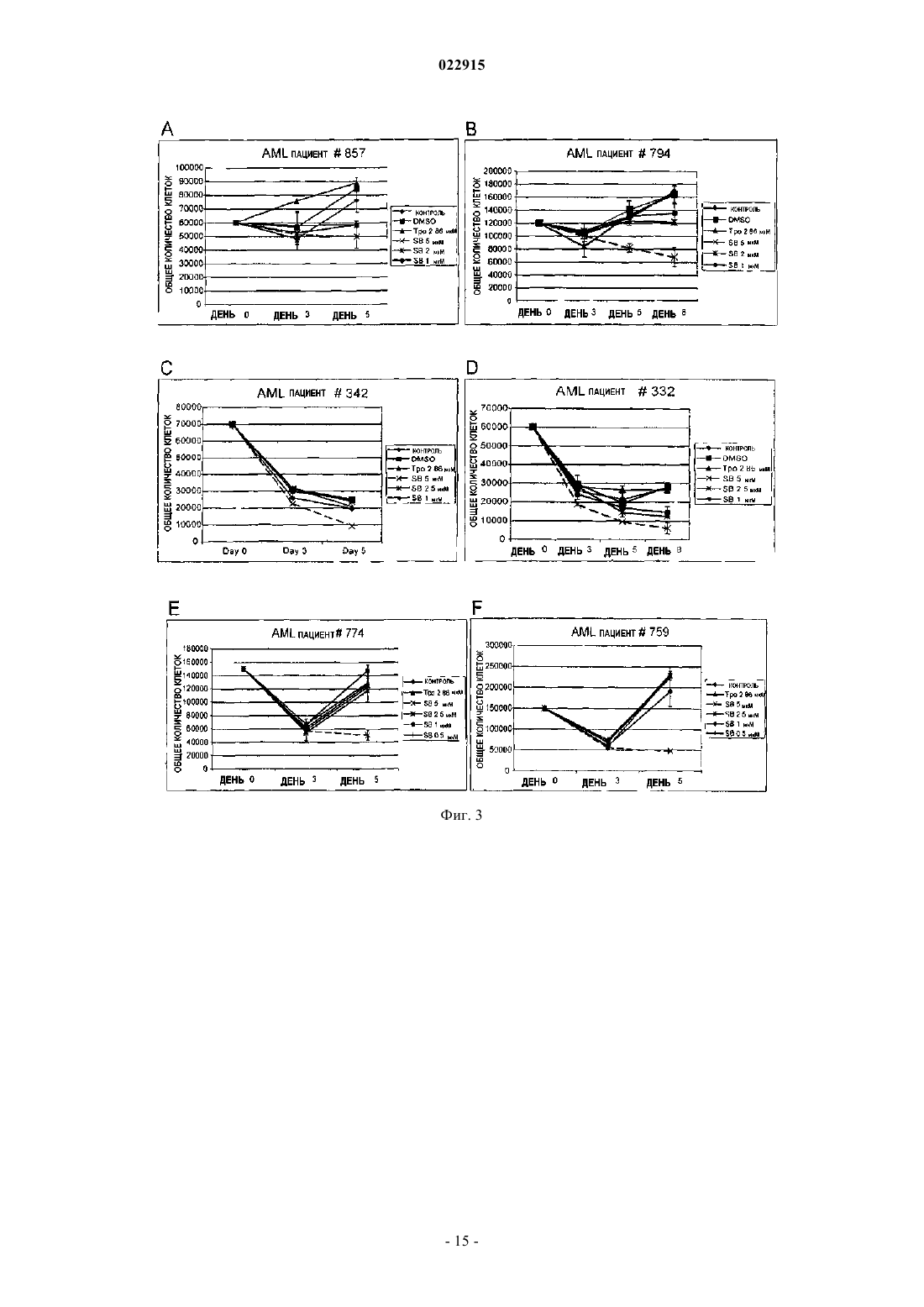
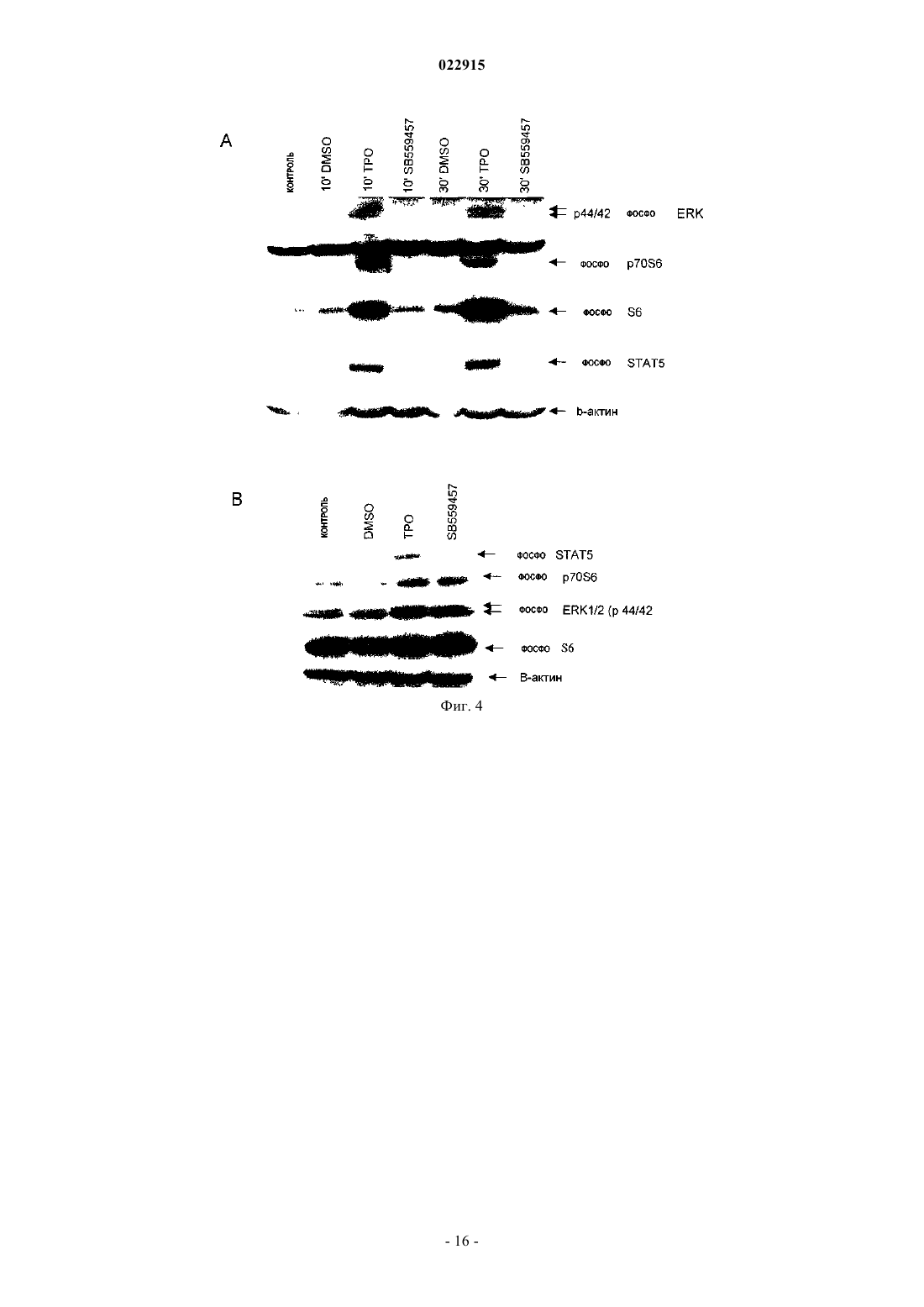
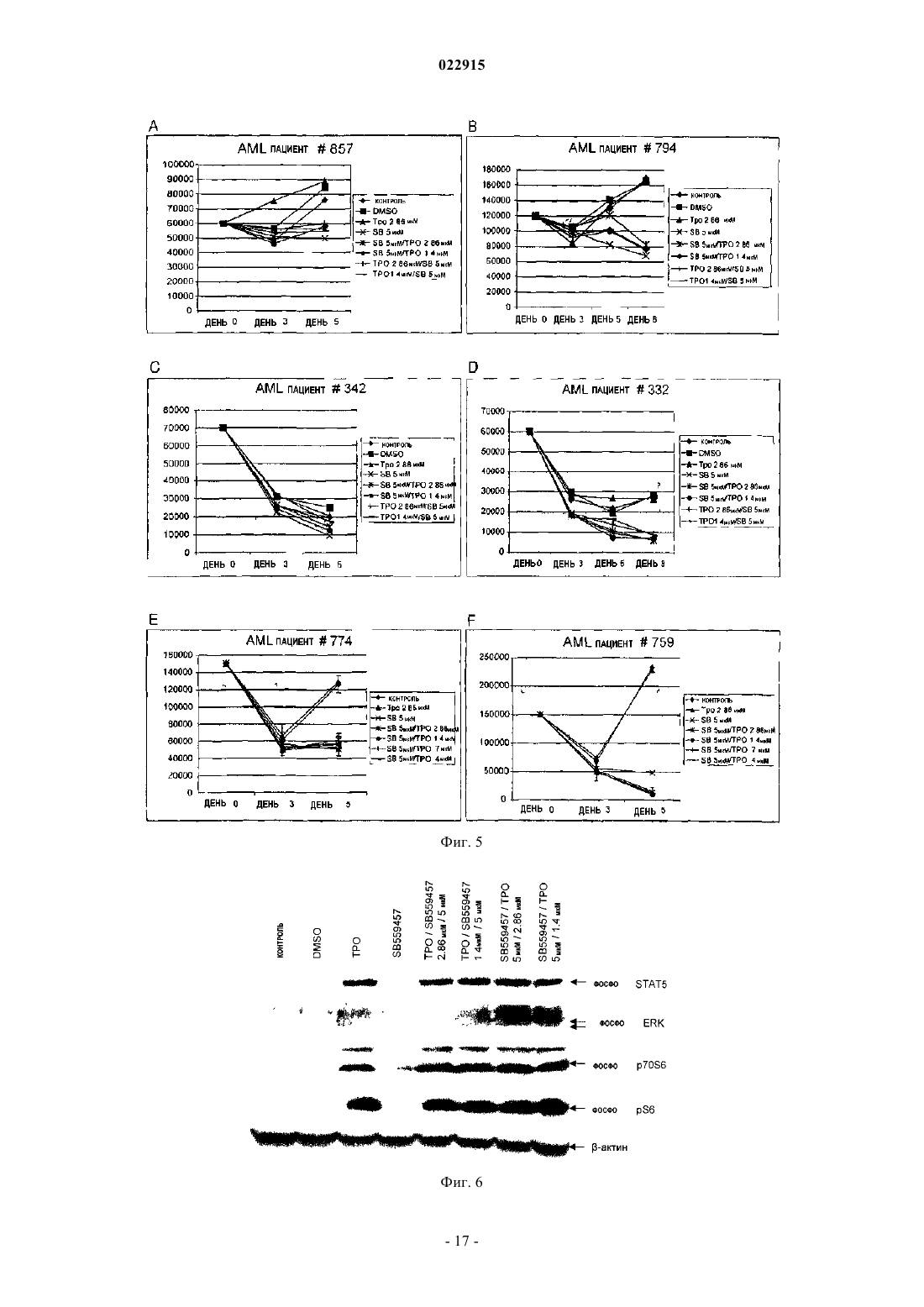
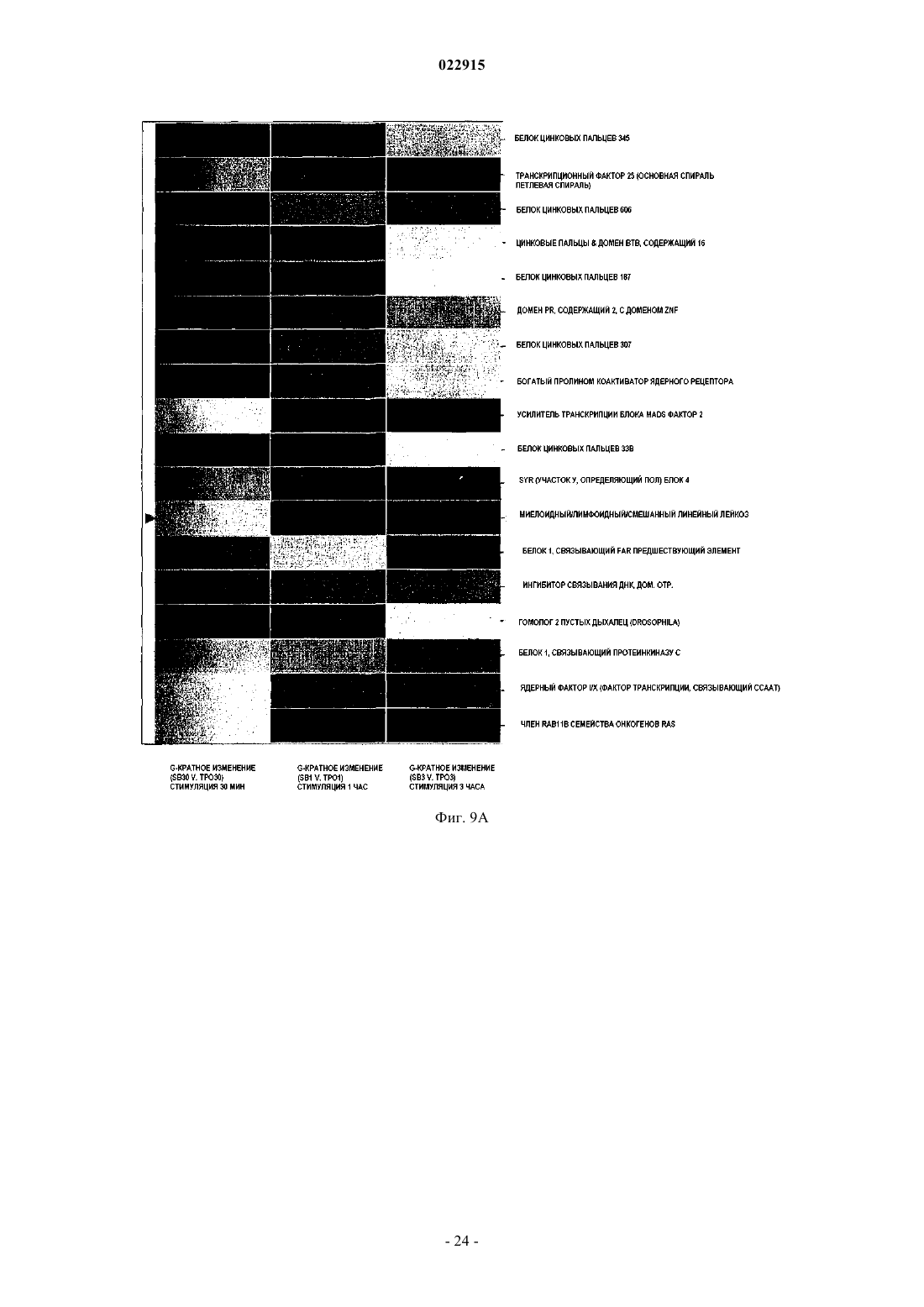
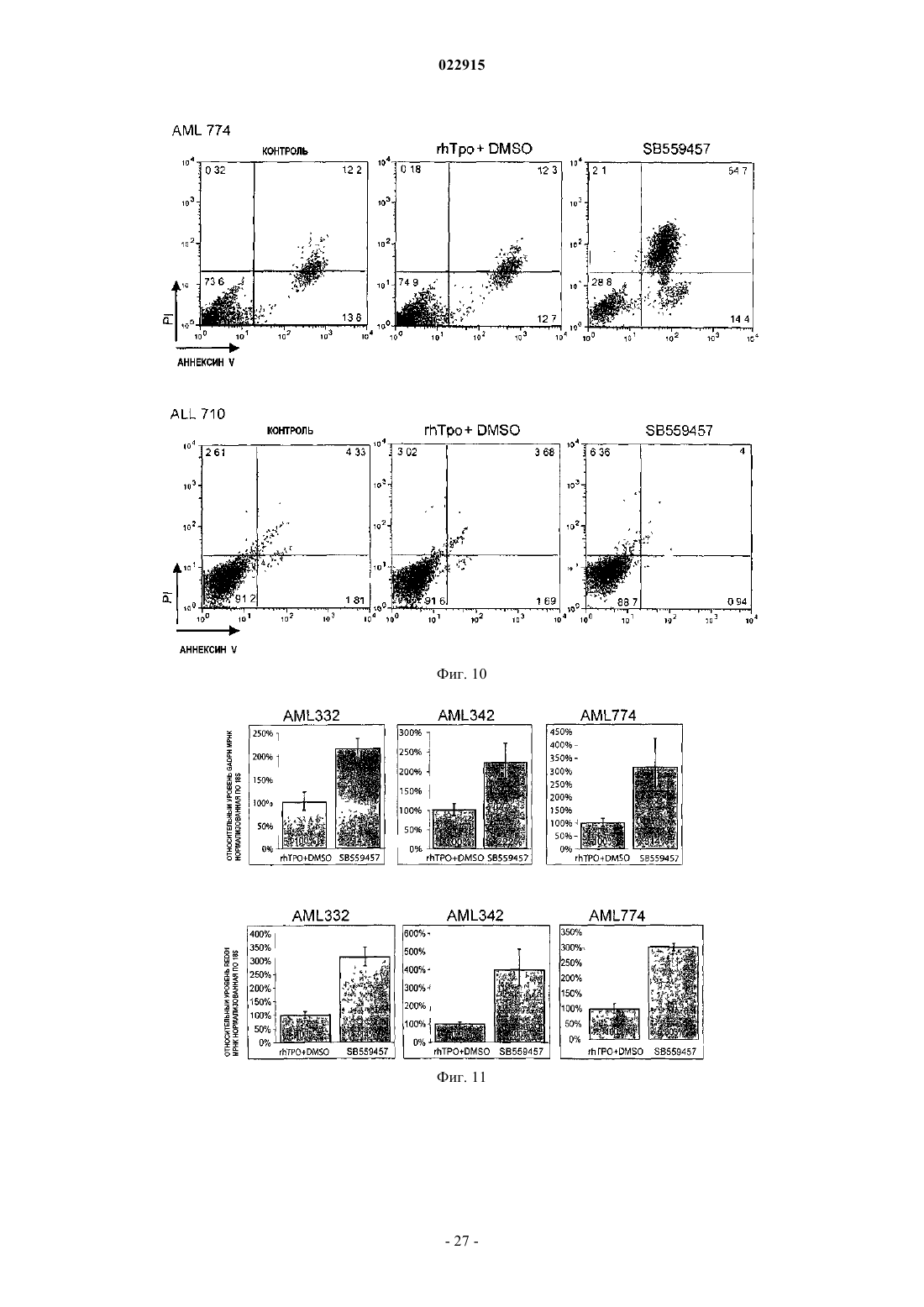
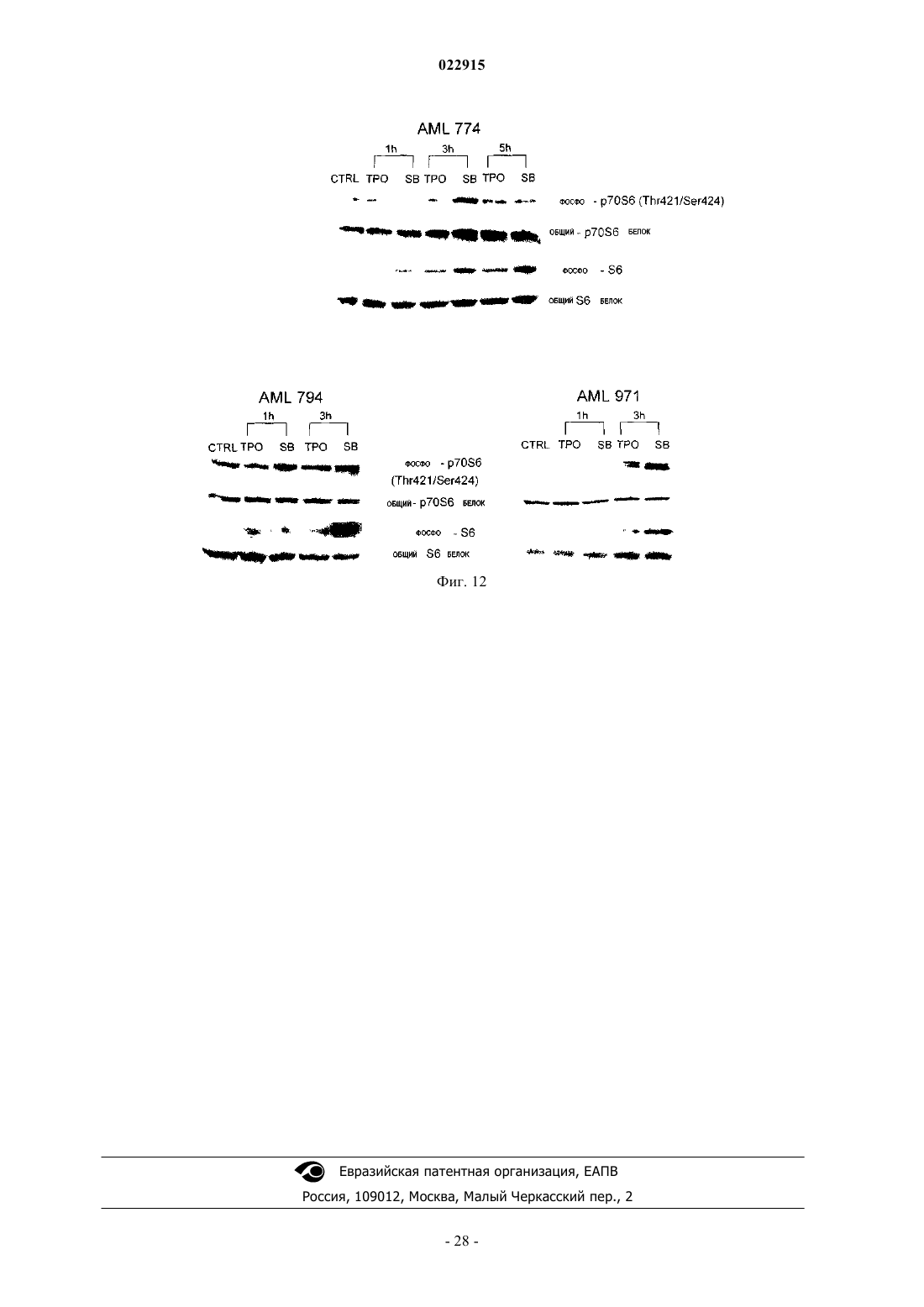
СПОСОБЫ ЛЕЧЕНИЯ ОСТРОГО МИЕЛОИДНОГО ЛЕЙКОЗА И МИЕЛОДИСПЛАСТИЧЕСКОГО СИНДРОМА Настоящее изобретение обеспечивает способы лечения пациента с диагнозом острого миелоидного лейкоза и миелодиспластического синдрома путем введения пациенту фармацевтической композиции, содержащей 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4 илиден]гидразин-5'-фтор-2'-гидроксибифенил-3-карбоновую кислоту (соединение А) или ее производное и фармацевтический носитель.(71)(73) Заявитель и патентовладелец: ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ; ГЛЭКСОСМИТКЛАЙН ЭлЭлСи (US) Предшествующий уровень техники изобретения Около 11920 новых случаев острого миелогенного лейкоза (AML; также известного как острый миелоцитарный лейкоз, острый миелоидный лейкоз, острый миелобластный лейкоз, острый гранулоцитарный лейкоз или острый нелимфоцитарный лейкоз) было диагностировано в Соединенных Штатах в 2005 г. (Surveillance, Epidemiology and End Results [SEER] Program, 2005). Острый лейкоз, наиболее часто поражающий взрослых, AML может возникать в любом возрасте, но у взрослых в возрасте 65 лет и старше более вероятно развитие заболевания, чем у более молодых людей. Кроме того, AML насчитывает около 15-20% случаев острого лейкоза у детей. Злокачественной клеткой при AML является миелобласт. При нормальном гемопоэзе миелобласт представляет собой незрелый предшественник миелоидных лейкоцитов. Однако при AML один миелобласт накапливает генетические изменения, которые "замораживают" клетку в ее незрелом состоянии и предотвращают дифференцировку. Такая мутация отдельно не вызывает лейкоз; однако, когда "остановка дифференцировки" сочетается с другими мутациями, которые повреждают гены, контролирующие пролиферацию, результатом является неконтролируемый рост незрелых клонов клеток (лейкозные бласты), которые не могут функционировать как нормальные клетки крови и также блокируют продукцию нормальных клеток костного мозга. Это приводит к дефициту эритроцитов (анемия), тромбоцитов(тромбоцитопения) и нормальных лейкоцитов, особенно нейтрофилов (нейтропения) в крови, приводя к клиническому развитию AML. Почти все пациенты с AML требуют лечения сразу же после постановки диагноза, насколько возможно. У большинства пациентов для достижения ремиссии требуется интенсивная химиотерапия (индукционная терапия), в течение которой вводят по меньшей мере два различных химиотерапевтических средства. Ремиссия достигается, когда количество лейкоцитов постепенно достигает нормы и лейкозные клетки не обнаруживаются в крови или костном мозге. Однако во время ремиссии остаточные лейкозные клетки все еще имеются, но неактивны; они не вмешиваются в нормальное развитие клеток крови, но обладают потенциалом повторного роста и вызывают рецидив лейкоза. По этой причине обычно рекомендуют дополнительную химиотерапию с или без введения аутологичных стволовых клеток или трансплантацию аллогенных стволовых клеток. Остаточные лейкозные клетки, которые не могут быть обнаружены в крови или при исследовании костного мозга, остаются в организме во время ремиссии. Следовательно, оптимальное лечение AML обычно требует дополнительной интенсивной терапии после достижения ремиссии (закрепляющее лечение). Даже после интенсивной химиотерапии закрепляющего лечения у некоторых пациентов остаются остаточные лейкозные клетки в костном мозге (резистентный лейкоз) и некоторые пациенты все еще страдают от "рецидива" после достижения ремиссии. Одной из наибольших проблем, которые нужно преодолевать при лечении пациента с AML, является то, что лейкозные клетки некоторых пациентов являются нечувствительными к химиотерапевтическим лекарственным препаратам. Это может приводить к неудаче в лечении, направленном на достижение или поддержание ремиссии. Существует три известных механизма устойчивости к лекарственному средству в лейкозных клетках, которые защищают их от эффектов химиотерапии. Во-первых, специфические гены, кодирующие белки, которые вовлечены в защиту примитивных клеток от токсинов (например, Р-гликопротеин (белок множественной устойчивости к лекарственным средствам), белок устойчивости легких и белок устойчивости рака молочной железы). Те или иные белки могут снижать эффективность химиотерапии в клетках острого лейкоза. Во-вторых, химиотерапия использует пути генов апоптоза путем индукции усиленной и ускоренной программируемой клеточной смерти. При некоторых лейкозах, однако, такие гены являются подавленными или даже заблокированными, дословно, блокируя клеточную смерть в результате химиотерапии. В-третьих, в клетках, устойчивых к химиотерапии, могут быть активны специфические семейства генов, что приводит к рецидиву лейкоза пациента. К настоящему времени не было обнаружено новых успешных клинических подходов, которые блокируют тот или иной из этих путей. Хотя часть пациентов с AML, которые входят в ремиссию, остаются в состоянии ремиссии в течение нескольких лет, или полностью излечиваются, увеличилась в течение последних 30 лет, AML остается одним из наиболее трудноизлечимых раков крови. Из-за такой трудности необходима новая терапия для лечения AML. Следовательно, существует долголетняя, неотложная необходимость в области техники в новых методах лечения такого разрушительного заболевания. Настоящее изобретение удовлетворяет эту необходимость. Сущность изобретения Один вариант осуществления изобретения включает способ лечения человека с диагнозом острого миелогенного лейкоза, способ включает введение человеку фармацевтической композиции, включающей агонист рецептора тромбопоэтина (TpoRA) - 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5 дигидропиразол-4-илиден]гидразин-5'-фтор-2'-гидроксибифенил-3-карбоновую кислоту (соединение А),где композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у человека. В одном аспекте композицию вводят человеку до, во время или после введения химиотерапевтического средства. В другом аспекте фармацевтическую композицию вводят человеку парентерально. Другой вариант осуществления изобретения включает способ лечения человека с диагнозом миелодиспластического синдрома, способ включает введение человеку фармацевтической композиции, содержащей TpoRA - соединение А, где композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у человека. В одном аспекте композицию вводят человеку до, во время или после введения химиотерапевтического средства. В другом аспекте фармацевтическую композицию вводят указанному человеку парентерально. Краткое описание чертежей Для целей иллюстрации изобретения определенные варианты осуществления изобретения изображены на чертежах. Однако изобретение не ограничено точными схемами и способами вариантов осуществления, изображенными на чертежах. Фиг. 1, включающая фиг. 1 А-1 С, представляет собой серию графиков, изображающих анализ образования колоний мегакариоцитов. Фиг. 1 А представляет собой изображение, отображающее рост человеческих клеток CD34+ в фибриновых сгустках в присутствии тромбопоэтина (ТРО). Фиг. 1 В представляет собой изображение, отображающее рост человеческих клеток CD34+ в фибриновых сгустках в присутствии соединения А. Фиг. 1 С представляет собой изображение, отображающее количество колоний, образованных из клеток CD34+ после стимуляции ТРО или соединением А. Фиг. 2, включающая фиг. 2 А-2 С, представляет собой серию графиков, изображающих кривые роста, представляющие исследование пролиферации человеческих первичных лейкозных клеток, подвергнутых воздействию ТРО или соединения А. Фиг. 2 А представляет собой пару графиков, изображающих эффект ТРО, соединения A (SB), контроля (CTRL) и ДМСО на первичные клетки, полученных от двух пациентов с острым миелоидным лейкозом (AML). Общее количество клеток показано на оси Y и различные временные точки (день 0, 3 и 4) показаны на оси X. Фиг. 2 В представляет собой пару графиков,изображающих эффекты ТРО, соединения A (SB), контроля (CTRL) и ДМСО на первичные клетки, полученные от двух пациентов с острым лимфоидным лейкозом (ALL). Общее количество клеток показано на оси Y и различные временные точки (день 0, 1, 3 и 5) показаны на оси X. Фиг. 2 С представляет собой пару графиков, изображающих эффекты ТРО, соединения A (SB), контроля (CTRL) и ДМСО на первичные клетки, полученные от двух пациентов с хроническим миелоидным лейкозом (CML). Общее количество клеток показано на оси Y и различные временные точки (день 0, 3 и 6) показаны на оси X. Фиг. 3, включающая фиг. 3 А-3F, представляет собой ряд графиков, изображающих эффект контроля, ДМСО, 2,8 мкМ ТРО, 5 мкМ соединения A (SB), 2,5 мкМ соединения A (SB) и 1 мкМ соединения(SB) на рост первичных лейкозных клеток, полученных от пациентов с AML. Фиг. 3 А представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 857. Фиг. 3 В представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 794. Фиг. 3 С представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 342. Фиг. 3D представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 332. Фиг. 3 Е представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 774. Фиг. 3F представляет собой график, изображающий эффекты 1, 2,5 и 5 мкМ соединения A (SB) и 2,8 мкМ ТРО на клеточный рост первичных лейкозных клеток, полученных от пациента AML 759. Клетки считали в дни 3, 5 и 8 во всех экспериментах. Фиг. 4, включающая фиг. 4 А и 4 В, представляет собой ряд изображений, отображающих иммуноблоттинг фосфорилирования киназ, вовлеченных в передачу сигнала ТРО. Фиг. 4 А представляет собой изображение, отображающее иммуноблоттинг UT-TPO клеток. Фиг. 4 В представляет собой изображение, отображающее иммуноблоттинг человеческих клеток предшественников CD34+. Соединение А обозначено как SB. Фиг. 5, включающая фиг. 5 А-5F, представляет собой серию графиков, изображающих результаты исследования пролиферации. Фиг. 5 А представляет собой график, изображающий результаты анализа пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 857. Фиг. 5 В представляет собой график, изображающий результат анализа пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 794. Фиг. 5 С представляет собой график,изображающий результат анализа пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 342. Фиг. 5D представляет собой график, изображающий результат анализа-2 022915 пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 332. Фиг. 5 Е представляет собой график, изображающий результат анализа пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 774. Фиг. 5F представляет собой график,изображающий результат анализа пролиферации, проводимого на первичных лейкозных клетках, полученных от пациента с AML 759. Соединение А обозначено как SB. Фиг. 6 представляет собой изображение, отображающее вестерн-блот анализ фосфорилирования киназ ERK1/2, p70S6, S6 и STAT5 в клетках N2C-TPO, подвергнутых воздействию и соединения А иrhTPO. Соединение А обозначено как SB. Фиг. 7 представляет собой изображение, отображающее тепловую карту, иллюстрирующую различия в экспрессии всех исследуемых генов в клетках N2C-TPO, стимулированных ТРО по сравнению с соединением А в различные моменты времени. Изменения экспрессии генов в клетках, стимулированных соединением А, указаны более светлым цветом. Фиг. 8, включающая фиг. 8 А и 8 В, представляет собой серию изображений, отображающих тепловые карты, изображающие регуляцию генов в ответ на стимуляцию ТРО vs соединение А. Фиг. 8 А представляет собой изображение, отображающее тепловую карту, иллюстрирующую гены, вовлеченные в путь апоптоза в клетках N2C-TPO, которые подавляются стимуляцией ТРО vs соединение А. Изменения экспрессии генов в клетках, стимулированных соединением А, указаны более светлым цветом. Фиг. 9, включающая фиг. 9 А и 9 В, представляет собой серию изображений, отображающих тепловые карты, показывающие регуляцию факторов транскрипции в клетках N2C-TPO, стимулированных ТРО vs соединение А. Фиг. 9 А представляет собой изображение, отображающее тепловую карту факторов транскрипции, которые стимулируются в клетках N2C-TPO, стимулированных ТРО vs соединение А. Фиг. 9 В представляет собой изображение, отображающее тепловую карту, иллюстрирующую факторы транскрипции, которые подавляются в клетках N2C-TPO, стимулированных ТРО vs соединение А. Изменения экспрессии генов в клетках, стимулированных соединением А, указаны более светлым цветом. Фиг. 10 представляет собой серию изображений, отображающих результаты анализа апоптоза, проводимого на первичных клетках, выделенных от пациентов людей с диагнозом или AML, или ALL. Верхняя группа из трех панелей изображает данные, полученные от пациента AML с 774, где выделенные первичные клетки подвергали воздействию контроля (левая панель), rhTPO + ДМСО (средняя панель) или SB559457 (правая панель), затем оценивали в отношении апоптоза. Нижняя группа из трех панелей изображает данные, полученные от пациента с ALL 710, где первичные клетки подвергали воздействию контроля (левая панель), rhTPO + ДМСО (средняя панель) или SB559457 (правая панель), затем оценивали в отношении апоптоза. Оси указывают количество клеток, окрашенных или йодидом пропидия (PI; ось ) или аннексином V (ось х). Фиг. 11 представляет собой серию графиков, изображающих сравнение количественного ПЦРанализа уровня мРНК GADPH (верхняя панель) и Redd1 (нижняя панель) в первичных клетках AML,стимулированных rhTPO (2,86 мкМ) или SB559457 (5 мкМ) в течение 6 ч. Фиг. 12 представляет собой серию изображений, отображающих результаты иммуноблоттинга фосфорилирования p70S и S6 киназ в трех различных образцах первичных клеток AML (AML 774, AML 794 и AML 971) после воздействия rhTPO или SB559457 в течение 1, 3 или 5 ч. Контроль = нестимулированные клетки; ТРО = клетки, стимулированные 2,86 6 мкМ rhTpo + 0,05% ДМСО; SB = клетки, стимулированные мкМ SB559457. Подробное описание изобретения Настоящее изобретение обеспечивает способы ингибирования роста и пролиферации человеческих клеток миелоидного лейкоза путем введения агониста рецептора тромбопоэтина (TpoRA), его производного или варианта пациенту с AML. В одном варианте осуществления изобретения TpoRA, его производное или вариант вводят пациенту с AML. В другом варианте осуществления изобретения TpoRA, его производное или вариант вводят пациенту с AML в качестве части схемы химиотерапии. Определения. Если не указано иначе, все технические и научные термины, используемые в настоящем описании,имеют такое же значение, как обычно понимает обычный специалист в области техники, к которой относится изобретение. Хотя любые методы и материалы, сходные с или эквивалентные описанным в настоящем патенте, могут быть использованы в осуществлении для изучения настоящего изобретения,предпочтительные материалы и методы представлены в настоящем описании. В описании и заявлении настоящего изобретения будет использоваться следующая терминология. Также необходимо понимать, что терминология, используемая в настоящем описании, предназначена только для целей описания определенных вариантов осуществления изобретения и не предназначена для ограничения."Аминокислота", как используется в настоящем описании, обозначает включение и естественных и синтетических аминокислот, и D и L аминокислот. "Стандартная аминокислота" обозначает любую из двадцати L-аминокислот, обычно обнаруживаемых в пептидах естественного происхождения. "Нестандартные остатки аминокислот" обозначают любую аминокислоту, иную чем стандартная аминокислота,вне зависимости от того, получают ее синтетически или она происходит из натурального источника. Как-3 022915 используется в настоящем описании, "синтетическая аминокислота" также охватывает химически модифицированные аминокислоты, включая, но не ограничиваясь, соли, производные аминокислот (такие как амиды) и замещения. Аминокислоты, содержащиеся в пептидах и особенно на карбокси- и аминоконце,могут быть модифицированы метилированием, амидированием, ацетилированием или замещением другими химическими группами, которые могут изменять время полужизни пептида в циркуляции, не влияя негативно на активность пептида. Кроме того, дисульфидная связь может присутствовать или отсутствовать в пептидах."Около", как используется в настоящем описании в отношении измеряемого значения, такого как количество, временная продолжительность и подобные обозначает охватывание вариаций 20% или 10%, более предпочтительно 5%, еще более предпочтительно 1% и еще более предпочтительно 0,1% от указанного значения, в таком качестве варианты соответствуют осуществлению указанных методов. Термины "агонист" и "агонистический" при использовании в настоящем описании, относятся к или описывают молекулу, которая способна прямо или опосредованно, по существу индуцировать, запускать или усиливать биологическую активность или активацию рецептора. Термин "химиотерапия", как используется в настоящем описании, относится к курсу лечения, где химиотерапевтическое средство вводят пациенту с диагнозом рака. Химиотерапевтическое средство включает средства, такие как лекарственные средства, которые могут преимущественно вводиться пациенту с раком, для лечения указанного рака. Химиотерапевтическое средство часто включает средство,индуцирующее апоптоз, которое индуцирует апоптоз в клетках, например опухолевых клетках. Клетки,включая раковые клетки, могут быть индуцированы для развития программируемой клеточной смерти,также известной как апоптоз. Апоптоз характеризуется селективным программируемым разрушением клеток на относительно мелкие фрагменты с ДНК, становящейся высокофрагментированной (т.е. полученные фрагменты обычно имеют не более чем около 200 оснований). Во время апоптоза возникает сморщивание клеток и расщепление интернуклеосомальной ДНК, что приводит к фрагментации ДНК. Термин "производное" используется для определения соединения, которое было получено из другого, особенно соединения включающего любую модификацию соединения А по настоящему изобретению, которое сохраняет биоактивность соединения А, как описано в настоящем описании. Термин "ДНК", как используется в настоящем описании, определяют как деоксирибонуклеиновую кислоту."Эффективное количество" или "терапевтически эффективное количество" используются в настоящем описании взаимозаменяемо и относятся к количеству соединения, рецептуры, материала или композиции, как описано в настоящем описании, эффективному для достижения определенного биологического результата. Такие результаты могут включать, но не ограничиваются, ингибирование вирусной инфекции, что определяют любыми средствами, подходящими в области техники."Выделенный" обозначает измененный или удаленный из натурального состояния. Например, нуклеиновая кислота или пептид, естественно присутствующий у живого животного не является "выделенным", но такая же нуклеиновая кислота или пептид, частично или полностью отделенные от совместно существующих веществ в их натуральном состоянии, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать в, по существу, очищенной форме или могут существовать в неестественном окружении, таком как, например, клетка-хозяин. Выражение "лейкопения", как используется в настоящем описании, относится к снижению у млекопитающего концентрации лейкоцитов крови (белых клеток крови) ниже нормы. Выражение "мутация", как используется в настоящем описании, относится к изменению в гене, которое возникает в результате изменения части линейной ДНК, которая представляет собой ген."Мутация половых клеток" присутствует в яйцеклетке или сперме и может быть передана от родителя(ей) потомству."Мутация соматических клеток" возникает в специфической тканевой клетке и может возникать в результате роста специфической тканевой клетки в опухоль. Большинство раков начинается после соматической мутации. При лейкозе, лимфоме или миеломе, незрелый костный мозг или клетки лимфатических узлов подвергаются соматической мутации(ям), которые приводят к образованию опухоли. В таких случаях опухоли обычно широко распространены при выявлении; они обычно включают костный мозг множества костей или включают лимфатические узлы в нескольких местах. Выражение "онкоген", как используется в настоящем описании, относится к мутантному гену, который является причиной рака. Несколько подтипов острого миелоидного лейкоза, острого лимфоцитарного лейкоза, лимфомы и почти все случаи хронического миелогенного лейкоза имеют соответствующий мутатный ген (онкоген). Как используется в настоящем описании, термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из остатков аминокислот, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты и не существует каких-либо ограничений максимального количества аминокислот, которые могут составлять-4 022915 последовательность белка или пептида. Полипептиды включают любой пептид или белок, включающий две или более аминокислоты, объединенные друг с другом пептидными связями. Как используется в настоящем описании, термин относится и к коротким цепям, которые также обычно называются в области техники пептидами, олигопептидами и олигомерами, например и к длинным цепям, которые обычно называют в области техники белками, которых существует множество типов. "Полипептиды" включают,например, среди остальных, биологически активные фрагменты, по существу, гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, сшитые белки. Полипептиды включают естественные пептиды, рекомбинатные пептиды, синтетические пептиды или их комбинации."Фармацевтически приемлемый" относится к таким свойствам и/или веществам, которые являются применимыми для пациента с фармакологической/токсикологической точки зрения и для производства фармацевтом-химиком с физической/химической точки зрения, касающейся композиции, рецептирования, стабильности, приемлемости для пациента и биодоступности. "Фармацевтически приемлемый носитель" относится к среде, которая не влияет на эффективность биологической активности активного ингредиента(ов) и не является токсичной для организма-хозяина, которому его вводят. Фраза "полимеразная цепная реакция (ПЦР)" как используется в настоящем описании, относится к методике увеличения следовых количеств ДНК или РНК, так что специфический тип ДНК или РНК может быть исследован или определен. Такая методика стала применимой в определении очень низкой концентрации остаточных лейкозных или лимфомных клеток, слишком небольшой для определения с использованием микроскопа. Методика может определить присутствие одной лейкозной клетки среди 500 тыс.-1 млн нелейкозных клеток. ПЦР требует специфических ДНК (или РНК) нарушений или маркера, как онкоген, в лейкозных или лимфоматозных клетках для его применения в определении остаточных аномальных клетках. Термин "полинуклеотид", как используется в настоящем описании, определяют как цепочку нуклеотидов. Более того, нуклеиновые кислоты являются полимерами нуклеотидов. Следовательно, нуклеиновые кислоты и полинуклеотиды, как используется в настоящем описании,являются взаимозаменяемыми. Специалист в области техники в общем понимает, что нуклеиновые кислоты являются полинуклеотидами, которые могут быть гидролизованы в мономерные "нуклеотиды". Мономерные нуклеотиды могут быть гидролизованы в нуклеозиды. Как используется в настоящем описании, полинуклеотиды включают, но не ограничиваются, все последовательности нуклеиновых кислот,которые получают любыми средствами, доступными в области техники, включая, без ограничения, рекомбинантные средства. Выражение "рефрактерное (заболевание)", как используется в настоящем описании, относится к заболеванию, которое не входит в ремиссию или существенно не улучшается после начального лечения с помощью стандартной терапии для заболевания. Выражение "рецидив (возврат)", как используется в настоящем описании, относится к возвращению заболевания после того, как оно находилось в ремиссии после лечения. Выражение "ремиссия", как используется в настоящем описании, относится к исчезновению симптомов заболевания, обычно в результате лечения. Термины "полная" или "частичная" используют для модификации термина "ремиссия". Полная ремиссия обозначает, что все симптомы заболевания ушли. Частичная ремиссия обозначает, что заболевание существенно улучшилось при лечении, но имеются остаточные симптомы заболевания. Длительные преимущества обычно требуют полной ремиссии, особенно при остром лейкозе или прогрессирующих лимфомах. Выражение "устойчивость к лечению", как используется в настоящем описании, относится к способности клеток жить и делиться, несмотря на воздействие на них химических веществ, которые обычно убивают клетки или ингибируют их рост. Рефрактерный лейкоз представляет собой обстоятельства, в которых часть злокачественных клеток устойчива к повреждающим эффектам лекарственного средства или лекарственных средств. Клетки имеют несколько путей развития устойчивости к лекарственным средствам. Термин "терапевтический", как используется в настоящем описании, обозначает лечение и/или профилактику. Терапевтический эффект получают путем подавления, ремиссии или устранения патологического состояния, ассоциированного с болезнью печени. Выражение "тромбоцитопения", как используется в настоящем описании, относится к снижению у млекопитающего концентрации тромбоцитов крови ниже нормы. Термин "лечение", как используется в рамках настоящего изобретения, обозначает включение терапевтического лечения, а также профилактических или супрессивных мер для заболевания или расстройства. Следовательно, например, термин "лечение" включает введение средства до или после развития заболевания или расстройства, таким образом, предотвращая или устраняя все признаки заболевания или расстройства. В качестве другого примера, введение средства после клинической манифестации заболевания для борьбы с симптомами заболевания включает "лечение" заболевания."Вариант" как термин, используемый в настоящем описании, представляет собой последователь-5 022915 ность нуклеиновых кислот или пептидную последовательность, которая отличается по последовательности от контрольной последовательности нуклеиновой кислоты или пептидной последовательности, соответственно, но сохраняет необходимые свойства контрольной молекулы. Изменения последовательности варианта нуклеиновой кислоты могут не изменять последовательности аминокислот пептида, кодируемого контрольной нуклеиновой кислотой или может приводить к заменам, добавлениям, делециям,сшивкам и разветвлениям аминокислот. Изменения последовательности вариантов пептидов обычно ограничены или консервативны, так что последовательности контрольного пептида и варианта очень сходны в целом и, во множестве участков, идентичны. Вариант и контрольный пептид могут отличаться в последовательности аминокислот одной или более замен, добавлений, делеций в любой комбинации. Вариант нуклеиновой кислоты или пептида может быть естественным, например, аллельный вариант,или может быть вариантом, который неизвестен в естественной среде. Неестественные варианты нуклеиновых кислот и пептидов могут быть получены методиками мутагенеза или прямым синтезом. Термин вариант также может относиться к модификации, проделанной с молекулой, которая не изменяет ее функцию. Описание. Настоящее изобретение обеспечивает способы ингибирования роста и пролиферации клеток человеческого миелоидного лейкоза с использованием агониста рецептора тромбопоэтина. Способ по настоящему изобретению является применимым в лечении расстройств пролиферации и/или дифференцировки клеток, особенно, таковых, связанных с острым миелоидным лейкозом. Агонисты рецептора тромбопоэтина в настоящем изобретении. Изобретение включает применение агониста рецептора тромбопоэтина (TpoRA) для ингибирования роста и пролиферации клеток AML. Термины "агонист рецептора тромбопоэтина" или "агонист рецептора ТРО" (TpoRA) используют в настоящем описании взаимозаменяемо и включают любое фармацевтическое соединение, небольшую молекулу, пептид или нуклеиновую кислоту, которые обладают свойствами связывания с рецептором тромбопоэтина, mpl и обладают биологическим свойством агониста mpl. В настоящем изобретении биологическим свойством агониста рецептора ТРО является ингибирование роста и пролиферации клеток AML. Предпочтительные TpoRA, применимые в способе по изобретению, представляют собой 3'-N'-[1(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразин-5'-фтор-2'гидроксибифенил-3-карбоновую кислоту, далее известную как соединение А. Соединение А представляет собой соединение, которое описано (как пример 13) и заявлено, вместе с его фармацевтически приемлемыми солями, гидратами, сольватами и сложными эфирами, как применимые в виде агониста рецептора ТРО, особенно в усилении продукции тромбоцитов и особенно в лечении тромбоцитопении, в Международной заявкеPCT/US01/16863 (Международная публикация номер WO 01/89457; публикация Соединенных Штатов номер US 2004/0019190 А 1), описание которых таким образом включено в виде ссылки, и чья структура является следующей: Способы лечения. В одном варианте осуществления способов по настоящему изобретению TpoRA, его производное или вариант вводят пациенту с диагнозом AML. В одном аспекте изобретения TpoRA, его производное или вариант вводят пациенту с AML в качестве части химиотерапевтической схемы для усиления эффективности химиотерапевтического средства. В другом варианте осуществления способов по настоящему изобретению TpoRA, его производное или вариант вводят пациенту с диагнозом миелодиспластического синдрома. В одном аспекте изобретения TpoRA его производное или вариант вводят пациенту с миелодиспластическим синдромом в качестве части схемы химиотерапии для усиления эффективности химиотерапевтического средства. Под "усилением эффективности химиотерапевтического средства" обозначают, что введение Tpo-6 022915RA, его производного или варианта принесет клинический результат, включая, но не ограничиваясь, увеличение выживаемости пациента, уменьшение клинических признаков AML или миелодиспластического синдрома у пациента или возможность снижения дозы химиотерапевтического средства или частоты введения химиотерапевтического средства, или обоих, таким образом, уменьшая нежелательные побочные эффекты, ассоциированные с токсичностью химиотерапевтических средств и делая схему химиотерапии более переносимой. TpoRA, его производное или вариант могут вводиться пациенту или до введения химиотерапевтического средства, или во время введения химиотерапевтического средства, или после введения химиотерапевтического средства, или в некоторой их комбинации, расцениваемой как эффективные для лечения пациента. Установление оптимальной схемы введения TpoRA, его производного или варианта в качестве части схемы химиотерапии находится в рамках области техники. В другом аспекте изобретения TpoRA, его производное или вариант вводят пациенту перед введением химиотерапии. Не желая быть связанным какой-либо теорией, специалист в области техники понимает, что введение TpoRA пациенту перед началом химиотерапии будет нацелено на лейкозные клетки,устойчивые к химиотерапии, и будет усиливать эффективность химиотерапевтического средства. Кроме того, все лейкозные клетки, которые экспрессируют рецептор ТРО, являются мишенями TpoRA, его производного или варианта. Специалисту в области техники очевидно, что введение TpoRA, его производного или варианта пациенту перед началом химиотерапии делает лейкозные клетки более чувствительными к химиотерапевтическим средствам, таким образом делая лечение более эффективным. В еще одном аспекте изобретения TpoRA, его производное или вариант вводят пациенту после того,как пациент завершит курс химиотерапии. Не желая быть связанным с какой-либо теорией, специалист в области техники понимает, что остаточные, неопределяемые циркулирующие лейкозные клетки увеличивают риск рецидива у пациентов с AML после завершения химиотерапии. Введение TpoRA, его производного или варианта пациенту, который завершил курс химиотерапии, нацелено на лейкозные клетки,несмотря на то, что они все еще неактивны, и уменьшает риск возврата заболевания. В еще одном аспекте изобретения TpoRA, его производное или вариант вводят пациенту вместо химиотерапии в качестве единственного метода лечения AML. Специалист в области техники понимает,что у ряда пациентов с диагнозом AML лейкозные клетки являются устойчивыми к химиотерапии. Лечение таких пациентов с помощью TpoRA, его производного или варианта является альтернативной терапией, которая обходит механизмы, которые позволяют лейкозным клеткам ускользать от химиотерапевтических средств. В еще одном аспекте изобретения TpoRA, его производное или вариант вводят пациенту вместо химиотерапии в качестве единственного метода лечения AML. Композиции и методы по настоящему изобретению могут быть использованы в комбинации с другими схемами лечения, включая виростатические и виротоксические средства, антибиотики, противогрибковые средства, противовоспалительные средства, терапии, уменьшающие боль, а также комбинированное лечение и подобные. Изобретение также может быть использовано в комбинации с другими способами лечения, такими как химиотерапия, криотерапия, гипертермия, лучевая терапия и подобные. Лечение и фармацевтические препараты.TpoRA, его производное или вариант могут вводить пациенту с использованием любого подходящего пути, известного в области техники, включая, например, протоколы внутривенного введения. Введение может осуществляться или быстрой, непосредственной инъекцией или в течение периода времени,например медленной инфузией. Также могут быть использованы композиции с медленным высвобождением. Более того, TpoRA, его производное или вариант могут быть стабильно связаны с полимером, таким как полиэтиленгликоль, для придания желаемых свойств, таких как растворимость, стабильность,удлиненный период полужизни и другие фармацевтически преимущественные свойства TpoRA, его производному или варианту (см., например, Burnham 1994, AM. J. Hosp. Pharm. 51:210-8). Ингибиторы и активаторы фосфатазы и ингибиторы и активаторы киназ также могут быть связаны или сконъюгированы с TpoRA для придания желаемых свойств, таких как растворимость, стабильность,более длительный период полужизни и другие фармацевтически преимущественные свойства TpoRA. Изобретение охватывает применение фармацевтических композиций для осуществления методов по изобретению, композиции включают соответствующее терапевтическое соединение и фармацевтически приемлемый носитель. Как используется в настоящем описании, термин "фармацевтически приемлемый носитель" обозначает химическую композицию, с которой терапевтическое соединение может быть скомбинировано, и которая, после комбинации, может быть использована для введения соответствующего терапевтического соединения млекопитающему. Фармацевтические композиции, применимые для осуществления изобретения, могут вводиться для доставки дозы от 1 нг/кг/сутки до 100 мг/кг/сутки. Точная вводимая дозировка будет варьироваться в зависимости от любого набора факторов, включая, но не ограничиваясь, тип животного и тип патологического состояния, которое лечат, возраст животного и путь введения. В рамках области техники находится установление оптимальной дозировки TpoRA, его производного или варианта, требуемой для мак-7 022915 симальной клинической пользы. Фармацевтические композиции, которые являются применимыми в способах по изобретению, могут вводиться системно во внутривенных композициях. В добавление к соответствующему терапевтическому соединению такие фармацевтические композиции могут содержать фармацевтически приемлемые носители и другие ингредиенты, известные как усиливающие и облегчающие введение лекарственного средства. Изобретение охватывает получение и применение фармацевтических композиций, включающих соединение, применимое для лечения AML, описанное в настоящем описании в качестве активного ингредиента. Такая фармацевтическая композиция может состоять из только активного ингредиента в форме,подходящей для введения пациенту, или фармацевтическая композиция может включать активный ингредиент и один или более фармацевтически приемлемых носителей, один или более дополнительных ингредиентов или некоторые комбинации таковых. Активный ингредиент может присутствовать в фармацевтической композиции в форме физиологически приемлемого сложного эфира или соли, например в комбинации с физиологически приемлемым катионом или анионом, как хорошо известно в области техники. Как используется в настоящем описании, термин "физиологически приемлемый" сложный эфир или соль обозначает форму сложного эфира или соли активного ингредиента, которая является совместимой с любыми другими ингредиентами фармацевтической композиции, которые не являются вредными для пациента, которому вводят композицию. Рецептуры фармацевтических композиций, описанных в настоящем описании, могут быть получены любым методом, известным или впоследствии разработанным в области техники фармакологии. В общем, такие методы получения включают стадию приведения активного ингредиента в контакт с носителем или одним или более другими вспомогательными ингредиентами и затем, если необходимо или желательно, формование или упаковку продукта в желаемые формы, содержащие разовую дозу или несколько доз. Фармацевтические композиции, которые являются применимыми в способах по изобретению, могут быть получены, упакованы или проданы в композициях, подходящих для парентерального, внутривенного или другого пути введения. Фармацевтическая композиция по изобретению может быть получена, упакована или продана в партии, в виде стандартной лекарственной формы, содержащей разовую дозу, или в виде множества стандартных лекарственных форм, содержащих разовую дозу. Как используется в настоящем описании,"стандартная лекарственная форма" представляет собой определенное количество фармацевтической композиции, включающее заранее определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, которую вводят пациенту, или удобной фракции такой дозировки, такому как, например, половина или одна треть такой дозировки. Относительные количества активного ингредиента, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции по изобретению будут варьироваться в зависимости от сущности, размера и состояния пациента, получающего лечение, и дополнительно в зависимости от пути, посредством которого композицию будут вводить. В качестве примера, композиция может включать от 0,1 до 100% (мас./мас.) активного ингредиента. В добавление к активному ингредиенту фармацевтическая композиция по изобретению может дополнительно включать одно или более дополнительных фармацевтически активных средств. Композиции с контролируемым или непрерывным высвобождением фармацевтической композиции по изобретению могут быть получены с использованием обычной методики. Как используется в настоящем описании "парентеральное введение" фармацевтической композиции включает любой путь введения, характеризуемый физическим разрывом ткани пациента и введением фармацевтической композиции через разрыв в ткани. Следовательно, парентеральное введение включает, но не ограничивается, введение фармацевтической композиции посредством инъекции композиции,применение композиции при хирургическом рассечении, нанесение композиции через тканепроникающие нехирургические раны и подобное. В частности, предусматривается, что парентеральное введение включает, но не ограничивается, внутривенную, подкожную, интраперитонеальную, внутримышечную, интрастернальную инъекцию и методики инфузии при диализе почек. Рецептуры фармацевтической композиции, подходящие для парентерального введения, включают активный ингредиент, смешанный с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие композиции могут быть получены, упакованы или проданы в форме, подходящей для болюсного введения или для непрерывного введения. Инъекционные композиции могут быть получены, упакованы или проданы в стандартной лекарственной форме, например в ампулах или в контейнерах с несколькими дозами, содержащих консервант. Композиции для парентерального введения включают, но не ограничиваются, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые биоразлагаемые композиции или композиции с длительным высвобождением. Такие композиции могут дополнительно включать один или более дополнительных ингредиентов, включая, но не ограничиваясь, суспендирующие, стабилизирующие или дис-8 022915 пергирующие средства. В одном варианте осуществления изобретения композиции для парентерального введения активный ингредиент обеспечивают в сухой (т.е. порошкообразной или гранулярной) форме для восстановления подходящим носителем (например, стерильная апирогенная вода) перед парентеральным введением восстановленной композиции. Фармацевтические композиции могут быть получены, упакованы или проданы в форме стерильной инъекционной водной или масляной суспензии или раствора. Такая суспензия или раствор могут быть рецептированы в соответствии с известной областью техники и могут включать, в добавление к активному ингредиенту, дополнительные ингредиенты, такие как диспергирующие средства, увлажняющие средства или суспендирующие средства, описанные в настоящем описании. Такие стерильные инъекционные композиции могут быть получены с использованием нетоксических парентерально-приемлемых разбавителей или растворителей, таких как вода или 1,3-бутандиол, например. Другие приемлемые разбавители и растворители включают, но не ограничиваются, раствор Рингера, изотонический раствор хлорида натрия и нелетучие масла, такие как синтетические моно- или диглицериды. Другие парентерально вводимые композиции, которые являются применимыми, включают таковые, которые содержат активный ингредиент в микрокристаллической форме, в препаратах липосом или в качестве компонента биоразлагаемых полимерных систем. Композиции с длительным высвобождением или импланты могут включать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсия,ионообменная смола, умеренно растворимый полимер или умеренно растворимая соль. Соединение может вводиться пациенту так часто, как несколько раз в сутки, или оно может вводиться менее часто, например один раз в сутки, один раз в неделю, один раз в две недели, один раз в месяц или даже менее часто, например один раз в несколько месяцев или даже один раз в год или меньше. Частота введения будет легко очевидна специалисту в области техники и будет зависеть от любого ряда факторов, таких как, не ограничиваясь, тип и тяжесть заболевания, подвергаемого лечению, тип и возраст пациента и др. Экспериментальные примеры Изобретение далее описано подробно со ссылками на следующие экспериментальные примеры. Такие примеры предназначены только для целей иллюстрации и не предназначены для ограничения, если не указано иначе. Следовательно, изобретение не должно никаким образом быть расценено, как ограниченное следующими примерами, но скорее должно расцениваться как охватывающее любой и все варианты, которые очевидны в свете руководства, представленного в настоящем описании. Материалы и методы, используемые в экспериментах, представленных в настоящем описании, описаны далее. Соединения. Соединение А получали от Glaxo SmithKline Pharmaceuticals (Collegeville, PA). Соединение растворяли в 100% ДМСО для получения 10 мМ исходного раствора и затем разводили в IMDM (Iscoves Modified Dulbecco's Medium, Invitrogen; Carlsbad, CA) для получения 1 мМ рабочего раствора. Полнодлинновой рекомбинантный человеческий тромбопоэтин (rhTPO) получали от RD Systems (Minneapolis, MN) и растворяли в среде IMDM до конечной концентрации 5 нг/мл. Культура клеток. Клетки N2C-TPO получали культивированием мегакариобластной клеточной линии в rhTpo в течение 10 недель и обеспечивали Glaxo SmithKline Pharmaceuticals (Collegeville, PA). Клетки N2C-TPO культивировали в среде RPMI (Invitrogen; Carlsbad, CA), дополненной 10% комплексом животной сыворотки - Fetaplex (Gemini Bio-Products, West Sacramento, CA), 0,5% пенициллином/стрептомицином (Invitrogen; Carlsbad, CA) и 20 нг/мл rhTpo. Клетки Мо 7 е культивировали в DMEM (Dulbecco's Modified Medium, Invitrogen; Carlsbad, CA), дополненной 10% Fetaplex, 0,5% пенициллином/стрептомицином и GM-CSF 10 нг/мл (RD Systems, Minneapolis, MN). Клетки обеих клеточных линий собирали в течение 24 ч до каждого эксперимента. Человеческие первичные лейкозные клетки получали от Stem Cell и Leukemia Core Университета Пенсильвании. Клетки культивировали в EGM-2 (Endothelial Cell Medium-2, Cambrex; East Rutherford,NJ). Все клетки культивировали в увлажненном инкубаторе при 37 С и 5% CO2. Анализ образования колоний мегакариоцитов. Нормальные человеческие клетки-предшественники сеяли в фибриновые сгустки с плотностью 5000 клеток CD34+ на мл. Сгустки фибриногена получали, как указано далее: клетки ресуспендировали в среде IMDM, дополненной бикарбонатом натрия (3 мг/мл); 3-меркапто-1,2-пропандиолом (0,002%); трансферрином (300 мкг/мл); CaCl2 (37 мкг/мл); без жирных кислот; деионизированным BSA (10%); инсулином (20 мкг/мл); холестерином (5,6 мкг/мл); цитокинами: IL-3 (10 нг/мл), SCF (10 нг/мл) и rhTPO(100 нг/мл равные 2,8 мкМ) или соединением А (5 мкМ). Затем свертывающую смесь, содержащую фибриноген (0,2%) и тромбин (0,2 мкг/мл). Клетки сеяли на 35 мм культуральные планшеты и культивировали в увлажненном инкубаторе при 37 С и 5% СО 2. Через 10 дней колонии фиксировали и окрашивали на маркер мегакариоцитов CD41a с помощью флуоресцентно-меченного антитела. Колонии мегакариоцитов подсчитывали с использованием инвертационного флуоресцентного микроскопа.-9 022915 Иммуноблоттинг фосфорилирования киназ. Контроль и клетки, стимулированные rhTPO или соединением А, дважды промывали PBS, затем осаждали. Осадки растворяли в тройном лизирующем буфере, состоящем из 50 мМ TRIS, 150 мМ NaCl,0,02% азида натрия, 0,1% додецилсульфата натрия (SDS) и 1% Igepal (Sigma, St. Louis, МО) и затем инкубировали в течение 30 мин на льду с перемешиванием каждые 10 мин. Затем лизат откручивали при максимальной скорости в микроцентрифуге при 4 С в течение 10 мин. Надосадочную жидкость экстрагированных клеток использовали для иммуноблоттинга. Концентрацию белка определяли анализом связывания Bradferd (Bio-Rad, Hercules, CA). Всего 150 мкг экстракта белка разгоняли на 10% полиакриламидном геле (150 В, 60 мин), затем переносили на поливинилиденфторидную (PVDF) мембрану (25 В, 60 мин). Конденсированное молоко (5%) использовали в качестве блокирующего раствора. Мембрану инкубировали в течение ночи при 4 С с первичным антителом в разведении 1:1000. После инкубации мембрану промывали три раза в буфере TBS-T и метили вторичным HRP-конъюгированным антителом (Amersham Biosciences; Piscataway, HJ) в разведении 1:1000 в течение 2 ч при комнатной температуре. Все антитела были приобретены от Cell Signaling Technology (Danvers, MA). Микрочиповый анализ. Клетки N2C-TPO (1106 клеток на 1 мл среды RPMI, дополненной 10% FBS) стимулировали 2,8 мкМ ТРО или 5 мкМ соединения А в течение 30 мин, 1 и 3 ч. Затем клетки промывали дважды в PBS и использовали для выделения РНК с использованием набора Qiagen's RNaesy (Valencia, CA). Каждый эксперимент проводили в трех экземплярах. РНК вводили в Penn Microarray Facility (University of Pensylvania; Philadelphia, PA). Анализ проводили с использованием Affymetrix GeneChip U133A vs.2. Анализ статистических данных проводили в Репп Bioinformatics Core (University of Pensylvania; Philadelphia, PA) с использованием алгоритма GCRMA и программы Array Assistlite 3.4. Визуализацию профиля генов проводили с использованием программного обеспечения Spotfire. Экспериментальный пример 1. Оценка молекулы соединения А в культуре клеток по сравнению с рекомбинантным человеческим ТРО. С целью определения обладает ли соединение А способностью действовать как агонист рецептора тромбопоэтина (TpoR) и стимулировать пролиферацию и дифференцировку человеческих мегакариоцитов, проводили ряд экспериментов в культурах клеток с использованием Тро-зависимой клеточной линии (N2C-TPO), а также нормальных человеческих клеток CD34+. Способность соединения А стимулировать пролиферацию ТРО зависимой клеточной линии N2C-TPO была обнаружена, как проявление дозозависимого увеличения пролиферации клеток между 1 и 10 мкМ с максимальным эффектом 5-10 мкМ. Впоследствии дозу 5 мкМ использовали в последующих экспериментах, где непосредственно сравнивали свойства rhTPO по сравнению с соединением А. Нормальные человеческие клетки-предшественники (CD34+) использовали для оценки способности соединения А стимулировать пролиферацию и дифференцировку мегакариоцитов. Клетки CD34+ сеяли на фибриновые сгустки и культивировали в течение 10 дней, после этого времени колонии фиксировали и окрашивали с помощью антитела, специфичного к мегакариоцитарному маркеру CD41. Количество колоний мегакариоцитов, полученных из клеток, стимулированных соединением А, было немного ниже по сравнению с количеством колоний мегакариоцитов из клеток, стимулированных rhTPO, однако не было различий в размере или форме колонии (фиг. 1). Такие результаты также были подтверждены в жидкой культуре человеческих клеток-предшественников. Клетки CD34+ инкубировали в цитокинах сrhTPO или соединением А в течение периодов 7-10 дней, после этого времени клетки в культуре оценивали в отношении степени полиплоидизации и экспрессии маркеров мегакариоцитарной линии CD41 иCD61. 14% клеток, выращенных в соединении А, показали большее чем 4 Н содержание ДНК по сравнению с 8% в rhTPO. Те же самые клетки экспрессировали маркеры мегакариоцитов CD41 и CD61 на 35% клеток, сравнимо с результатами с rhTPO. Экспериментальный пример 2. Дифференциальные эффекты соединения А на первичные лейкозные клетки. Образцы получали от 18 пациентов с острым миелогенным лейкозом (AML), 7 пациентов с острым лимфоцитарным лейкозом (ALL) и 3 пациентов с хроническим миелогенным лейкозом (CML). В 17 из 18 исследуемых образцах AML соединение А ингибировало пролиферацию клеток на 70-90% по сравнению с необработанным контролем или клетками, культивируемыми с rhTPO (фиг. 2 А). Не наблюдали существенного эффекта соединения А в первичных клетках из образцов пациентов ALL и CML (фиг. 2 В и С). Дополнительно исследовали эффект различных доз соединения А (1 мкМ, 2,5 мкМ и 5 мкМ) на образцы AML. Этот эксперимент проводили на 6 различных образцах. В 3 образцах дозы 1 и 2,5 мкМ соединения А обладали эффектом на пролиферацию клеток. В образцах 857 и 332 ингибирование клеточной пролиферации посредством доз 1 и 2,5 мкМ соединения А было сходным с ингибированием, достигаемым с дозой 5 мкМ (фиг. 3). В оставшихся 3 образцах дозы соединения А 1 мкМ и 2,5 мкМ не имели эффекта на пролиферацию и выживаемость клеток. В этих случаях только 5 мкМ соединения А ингибировали рост и пролиферацию лейкозных клеток. Не наблюдали существенных эффектов на рост или выживаемость клеток в образцах от пациентов с ALL или CML.- 10022915 Экспериментальный пример 3. Сравнение сигнальных путей, стимулированных rhTPO и соединением А. Для понимания механизма, посредством которого соединение А запускает клеточную смерть клеток AML, сравнивали внутриклеточные пути передачи сигнала, стимулируемые rhTPO и соединением А. Эти исследования проводили на гематопоэтических клетках-предшественниках (CD34+), а также на мегакариобластной клеточной линии N2C-TPO, созданной для экспрессии TpoR, и где пролиферация клеток контролируется стимуляцией Тро. Исследовали эффект соединения А на фосфорилирование киназ, известное, как важное в пути передачи сигнала Тро. Оцениваемые киназы включали STAT5, ERK, p70S6 и рибосомальную киназу S6. Клетки N2C-TPO, стимулированные rhTPO в течение 10-30 мин, показали высокий уровень фосфорилирования всех киназ, перечисленных выше. Однако, когда клетки подвергали воздействию соединения А в течение 10 или 30 мин, ни одна из этих киназ не активировалась (фиг. 4 А). Такой же эксперимент проводили на человеческих клетках-предшественниках CD34+, которые стимулировали соединением А для дифференцировки в мегакариоциты. В противоположность клеткам N2C-TPO клетки CD34+ показали активацию ERK, p70S6 и фосфорилирование рибосомального белка S6 после воздействия или rhTPO (2,8 мкМ) или соединения А (5 мкМ). Однако только клетки, подвергнутые воздействию rhTPO, стимулировали фосфорилирование STAT5, киназы, которая чрезмерно фосфорилирована в клетках AML (фиг. 4 В). Экспериментальный пример 4. Может ли стимуляция rhTPO блокировать эффект соединения А на клетки AML. Анализы пролиферации проводили на клетках, полученных от 6 пациентов с AML. В некоторых экспериментах клетки сначала подвергали воздействию соединения А и затем стимулировали с помощьюrhTPO через 5 мин. Во избежание возможности занятости всех рецепторов соединением А и следовательно предотвращения связывания rhTPO, также проводили другие эксперименты путем первичного стимулирования клеток с помощью rhTPO с последующим воздействием соединения А через 5 мин. В 4 из 6 образцов (857, 774, 759, 342) выживаемость клеток AML не улучшалась после добавления rhTPO после стимуляции соединением А или при первичной стимуляции клеток rhTPO перед воздействием соединения А. Однако, в образцах 794 и 332 добавление rhTPO не ослабляло эффект соединения А (фиг. 5). Такие результаты предполагают ряд возможностей: во-первых, соединение А может иметь существенно большее сродство к TpoR, чем rhTPO; во-вторых, что KD rhTPO существенно ниже и следовательно соединение А может смещать rhTPO с рецептора; или, в-третьих, соединение А стимулирует другие пути,чем запускающие клеточную смерть клеток AML. В попытке изучения таких возможностей, подобные восстановительные эксперименты были проведены на клетках N2C-ТРО, с оценкой фосфорилирования киназ, вовлеченных в путь ТРО. В обеих группах экспериментов (или добавление сначала rhTPO и затем соединения А, или добавление сначала соединения А, потом rhTPO), наблюдали восстановление фосфорилирования киназ STAT5, ERK, p70S6 и рибосомального белка S6, которые не фосфорилировались после стимуляции соединением А отдельно(фиг. 6). Полученные данные предполагают, что соединение А активирует иные пути, которые ведут к смерти клеток AML. Экспериментальный пример 5. Микрочиповый анализ различий в экспрессии генов в клетках,стимулированных ТРО, по сравнению с соединением А. Для дальнейшего понимания механизма, вовлеченного в передачу сигнала соединения А на клетках, стимулированных Тро или соединением А, проводили микрочиповый анализ с использованием Affimetrix GeneChips. В первой группе экспериментов клеточную линию N2C-TPO метили для установления оптимальной временной точки для дальнейшего анализа с использованием первичных клеток AML. Клетки стимулировали или ТРО (2,8 мкМ) или соединением А (5 мкМ) в течение 30 мин, 1 или 3 ч. Затем РНК выделяли из клеток и использовали для чиповых анализов. Были обнаружены существенные различия в экспрессии генов после стимуляции Тро по сравнению с соединением А. После 30 мин стимуляции дифференциально экспрессировались 200 генов, после 1 ч стимуляции дифференциально экспрессировались 400 генов и после 3 ч более 20 00 генов или стимулировались или подавлялись в образце с соединением А по сравнению с образцом, стимулированным ТРО (фиг. 7). Среди этих генов наблюдали различия в экспрессии количества генов, вовлеченных в путь апоптоза(фиг. 8), а также факторов транскрипции (фиг. 9). Наиболее подавляемые гены (изменения в 50-200 раз) включали семейство генов раннего ответа факторов роста 1-4 (каждый кодирует белки, которые действуют как ядерные эффекторы внеклеточных сигналов), супрессоров сигнала цитокинов 3 и цитокининдуцированных SH2-содержащих белков, вовлеченных в большинство путей передачи сигнала в клетках. Экспериментальный пример 6. Анализ апоптоза выделенных первичных клеток от людей с раком. Аннексин-V представляет собой фосфолипид-связанный белок с высоким сродством к фосфатидилсерину (PS). Аннексии V не будет связываться с нормальными, интактными клетками, но некротические клетки достаточно проницаемы для возможности доступа аннексина V к PS внутренней мембраны. Йодид пропидия окрашивает ДНК. Следовательно, анализ определяет клетки, подвергшиеся апоптозу.- 11022915 Первичные клетки выделяли от пациентов с AML (пациент 774; верхний ряд) или ALL (пациент 710; нижний ряд). Затем клетки подвергали воздействию или контрольного раствора (левая пара панелей), rhTpo +ДМСО (средняя пара панелей) или SB559457 (правая пара панелей) в течение 72 ч. На фиг. 10 изображено увеличение аннексин-V и PI-положительных клеток в образце AML, подвергнутом воздействию SB559457 в течение 72 ч (верх, правая панель) по сравнению с контрольными клетками. Не было отмечено существенного увеличения клеточного апоптоза в первичных клетках, выделенных от пациента с ALL. Это предполагает, что SB559457 вызывает апоптоз в клетках AML. Экспериментальный пример 7. Молекулярные последствия дифференциальной передачи сигнала в клетках AML. Анализ генетических чипов Affymetrix проводили на 5 различных образцах клеток AML (пациент сAML 332, 342, 774 и 794). Первичные клетки стимулировали в течение 6 ч или Тро или SB559457. Статистически значимые различия в экспрессии были обнаружены только в 2 из 22000 генов, представленных на чипах (показатель частоты ложного обнаружения менее чем 36%): глицеральдегид-3-фосфат дегидрогеназа (GAPDH) или транскрипт 4, индуцированные повреждением ДНК (также известный как Redd1). Такие результаты были подтверждены с использованием количественной ПЦР в реальном времени(QRT-PCR). В первичных образцах AML экспрессия GAPDH в клетках, обработанных SB559457, была по меньшей мере в два раза выше, чем в клетках, обработанных rhTpo в течение того же времени (6 ч). Сходным образом экспрессия гена Redd1 была в 3-4 раза выше в клетках, инкубируемых с SB559457,чем в контрольных клетках, инкубируемых с rhTpo (фиг. 11). В попытке установить корреляцию между передачей сигнала в клетке и данными распределения,исследовали фосфорилирование киназ, вовлеченных в путь передачи сигнала Тро в первичных лейкозных клетках. Фосфорилирование рибосомальной S6 и p70S6 киназ сравнивали в клетках, стимулированных SB559457 (5 мкМ) и Тро (2,86 мкМ) в течение 1, 3 и 5 ч в 3 образцах первичного AML. В обоих образцах AML клетки, стимулированные SB559457 в течение 3 ч, показали выраженное фосфорилированиеp70S6 киназы в Thr421/Ser424 и рибосомальной киназы S6, тогда как в нестимулированных контрольных клетках и клетках, стимулированных с помощью Тро, не определяли совсем или определяли очень небольшое фосфорилирование этих киназ (фиг. 12). Описание всех и каждого патента, патентной заявки и публикации, указанных в настоящем описании, таким образом, включено в настоящее описание в виде ссылки полностью. Тогда как настоящее изобретение было описано со ссылками на специфические варианты осуществления изобретения, очевидно, что другие варианты осуществления изобретения и вариации настоящего изобретения могут быть разработаны специалистом в области техники без отклонения от истинной сущности и рамок изобретения. Приложенная формула изобретения должна расцениваться, как включающая все такие варианты осуществления изобретения и эквивалентные варианты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения пациента с диагнозом острого миелоидного лейкоза, включающий введение фармацевтической композиции,содержащей 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5 дигидропиразол-4-илиден]гидразин-5'-фтор-2'-гидроксибифенил-3-карбоновую кислоту (соединение А) или ее производное и фармацевтический носитель, указанному человеку, где указанная фармацевтическая композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у указанного человека. 2. Способ по п.1, где указанную фармацевтическую композицию вводят указанному человеку до, во время или после введения химиотерапевтического средства. 3. Способ по п.2, где указанную фармацевтическую композицию вводят указанному человеку парентерально. 4. Способ лечения человека с диагнозом миелодиспластического синдрома, включающий введение фармацевтической композиции, содержащей соединение А или его производное и фармацевтический носитель, указанному человеку, где указанная фармацевтическая композиция дополнительно ингибирует рост и пролиферацию лейкозных клеток у указанного человека. 5. Способ по п.4, где указанную фармацевтическую композицию вводят указанному человеку до, во время или после введения химиотерапевтического средства. 6. Способ по п.5, где указанную фармацевтическую композицию вводят указанному человеку парентерально.
МПК / Метки
МПК: A61K 31/426, A61K 31/427, C07D 209/40, A61K 31/404
Метки: лечения, синдрома, острого, способы, лейкоза, миелоидного, миелодиспластического
Код ссылки
<a href="https://eas.patents.su/29-22915-sposoby-lecheniya-ostrogo-mieloidnogo-lejjkoza-i-mielodisplasticheskogo-sindroma.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения острого миелоидного лейкоза и миелодиспластического синдрома</a>
Предыдущий патент: Хелатообразователь и способ его применения
Следующий патент: Бритвенный узел (варианты)
Случайный патент: Каландр