Способ получения 2-[4-(3- и 2-фторбензилокси)бензиламино]пропанамидов
Номер патента: 17123
Опубликовано: 30.10.2012
Авторы: Барбанти Елена, Руффилли Тициано, Веларди Франческо, Каччья Карла, Сальвати Патричия, Богонья Луиджи
Формула / Реферат
1. Способ получения (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид) и (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (ралфинамид) высокой степени чистоты формулы (Ia) и (Ib)
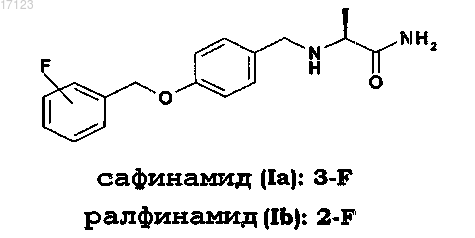
и их солей фармацевтически приемлемой кислоты, отличающийся тем, что промежуточное соединение основания Шиффа, соответственно формулы (VIa) или (VIb)
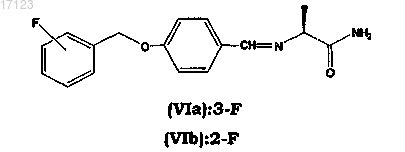
подвергают каталитической гидрогенизации газообразным водородом в присутствии гетерогенного катализатора в протонном органическом растворителе, и когда сафинамид или ралфинамид получают в форме свободного основания, необязательно преобразовывают указанную выше форму свободного основания в его соль фармацевтически приемлемой кислоты.
2. Способ по п.1, где каталитическую гидрогенизацию осуществляют, используя гетерогенный катализатор, выбранный из никелевого, родиевого, платинового и палладиевого катализаторов, на инертной подложке в присутствии растворителя, выбранного из алифатических (C1-C5)алканолов.
3. Способ по п.2, где растворитель выбран из метанола, этанола и изопропанола.
4. Способ по п.1, где катализатор является палладиевым или платиновым катализатором.
5. Способ по п.4, где катализатор является платиновым катализатором.
6. Способ по любому из пп.1-4, где катализатор представляет собой влажный 5% Pt/C (50% H2O) или влажный 10% Pd/C (50% H2O).
7. Способ по любому из пп.1-6, где фармацевтически приемлемой кислотой является метансульфоновая кислота.
8. Способ по любому из пп.1-7, где давление водорода находится в диапазоне от 1 до 10 бар и температура реакции находится в диапазоне от 10 до 70°C.
9. Способ по п.8, где давление водорода находится в диапазоне от 3 до 6 бар и температура реакции находится в диапазоне от 25 до 40°C.
10. Способ по любому из пп.1-9, где каталитическую гидрогенизацию осуществляют на промежуточном соединении основания Шиффа (VIa) или (VIb), полученном путем иминоалкилирования 4-(3-фторбензилокси)бензальдегида (IVa) или 4-(2-фторбензилокси)бензальдегида (XVb)
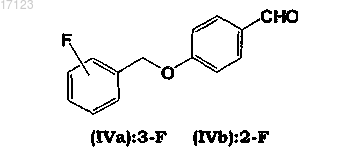
L-аланинамидом в присутствии протонного органического растворителя.
11. Способ по п.10, где L-аланинамид применяют в виде его кислотно-аддитивной соли в присутствии основания в количестве, достаточном для высвобождения L-аланинамида из его соли.
12. Способ по п.10, где каталитическую гидрогенизацию промежуточного соединения основания Шиффа осуществляют в той же реакционной смеси, полученной в результате завершения реакции иминоалкилирования в условиях, которые вызывают осаждение указанного выше промежуточного соединения основания Шиффа, с получением суспензии указанного выше промежуточного соединения в том же реакционном растворителе.
13. Способ по п.10, где промежуточное соединение основания Шиффа, полученное в результате завершения реакции иминоалкилирования, выделяют перед проведением стадии каталитической гидрогенизации.
14. Способ по любому из пп.1-13, где 4-(3-фторбензилокси)бензальдегид или 4-(2-фторбензилокси)бензальдегид формулы (IVa) или (IVb), используемые в качестве исходного вещества для получения промежуточного соединения основания Шиффа формулы (VIa) или (VIb), содержат менее 0,03 мас.% соответствующих примесей 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида (Va) и 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида (Vb)
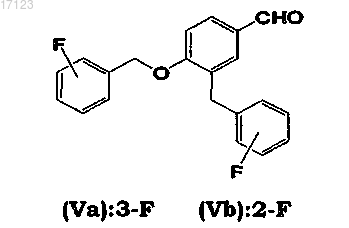
15. Способ по п.14, где 4-(3-фторбензилокси)бензальдегид или 4-(2-фторбензилокси)бензальдегид формулы (IVa) или (IVb) содержат 0,01 мас.% или меньше соответствующих примесей (Va) и (Vb).
16. Способ по любому из пп.14 и 15, где 4-(3-фторбензилокси)бензальдегид (IVa) или 4-(2-фторбензилокси)бензальдегид (IVb) получают путем алкилирования 4-гидроксибензальдегида соответственно 3-фторбензильным или 2-фторбензильным производным (IIIa) или (IIIb)

где Y является уходящей группой, включающей Cl, Br, I, OSO2CH3 и OSO2-C6H4-пСН3, в присутствии основания и подвергают кристаллизации перед использованием на следующей стадии реакции.
17. Способ по п.16, где Y представляет собой Cl.
18. Способ по любому из пп.16 и 17, где кристаллизацию осуществляют путем добавления инертного органического осадителя к раствору 4-(3-фторбензилокси)бензальдегида (IVa) или 4-(2-фторбензилокси)бензальдегида (IVb) в инертном органическом растворителе.
19. Способ по п.18, где инертный органический осадитель представляет собой н-гексан и инертный органический растворитель представляет собой толуол.
20. Способ по любому из пп.16 и 17, где кристаллизацию осуществляют путем растворения 4-(3-фторбензилокси)бензальдегида (IVa) или 4-(2-фторбензилокси)бензальдегида (IVb) в горячем растворителе, который представляет собой циклогексан или простой ди(C3-С4)алкиловый эфир, и затем охлаждают раствор при температуре 10-15°C.
21. Способ по п.20, где кристаллизацию осуществляют путем растворения в горячем ди(С3-С4)алкиловом эфире при кипячении с обратным холодильником и затем охлаждают раствор при 10-15°C.
22. Способ по любому из пп.16-21, где реакцию алкилирования осуществляют в условиях межфазового переноса.
23. Способ по п.22, где алкилирование в условиях межфазового переноса осуществляют в системе твердое вещество/жидкость, где реагенты и катализатор фазового переноса растворяют в жидкой органической фазе и фаза твердого вещества представляет собой неорганическое основание или соль 4-гидроксибензальдегида указанного выше неорганического основания.
24. Способ по п.22, где алкилирование в условиях межфазового переноса осуществляют в системе жидкость/жидкость, где алкилирующий реагент 3-фторбензильное или 2-фторбензильное производное формулы (IIIa) или (IIIb) растворяют в жидкой органической фазе и 4-гидроксибензальдегид растворяют в водной фазе в виде соли неорганического основания.
25. Способ по любому из пп.22-24, где катализатор фазового переноса выбирают из четвертичной аммониевой или фосфониевой солей или полиэтиленгликолей с низкой молекулярной массой.
26. Способ по п.25, где количество используемого катализатора фазового переноса находится в диапазоне от 0,02 до 1 моль на моль 4-гидроксибензальдегида.
27. Способ по п.26, где количество катализатора фазового переноса находится в диапазоне от 0,1 до 1 моль на моль 4-гидроксибензальдегида.
28. Способ по любому из пп.23-27, где органический растворитель жидкой органической фазы выбирают из простых диалкиловых эфиров и ароматических углеводородов.
29. Способ по любому из пп.23-28, где молярное соотношение между алкилирующим реагентом формулы (IIIa) или (IIIb) и 4-гидроксибензальдегидом находится в диапазоне от 0,6 до 1,5.
30. Способ по любому из пп.23-29, где температура реакции находится в диапазоне от 60 до 160°C.
31. Способ по любому из пп.23-30, где неорганическое основание выбирают из Na2CO3, K2CO3, NaOH и KOH, температура находится в диапазоне от 80 до 120°C и молярное соотношение между алкилирующим реагентом формулы (IIIa) или (IIIb) и 4-гидроксибензальдегидом находится в диапазоне от 0,9 до 1,1.
32. Способ по любому из пп.1-31, где сафинамид или ралфинамид или их соли фармацевтически приемлемой кислоты имеют содержание соответствующей примеси (S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIa) и (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (IIb)
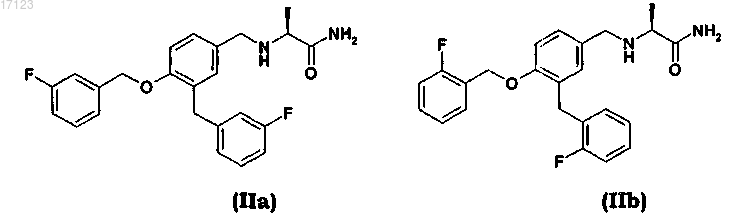
или их солей фармацевтически приемлемой кислоты ниже 0,03 мас.%.
33. Способ по п.32, где содержание соответствующей примеси формулы (IIa) и (IIb) в виде фармацевтически приемлемой соли ниже 0,01 мас.%.
34. Способ по любому одному из пп.32 и 33, где фармацевтически приемлемой кислотой является метансульфоновая кислота и содержание соответствующей примеси формулы (IIa) и (IIb) в виде соли метансульфоновой кислоты ниже 0,01 мас.%.
35. Основание Шиффа формулы (VIa) или (Vlb)

Текст
Способ получения терапевтически активных 2-[4-(3- и 2-фторбензилокси)бензиламино]пропанамидов и их солей фармацевтически приемлемых кислот высокой степени чистоты, в частности,с содержанием примесей дибензильных производных ниже 0,03%, предпочтительно ниже 0,01 мас.%. Способ осуществляют путем подвергания промежуточных соединений оснований Шиффа 2-[4-(3- и 2-фторбензилокси)бензиламино]пропанамидов каталитической гидрогенизации в присутствии гетерогенного катализатора в протонном органическом растворителе. 017123 Уровень техники, к которому относится изобретение Настоящее изобретение относится к новому способу получения(S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида, т.е. ралфинамида (Ib) и их солей с высокими выходами и очень высокой энантиомерной и химической чистотой. Данный способ также особенно полезен для их получения в больших количествах. Сафинамид (NW-1015, FCE-26743A, PNU-151774E) представляет собой блокатор натриевых каналов, модулятор кальциевых каналов, ингибитор моноаминоксидазы В (МАО-В), ингибитор высвобождения глутамата и модулятор метаболизма дофамина. Сафинамид применяется при лечении нарушений ЦНС, в частности эпилепсии, болезни Паркинсона, болезни Альцгеймера, депрессии, синдрома усталых ног и мигрени (WO 90/14334, WO 04/089353,WO 05/102300, WO 04/062655). Ралфинамид (NW-1029, FCE-26742A, PNU-0154339E) представляет собой блокатор натриевых каналов, применяемый при лечении болезненных состояний, включающих хроническую боль и нейропатическую боль, мигрень, биполярные расстройства, депрессии, сердечно-сосудистые, воспалительные, мочеполовые, метаболические и желудочно-кишечные нарушения (WO 99/35125, WO 03/020273, WO 04/062655, WO 05/018627, WO 05/070405, WO 05/102300, WO 06/02705). В настоящее время было обнаружено, что широко распространенные препараты сафинамида и ралфинамида в соответствии со способами, описанными на предыдущем уровне техники, содержат две нежелательные примеси,т.е.,соответственно,(S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамид Данный факт особенно важен из-за очень высокой токсичности двух приведенных выше примесей. Многие потенциальные лекарственные средства не проходят клинические испытания из-за непредвиденного действия на метаболизм человека или токсичности, обусловленной нежелательными примесями, и, следовательно, удаление подобных примесей на ранней доклинической стадии является важным и чрезвычайно необходимым. На доклинической стадии "лекарственное действие" новых соединений можно определить, пользуясь общепринятой совокупностью анализов in vitro, таких как, например, анализ на взаимодействие с ферментами, метаболизирующими лекарственные средства, цитотоксичность, метаболическую стабильность и профилирование, проницаемость мембраны, собственный клиренс и блокаду каналов гена специфических калиевых каналов сердца человека (HERG) и т.д. Система цитохрома Р 450 (CYP 450) является принципиальной ферментативной системой для метаболизма липофильных ксенобиотиков, включая лекарственные средства, канцерогены и загрязнители окружающей среды. CYP 450 представляет собой гемсодержащую, мембраносвязанную полиферментативную систему, которая присутствует во многих тканях, но в самой высокой концентрации присутствует в печени. Приблизительно оценивают, что в человеческой печени существуют от 15 до 20 различных форм CYP 450, метаболизирующих ксенобиотики. На данный момент у млекопитающих обнаружено более четырнадцати семейств генов CYP. Несмотря на существование высокой гомологии, обширные исследования раскрыли, что каждое CYP семейство и подсемейство играет различные роли в ксенобиотическом метаболизме. Три CYP семейства CYP1, CYP2 и CYP3 составляют около 70% человеческих печеночных микросом CYP, причем CYP3 составляет приблизительно 30%. Данные CYP главным образом ответственны за метаболизм большинства торговых лекарственных средств. Семейство CYP1 содержит несколько составляющих, которые включают CYP1A1, CYP1A2 иCYP1B1, и они участвуют в метаболизме ацетаминофена, кломипрамина и имипрамина. Семейство CYP2 содержит несколько подсемейств, включающих CYP2A, CYP2B, CYP2C, CYP2D и CYP2E. Подсемейство CYP2C содержит по меньшей мере семь составляющих. CYP2C9 отвечает за метаболизм ибупрофена, диклофенака, толбутамида и торсемида. CYP2C19 представляет собой основ-1 017123 ной изофермент, метаболизирующий диазепам и омепразол. Было показано, что CYP2D6 отвечает за метаболизирование свыше 30% лекарственных средств на рынке, включающих антидепрессанты и сердечно-сосудистые и антипсихотические лекарственные средства. Три изоформы семейства CYP3 были обнаружены в человеческой печени. Было установлено, что CYP3A4 человека является самой важной изоформой в метаболизме лекарственного средства. На сегодняшний день метаболизм, катализируемыйCYP3A4, является основным способом выведения практически для 50% торговых лекарственных средств. В силу своей важности для метаболизма лекарственных средств как CYP3A4, так и CYP2D6 часто вовлечены в лекарственные взаимодействия, и некоторые клинически применяемые соединения были идентифицированы в качестве мощного ингибитора данных CYP 450 изоформ, такие как кетоконазол,терфенадин, эритромицин, миконазол, пропанолол и хинидин, соответственно. Этот факт налагает очевидное ограничение на применение таких лекарственных средств. Дополнительная проблема, заключающаяся в скоропостижной смерти как побочном эффекте действия неантиаритмических средств, является основным фармацевтическим фактором опасности, с которым сталкивается фармацевтическая промышленность и органы здравоохранения. За последние годы по меньшей мере пять лекарственных средств, лидирующих на рынке продаж (астемизол, сертиндол, терфенадин, цисаприда моногидрат, грепафлоксацин), были изъяты с рынка из-за сообщений о скоропостижной смерти. Во всех случаях синдром удлинения интервала QT (LQTS), патология реполяризации сердечной мышцы, которая характеризуется удлинением интервала QT в электрокардиограмме, подразумевался в качестве предрасполагающего фактора "трепетание-мерцание", полиморфной желудочковой пароксизмальной тахикардии, которая может спонтанно обращаться в фибрилляцию желудочков и приводить к скоропостижной смерти. Можно проследить связь врожденного LQTS с некоторыми возможными мутациями, приводящими к повреждениям натриевых каналов и двух калиевых каналов: быстро активирующийся калиевый ток задержанного выпрямления (Ikr) и медленно активирующийся калиевый ток задержанного выпрямления (Iks). Важно отметить, что фактически в каждом случае увеличенной продолжительности стимулирующего сердечную деятельность эффекта, потенциально связанного с воздействием лекарственного средства (приобретенный LQTS), можно проследить связь с одним специфическим механизмом: блокировкой Ikr тока в сердце. Этот ток, основной фактор 3 фазы реполяризации в конце интервала QT, проводится тетрамерными порами, причем отдельные субъединицы кодируютсяHERG. В связи с блокировкой HERG K+ каналов, которую считают доминирующей причиной удлиненияQT, обусловленного действием лекарственного средства, важным объектом в фармацевтической промышленности стало раннее обнаружение соединений с подобным побочным эффектом. Соединения с усиленным ингибированием ферментов, метаболизирующих лекарственные средства,в частности CYP 450 ферментов, и блокирующими изоформами HERG канала имеют высокую вероятность токсичности, и разработка таких соединений должна быть прекращена на ранней стадии. Как показано в табл. 1, примеси (IIa и IIb), в виде метансульфонатной соли (IIc и IId), сильно ингибируют в микро- и субмикромолярном диапазоне CYP3A4, CYP2D6, CYP2C19, CYP2C9 и HERG токи и являются высоко цитотоксичными по сравнению с метансульфонатом сафинамида (Ic) и метансульфонатом ралфинамида (Id) высокой степени чистоты, синтезированных с применением способа данного изобретения. Таблица 1 В табл. 2 показаны сравнительные результаты (IC50) по ингибированию цитохрома CYP3A4 с использованием метансульфонатов сафинамида и ралфинамида высокой чистоты, синтезированных при помощи нового способа данного изобретения, с сафинамидом и ралфинамидом, полученными при помощи того же способа, в присутствии 0,3% примеси IIc и IId, соответственно. При добавлении 0,3% примеси IIc и IId к метансульфонатам сафинамида и ралфинамида высокой чистоты в обоих случаях наблюдается значительное уменьшение IC50 на CYP3A4, которое означает, что примеси способствуют усиленному ингибированию ферментативной активности. Как показано в табл. 3, примесь (IIc) повышает, начиная с 3 мг/кг в/б, смертность у мышей по тесту максимального электрошока (MES) без какой-либо фармакологической активности, т.е. защиты от конвульсий. Таблица 3 В табл. 4 показано, что примесь IId, при пероральном введении в концентрациях 10 и 20 мг/мг, по тесту максимального электрошока (MES) не защищает мышей от конвульсий в сравнении с такими же дозами метансульфоната ралфинамида. Таблица 4 На основании приведенных данных примеси IIc и IId, присутствующие в сафинамиде и ралфинамиде, соответственно, синтезированных при помощи способа, описанного в WO 90/14334 и Pevarello et al. вJ. Med. Chem, 1998, 41, 579-590, показывают in vitro некоторые нежелательные свойства, такие как клеточная токсичность, усиленное ингибирование какой-либо изоформы CYP 450, блокировка каналовHERG и отсутствие защитной активности на "in vivo" модели эпилепсии. Одним из важных аспектов CYP является изменение среди разных групп населения. Изменения в метаболизме лекарственных средств имеют большое значение в клинических исследованиях. Значительное изменение ферментативной активности CYP3A4 и CYP2D6 было показано среди различных этнических групп и среди различных индивидов в одной и той же этнической группе. Различие в CYP активности среди индивидов существенно меняется в зависимости от различных изоферментов. Изменения в уровне экспрессии CYP различных индивидов могут вызвать изменения в метаболизме лекарственного средства. Что еще более важно, полиморфизм также может привести к модификациям CYP фермента с пониженной или повышенной ферментативной активностью, которая влечет за собой изменения в метаболизме лекарственного средства. Полиморфизм CYP2D6 является хорошо изученным вопросом в метаболизме лекарственного средства. В клинических испытаниях, ярко выраженные изменения среди индивидов впервые были обнаружены в метаболизме антигипертензивных и противоэпилептических лекарственных средств. Выведение CYP2D6 метаболизированных лекарственных средств медленнее, чем у тех индивидов, которые несут дефектные CYP2D6 аллели. Индивиды с медленным метаболизмом классифицируются как медленные метаболизаторы (PM), тогда как индивидов, обладающих ускоренным метаболизмом, называют экстенсивными метаболизаторами (EM). Распространение PM фенотипа у населения различного расового происхождения меняется: приблизительно от 5 до 10% кавказцев имеют PM фенотип, но только 1% азиатского населения. CYP2C19 представляет собой другую важную полиморфную изоформу, которая имеет клинические проявления. Принимая во внимание данные наблюдения, соединение, которое не препятствует изоформамCYP450 (ни ингибированием, ни индукцией), имеет очень малый риск лекарственных взаимодействий в клинической практике и может просто и безопасно прописываться врачами. В частности, лекарственные средства, которые не препятствуют цитохромам системы CYP450, особенно требуются для терапевтического лечения индивидов, которые классифицируются как медленные метаболизаторы (PM) или для терапевтического лечения пациентов, которые параллельно принимают другие лекарственные средства, о которых известно, что они взаимодействуют с указанными цитохромами, такие как кетоконазол, терфенадин, эритромицин, миконазол, пропанолол и хинидин, и/или известно, что они обладают свойствами блокировки HERG каналов.-3 017123 В соответствии с распространенной клинической практикой, метансульфонаты сафинамида и ралфинамида (Ic и Id) обычно вводят пациенту, нуждающемуся в этом, в течение долгого периода времени,подразделяя на несколько суточных доз. Это, в частности, тот случай терапевтических применений, в котором заболевание, которое необходимо лечить, представляет собой: Болезнь Паркинсона, Болезнь Альцгеймера и синдром усталых ног (для применения сафинамида) или хроническую или нейропатическую боль, сердечно-сосудистые или воспалительные нарушения (для применения ралфинамида). Несмотря на то, что суточная доза может варьироваться в соответствии со специфическими условиями и нуждами пациентов, суточная доза метансульфоната сафинамида обычно может находиться в диапазоне от 10 мг/день до 800 мг/день, тогда как суточная доза метансульфонатов ралфинамида обычно может находиться в диапазоне от 10 мг/день до 1 г/день. При таких условиях и, принимая во внимание данные,о которых сообщалось выше, весьма целесообразно сохранять уровень примесей (IIa) и (IIb) или их солей, в частности, метансульфонатных солей (IIc) и (IId), в фармацевтических дозированных формах сафинамида и ралфинамида или их солей как можно ниже, в любом случае ниже 0,03%, предпочтительно ниже 0,01 мас.% по отношению к количеству, соответственно, сафинамида и ралфинамида или их солей,в частности, метансульфонатных солей. Научные исследования и экспериментальные исследования, проведенные авторами, показали, что сафинамид и ралфинамид и соответствующие соли фармацевтически приемлемых кислот, полученные в соответствии со способами предшествующего уровня техники, содержат количество соответствующих примесей (IIa) и (IIb) или соответствующих солей фармацевтически приемлемых кислот, таких как (IIc) и(IId), которое больше 0,03 мас.%. Следовательно, указанные выше продукты не подходят для безопасных терапевтических применений. В частности, фармацевтические препараты, содержащие сафинамид или ралфинамид или их соли фармацевтически приемлемых кислот, где содержание примесей (IIa), (IIb) и соответствующие солей фармацевтически приемлемых кислот не ниже 0,03%, предпочтительно 0,01 мас.% по отношению к указанным выше активным веществам, непригодны в качестве лекарственных препаратов. В данном описании и формуле изобретения значения определенных выше ограничений, если не оговорено иное, предлагаются в качестве выражения процентного соотношения по массе "активных веществ", т.е. эффективное содержание биологически активной примеси (IIa, IIb) по отношению к эффективному содержанию терапевтически активного вещества (Ia, Ib). Способ, описанный в данном изобретении, посредством значительного уменьшения примесей приводит к продуктам высокой химической чистоты и более безопасному биологическому профилю. Другие примеси, едва детектируемые, возникают из очень небольших количеств 2- и 4-фторбензилхлорида и 3- и 4-фторбензилхлорида, которые содержатся в коммерчески доступных 3-фторбензилхлориде и 2 фторбензилхлориде, соответственно, используемых для синтеза 4-(3-фторбензилокси)бензальдегидного(IVa) и 4-(2-фторбензилокси)бензальдегидного (IVb) промежуточных соединений для получения, соответственно, соединений (Ia) и (Ib). В соответствии со способом, описанным в настоящем изобретении, сафинамид и ралфинамид получают с высокими выходами и высокой чистоты, если содержание (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида(S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (IIb) и их солей, в частности, метансульфоновой кислоты (обычно называемых "дибензильными производными") в сафинамиде и ралфинамиде или их солях, в частности, метансульфоновой кислоты, ниже или равно 0,03%, предпочтительно 0,1% (по массе). Способ, являющийся целью настоящего изобретения, исходит из 4-гидроксибензальдегида и включает три следующие стадии: а) О-бензилирование 4-гидроксибензальдегида производными следующей общей формулы 3- или 2F-C6H4-CH2-Y, где Y представляет собой уходящую группу (Cl, Br, I, OSO2CH3 и т.д.); причем такое Oбензилирование проводят в условиях, которые являются высоко селективными в отношении Oалкилирования и дают 4- (3-фторбензилокси)бензальдегид и 4-(2-фторбензилокси)бензальдегид высокой чистоты;L-аланинамида,основания или соли,4-(3 фторбензилокси)бензальдегидом и 4-(2-фторбензилокси)бензальдегидом, где восстанавливающая система представляет собой газообразный водород и гетерогенный катализатор, с получением после кристаллизации сафинамида и ралфинамида, соответственно, очень высокой энантиомерной и химической чистоты;c) получение сафинамидных и ралфинамидных солей фармацевтически приемлемой кислоты путем солеобразования сафинамида и ралфинамида, соответственно, полученных на предыдущей стадии. Фармацевтически приемлемыми кислотами являются, например, выбранные из азотной, хлористоводородной, бромисто-водородной, серной, перхлорной, фосфорной, метансульфоновой, nтолуолсульфоновой, уксусной, трифторуксусной, пропионовой, гликолевой, молочной, щавелевой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной и салициловой кислоты.-4 017123 Известный уровень техники В WO 90/14334 и в статье Pevarello et al. в J. Med. Chem., 1998, 41, 579-590, описан трехстадийный способ получения бензилоксибензиламиноалканамидов:a) синтез промежуточных 4-бензилоксибензальдегидов путем О-бензилирования соответствующих 4-гидроксибензальдегидов подходящими бензилхлоридами, b) восстановительное алкилирование аминоамидов 4-бензилоксибензальдегидами с использованием цианоборогидрида натрия в качестве восстановителя, как схематически показано нижеR2 представляет собой, среди других заместителей, водород; R3 представляет собой, среди других заместителей, СН 3; как R4, так и R5 представляют собой, среди других заместителей, водород. В частности, поскольку дело касается получения сафинамида и ралфинамида, то восстановительное алкилирование представляет собой восстановительное алкилирование В J. Med. Chem. (Pevarello et al.), 1998, 41, 579-590 сообщаются выходы 45 и 60% при получении метансульфоната сафинамида и ралфинамида, соответственно, исходя из соответствующих (фторбензилокси)бензальдегидов. Способ, описанный в WO 90/14334 и в приведенной выше статье, является аналогичным и обеспечивает однореакторную систему, в которой иминоалкилирование и восстановление осуществляют в одном и том же реакторе. К смеси гидрохлорида L-аланинамида, цианоборогидрида натрия, метанола и измельченных молекулярных сит одновременно добавляют подходящий альдегид. В соответствии с Pevarello et al., в Org. Prep. Proc. Int. 1996, 28, 179-183 (где описан синтез некоторых производных -бензиламиноамида путем восстановительного алкилирования), использование аминоамида в виде гидрохлорида является важным для образования иминиевого иона вместо соответствующего имина, так как иминиевый ион легче реагирует с цианоборогидридом натрия, чем с альдегидной карбонильной группой. В соответствии с указанными выше авторами, оказывается, что однореакторный способ предотвращает проблемы рацемизации основания Шиффа, а молекулярные сита ускоряют эту реакцию (несмотря на то, что выходы плохие). Цианоборогидрид является лишь восстанавливающим агентом, который используется, и, как оказывается, такой выбор обусловлен его низкой реакционной способностью и селективностью (см. обзор "Sodium Cyanoborohydride - A Highly Selective Reducing Agent for Organic FunctionalGroups" - C.F. Lane, Synthesis 1975, 132-146), которая обусловливает его способность проводить различие между протонированным основанием Шиффа и исходным альдегидом. Синтез, описанный в статье Pevarello et al., обеспечивает выделение продуктов колоночной хроматографией с последующим преобразованием в соответствующие соли обработкой кислотами. Какойлибо информации об энантиомерной и/или химической чистоте как сафинамида, так и ралфинамида и/или их солей не обеспечивается. Способ, описанный на предшествующем уровне техники, имеет множество недостатков, которые ограничивают его применение в крупном масштабе; ниже перечислены несколько примеров указанных выше недостатков: образование цианидов; образование производных бора, которые трудно отделять от активных компонентов; использование измельченных молекулярных сит, которые являются физически неустойчивыми и дорогими; низкие выходы; низкая концентрация конечного продукта в реакционной смеси восстановительного алкилирования(около 2-3% мас./об.); выделение продуктов колоночной хроматографией, которая считается ненадежным и дорогим ме-5 017123 тодом очистки при получении активных агентов в промышленном масштабе путем химического синтеза. Кроме того, как показано в примерах, которые сопровождают данное описание, продукты, полученные в соответствии со способами, описанными на предшествующем уровне техники, содержат количество примесей (IIa), (IIb) (IIc) или (IId), которое выше 0,03 мас.% по отношению к соответствующему активному веществу (Ia), (Ib), (Ic) или (Id). Кроме того, было показано, что трудно отделить указанные выше примеси от конечного продукта сафинамида и ралфинамида или их солей, используя общеизвестные методы очистки, такие как кристаллизация из растворителей или хроматография, которые в любом случае влекут за собой уменьшение выходов. Синтез 4-(фторбензилокси)бензальдегидных промежуточных соединений В соответствии с известными способами фторбензилоксибензальдегидные промежуточные соединения для синтеза сафинамида и ралфинамида получают бензилированием 4-гидроксибензальдегида в основной среде, то есть бензилированием фенольных солей, которые, будучи амбидентными нуклеофилами, дают два различных продукта, а именно, желаемые O-алкилированные производные и нежелательные С-алкилированные производные. Фактически было обнаружено, что фторбензилирование 4-гидроксибензальдегида 3 фторбензилхлоридом, осуществляемое в соответствии с предшествующим уровнем техники, дает 4-(3 фторбензилокси)бензальдегид (IVa) в качестве главного продукта вместе с 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегидом (Va), который образуется из-за алкилирования как гидроксильной группы в положении 4, так и атома углерода в положении 3 4-гидроксибензальдегида. То же самое происходит при фторбензилировании 4-гидроксибензальдегида 2-фторбензилхлоридом в соответствии со следующей схемой: Восстановительное алкилирование L-аланинамида альдегидом, который содержит диалкилированную примесь, дает сафинамидный или ралфинамидный конечный продукт, который также загрязнен соответствующим диалкилированным соединением, дибензильным производным, или в виде свободного основания (IIa) или (IIb), или в виде солеобразных соединений, предпочтительно метансульфоновой кислоты (IIc) или (IId), как показано на следующей схеме: Вместо предпочтительной метансульфоновой кислоты можно использовать и другие фармацевтически приемлемые кислоты, например, азотную, хлористо-водородную, бромисто-водородную, серную,перхлорную, фосфорную, метансульфоновую, п-толуолсульфоновую, уксусную, трифторуксусную, пропионовую, гликолевую, молочную, щавелевую, малоновую, яблочную, малеиновую, винную, лимонную,бензойную, коричную, миндальную и салициловую кислоту. Моноалкилированное производное (сафинамид или ралфинамид) и соответствующие диалкилированные примеси обладают похожими химически-физическими свойствами, и это делает трудной очистку сафинамида и ралфинамида традиционными способами. Кроме того, известные способы имеют такие дополнительные недостатки: 1) применение низшего спирта в качестве растворителя; в основных условиях растворитель, например метанол, может сам действовать как нуклеофильный реагент и дает с 3- или 2-фторбензилхлоридом некоторое количество метилфторбензилэфира; 2) экстракция конечного продукта несмешивающимся с водой органическим растворителем возможна только после того, как растворитель спиртовой реакции удален из реакционной смеси. В настоящее время было обнаружено, что при использовании указанных выше способов предшествующего уровня техники для получения конечного продукта формулы (Ia) или (Ib), где содержание соответствующей примеси (IIa) или (IIb) ниже 0,03% (по массе), необходимо существенно очищать промежуточный 4-(3-фторбензилокси)бензальдегид (IVa) или 4-(2-фторбензилокси)бензальдегид (IVb), для того чтобы уменьшить содержание соответствующей примеси формулы (Va) и (Vb). Указанную выше очист-6 017123 ку предпочтительно осуществляют путем кристаллизации реакционных продуктов, более предпочтительно путем добавления к раствору неочищенного соединения (IVa) или (IVb) в инертном органическом растворителе смешивающегося инертного органического не-растворителя (осадителя). Органический инертный растворитель предпочтительно выбирают из ароматических углеводородов, и более предпочтительно представляет собой толуол. Смешивающийся инертный органический осадитель предпочтительно выбирают из низших алифатических углеводородов, и более предпочтительно представляет собой н-гексан. Дополнительный процесс кристаллизации может заключаться в растворении указанных выше соединений (IVa) или (IVb) в горячем растворителе, например циклогексане или простом ди(C3-C4)алкиловом эфире, таком как диизопропиловый эфир, при кипячении с обратным холодильником и затем охлаждении раствора до комнатной температуры, предпочтительно до 10-15C, наиболее предпочтительно индуцируя кристаллизацию добавлением чистых кристаллов чистого соединения(IVa) или (IVb). В соответствии с одним аспектом данного изобретения в настоящее время, неожиданно было обнаружено, что когда реакцию между алкилирующим агентом формулы (IIIa) или (IIIb) (см. схему ниже, где атом F присутствует в положении 2 или 3, и Y представляет собой уходящую группу, такую как, например, Cl, Br, I, OSO2CH3, OSO2C6H4-pCH3 и т.д.) и 4-гидроксибензальдегидом, проводят в условиях межфазового переноса, то соответствующие 4-(фторбензилокси)бензальдегиды получают с высокими выходами и с очень низким содержанием С,O-бисалкилированных примесей. Такое новое фторбензилирование 4-гидроксибензальдегида в условиях межфазового переноса можно проводить как в системе твердое вещество/жидкость, причем в жидкой органической фазе реагенты и катализатор фазового переноса растворяют, и твердая фаза представляет собой неорганическое основание или 4-гидроксибензальдегидную соль (по возможности полученную in situ из 4 гидроксибензальдегида и самого неорганического основания), так и в системе жидкость/жидкость органическая/водная, причем неорганическое основание растворено в водной фазе. Предпочтительной системой является система твердое вещество/жидкость, в которой неорганическое основание предпочтительно выбирают из Na2CO3, K2CO3, KOH, NaOH. Органические растворители, используемые в реакции, как в случае системы жидкость/жидкость,так и системы твердое вещество/жидкость, могут быть простыми диалкиловыми эфирами, такими как,например, ди-трет-бутиловый, этил-трет-бутиловый эфир, или ароматическими углеводородами, такими как, например, толуол, этилбензол, изопропилбензол и ксилолы. Все данные растворители можно легко регенерировать перегонкой. Используемые катализаторы фазового переноса могут быть четвертичными солями аммония или фосфония, такими как, например, тетрабутиламмонийбромид, тетрадецилтриметиламмонийбромид, гексадецилтрибутилфосфонийбромид, трикаприлилметиламмонийхлорид (Aliquat), метилтриалкил(С 8 С 10)аммонийхлорлд (Adogen), причем предпочтительным является тетрадецилтриметиламмонийбромид. Также в качестве катализаторов фазового переноса можно использовать полиэтиленгликоли с низкой молекулярной массой, такие как, например, PEG-200 (CAS 25322-68-3) или PEG-400 (CAS 25322-68-3). Количество используемого катализатора фазового переноса находится в диапазоне от 0,02 до 1 моль на моль 4-гидроксибензальдегида, предпочтительно от 0,1 до 1 моль на моль 4 гидроксибензальдегида, так как в данных условиях количество С,О-бис-фторбензилированных примесей может в результате составлять менее 0,03%, предпочтительно равно 0,01% или менее по массе. Соотношение между алкилирующими агентами формулы (IIIa) или (IIIb) и 4 гидроксибензальдегидом находится в диапазоне от 0,6 до 1,5, причем предпочтительно оно находится в диапазоне от 0,9 до 1,1. Температура реакции находится в дигшазоне от 60 до 160C, причем предпочтительный интервал составляет от 80 до 120C. Время реакции обычно составляет диапазон от 4 до 8 ч. Реакционные выходы очень высокие, как правило, более 90%. Эффективность реакции, т.е. концентрация реакционных продуктов в реакционной смеси очень высокая в описанных реакционных условиях, обычно больше или равна 25% (мас./об.). Синтез сафинамида и ралфинамида путем восстановительного алкилирования -аминоамидов Современное состояние привело специалистов в данной области к мнению, что восстановительное алкилирование -аминоамидов 4-(3- или 2-фторбензилокси)бензальдегидами с использованием водорода и гетерогенного катализатора в качестве восстанавливающего агента непригодно для получения сафинамида и ралфинамида из-за несовместимости между реагентами и конечными продуктами и восстанови-7 017123 тельными условиями. Фактически, хорошо известно, как легко бензальдегиды восстанавливаются до бензиловых спиртов или даже до соответствующих углеводородов, а также известно, что условия, которые следует применять для осуществления восстановительного алкилирования при помощи водорода и гетерогенного катализатора, аналогичны условиям, применяемым для разрушения связей между бензильным атомом углерода и гетероатомами, такими как азот или кислород, тип связей, который присутствует как в сафинамиде, так и в ралфинамиде и в их предшественниках. Фактически, бензильную группу обычно используют в качестве защитной группы фенолов или аминов (см. "Protective Groups in Organic Synthesis", T.W. Greene and P.G.M. Wuts, 3rd Edition, 1999, JohnWileySons, Inc.) из-за легкости ее введения и последующего удаления каталитическим восстановлением. При восстановительном алкилировании для получения сафинамида и ралфинамида можно было ожидать образования множества побочных продуктов, некоторые из которых представлены ниже Тот факт, что сафинамид и ралфинамид были получены с высокими выходами и чистотой путем восстановительного алкилирования L-аланинамида 4-(3- или 2-фторбензилокси)бензальдегидом с использованием водорода и гетерогенного катализатора в качестве восстанавливающей системы, является удивительным и прогрессивным аспектом данного синтетического способа. Кроме того, условия реакции, которые используются в соответствии с данным способом, легко применимы и в крупномасштабном производстве. Восстановительное алкилирование, что является целью настоящего изобретения, осуществляют в две стадии:a) образование основания Шиффа,b) каталитическое восстановление основания Шиффа. Две стадии можно осуществлять последовательно в одном и том же реакторе (однореакторная реакция) либо с, либо без выделения основания Шиффа, в обоих случаях с высокими выходами. В случае выделения основания Шиффа экспериментальные условия, применяемые для его образования, дают возможность получить выделенное основание Шиффа в виде осадка с высокими выходами и в очень чистом виде. Получение основания Шиффа осуществляют надлежащим образом в органическом протонном растворителе, который должен быть инертным к реагентам и продуктам, а также инертным к восстановительным условиям иминной двойной связи, таком как, например, низший (C1-C5)алканол, предпочтительно метанол, этанол и изопропанол. Образование основания Шиффа должно быть полным и это является важным фактором для получения высоких выходов на последующей стадии каталитического восстановления. Следовательно, предпочтительным является выделение оснований Шиффа (VIa) и (VIb) перед осуществлением восстановления иминной двойной связи. Выделенные иминосоединения (VIa) и (VIb) являются полезными промежуточными соединениями для получения сафинамида и ралфинамида, соответственно, согласно данному изобретению. Альтернативно, способствовать завершению реакции иминоалкилирования можно путем ее проведения в таких условиях, чтобы вызвать осаждение иминосоединений (VIa) и (VIb) и подвергнуть каталитическому восстановлению суспензию, содержащую промежуточное иминопроизводное. или 2 Соотношение между(основание или соль) и 4-(3 фторбензилокси)бензальдегидом может составлять 1:1, но также преимущественно можно использовать 10% избыток L-аланинамида.L-аланинамид можно вводить или в качестве свободного основания или в качестве его кислотноаддитивной соли. Предпочтительно его вводят в реакционную смесь в виде соли, наиболее предпочтительно в виде гидрохлоридной соли, вместе со стехиометрическим количеством основания, предпочтительно третичным амином, таким как, например, триэтиламин или диизопропилэтиламин. Температура реакции при получение основания Шиффа находится в диапазоне от 0 до 60C, предпочтительно от 20 до 30C.-8 017123 Время реакции находится в диапазоне от 1 до 15 ч, предпочтительно от 4 до 6 ч. Восстановление основания Шиффа при помощи водорода и гетерогенного катализатора начинают только после того, как образование основания Шиффа завершено: если его начинают до этого, то побочные реакции становятся существенными, иногда преобладающими, с потерей в выходах и чистоте. Одна из данных побочных реакций, более существенная, вызывает образование бензиловых спиртов восстановлением карбонильной группы выбранного (фторбензилокси)бензальдегида. Предпочтительными гетерогенными катализаторами являются никелевый, родиевый, палладиевый или платиновый катализаторы на инертной подложке, такой как, например, углеродная, алюмооксидная и кремниевая, предпочтительно углеродная и алюмооксидная, и его используют в количестве, составляющем диапазон от 2 до 20% 4-(3- или 2-фторбензилокси)бензальдегида, предпочтительно от 5 до 10%. Платиновый и палладиевый катализаторы являются наиболее предпочтительными. Платина на активированном угле, в частности, дает отличные результаты как по показателю выходов, которые почти количественные, так и по показателю селективности, так как восстанавливается только иминная двойная связь, тогда как двойная связь между бензильным атомом углерода и гетероатомами остается неизменной. Было обнаружено, что сафинамид и ралфинамид являются неожиданно устойчивыми к условиям реакции восстановления, что является существенным фактором в промышленном получении больших количеств сафинамида или ралфинамида, так как случайное увеличение времени реакции не повредило бы конечным продуктам. Наилучшие результаты были получены с влажным 5% Pt/C (50% Н 2 О) и, в частности, с 5% Pt на углеродном порошке Engelhard S.r.l., Rome, Italy. Реакцию гидрогенизации обычно осуществляют при давлении водорода, находящемся в диапазоне от 1 до 10 бар, предпочтительно от 3 до 6 бар и при температуре, находящейся в диапазоне от 10 до 70C, предпочтительно от 25 до 40C. Время реакции восстановления может варьироваться от 1 до 20 ч, в соответствии с температурой,давлением, концентрацией, турбулизацией и т.д., всеми факторами, хорошо известными специалистам в данной области техники. Наилучшие результаты были получены при времени реакции 4-6 ч. По окончании реакции катализатор восстанавливают путем фильтрования и повторно используют или регенерируют: реакционный растворитель перегоняют при пониженном давлении, остаток растворяют в не смешивающемся с водой органическом растворителе и неорганические соли удаляют промыванием водой. Из конечных неочищенных сафинамида или ралфинамида удаляют перегонкой органический растворитель, в котором они растворены. Затем неочищенные сафинамид или ралфинамид очищают кристаллизацией. Кристаллизацию предпочтительно осуществляют путем добавления к раствору соответствующего неочищенного соединения формулы (Ia) или (Ib) в инертном органическом растворителе смешивающегося инертного органического осадителя. Органический инертный растворитель предпочтительно выбирают из ароматических углеводородов, таких как бензол, толуол, диметилбензол и этилбензол, и низших алкилацетатов, и наиболее предпочтительно представляет собой этилацетат. Смешивающийся инертный органический осадитель предпочтительно выбирают из низших алифатических углеводородов, таких как гексан и гептан, и циклогексан, и наиболее предпочтительно представляет собой нгексан. Затем основания преобразовывают в необходимые соли в соответствии с известными способами, в частности, их преобразовывают в метансульфонатную соль, которая имеет физические/химические свойства (стабильность, гранулометрию, текучесть и т.д.), подходящие для последующего формулирования в фармацевтический препарат для применения в качестве лекарственного средства. Пример 1. Получение очищенного 4-(2-фторбензилокси)бензальдегида (IVb) путем межфазового переноса. Смесь 2-фторбензилхлорида (5 кг, 34,58 моль), 4-гидроксибензальдегида (3,9 кг, 31,94 моль), карбоната калия (4,3 кг, 31,11 моль) и тетрадецилтриметиламмонийбромида (0,41 кг, 1,22 моль) в толуоле(9,5 кг) медленно доводят при перемешивании в атмосфере азота до температуры кипения с обратным холодильником и кипятят с обратным холодильником в течение 6 ч. Затем раствор концентрируют при комнатном давлении, добавляют 3 кг толуола и отгоняют, и повторяют эту процедуру еще раз. Гетерогенную смесь затем охлаждают до комнатной температуры и твердое вещество выделяют фильтрованием. Оставшийся растворитель удаляют затем при пониженном давлении и к маслянистому остатку добавляют 1,2 кг толуола. Смесь нагревают до около 40C и добавляют затравку в виде нескольких граммов чистого 4-(2-фторбензилокси)бензальдегида. Гетерогенную смесь перемешивают в течение 15 мин при 35-40C и затем добавляют н-гексан (9 кг) при такой температуре в течение 30 мин. После охлаждения до 0-5C и перемешивания в течение дополнительного часа при такой температуре твердое вещество отделяют фильтрованием и сушат при пониженном давлении, с получением 6,5 кг (87,6% выход) 4-(2-фторбензилокси)бензальдегида; температура плавления 56,7C (ДСК, 5C/мин). Выше описанную реакцию повторяют в пропорции 1:100, используя 39 г (0,319 моль) 4-9 017123 гидроксибензальдегида в качестве исходного вещества и следуя описанной выше методике, за исключением того, что после удаления реакционного растворителя и добавления толуола к маслянистому остатку, полученную смесь нагревают до около 30-35 (вместо 40C) и после добавления затравки в виде небольшого количества чистого 4-(2-фторбензилокси)бензальдегида гетерогенную смесь перемешивают в течение 15 мин при 30C (вместо 35-40C) перед добавлением н-гексана. Выход составляет 66,8 г (90%) 4-(2-фторбензилокси)бензальдегида, температура плавления 56,7C (ДСК, 5C мин), имеющего ГХ чистоту 92,2 (% по площади, см. пример 16 А) и содержание 3-(2-фторбензил)-4-(2 фторбензилокси)бензальдегида 0,01 мас.%, определенное ГХ (газовая хроматография) (см. пример 16 В). Подразумевается, что выходы, представленные в данном и в следующих примерах, если специально не оговорено иное, представляют собой молярные выходы. 1.1 Дополнительная очистка 4-(2-фторбензилокси)бензальдегида путем кристаллизации. Один килограмм продукта, полученного в соответствии с методикой, описанной в примере 1, растворяют в 2 кг диизопропилового эфира при кипячении с обратным холодильником и при перемешивании. Раствор охлаждают до 50-55C в течение 10-15 мин и добавляют затравку в виде нескольких граммов чистого 4-(2-фторбензилокси)бензальдегида. Суспензию охлаждают до 10-15C в течение 45-60 мин и перемешивают дополнительно в течение часа. Осадок окончательно отделяют фильтрованием, промывают холодным диизопропиловым эфиром (0,2 кг) и сушат при пониженном давлении, с получением 0,93 кг 4-(2-фторбензилокси)бензальдегида ГХ чистоты 99,8 (% по площади, см. пример 16 А) и содержания 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида (Vb) 0,005 мас.%, определенного ГХ, в соответствии с примером 16 В. 1.2 Получение 4-(2-фторбензилокси)бензальдегида (IVb) путем межфазового переноса (РТС) с использованием различных катализаторов. 4-(2-Фторбензилокси)бензальдегид получают алкилированием 4-гидроксибензальдегида (0,39 г) 2 фторбензилхлоридом, следуя аналогичной методике примера 1, но используя три различных катализатора фазового переноса. Результаты представлены в следующей табл. 5. Таблица 5 Содержание соединения Vb определяют ГХ, в соответствии с примером 16 В. 1.3 Получение 4-(2-фторбензилокси)бензальдегида (IVb) путем межфазового переноса (РТС) в ксилоле. 4-(2-фторбензилоху)бензальдегид получают с 86,6% выходом и содержанием 3-(2-фторбензил)-4(2-фторбензилокси)бензальдегида 0,02 мас.%, определенным ГХ (см. пример 16 В), взаимодействием 4 гидроксибензальдегида (0,39 г) с 2-фторбензилхлоридом в соответствии с аналогичной методикой примера 1, но заменяя толуол ксилолом в качестве растворителя. 1.4 Получение 4-(2-фторбензилокси)бензальдегида (IVb) путем межфазового переноса с использованием гидроксида калия в качестве основания. 4-(2-фторбензилокси)бензальдегид получают с 86,7% выходом и содержанием 3-(2-фторбензил)-4(2-фторбензилокси)бензальдегида 0,51 мас.%, определенным ГХ (см. пример 16 В), взаимодействием 4 гидроксибензальдегида (0,39 г) с 2-фторбензилхлоридом в соответствии с аналогичной методикой примера 1, но используя гидроксид калия (0,35 моль) вместо карбоната калия. Полученный продукт можно дополнительно очистить кристаллизацией, в соответствии с примером 1.1. 1.5 Получение 4-(2-фторбензилокси)бензальдегида (IVb) путем межфазового переноса с использованием 2-фторбензилбромида. 4-(2-фторбензилокси)бензальдегид получают с 88,6% выходом и содержанием 3-(2-фторбензил)-4(2-фторбензилокси)бензальдегида 0,07 мас.%, определенным ГХ (см. пример 16 В), взаимодействием 4 гидроксибензальдегида (15,6 г) с 2-фторбензилбромидом вместо 2-фторбензилхлорида, в соответствии с аналогичной методикой примера 1. Пример 2. Получение (S)-2-[4-(2-фторбензилокси)бензилакино]пропанамида (ралфинамида, Ib) высокой степени чистоты (однореакторная реакция). В автоклав загружают 4-(2-фторбензилокси)бензальдегид (2,0 кг, 8,69 моль), полученный в соответствии с примером 1, и затем добавляют полученный отдельно раствор гидрохлорида L-аланинамида (1,2 кг, 9,63 моль) и триэтиламина (0,97 кг, 9,63 моль) в метаноле (9,5 кг). Смесь перемешивают при 20-25C в течение около 1 ч и затем после добавления в затравки в виде нескольких граммов (S)-2-[4-(2 фторбензилокси)бензилиденамино]пропанамида продолжают перемешивание дополнительно в течение- 10017123 15 мин. Затем к перемешанной гетерогенной смеси при 20-25 С добавляют метанол (1,6 кг) и влажный(50% H2O) Pt/C 5% (Engelhard cod. Escat 22, Engelhard S.r.l., Rome, Italy) (0,28 кг). Воздух удаляют из автоклава при помощи азота, затем вводят водород при 5,0 бар и давление поддерживают на данном значении в течение хода гидрогенизации. Спустя 5 ч при 30-35C реакционную смесь охлаждают до 15C, после добавления метанола (4,8 кг) и нагревания до 40-45C суспензию фильтруют и твердое вещество промывают метанолом (1,6 кг). Растворитель удаляют при пониженном давлении при около 30C, к остатку добавляют воду (5 л) при 20-25C при охлаждении и при перемешивании, так как добавление воды является экзотермическим процессом. Гетерогенную смесь дополнительно охлаждают до 15-20C, оставляют при такой температуре на 1 ч и затем фильтруют. Собранное твердое вещество промывают холодной водой (4 л) и сушат при пониженном давлении с получением 2,23 кг (85,0% выход) ралфинамида с ВЭЖХ чистотой 98,8 (% по площади), определенной в соответствии со способом примера 17 А, и содержанием С,Oдиалкилированного (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида 0,01 мас.%,определенным ВЭЖХ, в соответствии со способом примера 17 В. 2.1 Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (Ib) высокой степени чистоты с использованием палладиевого катализатора. Смесь 5 г 4-(2-фторбензилокси)бензальдегида, полученного в соответствии с примером 1, и соответствующее количество гидрохлорида L-аланинамида и триэтиламина гидрогенизируют, в соответствии с аналогичной методикой примера 2, но с использованием влажного (50% H2O) Pd/C 10% вместо влажного (50% H2O) Pt/C 5%, с получением (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (Ib) с 70% выходом. Пример 3. Получение метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (метансульфонат ралфинамида, Id) высокой степени чистоты. Ралфинамид (2,8 кг, 9,2 6 моль), полученный, как описано в примере 2, растворяют в изопропаноле(19,5 кг) и выдерживают при 65-70C и при перемешивании в инертной атмосфере. После обработки активированным углем (150 г) и фильтрования в раствор добавляют затравку чистого метансульфоната ралфинамида и добавляют метансульфоновую кислоту (900 г, 9,36 моль) в течение 30 мин при перемешивании и при температуре 50-55C. Затем суспензию охлаждают до 15-20C в течение 2 ч и продолжают перемешивание в течение дополнительного часа. Твердое вещество окончательно отделяют фильтрованием и сушат при пониженном давлении, с получением 3,59 кг (97,3% выход) метансульфоната ралфинамида. ВЭЖХ чистота полученного продукта составляет 99,8 (% по площади, см. пример 17 А) и содержание С,O-диалкилированного метансульфоната (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида составляет 0,005 мас.% (см. пример 17 В); температура плавления 240,6C посредством ДСК (5C/мин). Энантиомерная чистота метансульфоната ралфинамида, определенная при помощи хиральной колонки ВЭЖХ, выше 99,8 (% по площади, см. пример 18). Пример 4. Получение очищенного 4-(3-фторбензилокси)бензальдегида (IVa) в растворе этанола. К смеси 4-гидроксибензальдегида (1,52 кг, 12,45 моль), карбоната калия (1,72 кг, 12,45 моль), йодида калия (0,2 кг, 1,20 моль) в этаноле (13,0 кг) добавляют 1,8 кг 3-фторбензилхлорида (1,80 кг, 12,45 моль) при перемешивании при комнатной температуре. Смесь постепенно нагревают до кипения с обратным холодильником и поддерживают при такой температуре в течение 6 ч. Затем реакционной смеси дают охладиться до 25C, суспензию фильтруют и твердое вещество промывают этанолом (1,0 кг); растворы этанола объединяют и затем концентрируют при пониженном давлении, до получения остатка приблизительно 3,5 кг. К полученному остатку добавляют толуол (5,0 кг) и воду (1,7 кг), смесь растворителей интенсивно перемешивают в течение 30 мин и после отделения водной фазы органический слой упаривают досуха при пониженном давлении, с получением неочищенного 4-(3-фторбензилокси)бензальдегида. К полученному продукту, растворенному в 2 кг толуола, добавляют затравку 4-(3 фторбензилокси)бензальдегида при перемешивании при 20-25C, затем в течение 30 мин добавляют нгексан (3,8 кг) и смесь охлаждают до 0C при перемешивании. Через 2 ч твердое вещество фильтруют и промывают н-гексаном (1,3 кг). После сушки получают 2,6 кг (90,7% выход) желаемого продукта газохроматографической чистоты 99,9 (% по площади, см. пример 16 А) и содержанием 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида 0,005 мас.%, определенным ГХ (% по площади, см. пример 16 В); температура плавления 43,1C посредством ДСК 5C/мин. Пример 5. Получение 4-(3-фторбензилокси)бензальдегида (IVa) путем межфазового переноса. Смесь 3-фторбензилхлорида (5 кг, 34,58 моль), 4-гидроксибензальдегида (3,9 кг, 31,94 моль), карбоната калия (4,3 кг, 31,11 моль) и тетрадецилтриметиламмонийбромида (0,41 кг, 1,22 моль) в толуоле(13,5 кг) медленно доводят до температуры кипения с обратным холодильником при перемешивании и в атмосфере азота и затем кипятят с обратным холодильником в течение 6 ч.- 11017123 Раствор концентрируют при комнатном давлении, затем добавляют 3 кг толуола и отгоняют. Эту процедуру повторяют еще раз. Затем гетерогенную смесь охлаждают до комнатной температуры и твердое вещество выделяют фильтрованием. Оставшийся растворитель удаляют при пониженном давлении и затем добавляют 1,2 кг толуола к маслянистому остатку. Смесь перемешивают при 20-25C, добавляют затравку в виде нескольких граммов чистого 4-(3-фторбензилокси)бензальдегида и затем добавляют н-гексан (9 кг) при этой температуре в течение 30 мин. После охлаждения до 0-5C и перемешивания дополнительно в течение часа при этой температуре,твердое вещество отделяют фильтрованием и сушат при пониженном давлении, с получением 6,5 кг(85% выход) с ГХ чистотой 99,9 (% по площади, см. пример 16 А) и содержанием 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегида 0,008% по массе (см. пример 16 В). 5.1 Дополнительная очистка 4-(3-фторбензилокси]бензальдегида (IVa) путем кристаллизации. Один килограмм 4-(3-фторбензилокси)бензальдегида, полученного в соответствии с примером 5,растворяют в 2 кг диизопропилового эфира при кипячении с обратным холодильником при перемешивании. Раствор охлаждают до 50-55C в течение 10-15 мин и добавляют затравку в виде нескольких граммов чистого 4-(3-фторбензилокси)бензальдегида. Суспензию охлаждают до 10-15C в течение 45-60 мин и перемешивают дополнительно в течение часа. Осадок окончательно отделяют фильтрованием, промывают холодным диизопропиловым эфиром(0,2 кг) и сушат при пониженном давлении, с получением 0,95 кг 4-(3-фторбензилокси) бензальдегида с ГХ чистотой 99,9 (% по площади, см. пример 16 А) и содержанием 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегида ниже 0,005 мас.%, определенным ГХ (см. пример 16 В). 5.2 Получение 4-(3-фторбензилокси)бензальдегида (IVa) путем межфазового переноса с использованием 3-фторбензилбромида. 4-(3-Фторбензилокси)бензальдегид получают с 86,1% выходом и содержанием 3-(3-фторбензил)-4(3-фторбензилокси)бензальдегида 0,07% по массе, определенным ГХ (см. пример 16 В), взаимодействием 4-гидроксибензальдегида (15,6 г) с 3-фторбензилбромидом, в соответствии с аналогичной методикой примера 5, но используя 3-фторбензилбромид вместо 3-фторбензилхлорида. Полученный таким образом 4-(3-фторбензилокси)бензальдегид очищают в соответствии с примером 5.1, с получением указанного продукта с 97,3% выходом и содержанием 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегида 0,07 мас.%, определенным ГХ (см. пример 16 В). 5.3 Получение 4-(3-фторбензилокси)бензальдегида (IVa) путем межфазового переноса с использованием 3-фторбензилметансульфоната. 4-(3-Фторбензилокси)бензальдегид получают с 97,5% выходом и содержанием 3-(3-фторбензил)-4(3-фторбензилокси)бензальдегида 0,45 мас.%, определенным ГХ (см. пример 16 В), взаимодействием 4 гидроксибензальдегида (15,6 г) с 3-фторбензилметансульфонатом вместо 3-фторбензилхлорида, в соответствии с аналогичной методикой примера 5. Полученный продукт дополнительно очищают, в соответствии с методикой примера 5.1. Пример 6. Получение (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид, Ia) высокой степени чистоты (однореакторная реакция). В автоклав загружают 4-(3-фторбензилокси)бензальдегид (2,0 кг, 8,69 моль), полученный как в примере 4, и затем добавляют отдельно полученный раствор гидрохлорида L-аланинамида (1,2 кг, 9,63 моль) и триэтиламина (0,97 кг, 9,63 моль) в метаноле (7,1 кг). Смесь перемешивают при 20-25C в течение 1 ч и после добавления затравки в виде нескольких граммов (S)-2-[4-(-3-фторбензилокси)бензилиденамино]пропанамида продолжают перемешивание дополнительно в течение 15 мин. Затем к перемешанной гетерогенной смеси добавляют метанол (1,8 кг) и влажный (50% H2O) Pt/C 5% (Engelhard cod. Escat 22)(0,3 кг) при 20-25C. Воздух удаляют из автоклава при помощи азота и затем вводят водород при 5,0 бар. Спустя 5 ч при 30-35C, смесь охлаждают до 15C, добавляют метанол (4,8 кг) и смесь нагревают до 40-45C; твердое вещество окончательно отфильтровывают и промывают метанолом (1,6 кг). Растворитель удаляют при пониженном давлении приблизительно при 30C и затем добавляют к остатку смесь этилацетата (23,0 кг) и воды (18,0 кг). После перемешивания в течение 15 мин водную фазу отделяют и экстрагируют этилацетатом (7,0 кг). Собранные органические фазы концентрируют до получения остатка приблизительно 6,0 кг. К полученному остатку добавляют н-гептан (10,8 кг) и смесь перемешивают при 20C в течение около 2 ч. Затем твердое вещество отделяют фильтрованием и промывают н-гептаном. После сушки твердого вещества при пониженном давлении получают 2,41 кг (91,8% выход) указанного соединения с ВЭЖХ чистотой 98,4 (% по площади, см. пример 17 А) и содержанием С,Oдибензилированного(S)-2-[4-(3-Фторбензилокси)бензальдегид (5 г) гидрогенизировали в присутствии соответствующих количеств гидрохлорида L-аланинамида и триэтиламина, в соответствии с аналогичной методикой примера 6, используя влажный (50% H2O) Pd/C 10%, вместо влажного (50% H2O) Pt/C 5%, с получением 1 а с 72% выходом. 6.2 Получение (S)-2-[4-(3-фторбензилокси)бензиламино 3 пропанамида (Ia) высокой степени чистоты путем гидрогенизации при давлении 1 бар. Смесь (S)-2-[4-(3-фторбензилокси)бензальдегида, гидрохлорида L-аланинамида и триэтиламина гидрогенизируют, в соответствии с аналогичной методикой примера 6, но при 1 бар/Н 2 вместо 5 бар/Н 2. Выход (S)2-[4-(3-фторбензилокси)бензиламино]пропанамида составляет 90% с ВЭЖХ чистотой 98,7 (% по площади,см. пример 17 А) и содержанием (S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида 0,005% по массе, определенного ВЭЖХ (см. пример 17 В). 6.3 Получение (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (Ia) высокой степени чистоты(S)-2-[4-(3-фторбензилокси]бензальдегид (10 г) подвергают взаимодействию, в соответствии с аналогичной методикой примера 6, но с использованием L-аланинамидного основания вместо его гидрохлорида и триэтиламина. Выход (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида составляет 92% с ВЭЖХ чистотой 99,7 (% по площади, см. пример 17 А) и содержанием (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида ниже 0,005 мас.%, определенным ВЭЖХ (см. пример 17 В). Пример 7. Получение метансульфоната (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (метансульфонат сафинамида, Ic) высокой степени чистоты. Сафинамид (2,41 кг, 7,97 моль), полученный, как описано в примере 6, растворяют в этилацетате(56,5 кг) при 65C и обесцвечивают углем (100 г). После фильтрации раствор перемешивают, добавляют затравку в виде нескольких граммов метансульфоната сафинамида и через 15 мин добавляют метансульфоновую кислоту (850 г, 8,84 моль) в течение 30 мин при температуре 50-55C. Суспензию охлаждают при перемешивании до 20-25C в течение 2 ч и перемешивают дополнительно в течение часа. Осадок окончательно отделяют фильтрованием и сушат при пониженном давлении, с получением 2,83 кг (89,1% выход) метансульфоната сафинамида. Содержание примесного метансульфоната(S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIc), измеренное ВЭЖХ (см. пример 17 В), составляет 0,005% по массе. Указанное соединение имеет температуру плавления 216,8C по ДСК (5C/мин). Энантиомерная чистота, измеренная на хиральной колонке ВЭЖХ, свыше 99,9 (% по площади, см. пример 19). 1 Н-ЯМР: (D2O) (Bruker A V300)(м.д., относительно H2O на 4,7 м.д.): 1,43 (3H, д, J=7 Гц, СН 3); 2,66 (3H, с, CH3SO3H); 3,87 (1 Н, кв, J=7 Гц, Н-2); 3,97 (2 Н, ушир.с, CH2NR); 4,89 (2 Н, с, CH2OR); 6,88 и 7,23 (4 Н, АА'ХХ' ароматическая п-дизамещенная система; 6,90-7,22 (4 Н, ароматический Н). 13 С-ЯМР: (D2O) (Bruker AV300)м.д.: 15,68 (СН 3); 38,27 (CH3SO3H); 48,99 (CH2NR); 54,81 (СН); 69,00 (ОСН 2); 114,15 (д, JC-F=21 Гц, ароматический СН); 114,76 (д, JC-F=20 Гц, ароматический СН); 115,38(ароматический СН); 123,06 (д, JC-F=24 Гц, ароматический СН); 123,24; 130,29 (д, JC-F=6 ГЦ, ароматический СН); 131,54 (ароматический СН); 138,76 (д, JC-F=7 Гц, ароматический СН); 158,52; 162,89 (д, JC-F=245 Гц,C-F); 171,92 (СО). Пример 8. Получение (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид, 1 а) высокой степени чистоты с выделением промежуточного основания Шиффа (S)-2-[4-(3 фторбензилокси)бензилиденамино]пропанамида (VIa).a) (S)-2-[4-(3-Фторбензилокси)бензилиденамино]пропанамид (VIa). К суспензии 4-(3-фторбензилокси)бензальдегида (60,0 г 0,26 моль), полученного как в примере 5, и гидрохлорида L-аланинамида (35,7 г, 0,29 моль) в метаноле (280 мл) добавляют триэтиламин (29,1 г, 0,29 моль) при комнатной температуре при перемешивании в атмосфере азота. Перемешивание поддерживают дополнительно в течение одного часа. Затем в раствор добавляют затравку в виде нескольких мг(S)-2-[4-(3 фторбензилокси)бензилиденамино]пропанамида, температуру понижают до 5-10C и перемешивание продолжают в течение 2 ч. Твердое вещество отделяют фильтрованием и промывают метанолом при 0C. После сушки при пониженном давлении получают 57,3 г (73,2% выход) указанного в заголовке соединения с температурой плавления 112,0C по ДСК (5C/мин). 1H-ЯМР: (ДМСО-d6) (Bruker AV300)(м.д., относительно TMS на 2,55 м.д.; растворитель ДМСО на 3,35 м.д.): 1,31 (3H, д, J=7 Гц, СН 3); 3,86 (1 Н, кв, J=7 Гц, Н-2); 5,18 (2 Н, с, CH2OR); 7,08 и 7,79 (4 Н,АА'ХХ' п-дизамещенная ароматическая система); 7,10-7,50 (4 Н, м, ароматический Н); 8,27 (1 Н, с,CH=NR). 13 С-ЯМР: (ДМСО-d6) (Bruken AV300)(м.д.): 20,5 (СН 3); 67,6 (СН); 68,4 (ОСН 2); 114,1 е 114,4 (д,JC-F=21 ГЦ, ароматический СН); 114,5 и 114,8 (д, JC-F=21 Гц; ароматический СН); 114,8 (ароматический- 13017123 СН); 123,5 (д, JC-F=2 ГЦ, ароматический СН); 129,0 и 129,9 (ароматический СН); 130,4 и 130,5 (д, JC-F=7 Гц,ароматический СН); 139,6 и 139,7 (д, JC-F=6 Гц ароматический четвертичный С); 160,2; 160,5 и 163,8 (д,JC-F=245 Гц C-F); 160,6 (CH=N); 174,8 (СО).b) (S)-2-[4-(3-Фторбензилокси) бензиламино]пропанамид (Ia). В автоклав загружают (S)-2-[4-(3-фторбензилокси)бензилиденамино]пропанамид (16,0 г; 0,053 моль), полученный, как описано выше, и влажный (50% H2O) Pt/C 5% (1,7 кг: Engelhard S.r.l., Rome,Italy) и добавляют метанол (90 мл). Из автоклава удаляют воздух при помощи азота и затем вводят водород при 5,0 бар. Реакцию выдерживают при 5,0 бар и при 35C в течение 1 ч. После охлаждения до комнатной температуры и удаления катализатора фильтрованием растворитель отгоняют при пониженном давлении до получения остатка приблизительно 30 г. К полученному остатку добавляют смесь этилацетата (150 мл) и H2O (110 м) и гетерогенную смесь нагревают до 40C до получения двух отчетливых фаз. Две фазы разделяют и водный слой экстрагируют 50 мл этилацетата при 40C. Органические фазы собирают и упаривают досуха. Процедуру повторяют дважды путем добавления каждый раз 90 мл этилацетата, для обезвоживания продукта. Затем к остатку медленно и при перемешивании добавляют 95 мл нгептана. Затем смесь выдерживают при перемешивании в течение 3 ч при 20C. Образовавшееся твердое вещество отделяют фильтрованием, промывают н-гептаном (15 мл) и сушат при пониженном давлении, с получением 15,2 г (94,8% выход) сафинамида с ВЭЖХ чистотой 99,8 (% по площади, см. пример 17 А) и содержанием (S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида ниже 0,005 мас.%,измеренным ВЭЖХ (см. пример 17 В). Пример 9. Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (ралфинамид, Ib) высокой степени чистоты с выделением промежуточного основания Шиффа (S)-2-[4-(2 фторбензилокси)бензилиденамино]пропанамида (VIb).(S)-2-[4-(2-Фторбензилокси)бензилиденамино]пропанамид получают с 88% выходом, температура плавления 121C (в капилляре), следуя аналогичной методике примера 8, стадия а), но используя 4-(2 фторбензилокси)бензальдегид вместо 4-(3-фторбензилокси)бензальдегида. 1 Н-ЯМР: (CDCl3, 300 МГц, 298 К)(м.д., относительно TMS): 1,46 (3H, д, J=7,0 Гц, СН 3); 3,91 (1 Н,кв, J=7,0 Гц, СН-СО); 5,17 (2 Н, с, О-СН 2); 7,02 (2 Н, д, J=8,9 Гц ароматический Н орто по отношению к ОСН 2); 7,09 (1 Н, ддд, JH-F=9,78 Гц Jopтo=8,55 Гц Jмета=l,23 Гц Н орто по отношению к F); 7,15 (1 Н, дт,Jорто=7,35 Гц Jмета=l,23 Гц ароматический Н пара по отношению к F); 7,27-7,40 (1 Н, м, ароматический Н пара по отношению к СН 2); 7,48 (1 Н, дт, Jорто=JH-F=7 ,35 Гц, Jмета=l,53 Гц ароматический Н орто по отношению к СН 2); 7,71 (2 Н, д, J=8,9 Гц ароматический Н орто по отношению к CH=N); 8,17 (1 Н, с, C=N) 13 СЯМР: (CDCl3, 75,4 МГц, 298 К)(м.д.): 21,4 (СН 3); 63,8 (ОСН 2); 68,4 (H2NCOCH); 115,0 (д, JC-F=22,4 Гц,ароматический СН), 115,5 (д, JC-F=20,7 Гц, ароматический СН); 123,7 (д, JC-F=14,4 Гц, четвертичный ароматический С); 124,5 (ушир.д, ароматический СН); 129,0 (четвертичный ароматический С); 129,8(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид получают с 93% выходом из (S)-2-[4-(2 фторбензилокси)бензилиденамино]пропанамида, следуя аналогичной методике примера 8, стадия b). Содержание (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида составляет 0,02% по массе, определенное ВЭЖХ (см. пример 17 В). Пример 10. Получение метансульфоната(S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино] пропанамида (IIc). а) 3-(3-Фторбензил)-4-(3-фяюрбензилокси) бензальдегид (Va). В 4 л круглодонную колбу, выдержанную в атмосфере азота, последовательно добавляют 4 гидроксибензальдегид (400 г, 3,28 моль), карбонат калия (453 г, 3,28 моль), толуол (2 л) и 3 фторбензилхлорид (1400 г, 9,68 моль) и смесь кипятят с обратным холодильником при перемешивании в течение 5 дней. На данном этапе ГХ анализ показывает, что реакционная смесь содержит 4-(3 фторбензилокси)бензальдегид и 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегид в соотношении 91,4:8,6 (площадь/площадь, см. пример 16 А). Реакционную смесь охлаждают до комнатной температуры и затем добавляют 2 л воды при перемешивании. Органическую фазу отделяют и растворитель перегоняют при пониженном давлении (20 мм рт.ст.) при 35C до удаления всех растворителей. Затем давление понижают до 3 мм рт.ст., внешнюю температуру повышают до 300C и отделяют фракцию, которая отгоняется от 255 до 265C (40, 6 г). ГХ анализ показывает соотношение площадей С,O-дибензилированного производного (Va) указанного соединения к моноалкилированному производному (IVa) 99,6:0,4 (площадь/площадь, см. пример 16 А). 1 Н-ЯМР (CDCl3) (Bruker AV300)(м.д.г относительно TMS): 4,05 (2 Н, с, СН 2); 5,13 (2 Н, с, ОСН 2); 6,85-7,40 (9 Н, м, ароматический Н); 7,73-7,79 (2 Н, м, ароматический Н орто по отношению к С=О); 9,88b) (S)-2-[3-(3-Фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамид (IIa). К 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегиду (35,6 г, 0,105 моль) в 500 мл колбе добавляют при комнатной температуре раствор, предварительно полученный путем осторожного добавления при перемешивании триэтиламина (12 г, 0,119 моль) к 170 мл метанольного раствора гидрохлорида Lаланинамида (14,8 г, 0,119 моль). Полученную реакционную смесь перемешивают в течение 1 ч при комнатной температуре, затем переносят в 1,8 л автоклав и добавляют 3,4 г влажного (50% H2O) Pt/C 5%. Воздух удаляют из автоклава при помощи азота и затем вводят водород при 5,0 бар. Реакцию осуществляют при температуре 35C в течение 3-5 ч. После охлаждения до комнатной температуры и удаления катализатора фильтрованием растворитель отгоняют при пониженном давлении до получения приблизительно 65 г остатка. К полученному остатку добавляют смесь этилацетата (340 мл) и воду (250 мл), гетерогенную смесь нагревают до 40C и выдерживают при этой температуре без перемешивания, до получения двух отчетливых фаз. Две фазы разделяют и органическую фазу перегоняют при пониженном давлении, до получения приблизительно 50 г остатка. Полученный остаток растворяют в 220 мл этилацетата и растворителя, отогнанного при пониженном давлении при внешней температуре 40C. Эту операцию повторяют дважды и получают указанное соединение в виде остатка твердого вещества.c) Метансульфонат (S)-2-[3-(3-Фдорбензил)-4-(3-фторбензилокси]бензиламино]пропанамида (IIc). В 2 л стеклянном реакторе растворяют 42,4 г (0,103 моль) основания (S)-3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида в 950 мл этилацетата. Раствор нагревают при перемешивании при 50-55C и выдерживают при такой температуре в течение одного часа. К полученному раствору в течение 20 мин добавляют 14,5 г (0,15 моль) метансульфоновой кислоты и температуру понижают до 20C в течение 90 мин. Через 30 мин твердое вещество отделяют фильтрованием, сушат при 50C при пониженном давлении и затем кристаллизуют из метанола (метанол:продукт 1:5 по массе), с получением 25,1 г метансульфоната (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида, температура плавления 181C (в капилляре). 1 Н-ЯМР (ДМСО-d6) (Bruker AV300)(м.д., относительно TMS): 1,44 (3H, д, J=7 Гц, СН 3); 2,35 (3H,с, CH3SO3); 3,81 (1 Н, кв, J=7 Гц, Н-2), 3,99 (2 Н, ушир.с, СН 2 бензильный); 4,02 (2 Н, АВ система, CH2N-); 5,17 (2 Н, с, CH2OR); 6,98-7,63 (11 Н, м, ароматический Н); 7,62 и 7,75 (2 Н, ушир.с, NH2 амид); 9,02 (2 Н,широкий, NH2 + ). 13 С-ЯМР (ДМСО-d6) (Bruker AV300)(м.д.): 15,9 (СН 3); 35,5 (СН 2); 39,7 (CH3SO3H); 48,1 (CH2NR); 54,4(СН); 68,4(ОСН 2); 112,2 (ароматический СН); 112,7 (д, JC-F-22 ГЦ, ароматический СН); 113,8 (д, JC-F=22 Гц,ароматический СН); 114,5 (д, JC-F=22 ГЦ, ароматический СН); 115,2 (д, JC-F=22 Гц, ароматический СН); 123,2(ароматический СН); 123,8; 124,6 (ароматический СН); 128,7 и 130,0 (д, JHC-F=6 Гц, ароматический СН); 130,04 (ароматический СН); 130,3 (д, JC-F=6 ГЦ, ароматический СН); 132,6 (ароматический СН); 139,8 (д, JC-F=7 Гц); 143,4 (д, JC-F=7 Гц); 158,1, 160,5 и 163,7 (д, JC-F=240, C-F); 160,6 и 163,8 (д, JC-F=240, C-F); 170,5 (CON). Образец (90 мг) (S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIa) также выделяют препаративной ВЭЖХ из 200 г метансульфоната сафинамида (Ic), полученного в соответствии с J. Med. Chem., 1998, 41, 579, способ А, который содержит его в виде метансульфоната (IIc) 0,12% по массе. Разделение осуществляют в две стадии (стадия 1 и стадия 2), в соответствии со следующей схемой: Стадия 1. Назначением первой стадии является выделение неочищенного продукта, обогащенного IIa/ТФУК(трифторуксусная кислота). Условия препаративной ВЭЖХ представлены ниже: Условия препаративной ВЭЖХ: Оборудование:Waters Delta Prep 4000 (поршневой насос, устройство для создания градиента со смесителем низкого давления) Радиальный компрессионный модуль Prep LC Base (Waters)Merk D2 000 графический принтер Колонка: Delta Pak C18, 15 мкм, 40 100 мм (Waters) Элюент А: 70/30, вода/ацетонитрил+0,1% ТФУК Элюент В: 30/70, вода/ацетонитрил+0,1% ТФУК Скорость потока: 27,0 мл/мин Градиент: 40 мин, изократический 100% А, затем до 100% В в течение 1 мин Детекция: УФ 227 нм Инъекция: 5 г в 50 мл воды (по впускному трубопроводу насоса D) Стадия 2. На данной стадии необходимо удалить ТФУК из IIa/ТФУК и дополнительно очистить соединениеIIa/ТФУК хроматографируют, используя условия препаративной ВЭЖХ, приведенные ниже. Фракцию 4 и 5 объединяют вместе и упаривают при 40C в вакууме до полного удаления ацетонитрила. Оставшийся водный раствор выдерживают в холодильнике при 4C. Нерастворимое вещество отделяют фильтрованием и сушат в вакууме при комнатной температуре с получением соединения IIa (90 мг; ВЭЖХ чистота 100%). Условия препаративной ВЭЖХ: Оборудование:Waters Delta Prep 4000 (поршневой насос, устройство для создания градиента со смесителем низкого давления)- 16017123 Детекция: УФ 227 нм Инъекция: 50 мл примесного раствора "IIa/ТФУК" (по впускному трубопроводу насоса D) Пример 11. Получение метансульфонатаa) 3-(2-Фторбензил)-4-(2-фторбензилокси)бензальдегид (Vb). 3-(2-Фторбензил)-4-(2-фторбензилокси)бензальдегид получают, следуя аналогичной методике примера 10, стадия а), в пропорции 1:10, но используя 2-фторбензилхлорид вместо 3-фторбензилхлорида. Молярный выход составляет 3% с 98,1 чистотой, определенной ГХ анализом (% по площади, см. пример 16 А). Продукт имеет температуру плавления 71C (в капилляре). 1H-ЯМР: (CDCl3, 300 МГц, 298 К)(м.д., относительно TMS): 4,06 (2 Н, с, СН 2); 5,23 (2 Н, с, ОСН 2); 6,95-7,40 (9 Н, м, ароматический Н); 7,67 (1 Н, ушир.д, J=0,9 Гц, ароматический Н орто по отношению к С=О и СН 2); 7,76 (1 Н, дд, J1=2,1 Гц, J2 = 8,3 Гц, ароматический Н орто по отношению к С=О и ароматический СН); 9, 84 (1 Н, с, СНО). 13 С-ЯМР: (CDCl3, 75,4 МГц, 298 К)(м.д.): 29,2 (СН 2); 64,1 (ОСН 2); 111,4 (ароматический СН); 115,4 (д, JC-F=22,0 Гц, ароматический СН), 115,5 (д, JC-F=21,1 Гц, ароматический СН); 123,3 (д, JC-F=14,2 Гц, четвертичный ароматический С); 124,1 (д, JC-F=2,6 Гц, ароматический СН); 124,5 (д, JC-F=3,2 Гц,ароматический СН); 126,6 (д, JC-F=15,5 Гц, четвертичный ароматический С); 128,2 (д, JC-F=8,1 ГЦ, ароматический СН); 129,6 (д, JC-F=6,2 Гц, ароматический СН); 129,6 (четвертичный ароматический С); 130,0(S)-2-[3-(2-Фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамид получают, следуя аналогичной методике примера 10,стадия: Ь),но используя 3-(2-фторбензил)-4-(2 фторбензилокси)бензальдегид вместо 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида. Выход составляет 83%; температура плавления 161C (в капилляре). 1(2 Н, с, СН 2); 5,12 (2 Н, с, ОСН 2); 5,98 (1 Н, ушир.с, NH2); 6,89 (1 Н, д, Jopтo=8,3 Гц, ароматический Н орто по отношению к CH2NH и ароматический СН); 6,95-7,40 (10 Н, м, ароматический Н). 13 С-ЯМР: (CDCl3, 75,4 МГц, 298 К)(м.д.): 19,6 (СН 3); 29,2 (СН 2); 52,0 (NHCH2); 57,7 (H2NCOCH); 53,8 (ОСН 2); 111,7 (ароматический СН); 115,2 (д, JC-F=21,9 Гц, ароматический СН), 115,3 (д, JC-F=21,3 Гц,ароматический СН); 124,0 (д, JC-F=3,5 ГЦ, ароматический СН); 124,3 (д, JC-F=2,9 Гц, ароматический СН); 124,3 (д, JC-F=14,4 Гц, четвертичный ароматический С); 127,5 (ароматический СН); 127,6 (д, JC-F=15,0 Гц, четвертичный ароматический С); 127,8 (д, JC-F=7,5 ГЦ, ароматический СН); 128,8 (четвертичный ароматический С); 129,0-130,0 (м, 2 ароматический СН); 130,5 (ароматический СН); 131,3 (д, JC-F=4,6 Гц,ароматический СН); 131,8 (четвертичный ароматический С); 155,6 (четвертичный ароматический С); 160,4 (д, JC-F=245,8 ГЦ, четвертичный ароматический С); 161,2 (д, JC-F=244,6 ГЦ, четвертичный ароматический С); 178,2 (CONH2). с) метансульфонат (S)-2-[3-(2-фторбензил-4-(2-фторбензилокси)бензиламино]пропанамида (IId). Метансульфонат (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида получают, следуя аналогичной методике примера 10, стадия с), но используя (S)-2-[3-(2-фторбензил)-4-(2 фторбензилокси)бензиламино]пропанамид в качестве исходного вещества. Выход составляет 89%; температура плавления 190C (в капилляре). 1(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамидное сафинамидное основание, следуя аналогичной методике примера 6. Выход составляет 84% с содержанием примеси (IIa) 0,8 4% (см. пример 17 В) по массе. Свободное основание (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (Ia) преобразуют в соответствующий метансульфонат, следуя аналогичной методике примера 7 для получения метансульфоната (Ic), с 98% выходом и содержанием примеси метансульфоната (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида (IIc) 0,62 мас.%, определенным ВЭЖХ (см. пример 17 В). Пример 13. Кристаллизация метансульфоната сафинамида (Ic), загрязненного примесью (IIc). Метансульфонат сафинамида, загрязненный метансульфонатом (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамидом (IIc) 0,62 мас.%, определенным ВЭЖХ (см. пример 17 В),полученный в соответствии с примером 12, кристаллизуют, используя пять различных систем растворителей, путем растворения при температуре кипения с обратным холодильником и охлаждения при комнатной температуре. Результаты представлены в следующей табл. 6. Таблица 6 мас.%, определяют, в соответствии с примером 17 В. Пример 14. Получение (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид, Ia), метансульфоната (Ic)в соответствии со способами, описанными на предшествующем уровне технике 14.1 Получение 4(3-фторбензилокеи)бензальдегид (IVa) 14.1.а) Методика примера Ia US 6335354 В 2. 4-(3-Фторбензилокси)бензальдегид (IVa) получают по методике, описанной в примере la US 6335354 В 2 . Соответственно, смесь 3-фторбензилхлорида (2,86 г, 19,80 ммоль), 4-гидроксибензальдегида (3,03 г,24,80 ммоль), K2CO3 (10,30 г, 74,50 ммоль), NaI (137,1 мг, 0,91 ммоль) и этанола (40 мл) нагревают при кипении с обратным холодильником в течение 70 мин и выдерживают при температуре кипения в течение 4 ч и 15 мин. После обработки реакционной смеси, 4-(3-фторбензилокси)бензальдегид выделяют в виде желтого масла с 95% выходом. Продукт имеет ГХ чистоту 97,6 (% по площади, см. пример 16 А) и содержание 3-(3-фторбензил)-4(3-фторбензилокси)бензальдегида (Va) 0,14% по массе, определенное ГХ (см. пример 16 В). 14.1.b) Методика J. Agric. Food Chem, 27, 4. 1979. 4-(3-Фторбензилоси)бензальдегид (IVa) получают по методике, представленной в J. Agric. FoodChem, 27, 4, 1979. Соответственно к раствору 4-гидроксибензальдегида (12,2 г, 100 ммоль) и NaOH (4,0 г, 100 ммоль) в этаноле (100 мл) добавляют 3-фторбензилхлорид (14,5 д, 100 ммоль) при перемешивании и в атмосфере азота. Смесь постепенно нагревают в течение 25 мин при кипении с обратным холодильником и перемешивают при температуре кипения в течение 6 ч и 20 мин. Реакционную смесь фильтруют и затем концентрируют при пониженном давлении, с получением 4-(3-фторбензилокси)бензальдегида (23,43 г) в виде желтого твердого остатка. К остатку добавляют дихлорметан (250 мл), нерастворимое вещество отфильтровывают, полученный раствор концентрируют при пониженном давлении, с получением 4-(3 фторбензилокси)бензальдегида в виде желтого твердого вещества с 80,4% выходом. Продукт имеет ГХ чистоту 91,6 (% по площади, см. пример 16 А) и содержание 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегида (Va) 0,13 мас.%, определенное ГХ (см. пример 16 В). 14.2 Получение (S)-2-[4-(3-фторбензилоси)бензиламино]пропанамида (Ia) и его метансульфонадной соли (Ic). 14.2.а) Методика J. Med. Chem., 1998. 41. 579. способ А.L-аланинамида (1,37 г, 11 ммоль), с последующим восстановлением NaBH3CN (0,50 г, 8 ммоль). После обработки реакционной смеси и очистки флэш-хроматографией,(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамид выделяют в виде белого твердого вещества с 68,7% выходом. Продукт имеет ВЭЖХ чистоту 96,2 (% по площади, см. пример 17 А) и содержание (S)-2-[3-(3- 18017123 фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIa) 0,15 мас.% (см. пример 17 В). Смесь (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (1,50 г, 4,96 ммоль) и этилацетата(40,2 мл) нагревают до 50C, с получением прозрачного раствора. К полученному раствору добавляют метансульфоновую кислоту (0,53 г, 5,51 ммоль) при перемешивании в течение 15 мин и полученную гетерогенную смесь охлаждают при перемешивании до 20C в течение 90 мин. Спустя 30 мин при 20C,твердое вещество отделяют фильтрованием, промывают этилацетатом (6 мл) и сушат при 50C при пониженном давлении в течение 15 ч,с получением метансульфоната(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида (Ic) в виде белого твердого вещества с 96,1% выходом. Продукт имеет ВЭЖХ чистоту 98,6 (% по площади, см. пример 17 А) и содержание метансульфоната (S)-2-[3(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIc) 0,10 мас.%, определенное ВЭЖХ(S)-2-[4-(3-Фторбензилокси)бензиламино]пропанамид (Ia) получают, в соответствии с примером 14.2.а, из 4-(3-фторбензилокси)бензальдегида (10 ммоль), полученного как описано в примере 14.1.b., и гидрохлорида L-аланинамида (1,37 г, 11 ммоль), с последующим восстановлением NaBH3CN (0,50 г, 8 ммоль).(S)-2-[4-(3-фторбензилокси)бензиламино]пропанамид (Ia) получают в виде белого твердого вещества с 66,5% выходом. Продукт имеет ВЭЖХ чистоту 88,5 (% по площади, см. пример 17 А) и содержание(S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (IIa) 0,064 мас.%, определенное ВЭЖХ (см. пример 17 В). (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамид (Ia) преобразовывают в соответствующий метансульфонат (Ic) с 88,9% выходом обработкой метансульфоновой кислотой, в соответствии с примером 14.2.а. Продукт имеет ВЭЖХ чистоту 97,7 (% по площади, см. пример 17 А) и содержание метансульфоната (S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида(IIc) 0,05% по массе, определенное ВЭЖХ (см. пример 17 В). Пример 15. Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (ралфинамид, Ib), метансульфоната (Id), в соответствии со способами, описанными на предшествующем уровне техники 15.1 Получение 4-(2-фторбензилокси) бензальдегида (IVb). 15.1. а) Методика примера Ia US 6335354 В 2 4-(2-Фторбензилокси)бензальдегид (IVb) получают, в соответствии с примером 14.1.а), из 2-фторбензилхлорида (14,3 г, 98 ммоль), 4-гидроксибензальдегида(15,1 г, 123 ммоль), K2CO3 (51 г, 369 ммоль), NaI (500 мг, 3,3 ммоль) и этанола 7 5 мл. Смесь выдерживают при кипячении с обратным холодильником в течение 12 ч. После обработки реакционной смеси получают 4-(2-фторбензилокси)бензальдегид с 75% выходом в виде желтого масла. Продукт имеет ГХ чистоту 92,1 (% по площади, см. пример 16 А) и содержание 3-(2-фторбензил)4-(2 фторбензилокси)бензальдегида 0,25% по массе, определенное ГХ (см. пример 16 В). 15.1.b) Методика J. Agric. Food Chem, 27, 4, 1979. 4-(2-фторбензилокси)бензальдегид (IVb) получают, в соответствии с примером 14.1.b, из 2 фторбензилхлорида (18,0 г, 123 ммоль), 4-гидроксибензальдегида (15,3 г, 125 ммоль), NaOH (5,0 г, 12 ммоль) и этанола (125 мл). Смесь нагревают в течение 25 мин при кипении с обратным холодильником и выдерживают при температуре кипения при перемешивании в течение 12 ч. После обработки реакционной смеси, в соответствии с примером 14.1.b, 4-(2-фторбензилокси)бензальдегид получают в виде желтого твердого вещества с 90,0% выходом. Продукт имеет ГХ чистоту 90,4 (% по площади, см. пример 16 А) и содержание 3(2-фторбензил)-4-(2-фторбензилокси)бензальдегида (Vb) 0,14% по массе, определенное ГХ (см. пример 16 В). 15.2 Получение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (Ib) и его метансульфонатной соли (Id). 15.2.а) Методика J. Med. Chem, 1998, 41, 579, способ А(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид (Ib) получают, следуя методике примера 14.2.а, используя 4-(2-фторбензилокси)бензальдегид (10 ммоль, полученный в примере 15.1 а) вместо 4(3-фторбензилокси)бензальдегида.(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид получают с 67,3% выходом в виде белого твердого вещества. Продукт имеет ВЭЖХ чистоту 86,7 (% по площади, см. пример 17 А) и содержание(10,5 мл) нагревают до 50C и выдерживают при этой температуре, с получением прозрачного раствора. При перемешивании в течение 15 мин добавляют метансульфоновую кислоту (0,48 г, 5,01 ммоль). Затем гетерогенную смесь охлаждают при перемешивании до 20C в течение 2 ч. Спустя 1 ч при 20C, твердое вещество отделяют фильтрованием, сушат при пониженном давлении, с получением метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида в виде белого твердого вещества с- 19017123 89,1% выходом. Продукт имеет ВЭЖХ чистоту 96,9 (% по площади, см. пример 17 А) и содержание метансульфоната (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (IId) 0,14 мас.%,определенное ВЭЖХ (см. пример 17 В). 15.2.b) Методика J. Med. Ghent. 1998 41. 579. Способ A.(S)-2-[4-(2-Фторбензилокси)бензиламино]пропанамид получают в виде белого твердого вещества с 58,8% выходом. Продукт имеет ВЭЖХ чистоту 83,8 (% по площади, см. пример 17 А) и содержание (S)-2[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (IIb) 0,15% по массе, определенное ВЭЖХ (см. пример 17 В).(S)-2-[4-(2-фторбензилокси)бензиламино]пропанамид (Ib) преобразовывают в соответствующий метансульфонат (Id) с 89,4% выходом в виде белого твердого вещества. Продукт имеет ВЭЖХ чистоту 95,2(% по площади, см. пример 17 А) и содержание метансульфоната (S)-2-[3-(2-фторбензил)-4-(2 фторбензилокси)бензиламино]пропанамида 0,11 мас.%, определенное ВЭЖХ (см. пример 17 В). Пример 16 А. ГХ определение чистоты 4-(3-фторбензилокси)бензальдегида и 4-(2-фторбензилокси) бензальдегида. Исследуемый препарат. Растворяют около 100 мг образца в 10 мл метиленхлорида. Хроматографические условия Хроматографическую процедуру осуществляют используя: капиллярную колонку из кварцевого стекла 60 м в длину и внутренним диаметром 0,32 мм. RTX 35(35% дифенил-65% диметилполисилоксан). Толщина пленки=0,25 мкм; гелий в качестве газа-носителя при давлении 150 кПа; разделенный поток 25 мл/мин; инжекторную температуру 290C; температуру детектора (FID) 290C; при следующей температурной программе: Методика. Вводят 1 мкл исследуемого препарата. Записывают хроматограмму и вычисляют чистоту продукта путем вычисления процента по площади. Определение примесей. 4-(3-фторбензилокси)бензальдегид (IVa): Время удерживания: Время удерживания 4-(3-фторбензилокси)бензальдегида составляет около 17. Относительное время удерживания 4-гидроксибензальдегида составляет около 0,52. Относительное время удерживания 4-(2-фторбензилокси)бензальдегида составляет около 0,98. Относительное время удерживания 4-(4-фторбензилокси)бензальдегид составляет около 1,01. Относительное время удерживания 4-бензилоксибензальдегида составляет около 1,02. Относительное время удерживания 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида составляет около 1,78. 4-(2-фторбензилокси)бензальдегид (IVb): Время удерживания: Время удерживания 4-(2-фторбензилокси)бензальдегида составляет около 17. Относительное время удерживания 4-гидроксибензальдегида составляет около 0,53. Относительное время удерживания 4-(3-фторбензилокси)бензальдегида составляет около 1,02. Относительное время удерживания 4-(4-фторбензилокси)бензальдегида составляет около 1,03. Относительное время удерживания 4-бензилоксибензальдегида составляет около 1,04. Относительное время удерживания 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида составляет около 1,81. Пример 16 В. ГХ определение содержания 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида (Vb) в 4-(2 фторбензилокси)бензальдегиде (IVb) и 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида (Va) в 4-(3 фторбензилокси)бензальдегиде (IVa). Известным сопутствующим веществом, учитываемым для 4-(2-фторбензилокси)бензальдегида, является 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегид, для 4-(3-фторбензилокси)бензальдегида яв- 20017123 ляется 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегид. Определение осуществляют в соответствии со следующими условиями. Раствор внутреннего стандарта Готовят 3,4,5-триметоксибензальдегидный раствор с концентрацией 1,5 мг/мл в метиленхлориде(IS). Стандартный раствор для определения 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида в 4(2-фторбензилокси)бензальдегиде Аккуратно взвешивают около 20 мг стандартного раствора 3-(2-фторбензил)-4-(2 фторбензилокси)бензальдегида и 20 мг стандартного раствора 4-(2-фторбензилокси)бензальдегида в 20 мл пикнометре, растворяют и разбавляют до объема разбавителем; перемещают 500 мкл полученного раствора в 5 мл пикнометра, добавляют 500 мкл IS раствора и разбавляют до объема разбавителем, с получением раствора, содержащего 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегид и 4-(2 фторбензилокси)бензальдегид в концентрации около 100 мкг/мл (соответствующий около 0,10%). Стандартный раствор для определения 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида в 4-(3-фторбензилокси)бензальдегиде Аккуратно взвешивают около 20 мг стандартного раствора 3-(3-фторбензил)-4-(3 фторбензилокси)бензальдегида и 20 мг стандартного раствора 4-(3-фторбензилокси)бензальдегида в 20 мл пикнометре, растворяют и разбавляют до объема разбавителем; перемещают 500 мкл полученного раствора в 5 мл пикнометра, добавляют 500 мкл IS раствора и разбавляют до объема разбавителем, с получением раствора, содержащего 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегид и 4-(3 фторбензилокси)бензальдегид в концентрации около 100 мкг/мл (соответствующий около 0,10%). Исследуемый раствор Аккуратно взвешивают около 500 мг исследуемого продукта в 5 мл пикнометре, добавляют 500 млIS раствора, растворяют и разбавляют до объема разбавителем, с получением раствора, имеющего известную концентрацию около 100 мг/мл. Хроматографические условия: Хроматографическую процедуру осуществляют используя: колонку: капиллярная колонка из кварцевого стекла RTX 35 (35% дифенил-65% диметилполисилоксана) 60 м в длину, 0,32 мм ВД, толщина пленки=0,25 мкм; носитель (гелий) при давлении 150 кПа; разделенный поток 25 мл/мин; инжекторную температуру 290C; температуру детектора (FID) 290C; температурную программу: 0-5 мин изотермический при 150C, 5-11 мин линейный от 150 до 240C при скорости 15C/мин, 11-19 мин изотермический при 240C, 19-21 мин линейный от 240 до 290C при скорости 30C/мин, 21-40 мин изотермический при 290C; разбавитель: метиленхлорид вводимый объем 1 мкл. Методика: Вводят холостую пробу (разбавитель), стандартный раствор, исследуемый раствор и записывают хроматограммы. В стандартной хроматограмме устанавливается, что время удерживания 4-(2-фторбензилокси)бензальдегида составляет около 18 мин; относительное время удерживания 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида составляет около 1,7 или время удерживания 4-(3-фторбензилокси)бензальдегида составляет около 18 мин; относительное время удерживания 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида составляет около 1,7. Относительное время удерживания 3,4,5-триметоксибензальдегида (IS) составляет около 0,7. Вычисляют процентное содержание 3-(2-фторбензил)-4-(2-фторбензилокси)бензальдегида в исследуемом 4-(2-фторбензилокси)бензальдегиде или 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида в исследуемом 4-(3-фторбензилокси)бензальдегиде путем вычисления внутреннего стандарта. Значение предела количественного определения (LOQ) для (3-(2-фторбензил)-4-(2 фторбензилокси)бензальдегида и 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида составляет 0,005 мас.%. Значение предела обнаружения (LOD) для обеих рассматриваемых примесей составляет 0,0025 мас.%. Пример 17 А. ВЭЖХ определение чистоты (S)-2-[4-(3-фторбензилокси)бензиламино 3 пропанамида(сафинамид) (Ia), его метансульфоната (Ic), (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (ралфинамид) (Ib) и его метансульфоната (Id). Следующая хроматографическая методика пригодна как для формы свободного основания (Ia, Ib),так и для метансульфонатной соли (Ic, Id) данных продуктов. Разбавитель: Подвижная фаза.- 21017123 Исследуемый раствор: Аккуратно взвешивают около 25 мг продукта в 25 мл пикнометре, растворяют и разбавляют до объема разбавителем, с получением раствора, имеющего известную концентрацию около 1,0 мг/мл. Хроматографические условия Хроматографическую процедуру осуществляют используя: Колонку: Waters Symmetry C8, 150 4,6 мм, 5 мк; детекцию: УФ 220 нм; температуру колонки: 30C подвижную фазу: 40% растворителя А+10% растворителя В+50% растворителя С, содержащую 1,0 г/л октансульфоната натрия; растворитель А: буферный раствор=KH2PO4 0,05 М; растворитель В: ацетонитрил; растворитель С: метанол; изократическое элюирование, время прогона: 60 мин; скорость потока: 1,0 мл/мин; вводимый объем: 10 мкл. Методика Вводят исследуемый раствор, записывают хроматограмму и вычисляют чистоту продукта путем вычисления процента по площади. Определение (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид) и сопутствующих примесей Время удерживания: Время удерживания (S)-2-[4-(3-Фторбензилокси)бензиламино]пропанамида составляет около 5,5 мин. Относительное время удерживания (S)-2-[4-(3-фторбензилокси)бензиламино]пропионовой кислоты составляет около 0,73. Относительное время удерживания(S)-2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида составляет около 4, 08. Определение (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида (ралфинамид) и сопутствующих примесей Время удерживания: Время удерживания (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида составляет около 5,5 мин. Относительное время удерживания (S)-2-[4-(2-фторбензилокси)бензиламино]пропионовой кислоты составляет около 0,73. Относительное время удерживания(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамидных образцах (свободное основание и метансульфонат) осуществляют в соответствии со следующими условиями: Стандартный раствор для определения(S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида в (S) -2-[4-(2-фторбензилокси)бензиламино]пропанамиде: Аккуратно взвешивают около 30 мг стандартного образца метансульфоната (S)-2-[3-(2 фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида и 20 мг стандартного образца (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида в 50 мл пикнометре, растворяют и разбавляют до объема разбавителем; разбавляют 1,0 мл полученного раствора до 20 мл разбавителем (1 е разбавление); разбавляют 1,0 мл последний раствор до 20 мл разбавителем (2 е разбавление), с получением раствора, содержащего 2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамид (сколо 0,12%) в концентрации около 1,20 мкг/мл и метансульфонат (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида в концентрации около 1,00 мкг/мл (около 0,10%). Стандартный раствор для определения метансульфоната (S)-2-[3-(2-фторбензил)-4-(2 фторбензилокси)бензиламино]пропанамида в метансульфонате- 22017123 Аккуратно взвешивают около 30 мг стандартного образца метансульфоната (S)-2-[3-(2 фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида и 20 мг стандартного образца метансульфоната (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида в 50 мл пикнометре, растворяют и разбавляют до объема разбавителем; разбавляют 1,0 мл полученного раствора до 20 мл разбавитетем (1 е разбавление); разбавляют 1,0 мл последнего раствора до 20 мл разбавителя (2 е разбавление), с получением раствора, содержащего 2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамид (около 0,15% в виде метансульфоновой соли) в концентрации около 1,20 мкг/мл и метансульфонат (S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида в концентрации около 1,00 мкг/мл (около 0,10%). Стандартный раствор для определения(S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида в (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамиде: Аккуратно взвешивают около 24 мг стандартного образца (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида и 20 мг стандартного образца(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида в 50 мл пикнометре, растворяют и разбавляют до объема разбавителя; разбавляют 1,0 мл полученного раствора до 20 мл разбавителем (1 е разбавление); разбавляют 1,0 мл последнего раствора до 20 мл разбавителем (2 е разбавление), с получением раствора, содержащего 2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамид (около 0,12%) в концентрации около 1,20 мкг/мл и метансульфонат (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида в концентрации около 1,00 мкг/мл (около 0,10%). Стандартный раствор для определения метансульфоната (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида в метансульфонате(S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида: Аккуратно взвешивают около 24 мг стандартного образца (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида и 20 мг стандартного образца метансульфоната (S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида в 50 мл пикнометре, растворяют и разбавляют до объема разбавителем; разбавляют 1,0 мл полученного раствора до 20 мл разбавителем (1 е разбавление); разбавляют 1,0 мл последнего раствора до 20 мл разбавителем (2 е разбавление), с получением раствора, содержащего 2-[3-(3-фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамид (около 0,15% в виде метансульфоновой соли) в концентрации около 1,20 мкг/мл и метансульфонат (S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида в концентрации около 1,00 мкг/мл (около 0,10%). Исследуемый раствор Аккуратно взвешивают около 25 мг исследуемого продукта в 25 мл пикнометре, растворяют и разбавляют до объема разбавителем, с получением раствора, имеющего известную концентрацию около 1,0 мг/мл. Хроматографические условия: Хроматографическую процедуру осуществляют используя: колонку: Waters Simmetry C8 1504,6 мм, 5 мк, или эквивалентную; температуру колонки: 30C; подвижную фазу: смесь 40% растворителя А:10% растворителя В:50% растворителя С, содержащую 1 г/л октансульфоната натрия; растворитель А: буферный раствор 0,05 М KH2PO4; растворитель В: ацетонитрил; растворитель С: метанол; изократическое элюирование; время прогона: 60 мин; скорость потока: 1,0 мл/мин; детекцию: УФ 220 нм; вводимый объем: 100 мкл; разбавитель: подвижная фаза Методика Вводят холостую пробу (разбавитель), стандартный раствор, исследуемый раствор и записывают хроматограммы. В стандартной хроматограмме устанавливают следующие параметры пригодности системы: время удерживания (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида составляет около 5,2 мин;(S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида составляет около 5,1 или время удерживания (S)-2-[4-(3 Фторбензилокси)бензиламино]пропанамида составляет около 5,5 мин;(S)-2-[3-(3-фторбензил)-4-(3-фторбензил- 23017123 окси)бензиламино]пропанамида составляет около 4,1. Подбирают подвижную фазу таким образом, чтобы достичь пригодности системы. Вычисляют процентное содержание(S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (свободное основание и метансульфонат) в исследуемых образцах (S)-2[4-(2-фторбензилокси)бензиламино]пропанамида (свободное основание и метансульфонат) и (S)-2-[3-(3 фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида (свободное основание и метансульфонат) в исследуемых образцах (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (свободное основание и метансульфонат) путем вычисления внешнего стандарта. Значение предела количественного определения (LOQ) для (S)-2-[3-(2-фторбензил)-4-(2 фторбензилокси)бензиламино]пропанамида и для(S)-2-[4-(2-фторбензилокси)бензиламино]пропанамиде и (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамиде составляет 0,004 мас.%. Значение предела количественного определения (LOQ) для метансульфоната (S)-2-[3-(2 фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида и для метансульфоната (S)-2-[3-(3 фторбензил)-4-(3-фторбензилокси)бензиламино]пропанамида в соответствующих метансульфонате (S)2-[4-(2-фторбензилокси)бензиламино]пропанамиде и метансульфонате(S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида составляет 0,005 мас.%. Значение предела обнаружения всех рассматриваемых примесей составляет 0,001 мас.%. Пример 18. ВЭЖХ определение энантиомерной чистоты метансульфоната(S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида (ралфинамид) (Id). Энантиомерную чистоту образца определяют ВЭЖХ. Определение осуществляют в соответствии со следующим: Стандартный раствор 1. Растворяют около 5,3 мг стандартного образца метансульфоната(R)-2-[4-(2 фторбензилокси)бензиламино]пропанамида в 25 мл подвижной фазы. Стандартный раствор 2. Растворяют около 8,0 мг стандартного образца метансульфоната(S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида и 0,2 мл стандартного раствора 1 в 50 мл подвижной фазы. Концентрация метансульфоната (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида составляет около 0,5%,вычисленная относительно концентрации метансульфоната(S)-2-[4-(2 фторбензилокси)бензиламино]пропанамида. Исследуемые растворы 1 и 2: В двух экземплярах растворяют около 8,0 мг исследуемого продукта в 50 мл подвижной фазы. Хроматографические условия: Колонка: Chiralpak WH 250 мм 4,6 мм, В.Д. 5 мкм; температура колонки: 45C; подвижная фаза: 0,2 5 мМ CuSO4 (аккуратно взвешивают около 40 мг CuSO4 в 1000 мл воды)/МеОН 60/40; изократическое элюирование; скорость потока: 1,0 мл/мин; детекция: УФ 230 нм; вводимый объем: 10 мкл; время прогона: 15 мин. Методика: Анализируют один раз холостую пробу (подвижная фаза), стандартный раствор 2 дважды, исследуемые растворы 1 и 2 один раз и устанавливают, что для стандартных введений, OCO% (относительное стандартное отклонение %) для процента по площади метансульфоната (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида меньше 2,0%; как для стандартных растворов, так и для растворов образцов, для каждого введения процент по площади главного пика находится в диапазоне между средним значением 0,1%. Вычисляют содержание(R)-2-[4-(2 фторбензилокси)бензиламино]пропанамида в качестве среднего значения двух определений. Время удерживания: Время удерживания (S)-2-[4-(2-фторбензилокси)бензиламино]пропанамида составляет около 5,7 мин. Относительное время удерживания (R)-2-[4-(2-фторбензилокси)бензиламино]пропанамида составляет около 1,7.- 24017123 Пример 19. ВЭЖХ определение энантиомерной чистоты метансульфонада (S)-2-[4-(3 фторбензилокси)бензиламино]пропанамида (сафинамид) (Ic). Энантиомерную чистоту образца определяют ВЭЖХ. Определение осуществляют в соответствии со следующими условиями: Исследуемый раствор: Растворяют около 10 мг исследуемого образца в 10 мл подвижной фазы. Хроматографические условия: Колонка: Chiralpak WH 250 мм 4,6 мм, В.Д. 10 мкм; температура колонки: 50C; подвижная фаза: 0,25 мМ CuSO4 изократическое элюирование; скорость потока: 1,0 мл/мин; детекция: УФ 2 00 нм; вводимый объем: 10 мкл; время прогона: 30 мин. Методика: Вводят исследуемый раствор и вычисляют максимальный ответ энантиомеров в виде процента по площади. Время удерживания (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида составляет около 9,2 мин. Относительное время удерживания (R)-2-[4-(3-Фторбензилокси)бензиламино]пропанамида составляет около 1,9. Пример 20. Анализ цитохрома Р 450. Ингибирование пяти самых важных изоформ цитохрома Р 450 (CYP1A2, CYP2C9, CYP2C19,CYP2D6 и CYP3A4), связанное с лекарственным метаболизмом, измеряли, используя специфические субстраты, которые становятся флуоресцирующими в результате CYP метаболизма (Gentest Kit анализ). Соединения исследовали в 96-луночном планшете, содержащем инкубационный/NADPH регенерирующий буфер. Добавляли специфические человеческие рекомбинантные изоферменты и субстраты и выдерживали при 37C в течение 15 мин для CYP1A2/CEC, 40 мин для CYP2E1/MFC, 45 мин дляCYP2C9/MFC и 30 мин для других CYP450. Специфические субстраты представляли собой следующие: 3-циано-7-этоксикумарин (CYP2C19 и CYF1A2), 7-метокси-4-трифторметилкумарин (CYP2C9), 3[2-(N,N-диэтил-N-метиламино)этил]-7-метокси-4-метилкумарин(CYP3A4). Планшеты считывали на планшет-ридере Victor (Perkin Elmer) при подходящих длинах волн испускания/возбуждения, и определяли IC50 (концентрацию, ингибирующую до 50% ферментативной активности). Результаты представлены в табл. 1 и 2. Пример 21. Анализ на цитотоксичность в клеточной линии человеческих нейробластом SH-SY-5Y В момент времени ноль клетки высевали на 1,104/см 2 в 96-луночный планшет в питательной средеDMEM+10% подогретого инактивированного FBS+2 мМ 1-глутамина+100 Ед/мл-100 мкг/мл пенициллин/стрептомицина. Через 72 ч на субконфлюентной фазе роста среду удаляли, и клетки инкубировали в течение 24 ч при 37C в 180 мкл нейробазальной среды+2 мМ 1-глутамин (Life Techonologies) с или без исследуемых соединений (20 мкл по меньшей мере 5 концентраций в трех экземплярах). В конце инкубации к клеточной среде непосредственно добавляли 20 мкл красителя Alamar Blue(AlamarBlue Assay Kit, Promega). Четыре часа спустя определяли цитотоксичность путем измерения флуоресценции при длине волны возбуждения 530 нм и длине волны испускания 595 нм, используя планшет-ридер Tecan. Перед и по окончании обработки культуры изучали под микроскопом, используя Olympus 170 инвертированный световой микроскоп, подсоединенный к анализатору изображений (Image Pro Plus, 5.1),для определения клеточной морфологии. Результаты представлены в табл. 1 в виде концентрации, показывающей 50% смертность. Пример 22. HERG ток в трансфицированных клеточных линиях СНО. Ингибирование HERG тока исследовали в СНО клетках, стабильно экспрессирующих рекомбинантный HERG канал. Для определения эффекта исследуемых соединений на HERG токи клетки фиксировали на -80 мВ,деполяризовали до 0 мВ в течение 5 с, давая возможность активации HERG тока, и реполяризовали до 50 мВ в течение 5 с, давая возможность деактивироваться остаточному току HERG. Эту процедуру повторяли с частотой 0,06 Гц. Амплитуду тока при реполяризации (HERG остаточный ток) измеряли перед и после воздействия исследуемого соединения. Ингибирование тока вычисляли как разницу между амплитудой HERG остаточного тока, измерен- 25017123 ной по окончании периода перфузии холостого раствора, и HERG остаточным током, измеренным по окончании периода перфузии исследуемого соединения (когда достигается эффект стационарного состояния), поделенной на контрольный HERG остаточный ток. Кривые концентрации лекарственного средства-ингибирование были получены путем нанесения на график тонированных блоков в зависимости от концентраций лекарственного средства. Кривые зависимости доза-ответ строили по данным тонических блоков, в соответствии с логистическим уравнением:y=А 2+(А 1-А 2)/[1+ (х/IC50)Р]. А 1 и А 2 представляют собой фиксированные значения 0 и 1, соответствующие 0 и 100% ингибирования тока, х является концентрацией лекарственного средства, IC50 представляет собой концентрацию лекарственного средства, приводящую к 50% ингибированию тока, и p является соответствующим угловым коэффициентом. Результаты представлены в табл. 1. Пример 23. Тест максимального электрошока, (MISS) у мышей. Тест максимального электрошока (MES) применяется обычно в исследовании противоэпилептических лекарственных средств на грызунах. Животные и оборудование: Использовали мужских особей мышей CD1, массой 25 г. Следовали методике, описанной White et al. (White H.S., Woodhead J.H., Franklin M.R., Swinyard E.A., and Wolf H.H.Antiepileptic Drugs (1995) 4th ed. : 99-110, Raven Press, Ltd., New York). Чтобы подать электрический стимул достаточный, для получения реакции тонической разгибающей мышцы задней конечности по меньшей мере 97% контрольных животных, использовали электрошоковый генератор Ugo Basile (Model ЕСТUNIT 7801). Стимулы подавали внутриушным способом посредством зажимных электродов у мышей(0,7 с 40 мА шока с последовательностью импульсов 80 Гц, имеющей длительность импульсов 0,4 мс). Сильный эффект соединений, введенных внутрибрюшинно или перорально за 15-60 мин до индукции MES, исследовали и сравнивали с контрольной плацебо-группой. Изучали десять мышей на группу. Полное подавление функции тонической разгибающей мышцы задней конечности, вызывающей судороги, было принято в качестве доказательства противосудорожной активности. Соединения данного изобретения вводили перорально или внутрибрюшинно в дозах 3-30 мг/кг. Результаты представлены в табл.3 и 4 как % защиты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения (S)-2-[4-(3-фторбензилокси)бензиламино]пропанамида (сафинамид) и (S)-2-[4(2-фторбензилокси)бензиламино]пропанамида (ралфинамид) высокой степени чистоты формулы (Ia) и и их солей фармацевтически приемлемой кислоты, отличающийся тем, что промежуточное соединение основания Шиффа, соответственно формулы (VIa) или (VIb) подвергают каталитической гидрогенизации газообразным водородом в присутствии гетерогенного катализатора в протонном органическом растворителе, и когда сафинамид или ралфинамид получают в форме свободного основания, необязательно преобразовывают указанную выше форму свободного основания в его соль фармацевтически приемлемой кислоты. 2. Способ по п.1, где каталитическую гидрогенизацию осуществляют, используя гетерогенный катализатор, выбранный из никелевого, родиевого, платинового и палладиевого катализаторов, на инертной подложке в присутствии растворителя, выбранного из алифатических (C1-C5)алканолов. 3. Способ по п.2, где растворитель выбран из метанола, этанола и изопропанола. 4. Способ по п.1, где катализатор является палладиевым или платиновым катализатором. 5. Способ по п.4, где катализатор является платиновым катализатором. 6. Способ по любому из пп.1-4, где катализатор представляет собой влажный 5% Pt/C (50% H2O) или влажный 10% Pd/C (50% H2O). 7. Способ по любому из пп.1-6, где фармацевтически приемлемой кислотой является метансульфоновая кислота. 8. Способ по любому из пп.1-7, где давление водорода находится в диапазоне от 1 до 10 бар и тем- 26017123 пература реакции находится в диапазоне от 10 до 70C. 9. Способ по п.8, где давление водорода находится в диапазоне от 3 до 6 бар и температура реакции находится в диапазоне от 25 до 40C. 10. Способ по любому из пп.1-9, где каталитическую гидрогенизацию осуществляют на промежуточном соединении основания Шиффа (VIa) или (VIb), полученном путем иминоалкилирования 4-(3 фторбензилокси)бензальдегида (IVa) или 4-(2-фторбензилокси)бензальдегида (XVb)L-аланинамидом в присутствии протонного органического растворителя. 11. Способ по п.10, где L-аланинамид применяют в виде его кислотно-аддитивной соли в присутствии основания в количестве, достаточном для высвобождения L-аланинамида из его соли. 12. Способ по п.10, где каталитическую гидрогенизацию промежуточного соединения основания Шиффа осуществляют в той же реакционной смеси, полученной в результате завершения реакции иминоалкилирования в условиях, которые вызывают осаждение указанного выше промежуточного соединения основания Шиффа, с получением суспензии указанного выше промежуточного соединения в том же реакционном растворителе. 13. Способ по п.10, где промежуточное соединение основания Шиффа, полученное в результате завершения реакции иминоалкилирования, выделяют перед проведением стадии каталитической гидрогенизации. 14. Способ по любому из пп.1-13, где 4-(3-фторбензилокси)бензальдегид или 4-(2 фторбензилокси)бензальдегид формулы (IVa) или (IVb), используемые в качестве исходного вещества для получения промежуточного соединения основания Шиффа формулы (VIa) или (VIb), содержат менее 0,03 мас.% соответствующих примесей 3-(3-фторбензил)-4-(3-фторбензилокси)бензальдегида (Va) и 3-(2 фторбензил)-4-(2-фторбензилокси)бензальдегида (Vb) 15. Способ по п.14, где 4-(3-фторбензилокси)бензальдегид или 4-(2-фторбензилокси)бензальдегид формулы (IVa) или (IVb) содержат 0,01 мас.% или меньше соответствующих примесей (Va) и (Vb). 16. Способ по любому из пп.14 и 15, где 4-(3-фторбензилокси)бензальдегид (IVa) или 4-(2 фторбензилокси)бензальдегид (IVb) получают путем алкилирования 4-гидроксибензальдегида соответственно 3-фторбензильным или 2-фторбензильным производным (IIIa) или (IIIb) где Y является уходящей группой, включающей Cl, Br, I, OSO2CH3 и OSO2-C6H4-пСН 3, в присутствии основания и подвергают кристаллизации перед использованием на следующей стадии реакции. 17. Способ по п.16, где Y представляет собой Cl. 18. Способ по любому из пп.16 и 17, где кристаллизацию осуществляют путем добавления инертного органического осадителя к раствору 4-(3-фторбензилокси)бензальдегида (IVa) или 4-(2 фторбензилокси)бензальдегида (IVb) в инертном органическом растворителе. 19. Способ по п.18, где инертный органический осадитель представляет собой н-гексан и инертный органический растворитель представляет собой толуол. 20. Способ по любому из пп.16 и 17, где кристаллизацию осуществляют путем растворения 4-(3 фторбензилокси)бензальдегида (IVa) или 4-(2-фторбензилокси)бензальдегида (IVb) в горячем растворителе, который представляет собой циклогексан или простой ди(C3-С 4)алкиловый эфир, и затем охлаждают раствор при температуре 10-15C. 21. Способ по п.20, где кристаллизацию осуществляют путем растворения в горячем ди(С 3 С 4)алкиловом эфире при кипячении с обратным холодильником и затем охлаждают раствор при 10-15C. 22. Способ по любому из пп.16-21, где реакцию алкилирования осуществляют в условиях межфазового переноса.- 27017123 23. Способ по п.22, где алкилирование в условиях межфазового переноса осуществляют в системе твердое вещество/жидкость, где реагенты и катализатор фазового переноса растворяют в жидкой органической фазе и фаза твердого вещества представляет собой неорганическое основание или соль 4 гидроксибензальдегида указанного выше неорганического основания. 24. Способ по п.22, где алкилирование в условиях межфазового переноса осуществляют в системе жидкость/жидкость, где алкилирующий реагент 3-фторбензильное или 2-фторбензильное производное формулы (IIIa) или (IIIb) растворяют в жидкой органической фазе и 4-гидроксибензальдегид растворяют в водной фазе в виде соли неорганического основания. 25. Способ по любому из пп.22-24, где катализатор фазового переноса выбирают из четвертичной аммониевой или фосфониевой солей или полиэтиленгликолей с низкой молекулярной массой. 26. Способ по п.25, где количество используемого катализатора фазового переноса находится в диапазоне от 0,02 до 1 моль на моль 4-гидроксибензальдегида. 27. Способ по п.26, где количество катализатора фазового переноса находится в диапазоне от 0,1 до 1 моль на моль 4-гидроксибензальдегида. 28. Способ по любому из пп.23-27, где органический растворитель жидкой органической фазы выбирают из простых диалкиловых эфиров и ароматических углеводородов. 29. Способ по любому из пп.23-28, где молярное соотношение между алкилирующим реагентом формулы (IIIa) или (IIIb) и 4-гидроксибензальдегидом находится в диапазоне от 0,6 до 1,5. 30. Способ по любому из пп.23-29, где температура реакции находится в диапазоне от 60 до 160C. 31. Способ по любому из пп.23-30, где неорганическое основание выбирают из Na2CO3, K2CO3,NaOH и KOH, температура находится в диапазоне от 80 до 120C, и молярное соотношение между алкилирующим реагентом формулы (IIIa) или (IIIb) и 4-гидроксибензальдегидом находится в диапазоне от 0,9 до 1,1. 32. Способ по любому из пп.1-31, где сафинамид или ралфинамид или их соли фармацевтически приемлемой кислоты имеют содержание соответствующей примеси (S)-2-[3-(3-фторбензил)-4-(3 фторбензилокси)бензиламино]пропанамида (IIa) и (S)-2-[3-(2-фторбензил)-4-(2-фторбензилокси)бензиламино]пропанамида (IIb) или их солей фармацевтически приемлемой кислоты ниже 0,03 мас.%. 33. Способ по п.32, где содержание соответствующей примеси формулы (IIa) и (IIb) в виде фармацевтически приемлемой соли ниже 0,01 мас.%. 34. Способ по любому одному из пп.32 и 33, где фармацевтически приемлемой кислотой является метансульфоновая кислота и содержание соответствующей примеси формулы (IIa) и (IIb) в виде соли метансульфоновой кислоты ниже 0,01 мас.%. 35. Основание Шиффа формулы (VIa) или (Vlb)
МПК / Метки
МПК: C07C 233/13, C07C 231/10, A61K 31/165
Метки: получения, способ, 2-фторбензилокси)бензиламино]пропанамидов, 2-[4-(3
Код ссылки
<a href="https://eas.patents.su/29-17123-sposob-polucheniya-2-4-3-i-2-ftorbenziloksibenzilaminopropanamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения 2-[4-(3- и 2-фторбензилокси)бензиламино]пропанамидов</a>
Предыдущий патент: Сироп, используемый для изготовления напитков на основе воды, насыщенной кислородом (варианты)
Следующий патент: 8-бета-замещенные эстратриены в качестве селективно активных эстрогенов
Случайный патент: Способ и установка для очистки газа и продукты, получаемые с помощью этого способа












