8-бета-замещенные эстратриены в качестве селективно активных эстрогенов
Номер патента: 17124
Опубликовано: 30.10.2012
Авторы: Тиме Ина, Мун Ханс-Петер, Прелле Катя, Петерс Олаф, Брэюр Нико, Фритцемайер Карл-Генрих
Формула / Реферат
1. Производные 8β-замещенного эстра-1,3,5(5)-триена общей формулы I
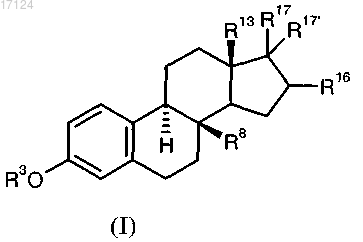
в которой R3 означает атом водорода,
R8 представляет собой винил, этинил или проп-1-инил,
R13 представляет собой метил или этил,
R16 представляет собой атом фтора в α-положении,
R17 и R17' в каждом случае независимо друг от друга представляют собой атом водорода и группу гидрокси.
2. Соединения общей формулы I по п.1, выбранные из
8β-винил-16α-фтор-эстра-1,3,5(10)-триен-3,17α-диол или
8β-винил-16α-фтор-эстра-1,3,5(10)-триен-3,17β-диол.
3. Фармацевтическая композиция, содержащая по крайней мере одно соединение по любому из пп.1 или 2, а также фармацевтически совместимый носитель.
4. Применение соединений общей формулы I, как определено в любом из пп.1 или 2, в качестве лекарственного средства.
5. Применение соединений общей формулы I, как определено в любом из пп.1 или 2, для получения фармацевтических агентов.
6. Применение по п.5, предназначенное для получения фармацевтического агента для лечения заболеваний и состояний, индуцированных недостатком эстрогена у женщин и у мужчин.
7. Применение по п.5, предназначенное для получения фармацевтического агента для лечения пери- и постменопаузальных симптомов.
8. Применение по п.5, предназначенное для получения фармацевтического агента для in vitro лечения бесплодия у женщин.
9. Применение по п.5, предназначенное для получения фармацевтического агента для in-vivo лечения бесплодия у женщин.
10. Применение по п.5, предназначенное для получения фармацевтического агента для терапии симптомов, индуцированных недостатком гормонов при дисфункции яичников, которая вызвана хирургическим вмешательством, приемом лекарственных средств.
11. Применение по п.5, предназначенное для получения фармацевтического агента для гормонозаместительной терапии (ГЗТ).
12. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии ревматоидного артрита, рассеянного склероза и волчанки.
13. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии воспалительных заболеваний кишечника.
14. Применение по п.13, где воспалительное заболевание кишечника представляет собой болезнь Крона.
15. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии воспалительных заболеваний кожи.
16. Применение по п.15, где воспалительное заболевание кожи представляет собой псориаз.
17. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии сердечно-сосудистых заболеваний.
18. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии артериосклероза, высокого кровяного давления и гипертензивной кардиопатии.
19. Применение по п.5, предназначенное для получения фармацевтического агента для предотвращения и лечения гиперплазии предстательной железы.
20. Применение по п.5, предназначенное для получения фармацевтического агента для лечения заболеваний иммунной системы.
21. Применение по п.5, предназначенное для получения фармацевтического агента для лечения эндометриоза.
22. Применение по п.5, предназначенное для получения фармацевтического агента для лечения рака толстого и тонкого кишечника.
23. Применение по п.5, предназначенное для получения фармацевтического агента для стимуляции роста волос.
Текст
8-БЕТА-ЗАМЕЩЕННЫЕ ЭСТРАТРИЕНЫ В КАЧЕСТВЕ СЕЛЕКТИВНО АКТИВНЫХ ЭСТРОГЕНОВ их применению в качестве фармацевтически активных ингредиентов, которые обладают invitro более высокой аффинностью по отношению к препаратам эстрогенного рецептора из предстательной железы крыс, чем к препаратам эстрогенного рецептора из матки крыс, а также предпочтительным действием in vivo в яичнике по сравнению с маткой, их получению, их терапевтическому применению и к фармацевтическим дозированным формам, которые содержат такие новые соединения.(71)(73) Заявитель и патентовладелец: БАЙЕР ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) 017124 Область техники, к которой относится изобретение Данное изобретение относится к новым производным 8-замещенного эстра-1,3,5(10)-триена общей формулыR3 означает атом водорода,R8 представляет собой винил, этинил или проп-1-инил,R13 представляет собой метил или этил,R16 представляет собой атом фтора в -положении,R17 и R17' в каждом случае независимо друг от друга представляют собой атом водорода и группу гидрокси. Данное изобретение дополнительно относится к применению нового 8-замещенного эстра 1,3,5(10)-триена в качестве фармацевтически активных ингредиентов, которые in vitro обладают более высокой аффинностью по отношению к препаратам эстрогенного рецептора из предстательной железы крыс, чем к препаратам эстрогенного рецептора из матки крыс, а также предпочтительным действием invivo в яичнике по сравнению с маткой, их получению, их терапевтическому применению и фармацевтическим дозированным формам, которые содержат такие новые соединения. Производные 8-замещенного эстра-1,3,5(10)-триена в соответствии с настоящим изобретением представляют собой новый стероидный эстратриен, селективный по отношению к подтипу рецептора эстрогена с улучшенной эффективностью и метаболической стабильностью. Предпосылки создания изобретения Эффективность эстрогенов в лечении симптомов, индуцированных недостатком гормонов, таких,как приливы жара, атрофия органов-мишеней эстрогена и недержание мочи, а также успешное применение терапий на основе эстрогена для предотвращения потери костной массы у женщин в пери- и постменопаузе, является убедительно подтвержденным документальными доказательствами и общепризнанным(Grady и др. 1992, Ann Intern Med 117: 1016-1037). Также подтвержденным является тот факт, что эстроген-заместительная терапия у женщин в периоде постменопаузы или у женщин с дисфункцией яичника,вызванной иными причинами, снижает риск сердечно-сосудистых заболеваний по сравнению с женщинами, которых не подвергали лечению с использованием эстрогена (Grady и др., цит. выше) При традиционной эстроген- или гормонозаместительной терапии (=ГЗТ) природные эстрогены,такие, как эстрадиол, и конъюгированные эстрогены, которые состоят из лошадиной мочи, применяются или сами по себе или в комбинации с гестагеном. Вместо природных эстрогенов также могут использоваться производные, которые получают путем эстерификации, такие как, например, 17-эстрадиолвалерат. По причине стимулирующего воздействия используемых эстрогенов на эндометрий, что приводит к повышению риска эндометриальной карциномы (Harlap, S. 1992, Am J Obstet Gynecol 166: 1986-1992), в гормонозаместительной терапии предпочтительно применяются препараты комбинаций эстроген/гестаген. Гестагенный компонент в комбинации эстроген/гестаген позволяет избежать гипертрофии эндометрия, однако возникновение нежелательных менструальных кровотечений в середине цикла также является связанным с комбинацией, содержащей гестаген Селективные эстрогены представляют более современную альтернативу препаратам комбинации эстроген/гестаген. До сих пор селективные эстрогены определялись как такие соединения, которые обладают эстрогеноподобным воздействием на мозг, кости и сосудистую систему благодаря своему антиутеротропному (то есть антиэстрогенному) частичному воздействию, но не оказывают пролиферативного эффекта на эндометрий. Класс веществ, которые частично соответствуют желаемому профилю селективного эстрогена представляет собой так называемые "Селективные модуляторы эстрогенного рецептора" (SERM) (R. F.Kauffman, H. U. Bryant 1995, DNAP 8 (9): 531-539). В этом случае они являются частичными агонистами рецептора эстрогена подтипа "ER." Однако этот тип вещества является неэффективным в отношении терапии острых постменопаузальных симптомов, таких как приливы жара. В качестве примера SERM можно упомянуть ралоксифен, который недавно был введен для назначения при лечении остеопороза. Для лечения расстройств фертильности у женщин, причиной которых часто являются нарушения функции яичника, вызванные хирургическим вмешательством, приемом лекарственных препаратов и т.п., с применением новых селективных эстрогенов открываются новые возможные способы терапии. Invitro лечение фертильности представляет собой процесс, который был разработан более 20 лет назад. Являются известными многочисленные способы лечения бесплодия, индуцированного яичниками, с по-1 017124 мощью экзогенных гонадотропинов. Путем введения гонадотропинов, таких как FSH (FSH = фолликулостимулирующий гормон), достигается стимуляция яичников, что обеспечивает возможность здорового созревания фолликулов. Фолликул представляет собой функциональную единицу яичника и имеет две цели: он содержит ооциты и обеспечивает возможность их роста и созревания. Образование фолликулов включает развитие фолликула яичника, начиная с зачаточной стадии и до беспрерывного роста антрального фолликула, что представляет собой последнюю стадию перед овуляцией. Только оптимально развитый антральный фолликул может высвобождать зрелый ооцит при овуляции. Пациенты с бесплодием, индуцированным яичниками (PCOS = синдром поликистозных яичников),страдают от нарушения созревания фолликулов, которое ассоциируется как с гормональными, так и овуляторными нарушениями, а также с неадекватно созревшими ооцитами. Количество первичных и вторичных фолликулов в данном случае является приблизительно в два раза выше, чем в нормальном яичнике (Hughesden и др., Obstet. Gynecol. Survey 37, 1982, стр. 59-77). Имеются указания на то, что ранние стадии фолликулогенеза (которые относятся к развитию примордиальных фолликулов до антральных фолликулов) являются независимыми от гонадотропина. Не существует точного объяснения того, на сколько велико влияние паракринных и аутокринных факторов на ранних стадиях фолликулогенеза (Elvin и др., Mol. Cell Endocrinol. 13, 1999, стр. 1035-1048; McNatty и др., J. Reprod. Fertil. Suppl. 54, 1999, стр. 3-16). Гонадотропины, такие, как FSH, являются в основном вовлеченными в последние стадии развития фолликулогенеза при созревании фолликулов, то есть в развитие ранних антральных фолликулов до зрелого фолликула, который может подвергаться овуляции. Бесплодие in vivo и in vitro предпочтительно подвергается лечению с помощью гонадотропинов(FSH и антиэстрогенов) (White и др., J. Clin. Endocrinol. Metab. 81, 1996, стр. 3821-3824). При in vitro лечении бесплодия ооциты удаляются из предовуляторных антральных фолликулов, которые являются способными к созреванию in vitro в ооциты, которые могут подвергаться оплодотворению. После оплодотворения и раннего эмбрионального развития от одного до трех эмбрионов имплантируют в матку женщины. Во многих отношениях лечение с помощью экзогенных гонадотропинов сопровождается многочисленными рисками и побочными эффектами. Самый большой риск заключается в избыточной стимуляции яичников, что в тяжелых случаях может представлять серьезную опасность для жизни (OHSS = синдром гиперстимуляции яичников). Другие побочные эффекты представляют собой высокие затраты на in vitro лечение бесплодия, которые оплачиваются супругами. Негативные побочные эффекты, такие как прибавка веса, вздутие живота, тошнота, рвота и даже еще неизвестный риск развития рака приписываются лечению с помощью гонадотропина. Один из способов избежать упомянутых выше побочных эффектов и рисков заключается в обеспечении созревания и стимуляции in vivo роста фолликулов в случае индуцированного яичниками бесплодия с помощью приемлемого активного ингредиента перед началом лечения при использовании экзогенных гонадотропинов. Бета-рецептор эстрогена (ER) Несколько лет тому назад был открыт эстрогеннный рецептор(ER) в качестве второго подтипа эстрогенного рецептора (Kuiper и др. (1996), Proc. Natl. Acad. Sci. 93: 5925-5930; Mosselman, Dijkema(1996) Febs Letters 392: 49-53; Tremblay и др. (1997), Molecular Endocrinology 11: 353-365). Модель экспрессии ER отличается от таковой для ER (Kuiper и др. (1996), Endocrinology 138: 863-870). ER, таким образом, преобладает над ER в предстательной железе крыс, в то время, как ER преобладает надER в матке крыс. Самые высокие концентрации ER и мРНК были обнаружены в яичниках (Couse и др.Endocrinology 138, 1997, стр. 4612-4613). Другие системы органов со сравнительно более высокой экспрессией ER включают кости (Onoe,Y. и др., 1997, Endocrinology 138: 4509-4512), сосудистую систему (Register, Т. С, Adams, M. R. 1998, J.Steroid Molec Biol 64: 187-191), мочеполовой тракт (Kuiper, G. J. M. и др. 1997, Endocrinology 138: 863870), желудочно-кишечный тракт (Campbell-Thopson 1997, BBRC 240: 478-483), а также яички (Mosselmann, S. и др. 1996 FEBS Lett. 392, 49-53), включая сперматиды (Shugrue и др. 1998, Steroids 63: 498-504). Такое тканевое распределение предполагает, что эстрогеннная регуляция функций органов с помощьюERP является высоко релевантной. Тот факт, что ER является функциональным в этой связи также следует из исследований у ER-(ERKO) или ER-(ERKO)-нокаутных мышей: овариоэктомия вызывает потерю костной массы у ERKO-мышей, которая может быть устранена замещением эстрогена (Kimbro и др. 1998, Abstract OR7-4, Endocrine Society Meeting, New Orleans). Эстрадиол в сосудах крови самокERKO мышей также ингибирует васкулярную среду и пролиферацию клеток гладкой мускулатуры (Iafrati, M. D. и др. 1997, Nature Medicine 3: 545-548). Такие защитные воздействия эстрадиола осуществлялись у ERKO мыши главным образом посредством ER. Тот факт, что ER и ER имеют функционально различное воздействие, был подтвержден после успешного получения ERKO и ERKO мышей. Таким образом, ER играет важную роль в матке взрос-2 017124 лых животных, в ткани молочных желез, в негативной регуляции активности гонадотропина, в то время,как ER в основном связан с процессами физиологии яичников, в частности, с такими, как фолликулогенез и овуляция (Couse и др., Endocrine Reviews 20, 1999, стр. 358-417). Наблюдения за PERKO мышами обеспечивают указание на функцию ER в предстательной железе и мочевом пузыре: в случае более старых самцов мышей возникают симптомы гиперплазии предстательной железы и мочевого пузыря (Krege, J. Н. и др. 1998, Proc Natl Acad Sci 95: 15677-15682). Кроме того,самки ERKO мышей (Lubahn, D. В. и др. 1993, Proc Natl Acad Sci 90: 11162-11166) и самцы ERKO мышейAcad Sci 95: 15677-15682) имеют нарушения фертильности. Таким образом, подтверждена основная функция эстрогенов в отношении поддержания функции яичек и яичников, а также относительно фертильности. Является возможным достичь селективного эстрогенного воздействия на специфические целевые органы с помощью лигандов, специфических для подтипа, на основе различного распределения в тканях и органах двух подтипов ER. Вещества, предпочтительные для ER по сравнению с ER в in-vitro анализе связывания рецептора, были описаны Kuiper и др. (Kuiper и др. (1996), Endocrinology 138: 863-870). Селективное воздействие лигандов, специфических для подтипа эстрогенных рецепторов, на чувствительные к эстрогену параметры in vivo не было ранее продемонстрировано. Патентная заявка WO 01/77139 А 1 описывает 8-замещенные эстратриены, в которых R8 означает алкильный или алкенильный радикал с разветвленной или неразветвленной цепью, необязательно частично или полностью галогенированный, содержащий вплоть до 5 атомов углерода, этинильный- или проп-1-инильный радикал, в качестве фармацевтически активных ингредиентов, которые обладают invitro более высокой аффинностью по отношению к препаратам эстрогенного рецептора предстательной железы крыс, чем препараты эстрогенного рецептора матки крыс, их получение, их терапевтическое применение и формы фармацевтического применения, которые содержат указанные соединения. Соединение 3-метокси-8-винилэстра-1,3,5(10)-триен-17-он (Пример 6) также является описанным вWO01/77139. Существует острая потребность в данной области техники в соединениях с мощной эстрогенной активностью и более высокой аффинностью по отношению к препаратам рецептора предстательной железы крыс, чем к препаратам эсгрогенного рецептора матки крыс, для получения лекарственного средства. Задача изобретения Задача данного изобретения заключается, таким образом, в получении соединений, которые обладают высокой раздвоенностью in vitro в отношении связывания препаратов эстрогенного рецептора из предстательной железы крыс и матки крыс. Соединения являются такими, которые демонстрируют более высокую аффинность in vitro по отношению к препаратам эстрогеного рецептора из предстательной железы крыс, чем к препаратам эстрогенного рецептора из матки крыс. Соединения в соответствии с настоящим изобретением обладают высокой эстрогенной активностью и эффективностью, в частности,высокой связывающей аффинностью с эстрогенным рецептором и более высокой раздвоенностью в отношении связывания с эстрогенным рецептором предстательной железы крыс по сравнению с маткой крыс применительно к известным соединениям. Соединения в соответствии с изобретением являются такими, которые обеспечивают повышенную фертильность в яичнике, в то время, как весьма незначительно воздействуют на матку в случае ассоциированного с яичниками бесплодия. Преимущественный профиль соединений в соответствии с изобретением достигался с помощью специфической комбинации заместителей R8, R13, R16, R17 и R17. В соответствии с изобретением указанная выше задача решается путем обеспечения производных 8-замещенного эстра-1,3,5(10)-триена общей формулы IR3 означает атом водорода,R8 представляет собой винил, этинил или проп-1-инил,R13 представляет собой метил или этил,R16 представляет собой атом фтора в -положении,R17 и R17' в каждом случае независимо друг от друга представляют собой атом водорода и группу гидрокси. Особое воплощение в соответствии с настоящим изобретением представляет собой соединения общей формулы I, в которой R3 представляет собой атом водорода. В соответствии с дополнительным воплощением данного изобретения соединения общей формулыI включают R8, который представляет собой группу винила, этинила или проп-1-инила. Другие возможные формы воплощения в соответствии с настоящим изобретением являются определенными в зависимых пунктах формулы изобретения. Соединения общей формулы I, в которой R17 и R17' представляют собой атом водорода и атом группы гидрокси также являются предпочтительными. Соединения общей формулы I, в которой R16 находится в -положении, или соединения общей формулы I, в которой R16 находится в -положении представляют собой в равной степени предпочтительные формы воплощения данного изобретения. Кроме того, частные воплощения в соответствии с настоящим изобретением представляют собой соединения общей формулы I, в которой R8 представляет собой группу винила, этинила или проп-1 инила, R16 представляет собой атом фтора, R17 и R17' независимо друг от друга представляют собой атом водорода и атом группы гидрокси. Соединения в соответствии с настоящим изобретением представляют собой: 8-винил-16-фторэстра-1,3,5(10)-триен-3,17-диол 8-винил-16-фторэстра-1,3,5(10)-триен-3,17-диол Одна или две гидроксильные группы при С атомах 3 и 16 могут быть эстерифицированы с помощью алифатической, разветвленной или неразветвленной, насыщенной или ненасыщенной C1-C14-моноили поликарбоновой кислоты или ароматической карбоновой кислоты. Такими приемлемыми карбоновыми кислотами для эстерификации являются, например,монокарбоновые кислоты: муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, валерьяновая кислота, изовалерьяновая кислота, триметилуксусная кислота, лауриновая кислота, миристимовая кислота, акриловая кислота, пропионовая кислота, метакриловая кислота, кротоновая кислота, изокротоновая кислота, олеиновая кислота и элаидиновая кислота, эстерификация с помощью уксусной кислоты, валерьяновой кислоты или триметилуксусной кислоты является предпочтительной; дикарбоновые кислоты: щавелевая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота, себациновая кислота, малеиновая кислота, фумаровая кислота, муконовая кислота, цитраконовая кислота и мезаконовая кислота; ароматические карбоновые кислоты: бензойная кислота, фталевая кислота, изофталевая кислота,терефталевая кислота, нафтойная кислота, о-, м- и п-толуиловая кислота, гидратроповая кислота, атроповая кислота, фенилакриловая кислота, никотиновая кислота и изоникотиновая кислота. Эстерификация с помощью бензойной кислоты является предпочтительной. В качестве пролекарственных форм эстеры 8-замещенных эстратриенов в соответствии с изобретением имеют преимущество по сравнению с неэстерифицированными активными ингредиентами в отношении способа их введения, их типа действия, силы и длительности действия. В частности, 8-замещенные эстратриены в соответствии с изобретением имеют фармакокинетические и фармакодинамические преимущества. Подобные эффекты уже были описаны у других стероидсульфаматов (J. Steroid Biochem. Molec. Biol, 55, 395-403 (1995); Exp. Opinion Invest. Drugs 7, 575-589(1998. В данной заявке стероиды на основе скелета 8-замещенного эстра-1,3,5(10)-триена описываются для лечения расстройств и состояний, опосредованных эстрогенным -рецептором, в качестве селективных эстрогенов, которые обладают in vitro раздвоенностью в отношении их связывания с препаратами эстрогенного рецептора из предстательной железы крыс и матки крыс и которые обладают in vivo предпочтительной раздвоенностью в отношении действия на яичники по сравнению с действием на матку.ER-специфические соединения в соответствии с настоящим изобретением являются такими, которые опосредуют in vivo пролиферативное действие на яичники. В то же время соединения демонстрируют раздвоенность в отношении влияния на яичники по сравнению с действием на матку. Было обнаружено, что 8-замещенные эстра-1,3,5(10)-триены в соответствии с общей формулой I являются приемлемыми в качестве селективных эстрогенов для лечения различных состояний и расстройств, которые характеризуются более высоким содержанием эстрогеннных рецепторов , чем эстрогенных рецепторовв соответствующей целевой ткани или целевом органе. Указанные соединения обладают улучшенной эффективностью и метаболической стабильностью. Изобретение также относится к фармацевтическим препаратам, которые содержат, по крайней мере, одно соединение общей формулы I (или их физиологически совместимые аддитивные соли с органическими или неорганическими кислотами) и применению соединений общей формулы I для получения фармацевтических агентов, в частности, для показаний, упомянутых ниже. Новые селективные эстрогены, которые описаны в данной заявке, могут использоваться в качестве индивидуальных компонентов в фармацевтических препаратах или в комбинации, в частности, с гестагенами. Часть настоящего изобретения представляет собой комбинацию селективных эстрогенов с ERселективными антиэстрогенами, которые являются периферически активными, то есть такими, которые-4 017124 не проходят через гематоэнцефалические барьеры, а также с селективными модуляторами эстрогенного рецептора (SERM).ER-селективные соединения в соответствии с изобретением могут использоваться, в частности,для получения фармацевтических агентов для лечения расстройств фертильности, для предотвращения и терапии гиперплазии предстательной железы, для предотвращения и лечения колебаний настроения, индуцированных недостатком гормонов у женщин и мужчин и для применения в гормонозаместительной терапии (ГЗТ) у мужчин и женщин. Кроме того, соединения в соответствии с изобретением обладают антипролиферативными эффектами в моделях гиперплазии толстого и тонкого кишечника и могут, таким образом, вводиться для предотвращения и лечения заболеваний, ассоциированных с пролиферацией эпителия толстого и тонкого кишечника, например, для лечения и предотвращения рака.ER-специфические соединения в соответствии с настоящим изобретением могут предпочтительно использоваться для селективной стимуляции роста волос. Терапевтический продукт, который содержит эстроген и чистый антиэстроген для одновременного,последовательного или раздельного применения в селективной эстрогенной терапии перименопаузальных и постменопаузальных состояний уже описан в ЕР-А 0346014. По причине их раздвоенности воздействия в яичнике по сравнению с действием в матке, вещества и фармацевтические агенты, которые их содержат, являются особенно приемлемыми для лечения в случае дисфункции яичников, которая вызвана хирургическим вмешательством, приемом лекарственных средств, и т.п., такой, как женское бесплодие, для стимуляции фолликулогенеза для самостоятельного лечения как такового с целью повышения фертильности, для поддержания in vitro лечения фертильности(IVF) в связи с in vivo лечением и для лечения расстройств, индуцированных яичниками, в пожилом возрасте ("поздняя фертильность"), а также лечения симптомов, индуцированных недостатком гормонов. Соединения в соответствии с данным изобретением являются также приемлемыми для терапии заболеваний яичников, такие как синдром поликистозного яичника, POF (преждевременное угасание функции яичников) синдроме и расстройствах овуляции. В завершение, соединения общей формулы I могут использоваться в сочетании с селективными модуляторами эстрогенного рецептора (SERM) или ралоксифеном, в частности, для применения в гормонозаместительной терапии (ГЗТ) и для лечения гинекологических расстройств. 8-замещенные эстратриены в соответствии с изобретением являются также приемлемыми в качестве индивидуальных компонентов для лечения перименопаузальных и постменопаузальных симптомов,в частности, приливов жара, нарушения сна, раздражительности, перепадов настроения, недержания мочи, вагинальной атрофии и психических расстройств, индуцированных недостатком гормонов. Упомянутые выше 8-замещенные эстратриены являются также приемлемыми для замещения гормонов и для терапии симптомов, индуцированных недостатком гормонов при нарушении функции яичников, что вызвано хирургическим вмешательством, приемом лекарственных средств и т.п. Кроме того, 8-замещенные эстратриены в соответствии с изобретением могут также использоваться для предотвращения сердечно-сосудистых заболеваний, в частности, сосудистых заболеваний, таких как артериосклероз, высокое кровяное давление, гипертензивной кардиомиопатии и для предотвращения нейродегенеративных заболеваний, индуцированных недостатком гормонов, таких как болезнь Альцгеймера, а также нарушения памяти и способности к обучению, индуцированных недостатком гормонов. Кроме того, соединения в соответствии с настоящим изобретением могут использоваться в качестве активных ингредиентов в препаратах для лечения воспалительных заболеваний и заболеваний иммунной системы, в частности, аутоиммунных заболеваний, таких как, например, ревматоидный артрит, рассеянный склероз, волчанка, болезнь Крона и других воспалительных заболеваний кишечника, воспалительных заболеваний кожи, таких как, псориаз, а также для лечения эндометриоза. Основываясь на фактах, полученных из предклинических моделей воспалительных заболеваний человека, ER-специфические соединения могут, таким образом, использоваться для предотвращения и лечения заболеваний, упомянутых выше (Heather, Н.А.; Mol Endocrinol. 2007 Jan;21(l): 1-13. Epub 2006Mar 23. Review). В дополнение к этому эти соединения являются эффективными против воспалительных заболеваний респираторного тракта, легких и бронхиол, таких как, например, астма. Лекарственная терапия является приемлемой для терапии и профилактики заболеваний, индуцированных недостатком эстрогена как у мужчин, так и у женщин. Данные соединения являются также приемлемыми для предотвращения и терапии гиперплазии предстательной железы. Эти соединения могут дополнительно использоваться для профилактики и терапии нарушений функции или заболеваний человека, связанных с возрастом. В частности, они могут использоваться для предотвращения или лечения, связанного с возрастом снижения уровня андрогенов, таких как тестостерон и DHEA, а также гормона роста. Количество соединения общей формулы I, которое вводится, колеблется в пределах широкого интервала и может охватывать любое эффективное количество. Основываясь на состоянии, которое под-5 017124 вергается лечению, и способе введения, количество соединения, которое вводится, может составлять 0,01 мкг/кг - 100 мг/кг веса тела, предпочтительно 0.04 мкг/кг - 1 мг/кг веса тела, в сутки. У людей это соответствует дозе от 0,8 мкг до 8 г, предпочтительно от 3,2 мкг до 80 мг ежедневно. В соответствии с изобретением единичная доза содержит от 1,6 мкг до 2000 мг одного или более соединений общей формулы I. Соединения в соответствии с изобретением и их соли присоединения кислоты являются приемлемыми для получения фармацевтических композиций и препаратов. Фармацевтические композиции или фармацевтические агенты содержат в качестве активных ингредиентов одно или более соединений в соответствии с изобретением или их соли присоединения кислоты, необязательно смешанные с другими фармакологически или фармацевтически активными веществами. Получение фармацевтически активных агентов осуществляют известным способом, при котором применяют известные и широко используемые фармацевтические адъюванты, а также могут применяться другие традиционно используемые носители или разбавители. В качестве таких носителей и адъювантов являются приемлемыми, например, те, которые рекомендованы или указаны в следующих библиографических ссылках в качестве адъювантов для фармацевтических агентов, косметических средств, а также в других областях: Ullmans Encyklopdie der technischenPharmaceutics, Cosmetics и Related Fields], Cantor KG, Aulendorf in Wrttemberg 1971. Эти соединения могут вводится перорально или парентерально, например интраперитонеально,внутримышечно, подкожно или чрескожно. Указанные соединения могут также имплантироваться в ткани. Для перорального введения являются приемлемыми капсулы, пилюли, таблетки, таблетки с покрытием и т.п. В дополнение к активному ингредиенту единичные дозы могут содержать фармацевтически совместимый носитель, такой как, например, крахмал, сахар, сорбит, желатин, скользящее вещество,кремниевую кислоту, тальк и т.п. Для парентерального введения активные ингредиенты могут быть растворены или суспендированы в физиологически совместимом разбавителе. В качестве разбавителей очень часто применяются масла с добавлением солюбилизатора, поверхностно-активного вещества, суспендирующего агента или эмульгирующего агента. Примеры масел, которые используются, представляют собой оливковое масло, ореховое масло, масло семян хлопчатника, соевое масло, касторовое масло и сезамовое масло. Эти соединения могут также использоваться в форме инъекций веществ медленного всасывания или в виде препаратов имплантата, которые могут быть рецептированы таким образом, что является возможным отсроченное высвобождение активного ингредиента. В качестве инертных материалов имплантаты могут содержать, например, биоразлагаемые полимеры или синтетические силиконы, такие как, например, силиконовый каучук. Кроме того, для чрескожного введения активные ингредиенты могут прибавляться, например, к пластырю. Для получения интравагинальных систем (например, вагинальных колец) или внутриматочных систем (например, вагинальных суппозиториев, спиралей, IUD, Mirena(R, которые содержат активные соединения общей формулы I для местного введения, являются приемлемыми различные полимеры, такие как, например, кремнийорганические полимеры, этиленвинилацетат, полиэтилен или полипропилен. Для достижения лучшей биодоступности активного ингредиента соединения также могут быть рецептированы в виде клатратов циклодекстрина. С этой целью соединения подвергают реакции с -, -,или -циклодекстрином или производным последнего (РСТ/ЕР 95/02656). В соответствии с изобретением соединения общей формулы I могут также подвергаться инкапсуляции с использованием липосом. Способы Исследование связывания эстрогенного рецептора: Связывающую аффинность новых селективных эстрогенов подвергали анализу в конкурентных анализах при использовании 3 Н-эстрадиола в качестве лиганда для препаратов эстрогенного рецептора из предстательной железы крыс и матки крыс. Получение цитозоля предстательной железы и анализ рецепторов эстрогена с использованием цитозоля предстательной железы осуществляли в соответствии с Testas и др. (1981) (Testas, J. и др., 1981, Endocrinology 109: 1287-1289). Получение цитозоля матки крыс, а также анализ рецепторов с использованием ER-содержащего цитозоля в основном осуществляли так, как описано Stack и Gorski, (1985) (Stack, Gorski 1985, Endocrinology 117, 2024-2032), с некоторыми модификациями, как описано у Fuhrmann и др. (1995) (Fuhrmann, U. и др. 1995, Contraception 51: 45-52). Вещества, описанные в данной заявке, имели более высокую связывающую аффинность с эстрогенными рецепторами предстательной железы крыс, чем с эстрогенными рецепторами матки крыс. В-6 017124 этом случает предполагается, что ER превалирует в предстательной железе крыс над ER, а ER превалирует в матке крыс над ER. Табл. 1 показывает, что соотношение связывания с рецепторами предстательной железы и матки качественно совпадает с показателем относительной связывающей аффинности Цитируется из: Kuiper и др. (1996), Endocrinology 138: 863-870 Табл. 2 показывает результаты для одного из производных 8-винил-эстра-1,3,5(10)-16-фтортриен-3,17-диола (соединение 1) в соответствии с изобретением. Соединение 2 (8-винил-эстра-1,3,5(10)триен-3,17-диол показано в качестве стандарта. Таблица 2 Соединение 1 в соответствии с изобретением, а также соединение 2 демонстрируют более высокую связывающую аффинность с эстрогенными рецепторами предстательной железы крыс, чем с эстрогенными рецепторами матки крыс. Соединение 1 превосходит соединение 2 по своей более высокой связывающей активности с эстрогенными рецепторами предстательной железы крыс и по улучшенной раздвоенности в отношении предстательной железы крыс по сравнению с эстрогенными рецепторами матки крыс. В дополнение к этому возможность прогнозирования тестовой системы ER предстательной железы против ER матки подтверждается применительно к селективному по отношениям к тканям воздействию в in vivo исследованиях. Вещества, предпочтительные для ER предстательной железы, раздваиваются invivo предпочтительно в отношении воздействия в яичниках и матке, а также воздействия в гипофизе в пользу воздействия на яичники. Исследования раздвоенности воздействия на матку и гипофиз Исследования в отношении воздействия на рост матки и овуляцию (опосредованный эффект путем влияния на секрецию гормонов гипофиза) осуществляли на взрослых самках крыс (вес тела 220-250 г). Вещества вводили подкожно четыре раза в течение четырех последовательных дней. Первое введение осуществляли в послетечковый период. Через один день после последнего введения проводили аутопсию. Определяли количество ооцитов в Фаллопиевой трубе (влияние на овуляцию), а также вес матки. В то время, как эстрадиол вызывает зависимое от дозы ингибирование овуляции и увеличение веса матки со значением ED50 0,004 мг/кг веса тела, вещество в соответствии с изобретением не вызывает никакого влияния на гипофиз и вес матки. Исследование яичников Соединения подвергали анализу in vivo с использованием молодых особей крыс с удаленным гипо-7 017124 физом. В модификации этого оперативного способа животным вводили GnRH антагонист (Cetrorelix). Исследовали, стимулирует ли вещество фолликулярную пролиферацию (созревание) в яичнике. Вес яичника представлял собой измеряемый параметр. В каждом случае пять животных (вес тела 40-50 г) случайным образом распределяли по группам обработки. Животные получали пищу "ad libitum" при использовании стандартного корма (алтроним) в клетках Макролона в комнатах с кондиционированным воздухом при использовании определенной программы освещения (12 ч темноты, 12 ч освещения) и обеспечивали подкисленной водой для питья. Для подкожного введения исследуемое вещество, а также контрольное вещество (эстрадиол Е 2) растворяли в смеси бензилбензоат/касторовое масло (1+4 об./об.). Молодых самок крыс либо подвергали удалению гипофиза в день 0 и подкожно вводили (введение 1 х ежедневно) от дня 1 до дня 4 эстрадиол, соединение в соответствии с изобретением, либо подкожно вводили (введение 1 х ежедневно) носитель (касторовое масло/бензил бензоат). В модифицированной версии этого способа вводили 0,5 мг/животное/сутки Цетрореликса животным одновременно с соединением в соответствии с изобретением или носителем и контрольным веществом эстрадиолом в течение четырех дней лечения. В обоих случаях животных умерщвляли через 24 ч после последнего введения и определяли вес яичника и также стадии фолликула. Соединения в соответствии с изобретением, таким образом, продемонстрировали четкое раздвоение воздействия на яичник по сравнению с воздействием на матку и воздействием на гипофиз, и являются как нельзя лучше приемлемыми для лечения бесплодия у женщин благодаря своему фолликулостимулирующему воздействию. Получение соединений в соответствии с изобретением Соединения общей формулы I в соответствии с изобретением получают так, как описано в примерах. Дополнительные соединения общей формулы I могут быть получены с помощью аналогичной процедуры при использовании реагентов, которые являются гомологичными реагентам, описанным в примерах. Этерификацию и/или эстерификацию гидроксигрупп осуществляют в соответствии со способами,известными специалисту в данной области техники. Соединения в соответствии с изобретением могут быть представлены в углеродных атомах 16 и 17 как ,-стереоизомеры. При получении соединений в соответствии с описанными процессами соединения в большинстве случаев аккумулируются как смеси соответствующих ,-изомеров. Смеси могут быть разделены, например, с помощью хроматографических процессов. В соответствии с общей формулой I возможные заместители могут присутствовать уже в заключительной форме или в форме предшественника даже в исходном продукте, замещенном эстроне, который уже соответствует желаемому конечному продукту. 17-заместители также вводят в соответствии с известными процессами с помощью нуклеофильного присоединения желаемого заместителя или его реактивного предшественника и необязательно дополнительно наращивают. Эстеры 8-замещенной эстратриенкарбоновой кислоты в соответствии с изобретением получают из соответствующих гидроксистероидов, аналогично процессам, которые также являются известными (см.,например., Pharmazeutische Wirkstoffe, Synthesen, Patente, Anwendungen [Pharmaceutical Active Ingredients,Syntheses, Patents, Applications]; A. Kleemann, J. Engel', Georg Thieme Verlag Stuttgart 1978, Arzneimittel,Fortschritte [Pharmaceutical Agents, Improvements], 1972-1985; A. Kleemann, E. Lindner, J. Engel (Editors),VCH 1987, стр. 773-814). Эстратриенсульфаматы в соответствии с изобретением являются доступными при использовании способа, известного в области техники, из соответствующих гидроксистероидов путем эстерификации с помощью сульфамоилхлоридов в присутствии основания (Z. Chem. 15, 270-272 (1975); Steroids 61, 710717 (1996. Последующее ацилирование сульфамидной группы приводит к образованию (N-ацил)сульфаматов в соответствии с изобретением, для которых уже определены фармакокинетические преимущества в случае отсутствия 8-заместителя (див. DE 19540233 А 1). Региоселективную эстерификацию полигидроксилированных стероидов с помощью N-замещенных и N-незамещенных сульфамоилхлоридов осуществляли в соответствии с частичной защитой тех гидроксильных групп, которые остаются неэстерифицированными. Силиловые этеры отключали как защитные группы с использованием селективной реактивности, которая является приемлемой для этой цели, поскольку такие силиловые этеры являются стабильными при условиях образования сулъфамата, и сульфаматная группа остается интактной тогда, когда силиловые этеры снова отщепляли для регенерации остаточной(ых) гидроксильной(ых) группы(групп), которые все еще содержались в молекуле (Steroids 61, 710-717 (1996. Получение сульфаматов в соответствии с изобретением с одной или более дополнительными гидроксильными группами в молекуле также является возможным, так как исходный материал представляет собой приемлемые гидроксистероидные кетоны. Сначала, в зависимости от поставленной цели, одну или более гидроксильных групп, которые являются присутствующими, подвергают сульфа-8 017124 моилированию. Потом сульфаматные группы необязательно могут быть превращены с использованием желательного ацилхлорида в присутствии основания в (N-ацил)сульфаматы, которые представляют интерес. Полученные оксосульфаматы или оксо-(N-ацил)сульфаматы превращают путем восстановления в соответствующие гидроксисульфаматы или гидрокси-(N-ацил)сульфаматы (Steroids 61, 710-717 (1996. Борогидрид натрия и борандиметилсульфидный комплекс являются приемлемыми в качестве подходящих восстанавливающих агентов. Введение различных заместителей в кольца D эстратриенового скелета, в частности, атома галогена(например, атома фтора) при С-атоме 16, может в основном осуществляться в соответствии с химическими методиками, которые являются известными специалисту в данной области техники, с помощью которых получают соответствующие производные эстратриена, которые не являются замещенными в 8 положении (смотри, среди прочих.: Steroide [Steroids], L. F. Fieser, M. Fieser, Verlag Chemie, Weinheim/Bergstr., 1961; Organic Reactions in Steroid Chemistry, J. Fried, J. A. Edwards, Van Nostrand ReinholdZeelen, Elsevier, Amsterdam, Oxford, New York, Tokyo, 1990). Заместители в соответствии с общей формулой I могут быть также введены на этапе эстратриенов,которые уже являются замещенными в 8-положении, в соответствии с известными в области техники способами. Это может быть полезным или необходимым, в частности, в случае многочисленных замещений желаемого заключительного соединения. Типичные, но не такие, которые ограничивают процессы синтеза, являющиеся полезными для обеспечения моделей замещения в скелете эстрона, также в комбинации с некоторыми заместителями, могут быть найдены, например, в: C(1) J. Chem. Soc. (С) 1968, 2915; С(7) Steroids 54, 1989, 71; С(8) TetrahedronChem. Soc. Perk. 1 1973, 2095; C(15) J. Chem. Soc. Perk. 1 1996, 1269.); C(13) Mendeleev Commun. 1994,187; C(14(3) Z. Chem. 23, 1983, 410. Примеры, приведенные ниже, используются для более подробного объяснения изобретения. Аналогично деградации образовавшихся групп 8-винила другие соединения общей формулы I могут быть получены с помощью реагентов, которые являются гомологичными реагентам, которые описываются в примерах. Этерификацию и/или эстерификацию свободных гидроксильных групп осуществляют в соответствии со способами, которые являются известными специалисту в данной области техники. Пример 1. 8-Винил-16-фтор-эстра-1,3,5(10)-триен-3,17-диол 3-Метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-он 7,3 г (23,5 ммоля) 3-метокси-8-винил-эстра-1,3,5(10)-триен-17-она в 65 мл ТГФ по каплям прибавляли в атмосфере аргона к 30 мл 2 М раствора диизопропиламида лития (60,0 ммолей) в смеси ТГФ/гептан/этилбензол, охлажденной при -78 С, и потом прибавляли 16 мл (115,4 ммоля) триэтиламина и 7,6 мл (59,9 ммоля) хлортриметилсилана друг за другом. Реакционную смесь последовательно нагревали вплоть до комнатной температуры в течение 1,5 ч, промывали с помощью раствора бикарбоната натрия и экстрагировали с помощью н-гексана. Собранные органические фазы промывали с помощью воды, высушивали над сульфатом натрия и концентрировали путем выпаривания в вакууме. Полученный сырой продукт (3-метокси-8-винил-эстра-1,3,5(10),16-триен-17-илокси)триметилсилана (12 г желтоватого жидкого остатка) использовали без какой-либо дополнительной очистки на следующем этапе.Rf=0,54 (циклогексан/этилацетат=8/2) 6,8 г сырого продукта (3-метокси-8-винил-эстра-1,3,5(10), 16-тетраен-17-илокси)триметилсилана растворяли в 50 мл метиленхлорида, соединяли с 5 г (15,9 ммоля) N-фтордибензолсульфонимида и перемешивали в течение 16 ч при комнатной температуре и несколько раз экстрагировали при использовании метилхлорида. Собранные органические фазы промывали с помощью раствора бикарбоната натрия, воды и насыщенного раствора хлорида натрия друг за другом, высушивали над сульфатом магния и концентрировали в вакууме. Полученный сырой продукт (8,43 желтовато-коричневого масла) очищали с помощью хроматографии на силикагеле (19/1 циклогексан/этилацетат). Таким образом получали 1,65 г (38%,бесцветная пена) 3-метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-она и 2,08 г (51%, бесцветная пена) 3-метокси-8-винил-эстра-1,3,5(10)-триен-17-она. 3-Метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-он 1 Н-ЯМР (CDCl3):0,96 (s, 3H; 18-CH3), 3,76 (s, 3H; ОМе), 5,01 (d, 1H; СН=СН 2), 5,05/5,18 (d, 1H; 16-Н), 5,13 (d, 1H; СН=СН 2), 5,54 (dd, 1H; СН=СН 2), 6,59 (d, 1H; 4-Н), 6,69 (dd, 1H; 1-Н, 2-Н), 7,15 (d, 1H; 1-Н, 1-Н). 3-Метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ол и 3-метокси-16-фтор-8-винил-эстра 1,3,5(10)-триен-17-ол 1,65 г (5,0 ммоля) 3-метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-она растворяли в смеси 150 мл ТГФ и 150 мл метанола, охлаждали при 5 С и соединяли с 1,9 г (50,2 ммоля) борогидрида натрия. Во время нагревания до комнатной температуры в течение 1,5 ч реакционную смесь перемешивали. Потом-9 017124 прибавляли 10 мл уксусной кислоты и раствор заключительно высушивали в вакууме. Остаток повторно растворяли в воде и несколько раз экстрагировали с помощью этилацетата. Собирали органические фазы,высушивали при использовании сульфата магния и концентрировали в вакууме. Полученный сырой продукт отделяли с помощью хроматографии на силикагеле (циклогексан/метил-трет.-бутиловый эфир= 13/1). В соответствии с этой процедурой получали 0,67 г (40%) 3-метокси-16-фтор-8-винил-эстра 1,3,5(10)-триен-17-ола и 1,00 г (60%) 3-метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ола в виде бесцветной пены. 3-Метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ол 1 Н-ЯМР (CDCl3):0,72 (s, 3H; 18-CH3), 3,72 (d, 1H, 17-Н), 3,75 (s, 3H; ОМе), 4,90 (d, 1H; СН=СН 2),5,04 (d, 1H; СН=СН 2), 5,14 / 5,28 (dd, 1H; 16-Н), 5,51 (dd, 1 Н; СН=СН 2), 6,57 (d, 1 Н; 4-Н), 6,67 (dd, 1H; 1 Н, 2-Н), 7,16 (d, 1H; 1-Н, 1-Н). 3-Метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ол 1 Н-ЯМР (CDCl3):0,79 (s, 3H; 18-CH3), 3,75 (s, 3H; ОМе), 3,81 (d, 1H, 17-Н), 4,82 / 4,95 (dd, 1H; 16 Н), 4,89 (d, 1H; СН=СН 2), 5,06 (d, 1H; СН=СН 2), 5,51 (dd, 1H; СН=СН 2), 6,57 (d, 1H; 4-Н), 6,68 (dd, 1H; 1 Н, 2-Н), 7,15 (d, 1H; 1-Н, 1-Н). 16-Фтор-8-винил-эстра-1,3,5(10)-триен-3,17-диол 690 мг (1,87 ммоля) тетрабутиламмониййодида прибавляли к раствору 70 мг (0,21 ммоля) 3 метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ола в 9 мл метиленхлорида в атмосфере аргона. Реакционную смесь охлаждали при -78 С и потом соединяли с 1,9 мл (1,9 ммоля) 1 М раствора боротрихлорида в метиленхлориде. Смесь перемешивали в течение 0,5 ч при -78 С, в заключение нагревали при комнатной температуре и гасили при использовании воды. Отделяли органическую фазу, водную фазу несколько раз экстрагировали с помощью метиленхлорида и собирали органические фазы, промывали с помощью насыщенного раствора хлорида натрия, высушивали при использовании сульфата магния и концентрировали в вакууме. Полученный сырой продукт отделяли с помощью хроматографии на силикагеле (циклогексан/ этилацетат = 9 /1). 26 мг (39%) 16-фтор-8-винил-эстра-1,3,5(10)-триен-3,17-диола получали в соответствии с этой процедурой. 16-Фтор-8-винил-эстра-1,3,5(10)-триен-3,17-диол 1 Н-ЯМР (ДМСО[D6]):0,64 (s, 3H; 18-CH3), 3,49-3,57 (t, 1H, 17-Н), 4,70-4,84 (dd, 1H; 16-Н), 4,85 (d,1H; СН=СН 2), 4,98 (d, 1 Н; СН=СН 2), 5,19 (d, 1H, 17-ОН), 5,46 (dd, 1H; СН=СН 2), 6,37 (d, 1H; 4-Н), 6,48(dd, 1H; 1-Н, 2-Н), 6,99 (d, 1 Н; 1-Н, 1-Н), 8,93 (s, 1 Н, 3-ОН). Пример 2. 16-Фтор-8-винил-эстра-1,3,5(10)-триен-3,17-диол 295 мг (0,80 ммоля) йодида тетрабутиламмония прибавляли к раствору 30 мг (0,09 ммоля) 3 метокси-16-фтор-8-винил-эстра-1,3,5(10)-триен-17-ола в 4 мл метиленхлорида в атмосфере аргона. Реакционную смесь охлаждали при -78 С и потом соединяли с 0,8 мл (0,8 ммоля) 1 М раствора боротрихлорида в метиленхлориде. Смесь перемешивали в течение 0,5 ч при -78 С, в заключение нагревали при комнатной температуре и гасили с помощью воды. Отделяли органическую фазу, водную фазу несколько раз экстрагировали с помощью метиленхлорида и собирали органические фазы, промывали с помощью насыщенного раствора хлорида натрия, высушивали при использовании сульфата магния и концентрировали в вакууме. Полученный сырой продукт отделяли с помощью хроматографии на силикагеле (циклогексан/ этилацетат = 7/3). В соответствии с этой процедурой получали 27 мг (94%) 16-фтор-8-винил-эстра 1,3,5(10)-триен-3,17-диола. 16-Фтор-8-винил-эстра-1,3,5(10)-триен-3,17-диол 1 в которой R3 означает атом водорода,R8 представляет собой винил, этинил или проп-1-инил,R13 представляет собой метил или этил,R16 представляет собой атом фтора в -положении,- 10017124R17 и R17' в каждом случае независимо друг от друга представляют собой атом водорода и группу гидрокси. 2. Соединения общей формулы I по п.1, выбранные из 8-винил-16-фтор-эстра-1,3,5(10)-триен-3,17-диол или 8-винил-16-фтор-эстра-1,3,5(10)-триен-3,17-диол. 3. Фармацевтическая композиция, содержащая по крайней мере одно соединение по любому из пп.1 или 2, а также фармацевтически совместимый носитель. 4. Применение соединений общей формулы I, как определено в любом из пп.1 или 2, в качестве лекарственного средства. 5. Применение соединений общей формулы I, как определено в любом из пп.1 или 2, для получения фармацевтических агентов. 6. Применение по п.5, предназначенное для получения фармацевтического агента для лечения заболеваний и состояний, индуцированных недостатком эстрогена у женщин и у мужчин. 7. Применение по п.5, предназначенное для получения фармацевтического агента для лечения перии постменопаузальных симптомов. 8. Применение по п.5, предназначенное для получения фармацевтического агента для in vitro лечения бесплодия у женщин. 9. Применение по п.5, предназначенное для получения фармацевтического агента для in vivo лечения бесплодия у женщин. 10. Применение по п.5, предназначенное для получения фармацевтического агента для терапии симптомов, индуцированных недостатком гормонов при дисфункции яичников, которая вызвана хирургическим вмешательством, приемом лекарственных средств. 11. Применение по п.5, предназначенное для получения фармацевтического агента для гормонозаместительной терапии (ГЗТ). 12. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии ревматоидного артрита, рассеянного склероза и волчанки. 13. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии воспалительных заболеваний кишечника. 14. Применение по п.13, где воспалительное заболевание кишечника представляет собой болезнь Крона. 15. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии воспалительных заболеваний кожи. 16. Применение по п.15, где воспалительное заболевание кожи представляет собой псориаз. 17. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии сердечно-сосудистых заболеваний. 18. Применение по п.5, предназначенное для получения фармацевтического агента для профилактики и терапии артериосклероза, высокого кровяного давления и гипертензивной кардиопатии. 19. Применение по п.5, предназначенное для получения фармацевтического агента для предотвращения и лечения гиперплазии предстательной железы. 20. Применение по п.5, предназначенное для получения фармацевтического агента для лечения заболеваний иммунной системы. 21. Применение по п.5, предназначенное для получения фармацевтического агента для лечения эндометриоза. 22. Применение по п.5, предназначенное для получения фармацевтического агента для лечения рака толстого и тонкого кишечника. 23. Применение по п.5, предназначенное для получения фармацевтического агента для стимуляции роста волос.
МПК / Метки
МПК: A61P 5/30, A61K 31/565, C07J 1/00
Метки: эстрогенов, эстратриены, 8-бета-замещенные, активных, качестве, селективно
Код ссылки
<a href="https://eas.patents.su/12-17124-8-beta-zameshhennye-estratrieny-v-kachestve-selektivno-aktivnyh-estrogenov.html" rel="bookmark" title="База патентов Евразийского Союза">8-бета-замещенные эстратриены в качестве селективно активных эстрогенов</a>
Предыдущий патент: Способ получения 2-[4-(3- и 2-фторбензилокси)бензиламино]пропанамидов
Следующий патент: Лифт
Случайный патент: Способ изготовления штанги для подвески постоянного катода












