Производные хинолина в качестве антибактериальных средств
Номер патента: 14834
Опубликовано: 28.02.2011
Авторы: Коул Анил, Андрис Кунрад Йозеф Лодевейк Марсель, Паскье Элизабет Тереза Жанна, Гийемон Жером Эмиль Жорж
Формула / Реферат
1. Применение соединения для получения лекарственного средства для лечения бактериальной инфекции, при этом указанное соединение имеет формулу (Ia)
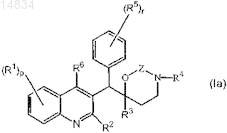
его фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, его четвертичного амина, его стереохимически изомерной формы или его N-оксидной формы, где
R1 представляет собой водород, галоген, Ar, Het, алкил, алкилокси;
р представляет собой целое число, равное 1, 2, 3 или 4;
R2 представляет собой алкилокси;
R3 представляет собой Ar;
R4 представляет собой алкил;
R5 представляет собой водород или галоген;
r представляет собой целое число, равное 1, 2, 3, 4 или 5; и
R6 представляет собой водород;
Z представляет собой CH2;
алкил представляет собой прямой или разветвленный, насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному, насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо;
Ar представляет собой фенил или нафтил;
Het представляет собой фуранил;
галоген представляет собой заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и
при условии, что бактериальная инфекция не является микобактериальной инфекцией.
2. Применение по п.1, где R1 представляет собой галоген.
3. Применение по любому из предыдущих пунктов, где р равно 1.
4. Применение по любому из предыдущих пунктов, где r равно 1.
5. Применение по любому из предыдущих пунктов, где алкил представляет собой С1-6алкил.
6. Применение по любому из предыдущих пунктов, где бактериальная инфекция представляет собой инфекцию с грамположительной бактерией.
7. Соединение, выбранное из
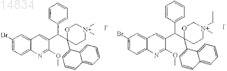
его стереохимически изомерная форма или его N-оксидная форма.
8. Комбинация (а) соединения, выбранного из соединений по п.7, и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами.
9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически активное количество (а) соединения, выбранного из соединений по п.7, и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами.
10. Применение комбинации по п.8 или фармацевтической композиции по п.9 для лечения бактериальной инфекции.
11. Продукт, содержащий (а) соединения, выбранные из соединений по п.7, и (b) один или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения для лечения бактериальной инфекции.
12. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную стафилококками, энтерококками и стрептококками.
13. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA), устойчивыми к метициллину коагуляза-отрицательными стафилококками (MRCNS), устойчивыми к пенициллину Streptococcus pneumoniae и мультирезистентными Enterococcus faecium.
14. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus или Streptococcus pneumoniae.
15. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA).
Текст
Настоящее изобретение относится к применению соединения для получения лекарственного средства для лечения бактериальной инфекции при условии, что бактериальная инфекция не является микобактериальной инфекцией, при этом указанное соединение представляет собой соединение формулы(Ia), его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его четвертичный амин,его стереохимически изомерную форму, его таутомерную форму или его N-оксидную форму, где R1 представляет собой водород, галоген, Ar, Het, алкил, алкилокси; р представляет собой целое число, равное 1, 2, 3 или 4; R2 представляет собой алкилокси; R3 представляет собой Ar; R4 представляет собой алкил; R5 представляет собой водород или галоген; r представляет собой целое число, равное 1, 2, 3, 4 или 5; и R6 представляет собой водород; Z представляет собой СН 2; алкил представляет собой прямой или разветвленный, насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода,присоединенный к прямому или разветвленному, насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо; Ar представляет собой фенил или нафтил; Het представляет собой фуранил; галоген представляет собой заместитель, выбранный из группы, включающей фтор, хлор, бром и йод. Андрис Кунрад Йозеф Лодевейк Марсель,Коул Анил (BE), Гийемон Жером Эмиль Жорж, Паскье Элизабет Тереза Жанна 014834 Настоящее изобретение касается применения производных хинолина для получения лекарственного средства, предназначенного для лечения бактериальной инфекции. Резистентность к основным антибиотикам представляет собой проблему, приобретающую все более большое значение. Некоторые значительные примеры включают резистентный к пенициллину Streptococcus pneumoniae, резистентные к ванкомицину энтерококки, резистентный к метициллину Staphylococcus aureus, полирезистентные сальмонеллы. Последствия резистентности к антибиотикам являются тяжелыми. Инфекции, вызываемые резистентными микробами, не поддаются лечению, что приводит к продолжительным заболеваниям и повышенной угрозе смерти. Безрезультатное лечение также приводит к более длительным инфекционным периодам, что повышает количество инфицированных людей, общающихся с другими людьми, и, таким образом, подвергает все население риску заражения резистентным штаммом инфекции. В больницах проблема антимикробной резистентности стоит наиболее остро во всем мире. Сочетание высоковосприимчивых пациентов, интенсивного и длительного применения антимикробных препаратов и перекрестной инфекции привели к возникновению инфекций с высокорезистентными бактериальными патогенами. Самолечение антимикробными препаратами является еще одним основным фактором, способствующим такой резистентности. Самостоятельный прием антимикробных препаратов может оказаться ненужным, зачастую неправильно дозированным либо может не содержать адекватных количеств активного лекарственного средства. Соблюдение больным рекомендуемого режима и схемы лечения является другой основной проблемой. Пациенты забывают принять лекарственное средство, прерывают лечение, когда начинают чувствовать себя лучше, или не могут позволить себе полный курс, тем самым, создавая идеальную среду для адаптирования микробов, но не для их гибели. Из-за возникающей резистентности к антибиотикам широкого спектра действия врачи вынуждены иметь дело с инфекциями, для которых не существует эффективного лечения. Распространенность, летальность и финансовые затраты на лечение таких инфекций создают дополнительные нарастающие трудности для систем здравоохранения во всем мире. Поэтому имеется насущная потребность в новых соединениях для лечения бактериальных инфекций, особенно для лечения инфекций, вызванных резистентными штаммами. Замещенные хинолины для лечения резистентных к антибиотикам инфекций были описаны в US 5965572 (США) и в WO 00/34265 для ингибирования роста бактериальных микроорганизмов. В WO 2004/011436, WO 2005/070924, WO 2005/07030 и WO 2005/075428 описаны замещенные производные хинолина, обладающие активностью против микобактерий, в частности против Mycobacteriumtuberculosis. Одно из конкретных соединений таких замещенных производных хинолина описано в Science (2005), 307, 223-227. Ни в одной из приведенных публикаций не описано применение настоящих замещенных производных хинолина согласно данному изобретению. Сущность изобретения Настоящее изобретение относится к применению соединения для получения лекарственного средства для лечения бактериальной инфекции, при этом указанное соединение имеет формулу (Ia) его фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, его четвертичного амина, его стереохимически изомерной формы или его N-оксидной формы, гдеR1 представляет собой водород, галоген, Ar, Het, алкил, алкилокси; р представляет собой целое число, равное 1, 2, 3 или 4;R5 представляет собой водород или галоген;r представляет собой целое число, равное 1, 2, 3, 4 или 5; иZ представляет собой CH2; алкил представляет собой прямой или разветвленный, насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содер-1 014834 жащий от 3 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному, насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо;Ar представляет собой фенил или нафтил;Het представляет собой фуранил; галоген представляет собой заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и при условии, что бактериальная инфекция не является микобактериальной инфекцией. Настоящее изобретение также относится к соединению, выбранному из его стереохимически изомерной форме или его N-оксидной форме. Кроме того, настоящее изобретение относится к комбинации: его стереохимически изомерной формы ии его N-оксидной формы, и(b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. Ещ одним объектом настоящего изобретения является фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически активное количество: его стереохимически изомерной формы ии его N-оксидной формы, и(b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. Настоящее изобретение также относится к применению вышеуказанных комбинаций или фармацевтической композиции для лечения бактериальной инфекции. Кроме того, настоящее изобретение относится к продукту, содержащему: его стереохимически изомерной формы ии его N-оксидной формы, и(b) одно или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами,предназначенному для применения в качестве комбинированного препарата для одновременного,раздельного или последовательного применения для лечения бактериальной инфекции. Подробное описание изобретения В рамках данного описания линии, проведенные от заместителей в кольцевые системы, показывают, что связь может быть прикреплена к любому из подходящих кольцевых атомов. Фарамцевтически приемлемые кислотно-аддитивные соли представляют собой соли, включающие-2 014834 терапевтически активные, нетоксичные кислотно-аддитивные солевые формы, которые способны образовывать соединения формулы (Ia). Такие кислотно-аддитивные соли могут быть получены обработкой основной формы соединений формул (Ia) соответствующими кислотами, например неорганическими кислотами, такими как галоидоводородная кислота, в частности хлористо-водородная кислота, бромистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами,например уксусная кислота, гидроксиуксусная кислота, пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламовая кислота,салициловая кислота, п-аминосалициловая кислота и памоевая кислота. Соединения формулы (Ia), содержащие кислотные протоны, также могут быть преобразованы в их терапевтически активные, нетоксичные основно-аддитивные солевые формы обработкой соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности лития,натрия, калия, магния и кальция, соли с органическими основаниями, например соли бензатина, Nметил-D-глюкамина, гибрамина, а также соли с аминокислотами, например аргинином и лизином. И наоборот, указанные кислотно- или основно-аддитивные солевые формы могут быть преобразованы в свободные формы обработкой соответствующим основанием или кислотой. Термин "аддитивная соль" в рамках данного описания также включает сольваты, которые способны образовывать соединения формулы (Ia), равно как и их соли. Такие сольваты представляют собой, например, гидраты и алкоголяты. Используемый выше термин "четвертичный амин" означает четвертичные соли аммония, которые способны образовывать соединения формулы (Ia) взаимодействием между основным азотом соединения формулы (Ia) с соответствующим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилалкилгалогенид, алкилкарбонилгалогенид, Ar-карбонилгалогенид, Hetалкилгалогенид или Het-карбонилгалогенид, например метилиодид или бензилиодид. Het предпочтительно представляет собой моноциклический гетероцикл, выбранный из фуранила или тиенила; либо бициклический гетероцикл, выбранный из бензофуранила или бензотиенила; каждый моноциклический и бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, при этом каждый заместитель независимо выбран из группы, включающей галоген, алкил и Ar. Кватернизирующий агент предпочтительно представляет собой алкилгалогенид. Могут быть также использованы другие реагенты с легко удаляемыми группами, такие как алкилфторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин включает положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат, ацетат, трифлат, сульфат,сульфонат. Противоионом предпочтительно является йод. Выбранный противоион может быть введен с использованием ионообменных смол. Соединения формулы (Ia) и некоторые из промежуточных соединений неизменно имеют в своей структуре по меньшей мере два стереогенных центра, которые могут привести к образованию по меньшей мере 4 стереохимически различных структур. Используемый в данном описании термин "стереохимически изомерные формы" означает все возможные изомерные формы, которые могут иметь соединения формулы (Ia). Если не приведено или указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических, (частично) насыщенных радикалах могут иметь цис- или трансконфигурацию. Стереохимически изомерные формы соединений формулы (Ia) безусловно входят в объем данного изобретения. В соответствии с условными обозначениями номенклатуры CAS, при наличии в молекуле двух стереогенных центров известной абсолютной конфигурации, R- или S-дескриптор приписывают (на основании правила последовательности Cahn-Ingold-Prelog) к хиральному центру с наименьшей цифрой, сравнительному центру. Конфигурацию второго стереогенного центра обозначают при помощи относительных дескрипторов [R,R] или [R,S], где R всегда обозначен как сравнительный центр, [R,R] означает центры с одинаковой хиральностью и [R,S] означает центры с различной хиральностью. Например, если хиральный центр с наименьшей цифрой в молекуле имеет S-конфигурацию, и второй центр имеет R-конфигурацию, то стереодескриптор будет обозначен как S-[R,S]. При использовании и: положение заместителя с наивысшим приоритетом на асимметричном атоме углерода в кольцевой системе, имеющей наименьшее кольцевое число, всегда произвольно находится в положении средней плоскости, определяемой кольцевой системой. Положение заместителя с наивысшим приоритетом на другом асимметричном атоме углерода в кольцевой системе относительно положения с наивысшим приоритетом на сравнительном атоме обозначают в том случае, если оно находится на той же стороне средней плоскости, определяемой кольцевой системой, либо , если оно находится на другой сторо-3 014834 не средней плоскости, определяемой кольцевой системой. Обозначение специфической стереоизомерной формы означает, что указанная форма является, по существу, свободной, т.е. связана с менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10%, еще более предпочтительно менее чем 5%, далее предпочтительно менее чем 2% и наиболее предпочтительно менее чем 1% другого изомера (изомеров). Таким образом, если соединение формулы (Ia), например, обозначено как (S,R), это означает, что соединение, по существу, свободно от(R,S) изомера. Соединения формулы (Ia) могут быть синтезированы в виде рацемических смесей энантиомеров,которые могут быть отделены одна от другой с использованием известных в данной области методов разделения. Рацемические соединения формулы (Ia) могут быть преобразованы в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяют, например, при помощи селективной или фракционной кристаллизации, и энантиомеры выделяют из них щелочью. Альтернативный способ отделения энантиомерных форм соединений формулы (Ia) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ при условии, что реакция протекает стереоспецифически. При желании предпочтительного получения специфического стереоизомера указанное соединение синтезируют стереоспецифическими способами получения. Таутомерные формы соединений формулы (Ia) означают, что они включают такие соединения формулы (Ia), где, например, энольная группа превращена в кетогруппу (кетоэнольный таутомеризм).N-Оксидные формы соединений формулы (Ia) означают, что они включают такие соединений формулы (Ia), где один или несколько атомов азота окислены до так называемого N-оксида, особенно такихN-оксидов, где азот аминорадикала является окисленным. Данное изобретение также включает производные (обычно называемые "пролекарствами") фармакологически активных соединений согласно данному изобретению, разлагающихся in vivo с образованием соединений согласно данному изобретению. Пролекарства обычно (но не всегда) оказывают более слабое действие на целевой рецептор, чем соединения, на которые они разлагаются. Пролекарства особенно полезны в тех случаях, когда желаемое соединение обладает химическими или физическими свойствами, затрудняющими или делающими неэффективным его введение. Например, желаемое соединение может быть малорастворимым, оно может плохо транспортироваться через эпителий слизистой оболочки либо может иметь нежелательно короткий период полувыведения из плазмы. Дальнейшие подробности о пролекарствах приведены в издании Stells, V.J., et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112176, и Drugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений согласно данному изобретению обычно представляют собой соединения формулы (Ia), их фармацевтически приемлемые кислотно- или основно-аддитивные соли, их стереохимически изомерные формы, их таутомерные формы и их Nоксидные формы, содержащие этерифицированную или амидированную кислотную группу. В число таких этерифицированных кислотных групп входят группы формулы -COORx, где Rx представляет собойC1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил и Rz представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения согласно данному изобретению, содержащие аминогруппу, могут быть производными кетона или альдегида, такого как формальдегид, с образованием основания Манниха. Такое основание будет гидролизоваться в водном растворе, следуя кинетике первого порядка. Подразумевается, что во всех нижеприведенных случаях термин "соединения формулы (Ia)" также означает их N-оксидные формы, их соли, их четвертичные амины, их таутомерные формы или их стереохимически изомерные формы. Особый интерес представляют такие соединения формулы (Ia), которые являются стереохимически чистыми. Представляющий интерес вариант осуществления настоящего изобретения относится к применению таких соединений формулы (Ia), их фармацевтически приемлемым кислотно- или основноаддитивным солям, их стереохимически изомерным формам, их таутомерным формам и их N-оксидным формам, гдеR1 представляет собой водород, галоген, Ar, Het, алкил, алкилокси; р представляет собой целое число, равное 1, 2, 3 или 4;R5 представляет собой водород или галоген;r представляет собой целое число, равное 1, 2, 3, 4 или 5; иZ представляет собой СН 2; алкил представляет собой прямой или разветвленный, насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному, насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо;Ar представляет собой фенил или нафтил;Het представляет собой фуранил; галоген представляет собой заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и при условии, что бактериальная инфекция не является микобактериальной инфекцией. Данное изобретение предпочтительно относится к применению приведенных выше соединений формулы (Ia), где R1 представляет собой галоген. Данное изобретение предпочтительно относится к применению приведенных выше соединений формулы (Ia), где р равно 1. Данное изобретение предпочтительно относится к применению приведенных выше соединений формулы (Ia), где r равно 1. Данное изобретение предпочтительно относится к применению приведенных выше соединений формулы (Ia), где алкил представляет собой C1-6 алкил. Соединение формулы (Ia) предпочтительно представляет собой конкретный диастереоизомер (по существу, свободный от другого диастереоизомера (диастереоизомеров. В том случае, когда соединение формулы (Ia) имеет два хиральных центра, это означает, что такое соединение представляет собой рацемическую смесь (R,S) и (S,R) энантиомеров или рацемическую смесь (R,R) и (S,S) энантиомера. Ниже рацемические смеси двух энантиомеров обозначены как диастереоизомер А или В. Присвоение рацемической смеси обозначения А или В зависит от того, выделяют ее первой согласно протоколу синтеза(т.е. А) или второй (т.е. В). Более предпочтительно соединение формулы (Ia) представляет собой конкретный энантиомер (по существу, свободный от других энантиомеров). В том случае, когда соединение формулы (Ia) имеет два хиральных центра, это означает, что такое соединение представляет собой (R,S),(S,R), (R,R) или (S,S) энантиомер. Указанные ниже конкретные энантиомеры обозначены как А 1, А 2, В 1 или В 2. Присвоение энантиомеру обозначения А 1, А 2, В 1 или В 2 зависит от того, выделяют его первым или вторым согласно протоколу синтеза. Настоящее изобретение также относится к соединениям, выбранным из их стереохимически изомерным формам или N-оксидной форме. В предпочтительном варианте данного изобретения бактериальная инфекция представляет собой инфекцию с грамположительной бактерией. Как правило, бактериальная инфекция представляет собой инфекцию, вызванную стафилококками,энтерококками и стрептококками, в частности представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA), устойчивыми к метициллину коагуляза-отрицательными стафилококками (MRCNS), устойчивыми к пенициллину Streptococcus pneumoniae и мультирезистентными Enterococcus faecium. В наиболее предпочтительном варианте бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus или Streptococcus pneumoniae, в частности инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA). Как правило, бактериальные патогены могут быть классифицированы как грамположительные или грамотрицательные патогены. Обычно считается, что соединения антибиотиков, обладающие активностью против как грамположительных, так и грамотрицательных патогенов, имеют широкий спектр активности. Считается, что соединения согласно настоящему изобретению обладают активностью против грамположительных и/или грамотрицательных бактериальных патогенов. В частности, данные соединения обладают активностью против по меньшей мере одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, более предпочтительно против одной или более грамположительных бактерий и/или одной или более грамотрицательных бактерий.-5 014834 Данные соединения обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включаютaeruginosa; и Escherichia, например E. coli. Грамположительные бактерии, например Staphylococci, Enterococci и Streptococci, являются особенно важными из-за развития после их появления устойчивых штаммов, трудно поддающихся лечению и искоренению, например, из окружающей среды в госпитале. Примерами таких штаммов являются резистентные к метициллину Staphylococcus aureus (MRSA), резистентные к метициллину, коагулаза-отрицательные стафилококки (MRCNS), резистентный к пенициллину Streptococcus pneumoniae и резистентный к различным бактериям Enterococcus faecium. Соединения согласно настоящему изобретению также проявляют активность против резистентных бактериальных штаммов. Соединения согласно настоящему изобретению особенно активны против Staphylococcus aureus,включая резистентный Staphylococcus aureus, такой как, например, резистентный к метициллину Staphylococcus aureus (MRSA), и Streptococcus pneumoniae. В частности, соединения согласно настоящему изобретению проявляют активность против таких бактерий, вариабельность которых зависит от правильного функционирования F1F0 ATP синтазы. Без ссылки на какую-либо теорию предполагается, что активность данных соединений заключается в ингибировании F1F0 ATP синтазы, в частности в ингибировании F0 комплекса F1F0 ATP синтазы, более конкретно, в ингибировании подгруппы F0 комплекса F1F0 ATP синтазы, приводящем к гибели бактерий в результате истощения клеточных АТР уровней бактерий. В данном описании под фразой, что "данные соединения способны лечить бактериальную инфекцию", подразумевается, что такие соединения способны лечить инфекцию с одним или более бактериальными штаммами. В данном описании под фразой, что "бактериальная инфекция отличается от микобактериальной инфекции", подразумевается, что бактериальная инфекция отличается от инфекции с одним или более штаммами микобактерий. Как хорошо известно специалистам в данной области, точная дозировка и частота введения данных соединений зависит от конкретного применяемого соединения формулы (Ia), конкретного подвергаемого лечению состояния, тяжести подвергаемого лечению состояния, возраста, массы, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также от других назначений пациента. Более того, очевидно, что эффективная суточная доза может быть снижена или повышена в зависимости от реакции подвергаемого лечению пациента и/или в зависимости от оценки врача, назначающего соединения согласно данному изобретению. Соединения согласно настоящему изобретению могут быть введены в фармацевтически приемлемой форме, необязательно, в фармацевтически приемлемом носителе. Данные соединения и композиции,содержащие такие соединения, могут быть введены местным, локальным или системным способом. Системное применение включает любой способ введения соединения в ткани организма, например интратекальное, эпидуральное, внутримышечное, трансдермальное, внутривенное, интраперитонеальное, подкожное, сублингвальное, ректальное и пероральное введение. Специфическая доза вводимого антибактериального препарата, равно как и продолжительность лечения, могут быть установлены надлежащим образом. Бактериальные инфекции, которые могут подвергаться лечению данными соединениями, включают, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острый средний отит, инфекции краниальных пазух, глазные инфекции, инфекции полости рта, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, мочеполовые инфекции, желудочно-кишечные инфекции, гинекологические инфекции, септицемию, инфекции костей и суставов, инфекции кожи и структуры кожи, бактериальный эндокардит, ожоги, антибактериальную профилактику хирургических операций, а также антибактериальную профилактику пациентов с подавленной иммунной системой, таких как пациенты, получающие химиотерапию от рака, или пациенты с пересаженными органами. С учетом того, что соединения формулы (Ia) обладают активностью против бактериальных инфекций, данные соединения могут быть комбинированы с другими антибактериальными средствами для успешного противостояния бактериальным инфекциям. Поэтому настоящее изобретение также относится к комбинации: его стереохимически изомерных форм или N-оксидной формы, и(b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. Настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически активное количество: его стереохимически изомерных форм или N-оксидной формы, и(b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. Согласно настоящему изобретению предпочтительно, когда вышеуказанная комбинация или фармацевтическая композиция применяются для лечения бактериальной инфекции. Настоящее изобретение также относится к продукту, содержащему: его стереохимически изомерных форм или N-оксидной формы, и(b) один или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами,в качестве комбинированного препарата для одновременного, раздельного или последовательного применения для лечения бактериальной инфекции. В предпочтительном варианте бактериальная инфекция представляет собой инфекцию, вызванную стафилококками, энтерококками и стрептококками. В предпочтительном варианте бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA), устойчивыми к метициллину коагулязаотрицательными стафилококками (MRCNS), устойчивыми к пенициллину Streptococcus pneumoniae и мультирезистентными Enterococcus faecium. Наиболее предпочтительно, когда бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus или Streptococcus pneumoniae, в частности, такую как инфекция, вызванная устойчивыми к метициллину Staphylococcus aureus (MRSA). Приведенная выше фармацевтическая композиция может иметь различные формы для введения. В качестве подходящих композиций могут быть приведены все композиции, обычно используемые для системного введения лекарственных средств. Для того чтобы получить фармацевтическую композицию согласно данному изобретению, эффективное количество конкретных соединений, необязательно в виде аддитивной соли, в качестве активного ингредиента объединяют в виде однородной смеси с фармацевтически приемлемым носителем, который может иметь самые различные формы в зависимости от вводимой формы препарата. Такие фармацевтические композиции представляют собой желаемые единичные дозированные формы, подходящие, в частности, для перорального введения или для парентеральных инъекций. Например, при получении композиций в виде пероральной дозированной формы могут быть использованы любые из фармацевтических сред, такие как, например, вода, гликоли, масла и т.п., для получения пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; либо жидкие носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие вещества, расщепляющие агенты и т.п., для получения порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы являются наиболее предпочтительными пероральными единичными дозированными формами, для получения которых очевидными являются твердые фармацевтиче-7 014834 ские носители. При получении парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере она составляет его большую часть, хотя могут быть включены и другие ингредиенты, например, для улучшения растворимости. Могут быть получены, например, растворы для инъекций,где носитель включает раствор соли, раствор глюкозы или смесь раствора соли и глюкозы. Могут быть также получены суспензии для инъекций, где могут быть использованы подходящие жидкие носители,суспендирующие агенты и т.п. Также могут быть использованы твердые препараты, превращаемые, непосредственно перед применением, в жидкие препаративные формы. В зависимости от способа введения фармацевтические композиции предпочтительно включают от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.% фармацевтически приемлемого носителя, при этом все значения процентного содержания приведены в расчете на общую композицию. Массовые отношения соединения формулы (Ia) и (b) другого антибактериального средства(средств), приведенные в виде комбинации, могут быть определены специалистом в данной области. Как хорошо известно специалистам в данной области, указанное соотношение, точная дозировка и частота введения данных соединений зависят от конкретного применяемого соединения формулы (Ia) и другого применяемого антибактериального средства (средств), конкретного подвергаемого лечению состояния,тяжести подвергаемого лечению состояния, возраста, массы, пола, диеты, времени введения и общего физического состояния конкретного пациента, способа введения, а также от других назначений пациенту. Более того, очевидно, что эффективная суточная доза может быть снижена или повышена в зависимости от реакции подвергаемого лечению пациента и/или в зависимости от оценки врача, назначающего соединения согласно данному изобретению. Соединения формулы (Ia) и один или более других антибактериальных средств могут быть объединены в виде общего препарата либо сформулированы в виде отдельных препаратов таким образом, чтобы они могли быть введены одновременно, по отдельности или последовательно. Таким образом, настоящее изобретение также касается продукта, содержащего (а) соединение формулы (Ia) и (b) одного или более других антибактериальных средств, при условии, что один или более таких антибактериальных средств не являются антимикобактериальными средствами, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении бактериальной инфекции. Фармацевтическая композиция может дополнительно содержать различные другие, известные в медицине ингредиенты, например лубрикант, стабилизирующий агент, буферный агент, эмульгирующий агент, регулирующий вязкость агент, поверхностно-активное вещество, консервант, корригент или краситель. Особенно предпочтительным является получение вышеприведенных фармацевтических композиций в виде единичной дозированной формы с целью облегчения введения и равномерности дозировки. Используемый в данном описании термин "единичная дозированная форма" означает физически дискретные единицы, приемлемые в качестве единичного дозирования, при этом каждая единица содержит заранее установленное количество активного ингредиента, рассчитанное таким образом, чтобы оказывать нужное терапевтическое действие в сочетании с нужным фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечками или покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекций и т.п., а также множества их отделенных компонентов. Суточная доза соединения согласно данному изобретению, безусловно, варьируется в зависимости от применяемого соединения, способа введения,желаемого лечения и диагностированного бактериального заболевания. Другие антибактериальные средства, которые могут быть комбинированы с соединениями формулы(Ia), представляют собой антибактериальные средства, известные в медицине. Другие антибактериальные средства включают антибиотики -лактамовой группы, такие как натуральные пенициллины, полусинтетические пенициллины, натуральные цефалоспорины, полусинтетические цефалоспорины, цефамицины, l-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как Nнуклеозиды, С-нуклеозиды, карбоциклические нуклеозиды; бластицидин S; макролиды, такие как 12 членные кольцевые макролиды, 14-членные кольцевые макролиды, 16-членные кольцевые макролиды; ансамицины; пептиды, такие как блеомицин, грамицидины, полимиксины, бацитрацины, пептидные антибиотики с большим кольцом, содержащие лактоновые связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацины, микамицин, неокарциностатин, стендомицин, биомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркмицин А; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; моненсины; пирролнитрин; фосфомицин; фузидовая кислота; D-(ргидроксифенил)глицин; D-фенилглицин; энедиины. Специфические антибиотики, которые могут быть комбинированы с описываемыми соединениями формулы (Ia), представляют собой, например, бензилпенициллин (калий, прокаин, бензатин), фенокисметилпенициллин (калий), фенетициллин калий, пропициллин, карбенициллин (динатрий, фенилнатрий,инданилнатрий), сулбенициллин, тикарциллин динатрий, метициллин натрий, оксациллин натрий, клоксациллин натрий, диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрий,-8 014834 амоксициллин, циклациллин, гектациллин, сулбактам натрий, талампициллина гидрохлорид, бакампициллина гидрохлорид, пивмециллинам, цефалексин, цефаклор, цефалоглицин, цефадроксил, цефадрин,цефроксадин, цефапирин натрий, цефалотин натрий, цефацертил натрий, цефсулодин натрий, цефалоридин, цефатризин, цефоперазон натрий, цефамандол, вефотиама гидрохлорид, цефазолин натрий, цефтизоксим натрий, цефотаксим натрий, цефменоксима гидрохлорид, цефуроксим, цефтриаксон натрий, цефтазимид, цефокситин, цефметазол, цефотетан, латамоксеф, клавулановая кислота, имипенем, азтреонам,тетрациклин, хлортетрациклина гидрохлорид, деметилхлортетрациклин, окситетрациклин, метацикли,доксициклин, ролитетрациклин, даунорубицина гидрохлорид, доксорубицин, акларубицин, канамицина сульфат, беканамицин, тобрамицин, гентамицина сульфат, дибекацин, амикацин, микрономицин, рибостамицин, неомицина сульфат, паромомицина сульфат, стрептомицина сульфат, дигидрострептомицин,дестомицин А, гидромицин В, апрамицин, сизомицин, нетилмицина сульфат, спектиномицина гидрохлорид, астромицина сульфат, валидамицин, касугамицин, полиоксин, бластицидин S, эритромицин, эритромицина эстолат, олеандомицина фосфат, трацетилолеандомицин, китазамицин, джозамицин, спирамицин, тилозин, ивермектин, мидекамицин, блеомицина сульфат, пепломицина сульфат, грамицидин S,полимиксин В, бацитрацин, колистина сульфат, колистинметансульфонат натрий, энрамицин, микамицин, виргиниамицин, капреомицина сульфат, биомицин, энвиомицин, ванкомицин, актиномицин D, неокарциностатин, бестатин, пепстатин, моненсин, лазалоцид, салиномицин, амфотерицин В, нистатин,натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицинпальмитата гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникола пальмитат, митомицин С, пирролнитрил, фосфомицин, фузидовая кислота, бикозамицин, тиамулин, сикканин. Общее получение Соединения согласно данному изобретению обычно могут быть получены путем осуществления последовательности стадий, каждая из которых известна специалисту в данной области. Предложенные соединения, где Z представляет собой CH2, представленные формулами (Ia-1), могут быть получены взаимодействием промежуточного соединения формул (II-а) с параформальдегидом в подходящем растворителе, таком как, например, толуол. Предложенные соединения, где Z представляет собой С(=O), могут быть получены взаимодействием промежуточного соединения формул (III-a), где W1 представляет собой подходящую уходящую группу, такую как, например, имидазол, алкоксигруппы, например метокси, с подходящим основанием, таким как, например, гидрид натрия, тертиобутилат калия, в подходящем растворителе, таком как, например, тетрагидрофуран, диэтиловый эфир, диоксан. В вышеприведенных реакциях полученное соединение формулы (Ia) может быть выделено и, при необходимости, очищено согласно общеизвестным в данной области методам, таким как, например, экстракция, кристаллизация, дистилляция, растирание и хроматография. В случае, когда соединение формулы (Ia) кристаллизуется, оно может быть выделено фильтрованием. В противном случае кристаллизация может быть вызвана добавлением соответствующего растворителя, такого как, например, вода, ацетонитрил; спирт, такой как, например, метанол, этанол; и комбинаций приведенных растворителей. Альтернативно, реакционная смесь может быть упарена досуха с последующей очисткой остатка хроматографией (например, ВЭЖХ с обращенной фазой, флэш-хроматография и т.п.). Реакционная смесь также может быть очищена хроматографией без предварительного выпаривания растворителя. Соединение формулы (Ia) также может быть выделено путем выпаривания растворителя с последующей перекристаллизацией из соответствующего растворителя, такого как, например, вода, ацетонитрил; спирт, такой-9 014834 как, например, метанол; и комбинаций приведенных растворителей. Специалисту в данной области будет понятно, какой способ должен быть использован, какой растворитель является наиболее подходящим для использования, либо наиболее подходящий способ выделения должен быть установлен путем экспериментирования. Соединения формулы (Ia) могут быть также получены путем преобразования соединений формулы(Ia) одного в другое согласно известным реакциям преобразования групп. Соединения формулы (Ia) могут быть преобразованы в соответствующие N-оксидные формы после известных методов преобразования трехвалентного азота в его N-оксидную форму. Такая реакция Nокисления обычно может быть осуществлена путем взаимодействия исходного вещества формулы (Ia) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочноземельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать перкислоты, такие как, например, бензолкарбопероксокислота или галогензамещенная бензолкарбопероксокислота, т.е. 3-хлорбензолкарбопероксокислота, надалкановые кислоты, например надуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, а также смеси таких растворителей. Соединения формулы (Ia), где R4 представляет собой алкил, могут быть преобразованы в подходящий четвертичный амин взаимодействием с подходящим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, например ICH3 или ICH2CH3, в присутствии подходящего растворителя, такого как, например, ацетон. Некоторые из соединений формулы (Ia) и некоторые из промежуточных соединений настоящего изобретения могут представлять собой смесь стереохимически изомерных форм. Чистые стереохимически изомерные формы приведенных соединений и указанных промежуточных соединений могут быть получены при помощи известных методик. Например, диастереоизомеры могут быть разделены физическими методами, такими как селективная кристаллизация или хроматографические методы, например противоточное распределение, жидкостная хроматография и подобные методы. Энантиомеры могут быть получены из рацемических смесей сначала преобразованием приведенных рацемических смесей при помощи подходящих разлагающих агентов, таких как, например, хиральные кислоты, до смесей диастереомерных солей или соединений; затем физическим разделением приведенных смесей диастереомерных солей или соединений с использованием, например, селективной кристаллизации или хроматографических методов, например жидкостной хроматографии и подобных методов; и, наконец, преобразованием приведенных отделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут быть также получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ, при условии, что побочные реакции носят стереоспецифический характер. Альтернативный метод разделения энантиомерных форм соединений формулы (Ia) и промежуточных соединений включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной неподвижной фазы. Следует понимать, что в описанных выше или ниже способах получения реакционные продукты могут быть выделены из реакционной среды и, при необходимости, дополнительно очищены в соответствии с общеизвестными методами, такими как, например, экстракция, кристаллизация, дистилляция,растирание и хроматография. Некоторые из промежуточных и исходных веществ представляют собой известные соединения и являются коммерчески доступными или могут быть получены согласно известным методикам или методикам, описанным в WO 2004/011436, включенном в данное описание посредством ссылки. Промежуточные соединения формулы (II-a) могут быть получены взаимодействием промежуточного соединения формулы (IV-a) с подходящим снимающим защиту агентом, таким как, например, 1 хлорэтилхлорформиат, в подходящем растворителе, таком как, например, 1,2-дихлорэтан, и подходящем спирте, таком как, например, метанол и т.п. Промежуточные соединения формулы (II-a) также могут быть получены взаимодействием промежуточного соединения формулы (IV-а) с формиатом аммония в присутствии палладия на угле и в при- 10014834 сутствии подходящего растворителя, такого как, например, спирт, например метанол. Промежуточные соединения формулы (IV-а), где R1 представляет собой галоген, могут потерять указанный галогеновый заместитель во время их преобразования в промежуточные соединения формулы (II-a). Промежуточные соединения формул (IV-a) могут быть получены взаимодействием промежуточного соединения формулы (V-a) с промежуточным соединением формулы (VI) в присутствии подходящего восстановителя, такого как, например, n-BuLi, в присутствии подходящего основания, такого как, например, N,N-диизопропиламин, и в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (IV-a), где R1 представляет собой Het и р равно 1, при этом указанные промежуточные соединения представлены формулой (IV-a-1), могут быть получены взаимодействием промежуточного соединения формулы (IV-a), где R1 представляет собой галоген, при этом указанные промежуточные соединения представлены формулой (IV-a-2), с промежуточным соединением формулы (VII) в присутствии подходящего катализатора, такого как, например, Pd(PPh3)4, подходящего основания, такого как, например, K2CO3, и подходящего растворителя, такого как, например, диметиловый эфир, и подходящего спирта, такого как, например, метанол и т.п. Промежуточные соединения формулы (III-a) могут быть получены взаимодействием промежуточного соединения формулы (II-а) промежуточным соединением формулы (VIII), где W1-(C=O) представляет собой вводимую группу, и R представляет остаток промежуточного соединения, такого как, например, 1,1'-карбонилбис-1 Н-имидазол, метилхлорформиат или этилхлорформиат, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (V-a) представляют собой либо коммерчески доступные соединения, либо соединения, которые могут быть получены согласно общепринятым реакционным методикам, известным в данной области. Например, промежуточные соединения формулы (V-a-1) могут быть получены согласно следующей реакционной схеме (1): Схема 1 где все переменные имеют значения, указанные в формулах (Ia). Реакционная схема (1) включает стадию(а), на которой соответствующим образом замещенный анилин подвергают взаимодействию с соответствующим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или пхлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этиленхлорид. Взаимодействие может быть предпочтительно осуществлено при температуре от комнатной до температуры кипячения с обратным холодильником. На следующей стадии (b) аддукт, полученный на стадии (а), подвергают взаимодействию с фосфорилхлоридом (POCl3) в присутствии подходящего растворителя, такого как, например, N,N-диметилформамид (формилирование Вилсмайера-Хаака с последующей циклизацией). Взаимодействие может быть предпочтительно осуществлено при температуре от комнатной до температуры кипячения с обратным холодильником. На следующей стадии (с) специфическую группу R2, где R2 представляет собой алкилокси- или алкилтиорадикал, вводят путем взаимодействия промежуточного соединения, полученного на стадии (b), с соединением X-Alk, где X является S или О и Alk представляет собой алкильную группу, имеющую значения, указанные в формулах (Ia) и (Ib), таким как, например,метанолат натрия, в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Промежуточные соединения формулы (V-a-2) могут быть получены в соответствии со следующей реакционной схемой (2), согласно которой на первой стадии (а) замещенный индол-2,3-дион подвергают взаимодействию с замещенным 3-фенилпропиональдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Пфайтзингера), затем соединение карбоновой кислоты на следующей стадии (b) декарбоксилируют при высокой температуре в присутствии подходящего реакционноинертного растворителя, такого как дифениловый эфир. Схема 2 Очевидно, что в описанных и описываемых ниже реакциях реакционные продукты могут быть выделены из реакционной среды и, при необходимости, дополнительно очищены согласно общеизвестным методам, таким как экстракция, кристаллизация и хроматография. Также очевидно, что реакционные продукты, имеющие более чем одну энантиомерную форму, могут быть выделены из их смеси известными методами, в частности препаративной хроматографией, такой как препаративная ВЭЖХ, хиральная хроматография. Отдельные диастереоизомеры или отдельные энантиомеры также могут быть получены сверхкритической хроматографией (SCF). Промежуточные соединения формулы (VI) являются либо коммерчески доступными соединениями,либо могут быть получены согласно общепринятым реакционным методикам, известным в данной области. Например, промежуточные соединения формулы (VI) могут быть получены согласно следующей реакционной схеме (3): Схема 3 Реакционная схема (3) включает стадию (а), на которой R3, например, соответственно замещенный фенил, нафтил или Het, подвергают реакции Фриделя-Крафтса с соответствующим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса,такой как AlCl3, FeCl3, SnCl3, TiCl4 или ZnCl2, и, необязательно, подходящим реакционно-инертным растворителем, таким как метиленхлорид или этилендихлорид. Реакцию целесообразно осуществлять при температуре от комнатной до температуры кипячения с обратным холодильником. На следующей стадии(b) аминогруппу (-NR4(СН 2-С 6 Н 5 вводят путем взаимодействия промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином в присутствии подходящего растворителя, такого как, например, ацетонитрил, и, необязательно, в присутствии подходящего основания, такого как, например, K2CO3.- 12014834 Следующие примеры иллюстрируют настоящее изобретение, не ограничивая его. Экспериментальная часть В некоторых соединениях абсолютную стереохимическую конфигурацию присутствующего в нем стереогенного атома(атомов) углерода не определяли экспериментально. В таких случаях выделяемую первой стереохимически изомерную форму обозначают как "А", и второй - как "В", без дальнейшей ссылки на действительную стереохимическую конфигурацию. Однако указанные изомерные формы "А" и "В" могут быть однозначно охарактеризованы специалистом в данной области при помощи известных способов, таких как, например, рентгеновская дифракция. В том случае, если "А" и "В" представляют собой смеси стереоизомеров, в частности смеси диастереоизомеров, они могут быть подвергнуты дальнейшему разделению, при этом выделенные соответствующие первые фракции обозначают "А 1", соответственно "В 1", и вторые - "А 2", соответственно "В 2",без дальнейшей ссылки на действительную стереохимическую конфигурацию. Однако указанные изомерные формы "A1", "A2" и "B1", "B2", в частности указанные энантиомерные формы "A1", "А 2" и "B1","В 2", могут быть однозначно охарактеризованы специалистом в данной области при помощи известных способов, таких как, например, рентгеновская дифракция. При синтезе данных соединений приводится WO 2005/070924, включенный в данное описание посредством ссылки. В дальнейшей части описания Rt означает время удерживания (в минутах), получаемое при анализе ЖХМС. Экспериментальная часть В дальнейшей части описания "т.пл." означает температуру плавления, "ТГФ" означает тетрагидрофуран, "EtOAc" означает этилацетат, "МеОН" означает метанол, "ДМЭ" означает диметиловый эфир,"DIPE" означает диизопропиловый эфир, "ДМФА" означает N,N-диметилформамид, "Et3N" означает триэтиламин, "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий, "CDI" означает 1,1-карбонилбис 1 Н-имидазол. А. Получение промежуточных соединений. Пример А 1. Получение промежуточного соединения 1. Промежуточное соединение 1 Бензолпропаноилхлорид (0,488 моль) при комнатной температуре по каплям добавляют к раствору 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) и смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и концентрированный NH4OH и экстрагируютCH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток кристаллизуют из диэтилового эфира. Остаток (119,67 г) поглощают в CH2Cl2 и промывают 1 н. HCl. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 107,67 г промежуточного соединения 1. Пример А 2. Получение промежуточного соединения 2. Реакцию осуществляют дважды. POCl3 (1,22 5 моль) при температуре 10 С по каплям добавляют к ДМФА (0,525 моль). Затем при комнатной температуре добавляют промежуточное соединение 1. Смесь перемешивают в течение ночи при температуре 80 С, выливают на лед и экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают, получая 77,62 г (67%) промежуточного соединения 2. Продукт используют без дальнейшей очистки. Пример A3. Получение промежуточного соединения 3. Смесь промежуточного соединения 2 (0,233 моль) в CH3ONa (30%) в МеОН (222,32 мл) и МеОН(776 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 20/80 и затем 100/0; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 25 г (33%) про- 13014834 межуточного соединения 3 (т.пл.: 84 С). Пример А 4. а) Получение промежуточных соединений 4 и 5. Смесь хлорида алюминия (34,3 г, 0,257 моль) и 3-хлорпропаноилхлорида (29,7 г, 0,234 моль) в 1,2 дихлорэтане (150 мл) перемешивают при температуре 0 С. Добавляют раствор нафталина (30 г, 0,234 моль) в 1,2-дихлорэтане (50 мл). Смесь перемешивают при температуре 5 С в течение 2 ч и выливают в ледяную воду. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (56 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/CH2Cl2: 60/40; 20-45 мкм). Две фракции собирают и растворитель выпаривают, получая промежуточное соединение 4(31 г, 61%) в виде масла. Вторую фракцию (14 г) поглощают в DIPE, получая промежуточное соединение 5 (8,2 г, 16%; т.пл.: 68 С) в виде бледно-желтого твердого вещества. Следующее промежуточное соединение получают в соответствии с описанной выше методикой:b) Получение промежуточного соединения 6. Хлорид алюминия (0,3 моль) осторожно добавляют к 1,3-дифторбензолу (0,26 моль) и смесь нагревают при энергичном перемешивании до 50 С. 3-Хлорпропаноилхлорид (0,26 моль) по каплям добавляют в течение 15 мин при температуре 40 С (охлаждение на льду) и смесь перемешивают при температуре 50 С. Смесь выливают в воду (250 мл), лед (250 г) и HCl (25 мл) и перемешивают в течение 20 мин. Полученный осадок отфильтровывают и экстрагируют CH2Cl2 и водой. Выход: 40 г промежуточного соединения 6 (75%). Пример А 5. а) Получение промежуточного соединения 7. Смесь промежуточного соединения 4 (3 г; 0,0137 моль), N-бензолметиламина (2 мл; 0,0150 моль) в ацетонитриле (100 мл) перемешивают при температуре 80 С в течение 2 ч. При комнатной температуре добавляют воду. Смесь экстрагируют CH2Cl2. Органический слой отделяют и сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (6 г) очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/MeOH: 97/3; 20-45 мкм), получая масло. Выход: 4,2 г промежуточного соединения 7. Следующее промежуточное соединение получают согласно описанной выше методике:b) Получение промежуточного соединения 8. Смесь промежуточного соединения 6 (0,015 моль), N-этилбензолметанамина (0,016 моль) и K2CO3(0,016 моль) в ацетонитриле (30 мл) перемешивают при температуре 70 С в течение 2 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 4 г промежуточного соединения 8 (88%). Пример А 6. а) Получение промежуточного соединения 9. н-Бутиллитий (0,0075 моль) добавляют при температуре -20 С к раствору диизопропиламина(0,0075 моль) в ТФГ (50 мл). Смесь охлаждают до -70 С. Добавляют промежуточное соединение 3(0,0062 моль). Смесь перемешивают при -70 С в течение 1 ч 30 мин. Добавляют промежуточное соединение 7 (0,0075 моль). Смесь перемешивают в течение 1 ч 30 мин. Добавляют H2O. Смесь экстрагируют(3 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 90/10; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 1,5 г смеси двух диастереоизомеров (38%), т.е. промежуточное соединение 9. Следующее промежуточное соединение получают согласно описанной выше методике:b) Получение промежуточного соединения 10. н-Бутиллитий (0,0075 моль) добавляют при температуре -20 С к раствору диизопропиламина(0,0075 моль) в ТФГ (50 мл). Смесь охлаждают до -70 С. Добавляют промежуточное соединение 3(0,0061 моль). Смесь перемешивают при температуре -70 С в течение 1 ч 30 мин. Добавляют 4[метил(фенилметил)амино]-1-фенил-1-бутанон (0,0073 моль). Смесь перемешивают в течение 1 ч 30 мин. Добавляют H2O. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (4,9 г) очищают колоночной хроматографией на силикагеле (элюент: 100% H2Cl2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 1,43 г промежуточного соединения 10 (40%, смесь диастереоизомеров: 60/40). Следующие промежуточные соединения получают согласно описанной выше методике: с) Получение промежуточных соединений 11 и 12.- 16014834 н-Бутиллитий (0,0075 моль) добавляют при температуре -20 С к раствору диизопропиламина(0,0075 моль) в ТФГ (50 мл). Смесь охлаждают до -70 С. Добавляют промежуточное соединение 3(0,00824 моль). Смесь перемешивают при температуре -70 С в течение 1 ч 30 мин. Добавляют промежуточное соединение 8 (0,0099 моль). Смесь перемешивают в течение 1 ч 30 мин. Добавляют H2O. Смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (5,4 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан 60/40; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Выход: 0,95 г промежуточного соединения 11 в виде диастереоизомера А (15%, т.пл.: 171 С, МН+: 631, Rt: 11,24) и 0,83 г промежуточного соединения 12 в виде диастереоизомера В (13%, МН+: 631, Rt: 11,17). Пример А 7. Получение промежуточного соединения 17.(0,158 ммоль), ДМЭ (30 мл), МеОН (10 мл) и K2CO3 (1,6 мл) нагревают микроволнами (300 W, 68 С) в течение 10 мин. Смесь охлаждают, выливают в воду и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (1,4 г) очищают колоночной хроматографией на силикагеле (элюент: циклогексан/EtOAc 90/10; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,47 г промежуточного соединения 17 в виде смеси диастереоизомеров: (60/40) (41%). Пример А 8. а-1) Получение промежуточных соединений 13 и 14. 1-Хлорэтилхлорформиат (15 мл) добавляют при комнатной температуре к смеси промежуточного соединения 9 (0,0023 моль) в 1,2-дихлорэтане (30 мл). Смесь перемешивают при температуре 80 С в течение 1 ч. Растворитель выпаривают. Добавляют МеОН (15 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 30 мин. Растворитель выпаривают. Остаток(1,49 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH 97/3/0,1; 15-40 мкм). Две фракции собирают и растворитель выпаривают. Первый остаток (0,23 г) кристаллизуют из DIPE. Осадок отфильтровывают и сушат, получая 0,168 г (13%) промежуточного соединения 13 (диастереоизомер А) (т.пл.: 225 С). Второй остаток (0,32 г) кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 0,298 г (23%) промежуточного соединения 14 (диастереоизомер В) (т.пл.: 225 С). Следующее промежуточное соединение получают согласно описанной выше методике. Очистка полученного остаткауказана для каждого промежуточного соединения отдельно. а-2) Получение промежуточных соединений 15 и 16. Промежуточное соединение 13 (диастереоизомер А) (0,9 г) очищают хиральной хроматографией на силикагеле (элюент: 100% этанол). Две фракции собирают и растворитель выпаривают. Выход: 0,420 г промежуточного соединения 15 (энантиомер А 1) (т.пл.: 161 С, МН+: 541) и 0,397 г промежуточного соединения 16 (энантиомер А 2) (т.пл.: 158 С, МН+: 541). а-3) Получение промежуточных соединений 44 и 45. Смесь промежуточного соединения 43 (получено согласно A6.a) (1,5 г, 2,62 моль), формиата аммония (0,83 г, 0,013 моль) и палладия на угле (10%, 1,5 г) в метаноле (30 мл) нагревают при кипячении с обратным холодильником в течение 1 ч. Смесь охлаждают и фильтруют через короткий рыхлый слой целита. Добавляют воду. Органический слой экстрагируют этилацетатом, отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток (1,3 г) очищают колоночной хроматографией на силикагеле (элюент: MeOH/AcNH4: 60/40; кромасил C18, 5 мкм). Чистые фракции собирают и растворитель- 20014834 выпаривают, получая две фракции. Выход: 0,14 г промежуточного соединения 44 в виде диастереоизомера А (12%, МН+: 403) и 0,26 г промежуточного соединения 45 в виде диастереоизомера В (22%, МН+: 403). Пример А 9. Получение промежуточного соединения 18. Смесь промежуточного соединения 39 (получено согласно примеру А 8.а-1) (0,0002 моль) и CDI Смесь промежуточного соединения 13 (получено согласно примеру А 8.а-1) (0,00009 моль) и параформальдегида (0,0001 моль) в толуоле (5 мл) перемешивают при температуре 80 С. Смесь упаривают. Остатокочищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 99/1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,025 г соединения 1 (диастереоизомер А) (49%, т.пл.: 112 С). Следующие соединения получают в соответствии с описанной выше методикой. Очистка остатка указана в том случае, если она отличается от описанной выше очистки. Смесь промежуточного соединения 30 (получено согласно примеру А 8.а-1) (0,00009 моль) и параформальдегида (0,0001 моль) в толуоле (5 мл) перемешивают при температуре 80 С. Смесь упаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/MeOH 99/1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Остаток (0,11 г, 100%) кристаллизуют из диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 0,033 г соединения 14 (диастереоизомер В) Смесь соединения 3 (диастереоизомер А, полученный согласно примеру В 1) (0,1 ммоль) и иодметан(0,1 ммоль) в ацетоне (2 мл) перемешивают при комнатной температуре в течение 2,5 ч. Осадок отфильтровывают, промывают ацетоном и сушат. Выход: 0,031 г соединения 15 (диастереоизомер А) (48%, т.пл.: 211 С). Следующее соединение получают в соответствии с описанной выше методикой: Смесь соединения 1 (0,139 ммоль) и иодометана (0,139 ммоль) в ацетоне (3 мл) перемешивают при комнатной температуре в течение 3 ч. Осадок отфильтровывают, промывают диэтилэфиром и ацетоном и сушат. Выход: 0,060 г соединения 17 (диастереоизомер А) (76%, т.пл.: 245 С). Следующее соединение получают в соответствии с описанной выше методикой: Смесь соединения 1 (0,139 ммоль) и иодэтана (0,209 ммоль) в ацетоне (3 мл) перемешивают при комнатной температуре в течение 24 ч. Осадок отфильтровывают, промывают диэтилэфиром и ацетоном и сушат. Выход: 0,076 г соединения 19 (диастереоизомер А) (94%, т.пл.: 236 С). Следующее соединение получают в соответствии с описанной выше методикой: С. Аналитические методы. Массу соединений определяют методом ЖХМС (масс-спектрометрия с жидкостной хроматографией). Было использовано три описанных ниже способа. Полученные данные представлены ниже в табл. 1. Способ 1 ЖХМС. Анализ ЖХМС (положительная ионизация электрораспылением, сканирование от 100 до 900 аем(атомных единиц массы осуществляли на колонке Kromasil C18 (Interchim, Montluon, FR; 5 мкм,4,6150 мм) со скоростью потока, составляющей 1 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 30% 6,5 мМ ацетат аммония+40% ацетонитрил+30% муравьиную кислоту (2 мл/л); подвижная фаза В: 100% ацетонитрил) для получения градиентного состояния от 100% А за 1 мин до 100% В за 4 мин, от 100% В за 5 мин до 100% А за 3 мин и повторного уравновешивания 100% А за 2 мин. Способ 2 ЖХМС. Анализ ЖХМС (ионизация электрораспылением как с положительным, так и отрицательным (импульсным) сканированием от 100 до 1000 аем) осуществляли на колонке Kromasil C18 (Interchim, Montluon, FR; 3,5 мкм, 4,6100 мм) со скоростью потока, составляющей 0,8 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 35% 6,5 мМ ацетат аммония+30% ацетонитрил+30% муравьиная кислота (2 мл/л); подвижная фаза В: 100% ацетонитрил) для получения градиентного состояния от 100% А за 1 мин до 100% В за 4 мин, от 100% В со скоростью потока, составляющей 1,2 мл/мин, за 4 мин до 100% А со скоростью потока, составляющей 0,8 мл/мин, за 3 мин и повторного уравновешивания 100% А за 1,5 мин. Способ 3 ЖХМС. Анализ ЖХМС (ионизация электрораспылением как с положительным, так и отрицательным (импульсным) сканированием от 100 до 1000 аем) осуществляли на колонке Sunfire C18 (Waters, Millford,USA; 3,5 мкм, 4,6100 мм) со скоростью потока, составляющей 0,8 мл/мин. Использовали две подвижные фазы (подвижная фаза А: 35% 6,5 мМ ацетат аммония+30% ацетонитрил+30% муравьиная кислота(2 мл/л); подвижная фаза В: 100% ацетонитрил) для получения градиентного состояния от 100% А за 1 мин до 100% В за 4 мин, от 100% В со скоростью потока, составляющей 1,2 мл/мин, за 4 мин до 100% А со скоростью потока, составляющей 0,8 мл/мин, за 3 мин и повторного уравновешивания 100% А за 1,5 мин. Таблица 1 Основной пик ЖХМС Фармакологические примеры. Приготовление бактериальных суспензий для тестов на восприимчивость. Бактерии, используемые в данном исследовании, выращивают в течение ночи в колбах, содержащих по 100 мл питательной среды Mueller-Hinton (Becton Dickinson - кат.275730), в стерильной деио- 25014834 низированной воде при встряхивании, при температуре 37 С. Запасы (0,5 мл/пробирка) хранят при температуре -70 С до использования. Титрование бактерий осуществляют в планшетах для титрования и определяют количество колониеобразующих единиц (CFU). Как правило, для тестов на восприимчивость используют количество инокулята, составляющее приблизительно 100 CFU. Тестирование на антибактериальную восприимчивость. Определение IC90. Анализ с использованием планшетов для титрования. Стерильные 96-луночные пластиковые планшеты для титрования с плоским дном заполняют 180 мкл стерильной деионизированной воды, дополненной 0,25% BSA (бычий сывороточный альбумин). Затем по 45 мкл исходных растворов (конечная концентрация которых составляет 7,8) соединений помещают в колонку 2. Серийное пятикратное разведение (45 мкл в 180 мкл) осуществляют непосредственно в планшетах для титрования, начиная с колонки 2 по колонку 11. В каждый планшет для титрования включают контрольные образцы с инокулятом (колонка 1) и без него (колонка 12). В зависимости от типа бактерий в ряды А-Н, за исключением колонки 12, добавляют инокулят бактерий (100 TCID50) в количестве приблизительно от 10 до 60 CFU на лунку, в количестве, составляющем 100 мкл в 2,8 питательной среде Mueller-Hinton. Такой же объем питательной среды без инокулята добавляют в колонку 12 в ряду А-Н. Культуры инкубируют при температуре 37 С в течение 24 ч в нормальной атмосфере (инкубатор с открытым воздушным клапаном и постоянной вентиляцией). В конце инкубации, через день после инокуляции количественный рост бактерий определяют флуоресцентным способом. Для этого во все лунки через 3 ч после инокуляции добавляют резацурин (0,6 мг/мл) в количестве, составляющем 20 мкл,и планшеты снова инкубируют в течение ночи. Изменение цвета с голубого на розовый означает рост бактерий. Флуоресценцию определяют на компьютерном флуорометре (Cytofluor Biosearch) при длине волны возбуждения, составляющей 530 нм, и длине волны эмиссии, составляющей 590 нм. Процент увеличения ингибирования, обеспечиваемого данными соединениями, определяют стандартными способами. IC90 (выраженный в мкл/мл) определяют как 90% ингибирующую концентрацию бактериального роста. Полученные результаты представлены в табл. 2. Способ разведения агара. Величины MIC99 (минимальная концентрация для обеспечения 99% ингибирования бактериального роста) могут быть определены при помощи обычного способа разведения агара в соответствии со стандартами NCCLS (Институт клинических лабораторных стандартов. Тесты на микробную восприимчивость для аэробно растущих бактерий: одобренный стандарт - шестое издание), согласно которым питательная среда включает агар Mueller-Hinton. Испытания по определению срока гибели. Бактериальная или бактериостатическая активность соединений может быть определена путем проведения испытания по определению срока гибели с использованием способа микроразведения питательной среды (Zurenko, G.T. et al. In vitro activities of U-100592 and U-100766, novel oxazolidinone antibacterialagents. Antimicrob. Agents Chemother. 40, 839-845 (1996. В испытании по определению срока гибели Staphylococcus aureus и резистентного к метициллину S.aureus (MRSA) количество исходного инокулята S. aureus и MRSA составляет 106 КОЕ/мл в питательной среде Mueller-Hinton. Антибактериальные соединения используют в концентрации, в 0,1-10 раз превышающей MIC (т.е. IC90, определяемый в результате анализа с использованием планшета для титрования). Лунки без антибактериального агента служат для контроля роста культуры. Планшеты, содержащие микроорганизм и исследуемые соединения, инкубируют при температуре 37 С. Через 0, 4, 24 и 48 ч инкубации образцы извлекают для определения количества жизнеспособных микроорганизмов путем серийного разведения (10-1-10-6) в стерильном PBS и высевания (200 мкл) на агаре Mueller-Hinton. Планшеты инкубируют при температуре 37 С в течение 24 ч и определяют количество колоний. Кривые их гибели могут быть построены путем откладывания log10 КОЕ на мл против времени. Бактериальный эффект обычно определяют как 3-log10 увеличение количества КОЕ на мл по сравнению с необработанным инокулятом. Эффект потенциального переноса лекарственных средств устраняется путем серийных разведений и подсчета используемых для высевания колоний при наибольшем разведении. При разведении для высевания, составляющем 10-2, эффекта переноса не наблюдается. Это приводит к ограничению детектирования, составляющему 5102 КОЕ/мл или 2,7 log КОЕ/мл. Определение уровня клеточного ATP. Для того чтобы определить изменение общей концентрации клеточного АТР (при помощи биолюминесцентного набора Roche), поводят испытания по выращиванию запасов культуры S. aureus(АТСС 29213) в 100-мл колбах Mueller-Hinton и инкубируют в вибрационном инкубаторе в течение 24 ч при температуре 37 С (300 об./мин). Измеряют нм OD405 и подсчитывают количество КОЕ/мл. Культуры разводят до 1106 КОЕ/мл (конечная концентрация для измерения АТР: 1105 КОЕ/100 мкл на лунку) и добавляют исследуемое соединение в количестве, в 0,1-10 раз превышающем MIC (т.е. IC90, определяемый в результате анализа с использованием планшета для титрования). Инкубируют такие пробирки в течение 0, 30 и 60 мин при вращении со скоростью, составляющей 300 об./мин, и температуре, состав- 26014834 ляющей 37 С. Забирают 0,6 мл бактериальной суспензии из пробирок с защелкивающейся крышкой и помещают в новые 2-мл пробирки Эппендорфа. Добавляют 0,6 мл клеточного лизисного реагента (наборRoche), встряхивают с максимальной скоростью и инкубируют в течение 5 мин при комнатной температуре. Охлаждают на льду. Нагревают люминометр до 30 С (Luminoskan Ascent Labsystems с инжектором). Заполняют одну колонку (=6 лунок) 100 мкл такого же образца. При помощи инжекторной системы в каждую лунку добавляют по 100 мкл реагента люцифераза. Измеряют люминесценцию в течение 1 с. Таблица 2 Значения IC90 (мкг/мл), полученные согласно анализу с использованием планшета для титрованияSTA 29213 означает Staphylococcus aureus (ATCC29213); STA RMETH означает резистентный к метициллину Staphylococcus aureus (MRSA) (клинический изолят из университета Антверпена). АТСС означает Американскую коллекцию тканевых культур. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения для получения лекарственного средства для лечения бактериальной инфекции, при этом указанное соединение имеет формулу (Ia) его фармацевтически приемлемой кислотно-аддитивной или основно-аддитивной соли, его четвертичного амина, его стереохимически изомерной формы или его N-оксидной формы, гдеR1 представляет собой водород, галоген, Ar, Het, алкил, алкилокси; р представляет собой целое число, равное 1, 2, 3 или 4;R5 представляет собой водород или галоген;r представляет собой целое число, равное 1, 2, 3, 4 или 5; и- 27014834 алкил представляет собой прямой или разветвленный, насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; или циклический, насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному, насыщенному углеводородному радикалу, содержащему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо;Ar представляет собой фенил или нафтил;Het представляет собой фуранил; галоген представляет собой заместитель, выбранный из группы, включающей фтор, хлор, бром и йод, и при условии, что бактериальная инфекция не является микобактериальной инфекцией. 2. Применение по п.1, где R1 представляет собой галоген. 3. Применение по любому из предыдущих пунктов, где р равно 1. 4. Применение по любому из предыдущих пунктов, где r равно 1. 5. Применение по любому из предыдущих пунктов, где алкил представляет собой С 1-6 алкил. 6. Применение по любому из предыдущих пунктов, где бактериальная инфекция представляет собой инфекцию с грамположительной бактерией. 7. Соединение, выбранное из его стереохимически изомерная форма или его N-оксидная форма. 8. Комбинация (а) соединения, выбранного из соединений по п.7, и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. 9. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически активное количество (а) соединения, выбранного из соединений по п.7, и (b) одного или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами. 10. Применение комбинации по п.8 или фармацевтической композиции по п.9 для лечения бактериальной инфекции. 11. Продукт, содержащий (а) соединения, выбранные из соединений по п.7, и (b) один или более других антибактериальных агентов при условии, что один или более других антибактериальных агентов не являются антимикобактериальными агентами, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения для лечения бактериальной инфекции. 12. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную стафилококками, энтерококками и стрептококками. 13. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA), устойчивыми к метициллину коагуляза-отрицательными стафилококками (MRCNS), устойчивыми к пенициллину Streptococcuspneumoniae и мультирезистентными Enterococcus faecium. 14. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную Staphylococcus aureus или Streptococcus pneumoniae. 15. Применение по любому из пп.1-6 и 10, где бактериальная инфекция представляет собой инфекцию, вызванную устойчивыми к метициллину Staphylococcus aureus (MRSA).
МПК / Метки
МПК: A61K 31/4709, C07D 413/06, A61P 31/04
Метки: антибактериальных, средств, качестве, производные, хинолина
Код ссылки
<a href="https://eas.patents.su/29-14834-proizvodnye-hinolina-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве антибактериальных средств</a>
Предыдущий патент: Производные хинолина в качестве антибактериальных средств
Следующий патент: Получение пропилена и этилена из бутана и этана
Случайный патент: Окно с оконной рамой












