Вирусные цитруллинированные пептиды и их применение
Формула / Реферат
1. Антигенно эффективный пептид, включающий от N- до С-конца аминокислотную последовательность:
GPPWWPPICDPPQPSKTQGQSX1GQSX2GX3GX4GХ5GХ6GX7GKGKSХ8DKQХ9KPGGРWХ10РЕР (SEQ ID NO: 1), где аминокислоты X1-X10 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из X1-Х10 представляет собой остаток цитруллина или его функциональный фрагмент.
2. Пептид по п.1, включающий аминокислотную последовательность:
GQSX1GQSX2GX3GX4GX5GX6GX7GKG (аминокислоты 19-39 SEQ ID NO: 1), где аминокислоты X1-X7 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из X1-X7 представляет собой остаток цитруллина или его функциональный фрагмент.
3. Пептид по п.2, включающий аминокислотную последовательность:
GQSCitGQSCitGX3GCitGX5GХ6GX7GKG (SEQ ID NO: 27), где аминокислоты Х3-Х7 независимо выбраны из остатка аргинина или остатка цитруллина.
4. Пептид по п.2 или 3, включающий последовательность, выбранную из группы:
GQSRGQSCitGRGRGRGRGRGKG (SEQ ID NO: 4),
GQSRGQSRGRGCitGRGRGRGKG (SEQ ID NO: 6),
GQSRGQSCitGRGCitGRGRGRGKG (SEQ ID NO: 12),
GQSCitGQSCitGRGCitGRGRGRGKG (SEQ ID NO: 22) или
GQSCitGQSCitGCitGCitGCitGCitGCitGKG (SEQ ID NO: 2), где Cit представляет собой остаток цитруллина,
его функциональный фрагмент.
5. Пептид по любому из пп.1-4, представленный в линейной форме.
6. Пептид по любому из пп.1-4, представленный в форме многомерного разветвленного пептида.
7. Пептид по п.6, включающий четыре идентичные копии пептида по пп.1-4.
8. Пептид по п.7, представляющий собой (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4K2K бета-аланин:

где Cit представляет собой остаток цитруллина.
9. Применение пептида по любому из пп.1-8 в медицине.
10. Применение по п.9 в качестве агента против аутоиммунного заболевания.
11. Способ диагностики аутоиммунного заболевания у пациента, включающий стадию детекции антител, специфичных для аутоиммунного заболевания, в биологическом образце, полученном от пациента, с помощью
реакции в подходящих условиях указанного биологического образца по меньшей мере с одним пептидом любого из пп.1-7 с получением комплекса;
детекции комплекса,
причем аутоиммунное заболевание представляет собой ревматоидный артрит.
12. Способ по п.11, где биологический образец вступает в реакцию по меньшей мере с одним пептидом любого из пп.1-7 и с пептидом, включающим последовательность (GGDNНGCitGCitGCitGCitGCit GGGCitPGAPG)4K2K бета-аланина:
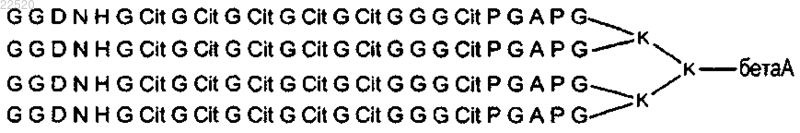
где Cit - цитруллин или его функциональный фрагмент.
13. Способ по п.11 или 12, где биологический образец вступает в реакцию с пептидом, включающим последовательность (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4 K2 K бета-аланина:

где Cit - цитруллин или его функциональный фрагмент,
и с пептидом, включающим последовательность (GGDNНGCitGCitGCitGCitGCitGGGCitPGAPG)4K2K бета-аланина:
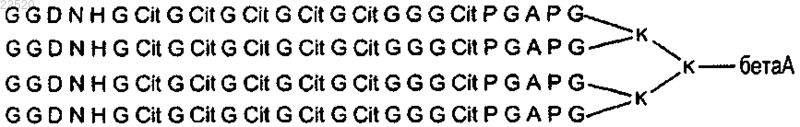
где Cit - цитруллин или его функциональный фрагмент.
14. Способ по любому из пп.11-13, представляющий собой иммунологический способ.
15. Набор реагентов для диагностики аутоиммунного заболевания, включающий по меньшей мере один пептид любого из пп.1-8 или его функциональный фрагмент.
16. Набор реагентов по п.15, дополнительно включающий пептид, включающий последовательность (GGDNНGCitGCitGCitGCitGCitGGGCitPGAPG)4K2K бета-аланина:

где Cit - цитруллин или его функциональный фрагмент.
17. Пептид по п.10, где аутоиммунное заболевание представляет собой ревматоидный артрит.
18. Пептид из набора по п.15, где аутоиммунное заболевание представляет собой ревматоидный артрит.
19. Фармацевтическая композиция, включающая фармацевтически приемлемое и эффективное количество пептида по любому из пп.1-10 или его функционального фрагмента.
Текст
ВИРУСНЫЕ ЦИТРУЛЛИНИРОВАННЫЕ ПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ Настоящее изобретение относится к антигенно эффективному пептиду,включающему от(SEQ ID NO: 1), где аминокислоты X1-X10 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из X1-X10 представляет собой остаток цитруллина или его функциональный фрагмент, а также относится к их применениям. Область техники Настоящее изобретение относится к новым цитруллинированным синтетическим пептидам, полученным из вируса Эпштейна-Барра, и к их применению в диагностике и лечении аутоиммунных заболеваний, в частности, ревматоидного артрита (РА). Уровень техники В широком спектре воспалительных заболеваний суставов ревматоидный артрит (РА) занимает особое место. Вызывая симметричное и деструктивное воспаление в малых и в крупных суставах РА приводит к появлению боли и к разрушению сустава, приводя в конечном итоге к выраженному пороку и к инвалидности. Появление различных антител является отличительным признаком РА. Лучше всего известен ревматоидный фактор (RF), класс антител IgG или IgM, направленных против Fc-участка IgG-изотипа иммуноглобулинов. Примерно 70-80% РА-пациентов сероположительны к RF, но RF также обнаруживается при хронических инфекциях, лимфопролиферативных заболеваниях, других ревматоидных заболеваниях и встречается почти у 20% здоровых индивидуумов старшего возраста. Таким образом, при условии ограниченной специфичности RF для RA, изыскивали другие более специфичные антитела. Со всей очевидностью было продемонстрировано, что APF-антитела (антиперинуклеарный фактор) и AKA (антикератиновые антитела) являются высоко специфичными к заболеванию. Позже было обнаружено, что антигены, распознаваемые APF-антителами и AKA, представляют собой цитруллинсодержащие белки, генерированные пост-трансляционно путем модификации аргининов в остатки цитруллина. Был разработан метод тИФА (ELISA) с использованием синтетических цитруллинированных пептидов (ЦП), полученных из филагрина (G.A. Schellekens et al. J. Clin. Invest. 1998, 101,273). Для повышения чувствительности теста ЦП модифицировали с получением структуры циклического цитруллинированного пептида (ЦЦП), в котором компонент цитруллина оптимально экспонирован для связывания с антителом (международная заявка WO 1998022503). В так называемом ЦЦП 1-тесте(G.A. Schellekens et al. Arthritis Rheum. 2000, 43, 155) антитела можно было детектировать в 68% сывороток РА-пациентов со специфичностью 98% к единственному ЦЦП. Недавние исследования выявляют,что ЦЦП-тест второго поколения ЦЦП 2 (J. Avouac et al. Ann. Rheum. Dis. 2006, 65, 845) очень чувствителен и специфичен, демонстрируя чувствительность 68% (интервал 39-94%) со специфичностью 95% (интервал 81-100%). Недавно в INOVA был разработан анализ третьего поколения (L. Lutteri et al. Clin. Chirm.Acta 2007, 386, 76) и было заявлено, что он является новым более чувствительным анти-ЦЦП тИФА, который сохраняет специфичность 98%. Все эти анализы тИФА являются коммерчески доступными (Euro-Diagnostica,Arnhem, The Netherlands; Axis-Shield, Dundee, Scotland; INOVA, San Diego, USA). Кроме того, был подан ряд патентных заявок, относящихся к методам детекции антител у РАпациентов на основе цитруллинированных белков/пептидов (US 20020143143, US 20070087380, ЕР 1946109, US 20070148704, WO 2009007846, WO 2009000077, WO 2007017556, ЕР 1456662, WO 1999028344, WO 2008132264). Различные цитруллинированные белки были описаны в синовиальной жидкости при РА, например,экстраваскулярный цитруллинированый фибрин (С. Masson-Bessiere et al. J. Immunol. 2001, 166, 4177),коллаген II (H. Burkhardt et al. Eur. J. Immunol. 2005, 35, 1643) и виментин в макрофагах (E.R. Vossenaar etal. Arthritis Rheum. 2004, 50, 3485). Хотя филагрин не экспрессируется в синовиальной жидкости, его цитруллинированные производные использовали для детекции анти-ЦП антител (US 20090028885, US 7445903, US 6890720). РА включает одновременно генетические и внешние факторы влияния, и в течение продолжительного времени предполагали, что вирусы стимулируют развитие РА. Для того чтобы быть вероятными кандидатами на ключевую роль в РА, вирусы должны повсеместно присутствовать внутри организма,должны демонстрировать прямой или косвенный тропизм для суставов и должны быть способны к изменению иммунного ответа хозяина. Вирус Эпштейна-Барра (EBV) демонстрирует эти характеристики. В результате на потенциальных связях между EBV и РА были сфокусированы исследования последних трех десятилетий (K.Н. Costenbader et al. Arthritis Res. Ther. 2006, 8, 204). Известно, что пациенты с РА обладают повышенным уровнем антител к белкам латентного и репликативного EBV и особенно кEBNA-1 (ядерный антиген 1 вируса Эпштейна-Барра). Кроме того, нагрузка EBV периферической крови у РА-пациентов выше, чем в контролях. Ряд исследований пролил свет на возможную этиологическую роль EBV в синовиальной оболочке у РА-пациентов (S. Sawada et al. Autoimmun. Rev. 2005, 4, 106). Эти исследования привели к мысли изучить иммунный ответ у РА-пациентов с использованием ЦП вирусного происхождения. Антитела, специфичные к пептиду, соответствующему последовательности EBNA-1(35-58) (вирусный цитруллинированный пептид 1, VCP1), содержащему цитруллин вместо аргинина,детектировали в 50% РА-сывороток и в менее чем 5% сывороток здоровых или больных контролей (F.Pratesi et al. Arthritis Rheum. 2006, 54, 733). Кроме того, аффинно очищенные анти-VCP1 антитела из сыворотки РА-пациентов реагировали с полученным из филагрина ЦП, с дезиминированным фибриногеном и с дезиминированным рекомбинантным EBNA-1. Частоту анти-VCP1 антител определяли в 627 образцах сыворотки, 300 из пациентов с РА, и 327 из контролей, включающих пациентов с заболеваниями соединительной ткани, хроническим артритом и здоровых доноров. Анти-VCP1 антитела были обна-1 022520Incaprera et al. [Clin, and Exp. Rheum. 1998, 16(3), 289-294] раскрыли потенциальную роль EBV в аутоиммунном заболевании системная красная волчанка. Конкретно, в этом документе выявлено, чтоEBNA-2(354-373) распознает анти-SmD1 IgG антитела. Цитруллинированные пептиды на основе дезиминированного EBNA-1(35-58) представляют собой цель международной заявки WO2004087747, в которой описано их применение для детекции антител в сыворотке РА-пациентов. В этой заявке также раскрыто, что применение пептида со множеством антигенов (multiple antigen peptide) [MAP; J. P. Tarn PNAS U.S.A. 1988, 85, 5409], содержащего по меньшей мере 4 копии дезиминированного EBNA-1(35-58) в качестве антигена покрытия в иммунологическом анализе для детекции антител, дает возможность детекции антител в 45% сывороток РА-пациентов со специфичностью 95%. Сущность изобретения Настоящее изобретение относится к новым цитруллинированным синтетическим пептидам, полученным из EBV, и к их применению в диагностике и лечении аутоиммунных заболеваний, особенно РА. Конкретно, эти последовательности получают из белков EBV (например, EBNA-1, EBNA-2). Цитруллинированные пептиды согласно изобретению имеют аминокислотную последовательность, включенную в последовательность участка 320-375 а.к. белка EBNA-2 EBV (Swiss-Prot P12978). Неожиданно было продемонстрировано, что пептиды, описанные в изобретении и содержащие остатки цитруллина в количестве более чем один, очень подходят для специфичной диагностики РА. С целью повышения чувствительности с сохранением специфичности анализа авторы настоящего изобретения искали другие дезиминированные последовательности вирусного происхождения для разработки анализов диагностики РА. С этой целью пептидные последовательности, полученные из белковEBV, синтезировали с различной степенью замен аргинин/цитруллин и тестировали на реактивность в сыворотке РА-пациентов (табл. 1). Среди них некоторые последовательности позволяли дифференцировать РА-сыворотку из нормальных контролей. Лучшие результаты были получены с цитруллинированными пептидами,полученными из дезиминированного пептида(GQSRGQSRGRGRGRGRGRGKG). Эти последовательности и их применение в диагностике и лечении аутоиммунных расстройств являются целью настоящего изобретения. Конкретно, настоящее изобретение демонстрирует, что не цитруллинированный EBNA-2(338-358) не реагирует с РА-сывороткой. В отличие от этого цитруллинированные пептиды по изобретению демонстрируют повышенную реактивность по отношению к РА-сыворотке. Также демонстрируется, что популяция IgG, идентифицированная пептидами по изобретению, характеризуется тем, что она представляет собой РА-специфичные анти-ЦП IgG и не специфичные для SLE анти-SmD1 IgG. В настоящем изобретении также идентифицировали два эпитопа,один из которых характеризуется повторами Gly-Cit, а другой повторами Gly-Gln-Ser-Cit, причем положения Cit-341, Cit-345 и Cit-349 являются наиболее реактивными. Пептиды по изобретению получают из участка EBNA-2 (320-375). Таким образом, целью настоящего изобретения является антигенно эффективный пептид, включающий от N- до С-конца аминокислотную последовательность: GPPWWPPICDPPQPSKTQGQSX1GQSX2GX3GX4GX5GX6GX7GKGKSX8DKQX9KPGGPWX10PEP (формула I, SEQ ID NO:1), где аминокислоты X1-Х 10 независимо выбраны из остатка аргинина или остатка цитруллина, и по меньшей мере один из X1-X10 представляет собой остаток цитруллина или его функциональный фрагмент. Предпочтительно пептид включает аминокислотную последовательность GQSX1GQSX2GX3GX4GX5GX6GX7GKG (формула II, аминокислоты 19-39 SEQ ID NO:1), где аминокислоты Х 1-Х 7 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из Х 1-Х 7 представляет собой остаток цитруллина или его функциональный фрагмент. Еще более предпочтительно пептид включает аминокислотную последовательностьGQSCitQSCitGX3GCitGX5GX6GX7GKG (SEQ ID NO:27), где аминокислоты Х 3-Х 7 независимо выбраны из остатка аргинина или остатка цитруллина. Еще более предпочтительно, пептид включает аминокислотную последовательность, выбранную из группы:GQSCitGQSCitGCitGCitGCitGCitGCitGKG (SEQ ID NO:2), где Cit представляет собой остаток цитруллина, его функциональный фрагмент. В предпочтительном варианте осуществления пептид представлен в линейной форме. Еще более предпочтительно пептид представлен в форме многомерного разветвленного пептида или другого конъюгированного комплекса. Многомерный разветвленный пептид состоит из центральной структуры MAP; линейного пептида, имеющего аминокислотную последовательность формулы I, II и/или IV, связанного посредством карбамидной связи с каждым из концевых аминокислотных остатков центральной структуры MAP, где линейные пептиды являются идентичными или отличаются друг от друга. Согласно изобретению центральная структура MAP представляет собой где X представляет собой аминокислоту, содержащую по меньшей мере два функциональных остатка аминогруппы, Y представляет собой аминокислоту, выбранную из группы, состоящей из аланина,и/или глицина, и/или лизина, и/или молекулы, используемой в качестве спейсера, m составляет 0 или 1,n1, n2, n3, n4 представляют собой целые числа, заключенные в интервале от 0 до 10, и где связь представляет собой карбамидную связь. Таким образом, MAP или конъюгат, включающий множество копий цитруллинированного линейного синтетического пептида или антигенно эффективного фрагмента, полученного из него, как описано выше, связанный с иммунологически инертным аминокислотным кором, также попадает в рамки настоящего изобретения. Предпочтительно многомерный разветвленный пептид включает четыре идентичных копии пептида по изобретению. Еще более предпочтительно многомерный разветвленный пептид представляет собой (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4K2K бета-аланин: где Cit представляет собой остаток цитруллина. Пептиды, как описано выше, в свободной форме или связанные с соответствующими смолами, могут использоваться для лечения пациентов, подверженных аутоиммунному заболеванию, такому как РА,например, благодаря их высокой специфичности в распознавании антител, они могут использоваться для селективного удаления антитела, а также в качестве иммуномодулятора заболевания. Таким образом, следующей целью изобретения является пептид, определенный выше, для медицинского применения. Предпочтительно для применения в качестве агента против аутоиммунного заболевания. Пептиды, описанные в изобретении, реактивны по отношению к специфичным антителам, присутствующим в сыворотке пациентов с аутоиммунным заболеванием, конкретно у РА-пациентов. Антитело,присутствующее в биологических жидкостях пациентов с аутоиммунным заболеванием, будет связываться с пептидами по изобретению. Как указано выше, цитруллинированные пептиды по изобретению как в линейной форме, так и в форме MAP, особенно подходят для использования в качестве антигенов в анализе для детекции присутствия и/или для измерения уровня антител, специфичных для аутоиммунного заболевания, таких как анти-ЦП антитела, в образце биологической жидкости. С целью осуществления анализа пептиды могут быть адсорбированы или ковалентно связаны или модифицированы с использованием носителя для связывания их с твердой подложкой (например, такой как чипы, микросферы, золото, полистирол, реакционные сосуды или камеры, микропланшеты). На первой стадии способа анализируемый образец биологической жидкости помещают в контакт и инкубируют с пептидом по изобретению, который может быть соединен с твердой подложкой. Любые антитела, специфичные для аутоиммунного заболевания, такие как анти-ЦП антитела, которые возможно присутствуют в образце, таким образом специфично связываются с пептидом по изобретению с получением комплекса антиген/антитело. Анти-ЦП антитела, детектируемые в иммуноанализе, это иммуноглобулиныIgG, IgA или IgM. Оценка количественного присутствия комплекса антиген/антитело может осуществляться с использованием спектроскопического, пьезоэлектрического или электрохимического биосенсора. Вышеописанный способ может представлять собой иммунологический анализ тИФА, в котором индикаторное антитело, подобное антителу, связывающему человеческий иммуноглобулин, конъюгируется с ферментом и добавляется для измерения антительного титра с помощью спектроскопического преобразователя. Таким образом, следующей целью изобретения является способ диагностики аутоиммунного заболевания у пациента, включающий стадию детекции антител, специфичных для аутоиммунного заболевания в биологическом образце с помощью реакции в подходящих условиях указанного биологического образца по меньшей мере с одним пептидом, описанным выше, с получением комплекса; детекции комплекса. Более высокую чувствительность и специфичность способа получают, когда пептиды используются в форме MAP или в форме другого конъюгированного комплекса. Конкретно, в форме четырехвалентных MAP. Таким образом, предпочтительно биологический образец реагирует по меньшей мере с одним пептидом по изобретению, причем пептид включает последовательность (GGDNHGCitGCitGCitGCitGCitGGGCitPGAPG)4 K2 K бета-аланина: где Cit - цитруллин или его функциональный фрагмент. Было обнаружено, что с помощью способа, основанного на объединенном применении MAP цитруллинированных пептидов формулы (I) и MAP дезиминированного EBNA-1(35-58) последовательностиGGDNHGCitGCitGCitGCitGCitGGGCitPGAPG (формула III, SEQ ID NO: 3), получают наиболее чувствительный и специфичный тест для детекции специфичных для РА антител. Таким образом, предпочтительно биологический образец вступает в реакцию с пептидом, включающим последовательность (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4K2K бета-аланина (формула V,также называемый VCP-2): где Cit - цитруллин или его функциональный фрагмент, и с пептидом, включающим последовательность (GGDNHGCitGCitGCitGCitGCitGGGCitPGAPG)4K2K бета-аланина (формула VI, также называемый где Cit - цитруллин или его функциональный фрагмент. В предпочтительном варианте осуществления способ представляет собой иммунологический анализ. Следующей целью изобретения является набор реагентов для диагностики аутоиммунного заболевания, включающий по меньшей мере один пептид по изобретению или его функциональный фрагмент. Предпочтительно, набор реагентов дополнительно включает пептид, включающий последовательность (GGDNHGCitGCitGCitGCitGCitGGGCitPGAPG)4K2K бета-аланина (формула VI, также называемый где Cit - цитруллин или его функциональный фрагмент. Конкретно, набор реагентов дает возможность детектировать анти-ЦП антитела в биологических жидкостях. Диагностический набор реагентов включает комбинацию цитруллинированных пептидов, определенных выше или их функциональных фрагментов, и по меньшей мере один дополнительный реагент. Предпочтительно дополнительный реагент представляет собой антитело, связывающее человеческий иммуноглобулин, конъюгированное с ферментом, способным вступать в реакцию с хромогенным субстратом. В настоящем изобретении предпочтительным аутоиммунным заболеванием является ревматоидный артрит. Другой целью изобретения является фармацевтическая композиция, включающая фармацевтически приемлемое и эффективное количество пептида по изобретению или его функционального фрагмен-4 022520 та. В настоящем изобретении "антигенно эффективный" обозначает, что пептид или его функциональный фрагмент способен специфично связываться с антителами, специфичными для аутоиммунного заболевания, и/или с Т-клетками, специфичными для аутоиммунного заболевания. Подробное описание изобретения Изобретение может быть проиллюстрировано посредством иллюстративных не ограничивающих примеров со ссылкой на следующие фигуры. Фиг. 1. 79 РА-сывороток тестировали с помощью тИФА для оценки присутствия различных популяций аутоантител, сравнивая реактивность по отношению к следующим антигенам: ЦЦП 2, ЦЦП 3,VCP1 [пептид формулы (VI)] и VCP2 [пептид формулы (V)]. Присутствие различных популяций аутоантител изображено на структурной схеме. Количество РА-сывороток, положительных (+) или отрицательных (-) по отношению к анти-ЦЦП 2, анти-ЦЦП 3, анти-VCP1 [пептид формулы (VI)] и анти-VCP2 [пептид формулы (V)] представлены на диаграмме выше. Выделены популяции антител, положительных кVCP1 [пептид формулы (VI)] и/или VCP2 [пептид формулы (V)], но отрицательных к ЦЦП 2 и ЦЦП 3. Фиг. 2. Распределение антител к цитруллинированным пептидам/белкам (АСРА - анти-ЦП антитела) детектировали с помощью VCP2 у 100 РА-пациентов, 100 нормальных здоровых субъектов (NHS) и в 206 контрольных заболеваниях (анкилозирующий спондилоартрит, AS; инфекционный мононуклеоз, IM; криоглобулинемия смешанного типа, МС; ревматическая полимиалгия, PMR; псориатический артрит,PsA; синдром Шегрена, SjS; системная красная волчанка, SLE; склеродермия, Ssc; недифференцированный артрит, UA). Образцы сыворотки тестировали с помощью тИФА с использованием метода, описанного в примере 2. Результаты демонстрируют высокую специфичность VCP2 в детекции АСРА у РАпациентов. Кроме того, антитела детектировали в контролях заболеваний и конкретно в IM и SLE, в отличие от результатов, описанных у Incaprera et al. [Clin Exp Rheumatol 1998, 16, 289], где было описано детектирование IgG с использованием не дезиминированной последовательности EBNA2(354-373) в сыворотке IM и SLE. Фиг. 3. Корреляция между анти-ЦЦП и анти-VCP2 антителами. 100 РА-сывороток анализировали с помощью ЦЦП 2-теста и с помощью VCP2 с использованием метода, описанного в примере 2. Результаты демонстрируют значительную корреляцию (р 0,0001) между двумя популяциями антител, демонстрирующую, что анти-VCP2 антитела представляют собой АСРА и поэтому они специфичны для РА и не специфичны для других аутоиммунных заболеваний. Фиг. 4. Выделение анти-VCP2 антител из РА-сывороток осуществляли согласно способу, описанному в примере 4. Четыре препарата анти-VCP2 антител из 4 различных РА-сывороток тестировали с помощью тИФА на VCP2, не дезиминированный EBNA2 (338-358) и на контроль MAP. Анти-VCP2 IgG демонстрирует очень высокую реактивность с VCP2, с MAP, полученным из цитруллинированногоEBNA2 (338-358), и демонстрирует отсутствие связывания с аргинин-содержащим EBNA2 (338-358) и с контрольным MAP. Пример 1. Пептидный синтез Пептиды синтезировали с использованием смолы Wang, предварительно нагруженной С-концевой аминокислотной последовательностью или предварительно нагруженной коровой последовательностьюMAP, и следовали стратегии твердофазного пептидного синтеза Fmoc/tBu. Снятие защитных групп Fmoc проводили в течение 20 мин с использованием 20% пиперидина в DMF. Реакции конденсации осуществляли путем обработки смолы в течение 45 мин с помощью 0,5 М раствора Fmoc-защищенных аминокислот и HOBt в DMF (2,5 экв), 0,5 М раствор TBTU в DMF (2,5 экв) и 4 М NMM в DMF (5 экв). Отщепление пептидов от смолы и снятие защитных групп с боковых цепей аминокислот проводили в течение 3 ч с помощью TFA тиоанизол/этандитиол/фенол/H2O (82,5:5:2,5:5:5). Сырые продукты осаждали с помощью холодного Et2O, центрифугировали и лиофилизировали. Чистые пептиды получали с помощьюHPLC со степенью чистоты 95% и охарактеризовывали с помощью масс-спектрометрии (ESI-Orbitrap и/или MALDI-TOF). Пример 2. тИФА для определения анти-ЦП антителMAP цитруллинированных пептидных антигенов согласно изобретению разводили до концентрации 20 мкг/мл в фосфатно-солевом буфере (PBS) и загружали в лунки полистироловых микропланшетов(50 мкл/на лунку). Планшет оставляли на ночь при +4 С, чтобы прошла реакция между пептидом и пластиком (однако он мог инкубироваться при 37 С в течение 1-2 ч с тем же результатом). По завершении периода нанесения покрытия лунки, содержащие антиген, а также равное количество лунок, используемых в качестве контролей, обрабатывали в течение 1 ч при комнатной температуре (КТ) с помощью 3% бычьего сывороточного альбумина (BSA) в PBS. Образцы сывороток пациентов (разведенные 1:200 в буфере, состоящем из 1% BSA, 0,05% Tween X-100 в PBS) затем загружали в планшет (50 мкл/лунка) и оставляли инкубироваться в течение 3 ч при КТ. После периода инкубации осуществляли одну промывку с использованием 1% PBS Tween X-100 и две промывки с помощью PBS (150 мкл/на лунку). Антитела,связывающие человеческие IgG, IgM или IgA, конъюгированные с ферментом щелочной фосфатазой (соответственно, разведенные 1:3000, 1:1000 и 1:3000) в 1% PBS BSA, 0,05% Tween X-100, использовали для демонстрации того, что имеет место реакция антиген/антитело. Антитело (50 мкл/на лунку) затем инкубировали в течение 3 часов при КТ с перемешиванием. По завершении инкубирования после трех промывок, описанных выше, в лунки добавляли субстрат щелочной фосфатазы (п-нитрофенилфосфат) и в присутствии фермента получали желтый продукт, измеряемый спектрофотометрически при длине волны 405 нм; его количество было пропорционально титру связанных антител. Результаты теста выражали в виде процента положительности, рассчитываемого путем деления поглощения каждого образца на поглощение положительного образца сыворотки, значение которой произвольно устанавливали как 100. Образцы сыворотки от 104 пациентов, страдающих РА, от 97 нормальных здоровых субъектов(NHS) и от 194 контролей заболеваний (системная красная волчанка, системная склеродерма, синдром Шегрена, криоглобулинемия смешанного типа, псориатический артрит, анкилозирующий спондилоартрит, ревматическая полимиалгия и инфекционный мононуклеоз) тестировали с помощью данного метода с использованием пептида формулы (V). Предполагая, что каждый результат, который составляет выше чем 97,5 процентиль нормальной контрольной группы, является положительным по отношению к пептиду формулы (V), анти-ЦП IgG антитела были обнаружены в 67/104 (64%), IgM в 48/104 (46%) и IgA в 41/104 (40%) образцов сыворотки пациентов с РА, и у менее чем 5% нормальных здоровых субъектов и в контролях заболеваний. Пример 3. Специфичность пептидов по отношению к другим аутоиммунным заболеваниям Фиг. 2 демонстрирует распределение АСРА, детектированных с помощью VCP2 у 100 РАпациентов, 100 нормальных здоровых субъектов (NHS) и у 206 контролей заболеваний (анкилозирующий спондилоартрит, AS; инфекционный мононуклеоз, IM; криоглобулинемия смешанного типа, МС; ревматическая полимиалгия, PMR; псориатический артрит, PsA; синдром Шегрена, SjS; системная красная волчанка, SLE; склеродермия, Ssc; недифференцированный артрит, UA). Образцы сыворотки тестировали с помощью ИФА с использованием метода, описанного в примере 2. Результаты демонстрируют высокую специфичность VCP2 в детектировании АСРА у РА-пациентов. Кроме того, антитела детектировали в контролях заболеваний и конкретно в IM и SLE, в отличие от результатов, описанных у Incaprera et al. [Clin Exp Rheumatol 1998, 16, 289], где была описана детекция IgG с использованием не дезиминированной последовательности EBNA2(354-373) в сыворотке IM и SLE. Кроме того, фиг. 3 демонстрирует корреляцию между анти-ЦЦП и анти-VCP2 антителами. 100 РАсывороток анализировали с помощью ЦЦП 2-теста и с помощью VCP2 с использованием метода, описанного в примере 2. Результаты демонстрируют значительную корреляцию (р 0,0001) между двумя популяциями антител, демонстрирующую, что анти-VCP2 антитела представляют собой АСРА и поэтому они специфичны для РА и не специфичны для других аутоиммунных заболеваний. Пример 4. тИФА для сравнения антител к ЦП формулы (V) и антител к ЦП формулы (VI) Способность распознавать специфичные антитела у РА-пациентов с помощью MAP формулы (V),по сравнению с MAP формулы (VI) оценивали с помощью тИФА.MAP формулы (V) и MAP формулы (VI) разводили соответственно до концентрации 20 и 5 мкг/мл в PBS, загружали в лунки полистиролового микропланшета (50 мкл/на лунку), оставляли на ночь при+4 С. По завершении периода нанесения покрытия лунки обрабатывали в течение 1 ч при КТ с помощью 3% BSA в PBS. Образцы сывороток пациентов (разведенные 1:200 в буфере, состоящем из 1% BSA,0,05% Tween X-100 в PBS) затем загружали в планшет (50 мкл/лунка) и оставляли инкубироваться в течение 3 ч при КТ. После периода инкубации осуществляли одну промывку с использованием 1% PBSIgG, конъюгированное с ферментом щелочной фосфатазы (50 мкл/на лунку), разведенное 1:3000 в 1%PBS BSA, 0,05% Tween X-100, инкубировали в течение 3 ч при КТ, со встряхиванием. По завершении инкубации после трех промывок, описанных выше, в лунки добавляли п-нитрофенилфосфат и определяли поглощение при длине волны 405 нм. Результаты теста выражали в виде процента положительности,рассчитанного путем деления поглощения каждого образца на поглощение положительного образца сыворотки, значение которой произвольно устанавливали как 100. Образцы сывороток 100 пациентов, страдающих РА, тестировали с помощью этого метода. Предполагая, что каждый результат, который составляет выше чем 97,5 процентиль нормальной контрольной группы, является положительным, были обнаружены антитела анти-ЦП MAP формулы (VI) у 7% РАпациентов и антитела анти-ЦП MAP формулы (V) у 64%. Таким образом, использование антител антиЦП MAP формулы (V) привело к более высокой чувствительности с сохранением такой же специфичности 95%. Пример 5. Очистка анти-ЦП антител и их применения Анти-ЦП антитела могут быть очищены из сыворотки РА-пациентов посредством процедур аффинной хроматографии. Цитруллинированный пептид или MAP согласно настоящему изобретению конъюгировали с CNBrактивированной сефарозой согласно стандартным процедурам, известным специалисту в данной области. Общее количество иммуноглобулинов из сывороток, содержащих анти-ЦП антитела, осаждали с помощью насыщенного 50% сульфата аммония; осадки растворяли в фосфатном буфере (рН 7,4) и диализовали в течение ночи против PBS. Обогащенные препараты иммуноглобулинов прогоняли через колон-6 022520 ку и проточную жидкость собирали для последующего анализа. Колонку интенсивно промывали с помощью 20 мМ Na2HPO4, 150 мМ NaCl (pH 7,2) и антитела, связанные с колонкой, элюировали с помощью 0,1 М глицинового буфера (рН 2,8) (0,5 мл/на фракцию), сразу нейтрализовали с помощью 50 мклTris 1 M (рН 8) и диализовали в течение ночи против PBS. Содержание анти-ЦП антител в элюатах и в проточной жидкости тестировали с помощью тИФА. Такие очищенные антитела можно использовать в качестве контролей в твердофазных анализах с использованием цитруллинированных антигенов. Кроме того, четыре препарата анти-VCP2 антител из 4 различных РА-сывороток тестировали с помощью тИФА на VCP2, не дезиминированный EBNA2(338-358) и на контроль MAP. Анти-VCP2 IgG демонстрируют очень высокую реактивность с VCP2, с MAP, полученными из цитруллинированной последовательности EBNA2 (338-358), и демонстрирует отсутствие связывания с аргинин-содержащимEBNA2(338-358) и с контрольным MAP (фиг. 4). Пример 6. Роль количества и положения цитруллинов Роль количества и положения цитруллинов внутри последовательности EBNA-2 (338-358) в детекции специфичных антител в РА-сыворотках исследовали посредством в разной степени цитруллинированных пептидов (табл. 1). Таблица 1 Образцы сыворотки 24 РА-пациентов и 23 нормальных здоровых субъектов (NHS) тестировали с помощью тИФА с использованием метода, описанного в примере 2. Предполагая, что каждый результат,который составляет выше чем 97,5 процентиль нормальной контрольной группы, является положительным, было обнаружено, что чувствительность теста увеличивается соответственно количеству цитруллинов и зависит от их положений внутри последовательности. В частности, не дезиминированная последовательность EBNA-2 (338-358) не распознает антител IgG в соответствующем количестве РА-сывороток(предполагая, что результат является релевантным, когда количество положительных по РА пациентов составляет выше, чем 25% от общей РА-популяции). Результат соответствует данным в области РАдиагностики, из которых известно, что антитела направлены против цитруллинированных последовательностей. Введение единственного остатка цитруллина в EBNA-2 (338-358) демонстрирует, что положения 345 и 349 важны для распознавания, так как пептиды, где каждое положение цитруллинировано,демонстрируют повышенный процент положительных РА-сывороток. Считается, что эти два положения относятся к двум различным антигенным участкам. Введение двух остатков цитруллина демонстрирует, что пептид [Cit345, Cit349] EBNA2 (338-358) является наиболее активным и селективным ди-цитруллинированным пептидом. Этот результат подтверждает, что положения 345 и 349 важны для распознавания. Следует заметить, что пептид [Cit349, Cit351] также является очень активным. Однако он менее специфичен и селективен. Кроме того, данные, полученные для три-цитруллинированных EBNA-2(338-358), демонстрируют,что пептид [Cit341, Cit345, Cit349] EBNA2 (338-358) является наиболее активным пептидом в этом ряду. Этот результат подтверждает, что положения 341, 345 и 349 важны для распознавания. Считается, что было идентифицировано два эпитопа: один в повторах Gly-Cit и другой в повторах Gly-Gln-Ser-Cit. Пример 7. Диагностические свойства тИФА на основе одновременного использования MAP формулы (V) и MAP формулы (VI) Для получения высокочувствительного иммуноанализа эквимолярной смеси MAP формулы (V) иMAP формулы (VI) давали адсорбироваться на 96-луночных микропланшетах в течение 4 ч при КТ. Тест затем осуществляли, как описано в примере 2. Используя MAP формулы (V) и MAP формулы (VI) в качестве агентов покрытия, антитела можно было обнаружить у 68% РА-пациентов. Объединенное применение цитруллинированного пептида MAP формулы (V) и цитруллинированного MAP формулы (VI) улучшает параметры диагностики анализов на основе единственного пептида, приводя к получению высокочувствительных анализов для диагностики РА. По существу, в популяции из 79 РА-пациентов, тестированных на анти-ЦЦП 2, анти-ЦЦП 3 и антивирусные цитруллинированные MAP пептиды формулы (V) и (VI), авторы обнаружили, что 44/79 (56%) являются анти-ЦЦП 2 положительным, 48/79 (61%) анти-ЦЦП 3 положительными, 49/79 (62%) реагируют с пептидом формулы (VI) и 41/79 (52%) реагируют с пептидом формулы (V). Примечательно 7/79 (9%) анти-ЦЦП 2 и анти-ЦЦП 3 отрицательные сыворотки положительны к пептиду формулы (VI); 2/79 (3%) анти-ЦЦП 2 и анти-ЦЦП 3 отрицательные сыворотки являются положительными к пептиду формулы (V); 1/79 (1%) анти-ЦЦП 2 и анти-ЦЦП 3 отрицательная сыворотка положительна к обоим пептидам формулы(V) и формулы (VI). Таким образом, формула (V) и (VI) дает возможность детектировать антитела в подгруппе анти-ЦЦП отрицательных РА-пациентов (фиг. 1). Сравнивая результаты, полученные с MAP формулы (V) и MAP формулы (VI), было обнаружено,что большинство РА-сывороток содержит антитела, реагирующие с обоими MAP. Примечательно, что 15% РА-сывороток содержит антитела, реагирующие с каждым из двух дезиминированных MAP формулы (V) и (VI), предполагая, что две антительные популяции перекрываются, но являются различными. Т-клеточный ответ Авторы изобретения также обнаружили, что цитруллинированные пептиды по изобретению способны распознавать не только анти-ЦП антитела, описанные выше, но также Т-клетки, специфичные к цитруллинированным пептидам. Т-клетки, специфичные к цитруллинированным пептидам, характеризуют некоторые иммунные заболевания, в которых имеет место клеточно-опосредованный иммунный ответ к цитруллинированным антигенам. Например, при рассеянном склерозе (MS) было продемонстрировано существование Т-клеток, специфичных к основному белку дезиминированного миелина (MBP)[L.R. Tranquill et al., Mult. Scler. 2000, 6, 220]. Цитруллинированные синтетические пептиды по изобретению как в линейной форме, так и в формеMAP, могут таким образом использоваться в качестве антигенов для детекции Т-клеток, специфичных к цитруллинированным антигенам. Тип анализа, широко применяемого для детекции антиген-специфичных Т-клеток, представляет собой тест пролиферации, в котором лейкоциты периферической крови пациента растут вместе со ступенчато изменяющимися дозами антигена, в данном случае цитруллинированного синтетического пептида,описанного выше. Если пациент ранее встречался с цитруллинированными пептидами и имеет достаточное количество Т-клеток, специфичных к ним, то будет иметь место пролиферации в присутствии данного антигена. Как ожидалось, в тесте необходимо вводить вещество, способное индуцировать пролиферацию всех Т-клеток, (митоген) в качестве положительного контроля, а также некоторые антигены, против которых,как предполагается, пациент не иммунизирован, в качестве отрицательного контроля. Цитруллинированные пептиды по изобретению, особенно в форме MAP, представляют собой оптимальные антигены для данного типа анализа. Фактически известно, что полимерная структура MAP облегчает их процессирование и презентацию Т-клеткам. Антиген-специфичные Т-клетки могут быть морфологически и функционально охарактеризованы,например, они могут анализироваться с помощью цитофлуорометрии на предмет экспрессии поверхностных молекул и продуцирования цитокинов. Терапевтическое применение Наконец, цитруллинированные пептиды по изобретению как в линейной форме, так и в формеMAP, также могут использоваться в качестве модуляторов иммунного ответа в аутоиммунных заболеваниях, например РА. Цитруллинированные синтетические пептиды по изобретению могут использоваться для лечения пациентов, подверженных PA, MS или другим аутоиммунным заболеваниям, в которых было продемонстрировано существование клеточно-опосредованного иммунного ответа на дезиминированные антигены. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Антигенно эффективный пептид, включающий от N- до С-конца аминокислотную последовательность:(SEQ ID NO: 1), где аминокислоты X1-X10 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из X1-Х 10 представляет собой остаток цитруллина или его функциональный фрагмент. 2. Пептид по п.1,включающий аминокислотную последовательностьGQSX1GQSX2GX3GX4GX5GX6GX7GKG (аминокислоты 19-39 SEQ ID NO: 1), где аминокислоты X1-X7 независимо выбраны из остатка аргинина или остатка цитруллина и по меньшей мере один из X1-X7 представляет собой остаток цитруллина или его функциональный фрагмент. 3. Пептид по п.2,включающий аминокислотную последовательностьGQSCitGQSCitGX3GCitGX5GX6GX7GKG (SEQ ID NO: 27), где аминокислоты Х 3-Х 7 независимо выбраны из остатка аргинина или остатка цитруллина. 4. Пептид по п.2 или 3, включающий последовательность, выбранную из группы:GQSCitGQSCitGCitGCitGCitGCitGCitGKG (SEQ ID NO: 2), где Cit представляет собой остаток цитруллина,его функциональный фрагмент. 5. Пептид по любому из пп.1-4, представленный в линейной форме. 6. Пептид по любому из пп.1-4, представленный в форме многомерного разветвленного пептида. 7. Пептид по п.6, включающий четыре идентичные копии пептида по пп.1-4. 8. Пептид по п.7, представляющий собой (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4K2K бетааланин: где Cit представляет собой остаток цитруллина. 9. Применение пептида по любому из пп.1-8 в медицине. 10. Применение по п.9 в качестве агента против аутоиммунного заболевания. 11. Способ диагностики аутоиммунного заболевания у пациента, включающий стадию детекции антител, специфичных для аутоиммунного заболевания, в биологическом образце, полученном от пациента, с помощью реакции в подходящих условиях указанного биологического образца по меньшей мере с одним пептидом любого из пп.1-7 с получением комплекса; детекции комплекса,причем аутоиммунное заболевание представляет собой ревматоидный артрит. 12. Способ по п.11, где биологический образец вступает в реакцию по меньшей мере с одним пептидом любого из пп.1-7 и с пептидом, включающим последовательность (GGDNHGCitGCitGCitGCitGCit где Cit - цитруллин или его функциональный фрагмент. 13. Способ по п.11 или 12, где биологический образец вступает в реакцию с пептидом, включающим последовательность (GQSCitGQSCitGCitGCitGCitGCitGCitGKG)4K2K бета-аланина: где Cit - цитруллин или его функциональный фрагмент,и с пептидом,включающим где Cit - цитруллин или его функциональный фрагмент. 14. Способ по любому из пп.11-13, представляющий собой иммунологический способ. 15. Набор реагентов для диагностики аутоиммунного заболевания, включающий по меньшей мере один пептид любого из пп.1-8 или его функциональный фрагмент. 16. Набор реагентов по п.15, дополнительно включающий пептид, включающий последовательность (GGDNHGCitGCitGCitGCitGCitGGGCitPGAPG)4K2K бета-аланина: где Cit - цитруллин или его функциональный фрагмент. 17. Пептид по п.10, где аутоиммунное заболевание представляет собой ревматоидный артрит. 18. Пептид из набора по п.15, где аутоиммунное заболевание представляет собой ревматоидный артрит. 19. Фармацевтическая композиция, включающая фармацевтически приемлемое и эффективное количество пептида по любому из пп.1-10 или его функционального фрагмента.
МПК / Метки
МПК: C07K 14/05, C07K 14/00, C07K 14/47
Метки: цитруллинированные, вирусные, применение, пептиды
Код ссылки
<a href="https://eas.patents.su/28-22520-virusnye-citrullinirovannye-peptidy-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Вирусные цитруллинированные пептиды и их применение</a>
Предыдущий патент: Панировка, предназначенная для приготовления или разогревания пищевых продуктов в микроволновой печи
Следующий патент: Соединения тетрагидробензотиофена, фармацевтическая композиция на их основе, их применение и способ лечения гиперфосфатемии
Случайный патент: Способ получения производных пиперазина












