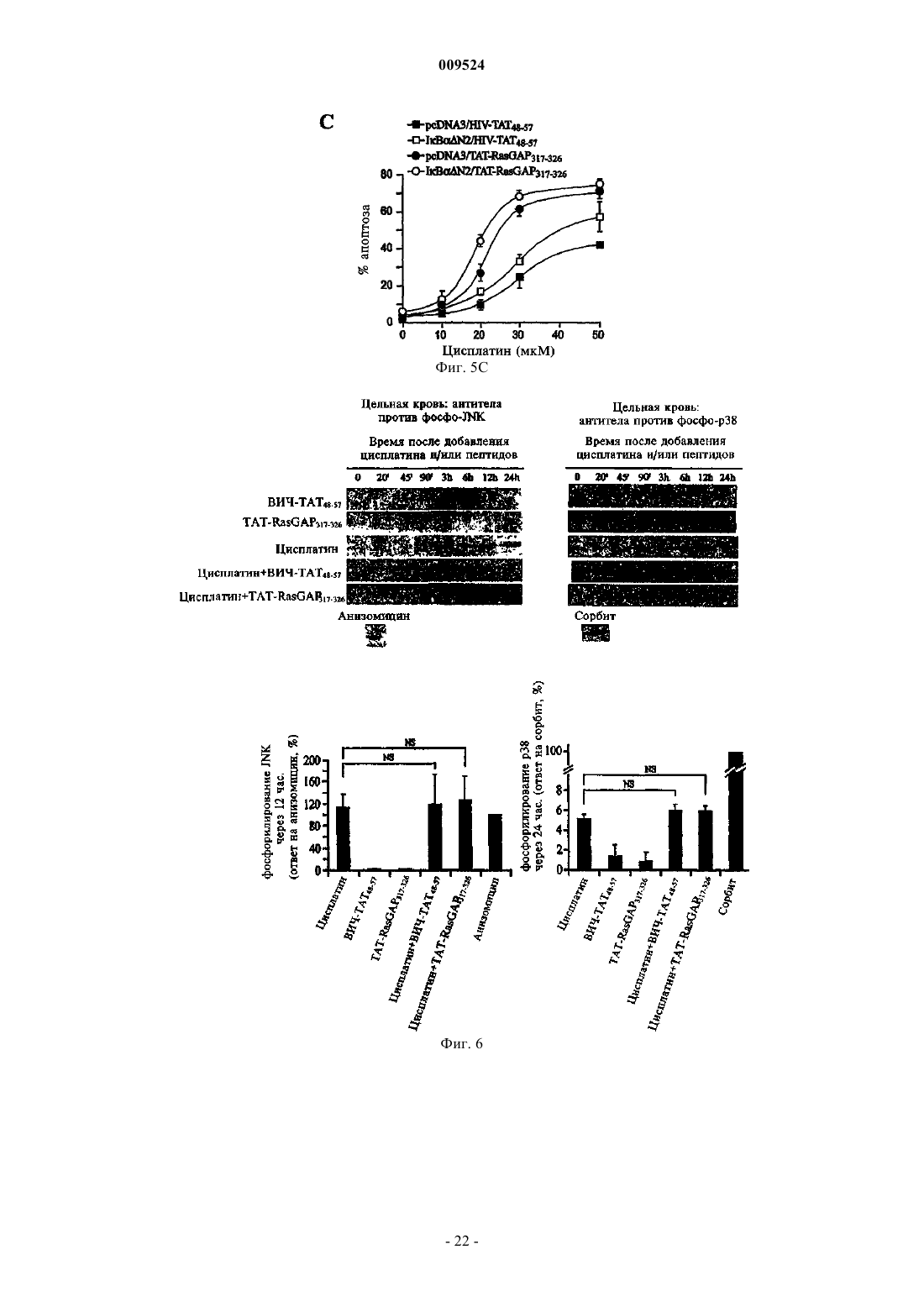
Способ уничтожения раковых клеток (варианты), фармацевтическое средство (варианты) и набор для его осуществления
Формула / Реферат
1. Фармацевтическая композиция для уничтожения раковых клеток или апоптоза, содержащая в качестве активной субстанции лекарственное средство, способное вызвать апоптоз или уничтожение клеток, отличающаяся тем, что она дополнительно содержит фармацевтически эффективное количество по меньшей мере одного пептида, состоящего в основном из последовательности N2 белка RasGAP, ее фрагмента или варианта, предпочтительно с фармацевтически приемлемыми носителями, разбавителями и вспомогательными компонентами.
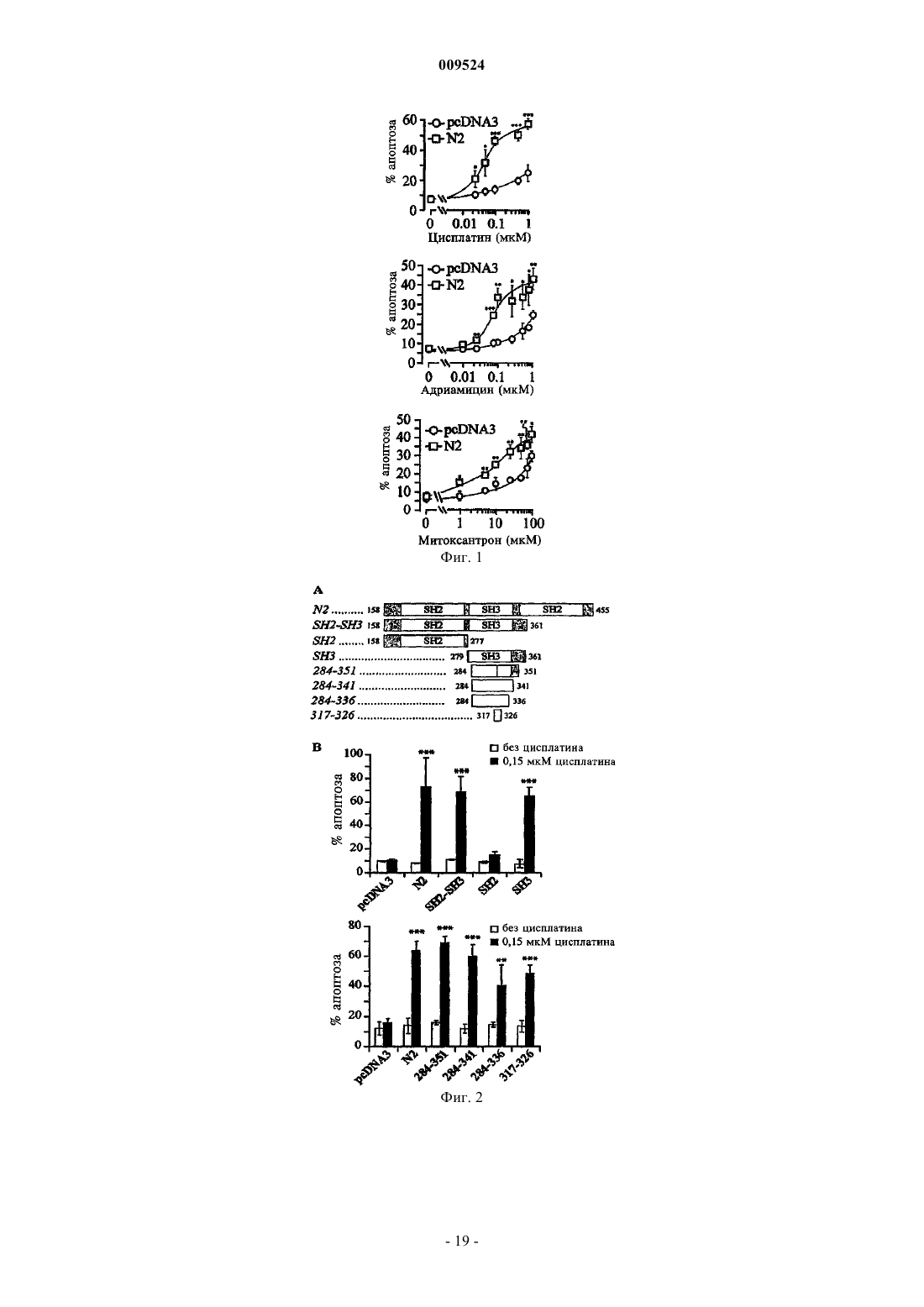
2. Фармацевтическая композиция по п.1, отличающаяся тем, что фрагмент последовательности N2 белка RasGAP содержит домен SH3, ее часть или вариант.
3. Фармацевтическая композиция по п.2, отличающаяся тем, что часть или вариант домена SH3 содержит не более 70 аминокислот его последовательности.
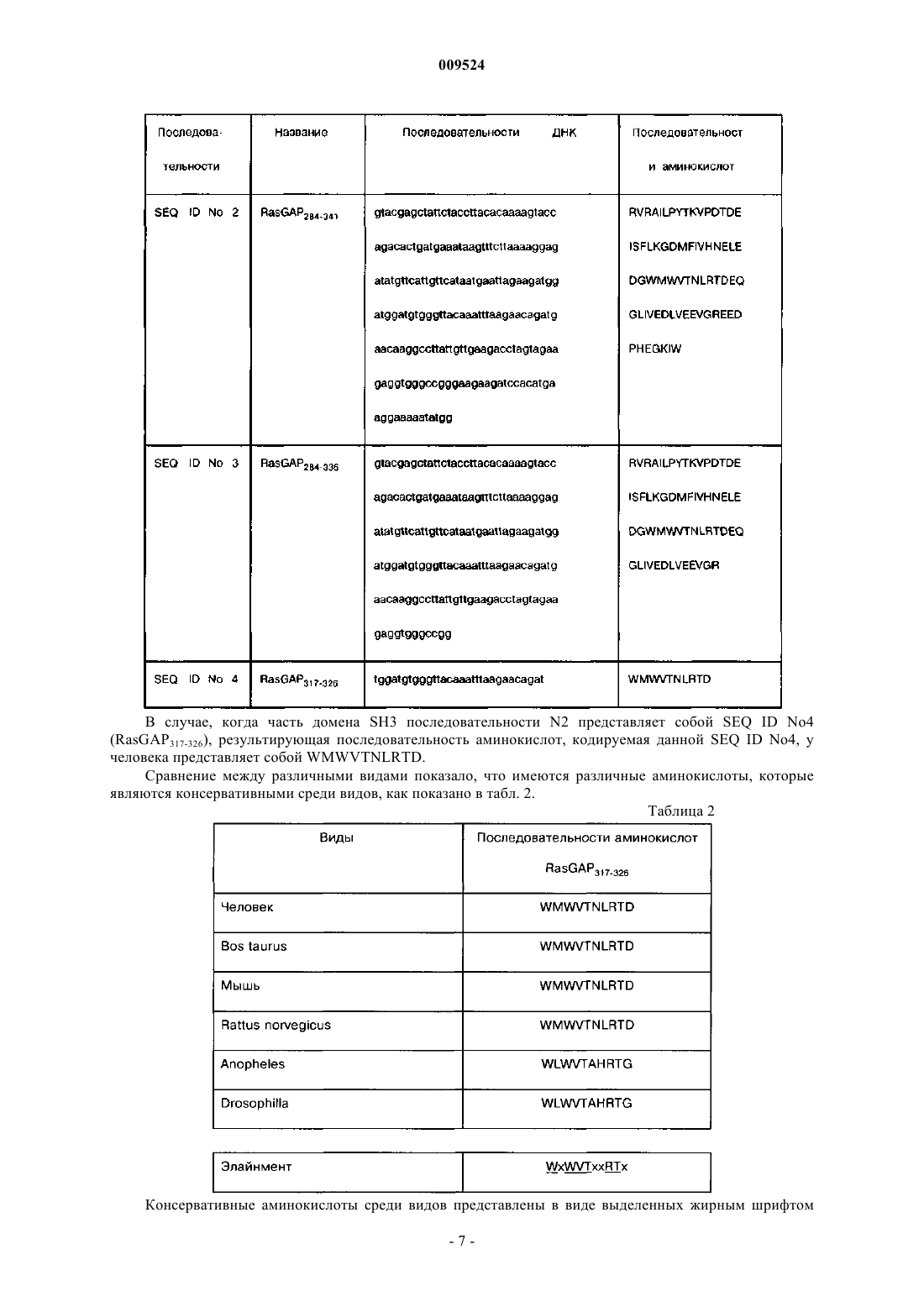
4. Фармацевтическая композиция по п.3, отличающаяся тем, что часть домена SH3 содержит аминокислотную последовательность, кодируемую одной из последовательностей ДНК, выбранной из группы SEQ ID No.1, SEQ ID No.2, SEQ ID No.3 или SEQ ID No.4.
5. Фармацевтическая композиция по п.3, отличающаяся тем, что часть или вариант домена SH3 содержит аминокислотную последовательность WXWVTXXRTX, в которой X означает остаток аминокислоты.
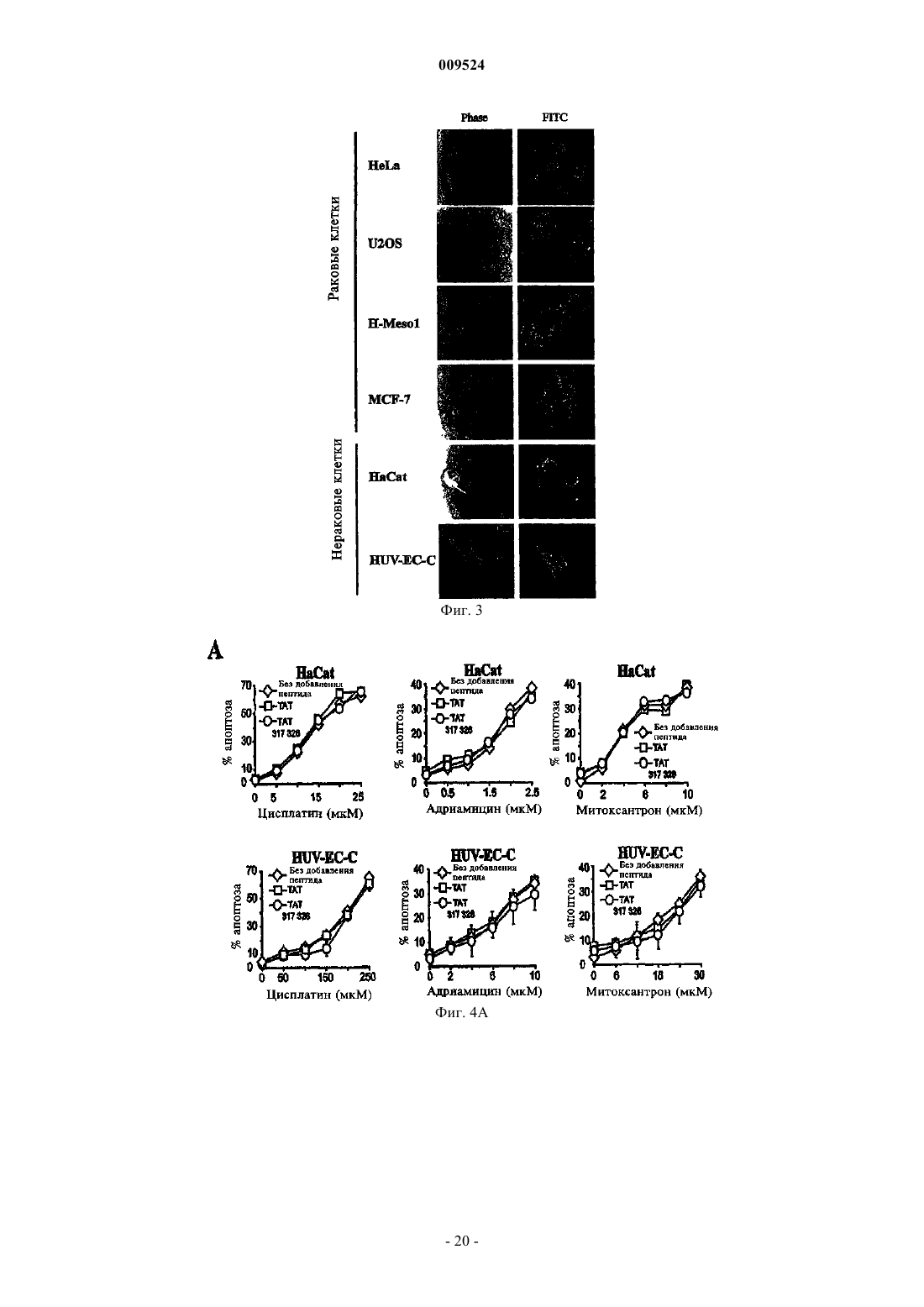
6. Фармацевтическая композиция по пп.1-5, отличающаяся тем, что указанный пептид конъюгирован с агентом, который повышает накопление указанного пептида в клетке.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что агент представляет собой носитель, проникающий через клеточную мембрану.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что указанный носитель является пептидом.
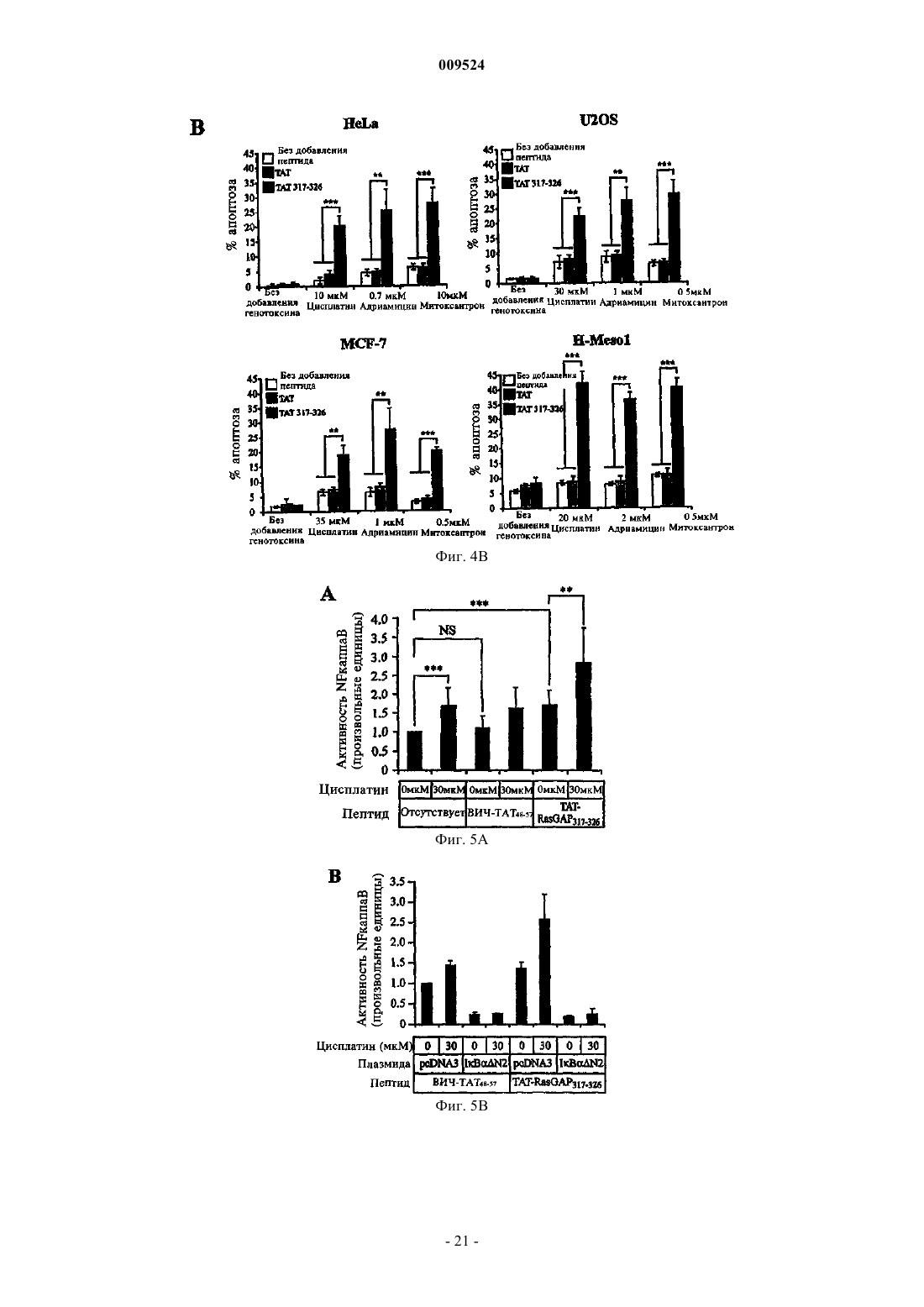
9. Фармацевтическая композиция по п.8, отличающаяся тем, что указанный пептид содержит повторяющиеся остатки аргинина и выбран из группы, включающей пептид ВИЧ-ТАТ48-57, пептид FHV-оболочки35-49, пептид HTLV-II Rex4-16 и пептид BMV gag7-25.
10. Фармацевтическая композиция по п.9, отличающаяся тем, что пептид представляет собой пептид ВИЧ-ТАТ48-57.
11. Фармацевтическая композиция по пп.1-10, отличающаяся тем, что указанное лекарственное средство представляет собой генотоксин.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что генотоксин выбран из группы, содержащей алкилирующие агенты, антиметаболиты, агенты, разрезающие ДНК, агенты, связывающие ДНК, токсины, действующие на топоизомеразу, и токсины, действующие на веретено.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что алкилирующие агенты выбраны из группы, содержащей ломустин, кармустин, стрептозоцин, мехлортамин, мелфалан, урацил-азотно-горчичное соединение, хлорамбуцил, циклосфамид, ифосфамид, цисплатин, карбоплатин, митомицин, тиотепа, дакарбацин, прокарбацин, гексаметилмеламин, триэтиленмеламин, бусульфан, пипоброман, митотан и другие производные платины.
14. Фармацевтическая композиция по п.12, отличающаяся тем, что агент, разрезающий ДНК, представляет собой блеомицин.
15. Фармацевтическая композиция по п.12, отличающаяся тем, что токсины, действующие на топоизомеразу, выбраны из группы, содержащей топотекан, иринотекан, камптотецина натриевую соль, даорубицин, доксорубицин, идарубицин, митоксантрон, тенипозид, адриамицин и этопозид.
16. Фармацевтическая композиция по п.12, отличающаяся тем, что агенты, связывающие ДНК, выбраны из группы, содержащей дактиномицин и митрамицин.
17. Фармацевтическая композиция по п.12, отличающаяся тем, что токсины, действующие на веретено, выбраны из группы, содержащей винбластин, винкристин, навелбин, паклитаксел и доцетаксел.
18. Фармацевтическая композиция по п.12, отличающаяся тем, что антиметаболиты выбраны из группы, содержащей метотрексат, триметрексат, пентостатин, циторабин, ара-СМР, флударабин фосфат, гидроксимочевину, фторурацил, флоксаридин, хлордезоксиаденозин, гемцитабин, тиогуанин и 6-меркаптопурин.
19. Фармацевтическая композиция по п.11, отличающаяся тем, что генотоксин выбран из группы, содержащей цисплатин, митоксантрон и адриамицин.
20. Фармацевтическая композиция по пп.1-19, которая является лекарственным средством для лечения или профилактики рака.
21. Применение фармацевтической композиции по пп.1-19 в качестве средства получения лечебного или профилактического медикамента против рака.
22. Применение по п.21, в котором рак выбран из группы, состоящей из карциномы, лимфомы, бластомы, саркомы, липосаркомы, нейроэндокринной опухоли, мезотелиомы, шваномы, менингиомы, аденокарциномы, меланомы, лейкоза, лимфоидных злокачественных новообразований, рака сквамозных клеток, рака эпителиальных сквамозных клеток, рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, сквамозной карциномы легкого, рака брюшины, гепатоцеллюларного рака, желудочного рака или рака желудка, желудочно-кишечного рака, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы, пенильной карциномы, рака яичка, рака пищевода, опухоли желчных путей и рака головы и шеи.
23. Применение по п.22, в котором рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы.
24. Способ лечения или профилактики рака, отличающийся тем, что рак выбран из группы, состоящей из карциномы, лимфомы, бластомы, саркомы, липосаркомы, нейроэндокринной опухоли, мезотелиомы, шваномы, менингиомы, аденокарциномы, меланомы, лейкоза, лимфоидных злокачественных новообразований, рака сквамозных клеток, рака эпителиальных сквамозных клеток, рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, сквамозной карциномы легкого, рака брюшины, гепатоцеллюларного рака, желудочного рака или рака желудка, желудочно-кишечного рака, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы, пенильной карциномы, рака яичка, рака пищевода, опухоли желчных путей и рака головы и шеи, и включает введение пациенту терапевтически эффективного количества фармацевтической композиции по пп.1-19.
25. Способ по п.24, отличающийся тем, что рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы.
26. Способ селективного усиления апоптоза в раковой клетке, заключающийся в том, что раковая клетка контактирует с фармацевтической композицией по пп.1-19.
27. Способ селективного уничтожения раковых клеток, заключающийся в том, что раковая клетка контактирует с фармацевтической композицией по пп.1-19.
28. Набор для лечения или профилактики рака, содержащий по меньшей мере одно лекарственное средство, отличающийся тем, что он дополнительно содержит по меньшей мере один пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или варианта, который усиливает селективность действия в отношении раковых клетках, и предпочтительно дополнительные реагенты.
29. Набор по п.28, отличающийся тем, что он дополнительно содержит отдельную фармацевтическую дозированную форму, представляющую собой дополнительный противораковый агент, выбранный из группы, состоящей из лекарственных препаратов, антител против рецепторов эпидермального фактора роста, радиоиммунотерапевтических агентов и их комбинаций.
Текст
009524 Область техники, к которой относится изобретение Данное изобретение относится к химии природных соединений, фармакологии и медицине, конкретно к пептидам, в основном состоящим из аминокислотной последовательности N2 белка RasGAP, ее фрагментов или вариантов, и фармацевтической композиции, содержащей в качестве активного начала,кроме известных противоопухолевых препаратов, по меньшей мере один из указанных пептидов, которая обладает повышенной селективностью апоптоза или уничтожения раковых клеток и может быть использована для лечения и профилактики различных форм рака. Сведения о предшествующем уровне техники Опухоли разнообразны и гетерогенны, но все они обладают способностью бесконтрольной пролиферации. Нерегулируемая клеточная пролиферация в сочетании с подавленной апоптотической чувствительностью составляет минимальное требование, при котором происходит развитие опухоли. Апоптоз представляет собой процесс, в результате которого в клетках начинается запрограммированная гибель клеток, жизненный феномен, который происходит во время развития и который является основным для поддержания гомеостаза. Биохимическим событием, которое, как полагают, необратимо вводит клетку в апоптоз, является активация каспаз (цистеинпротеаз, расщепляющих после остатков аспарагиновой кислоты). Клетки, в которых происходит апоптоз, демонстрируют характерные морфологические и биохимические изменения, включая образование мембранных пузырьков, приобретение клеткой округлой формы, конденсацию хроматина, расщепление ДНК, экспрессию апоптотических маркеров на поверхности клетки и ингибирование антиапоптотических путей передачи сигнала. Все данные события могут блокироваться специфическими ингибиторами каспаз. Именно вследствие этого во время апоптоза наблюдают расщепление субстрата каспаз, которое ответственно за большинство, если не все характерные изменения. Осуществление фазы апоптоза запускается, когда происходит расщепление субстратов каспазы в клетке. Идентифицированы десятки субстратов каспаз и их перечень неизменно растет (см. статью Earnshaw W.C. et al., "Mammalian caspases: structure, activation, substrates, and functions during apoptosis" (Каспазы млекопитающих: структура, активация, субстраты и функции во время апоптоза) Annu. Rev. Biochem. 68, 383, 1999). Будучи расщепленными, субстраты каспаз опосредуют биохимические и морфологические события, наблюдаемые при апоптозе, такие как усиление амплификации каспаз, фрагментация ДНК, распад ядра и т.п. Кроме того, было показано, что пути митоген-активируемой протеинкиназы (MAPK) регулируют апоптоз положительным или отрицательным образом (см. статьи Jarpe M.B. et al., "Anti-apoptotic versuspro-apoptotic signal transduction: checkpoints and stop signs along the road to death" (Антиапоптотическая сигнальная трансдукция относительно проапоптотической, точки регуляции и стоп-сигналы на пути к гибели), Oncogene, 17, 1475, 1998; Widmann С. et al., "Mitogen-activated protein kinase: conservation of athree-kinase module from yeast to human" (Митоген-активируемая протеинкиназа: консервативность модуля трех киназ от дрожжей до человека), Physiol. Rev. 79, 143, 1999). Это могло бы объяснить, почему апоптотические каспазы направлены на некоторые из белков передачи сигнала, которые регулируют MAPK и/или компоненты путей MAPK (см. статью Widmann С. etsignals" (Каспаза-зависимое расщепление белков передачи сигнала при апоптозе. Механизм выключения антиапоптотических сигналов), J. Biol. Chem., 273, 7141, 1998). Данные белки включают MEKK1, PAK2, Mst1 and RasGAP. Недавно Yang и Widmann, (см. статьи Yang J.-Y. и Widmann С. "Antiapoptotic signaling generated bycaspase-induced cleavage of RasGAP" (Передача антиапоптотического сигнала, генерированного индуцированным каспазой расщеплением RasGAP), Mol. Cell. Biol., 21, 5346, 2001; "A subset of caspase substratesfunctions as the Jekyll and Hyde of apoptosis" (Подгруппа субстратов каспаз действует как Джекил и Хайд апоптоз) Eur. Cytokine Netw., 13, 387, 2002 а; "The RasGAP N-terminal fragment generated by caspase cleavage protects cells in a Ras/PI3K/Akt-dependent manner that does not rely on NFkappa В"(N-концевой фрагмент RasGAP, генерированный каспазным расщеплением защищает клетки Ras/PI3K/Akt-зависимым образом, который не связан с NFкаппаB) J. Biol. Chem., 277, 14641, 2002b), показали, что RasGAP, регулятор ГТФ-связывающих белков Ras и Rho, представляет собой необычный субстрат каспазы, поскольку он может индуцировать оба, как анти-, так и проапоптотические сигналы в зависимости от степени его расщепления каспазами. Авторами показано, что при очень низких уровнях активности каспазы, RasGAP расщепляется в положении 455 с образованием N-концевой последовательности (последовательности N) и С-концевой последовательности (последовательности С). Последовательность С, но не RasGAP полной длины, индуцировала сильный апоптотический ответ в клетках HeLa, как оценено по их способности вызывать внешний вид пикнотических ядер, активацию каспазы 3 и расщепление PARP. В том же самом исследовании авторы показали, что последовательность N, по-видимому, скорее представляет собой общий блокатор апоптоза после активации каспазы, чем стимулирует гибель клеток.-1 009524 На более высоких уровнях активности каспазы способность последовательности N противодействовать апоптозу подавлена, когда она расщепляется в положении 157. Данное последнее событие расщепления приводит к образованию двух последовательностей, N1 иN2, которые, как было показано, в противоположеность последовательности N, сенсибилизируют клетки,в которых могут проявляться высокие активности каспазы в отношении апоптоза, индуцированного цисплатином, лекарственным препаратом, используемым в химиотерапии при лечении рака. Однако в работе Leblanc et al. (см. статью Leblanc V. et al., "Ras-GTPase activating protein inhibitionspecifically induces apoptosis of tumour cells" (Ингибирование белка, активирующего Ras-GTPaзy, специфически индуцирует апоптоз опухолевых клеток, Oncogene, 18, 4884, 1999) показано, что инъекция моноклонального антитела, направленного против домена SH3 последовательности N2 RasGAP, сделанная с целью ингибирования данного белка, специфически индуцирует апоптоз в раковых клетках. Из патентной заявки WO 99/65947 (Parker et al.) известно также, что моноклональные антитела, направленные против белка, связывающего домен SH3 RasGAP, G3BP, индуцируют апоптоз в раковых клетках, в которых происходит сверхэкспрессия G3BP. Полагают, что данные результаты показывают, что путь RasGAP регуляции роста, через домен SH3RasGAP, важен для выживаемости некоторых раковых клеток. Данные факты, как считают, противоречат результатам, полученным Yang и Widmann, приводя, таким образом, к заключению о том, что домен SH3 RasGAP имеет до некоторой степени двойственную функцию в индукции и регуляции апоптоза в клетках. Химиотерапия в виде монотерапии или в комбинации с другими способами лечения (например, радиотерапией) в настоящее время является наиболее распространенным и эффективным терапевтическим инструментом для лечения рака. Эффективность лекарственных препаратов, используемых в химиотерапии для лечения рака, основана на их способности уничтожать раковые клетки. Однако в использовании данных лекарственных препаратов имеется ограничение, которое исходит из того факта, что они также оказывают вредное действие на нормальные, нераковые клетки, поскольку вызывают сильную стимуляцию каспаз не только в раковых клетках, но также в нормальных, нераковых клетках, в особенности тех клетках, которые быстро делятся. Вследствие этого проблема для клинических врачей состоит в том, чтобы выбрать дозы лекарственных препаратов, которые достаточно высоки для того, чтобы уничтожить опухоли, но не настолько высоки, чтобы вызвать тяжелые побочные эффекты у пациентов, такие как выпадение волос, тошнота и рвота, кардиотоксичность и вторичные опухоли. Таким образом, задачей настоящего изобретения является повышение селективности лекарственных препаратов в отношении раковых клеток, что очевидным образом сделает химиотерапевтическое лечение более эффективным, даст возможность использовать более низкие дозы лекарственных препаратов, приведет к снижению побочных эффектов химиотерапии. Сущность изобретения Изобретательская задача была решена тем и объектом настоящего изобретения вследствие этого является усовершенствованный подход в химиотерапии и профилактике рака, заключающийся в комбинации известных лекарственных препаратов для лечения или профилактики рака с пептидом, способным повысить селективность их действия в отношении раковых клеток, и не имееющий вышеупомянутых недостатков. Таким образом, изобретательская задача была прежде всего решена путем получения пептида, состоящего в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта, который повышает способность противоракового лекарственного препарата селективно уничтожать или вводить в апоптоз раковые клетки. Изобретение далее представляет собой фармацевтическую композицию, обладающую повышенной селективностью уничтожения или апоптоза раковых клеток и которая может быть использована для лечения и профилактики различных форм рака, содержащую, кроме известного противоракового средства в качестве активной субстанции фармацевтически эффективное количество по меньшей мере одного пептида, соответствующего изобретению, предпочтительно с фармацевтически приемлемыми носителями, разбавителями и вспомогательными компонентами. Настоящее изобретение охватывает также применение фармацевтической композиции для получения лекарственного средства для лечения или предупреждения (профилактики) рака, соответстветствующие способы воздействия на раковую опухоль и клетку и фармацевтический набор. Перечень фигур, чертежей и иных материалов На фиг. 1 представлен процент индукции апоптоза различными лекарственными препаратами в клетках HeLa, трансфицированных либо фрагментом N2, либо ненагруженной плазмидой pcDNA.(Клетки HeLa (2106) помещают в чашки Петри диаметром 10 см, трансфицируют 1 мкг GFPэкспрессирующей плазмиды (чтобы пометить трансфицированные клетки) вместе с 2 мкг ненагруженной плазмиды pcDNA3 или 2 мкг вектора pcDNA3, кодирующего фрагмент N2. На следующий день после трансфекции клетки инкубируют в течение 24 ч с указанными концентрациями цисплатина, адриамицина или митоксантрона. Затем подсчитывают число GFP-положительных клеток, демонстрирующих пик-2 009524 нотическое ядро. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым определениям. Звездочки означают значимые различия между контрольными клетками и клетками, обработанными цисплатином (, р 0,05; , р 0,01; , р 0,001. На фиг. 2 А схематически представлены различные конструкции, используемые в данном исследовании.(SH означает домен гомологии Src). На фиг. 2 В представлен процент индукции апоптоза цисплатином в клетках HeLa, трансфицированных плазмидами, кодирующими конструкции, описанные на фиг. 2 А.(Клетки HeLa трансфицируют, как описано на фиг. 1, плазмидами, кодирующими конструкции,описанные на фиг. 2 А. Затем клетки HeLa обрабатывают или не обрабатывают 0,15 мкМ цисплатина и определяют степень апоптоза через 20 ч. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым определениям. Звездочки означают значимые различия между клетками, обработанными 0,15 мкМ цисплатина и клетками без обработки (, р 0,01; , р 0,001. На фиг. 3 представлены фазово-контрастные и эпифлуоресцентные изображения живых клеток, инкубированных с меченным FITC пептидом ТАT-RasGAP317-326.(Следующие клеточные линии (HeLa, U2OS, H-Meso1, MCF-7, HaCat и HUV-EC-C) инкубируют в течение 3 ч при 37 С, при содержании 5% CO2 в среде для культивирования с добавлением 20 мкМ меченного FITC пептида TAT-RasGAP317-326, a затем трижды промывают средой для культивирования). На фиг. 4 А представлен процент индукции апоптоза различными лекарственными препаратами в двух нераковых клетках, обработанных или не обработанных TAT-RasGAP317-326.(Две нераковые клеточные линии (HaCat и HUV-EC-C) инкубируют с повышающимися концентрациями цисплатина, адриамицина и митоксантрона в отсутствие или в присутствии 20 мкМ TATRasGAP317-326. Степень апоптоза определяют через 20 ч). На фиг. 4 В представлен процент индукции апоптоза различными лекарственными препаратами в четырех раковых клеточных линиях, обработанных или не обработанных TAT-RasGAP317-326.(Четыре раковые клеточные линии (HeLa, U2OS, MCF-7 и H-Meso1) помещают в 6-луночные платы и обрабатывают указанными концентрациями цисплатина, адриамицина и митоксантрона в отсутствие или в присутствии 20 мкМ одного из пептидов, либо ВИЧ-ТАТ 48-57, либо TAT-RasGAP317-326 в течение 20 ч. Затем подсчитывают число клеток, демонстрирующих пикнотическое ядро. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым определениям. Звездочки означают значимые различия между обработанными генотоксином клетками, инкубированными с TATRasGAP317-326, и теми, которые остаются необработанными или инкубированными с пептидом ВИЧТАТ 48-57 (, р 0,01; , р 0,001. На фиг. 5 А представлена активность NFкаппаB в клетках U2OS, обработанных цисплатином и в присутствии пептидов HIV-TAT48-57 или ТАТ- RasGAP317-326.(Клетки U2OS (1105) помещают в 6-луночные платы и трансфицируют 1 мкг сигнальной плазмиды люциферазы светляка для определения активности NFкаппаB и 0,1 мкг плазмиды, кодирующей люциферазу Renilla. На следующий день клетки обрабатывают указанными концентрациями цисплатина в отсутствие или в присутствии 20 мкМ пептидов ВИЧ-ТАТ 48-57 или TAT-RasGAP317-326 в течение 20 ч. Данные представляют активность люциферазы святляка, нормализованной относительно активности люциферазы Renilla, и выражают как количество раз, в которое возрастает базовая активность МкаппаВ, полученная в контрольных необработанных клетках. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым определениям. Звездочки означают значимые различия между указанными условиями (, р 0,01; , р 0,001. На фиг. 5 В представлена активность NFKannaB в клетках U2OS, обработанных цисплатином и в присутствии пептида HIV-TAT48-57 и IкаппаBN2 или пептида TAT-RasGAP317-326 IкаппаBN2.(Клетки U2OS трансфицируют 1 мкг сигнальной плазмиды люциферазы светляка для определения активности NfкаппаВ, 0,1 мкг плазмиды, кодирующей люциферазу Renilla, 0,5 мкг плазмиды, экспрессирующей GFP (для того, чтобы пометить трансфицированные клетки), 1 мкг плазмиды, кодирующейIкаппаBN2, которая ингибирует путь NfкаппаB или 1 мкг ненагруженного вектора pcDNA3. Клетки инкубируют в течение следующего дня с возрастающими концентрациями цисплатина в присутствии 20 мкМ ВИЧ-ТАТ 48-57 или 20 мкМ TAT-RasGAP317-326 в течение дополнительного 20-часового периода. Затем клетки лизируют и определяют активность NfкаппаB, как описано в разделе А за исключением того,что результаты выражают, как число раз, в которое увеличивается активность NfкаппаB, определенная в клетках, инкубированных с контрольным пептидом ВИЧ-ТАТ 48-57). На фиг. 5 С представлен процент апоптоза трансфицированных клеток, по фиг. 5 А и В.(Альтернативно определяют число GFP-положительных клеток, демонстрирующих пикнотическое ядро. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым определениям). На фиг. 6 представлены данные вестерн-блоттинга и процент JNK-фосфорилирований клетокU2OS, трансфицированных пептидами либо ВИЧ-ТАТ 48-57, либо TAT-RasGAP317-326 и обработанных цисплатином.(Клетки U2OS (2105) помещают в 6-луночные планшеты и обрабатывают в указанные периоды времени указанными комбинациями пептидов ВИЧ-ТАТ 48-57 или TAT-RasGAP317-326 (в концентрации 20 мкМ) и цисплатином (в концентрации 30 мкМ). Положительные контроли для активации JNK и р 38 получают после стимуляции клеток 1 мкг/мл анисомицина в течение 3 ч и 0,5 М сорбита в течение 30 мин,соответственно. Данные количественных определений, приведенные под результатами вестернблоттинга, получены на 12-часовых полосах и нормализованы относительно положительных контролей. Результаты соответствуют среднему значениюстандартное отклонение по трем независимым экспериментам). Сведения, подтверждающие возможность осуществления изобретения Как используют в данном контексте, термины "пептид", "белок", "полипептид", "полипептидный" и"пептидный" применяют взаимозаменяемо для обозначения серии аминокислотных остатков, соединенных друг с другом пептидными связями между -амино- и карбоксигруппами соседних остатков.RasGAP, регулятор ГТФ-связывающих белков Ras и Rho, представляет собой необычный субстрат каспазы, поскольку он может индуцировать оба, как анти-, так и проапоптотические сигналы в зависимости от степени его расщепления каспазами. При низких уровнях каспаз RasGAP расщепляется в положении 455 с образованием N-концевого фрагмента (фрагмента N молекулярной массы приблизительно 56 кД) и С-концевого фрагмента (фрагмента С молекулярной массы приблизительно 64 кД). Фрагмент N,по-видимому, представляет собой общий блокатор апоптоза после активации каспазы (см. статьи YangJ.-Y. и Widmann С., Mol. Cell. Biol., 21, 5346, 2001 и J. Biol. Chem., 277, 14641, 2002b). При высоких уровнях активности каспазы фрагмент N далее расщепляется в положении 157, с образованием, таким образом, двух фрагментов, N1 (аминокислоты 1-157) и N2 (аминокислоты 158-455). Под термином "раковая клетка" подразумевают появляющуюся у животного in vivo клетку, которая способна к нежелательному и нерегулируемому клеточному росту или патологической персистенции либо аномальной инвазии тканей. In vitro данный термин относится также к клеточной линии, которая представляет собой перманентно иммортализованную стабилизированную клеточную культуру, которая будет неопределенным и нерегулируемым образом пролиферировать, когда ее помещают в соответствующую свежую среду и пространство. Термин "лекарственный препарат" относится к лекарственным препаратам, которые способны уничтожать клетки млекопитающих, предпочтительно клетки человека. Имеется несколько классов лекарственных препаратов различной природы и с различными способами действия. Лекарственные препараты, соответствующие данному изобретению, относятся к агентам, которые выделены из или которые благоприятным образом модулируют биологические процессы хозяина. Интерфероны, факторы роста опухоли, факторы некроза опухоли, факторы роста, такие как GM-CSF (гранулоцитарно-макрофагальный колониестимулирующий фактор) и G-CSF (гранулоцитарный колониестимулирующий фактор), а также интерлейкины, такие как интерлейкин-2, интерлейкин-6, интерлейкин 7 и интерлейкин-12 являются примерами таких биологических лекарственных препаратов, используемых в настоящее время в терапии рака. Лекарственный препарат, соответствующий данному изобретению, может также относиться к агентам, которые повреждают ДНК и/или препятствуют размножению клеток, таким как генотоксины. Генотоксины могут быть выбраны из группы, содержащей алкилирующие агенты, антиметаболиты, агенты,разрезающие ДНК, агенты, связывающие ДНК, токсины, действующие на топоизомеразу, и токсины,действующие на веретено. Примерами алкилирующих агентов являются ломустин, кармустин, стрептозоцин, мехлортамин,мелфалан, урацил-азотно-горчичное соединение, хлорамбуцил, циклосфамид, ифосфамид, цисплатин,карбоплатин, митомицин, тиотепа, дакарбацин, прокарбацин, гексаметилмеламин, триэтиленмеламин,бусульфан, пипоброман, митотан и другие производные платины. Примером агентов, разрезающих ДНК, является блеомицин. Токсины, действующие на топоизомеразы, могут быть выбраны из группы, содержащей топотекан,иринотекан, камптотецина натриевую соль, даорубицин, доксорубицин, идарубицин, митоксантрон, тенипозид, адриамицин и этопозид. Примерами агентов, связывающих ДНК, являются дактиномицин и митрамицин, тогда как токсины,действующие на веретено, могут быть выбраны из группы, содержащей винбластин, винкристин, навелбин, паклитаксел и доцетаксел. В качестве лекарственного препарата, а также антиметаболитов могут быть использованы такие,которые выбраны среди следующих соединений: метотрексат, триметрексат, пентостатин, циторабин,ара-СМР, флударабин фосфат, гидроксимочевина, фторурацил, флоксаридин, хлордезоксиаденозин, гемцитабин, тиогуанин и 6-меркаптопурин. Предпочтительно, когда генотоксин, более предпочтительно цисплатин, митоксантрон и адриамицин используют в качестве лекарственного препарата в данном изобретении.-4 009524 Данные лекарственные препараты могут быть использованы в виде монотерапии или в комбинации друг с другом. В случае, когда используют более одного лекарственного препарата, определение эффективной комбинации лекарственных препаратов вполне входит в компетенцию квалифицированных специалистов в области техники и будет зависеть, например, от раковых клеток, которые следует уничтожить. Термин "усиливающий", как используют в данном контексте, относится к способности пептида повышать эффект лекарственного препарата в плане уничтожения клеток. Данную способность можно измерить in vitro, например, измеряя процент апоптоза клеток, содержащих пептид и обработанных по меньшей мере одним лекарственным препаратом посредством подсчета числа клеток, демонстрирующих пикнотические ядра (маркер апоптотических клеток). Как правило, результаты сравнивают с теми, которые получены для клеток, обработанных лекарственным препаратом, но не содержат указанный пептид. Пептид, который приводит к двукратному или большему повышению уровня апоптоза в клетках в заданной концентрации или который снижает по меньшей мере в два раза дозу лекарственного препарата, необходимую для индукции заданного апоптотического ответа, будут считать повышающим способность лекарственного препарата уничтожать клетки. Как используют в данном контексте, под термином "селективный" подразумевают, что пептид, соответствующий изобретению, повышает способность лекарственного препарата уничтожать клетки в заданной концентрации, специфически среди раковых клеток, но, неожиданно, не среди нераковых клеток. Интервалы концентраций лекарственного препарата in vitro, в которых пептид повышает способность лекарственного препарата селективно уничтожать клетки среди раковых клеток, зависят обычно от используемого лекарственного препарата. Например, в случае, когда используют генотоксин, как правило, концентрация лекарственного препарата in vitro составляет от 0,1 до 100 мкМ, предпочтительно от 0,15 до 30 мкМ. Последовательность N2 белка RasGAP предпочтительно выделена у человека и относится к белку молекулярной массы 36 кД, содержащему 297 аминокислот, которые охватывают два SH2 и один SH3 домен, как показано на фиг. 2 А. В общем, домены гомологии Src 2 (SH2) участвуют в распознавании фосфорилированного тирозина, тогда как домены гомологии Src 3 (SH3) часто являются показателем белка, участвующего в сигнальной трансдукции, связанной с организацией цитоскелета. Термин "фрагмент" относится к последовательности, содержащей меньше аминокислот в длину,чем в последовательности N2 белка RasGAP. Данная последовательность может быть использована до тех пор, пока она проявляет те же свойства, что нативная последовательность, из которой она выделена. Предпочтительно, когда данная последовательность содержит в длину меньше чем 90%, предпочтительно меньше чем 60%, в частности меньше чем 30% аминокислот, чем соответствующая последовательность N2 белка RasGAP. Данное изобретение включает также вариант последовательности N2 белка RasGAP. Термин "вариант" относится к пептиду, имеющему последовательность аминокислот, которая отличается до некоторой степени от пептида нативной последовательности, т.е. представляет собой последовательность аминокислот, которая отличается от нативной последовательности консервативными заменами аминокислот,причем одна или более аминокислот замещены другими с такими же характеристиками и конформационными функциями. Варианты последовательности аминокислот имеют замещения, делеции и/или инсерции в ряде положений в аминокислотной последовательности нативной последовательности аминокислот. Консервативные замещения аминокислот в данном контексте определяют как изменения в одной из следующих пяти групп:I. Маленькие алифатические неполярные или слабо полярные остатки: Ala, Ser, Thr, Pro, Gly.II. Полярные положительно заряженные остатки: His, Arg, Lys.III. Полярные отрицательно заряженные остатки и их амиды: Asp, Asn, Glu, Gln.V. Большие алифатические неполярные остатки: Met, Leu, lle, Val, Cys. Последовательность N2, а также ее фрагмент или вариант могут быть получены с помощью ряда способов и методик, известных в области техники, таких как, например, химический синтез или рекомбинантные технологии, как описано в монографии Maniatis et al. 1982, Molecular Cloning, A laboratoryManual (Лабораторное руководство по молекулярному клонированию), Cold Spring Harbor Laboratory. Предпочтительно, когда фрагмент последовательности N2 белка RasGAP содержит аминокислотную последовательность домена SH3 последовательности N2, ее части или ее варианта. Заявители неожиданного охарактеризовали более короткую последовательность N2 белка RasGAP,которая еще усиливает способность лекарственного препарата селективно уничтожать раковые клетки и которая имеет также преимущество в том, что ее легче синтезировать. Для того чтобы оценить, можно ли выделить такую часть белка, заявители создали серию укороченных вариантов фрагмента N, как показано на фиг. 2 А, и определили их способность потенцировать индуцированный лекарственным препаратом апоптоз в раковой клеточной линии (см. фиг. 2 В).-5 009524 Данные части последовательности N2 клонировали в вектор и ими трансфицировали раковую клеточную линию (HeLa). Заявители показали, что клетки HeLa, трансфицированные ненагруженной конструкцией, или конструкцией, кодирующей только домен SH2 N2, не усиливают гибель, индуцированную цисплатином. Напротив, клетки, экспрессирующие конструкции, содержащие домен SH3, имели более высокий уровень усиления цисплатин-индуцированного апоптоза, как показано на фиг. 2 В. Заявители создали последовательные укорочения в домене SH3 в попытке идентифицировать минимальную усиливающую последовательность. Все данные конструкции или части последовательности N2 (см. фиг. 2 А), включая самую короткую(317-326), которая кодирует пептид длиной 10 аминокислот, потенцировали способность цисплатина уничтожать клетки HeLa (см. фиг. 2 В). Данные результаты показывают, что свойство фрагмента N2 усиливать гибель клеток не требует полного домена, но опосредуется частью домена SH3, такой как короткая пептидная последовательность. Часть домена SH3 или его варианта содержит предпочтительно меньше чем или равное 70, более предпочтительно меньше чем или равное 30, наиболее предпочтительно меньше чем или равное 10 число аминокислот аминокислотной последовательности домена SH3. В частности, данное изобретение охватывает часть домена SH3, которая состоит из последовательностей аминокислот, кодируемых последовательностями ДНК, приведенными в табл. 1. Таблица 1 В случае, когда часть домена SH3 последовательности N2 представляет собой SEQ ID No4(RasGAP317-326), результирующая последовательность аминокислот, кодируемая данной SEQ ID No4, у человека представляет собой WMWVTNLRTD. Сравнение между различными видами показало, что имеются различные аминокислоты, которые являются консервативными среди видов, как показано в табл. 2. Таблица 2 Консервативные аминокислоты среди видов представлены в виде выделенных жирным шрифтом-7 009524 подчеркнутых остатков, тогда как X соответствуют остаткам аминокислот, которые могут быть изменены путем консервативных или неконсервативных замещений аминокислот без нарушения соответствующих изобретению свойств данных частей из 10 аминокислот домена SH3 N2. Данные пептидные варианты этой части из 10 аминокислот домена SH3 N2 человека и, в частности,последовательность, полученная при элайнменте WXWVTXXRTX, также охватываются настоящим изобретением, и они относятся к пептидам, имеющим последовательность аминокислот, которая отличается в некоторой степени от последовательности нативного пептида, т.е. последовательности аминокислот,которая изменяется относительно нативной последовательности WMWVTNLRTD путем консервативных или неконсервативных замещений аминокислот, причем один или более остатков аминокислот замещены другими с такими же характеристиками и конформационными функциями. Как правило, пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта, как описано в настоящем изобретении, конъюгирован с агентом, который повышает накопление пептида в клетке. Данный агент может быть соединением, которое индуцирует рецептор-опосредованный эндоцитоз,такой как, например, опосредованный мембранным рецептором трансферрина эндоцитоз трансферрина,конъюгированного с терапевтическими лекарственными препаратами (см. статью Qian Z. M. et al., "Targeted drug delivery via the transferrin receptor-mediated endocytosis pathway" (Направленная доставка лекарственного препарата через путь эндоцитоза, опосредованного трансферриновым рецептором) Pharmacological Reviews, 54, 561, 2002) или носителем, проникающим через клеточную мембрану, который может быть выбран, например, в группе жирных кислот, таких как декановая кислота, миристиновая кислота и стеариновая кислота, которые уже были использованы для внутриклеточной доставки пептидных ингибиторов протеинкиназы С (см. статью Ioannides C.G. et al., "Inhibition of IL-2 receptor induction and IL-2production in the human leukemic cell line Jurkat by a novel peptide inhibitor of protein kinase С" (Ингибирование индукции рецепторов ИЛ-2 и продукции ИЛ-2 в лейкозной клеточной линии человека Jurkat посредством нового пептидного ингибитора протеинкиназы С), Cell Immunol., 131, 242, 1990) и протеинтирозинфосфатазы (см. статью Kole H.K. et al., "А peptide-based protein-tyrosine phosphatase inhibitor specifically enhances insulin receptor function in intact cells" (Ингибитор протеин-тирозинфосфатазы на пептидной основе специфически повышает функцию инсулиновых рецепторов в интактных клетках) J. Biol.Chem. 271, 14302, 1996), или среди пептидов. Предпочтительно, когда используют носители, проникающие через клеточную мембрану, более предпочтительно, когда используют пептидный носитель, проникающий через клеточную мембрану. В случае, когда проникающий через клеточную мембрану носитель представляет собой пептид, он предпочтительно будет пептидом, богатым аргинином. Недавно в работах Futaki et al. показано (см. статью Futaki S. et al., "Arginine-rich peptides. An abundant source of membrane-permeable peptides having potential as carriers for intracellular protein delivery" (Пептиды, богатые аргинином. Обильный источник проникающих через мембрану пептидов, потенциальных носителей для внутриклеточной доставки белка), J.Biol. Chem., 276, 5836, 2001), что число остатков аргинина в проникающем через клеточную мембрану пептиде-носителе в существенной мере влияет на способ интернализации и что, как полагают, имеется оптимальное число остатков аргинина для интернализации, предпочтительно, когда они содержат больше чем 6 аргининов. Пептид, соответствующий изобретению, обычно конъюгирован с носителем, проникающим через мембрану, посредством спейсера. В данном случае носитель, проникающий через клеточную мембрану, предпочтительно представляет собой пептид. Обычно пептиды, богатые аргинином, выбраны из группы, содержащей пептид ВИЧ-ТАТ 48-57, пептид оболочки FHV35-49, пептид HTLV-II Rex4-16 и пептид BMV gag7-25. Предпочтительно, когда пептид,богатый аргинином, представляет собой пептид ВИЧ-ТАТ 48-57. В случае, когда пептид ВИЧ-ТАТ 48-57 конъюгирован с последовательностью RasGAP, такой как, например, RasGAP317-326, вводят два остатка глицина между последовательностями ТАТ и RasGAP в качестве спейсера для обеспечения гибкости. Поскольку проблемой, присущей нативным пептидам (в L-форме), является разложение природными протеазами, может быть получен пептид, соответствующий изобретению, включающий D-формы и/или "ретро-инверсо изомеры" пептида. В данном случае получены ретро-инверсо изомеры коротких фрагментов и вариантов пептида, соответствующего изобретению. Защита пептида от естественного протеолиза, следовательно, повышала бы эффективность специфического гетеробивалентного или гетеромультивалентного соединения. Для ретро-инверсосодержащего пептида предсказывают более высокую биологическую активность по сравнению с не-ретроинверсосодержащим аналогом вследствие защиты от разложения нативными протеиназами. Более того, показано, что они проявляют повышенную стабильность и пониженную иммуногенность (см. статью Sela M. и Zisman E., "Different roles of D-amino acids in immune phenomena" (Различные роли D-аминокислот в иммунных феноменах) FASEB J. 11, 449, 1997).-8 009524 Ретро-инверсо-пептиды получают для пептидов известной последовательности, как описано, например, в статье Sela и Zisman, (1997). Под термином "ретро-инверсо-изомер" подразумевают изомер линейного пептида, в котором направление последовательности реверсировано и хиральность каждого остатка аминокислот инвертирована, таким образом, в данном случае не может быть комплементарности концевой группы. Настоящее изобретение охватывает также модификации пептида (которые в норме не изменяют первичную последовательность), включая химическую дериватизацию пептидов in vivo или in vitro, например, ацетилирование или карбоксилирование. Включены также модификации гликозилирования, например, такие, которые осуществлены посредством модификации типов гликозилирования пептида во время его синтеза и процессинга или на следующих стадиях процессинга, например, путем обработки пептида ферментами, которые действуют на гликозилирование, например, гликозилирующими или дегликозилирующими ферментами млекопитающих. Включены также последовательности, которые содержат фосфорилированные остатки аминокислот, например, фосфотирозина, фосфосерина или фосфотреонина. Изобретение включает также аналоги, в которых одна или более пептидных связей замещены альтернативным типом ковалентной связи ("пептидомиметик"), которая нечувствительна к расщеплению пептидазами. Когда протеолитическое разложение пептидов после инъекции субъекту представляет собой проблему, замещение особенно чувствительной пептидной связи нерасщепляемым пептидомиметиком сделает полученный в результате пептид более стабильным и, таким образом, более эффективным в качестве активной субстанции. Данные миметики и способы их включения в пептиды хорошо известны в области техники. Используют также аминоконцевые блокирующие группы, такие как трет-бутилоксикарбонил, ацетил, теил, сукцинил, метоксисукцинил, суберил, адипил, азелаил, дансил, бензилоксикарбонил, флуоренилметоксикарбонил, метоксиазелаил, метоксиадипил, метоксисуберил и 2,4-динитрофенил. Блокирование заряженных амино- и карбоксиконцов пептидов дало бы дополнительное преимущество усиления прохождения пептида через гидрофильную клеточную мембрану и в клетку. Когда рекомбинантные технологии применяют для получения пептида, состоящего в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта в соответствии с настоящим изобретением, предпочтительно используют последовательности нуклеиновых кислот, кодирующие полипептиды. Относительно способа практической реализации рекомбинантных технологий см., например, монографию Maniatis et al. 1982, Molecular Cloning, A laboratory Manual (Лабораторное руководство по молекулярному клонированию), Cold Spring Harbor Laboratory, а также коммерчески доступные способы. Вследствие этого настоящее изобретение относится также к очищенной и выделенной последовательности нуклеиновой кислоты, кодирующей пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта, как описано выше. Выражение "очищенная и выделенная нуклеиновая кислота или последовательность нуклеиновой кислоты" относится к состоянию, в котором последовательность нуклеиновой кислоты, кодирующая пептид, соответствующий изобретению, или нуклеиновая кислота, кодирующая такой пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта будет находится в соответствии с настоящим изобретением. Очищенная и выделенная нуклеиновая кислота или последовательность нуклеиновой кислоты, охватываемая настоящим изобретением, может быть ДНК, РНК или гибридом ДНК/РНК. ДНК, которая может быть использована в данном случае, представляет собой полидезоксинуклеотидную последовательность, включая двунитевую ДНК, однонитевую ДНК, двунитевую ДНК, в которой одна или обе нити имеют непрерываемый фосфодиэфирный скелет, ДНК, содержащую одну или более однонитевых частей и одну или более двунитевых частей, двунитевую ДНК, в которой нити ДНК полностью комплементарны, двунитевую ДНК, в которой нити ДНК только частично комплементарны, кольцевую ДНК, ковалентно замкнутую ДНК, линейную ДНК, ковалентно перекрестно-сшитую ДНК, кДНК,химически синтезированную ДНК, полусинтетическую ДНК, биосинтетическую ДНК, ДНК, выделенную из природного источника, разложенную ферментом ДНК, разрезанную ДНК, меченую ДНК, такую как радиоактивно меченная ДНК и ДНК, меченная флуорохромом, ДНК, содержащую один или больше неприродных видов нуклеиновой кислоты. Последовательности ДНК, которые кодируют пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмент или ее вариант, могут быть синтезированы стандартными химическими технологиями, например, фосфотриэфирным способом, или способами на основе автоматизированного синтеза или способами ПЦР. Очищенная и выделенная последовательность ДНК, кодирующая пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмент или ее вариант, соответствующие изобретению, могут быть также получены с помощью ферментативных методик. Таким образом, рестрикционные ферменты, которые расщепляют молекулы нуклеиновой кислоты в заранее определенных последовательно-9 009524 стях распознавания, могут быть использованы для выделения последовательностей нуклеиновых кислот из более крупных молекул нуклеиновых кислот, содержащих последовательность нуклеиновой кислоты,такую как ДНК (или РНК), которая кодирует пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта. Настоящее изобретение охватывает также нуклеиновую кислоту в форме полирибонуклеотида(РНК), включая, например, однонитевую РНК, кРНК, двунитевую РНК, двунитевую РНК, в которой одна или более нитей состоят из двух или более фрагментов, двунитевую РНК, в которой одна или обе нити имеют непрерывающийся фосфодиэфирный скелет, РНК, содержащую одну или более однонитевых частей и одну или более двунитевых частей, двунитевую РНК, в которой нити РНК полностью комплементарны, двунитевую РНК, в которой нити РНК только частично комплементарны, ковалентно перекрестно-сшитую РНК, разложенную ферментом РНК, разрезанную РНК, мРНК, химически синтезированную РНК, полусинтетическую РНК, биосинтетическую РНК, РНК, выделенную из природного источника,меченую РНК, такую как радиоактивно меченная РНК и РНК, меченная флуорохромом, РНК, содержащую один или больше неприродных видов нуклеиновой кислоты. Предпочтительно, когда в качестве нуклеиновой кислоты используют очищенную и выделенную последовательность ДНК из группы, содержащей SEQ ID No 1, SEQ ID No 2, SEQ ID No 3 или SEQ IDNo 4. Настоящее изобретение включает также варианты вышеуказанных последовательностей, т.е. нуклеотидные последовательности, которые отличаются от референс-последовательности консервативными замещениями нуклеотидов, причем один или больше нуклеотидов замещены другими с такими же характеристиками. Изобретение охватывает также аллельные варианты описанной очищенной и выделенной последовательности нуклеиновой кислоты, т.е. природные альтернативные формы выделенной и очищенной нуклеиновой кислоты, которые также кодируют пептиды, идентичные, гомологичные или родственные тем, которые кодируются очищенными и выделенными последовательностями нуклеиновых кислот. Альтернативно неприродные варианты могут быть получены методиками мутагенеза или прямым синтезом. Вышеупомянутая очищенная и выделенная последовательность нуклеиновой кислоты, кодирующая пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта,может далее содержать нуклеотидную последовательность, кодирующую пептид-носитель, проникающий через клеточную мембрану. Еще одним аспектом настоящего изобретения является получение экспрессионного вектора, содержащего по меньшей мере одну копию выделенной и очищенной последовательности нуклеиновой кислоты, кодирующей пептид, состоящей в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта, как описано выше. Предпочтительно, когда выделенная и очищенная последовательность нуклеиновой кислоты, кодирующая пептид, соответствующий изобретению, представляет собой ДНК. Как используют в данном контексте, термины "вектор", "плазмида" и "экспрессионный вектор" используют взаимозаменяемо, причем плазмида является наиболее распространенной формой вектора. Вектор может далее содержать нуклеотидную последовательность, кодирующую проникающий через клеточную мембрану пептид-носитель, соответствующий изобретению. Выбор экспрессионного вектора зависит непосредственно, как это хорошо известно в области техники, от требующихся функциональных свойств, например, экспрессии пептида или клетки-хозяина, которую предусмотрено трансформировать или трансфицировать. Кроме того, экспрессионный вектор может далее содержать промотор, функционально связанный с очищенной и выделенной последовательностью ДНК. Это означает, что связанная выделенная и очищенная последовательность ДНК, кодирующая пептид, соответствующий настоящему изобретению, находится под контролем подходящей регуляторной последовательности, которая обеспечивает возможность экспрессии, т.е. транскрипцию и трансляцию введенной в виде инсерции выделенной и очищенной последовательности ДНК. Как используют в данном контексте, термин "промотор" означает любые дополнительные регуляторные последовательности, как известно в области техники, например, промотор и/или энхансер, сайты полиаденилирования и места сплайс-соединений, обычно используемые для экспрессии полипептида,или могут включать дополнительно одну или более отдельных направляющих последовательностей и могут необязательно кодировать селектируемый маркер. Промоторы, которые могут быть использованы,при условии, что данные промоторы совместимы с клеткой-хозяином, являются, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, аденовирус (такой как аденовирус 2),вирус папилломы (такой как вирус папилломы крупного рогатого скота), вирус саркомы птиц, цитомегаловирус (такой как средне-ранний промотор мышиного или человеческого цитомегаловируса), ретровирус, вирус гепатита В и обезьяний вирус 40 (такой как ранний и поздний промоторы SV 40) или промоторы, полученные из гетерологичных промоторов млекопитающих, такие как актиновый промотор или иммуноглобулиновый промотор, либо промоторы теплового шока.- 10009524 Энхансеры, которые могут быть использованы, представляют собой, например, энхансерные последовательности, известные из генов млекопитающих (глобина, альбумина, а-фетопротеина и инсулина) или энхансер из вируса эукариотической клетки, например энхансер SV40, энхансер раннего промотора цитомегаловируса, энхансеры полиомы и аденовируса. При экспрессии последовательностей ДНК, соответствующих данному изобретению, может быть использован широкий круг комбинаций хозяев/экспрессионных векторов. Эффективные экспрессионные векторы, например, могут состоять из сегментов хромосомной, нехромосомной и синтетической последовательностей ДНК. Подходящие векторы включают производные SV40 и известные бактериальные плазмиды, например, плазмиды Е. coli: col El, pCRI, pBR322, pcDNA3, рМВ 9 и их производные, такие плазмиды, как RP4; фаговые ДНК, например, многочисленные производные фага X, например, NM989, и другие фаговые ДНК, например, ДНК М 13 и филаментозного однонитевого фага; дрожжевые плазмиды, такие как плазмида 2 или ее производные; векторы, используемые в эукариотических клетках, такие как векторы, используемые с клетках насекомых или млекопитающих; векторы, полученные из комбинаций плазмид и фаговых ДНК, такие как плазмиды, которые модифицированы для того, чтобы использовать фаговую ДНК или другие последовательности контроля экспрессии и т.п. Наиболее предпочтительным экспрессионным вектором является pcDNA3. Другим аспектом настоящего изобретения является получение эукариотической или прокариотической клетки-хозяина, содержащей пептид, соответствующий изобретению, выделенную или очищенную последовательность нуклеиновой кислоты, соответствующей изобретению, и/или экспрессионный вектор, описанный в данном контексте. Трансформацию или трансфекцию соответствующих эукариотических или прокариотических клеток-хозяев экспрессионным вектором, содержащим очищенную и выделенную последовательность ДНК,соответствующую изобретению, осуществляют хорошо известными способами, которые, как правило,зависят от типа используемого вектора. Относительно данных способов см., например, монографию Maniatis et al. 1982, Molecular Cloning,A laboratory Manual (Лабораторное руководство по молекулярному клонированию), Cold Spring HarborLaboratory и коммерчески доступные способы. Термин "трансфекция" клетки или "трансформация" клетки или "трансфицированная/трансформированная клетка" означает клетку, в которую интродуцирована внеклеточная ДНК и которая, таким образом, несет экстрацеллюларную (внеклеточную) ДНК. ДНК можно было бы интродуцировать в клетку так, чтобы нуклеиновая кислота реплицировалась либо как часть хромосомы, либо как внехромосомный элемент. Пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или ее варианта, необязательно конъюгированный с агентом, который повышает накопление пептида в клетке, как описано в данном контексте, предпочтительно получают рекомбинантным путем или в клеточной экспрессионной системе. Широкий круг одноклеточных клеток-хозяев используют для экспрессии последовательностей ДНК, соответствующих изобретению. Данные хозяева могут включать хорошо известных эукариотических и прокариотических хозяев, таких как штаммы Е. coli, Pseudomonas, Bacillus, Streptomyces, грибы,такие как дрожжи, и клетки животных, такие как клетки СНО, YB/20, NSO, SP2/0, R1.1, B-W и L-M,клетки почки африканской зеленой обезьяны (например, COS 1, COS 7, BSC1, BSC40 и ВМТ 10), клетки насекомых (например, Sf9) и клетки человека, а также клетки растений в тканевой культуре. Предпочтительно, когда клетка-хозяин является бактериальной клеткой, более предпочтительно клеткой Е. coli. Настоящее изобретение направлено также на фармацевтическую композицию, содержащую в качестве активной субстанции фармацевтически эффективное количество по меньшей мере одного пептида,как описано, необязательно в комбинации с фармацевтически приемлемыми носителями, разбавителями и адъювантами. Термин "фармацевтически эффективное количество" относится к химическому материалу или соединению, которое при введении в организм человека или животного вызывает определяемый фармакологический и/или физиологический эффект. Соответствующее фармацевтически эффективное количество может зависеть от конкретного пациента, которого предполагают лечить, от заболевания, которое предполагают лечить, и от способа введения. Кроме того, фармацевтически эффективное количество зависит от конкретного используемого пептида, в особенности, от того, содержит ли пептид дополнительно лекарственный препарат, как описано,или не содержит. Лечение обычно включает многократное введение фармацевтической композиции, как правило, через интервалы в несколько часов, дней или недель. Фармацевтически эффективное количество унифицированной дозы полипептида обычно лежит в интервале от 0,001 нг до 100 мкг/кг массы тела пациента, проходящего лечение.- 11009524 Предпочтительно, когда кроме по меньшей мере одного пептида, как описано в данном контексте,фармацевтическая композиция может содержать один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных компонентов. Приемлемые носители, разбавители и вспомогательные компоненты, облегчающие обработку активных соединений для получения препарата, которые можно использовать фармацевтически, нетоксичны для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония, хлорид гексаметония, хлорид бензалкония, хлорид бензетония, фенол, бутиловый или бензиловый спирт, алкилпарабены, такие как метил- или пропилпарабен, катехол, резорцинол, циклогексанол, 3-пентанол и m-крезол); низкомолекулярные (содержащие меньше, чем приблизительно 10 остатков) полипептиды, белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА, сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок) и/или неионогенные поверхностно-активные вещества, такие как TWEEN, PLURONICS или полиэтиленгликоль (ПЭГ). Форма введения фармацевтической композиции может быть соматической или наружной. Например, введение данной композиции может быть осуществлено различными парентеральными способами,такими как подкожный, внутривенный, внутрикожный, внутримышечный, внутрибрюшинный, интраназальный, чрескожный, защечный способ или посредством имплантируемого устройства и ее можно также доставить перистальтическими средствами. Фармацевтическая композиция, содержащая пептид в качестве активного агента, может быть включена в биоадсорбируемую матрицу или она ею может быть пропитана, с которой вводится в форме суспензии, геля или твердого носителя. Кроме того, матрица может состоять из биополимера. Можно получить препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы твердых гидрофобных полимеров, содержащих антитело, причем матрицы имеют вид формованных изделий, например, пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поливиниловый спирт) полилактиды (см. Патент США No. 3773919),сополимеры L-глутаминовой кислоты и [] этил-L-глутамата, неразлагающийся этилен-винилацетат, разлагающиеся сополимеры молочной кислоты-гликолевой кислоты, такие как LUPRON DEPOT (инъекционные микросферы, состоящие из сополимера молочной кислоты-гликолевой кислоты и лейпролидацетата) и поли-D-(-)-3-гидроксимасляная кислота. Препараты, предназначенные для введения in vivo, должны быть стерильными. Это легко осуществить, например, путем фильтрации через стерильные фильтрационные мембраны. Ясно, что подходящая доза пептида, соответствующего настоящему изобретению, будет зависеть от возраста, пола, состояния здоровья и массы тела реципиенту, типа сопутствующего лечения, если его проводят, и природы требующегося эффекта. Соответствующая дозированная форма будет зависеть от заболевания, пептида и способа введения,и включает таблетки, капсулы, лепешки, зубные пасты, суппозитории, ингаляционные препараты, растворы, мази и парентеральные депо-формы. Поскольку аминокислотные модификации пептида также охватываются настоящим изобретением,эта возможность может быть использована для сшивания пептида с нерастворимой в воде матрицей или другими макромолекулярными носителями для улучшения растворимости, всасывания либо проницаемости через гематоэнцефалический барьер. Данные модификации хорошо известны в области техники и могут альтернативно устранить или ослабить любой возможный нежелательный побочный эффект пептида и т.п. Хотя предпочтительная фармацевтическая композиция, соответствующая настоящему изобретению, содержит пептид в качестве активного агента, фармацевтическая композиция может содержать в качестве активного агента очищенную и выделенную последовательность нуклеиновой кислоты, кодирующую пептид, как описано в данном контексте. Данная фармацевтическая композиция может включать либо одну очищенную и выделенную последовательность ДНК, экспрессионный вектор, содержащий указанную очищенную и выделенную последовательность ДНК, либо клетку-хозяин, предварительно трансфицированную или трансформированную экспрессионным вектором, описанным в данном контексте. В данном последнем примере клетка-хозяин предпочтительно будет выделена у пациента, которого предполагают лечить, для того, чтобы избежать каких-либо проблем с антигенностью. Данные подходы гено- и клеточной терапии особенно хорошо подходят для пациентов, которым требуется многократное введение фармацевтической композиции, поскольку указанная очищенная и вы- 12009524 деленная последовательность ДНК, экспрессионный вектор или клетка-хозяин, предварительно трансформированная или трансфицированная экспрессионным вектором, могут быть инкоропорированы в клетку пациента, которая будет затем эндогенно продуцировать белок. Как правило, фармацевтическую композицию, как используют в данном контексте, применяют для лечения или предупреждения рака. Настоящее изобретение охватывает также применение фармацевтической композиции, соответствующей изобретению, лечения или предупреждения рака. Термин "рак" относится или описывает физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Обычно рак, который лечат или предупреждают, будет выбран из группы, состоящей из карциномы, лимфомы, бластомы, саркомы, липосаркомы, нейроэндокринной опухоли, мезотелиомы, шваномы,менингиомы, аденокарциномы, меланомы, лейкоза, лимфоидных злокачественных новообразований,рака сквамозных клеток, рака эпителиальных сквамозных клеток, рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, сквамозной карциномы легкого, рака брюшины, гепатоцеллюларного рака, желудочного рака или рака желудка, желудочно-кишечного рака, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы,пенильной карциномы, рака яичка, рака пищевода, опухоли желчных путей и рака головы и шеи. Предпочтительно, когда рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы. Пептид, соответствующий изобретению, как правило, будут использовать в количестве, необходимом для достижения назначенной цели. Для применения с целью лечения или предупреждения рака пептид или его фармацевтические композиции вводят или наносят в терапевтически эффективном количестве."Терапевтически эффективное количество" представляет собой количество, эффективное для облегчения или предупреждения симптомов или увеличения продолжительности жизни субъекта, проходящего лечение. Определение терапевтически эффективного количества вполне входит в компетенцию квалифицированных специалистов в области техники, в особенности в свете детального описания, представленного в данном контексте. Для системного (соматического) введения терапевтически эффективное количество или дозу можно исходно оценить с помощью анализов in vitro. Например, доза может быть определена в моделях на животных для достижения интервала концентраций в кровотоке, который включает IC50, как определяют в культуре клеток. Данную информацию можно использовать для более точного определения эффективных доз у человека. Исходные дозы можно также оценить на основании данных in vivo, например, с помощью моделей на животных, при использовании методик, которые хорошо известны в области техники. Обычный специалист в области техники может легко оптимизировать назначение доз лекарства для человека на основе данных, полученных на животных, и оно, конечно, будет зависеть от субъекта, подвергаемого лечению, массы тела субъекта, тяжести нарушения, способа введения и решения лечащего врача. Настоящее описание представляет также способ лечения или предупреждения рака у субъекта, которому это требуется, включающий введение данному субъекту терапевтически эффективного количества фармацевтической композиции, как описано в данном контексте. Примеры рака, который можно лечить и предупреждать, описан выше. Предпочтительно, когда рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы. В предпочтительных способах субъект является больным человеком, и введенный пептид, который селективно усиливает способность по меньшей мере одного лекарственного препарата уничтожать раковые клетки, представляет собой пептид TAT-RasGAP317-326. Объем настоящего изобретения охватывает также способ селективного повышения уровня апоптоза в раковой клетке, включающий контактирование раковой клетки с по меньшей мере одним пептидом,соответствующим настоящему изобретению, и лекарственным препаратом. Предусмотрен также способ селективного уничтожения раковых клеток, включающий контактирование раковой клетки с по меньшей мере одним пептидом, соответствующим настоящему изобретению,и лекарственным препаратом. Применение пептида, описанного в данном контексте, для повышения способности лекарственного препарата селективно уничтожать клетки среди раковых клеток также предусмотрена. Следующим объектом настоящего изобретения является получение набора для лечения или предупреждения рака у субъекта, причем набора, содержащего по меньшей мере один пептид, как описано в данном контексте, необязательно с реагентами и/или инструкциями по применению. В основном набор содержит контейнер и этикетку или вкладыш в упаковку на контейнере или свя- 13009524 занные с ним. Подходящие контейнеры включают, например, бутылочки, флаконы, шприцы и т.п. Контейнеры могут быть выполнены из множества материалов, таких как стекло или пластик. Контейнер содержит композицию, которая эффективна для лечения рака, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон,имеющий крышку, прокалываемую гиподермической инъекционной иглой). Этикетка или вкладыш в упаковку указывают, что композицию используют для лечения выбранного рака. Необязательно набор далее содержит отдельную фармацевтическую дозированную форму, содержащую дополнительный противораковый агент, выбранный из группы, состоящей из лекарственных препаратов, как описано выше, антител против рецепторов эпидермального фактора роста, радиоиммунотерапевтических агентов и их комбинаций. Пример 1. Клетки и трансфекция. Клетки HeLa и MCF-7 поддерживают в среде RPMI 1640 (Sigma; No по каталогу 8758), содержащей 10% сыворотки новорожденных телят (Sigma; No по каталогу N4637) при 37 С и 5% CO2. Клетки U2OS поддерживают в среде DMEM (Sigma; No по каталогу 5796), содержащей 15% сыворотки телячьих эмбрионов (Sigma; No по каталогу F7524) при 37 С и 5% CO2. Клетки H-Meso-1 поддерживают в средеRPMI 1640, содержащей 15% сыворотки телячьих эмбрионов при 37 С и 5% CO2. Клетки HUV-EC-C поддерживают в среде человеческих эндотелиальных SFM (Gibco; No по каталогу 11111-044) с добавлением 10% сыворотки телячьих эмбрионов, 20 нг/мл фактора роста основных фибробластов (Gibco; No по каталогу 13256-029), 10 нг/мл эпидермального фактор роста (Gibco; No по каталогу 13247-051), 10 мкг/мл фибронектина (Gibco; No по каталогу 33016-015) при 37 С и 5% CO2. Клетки HaCat поддерживают в среде SFM кератиноцитов, содержащей эпидермальный фактор роста 1-53 и экстракт гипофиза крупного рогатого скота (Gibco; No по каталогу 17005-075) при 37 С и 5% CO2. Клетки HeLa трансфицируют, как описано ранее (см. статью Yang J.-Y. и Widmann С., Mol. Cell. Biol., 21, 5346, 2001). Обработку генотоксином проводят в 6-луночных планшетах. Клетки разбивают за день до обработки в концентрации 2,5105 клеток/лунку. Клетки U2OS трансфицируют в 6-луночных планшетах при использовании кальциево/фосфатной методики преципитации (см. статью Jordan M. et al., "Tranfecting mammalian cells:optimization of critical parameters affecting calcium-posphate precipitate formation" (Трансфекция клеток млекопитающих, оптимизация основных параметров, действующих на образование кальциевофосфатного преципитата), Nucleic Acids Res., 24, 596, 1996). Вкратце, плазмиды разводят в 90 мкл H2O,смешивают с 10 мкл CaCl2 2,5 М и инкубируют в течение 10 мин при комнатной температуре. Затем 100 мкл раствора HEP (280 мМ NaCl, 10 мМ KCl, 1,5 мМ Na2HPO4, 12 мМ D-глюкоза, 50 мМ HEPES) быстро смешивают с раствором ДНК, инкубируют при комнатной температуре ровно 1 мин и, наконец, переносят в среду для культивирования клеток. Через 8 ч при 37 С и 5% CO2 среду заменяют свежей средой для культивирования, и клетки далее инкубируют в течение 16-24 ч перед проведением анализа. Химические реагенты. Используют цисплатин и митоксантрон фирмы Sigma (по каталогу No Р 4394 и No M6545, соответственно). Цисплатин разводят в ДМСО в конечной концентрации 100 мМ и хранят при -20 С. Митоксантрон разводят в 100% этаноле в конечной концентрации 10 мМ и хранят при -80 С. Используют адриамицин фирмы Calbiochem (No по каталогу 324380). Его разводят в воде в конечной концентрации 10 мМ и хранят при -20 С. Используют Hoechst 33342 фирмы Roche (No по каталогу Н-1399). Его разводят в воде в конечной концентрации 10 мг/мл и хранят при 4 С в темноте. Синтез и мечение пептидов. Пептиды ВИЧ-ТАТ 48-57(GRKKRRQRRRGGWMWVTNLRTD) синтезируют в Институте биохимии Лозаннского университета,Швейцария, используя технологию FMOC, очищают с помощью ВЭЖХ (высокоэффективной жидкостной хроматографией) и тестируют масс-спектрометрическими методами. Мечение флуоресцеин изотиоцианатом (FITC) проводят на последовательности -аланинGRKKRRQRRRGGWMWVTNLRTD, в которой Fmoc-защищенные аминокислоты боковой цепи представляют собой Arg(bpf), Lys(Boc), Gln(Trt), Trp(Boc), Thr(tBu), Asn(Trt) и Asp(OtBu). Пептид синтезируют поэтапно на 0,2 ммоль смолы Rink Amide AM при использовании химических методик на основеFmoc удаляют 20% пиперидином в диметилформамиде (ДМФ). На данной стадии группу флуоресцеина конъюгируют с N-концом пептида с помощью FITC (5-кратный избыток относительно замещения смолы в 4 мл ДМФ и 1 мл N-этилдиизопропиламина) для получения пептида, дериватизированного флуоресцеином. Пептиды растворяют в деионизированной воде в конечной концентрации 1 мМ при -20 С до дальнейшего использования. Плазмиды. Вставка dn3 в названии плазмиды показывает, что скелетная плазмида представляет собой экспрессионный вектор pcDNA3 (Invitrogen). Все конструкции соеденены с последовательностью НАPromega. prLUC представляет собой сигнальную плазмиду, несущую кДНК люциферазы светляка под контролем NFкаппаB-чувствительных элементов (см. статью Yang J.-Y. и Widmann С., Mol. Cell. Biol.,21, 5346, 2001). Измерения апоптоза. Апоптоз определяют, подсчитывая число клеток, демонстрирующих пикнотические ядра. Ядра живых клеток метят Hoechst 33342 (конечная концентрация 10 мкг/мл) в течение 5 мин, и затем клетки анализируют (по меньшей мере 400 клеток/условие), используя инвертированный микроскоп Leica DMIRB,снабженный флуоресцентной и предназначенной для проходящего света оптикой. Оценку апоптоза проводят через один день после трансфекции или обработки клеток. В эксперименте, включающем трансфицированные клетки, pEGFP-C1 вводят в раствор для трансфекции для мечения трансфицированных клеток GFP. В данном случае степень апоптоза оценивают только в трансфицированных клетках. Анализ сигнала люциферазы. Анализ люциферазы проводят с использованием Dual-Luciferase(R) анализатора сигнала фирмыPromega (No по каталогу Е 1910). Клетки лизируют из 6-луночного планшета, используя 100 мкл лизирующего буфера PLB, представляемого в наборе Promega, и инкубируют в течение тридцати минут на льду. Затем лизат осветляют центрифугированием при 16000 g в течение 15 мин. Активность люциферазы светляка регистрируют, смешивая 20 мкл лизата с 25 мкл реагента LARII, и активность люциферазыRenilla регистрируют, добавляя в ранее полученную смесь 25 мкл реагента StopGlo (блокирующего и вызывающего флуоресценцию). Для каждого измерения проводят количественное измерение световой эмиссии в течение 12 с при использовании люминометра Lumat LB 9501 (Berthold Technologies, Zurich,Switzerland). Анализ с использованием вестерн-блоттинга. Клетки лизируют в лизирующем буфере (25 мМ Hepes, 300 мМ NaCl, 1,5 мМ MgCl2, 0,2 мМ ЭДТА,0,1 мМ Na3VO4, 1% Triton Х 100, Таблетки полного коктейля ингибитора протеазы, не содержащие ЭДТА(Roche; No по каталогу 1873580). Белки разделяют на SDS-PAGE (гель-электрофорез в полиакриламидном геле с использованием додецилсульфата натрия) и наносят на нитроцеллюлозные мембраны(BioRad; No по каталогу 162-0115). После этого мембраны блокируют TBS (18 мМ HCl, 130 мМ NaCl, 20 мМ Tris), 5% обезжиренного сухого молока в течение 30 мин при комнатной температуре и инкубируют в течение ночи с соответствующим первичным антителом. Данные антитела определяют с помощью вторичных антител, конъюгированных с Alexa Fluor 680 (Molecular Probes; No по каталогу А 21109), разведенных 1:2500 в TBS, 5% обезжиренном сухом молоке, а затем визуализируют с помощью инфракрасной визуализирующей системы Odyssey (Licor, Homburg, Germany). Первичное антитело против фосфо-р 38(Cell Signaling Technology; номер по каталогу 9211L) разводят 1:500 в 5% BSA в TBS. Первичное антитело против фосфо-JNK (Cell Signaling Technology; No по каталогу 9551L) разводят 1:1000 в TBS, 5% BSA. Количественное определение проводятс использованием программы инфракрасной визуализации Odyssey. Статистический анализ. Все статистические анализы проводят с помощью Microsoft Excel (редакция ХР) при использованииt-критерия Стьюдента. Пример 2. Фрагмент N2 RasGAP потенцирует апоптотический ответ, индуцируемый рядом генотоксинов. Заявители недавно показали, что фрагмент N2 усиливает способность цисплатина уничтожать линию опухолевых клеток HeLa (см. статью Yang J.-Y. и Widmann С, Mol. Cell. Biol., 21, 5346, 2001). Чтобы оценить, может ли фрагмент N2 потенцировать апоптотический ответ, индуцированный генотоксинами,клетки HeLa, экспрессирующие или не экспрессирующие фрагмент N2, подвергают воздействию повышающихся концентраций адриамицина или митоксантрона (и цисплатина в контроле). На фиг. 1 показывают, что присутствие фрагмента N2 делает клетки HeLa по меньшей мере в 10 раз более чувствительными, чем контрольные клетки в отношении различных лекарственных препаратов. Данный результат показывает, что фрагмент N2 является сенсибилизатором генотоксинов широкого спектра. Идентификация минимальной последовательности внутри фрагмента N, которая повышает способность лекарственного препарата уничтожать раковые клетки. Фрагмент N2 представляет белок молекулярной массы 36 кД, может затруднить химический синтез. Характеризация более короткой последовательности, которая еще будет нести способности сенсибилизации генотоксина, является важной стадией в процессе разработки терапевтического инструмента из фрагмента N2. Для того чтобы оценить, можно ли выделить данную короткую последовательность, авторы генерируют серию укороченных вариантов фрагмента N2 (см. фиг. 2 А) и определяют их способность потен- 15009524 цировать индуцированный цисплатином апоптоз в клетках HeLa (см. фиг. 2 В). Фрагмент N2 содержит два домена SH2 и один домен SH3 (см. фиг. 2 А). Сначала определяют, какие из данных доменов содержат проапоптотическую активность фрагмента N2. Клетки HeLa трансфицируют плазмидами, кодирующими различные домены SH, в присутствии или в отсутствие 0,15 мкМ цисплатина, концентрации, при которой разница в чувствительности в отношении лекарственного препарата между клетками, экспрессирующими или не экспрессирующими фрагмент N2 максимальна (см. фиг. 1). Ненагруженная конструкция или конструкция, кодирующая домен SH2, не повышает способность цисплатина уничтожать клетки HeLa, трансфицированные данными конструкциями. Напротив, конструкции, содержащие домен SH3, повышают способность цисплатина уничтожать клетки посредством апоптоза (см. фиг. 2 В). Неспособность домена SH2 в виде монокомпонента потенцировать гибель клеток среди клетокHeLa не является следствием пониженной экспрессии белка, поскольку анализ с помощью вестернблоттинга показывает, что домен SH2 экспрессируется так же эффективно, как другие конструкции. Далее заявители генерируют последовательные укорочения в домене SH3, пытаясь идентифицировать минимальную генотоксин-сенсибилизирующую последовательность. Все данные конструкции (см. фиг. 2 А), включая самую короткую (317-326), которая кодирует пептид длиной 10 аминокислот, потенцируют способность цисплатина уничтожать клетки HeLa (см. фиг. 2 В). Данные результаты показывают, что свойство фрагмента N2 сенсибилизировать гибель клетки не требует наличия полного домена SH, но опосредуется очень короткой пептидной последовательности. Пептид ВИЧ-ТАТ 48-57, конъюгированный с последовательностью 317-326 RasGAP, действует как проникаемый в клетку генотоксин-сенсибилизирующий пептид. Если плазмида, кодирующая аминокислоты 317-326 RasGAP, обладает возможностью усиливать способность лекарственного препарата уничтожать раковые клетки, синтетический пептид, соответствующий 316-326, также проявлял бы данную активность при условии, что он мог бы проникать в клетку. Показано, что введение короткой последовательности, выделенной из белка ТАТ ВИЧ (ВИЧ-ТАТ 48-57),позволяет полипептидам эффективно накапливаться в клетках (см. статью Schwarze S.R. et al., "In vivoprotein transduction: delivery of biologically active protein into the mouse" (Трансдукция белка in vivo: доставка биологически активного белка в полость рта), Science, 285, 1569, 1999). Вследствие этого заявители синтезировали пептид, содержащий аминокислоты 317-326 RasGAP, ковалентно связанный с пептидомносителем аминокислот ВИЧ-ТАТ 48-57. Между последовательностями ТАТ и RasGAP вводят два остатка глицина для обеспечения гибкости. В качестве средства оценки клеточного поглощения данного пептида(здесь и далее называемого пептидом TAT-RasGAP317-326) его метят флуорофором FITC. Меченый пептид инкубируют с четырьмя различными опухолевыми клеточными линиями: человеческой аденокарциномы из шейки матки (клетками HeLa), человеческой остеосаркомы (клетками U2OS), клеточной линии рака молочной железы (клетками MCF-7) и человеческой злокачественной мезотеломии (клетками H-Meso-1) и двумя нераковыми клеточными линиями (HaCat - клеточной линии кожных кератиноцитов человека иHUV-EC-C - клетками пуповинного эндотелия человека). Как показано на фиг. 3, пептид TATRasGAP317-326 эффективно входит во все данные клеточные линии. Не замечено никакой разницы в транслокации пептида между нераковыми клетками и раковыми клетками. Сначала оценивают чувствительность раковых клеточных линий в отношении повышающихся концентраций трех генотоксинов(данные на представлены). Это позволяет определить сублетальные концентрации генотоксинов для каждой из тестируемых клеточных линий. Неожиданно заявители показывают, что пептид TAT-RasGAP317326, но не контрольный пептид ВИЧ-ТАТ 48-57, у которого отсутствуют последовательности RasGAP, повышает способность цисплатина, адриамицина и митоксантрона уничтожать тестируемые раковые клеточные линии, и они не индуцируют или только на пограничном уровне индуцируют апоптоз в контрольных условиях. Напротив, присутствие пептидов не воздействует на апоптотический ответ, индуцируемый цисплатином, адриамицином и митоксантроном в двух нераковых линиях (см. фиг. 4 В). Вследствие этого авторы идентифицируют минимальный синтетический пептид, способный входить и усиливать способность лекарственных препаратов уничтожать раковые клетки. Пути NFкаппаB и SAPK не обеспечивают свойств TAT-RasGAP317-326. Как модулятор Ras, RasGAP может воздействовать на некоторые Ras-зависимые пути контроля гибели клетки, такие как путь Ras-PI3K-Akt-NFкаппаB (см. статью Datta S.R. et al., "Cellular survival: a playin three Akts" (Выживаемость клеток - пьеса в трех действиях), Genes Dev., 13, 2906, 1999). Вследствие этого оценивают, участвует ли модуляция активности NFкаппаB в повышении способности, опосредованной TAT-RasGAP317-326. Как показано на фиг. 5 А, NFкаппаB активируется в клетках U2OS после обработки цисплатином или TAT-RasGAP317-326, но не при стимуляции контрольным пептидом ВИЧТАТ 48-57. Инкубирование клеток как с цисплатином, так и с TAT-RasGAP317-326 приводит в результате к дополнительной активации NFкаппаB (см. фиг. 5 А). Путь NFкаппаB участвует в индукции ответов выживаемости клеток во многих типах клеток (см. статьи Van Antwerp D.J. et al., "Supression of TNF-induced apoptosis by NF-каппаВ" (Супрессия TNFиндуцированного апоптоза с помощью NF-каппаВ),Science, 274, 787, 1996; Beg A.A. и Baltimore D., "An essential role for NFкаппаВ in preventing TNF 16009524induced cell death" (Основная роль NFкаппаВ в предупреждении TNFиндуцированной гибели клеток),Science, 274, 782, 1996), но может также требоваться для индукции апоптотических ответов в некоторых ситуациях (см. статью Ryan K.M. et al., "Role of NFкаппаВ in p53-mediated programmed cell death" (РольNFкаппаВ в р 53-опосредованной запрограммированной гибели клеток), Nature, 404, 892, 2000). Чтобы определить, требуется ли активация NFкаппаB посредством TAT-RasGAP317-326 для функции повышения способности, в клетках экспрессируют неразлагающуюся форму IкаппаB (IкаппаBN2). Как ожидают,данная конструкция эффективно предупреждает активацию NFкаппаB цисплатином TAT-RasGAP317-326(см. фиг. 5 В). IкаппаBN2 слабо повышает апоптотический ответ, опосредуемый цисплатином (см. фиг. 5 С). Однако активность TAT-RasGAP317-326 повышать способность цисплатина уничтожать клетки U2OS посредством апоптоза на затрагивается ингибитором NFкаппаB (см. фиг. 5 С). Данные результаты показывают, что активация пути NFкаппаB не включена в эффект способности усиливать гибель клеток, опосредуемый TAT-RasGAP317-326. Стресс-активированные протеинкиназы (SAPKs) - JNKs и р 38 MAPKs участвуют в апоптотическом ответе, индуцированном различными стимулами (см. статью Japre M.B. et al., Oncogen, 17, 1475, 1998). На фиг. 6 показывают, что ни контрольный пептид ВИЧ-ТАТ 48-57, ни пептид TAT-RasGAP317-326 не активируют данные пути MAPK. Кроме того, данные пептиды не могут повышать способность цисплатина стимулировать JNK или р 38 MAPKs (см. фиг. 6). Данные результаты показывают, что стрессактивированные пути MAPK не участвуют в активности TAT-RasGAP317-326, повышающей способность генотоксинов уничтожать раковые клетки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для уничтожения раковых клеток или апоптоза, содержащая в качестве активной субстанции лекарственное средство, способное вызвать апоптоз или уничтожение клеток, отличающаяся тем, что она дополнительно содержит фармацевтически эффективное количество по меньшей мере одного пептида, состоящего в основном из последовательности N2 белка RasGAP, ее фрагмента или варианта, предпочтительно с фармацевтически приемлемыми носителями, разбавителями и вспомогательными компонентами. 2. Фармацевтическая композиция по п.1, отличающаяся тем, что фрагмент последовательности N2 белка RasGAP содержит домен SH3, ее часть или вариант. 3. Фармацевтическая композиция по п.2, отличающаяся тем, что часть или вариант домена SH3 содержит не более 70 аминокислот его последовательности. 4. Фармацевтическая композиция по п.3, отличающаяся тем, что часть домена SH3 содержит аминокислотную последовательность, кодируемую одной из последовательностей ДНК, выбранной из группы SEQ ID No.1, SEQ ID No.2, SEQ ID No.3 или SEQ ID No.4. 5. Фармацевтическая композиция по п.3, отличающаяся тем, что часть или вариант домена SH3 содержит аминокислотную последовательность WXWVTXXRTX, в которой X означает остаток аминокислоты. 6. Фармацевтическая композиция по пп.1-5, отличающаяся тем, что указанный пептид конъюгирован с агентом, который повышает накопление указанного пептида в клетке. 7. Фармацевтическая композиция по п.6, отличающаяся тем, что агент представляет собой носитель, проникающий через клеточную мембрану. 8. Фармацевтическая композиция по п.7, отличающаяся тем, что указанный носитель является пептидом. 9. Фармацевтическая композиция по п.8, отличающаяся тем, что указанный пептид содержит повторяющиеся остатки аргинина и выбран из группы, включающей пептид ВИЧ-ТАТ 48-57, пептид FHVоболочки 35-49, пептид HTLV-II Rex4-16 и пептид BMV gag7-25. 10. Фармацевтическая композиция по п.9, отличающаяся тем, что пептид представляет собой пептид ВИЧ-ТАТ 48-57. 11. Фармацевтическая композиция по пп.1-10, отличающаяся тем, что указанное лекарственное средство представляет собой генотоксин. 12. Фармацевтическая композиция по п.11, отличающаяся тем, что генотоксин выбран из группы,содержащей алкилирующие агенты, антиметаболиты, агенты, разрезающие ДНК, агенты, связывающие ДНК, токсины, действующие на топоизомеразу, и токсины, действующие на веретено. 13. Фармацевтическая композиция по п.12, отличающаяся тем, что алкилирующие агенты выбраны из группы, содержащей ломустин, кармустин, стрептозоцин, мехлортамин, мелфалан, урацил-азотногорчичное соединение, хлорамбуцил, циклосфамид, ифосфамид, цисплатин, карбоплатин, митомицин,тиотепа, дакарбацин, прокарбацин, гексаметилмеламин, триэтиленмеламин, бусульфан, пипоброман,митотан и другие производные платины. 14. Фармацевтическая композиция по п.12, отличающаяся тем, что агент, разрезающий ДНК, представляет собой блеомицин. 15. Фармацевтическая композиция по п.12, отличающаяся тем, что токсины, действующие на то- 17009524 поизомеразу, выбраны из группы, содержащей топотекан, иринотекан, камптотецина натриевую соль,даорубицин, доксорубицин, идарубицин, митоксантрон, тенипозид, адриамицин и этопозид. 16. Фармацевтическая композиция по п.12, отличающаяся тем, что агенты, связывающие ДНК, выбраны из группы, содержащей дактиномицин и митрамицин. 17. Фармацевтическая композиция по п.12, отличающаяся тем, что токсины, действующие на веретено, выбраны из группы, содержащей винбластин, винкристин, навелбин, паклитаксел и доцетаксел. 18. Фармацевтическая композиция по п.12, отличающаяся тем, что антиметаболиты выбраны из группы, содержащей метотрексат, триметрексат, пентостатин, циторабин, ара-СМР, флударабин фосфат,гидроксимочевину, фторурацил, флоксаридин, хлордезоксиаденозин, гемцитабин, тиогуанин и 6 меркаптопурин. 19. Фармацевтическая композиция по п.11, отличающаяся тем, что генотоксин выбран из группы,содержащей цисплатин, митоксантрон и адриамицин. 20. Фармацевтическая композиция по пп.1-19, которая является лекарственным средством для лечения или профилактики рака. 21. Применение фармацевтической композиции по пп.1-19 в качестве средства получения лечебного или профилактического медикамента против рака. 22. Применение по п.21, в котором рак выбран из группы, состоящей из карциномы, лимфомы, бластомы, саркомы, липосаркомы, нейроэндокринной опухоли, мезотелиомы, шваномы, менингиомы, аденокарциномы, меланомы, лейкоза, лимфоидных злокачественных новообразований, рака сквамозных клеток, рака эпителиальных сквамозных клеток, рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, сквамозной карциномы легкого, рака брюшины, гепатоцеллюларного рака, желудочного рака или рака желудка, желудочно-кишечного рака, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря,гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы, пенильной карциномы, рака яичка, рака пищевода, опухоли желчных путей и рака головы и шеи. 23. Применение по п.22, в котором рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы. 24. Способ лечения или профилактики рака, отличающийся тем, что рак выбран из группы, состоящей из карциномы, лимфомы, бластомы, саркомы, липосаркомы, нейроэндокринной опухоли, мезотелиомы, шваномы, менингиомы, аденокарциномы, меланомы, лейкоза, лимфоидных злокачественных новообразований, рака сквамозных клеток, рака эпителиальных сквамозных клеток, рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, аденокарциномы легкого, сквамозной карциномы легкого, рака брюшины, гепатоцеллюларного рака, желудочного рака или рака желудка, желудочно-кишечного рака, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака толстой кишки, рака прямой кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака простаты, рака вульвы, рака щитовидной железы, гепатокарциномы, анальной карциномы, пенильной карциномы, рака яичка, рака пищевода, опухоли желчных путей и рака головы и шеи, и включает введение пациенту терапевтически эффективного количества фармацевтической композиции по пп.1-19. 25. Способ по п.24, отличающийся тем, что рак представляет собой мезотелиому, рак яичка или рак поджелудочной железы. 26. Способ селективного усиления апоптоза в раковой клетке, заключающийся в том, что раковая клетка контактирует с фармацевтической композицией по пп.1-19. 27. Способ селективного уничтожения раковых клеток, заключающийся в том, что раковая клетка контактирует с фармацевтической композицией по пп.1-19. 28. Набор для лечения или профилактики рака, содержащий по меньшей мере одно лекарственное средство, отличающийся тем, что он дополнительно содержит по меньшей мере один пептид, состоящий в основном из последовательности N2 белка RasGAP, ее фрагмента или варианта, который усиливает селективность действия в отношении раковых клетках, и предпочтительно дополнительные реагенты. 29. Набор по п.28, отличающийся тем, что он дополнительно содержит отдельную фармацевтическую дозированную форму, представляющую собой дополнительный противораковый агент, выбранный из группы, состоящей из лекарственных препаратов, антител против рецепторов эпидермального фактора роста, радиоиммунотерапевтических агентов и их комбинаций.
МПК / Метки
МПК: A61K 38/17, C07K 14/435, A61P 35/00, C07K 14/47
Метки: варианты, набор, осуществления, раковых, средство, уничтожения, клеток, фармацевтическое, способ
Код ссылки
<a href="https://eas.patents.su/27-9524-sposob-unichtozheniya-rakovyh-kletok-varianty-farmacevticheskoe-sredstvo-varianty-i-nabor-dlya-ego-osushhestvleniya.html" rel="bookmark" title="База патентов Евразийского Союза">Способ уничтожения раковых клеток (варианты), фармацевтическое средство (варианты) и набор для его осуществления</a>
Предыдущий патент: Ингибиторы в отношении активации ар-1и nfat
Следующий патент: Рекомбинантный модифицированный вирус осповакцины ankara, содержащий ati-промотор вируса коровьей оспы, и способы применения вируса и промотора
Случайный патент: Полупроводниковые пленки из четырех и более компонентных сплавов элементов групп i-iii-vi