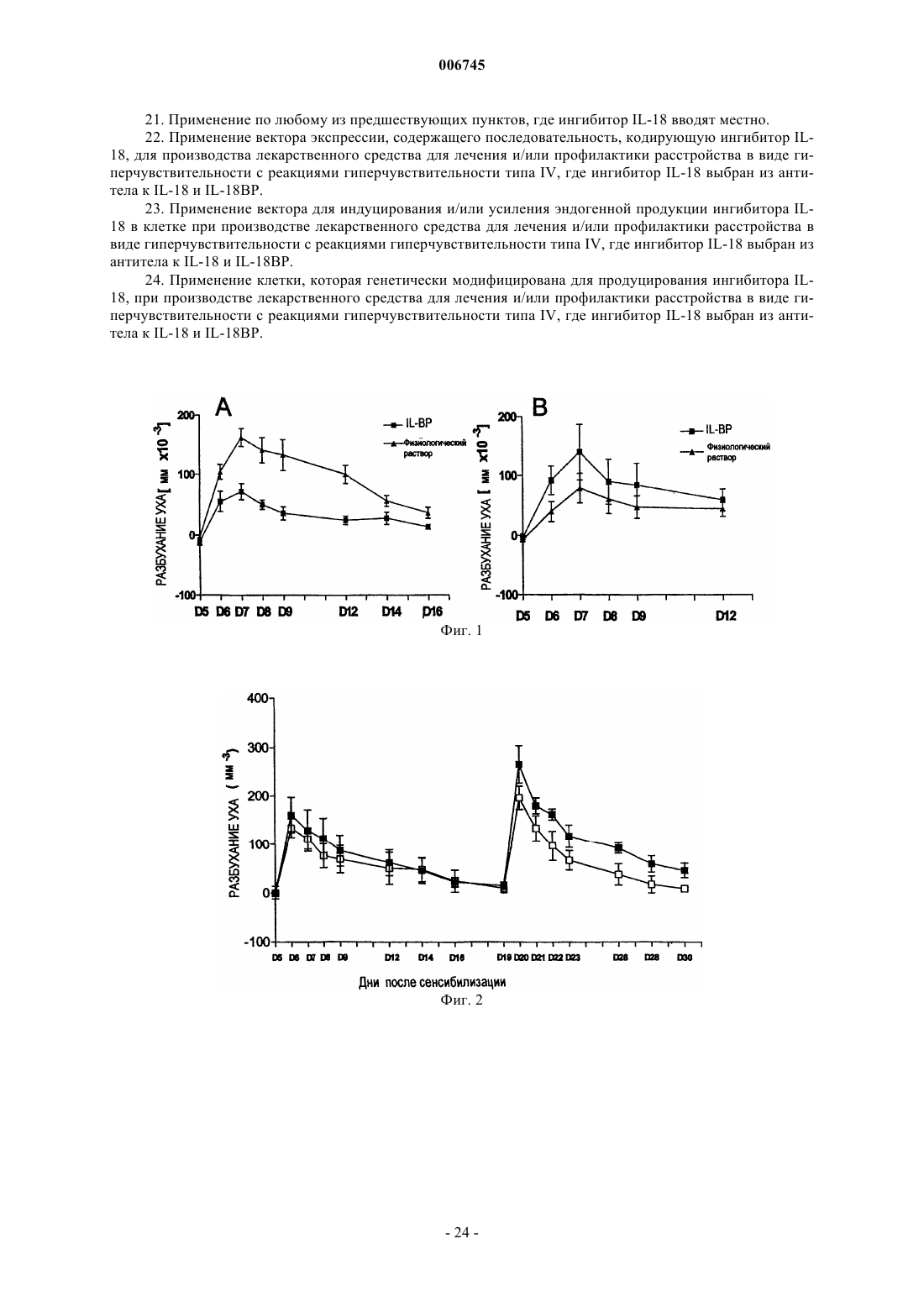
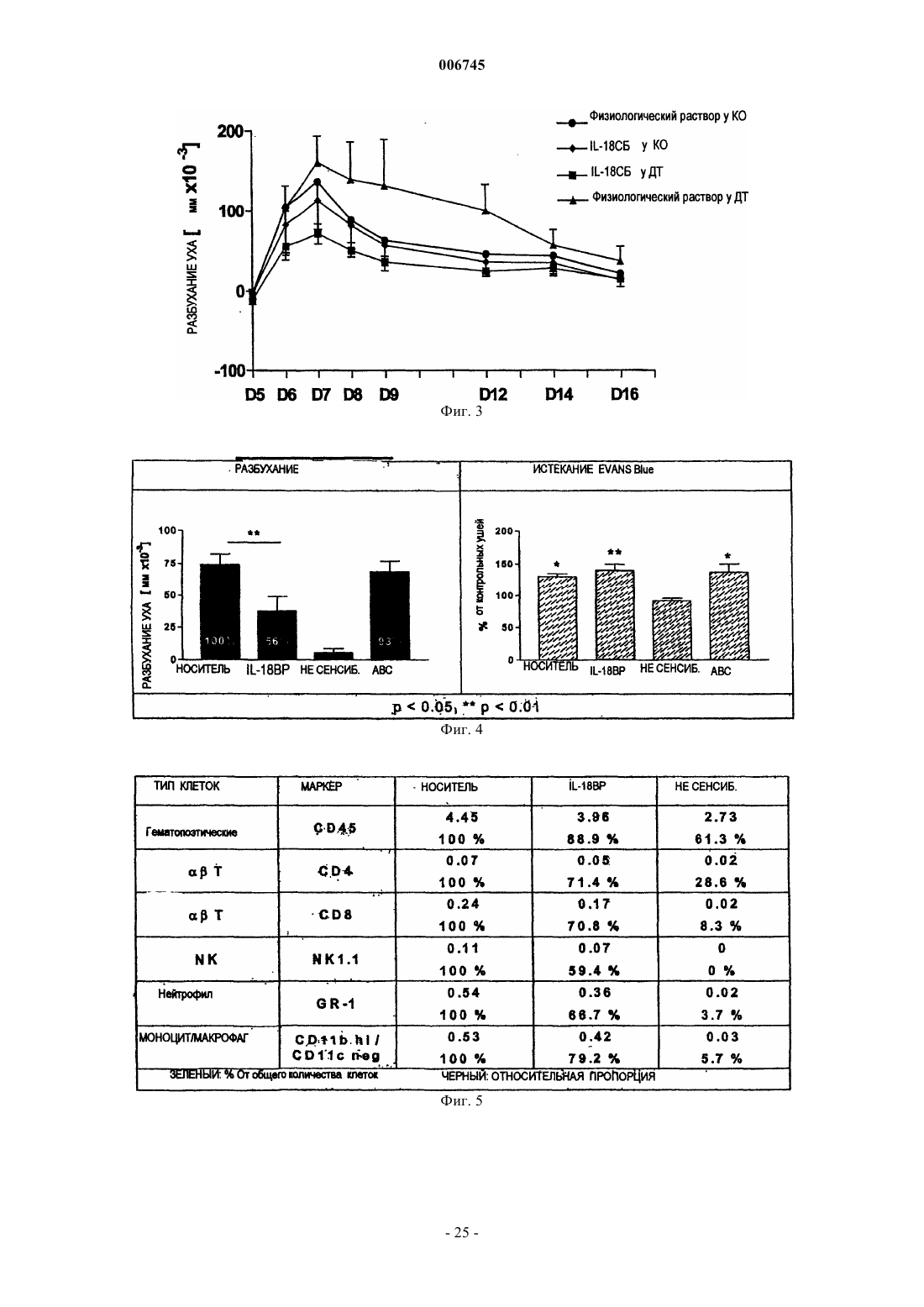
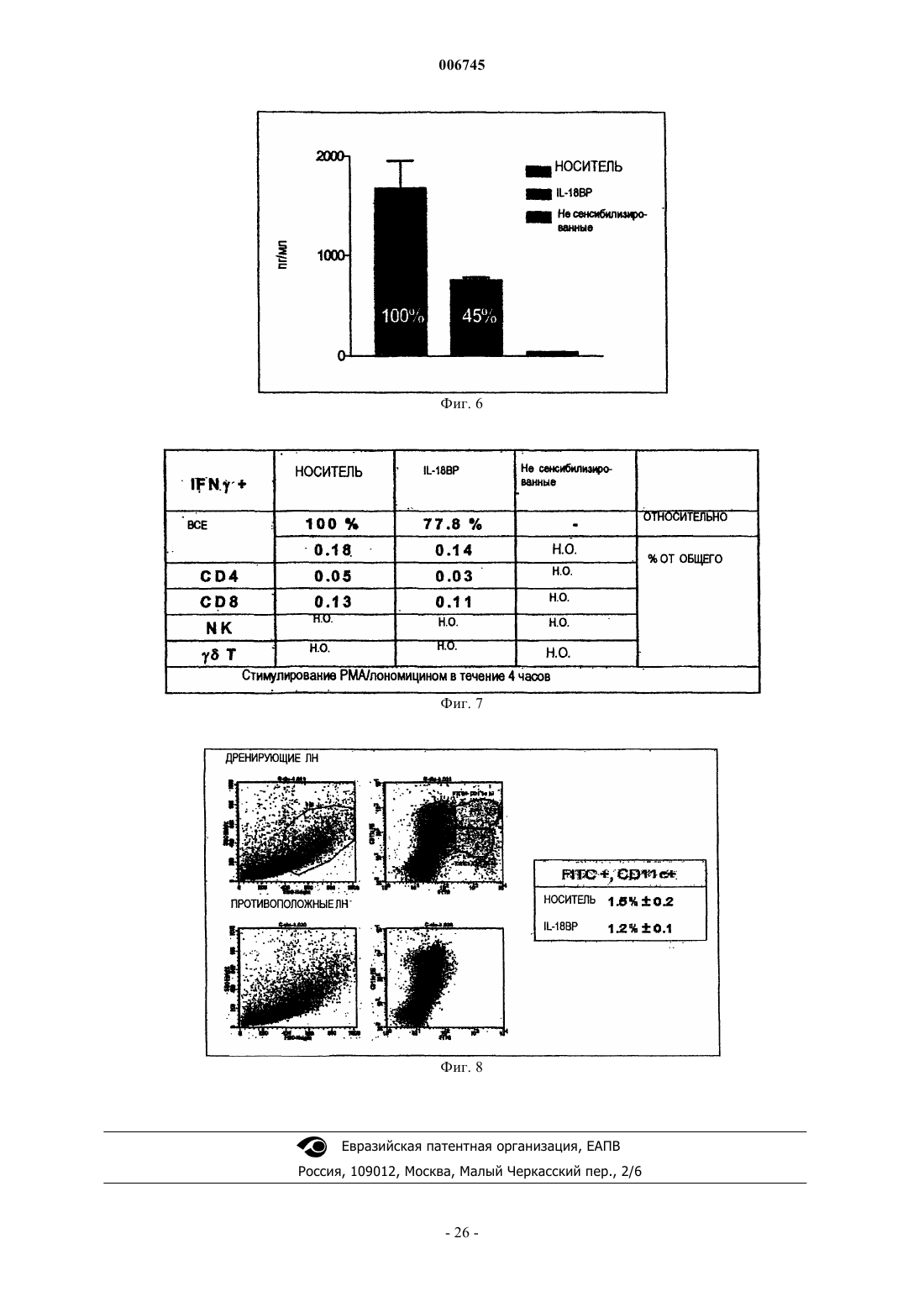
Применение ингибиторов il-18 при расстройствах в виде гиперчувствительности
Формула / Реферат
1. Применение ингибитора IL-18 для производства лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антител к IL-18 и IL-18-связывающих белков (IL-18BP), или их изоформ, мутеинов, слитых белков, функциональных производных, активных фракций, производных циркулярной перестановки или солей, по существу, обладающих биологической активностью, по меньшей мере, сходной с IL-18BP.
2. Применение по п.1, где расстройством в виде гиперчувствительности является гиперчувствительность замедленного типа.
3. Применение по п.1 или 2, где расстройством в виде гиперчувствительности является контактная гиперчувствительность.
4. Применение по любому из предшествующих пунктов, где ингибитором IL-18 является антитело к IL-18.
5. Применение по п.4, где антителом к IL-18 является гуманизированное антитело к IL-18.
6. Применение по п.4, где антителом к IL-18 является антитело к IL-18 человека.
7. Применение по пп.1-3, в котором ингибитором IL-18 является IL-18-связывающий белок или его изоформа, мутеин, слитый белок, функциональное производное, активная фракция, производное циркулярной перестановки или соль.
8. Применение по п.7, в котором ингибитором IL-18 является слитый белок, включающий слияние с иммуноглобулином, где слитый белок, по существу, обладает биологической активностью, по меньшей мере, сходной с IL-18BP.
9. Применение по любому из предшествующих пунктов, где функциональное производное содержит по меньшей мере одну составляющую, присоединенную к одной или более функциональным группам, которые являются одной или более боковыми цепями на остатках аминокислот, и где функциональное производное, по существу, обладает биологической активностью, по меньшей мере, сходной с IL-18BP.
10. Применение по п.9, где указанной составляющей является полиэтиленгликоль (ПЭГ).
11. Применение по любому из предшествующих пунктов, где лекарственное средство дополнительно содержит интерферон для одновременного, последовательного или раздельного применения.
12. Применение по п.11, в котором интерфероном является интерферон-b .
13. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит ингибитор фактора некроза опухоли (TNF) для одновременного, последовательного или раздельного введения.
14. Применение по п.13, в котором ингибитором TNF является TBPI и/или ТВРII.
15. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит противовоспалительный агент для одновременного, последовательного или раздельного введения.
16. Применение по п.15, где противовоспалительным агентом является СОХ-ингибитор.
17. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит противоаллергический агент для одновременного, последовательного или раздельного введения.
18. Применение по любому из предшествующих пунктов, в котором ингибитор IL-18 применяют в количестве от около 0,001 до 1000 мг/кг веса тела, или от около 0,01 до 100 мг/кг веса тела, или от около 0,1 до 10 мг/кг веса тела, или около 5 мг/кг веса тела.
19. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят подкожно.
20. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят внутримышечно.
21. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят местно.
22. Применение вектора экспрессии, содержащего последовательность, кодирующую ингибитор IL-18, для производства лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP.
23. Применение вектора для индуцирования и/или усиления эндогенной продукции ингибитора IL-18 в клетке при производстве лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP.
24. Применение клетки, которая генетически модифицирована для продуцирования ингибитора IL-18, при производстве лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP.
Текст
006745 Область техники Данное изобретение лежит в области аллергий. Более конкретно, оно относится к применению ингибитора IL-18 для лечения и/или профилактики расстройств в виде гиперчувствительности, и в частности расстройств, включающих реакции гиперчувствительности замедленного типа организма человека. Уровень техники Термин аллергия или гиперчувствительность применяется, когда имеет место адаптивный иммунный ответ в неадекватной форме. Аллергические реакции или реакции гиперчувствительности являются результатом обычных полезных иммунных ответов, действующих неадекватно на чужеродные антигены (обычно макромолекулам окружающей среды) и иногда приводят к воспалительным реакциям и повреждению тканей. В таких ситуациях обычно безвредный стимулятор окружающей среды, называемый аллергеном, вызывает иммунный ответ, который, при повторном контакте, реактивируется с возникновением патологического повреждения. Реакции гиперчувствительности являются повреждающими иммунологическими реакциями на внешние антигены. Существует множество классификаций гиперчувствительности. Некоторые основаны на времени, требуемом для проявления симптомов или кожных тест-реакций после контакта с антигеном(например, гиперчувствительность немедленного или замедленного типа), типе антигена (например, реакции на лекарственные средства) или на природе вовлеченного органа. Классификации обычно сильно упрощены и не учитывают, что может иметь место более чем один тип иммунного ответа или что для возникновения иммунологического повреждения необходим более чем один тип. Наиболее широко применяемой классификацией является следующая. Гиперчувствительность типа I или немедленного типа является IgE-опосредованной. Ее также называют обычной аллергией. Реакции гиперчувствительность немедленного типа (тип I) возникают из-за связывания антигена с IgE на тучных клетках или базофилах. Расстройства в виде реакций гиперчувствительности I типа также называют атопическими заболеваниями, они включают, например, аллергический ринит, аллергический конъюнктивит, атопический дерматит, аллергическую приобретенную бронхиальную астму, крапивницу, системную анафилаксию. Значительно увеличилось количество случаев астмы, хотя причины в большинстве случаев неизвестны. Недавно было замечено значительное увеличение количества реакций типа I при контакте с растворимыми в воде белками, содержащимися в латексных продуктах (например, резиновых перчатках, стоматологических прокладках, презервативах, трубках для дыхательного оборудования, катетерах), особенно среди медицинского персонала и у пациентов, обращавшихся с латексом, и у детей с расщепленным позвоночником и урогенитальными врожденными дефектами. Частыми реакциями на латекс являются крапивница, ангионевротический отек, конъюнктивиты, риниты, бронхоспазмы и анафилаксия. Пациенты с атопическими заболеваниями (включая атопический дерматит) обычно имеют наследственную предрасположенность для развития опосредованной антителом-IgE гиперчувствительности к вдыхаемым и съедаемым веществам (аллергенам), которые безвредны для людей, которые не имеют аллергии. За исключением атопического дерматита, антитела-IgE обычно опосредуют гиперчувствительность. Гиперчувствительность типа II или цитотоксическая гиперчувствительность включает цитолитические действия, опосредованные антителом, комплементом и/или клеточными механизмами. Мишенью в реакциях типа II является поверхность клетки, а ее результатом является повреждение или гибель клетки. Антитело к связанному с клеткой антигену (тип II) вызывает разрушение клетки путем активации комплемента или стимуляции фагоцита. Примеры повреждения клеток, при которых антитело взаимодействует с антигенными компонентами клетки, включают Кумбс-положительную гемолитическую анемию,инфицируемую антителами тромбоцитопеническую пурпуру, лейкопению, пузырчатку, пемфигоид, синдром Гудпасчера и пернициозную анемию. Эти реакции имеют место у пациентов после переливания несовместимой крови, при гемолитических заболеваниях новорожденных и при тромбоцитопении новорожденных, они также могут играть роль в мультисистемных заболеваниях, являющихся проявлением гиперчувствительности, например при системной красной волчанке, СКВ. Механизм повреждения лучше всего продемонстрирован на примере действия на эритроциты. При гемолитической анемии эритроциты разрушаются в результате либо внутрисосудистого гемолиза, либо захвата макрофагами, преимущественно в селезенке. Исследования in vitro показали, что в присутствии комплемента некоторые комплементсвязывающие антитела (например, антитела к групповым антителам крови анти-А и анти-В) вызывают быстрый гемолиз. Другие (например, антитело к LE) вызывает медленный лизис клеток; в то время как другие не повреждают непосредственно клетки, но вызывают их адгезию и разрушение фагоцитами. Наоборот, антитела к антителам резус эритроцитах не активируют комплемент, и они разрушают клетки преимущественно посредствам внесосудистого фагоцитоза. Примеры, в которых антиген является компонентом ткани, включают раннее острое (гиперострое) отторжение трансплантата пересаженной почки, которое происходит из-за присутствия антитела в эндотелии сосуда, и синдром Гудспасчера, который возникает из-за реакции антитела с базальной мембраной клубочкового и альвеолярного эндотелия. В экспериментальном синдроме Гудпасчера комплемент является важным медиатором повреждения, но роль комплемента не определена четко при раннем остром отторжении трансплантата.-1 006745 Примеры реакций вследствие связывания гаптена с клетками или тканью включают множество реакций гиперчувствительности к лекарственным средствам (например, инфицируемая пенициллином гемолитическая анемия, см. ниже). Антирецепторные реакции гиперчувствительности изменяют клеточную функцию в результате связывания антитела с рецепторами мембраны. При многих заболеваниях (например, злокачественная миастения, болезнь Грейвса, инсулинустойчивый диабет) антитела к рецепторам мембраны клетки были описаны. У некоторых пациентов с диабетом с сильной устойчивостью к инсулину были выявлены антитела к рецепторам инсулина, тем самым предотвращая связывание инсулина с его рецептором. У пациентов с болезнью Грейвса было идентифицировано антитело к рецептору тироидстимулирующего гормона(TSH), которое стимулирует действие TSH на его рецептор, что приводит к гипертиреозу. Механизмы типа III, в основном, включают антитела, образующие иммунные комплексы с антигеном. Циркулирующие комплексы активируют комплемент, присоединяются к эритроцитам (которые затем подвергаются фароцитазу в селезенке), выходят из кровообращения и инициируют воспаление в тканях (реакция Артюса) или фагоцитируются макрофагами, которые презентируют антиген, выделяют цитокины и активируют В- и Т-клетки. IgE, IgA, IgG и IgM образуют комплексы с антигеном. Реакции типаIII возникают при отложении иммунных комплексов в тканях, особенно в коже, суставах и почках. Хронический иммунный комплексный нефрит ответственен за большинство случаев гломерулонефрита у человека. Состояния, в которых иммунные комплексы (ИК), играют, по-видимому, роль, включают сывороточную болезнь, вызываемую сывороткой, лекарственным средством или антителом вирусного гепатита; системную красную волчанку; ревматоидный артрит; полиартериит; криоглобулинемию; пневмонит вследствие гиперчувствительности; аспергиллез бронхов и легких; острый гломерулонефрит; хронический мембранопролиферативный гломерулонефрит; и сопутствующие заболевания почек. Считают,что при аспергиллезе бронхов и легких, вызванном лекарственным средством или сывороткой сывороточной болезни, и некоторых формах почечных заболеваний IgE-опосредованная реакция предшествует реакции III типа. Стандартные модели реакции III типа на основе животных представляют собой реакцию Артюса и экспериментальную сывороточную модель. При реакции Артюса (как правило, местная кожная реакция) животных сначала многократно иммунизируют для того, чтобы достичь большого количества циркулирующих антител-IgG, и затем небольшие количества антигена вводят внутрикожно. Антиген преципилирует с избыточными IgG и активирует комплемент, так что быстро возникает воспалительное, отечное,болезненное местное повреждение (через 4-6 ч), и оно может быстро прогрессировать до стерильного абсцесса, содержащего множество полиморфоядерных клеток, и затем до некроза ткани. Некротизирующий васкулит с закупоренным просветом артериол может быть виден в микроскоп. Реакции не предшествует латентный период, поскольку антитело уже присутствует. Реакции типа I, II и III вызываются антителами. Реакции типа IV вызываются Т-лимфоцитами. Гиперчувствительности типа IV, включающей реакции, опосредованные клетками, обычно требуется 12 или более часов для развития, и она основана на сетях активированных иммунных клеток. Основной характеристикой тканей является воспаление, и в результате может развиваться хроническое воспалительное заболевание. Гиперчувствительность типа IV также называют гиперчувствительностью замедленного типа (типа IV) или DTH. Реакции опосредуются интерлейкином-2, интерфероном- и другими цитокинами, выделяемыми Т-лимфоцитами. При DTH Т-лимфоциты вступают в реакцию с антигеном и выделяют интерлейкин-9, интерферон- и другие цитокины. После того как Т-клетки сенсибилизированы в результате первичного воздействия антигена, вторичное воздействие приводит к реакции гиперчувствительности замедленного типа, местной воспалительной реакции, клиническое проявление которой занимает 2-3 дня. Гистологически эти реакции состоят из инфильтрирующих Т-лимфоцитов, макрофагов и случайных эозинофилов. Экспериментально DTH может быть перенесена с помощью Т-лимфоцитов, но не сыворотки, т.е. антитела не вовлечены.DTH может развиться из обычного опосредованного клетками иммунного ответа на инфекцию, вызванную вирусами, грибами и некоторыми бактериями, а именно Mycobacterium tuberculosis и Mycobacterium leprae. Если макрофаги не могут разрушить захваченные микроорганизмы, они могут претерпевать дифференциацию в эпителиальные клетки или многоядерные гигантские клетки. Множество таких клеток образуют гранулему. Локальное повреждение ткани является нежелательным побочным эффектом данного, в остальном защитного, иммунного ответа. Однако, если DTH-ответ отсутствует или ослаблен, Т-лимфоциты не могут локализовать вторгнувшиеся микроорганизмы, и у пациента развивается инвазивная агрессивная динеминированная болезнь, такая как острый туберкулез. Контактный дерматит к профессиональным и другим антигенам также является реакцией типа IV. Агенты, которые его вызывают, обычно имеют относительно низкую молекулярную массу (1 кД) и не являются иммуногенными сами по себе, но они являются высокореакционноспособными молекулами,которые ковалентно связываются с белками кожи или ткани. Сенсибилизирующее химическое соединение известно как гаптен, а белок-хозяин, с которым он соединяется, известен как носитель. Спектр потенциальных сенсибилизирующих антигенов широк. Распознают две фазы патогенеза: фаза сенсибили-2 006745 зации и фаза проявления. Во время фазы сенсибилизации антигенпрезентирующие клетки в коже, известные как клетки Лангерганса, связывают комплекс гаптен-(белок-носитель) и презентируют его Тлимфоцитам в сочетании с антигеном МНС класса II. Индукция Т-клеток может происходить через месяцы после контакта с небольшим количеством антигена. Повторный контакт с соответствующим антигеном инициирует фазу проявления, при которой эффекторные клетки мигрируют в кожу в направлении белкового комплекса, презентированного клетками Лангерганса в эпидермисе, с последующим выделением цитокина и кожным воспалением. Диагностику вызывающего реакцию аллергена осуществляют аппликационными кожными пробами. Подозреваемый контактный сенсибилизатор наносят на спину пациента и закрывают на 48 ч. Место реакции проверяют после 2 и 24 ч. При положительном ответе имеют место воспаление и уплотнение на тестируемом участке. Гиперчувствительность замедленного типа также является ключевым механизмом, определяющим отторжение трансплантированных тест-органов. Некоторые клинические состояния, при которых, как полагают, реакции типа IV играют важную роль, включают контактный дерматит, пневмонит, являющийся проявлением, отторжение аллотрансплантанта, гранулему, вызванную внутриклеточными организмами, некоторые формы чувствительности к лекарственным средствам, тиреоидит и энцефаломиелиты после вакцинирования против бешенства. Доказательства для последних двух состояний основаны на экспериментальных моделях, при заболеваниях человека при появлении лимфоцитов в воспалительном экссудате щитовидной железы и мозга. Дерматит также называют экземой. Он относится к поверхностным воспалениям кожи, гистологически характеризуемым отеком эпидермиса и клинически характеризуемым везикулами (при остром состоянии), краснотой с плохо очерченными краями, отеком, мокнутием, струпьями, шелушением, обычным зудом и лихенизацией, вызываемой расчесыванием или растиранием. Часто экзема относится к везикулярному дерматиту, но иногда термин ограничен экземой в смысле хронического дерматита. Некоторые также называют дерматит спонгиозным дерматитом, так как спонгиоз (внутриэпидермальный отек) является гистологической характеристикой. Контактный дерматит представляет собой острое или хроническое воспаление, часто асимметрической или странной формы, вызываемое веществами, контактирующими с кожей и вызывающими токсические (раздражающие) или аллергические реакции. Диагностика реакций гиперчувствительности зависит от типа вовлеченной реакции. Реакцию типа IV можно предположить, когда воспалительная реакция гистологически характеризуется околососудистыми лимфоцитами и макрофагами. Кожные пробы на гиперчувствительность замедленного типа и аппликационные кожные пробы являются наиболее доступными методами тестирования гиперчувствительности замедленного типа. Для предотвращения обострения контактного дерматита аппликационные кожные пробы проводят после того, как контактный дерматит устранен. Подозреваемый аллерген (в соответствующей концентрации) наносят на кожу под неабсорбирующий пластырь и оставляют на 48 ч. Если жжение или зуд начинается раньше, пластырь удаляют. Положительный результат тестирования представляет собой эритему с некоторым уплотнением и, иногда, образованием везикул. Так как некоторые реакции не проявляются до удаления пластыря, место реакции повторно проверяют через 72 и 96 ч. Гиперчувствительность также может проявляться как реакция на лекарственные средства. Прежде чем относить данную реакцию за счет лекарственного средства, необходимо отметить, что плацебо также может вызывать множество симптомов и даже объективных показателей, таких как сыпь на коже. Тем не менее, действительные реакции на лекарственные средства составляют основную медицинскую проблему. При непереносимости лекарственных средств неблагоприятные реакции возникают при первом же введении или нанесении лекарственного средства. Это может быть та же токсическая реакция, которую обычно ожидают при более высоких дозах, или это может быть преувеличение обычно умеренного побочного эффекта (например, антигистаминный седативный эффект). Идиосинкразия представляет собой состояние, при котором неблагоприятная реакция при первом введении и нанесении лекарства является фармакологически неожиданной и уникальной. Характеристики аллергических реакций на лекарства включают IgE-опосредованные реакции, возникающие только после того, как пациент был подвергнут воздействию лекарственного средства (необязательно для терапии) один или много раз без проблем. Как только развивается гиперчувствительность,реакция может быть вызвана дозами намного ниже терапевтических количеств, и обычно ниже тех уровней, которые вызывают идиосинкразические реакции. Клинические характеристики ограничены в своих проявлениях. Кожная сыпь (особенно крапивница), синдром, напоминающий сывороточную болезнь,неожиданная лихорадка, анафилаксия и эозинофильные легочные инфильтраты, возникающие во время лекарственной терапии, являются, как правило, следствием гиперчувствительности; в некоторых случаях анемии, тромбоцитопении или агранулоцитоза. Редко, васкулит возникает после повторного воздействия с помощью лекарственного средства (например, сульфонамидов, йодидов, пенициллина), и интерстициальный нефрит (например, метициллин) и повреждение печени (например, галотан) были описаны в условиях, согласующихся с развитием определенной гиперчувствительности.-3 006745 Наиболее серьезным примером гиперчувствительности к лекарственным средствам является анафилаксия. Однако намного более частой реакцией на лекарственные средства является кореподобная сыпь, опять же неизвестной этиологии. Лихорадка и крапивница также являются довольно частыми последствиями аллергии на лекарственные средства. Если для терапии применяется сыворотка животного,сывороточная болезнь является осложнением, но в настоящее время сыворотка животного применяется редко. Может возникнуть серьезный сидром, напоминающий сывороточную болезнь неизвестного патогенеза без высоких уровней циркулирующих антител IgG, но обычно ассоциируемый с антителами IgE,особенно при приеме таких лекарственных средств, как пенициллин. Реакции гиперчувствительности на лекарственные средства основаны на способности белков и больших полипептидных лекарственных средств стимулировать образование специфических антител прямыми иммунологическими механизмами. Возможно, наименьшей молекулой, которая является потенциально антигенной, является глюкагон, молекулярная масса которого около 3500. Большинство молекул лекарственных средств намного меньше и не могут сами по себе действовать как антигены. Однако, как и гаптены, некоторые ковалентно связываются с белками, и полученные конъюгаты стимулируют образование специфичных антител к лекарственному средству. Лекарственное средство или один из его метаболитов способно вступать в химическую реакцию с белком. Связывание с белком сыворотки, характерное для многих лекарственных средств, является намного слабее и не обладает достаточной силой для антигенности. Специфическая иммунологическая реакция была определена только для бензилпенициллина. Это лекарственное средство не связывается достаточно сильно с белками ткани или сыворотки с образованием антигенного комплекса, но основной продукт его разложения, бензилпенициллиновая кислота, может объединяться с белками ткани с образованием бензилфенициллоила (БФО), главной антигенной детерминантой пенициллина. Некоторые минорные антигенные детерминанты образуются в относительно небольших количествах механизмами, которые намного менее определены. Реакции гиперчувствительности (I, II, III, IV) наиболее часто вовлекают детерминанту БФО. Антитела IgE к минорным детерминантам могут быть ответственны у некоторых пациентов за анафилаксию и крапивницу. Антитела IgE были обнаружены к главной, но не к минорным детерминантам. Они могут действовать как блокирующие антитела к БФО, модифицируя или даже предотвращая реакцию с БФО, в то время как отсутствие блокирующих IgG-антител к минорным детерминантам может объяснить способность этих детерминант индуцировать анафилаксию. Все полусинтетические пенициллины (например, амоксициллин, карбенициллин, тикарциллин) потенциально вступают в перекрестную реакцию с пенициллином таким образом, что чувствительные к пенициллину пациенты часто реагируют также и на них. Перекрестные реакции с цефалоспоринами проходят в меньшей степени. Лечение цефалоспоринами необходимо начинать очень осторожно, если у пациента имелись случаи острой реакции (например, анафилаксии) к пенициллину. Гематологические, опосредованные антителами (цитотоксические, типа II) реакции на лекарственные средства могут развиваться по любому из трех механизмов: при индуцированной пенициллином анемии антитело взаимодействует с гаптеном, который тесно связывается с мембраной эритроцита, вызывая агглютинацию и усиленное разрушение эритроцитов. При индуцированной стибофеном и квинидином тромбоцитофении лекарственное средство образует растворимый комплекс с его специфическим антителом. Затем комплекс вступает в реакцию с соседними тромбоцитами (клетки-мишени невинные свидетели) и активирует комплемент, который один остается в мембране тромбоцита и индуцирует лизис клеток. При других гемолитических анемиях лекарственное средство (например, метилдопа), повидимому, химически изменяет поверхность эритроцитов, тем самым раскрывая антиген, который индуцирует и затем взаимодействует с автоантителом, обычно с Rh-специфичностью. Токсически идиосинкратические и анафилактические реакции достаточно уникальны по видам или по времени так, что вызывающее их лекарственное средство обычно легко идентифицируется. Реакции типа сывороточной болезни наиболее часто вызываются пенициллинами, но иногда их вызывают и сульфонамиды, гидразин, сульфонилмочевины или тиазиды. Фотосенсибилизация является характерной для хлорпромазина, определенных антисептиков в мыле, сульфонамидов, псораленов, демеклоциклина и гризеофульвина. Все лекарства, за исключением тех, которые считаются абсолютно необходимыми,должны быть отменены. Если имеется подозрение на возникновение лихорадки от лекарственного средства, наиболее вероятно вызывающее ее лекарство отменяют (например, аллопуринол, пенициллин, изониазид, сульфонамиды, барбитураты, квинидин). Ослабление лихорадки в течение 48 ч указывает именно на это лекарственное средство. Если лихорадка сопровождается гранулоцитопенией, токсичность лекарственного средства наиболее вероятна, чем аллергия, и гораздо более серьезна. Аллергические легочные реакции на лекарственные средства обычно являются инфильтрирующими, с эозинофилией и могут быть вызваны среди прочих солями золота, пенициллином и сульфонамидами. Наиболее частой причиной возникновения острой инфильтрирующей легочной реакции является нитрофурантоин. Он, вероятно, является аллергенным, но обычно не является эозинофильным. Печеночные реакции могут быть, в первую очередь, холестатическими (наиболее часто на фенотиазины и эритромицин эстолат) или печеночно-клеточными (аллопуринол, гидантоин, соли золота, изониа-4 006745 зид, сульфонамиды, валпроевая кислота и многие другие). Обычной аллергической почечной реакцией является интерстициальный нефрит, в основном, из-за метициллина; также могут быть вовлечены другие противомикробные средства и циметидин. Синдром, напоминающий системную красную волчанку, может быть вызван несколькими лекарственными средствами, наиболее часто гидралозином и прокаинамидом. Синдром ассоциируют с положительной пробой на антиядерные антитела, и он является относительно неопасным, не затрагивающим почки и ЦНС. Пеницилламин может вызывать СКВ и другие аутоиммунные заболевания, наиболее часто злокачественную миастению. В 1989 г. была описана индуцированная эндотоксином активность сыворотки, которая индуцирует интерферон- (ИФН-), полученный в клетках селезенки мышей (Nakamura et al., 1989). Данная активность сыворотки действовала не как прямой индуктор IFN-, а, скорее, как костимулятор вместе с IL-2 или митогенами. При попытке выделить активное вещество из сыворотки мышей после воздействия эндоксина был обнаружен гомогенный белок массой 50-55 кДа. Так как другие цитокины могут действовать как костимуляторы продукции IFN-, из-за неспособности нейтрализующих антител к IL-1, IL-4, IL-5,IL-6 или TNF нейтрализовать активность сыворотки предположим, она определилась особым фактором. В 1995 г. те же самые исследователи продемонстрировали, что индуцированный эндотоксином костимулятор продукции IFN- присутствует в экстрактах печени мышей, предварительно подвергнутой воздействию Р. acnes (Okamura et al., 1995). В данной модели популяция печеночных макрофагов (клетки Купффера) увеличивалась, и у данных мышей низкие дозы бактериального липополисахарида (ЛПС),которые у предварительно неподготовленных мышей не являлись летальными, становились смертельными. Фактор, названный IFNиндуцирующим фактором (IGIF) и позднее обозначенный как интерлейкин-18 (IL-18), был очищен до гомогенности из 1200 г печени, подвергнутой воздействию Р. acnes мышей. Вырожденные олигонуклеотиды, происходящие из последовательностей аминокислот очищенногоIL-18, применяли для клонирования кДНК IL-18 мышей. IL-18 является белком с массой 18-19 кДа, состоящим из 157 аминокислот, который не имеет очевидного сходства с каким-либо пептидом в базе данных. Молекулы матричной РНК для IL-18 и интерлейкина-12 (IL-12) легко определяются в клетках Купффера и активированных макрофагах. Рекомбинантный IL-18 стимулируют IFN-гамма более эффективно, чем IL-12, очевидно, через отдельный механизм (Micallef et al., 1996). Подобно индуцированной эндотоксином активности сыворотки, IL-18 стимулирует IFN- не самостоятельно, а действует преимущественно как костимулятор с митогенами или IL-2. IL-18 усиливает пролиферацию Т-клеток, очевидно,по IL-2-зависимому пути и усиливает продукцию цитокинов Th1 in vitro и оказывает синергическое действие при сочетании с IL-12 в отношении продукции IFN- (Maliswewski et al., 1990). После клонирования мышиных форм в 1996 г. была описана последовательность кДНК IL-18 человека (Ushio et al., 1996). При клонировании IL-18 из пораженных тканей и изучения экспрессии гена IL-18 гена была обнаружена тесная ассоциация данного цитокина с аутоиммунными заболеваниями. У мышей без ожирения с диабетом (NOD) спонтанно развивается аутоиммунный инсулит и диабет, которые могут быть усилены и синхронизированы единственной инъекцией циклофосфамида. Наличие мРНК IL-18 продемонстрировано методом ПЦР обратной транскриптазой в поджелудочной железе МОД-мышей во время ранних стадий инсулита. Уровни мРНК IL-18 быстро увеличивались после лечения циклофосфамидом и предшествовали увеличению мРНК в IFN- и, впоследствии, диабета. Интересно, но данная кинетика повторяет типовую мРНК IL-12-p40, приводя к тесной корреляции между индивидуальными уровнями мРНК. Клонирование кДНК IL-18 из РНК поджелудочной железы с последующим секвенированием выявило идентичность с последовательностью у IL-18, клонированной из клеток Купффера и предварительно активированных in vivo макрофагов. Также макрофаги MOD-мышей реагировали на циклофосфамид экспрессией гена IL-18, в то время как макрофаги мышей линии Balb/c, обработанных параллельно, не реагировали. Следовательно, регуляция экспрессии IL-18 нарушена у мышей с аутоиммунной патологией и тесно ассоциирована с развитием диабета (Rothe et al., 1997).IL-18 играет потенциальную роль в иммунорегулировании или воспалении путем усиления функциональной активности Fas-лиганда на клетках Th1 (Conti et al., 1997). IL-18 также экспрессируется в коре надпочечника и, следовательно, может являться секретируемым нейроиммуномодулятором, играющим важную роль в гармоничной работе иммунной системы в ответ на стрессовое воздействиеIn vivo IL-18 образуется путем расщепления про-IL-18 и, видимо, его эндогенная активность отвечает за продукцию IFN- при смертной опосредованной Р. acnes и ЛПС. Зрелый IL-18 образуется из его предшественника с помощью IL-1 конвертирующего фермента (IL-1 бета-конвертирующий фермента,ICE, каспаза-1). Рецептор IL-18 состоит из, по крайней мере, двух компонентов, совместно действующих при связывании лиганда. Части связывания с высоким и низким сродством для IL-18 были обнаружены на стимулированных IL-12 Т-клетках мышей (Yoshimoto et al., 1998), что позволило предположить наличие рецепторного комплекса с множеством цепей. До настоящего времени были идентифицированы две-5 006745 субъединицы, обе принадлежащие семейству рецепторов IL-1 (Parnet et al., 1996). В трансдукцию сигнала IL-18 вовлечена активация NF-kB (DiDonato et al., 1997). Недавно растворимый белок, имеющий высокое сродство к IL-18, был выделен из мочи человека, и были описаны кДНК человека и мыши (Novick et al., 1999; WО 99/09063). Данный белок был назван IL18-связывающий белок (IL-18BP).IL-18BP является не внеклеточным доменом одного из известных рецепторов IL-18, а секретируемым, встречающимся в природе циркулирующим белком. Он принадлежит к новому семейству секретируемых белков. Данное семейство также включает несколько кодируемых вирусом белков, которые имеют высокую гомологию с IL-18BP (Novick et al., 1999). IL-18BP, постоянно экспрессируемый в селезенке, принадлежит к надсемейству иммуноглобулинов и имеет ограниченную гомологию с рецепторомIL-1 типа II. Его ген локализован на хромосоме человека 11q13, и не обнаружено энзима, кодирующего трансмембранный домен, в геномной последовательности размером 8,3 т.п.н. (Novick et al., 1999). Четыре человеческие и две мышиные изоформы IL-18BP, получающиеся в результате сплайсинга мРНК, обнаруженные в различных библиотеках кДНК, были экспрессированы, очищены и оценены в отношении биологической активности связывания и нейтрализации ИЛ-18 (Kim et al., 2000). Человеческая изоформа IL-18BP (IL-18BPa) продемонстрировала самое большое сродство к IL-18 с быстрым связыванием и медленным отсоединением и константой диссоциации (К(d, составляющей 399 пМ. IL18BPс имеет Ig-домен такой же или IL-18BPa, за исключением 29 С-концевых аминокислот; K(d) IL18BPс в 10 раз меньше (2,94 нМ). Тем не менее, IL-18BPa и IL-18BPс нейтрализуют IL-1895% при молярном избытке, равном двум. У изоформ IL-18BPb и IL-18BPc отсутствует полный Ig-домен и отсутствует способность к связыванию или нейтрализации IL-18. Мышиные изоформы IL-18BPc и IL-18BPd,имеющие идентичный Ig домен, также нейтрализуют 95% мышиного IL-18 при молярном избытке, равном двум. Однако мышиный IL-18BPd, который обладает такой же С-концевой последовательностью,что и человеческий IL-18BPa, также нейтрализует человеческий IL-18. Молекулярное моделирование позволило идентифицировать большой комбинированный электростатически и гидрофобный участок связывания в Ig-домене IL-18BP, который может отвечать за его высокоаффинное связывание с лигандом(Kim et al., 2000). В 1998 г. было предположено, что экспрессия интерлейкина-18 (IL-18) вовлечена в патогенез контактной гиперчувствительности у мышей (Хu et al., 1998). Хu et al. применяли мышиную модель контактной гиперчувствительности с использованием оксазолона в качестве контактного аллергена и показали индукцию экспрессии IL-18 в поврежденных участках кожи. Наивысшее повышение регуляции было обнаружено через 24 ч после контакта с аллергеном, затем экспрессия IL-18 постепенно уменьшилась. Другое сообщение о способности IL-18 индуцировать DTH-ответ независимо от IL-18 было опубликовано Kitching et al., 2000. Однако роль IL-18 остается неясной, так как было описано, что IL-18 сам по себе является потенциально эффективным терапевтическим средством для пациентов с атопическим дерматитом (Habu et al., 2001), что соответствует нескольким клиническим испытаниям, дающим основание предполагать, что IFN- улучшает симптомы атонического дерматита (Reinhold et аl., 1990; Hanifinet al., 1993). Краткое описание изобретения Настоящее изобретение основано на обнаружении того, что лечение мышей ингибиторами IL-18 в модели гиперчувствительности типа IV приводит к ослаблению реакции гиперчувствительности у животных по сравнению с контрольными животными. Поэтому настоящее изобретение относится к применению ингибитора IL-18 для получения лекарственного средства для лечения и/или профилактики расстройств в виде гиперчувствительности. Применение комбинаций ингибитора IL-18 с интерфероном,и/или ингибитором TNF, и/или ингибиторами воспаления, и/или противоаллергическими лекарственными средствами также входит в объем данного изобретения. В другом аспекте, данное изобретение относится к применению вектора экспрессии, содержащего кодирующую ингибитор IL-18 последовательность, для лечения и/или профилактики состояний гиперчувствительности. Изобретение также относится к применению клеток, генетически сконструированных с целью экспрессии ингибиторов IL-18, для лечения и/или профилактики расстройств в виде гиперчувствительности. Краткое описание фигур На фиг. 1 показано, что лечение IL-18BP во время провокационной пробы защищает от контактной гиперчувствительности (КГЧ). Мышей сенсибилизировали DNFB в спину в 0 день и делали провокационную пробу через 5 дней в уши. Опухание ушей измеряли ежедневно и выражали в виде увеличения опухания подвергнутых воздействию DNFB по отношению к обработанному растворителем контрольному уху. Лечение 250 мкг IL-18BP в.б. на одну мышь в день в дни от 5 до 8 значительно снижало опухание ушей (А), в то время как лечение в дни от 0 до 2 не оказало воздействия при данных параметрах эксперимента (В) (n=5 мышей в группе). Квадраты: мыши, леченные IL-18BP; треугольники: контрольные, т.е. обработанные физиологическим раствором животные. На фиг. 2 показана степень опухания ушей от дня 5 до дня 30 после первого контакта с гаптеном в день 5 и второго контакта в день 19 в модели гиперчувствительности замедленного типа с системным-6 006745 введением 250 мкг/мышь/день IL-18BP (незакрашенные квадраты) или раствора (закрашенные квадраты) в дни от 19 до 22. На фиг. 3 показано, что IL-18BP защищает от КГЧ нейтрализацией IL-18. Мышей, у которых отсутствует IL-18 (КО), и мышей дикого типа C57BL/6 сравнивали для определения их способности давать ответ в виде КГЧ. У мышей с отсутствием IL-18 КГЧ развивается в ответ на DNFB, хотя менее явно, чем у мышей дикого типа. Однако у мышей с отсутствием IL-18 не наблюдалось никакого эффекта от лечения IL-18BP, что указывает на то, что противовоспалительное действие IL-18BP при КГЧ достигается за счет нейтрализации IL-18 (n=5 мышей в группе). Круги: физиологический раствор у мышей с дефицитом(WT); треугольники: физиологический раствор у мышей дикого типа (WT). На фиг. 4 показано, что IL-18BP не снижает проницаемости сосудов во время КГЧ. КГЧ индуцировали у мышей C57BL/6. Для мониторинга отека, вызванного реакцией КГЧ, Evans Blue вводили в.в. за 2 ч до воздействия DNFB. Мышей умерщвляли через 24 ч и обрабатывали уши так, чтобы экстрагировать краситель, который проник из сосудистой сети и скопился в окружающих тканях. Проникновение в ткани из сосудов оценивали как количество красителя на мг высушенной ткани уха, скорректированное на концентрацию Evans Blue в сыворотке и выраженное в виде отношения подвергнутых воздействию и контрольных ушей. Хотя лечение IL-18BP на день 4 и день 5 снижало опухание до 56% от контрольных ушей, обработанных раствором (левая панель, р 0,01), в проницаемости сосудов не наблюдалось значительного различия между этими двумя группами. В обеих группах показан значительно увеличенный отек по сравнению с несенсибилизированной контрольной группой (р 0,05 и р 0,01). В качестве дальнейшего контроля, мышей обрабатывали 250 мкг нерелевантного белка БСА на одно животное в день. У этих мышей КГЧ развивалось так же, как и у животных, обработанных раствором (n=10 мышей в группе). На фиг. 5 лечение IL-18BP уменьшает воспалительную инфильтрацию подвергнутого воздействиюDNFB уха. КГЧ индуцировала у мышей C57BL/6, как описано. Животных обрабатывали IL-18BP или раствором в дни 4-6. Лечение IL-18BP уменьшало опухание до 58% от контрольной группы с раствором на 7 день. Мышей умерщвляли на 7 день, собирали подвергнутые воздействию уши, и группировали их(n=8), и подвергали ферментативному расщеплению с получением суспензии отдельных клеток. Клетки характеризовали последующим анализом FACs, основываясь на CD45-положительных живых клетках. Количество Т-клеток, NK-клеток, нейтрофилов и моноцитов/макрофагов, обнаруженных в препаратах уха, выражают как процент от общего количества анализированных клеток (верхние значения). Снижение указанных типов клеток после лечения IL-18BP по отношению к контрольной группе с раствором дано в нижних цифрах. На фиг. 6 показано, что активация Т-клеток ослабляется при лечении IL-18BP. Клетки, полученные из подвергнутых воздействию DNFB ушей, повторно стимулируют при 2 х 105 на ячейку планшета со связанными на нем антителами к CD3. Во время последующей культивации в течение 24 ч IL-18BP не добавляли. Продукцию IFN- измеряли в трех повторах с помощью ELISA. Клетки, полученные от обработанных IL-18BP мышей, продуцировали только 45% IFN-, обнаруженного в культурах клеток, полученных от контрольных животных, обработанных раствором. На фиг. 7 показано, что лечение IL-18BP снижает количество клеток, продуцирующих IFN, в воспалительном инфильтрате уха. Препараты клеток из подвергнутых воздействию DNFB ушей стимулировали 50 нг/мл РМА и 500 нг/мл лономицина в течение 4 ч. Секрецию цитокина блокировали добавлением 2 мкг/мл брефелдина А в последние 2 ч инкубирования. Затем клетки подвергали многоцветному иммунофлуоресцентному окрашиванию на предмет внутриклеточных IFN и поверхностных антигенов. Лечение IL-18BP снижало общее количество клеток, положительных в отношении окрашивания на предмет IFN до 78% от контроля. IFN продуцировал Т-клетками CD8 и, в меньшей степени, Тклетками CD4. В NK-клетках и Т-клетках IFN не обнаружен (н.о. - не определено;Форбол 12 Миристат 13-Ацетат). На фиг. 8 Лечение IL-18BP не ослабляет рекрутимент клеток Лангерганса в дренирующий лимфатический узел. Мышей окрашивали нанесением гаптена FITC или раствора ацетон/дибутилфталат (1:1) на правый и левый бок, соответственно. Паховые лимфатические узлы собирали через 24 ч после окрашивания. Конъюгированные с гаптеном клетки Лангерганса могли быть определены с помощью FACS как клетки FITC+, CD11c+ в лимфатическом узле, дренирующем окрашенный FITC бок, но не в лимфатическом узле, дренирующем противоположный бок, окрашенный только раствором. Процент несущих гаптен клеток Лангерганса в дренирующем лимфатическом узле составлял 1,2% от общего количества клеток лимфатического узла у животных, леченных IL-18BP за 24 и 1 ч до окрашивания. Это не отличалось значительно от количества, полученного у контрольных животных (n=5 дренирующих лимфатических узлов на группу). Описание изобретения Настоящее изобретение основано на обнаружении того, что ингибитор IL-18 оказывает благотворное действие на восстановление после сенсибилизации гаптеном в модели гиперчувствительности типа-7 006745 Поэтому данное изобретение относится к применению ингибитора IL-18 для получения лекарственного средства для лечения и/или профилактики расстройств в виде гиперчувствительности. В контексте данного изобретения выражения расстройство в виде гиперчувствительности и аллергическое расстройство являются синонимами. Оба термина относятся к расстройствам или реакциям, вызванным неадекватным адаптивным иммунным ответом. Реакции гиперчувствительности являются результатом в корне благотворного иммунного ответа, действующего неадекватно в отношении чужеродных антигенов, таких как, например, обычные макромолекулы окружающей среды, который может привести к воспалительным реакциям и повреждению ткани. При расстройствах, являющихся проявлением гиперчувствительности, обычно безвредный стимулятор, аллерген, вызывает иммунный ответ, который при повторном контакте реактивируется с возникновением патологического повреждения. Расстройства в виде гиперчувствительности, а также их клинические симптомы и проявления подробно описаны в Уровне техники и применение в соответствии с данным изобретением относится к,но не ограничено ими, расстройствам в виде гиперчувствительности, описанным выше. В предпочтительном варианте данного изобретения расстройство в виде гиперчувствительности выбирают из группы, включающей расстройства с реакциями гиперчувствительности типа I, расстройства с реакциями гиперчувствительности типа II, расстройства с реакциями гиперчувствительности типаIII или расстройства с реакциями гиперчувствительности типа IV. Расстройства с гиперчувствительностью типа I также называют гиперчувствительностью немедленного типа или обычной аллергией. Данная гиперчувствительность опосредуется IgE. Реакции гиперчувствительности немедленного типа (тип I) возникают из-за связывания антигена с IgE на тучных клетках или базофилах. В понятие расстройств с реакциями гиперчувствительности типа I включены атопические заболевания, такие как, но не ограниченные ими, аллергический ринит, аллергический конъюнктивит, атопический дерматит, аллергическая приобретенная бронхиальная астма, крапивница, системная анафилаксия. Анафилаксия является тяжелой, угрожающей жизни аллергической реакцией, возникающей при гиперчувствительности типа I (немедленной). Гиперчувствительность типа II или цитотоксическая гиперчувствительность включает цитолитические действия, опосредованные антителом, комплементом и/или клеточными механизмами. Антитело к связанному с клеткой антигену (тип II) вызывает разрушение клетки путем активации комплемента или стимуляции фагоцитоза. Расстройства с гиперчувствительностью типа II в соответствии с данным изобретением включают, например, Кумбс-положительную гемолитическую анемию, индуцируемую антителами тромбоцитопеническую пурпуру, лейкопению, пузырчатку, пемфигоид, синдром Гудпасчера и пернициозную анемию. Эти реакции имеют место у пациентов после переливания несовместимой крови,при гемолитических заболеваниях новорожденных и при тромбоцитопении новорожденных, они также могут играть роль в мультисистемных заболеваниях, являющимися проявлением гиперчувствительности,(например, при системной красной волчанке, СКВ). Расстройства с гиперчувствительностью III типа включают реакции, в которых антитела образуют иммунные комплексы с антигеном. Циркулирующие комплексы активируют комплемент, присоединяются к эритроцитам, которые затем подвергаются фотоцитозу селезенке, выходят из системы кровообращения и вызывают воспаление тканей. Эта реакция называется реакцией Артюса. Альтернативно, комплексы фагоцитозируются макрофагами, которые презентируют антиген, выделяют цитокины и активируют В и Т-клетки. IgE, IgA, IgG и IgM образуют комплексы с антигеном. Реакции типа III возникают,как правило, при отложении иммунных комплексов в тканях, особенно в коже, суставах и почках. Хронический иммунный комплексный нефрит ответственен за большинство случаев гломерулонефрита у человека. В соответствии с данным изобретением расстройства гиперчувствительности типа III включают, например, сывороточную болезнь, вызываемую сывороткой, лекарственными средствами или антителом вирусного гепатита; СКВ; ревматоидный артрит (РА); полиартериит; криоглобулинемию; гиперчувствительный пневмонит; аспергиллез бронхов и легких; острый гломерулонефрит; хронический мембранопролиферативный гломерулонефрит; и сопутствующие заболевания почек. Расстройства с гиперчувствительностью типа IV включают опосредованные клетками реакции, и их развитие обычно занимает 12 или более часов. Расстройства с гиперчувствительностью типа IV могут включать воспаление, и результатом может быть хроническое воспалительное заболевание. Гиперчувствительности типа IV также называют гиперчувствительностью замедленного типа или DTH. После того как только Т-клетки сенсибилизированы в результате первичного воздействия, вторичное воздействие приводит к реакции гиперчувствительности замедленного типа. Эта реакция является местным воспалительным ответом, который иногда занимает 2-3 дня для клинического проявления. В предпочтительном варианте данного изобретения расстройство с гиперчувствительностью является гиперчувствительностью замедленного типа. Таким образом, данное изобретение предпочтительно относится ко всем видам клинических состояний, в которых реакции типа IV играют важную роль, таким как контактная гиперчувствительность замедленного типа, дерматит, контактный дерматит, гиперчувствительный пневмонит, отторжение аллотрансплантата, гранулема, вызванная внутриклеточными организмами, некоторые формы чувствительности к лекарственным средствам, тиреоидит и энцефаломиелиты после вакцинирования против бешенства.DTH может возникнуть при обычном опосредованном клетками иммунном ответе на заражение вирусами, грибами и некоторыми бактериями, а именно Mycobacterium tuberculosis и Mycobacterium leprae. Другими внешними агентами, вызывающими DTH, могут быть секреции растений, животных, насекомых и рептилий, химические или биохимические антигены. Они могут происходить из природных или синтетических источников. Различные типы волокон, тканей и подобных, таких как латекс, применяемый в хирургических перчатках, могут вызвать опосредуемую Т-клетками реакцию гиперчувствительности у некоторых индивидуумов. Вызывающие реакцию внешние агенты могут быть агентами, поступающими с водой, такими как растворенные соли и минералы, встречающиеся, например, в окружающей среде, в угледобывающей, металлургической и химической промышленности. В другом предпочтительном варианте данного изобретения расстройством с гиперчувствительностью является контактный дерматит или контактная гиперчувствительность. Контактный дерматит, также являющийся реакцией типа IV, является реакцией на профессиональные и другие антигены. Агенты,вызывающие контактный дерматит, обычно имеют относительно низкую молекулярную массу (1 кД) и не являются иммуногенными сами по себе, но они представляют собой высокореакционноспособные молекулы, которые ковалентно связываются с белками кожи или тканей. Сенсибилизирующее химическое соединение известно как гаптен, белок-хозяин, с которым он соединяется, известен как носитель. Известно множество гаптенов, вызывающих контактный дерматит. Для того чтобы обнаружить, будет ли у пациента развиваться контактный дерматит в ответ на указанный сенсибилизатор, подозреваемый контактный сенсибилизатор наносят на спину пациента и закрывают на 48 ч. Место реакции проверяют после 2 и 24 ч. При положительном ответе имеет место воспаление и уплотнение на тестируемом участке. Гиперчувствительность замедленного типа также является ключевым механизмом, определяющим отторжение трансплантированных тест-органов, и поэтому данное изобретение также относится к применению ингибитора IL-18 для предотвращения отторжения трансплантата. Термин ингибитор IL-18 в контексте данного изобретения относится к любой молекуле, модулирующей продукцию IL-18 и/или действие IL-18 таким образом, что продукция и/или его действие IL-18 ослабляется, уменьшается или частично, существенно или полностью предотвращается или блокируется. Термин ингибитор IL-18 охватывает ингибиторы продукции IL-18, а также ингибиторы действия IL18. Ингибитором продукции может быть любая молекула, отрицательно влияющая на синтез, процессинг или созревание IL-18. Ингибиторы в соответствии с данным изобретением могут быть, например,суппрессорами экспрессии гена интерлейкина IL-18, антисмысловыми мРНК, уменьшающими или предотвращающими транскрипцию мРНК IL-18 или ведущими к деградации мРНК, белками, нарушающими правильную укладку или частично или существенно предотвращающими секрецию IL-18, протеазами,способствующими деградации IL-18, после того как он был синтезирован, ингибиторами протеаз, расщепляющих про-IL-18 с получением зрелого IL-18, такими как ингибиторы каспазы-1, и подобными. Ингибитором действия IL-18 может быть, например, антагонист IL-18. Антагонисты могут связывать или изолировать саму молекулу IL-18 с достаточным сродством и специфичностью с частичной или существенной нейтрализацией IL-18 или участка(ов) связывания IL-18, ответственного за связывание IL-18 с его лигандами (как, например, с его рецепторами). Антагонист может также ингибировать путь передачи сигнала с участием IL-18, который активируется в клетках после связывании IL-18 с его рецептором. Ингибиторами действия IL-18 могут также быть растворимые рецепторы IL-18, или молекулы, имитирующие рецепторы, или агенты, блокирующие рецепторы IL-18, или антитела к IL-18, такие как поликлональные или моноклональные антитела, или любые другие агенты или молекулы, предотвращающие связывание IL-18 с его мишенями, что уменьшает или предотвращает инициирование внутри- или внеклеточных реакций, опосредованных IL-18. В предпочтительном варианте данного изобретения ингибитор IL-18 выбирают из ингибиторов каспазы-1 (ICE), антител к IL-18, антител к любым подъединицам рецептора IL-18, ингибиторов пути передачи сигнала с участием IL-18, антагонистов IL-18, которые конкурируют с IL-18 и блокируют рецептор IL-18, и связывающих IL-18 белков, изоформ, мутеинов, слитых белков, функциональных производных, активных фракций или производных циркулярной перестановки, имеющих то же действие. Термин связывающие IL-18 белки в данном описании применяется как синоним термина связывающий IL-18 белок или IL-18BP. Он включает связывающие IL-18 белки такие, как определены вWO 99/09063 или у Novick et al., 1999, включая варианты сплайсинга и/или изоформы связывающих IL18 белков, как определено у Kim et al., 2000, которые связываются с IL-18. В частности, в соответствии с данным изобретением применяются человеческие изоформы а и с IL-18BP. Белки, применяемые в соответствии с данным изобретением, могут быть гликозилированными или негликозилированными, они могут быть получены из природных источников, таких как моча, или они могут быть предпочтительно получены рекомбинантным путем. Рекомбинантная экспрессия может проводиться в прокариотных системах экспрессии, таких как Е. coli, или в эукариотной, предпочтительно системе экспрессии млекопитающих. В данном описании термин мутеины относится к аналогам IL-18 ВР или аналогам вирусного IL18BP, в которых один или более аминокислотных остатков встречающегося в природе IL-18BP или ви-9 006745 русного IL-18BP замещены отличными аминокислотными остатками или делетированы или один или более аминокислотных остатков добавлены к встречающейся в природе последовательности IL-18BP или вирусного IL-18BP, без оказания значительного влияния на активность полученных продуктов по сравнению с диким типом IL-18BP или вирусным IL-18BP. Данные мутеины получают известным синтезом и/или сайт-направленными методами мутагенеза, или любым другим известным методом, подходящим для данной цели. Мутеины в соответствии с данным изобретением включают белки, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которая гибридизируется с ДНК или РНК, которая кодирует IL-18BP или кодирует вирусный IL-18BP в соответствии с данным изобретением в жестких условиях. Термин жесткие условия относится к условиям гибридизации и последующего промывания, которые специалисты в данной области техники обычно называют жесткими. См. Ausubel et al., Current Protocols in MolecularBiology, ранее, Interscience, N.Y.,6,3 и 6,4 (1987, 1992) и Sambrook et al., ранее. Не ограничиваясь ими,примеры жестких условий включают условия промывания при температуре на 12-20 С ниже рассчитанной Тm изучаемого гидрида, например, в 2xSSC и 0,5% SDS в течение 5 мин, 2xSSC и 0,1% SDS в течение 15 мин; 0,1xSSC и 0,5% SDS при температуре 37 С в течение 30-60 мин и затем 0,1xSSC и 0,5% SDS при температуре 68 С в течение 30-60 мин. Специалисты в данной области техники понимают, что жесткость условий также зависит от длины последовательности ДНК, олигонуклеотидных зондов (таких как 10-40 оснований) или смеси олигонуклеотидных зондов. Если применяется смесь зондов, предпочтительно вместо SSC применять хлорид тетраметиламмония (ТМАС). См. Ausubel, ранее. Идентичность отражает взаимоотношение между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определяемыми путем сравнения последовательностей. В общем, идентичность относится к точному соответствию нуклеотида нуклеотиду или аминокислоты аминокислоте в двух полинуклеотидных или двух полипептидных последовательностях, соответственно, по всей длине сравниваемых последовательностей. Для последовательностей, в которых нет точного соответствия, может быть определен % идентичности. В общем, две сравниваемые последовательности выравнивают для получения максимального соответствия между ними. Данный процесс может включать добавление интервалов в одну или в обе последовательности для увеличения степени выравнивания. % идентичности может быть определен для всей длины каждой сравниваемой последовательности (так называемое глобальное выравнивание), что особенно подходит для последовательностей одинаковой или очень сходной длины, или для более коротких, определенных длин (так называемое локальное выравнивание), что больше подходит для последовательностей с неравными длинами. Способы сравнения идентичности и гомологии двух или более последовательностей хорошо известны в данной области техники. Так, например, имеется программное обеспечение от WisconsinSequence Analysis Package, версия 9.1 (Devereux J. et al., 1984), например программы BESTFIT и GAP могут применяться для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии между двумя полипептидными последовательностями. BESTFIT использует алгоритм локальной гомологии Smith and Waterman (1981) и обнаруживает наилучшую единичную область сходства между двумя последовательностями. Другие программы для определения идентичности и/или сходства между последовательностями также известны в данной области техники, например ряд программ BLAST (Altschul S.F. et al., 1990, Altschul S.F. et al., 1997, доступные с домашней страницы NCBI на www.ncbi.nim.nin.gov) и FASTA (Pearson W.R., 1990; Pearson 1998). Любой такой мутеин предпочтительно имеет последовательность аминокислот, в достаточной степени дублирующую последовательность IL-18BP или в достаточной степени дублирующую последовательность вирусного IL-18BP так, чтобы обладать в значительной степени сходной активностью с IL18BP. Одним из видов активности IL-18BP является его способность связывать IL-18. Пока мутеин обладает существенной активностью связывания IL-18, он может применяться для очистки IL-18, такой как с помощью аффинной хроматографии, и поэтому можно считать, что он обладает в значительной степени сходной активностью с IL-18BP. Следовательно, можно определить, обладает ли любой конкретный мутеин активностью, в значительной степени сходной с IL-18BP, с помощью обычных экспериментов,включающих в качестве объекта такой мутеин, например методом простого конкурентного сэндвичанализа для определения, связывает ли он соответствующим образом помеченный IL-18, такого как радиоиммунологический анализ или анализ ELISA. В предпочтительном варианте любой такой мутеин имеет, по крайней мере, 40% идентичности или гомологии с последовательностью либо IL-18BP, либо кодированного вирусом гомола IL-18BP, как определено в WO 99/09063. Более предпочтительно, чтобы он имел, по крайней мере, 50%, по крайней мере, 60%, по крайней мере, 70%, по крайней мере, 80% или, наиболее предпочтительно, по крайней мере,90% идентичности или гомологии с ними. Мутеины полипептидов IL-18BP или мутеины вирусных IL-18BP, которые могут применяться в соответствии с данным изобретением, или кодирующая их нуклеиновая кислота включают ограниченный набор в значительной степени соответствующих последовательностей, как, например, замещающие пептиды или полинуклеотиды, которые могут быть обыкновенно получены специалистом в данной области- 10006745 техники, без чрезмерного экспериментирования, основываясь на методах и инструкциях, представленных здесь. Предпочтительными изменениями для мутеинов в соответствии с данным изобретением являются те, которые называют консервативными заменами. Консервативные замены аминокислот полипептидов или белков IL-18BP или вирусных IL-18BP могут включать синонимические аминокислоты в пределах групп, которые обладают в достаточной степени сходными физико-химическими свойствами, такие замены между членами группы позволяют сохранить биологическую функцию молекулы (Granthman,1974). Понятно, что вставки и делеции аминокислот также могут быть сделаны в охарактеризованных выше последовательностях без нарушения из функций, особенно если вставки и делеции вовлекают только несколько аминокислот, например менее тридцати и предпочтительно менее десяти, и не удаляют или не перемещают аминокислоты, которые являются критическими для функциональной конформации,например цистеиновые остатки. Белки и мутеины, полученные путем таких делеций и/или вставками,входят в объем данного изобретения. Предпочтительно группами синонимических аминокислот являются те, которые представлены в табл. 1. Более предпочтительно группами синонимических аминокислот являются те, которые представлены в табл. 2; и наиболее предпочтительно группами синонимических аминокислот являются те, которые представлены в табл. 3. Таблица 1 Предпочтительные группы синонимических аминокислот- 11006745 Таблица 2 Более предпочтительные группы синонимических аминокислот Таблица 3 Наиболее предпочтительные группы синонимических аминокислот- 12006745 Примеры получения замен аминокислот в белках, которые могут применяться для получения мутеинов полипептидов или белков IL-18, или мутеинов вирусных IL-18BP для применения в соответствии с данным изобретением, включают любые известные стадии способа, такие как представленные в патентах США 4959314, 4588858 и 4737462, выданных Mark et al.; 5116943, выданном Koths et al.; 4965195, выданном Namen et al.; 4879111, выданном Chong et al.; и 5017691, выданном Lee et al.; и лизинзамещенных белков, представленных в патенте США 4904584 (Shaw et al.). Термин слитый белок относится к полипептиду, содержащему IL-18BP, или вирусный IL-18BP,или их мутеин, или их фрагмент, в слиянии с другим белком, который, например, имеет более продолжительное время существования в жидких средах организма. IL-18BP или вирусный IL-18BP может быть слит с другим белком, полипептидом или т.п., например с иммуноглобулином или его фрагментом. Термин функциональные производные, принимаемый в данном описании, включает производныеIL-18BP или вирусного IL-18BP и их мутеины и слитые белки, которые могут быть получены из функциональных групп, которые встречаются в виде боковых цепей на остатках или N-, или С-концевых групп, посредством способов, известных в данной области техники, и они включаются в данное изобретение до тех пор, пока они остаются фармацевтически приемлемыми, т.е. не нарушают активности белка,которая в значительной степени сходна с активностью IL-18BP или вирусного IL-18BP, и не придают токсических свойств содержащим их композициям. Данные производные могут, например, включать боковые цепи полиэтиленгликоля, которые могут маскировать антигенные участки и продлевать время жизни IL-18BP или вирусного IL-18BP в жидких средах организма. Другие производные включают алифатические эфиры карбоксильных групп, амиды карбоксильных групп, полученные реакцией с аммиаком или с первичными или вторичными аминами,N-ацильные производные свободных аминогрупп остатков аминокислот, полученные с ацильными группами (например, алканоильными или карбоциклическими ароильными группами), или О-ацильные производные свободных гидроксильных групп (например, групп сериновых или треониновых остатков), полученные с ацильными группами. В качестве активных фракций IL-18BP или вирусного IL-18BP, мутеинов и слитых белков данное изобретение включает любые фрагменты или предшественники полипептидной цепи молекулы белка как таковой или вместе с ассоциированными с ней молекулами или связанными с ней остатками, например сахаром или фосфатными остатками, или агрегатами молекулы белка или остатками сахара, при условии,что указанная фракция имеет активность, в значительной степени сходную с IL-18BP. Термин соли в данном описании относится как к солям карбоксильных групп, так и к кислотноаддитивным солям аминогрупп молекулы ингибитора IL-18 или их аналогов. Соли карбоксильной группы могут быть получены методами, известными в данной области техники, и включают неорганические соли, например натриевые, кальциевые, аммониевые, железные или цинковые соли и подобные, и соли с органическими основаниями, например с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и подобные. Кислотно-аддитивные соли включают, например, соли с минеральными кислотами, такими как, например, хлористо-водородная кислота или серная кислота, и соли с органическими кислотами, такими как, например, уксусная кислота или щавелевая кислота. Конечно, любые такие соли должны сохранять биологическую активность ингибитора IL-18 в соответствии с данным изобретением, такую как оказание благотворного действия на DHT, например. В другом предпочтительном варианте данного изобретения ингибитором IL-18 является антитело кIL-18. Антитела к IL-18 могут быть поликлональными или моноклональными, химерными, гуманизированными или даже полностью человеческими. Рекомбинантные антитела и их фрагменты характеризуются высокой степенью сродства связывания с IL-18 in vivo и низкой токсичностью. Антитела, которые могут применяться в соответствии с данным изобретением, характеризуются способностью лечить пациентов в течение периода времени, достаточного для получения от хорошей до превосходной регрессии или облегчения патогенного состояния или любого симптома или группы симптомов, относящихся к патогенному состоянию, и низкой токсичностью. Нейтрализующие антитела легко получают у животных, таких как кролики, козы или мыши, иммунизацией IL-18. Иммунизированные мыши особенно полезны для обеспечения источников В-клеток для получения гибридом, которые, в свою очередь, культивируют для получения больших количеств антиIL-18 моноклональных антител. Химерные антитела представляют собой молекулы иммуноглобулина, характеризующиеся двумя или более сегментами или частями, происходящими от различных видов животных. Как правило, вариабельную область химерного антитела получают из антитела млекопитающего, не относящегося к человеку, такого как мышиное моноклональное антитело, а константную область иммуноглобулина получают из молекулы иммуноглобулина человека. Предпочтительно, чтобы обе области и их комбинация имели низкую иммуногенность, что определяется обычным путем (Elliott et al., 1994). Гуманизированные антитела представляют собой молекулы иммуноглобулина, созданные методами генной инженерии, при которых мышиные константные области заменяют соответствующими человеческими областями, при этом сохраняют мышиные связывающие антиген области. Полученное мышино-человеческое химерное анти- 13006745 тело предпочтительно имеет сниженную иммуногенность и улучшенную фармакокинетику у человека(Knight et al., 1993). Таким образом, еще в одном предпочтительном варианте антитело к IL-18 представляет собой гуманизированное антитело к IL-18. Предпочтительные примеры гуманизированных антител к IL-18 описаны, например, в заявке на европейский патент ЕР 0974600. Еще в одном предпочтительном варианте антитело к IL-18 является полностью человеческим. Технология получения человеческих антител подробно описана, например, в WO 00/76310, WO 99/53049, US 6162963 или AU5336100. Полностью человеческими антителами являются рекомбинантные антитела,предпочтительно получаемые у трансгенных животных, например, ксеномышей, включающих полностью или частично функциональные локусы иммуноглобулина человека. В наиболее предпочтительном варианте данного изобретения ингибитором IL-18 является IL-18BP или его изоформа, мутеин, слитый белок, функциональное производное, активная фракция или производное циркулярной перестановки. Данные изоформы, мутеины, слитые белки или функциональные производные сохраняют биологическую активность IL-18BP, в частности связываются с IL-18, и предпочтительно имеют, по существу, как минимум, активность, сходную с IL-18BP. В идеале, такие белки обладают повышенной биологической активностью по сравнению с немодифицированным IL-18BP. Предпочтительные активные фракции обладают активностью, которая лучше активности IL-18BP, или имеют дальнейшие преимущества, такие как лучшая стабильность или меньшая токсичность или иммуногенность, или их легче получать в больших количествах, или легче очищать. Последовательности IL-18BP и его вариантов/изоформов сплайсенга могут быть получены из WO 99/09063 или у Nivick et al., 1999, а также у Kim et al., 2000. Функциональные производные IL-18BP могут быть конъюгированы с полимерами для улучшения свойств белка, таких как стабильность, период полураспада, биодоступность, переносимость организма человека или иммуногенность. Для достижения этой цели IL-18BP может быть связан, например, с полиэтиленгликолем (ПЭГ). ПЭГилирование может проводиться известными методами, описанными, например, в WO 92/13095. Следовательно, в предпочтительном варианте функциональное производное содержит, по крайней мере, одну составляющую, присоединенную к одной или более функциональным группам, которые встречаются как одна или более боковых цепей на остатках аминокислот. Вариант, в котором такой составляющей является полиэтиленгликоль (ПЭГ), наиболее предпочтителен. В другом предпочтительном варианте данного изобретения ингибитором IL-18 является слитый белок, содержащий целый IL-18 связывающий белок или его часть, который соединен с целым иммуноглобулином или его частью. Методы получения белков, слитых с иммуноглобулином, хорошо известны в данной области техники, некоторые из них описаны, например, в WO 01/03737. Специалист в данной области техники поймет, что получаемый слитый белок в соответствии с данным изобретением сохраняет биологическую активность IL-18BP, в частности, в отношении связывания с IL-18. Слияние может быть непосредственным или через короткий линкерный пептид, который может иметь от 1 до 3 аминокислот в длину или больше, например 13 остатков аминокислот в длину. Указанный линкер может быть,например, трипептидом с последовательностью E-F-M (Glu-Phe-Met) или линкером с последовательностью из 13 аминокислот, включающей Glu-Phe-Gly-Ala-Gly-Leu-Val-Leu-Gly-Gly-Gln-Phe-Met, введенным между последовательностью IL-18BP и последовательностью иммуноглобулина. Полученный слитый белок имеет улучшенные свойства, такие как увеличенное время существования в жидких средах организма (период полураспада), повышенная специфическая активность, повышенный уровень экспрессии, или улучшается очистка слитого белка. В предпочтительном варианте IL-18BP соединен с константной областью молекулы Ig. Предпочтительно он соединен с областями тяжелых цепей, например такими, как домены СН 2 или СН 3 человеческого IgG1. Создание специфических слитых белков, содержащих IL-18BP и часть иммуноглобулина,описано, например, в примере 11 WO 99/09063. Другие изоформы молекул Ig также подходят для создания слитых белков в соответствии с данным изобретением, такие как изоформы IgG2 или IgG4, или другие классы Ig, такие как, например, IgM или IgA. Слитые белки могут быть мономерными или мультимерными, гетеро- или гомомультимерными. Интерфероны особенно известны своим ингибирующим действием на репликацию вирусов и пролиферацию клеток. Интерферон-, например, играет важную роль в стимуляции иммунного и воспалительного ответов. Считается, что интерферон(IFN-, интерферон типа I) играет противовоспалительную роль. Таким образом, данное изобретение также относится к применению комбинации ингибитора IL-18 и интерферона в производстве лекарственных средств для лечения расстройств, являющихся проявлением гиперчувствительности. Интерфероны могут также быть конъюгированы с полимерами для улучшения стабильности белков. Конъюгат между интерфероном и многоатомным спиртом полиэтиленгликолем (ПЭГ) описан, например, в WO 99/55377.- 14006745 В другом предпочтительном варианте в соответствии с данным изобретением интерфероном является интерферон- (IFN-) и, более предпочтительно, IFN- 1 а. Ингибитор продукции и/или действие IL-18 предпочтительно применяют одновременно, последовательно или раздельно с интерфероном. Еще в одном предпочтительном варианте в соответствии с данным изобретением ингибитор IL-18 применяют в сочетании с антагонистом TNF. Антагонисты TNF оказывают свое действие несколькими путями. Во-первых, антагонисты могут связываться или изолировать саму молекулу TNF с достаточным сродством и специфичностью для частичной или в значительной степени полной нейтрализации эпитопаTNF или эпитопов, ответственных за связывание с рецептором TNF (далее называемым изолирующим антагонистом). Изолирующим антагонистом может быть, например, антитело, направленное против TNF. Альтернативно, антагонисты TNF могут ингибировать путем передачи сигнала с участием TNF, активированного рецептором клеточной поверхности после связывания TNF (далее называемые сигнализирующие антагонисты). Обе группы антагонистов являются полезными по отдельности или вместе с ингибитором IL-18 для лечения расстройств, являющихся проявлением гиперчувствительности. Антагонисты TNF могут быть легко идентифицированы и оценены обычным скринингом кандидатов по их действию на активность природного TNF в отношении чувствительных линий клеток in vitro,например В-клеток человека, в которых TNF вызывает пролиферацию и секрецию иммуноглобулина. Исследование включает композицию TNF при различной степени разбавленности испытуемого антагониста, например от 0,1 до 100 раз от молярного количества TNF, используемого в исследовании, и контрольную композицию, не содержащую TNF или содержащую только антагонист (Tucci et al., 1992). Изолирующие антагонисты являются предпочтительными антагонистами TNF, применяемыми в соответствии с данным изобретением. Среди изолирующих антагонистов предпочтительны те полипептиды, которые связывают TNF с высоким сродством и обладают низкой иммуногенностью. Растворимые молекулы рецептора TNF и нейтрализующие антитела к TNF особенно предпочтительны. Например,растворимые TNF-RI и TNF-RII применяются в соответствии с данным изобретением. Усеченные формы этих рецепторов, содержащие внеклеточные домены рецепторов или их функциональные части, являются особенно предпочтительными антагонистами в соответствии с данным изобретением. Усеченные растворимые рецепторы TNF типа-I и типa-II описаны, например, в ЕР 914431. Усеченные формы рецепторов TNF являются растворимыми и были обнаружены в моче и сыворотке как белки с М.м 30 и 40 кДа, связывающие и ингибирующие TNF, которые называют TBPI и TBPII,соответственно (Engelmann et al., 1990). Одновременное, последовательное или раздельное применение ингибитора IL-18 с антагонистом TNF и/или интерфероном является предпочтительным в соответствии с данным изобретением. В соответствии с данным изобретением TBPI и TBPII являются предпочтительными антагонистамиTNF для применения в сочетании с ингибитором IL-18. Производные, фрагменты, области и биологически активные части молекул рецептора, функционально похожие на молекулы рецепторов, также могут применяться в соответствии с данным изобретением. Такие биологически активные эквиваленты или производные молекулы рецептора относятся к части полипептида или последовательности, кодирующей молекулу рецептора, которые имеют достаточный размер и способны связывать TNF с таким сродством,что взаимодействие со связанным с мембраной рецептором TNF ингибируется или блокируется. В другом предпочтительном варианте человеческий растворимый TNF-RI (TBPI) представляет собой антагонист TNF, применяемый в соответствии с данным изобретением. Природные и рекомбинантные растворимые молекулы TNF-рецептора и способы их получения описаны в европейских патентах ЕР 308378, ЕР 398327 и ЕР 433900. Ингибитор IL-18 может применяться одновременно, последовательно или раздельно с ингибиторомTNF. В другом предпочтительном варианте данного изобретения лекарственное средство дополнительно содержит противовоспалительный агент, такой как NSAID (нестероидное противовоспалительное лекарственное средство). В предпочтительном варианте СОХ-ингибитор, и наиболее предпочтительно СОХ-2 ингибитор, применяют в сочетании с ингибитором IL-18. СОХ-ингибиторы известны в данной области техники. Определенные СОХ-2 ингибиторы, например, описаны в WO 01/00229. Активные компоненты могут применяться одновременно, последовательно или раздельно. Реакции гиперчувствительности часто лечат противоаллергическими лекарственными средствами,такими как антигистаминные препараты, кромолин, глюкокортикоиды или симпатомиметики. Поэтому данное изобретение также относится к комбинаторной терапии, включающей ингибитор IL-18 и противоаллергическое средство. Применение антигистамина, и/или кромолина, и/или глюкокортикоида, и/или симпатомиметического средства при раздельном, последовательном или одновременном применении с ингибитором IL-18 является предпочтительным в соответствии с данным изобретением. В следующем предпочтительном варианте данного изобретения ингибитор IL-18 применяют в количестве от около 0,0001 до 1000 мг/кг веса тела, или от около 0,001 до 100 мг/кг веса тела, или от около 0,01 до 10 мг/кг веса тела, или от около 0,1 до 5 мг/кг веса тела, или от около 1 до 3 мг/кг веса тела.- 15006745 Ингибитор IL-18 в соответствии с данным изобретением предпочтительно вводят местно, т.е. локально. При контактном дерматите, например, ингибитор IL-18 можно вводить непосредственно в поврежденную область кожи. В другом варианте данного изобретения ингибитор IL-18 вводят системно, предпочтительно подкожно или внутримышечно. Настоящее изобретение, кроме того, относится к применению вектора экспрессии, включающего кодирующую последовательность ингибитора IL-18, при получении лекарственного средства для профилактики и/или лечения расстройств в виде гиперчувствительности. Таким образом, предусматривается подход с использованием генной терапии для доставки ингибитора IL-18 в сайт, в котором он требуется. Для лечения и/или профилактики расстройства в виде гиперчувствительности вектор генной терапии,содержащий последовательность ингибитора продукции и/или действия IL-18, может быть инъецирован непосредственно в пораженную ткань, например, позволяя таким образом избежать проблем, возникающих при системном введении векторов генной терапии, таких как разбавление векторов, достижение или поражение клеток-мишеней или тканей-мишеней, и побочных эффектов. Применение вектора для инфицирования и/или увеличения эндогенной продукции ингибитора IL18 в клетке, обычно не активной в отношении экспрессии ингибитора IL-18, или которая экспрессирует недостаточное количество ингибиторов, также предусмотрено данным изобретением. Вектор может содержать регуляторные последовательности, функционирующие в клетках, в которых требуется экспрессировать ингибитор IL-18. Такие регуляторные последовательности могут быть, например, промоторами или энхансерами. Регуляторная последовательность может быть затем введена в правильный локус генома путем гомологической рекомбинацией, таким образом регуляторная последовательность функционально связывается с геном, экспрессию которого требуется инфицировать или усилить. Технологию обычно называют эндогенная активация гена (EGA), и она описана, например, в WO 91/09955. Специалисту в данной области техники должно быть понятно, что также возможно остановить экспрессию IL-18 непосредственно, не применяя ингибитор IL-18, тем же методом. Для этого отрицательный регуляторный элемент, такой как, например, вызывающий молчание элемент, можно встроить в локус гена IL-18, что приведет к снижению или прекращению экспрессии IL-18. Специалист в данной области техники понимает, что такое снижение регуляции или прекращение экспрессии IL-18 имеет тот же эффект, что и применение ингибитора IL-18 для профилактики и/или лечения заболевания. Данное изобретение также относится к применению клетки, которая была генетически модифицирована с целью продукции ингибитора IL-18, для производства лекарственного средства для лечения и/или профилактики расстройств в виде гиперчувствительности. Данное изобретение также относится к фармацевтическим композициям, особенно полезным для профилактики и/или лечения расстройств в виде гиперчувствительности, которые включают терапевтически эффективное количество ингибитора IL-18, и/или терапевтически эффективное количество интерферона, и/или терапевтически эффективное количество ингибитора TNF, и/или фармацевтически эффективное количество противовоспалительного агента, и/или фармацевтически эффективное количество противоаллергического агента, в частности антигистамина. В качестве ингибитора IL-18 композиция может содержать ингибиторы 1-каспазы, антитела к IL-18,антитела к любой субъединице рецептора IL-18, ингибиторы путем передачи сигнала с участием IL-18,антагонисты IL-18, которые конкурируют с IL-18 и блокируют рецептор IL-18, и связывающие IL-18 белки, их изоформы, мутеины, слитые белки, функциональные производные, активные фракции или производные циркулярной перестановки, имеющие ту же активность.IL-18BP и его изоформы, мутеины, слитые белки, функциональные производные, активные фракции или производные циркулярной перестановки, такие как описанные выше, являются предпочтительными активными ингредиентами фармацевтической композиции. Интерферон, содержащийся в фармацевтической композиции, предпочтительно является IFN-. Еще в одном предпочтительном варианте фармацевтическая композиция включает терапевтически эффективное количество ингибитора TNF альфа. Фармацевтическая композиция в соответствии с данным изобретением также может включать один или более СОХ-ингибиторов. Определение фармацевтически приемлемый охватывает любые носители, которые не влияют на эффективность биологической активности активного ингредиента и не являются токсичными для пациента, которому их вводят. Например, при парентеральном введении активный белок(ки) может быть составлен в форме единицы дозирования для инъекций в носителях, таких как физиологический раствор,раствор декстрозы, альбумин сыворотки и раствор Рингера. Активные ингредиенты фармацевтических композиций в соответствии с данным изобретением могут вводиться индивидууму множеством способов. Способы введения включают внутрикожный, чрескожный (например, препаративные формы с медленным высвобождением), внутримышечный, внутрибрюшинный, внутривенной, подкожный, пероральный, интракраниальный, эпидуральный, местный, ректальный и интраназальный способы. Могут применяться любые другие терапевтически эффективные способы введения, например абсорбция через эпителиальные или эндотелиальные ткани или путь генной терапии, где молекулу ДНК, кодирующую активный агент, вводят пациенту (например, через вектор),- 16006745 что вызывает экспрессию и секрецию активного агента in vivo. Кроме того, белок(ки) в соответствии с данным изобретением можно вводить вместе с другими компонентами биологически активных агентов,такими как фармацевтически приемлемые поверхностно-активные вещества, наполнители, носители,разбавители и растворители. Для парентерального (например, внутривенного, подкожного, внутримышечного) введения активный белок(ки) могут быть представлены в виде раствора, суспензии, эмульсии или лиофилизированного порошка в сочетании с фармацевтически приемлемым носителем для парентерального введения (например, водой, физиологическим раствором, раствором декстрозы) и добавками, которые поддерживают изотоничность (например, манит) или химическую стабильность (например, консерванты и буферы). Препаративную форму стерилизуют обычными методами. Биодоступность активного белка(ов) в соответствии с данным изобретением также может быть улучшена методиками конъюгирования, которые увеличивают период полураспада молекулы в теле человека, например связыванием молекулы с полиэтиленгликолем, как описано в заявке на патент РСТ WO 92/13095. Терапевтически эффективные количества активного белка(ов) являются производными от множества параметров, включая тип антагониста, сродство антагониста с IL-18, любую остаточную цитотоксическую активность, проявленную антагонистом, способ введения, клиническое состояние пациента (включая желательность достижения нетоксичного уровня активности эндогенного IL-18). Терапевтически эффективным количеством является такое количество, при введении которого ингибитора IL-18 приводит к ингибированию биологической активности IL-18. Вводимая пациенту доза в виде единичной или множественной дозы может варьировать в зависимости от множества факторов,включая фармакокинетические свойства ингибитора IL-18, способ введения, состояние и характеристики пациента (пол, возраст, вес тела, состояние здоровья, рост), тяжесть симптомов, сопутствующее лечение,частота лечения и желаемый эффект. Корректировка и изменение указанных доз, а также in vivo и in vitro методы определения ингибирования IL-18 у пациента находится в компетенции специалиста в данной области техники. В соответствии с данным изобретением ингибитор IL-18 применяют в количестве от около 0,001 до 100 мг/кг, или от около 0,01 до 10 мг/кг веса тела, или от около 0,1 до 5 мг/кг веса тела, или от около 1 до 3 мг/кг веса тела, или около 2 мг/кг веса тела. Способом введения, который является предпочтительным в соответствии с данным изобретением,является введение подкожно. Также в соответствии с данным изобретением предпочтительно внутримышечное введение. Для введения ингибитора IL-18 непосредственно в место его действия также предпочтительно вводить его местно. Еще в одном предпочтительном варианте ингибитор IL-18 вводят ежедневно или через день. Ежедневные дозы обычно применяют в виде разделенных доз или в формах с замедленным высвобождением, эффективных для достижения желаемых результатов. Второе и последующие введения могут проводиться в дозе, которая является такой же, меньше или больше исходной или предыдущей дозы,вводимой пациенту. Второе или последующее введение может осуществляться во время или до развития заболевания. В соответствии с данным изобретением ингибитор IL-18 можно вводить индивидууму профилактически или терапевтически до, одновременно или последовательно с другими терапевтическими мероприятиями или агентами (например, прием нескольких лекарственных средств), в терапевтически эффективном количестве, в частности, с интерфероном, и/или ингибитором TNF, и/или другим противовоспалительным агентом, таким как ингибитор СОХ, и/или антиаллергическим агентом. Активные ингредиенты, которые вводят одновременно с другими терапевтическими средствами, могут вводиться в одной или в различных композициях. Данное изобретение также относится к способу получения фармацевтической композиции, содержащей смесь эффективного количества ингибитора IL-18, и/или интерферона, и/или антагониста TNF,и/или ингибитора СОХ с фармацевтически приемлемым носителем. Данное изобретение, кроме того, относится к способу лечения расстройств, являющихся проявлением гиперчувствительности, включающему введение фармацевтически эффективного количества ингибитора IL-18 пациенту, нуждающемуся в этом. Исходя из представленного выше полного описания, специалисту в данной области техники будет понятно, что то же самое может быть осуществлено в широком спектре эквивалентных параметров, концентраций и условий, не выходя за рамки данного изобретения, и без чрезмерного экспериментирования. Хотя данное изобретение описано в сочетании с конкретными вариантам осуществления, должно быть понятно, что возможны дальнейшие модификации. Данная заявка охватывает любые варианты,применения или адаптации данного изобретения, которые следуют, в общем, принципам изобретения и включают такие отклонения от данного описания, которые известны или обычно используются в области техники, к которой относится данное изобретение, и могут быть отнесены к представленным ранее в данном описании существенным признакам, определенным в формуле изобретения.- 17006745 Все представленные здесь ссылки, включая журнальные статьи или абстракты, опубликованные или неопубликованные патенты США или зарубежные патентные заявки, выданные патенты США или других стран или любые другие ссылки полностью включены в данное описание в виде ссылок, включая все данные, таблицы, фигуры и текст, представленные в указанных ссылках. Кроме того, полное содержание ссылочных документов, указанных в ссылочных документах, приводимых в данном описании,также полностью включены в качестве ссылок. Ссылки на стадии известных методов, стадии обычных методов, известные методы или обычные методы не являются допущением того, что любой аспект, описание или вариант воплощения данного изобретения описаны, раскрыты или предложены в соответствующей области техники. Представленное выше описание конкретных вариантов так раскрывает общую сущность данного изобретения, что другие, применяя специальные знания в области техники (включая содержание указанных в данном описании ссылочных документов), легко могут модифицировать и/или адаптировать для различных областей применения такие конкретные варианты воплощения без чрезмерного экспериментирования, не выходя из общей концепции данного изобретения. Поэтому такие адаптации и модификации подразумеваются в качестве эквивалентов описанных вариантов воплощения, основанных на описании и инструкциях, представленных выше. Должно быть понятно, что фразеология или терминология применяется только в описательных целях и не ограничивает данное изобретение, таким образом, фразеология или терминология данного описания должна быть интерпретирована специалистами в данной области техники в свете описаний и инструкций данного изобретения вместе со знаниями специалиста в данной области техники. Примеры Пример 1. Обработка IL-18BP снижает контактную гиперчувствительность. Методы Во всех представленных ниже примерах использовалась мышиная модель экспериментально индуцированной контактной гиперчувствительности (КГЧ). Степень КГЧ измеряют по опуханию уха в ответ на наносимый местно сенсибилизатор. Тест на опухание уха мыши, который использовали для получения данных, представленных на фиг. 13 (см. ниже), подробно описан (Garrigue et al., 1994). Коротко, мышей сенсибилизировали нанесением локально 25 мкл 0,5% раствора 2,4-динитрофторбензола (ДНФБ; Sigma Chemical Co.) в ацетоне/оливковом масле (4:1) на выбритый живот (0 день). Через 5 дней 20 мкл 0,2% ДНФБ в том же носителе наносили на правые уши и только носитель на левые уши. Мыши получали ежедневно, в 5-8 дни, 250 мкг/мышь/день rhIL-18BP (рекомбинантного IL-18BP человека) или физиологический раствор в контрольной группе внутрибрюшинно (в.б.) (фиг. 1 А) или они получали IL-18BP в дни 0-2 (фиг. 1 В). Толщину уха измеряли двойным толщиномером (Mitutoyo Corp., Kawasaki, Japan) и опухание уха оценивали вычитанием значения до контакта из значения после контакта и дальнейшим вычитанием любого значения опухания, определенного для обработанного носителем противоположного уха. Опухание уха измеряли на 0, 5, 6, 7, 8, 9, 12, 14, 16 дни. Другую модель использовали для получения данных, представленных на фиг. 4-6, см. примеры ниже. IL-18-связывающий белок (IL-18BP) применяли для нейтрализации IL-18 во время экспериментально индуцированной контактной гиперчувствительности (КГЧ) нанесением 2,4-динитрофторбензола(ДНФБ). Условия эксперимента были следующие: 1. 0 день: сенсибилизация. 25 мкл ДНФБ (0,5% в ацетоне/оливковом масле (4/1) в качестве носителя) на выбритую спину. 2. 5 день: контакт. 5 мкл ДНФБ (0,2%) на каждую внешнюю и внутреннюю часть правого уха. 5 мкл носителя на каждую дорзальную и вентральную часть левого уха. 3. 6 день: считывание. Проверка толщины уха как признака воспаления. Значения выражены как увеличение опухания (мкм) подвергнутого воздействию уха к контрольному уху. 4. 6 и 7 дни: обработка величин толщины ушей для анализа. В этой модели пики опухания приходятся между 6 и 7 днем. IL-18 нейтрализовали ежедневными инъекциями 250 мкг IL-18BP (в физиологическом растворе) на животное, либо во время сенсибилизации в 0, 1 и 2 дни, либо во время контакта в 4, 5 и 6 дни. Результаты Реакцией при контактной гиперчувствительности (КГЧ) являются гаптен-специфические воспаления кожи, опосредованные Т-клетками. Большинство гаптенов индуцируют олигоклональные Тклеточным ответом, включающие, в основном, эффекторные Т-клетки CD8+, в то время как Т-клеткиCD4+ регулируют реакцию КГЧ в форме ее снижения (Bour, H., et al., 1995; Grabbe et al., 1998). Для исследования роли IL-18 в КГЧ мышей сенсибилизировали нанесением на кожу ДНФБ, а затем подвергали повторному контакту через 5 дней нанесением гаптена на кожу уха. При повторном нанесении гаптена- 18006745 мышам вводили в.б. 250 мкг/мышь/день rhIL-18BP или физиологический раствор. IL-18BP или физиологический раствор в качестве контроля вводили ежедневно в течение 3 дней, на 5-8 дни после первой сенсибилизации ДНФБ (0 день). Повторный контакт с ДНФБ на 5 день вызывал значительное опухание уха в обеих группах (фиг. 1 А). Степень опухания у мышей, обработанных физиологическим раствором (треугольники), была намного более выраженной, чем у мышей, леченных IL-18BP (квадраты), причем ухо возвращалось к практически нормальному состоянию уже на 9 день. Изменение опухания уха, наблюдаемое при лечении IL-18BP, в дни 0-2 было статистически незначимым (фиг. 1 В). Время введения IL-18BP, по-видимому, является важным фактором для достижения благоприятного действия при лечении IL-18BP. Заключение В данной модели контактной гиперчувствительности/контактного дерматита на основе мышей трехдневное лечение ингибитором IL-18BP давало значительный благоприятный эффект на степень опухания/воспаления, вызванного обработкой гаптеном. Пример 2. Лечение IL-18BP снижает контактную гиперчувствительность после вторичного воздействия. Методы Мышей C57BL/6 сенсибилизировали нанесением на кожу выбритого живота 25 мкл 0,5% раствора ДНФБ (0 день). Мышей подвергали первому воздействию 20 мкл 0,2% ДНФБ на уши на 5 день. На 19 день мышей подвергали второму воздействию ДНФБ. Опухание уха измеряли в 0 день (сенсибилизация гаптеном), 5 день первое воздействие, 6, 7, 8, 9, 12, 14, 16, 19 дни (второе воздействие), 20, 21, 22, 23, 26,28 и 30 дни. Средние значения со среднеквадративными отклонениями для каждой группы представлены на фиг. 2. Мышей обрабатывали ежедневно 250 мкг/мышь/день IL-18BP в.б. (n=5; фиг. 2, незакрашенные квадраты) или физиологическим раствором (n=5; фиг. 2, закрашенные квадраты) в дни с 19 до 23. Результат Как показано на фиг. 2, лечение IL-18BP значительно снижало опухание уха, в особенности после вторичного воздействия гаптеном. Поэтому терапия с использованием IL-18BP особенно подходит для терапии расстройств в виде гиперчувствительности, при которых пациенты обычно повторно подвергаются воздействию одного и того же аллергена и нуждаются в лечении для того, чтобы преодолеть воспалительные реакции, вызванные воздействием. Пример 3. IL-18BP защищает от КГЧ посредством нейтрализации IL-18. Для того чтобы удостовериться, что защита от опухания достигается при терапии IL-18BP благодаря нейтрализации IL-18, мышей дикого типа C57BL/6 и мышей, у которых отсутствует IL-18, сравнивали по их способности давать ответ в виде КГЧ. Мыши с отсутствием IL-18 развивали КГЧ в ответ на ДНФБ,хотя менее заметную, чем у мышей дикого типа. Однако у мышей с отсутствием IL-18 эффекта от лечения IL-18BP отмечено не было, как показано на фиг. 3, что указывает на то, что противовоспалительное действие IL-18BP при КГЧ достигается за счет IL-18 (n=5 мышей на группу). Пример 4. IL-18BP не снижает проницаемости сосудов. Методы КГЧ индуцировали у мышей C57BL/6, как описано выше. Для мониторинга отека, вызванного реакцией КГЧ, вводили Evans Blue в.в. за 2 ч до контакта с ДНФБ. Мышей умерщвляли через 24 ч и уши обрабатывали для выделения красителя, который проник из сосудов и аккумулировался в окружающих тканях. Проницаемость сосудов оценивали как количество красителя на мг высушенной ткани уха, скорректированное на концентрацию Evans Blue в сыворотке, и выражали в виде отношения подвергнутое воздействию/контрольное уши. Хотя лечение IL-18BP в 4 и 5 день снижало опухание до 56% от контрольной группы, получающей носитель (фиг. 4, левая часть, р 0,01), не отмечалась значительная разница в проницаемости сосудов в обеих группах (фиг. 4, правая часть). Обе группы показали значительно увеличенный отек по сравнению с несенсибилизированной контрольной группой (р 0,05 и р 0,01). Для дальнейшего контроля мышей обрабатывали 250 мкг нерелевантного белка БСА на одно животное в день. У этих мышей КГЧ развивалась так же, как и у обработанных носителем контрольных животныхIn vivo исследование проницаемости сосудов (Evans Blue) Принцип: инъекция (в.в.) Evans Blue и экстракция из ткани-мишени (ухо) Данные для оценки: Стандартная кривая Evans Blue (ОП 620/нг) Концентрация Evans Blue в крови (ОП 620/мл или мкг/мл, соответственно) Вес высушенной ткани уха (ипсилатерального и противоположного, мг) Содержание Evans Blue в ушах (ипсилатерального и противоположного, ОП 620/мкг или нг/мг, соответственно) Протокол в сочетании с индуцированной ДНФБ КГЧ на 5 день экспериментально индуцированной КГЧ вводят 100 мкл Evans Blue (7,5 мг/мл Evans Blue(S 2129) в физиологическом NaCl, 100 мкл, в.в.) в.в. ретроорбитально за 2 ч до контакта мыши с ДНФБ- 19006745 вводят IL-18BP в.б. за 1 ч до контакта на 6 день (24 ч после контакта уха с ДНФБ) измеряют опухание и умерщвляют животных берут образцы крови и обрабатывают следующим образом: добавляют 30 мкл сыворотки к 970 мкл формамида ( 1/33 разбавление) определяют ОП при 620 нм ( 1 ОП 620 равно 33 ОП 620/мл) собирают ипсилатеральные и противоположные уши и обрабатывают следующим образом: сушат 24 ч при 80 С определяют сухой вес измельчают и экстрагируют краситель с помощью 1 мл формамида, осторожно встряхивая в течение 24 ч при 55 С фильтруют для удаления остатков (фильтр для образца-препарата Whatman 5 мкм РТЕЕ меш,6984.0350), наполняют кюветы, осаждают при комнатной температуре в течение нескольких часов, чтобы позволить жирам всплыть наверх определяют ОП при 620 нм Рассчитываемые значения: Результаты В основном, в опухание во время КГЧ вовлечены два процесса: проникновение жидкости из сосудистой сети в окружающие ткани, что приводит к отеку, и транссудация воспалительных клеток из кровеносных сосудов в место повреждения ткани. Применение Evans Blue в качестве индикатора показало, что, несмотря на общее снижение опухания, лечение IL-18BP не снижает проницаемости сосудов (фиг. 4). Пример 5. Лечение IL-18BP снижает воспалительную инфильтрацию и образование IFN в подвергнутом воздействию ДНФБ ухе. Методы КГЧ индуцировали у мышей C57BL/6, как описано выше. Животных обрабатывали IL-18BP или носителем в 4-6 дни. Лечение IL-18BP снижало опухание до 58% от контрольной группы на 7 день. Мышей умерщвляли на 7 день, подвергнутые воздействию уши собирали, разделяли на группы (n=8) и подвергали ферментативному расщеплению с получением суспензии отделенных клеток. Клетки характеризовали анализом FACS, отсекающим СD45-положительные живые клетки. Количество Т-клеток, NKклеток, нейтрофилов и моноцитов/макрофагов, обнаруженных в препарате уха, выражали в процентном отношении к общему количеству анализируемых клеток. Также рассчитывали снижение количества указанных типов клеток после лечения IL-18BP по отношению к контролю с носителем. Для измерения продукции IFN клетки, полученные из подвергнутых воздействию ДНФБ ушей, повторно стимулировали при 2 х 105 на ячейку планшета со связанными на нем анти-СD3 антителами. В течение последующих 24 ч культивирования IL-18BP не добавляли. Продукцию IFN измеряли в трех повторах с помощью ELISA. Препараты клеток из подвергнутых воздействию ДНФБ ушей стимулировали 50 нг/мл РМА и 500 нг/мл лономицина в течение 4 ч. Секрецию цитокина блокировали добавлением 2 мкг/мл брефелдина А в течение последних 2 ч инкубирования. Затем клетки подвергали многоцветному иммунофлуоресцентному окрашиванию на предмет внутриклеточного IFN и поверхностных антигенов. IFN вырабатывался Тклетками CD8 и, в меньшей степени, Т-клетками CD4. В NK-клетках и Т-клетках IFN обнаружен не был. (н.о., не обнаружено;Форбол 12-Миристат 13-Ацетат). Получение суспензии отдельных клеток Ферментативное расщепление мышиных ушей с получением суспензии отдельных клеток основано на протоколах из Schulter, G. and Steinman, R.M. (1985) и Stingi et al., (1983). 1. отрезают уши, разделяют по 5 ушей на препарат 2. промывают 70% этанолом 3. разделяют с помощью пинцета 4. помещают дермой вниз на 7,5 мл ССРХ (сбалансированный солевой раствор Хенкса без Ca2+ и 2+Mg (GIBCO14170.070 при температуре 37 С 5. добавляют 5 мл 2,5% трипсина (2,5% трипсин/ЭДТК (10x) (GIBCO35400-027 (10 х) с получением конечной концентрации 1% 6. инкубируют в течение 35 мин при температуре 37 С- 20006745 7. переносят половинки ушей дермой вниз на нейлоновое сито (сито для клеток), помещенное в 10 мл ССРХ/80% FCS на льду, и осторожно перемешивают для выемки клеток из внеклеточной матрицы 8. удаляют сита с крупными остатками 9. дважды промывают холодным ССРХ/10% FCS 10. считают клетки Анализ FACS 1. повторно суспендируют клетки в окрашивающем буфере (1% бычий сывороточный альбумин в физиологическом растворе с фосфатным буфером) для FACS, все последующие стадии проводят на льду 2. используют 106 клеток на окрашивание 3. добавляют 1 мкг FC-Block, 10 мин 4. добавляют антитела CD45 в сочетании с антителами, направленными против интересующих маркеров, 1 мкг каждого, 30 мин 5. дважды промывают 6. собирают в общем 0,5 х 106 случаев с помощью FACS 7. анализируют специфические маркеры после отсечения живых клеток CD45+ Результаты Для исследования воспалительной инфильтрации в месте контакта получали суспензии отдельных клеток из не подвергнутых и подвергнутых воздействию ушей и анализировали с помощью FACS, отсекая живые клетки CD45+ (фиг. 5). Как показано, CD45+ клетки, присутствующие в не подвергнутых воздействию ушах, являются, в основном, Т-клетками и дентритными клетками кожи. Воспалительный инфильтрат через 24 ч после воздействия состоял из Т-клеток CD8 и CD4, нейтрофилов, моноцитов иNK-клеток, увеличивая общий уровень клеток CD45+ в ухе приблизительно в 2 раза. В соответствии со снижением опухания обработка IL-18BP снижалa общее количество лейкоцитов, инфильтрующих место контакта. Это влияло на все различные типы клеток воспалительного инфильтрата. Снижение составляло от 20 до 40% в зависимости от типа клетки. Исследование дальнейших характеристик свойств инфильтрата, полученного из ушей леченных IL18BP мышей, показывало ухудшенную продукцию INF при повторной стимуляции анти-СD3 (фиг. 6). Анализ FACS показывал, что IFN, в основном, образуется Т-клетками CD8 и в меньшей степени Тклетками CD4. Интересно что Т-клетки и NК-клетки не вовлечены в продукцию IFN (фиг. 7). Пример 6. IL-18BP не ослабляет рекрутимента клеток Лангерганса. Метод Мышей окрашивали путем нанесения гаптенов FITC (50 мкл 4 мг/мл раствора) или носителя ацетон/дибутилфталат (1:1) на правый и левый бока, соответственно. Паховые лимфатические узлы собирали через 24 ч после окрашивания. Конъюгированные с гаптеном клетки Лангерганса определяются с помощью FACS как клетки FITC+, CD11c+ в лимфатическом узле, дренирующем окрашенный FITC бок, но не определяются в лимфатическим узле, дренирующем противоположный бок, окрашенный только носителем (n=5 дренирующих лимфатических узлов на группу). Результаты Миграция клеток Лангерганса (LC), несущих антиген, в дренирующий лимфатический узел зависит от провоспалительных цитокинов IL-1 и TNF и регулируется каспазой-1 (Antonopoulos et аl., 2001;al., 2001). Поэтому лечение IL-18BP могло бы ослабить рекрутный LC и, следовательно, ослабить иммунный ответ на DNFB во время фазы воздействия. Для проверки этой гипотезы мышей окрашивают путем нанесения гаптена FITC или носителя на правый и левый бокa, соответственно. Дренирующие кожу паховые лимфатические узлы собирали через 24 ч после окрашивания и оценивали количество клетокFITC+ на лимфатический узел. Лечение животных IL-18BP за 24 и 1 ч до окрашивания не изменяло количество (LC), несущих гаптен LC, присутствующих в дренирующем лимфатическом узле через 24 ч после окрашивания (фиг. 8). Поэтому в данной модели нет значительного вклада IL-18 в передвиженииLC. Пример 7. IL-18BP снижает продолжительность гиперчувствительности замедленного типа в другой мышиной модели DHT. Методы Гиперчувствительность замедленного типа Мышей сенсибилизировали внутривенной инъекцией 106 BALB/c-спленоцитов и подвергали повторному воздействию на 5 день 13 х 106 BALB/c-спленоцитами (50 мкл ФРФБ) в правые подушечки лап. В контрольные левые подушечки лап вводили 50 мкл ФСБ. Опухание правой подушечки лапы рассчитывают для различных дней вычитанием значения перед воздействием и значения опухания, измеренного в левых подушечках лап, из значения после воздействия. В экспериментах адаптивного переноса суспензию клеток из лимфатических узлов сенсибилизированных спленоцитам или необработанных мышей BALB/c подвергали истощению в отношении клеток В 220+ и CD8+ инкубированием с крысиным антимышиным В 220-FITC и CD8-FITC с последующим раз- 21006745 делением на колонках MACS с парамагнитными анти-FITC микрошариками (Miltenyi Biotech, Auburn,California, США). Элюированные препараты, обогащенные Т-клетками CD4+, вводят в хвостовую вену рецепиентной мыши (2 х 107 клеток/мышь). Через 16 ч мышам вводят 13 х 106 BALB/c-спленоцитов (без эритроцитов) в правые подушечки лап и опухание отслеживают все последующие дни. Результат Гиперчувствительность замедленного типа (DHT) вызывается Т-клетками CD4+ с очевидным регулированием в форме снижения Т-клетками CD8+ (Grabbe et al., 1998). Поведение Т-клеток CD4+ от мышей, леченных IL-18BP, изучают на модели DHT. Животных C57BL/6 сенсибилизируют внутривенной инъекцией 106 аллогенных BALB/c-спленоцитов. Через 5 дней 13 х 106 BALB/c-спленоцитов вводят в правые подушечки лап, вместе с либо 10 мг/кг рекомбинантного IL-18BP человека в.б., либо носителем. Местное воспаление измеряют определением опухания подушечки лап через 24 ч. Список литературы 1. Altschul, S.F. et al., J. Mol. Biol., 215, 403-410, 1990, Altschul, S.F. et al., Nucleic Acids Res., 25:3893402, 1997. 2. Antonopoulos, С., М. Cumberbatch, R.J. Dearman, R.J. Daniel, I. Kimber, and R.W. Groves. 20.01.Jun. 1;156(11):4274-9 29. Yoshimoto, T., Takeda, K., Tanaka, T., Ohkusu, K., Kashiwamura, S., Okamura, H., Akira, S. and Nakanishi, K. (1998), J. Immunol. 161, 3400-3407. 30. Xu et al. (1998). J. of Interferon and Cytokine Research 18:653-659. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ингибитора IL-18 для производства лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антител к IL-18 и IL-18-связывающих белков (IL-18BP), или их изоформ, мутеинов, слитых белков, функциональных производных, активных фракций, производных циркулярной перестановки или солей, по существу, обладающих биологической активностью, по меньшей мере, сходной с IL-18BP. 2. Применение по п.1, где расстройством в виде гиперчувствительности является гиперчувствительность замедленного типа. 3. Применение по п.1 или 2, где расстройством в виде гиперчувствительности является контактная гиперчувствительность. 4. Применение по любому из предшествующих пунктов, где ингибитором IL-18 является антитело кIL-18. 5. Применение по п.4, где антителом к IL-18 является гуманизированное антитело к IL-18. 6. Применение по п.4, где антителом к IL-18 является антитело к IL-18 человека. 7. Применение по пп.1-3, в котором ингибитором IL-18 является IL-18-связывающий белок или его изоформа, мутеин, слитый белок, функциональное производное, активная фракция, производное циркулярной перестановки или соль. 8. Применение по п.7, в котором ингибитором IL-18 является слитый белок, включающий слияние с иммуноглобулином, где слитый белок, по существу, обладает биологической активностью, по меньшей мере, сходной с IL-18BP. 9. Применение по любому из предшествующих пунктов, где функциональное производное содержит по меньшей мере одну составляющую, присоединенную к одной или более функциональным группам, которые являются одной или более боковыми цепями на остатках аминокислот, и где функциональное производное, по существу, обладает биологической активностью, по меньшей мере, сходной с IL18BP. 10. Применение по п.9, где указанной составляющей является полиэтиленгликоль (ПЭГ). 11. Применение по любому из предшествующих пунктов, где лекарственное средство дополнительно содержит интерферон для одновременного, последовательного или раздельного применения. 12. Применение по п.11, в котором интерфероном является интерферон-. 13. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит ингибитор фактора некроза опухоли (TNF) для одновременного, последовательного или раздельного введения. 14. Применение по п.13, в котором ингибитором TNF является TBPI и/или ТВРII. 15. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит противовоспалительный агент для одновременного, последовательного или раздельного введения. 16. Применение по п.15, где противовоспалительным агентом является СОХ-ингибитор. 17. Применение по любому из предшествующих пунктов, в котором лекарственное средство дополнительно содержит противоаллергический агент для одновременного, последовательного или раздельного введения. 18. Применение по любому из предшествующих пунктов, в котором ингибитор IL-18 применяют в количестве от около 0,001 до 1000 мг/кг веса тела, или от около 0,01 до 100 мг/кг веса тела, или от около 0,1 до 10 мг/кг веса тела, или около 5 мг/кг веса тела. 19. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят подкожно. 20. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят внутримышечно.- 23006745 21. Применение по любому из предшествующих пунктов, где ингибитор IL-18 вводят местно. 22. Применение вектора экспрессии, содержащего последовательность, кодирующую ингибитор IL18, для производства лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP. 23. Применение вектора для индуцирования и/или усиления эндогенной продукции ингибитора IL18 в клетке при производстве лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP. 24. Применение клетки, которая генетически модифицирована для продуцирования ингибитора IL18, при производстве лекарственного средства для лечения и/или профилактики расстройства в виде гиперчувствительности с реакциями гиперчувствительности типа IV, где ингибитор IL-18 выбран из антитела к IL-18 и IL-18BP.
МПК / Метки
МПК: A61P 37/00, A61K 38/21, A61K 39/395, A61K 48/00, A61K 38/17
Метки: ингибиторов, гиперчувствительности, расстройствах, il-18, применение, виде
Код ссылки
<a href="https://eas.patents.su/27-6745-primenenie-ingibitorov-il-18-pri-rasstrojjstvah-v-vide-giperchuvstvitelnosti.html" rel="bookmark" title="База патентов Евразийского Союза">Применение ингибиторов il-18 при расстройствах в виде гиперчувствительности</a>
Предыдущий патент: Применение ингибиторов il-18 для лечения и предотвращения повреждений цнс
Следующий патент: Способы лечения глазных неоваскулярных заболеваний
Случайный патент: Зонный реактор с обратимым захватыванием и высвобождением галогеноводородов