Замещенные 1,2,3,4 -тетрагидро-2-дибензофуранамины
Формула / Реферат
1. Соединение формулы I
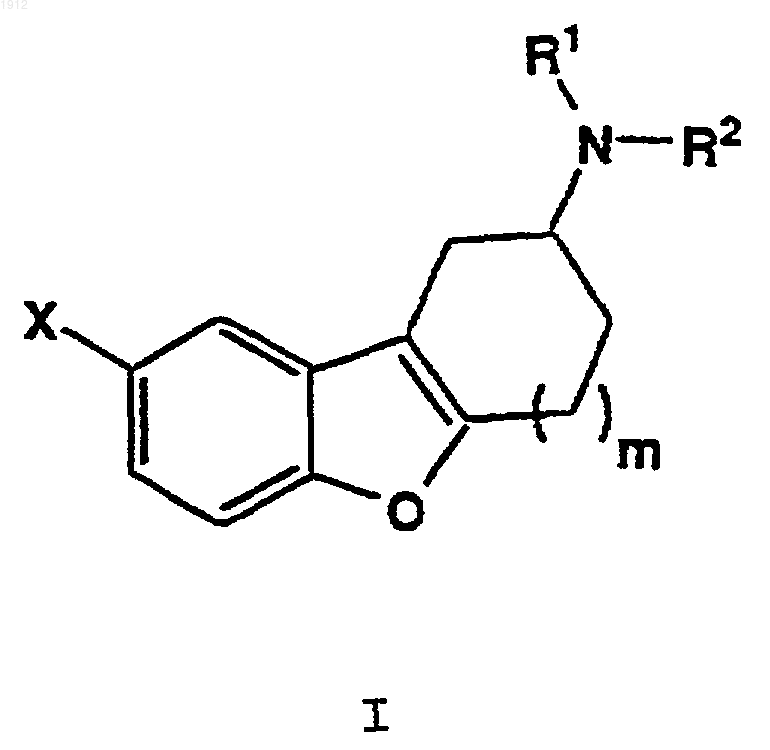
где R1 и R2 представляют независимо водород, С1-С4-алкил, бензил или a-метил-4-нитробензил;
Х представляет нитро, галоген, -ОН, -NH2, -CN, -NHC(O)R3, -C(O)R6, -NHSO2R7 или -SO2NHR10;
R3 представляет С1-С6-алкил, С2-С6-алкенил, С3-С8-циклоалкил, фенил, замещенный фенил, нафтил, фенил(С1-С4-алкилен), тие-нилметил или гетероцикл;
R6 представляет гидрокси, амино, С1-С6-алкокси, бензилокси, фенокси или -NHR8;
R7 представляет С1-С6-алкил, фенил или фенил, монозамещенный галогеном или С1-С4-алкилом;
R8 представляет С1-С6-алкил, С2-С6-алкенил, С3-С8-циклоалкил, фенил, замещенный фенил, нафтил или гетероцикл; и
R10 представляет С1-С6-алкил, фенил или фенил, монозамещенный галогеном или С1-С4-алкилом;
m равно 1 и его фармацевтически приемлемые соли.
2. Соединение по п.1, где Х представляет -NHC(O)R3.
3. Соединение по п.2, где R3 выбирают из группы, состоящей из фенила, замещенного фенила или гетероцикла.
4. Соединение по п.1, где Х представляет -C(O)R6.
5. Соединение по п.4, где R6 представляет -NHR8.
6. Способ повышения активации рецептора 5-HT1F у млекопитающего, включающий введение млекопитающему, нуждающемуся в такой активации, эффективного количества соединения по п.1.
7. Способ по п.6, где млекопитающим является человек.
8. Фармацевтическая препаративная форма, содержащая эффективное количество соединения формулы
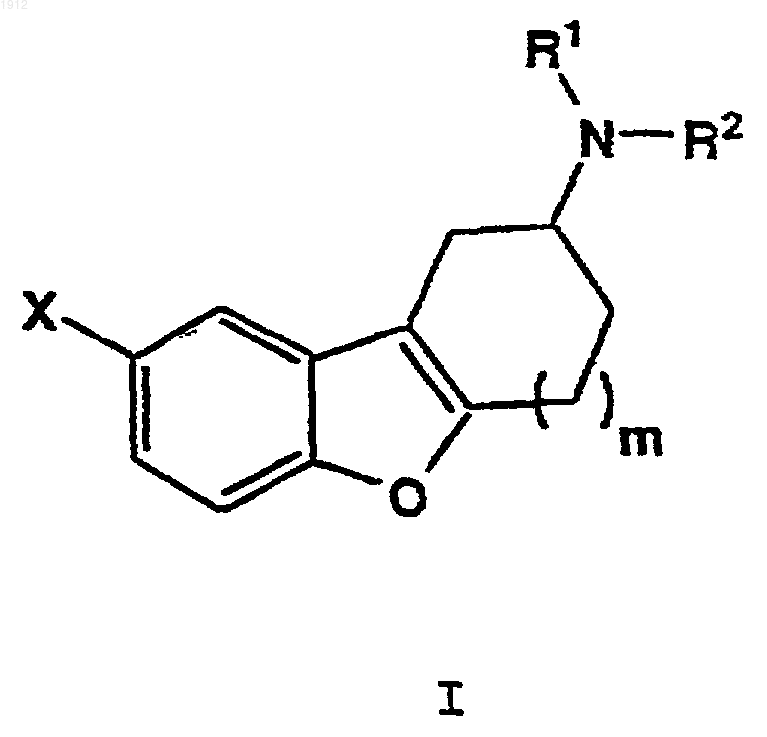
где R1 и R2 представляют независимо водород, С1-С4-алкил, бензил или a-метил-4-нитробензил;
Х представляет нитро, галоген, -ОН, -NH2, -CN, -NHC(O)R3, -C(O)R6, -NHSO2R7 или -SO2NHR10;
R3 представляет С1-С6-алкил, С2-С6-алкенил, С3-С8-циклоалкил, фенил, замещенный фенил, нафтил, фенил(С1-С4-алкилен), тиенилметил или гетероцикл,
R6 представляет гидрокси, амино, С1-С6-алкокси, бензилокси, фенокси или -NHR8;
R7 представляет С1-С6-алкил, фенил или фенил, монозамещенный галогеном или С1-С4-алкилом;
R8 представляет С1-С6-алкил, С2-С6-алкенил, С3-С8-циклоалкил, фенил, замещенный фенил, нафтил или гетероцикл; и
R10 представляет С1-С6-алкил, фенил или фенил, монозамещенный галогеном или С1-С4-алкилом;
m равно 1 и его фармацевтически приемлемых солей в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем.
Текст
Graham and Wolff (Arch. Neurol. Psychiatry, 39,737-63 (1938. Они предположили, что причиной головной боли при мигрени было вазодилатация внечерепных кровеносных сосудов. Эта точка зрения была подтверждена известным фактом, что эрготалкалоиды и суматриптан,гидрофильный агонист 5-HT1 (HT означает серотонин, или 5-гидрокситриптамин), который не проникает через тематоэнцефалический барьер,сокращают головную сосудистую гладкую мышцу и эффективны при лечении мигрени(Humphrey, et al., Ann. NY Acad. Sci., 600, 587600 (1990. Последняя работа Moskowitz показала, однако, что появление головных болей при мигрени не зависит от изменений в диаметре сосудов (Cephalalgia, 12, 5-7 (1992.Moskowitz предположил, что неизвестные в настоящее время пусковые механизмы боли стимулируют ганглии тройничного нерва, которые иннервируют сосудистую сеть в головной ткани, вызывая высвобождение вазоактивных нейропептидов из аксонов на сосудистой системе. Эти высвобождаемые нейропептиды затем активируют ряд событий, следствием которых является боль. Это нейрогенное воспаление блокируется суматриптаном и эрготалкалоидами посредством механизмов, включающих рецепторы 5-НТ, которые, как полагают, тесно связаны с 5-НТ 1D-подтипом, расположенным на тройничноваскулярных тканях (Neurology, 43(suppl. 3), S16-S20 (1993. Серотонин (5-НТ) проявляет разнообразную физиологическую активность, медиированную, по меньшей мере, четырьмя классами рецепторов, наиболее гетерогенным из которых,по-видимому, является 5-НТ 1. Ген человека,который экспрессирует пятый подтип 5-HT1,названный 5-HT1F, был выделен Као и сотрудниками (Рrос. Natl. Acad. Sci. USA, 90, 408-412(1993. Этот рецептор 5-HT1F проявляет фармакологический профиль, отличный от любого,уже описанного, серотонергического рецептора. Высокая аффинность суматриптана у этого подтипа, K1=23 нМ, предполагает роль рецептора 5HT1F в мигрени. Это изобретение предлагает новые агонисты 5-HT1F, которые ингибируют пептидную экстравазацию вследствие стимуляции ганглий тройничного нерва и, следовательно, полезны для лечения и профилактики мигрени и ассоциированных нарушений. Настоящее изобретение предлагает новые 8-замещенные 1,2,3,4-тетрагидро-2-дибензофуранамины формулыR7 представляет C1-С 6-алкил, фенил или фенил, монозамещенный галогеном или C1-С 4 алкилом;R10 представляет C1-С 6-алкил, фенил или фенил, монозамещенный галогеном или С 1-С 4 алкилом;m равно 1 и их фармацевтически приемлемые соли. Следующим воплощением этого изобретения является способ повышения активации рецептора 5-HT1F введением соединения формулыI. Активация рецептора 5-HT1F обеспечивает способ лечения различных нарушений, которые были связаны с пониженной нейропередачей серотонина у млекопитающих. Эти нарушения включают депрессию, мигреневую боль, профилактику мигрени, булимию, предменструальный синдром или синдром поздней лютеиновой фазы, алкоголизм, злоупотребление табаком, паническое нарушение, тревожное состояние, послетравматический синдром, потерю памяти,старческое слабоумие, социальную фобию, дефицит внимания, нарушение, выражаемое в повышенной активности, нарушения, проявляющиеся в разрушительном поведении, расстройство импульсивного контроля, пограничное личностное расстройство, навязчивое компульсивное нарушение, синдром хронической усталости, преждевременное семяизвержение, эректильное затруднение, нервную анорексию, нарушения сна, аутизм, мутизм, аллергический ринит, симптомы простуды, боль или трихотилломанию. Любой из этих способов использует соединение формулы I. Кроме того, это изобретение предлагает фармацевтические препаративные формы, содержащие эффективное для активации рецепто 3 ра 5-HT1F количество соединения формулы I в комбинации с подходящим фармацевтическим носителем, разбавителем или наполнителем. Это изобретение предлагает использование соединения формулы I для изготовления лекарственного препарата для профилактики или лечения мигрени и ассоциированных нарушений. Кроме того, это изобретение предлагает фармацевтическую готовую препаративную форму,приспособленную для профилактики или лечения мигрени, содержащую соединение формулыI. Кроме того, это изобретение включает способ профилактики или лечения мигрени, который включает введение эффективного количества соединения формулы I. Общие химические термины, используемые в приведенных выше формулах, имеют их обычные значения. Например, термин алкил включает такие группы, как метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, 1-пентил, 2-пентил, 3-пентил,неопентил, гексил и тому подобное. Термин алкокси включает метокси, этокси, изопропокси, бутокси, трет-бутокси, гексилокси и тому подобное. Термин алкилтио включает метилтио, этилтио, изопропилтио, бутилтио, третбутилтио, гексилтио и тому подобное. Термин алкенил включает аллил, 1-бутен-4-ил, 2 метил-1-бутен-4-ил, 2-бутен-4-ил, 1-пентен-5 ил, 4-метил-2-пентен-5-ил, 2-пентен-5-ил, 3 пентен-5-ил, 1-гексен-6-ил, 2-гексен-6-ил, 3 гексен-6-ил, 4-гексен-6-ил и тому подобное. Термин ацил включает формил, ацетил, пропаноил, бутаноил и 2-метилпропаноил. Термин циклоалкил включает такие группы, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Термин фенил(С 1-С 4-алкилен) включает такие группы,как бензил,фенетил,1-фенил-2 метилпропил, фенпропил и фенбутил. Термин(С 1-С 4-алкил)сульфонил включает метансульфонил, этансульфонил, пропансульфонил,изо-пропансульфонил, бутансульфонил и тому подобное. Термин галоген включает фтор,хлор, бром и йод. Термин замещенный фенил используют для обозначения фенильной группы, замещенной одним заместителем, выбранным из группы,состоящей из галогена, C1-С 4-алкила, С 1-С 4 алкокси, C1-С 4-алкилтио, нитро, циано, ди(С 1 С 4-алкил)амино, трифторметила, трифторметокси, фенила, С 1-С 4-ацила, бензоила или (C1-C4 алкил)сульфонила, или двумя или тремя заместителями, независимо выбранными из группы,состоящей из галогена, нитро, С 1-С 4-алкила или С 1-С 4-алкокси. Термин гетероцикл используют для обозначения необязательно замещенного фурила,тиенила, пиридинила, пиридинил-N-оксида,пирролила, N-метилпирролила, оксазолила, изоксазолила, пиразолила, имидазолила, триазолила, оксадиазолила, тиадиазолила, пиримиди 001912 4 нила, пиразинила, пиридазинила, хинолинила,изо-хинолинила,бензофуранила,бензо[b] тиенила или 1H-индолила, связанного через любой доступный атом углерода кольца. Необязательное замещение этих гетероциклов 1-3 заместителями, выбранными из группы, состоящей из галогена, С 1-С 4-алкила или С 1-С 4 алкокси, может иметь место у доступных атомов углерода кольца. Термин -метил-4-нитробензил используют для обозначения рацемической формы, а также индивидуальных (R)-(+)- и S-(-)энантиомеров. Термин алкоксикарбонил используют для обозначения эфирного фрагмента, атом кислорода которого связан с C1-С 4-алкилом илиC3-С 6-циклоалкилом. Термин арилоксикарбонил используют для обозначения эфирного фрагмента, атом кислорода которого связан с фенилом, бензилом,нафтилом, замещенным фенилом или группой гетероцикла. Соединения настоящего изобретения имеют асимметрический углерод, помеченный звездочкой в следующей формуле Как таковое, каждое из соединений настоящего изобретения существует не только как рацемат, но также в виде индивидуальных d- и lэнантиомеров Соединения настоящего изобретения включают не только dl-рацематы, но также их соответствующие оптически активные d- и lэнантиомеры. Особенно полезными хиральными промежуточными продуктами для получения соединения этого изобретения являются те соединения, где Х представляет бром или -NH2. Между тем как все соединения этого изобретения полезны в качестве агонистов 5-HT1F,некоторые классы предпочтительны. Следующий список описывает такие предпочтительные классы. аа) R1 представляет водород;cf) соединение является l-энантиомером; сg) соединение является d-энантиомером; сh) соединение является свободным основанием;cj) соединение является гидрохлоридной солью;ck) соединение является фумаратной солью;cl) соединение является оксалатной солью. Следует понимать, что указанные выше классы можно объединить для образования дополнительных предпочтительных классов. Соединения этого изобретения можно использовать в способе повышения активации рецептора 5-HT1F для лечения различных нарушений, которые были связаны с пониженной нейропередачей серотонина у млекопитающих. Предпочтительно, когда млекопитающим, которых можно лечить введением соединений этого изобретения, является человек. Так как соединения этого изобретения представляют собой амины, они основны по природе и в соответствии с этим реагируют с любым членом неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Так как некоторые из свободных аминов соединений этого изобретения представляют собой типичные масла при комнатной температуре, предпочтительно превращение свободных аминов в их фармацевтически приемлемые кислотноаддитивные соли для облегчения обращения с ними и введения, поскольку последние, как правило, твердые при комнатной температуре. Кислоты, обычно используемые для образования таких солей, являются неорганическими кислотами, такими как хлористо-водородная кислота,бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и тому подобное, и органическими кислотами, такими как п-толуолсульфоновая кислота,метансульфоновая кислота, щавелевая кислота,п-бромфенилсульфоновая кислота, угольная кислота, янтарная кислота, лимонная кислота,бензойная кислота, уксусная кислота и тому подобное. Примерами таких фармацевтически приемлемых солей, таким образом, являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид,бромид, йодид, ацетат, пропионат, деканоат,каприлат, акрилат, формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат,сукцинат, суберат, себацат, фумарат, малеат,бутин-1,4-диоат, гексин-1,6-диоат, бензоат,хлорбензоат, метилбензоат, динитробензоат,гидроксибензоат, метоксибензоат, фталат, суль 7 фонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и тому подобное. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные с хлористо-водородной кислотой, щавелевой кислотой или фумаровой кислотой. Следующая группа является иллюстративной группой соединений, рассматриваемых в пределах объема этого изобретения: 13 или вместе с азотом, к которому они присоединены, образуют фталимидогруппу; R6 представляет гидрокси, C1-С 6-алкокси, бензилокси или фенокси; R9 представляет азотозащитную группу; и R10 и m такие, как определено ранее. Азотозащитные группы, которые можно использовать для этих реакций, хорошо известны специалистам в данной области техники (Greene,Protective Groups in Organic Synthesis, SecondEdition, Wiley Interscience, New York (1991. Предпочтительными защитными группами являются бензил и 4-метоксибензил. Синтетическая схема I Подходящий 4-аминокетон и гидрохлорид гидроксиламина смешивают в подходящем растворителе, обычно низшем алканоле, таком как метанол или этанол. Получаемую смесь обрабатывают подходящим основанием, обычно пиридином или триэтиламином, и реакционную смесь нагревают при кипении с обратным холодильником до тех пор, пока не прореагирует весь исходный аминокетон. Получаемый оксим можно затем использовать непосредственно или можно очистить кристаллизацией или хроматографией. Получаемый оксим и замещенный фторбензол смешивают в подходящем растворителе, например, тетрагидрофуране, диметилформамиде или N-метилпирролидиноне. Эту смесь затем обрабатывают подходящим основанием, таким как гидрид натрия или калия, и реакционную смесь нагревают в диапазоне от около 50 до около 70 С до тех пор, пока оксим не будет израсходован. Предпочтительно использование гидрида калия в тетрагидрофуране. Эту стадию предпочтительно проводят в присутствии краун-эфира, обычно 18-краун-6. Получаемый O-замещенный оксим (II) выделяют обычной экстракцией. Его можно очистить, если это необходимо или желательно, кристаллизацией или хроматографией. О-замещенный оксим затем обрабатывают кислотой, предпочтительно муравьиной кислотой или смесью кислот, для получения соединений формулы I. Реакцию можно проводить при температуре,примерно, от комнатной до температуры флегмы реакционной смеси. Получаемое соединение выделяют обычной экстракцией; его можно очистить кристаллизацией или хроматографией. Соединения формулы I, где X' представляет 14 группу, освобождают от защитной группы в стандартных условиях, получая вторичные сульфонамиды данного изобретения.O-замещенные оксимы формулы II являются новыми соединениями и представляют собой еще одно воплощение данного изобретения. Способ, описанный выше, для полученияO-замещенных оксимов новый и является осуществлением данного изобретения. Способ получения O-замещенных оксимов формулы-СН 2 СН 2-арил, где арил представляет фенил,фенил, монозамещенный галогеном, или 1-(C1 С 6-алкил)-пиразол-4-ил;m равно 1,w представляет от 1 до 3 заместителей, независимо выбранных из нитро, циано, C(O)R6,-SO2NR9R10 или трифторметила;R6 представляет C1-С 6-алкил, C1-С 6 алкокси, бензилокси, фенокси, C3-С 8-циклоалкил, фенил, нафтил, фенил, монозамещенный галогеном или С 1-С 4-алкокси, или гетероцикл;R10 представляет C1-С 6-алкил, фенил или фенил, монозамещенный галогеном или C1-С 6 алкилом; включает а) обработку оксима подходящим основанием, необязательно в присутствии краунэфира, для получения соответствующего аниона и б) обработку аниона арилгалогенидом формулы где галоген представляет фтор, хлор, бром или йод и W такой, как определено ранее. Азотозащитные группы, которые можно использовать для этих реакций, хорошо известны специалистам в данной области (Greene,Protective Group in Organic Synthesis, SecondEdition, Wiley Interscience. New York (1991. Оксим и основание смешивают в подходящем апротонном растворителе. Нет необходимости, чтобы оксим был полностью растворим в растворителе, но он должен иметь доста 15 точную растворимость, позволяющую реакции проходить с приемлемой скоростью. Подходящие растворители включают простые эфиры,такие как тетрагидрофуран, диоксан, тетрагидропиран и диэтиловый простой эфир. Предпочтительным растворителем реакции является тетрагидрофуран. Основания, которые можно использовать для данного способа, должны быть способны депротонировать оксим и, кроме того, получаемые кислоты, сопряженные с основанием, не должны мешать реакции. Подходящие основания включают гидрид натрия и гидрид калия, причем последний предпочтителен. Когда к реакционной смеси добавляют краун-эфир, предпочтительно 18-краун-6, предпочтительно, чтобы применяли от 0,01 до 0,1 эквивалентов. Стадию депротонирования можно проводить при температуре от примерно 0 С до температуры флегмы растворителя. Предпочтительно, чтобы стадию депротонирования проводили при температуре от примерно 0 С до комнатной температуры. Особенно предпочтительно, чтобы стадию депротонирования проводили при примерно 0 С. Стадия депротонирования обычно завершается в пределах от примерно 15 мин до примерно 24 ч, но обычно завершается в пределах от 15 мин до 1 ч. Особенно предпочтительно, чтобы эту стадию проводили в присутствии краун-эфира. Специалист в данной области понимает,что оксим можно добавлять к раствору или суспензии основания в растворителе для реакции,основание можно добавлять к раствору или суспензии оксима в растворителе для реакции или оксим и основание можно добавлять одновременно к растворителю для реакции. Любая из этих вариаций предполагается настоящим изобретением. К реакционной смеси, содержащей анион оксима, можно затем добавить арилгалогенид или, если удобно или необходимо, смесь аниона можно добавить к арилгалогениду. Получаемой смеси затем дают реагировать при температуре примерно от комнатной температуры до температуры флегмы растворителя для реагирования до тех пор, пока не будут израсходованы субстраты. Реакция требует от примерно 15 мин до примерно 2 дней, но типично она завершается в диапазоне примерно от 1 до 2 ч. Замещенный оксим выделяют обычной экстракционной обработкой, его можно очистить хроматoграфией или кристаллизацией. Галогеновым заместителем на арилгалогениде (IV) может быть фтор, хлор, бром или йод. Предпочтительно, чтобы галогеновый заместитель был фтором или хлором и, особенно предпочтительно, чтобы он был фтором. Заместитель W представляет от одного до трех электроноакцепторных заместителей. Специалист в данной области хорошо знает заместители, являющиеся электроноакцепторными. Типичные 16 классы электроноакцепторных заместителей включают нитро, циано, алкоксикарбонил, арилоксикарбонил и трифторметил. Предпочтительные электроноакцепторные заместители включают нитро и циано. Когда удобно или необходимо, все реагенты можно смешать в одной и той же реакционной смеси для получения целевых Oзамещенных оксимов. Специалист в данной области должен понимать, однако, что возможность проведения способа, таким образом, ограничивается природой электроноакцепторных заместителей на арилгалогениде. Соединения формулы I, где Х представляет нитро, можно также использовать в качестве промежуточных продуктов для получения других соединений изобретения, как иллюстрировано на синтетической схеме II. R1, R2, m, R3 и Соединения формулы I, где Х представляет нитро, гидрируют над катализатором на основе благородного металла, предпочтительно палладием на угле, и гидрируют при примерно комнатной температуре и при начальном давлении примерно 2,812 атм (40 psi) в течение от примерно 1 до 24 ч в подходящем растворителе,таком как низший алканол или тетрагидрофуран, получая соответствующие аминопроизводные формулы V. Соединения формулы V являются новыми соединениями и представляют следующее воплощение данного изобретения. Соединения,где Х представляетR3C(O)NH- или R7SO2NH-, получают реакцией анилина с подходящей карбоновой кислотой или сульфонилхлоридом, -бромидом или ангидридом, необязательно в присутствии катализатора ацилирования, такого как диметиламинопиридин, в присутствии подходящего основания. Подходящие основания включают амины,обычно используемые в качестве акцепторов кислот, такие как пиридин или триэтиламин,или коммерчески доступные, связанные с полимером основания, такие как поливинилпиридин. Альтернативно, соединения, где Х представляет R3C(O)NH-, получают реакцией с под 17 ходящей карбоновой кислотой в присутствии типичных реагентов концентрации пептидов,таких как N,N'-карбонилдиимидазол (КДИ),N,N'-дициклогексилкарбодиимид (ДЦК) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ЭКД). Форма ЭДК, нанесенного на полимер, была описана (Tetrahedron Letters, 34(48), 7685 (1993, она очень пригодна для получения соединений настоящего изобретения. Продукты этих реакций выделяют и очищают,как описано выше. Соединения формулы V также можно использовать для получения соединений изобретения, где Х представляет гидрокси, циано и галоген, как описано в синтетической схеме III. Первичный амин формулы V добавляют к минимальному количеству холодной, водной минеральной кислоты, например, хлористоводородной кислоты, бромисто-водородной кислоты, фосфорной кислоты или серной кислоты. Хотя для аминогрупп является определяющим фактором, чтобы они были полностью протонированы кислотой, нет необходимости всю соответствующую соль растворять в кислоте, поскольку она достаточно растворена в любое время реакции, чтобы дать возможность ей протекать. К этой смеси затем добавляют раствор нитрита натрия. Образование диазониевой соли происходит быстро. Для получения соединений,где X представляет хлор или бром, смесь диазониевой соли добавляют к концентрированному раствору соответствующего хлорида или бромида меди (I) в хлористо-водородной или бромисто-водородной кислоте, соответственно. Альтернативно, свежеполученную диазониевую соль добавляют к смеси металлической меди с хлористо-водородной или бромисто-водородной кислотой. Соединения, где X представляет йод,можно получить добавлением диазониевой соли непосредственно к раствору йодида натрия или калия. Соединения, где X представляет гидрокси, получают добавлением диазониевой соли непосредственно к кипящему раствору разбавленной серной кислоты. Целевые продукты этих превращений можно выделить обычной экстракцией, их можно затем очистить, если необ 001912 18 ходимо или желательно, кристаллизацией или хроматографией из подходящего растворителя. Соединения, где X представляет циано,можно получить сначала обработкой смеси диазониевой соли холодным, водным раствором карбоната калия или натрия. Получаемый раствор затем обрабатывают цианидом меди(I) и целевой продукт выделяют, как описано ранее. Соединения, где X представляет фтор,получают сначала обработкой смеси диазониевой соли фторборной кислотой или, что предпочтительно, тетрафторборатом натрия. Получаемая фторборатная соль осаждается из реакционной смеси. Эту соль затем фильтруют,промывают водой и сушат. Тетрафторборатные соли соединений, где X представляет диазо,являются новыми соединениями и представляют еще одно воплощение данного изобретения. Высушенную фторборатную соль затем нагревают для получения соответствующего фторзамещенного соединения. Эти фторборатные соли можно также подвергнуть реакции с диметилсульфоксидом и затем гидролизовать для получения соединений изобретения, где Х представляет гидрокси. 4-замещенные циклогексаноны, требуемые для получения соединений изобретения, где m равно 1, могут быть получены способами, хорошо известными в данной области, как иллюстрировано в синтетической схеме IV. Синтетическая схема IV Монокеталь 1,4-циклогександиона восстановительно аминируют подходящим амином в стандартных условиях для получения соответствующего кеталя 4-аминоциклогексанона. С кетала затем снимают защитную группу либо в условиях водной кислоты, либо, что предпочтительно, муравьиной кислотой для получения соответствующего 4-аминоциклогексанона. Соединения изобретения, где R1 = R2 = Н,получают из 4-(1-фталимидил)циклогексанона,который может быть получен способами, хорошо известными в данной области, например,King et al. (Journal of Medicinal Chemistry, 36,1918 (1993. Говоря кратко, 4-аминоциклогексанол сначала подвергают реакции с Nкарбэтоксифталимидом и получаемый 4-(1 фталимидил)циклогексанол обрабатывают хлорхроматом пиридиния, получая целевой кетон. Получаемому 4-(1-фталимидил)циклогексанону затем дают реагировать, как описано в синтетической схеме I, чтобы получить соответствующие 8-замещенные 1,2,3,4-тетрагидро-2-(1 фталимидил)дибензофураны формулы I. Фталимид затем удаляют реакцией с гидразином в 19 любой мoмент синтеза, получая соединения изобретения, где R1 = R2 = Н. Соединения изобретения, где Х представляет бром, можно использовать в качестве промежуточных продуктов для введения различных заместителей в 8-положение кольца 1,2,3,4 тетрагидро-2-дибензофуранамина. Например,бромзамещенный субстрат можно использовать для получения соединений изобретения, где Х представляет -СООН, как описано в синтетической схеме VI. R1 и R2 представляют C1-С 4 алкил или бензил. Синтетическая схема VI Раствор бромсоединения в подходящем растворителе, таком как тетрагидрофуран или диэтиловый простой эфир, обрабатывают алкиллитием, таким как н-бутил- или третбутиллитий, при температуре примерно -70 С в течение около часа для осуществления обмена галоген-металл. Раствор затем насыщают диоксидом углерода для получения соответствующей карбоновой кислоты. Соединения изобретения, где R6 представляет -NHR8, получают реакцией соответствующих карбоновых кислот с соединением формулы R8-NH2 в ранее описанных условиях амидного сочетания. Соединения формулы I, где Х представляет -С(О)ОН, являются новыми соединениями и также представляют одно из воплощений настоящего изобретения. Специалист в данной области должен понимать, что карбоновые кислоты и карбоксамиды можно также получить из соответствующих соединений формулы I, где Х представляет циано. Карбоновые кислоты получают нагреванием цианосоединения в водной кислоте. Карбоксамиды получают нагреванием цианосоединения в подходящем растворителе, например, хлороформе или ксилоле, в присутствии полифосфорной кислоты. Соединения изобретения, где Х представляет R6C(O)- и R1 и R2 независимо представляют водород, могут быть получены путем каталитического гидрирования соответствующих -2 дибензиламиносоединений над катализатором на основе благородного металла, такого как палладий на угле, или над никелем Ренея. Эти реакции обычно проводят в низшем алканоле или тетрагидрофуране при температуре от комнатной температуры до примерно 60 С, в течение от примерно 1 до 24 ч и при давлении водорода примерно 4,219 атом (60 psi). Соединения, где либо один, либо оба из R1 2 и R представляют водород, могут быть далее функционализированы для получения других соединений изобретения восстановительным алкилированием. В этих условиях первичному 20 или вторичному амину дают реагировать с подходящим альдегидом или кетоном для получения соответствующего имина или енамина. Имин или енамин затем восстанавливают в целевое соединение каталитическим гидрированием или восстановлением подходящим гидридным восстанавливающим реагентом (восстановителем) в присутствии кислоты. Превращение предпочтительно проводят прямым алкилированием. Исходный первичный или вторичный амин и основание смешивают в растворителе для реакции с последующим добавлением алкилирующего агента. Растворителем реакции может быть любой нереакционноспособный растворитель, обычно используемый для алкилирований этого типа, такой как ацетонитрил, диметилформамид или N-метил-2-пирролидинон, и ограничиваемый растворимостью субстратов. Основание должно быть достаточно основным для нейтрализации кислоты, образуемой во время протекания реакции, но не таким основным,чтобы депротонировать другие места в субстрате, давая другие продукты. Кроме того, основание не должно конкурировать в какой-либо значительной степени с субстратом за алкилирующий агент. Основаниями, обычно используемыми для этих реакций, являются карбонат натрия или карбонат калия. Реакционную смесь обычно перемешивают при температуре от комнатной температуры до 80 С в течение около от 8 ч до 3 дней. Алкилированные продукты выделяют концентрированием реакционной смеси при пониженном давлении с последующим распределением получаемого остатка между водой и подходящим органическим растворителем, таким как этилацетат, диэтиловый эфир, дихлорметан, этиленхлорид, хлороформ или тетрахлорид углерода. Выделенный продукт можно очистить хроматографией, кристаллизацией из подходящего растворителя, образованием соли или комбинацией этих методик. Конкретный применяемый алкилирующий агент определяется его коммерческой доступностью или получен подходящим синтезом из коммерчески доступных исходных материалов. Предпочтительные алкилирующие агенты для синтеза соединений этого изобретения выбирают из подходящих хлоридов, бромидов, йодидов или метансульфонатов. Алкилирующие агенты, где удаляемая группа представляет собой хлор, получают из соответствующего спирта стандартными способами, предпочтительно обработкой спирта чистым тионилхлоридом при комнатной температуре. Алкилирующие агенты,где удаляемая группа представляет собой метансульфонилокси, получают обработкой раствора подходящего спирта в подходящем безводном растворителе, таком как тетрагидрофуран, диэтиловый эфир, п-диоксан или ацетонитрил, которые содержат основание. Основание должно быть достаточно основным для нейтра 21 лизации кислоты, образуемой во время протекания реакции, но не таким основным, чтобы депротонировать другие места в субстрате, давая другие продукты. Кроме того, основание не должно конкурировать в какой-либо значительной степени с субстратом за сульфонирующий реагент и должно иметь достаточную растворимость в реакционном растворителе. Основаниями, обычно используемыми в этих реакциях,являются третичные амины, такие как пиридин,триэтиламин или N-метилморфолин. К реакционной смеси затем при охлаждении добавляют сульфонилирующий реагент. Сульфонилирующим реагентом может быть метансульфонилгалогенид, такой как хлорид, или ангидрид метансульфоновой кислоты. Реакционной смеси дают реагировать в течение от 1 до 24 ч при комнатной температуре. Продукт выделяют концентрированием реакционной смеси при пониженном давлении с последующим распределением остатка между водой и подходящим органическим растворителем, таким как дихлорметан, этилен-хлорид, хлороформ или тетрахлорид углерода. Выделенный продукт используют непосредственно на стадии алкилирования. Соединения настоящего изобретения обладают хиральным центром, и как таковые существуют в виде рацемических смесей или индивидуальных энантиомеров. Как указано выше,рацематы и индивидуальные изомеры, все являются частью настоящего изобретения. Индивидуальные энантиомеры могут быть разделены фракционной кристаллизацией солей рацемических оснований и энантиомерно чистых кислот,например, дитолуоилвинной кислоты. Альтернативно, индивидуальные энантиомеры можно получить путем использования хирального вспомогательного вещества во время получения соединения, как описано в следующей синтетической схеме VII. Синтетическая схема VII Моно-(2,2-диметилпропан-1,3-диол)кеталь 1,4-циклогександиона восстановительно аминируют в стандартных условиях энантиомером 001912 22 метил-(4-нитрофенил)этиламина (синтетическая схема VII иллюстрирует использование R-(+)энантиомера). Кеталь удаляют, как описано ранее, и получаемый аминоциклогексанон подвергают реакции в условиях, описанных для синтетической схемы I, с получением диастереомерной смеси. Диастереомеры затем разделяют хроматографией или фракционной кристаллизацией. Амин можно затем обработать, при желании, подходящим алкилирующим агентом, например, подходящим алкилгалогенидом, для получения соответствующей четвертичной соли до отщепления -метил-(4-нитрофенил)этильной части. Специалисту в данной области будет понятно, что хотя синтетическая схема IX иллюстрирует использование циклогексанона для получения соединений формулы I, где m = 1,данная синтетическая методология пригодна также для получения тех соединений формулы-метил-(4-нитрофенил) этильной части достигают восстановлением 4 нитрогруппы с последующим катализируемым кислотой сольволизом получаемой -метил-(4 аминофенил)этильной части. Восстановление нитрогруппы можно выполнить с помoщью широкого ряда восстанавливающих агентов, включая, например, тетрахлорид титана, литийалюминийгидрид или систему цинк/уксусная кислота, или каталитическим гидрированием. Сольволитическое расщепление происходит, когда моногидрохлорид (или другую одноосновную соль) продукта восстановления обрабатывают водой или спиртом при комнатной температуре или, в некоторых случаях, при повышенных температурах. Особенно пригодным условием для удаления -метил-(4-нитрофенил)этильной части является гидрирование моногидрохлорида амина в метаноле над платиновым катализатором. Специалисту в данной области также понятно, что последовательность осуществления стадии получения соединений данного изобретения во многих случаях не имеет значения. Следующие препаративные примеры и примеры будут служить для иллюстрации некоторых вариантов, возможных в пределах описанных синтетических путей. Препаративный пример I. 4-Диметиламиноциклогексанон.(2,2-Диметилпропан-1,3-диол)кеталь 4-диметиламиноциклогексанона. К раствору 25,0 г (0,55 моль) диметиламина в 500 мл метанола добавляют 50,0 г (0,25 моль) моно-2,2-диметилпропан-1,3-диолкеталя 1,4-циклогександиона и реакционную смесь перемешивают в течение 2 ч при комнатной температуре. К этому раствору затем постепенно добавляли 31,69 г (0,50 моль) цианборогидрида натрия. После того как это добавление было завершено, для установления рН смеси около 23 6 добавляли уксусную кислоту. рН периодически контролировали и добавления уксусной кислоты продолжали для поддержания рН около 6. Когда добавление уксусной кислоты больше не приводило к выделению газа, реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь затем концентрировали при пониженном давлении до объема около 100 мл и затем распределяли между 1 н. гидроксидом натрия и дихлорметаном. Оставшуюся водную фазу обрабатывали насыщенным водным хлоридом натрия и снова экстрагировали дихлорметаном. Эти органические фазы объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 40,15 г (70%) целевого соединения в виде желтого масла. МС (m/е): 228 (М+1). Удаление кеталя. Раствор 18,4 г (81 ммоль) (2,2-диметилпропан-1,3-диол)кеталя 4-диметиламиноциклогексанона в 250 мл 90% муравьиной кислоты нагревали при кипячении с обратным холодильником в течение 3 ч. Реакционную смесь затем перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь затем разбавляли 250 мл воды и концентрировали до объема около 250 мл на роторном испарителе. Последовательность разбавление/концентрирование затем повторяли еще два раза. Остаток затем концентрировали до объема около 50 мл,подщелачивали 5 н. гидроксидом натрия и экстрагировали дихлорметаном. Органические фазы объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении,получая 11,8 г (100%) целевого соединения в виде желтого масла.MC(m/e): 141 (M+). ЯМР (СDСl3):2,50 (м, 2 Н), 2,28 (м, 2 Н),2,28 (м, 6 Н), 2,01 (м, 2 Н), 1,80 (м, 2 Н). Препаративный пример II. 4-(1-фталимидил)циклогептанон. К перемешиваемому раствору 5,00 г (20,6 ммоль) 4-(1-фталимидил)циклогексанона в 30 мл диэтилового простого эфира добавляли 3,79 мл (30,8 ммоль) эфирата трифторида бора. После перемешивания в течение 20 мин при комнатной температуре по каплям добавляли 3,24 мл (30,8 ммоль) этилдиазоацетата. Получаемый раствор перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь разбавляли насыщенным водным карбонатом натрия и затем экстрагировали диэтиловым простым эфиром. Объединенные органические экстракты сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток растворяли в 15 мл диметилсульфоксида. К этому раствору добавляли 1,3 мл воды и 1,5 г хлорида натрия. Получаемую смесь нагревали при 170 С в течение 7 ч. Реакционную смесь затем охлаждали, выливали в 150 мл воды и экстрагировали диэтиловым простым эфиром. Объеди 001912 24 ненные органические фазы промывали последовательно водой и насыщенным водным хлоридом натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле, элюируя смесью (6:4) гексан/этилацетат. Фракции, которые, как было показано, содержали продукт, объединяли и концентрировали при пониженном давлении, получая 4,17 г (79%) указанного в заголовке соединения. МС (m/е): 257 (M+). Препаративный пример III. Оксим 4 диметиламиноциклогексанона. Смесь 1,78 г (10 ммоль) гидрохлорида 4 диметиламиноциклогексанона и 0,70 г (10 ммоль) гидрохлорида гидроксиламина в 25 мл этанола обрабатывали 3 мл пиридина и затем нагревали при кипячении с обратным холодильником в течение 30 минут. Реакционную смесь затем охлаждали до комнатной температуры и выдерживали при 4 С в течение 18 ч. Получаемый кристаллический твердый продукт собирали и промывали холодным этанолом. Твердый продукт затем растворяли в воде и водный раствор подщелачивали добавлением карбоната калия. Водную фазу затем экстрагировали дихлорметаном, который содержал небольшое количество изопропанола. Органические экстракты объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая кристаллический твердый продукт. Этот твердый продукт перекристаллизовывали из этанола, получая 1,05 г (67%) целевого оксима. Т.пл. = 96-7 С. МС (m/е): 156 (М+). Вычислено для C8H16N2O: теория: С 61,51; Н 10,32; N 17,93. Найдено: С 61,23; Н 10,44; N 17,81. Пример 1. Полугидрат дигидрохлоридаN,N-диметил-8-амино-1,2,3,4-тетрагидро-2 дибензофуранамина. Оксим О-(4-фторнитрофенил)-4-диметиламиноциклогексанона. К суспензии 1,50 г (13,1 ммоль) гидрида калия (35% в минеральном масле) в 80 мл тетрагидрофурана добавляли порциями при охлаждении 2,00 г (12,8 ммоль) оксима 4 диметиламиноциклогексана. После перемешивания реакционной смеси в течение около 20 мин добавляли раствор 2,00 г (14,2 ммоль) 4 фторнитробензола в тетрагидрофуране, затем 50 мг 18-краун-6-эфира. После перемешивания в течение 2 ч реакционную смесь гасили выливанием в холодную воду. Получаемую смесь экстрагировали дихлорметаном. Объединенные органические экстракты промывали холодным водным гидроксидом натрия (0,1 М), затем насыщенным водным хлоридом натрия. Оставшийся органический раствор сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 4,52 г сырого продукта. 25 Часть (3,52 г) этого материала подвергали хроматографии на силикагеле, элюируя 5% метанолом (содержащим около 5% гидроксида аммония) в хлороформе. Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении, получая 2,64 г целевого соединения. Т.пл. = 74-5 С. МС (m/е): 277 (M+). Вычислено для С 14 Н 19N3 О 3: теория: С 60,63; Н 6,91; N 15,15. Найдено: С 60,88; Н 6,99; N 15,31.N,N-диметил-8-нитро-1,2,3,4-тетрагидро-2 дибензофуранамин. Раствор 2,50 г (9,03 ммоль) оксима О-(4 фторнитрофенил)-4-диметиламиноциклогексанона в 25 мл 96% муравьиной кислоты медленно нагревали для кипячения с обратным холодильником в атмосфере азота. Через 90 мин реакционную смесь охлаждали до комнатной температуры и большую часть муравьиной кислоты удаляли при пониженном давлении. Остаток растворяли в воде и водную фазу подщелачивали добавлением 2 н. гидроксида натрия. Водную смесь затем экстрагировали дихлорметаном,содержащим небольшое количество изопропанола. Объединенные экстракты объединяли и концентрировали при пониженном давлении,получая 1,2 г кристаллического твердого продукта. Этот твердый продукт подвергали хроматографии на силикагеле, элюируя с градиентом хлороформа, содержащего 2-5% метанола (содержащего около 5% гидрoксида аммония). Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении. Твердый остаток перекристаллизовывали из гексана, получая 0,91 г (39%) целевого соединения. Т.пл. = 88-89 С. МС (m/е): 260 (М+). Вычислено для C14H16N2O3: теория: С 64,60; Н 6,20; N 10,76. Найдено: С 64,41; Н 6,36; N 10,47. Восстановление нитрогруппы. Раствор 0,38 г (1,46 ммоль) N,N-диметил 8-нитро-1,2,3,4-тетрагидро-2-дибензофуранамина в 150 мл этанола гидрировали над 200 мг 5% платины на угле при 2,812 атм (40 psi) в течение 2 ч при комнатной температуре. Катализатор удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Остаток подвергали радиальной хроматографии (силикагель, 2 мм), элюируя 10% метанолом (содержащим около 5% гидроксида аммония) в хлороформе. Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении, получая 265 мг N,N-диметил-8-амино 1,2,3,4-тетрагидро-2-дибензофуранамина в виде вязкого масла. Масло растворяли в диэтиловом простом эфире и этот раствор обрабатывали хлоридом водорода. Осажденную соль фильтро 001912(0,115 ммоль) поливинилпиперидина в 1,0 мл дихлорметана нагревали до 60 С в течение 45 мин. К этой гомогенной смеси добавляли 1 мг(0,036 ммоль) метансульфонилхлорида. Реакционную смесь перемешивали в течение 2 дней при комнатной температуре. К этой смеси затем добавляли 58,0 мг (0,058 ммоль) аминометилированного полистирола и реакционную смесь перемешивали еще 18 ч. Реакционную смесь затем фильтровали и летучие компоненты выпаривали, получая 5,7 мг (64%) указанного в заголовке соединения. МС (m/е): 309 (М + 1). Пример 3. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-4-фторбензолсульфонамид. По методу, описанному в примере 2, исходя из 9,0 мг (0,029 ммоль) полугидрата дигидрохлорида N,N-диметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 7,0 мг (0,036 ммоль) 4-фторбензолсульфонилхлорида, выделяли 5,61 мг (50%) указанного в заголовке соединения. МС (m/е): 389(М + 1). Пример 4. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-ацетамид. По методу, описанному в примере 2, исходя из 9,0 мг (0,029 ммоль) полугидрата дигидрохлорида N,N-диметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 2,8 мг (0,036 ммоль) ацетилхлорида, выделяли 6,05 мг (77%) указанного в заголовке соединения. МС (m/е): 273 (М + 1). Пример 5. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-циклопропанамид. По методу, описанному в примере 2, исходя из 9,0 мг (0,029 ммоль) полугидрата дигидрохлорида N,N-диметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 4,3 мг (0,036 ммоль) циклопропанкарбонилхлорида, выделяли указанное в заголовке соединение. МС (m/е): 299(М + 1). Пример 6. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-циклобутанамид. По методу, описанному в примере, исходя из 9,0 мг (0,029 ммоль) полугидрата дигидрохлорида N,N-диметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 4,3 мг (0,036 ммоль)(81%) указанного в заголовке соединения. МС (m/е): 341 (М + 1). Общая методика сочетания карбоновых кислот с N,N-диметил-8-амино-1,2,3,4 тетрагидро-2-дибензофуранамином Суспензию 1 эквивалента полугидрата дигидрохлоридаN,N-диметил-8-амино-1,2,3,4 тетрагидро-2-дибензофуранамина и 4-5 эквивалентов поливинилпиперидина в 1 мл хлороформа нагревают при 60 С в течение 45 мин. К этой 28 смеси затем добавляют 4-5 эквивалентов связанного с полимером 1-этил-3-(3-диметиламинопропил)карбодиимида (Desai, et al., Tetrahedron Letters, 34 (48), 7685 (1993 и 2-3 эквивалента карбоновой кислоты. Реакционную смесь перемешивают при 70 С до тех пор, пока реакция не завершится. Для удаления непрореагировавшего исходного материала, если нужно, добавляют изоцианатную смолу. Смолы удаляют фильтрованием и затем продукт выделяют выпариванием растворителя. Эта методика иллюстрируется примерами 12-16. Пример 12. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-3-тиофенкарбоксамид. 1,3 мг (13%) указанного в заголовке соединения получали, исходя из 9,0 мг (0,029 ммоль) полугидрата дигидрохлорида N,N-диметил-8 амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 7,4 мг (0,058 ммоль) 3-тиофенкарбоновой кислоты. МС (m/е): 341 (М + 1). Пример 13. 29 Пример 17. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-4-фторбензамид. К раствору 0,132 г (0,57 ммоль) N,Nдиметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина в 5 мл тетрагидрофурана добавляли 1,5 мл триэтиламина, затем 0,10 мл (0,13 г, 0,85 ммоль) 4-фторбензоилхлорида. Получаемую смесь перемешивали при комнатной температуре в течение 90 мин, в это время реакционную смесь разбавляли 0,1 н. водным гидроксидом натрия. Этот водный раствор экстрагировали дихлорметаном и органические фазы промывали последовательно водой и насыщенным водным хлоридом натрия. Раствор в дихлорметане сушили над сульфатом натрия и концентрировали при пониженном давлении. Этот остаток растворяли в разбавленной водной винной кислоте и затем промывали дихлорметаном. Органическую фазу подщелачиивали водным карбонатом натрия и затем экстрагировали дихлорметаном. Эти экстракты в дихлорметане объединяли и концентрировали при пониженном давлении. Остаток подвергали радиальной хроматографии (силикагель 2 мм), элюируя 5% метанолом (содержащим 5% гидроксида аммония) в хлороформе. Фракции, содержащие продукт,объединяли и концентрировали при пониженном давлении. Остаток кристаллизовали из смеси толуол/гексан, получая 0,130 г (64%) указанного в заголовке соединения в виде двух порций. Т.пл. = 167-8 С. МС (m/е): 352 (М+). Вычислено для C21H21N2OF: теория: С 71,57; Н 6,01; N 7,95. Найдено: С 71,84; Н 6,11; N 7,95. Пример 18. N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-пиридин-4 карбоксамид. По методу, описанному в примере 20, исходя из 0,132 мг (0,57 ммоль) N,N-диметил-8 амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 0,15 мг (0,84 ммоль) изоникотиноилхлорида,получали 0,081 (42%) указанного в заголовке соединения. Т.пл. = 146-7 С. МС (m/е): 335 (М+). Вычислено для С 20 Н 20N3O2: теория: С 71,62; Н 6,31; N 12,53. Найдено: С 71,77; Н 6,48; N 12,36. Пример 19. (2R)- и (2S)-N-R)-(+)(4 нитрофенил)этил)-8-нитро-1,2,3,4-тетрагидро-2 дибензофуранамин. Восстановительное алкилирование. К раствору 20,0 г (101 ммоль) (2,2 диметил)пропан-1,3-диолмонокеталя 1,4-циклогександиона в 250 мл метанола добавляли 35,0 гR-(+)(4 нитрофенил)-этиламина, 25,0 г (398 ммоль) цианборогидрида натрия и 10 мл уксусной кисло 001912 30 ты. Реакционную смесь перемешивали в течение 18 ч при комнатной температуре. К реакционной смеси затем добавляли дополнительную загрузку 25,0 г (398 ммоль) цианборгидрида натрия и реакционную смесь перемешивали еще 18 ч при комнатной температуре. Реакционную смесь затем обрабатывали разбавленной водной винной кислотой и раствор до истощения экстрагировали дихлорметаном. Оставшуюся водную фазу подщелачивали водным гидроксидом натрия и экстрагировали дихлорметаном. Эти экстракты в дихлорметане объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 33,7 г (96%) 2,2 диметилпропан-1,2-диолкеталя N-R)-(+)(4 нитрофенил)этил)-4-аминоциклогексанона в виде коричневато-желтого масла. МС (m/е): 348 (M+). Удаление кеталя. Раствор 33,42 г (95,9 ммоль) 2,2-диметилпропан-1,2-диолкеталя N-R)-(+)(4-нитрофенил)этил)-4-аминоциклогексанона в 250 мл 98% муравьиной кислоты нагревали до 40 С в течение 66 ч. Реакционную смесь концентрировали при пониженном давлении до объема около 50 мл и затем подщелачивали водным карбонатом калия. Эту смесь экстрагировали дихлорметаном и органический экстракт затем сушили над сульфатом натрия и концентрировали при пониженном давлении, получая 22,36 г (89%) NR)-(+)(4-нитрофенил)этил)-4-аминоциклогексанона в виде коричневого масла. Получение оксима. Смесь 5,24 г (20 ммоль) N-R)-(+)(4 нитрофенил)этил)-4-аминоциклогексанона и 1,40 г (20 ммоль) гидрохлорида гидроксиламина в 40 мл этанола кипятили с обратным холодильником на паровой бане в течение 30 мин. Реакционную смесь охлаждали в течение 18 ч при 4 С, после чего гидрохлорид оксима N-R)(+)(4-нитрофенил)этил)-4-аминоциклогексанона выделяли фильтрованием. После сушки при пониженном давлении выделяли 3,95 г[]D (с = 1,0, метанол): +61. Алкилирование оксима. Оксим N-R)-(+)(4-нитрофенил)этил)4-аминоциклогексанона получали путем распределения 3,80 г (12,1 ммоль) соответствующей гидрохлоридной соли между разбавленным водным бикарбонатом натрия и дихлорметаном. После разделения фаз органическую фазу сушили над сульфатом натрия и затем концентрировали при пониженном давлении, получая целевое свободное основание в виде вязкого масла. 31 Свободное основание растворяли в 100 мл тетрагидрофурана и к этому раствору добавляли 3,00 г (21,3 ммоль) 4-фторнитробензола и 0,30 г 18-краун-6-эфира. Полученный раствор охлаждали до около 0 С, затем по каплям в течение 20 мин добавляли 1,30 г (11,4 ммоль) гидрида калия (35% в минеральном масле). Реакционную смесь перемешивали в течение 2 ч и затем гасили добавлением холодной воды с последующей экстракцией дихлорметаном. Органические фазы объединяли, промывали насыщенным водным хлоридом натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении, получая кристаллический остаток. Остаток подвергали хроматографии на силикагеле, элюируя градиентной системой хлороформа и 0-2% метанола (содержащего 5% гидроксида аммония). Фракции, содержащие продукт,объединяли и концентрировали при пониженном давлении, получая 4,30 г (95%) целевого соединения в виде желтых кристаллов. Этот материал перекристаллизовывали из смеси толуол/гексан, получая 3,88 г (85%) 4-нитрофенилоксима N-R)-(+)(4-нитрофенил)этил)4-аминоциклогексанона. Т.пл. = 96-7 С. МС (m/е): 398 (M+). Вычислено для C20H22N4O5: теория: С 60,29; Н 5,57; N 14,06. Найдено: С 60,33; Н 5,68; N 13,95.[]D (с = 1,0, метанол): +64. Циклизация. Раствор 3,75 г (9,41 ммоль) 4 нитрофенилоксима N-R)-(+)(4-нитрофенил) этил)-4-аминоциклогексанона в 40 мл муравьиной кислоты перемешивали при кипячении с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и затем выливали в холодную воду. Раствор осторожно подщелачивали до рН 10 постепенным добавлением около 400 мл холодного 2 н. гидроксида натрия и затем водного карбоната натрия. Водную смесь затем экстрагировали дихлорметаном. Экстракт промывали водным карбонатом натрия, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии,на силикагеле, элюируя этилацетатом. Первый элюирующийся диастереомер NR)(4-нитрофенил)этил)-8-нитро-1,2,3,4 тетрагидро-2-дибензофуранамина. Более быстро элюирующийся диастереомер после перекристаллизации из смеси толуол/гексан выделяли в виде 0,82 г (23%) кристаллического твердого продукта. Т.пл. = 170-1 С. МС (m/е): 381 (М+). Вычислено для C20H19N3O5: теория: С 62,99; Н 5,02; N 11,02. Найдено: С 62,99; Н 5,03; N 10,78.N-R)(4-нитрофенил)-этил)-8-нитро-1,2,3,4 тетрагидро-2-дибензофуранамина. Более медленно элюирующийся диастереомер после перекристаллизации из смеси толуол/гексан выделяли в виде 0,88 г (25%) кристаллического твердого продукта. Т.пл. = 164,5-166 С. МС (m/е): 381 (М+). Вычислено для C20H19N3O5: теория: С 62,99; Н 5,02; N 11,02. Найдено: С 63,27; Н 5,22; N 11,21. Пример 20.(+)-N,N-диметил-8-(третбутоксикарбонил)амино-1,2,3,4-тетрагидро-2 дибензофуранамин. Кватернизация. К раствору 0,85 г (2,13 ммоль) более медленно элюирующегося диастереомера N-R)-(4-нитрофенил)этил)-8-нитро-1,2,3,4-тетрагидро-2-дибензофуранамина в 10 мл ацетонитрила добавляли 2,0 мл йодметана, затем 1,0 карбоната калия. Смесь перемешивали в течение 18 ч при 60 С и затем добавляли еще 1,0 мл йодметана и нагревание продолжали в течение 18 ч. Реакционную смесь затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток быстро нагревали в 30 мл метанола и после охлаждения собирали на фильтре. Промывки метанолом собирали и концентрировали при пониженном давлении. Промывание остатка водой давало небольшое количество дополнительного продукта. Твердые продукты объединяли, промывали холодной водой и сушили, получая 1,00 г (88%) йодида (+)-N,N-диметил-N-R)(4-нитрофенил)этил)-8-нитро-1,2,3,4-тетрагидро-2-дибензофуранаммония. Вычислено для С 22H24N3 О 5I: теория: С 49,17; Н 4,50; N 7,82; I 23,62. Найдено: С 48,89; Н 4,44; N 7,65; I 23,38. Гидрогенолиз/гидрирование. Смесь 0,95 г (1,71 ммоль) йодида (+)-N,Nдиметил-N-R)(4-нитрофенил)этил)-8-нитро 1,2,3,4-тетрагидро-2-дибензофуранаммония и 0,25 г 5% палладия на угле в 250 мл метанола гидрировали при комнатной температуре в течение 6 ч при начальном давлении водорода 2,812 атм (40 psi). Реакционную смесь затем фильтровали и промывали для осуществления метанолиза. Реакционную смесь концентрировали при пониженном давлении без нагревания и остаток растирали с диэтиловым простым эфиром, получая около 0,800 г гидройодида (+)N,N-диметил-8-амино-1,2,3,4-тетрагидро-2 дибензофуранамина в виде хорошо разделяемого, гранулированного твердого продукта. Ацилирование. Гидройодид амина распределяли между дихлорметаном и 1 н. гидроксидом натрия. Органическую фазу промывали насыщенным водным хлоридом натрия, сушили над сульфатом 33 натрия и концентрировали при пониженном давлении до объема около 50 мл. К этому раствору затем добавляли 0,5 г дитретбутилдикарбоната и полученную смесь оставляли стоять в течение 18 ч при комнатной температуре. В это время добавляли дополнительные 0,2 г дитретбутилдикарбоната и реакцию продолжали в течение еще 18 ч. Реакционную смесь затем перемешивали с водным карбонатом натрия в течение 2 дней. Органическую фазу отделяли,сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле, элюируя 5% метанолом (содержащим 5% гидроксида аммония) в хлороформе. Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении, получая 0,224 г (40%) указанного в заголовке соединения. МС (m/е): 330 (М+). Вычислено для С 19 Н 26N2 О 3: теория: С 69,07; Н 7,93; N 8,48. Найдено: С 69,34; Н 7,86; N 8,29.[]D (с = 1,0, метанол): +62. Пример 21. (+)-N-(N,N-диметил-1,2,3,4 тетрагидро-2-аминодибензофур-8-ил)-4-фторбензамид. Смесь 0,090 г (0,273 ммоль) (+)-N,Nдиметил-8-(трет-бутоксикарбонил)амино 1,2,3,4-тетрагидро-2-дибензофуранамина и 1 мл трифторуксусной кислоты перемешивали при комнатной температуре в течение 20 мин. Избыток трифторуксусной кислоты затем удаляли при пониженном давлении. Остаток растворяли в 5 мл тетрагидрофурана и к этому раствору добавляли 1,5 мл триэтиламина, затем 0,05 мл(0,42 ммоль) 4-фторбензоилхлорида. После перемешивания в течение 1 часа летучие компоненты удаляли при пониженном давлении. Остаток растворяли в 5 мл дихлорметана и перемешивали с разбавленным водным карбонатом натрия. После перемешивания в течение 16 ч слой дихлорметана отделяли и водный слой экстрагировали свежим дихлорметаном. Экстракты в дихлорметане объединяли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле, элюируя 5% метанолом (содержащим 5% гидроксида аммония) в хлороформе. Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении. Получаемый остаток кристаллизовали из смеси толуол/гексан, получая 0,058 г (60%) указанного в заголовке соединения в виде кристаллического твердого продукта двумя порциями. Т.пл. 137-8 С. Вычислено для C21H21N2O2F: теория: С 71,57; Н 6,01; N 7,95; F 5,39. Найдено: С 71,36; Н 5,86; N 7,72; F 5,25. 34 Пример 22. (+)-N-(N,N-диметил-1,2,3,4 тетрагидро-2-аминодибензофур-8-ил)пиридин 4-карбоксамид. По методу, описанному в примере 24, исходя из 0,100 г (0,30 ммоль) (+)-N,N-диметил-8(трет-бутаксикарбонил)-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 0,100 г (0,56 ммоль) гидрохлорида изоникотиноилхлорида,выделяли двумя порциями из смеси толуол/гексан 0,036 г (36%) указанного в заголовке соединения. Т.пл. 146-7 С. Вычислено для C20H21N3O5: теория: С 71,62; Н 6,31; N 12,53. Найдено: С 71,37; Н 6,28; N 12,51.[]D (с = 1,0, метанол): +70,7. Пример 23. N,N-диметил-8-циано-1,2,3,4 тетрагидро-2-дибензофуранамин. Оксим О-(4-цианофенил)-4-диметилциклогексанона. По методу, описанному в примере 1, исходя из 3,0 г (19,2 ммоль) оксима 4-диметиламиноциклогексанона и 2,77 г (22,9 ммоль) 4 фторбензонитрила, 3,51 г (71%) целевого простого эфира оксима выделяли в виде темнокоричневого твердого продукта. Циклизация. По методу, описанному в примере 1, исходя из 11,69 ммоль простого эфира оксима и 100 мл муравьиной кислоты, 1,03 г (37%) указанного в заголовке соединения выделяли в виде рыжевато-коричневого твердого продукта. МС (m/е): 240 (М+). Пример 24. N-диметил-8-карбоксамидо 1,2,3,4-тетрагидро-2-дибензофуранамин. Смесь 0,20 г (0,83 ммоль) N,N-диметил-8 циано-1,2,3,4-тетрагидро-2-дибензофуранамина,15 г полифосфорной кислоты и хлороформа в количестве, достаточном для облегчения перемешивания, энергично перемешивали вместе,при этом температуру реакционной смеси постепенно повышали до 90 С. Реакционную смесь выдерживали при этой температуре в течение около 4 ч и затем обрабатывали ледяной крошкой. В том случае, если реакционная смесь была жидкая, ее выливали в холодный раствор 5 н. водного гидроксида натрия. Получаемую смесь экстрагировали 3350 мл хлороформа. Экстракты в хлороформе объединяли, сушили над карбонатом калия и концентрировали при пониженном давлении, получая 0,144 г (67%) указанного в заголовке соединения. Пример 25. Гидрохлорид N-(N,N-диметил 1,2,3,4-тетрагидро-2-аминодибензофур-8-ил) пиридин-N-оксид-4-карбоксамида. Раствор 0,117 г (0,51 ммоль) N,N-диметил 8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина в 5 мл тетрагидрофурана добавляли к смеси 0,117 г (0,61 ммоль) гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида,0,082 г (0,61 ммоль) гидрата 1-гидрокси 35 бензотриазола и 0,085 г (0,61 ммоль) пиридинN-оксид-4-карбоновой кислоты в 20 мл диметилформамида. После перемешивания в течение 18 ч при комнатной температуре реакционную смесь разбавляли водным карбонатом калия и перемешивали еще в течение часа при комнатной температуре. Эту смесь эффективно экстрагировали хлороформом. Органические экстракты объединяли и концентрировали при пониженном давлении. Остаток подвергали дважды радиальной хроматографии (2 мм, силикагель),элюируя 5% метанолом в дихлорметане, содержащим 0,5% гидроксида аммония. Фракции,содержащие продукт, объединяли и концентрировали при пониженном давлении. Остаток растворяли в хлороформе и к этому раствору добавляли раствор хлорида водорода в этаноле,получая 0,107 г (50%) указанного в заголовке соединения. МС (m/е): 351 (M+). Вычислено для C20H21N3O3-HCl: теория: С 61,93; Н 5,72; N 10,83. Найдено: С 61,80; Н 5,75; N 10,57. Пример 26. Альтернативное получение гидрохлорида N-(N,N-диметил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)фуран-3-карбоксимида. По методу примера 17, исходя из 0,105 г(0,35 ммоль) полугидрата дигидрохлорида N,Nдиметил-8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина и 0,069 г (0,53 ммоль) фуро-3 илхлорида, выделяли 0,088 г (70%) указанного в заголовке соединения в виде не совсем белого твердого продукта. МС (m/е): 324 (М+). Вычислено дляN,N-диметил-8-гидрокси 1,2,3,4-теграгидро-2-дибензофуранамин. Раствор 0,332 г (1,44 ммоль) N,N-диметил 8-амино-1,2,3,4-тетрагидро-2-дибензофуранамина в 5 мл концентрированной хлористоводородной кислоты и 5 мл воды охлаждали до-10 С. К этому раствору по каплям добавляли раствор 0,109 г (1,58 ммоль) нитрита натрия в 10 мл воды. Полученный раствор перемешивали в течение 1 ч и затем добавляли к 10 мл концентрированной серной кислоты. Эту смесь перемешивали при кипячении с обратным холодильником в течение 4 ч. Реакционную смесь выливали на лед и раствор подщелачивали добавлением водного карбоната калия. Раствор затем эффективно экстрагировали хлороформом, содержащим 10% изопропанола. Органические экстракты объединяли, сушили над карбонатом калия и концентрировали при пониженном давлении. Остаток подвергали радиальной хроматографии (силикагель, 2 мм). Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении, полу 001912 36 чая 0,121 г (36%) указанного в заголовке соединения в виде не совсем белой пены. МС (m/е): 231 (М+). Вычислено для C14H17NO2: теория: С 72,70; Н 7,41; N 6,06. Найдено: С 72,85; Н 7,27; N 5,98. Пример 28. 8-Нитро-1,2,3,4-тетрагидро-2 дибензофуранамин. По методу, описанному в примере 1, исходя из 4-(фталимид-1-ил)циклогексанона, был получен 8-нитро-2-(фталимид-1-ил)дибензофуранамин. Смесь 5,50 г (15,2 ммоль) 8-нитро-2(фталимид-1-ил)дибензофуранамина, 100 мл гидразингидрата, 150 мл этанола и 50 мл воды перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток обрабатывали карбонатом калия и затем экстрагировали хлороформом. Органические фазы объединяли и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле. Фракции, содержащие продукт,объединяли и концентрировали при пониженном давлении, получая 0,59 г (92%) указанного в заголовке соединения в виде желтого масла. Пример 29. Дигидрохлорид 8-амино 1,2,3,4-тетрагидро-2-диэтиламинодибензофурана. Смесь 0,88 г (3,79 ммоль) 8-нитро-1,2,3,4 тетрагидро-2-дибензофуранамина, 0,89 г (5,68 ммоль) йодэтана и 1,58 г (11,4 ммоль) карбоната калия в 50 мл ацетона нагревали при кипячении с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в воде. Эту смесь эффективно экстрагировали хлороформом. Органические фазы объединяли, сушили над карбонатом калия и концентрировали при пониженном давлении. Остаток подвергали радиальной хроматографии (силикагель, 2 мм). Фракции, содержащие продукт, объединяли и концентрировали при пониженном давлении,получая 0,49 г(45%) 8-нитро-1,2,3,4 тетрагидро-2-диэтиламинодибензофурана в виде желтого масла. Смесь 0,48 г (1,66 ммоль) 8-нитро-1,2,3,4 тетрагидро-2-диэтиламинодибензофурана и 0,20 г 5% платины на угле в 250 мл этанола гидрировали при 2,812 атм (40 psi) и при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растворяли в дихлорметане, сушили над карбонатом калия и концентрировали при пониженном давлении. Этот остаток снова растворяли в дихлорметане и раствор обрабатывали хлоридом водорода. Образованный осадок выделяли и сушили, получая 0,49 г (89%) указанного в заголовке соединения в виде бесцветного твердого продукта. Пример 30. Гидрохлорид 8-амино-1,2,3,4 тетрагидро-2-дипропиламинодибензофурана. 37 По методу, описанному в примере 29, исходя из 0,88 г (3,79 ммоль) 8-нитро-1,2,3,4 тетрагидро-2-дибензофуранамина и 1-йодпропана, выделяли 0,49 г (42%) указанного в заголовке соединения в виде не совсем белого твердого продукта. Пример 31. Гидрохлорид N-(N,N-диэтил 1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-4 фторбензамида. По методу, описанному в примере 17, исходя из 0,100 г (0,30 ммоль) 8-амино-1,2,3,4 тетрагидро-2-диэтиламинодибензофурана и 0,052 г (0,33 ммоль) 4-фторбензоилхлорида,выделяли 0,088 г (70%) указанного в заголовке соединения в виде не совсем белого твердого продукта. МС (m/е): 380 (М+). Вычислено для C23H25N2O2F-HCl: теория: С 66,26; Н 6,29; N 6,72. Найдено: С 66,14; Н 6,40; N 6,79. Пример 32. Дигидрохлорид N-(N,Nдиэтил-1,2,3,4-тетрагидро-2-аминодибензофур 8-ил)изоникотинамида. По методу, описанному в примере 17, исходя из 0,100 г (0,30 ммоль) 8-амино-1,2,3,4 тетрагидро-2-диэтиламинодибензофурана и 0,059 г (0,33 ммоль) гидрохлорида изоникотиноилхлорида, выделяли 0,068 г (52%) указанного в заголовке соединения в виде желтого твердого продукта. МС (m/е): 363 (М+). Вычислено для С 22 Н 25N3O2-НСl: теория: С 60,25; Н 6,24; N 9,63. Найдено: С 60,69; Н 6,06; N 9,59. Пример 33. Гидрохлорид N-(N,N-диэтил 1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-3 фурамида. По методу, описанному в примере 17, исходя из 0,100 г (0,30 ммоль) 8-амино-1,2,3,4 тетрагидро-2-диэтиламинодибензофурана и 0,052 г (0,40 ммоль) фуран-3-карбонилхлорида,выделяли 0,081 г (69%) указанного в заголовке соединения в виде не совсем белого твердого продукта. МС (m/е): 352 (М+). Вычислено для C21H24N2O3-HCl: теория: С 64,86; Н 6,48; N 7,20. Найдено; С 64,73; Н 6,22; N 7,29. Пример 34. ГидрохлоридN-(N,Nдипропил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)-4-фторбензамида. По методу, описанному в примере 17, исходя из 0,072 г (0,20 ммоль) 8-амино-1,2,3,4 тетрагидро-2-дипропиламинодибензофурана и 0,032 г (0,20 ммоль) 4-фторбензоилхлорида,выделяли 0,078 г (87%) указанного в заголовке соединения в виде не совсем белого твердого продукта. МС (m/е): 408 (М+). Вычислено для C25H29N2O2F-HCl: теория: С 67,48; Н 6,80; N 6,30. Найдено: С 67,26; Н 6,68; N 6,05. 38 Пример 35. Дигидрохлорид N-(N,Nдипропил-1,2,3,4-тетрагидро-2-аминодибензофур-8-ил)изоникотинамида. По методу, описанному в примере 17, исходя из 0,072 г (0,20 ммоль) 8-амино-1,2,3,4 тетрагидро-2-дипропиламинодибензофурана и 0,054 г (0,30 ммоль) гидрохлорида изоникотиноилхлорида, выделяли 0,075 г (81%) указанного в заголовке соединения в виде желтого твердого продукта. МС (m/е): 391 (М+). Пример 36. Гидрохлорид(82%) целевого простого эфира оксима в виде рыжевато-коричневого твердого продукта. МС (m/е): 304 (М+). Циклизация. По методу, описанному в примере 1, исходя из 0,70 г (2,30 ммоль) простого эфира оксима и 50 мл муравьиной кислоты, выделяли 0,48 г(73%) указанного в заголовке соединения в виде белого кристаллического твердого продукта. Пример 38.N,N-диметил-8-карбокси 1,2,3,4-тетрагидро-2-дибензофуранамин. Смесь 0,21 г (0,73 ммоль) N,N-диметил-8 этоксикарбонил-1,2,3,4-тетрагидро-2-дибензофуранамина и 25 мл 2 н. гидроксида натрия в 25 мл тетрагидрофурана перемешивали при 35 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и промывали дихлорметаном. В водной фазе устанавливали рН до 7, насыщали хлоридом натрия и затем эффективно экстрагировали хлороформом, содержащим 10% изопропанола. Органические экстракты объединяли и концентрировали при пониженном давлении, получая белый твердый продукт,который обрабатывали хлористоводородной кислотой. Образованный бесцветный кристаллический осадок фильтровали и сушили, получая 0,098 г (55%) указанного в заголовке соединения. МС (m/е): 259 (М+). 39 Пример 39. N-(пиридин-3-ил)-2-диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбоксамид. По методу, описанному в примере 25, исходя из 0,17 г (0,57 ммоль) N,N-диметил-8 карбокси-1,2,3,4-тетрагидро-2-дибензофуранамина и 0,06 г (0,63 ммоль) 3-аминопиридина,выделяли 0,083 г (44%) указанного в заголовке соединения в виде не совсем белой пены. МС (m/е): 336 (М+1). Вычислено для C20H21N3O2: теория; С 71,62; Н 6,31; N 12,53. Найдено: С 71,88; Н 6,41; N 12,79. Общая методика сочетания аминов с 2 диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбонилхлоридом Смесь 8-карбокси-2-диметиламино-1,2,3,4 тетрагидродибензофурана и тионилхлорида перемешивают при комнатной температуре до тех пор, пока она не станет гомогенной. Реакционную смесь концентрируют при пониженном давлении, получая соответствующий хлорангидрид. Один эквивалент хлорангидрида, 2 эквивалента подходящего амина и 3 эквивалента пиперидинометилполистирола в хлороформе перемешивают при комнатной температуре в течение 18 ч. Для удаления непрореагировавшего амина добавляют изоцианатную смолу и смесь перемешивают при комнатной температуре в течение 4 ч. Смолы удаляют фильтрованием и продукт выделяют выпариванием растворителя. Эта методика иллюстрируется примерами 40-44. Пример 40. N-(метил)-2-диметиламино 1,2,3,4-тетрагидродибензофуран-8-карбоксамид. 0,0023 г (20%) указанного в заголовке соединения получали, исходя из 0,011 г (0,04 ммоль) 2-диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбонилхлорида и 0,08 ммоль метиламина. МС (m/е): 273 (М+1). Пример 41. N-(этил)-2-диметиламино 1,2,3,4-тетрагидродибензофуран-8-карбоксамид. 0,0037 г (33%) указанного в заголовке соединения получали, исходя из 0,011 г (0,04 ммоль) 2-диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбонилхлорида и 0,08 ммоль этиламина. МС (m/е): 287 (М+1). Пример 42. N-(циклопропил)-2-диметиламино-1,2,3,4-тетрагидродибензофуранкарбоксамид. 0,004 г (32%) указанного в заголовке соединения получали, исходя из 0,011 г (0,04 ммоль) 2-диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбонилхлорида и 0,08 ммоль циклопропиламина. МС (m/е): 299 (М+1). Пример 43. N-(4-Фторфенил)-2-диметиламино-1,2,3,4-тетрагидродибензофуран-8-карбоксамид.N,N-диметил-4-фторфенилсульфонамида, выделяли 0,135 г (65%) целевого простого эфира оксима в виде кристаллического твердого продукта. Циклизация. По методу, описанному в примере 1, исходя из 0,135 г (0,40 ммоль) простого эфира оксима и 10 мл муравьиной кислоты, выделяли 0,088 г (61%) указанного в заголовке соединения в виде белого твердого продукта. МС (m/е): 322 (М+). Вычислено для C16H22N2O3S-HCl: теория: С 53,55; Н 6,46; N 7,81. Найдено: С 53,48; Н 6,54; N 7,61. Пример 46. Гидрохлорид 2-диметиламино 8-(N-метил)аминосульфонил-1,2,3,4-тетрагидродибензофурана. Оксим О-(4-(N-метил-N-(4-метоксибензиламиносульфонилфенил)-4-диметилциклогексанона. По методу, описанному в примере 1, исходя из 0,313 г (2,0 ммоль) оксима 4 диметиламиноциклогексанона и 0,681 г (2,2 ммоль) N-метил-N-(4-метокси)бензил-4-фторфенилсульфонамида, выделяли 0,781 г (90%) целевого простого эфира оксима в виде бледножелтого кристаллического твердого продукта. Циклизация. По методу, описанному в примере 1, исходя из 0,750 г (1,74 ммоль) простого эфира оксима и 20 мл муравьиной кислоты, выделяли 0,135 г (25%) указанного в заголовке соединения в виде не совсем белого твердого продукта. 41 Пример 47. 2-Диметиламино-8-(N-(4-фторфениламиносульфонил-1,2,3,4-тетрагидродибензофуран. Оксим О-(4-(N-(4-фторфенил)-N-(4-метоксибензиламиносульфонилфенил)-4-диметилциклогексанона. По методу, описанному в примере 1, исходя из 0,78 г (5,0 ммоль) оксима 4-диметиламиноциклогексанона и 2,14 г (5,5 ммоль) N-(4 фтор)фенил-N-(4-метокси)бензил-4-фторфенилсульфонамида, выделяли 1,13 г (43%) целевого простого эфира оксима в виде не совсем белого твердого продукта.MC (m/e): 525 (М+). Циклизация. По методу, описанному в примере 1, исходя из 1,13 г (2,15 ммоль) простого эфира оксима и 20 мл муравьиной кислоты, выделяли 0,610 г(73%) указанного в заголовке соединения в виде не совсем белого твердого продукта.MC (m/e): 388 (М+). Вычислено для C20H21NO3S: теория: С 61,84; Н 5,45; N 7,21. Найдено: С 62,01; Н 5,50; N 7,09. Для демонстрации использования соединений этого изобретения при лечении мигрени определяли их способность связываться с подтипом рецептора 5-HT1F. Способность соединений этого изобретения связываться с подтипом рецептора 5-HT1F измеряли в основном так, как описано в N. Adham et al., Proceedings of the National Academy of Sciences (USA), 90, 408-412(1993). Мембранный препарат. Мембраны получали из трансфекцированных Ltk-клеток, которые были выращены до 100% слияния. Клетки промывали два раза забуференным фосфатом солевым раствором, соскабливали с чашек для культивирования в 5 мл охлажденного льдом забуференного фосфатом солевого раствора и центрифугировали при 200 г в течение 5 мин при 4 С. Осадок ресуспендировали в 2,5 мл охлажденного льдом Трис-буфера (20 мм ТрисHCl, рН = 7,4 при 23 С, 5 мМ ЭДТК) и гомогенизировали измельчителем ткани Wheaton. Лизат затем центрифугировали при 200 г в течение 5 мин при 4 С для отделения больших фрагментов в виде осадка, который выгружали. Супернатант собирали и центрифугировали при 40000 г в течение 20 мин при 4 С. Осадок,получаемый при этом центрифугировании, промывали один раз охлажденным льдом Трисбуфером для промывания и ресуспендировали в конечном буфере, содержащем 50 мм Трис-НСl и 0,5 мМ ЭДТК, рН = 7,4 при 23 С. Мембранные препараты сохраняли на льду и использовали в пределах двух часов для анализов связывания радиолиганда. Концентрации белков определяли способом Bradford (Anal. Biochem., 72,248-254 (1976.[3H-5-HT] проводили с использованием незначительных модификаций условий анализа 5 НТ 1D, описанного Herrick-Davis and Titeler (J.Neurochem., 50, 1624-1631 (1988, без включения маскирующих лигандов. Исследование связывания радиолиганда проводили при 37 С в общем объеме 250 мкл буфера (50 мм Трис, 10 мМ MgCl2, 0,2 мМ ЭДТК, 10 мкМ паргилина,0,1% аскорбат, рН = 7,4 при 37 С) в микротитрационных планшетах на 96 лунок. Изучение насыщения проводили с использованием [3 Н]5 НТ при 12 различных концентрациях в диапазоне от 0,5 до 100 нМ. Изучение замещения проводили с использованием 4,5-5,5 нМ [3 Н]5-НТ. Профиль связывания лекарственных средств в экспериментах с конкурентным связыванием получали с использованием 10-12 концентраций соединения. Время инкубации было 30 мин для исследований как насыщения, так и замещения,основанных на первоначальных исследованиях,которые определяли условия равновесного связывания. Неспецифическое связывание определяли в присутствии 10 мкМ 5-НТ. Связывание инициировали добавлением 50 мкл мембранных гомогенатов (10-20 мкг). Реакцию завершали быстрой фильтрацией через предварительно смоченные (0,5% полиэтиленамин) фильтры с использованием харвестера 48R Cell Brandel(Gaithersburg, MD). Затем фильтры промывали в течение 5 с охлажденным льдом буфером (50 мМ Трис НСl, рН = 7,4 при 4 С), сушили и помещали в пробирки, содержащие 2,5 мл ReadiSafe (Beckman, Fullerton, CA), и радиоактивность измеряли с использованием счетчика жидкостной сцинцилляции Beckman LS 5000TA. Эффективность подсчета [3 Н]5-НТ была в среднем между 45-50%. Данные связывания анализировали с помощью компьютера нелинейным регрессивным анализом (Accufit and Accucomp.IC50 превращали в величины Ki, с использованием уравнения Cheng-Prusoff (Biochem. Pharmacol., 22, 3099-3108 (1973). Все эксперименты проводили с тройным повтором. Все приведенные в качестве примеров соединения изобретения имели IC50 у рецептора 5-HT1F, по меньшей мере, 5 мкмоль. Как сообщалось R.L. Weinshank, et al., WО 93/14201, рецептор 5-HT1F функционально связывается с G-белком, что измерено посредством способности серотонина или серотонергических лекарственных средств ингибировать стимулированное форсколином продуцирование цАМФ в NIН 3 Т 3-клетках, трансфекцированных рецептором 5-HT1F. Активность аденилатциклазы определяли с использованием стандартных методик. Максимальный эффект достигается серотонином. Еmах определяют делением ингибирования испытуемого соединения на максимальный эффект и определением процентного ингибирования. (N. Adham. et al., supra,; R.L.(Вmах, оцененный при изучении конкуренции в одной точке = 488 фмоль/мг белка) инкубировали в DMEM (модифицированная по способу Дульбекко среда Игла), 5 мМ теофиллина, 10 мМ ГЕПЕС (4-[2-гидроксиэтил]-1-пиперазинэтансульфоновая кислота) и 10 мкМ паргилина в течение 20 мин при 37 С, 5% CO2. Кривые зависимости доза лекарственного средстваэффект затем получали добавлением 6 разных конечных концентраций лекарственного средства с последующим незамедлительным добавлением форсколина (10 мкМ). Затем клетки инкубировали в течение дополнительных 10 мин при 37 С, 5% СО 2. Среду отсасывали и реакцию останавливали добавлением 100 мМ НСl. Для демонстрации конкурентного антагонизма параллельно измеряли для 5-НТ кривую доза-реакция,используя фиксированную дозу метиотепина(0,32 мкМ). Планшеты сохраняли при 4 С в течение 15 мин и затем центрифугировали в течение 5 мин при 500 г для осаждения клеточного дебриса и из супернатанта брали аликвотные пробы и сохраняли при -20 С до оценки образования цАМФ радиоиммуноанализом (набор для радиоиммуноанализа цАМФ; Advanced Magnetics, Cambridge, МА). Радиоактивность количественно определяли с использованием автоматического гамма-счетчика Packard COBRA,снабженного программным обеспечением со сжатием данных. Открытие, что боль, связанная с мигренью и ассоциированными нарушениями, ингибируется агонистами рецептора 5-HT1F, требовало анализа данных различных анализов фармакологической активности. Чтобы установить, что подтип рецептора 5-НТ 1F ответственен за медиирование нейрогенной менингеальной экстравазации, которая ведет к боли мигрени, сначала с использованием стандартных методик измеряли аффинность связывания набора соединений к рецепторам серотонина. Например,способность соединения связываться с подтипом рецептора 5-HT1F определяли, как описано выше. Для целей сравнения определяли также аффинности связывания соединений к рецепторам 5-HT1D, 5-НТ 1D, 5-HT1E и 5-HT1F, как описано выше, за исключением того, что вместо используемого здесь клона рецептора 5-HT1F использовали другие клонированные рецепторы. Тот же самый набор затем испытывали в анализе цАМФ для определения их агонистического или антагонистического характера. Наконец, измеряли способность этих соединений ингибировать нейрональную белковую экстравазацию, функциональный анализ боли при мигрени. 44 Набор соединений, использованных в этом изучении, представляет собой определенные структурные классы соединений, которые, как было показано, проявляют широкий диапазон аффинностей к анализированным рецепторам серотонина. Дополнительно было показано, что соединения данного набора обладают также широким диапазоном эффективности в анализе нейрональной белковой экстравазации. Набор соединений, выбранных для этого изучения,описывается ниже. Соединение I Бутан-1,4-диоат 3-[2-(диметиламино)этил]-Nметил-1 Н-индол-5-метансульфонамида (1:1) Сукцинат суматриптана коммерчески доступен как Imitrex, или его можно получить,как описывается в патенте Соединенных Штатов Америки 5 037 845, выданном 6 августа 1991 г., который включен здесь в качестве ссылки. Соединение II Гидрохлорид 5-фтор-3-(1-(2-(1-метил-1 Нпиразол-4-ил)этил)-4-пиперидинил)-1 Н-индола Соединения II-V описываются в патенте Соединенных Штатов Америки 5 521 196,выданном 28 мая 1966 г., который включен здесь в качестве ссылки во всей его полноте. Анализы связывания. Аффинность связывания соединений для различных рецепторов серотонина определяли по существу так, как описано выше, за исключением того, что вместо используемого здесь клона рецепторов 5-HT1F применяли другие клонированные рецепторы. Результаты этих экспериментов по связыванию суммируются в табл. II. Таблица II Связывание с подтипами рецептора (5-HT1) серотонина (Ki нМ) Соединение 5-HT1D 5-НТ 1D Образование цАМФ. Все соединения данного набора испытывали в анализе образования цАМФ, описанном выше, было обнаружено, что все они являются агонистами рецептора 5-HT1F. Белковая экстравазация. Крыс Harlan Sprague-Dawley (225-325 г) или морских свинок из Charles River Laboratories(225-325 г) анестезировали внутрибрюшинно пентобарбиталом натрия (65 или 45 мг/кг соответственно) и помещали в стереотаксическую раму (David Kopf Instruments) с набором резцов 3,5 мм для крыс или 4,0 мм для морских свинок. После сагиттального рассечения скальпа по средней линии через череп просверливали две пары билатеральных отверстий (6 мм заднее отверстие, 2,0 и 4,0 мм боковые отверстия у крыс; 4 мм заднее отверстие и 3,2 и 5,2 мм боковые отверстия у морских свинок, все координаты указываются относительно брегмы). Пары стимулирующих электродов из нержавеющей стали (Rhodes Medical Systems, Inc.) были опущены через отверстия в обоих полушариях на глубину 9 мм (крысы) или 10,5 мм (морские свинки) от твердой мозговой оболочки. Бедренную вену обнажали и внутривенно инъецировали дозу испытуемого соединения (1 мл/кг). Приблизительно через 7 мин внутривенно инъецировали дозу 50 мг/кг синего Evans,флуоресцентного красителя. Синий Evans обра 46 зовывал комплекс с белками в крови и действовал в качестве маркера для белковой экстравазации. Точно через 10 мин после инъекции испытуемого соединения левый ганглий тройничного нерва стимулировали в течение 3 мин при силе тока 1,0 мА (5 Гц, продолжительность 4 мс) системой потенциостат/гальваностат Model 273(EGG Princeton Applied Research). Через 15 мин после стимуляции животных умерщвляли и обескровливали 20 мл физиологического раствора. Верх черепа удаляли для облегчения сбора дуральных мембран. Мембранные образцы отбирали из обоих полушарий, промывали водой и ровно распределяли на предметных стеклах микроскопа. После высушивания ткани покрывали 70% раствором глицерин/вода. Флуоресцентный микроскоп(Цейсс),снабженный дифракционным монохроматором и спектрофотометром, использовали для количественного определения синего красителяEvans в каждой пробе. Использовали длину волны возбуждения приблизительно 535 нм и определяли интенсивность излучения у 600 нм. Микроскоп снабжали моторизированным столиком и соединяли также с персональным компьютером. Это облегчало контролируемое компьютером движение столика с флуоресцентными измерениями у 25 точек (шаги 500 мкм) на каждый дуральный образец. Среднее и стандартное отклонение измерений определяли при помощи компьютера. Экстравазация, индуцированная электрической стимуляцией ганглия тройничного нерва,была ипсилатеральным эффектом (т.е. имеет место только на стороне твердой мозговой оболочки, в которой стимулировали ганглий тройничного нерва). Это позволяло использовать другую (нестимулированную) половину твердой мозговой оболочки в качестве контроля. Вычисляли отношение количества экстравазации в твердой мозговой оболочке из стимулированной стороны к нестимулированной стороне твердой мозговой оболочки. Контроли с физиологическим раствором давали отношение приблизительно 2,0 у крыс и 1,8 у морских свинок. В противоположность этому, соединение, которое эффективно предотвращает экстравазацию в твердой мозговой оболочке из стимулированной стороны, будет иметь отношение приблизительно 1,0. Получали кривую зависимости доза-реакция, и аппроксимировали дозу, которая ингибировала экстравазацию на 50% (ID50). Эти данные приводятся в табл. III. Таблица III Ингибирование белковой экстравазации (ID50,ммоль/кг) Для определения связи между связыванием у различных рецепторов серотонина и ингибированием нейрональной белковой экстравазации аффинность связывания всех соединений к каждому из рецепторов 5-HT1D, 5-НТ 1D, 5-HT1E и 5-HT1F наносили на графике против их ID50 в модели белковой экстравазации. Линейный регрессионный анализ проводили для каждого набора данных и вычисляли фактор корреляцииR2. Результаты этого анализа суммируются в табл. IV. Таблица IV Зависимость фактора корреляции (R2) для аффинности специфического связывания подтипа 5-HT1 от ингибирования белковой экстравазации Подтип 5-HT1 Фактор корреляции (R2) 0,07 5-НТ 1D 0,001 5-HT1D 5-HT1E 0,31 5-HT1F 0,94 Идеальная линейная связь генерировала бы фактор корреляции 1,0, что свидетельствует о связи (причина и эффект) между двумя переменными. Экспериментально определенный фактор корреляции между ингибированием нейрональной белковой экстравазации и аффинностью связывания 5-HT1F составляет 0,94. Эта почти идеальная зависимость ID50 в модели белковой экстравазации от аффинности связывания к рецептору 5-HT1F отчетливо показывает,что рецептор 5-HT1F медиирует ингибирование белковой экстравазации, являющейся результатом стимуляции ганглий тройничного нерва. Суматриптан проявляет слабую биологическую доступность и относительно короткую продолжительность действия. Его сродство для ряда подтипов рецептора серотонина вызывает нежелательное побочное действие, особенно вазоконстрикцию, которое серьезно ограничивает его использование при лечении мигрени. Однако соединения данного изобретения обладают высокой биологической доступностью при введении несколькими путями, включая, но не ограничиваясь ими, пероральный, буккальный,внутривенный, подкожный и ректальный. Они проявляют быстрое начало действия и долговременное действие, обычно требуя только одну дозу на день для поддержания терапевтического уровня. Так как соединения этого изобретения являются сильными агонистами рецептора 5HT1F, для поддержания терапевтических уровней требуются крайне низкие дозы. Кроме того,из-за высокой селективности соединений этого изобретения для рецептора 5-HT1F, удается избежать осложнений из-за вазоконстрикции. Со 48 единения этого изобретения ингибируют также белковую экстравазацию, если их вводят до или после стимуляции ганглий тройничного нерва. Как таковые, их можно либо вводить профилактически для предотвращения приступа мигрени,либо вводить до или во время приступа мигрени для облегчения боли. Хотя соединение, используемое в способах данного изобретения, можно вводить непосредственно, без приготовления любой готовой препаративной формы, соединения обычно вводят в виде фармацевтических композиций, содержащих фармацевтически приемлемый наполнитель и, по меньшей мере, один активный ингредиент. Эти композиции можно вводить различными путями, включая пероральный, ректальный, чрескожный, подкожный, внутривенный,внутримышечный и внутриносовой. Многие соединения, применяемые в способах этого изобретения, эффективны в качестве как инъецируемых, так и пероральных композиций. Такие композиции получают методикой, хорошо известной в фармацевтической области, они содержат, по меньшей мере, одно активное соединение. См., например, REMINGTON'S PHARMACEUTICAL SCIENCES (16th ed. 1980). При получении композиций, используемых в данном изобретении, активный ингредиент обычно смешивают с наполнителем, разбавляют наполнителем или заключают в такой носитель, который может быть в форме капсулы,саше, бумаги или другого контейнера. Когда наполнитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует в качестве наполнителя, носителя или среды для активного ингредиента. Таким образом, композиции могут быть в виде таблеток, пилюль, порошков, лепешек, саше, крахмальных облаток, эликсиров,суспензий, эмульсий, растворов, сиропов, аэрозолей (твердых или в жидкой среде), мазей, содержащих, например, до 10% по массе активного соединения, мягких и твердых желатиновых капсул, суппозиторий, стерильных инъецируемых растворов или стерильных упакованных порошков. При получении готовой препаративной формы может быть необходимо размолоть активное соединение, чтобы обеспечить подходящий размер частиц, до смешивания с другими ингредиентами. Если активное соединение по существу нерастворимо, его обычно размалывают до размера частиц меньше, чем 200 меш. Если активное соединение по существу водорастворимо, размер частиц обычно регулируют разламыванием, чтобы обеспечить по существу однородное распределение его в готовой препаративной форме, например, около 40 меш. Некоторые примеры подходящих наполнителей включают лактозу, декстрозу, сахарозу,сорбит, маннит, крахмалы, аравийскую камедь,фосфат кальция, альгинаты, трагакант, желатин, 49 силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Готовые препаративные формы могут дополнительно включать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты, такие как метил- и пропилгидроксибензоаты; подслащивающие агенты и ароматические агенты. Композиции изобретения могут быть изготовлены так, чтобы обеспечить быстрое, пролонгированное или замедленное высвобождение активного ингредиента после введения пациенту, с использованием методик, известных в данной области. Композиции предпочтительно изготовляют в виде стандартных лекарственных форм,причем каждая доза содержит от около 0,05 до около 100 мг, более обычно от около 1,0 до около 30 мг, активного ингредиента. Термин стандартная лекарственная форма относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов-людей и других млекопитающих, причем каждая единица содержит предварительно определенное количество активного компонента, вычисленное для обеспечения желаемого терапевтического действия, в ассоциации с подходящим фармацевтическим наполнителем. Активные соединения обычно эффективны в широком диапазоне доз. Например, дневная доза обычно попадает в диапазон от около 0,01 до около 30 мг/кг массы тела. При лечении взрослых людей особенно предпочтителен диапазон от около 0,1 до около 15 мг/кг/день в одной или разделенной дозе. Однако следует учесть, что количество фактически введенного соединения будет определяться врачом в свете уместных обстоятельств, включая состояние,которое нужно лечить, выбранного пути введения, конкретного вводимого соединения или соединений, возраста, массы и ответной реакции отдельного пациента и серьезности симптомов у пациента, и поэтому указанные выше диапазоны доз никоим образом не предназначаются для ограничения объема изобретения. В некоторых случаях уровни доз ниже нижнего предела вышеуказанного диапазона, могут быть более чем достаточны, в то же время в других случаях еще более высокие дозы можно использовать без вызывания любого вредного побочного действия, при условии, что такие более высокие дозы сначала делят на несколько меньших доз для введения на протяжении дня. Пример 1 готовой препаративной формы. Получают твердые желатиновые капсулы,содержащие следующие ингредиенты: Ингредиент Соединение примера 24 Крахмал Стеарат магния 50 Вышеуказанные ингредиенты смешивают и помещают в твердые желатиновые капсулы в количестве 340 мг. Пример 2 готовой препаративной формы. Готовую препаративную форму в виде таблетки получают с использованием приведенных ниже ингредиентов: Ингредиент Соединение примера 25 Целлюлоза микрокристаллическая Коллоидальный диоксид кремния Стеариновая кислота Компоненты смешивают и прессуют для образования таблеток, причем каждая весит 240 мг. Другая предпочтительная готовая препаративная форма, используемая в способах данного изобретения, использует устройства для чрескожной доставки (пластыри). Такие чрескожные пластыри можно использовать для обеспечения непрерывной или периодической инфузии соединений данного изобретения в регулируемых количествах. Конструкция и использование чрескожных пластырей для доставки фармацевтических агентов хорошо известна в данной области. См., например, патент США 5 023 252, выданный 11 июня 1991 г., включенный здесь в качестве ссылки. Такие пластыри можно конструировать для непрерывной, пульсирующей или требуемой доставки фармацевтических средств. Часто бывает желательно или необходимо вводить фармацевтическую композицию в головной мозг, либо прямым, либо непрямым путем. Методики прямого введения обычно включают помещение катетера для доставки лекарственного средства в вентрикулярную систему хозяина для обхода гематоэнцефалического барьера. Одна такая имплантируемая система доставки, используемая для переноса биологических факторов в определенные анатомические области тела, описывается в патенте США 5 011 472, выданном 30 апреля 1991 г., который включен здесь в качестве ссылки. Методы непрямого введения, которые,главным образом, предпочтительны, обычно включают изготовление композиций с латентными лекарственными средствами, получаемыми путем преобразования гидрофильных лекарственных средств в растворимые в липидах лекарственные средства или пролекарства. Латентное состояние обычно достигается посредством блокирования гидрокси, карбонильных,сульфатных и первичных аминогрупп, которые имеются в структуре лекарственного средства,чтобы сделать лекарственное средство более растворимым в липидах и поддающимся переносу через гематоэнцефалический барьер. Альтернативно, доставку гидрофильных лекарственных средств можно повысить внутриартери 51 альной инфузией гипертонических растворов,которые могут временно открывать гематоэнцефалический барьер. Тип готовой препаративнoй формы, используемой для введения соединений, используемых в способах данного изобретения, может определяться конкретными используемыми соединениями, типом фармакокинетического профиля, зависимого от пути введения и соединения(й), и состоянием пациента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR7 представляет С 1-С 6-алкил, фенил или фенил, монозамещенный галогеном или С 1-С 4 алкилом;R10 представляет С 1-С 6-алкил, фенил или фенил, монозамещенный галогеном или С 1-С 4 алкилом;m равно 1 и его фармацевтически приемлемые соли. 2. Соединение по п.1, где Х представляет-NHC(O)R3. 3. Соединение по п.2, где R3 выбирают из группы, состоящей из фенила, замещенного фенила или гетероцикла.-NHR8. 6. Способ повышения активации рецептора 5-HT1F у млекопитающего, включающий введение млекопитающему, нуждающемуся в такой активации, эффективного количества соединения по п.1. 7. Способ по п.6, где млекопитающим является человек. 8. Фармацевтическая препаративная форма, содержащая эффективное количество соединения формулыR7 представляет С 1-С 6-алкил, фенил или фенил, монозамещенный галогеном или С 1-С 4 алкилом;R10 представляет С 1-С 6-алкил, фенил или фенил, монозамещенный галогеном или С 1-С 4 алкилом;m равно 1 и его фармацевтически приемлемых солей в сочетании с подходящим фармацевтическим носителем, разбавителем или наполнителем.
МПК / Метки
МПК: A61K 31/343, A61P 25/00, C07D 307/91
Метки: тетрагидро-2-дибензофуранамины, 1,2,3,4, замещенные
Код ссылки
<a href="https://eas.patents.su/27-1912-zameshhennye-1234-tetragidro-2-dibenzofuranaminy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 1,2,3,4 -тетрагидро-2-дибензофуранамины</a>
Предыдущий патент: Способы увеличения продуцирования окиси азота.
Следующий патент: Фармацевтические соединения
Случайный патент: Элемент кровельного покрытия































