Микрокапсулы с замедленным высвобождением, основанные на сополимере лактида и гликолида, включающие полипептид и сахар
Номер патента: 11584
Опубликовано: 28.04.2009
Авторы: Локенсгард Дэвид М., Кумар Раджеш, Костантино Генри Р., Кристенсон Трой, Рики Майкл Э., Онг Джон Т.Х., Файнман Марк, Хотц Джойс М., Смит Кристин, Йеох Тин И., Райт Стивен Дж.
Формула / Реферат
1. Композиция для замедленного высвобождения биологически активного полипептида, состоящая из биосовместимого полимера, биологически активного полипептида и сахара, в которой общий объем пор составляет примерно 0,1 мл/г или менее, как это определено с использованием метода ртутной интрузионной порометрии, чтобы обеспечить профиль высвобождения, имеющий соотношение максимальной концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cmax) к средней концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее.
2. Композиция с замедленным высвобождением по п.1, в которой биологически активный полипептид представляет собой пептид с глюкорегуляторным действием, выбранный из группы, состоящей из глюкагона, глюкагонподобных пептидов, эксендинов и агонистов глюкагонподобных пептидов.
3. Композиция с замедленным высвобождением по п.2, в которой пептид с глюкорегуляторным действием выбирают из GLP-1, GLP-2, эксендина-3, эксендина-4 или их сочетания.
4. Композиция с замедленным высвобождением по п.3, в которой биологически активный полипептид присутствует в количестве от примерно 0,1 до примерно 10 мас.% от общей массы композиции с замедленным высвобождением.
5. Композиция с замедленным высвобождением по п.4, в которой биологически активный полипептид присутствует в количестве от примерно 0,5 до примерно 5 мас.% от общей массы композиции с замедленным высвобождением.
6. Композиция с замедленным высвобождением по п.5, в которой сахар присутствует в количестве от примерно 0,01 до примерно 10 мас.% от общей массы композиции с замедленным высвобождением.
7. Композиция с замедленным высвобождением по п.6, в которой сахар присутствует в количестве от примерно 0,1 до примерно 5 мас.% от общей массы композиции с замедленным высвобождением.
8. Композиция с замедленным высвобождением по п.7, в которой сахар выбирают из моносахарида, дисахарида, сахарного спирта или их сочетания.
9. Композиция с замедленным высвобождением по п.8, в которой сахар выбирают из сахарозы, маннита и их сочетания.
10. Композиция с замедленным высвобождением по п.8, в которой биосовместимый полимер выбирают из группы, состоящей из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот, поликапролактона, поликарбонатов, полиэфирамидов, полиангидридов, полиаминокислот, полиортоэфиров, полицианоакрилатов, поли-п-диоксанона, полиалкиленоксалатов, биоразлагаемых полиуретанов, их смесей и их сополимеров.
11. Композиция с замедленным высвобождением по п.10, в которой биосовместимый полимер включает сополимер лактида и гликолида.
12. Композиция с замедленным высвобождением по п.11, в которой биосовместимый полимер представляет собой 50:50 сополимер лактида и гликолида.
13. Композиция с замедленным высвобождением по п.12, в которой биосовместимый полимер имеет присущую ему вязкость от примерно 0,3 до 0,5 дл/г.
14. Композиция с замедленным высвобождением биологически активного полипептида, включающая биосовместимый полимер, содержит диспергированный в ней биологически активный полипептид в количестве примерно от 0,5 до примерно 5 мас.% от массы композиции и диспергированную в ней сахарозу в количестве примерно 2 мас.% от массы композиции.
15. Композиция с замедленным высвобождением по п.14, в которой биологически активный полипептид представляет собой эксендин-4.
16. Композиция с замедленным высвобождением по п.15, в которой биологически активный полипептид диспергирован в количестве примерно 5 мас.% от массы композиции.
17. Композиция с замедленным высвобождением по п.14, в которой композиция состоит, по существу, из биосовместимого полимера, диспергированного эксендина-4 в количестве примерно 5 мас.% и диспергированной сахарозы примерно в количестве 2 мас.% по массе композиции.
18. Композиция с замедленным высвобождением по п.16 или 17, в которой биосовместимый полимер выбирают из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот и их смесей и сополимеров.
19. Композиция с замедленным высвобождением по п.18, в которой биосовместимый полимер включает сополимер лактида и гликолида.
20. Композиция с замедленным высвобождением по п.19, в которой биосовместимый полимер представляет собой 50:50 сополимер лактида и гликолида.
21. Композиция с замедленным высвобождением по п.18, в которой профиль высвобождения композиции имеет соотношение максимальной концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cmax) к средней концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее.
22. Композиция с замедленным высвобождением эксендина-4, включающая биосовместимый полимер, содержит диспергированные в ней эксендин-4 в количестве примерно от 3 до примерно 5 мас.% от массы композиции и диспергированную в ней сахарозу в количестве примерно 2 мас.% от массы композиции.
23. Композиция с замедленным высвобождением по п.22, в которой эксендин-4 диспергирован в количестве примерно 5 мас.% от массы композиции.
24. Применение композиции с замедленным высвобождением эксендина-4, включающей биосовместимый полимер, эксендин-4 и сахарозу, в которой общий объем пор составляет примерно 0,1 мл/г или менее, как это определено с использованием метода ртутной интрузионной порометрии, чтобы обеспечить профиль высвобождения, имеющий соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) к средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее, в производстве лекарственного средства для лечения диабета 2 типа.
25. Применение по п.24, в котором биосовместимый полимер выбирают из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот и их смесей и сополимеров.
26. Применение композиции с замедленным высвобождением эксендина-4, включающей биосовместимый полимер с диспергированным в ней эксендин-4 в количестве примерно от 0,5 до примерно
5 мас.% от массы композиции и диспергированной в ней сахарозой в количестве примерно 2 мас.% от массы композиции, в производстве лекарственного средства для лечения диабета 2 типа.
27. Применение по п.26, в котором эксендин-4 диспергирован в количестве примерно 5 мас.% от массы композиции.
28. Способ получения композиции с замедленным высвобождением полипептида, включающий стадии:
а) получения смеси путем объединения водной фазы, включающей водорастворимый полипептид и сахар, с масляной фазой, включающей биосовместимый полимер и растворитель для полимера;
b) получения эмульсии типа вода-в-масле из смеси, полученной на стадии а);
c) добавления агента коацервации к смеси с получением зародышевых микрочастиц, где агент коацервации представляет собой силиконовое масло, добавляемое в количестве, достаточном для достижения соотношения силиконового масла и растворителя для полимера от примерно 1:1 до примерно 1,5:1;
d) переноса зародышевых микрочастиц к растворителю для гашения для отверждения микрочастиц;
e) сбора отвержденных микрочастиц и
f) сушки отвержденных микрочастиц.
29. Способ по п.28, в котором соотношение силиконового масла и растворителя полимера составляет 1,5:1.
30. Способ по п.28, в котором полимер присутствует в масляной фазе в концентрации примерно 10% мас./об. или менее.
31. Способ по п.28, в котором указанный полимер выбирают из группы, состоящей из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот и их смесей и сополимеров.
32. Способ по п.28, в котором полипептид выбирают из группы, состоящей шч глюкагона, глюкагонподобных пептидов, эксендинов и агонистов глюкагонподобных пептидов.
33. Композиция с замедленным высвобождением по любому из пп.1-23, которая находится в форме микрочастиц.
34. Инъецируемая композиция, пригодная для прохождения через иглу, включающая:
(a) композицию с замедленным высвобождением по любому из пп.1-23 и
(b) водную среду для инъекций.
35. Инъецируемая композиция, пригодная для прохождения через иглу, включающая:
(a) композицию с замедленным высвобождением по п.33 и
(b) водную среду для инъекций.
36. Инъецируемая композиция по п.34 или 35, в которой водная среда для инъекций имеет вязкость по меньшей мере 20 сП при 20шС.
37. Инъецируемая композиция по п.34 или 35, в которой водная среда для инъекций имеет вязкость от более чем 50 сП при 20шС до менее чем 60 сП при 20шС.
38. Инъецируемая композиция по п.35, в которой микрочастицы суспендированы в водной среде для инъекций в концентрации более чем 30 мг/мл в форме суспензии, имеющей жидкую фазу, и в которой жидкая фаза суспензии имеет вязкость по меньшей мере 20 сП при 20шС.
39. Инъецируемая композиция по п.34 или 35, дополнительно содержащая по меньшей мере один повышающий вязкость агент, повышающий плотность агент, повышающий концентрацию агент и увлажняющий агент.
40. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром от примерно 23 размера до примерно 18 размера.
41. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром от примерно 25 размера до примерно 18 размера.
42. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром примерно 23 размера, где водная среда для инъекций содержит натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об., Полисорбат 20 0,1% об./об. и воду.
43. Инъецируемая композиция по п.42, дополнительно содержит буфер.
44. Инъецируемая композиция по п.35, которая пригодна для прохождения через иглу диаметром от примерно 23 размера до примерно 18 размера, где средний размер частиц у микрочастиц составляет от примерно 50 до примерно 100 мкм.
45. Инъецируемая композиция по п.35, которая пригодна для прохождения через иглу диаметром от примерно 25 размера до примерно 18 размера, где средний размер частиц у микрочастиц составляет от примерно 50 до примерно 100 мкм.
46. Инъецируемая композиция, пригодная для прохождения через иглу 25 размера, включающая композицию с замедленным высвобождением, содержащую 50:50 DL PLG 4А полимера, примерно 3-5 мас.% эксендина-4 и примерно 2 мас.% сахарозы, где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее и где общий объем пор в композиции составляет примерно 0,1 мл/г или менее, суспендированную в среде для инъекций, включающей натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об. и Полисорбат 20 0,1% об./об. в воде.
47. Набор для получения инъецируемой композиции, пригодной для прохождения через иглу 25 размера, включающий:
(а) флакон, содержащий терапевтически эффективную дозу сухой композиции с замедленным высвобождением, которая содержит 50:50 DL PLGA 4A полимера, примерно 3-5 мас.% эксендина-4 и примерно 2 мас.% сахарозы, где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее, и где общий объем пор в композиции составляет примерно 0,1 мл/г или менее; и
(b) флакон, содержащий среду для инъекций, которая включает натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об. и Полисорбат 20 0,1% об./об. в воде, где имеется достаточное количество среды для инъекции, с тем чтобы суспендировать композицию с замедленным высвобождением в концентрации по меньшей мере 30 мг/мл.
48. Способ получения фармацевтически приемлемой композиции с замедленным высвобождением эксендина-4, включающий:
a) получение смеси путем объединения водной фазы, включающей водорастворимый полипептид эксендин-4 и сахарозу, в отсутствие сульфата аммония, с масляной фазой, включающей очищенный 50:50 DL PLG 4A полимер в метиленхлориде; где очищенный полимер обладает вязкостью примерно от 0,3 до 0,5 дл/г;
b) получение эмульсии типа вода-в-масле из смеси, полученной на стадии а), где размер капель во внутренней эмульсии составляет примерно от 0,2 до 0,4 мкм;
c) добавление агента коацервации к смеси с получением зародышевых микрочастиц, где агент коацервации представляет собой силиконовое масло, добавляемое в количестве, достаточном для достижения соотношения силиконового масла к растворителю для полимера от примерно 1:1 до примерно 1,5:1, и где силиконовое масло добавляют к эмульсии типа вода-в-масле в течение примерно менее 3 мин, и смесь для коацервации выдерживают в течение примерно 1 мин или менее;
d) перенос зародышевых микрочастиц к растворителю для гашения в соотношении растворителя для гашения и метиленхлорида, равном 16:1 об./об., для отверждения микрочастиц, где растворитель для гашения представляет собой смесь гептан/этанол и время переноса составляет примерно 3 мин или менее;
e) сбор отвержденных микрочастиц и
f) сушку отвержденных микрочастиц;
где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее и где общий объем пор в композиции составляет примерно 0,1 мл/г или менее.
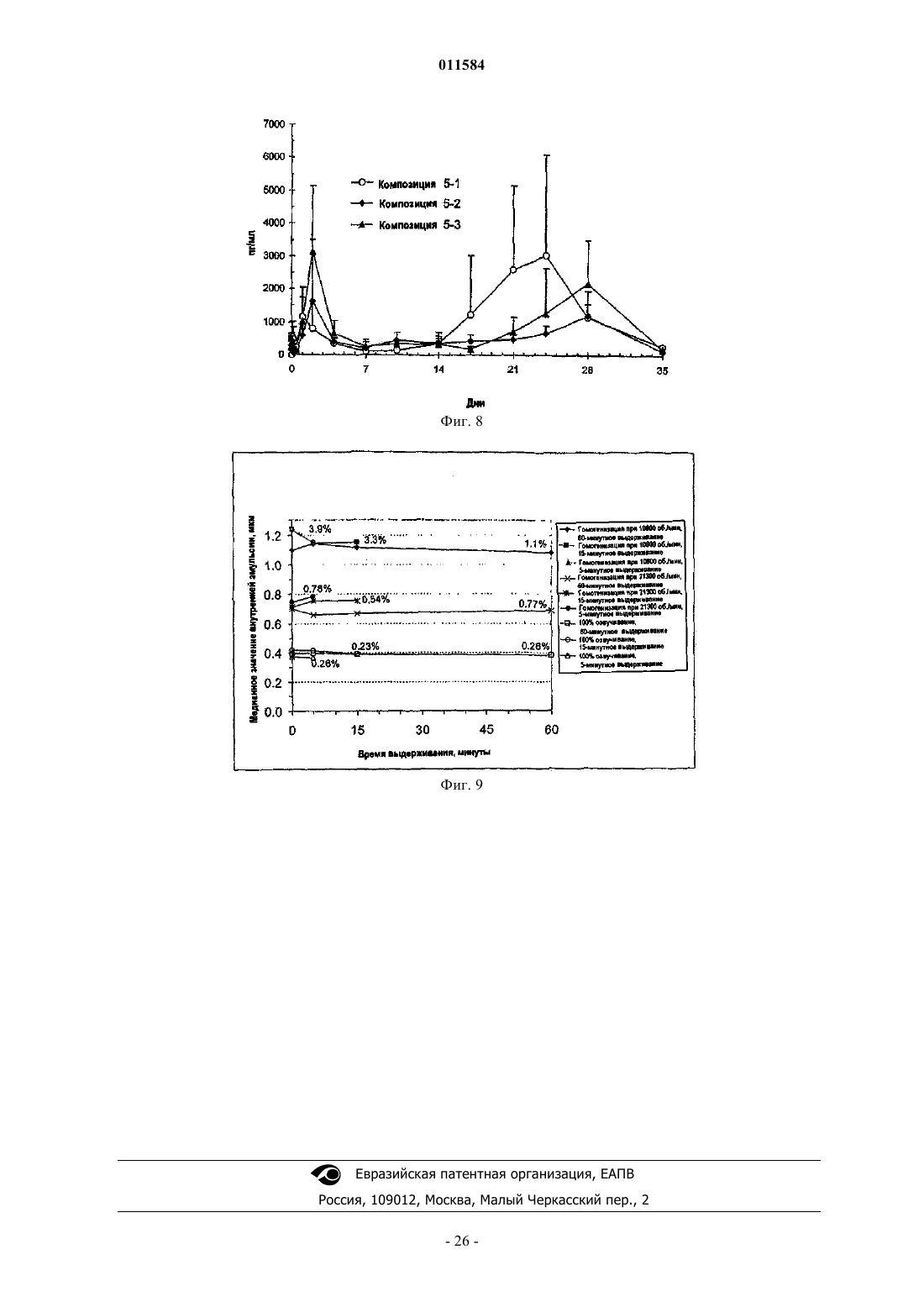
Текст
011584 Родственная(ые) заявка(и) Заявка на данный патент подтверждает преимущества предварительной заявки на патент США 60/563245, поданной 15 апреля 2004 г., и USSN, поданнойапреля 2005 г. (экспресс-почта EV 57190029 US), озаглавленной Устройство для замедленного высвобождения на основе полимеров, дело патентного поверенного 1733.2056 US1, авторами которой являются Steven G. Wright, Troy Christensen, Thean Yeoh, Michael Rickey, Joyce Hotz, Rajesh Kumar и Henry R. Costantino. Полное описание указанных заявок включено в настоящий документ в качестве ссылки. Предпосылки создания изобретения Большое число белков и пептидов, в совокупности обозначаемых в настоящем описании как полипептиды, демонстрируют биологическую активность in vivo при их использовании в качестве лекарственных средств. Многие заболевания или определенные состояния здоровья требуют введения лекарственного средства с замедленным высвобождением для достижения наиболее эффективного профилактического и/или терапевтического действия. Для поддержания в организме в течение длительного периода времени нужных уровней таких средств в основном требуется введение биологически активных полипептидов путем неоднократных подкожных инъекций, которые зачастую приводят к колебаниям уровней лекарственного средства и, кроме того, это приводит к несоблюдению пациентом режима введения лекарственного средства. В качестве альтернативной системы доставки с замедленным высвобождением может рассматриваться использование биоразлагаемых материалов, таких как полимеры с инкапсулированным лекарственным средством. Использование биоразлагаемых полимеров, например, в форме микрочастиц или микроносителей может обеспечить замедленное высвобождение лекарственного средства за счет использования свойственной полимеру способности к биологическому разложению, что позволяет контролировать высвобождение лекарственного средства, обеспечивает более стабильный, замедленный уровень в организме лекарственного средства и делает такой режим доставки более удобным для пациента. Однако известно, что такие устройства для замедленного высвобождения могут зачастую приводить к высоким первоначальным выбросам в организме лекарственного средства и с минимальным высвобождением впоследствии, что выводит достигаемый в сыворотке крови уровень лекарственного средства за пределы терапевтического окна и/или сказывается на плохой биологической доступности лекарственного средства. Кроме того, присутствие полимера, физиологический диапазон температур и ответ организма на композицию с замедленным высвобождением могут вызывать изменения лекарственного средства (например, его деградацию, агрегацию), что мешает достижению желательного профиля высвобождения лекарственного средства. Кроме того, способы, используемые для создания композиций с замедленным высвобождением, могут приводить к потере активности лекарственного средства из-за нестабильности такого лекарственного средства и к эффектам деградации на последующих стадиях обработки. Деградация представляет особенно серьезную проблему в случае использования полипептида в качестве лекарственного средства. В этой связи, имеется потребность в системах для введения биологически активных полипептидов в замедленном режиме, так чтобы количество доставляемого полипептида находилось в диапазоне терапевтических уровней и сохранялись их активность и эффективность в течение желательного периода высвобождения. Несмотря на то, что к настоящему времени проведено много работ, направленных на решение данной проблемы, все еще имеется потребность в новых подходах. Краткое описание сущности изобретения Настоящее изобретение относится к открытию того факта, что высокие профили высвобождения(такие как профили, характеризующиеся соотношением Cmax к Cave, равным примерно 3 или менее) могут быть достигнуты с использованием композиции, содержащей несколько компонентов, за счет контроля соотношения агента-коацервата к полимерному растворителю, такого как соотношение силиконового масла к полимерному растворителю, в процессе производства, что позволяет достигнуть низкой пористости. Далее было обнаружено, что такой нужный профиль желательного высвобождения может быть достигнут за счет контроля процесса коацервации, например, путем контроля длительности стадии добавления агента, способствующего коацервации, такого как силиконовое масло, длительности периода выдерживания после добавления и длительности процесса перехода к стадии добавления гасящего агента. Было также показано, что такая желательная низкая пористость композиций с замедленным высвобождением, таких как микрочастицы, может быть достигнута за счет контроля размера капель во внутренней эмульсии. Далее было обнаружено, что контроль размера частиц и распределения частиц по размеру также обеспечивает хорошие профили желательного высвобождения (такие как соотношение Cmax к Cave,равное примерно 3) и более постоянный профиль высвобождения от серии к серии. Настоящее изобретение также относится к композициям для длительного высвобождения агентов, таких как биологически активные полипептиды, и к способам получения и использования таких композиций в режиме замедленного высвобождения биологически активных полипептидов. Композиции с замедленным высвобождением по настоящему изобретению включают биосовместимый полимер, агент, такой как биологически активный полипептид, и сахар. Полипептид и сахар предпочтительно диспергируют в полимере. Полипептид и сахар могут быть также диспергированы поодиночке, или предпочтительно они могут быть дис-1 011584 пергированы в сочетании. Композиции с замедленным высвобождением обеспечивают желательный и устойчивый профиль высвобождения. В конкретном варианте осуществления настоящего изобретения указанный профиль характеризуется соотношением Cmax к Cave, равным примерно 3 или менее. В предпочтительном варианте биологически активный полипептид представляет собой антидиабетический полипептид или полипептид, обладающий свойствами регулировать содержание глюкозы, такой как GLP-1,GLP-2, эксендин-3, эксендин-4 или их аналог, производное или агонист, предпочтительно эксендин-4. Сахар предпочтительно представляет собой сахарозу, маннит или их сочетание. Предпочтительные сочетания включают эксендин-4 и сахарозу и/или маннит. Дополнительно или альтернативно, композиция с замедленным высвобождением включает биосовместимый полимер, агент, такой как биологически активный полипептид, и сахар, где указанная композиция имеет общий объем пор, равный примерно 0,1 мл/г или менее. В конкретном варианте осуществления настоящего изобретения общий объем пор определяется с использованием порометрии, основанной на оценке ртутной интрузии. Дополнительно или альтернативно, композиция с замедленным высвобождением состоит, по существу, из биосовместимого полимера, эксендина-4 в концентрации примерно 3% мас./мас., и сахарозы в концентрации примерно 2% мас./мас. Биосовместимый полимер представляет собой предпочтительно сополимер лактида и гликолида. Настоящее изобретение также относится к способу получения композиций с замедленным высвобождением биологически активных агентов, таких как полипептиды, который включает получение смеси путем объединения жидкой фазы, включающей воду, агент, такой как водорастворимый полипептид, и сахар, с масляной фазой, включающей биосовместимый полимер и растворитель для данного полимера; формирование эмульсии типа вода-в-масле, например, путем обработки ультразвуком или гомогенизации смеси; добавление силиконового масла к смеси для образования зародышевых микрочастиц; перенос зародышевых микрочастиц к растворителю, используемому для гашения, с целью отверждения микрочастиц; сбор отвержденных микрочастиц; и сушку отвержденных микрочастиц. В конкретном варианте осуществления настоящего изобретения силиконовое масло добавляют в количестве, достаточном для достижения соотношения силиконового масла к полимерному растворителю, равного примерно 1,5:1. Дополнительно или альтернативно, полимер присутствует в масляной фазе в количестве примерно 10% вес./об. или менее. Агент или полипептид, например эксендин-4, может присутствовать в композиции, приведенной в настоящем описании, в концентрации от примерно 0,01 до примерно 10% мас./мас. от общего веса готовой композиции. Дополнительно, сахар, например сахароза, может присутствовать в концентрации от примерно 0,01 до примерно 5% мас./мас. от веса готовой композиции. Композиция по настоящему изобретению может вводиться человеку или другому животному путем инъекции, имплантации (например, подкожно, внутримышечно, внутрибрюшинно, интракраниально или внутрикожно), путем введения в слизистые оболочки (например, интраназально, интравагинально, внутрилегочно или с помощью суппозиториев) или с использованием системы доставки in situ (например, с помощью клизмы или аэрозольного спрея). В том случае, когда композиция с замедленным высвобождением содержит включенный в нее гормон, в частности, пептид антидиабетического или глюкорегуляторного действия, такой как GLP-1, GLP2, эксендин-3, эксендин-4 или их агонисты, аналоги или производные, такую композицию вводят в терапевтически эффективном количестве для лечения пациента с диабетом, нарушенной толерантностью к глюкозе (IGT), с ожирением, расстройством сердечно-сосудистой системы (CV) или с любым другим расстройством, которое может подвергаться лечению одним из указанных выше полипептидов или их производных, аналогов или агонистов. Использование сахара в композициях с замедленным высвобождением по настоящему изобретению улучшает биологическую доступность включенного в состав композиции биологически активного полипептида, например пептида с антидиабетическим или глюкорегуляторным действием, и минимизирует снижение активности из-за нестабильности и/или химических взаимодействий между полипептидом и другими компонентами, содержащимися в композиции с замедленным высвобождением или используемыми в процессе ее изготовления, при сохранении благоприятного профиля высвобождения. В одном варианте композиция по настоящему изобретению содержит активный агент эксендин-4 в концентрации примерно 5%, сахар в концентрации примерно 2% и биополимер. В другом варианте композиция содержит активный агент эксендин-4 в концентрации примерно 3%, сахар в концентрации примерно 2% и биополимер. В еще одном варианте композиция содержит полимер PLGA. В еще одном варианте композиция содержит полимер PLG 4A, который включает примерно 50 мол.% DL лактида и 50 мол.% гликолида с незащищенной свободной карбоксильной концевой группой (обозначаемой как 4 А). В еще одном варианте композицию получают в виде микрочастицы, характеризующейся показателями размера частиц, распределения частиц по размерам и общего объема пор, соответствующими показателям по настоящему описанию. В еще одном варианте общий объем пор составляет менее чем примерно 0,1 мл/г, средний размер частиц DV50 может составлять примерно 50 микрон (мкм) с распределением частиц, со сниженным пределом DV10 примерно 30 мкм, а частиц с верхним пределом DV90 при-2 011584 мерно 90 мкм. В еще одном варианте микрочастицы формируют, получают или они могут быть получены в соответствии с приведенными в описании процессами. В одном таком варианте указанный способ представляет собой процесс, протекающий в водной/масляной/масляной среде (в/м/м), где размер частиц во внутренней эмульсии соответствует характеристикам, приведенным в настоящем описании. Кроме того, указанный способ может включать коацерват силиконового масла, соотношение которого к полимерному растворителю может характеризоваться коэффициентом от 1,5 до 1. Далее, указанный способ может включать контроль стадии коацервации в соответствии с настоящим описанием, и даже в том случае, когда имеется стадия переноса коацервата к внутренней эмульсии, она составляет 3 мин или менее,стадия выдерживания составляет примерно 1 мин или менее и стадия быстрого переноса к растворителю для гашения/отверждения длится менее примерно 3 мин. В еще одном варианте указанный растворитель представляет собой двойной растворитель, предпочтительно смесь гептана/этанола. В еще одном варианте композиции по настоящему изобретению могут быть также изготовлены с образованием формы, приемлемой для введения через иглу в организм хозяина. Инъецируемая композиция может включать описанные композиции микрочастиц в водном носителе для инъекций, характеризующемся соответствующей вязкостью. Водный носитель для инъекций может иметь вязкость, равную по меньшей мере 20 сантипуаз (сП) при температуре 20 С, и может также иметь вязкость выше чем 50 сП и менее чем 60 сП при температуре 20 С. Микрочастицы могут быть суспендированы в носителе для инъекций в концентрации выше чем примерно 30 мг/мл с образованием суспензии, при этом жидкая фаза суспензии будет иметь вязкость, равную по меньшей мере 20 сП при температуре 20 С. Композиция может также включать агент, повышающий вязкость, агент, повышающий плотность, агент, усиливающий тонизирующие свойства, и/или увлажнитель. Вязкость носителя для инъекции обеспечивает инъецируемость композиции через иглу, имеющую диаметр примерно 18-23 размера, более предпочтительно через иглу с размером примерно 18-25 и еще более предпочтительно через иглу с размером около 25. В одном варианте носитель для инъекций, подходящий для прохождения через иглу 23 размера,включает натрий-карбоксиметилцеллюлозу в количестве 3,0% вес./об., хлорид натрия в количестве 0,9% вес./об. и Полисорбат-20, НФ (Tween 20) в количестве 0,1% об./об. или необязательно в количестве 0,5%, в воде. Раствор оптимально забуферивают. В еще одном варианте описанные выше микрочастицы,содержащие эксенатид, суспендируют в носителе для инъекций, включающем натрийкарбоксиметилцеллюлозу в количестве 3,0% вес./об., хлорид натрия в количестве 0,9% вес./об. и Полисорбат-20, НФ (Tween 20) в количестве 0,1% об./об. или необязательно в количестве 0,5% в воде. В еще одном варианте концентрация суспендируемых микрочастиц с эксенатидом выше чем примерно 30 мг/мл. В типичном случае суспендируют примерно 100-200 мг сухих микрочастиц на 1 мл носителя. Преимущества композиций с замедленным высвобождением, приведенных в настоящем описании, определяются их большим удобством для приема пациентом за счет устранения необходимости повторного введения, более высоким терапевтическим эффектом, благодаря отсутствию колебаний в концентрации активного агента в крови, что обеспечивает желательный профиль высвобождения, а также потенциальным снижением общего количества биологически активного полипептида, необходимого для достижения терапевтического эффекта в случае снижения таких колебаний. В еще других вариантах, включающих композиции и соответствующие способы согласно настоящему изобретению, указанный агент представляет собой эксендин-4, включающий аминокислотное замещение лейцина на метионин в положении 14. Например, в одном варианте описывается инъецируемая композиция, подходящая для прохождения через иглу 18-23 размера, более предпочтительно через иглу 25 размера, включающая композицию с замедленным высвобождением, которая содержит DL:PLG 4A полимер (50:50), примерно 3-5% мас./мас. эксендина-4 с аминокислотным замещением лейцина на метионин в положении 14 и примерно 2% мас./мас. сахарозы, где соотношение Cmax к Cave составляет примерно 3 или менее и общий объем пор в композиции составляет примерно 0,1 мл/г или менее, где данную композицию суспендируют в носителе для инъекций, включающем натрий-карбоксиметилцеллюлозу в количестве 3,0% вес./об., хлорид натрия в количестве 0,9% вес./об. и Полисорбат-20, НФ (Tween 20) в количестве 0,1% об./об. в воде. Краткое описание рисунков На фиг. 1 показан график, демонстрирующий взаимосвязь между средним диаметром пор и высвобождением in vitro композиций с замедленным высвобождением по настоящему описанию (A.S. = сульфат аммония). На фиг. 2 показан график, демонстрирующий эффект пористости на высвобождение in vitro эксендина-4 из микрочастиц и влияние условий обработки, а именно соотношения силиконового масла к метиленхлориду, на пористость образуемых микрочастиц. На фиг. 3 А-3 В показаны сканограммы криогенных SEM для выбранных композиций из микрочастиц согласно настоящему описанию. На фиг. 4 А-4D показаны сканограммы криогенных SEM для выбранных композиций из микрочастиц согласно настоящему описанию. На фиг. 5 приведен график, показывающий зависимость % содержания остаточного этанола и метиленхлорида от Tg для композиций из микрочастиц согласно настоящему описанию. На фиг. 6 приведена репрезентативная кривая, описывающая фармакокинетические свойства (кон-3 011584 центрация, в пг/мл, в зависимости от времени, дней, со вставкой, указывающей концентрации в первый день) для композиции 2-1 (3% эксендина-4 и 2% сахарозы), композиции 1 (3% одного эксендина-4) и композиции 4 (3% эксендина-4 и 0,5% сульфата аммония). На фиг. 7 показан график, демонстрирующий профиль высвобождения in vivo для трех композиций с микрочастицами 2, 2-1 и 2-2. На фиг. 8 показан график, демонстрирующий фармакокинетические данные для композиций из микрочастиц 5-1, 5-2 и 5-3. На фиг. 9 показан график, иллюстрирующий взаимосвязь между параметрами процесса получения и внутренним размером эмульсии, достигаемым в рамках данного процесса. Подробное описание изобретения Настоящее изобретение относится к композициям с замедленным высвобождением биологически активных полипептидов и к способам получения и использования таких композиций для достижения замедленного высвобождения биологически активных полипептидов. Композиции с замедленным высвобождением по настоящему изобретению включают биосовместимый полимер и агент, такой как биологически активный полипептид, а также сахар. Агент и сахар диспергируют в биосовместимом полимере поодиночке или предпочтительно вместе. В конкретном варианте осуществления изобретения композиция с замедленным высвобождением имеет профиль высвобождения, характеризующийся соотношением максимальной концентрации в сыворотке (Cmax) к средней концентрации в сыворотке (Cave), равным примерно 3 или менее. Агент. В предпочтительном варианте осуществления настоящего изобретения агент представляет собой биологически активный полипептид, такой как полипептид антидиабетического или действия, регулирующего содержание глюкозы, включающий GLP-1, GLP-2, эксендин-3, эксендин-4 или их аналог, производное или агонист. Более конкретно, полипептид представляет собой эксендин-4. Однако использование других агентов может также быть полезно для использования в настоящем изобретении. В контексте настоящего описания биологически активные полипептиды в целом относятся к биологически активным белкам и пептидам и их фармацевтически приемлемым солям, которые имеют свойственную им молекулярную, биологически активную форму при высвобождении in vivo, что позволяет сохранять характерные для них желательные терапевтические, профилактические и/или диагностические свойства in vivo. В типичном случае полипептид имеет молекулярную массу от 500 до 200000 Дальтон(Да). Подходящие биологически активные полипептиды включают, без ограничения, глюкагон, глюкагонподобные пептиды, такие как GLP-1, GLP-2 или другие аналоги GLP, производные или агонисты глюкагонподобных пептидов, эксендины, такие как эксендин-3 и эксендин-4, их производные, агонисты и аналоги, вазоактивный интестинальный пептид (ВИП), иммуноглобулины, антитела, цитокины (например, лимфокины, монокины, хемокины), интерлейкины, факторы активации макрофагов, интерфероны, эритропоэтин, нуклеазы, фактор некроза опухоли, колониестимулирующие факторы (например, ГКСМ), инсулин, ферменты (например, супероксиддисмутаза, активатор плазминогена и т.п.), супрессоры опухоли, белки крови, гормоны и аналоги и агонисты гормонов (например, фолликулостимулирующий гормон, гормон роста, адренокортикотропный гормон и рилизинг-фактор лютеинизирующего гормона(РФЛГ, вакцины (например, опухолевые, бактериальные и вирусные антигены), антигены, факторы свертывания крови, факторы роста (NGF и EGF), гастрин, GRH, антибактериальные пептиды, такие как дефензин, энкефалин, брадикинины, кальцитонин и мутеины, аналоги, варианты с усечением, делецией и замещением, а также фармацевтически приемлемые соли указанных выше соединений. Эксендин-4 представляет полипептид из 39 аминокислот. Аминокислотная последовательность эксендина-4 описана в патенте США 5424286, выданном Eng 13 июня 1995 г., полное содержание которого включено в настоящее описание в качестве ссылки. АС 2993 и эксенатид являются синонимами термина "эксендин-4". Было показано, что эксендин-4 стимулирует у людей и животных секрецию инсулина при наличии повышенных концентраций глюкозы в крови, но не в периоды сниженных концентраций в крови (гипогликемия). Было также показано, что он подавляет секрецию глюкагона, замедляет освобождение желудка и влияет на поглощение пищи и вес тела, а также оказывает другие виды воздействия. В качестве таковых эксендин-4 и его аналоги и агонисты могут быть полезны при лечении сахарного диабета, IGT, ожирения и т.п. Количество биологически активного полипептида, который содержится в полимерной матрице в композиции с замедленным высвобождением, представляет собой терапевтически, диагностически или профилактически эффективное количество, которое может определить специалист со средним уровнем знаний в данной области с учетом ряда факторов, таких как вес тела, состояние, подлежащее лечению,тип используемого полимера и скорость высвобождения агента из полимера. Композиции с замедленным высвобождением в основном содержат от примерно 0,01% мас./мас. до примерно 50% мас./мас. агента, например, биологически активного полипептида (такого как эксендин-4)(от общего веса композиции). Например, количество биологически активного полипептида (такого как эксендин-4) может составлять от примерно 0,1% мас./мас. до примерно 30% мас./мас. от общего веса-4 011584 композиции. Количество полипептида может варьировать в зависимости от желательного эффекта, эффективности агента, требуемых уровней высвобождения и периода времени, в течение которого полипептид должен высвобождаться. Предпочтительно диапазон вносимых в композицию количеств составляет от примерно 0,1% мас./мас. до примерно 10% мас./мас., например, от 0,5% мас./мас. до примерно 5% мас./мас. Наилучшие профили высвобождения достигаются в том случае, когда агент, например эксендин-4, вносят в количестве примерно 3% мас./мас. и еще лучше, когда указанное количество составляет примерно 4 или примерно 5%. Сахар. Сахар в контексте настоящего описания представляет собой моносахарид, дисахарид или олигосахарид (от примерно 3 до примерно 10 моносахаридов) или их производное. Например, сахарные спирты моносахаридов представляет собой приемлемые производные, охватываемые определением сахара по настоящему изобретению. В этой связи, например, сахарный спирт маннит, получаемый из моносахарида маннозы, включается в определение сахара по настоящему изобретению. Приемлемые моносахариды включают, без ограничения, глюкозу, фруктозу и маннозу. Дисахарид,также в соответствии с определением по настоящему изобретению, представляет собой соединение, которое при гидролизе дает две молекулы моносахарида. Приемлемые дисахариды включают, без ограничения, сахарозу, лактозу и трегалозу. Приемлемые олигосахариды включают, без ограничения, раффинозу и акарбозу. Количество сахара, присутствующего в композиции с замедленным высвобождением, может варьировать от примерно 0,01% мас./мас. до примерно 50% мас./мас., в таком диапазоне, как от примерно 0,01% мас./мас. до примерно 10% мас./мас., в частности, от примерно 0,1% мас./мас. до примерно 5% мас./мас. от общего веса композиции с замедленным высвобождением. Получают прекрасные профили высвобождения в случае включения в композицию примерно 2% мас./мас. сахарозы. Альтернативно, количество сахара, присутствующего в композиции с замедленным высвобождением, может выражаться в виде весового соотношения с агентом или биологически активным полипептидом. Например, полипептид и сахар могут присутствовать в соотношении от примерно 10:1 до примерно 1:10 мас./мас. В особенно предпочтительных вариантах соотношение полипептида (например, эксендина-4) с сахаром (например, с сахарозой) составляет примерно 3:2, 4:2 и 5:2 мас./мас. Могут использоваться также сочетания двух или более сахаров. Количество сахара в случае использования сочетания соответствует указанным выше диапазонам. Когда указанный полипептид представляет собой эксендин-4, сахар представляет собой предпочтительно сахарозу, маннит или их сочетание. Полимер. Полимеры, приемлемые для создания композиции с замедленным высвобождением согласно настоящему изобретению, представляют собой биосовместимые полимеры, которые могут разлагаться либо по биологическому, либо по не биологическому механизму, или могут быть представлены их смесями или их сополимерами. Полимер представляет собой биосовместимый полимер, если данный полимер или любой из продуктов его разложения являются нетоксичными для реципиента, а также не оказывают существенных повреждающих или нежелательных эффектов на организм реципиента, таких как выраженная иммунологическая реакция в сайте инъекции. Термин биоразлагаемый в контексте настоящего описания обозначает композицию, которая подвергается разложению или эрозии in vivo с образованием более мелких единиц или химических видов. Разложение может происходить, например, в ходе энзиматических, химических и физических процессов. Подходящие биосовместимые, биоразлагаемые полимеры включают, например, полилактиды, полигликолиды, сополимер лактида и гликолида, полимолочные кислоты, полигликолевые кислоты, поликарбонаты, полиэфирамиды, полиангидриды, полиаминокислоты, полиортоэфиры, полидиоксаноны, полиалкиленалкилаты, сополимеры полиэтиленгликоля и полиортоэфира, биоразлагаемый полиуретан, их смеси и их сополимеры. Приемлемые биосовместимые, не разлагаемые биологически полимеры включают не разлагаемые биологически полимеры, выбранные из группы, состоящей из полиакрилатов, полимеров этиленавинилацетата и других ацилзамещенных ацетатов целлюлозы, неразлагаемых полиуретанов, полистиролов, поливинилхлорида, поливинилфторида, поливинилимидазола, хлорсульфоната полиолефинов, полиэтиленоксида и их смесей и сополимеров. Приемлемая молекулярная масса полимеров, используемых в рамках настоящего изобретения, может быть определена специалистом со средним уровнем знаний в данной области с учетом ряда факторов, таких как желательная скорость разложения полимера, его физические свойства, такие как механическая прочность, химия концевой группы и скорость растворения полимера в растворителе. В типичном случае приемлемый диапазон значений молекулярной массы составляет от примерно 2000 до примерно 2000000 Да. В предпочтительном варианте полимер представляет собой биоразлагаемый полимер или сополимер. В более предпочтительном варианте указанный полимер представляет собой сополимер лактида и гликолида (называемый далее по тексту как PLG), характеризующийся соотношением лактид:гликолид, равным примерно 1:1, и молекулярной массой от примерно 10000 до примерно 90000 Да.-5 011584 В другом, еще более предпочтительном варианте молекулярная масса PLG, используемого в настоящем изобретении, составляет от примерно 30000 до примерно 70000 Да и укладывается в такой диапазон значений, как от примерно 50000 до примерно 60000 Да.PLG могут содержать кислотные концевые группы или блокирующие концевые группы, которые могут быть получены при этерификации кислотой. Прекрасные результаты получают при использованииPLG с кислотной концевой группой. Полимеры могут быть также выбраны на основе присущей им вязкости. Приемлемая вязкость составляет от примерно 0,06 до примерно 1,0 дл/г, в частности, от примерно 0,2 до 0,6 дл/г, более предпочтительно от примерно 0,3 до 0,5 дл/г. Предпочтительными полимерами из числа выбранных будут такие полимеры, которые разлагаются в течение периода времени от 3 до 4 недель. Подходящие полимеры могут быть получены от компании Alkermes, Inc. под торговым названием Medisorb, такие как полимеры,предлагаемые на рынке под марками 5050 DL 3 А или 5050 DL 4A. Могут быть также использованы Boehringer Ingelheim Resomer PLG, такие как Resomer RG503 и 503 Н. Композиция с замедленным высвобождением по настоящему изобретению может быть получена в виде двух форм, таких как пленка, гранула, цилиндр, диск и микрочастица. Микрочастица в контексте настоящего описания включает полимерный компонент с диаметром менее чем примерно 1 мм, которые содержит диспергированный или растворенный в нем биологический активный полипептид. Микрочастица может иметь сферическую, не сферическую или неправильную форму. В типичном случае микрочастица может иметь размер, приемлемый для инъекций. В типичном случае микрочастица имеет размер 1000 мкм или менее. В конкретном варианте размеры микрочастиц варьируют от примерно 1 до примерно 180 мкм в диаметре. В еще других вариантах достигаются хорошие профили высвобождения в том случае, когда размер микрочастиц варьирует от примерно 1 до 100 мкм, от примерно 30 до 90 мкм, от примерно 50 до 70 мкм и, кроме того, средний размер частиц может составлять от примерно 50 до 60 мкм. В одном варианте осуществления изобретения средний размер частиц не менее или равен примерно 50, 60 или 70 мкм и предпочтительно меньше чем примерно 80, 90 или 100 мкм. Частицы, в случае их больших размеров, предпочтительно, по существу, не агрегируют, что позволяет им проходить через иглу размером 23 и еще более предпочтительно через иглу размером 25. В еще одном варианте достигаются стабильные и хорошие профили высвобождения за счет контроля распределения частиц по размерам. В одном варианте средний размер частиц составляет примерно 50 мкм и ниже, а верхний диапазон частиц составляет примерно 30-90 мкм, соответственно. Распределение микрочастиц можно охарактеризовать с помощью такого показателя, как средний диаметр объема. Средний диаметр распределения объема отражает центр тяжести рассматриваемого распределения и представляет собой некоторый тип среднего размера частиц. В одном варианте композиция характеризуется средним диаметром распределения объема примерно 50-70 мкм, примерно 50-60 мкм или примерно 50, 60 или 70 мкм, при распределении объема (DV) менее чем или примерно 5, 10 или 15% при 30 мкм и DV более чем или примерно 80, 85, 90 или 95 при 90 мкм. В одном варианте композиция имеет средний диаметр распределения объема примерно 60 мкм, при распределении объема (DV), менее чем или примерно равном 10% при 30 мкм и DV, более чем или примерно равном 90% при 90 мкм. Дополнительные эксципиенты. Поскольку в композиции согласно настоящему изобретению можно вносить дополнительные эксципиенты, известные в данной области, неожиданным открытием в настоящем изобретении был тот факт, что может быть достигнут прекрасный профиль высвобождения при использовании простых композиций, приведенных в настоящем описании. Такие дополнительные эксципиенты могут увеличить или уменьшить скорость высвобождения агента и/или усилить стабильность или другое желательное свойство агента. Ингредиенты, которые могут, по существу, повышать скорость высвобождения, включают порообразующие агенты и эксципиенты, которые облегчают разложение полимера. Например, скорость гидролиза полимера повышается при значении pH, отличном от нейтрального. В этой связи, кислотный или основной эксципиент, такой как неорганическая кислота или неорганическое основание, могут быть добавлены к раствору полимера, используемого для образования микрочастиц, с тем, чтобы изменить скорость эрозии полимера. Ингредиенты, которые могут существенно снизить скорость высвобождения,включают эксципиенты, уменьшающие водорастворимость агента. Предпочтительный вариант осуществления настоящего изобретения применительно к описанным композициям с замедленным высвобождением состоит, по существу, из биосовместимого полимера,агента и сахара. Термин состоит, по существу означает отсутствие ингредиентов, которые существенно повышают скорость высвобождения активного агента из композиции. Примеры дополнительных эксципиентов, которые, как ожидается, не будут существенно повышать или снижать скорость высвобождения агента, включают дополнительные активные агенты и инертные ингредиенты. В еще одном варианте композиция состоит из биосовместимого полимера, агента и сахара. Термин состоит из означает отсутствие компонентов или ингредиентов, отличных от перечисленных и остаточных количеств исходных материалов, растворителей и т.п. в ходе данного процесса. Неожиданно было обнаружено, что забуферивающие агенты, такие как ацетат, цитрат, фосфат или-6 011584 другие биологически совместимые буферы, необязательно вносить в водную фазу в композицию с замедленным высвобождением, включающую агент, такой как эксендин-4, для достижения отличной биологической совместимости. Было также неожиданно обнаружено, что высаливание солей является необязательным для целей контролирования выброса агента, например эксендина-4. В этой связи, композиции согласно настоящему изобретению также включают композиции, приведенные в настоящем описании,которые, по существу, (или полностью) не содержат буфера и/или высаливающих солей. Альтернативно или дополнительно, композиция с замедленным высвобождением по настоящему изобретению обладает низкой пористостью. В таких вариантах осуществления настоящего изобретения композиция с замедленным высвобождением включает биосовместимый полимер, биологически активный полипептид и сахар, где указанная композиция имеет общий объем пор, равный примерно 0,1 мл/г или менее. Дополнительно, общий объем пор может составлять от 0,0 до 0,1 мл/г и от 0,01 до менее чем 0,1 мл/г. Было показано, что очень малый объем пор ведет к небольшому первоначальному выбросу (высвобождению) агента и, кроме того, способствует более медленному и/или длительному профилю высвобождения, чем традиционные композиции, и позволяет сдвинуть показатель Cmax к более позднему времени в профиле высвобождения. В конкретном варианте общий объем пор определяют с использованием порометрии по интрузии ртути, например, как это ниже будет описано более подробно. В другом варианте, в том случае, когда композиции с замедленным высвобождением обладают низкой пористостью, в соответствии с настоящим изобретением, что позволяет и снизить первоначальный выброс, и обеспечить более длительное высвобождение с желательным соотношением Cmax к Cave, могут присутствовать дополнительные эксципиенты. Предпочтительно такие агенты характеризуются небольшим эффектом или, по существу, отсутствием эффекта на уровень высвобождения. Такие эксципиенты могут включать те из них, которые обеспечивают стабильность агента или повышают ее, либо в процессе производства, либо при хранении или в ходе высвобождения. Приемлемые стабилизаторы включают,например, углеводы, аминокислоты, жирные кислоты и поверхностно-активные вещества, известные специалистам в данной области. Кроме того, стабилизаторы включают антиоксиданты, такие как метионин, витамин С, витамин Е и малеиновая кислота. Антиоксидант может присутствовать в композиции как часть стабилизированной водной композиции или может вноситься в полимерную фазу. Кроме того,может быть добавлен буфер для поддержания pH. Буферы представляют собой растворы, содержащие слабую кислоту и родственную соль данной кислоты или слабое основание и соль такого основания. Буферы могут поддерживать желательный уровень pH для стабилизации композиции в ходе любой стадии производства, хранения или высвобождения. Например, буфер может представлять собой одноосновную фосфатную соль или двуосновную фосфатную соль или их сочетание, или может быть летучим буфером,таким как бикарбонат натрия. Другие буферы включают, без ограничения, ацетат, цитрат, сукцинат и аминокислоты, такие как глицин, аргинин и гистидин. Буфер может присутствовать в композиции от примерно 0 до примерно 10% от общего веса и предпочтительно в количестве менее чем примерно 10,15, 20, 25 или 30 мМ. В свете неожиданных новых физических свойств микрочастиц согласно настоящему изобретению и новых способов их производства, согласно настоящему описанию, можно полагать,что настоящее изобретение относится к новым микрочастицам и способам, даже в тех случаях, когда будут присутствовать эксципиенты, которые влияют на скорость высвобождения. Новые свойства микрочастиц могут устранять или снижать нежелательные эффекты высвобождения нужного эксципиента(такого как стабилизирующая соль). В другом варианте эксципиенты присутствуют в количествах, которые существенно влияют на скорость высвобождения, дополнительно усиливая желательный профиль высвобождения. Введение. Композиции согласно настоящему изобретению могут вводиться с использованием способов, известных в данной области. Композиция согласно настоящему изобретению может вводиться пациенту(например, человеку, при необходимости введения такого агента) или другому животному путем инъекции, имплантации (например, подкожно, внутримышечно, внутрибрюшинно, интракраниально и внутрикожно), путем введения в слизистые оболочки (например, интраназально, интравагинально, внутрилегочно или с помощью суппозиториев), перорально, путем безыгольного впрыскивания (см., например,патенты США 5312335 и 5630796, которые включены в настоящее описание в качестве ссылки) или путем доставки in situ (например, с помощью клизмы или аэрозольного спрея). Композиция с замедленным высвобождением может вводиться с использованием любого режима дозирования, который позволяет достичь желательных терапевтических уровней в течение нужного периода времени. Например, вводят композицию с замедленным высвобождением, проводя мониторинг достигаемых у пациента уровней вводимого лекарственного средства до момента возвращения к базовой линии. После возвращения анализируемых уровней до базовой линии композиция с замедленным высвобождением может вводиться снова. Альтернативно, композиция с замедленным высвобождением может вновь вводиться раньше, чем будет достигнут базовый уровень у пациента. Например, когда композиция с замедленным высвобождением содержит включенный в нее гормон,в частности, пептид антидиабетического или глюкорегуляторного действия, например, GLP-1, GLP-2,эксендин-3, эксендин-4 или их агонисты, аналоги или производные, композицию вводят в терапевтиче-7 011584 ски эффективном количестве для лечения пациента с сахарным диабетом, нарушенной толерантностью к глюкозе (IGT), ожирением, сердечно-сосудистым расстройством (СС) или любым другим расстройством,которое поддается лечению любым из указанных выше полипептидов или их производными, аналогами или агонистами. Другие состояния, которые могут подвергаться лечению путем введения композиции с замедленным высвобождением согласно настоящему изобретению, включают диабет типа I и типа II, который может лечиться композицией с замедленным высвобождением, содержащей включенный в нее инсулин. Дополнительно, в том случае, когда включенный полипептид представляет собой ФСГ или его аналоги,композиция с замедленным высвобождением может использоваться для лечения инфертильности. В других случаях композиция с замедленным высвобождением может использоваться для лечения рассеянного склероза, если включенный полипептид представляет собой бета-интерферон или его мутеин. Как это очевидно, композиция с замедленным высвобождением может использоваться для лечения заболеваний,которые отвечают на введение данного полипептида. В еще одном варианте осуществления настоящего изобретения описываемая в нем композиция с замедленным высвобождением может вводиться с кортикостероидом. Совместное введение композиции с замедленным высвобождением с кортикостероидом может дополнительно повышать биологическую доступность биологически активного полипептида в композиции с замедленным высвобождением. Совместное введение кортикостероида в сочетании с композицией с замедленным высвобождением описано подробно в заявке на патент США 60/419430, озаглавленной Способ модификации профиля высвобождения композиций с замедленным высвобождением, Dasch et al., полное содержание которой включено в настоящее описание в качестве ссылки. Кортикостероиды в контексте настоящего изобретения относятся к стероидным противовоспалительным средствам, которые также называются глюкокортикоидами. Подходящие кортикостероиды включают, без ограничения, 21-ацетоксипрегненолон, алклометазон,альгестон, амцинонид, беклометазон, бетаметазон, будезонид, хлорпреднизон, клобетазол, клобетазон,клокортолон, клопреднол, кортикостерон, кортизон, кортивазол, дефлазакорт, дезонид, дезоксиметазон,дексаметазон, дисфлоразон, дифлукортолон, дифлупреднат, эноксолон, флуазакорт, флуклоронид, флуметазон, флунизолид, флуцинолона ацетонид, флуоцинонид, флуокортинбутил, флукортолон, флуорометолон, флуперолона ацетат, флупреднидена ацетат, флупреднизолон, флурандренолид, флутиказона пропионат, формокортал, халцинонид, галобетазола пропионат, галометазон, галопредона ацетат, гидрокортамат, гидрокортизон, лотепреднола этабонат, мазипредон, медризон, мепреднизон, метилпреднизолон,мометазона фуроат, параметазон, предникарбат, преднизолон, преднизолона 25-диэтиламиноацетат,преднизолона натрий-фосфат, преднизон, преднивал, преднилиден, римексолон, тиксокортол, триамцинолон (все формы), например, триамцинолона ацетонид, сложный метиловый эфир ацетонида триамцинолон-21-оевой кислоты, триамцинолона бенетонид, триамцинолона гексацетонид, триамцинолона диацетат и все их фармацевтически приемлемые смеси, их соли и любые другие их производные и аналоги. В одном варианте кортикостероид может быть включен в композицию с замедленным высвобождением, содержащую введенные в нее биосовместимый полимер и биологически активный полипептидный агент. В другом варианте кортикостероид может быть отдельно введен во второй биосовместимый полимер. Второй биосовместимый полимер может быть тем же самым или может отличаться от первого биосовместимого полимера, который содержит включенный в него биологический активный полипептидный агент. В еще одном варианте кортикостероид может присутствовать в неинкапсулированном состоянии,но может быть смешан с композицией с замедленным высвобождением. Например, кортикостероид может быть солюбилизирован в носителе, используемом для доставки композиции с замедленным высвобождением. Альтернативно, кортикостероид может присутствовать в виде твердого вещества, суспендированного в соответствующем носителе. Кроме того, кортикостероид может присутствовать в виде порошка, который смешивают с композицией с замедленным высвобождением. Следует понимать, что кортикостероид присутствует в количестве, достаточном для повышения биологической доступности биологически активного полипептида из композиции с замедленным высвобождением. Повышенная биологическая доступность означает повышение биологической доступности биологически активного полипептида из композиции с замедленным высвобождением в случае ее совместного введения с кортикостероидами, в сравнении с ситуацией введения в отсутствие кортикостероида,в течение периода времени от двух дней после введения до конца цикла высвобождения конкретной композиции. В контексте настоящего описания термин пациент относится к человеку, например к человеку,имеющему потребность в данном агенте или терапии, профилактическом или диагностическом воздействии. В контексте настоящего описания замедленное высвобождение биологически активного полипептида обозначает высвобождение полипептида из композиции с замедленным высвобождением согласно настоящему изобретению, осуществляемое в течение периода времени, более длительного, чем период, в-8 011584 течение которого биологически значимое количество полипептида будет доступно в случае прямого введения раствора полипептида. Предпочтительно, чтобы замедленное высвобождение представляло собой высвобождение, которое происходит в течение периода времени, равного по меньшей мере примерно одной неделе, в частности, в течение примерно двух недель, по меньшей мере примерно трех недель или по меньшей мере примерно четырех недель. Замедленное высвобождение может быть непрерывным или представлять собой прерывистое высвобождение с относительно постоянной или варьирующей скоростью высвобождения. Непрерывность высвобождения и уровень высвобождения зависят от типа используемой полимерной композиции (например, от соотношения мономеров, молекулярной массы, блоккомпозиции и варьирующих сочетаний полимеров), от количества полипептида и/или от выбора эксципиентов для достижения желательного эффекта. В контексте настоящего описания терапевтически эффективное количество, профилактически эффективное количество или диагностически эффективное количество представляет собой количество композиции с замедленным высвобождением, необходимое для проявления желательного биологического ответа после введения. Показатель Cmax в контексте настоящего описания представляет собой максимальную концентрацию лекарственного средства в сыворотке крови, которая достигается в течение периода высвобождения,подлежащего мониторингу. Показатель Cave в контексте настоящего описания представляет собой среднее значение концентрации доставляемого лекарственного средства в сыворотке крови, разделенное на значение площади под кривой (AUC) в профиле высвобождения в расчете на период высвобождения. Предпочтительно, чтобы соотношение Cmax к Cave составляло примерно 3 или менее. Указанный профиль в особенности желателен в случае полипептидов антидиабетического или глюкорегуляторного действия, таких как приведенные выше полипептиды. Соотношение, равное примерно 3 или менее, может обеспечивать показатель Cave в терапевтическом окне, при устранении неблагоприятных побочных эффектов лекарственного средства, которые могут возникать при более высоких соотношениях. Кроме того, было показано, что за счет контроля физических свойств композиции с замедленным высвобождением, приведенной в настоящем описании, можно получить другие желательные параметры, характеризующие нужный профиль высвобождения, и контролировать их. Данный способ и композиции по настоящему изобретению позволяют достичь значительного снижения выброса (то есть первоначального высвобождения; например, значения Cmax в 0-1 дни). В одном варианте осуществления настоящего изобретения первоначальный выброс составляет меньше, чем примерно 1% от общего количества агента. В другом варианте первоначальный выброс составляет меньше, чем примерно 0,75% от общего количества агента, а также он может быть меньше, чем примерно 0,5%. В том, что касается соотношения Cmax к Cave,оно имеет значение меньше, чем примерно 3, и может составлять примерно 1-3, а также может быть равно примерно 2-3. Кроме того, Cmax, в случае его достижения, может быть сдвинут по времени в периоде замедленного высвобождения, и длительность этого периода будет отличаться от периода выброса, или периода первоначального высвобождения, в сторону замедленной фазы высвобождения. В одном варианте Cmax может достигаться по меньшей мере через 7, 14, 21, 28, 35 или 42 дня после введения и может осуществляться в любой день между ними. В другом варианте Cmax достигается в период от примерно 21 до 35 дня после введения, а в еще одном варианте он достигается в период от примерно 28 до 31 дня и также примерно на 28 день после введения. В еще одном варианте осуществления настоящего изобретения максимальная концентрация лекарственного средства (т.е. концентрация в плазме) имеет место по меньшей мере через 7, 14, 21, 28, 35 или 42 дня после введения и может иметь место в любой день между ними. В еще одном варианте максимальная концентрация лекарственного средства имеет место в период от примерно 21 до 35 дня после введения, в особенности в случае введения глюкорегуляторных агентов, таких как эксендин-4, GLP-1, GIP или их аналогов. Улучшенные профили замедленного высвобождения в случае композиций по настоящему изобретению позволяют осуществлять введение активного агента или агентов в дозах, которые не вызывают нежелательного (побочного) эффекта, такого как тошнота, за счет снижения нежелательного высокого первоначального выброса. Кроме того, улучшенные профили замедленного высвобождения позволяют применять способ введения одного или нескольких активных агентов в дозе, которая ниже, чем терапевтически эффективное количество, но при замедленном высвобождении многократных доз достигается терапевтически эффективная концентрация у пациента. Указанная концентрация далее легко поддерживается за счет замедленного высвобождения дозы. Одним достоинством такого терапевтического подхода, который становится возможным благодаря настоящему изобретению, является тот факт, что нежелательные (побочные) эффекты, такие как тошнота, снижаются или устраняются за счет снижения нежелательно высоких выбросов лекарственного средства, а также благодаря тому, что такой способ позволяет пациенту лучше адаптироваться к постепенно возрастающим концентрациям одного или нескольких агентов. Соответственно, в одном варианте обеспечивается замедленное высвобождение многократных доз, так что каждая последующая доза повышает концентрацию одного или нескольких агентов у пациента, что приводит к достижению терапевтически эффективной концентрации одного или нескольких агентов у пациента. В еще одном варианте каждая последующая доза препарата с замедленным высво-9 011584 бождением вводится таким образом, что ее замедленная фаза перекрывается с замедленной фазой предыдущей дозы. Кроме того, показатель Cmax дозы или максимальная концентрация агента может перекрываться с Cmax или максимальной концентрацией агента от предыдущей дозы. Термин биологическая доступность в контексте настоящего описания относится к количеству терапевтического агента, которое поступает в систему кровообращения. Биологическая доступность может быть определена как вычисленная площадь под кривой (AUC) в профиле высвобождения конкретного полипептида в течение периода времени, начинающегося от момента введения и заканчивающегося в заданной точке времени. Как известно в данной области, профиль высвобождения можно оценить путем построения графика зависимости сывороточных уровней биологически активного агента у субъекта (осьY) от заданных временных точек (ось X). Биологическую доступность часто определяют в терминах % биологической доступности, что представляет собой биологическую доступность, достигаемую для конкретного полипептида после введения композиции с замедленным высвобождением при делении этого показателя на биологическую доступность, достигаемую для конкретного полипептида после внутривенного введения той же самой дозы лекарственного средства, с последующим умножением полученного значения на 100. Модификация профиля высвобождения может быть подтверждена при соответствующем фармакокинетическом мониторинге сыворотки пациента на наличие биологически активного полипептидного агента. Например, тестирование с использованием специфических антител (например, в рамках методовELISA и IRMA), известное в данной области, может быть использовано для определения концентрации определенных биологически активных полипептидных агентов в сыворотке пациента. Примером такого метода является процедура тестирования эксендина-4, приведенная в настоящем описании. Фармакодинамический мониторинг пациента для отслеживания терапевтических эффектов конкретного агента у пациента может использоваться для подтверждения наличия биологической активности у высвобождаемого агента. Способы мониторинга фармакодинамических эффектов могут быть выбраны на основе оценки биологической активности введенного агента с использованием большого числа доступных методик. Производство. Известно множество способов, с помощью которых могут быть получены композиции с замедленным высвобождением (матрицы полимера/биологически активного полипептида) согласно настоящему изобретению, в частности, композиции, имеющие низкую пористость, описанные в настоящем изобретении. Подробные процедуры некоторых методов получения микрочастиц приведены в рабочих примерах. В предпочтительном варианте настоящего изобретения способ изготовления композиции с замедленным высвобождением биологически активного полипептида включает получение смеси путем объединения водной фазы, включающей воду, агент, такой как водорастворимый полипептид, и сахар, с масляной фазой, включающей биосовместимый полимер и растворитель для полимера; формирование эмульсии водав-масле; добавление агента для коацервации, например, силиконового масла, растительного масла или минерального масла, к смеси с образованием зародышевых микрочастиц; перенос зародышевых микрочастиц к гасящему растворителю для отверждения микрочастиц; сбор отвержденных микрочастиц и сушку отвержденных микрочастиц. Данный процесс в целом называется в настоящем описании как процесс в воде-масле-масле (в/м/м). Предпочтительно полимер может присутствовать в масляной фазе в концентрации, варьирующей от примерно 3% мас./мас. до примерно 25% мас./мас., предпочтительно от примерно 4% мас./мас. до примерно 15% мас./мас., например, от примерно 5% мас./мас. до примерно 10% мас./мас. Прекрасные результаты могут быть достигнуты при использовании 6% мас./мас., концентрации PLG в масляной фазе. Полимер в основном объединяют с полимерным растворителем. В том случае, когда полимер представляет собой PLG, такие как PLG, предпочтительные для настоящего описания, полимер добавляют к растворителю для PLG. Такие растворители известны в данной области. Предпочтительным растворителем является метиленхлорид. Агент и сахар добавляют в водной фазе, предпочтительно в одной водной фазе. Концентрация агента составляет предпочтительно 10-100 мг/г, предпочтительно от 50 до 100 мг/г. Концентрация сахара составляет предпочтительно 10-50 и 30-50 мг/г. Затем обе фазы смешивают с образованием эмульсии. Предпочтительно, чтобы эмульсия была образована таким образом, чтобы размер капель во внутренней эмульсии был меньше чем примерно 1 мкм,предпочтительно меньше чем примерно 0,7 мкм, более предпочтительно меньше чем примерно 0,5 мкм и составлял например около 0,4 мкм. Кроме того, размер капель во внутренней эмульсии может составлять примерно от 0,1 до 1,2 мкм и даже может составлять примерно от 0,1 до 1,0 мкм, а также может составлять примерно от 0,2 до 0,4 мкм. Нижний предел определяется в значительной мере желанием минимизировать разложение полимера, такое как возникающее, например, в процессе сдвига, или разложение агента, например, в результате выделения тепла в процессе получения эмульсии. Соответственно, в одном варианте осуществления настоящего изобретения способы формирования эмульсии, например, путем гомогенизации, путем высокого сдвига или путем обработки ультразвуком, применяются при чередовании и/или в течение относительно коротких периодов времени, так чтобы, например, можно было- 10011584 минимизировать и/или рассеивать выделение тепла в эмульсии. Например, гомогенизация может проводиться дискретными воздействиями на массу эмульсии. Могут использоваться приборы для обработки ультразвуком и гомогенизаторы для получения такой эмульсии. Агент для коацервации в контексте настоящего описания относится к любому маслу, в котором полимерный раствор (полимер и растворитель) не подвергается легкой солюбилизации, так что образуется отдельная фаза с полимерным раствором. Приемлемые агенты для коацервации, используемые в рамках настоящего изобретения, включают, без ограничения, силиконовое масло, растительное масло, минеральное масло. В конкретном варианте осуществления изобретения агент для коацервации представляет собой силиконовое масло и добавляется в количестве, достаточном для достижения соотношения силиконового масла к полимерному растворителю в диапазоне от примерно 0,75:1 до примерно 2:1. В конкретном варианте соотношение силиконового масла к полимерному растворителю составляет от примерно 1:1 до примерно 1,5:1. В предпочтительном варианте соотношение силиконового масла к полимеру составляет примерно 1,5:1. Коэффициенты соотношения других агентов для коацервации, как ожидается,будут аналогичными или могут быть определены более детально при использовании указанных выше соотношений в качестве исходных точек. В одном варианте стадия коацервации включает примерно 1-5-минутный период добавления (или переноса) агента для коацервации к эмульсии или наоборот, эмульсии к агенту для коацервации, с последующей стадией добавления или переноса, которая может длиться примерно 2-4 мин и может также составлять примерно 3 мин. В еще одном варианте длительность стадии добавления или переноса меньше или равна примерно 1, примерно 2, примерно 3 или примерно 3,5 мин. В еще одном варианте в том случае, когда контролируется стадия добавления или переноса в соответствии с настоящим описанием,агент для коацервации представляет собой силиконовое масло, описанное в настоящем изобретении. В еще одном варианте соотношение объема агента для коацервации к объему полимерного растворителя в соответствии с настоящим описанием, составляет, в частности, примерно 1,5 к 1 (например, силиконового масла к метиленхлориду). В еще одном варианте внутренняя эмульсия может иметь размер капель меньше чем примерно 1 мкм, а также может иметь размер, указанный в настоящем описании. В одном варианте агент представляет собой пептид с глюкорегуляторным действием, такой как эксендин-4, GLP1, GIP или их аналоги, которые могут быть внесены в концентрациях, указанных в настоящем описании. В еще одном варианте полимер представляет собой PLGA, указанный в настоящем описании, предпочтительно в соотношении 50:50 лактидной формы к гликолидной форме. В одном варианте полимерный раствор и/или водный раствор, который включает эмульсию до коацервации, может содержать эксципиенты, если это желательно. Стадия коацервации может также включать период выдерживания, когда смесь агента для коацервации и эмульсии выдерживают в течение небольшого периода времени, например, в течение периода времени от примерно 1 до примерно 5 мин перед обработкой на стадии отверждения. Дополнительно,период выдерживания может составлять примерно от 30 до 90 с, а также может быть равен примерно 1 мин. Дополнительно, в других вариантах период выдерживания, который является необязательным,может составлять менее 1 мин и может быть также меньше 30 с. В еще одном варианте смесь для коацервации обрабатывают для предотвращения или минимизации разделения компонентов смеси водамасло-масло. Такая обработка может быть проведена любым способом, включая, например, перемешивание, гомогенизацию, встряхивание, обработку ультразвуком, смешивание, взбалтывание и давление. Условия обработки выбирают таким образом, чтобы минимизировать разложение компонентов композиции, включая деструкцию композиции зародышевого полимера/агента, которая может быть представлена микрочастицами или иметь другую форму. Стадия коацервации также включает перенос коацерватной смеси к раствору для гашения или отверждения. Гашение может включать полимерный осадитель. Полимерные осадители в основном известны в данной области. Особенно предпочтительный гаситель включает смесь отверждающего растворителя и промывного растворителя, например, систему гептан/этанольного растворителя, такую как смесь, описанная в патенте США 6824822, который включен в настоящее описание в качестве ссылки. Данную стадию переноса осуществляют как можно быстрее, и в ряде вариантов ее длительность составляет менее чем примерно 0,5, 1, 2, 3 или 4 мин. Твердое лекарственное средство может быть также инкапсулировано с использованием модифицированного варианта способа, описанного выше. Модифицированный способ можно описать как способ,осуществляемый в твердой/масляной/масляной фазе (т/м/м). Например, твердый эксендин-4 суспендируют в метиленхлориде, содержащем 6% PLG, и обрабатывают ультразвуком примерно в течение 4 мин на льду. Последующую обработку проводят по способу,аналогичному методу обработки в фазе в/м/м. В одном варианте композиция содержит активный агент эксендин-4 примерно в 5% концентрации,сахар - примерно в 2% концентрации и биополимер. В другом варианте композиция содержит активный агент эксендин-4 примерно в концентрации 3%, сахар - в концентрации примерно 2% и биополимер. В другом таком варианте композиция содержит полимер PLGA. В еще одном варианте композиция содержит PLG 4A полимер, который включает примерно 50 мол.% DL лактида и 50 мол.% гликолида с неза- 11011584 щищенной свободной концевой группой карбоновой кислоты (обозначение 4 А). В еще одном варианте композицию получают в виде микрочастиц с характером распределения частиц по размеру и общим объемом пор, соответствующими настоящему описанию. В еще одном варианте общий объем пор составляет меньше чем примерно 0,1 мл/г, средний размер частиц может составлять примерно 50 мкм, с распределением по нижней границе, равной примерно 30 мкм, и по верхней границе, равной примерно 90 мкм. В еще одном варианте микрочастицы формируют, получают или подвергают соответствующей обработке для последующего получения в соответствии с процессами, приведенными в настоящем описании. В одном таком варианте указанный способ представляет собой процесс в фазе вода/масло/масло (в/м/м),где размер частиц внутренней эмульсии указан в настоящем описании. Кроме того, указанный способ может включать коацерват с силиконовым маслом, который может характеризоваться соотношением с полимерным растворителем, равным примерно 1,5 к 1. Кроме того, данный способ может включать контроль стадии коацервации в соответствии с приведенным выше описанием, и даже в том случае, когда имеет место перенос коацервата к внутренней эмульсии, она будет иметь длительность примерно 3 мин или менее, стадия выдерживания будет длиться примерно 1 мин или менее и стадия быстрого переноса к растворителю для гашения/отверждения будет осуществляться в течение периода времени менее чем примерно 3 мин. В еще одном варианте растворитель представляет собой двойной растворитель, предпочтительно смесь гептан/этанол. В еще одном варианте композиции согласно настоящему изобретению могут быть также приготовлены с получением формы, пригодной для инъекции через иглу в организм хозяина. Инъецируемая композиция может включать композицию микрочастиц согласно настоящему описанию в вязком водном носителе для инъекций, например, как описано в патенте США 6495164, который включен в настоящее описание в качестве ссылки. Водный носитель для инъекций может иметь вязкость, равную по меньшей мере 20 сП при температуре 20 С, и может также иметь вязкость выше чем 50 сП и менее чем 60 сП при температуре 20 С. Микрочастицы могут быть суспендированы в носителе для инъекций в концентрации выше чем примерно 30 мг/мл с образованием суспензии, где жидкая фаза в данной суспензии имеет вязкость, равную по меньшей мере 20 сП при температуре 20 С. В других вариантах жидкая суспензия имеет вязкость при 20 С, равную по меньшей мере примерно 30, 40, 50 и 60 сП. Композиция может также включать агент, повышающий вязкость, агент, повышающий плотность, агент, усиливающий тонизирующие свойства, и/или увлажнитель. Вязкость носителя для инъекций позволяет инъецировать композицию через иглу, диаметр которой варьирует от 18 до 23 размера, еще более предпочтительно инъекцию можно проводить через иглу 25 размера. Как известно специалистам в данной области, игла с обычной стенкой 18 размера (RW) имеет номинальный внутренний диаметр (в.д.) 0,033 дюйма и игла с обычной стенкой 22 размера имеет номинальный внутренний диаметр 0,016 дюйма. Носитель для инъекции может содержать агент, повышающий вязкость. В одном варианте агент, повышающий вязкость, представляет собой натрий-карбоксиметилцеллюлозу, хотя могут также использоваться другие приемлемые агенты для повышения вязкости. Носитель для инъекций может дополнительно включать агент, повышающий плотность, который повышает плотность носителя для инъекций. В еще одном варианте агент, повышающий плотность, представляет собой сорбит, хотя могут использоваться другие приемлемые агенты,повышающие вязкость. Носитель для инъекций может также содержать средство, корректирующее тонизирующие свойства для поддержания нужных тонизирующих свойств и, соответственно, устранения токсических эффектов, а также для повышения биологической совместимости. Предпочтительным средством для коррекции тонизирующих свойств является хлорид натрия, хотя могут также использоваться другие приемлемые средства для коррекции тонизирующих свойств. Носитель для инъекций может также включать увлажнитель, позволяющий достичь полного увлажнения микрочастиц в носителе для инъекций. Увлажнитель включает полисорбат 20 (Tween 20), полисорбат 40 (Tween 40) и полисорбат 80(Tween 80). Микрочастицы могут быть суспендированы в носителе для инъекций в концентрации выше чем примерно 30 мг/мл. В одном варианте микрочастицы суспендируют в концентрации от примерно 150 до примерно 300 мг/мл. В другом варианте микрочастицы суспендируют в концентрации от примерно 100 до примерно 400 мг/мл. Однако следует понимать, что настоящее изобретение не ограничивается конкретной концентрацией. В одном варианте носитель для инъекций, приемлемый для прохождения через иглу 23 размера,включает натрий-карбоксиметилцеллюлозу в концентрации 3,0% вес./об., хлорид натрия в концентрации 0,9% вес./об. и полисорбат 20, НФ (Tween 20) при 0,1 об.% или необязательно при 0,5% в воде. Раствор необязательно может быть забуферен. В еще одном варианте эксенатидсодержащие микрочастицы, описанные выше, суспендируют в носителе для инъекций, включающем натрий-карбоксиметилцеллюлозу в концентрации 3,0% вес./об., хлорид натрия в концентрации 0,9% вес./об. и полисорбат 20, НФ (Tween 20) при 0,1 об.% или необязательно при 0,5% в воде. В другом варианте концентрация суспендированных эксенатидсодержащих микрочастиц выше чем примерно 30 мг/мл. В типичном случае суспендируют примерно 100-200 мг сухих микрочастиц на 1 мл носителя. В других вариантах осуществления настоящего изобретения исключены некоторые микрочастицы,описанные в публикации WO2004 03618 6 от 29 апреля 2004 года. Более конкретно исключены те мик- 12011584 рочастицы, которые не содержат то количество сульфата аммония, которое, по существу, воздействует на высвобождение. Такие специфические микрочастицы включают микрочастицы, обозначенные какIF-1, IF-2, IF-3, IF-4, M1-M4, M7-М 14, М 18, M19. Далее настоящее изобретение описывается более подробно с помощью приведенных примеров. Примеры. Способ I получения микрочастиц. Композиции с замедленным высвобождением согласно настоящему описанию получают с использованием процесса разделения фаз. В основном данный процесс описан ниже для микрочастиц, содержащих эксендин-4 и сахарозу, на примере партии размером 1 кг. А. Получение внутренней эмульсии вода-в-масле. Эмульсию типа вода-в-масле готовят с помощью гомогенизатора. Подходящий гомогенизатор включает встроенный в поточную линию гомогенизатор Megatron MT-V 3-65 F/FF/FF, Kinematica AG,Швейцария. Водную фазу эмульсии получают путем растворения эксендина-4 и эксципиентов, таких как сахароза, в воде. Концентрация лекарственного средства в полученном растворе может составлять от примерно 50 до примерно 100 мг/г. Например, в том случае, когда лекарственное средство представляет собой эксендин-4, концентрация лекарственного средства в растворе может варьировать от примерно 30 до примерно 60 г на 600 г воды. В конкретном варианте осуществления изобретения 50 г эксендина-4 и 20 г сахарозы растворяют в 600 г воды для последующего смачивания (WFI). Указанные выше количества отражают номинальные величины и не включают корректировки, проводимые для компенсации содержания пептидов по эффективности, специфичной для используемой серии эксендин-4. Масляную фазу эмульсии получают при растворении полимера PLGA (например, 930 г очищенного 50:50 DL4APLGA (Alkermes, Inc. в метиленхлориде (14,6 кг или 6% мас./мас.). Далее водную фазу добавляют к масляной фазе с образованием крупнозернистой эмульсии, при использовании для этого подвесного смесителя в течение примерно 3 мин. Далее указанную крупнозернистую эмульсию гомогенизируют примерно со скоростью 21300 об/мин при температуре окружающей среды в течение трех сеансов. Полученная внутренняя эмульсия содержит капли с размером менее чем 1 мкм. Следует понимать, что внутренняя эмульсия может быть получена с помощью любых других приемлемых способов. Такие приемлемые способы получения эмульсии включают, без ограничения, описанную выше гомогенизацию и обработку ультразвуком. В. Образование коацервата. Далее проводят стадию коацервации путем добавления силиконового масла (21,8 кг диметикона,НФ, 350 сП) в течение примерно 5 мин к внутренней эмульсии. Такая процедура эквивалентна достижению соотношения 1,5:1, применительно к соотношению силиконового масла к метиленхлориду. Метиленхлорид из полимерного раствора распределяется внутри силиконового масла и начинает осаждать полимер вокруг водной фазы, содержащей эксендин-4, что ведет к микроинкапсулированию. Образованные таким образом зародышевые микросферы еще мягкие и требуют отверждения. Зачастую зародышевые микросферы оставляют для выдерживания в течение небольшого периода времени, например, в течение периода времени от примерно 1 мин до примерно 5 мин, перед обработкой на стадии отверждения микросфер.C. Отверждение микросфер и промывка. Далее, зародышевые микросферы быстро переносят в смесь растворителей гептан/этанол. Нужный для этого объем смеси гептан/этанол определяют с учетом размера партии микросфер, в типичном случае используют соотношение 16:1, применительно к соотношению метиленхлорида и растворителя гептан/этанол. В данном примере используют примерно 210 кг гептана и 23 кг этанола при охлаждении до 3 С при перемешивании в реакторе. Указанная смесь растворителей отверждает микросферы за счет экстракции дополнительного количества метиленхлорида из микросфер. Данная стадия отверждения может быть также названа гашением. После проведения гашения в течение одного часа при температуре 3 С смесь растворителей декантируют и добавляют свежий гептан (13 кг) при температуре 3 С и выдерживают в течение одного часа для отмывания остаточных количеств силиконового масла, этанола и метиленхлорида с поверхности микросфер или непосредственно продвигают на стадию сбора.D. Сушка и сбор микросфер. Микросферы в конце стадии гашения или декантирования/промывки переносят для последующего сбора на фильтрующее устройство-сушилку 12" Sweco Pharmasep, модель PH12Y6. Используемое фильтрующее устройство/сушилка содержит многослойное сито размером 20 мкм, соединенное с мотором,который заставляет сито вибрировать в ходе сборки и сушки. Проводят окончательную промывку гептаном (6 кг при 3 С) для наиболее полного переноса материала по поточной линии и удаления избытка силиконового масла. После этого микросферы сушат в вакууме при пропускании постоянного потока газообразного азота с контролируемой скоростью в следующем режиме: 6 ч при температуре 3 С, подъем температуры в течение 6 ч до 41 С и 84 ч при температуре 41 С. После завершения процесса сушки микросферы загружают в сборочный контейнер, просеивая через сито размером 150 мкм, и хранят при температуре примерно -20 С до фасовки. Для всех композиций с микрочастицами, получаемых в соответствии с настоящим описанием, ко- 13011584 личество полипептида, например, эксендина-4, и эксципиентов, имеющихся в приготовленных композициях, выражают в виде % мас./мас. от веса готовой композиции с замедленным высвобождением. Указанный показатель в % мас./мас. представляет собой номинальный процент, за исключением тех случаев,где это особо отмечается. Способ II получения микрочастиц. А. Получение внутренней эмульсии типа вода-в-масле. Эмульсию типа вода-в-масле изготавливают при обработке ультразвуком. Подходящие ультразвуковые дезинтеграторы включают Vibracell VCX 750 с измерительной головкой модели CV33, Sonics andMaterials Inc., Newtown, СТ. Водную фазу эмульсии получают путем растворения эксендина-4 и эксципиентов, таких как сахароза, в воде. Концентрация лекарственного средства в полученном растворе может составлять от примерно 50 до примерно 100 мг/мл. Например, в том случае, когда лекарственное средство представляет собой эксендин-4, концентрация лекарственного средства в растворе может варьировать от примерно 3,28 до примерно 6,55 г на 65,5 г воды. В конкретном варианте 5,46 г эксендина-4 и 2,18 г сахарозы растворяют в 65,5 г воды с последующим смачиванием WFI. Указанное выше конкретное количество представляет собой 4% надбавку относительно целевого количества с тем, чтобы компенсировать потери компонентов при стерилизации фильтрованием. Масляную фазу эмульсии готовят при растворении полимера PLGA (например, 97,7 г очищенного 50:50 DL4A PLGA (Alkermes, Inc. в метиленхлориде (1539 г или 6% вес./об.). Далее водную фазу добавляют к масляной фазе в течение примерно 3 мин при обработке ультразвуком со 100% амплитудой при температуре окружающей среды. Водную фазу пропускают с помощью насоса через трубку из нержавеющей стали размером 1/4" с трубкой 1" на конце в системе ВЭЖХ(в.д.=20/1000") при манометрическом давлении 5 фунтов на кв.дюйм, введенную ниже обрабатываемой ультразвуком пробы в зоне обработки ультразвуком. Затем содержимое реактора перемешивают со скоростью 1400-1600 об/мин, с дополнительным периодом обработки ультразвуком со 100% амплитудой в течение 2 мин, далее выдерживают в течение 30 с, после чего обрабатывают ультразвуком еще в течение 1 мин. Указанная процедура приводит к получению внутренней эмульсии с размером капель менее чем 0,5 мкм. Следует понимать, что внутренняя эмульсия может быть получена с использованием любых других приемлемых способов. Подходящие способы создания эмульсии включают, без ограничения, обработку ультразвуком, описанную выше, и гомогенизацию.B. Образование коацервата. Далее проводят процесс на стадии коацервации при добавлении к внутренней эмульсии силиконового масла (2294 г диметикона, НФ, 350 сП) в течение примерно 3-5 мин. Указанная процедура эквивалентна достижению соотношения 1,5:1, применительно к соотношению силиконового масла и метиленхлорида. Метиленхлорид из полимерного раствора распределяется по силиконовому маслу и начинает осаждать полимер вокруг водной фазы, содержащей эксендин-4, что ведет к микроинкапсулированию. Образованные таким образом зародышевые микросферы еще мягкие и требуют отверждения. Зачастую зародышевые микросферы оставляют выстаиваться в течение небольшого периода времени, например, в течение периода времени от примерно 1 до примерно 5 мин до обработки микросфер на стадии отверждения.C. Отверждение и промывка микросфер. Далее зародышевые микросферы сразу переносят к смеси растворителей гептан/этанол. Нужный для этого объем смеси гептан/этанол может быть определен с учетом размера партии микросфер. В данном примере используют партию, содержащую примерно 22 кг гептана и 2448 г этанола при температуре 3 С, при ее перемешивании в контейнере (350-450 об/мин). Указанная смесь растворителей отверждает микросферы за счет экстракции из них дополнительного количества метиленхлорида. Данная стадия может быть названа как стадия гашения. После проведения гашения в течение 1 ч при температуре 3 С смесь растворителей декантируют и добавляют свежий гептан (13 кг) при температуре 3 С и выдерживают в течение 1 ч для отмывки остаточного количества силиконового масла, этанола и метиленхлорида с поверхности микросфер.D. Сушка и сбор микросфер. В конце стадии промывки микросферы переносят и собирают на многослойном экране диаметром 6", размером 20 мкм, расположенном внутри конусообразной сушильной камеры, который работает как оконечный фильтр. Далее микросферы сушат при постоянном продувании газообразного азота с контролируемой скоростью в следующем режиме: 18 ч при температуре 3 С, 24 ч при температуре 25 С; 6 ч при температуре 35 С и 42 ч при температуре 38 С. После завершения процесса сушки микросферы выгружают в контейнер из тефлона/нержавеющей стали для сбора стерилизованного материала, подсоединенного к сушильному конусу. Контейнер с собранным материалом запечатывают, выводят из сушильного конуса и хранят при температуре -205 С до фасовки. Оставшийся в конусе материал отбирают в ходе чистки устройства для анализа содержания лекарственного средства. Выход составляет примерно 100 г микросфер. Для всех композиций микросфер, которые получают в соответствии с описанным способом, количество полипептида, например эксендина-4, и эксципиентов, присутствующих в изготовленных компо- 14011584 зициях, выражают в виде % мас./мас. относительно веса готовой композиции с замедленным высвобождением. Указанный показатель % мас./мас. представляет собой номинальный процент, за исключением тех случаев, где особо указано иное. Полимер. Ниже перечислены примеры конкретных PLG полимеров, пригодных для использования. Все полимеры, используемые в приведенных ниже примерах, перечислены в перечне, и все указанные полимеры получают от компании Alkermes, Inc., Cincinnati, ОН и могут быть охарактеризованы следующим образом. Полимер 2 А: Сополимер лактида и гликолида; соотношение 50:50 лактид:гликолид; молекулярная масса 12,3 кДа; IV = 0,15 (дл/г). Полимер 4 А: Сополимер лактида и гликолида; соотношение 50:50 лактид:гликолид; молекулярная масса 45-64 кДа; IV = 0,45-0,47 (дл/г). Очистка PLG. В настоящей области известно (см., например, Peptide Acylation by Poly(-HydroxyEsters) by Lucke et al., Pharmaceutical Research, Vol. 19, No. 2, p. 175-181. February 2002), что белки и пептиды, которые включаются в матрицы PLG, могут подвергаться нежелательным изменениям (т.е. разлагаться или подвергаться химическим модификациям) в результате взаимодействия с продуктами деградации PLG или с примесями, остающимися после получения полимера. В этой связи, PLG полимеры,используемые при получении большинства композиций микрочастиц, приведенных в настоящем описании, очищают перед получением композиции с замедленным высвобождением с использованием известных способов очистки. Способы характеристики материалов. Было показано, что описанные ниже способы характеристики материалов пригодны для идентификации микрочастиц, которые могут обеспечивать желательный профиль высвобождения активного агента.SEM используют для оценки размера частиц, их формы и поверхностных свойств. Визуализацию по методу SEM проводят в системе Personal SEM (ASPEX LLC). Все образцы наносят с помощью шпателя на стандартные стержни для SEM, покрытые углеродной двусторонней лентой. Образцы покрываютAu в течение 90 с при токе эмиссии 18 мА с использованием устройства для нанесения покрытия, модельSC 7620 Mini Sputter Coater (Energy Beam Sciences). Все SEM анализы проводят с использованием электронного луча 20 KeV в диапазоне увеличения примерно 250-2500X. Криогенная SEM. Поперечный разрез микрочастиц изучают с помощью криогенной SEM. Образец микрочастиц смешивают с раствором HISTO PREP (Fischer) и выдерживают в криостате при температуре -20 С в течение ночи. Отвержденные микрочастицы помещают на покровное стекло и делают срезы с помощью металлического ножа. Срезы частиц помещают на алюминиевые стержни, покрывают платиной и палладием и наблюдают под электронным сканирующим микроскопом (Phillips 525M). Визуальный осмотр срезов позволяет определить степень пористости микрочастиц. Измерение пористости по интрузии ртути. Распределение микрочастиц по объему пор определяют с использованием порометра по интрузии ртути, модель SutoPor IV 9500 Moden Mercury Intrusion Porosimeter (Micromeritics, Norcross, GA). В общих чертах, метод состоит в том, что ртуть проталкивают в порометре через известное количество микрочастиц, прилагая давление ступенчато до достижения максимального манометрического давления 60000 фунтов на кв.дюйм. Измеряют объем ртути, проникшей в поры, при различных давлениях. Данный метод позволяет количественно оценивать распределение пор в микрочастицах. Размер пор, в которые произошло проникновение, обратно пропорционален приложенному давлению. Равновесие внутренних и внешних сил на систему жидкость - твердое тело - пар может быть описано уравнением Washburn. Взаимозависимость между приложенным давлением и размером пор, в которые с силой проталкивается ртуть, описывается следующей формулой:D=-4cos/P,где D - диаметр пор;- поверхностное натяжение (постоянное);- угол контакта (постоянный); Р - давление. Исходя из этого, размер пор, в которые проникает ртуть, обратно пропорционален приложенному давлению. Полагая, что все поры являются жесткими цилиндрами, можно вычислить среднее значение диаметра пор (D = 4V/A) при делении объема пор (V = D2h/4) на площадь пор (А = Dh). Остаточные растворители. Был использован единственный метод для количественного определения гептана, этанола и метиленхлорида. Оборудование состоит из газового хроматографа серии 2 HP 5890 с колонкой Rtx 1301,30 см 0,53 мм. Растворяют примерно 130 мг микрочастиц в 10 мл N,N-диметилформамида. Пропилаце- 15011584 тат используют в качестве внутреннего стандарта. Препарат образца корректируют таким образом, чтобы можно было количественно определить концентрацию метиленхлорида, в количестве до 0,03%. Получение микрочастиц. Партии микрочастиц, указанные в табл. 1, получают по описанной выше процедуре, по шкале 100 г,при использовании полимера 4 А и с соотношением силиконового масла к метиленхлориду, равным 1,5:1 или 1:1, где силиконовое масло имеет вязкость 350 сП. Количество используемых в композиции эксендина-4 и эксципиентов показано также в табл. 1. Таблица 1 Все композиции содержат 3% количество лекарственного средства, за исключением 5 POROSITY. Общий объем интрузии, полученной при оценке методом порометрии по интрузии азота, и вычисленные средние диаметры пор приведены в табл. 2. Зависимость между средним диаметром пор и высвобождением in vitro показана на фиг. 1. Таблица 2- 17011584 На фиг. 1 приведены эффекты сульфата аммония на первоначальный выброс in vitro. Приведенные данные показывают, что первоначальный выброс in vitro коррелирует с диаметром пор в микрочастицах. Композиции, изготовленные с использованием сульфата аммония, демонстрируют различные уровни высвобождения in vitro и разную пористость, в отличие от композиций без сульфата аммония, которые демонстрируют стабильные значения пористости и уровня высвобождения. В процессе производства микрочастиц наличие сульфата аммония в водной среде может приводить к высаливанию лекарственного средства при получении внутренней эмульсии. Различия в микроокружении преципитатов могут определять различия в пористости и, в этой связи, вариации в первоначальном высвобождении. Данный эффект не наблюдается в композициях, изготовленных без сульфата аммония. Композиции с сахарозой и эксендином-4 демонстрируют более желательный и постоянный уровень первоначального высвобождения, в сравнении с композициями, включающими эксендин-4, сахарозу и сульфат аммония. На фиг. 2 также показан эффект пористости на высвобождение in vitro и влияние условий обработки, а именно соотношения силиконового масла к метиленхлориду, на пористость образованных микрочастиц. В целом, композиции с микрочастицами, приготовленные с использованием соотношения силиконового масла и метиленхлорида, равного 1:1 (композиции 2-4 и 2-5 в табл. 1) характеризуются более высоким первоначальным высвобождением, чем такие же композиции, приготовленные с использованием силиконового масла и метиленхлорида в соотношении 1,5:1 (композиции 2, 2-1 и 2-2 в табл. 1). Из данных фиг. 2 следует, что более высокое соотношение силиконового масла к метиленхлориду приводит к снижению пористости, что сказывается на снижении первоначального высвобождения. Криогенная SEM. Анализ в системе криогенной SEM проводят по описанной выше методике, применительно к композициям типа 2, 3 и 5 из табл. 1. На фиг. 3A, 3B показаны сканограммы микрофотографий выбранных композиций типа 2 (композиции 2-2, фиг. 3 А) и типа 5 (5% эксендин-4, 2% сахарозы, фиг. 3 В). На фиг. 4A-4D показаны сканограммы микрофотографий для композиций 3-4, 3-5, 3-6 и 3-7 соответственно,из табл. 1. И вновь, в криогенной SEM на поперечных срезах, показанных на фиг. 4A-4D, можно видеть вариации в пористости, наблюдаемые при использовании сульфата аммония, сказывающиеся на вариабельности первоначального высвобождения. Остаточные уровни растворителя. Уровень остаточных растворителей в данной композиции может оказывать воздействие на показатель Tg для композиции. Остаточные уровни растворителя определяют для композиций микрочастиц типа 2 и 5 из табл. 1. Был использован единственный метод для количественного определения гептана,этанола и метиленхлорида. Используемое оборудование состоит из газового хроматографа HP 5890 серии 2 с колонкой Rtx 1301, 30 м 0,53 мм. Растворяют примерно 130 мг микрочастиц в 10 мл N,Nдиметилформамида. Пропилацетат используют в качестве внутреннего стандарта. Препарат образца корректируют таким образом, чтобы можно было количественно определить концентрацию метиленхлорида, вплоть до 0,03%. На фиг. 5 показан график зависимости % содержания остаточного этанола и метиленхлорида в композициях типа 2 и 5 из табл. 1 (3 или 5% эксендина-4, 2% сахарозы). На фиг. 5 показано, что Tg снижается по мере повышения количества остаточного растворителя. Получение микрочастиц, содержащих 3% экседина-4 и 2% сахарозы. В связи с вариациями в пористости из-за присутствия сульфата аммония в композициях микрочастиц и в результате идентификации пористости как показателя, который существенно влияет на первоначальный выброс, в дальнейших исследованиях не отслеживается влияние сульфата аммония. Воздействие размера капель во внутренней эмульсии. Описанное ниже исследование было проведено с целью оценки воздействия параметров процесса на образование внутренней эмульсии, а также на стабильность полученной эмульсии и на достигаемое invitro высвобождение в течение 24 ч полученных микросфер с использованием различных параметров процесса. Внутренние эмульсии в водной фазе и в фазе растворителя получают путем обработки ультразвуком, как было описано выше, по 100-граммовой шкале или гомогенизацией с использованием гомогенизатора МТ 5000 с генератором 36/4 (Kinematica AG, Швейцария), с низкой скоростью (10800 об/мин) или с высокой скоростью (21300 об/мин). После образования внутренней эмульсии с использованием различных методик, полученные эмульсии выдерживают в реакторе при слабом перемешивании подвесным смесителем в течение 5, 15 или 60 мин перед отбором аликвот. По истечении установленных периодов выдерживания внутреннюю эмульсию подвергают дальнейшей обработке, как было описано выше, с получением микрочастиц, после чего оценивают высвобождение in vitro в течение 24 ч для каждой партии, как будет описано ниже. Диаметр капель во внутренней эмульсии может быть определен с использованием анализатора Horiba для определения размера частиц. Аликвоту внутренней эмульсии отбирают из реактора с помощью стеклянной пипетки. С использованием пипетки с меткой добавляют примерно 30 капель внутренней эмульсии примерно к 10 мл 6%Medisorb 50:50 4 А PLG раствора полимера во флаконы на 20 см 3 с закручивающимися крышками, со- 18011584 держащие сцинтилляционную жидкость, и все перемешивают. 6% Medisorb 50:50 4 А PLG раствор полимера также служит в качестве стандартного раствора слепой пробы. Затем переносят примерно 9 мл указанного образца разбавленной эмульсии в чистый держатель Horiba для образцов по 10 мл. Закрывают держатели с образцами для предотвращения быстрого испарения полимерного растворителя. Приготовленный образец укладывается в приемлемый диапазон % пропускания, равный 0,65-0,90% на синем свете (лампа). Относительный показатель преломления, установленный на уровне 0,94-0,00i, подбирают с помощью программного обеспечения. Затем образец исследуют в анализаторе Horiba, таком как модельLA 910, для определения размера капель. На фиг. 9 приведены данные, указывающие на наличие корреляции между параметрами процесса и достигаемым размером капель во внутренней эмульсии при времени выдерживания 5, 15 и 60 мин, а также уровнем высвобождения in vitro в течение 24 ч (в скобках). Характеристика микросфер. Микросферы с эксендином-4 анализируют известным способом с точки зрения содержания лекарственного средства, размера частиц, остаточных количеств растворителей, первоначального высвобождения in vitro и ФК показателей у крыс. Лекарственное средство экстрагируют с получением предварительных данных по чистоте эксендина-4 после инкапсулирования, в разных выбранных для анализа партиях. Первоначальное высвобождение in vitro. Первоначальное высвобождение эксендина-4 определяют при измерении концентрации эксендина 4 через 1 ч в буфере для высвобождения (10 мМ HEPES, 100 мМ NaCl pH 7,4). 1505 мг микросфер помещают в 5,0 мл буфера, содержащего 10 мМ HEPES, 100 мМ NaCl, pH 7,4, при комнатной температуре и перемешивают в вихревом смесителе в течение примерно 30 с для суспендирования раствора и затем помещают в воздушную камеру при 37 С на 1 ч. Через 1 ч образцы отбирают из камеры и несколько раз переворачивают их для перемешивания, после чего центрифугируют при 3500 об/мин в течение 10 мин. Затем отбирают супернатант и сразу же проводят анализ по методу ВЭЖХ в следующих условиях: колонка TSK-GEL, 7,8 мм 30 см, 5 м (TSOH BIOSEP PART 08540); Температура термостата для колонки: температура окружающей среды, температура аутосемплера: 6 С; скорость течения: 0,8 мл/мин; выявление: при длине волны 280 нм; инъецируемый объем: 10 л; мобильная фаза: 35% ацетонитрил/65% вода с содержанием 0,1% ТФУ/литр (об./об.); время анализа: примерно 20 мин. Лекарственное вещество эксендин-4 в объеме, 0,2 мг/мл, приготовленное в 30 мМ ацетатном буфере, pH 4,5, используют в качестве стандарта. Исследования на животных. Все фармакокинетические (ФК) исследования, приведенные в настоящем описании, проводят на взрослых самцах крыс Sprague-Dawley с весом примерно 50050 г. Для фармакокинетической характеристики композиций микрочастиц каждому животному проводят подкожную инъекцию микрочастиц, суспендированных в разбавителе (3% карбоксиметилцеллюлозы,0,9% NaCl, 0,1% Tween 20) в межлопаточную область. В основном доза составляет примерно 1,0 мг эксендина-4 на крысу в инъецируемом объеме 0,75 мл. Образцы крови отбирают через латеральную хвостовую вену в точках 0,5, 2, 4, 6, 10, 24 ч и 2, 4, 7, 10, 14, 17, 21, 24 и 28 дней после введения дозы. Образцы крови сразу помещают в пробирки MICROTAINER, содержащие ЭДТА, и центрифугируют примерно при 14000g в течение примерно 2 мин. Затем плазму переносят в пробирки MICROTAINER без добавок и хранят при температуре -70 С до проведения анализа. Используют метод IRMA для определения концентрации эксендина в плазме. Определение высвобождения in vivo по методу IRMA. Для количественного определения эксендина-4 в плазме крови используют иммунологический анализ по методу сэндвича с вариантом анализа по захвату моноклонального антитела ЕХЕ 42-8.4 в твердой фазе, выявляя его количество по уровню радиоактивной метки в моноклональном антителе GLP-1:3-3,меченном радиоактивным йодом. Показатель счета анализируют с использованием стандартной калибровочной кривой. Данный тест является специфичным для эксендина-4 полной длины или интактного эксендина-4 и не позволяет выявить эксендин-4 (3-39). Типичный диапазон стандартной кривой составляет 30-2000 пг/мл в зависимости от срока хранения меченого антитела. Высвобождение in vitro и in vivo. Композиции 2, 2-1 и 2-2 (3% эксендина-4 и 2% сахарозы) оценивают по их первоначальному выбросу in vitro, как было описано выше. Высвобождение in vitro составляет 0,4, 0,4 и 0,5%, соответственно. Все три партии также характеризуются относительно низким первоначальным выбросом in vivo в диапазоне от 1154 до 1555 пг/мл как Cmax в 0-1 день. На фиг. 6 приведена репрезентативная фармакокинетическая кривая для композиций, содержащих 3% эксендина-4 и 2% сахарозы (2-1), а также для композиции с 3% только эксендина-4 (1) и композиции с 3% эксендина-4 и 0,5% сульфата аммония (4). Используют соотношение силиконового масла к метиленхлориду, равное 1,5:1, и вязкость силиконового масла составляет 350 сП. Из данных, приведенных на фиг. 6, можно видеть, что композиции, не содержащие сульфата аммония, демонстрируют сниженное первоначальное высвобождение. Хотя композиция, содержащая только- 19011584 эксендин-4, демонстрирует приемлемое первоначальное высвобождение, чистота лекарственного средства после инкапсулирования снижается, в сравнении с композицией, содержащей эксендин-4 в сочетании с сахарозой. Добавление сахара в композицию снижает разложение агента. Профиль высвобождения in vivo для трех композиций 2, 2-1 и 2-2, описанных выше, показан на фиг. 7. Все три партии демонстрируют относительно низкое первоначальное высвобождение с последующим прорывом (низкие уровни сыворотки поддерживаются в период примерно от 4 до 17 дня),после чего идет замедленное высвобождение в период от 21 до 28 дня. Низкое первоначальное высвобождение и форма профиля высвобождения отмечены для всех трех композиций. Композиции с использованием соотношения 1:1 силиконового масла к метиленхлориду. Композиции 2-3, 2-4 и 2-5 из табл. 1 (3% эксендина-4 и 2% сахарозы) готовят с использованием соотношения 1:1 силиконового масла к метиленхлориду. Первоначальное высвобождение в этих композициях выше, чем у композиций 2, 2-1 и 2-2 из таблицы 1 (3% эксендина-4 и 2% сахарозы с соотношением 1,5:1 силиконового масла к метиленхлориду). А именно соотношение 1,5:1 в композициях обеспечивает среднее первоначальное высвобождение, равное примерно 0,4%, тогда как соотношение 1:1 в композициях дает среднее первоначальное высвобождение, равное примерно 1,0%. Такая же тенденция наблюдается in vivo со значением Cmax в 0-1 день у крыс, равным 2288520 пг/мл, в случае соотношения 1:1, тогда как Cmax в 0-1 день у крыс составляет 1300221 пг/мл в случае соотношения 1,5:1. Повышение лекарственного средства, вводимого в композицию. Повышение количества эксендина-4 в композиции до 4% при сохранении содержания сахарозы на уровне 2% приводит к первоначальному высвобождению in vitro и in vivo в том же диапазоне, что и при введении 3% количества. Готовят три композиции типа 5 из табл. 1 (5% лекарственного средства, 2% сахарозы, соотношение 1,5:1 силиконового масла к метиленхлориду). Все три партии 5-1, 5-2 и 5-3 демонстрируют низкое первоначальное высвобождение in vitro, варьирующееся от 0,2 до 0,5%. Аналогично, значение Cmax in vivo было неизменно низким и варьировалось от 467 до 1267 пг/мл для всех трех исследованных партий. На фиг. 8 показан график фармакокинетической оценки для трех последующих партий. В сравнении с композицией, включающей 3% эксендина-4, композиции, аналогичные 5%-м композициям, создавали более высокие уровни лекарственного средства в сыворотке крови в период примерно от 1 до 2 дня. Оставшаяся часть профиля для 5% композиций аналогична таковым для 3% композиций, имеющих прорыв после высвобождения лекарственного средства в основном в период от 21 до 28 дней. Несмотря на то, что данное изобретение было конкретно показано и описано со ссылкой на предпочтительные варианты его осуществления, специалистам в данной области понятно, что возможны различные изменения в форме и деталях без отклонений от области настоящего изобретения, определенной в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для замедленного высвобождения биологически активного полипептида, состоящая из биосовместимого полимера, биологически активного полипептида и сахара, в которой общий объем пор составляет примерно 0,1 мл/г или менее, как это определено с использованием метода ртутной интрузионной порометрии, чтобы обеспечить профиль высвобождения, имеющий соотношение максимальной концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cmax) к средней концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее. 2. Композиция с замедленным высвобождением по п.1, в которой биологически активный полипептид представляет собой пептид с глюкорегуляторным действием, выбранный из группы, состоящей из глюкагона, глюкагонподобных пептидов, эксендинов и агонистов глюкагонподобных пептидов. 3. Композиция с замедленным высвобождением по п.2, в которой пептид с глюкорегуляторным действием выбирают из GLP-1, GLP-2, эксендина-3, эксендина-4 или их сочетания. 4. Композиция с замедленным высвобождением по п.3, в которой биологически активный полипептид присутствует в количестве от примерно 0,1 до примерно 10 мас.% от общей массы композиции с замедленным высвобождением. 5. Композиция с замедленным высвобождением по п.4, в которой биологически активный полипептид присутствует в количестве от примерно 0,5 до примерно 5 мас.% от общей массы композиции с замедленным высвобождением. 6. Композиция с замедленным высвобождением по п.5, в которой сахар присутствует в количестве от примерно 0,01 до примерно 10 мас.% от общей массы композиции с замедленным высвобождением. 7. Композиция с замедленным высвобождением по п.6, в которой сахар присутствует в количестве от примерно 0,1 до примерно 5 мас.% от общей массы композиции с замедленным высвобождением. 8. Композиция с замедленным высвобождением по п.7, в которой сахар выбирают из моносахарида,дисахарида, сахарного спирта или их сочетания. 9. Композиция с замедленным высвобождением по п.8, в которой сахар выбирают из сахарозы,- 20011584 маннита и их сочетания. 10. Композиция с замедленным высвобождением по п.8, в которой биосовместимый полимер выбирают из группы, состоящей из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот, поликапролактона, поликарбонатов, полиэфирамидов, полиангидридов, полиаминокислот, полиортоэфиров, полицианоакрилатов, поли-п-диоксанона, полиалкиленоксалатов, биоразлагаемых полиуретанов, их смесей и их сополимеров. 11. Композиция с замедленным высвобождением по п.10, в которой биосовместимый полимер включает сополимер лактида и гликолида. 12. Композиция с замедленным высвобождением по п.11, в которой биосовместимый полимер представляет собой 50:50 сополимер лактида и гликолида. 13. Композиция с замедленным высвобождением по п.12, в которой биосовместимый полимер имеет присущую ему вязкость от примерно 0,3 до 0,5 дл/г. 14. Композиция с замедленным высвобождением биологически активного полипептида, включающая биосовместимый полимер, содержит диспергированный в ней биологически активный полипептид в количестве примерно от 0,5 до примерно 5 мас.% от массы композиции и диспергированную в ней сахарозу в количестве примерно 2 мас.% от массы композиции. 15. Композиция с замедленным высвобождением по п.14, в которой биологически активный полипептид представляет собой эксендин-4. 16. Композиция с замедленным высвобождением по п.15, в которой биологически активный полипептид диспергирован в количестве примерно 5 мас.% от массы композиции. 17. Композиция с замедленным высвобождением по п.14, в которой композиция состоит, по существу, из биосовместимого полимера, диспергированного эксендина-4 в количестве примерно 5 мас.% и диспергированной сахарозы примерно в количестве 2 мас.% по массе композиции. 18. Композиция с замедленным высвобождением по п.16 или 17, в которой биосовместимый полимер выбирают из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот и их смесей и сополимеров. 19. Композиция с замедленным высвобождением по п.18, в которой биосовместимый полимер включает сополимер лактида и гликолида. 20. Композиция с замедленным высвобождением по п.19, в которой биосовместимый полимер представляет собой 50:50 сополимер лактида и гликолида. 21. Композиция с замедленным высвобождением по п.18, в которой профиль высвобождения композиции имеет соотношение максимальной концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cmax) к средней концентрации биологически активного полипептида в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее. 22. Композиция с замедленным высвобождением эксендина-4, включающая биосовместимый полимер, содержит диспергированные в ней эксендин-4 в количестве примерно от 3 до примерно 5 мас.% от массы композиции и диспергированную в ней сахарозу в количестве примерно 2 мас.% от массы композиции. 23. Композиция с замедленным высвобождением по п.22, в которой эксендин-4 диспергирован в количестве примерно 5 мас.% от массы композиции. 24. Применение композиции с замедленным высвобождением эксендина-4, включающей биосовместимый полимер, эксендин-4 и сахарозу, в которой общий объем пор составляет примерно 0,1 мл/г или менее, как это определено с использованием метода ртутной интрузионной порометрии, чтобы обеспечить профиль высвобождения, имеющий соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) к средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее, в производстве лекарственного средства для лечения диабета 2 типа. 25. Применение по п.24, в котором биосовместимый полимер выбирают из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот, сополимеров молочной и гликолевой кислот и их смесей и сополимеров. 26. Применение композиции с замедленным высвобождением эксендина-4, включающей биосовместимый полимер с диспергированным в ней эксендин-4 в количестве примерно от 0,5 до примерно 5 мас.% от массы композиции и диспергированной в ней сахарозой в количестве примерно 2 мас.% от массы композиции, в производстве лекарственного средства для лечения диабета 2 типа. 27. Применение по п.26, в котором эксендин-4 диспергирован в количестве примерно 5 мас.% от массы композиции. 28. Способ получения композиции с замедленным высвобождением полипептида, включающий стадии: а) получения смеси путем объединения водной фазы, включающей водорастворимый полипептид и сахар, с масляной фазой, включающей биосовместимый полимер и растворитель для полимера;b) получения эмульсии типа вода-в-масле из смеси, полученной на стадии а);c) добавления агента коацервации к смеси с получением зародышевых микрочастиц, где агент коацервации представляет собой силиконовое масло, добавляемое в количестве, достаточном для достижения соотношения силиконового масла и растворителя для полимера от примерно 1:1 до примерно 1,5:1;d) переноса зародышевых микрочастиц к растворителю для гашения для отверждения микрочастиц;e) сбора отвержденных микрочастиц иf) сушки отвержденных микрочастиц. 29. Способ по п.28, в котором соотношение силиконового масла и растворителя полимера составляет 1,5:1. 30. Способ по п.28, в котором полимер присутствует в масляной фазе в концентрации примерно 10% мас./об. или менее. 31. Способ по п.28, в котором указанный полимер выбирают из группы, состоящей из полилактидов, полигликолидов, сополимеров лактида и гликолида, полимолочных кислот, полигликолевых кислот,сополимеров молочной и гликолевой кислот и их смесей и сополимеров. 32. Способ по п.28, в котором полипептид выбирают из группы, состоящей из глюкагона, глюкагонподобных пептидов, эксендинов и агонистов глюкагонподобных пептидов. 33. Композиция с замедленным высвобождением по любому из пп.1-23, которая находится в форме микрочастиц. 34. Инъецируемая композиция, пригодная для прохождения через иглу, включающая:(a) композицию с замедленным высвобождением по любому из пп.1-23 и(b) водную среду для инъекций. 35. Инъецируемая композиция, пригодная для прохождения через иглу, включающая:(a) композицию с замедленным высвобождением по п.33 и(b) водную среду для инъекций. 36. Инъецируемая композиция по п.34 или 35, в которой водная среда для инъекций имеет вязкость по меньшей мере 20 сП при 20 С. 37. Инъецируемая композиция по п.34 или 35, в которой водная среда для инъекций имеет вязкость от более чем 50 сП при 20 С до менее чем 60 сП при 20 С. 38. Инъецируемая композиция по п.35, в которой микрочастицы суспендированы в водной среде для инъекций в концентрации более чем 30 мг/мл в форме суспензии, имеющей жидкую фазу, и в которой жидкая фаза суспензии имеет вязкость по меньшей мере 20 сП при 20 С. 39. Инъецируемая композиция по п.34 или 35, дополнительно содержащая по меньшей мере один повышающий вязкость агент, повышающий плотность агент, повышающий концентрацию агент и увлажняющий агент. 40. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром от примерно 23 размера до примерно 18 размера. 41. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром от примерно 25 размера до примерно 18 размера. 42. Инъецируемая композиция по пп.34-38, которая пригодна для прохождения через иглу диаметром примерно 23 размера, где водная среда для инъекций содержит натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об., Полисорбат 20 0,1% об./об. и воду. 43. Инъецируемая композиция по п.42, дополнительно содержит буфер. 44. Инъецируемая композиция по п.35, которая пригодна для прохождения через иглу диаметром от примерно 23 размера до примерно 18 размера, где средний размер частиц у микрочастиц составляет от примерно 50 до примерно 100 мкм. 45. Инъецируемая композиция по п.35, которая пригодна для прохождения через иглу диаметром от примерно 25 размера до примерно 18 размера, где средний размер частиц у микрочастиц составляет от примерно 50 до примерно 100 мкм. 46. Инъецируемая композиция, пригодная для прохождения через иглу 25 размера, включающая композицию с замедленным высвобождением, содержащую 50:50 DL PLG 4 А полимера, примерно 3-5 мас.% эксендина-4 и примерно 2 мас.% сахарозы, где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее и где общий объем пор в композиции составляет примерно 0,1 мл/г или менее, суспендированную в среде для инъекций, включающей натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об. и Полисорбат 20 0,1% об./об. в воде. 47. Набор для получения инъецируемой композиции, пригодной для прохождения через иглу 25 размера, включающий:(а) флакон, содержащий терапевтически эффективную дозу сухой композиции с замедленным высвобождением, которая содержит 50:50 DL PLGA 4A полимера, примерно 3-5 мас.% эксендина-4 и примерно 2 мас.% сахарозы, где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cave) примерно 3 или менее, и где общий объем пор в композиции составляет примерно(b) флакон, содержащий среду для инъекций, которая включает натрий карбоксиметилцеллюлозу в концентрации 3,0% мас./об., хлорид натрия 0,9% мас./об. и Полисорбат 20 0,1% об./об. в воде, где имеется достаточное количество среды для инъекции, с тем чтобы суспендировать композицию с замедленным высвобождением в концентрации по меньшей мере 30 мг/мл. 48. Способ получения фармацевтически приемлемой композиции с замедленным высвобождением эксендина-4, включающий:a) получение смеси путем объединения водной фазы, включающей водорастворимый полипептид эксендин-4 и сахарозу, в отсутствие сульфата аммония, с масляной фазой, включающей очищенный 50:50 DL PLG 4A полимер в метиленхлориде; где очищенный полимер обладает вязкостью примерно от 0,3 до 0,5 дл/г;b) получение эмульсии типа вода-в-масле из смеси, полученной на стадии а), где размер капель во внутренней эмульсии составляет примерно от 0,2 до 0,4 мкм;c) добавление агента коацервации к смеси с получением зародышевых микрочастиц, где агент коацервации представляет собой силиконовое масло, добавляемое в количестве, достаточном для достижения соотношения силиконового масла к растворителю для полимера от примерно 1:1 до примерно 1,5:1,и где силиконовое масло добавляют к эмульсии типа вода-в-масле в течение примерно менее 3 мин, и смесь для коацервации выдерживают в течение примерно 1 мин или менее;d) перенос зародышевых микрочастиц к растворителю для гашения в соотношении растворителя для гашения и метиленхлорида, равном 16:1 об./об., для отверждения микрочастиц, где растворитель для гашения представляет собой смесь гептан/этанол и время переноса составляет примерно 3 мин или менее;e) сбор отвержденных микрочастиц иf) сушку отвержденных микрочастиц; где соотношение максимальной концентрации эксендина-4 в сыворотке в течение периода высвобождения (Cmax) и средней концентрации эксендина-4 в сыворотке в течение периода высвобождения(Cave) примерно 3 или менее и где общий объем пор в композиции составляет примерно 0,1 мл/г или менее.
МПК / Метки
МПК: A61K 9/10, A61K 9/50, A61K 38/26, A61K 47/26, A61K 47/38, A61K 38/22
Метки: полипептид, сополимере, основанные, лактида, гликолида, включающие, замедленным, сахар, высвобождением, микрокапсулы
Код ссылки
<a href="https://eas.patents.su/27-11584-mikrokapsuly-s-zamedlennym-vysvobozhdeniem-osnovannye-na-sopolimere-laktida-i-glikolida-vklyuchayushhie-polipeptid-i-sahar.html" rel="bookmark" title="База патентов Евразийского Союза">Микрокапсулы с замедленным высвобождением, основанные на сополимере лактида и гликолида, включающие полипептид и сахар</a>
Предыдущий патент: Миметические антитела glp – 1 человека, композиции, способы и применения
Следующий патент: Смеси антраниламидных средств борьбы с беспозвоночными вредителями