Способ стимуляции иммунного ответа путем введения тиазолидных соединений
Формула / Реферат
1. Способ стимуляции иммунного ответа у субъекта, нуждающегося в этом, включающий введение указанному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество тиазолидного соединения, где указанное тиазолидное соединение представляет собой нитазоксанид, или тизоксанид, или N-(5-хлортиазол-2-ил)-2-гидроксибензамид, или его соль, или его полиморф.
2. Способ по п.1, отличающийся тем, что субъект страдает вирусной инфекцией, раком или внутриклеточной протозойной инфекцией или имеет риск их развития.
3. Способ по п.1 или 2, отличающийся тем, что тиазолидное соединение вводят в комбинации с вакциной, иммуностимулятором, ингибитором нейраминидазы, выбранным из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира, аналогом адамантина или рекомбинантным гибридным белком сиалидазой.
4. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает вирусной инфекцией.
5. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает раком.
6. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает внутриклеточной протозойной инфекцией.
7. Способ по п.5, отличающийся тем, что тиазолидное соединение вводят в комбинации с противораковым лекарственным средством.
8. Способ по п.6, отличающийся тем, что тиазолидное соединение вводят в комбинации с вакциной, или иммуностимулятором, или противопротозойным лекарственным средством.
Текст
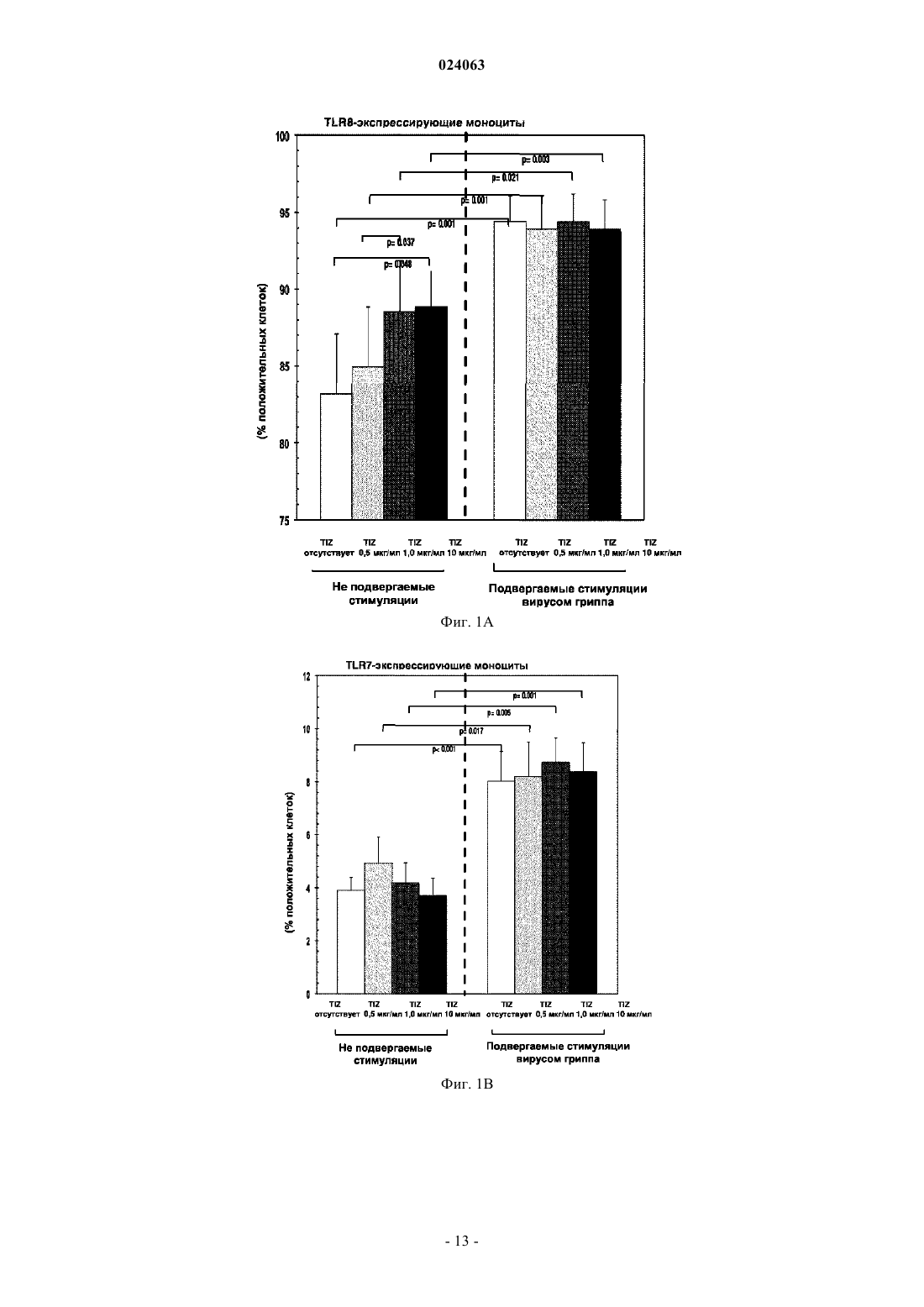
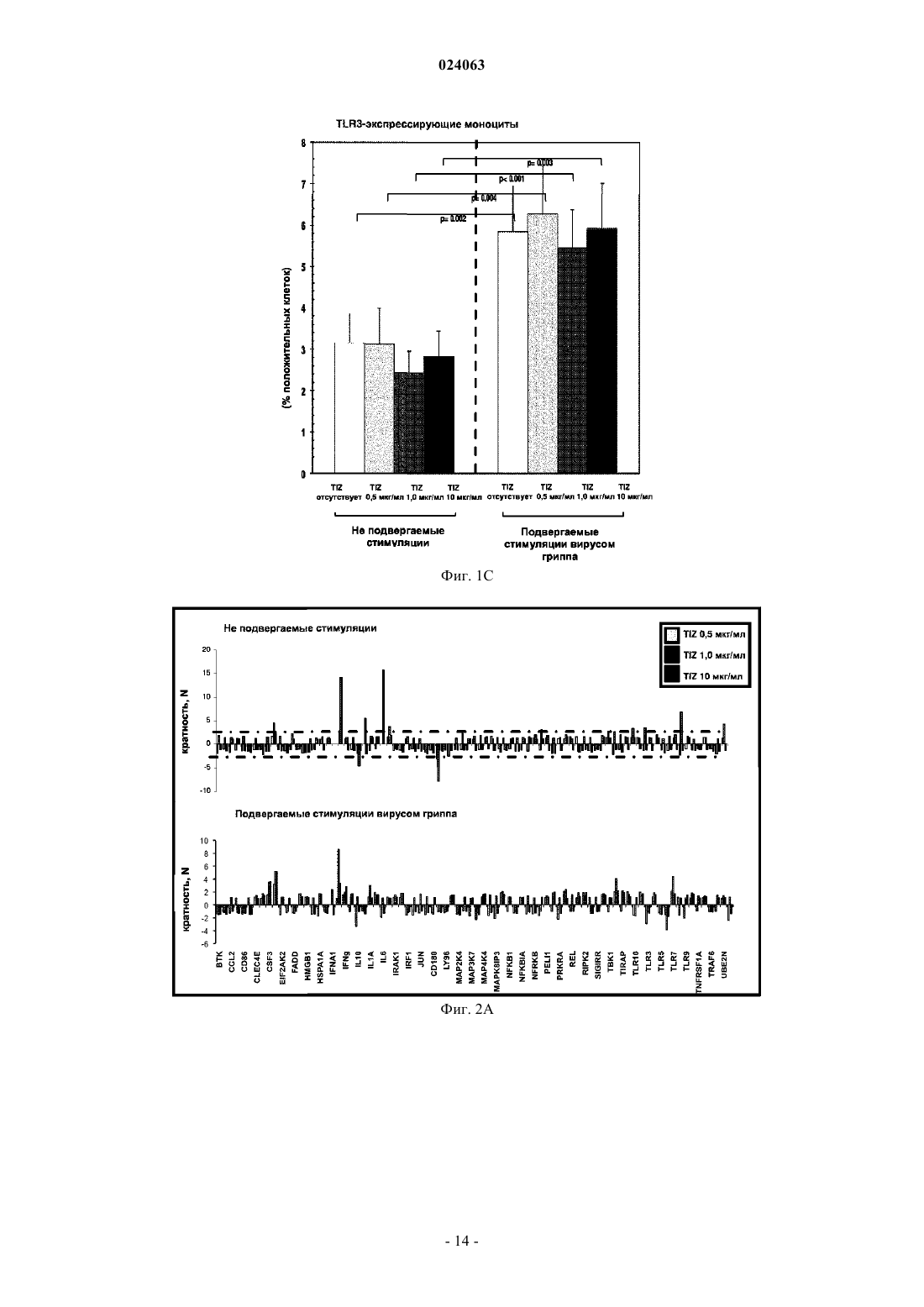
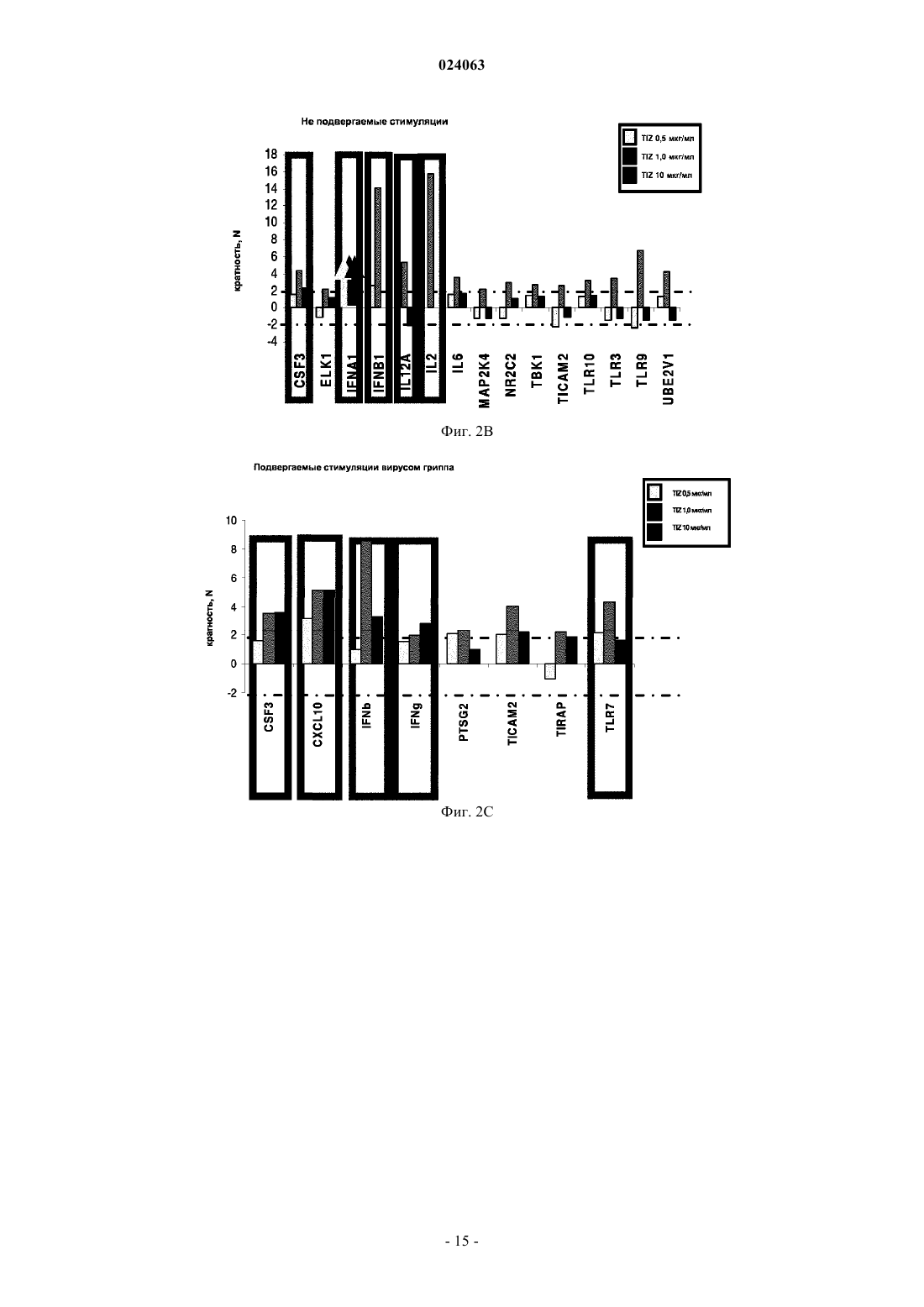
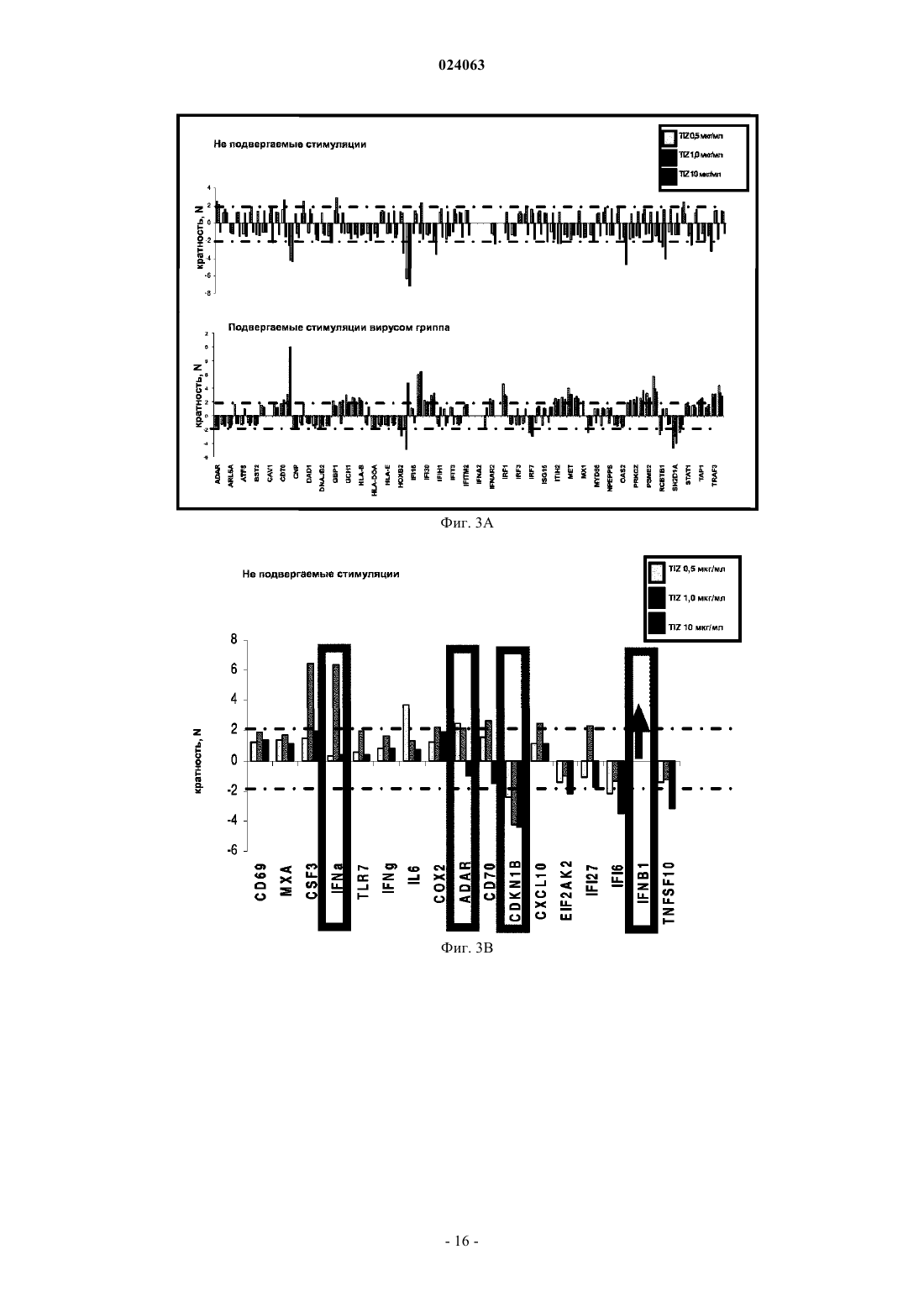
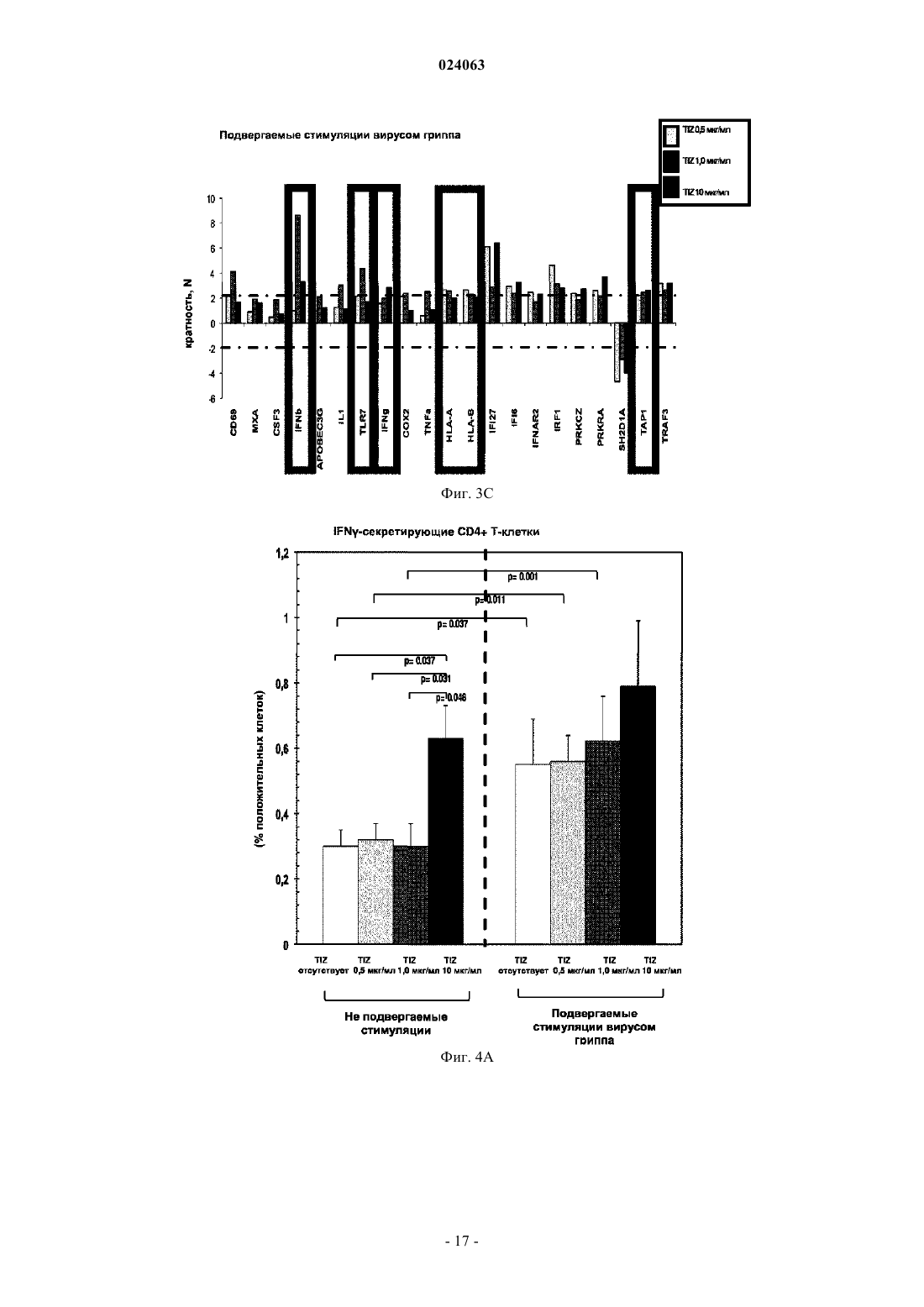
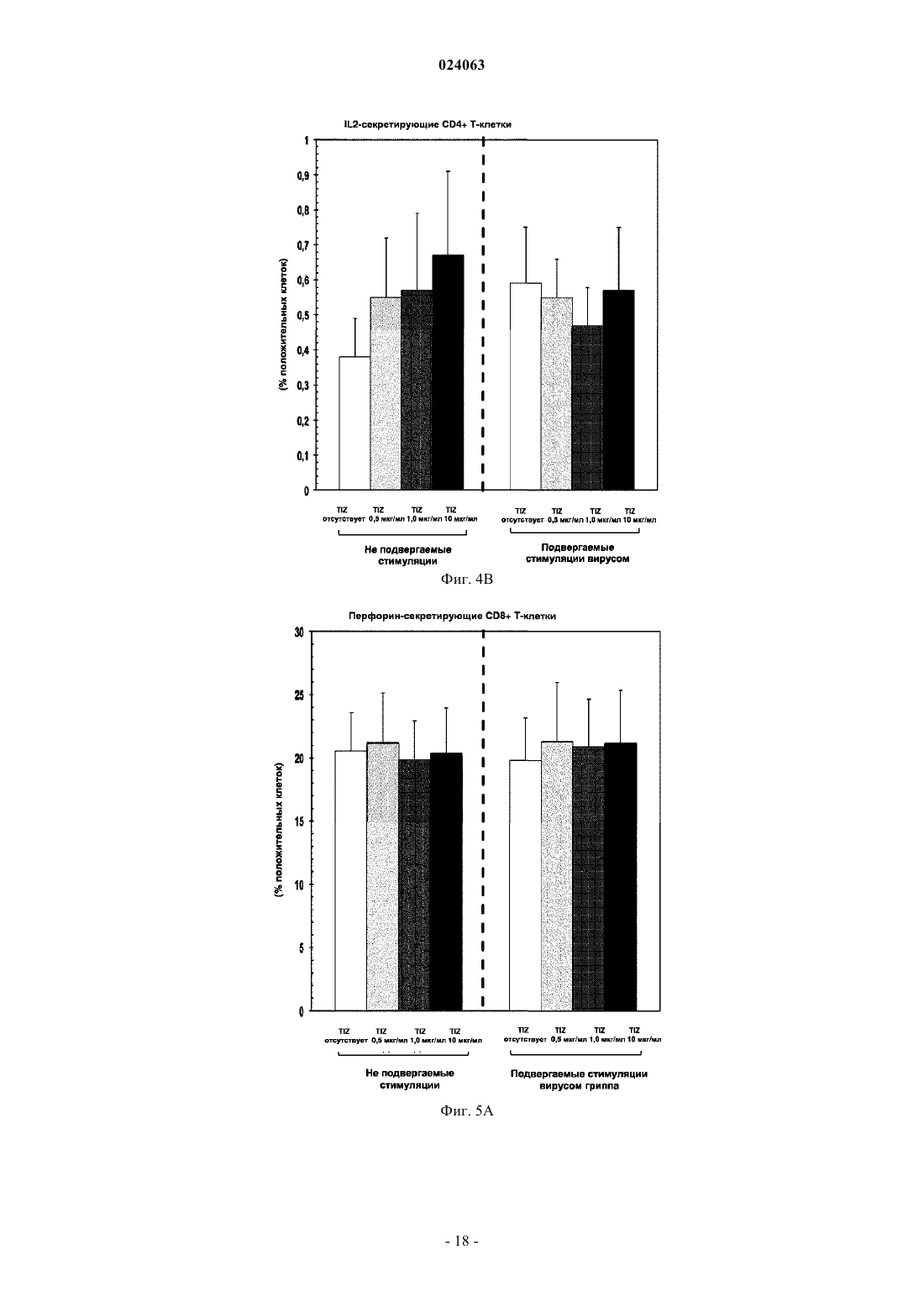
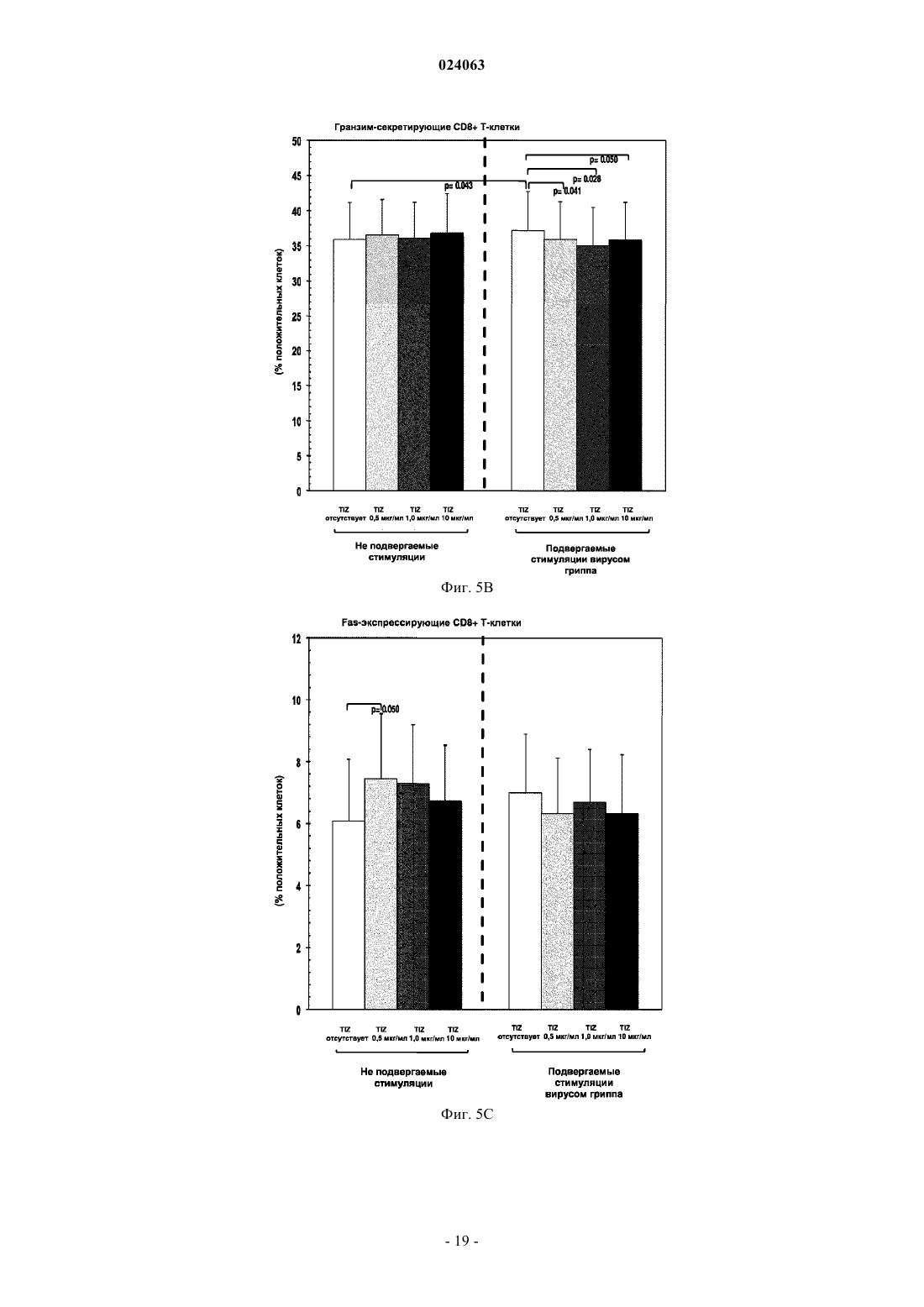
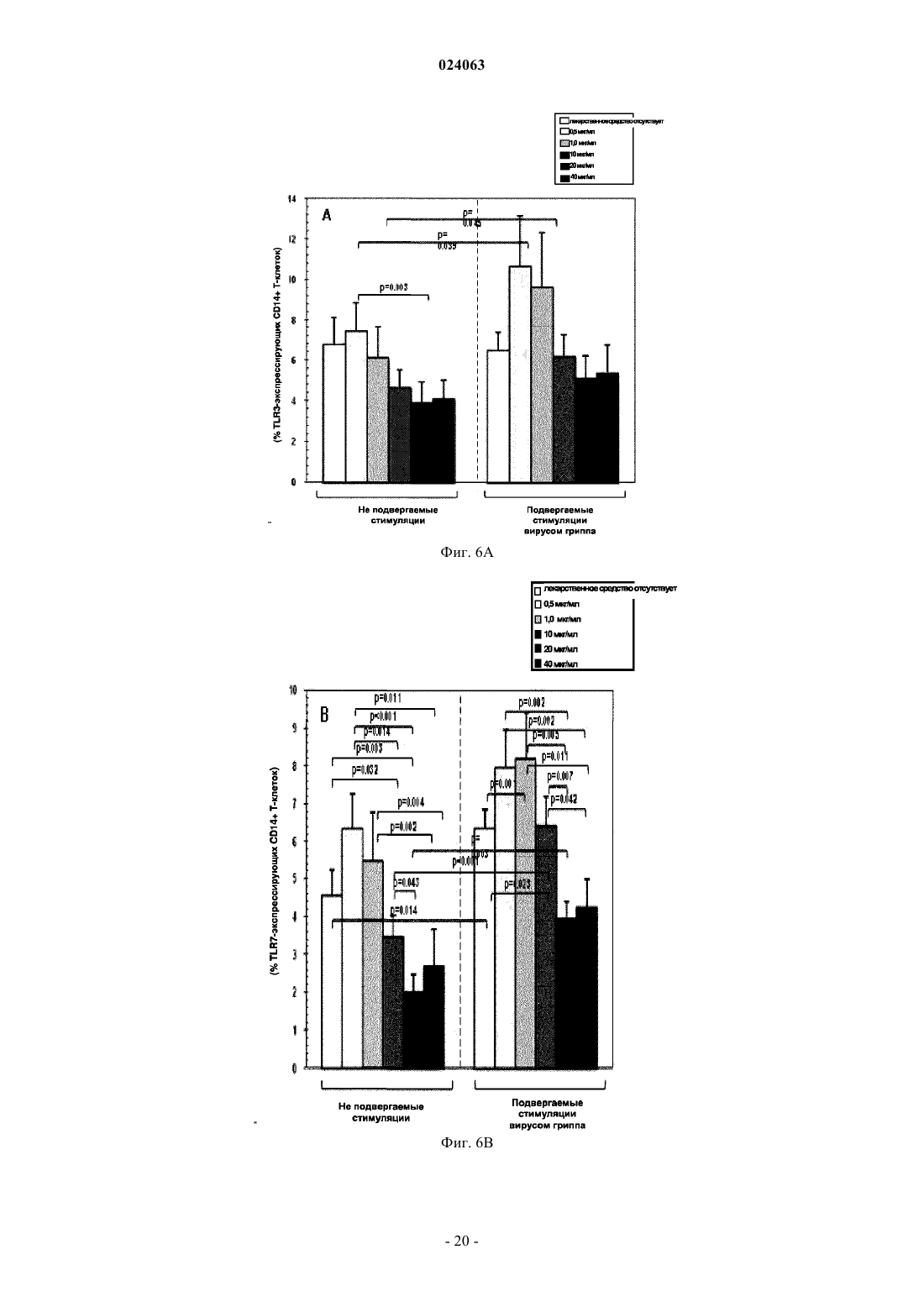
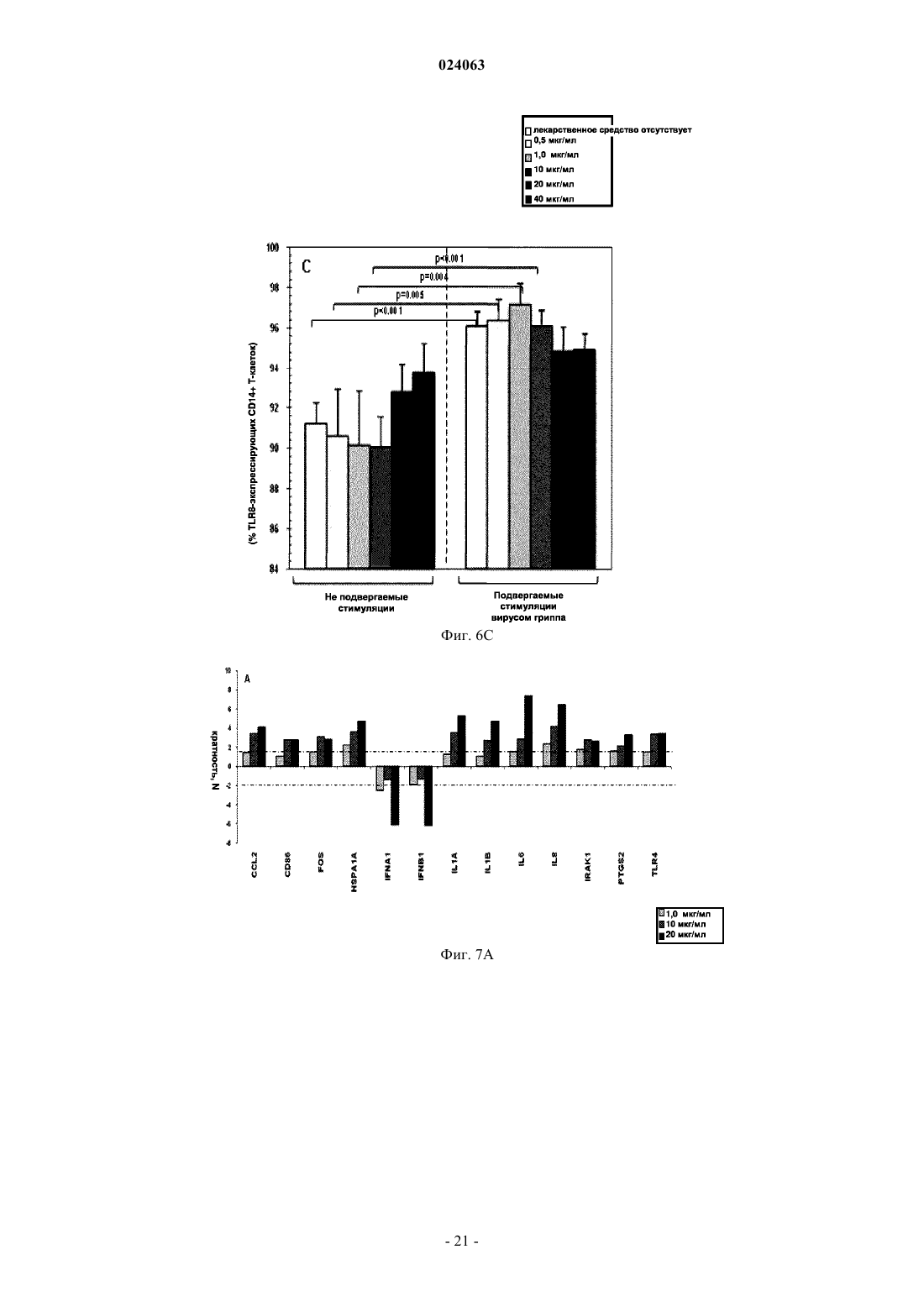
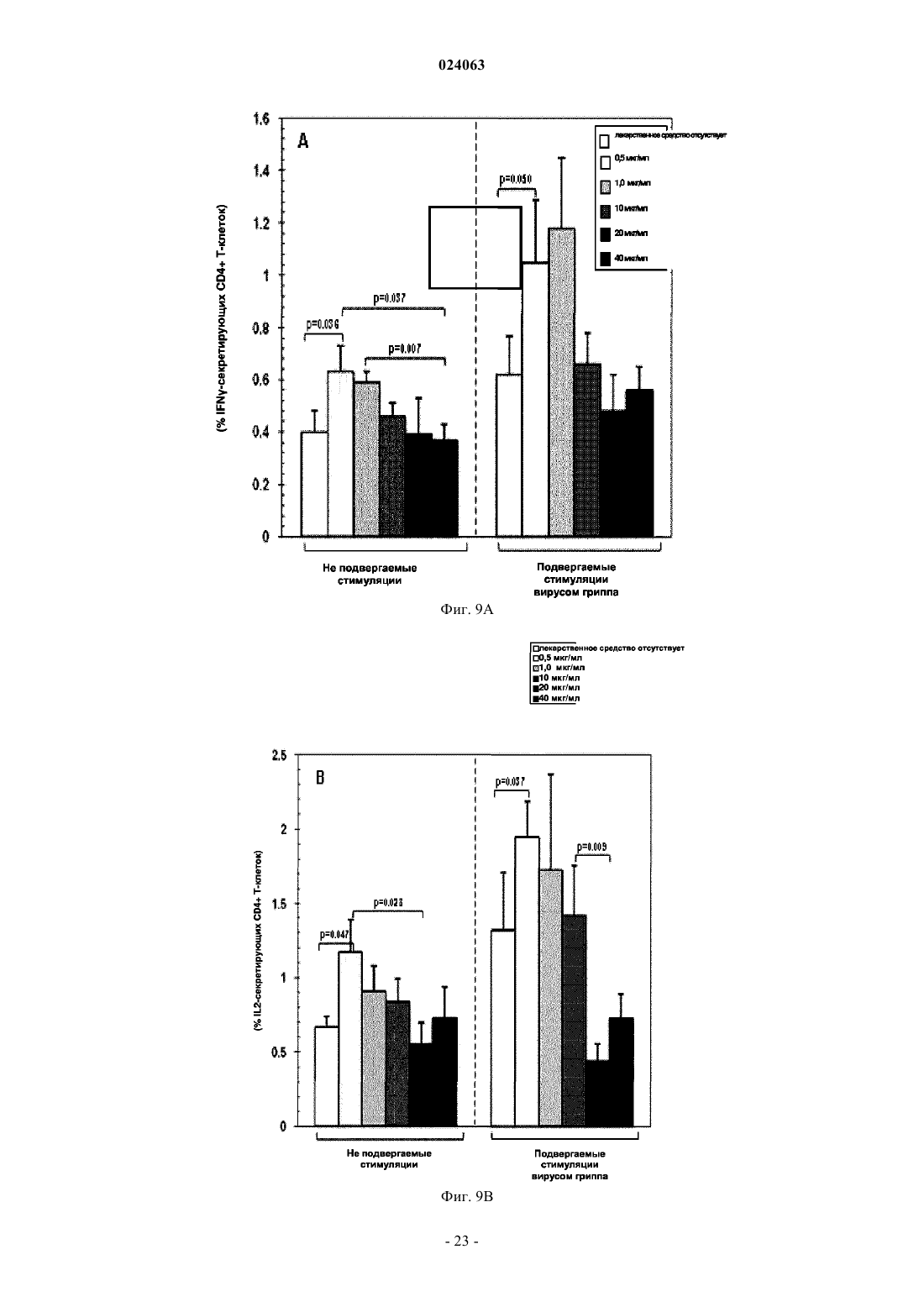
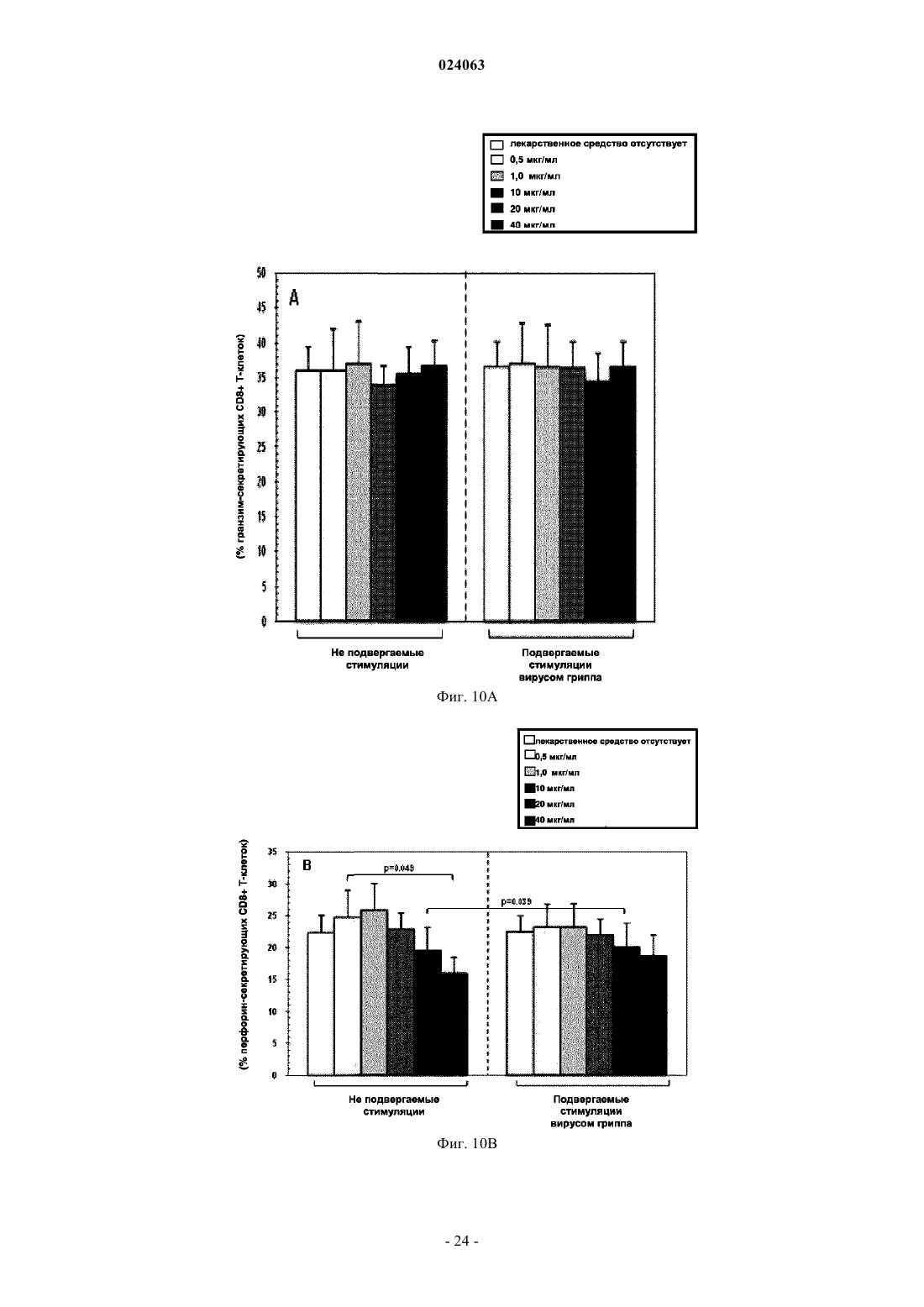
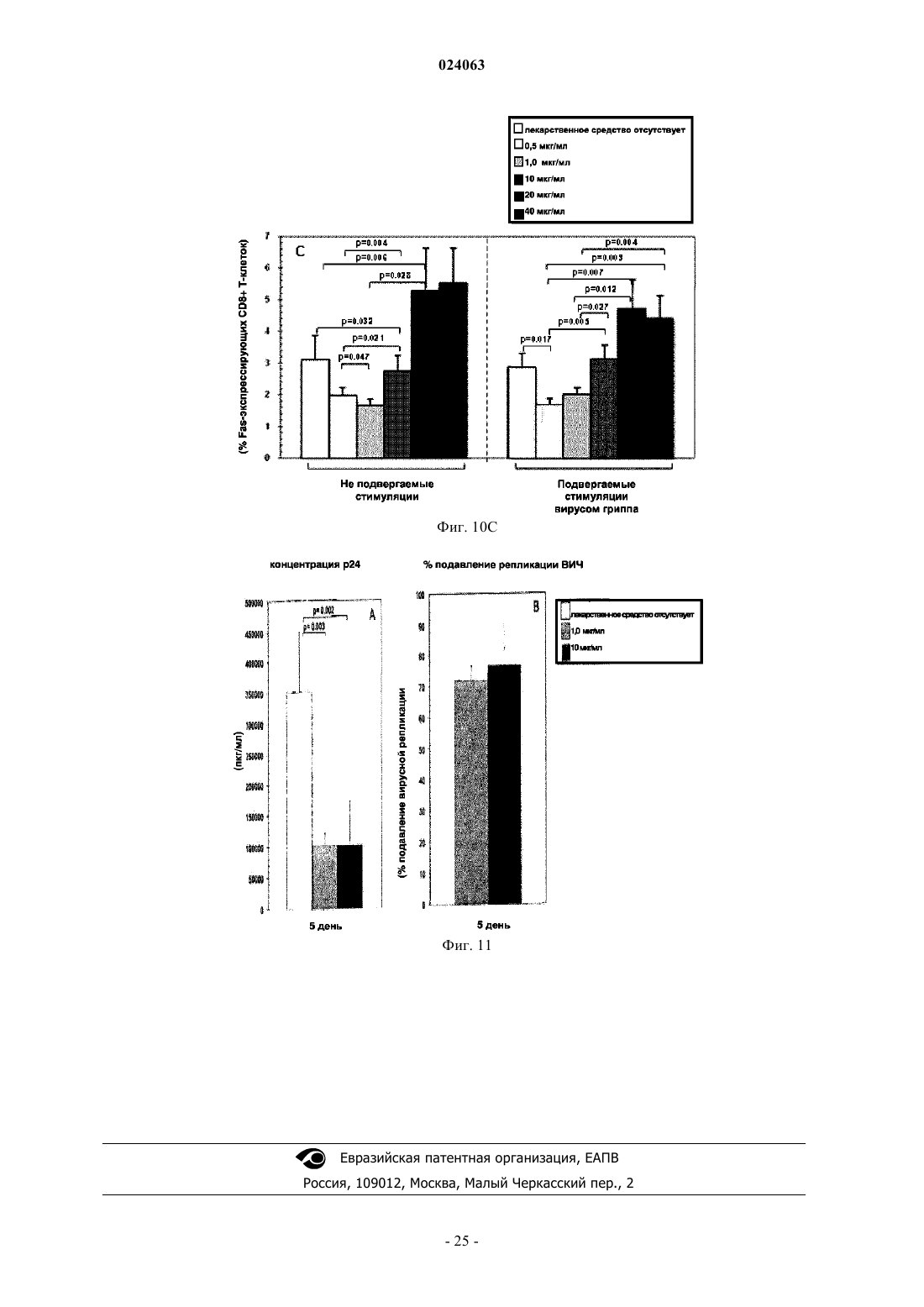
СПОСОБ СТИМУЛЯЦИИ ИММУННОГО ОТВЕТА ПУТЕМ ВВЕДЕНИЯ ТИАЗОЛИДНЫХ СОЕДИНЕНИЙ Согласно изобретению предложено применение фармацевтических композиций, содержащих тиазолид, для стимуляции иммунной системы у субъекта, нуждающегося в указанной стимуляции,и, таким образом, предотвращения и/или лечения вирусных заболеваний, рака и заболеваний,вызванных внутриклеточными протозойными инфекциями. Перекрестная ссылка на родственные патентные заявки Заявка на данное изобретение испрашивает приоритет согласно предварительной заявке на патент США 61/486728, поданной 16 мая 2011 г., которая полностью включена в данное описание посредством ссылки. Область техники Настоящее изобретение относится к композициям и способам для иммуномодуляции, включая предотвращение или лечение вирусных заболеваний, рака и заболеваний, вызванных внутриклеточными протозойными инфекциями. Уровень техники Грипп представляет собой высококонтагиозное острое респираторное заболевание, которое поражает все возрастные группы населения и лишь в США приводит примерно к 36000 смертельных исходов и более 226000 случаев госпитализации в год. Вирусы гриппа представляют собой оболочечные РНКвирусы с "отрицательной" цепью РНК, которые классифицируют (как типы А, В и С) в соответствии с антигенными различиями их нуклеопротеина и матриксного белка. Многочисленные подтипы вируса гриппа А различаются по двум поверхностным гликопротеинам, гемагглютинину ("НА") и нейраминидазе ("NA"), которые представляют собой основные мишени защитного иммунного ответа и обозначаются в соответствии с типом гемагглютинина (указывается с помощью числа Н) и нейраминидазы (указывается с помощью числа N). НА и NA непрерывно изменяются в результате антигенного дрейфа и антигенной изменчивости. Известно 16 подтипов Н (или "серотипов") и 9 подтипов N. Гепатит В представляет собой инфекционное заболевание, вызываемое вирусом гепатита В (HBV). Примерно четверть населения мира - более 2 миллиардов человек - были инфицированы вирусом гепатита В. Острое заболевание вызывает воспаление печени, рвоту, желтуху и в редких случаях смерть. Хронический гепатит В в конечном итоге может приводить к циррозу печени и раку печени - смертельному заболеванию с очень слабым ответом на существующее в настоящее время химиотерапевтическое лечение. Вирус гепатита В имеет кольцевой геном, состоящий из частично двухцепочечной ДНК, который,подобно ретровирусам, реплицируется через РНК-посредника путем обратной транскрипции. Несмотря на то, что репликация вируса происходит в печени, указанный вирус проникает в кровь, и в крови у инфицированных людей обнаружены вирус-специфичные белки и соответствующие антитела. Рак характеризуется неконтролируемым ростом и распространением аномальных клеток. Поскольку опухолевые клетки происходят из нормальных клеток, иммунная система хозяина не распознает антигены опухолевых клеток как чужеродные. Более того, некоторые опухоли развивают способы "ускользания" от защитного иммунного ответа организма путем устранения антигенов или снижения количества рецепторов на поверхности клеток. Меланома представляет собой злокачественную опухоль кожи, которая развивается из меланоцитов. При выявлении и лечении на ранней стадии она излечима примерно в 100% случаев. При отсутствии лечения на ранней стадии рак может прогрессировать, распространяться и приводить к смертельному исходу. Меланома представляет собой рак кожи, который приводит к наибольшему количеству смертельных случаев. Меланома с поверхностным распространением является наиболее распространенным типом меланомы, особенно среди молодых людей. Указанная меланома поражает только верхний слой кожи в течение довольно длительного времени до начала более глубокого проникновения. Злокачественное лентиго обнаруживается наиболее часто у пожилых людей, которые подвержены постоянному воздействию солнца. Акральная лентигинозная меланома также распространяется на поверхности до начала более глубокого проникновения и является наиболее распространенной меланомой у афроамериканцев и азиатов и наименее распространенной среди европейцев. Нодулярная меланома, как правило, является инвазивной на момент ее первичного диагностирования и представляет собой наиболее агрессивную форму меланомы. Лейкоз представляет собой рак крови или костного мозга, характеризующийся аномальным повышением количества лейкоцитов. Волосисто-клеточный лейкоз представляет собой редко встречающуюся гематологическую злокачественную опухоль, характеризующуюся накоплением в костном мозге аномальных В-лимфоцитов, которые препятствуют образованию нормальных лейкоцитов, эритроцитов и тромбоцитов. Хронический миелоидный лейкоз (CML) представляет собой раковое заболевание лейкоцитов, характеризующееся повышенным и неконтролируемым ростом преимущественно миелоидных клеток в костном мозге и накоплением указанных клеток в крови. Неходжкинские лимфомы могут быть агрессивными или вялотекущими, могут возникать в любом возрасте и часто характеризуются увеличением лимфатических узлов по сравнению с нормой, лихорадкой и потерей массы тела. B-клеточные неходжкинские лимфомы включают лимфому Беркитта, хронический лимфоцитарный лейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную B-крупноклеточную лимфому,фолликулярную лимфому, иммунобластную крупноклеточную лимфому, В-лимфобластную лимфому из клеток-предшественников и лимфому из клеток мантийной зоны. T-клеточные неходжкинские лимфомы включают фунгоидный микоз, анапластическую крупноклеточную лимфому и Т-лимфобластную лимфому из клеток-предшественников. Почечно-клеточная карцинома, которая включает почечно-клеточную карциному, карциному почечной лоханки и опухоль Вильмса, представляет собой наиболее распространенный тип рака почки у взрослых. В 2010 году только в США было отмечено 58240 новых случаев ее возникновения и 13040 смертельных исходов. Несмотря на значительные успехи в идентификации опухолевых антигенов и их продукции в рекомбинантной и синтетической форме методами молекулярной биологии, обеспечивающие множество усовершенствованных подходов к лечению рака, успешная иммуногенность вакцин на основе опухолевых клеток в конечном итоге зависит от экспрессии молекул главного комплекса гистосовместимости(МНС) на антиген-презентирующих клетках и распознавания опухолевых антигенов как "чужеродных" иммунной системой организма. Однако предотвращение и лечение затрудняется способностью патогенов "ускользать" от иммунного ответа хозяина. Таким образом, в данной области техники существует острая необходимость в разработке новых способов профилактики и лечения вирусных и раковых заболеваний. Нитазоксанид(2-(ацетолилокси)-N-(5-нитро-2-тиазолил)бензамид) представляет собой тиазолидный противопаразитарный агент, имеющий следующую структуру: Тизоксанид представляет собой активный циркулирующий в крови метаболит нитазоксанида. После перорального введения нитазоксанида или смесей нитазоксанида и тизоксанида человеку указанные соединения частично абсорбируются из кишечника, и нитазоксанид быстро гидролизуется в плазме крови с образованием тизоксанида. Тизоксанид связан с белками плазмы, и период его полувыведения почками составляет 7,3 ч. Тизоксанид конъюгирован с глюкуроном, и указанное лекарственное средство выводится с мочой и желчью в виде тизоксанида или глюкуронида тизоксанида. Время полужизни тизоксанида в плазме составляет всего примерно 1,5 ч. Тизоксанид имеет следующую структуру:RM-4848 представляет собой замещенный тиазолид, имеющий такую же структуру, как тизоксанид,но с замещением нитрогруппы на хлорную группу, приводящим, таким образом, к получению соединения N-(5-хлортиазол-2-ил)-2-гидроксибензамида. Нитазоксанид (Alinia, NTZ) и тизоксанид (TIZ) представляют собой тиазолидные соединения, обладающие активностью в отношении паразитов, анаэробных бактерий и вирусов. NTZ одобрен в США для лечения диареи, вызванной видами Cryptosporidium parvum и Giardia lamblia. NTZ и TIZ также подавляют репликацию РНК- и ДНК-вирусов, включая вирусы гриппа А и гепатита С. В клинических исследованиях было показано, что NTZ является эффективным при лечении вызванного ротавирусом гастроэнтерита, вызванного норовирусом гастроэнтерита и хронического гепатита С; NTZ также находится в последней стадии клинических исследований для лечения гриппа. Краткое описание изобретения Согласно изобретению предложено применение фармацевтических композиций, содержащих тиазолид, для иммуномодуляции у субъекта, нуждающегося в указанной иммуномодуляции, включая предупреждение и/или лечение вирусных заболеваний, рака и заболеваний, вызванных внутриклеточными протозойными или бактериальными инфекциями. Согласно конкретному варианту реализации изобретения предложен способ стимуляции иммунного ответа у субъекта, нуждающегося в указанной стимуляции, включающий введение указанному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество тиазолидного соединения. Подходящие тиазолидные соединения согласно изобретению включают соединения, описанные в патентах США 7645783, 7550493, 7285567,6117894, 6020353, 5968961, 5965590, 5935591 и 5886013, полностью включенных в настоящее описание посредством ссылки. Согласно предпочтительному варианту реализации изобретения тиазолидный агент представляет собой нитазоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой тизоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой RM-4848. Согласно предпочтительному аспекту изобретения субъект страдает вирусной инфекцией. Согласно другому предпочтительному аспекту изобретения субъект имеет риск развития вирусной инфекции. Согласно одному аспекту изобретения вирусная инфекция представляет собой грипп. Грипп может быть вызван вирусом, выбранным из вирусов H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2, H7N2, H7N3 и H10N7. Согласно другому аспек-2 024063 ту изобретения вирусная инфекция представляет собой гепатит В. Согласно предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другим предпочтительным вариантам реализации изобретения тиазолидное соединение вводят в комбинации с ингибитором нейраминидазы, таким как ланинамивир, осельтамивир, занамивир или перамивир, или иммуностимулятором,таким как имиквимод или резиквимод, или аналогом адамантана, или рекомбинантным гибридным белком сиалидазой, или лекарственным средством против гепатита В. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной. Согласно другому предпочтительному аспекту изобретения субъект страдает раком. Согласно другому предпочтительному аспекту изобретения субъект имеет риск развития рака. Согласно одному варианту реализации изобретения рак представляет собой лейкоз. Предпочтительно, лейкоз представляет собой волосисто-клеточный лейкоз или хронический миелоидный лейкоз. Согласно другому аспекту изобретения рак представляет собой меланому. Согласно другому аспекту изобретения рак представляет собой неходжкинскую лимфому. Согласно другому аспекту изобретения рак представляет собой почечно-клеточную карциному. Согласно одному предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной или иммуностимулятором или противораковым лекарственным средством. Противораковое лекарственное средство может включать, но не ограничивается указанными, STI571, CGP 74588, 1D-арабинофуранозилцитозин (Ara-C), доксорубицин,дакарбазин, цисплатин, блеомицин, винкристин, ломустин, винбластин, кармустин, DTIC, тамоксифен,сунитиниб, сорафениб и интерферон-. Согласно другому предпочтительному аспекту изобретения субъект страдает внутриклеточной протозойной инфекцией. Согласно другому предпочтительному аспекту изобретения субъект имеет риск развития внутриклеточной протозойной инфекции. Согласно одному варианту реализации изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Cryptosporidium spp. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекциюLeishmania spp. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Toxoplasma gondii. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Trypanosoma cruzii. Согласно одному предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной или иммуностимулятором или противопротозойным лекарственным средством. Противопротозойное лекарственное средство может включать, но не ограничивается указанными, триметоприм/сульфаметоксазол, атоваквон, клиндамицин, пириметамин, спирамицин, диминазин,хомидиум, сурамин, меларсамин, стибоглюконат натрия и меглуминантимонат. Согласно другому предпочтительному аспекту изобретения субъект страдает внутриклеточной бактериальной инфекцией. Согласно другому предпочтительному аспекту изобретения субъект имеет риск развития внутриклеточной бактериальной инфекции. Согласно одному варианту реализации изобретения внутриклеточная бактериальная инфекция представляет собой микобактерию туберкулеза. Согласно одному конкретному варианту реализации изобретения предложен способ лечения или предотвращения вирусной инфекции у субъекта, нуждающегося в указанном лечении или предотвращении, включающий введение указанному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество тиазолидного соединения. Согласно предпочтительному варианту реализации изобретения тиазолидный агент представляет собой нитазоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой тизоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой RM-4848. Согласно одному аспекту изобретения вирусная инфекция представляет собой грипп. Грипп может быть вызван вирусом, выбранным из вирусов H1N1, H2N2, H3N2, H5N1, H7N7, H1N2,H9N2, H7N2, H7N3 и H10N7. Согласно другому аспекту изобретения вирусная инфекция представляет собой гепатит В. Согласно другому аспекту изобретения вирусная инфекция представляет собой диарею или гастроэнтерит, вызванный ротавирусом или норовирусом. Согласно предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с ингибитором нейраминидазы, таким как ланинамивир, осельтамивир, занамивир или перамивир, или иммуностимулятором,таким как имиквимод или резиквимод, или аналогом адамантана, или рекомбинантным гибридным белком сиалидазой, или лекарственным средством против гепатита В. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной. Согласно другому конкретному варианту реализации изобретения предложен способ лечения или предотвращения рака у субъекта, нуждающегося в указанном лечении или предотвращении, включающий введение указанному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество тиазолидного соединения. Согласно предпочтительному варианту реализации изобре-3 024063 тения тиазолидный агент представляет собой нитазоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой тизоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой RM-4848. Согласно конкретному аспекту изобретения рак представляет собой лейкоз. Предпочтительно, лейкоз представляет собой волосисто-клеточный лейкоз или хронический миелоидный лейкоз. Согласно другому аспекту изобретения рак представляет собой меланому. Согласно другому аспекту изобретения рак представляет собой неходжкинскую лимфому. Согласно другому аспекту изобретения рак представляет собой почечно-клеточную карциному. Согласно одному предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной или иммуностимулятором или противораковым лекарственным средством. Противораковое лекарственное средство может включать, но не ограничивается указанными, STI571, CGP 74588, 1D-арабинофуранозилцитозин (Ara-C),доксорубицин, дакарбазин, цисплатин, блеомицин, винкристин, ломустин, винбластин, кармустин, DTIC,тамоксифен, сунитиниб, сорафениб и интерферон-. Согласно другому конкретному варианту реализации изобретения предложен способ лечения или предотвращения внутриклеточных протозойных инфекций у субъекта, нуждающегося в указанном лечении или предотвращении, включающий введение указанному субъекту фармацевтической композиции,содержащей терапевтически эффективное количество тиазолидного соединения. Согласно предпочтительному варианту реализации изобретения тиазолидный агент представляет собой нитазоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой тизоксанид. Согласно другому предпочтительному варианту реализации изобретения тиазолидный агент представляет собой RM-4848. Согласно конкретному аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Cryptosporidium spp. Согласно другому аспекту изобретения рак представляет собой меланому. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Leishmania spp. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Toxoplasma gondii. Согласно другому аспекту изобретения внутриклеточная протозойная инфекция представляет собой инфекцию Trypanosoma cruzii. Согласно одному предпочтительному варианту реализации изобретения вводят только тиазолидное соединение. Согласно другому предпочтительному варианту реализации изобретения тиазолидное соединение вводят в комбинации с вакциной или иммуностимулятором или противопротозойным лекарственным средством. Противопротозойное лекарственное средство может включать, но не ограничивается указанными, триметоприм/сульфаметоксазол, атоваквон, клиндамицин, пириметамин, спирамицин, диминазин, хомидиум, сурамин, меларсамин, стибоглюконат натрия и меглуминантимонат. У субъектов с иммунодефицитом иммунный ответ, необходимый для эффективного лечения или предотвращения вирусного заболевания, рака или внутриклеточной протозойной или бактериальной инфекции, может не достигаться при использовании такого же режима дозирования тиазолидов, который обычно используется для успешного лечения субъектов, иммунная система которых является абсолютно компетентной. Субъекты с сильным иммунодефицитом могут являться плохими кандидатами для лечения тиазолидами. Для субъектов с умеренным иммунодефицитом могут требоваться более высокие дозы тиазолида, более частое введение дозы или введение дозы в течение более длительного периода времени по сравнению с субъектами, иммунная система которых является абсолютно компетентной. Субъектам,страдающим ВИЧ-инфекциями, у которых не развился иммунодефицит, можно проводить эффективное лечение с помощью тиазолидов, тогда для субъектов с иммунодефицитом, связанным с ВИЧ-инфекцией,может требоваться лечение антиретровирусными лекарственными средствами для снижения титраHIV-вируса и частичного восстановления функции иммунной системы до начала лечения тиазолидом или одновременно с лечением тиазолидом. Таким образом, способ применения тиазолида для стимуляции иммунного ответа можно адаптировать для конкретных пациентов на основе их иммунологического статуса. Вышеизложенное общее описание изобретения и следующие далее краткое описание фигур и подробное описание изобретения приведены в качестве примера и в пояснительных целях и обеспечивают более подробное объяснение формулы изобретения. Другие цели, преимущества и новые признаки будут очевидны специалистам в данной области техники из следующего далее подробного описания изобретения. Краткое описание чертежей Фиг. 1 А-1 С представляют собой диаграммы, на которых показаны CD14+ моноциты в отсутствие или в присутствии различных доз тизоксанида при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны средние значения, стандартные ошибки среднего и р-значения. Фиг. 2 А-2 С представляют собой диаграммы, отражающие модуляцию сигнального пути TLR с помощью тизоксанида в не подвергаемых стимуляции и подвергаемых стимуляции вирусом гриппа РВМС в отсутствие или в присутствии различных доз тизоксанида при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны средние значения. Фиг. 3 А-3 С представляют собой диаграммы, отражающие модуляцию сигнального пути IFN с помощью тизоксанида в не подвергаемых стимуляции и подвергаемых стимуляции вирусом гриппа РВМС в отсутствие или в присутствии различных доз тизоксанида при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны средние значения. Фиг. 4 А и 4 В представляют собой диаграммы, отражающие Т-хелперные функции. IFN- иIL2-секретирующие CD4+ T-клетки в отсутствие или в присутствии различных доз тизоксанида при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны средние значения, стандартные ошибки среднего и р-значения. Фиг. 5 А-5 С представляют собой диаграммы, отражающие цитотоксические функции T-клеток. Перфорин-, гранзим- и Fas-экспрессирующие CD8+ T-клетки в отсутствие или в присутствии различных доз тизоксанида при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны средние значения, стандартные ошибки среднего и р-значения. Фиг. 6 А-6 С представляют собой диаграммы, показывающие процент TLR3-(фиг. 6 А), TLR7(фиг. 6 В) и TLR8- (фиг. 6 С) экспрессирующих CD14+ клеток при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны данные, полученные в отсутствие или в присутствии пяти различных доз RM4848 (0,5; 1,0; 10; 20; 40 мкг/мл). Показаны средние значения, стандартные ошибки среднего и р-значения. Фиг. 7 А и 7 В представляют собой диаграммы, отражающие экспрессию мРНК белков сигнального пути Toll-подобного рецептора после стимуляции тремя различными дозами RM4848 (1,0; 10; 20 мкг/мл) при отсутствии стимуляции (фиг. 7 А) и в условиях стимуляции вирусом гриппа (фиг. 7 В). Экспрессию 84 генов, вовлеченных в сигнальный путь Toll-подобного рецептора, оценивали с помощью количественной ПЦР в реальном времени, рассчитывали относительно пяти генов "домашнего хозяйства" и выражали в виде кратности изменения экспрессии по сравнению с не подвергаемым стимуляции образцом. На фигуре показаны только те мишени, для которых наблюдались отличия в уровне экспрессии после стимуляции тизоксанидом. Фиг. 8 А и 8 В представляют собой диаграммы, отражающие экспрессию мРНК белков сигнального пути интерферона I типа после стимуляции тремя различными дозами RM4848 (1,0; 10; 20 мкг/мл) при отсутствии стимуляции (фиг. 8 А) и в условиях стимуляции вирусом гриппа (фиг. 8 В). Экспрессию 84 генов, вовлеченных в сигнальный путь интерферона I типа, оценивали с помощью количественной ПЦР в реальном времени, рассчитывали относительно пяти генов "домашнего хозяйства" и выражали в виде кратности изменения экспрессии по сравнению с не подвергаемым стимуляции образцом. На фигуре показаны только те мишени, для которых наблюдали отличия в уровнях экспрессии после стимуляции тизоксанидом. Фиг. 9 А и 9 В представляют собой диаграммы, показывающие процент IFN- (фиг. 9 А) и IL2(фиг. 9 В) секретирующих CD4+ T-клеток при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны данные, полученные в отсутствие или в присутствии пяти различных доз RM4848(0,5 мкг/мл; 1,0; 10; 20; 40 мкг/мл). Показаны средние значения, стандартные ошибки среднего и р-значения. Фиг. 10 А-10 С представляют собой диаграммы, представляющие вариант реализации изобретения,согласно которому оценивали процент гранзим- (фиг. 10 А), перфорин- (фиг. 10 В) и Fas- (фиг. 10 С) экспрессирующих CD8+ T-клеток при отсутствии стимуляции и в условиях стимуляции вирусом гриппа. Показаны данные, полученные в отсутствие или в присутствии пяти различных доз RM4848 (0,5; 1,0; 10; 20; 40 мкг/мл). Показаны средние значения, стандартные ошибки среднего и р-значения. На фиг. 11 показаны диаграммы, представляющие вариант реализации изобретения, согласно которому проводили оценку подавления репликации вируса HIV-1: уровня р 24 в РВМС, подверженных воздействию вируса HIV (фиг. 11 А) и процентного подавления репликации вируса HIV (фиг. 11 В) в отсутствие/присутствии различных доз тизоксанида (1,0; 10 мкг/мл) через 5 дней после инфицирования. Показаны средние значения, стандартные ошибки среднего и р-значения. Подробное описание предпочтительных вариантов реализации изобретения Если иное не указано, существительное, употребляемое в единственном числе, относится к одному или более указанных существительных. Композиции и способы согласно настоящему изобретению предназначены для стимуляции иммунного ответа у субъекта, нуждающегося в указанной стимуляции, и, таким образом, предотвращения и лечения инфекций и/или раковых состояний. Целью изобретения является обеспечить эффективные, неинвазивные способы предотвращения и лечения вирусной инфекции, ракового состояния и/или заболеваний, вызванных внутриклеточными протозойными инфекциями, у субъекта, нуждающегося в указанном лечении или предотвращении, путем стимуляции у указанного субъекта сильного иммунного ответа,который опосредован как врожденными, так и приобретенными иммунными реакциями. Врожденная иммунная система, которая обеспечивает немедленную кратковременную защиту от инфекций, вызывает привлечение в место воспаления фагоцитов и, главным образом, нейтрофилов, которые, в свою очередь, стимулируют высвобождение лейкоцитов и лимфоцитов, с сопутствующей продукцией цитокинов, включающих TNF, HMGB1 и IL-1. Лейкоциты врожденной иммунной системы включают "натуральные киллерные" клетки, тучные клетки, эозинофилы, базофилы и фагоциты, включая макрофаги, нейтрофилы и дендритные клетки. Toll-подобные рецепторы (TLR) являются ключевыми компонентами врожденной иммунной системы, так как они обеспечивают обнаружение микробных инфекций и возбуждают защитные противомикробные ответы организма. TLR контролируют множество функций дендритных клеток и возбуждают сигнальный каскад, который приводит к приобретенному иммунному ответу, включая продукцию интерферонов I типа (I IFN). TLR 3, 7, 8 и 9 участвуют в обнаружении вируса и распознавании нуклеиновых кислот патогена. TLR 7, 8 и 9 находятся во внутриклеточных эндолизосомальных компартментах. Приобретенный, или адаптивный, иммунитет, который запускается у позвоночных при "ускользании" патогена от врожденного иммунного ответа, отвечает за распознавание специфических "чужих" антигенов при "презентации" антигена и за иммунный ответ, направленный на устранение чужеродных патогенов или инфицированных патогенном клеток. В приобретенной иммунной системе B-клетки вовлечены в гуморальный иммунный ответ, а T-клетки отвечают за клеточные иммунные ответы. Презентация антигена дендритными клетками вызывает превращение T-клеток либо в "цитотоксичные" CD8+ клетки, либо в "хелперные" CD4+ клетки. В лимфатических узлах дендритные клетки "презентируют" на своей поверхности "чужеродные" антигены путем их соединения с молекулой главного комплекса гистосовместимости (majorhistocompatibility complex, MHC, также называемым у человека лейкоцитарным антигеном человека,human leukocyte antigen, HLA), который распознается T-клетками, проходящими через лимфатические узлы. Экзогенные антигены обычно презентируются на молекулах МНС II класса, активирующих CD4+ хелперные T-клетки. Эндогенные антигены, продуцируемые вирусами, которые реплицируются внутри клетки-хозяина, как правило, презентируются на молекулах МНС I класса и активируют CD8+ цитотоксические T-клетки. Приобретенная иммунная система включает цитотоксические T-клетки, также называемые ТС, киллерными T-клетками или цитотоксическими Т-лимфоцитами (CTL). Как толькоT-клеточный рецептор (TCR) цитотоксических T-клеток взаимодействует со связанной с пептидом молекулой МНС I класса, CTL активируется и превращается в эффекторный CTL, высвобождающий цитотоксины, такие как перфорин и гранулизин, которые приводят к образованию пор в плазматической мембране клетки-мишени. Активация CTL регулируется CD4+ лимфоцитами или хелперными T-клетками. Хелперные T-клетки экспрессируют T-клеточные рецепторы (TCR), которые распознают антиген, связанный с молекулами МНС II класса. Эффекторные CD4+ Т-хелперные клетки могут отвечать на инфекцию возбуждением ответа по типу Th1 или Th2. Th1-ответ приводит к активации клеточного иммунитета и характеризуется продукцией интерферона-гамма, который активирует макрофаги и вызывает продукцию антител B-клетками. Th2-ответ приводит к активации гуморального иммунитета и характеризуется высвобождением интерлейкина 4 с последующей активацией B-клеток и продукцией нейтрализующих антител. В целом, Th1-ответы более эффективны в отношении внутриклеточных патогенов, таких как вирусы и бактерии, присутствующие внутри клеток хозяина, тогда как Th2-ответы более эффективны в отношении внеклеточных бактерий, паразитов и токсинов. Авторы настоящего изобретения обнаружили, что противовирусные эффекты тиазолидных агентов,в частности нитазоксанида, тизоксанида и RM-4848, являются результатом иммуномодулирующей активности указанных агентов, которые способны стимулировать сильный иммунный ответ путем активации как врожденного, так и приобретенного иммунитета. В частности, авторы настоящего изобретения обнаружили, что нитазоксанид, тизоксанид и RM-4848 стимулируют активность Т-хелперных клеток иCTL, экспрессию TLR7 и TLR8 и ответ интерферона I типа путем индукции повышения 1) IFN- иIL2-секретирующих CD4+ T-клеток, 2) дегрануляции CTL, 3) Fas-экспрессирующих CD8+ T-клеток,4) TLR8-экспрессирующих моноцитов, 5) экспрессии IFN- и IFN- мРНК, 6) мРНК, специфичной для индуцируемых IFN I типа генов (МХА, PRKCZ, ADAR, CXCL10, IRF1, PRKRA), и 7) мРНК, специфичной для гена, вовлеченного в презентацию молекул МНС I класса (HLA-A, HLA-B, TAP1). Таким обра-6 024063 зом, указанные тиазолидные агенты могут применяться для стимуляции иммунного ответа у субъекта,нуждающегося в указанной стимуляции, в частности у субъектов, которые имеют риск развития или страдают заболеванием, требующим сильного иммунного ответа, например вирусной инфекцией, раком или заболеванием, вызванным внутриклеточной протозойной инфекцией (инфекциями). Кроме того,способы согласно изобретению могут применяться для облегчения симптомов заболевания или в качестве профилактической меры у субъекта. Термины "субъект" и "пациент" используются взаимозаменяемо и относятся к любому млекопитающему, включая человека, которое страдает вирусной инфекцией или раковым состоянием или имеет риск их развития. Субъект или пациент, как правило, представляет собой человека, однако другие подходящие субъекты или пациенты включают, но не ограничиваются указанными, лабораторных животных, таких как мышь, крыса, кролик или морская свинка, сельскохозяйственных животных и домашних животных или питомцев. Указанные термины также включают приматов, не представляющих собой человека. При использовании в настоящем описании термины "лечить" и "лечение" относятся к снижению выраженности и/или частоты возникновения симптомов, устранению симптомов и/или первопричины,предотвращению случаев возникновения симптомов и/или их первопричины (например, профилактической терапии), улучшению или восстановлению повреждения или снижению интенсивности инфекции. При использовании в настоящем описании "терапевтически эффективное количество" представляет собой количество, эффективное для достижения клеточного ответа, который является клинически значимым. Термин "фармацевтически приемлемый" относится к материалу, который не является неприемлемым с биологической или другой точки зрения, т.е. материалу, который может быть включен в состав фармацевтической композиции, может вводиться пациенту и не вызывать нежелательные биологические эффекты или не иметь неблагоприятного взаимодействия с любым из других компонентов композиции, в состав которой он включен. Когда термин "фармацевтически приемлемый" используется в отношении фармацевтического носителя или вспомогательного вещества, предполагается, что указанный носитель или вспомогательное вещество удовлетворяет требуемым стандартам токсикологических и производственных испытаний или включено в Руководство по инертным ингредиентам, составленное Управлением по контролю за пищевыми продуктами и лекарственными средствами США. Способы согласно настоящему изобретению предполагают введение композиций, содержащих тиазолидные соединения. Приемлемые тиазолидные соединения согласно изобретению представляют собой соединения, описанные в патентах США 7645783, 7550493, 7285567, 6117894, 6020353, 5968961,5965590, 5935591, 5886013, которые полностью включены в настоящее описание посредством ссылки. Предпочтительные тиазолидные соединения представляют собой нитазоксанид, тизоксанид илиRM-4848. При использовании в настоящем описании термин "тиазолид" относится к тиазолиду, аналогу тиазолида или замещенному тиазолиду. При использовании в настоящем описании термин "нитазоксанид" относится к нитазоксанид(2-(ацетолилокси)-N-(5-нитро-2-тиазолил)бензамиду) и к аналогу нитазоксанида, например, к одному из соединений, описанных в патенте США 7285567 или патенте США 2007/0167504. При использовании в настоящем описании термин "тизоксанид" относится к тизоксаниду,аналогу тизоксанида или замещенному тизоксаниду. Нитазоксанид, тизоксанид, RM-4848 или любой из аналогов тиазолида можно вводить в виде чистого соединения и/или в подходящих случаях в виде соли,полиморфа и т.д. при условии, что указанная соль или полиморф являются фармакологически приемлемыми. Такие соли указанных активных агентов могут быть получены с использованием стандартных методов, известных специалистам в области синтетической органической химии и описанных, например,в источнике: J. March, Advanced Organic Chemistry: Reactions, Mechanisms and Structure, 4th Ed. (NewYork: Wiley-Interscience, 1992). Общее количество нитазоксанида или тизоксанида в композициях согласно изобретению, как правило, составляет примерно от 60 до 75% от общей массы композиции. Могут быть получены композиции с немедленным высвобождением, контролируемым высвобождением или замедленным высвобождением. Композиции могут содержать одну или более дополнительных фармацевтически приемлемых добавок или вспомогательных веществ. Указанные вспомогательные вещества представляют собой терапевтически инертные ингредиенты, которые хорошо известны и признаны в данной области техники. При использовании в настоящей заявке, термин "инертный ингредиент" относится к таким терапевтически инертным ингредиентам, которые хорошо известны в области фармацевтики и которые могут использоваться отдельно или в различных комбинациях и включают, например,разбавители, дезинтегрирующие вещества, связующие вещества, суспендирующие агенты, глиданты,смазывающие вещества, наполнители, покрывающие агенты, солюбилизирующие агенты, подсластители, красители, ароматизаторы и антиоксиданты. См., например, издание Remington: The Science and Practice of Pharmacy 1995, изданное Е.У. Мартином (E.W. Martin, Mack Publishing Company, 19-e изд., Истон,Пенсильвания, США). Примеры разбавителей или наполнителей включают, но не ограничиваются указанными, крахмал,лактозу, ксилитол, сорбитол, кондитерский сахар, сгущаемый сахар, декстраты, декстрин, декстрозу,фруктозу, лактит, маннит, сахарозу, тальк, микрокристаллическую целлюлозу, карбонат кальция, двух-7 024063 основный или трехосновный фосфат кальция, дикальцийфосфат дигидрат, сульфат кальция и т.д. Количество разбавителей или наполнителей может находиться в диапазоне от примерно 2 до примерно 15% от общей массы композиции. Примеры дезинтегрирующих веществ включают, но не ограничиваются указанными, альгиновую кислоту, метакриловую кислоту/дивинилбензол, поперечно-сшитый поливинилпирролидон, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия, гликолят крахмал натрия, крахмал, включая кукурузный или маисовый крахмал, прежелатинизированный крахмал и т.д. Дезинтегрирующее вещество (вещества), как правило, составляет от примерно 2 до примерно 15% от общей массы композиции. Примеры связующих веществ включают, но не ограничиваются указанными, крахмалы, такие как картофельный крахмал, пшеничный крахмал, кукурузный крахмал; микрокристаллическую целлюлозу; целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза (НРМС), этилцеллюлоза, карбоксиметилцеллюлоза натрия; природные камеди, такие как гуммиарабик, альгиновая кислота, гуаровая камедь; жидкую глюкозу, декстрин, повидон, сироп, полиэтиленоксид,поливинилпирролидон, поли-N-виниламид, полиэтиленгликоль, желатин, полипропиленгликоль, трагант и т.д. Количество связующих веществ составляет от примерно 0,2 до примерно 14% от общей массы композиции. Примеры глидантов включают, но не ограничиваются указанными, диоксид кремния, коллоидный диоксид кремния, трисиликат магния, трехосновный фосфат кальция, силикат кальция, силикат магния,коллоидный диоксид кремния, порошкообразную целлюлозу, крахмал, тальк и т.д. Количество глиданта(глидантов) составляет от примерно 0,01 до примерно 0,3% от общей массы композиции. Примеры скользящих веществ включают, но не ограничиваются указанными, стеарат магния, стеарат алюминия, стеарат кальция, стеарат цинка, стеариновую кислоту, полиэтиленгликоль, глицерилбегенат, минеральное масло, стеарилфумарат натрия, тальк, гидрогенизированное растительное масло и т.д. Количество скользящего вещества (веществ) составляет от примерно 0,2 до примерно 1,0% от общей массы композиции. Композиции могут содержать связующее вещество, которое представляет собой полимер с низкой вязкостью. Примеры полимеров с низкой вязкостью включают, но не ограничиваются указанными, полимеры гидроксипропилметилцеллюлозы с низкой вязкостью, такие как полимеры, продаваемые компанией Dow Chemical под торговой маркой "Metocel" (например, Metocel E50LV, Metocel K100LV иMetocel F50LV) и полимеры гидроксиэтилцеллюлозы с низкой вязкостью. Полимер с низкой вязкостью, как правило, составляет от примерно 10 до примерно 20%, или от примерно 10 до примерно 15%,или предпочтительно примерно 12% от общей массы композиции; или же, в вариантах реализации композиций, имеющих порции с контролируемым высвобождением и немедленным высвобождением, полимер с низкой вязкостью в порции с контролируемым высвобождением, как правило, составляет от примерно 15 до примерно 20%, предпочтительно примерно 18% от массы порции с контролируемым высвобождением. Композиции могут также содержать материал покрытия. Материал покрытия, как правило, присутствует в виде внешнего слоя, нанесенного на форму дозирования, который полностью покрывает лекарственную форму. Например, согласно некоторым вариантам реализации изобретения форма дозирования представляет собой таблетку для перорального введения, в которой порция с контролируемым высвобождением образует первый слой, и порция с немедленным высвобождением образует второй слой таблетки, который наносится на поверхность указанного первого слоя для получения сердцевины таблетки. В таких вариантах реализации материал покрытия, например, может быть в виде внешнего слоя покрытия,который наносится на поверхность сердцевины таблетки. Материал покрытия, как правило, составляет от примерно 1 до примерно 5% (по массе) от массы композиции и может содержать гидроксипропилметилцеллюлозу и/или полиэтиленгликоль и одно или более вспомогательных веществ, выбранных из группы, включающей покрывающие агенты, замутняющие вещества, вещества, корригирующие вкус,наполнители, полирующие агенты, красители, антиадгезивных агентов и т.д. Примеры веществ для пленочного покрытия и способы применения таких покрывающих веществ хорошо известны специалистам в данной области техники. Композиции согласно настоящему изобретению могут эффективно применяться для стимуляции иммунной системы у субъекта, нуждающегося в указанной стимуляции, и, таким образом, лечения или предотвращения вирусных инфекций, рака или заболеваний, вызванных внутриклеточными протозойными или бактериальными инфекциями. Вирусная инфекция может представлять собой грипп, в частности грипп, вызванный вирусом, выбранным из вирусов H1N1, H2N2, H3N2, H5N1, H7N7, H1N2, H9N2,H7N2, H7N3 и H10N7, или гепатит В или диарею или гастроэнтерит, вызванный ротавирусом или норовирусом. Рак может представлять собой лейкоз, включая волосисто-клеточный лейкоз и хронический миелоидный лейкоз, меланому, неходжкинскую лимфому или почечно-клеточную карциному. Заболевание, вызванное внутриклеточными протозойными инфекциями, может представлять собой инфекцию внутриклеточной бактериальной инфекцией, может представлять собой микобактерию туберкулеза. Композиции можно вводить в течение любого периода времени, подходящего для эффективного лечения или предотвращения вирусных инфекций, рака или заболевания, вызванного внутриклеточными протозойными инфекциями. Для введения композиций может использоваться любая подходящая доза и режим дозирования. Введение, как правило, можно осуществлять в течение от примерно 3 дней до примерно 104 недель, но также можно осуществлять в течение периода более 104 недель и даже в течение бессрочного периода. Подходящие режимы дозирования могут определяться врачом. Тиазолидные соединения можно вводить отдельно или в комбинации с одним или более дополнительными активными агентами, включая ингибитор нейраминидазы, такой как ланинамивир, осельтамивир, занамивир или перамивир, иммуностимулятор, такой как имиквимод или резиквимод, аналог адамантана и рекомбинантный гибридный белок сиалидазу. Тиазолидные соединения также можно вводить отдельно или в комбинации с одним или более дополнительными активными агентами, включая противопротозойное лекарственное средство. Противопротозойное лекарственное средство может включать,но не ограничивается указанными, триметоприм/сульфаметоксазол, атоваквон, клиндамицин, пириметамина, спирамицин, диминазин, хомидиум, сурамин, меларсамин, стибоглюконат натрия и меглуминантимонат. Тиазолидные соединения можно вводить в профилактических целях в комбинации с вакциной или в комбинации с противораковым лекарственным средством. Противораковое лекарственное средство может включать, но не ограничивается указанными, STI571, CGP 74588,1D-арабинофуранозилцитозин (Ara-C), доксорубицин, дакарбазин, цисплатин, блеомицин, винкристин, ломустин, винбластин, кармустин, DTIC, тамоксифен, сунитиниб, сорафениб и интерферон-. Композиции и дополнительный активный агент (например, интерферон) можно вводить вместе или раздельно, одновременно или в виде различных композиций (включая раздельные композиции, различающиеся по форме дозирования, профилю высвобождения и т.д.). Необходимо понимать, что предложенное выше описание изобретения, а также следующие далее примеры приведены в качестве иллюстрации и не ограничивают объем настоящего изобретения. Другие аспекты, преимущества и модификации в пределах объема изобретения будут очевидны специалистам в области техники, к которой относится настоящее изобретение. У субъектов с иммунодефицитом иммунный ответ, необходимый для эффективного лечения или предотвращения вирусного заболевания, рака или внутриклеточной протозойной или бактериальной инфекции, может не достигаться при использовании такого же режима дозирования тиазолидов, который обычно используется для успешного лечения субъектов, иммунная система которых является абсолютно компетентной. Субъекты с сильным иммунодефицитом могут являться плохими кандидатами для лечения тиазолидами. Для субъектов с умеренным иммунодефицитом могут требоваться более высокие дозы тиазолида, более частое введение дозы или введение дозы в течение более длительного периода времени по сравнению с субъектами, иммунная система которых является абсолютно компетентной. Субъектам,страдающим ВИЧ-инфекциями, у которых не развился иммунодефицит, можно проводить эффективное лечение с помощью тиазолидов, тогда для субъектов с иммунодефицитом, связанным с ВИЧ-инфекцией,может требоваться лечение антиретровирусными лекарственными средствами для снижения титраHIV-вируса и частичного восстановления функции иммунной системы до начала лечения тиазолидом или одновременно с лечением тиазолидом. Таким образом, способ применения тиазолида для стимуляции иммунного ответа можно адаптировать для конкретных пациентов на основе их иммунологического статуса. Примеры Пример 1. Получение клеток. Мононуклеарные клетки крови играют важную роль в системе иммунного ответа, так как они продуцируют различные цитокины в ответ на инфекцию патогенами. Таким образом, иммуномодулирующие эффекты тизоксанида (TIZ) оценивали на мононуклеарных клетках периферической крови (РМВС), которые получали от 10 здоровых доноров и выделяли центрифугированием в градиенте плотности фиколл-пака. РМВС культивировали в среде RPMI-1640 с добавлением 10% человеческой сыворотки в присутствии или в отсутствие трех различных доз TIZ (0,5, 1,0 и 10 мг/мл) как при отсутствии стимуляции,так и в условиях стимуляции вирусом гриппа. Пример 2. Иммунологические анализы. Проводили оценку Т-хелперной активности и CTL-активности, а также экспрессии TLR7 и TLR8 иIFN I-ответов у не подвергаемых стимуляции и подвергаемых стимуляции РМВС в отсутствие или в присутствии различных доз тизоксанида. Иммунологические анализы проводили следующим образом. Т-хелперные функции определяли путем оценки количества IFN- и IL-2-секретирующих CD4+T-клеток. CTL-активность определяли путем оценки количества перфорин-, гранзим- иFas-экспрессирующих CD8+ T-клеток. Экспрессию TLR выявляли путем измерения TLR8-, TLR7- и TLR3-экспрессирующих CD14+ моноцитов. Модулирование сигнального пути TLR тизоксанидом выявляли с использованием матрицы для ПЦР-анализа человеческого интерферона I типа (IFN). В частности, иммуномодулирующие эффекты TIZ определяли в не подвергаемых стимуляции и подвергаемых стимуляции вирусом гриппа РМВС путем проведения следующих анализов. Человеческий интерферон I типа (IFN) и путь TLR (матрица для ПЦР). Интерфероны: Лиганды рецепторов интерферона-альфа и интерферона-бета: IFNA1, IFNA4, IFNB1, IFNK, IFNW1. Лиганды рецепторов интерферона-гамма: IFNG. Лиганды рецепторов цитокинов класса гематопоэтинов и интерферонов (D200-домен): IFNA14,IFNA2, IFNA21, IFNA5, IFNA6, IFNA8, IFNE1, IL15. Другие гены, связанные с интерферонами: IFRD1, IFRD2, IL28A, IL29, IL6. Рецепторы интерферона: Рецепторы интерферона-альфа и интерферона-бета: IFNAR1, IFNAR2. Рецепторы интерферона-гамма: IFNGR1, IFNGR2. Другие рецепторы цитокинов класса гематопоэтинов и интерферонов (D200-домен): CNTFR,CRLF2, CSF2RA, CSF3R, EBI3, F3, IL20RB (FNDC6), IL10RA, IL10RB, IL11RA, IL12B, IL13RA1,IL20RA, IL21R, IL22RA2, IL28RA, IL2RB, IL2RG, IL31RA, IL3RA, IL4R, IL5RA, IL6R, IL7R, IL9R,LEPR, MPL, TTN. Регулирующие интерферон факторы: Регуляторы транскрипции: IRF1, IRF2, IRF3, IRF4, IRF5, IRF6, IRF7, IRF8. Другие регулирующие интерферон белки: IRF2BP1, IRF2BP2. Индуцируемые интерфероном белки: Гены, вовлеченные в ответ на вирус: ISG15 (G1P2), IFI16, IFI35, IFI44, IFIH1, МХ 1, OAS1. Регуляторы транскрипции: IFI16, SP110. Другие индуцируемые интерфероном гены: ADAR, CXCL10, IFI6 (G1P3), IFI27, IFI30, IFI44L,IFIT1, IFIT1L, IFIT2, IFIT3, IFITM1, IFITM2, IRGM, PSME1, PYHIN1.Toll-подобные рецепторы: LY64, SIGIRR, TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8,TLR9, TLR10. Белки-адапторы и взаимодействующие с TLR белки: BTK, CD14, HMGB1, HRAS, HSPA1A, HSPD1,LY86 (MD-1), LY96 (MD-2), MAPK8IP3, MYD88, PELI1, RIPK2, SARM1, TICAM2, TIRAP, TOLLIP,TRIF. Эффекторы: CASP8, EIF2AK2, FADD, IRAKI, IRAK2, МАРЗК 7 (ТАК 1), MAP3K7IP1 (ТАВ 1),NR2C2, PPARA, PRKRA, SITPEC, TRAF6, UBE2N, UBE2V1. Нисходящие сигнальные пути и гены-мишени: Путь NFB: CCL2, CHUK, CSF2 (GMCSF), CSF3 (GCSF), IFNA1, IFNB1, IFNG, 1KBKB, IL1A,IL1B, IL2, IL6, IL8, IL10, IL12A, LTA, MAP3K1, MAP4K4, NFKB1, NFKB2, NFKBIA, NFKBIL1, NFRKB,REL, RELA, TNF, TNFRSF1A. Путь JNK/p38: ELK1, FOS (c-Fos), JUN, MAP2K3, MAP2K4 (JNKK1), MAP3K1 (MEKK), МАРК 8(JNK1). Путь NF/IL6: CLECSF9, PTGS2. Путь IRF: CXCL10, IFNA1, IFNB1, IFNG, IRF1, IRF3, TBK1. Регуляция приобретенного иммунитета: CD80, CD86, RIPK2, TRAF6. Пример 3. Иммуномодулирующие эффекты тизоксанида. Было показано, что TIZ обладает сильным иммуномодулирующим действием, включая повышение 1) IFN- и IL2-секретирующих CD4+ T-клеток (фиг. 4 А и 4 В); 2) CTL-дегрануляцию (фиг. 5 В); 3) Fas-экспрессирующих CD8+ T-клеток (фиг. 5 С); 4) TLR3-, TLR8- и TLR7- экспрессии на моноцитахIFN I типа генов (МХА, PRKCZ, ADAR, CXCL10, IRF1, PRKRA) (фиг. 3 В); и 7) мРНК, специфичной для гена, вовлеченного в презентацию молекул МНС I класса (HLA-A, HLA-B, TAP1) (фиг. 3 С). Указанные результаты очевидно демонстрируют, что TIZ обладает значительной иммуномодулирующей активностью и стимулирует сильный иммунный ответ, который опосредуется как врожденной,так и приобретенной иммунной системой. Пример 4. Экспрессия TLR на моноцитах. Экспрессию TLR3, TLR7 и TLR8 оценивали на CD14+ клетках (моноцитах) как при отсутствии стимуляции, так и в условиях стимуляции вирусом гриппа. RM-4848 вызывал повышение процентаTLR7-экспрессирующих CD14+ клеток по сравнению с контролем при flu-антигенной стимуляции (доза 1,0 мкг/мл: р=0,001; доза 10 мкг/мл: р=0,023), тогда как при отсутствии стимуляции не наблюдали значительных различий. Не наблюдали воздействия на TLR3- и TLR8-экспрессирующие CD14+ клетки при использовании всех пяти анализируемых доз, как при отсутствии стимуляции, так и в условиях стимуляции вирусом гриппа (фиг. 1 А-1 С). Пример 5. Путь TLR и RM-4848. Для того чтобы определить, зависит ли воздействие RM-4848 на экспрессию TLR от характерной модуляции TLR-ассоциированных путей передачи сигнала, использовали матрицу для ПЦР в реальном времени, с помощью которой проводили скрининг экспрессии 84 генов, вовлеченных в активацию TLRпути. Данные, полученные на не подвергаемых стимуляции РВМС через 3 ч инкубации с RM-4848, показали, что только 3 из 84 генов активировались, при этом наблюдалось примерно 5-кратное повышениеIL1A и IL1B и 6-кратное повышение IL6 при использовании дозы 20 мкг/мл, как показано на фиг. 2 А. Данные, полученные на подвергаемых стимуляции вирусом гриппа РВМС через 3 ч инкубации сRM-4848, показали, что только 7 из 84 генов активировались, как показано на фиг. 2 В. При использовании дозы 1 мкг/мл наблюдалось примерно 6-кратное повышение INFA1 и INFB1 и 7-кратное повышениеTLR3 и TLR5; при использовании дозы 20 мкг/мл наблюдалось 6-кратное повышение TLR9, тогда как уровень TLR-7 и TLR8 немного превышал 2-кратный исходный уровень при использовании всех анализируемых доз. Пример 6. Пути IFN и RM-4848. Для того чтобы определить, может ли влиять повышение уровня экспрессии интерферона I типа в РВМС, которые инкубировали с RM-4848, на экспрессию индуцируемых интерфероном генов, использовали матрицу для ПЦР в реальном времени, с помощью которой проводили скрининг экспрессии 84 генов, вовлеченных в ответ интерферона-альфа и бета. Результаты анализов, проведенных на не подвергаемых стимуляции РВМС, которые инкубировали с RM-4848, показали, что ни один из 84 анализируемых генов не активировался, напротив, наблюдалось подавление 16 генов. В частности, было показано 20-кратное снижение уровня INFA1, 15-кратное снижение INFA2 и INFB1, и 10-кратное снижение INFA4 при использовании высокой дозы 20 мкг/мл. Указанные эффекты подавления не наблюдались при использовании двух более низких доз, составляющих 1 и 10 мкг/мл (фиг. 3 А). Результаты анализов, проведенных на подвергаемых стимуляции вирусом гриппа РВМС, которые инкубировали с RM-4848, показали, что 12 из 84 анализируемых генов активировались. Данные, полученные на подвергаемых стимуляции вирусом гриппа РВМС через 3 ч инкубации с RM-4848, показали 10-кратное повышение для INFA1 и INFA4, 8-кратное повышение для INFB1 и 6-кратное повышение дляIFNA2 при использовании низкой дозы, составляющей 1 мкг/мл. Три уровня дозы приводили к умеренной активации ISG, IFI27 и IFIT1 с более выраженным эффектом при использовании дозы 10 мкг/мл (в 4 раз) (фиг. 3 В). Пример 7. Т-хелперные функции и RM-4848. Продукцию IFN- и IL2 CD4+ T-клетками оценивали как в исходных условиях, так и после стимуляции Flu-специфичными антигенами. Низкая доза 0,5 мкг/мл RM-4848 вызывала статистически значимую активацию продукции IFN- у не подвергаемых стимуляции клеток (р=0,035) и в условиях стимуляции (р=0,050) (фиг. 4 А). Подобная тенденция наблюдалась для IL2-секретирующих CD4+ T-клеток как при отсутствии стимуляции (доза 0,5 мкг/мл: р=0,047), так и в условиях стимуляции вирусом гриппа (доза 0,5 мкг/мл: р=0,037) (фиг. 4 В). Пример 8. CTL-активность и RM-4848. Гранзим-, перфорин- и Fas-экспрессирующие CD8+ T-клетки анализировали при отсутствии стимуляции и при Flu-антигенной стимуляции. RM-4848 при использовании трех более высоких анализируемых уровней дозы вызывал дегрануляцию CTL, которую оценивали по снижению экспрессии перфорина(фиг. 5 В). Процент Fas-экспрессирующих CD8+ T-клеток также был статистически значимо повышен в присутствии более высоких доз, составляющих 20 и 40 мкг/мл RM-4848, как при отсутствии стимуляции(р=0,006), так и в условиях стимуляции (р=0,003) (фиг. 5 С). Из примеров 4-8 очевидно, что наблюдается стимуляция и активация TLR, в частности непосредственная; при этом активация TLR7 приводит к селективному повышению продукции интерферона I типа(IFN-, IFN-) с последующей активацией сигнальных путей стимулируемых интерфероном генов (IsG). Более конкретно, наблюдается активация индуцируемых IFN I типа генов (CD70, COL16A1, HSPA1L,IFI27, IFIT1, NRG1 и SHB). Все указанные гены вовлечены в контроль репликации вирусов. RM4848 одновременно активирует CD4+ и CD 8+ Т-лимфоциты. В частности, в CD4+ Т-лимфоцитах наблюдается активация продукции INF- и IL-2, тогда как в CD8+ T-клетках наблюдается индукция дегрануляции, что согласуется с активацией клеточного иммунитета. Указанные результаты подтверждают противовирусную активность широкого спектра соединенияRM4848, которое стимулирует борьбу иммунной системы с вирусными инфекциями. Особенно важно,что указанное лекарственное средство не только стимулирует врожденный иммунный ответ, который,вероятно, отвечает за устранение большинства инфекций до начала развития ощущаемого заболевания,даже в случае возникновения у многих патогенов механизмов, препятствующих их выявлению. С клинической точки зрения, указанные данные предполагают, что RM4848 и, вероятно, другие тиазолиды с подобным профилем иммуностимуляции могут применяться для предотвращения заболеваний или для ограничения распространения заболевания. Активность RM4848 в отношении адаптивного иммунитета важна не только потому, что она дополняет его действие в отношении врожденного иммунитета, но также потому, что она обеспечивает механизм, с помощью которого лечатся вирусные заболевания. Приобретенные иммунные реакции основаны на лимфоцитах, которые имеют один тип рецепторов, но, по существу, неограниченный "репертуар" вариантов, распознающих антигены - термин, определенный оперативностью, который отражает их универсальность. Помимо продукции некоторых лимфоцитов, хелперных или киллерных клеток, кульминацией приобретенных иммунных реакций является продукция антител B-клетками. Если приобретенные иммунные реакции отсрочены на несколько дней при возникновении конкретной инфекции, то действие RM4848, которое вызывает продукцию частиц, токсичных для патогена, и развитие иммунологической памяти представляют собой наиболее сильный противовирусный механизм, который наблюдается при врожденном иммунном ответе; при этом и врожденный, и приобретенный иммунитет являются важными и взаимосвязанными. Несмотря на то что вышеизложенное относится к конкретным предпочтительным вариантам реализации изобретения необходимо понимать, что настоящее изобретение не ограничивается указанными вариантами реализации. Специалистам в данной области техники ясно, что возможны различные модификации описанных вариантов реализации изобретения и что указанные модификации находятся в пределах объема настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ стимуляции иммунного ответа у субъекта, нуждающегося в этом, включающий введение указанному субъекту фармацевтической композиции, содержащей терапевтически эффективное количество тиазолидного соединения, где указанное тиазолидное соединение представляет собой нитазоксанид,или тизоксанид, или N-(5-хлортиазол-2-ил)-2-гидроксибензамид, или его соль, или его полиморф. 2. Способ по п.1, отличающийся тем, что субъект страдает вирусной инфекцией, раком или внутриклеточной протозойной инфекцией или имеет риск их развития. 3. Способ по п.1 или 2, отличающийся тем, что тиазолидное соединение вводят в комбинации с вакциной, иммуностимулятором, ингибитором нейраминидазы, выбранным из группы, состоящей из ланинамивира, осельтамивира, занамивира и перамивира, аналогом адамантина или рекомбинантным гибридным белком сиалидазой. 4. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает вирусной инфекцией. 5. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает раком. 6. Способ по любому из пп.1-3, отличающийся тем, что субъект страдает внутриклеточной протозойной инфекцией. 7. Способ по п.5, отличающийся тем, что тиазолидное соединение вводят в комбинации с противораковым лекарственным средством. 8. Способ по п.6, отличающийся тем, что тиазолидное соединение вводят в комбинации с вакциной,или иммуностимулятором, или противопротозойным лекарственным средством.
МПК / Метки
МПК: A61K 31/425, A01N 43/78
Метки: путем, ответа, тиазолидных, способ, стимуляции, введения, соединений, иммунного
Код ссылки
<a href="https://eas.patents.su/26-24063-sposob-stimulyacii-immunnogo-otveta-putem-vvedeniya-tiazolidnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ стимуляции иммунного ответа путем введения тиазолидных соединений</a>
Предыдущий патент: Усовершенствованный протектор для шины для транспортных средств большой грузоподъемности
Следующий патент: Беговой протектор пневматической шины для сельскохозяйственного трактора
Случайный патент: Расклинивающий наполнитель для газовых и нефтяных скважин глубиной менее 7500 футов, способ его изготовления и применения