Способ индукции дифференцировки клеток
Номер патента: 7474
Опубликовано: 27.10.2006
Авторы: Трещалин Иван Дмитриевич, Райхлин Натан Танфелевич, Горбунова Вера Андреевна, Желтухина Галина Александровна, Гарин Август Михайлович, Трещалина Елена Михайловна, Небольсин Владимир Евгеньевич, Бычков Марк Борисович
Формула / Реферат
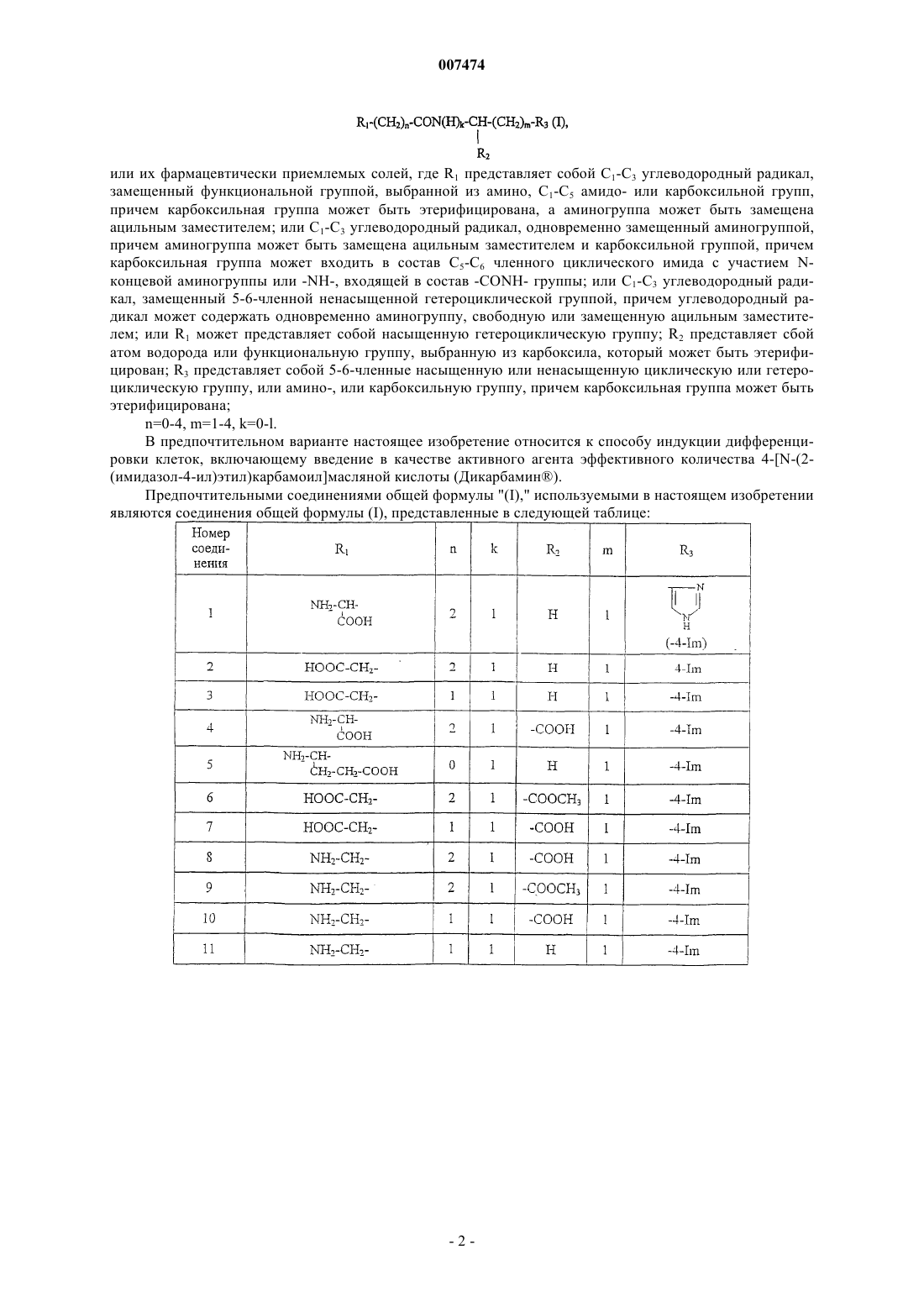
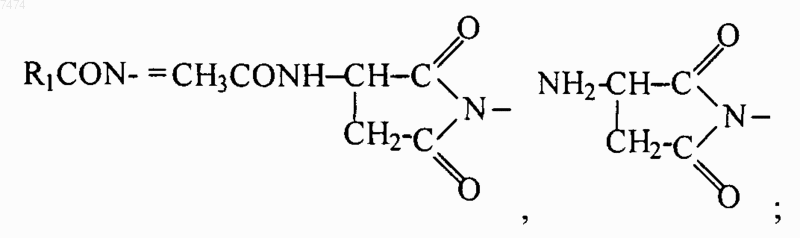
1. Способ индукции дифференцировки клеток у млекопитающих, в том числе человека, включающий введение производного пептида общей формулы
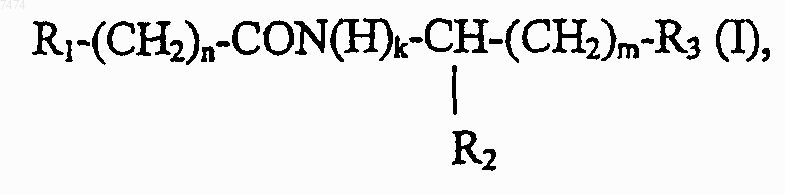
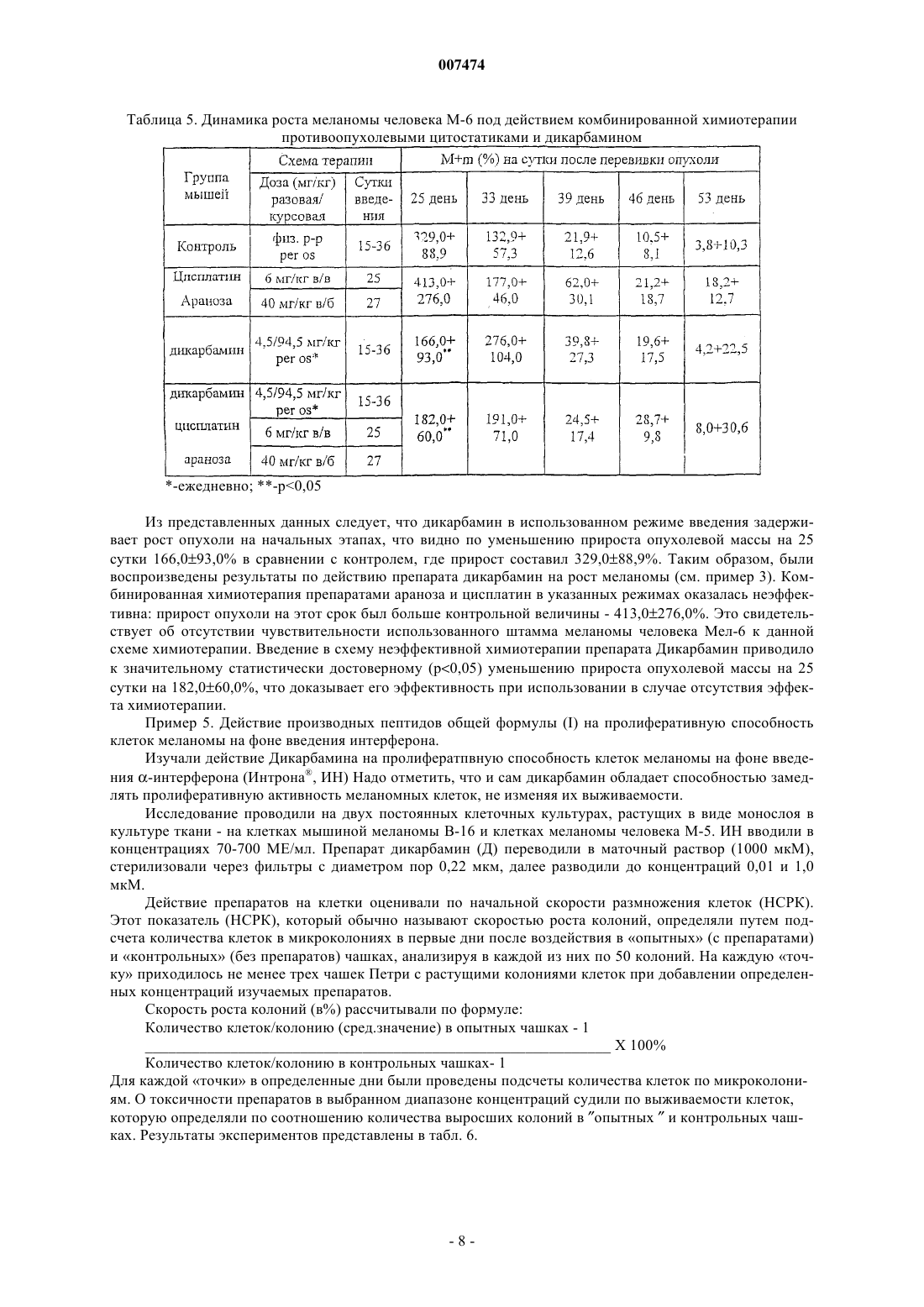
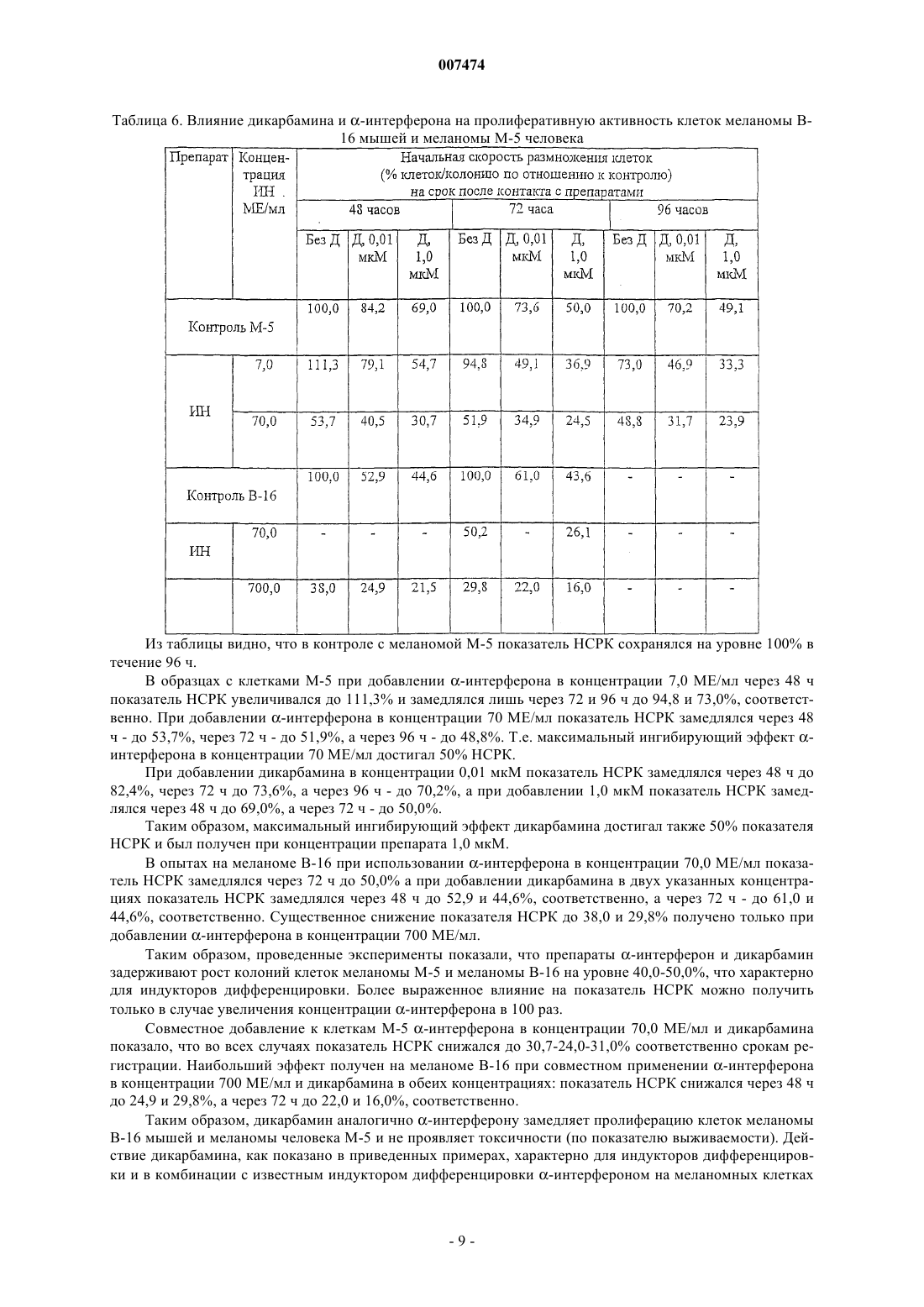
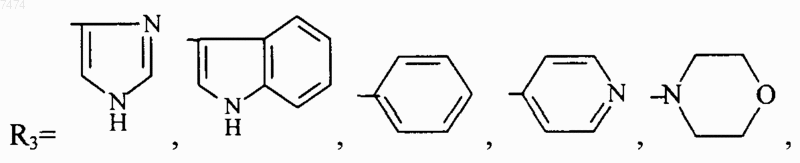
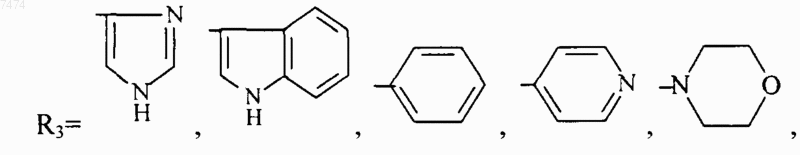
где R1 представляет собой С1-С3 углеводородный радикал, замещенный функциональной группой, выбранной из амино, С1-С5 амидо- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована, а аминогруппа может быть замещена ацильным заместителем; или С1-С3 углеводородный радикал, одновременно замещенный аминогруппой, причем аминогруппа может быть замещена ацильным заместителем и карбоксильной группой, причем карбоксильная группа может входить в состав C5-С6 членного циклического имида с участием N-концевой аминогруппы или -NH-, входящей в состав -CONH- группы; или С1-С3 углеводородный радикал, замещенный 5-6-членной ненасыщенной гетероциклической группой, причем углеводородный радикал может содержать одновременно аминогруппу, свободную или замещенную ацильным заместителем; или R1 может представляет собой насыщенную гетероциклическую группу; R2 представляет собой атом водорода или функциональную группу, выбранную из карбоксила, который может быть этерифицирован; R3 представляет собой 5-6-членные насыщенную или ненасыщенную циклическую или гетероциклическую группу, или амино-, или карбоксильную группу, причем карбоксильная группа может быть этерифицирована; n=0-4, m=1-4, k=0-1;
или его фармацевтически приемлемых солей в эффективном количестве.
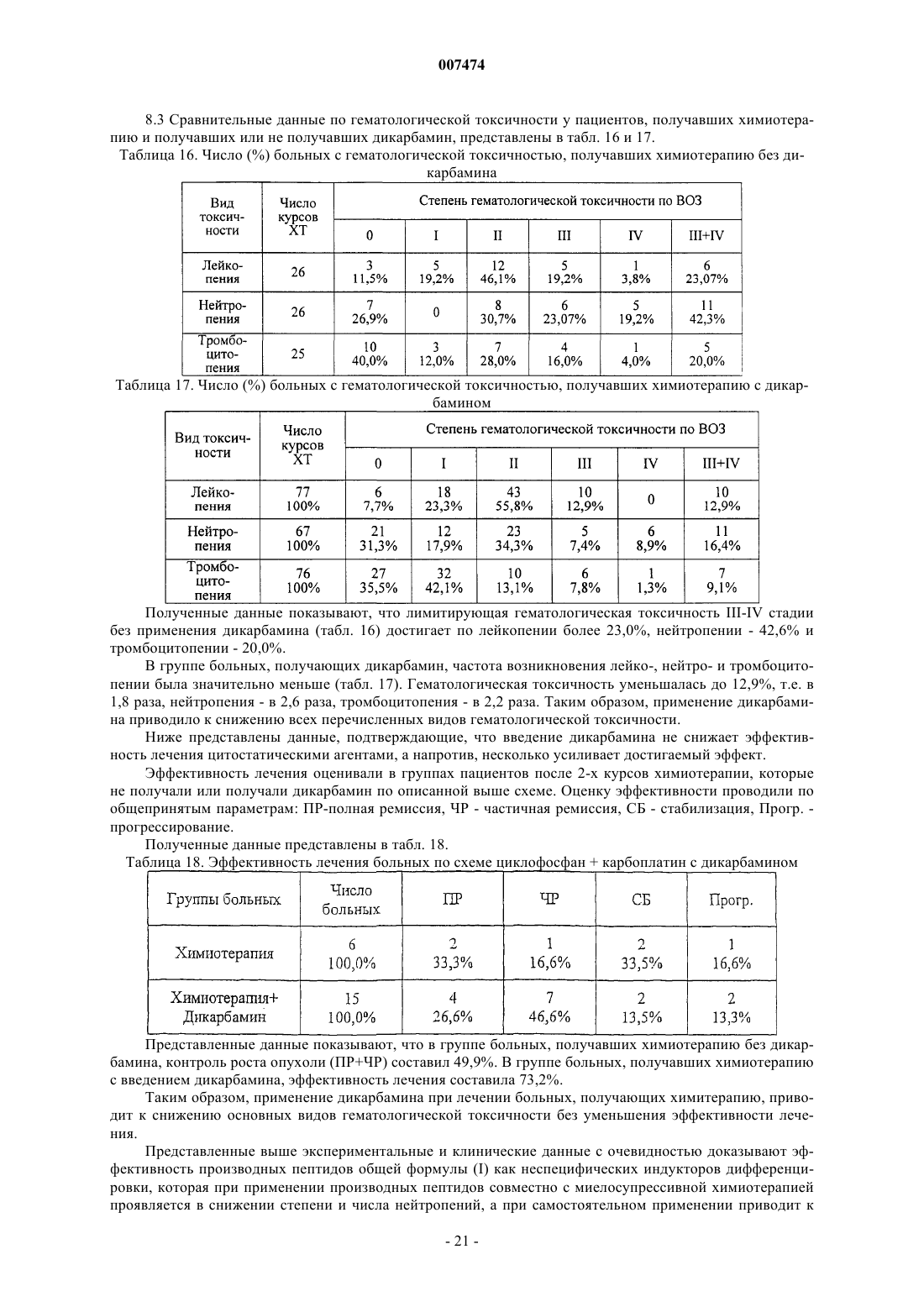
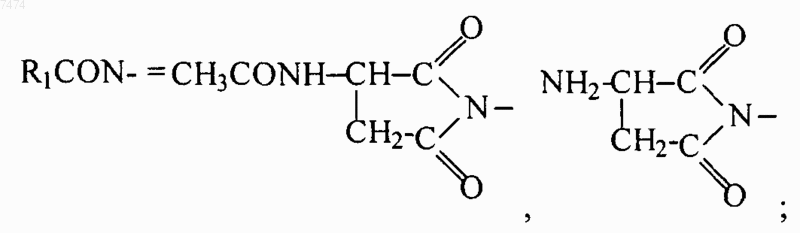
2. Способ по п.1, в котором производное пептида общей формулы (I) по п.1 вводят ежедневно перорально в дозе 0,5-5,0 мг/кг.
3. Способ по любому из пп.1 и 2, в котором производное пептида общей формулы (I) по п.1 вводят в сочетании с курсом химиотерапии.
4. Способ по любому из пп.1-3, в котором для стабилизации роста злокачественных опухолей производное пептида общей формулы (I) по п.1 вводят не менее 15 дней.
5. Способ по любому из пп.1-4, в котором для повышения эффективности иммунотерапии злокачественных опухолей производное пептида общей формулы (I) по п.1 вводят совместно с интерфероном.
6. Способ по любому из пп.4 и 5, в котором злокачественная опухоль является меланомой или гемобластозом.
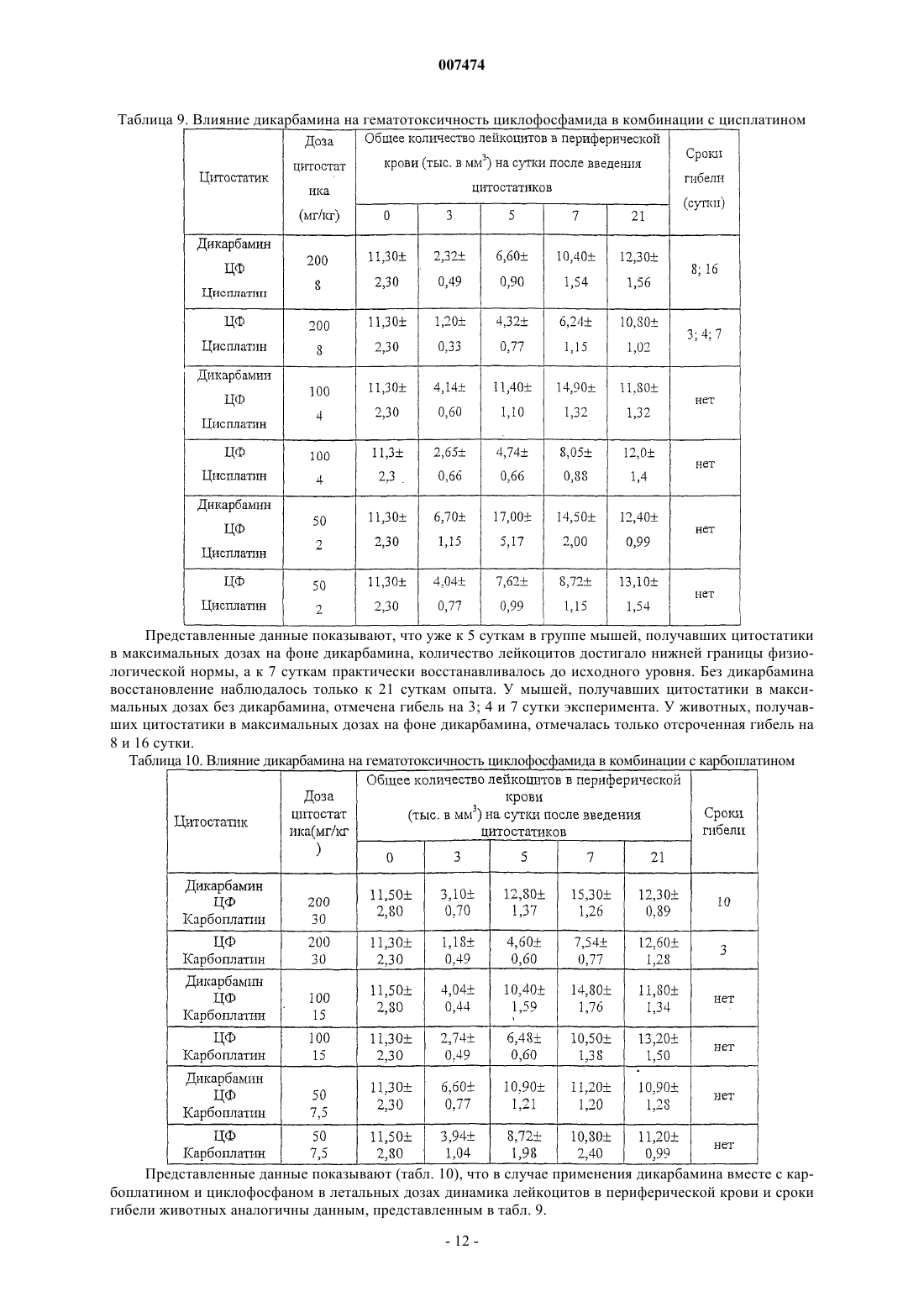
7. Способ по любому из пп.1-3, в котором для снижения гематологической токсичности производное пептида общей формулы (I) по п.1 вводят за 5 дней до начала курса химиотерапии и вплоть до его окончания.
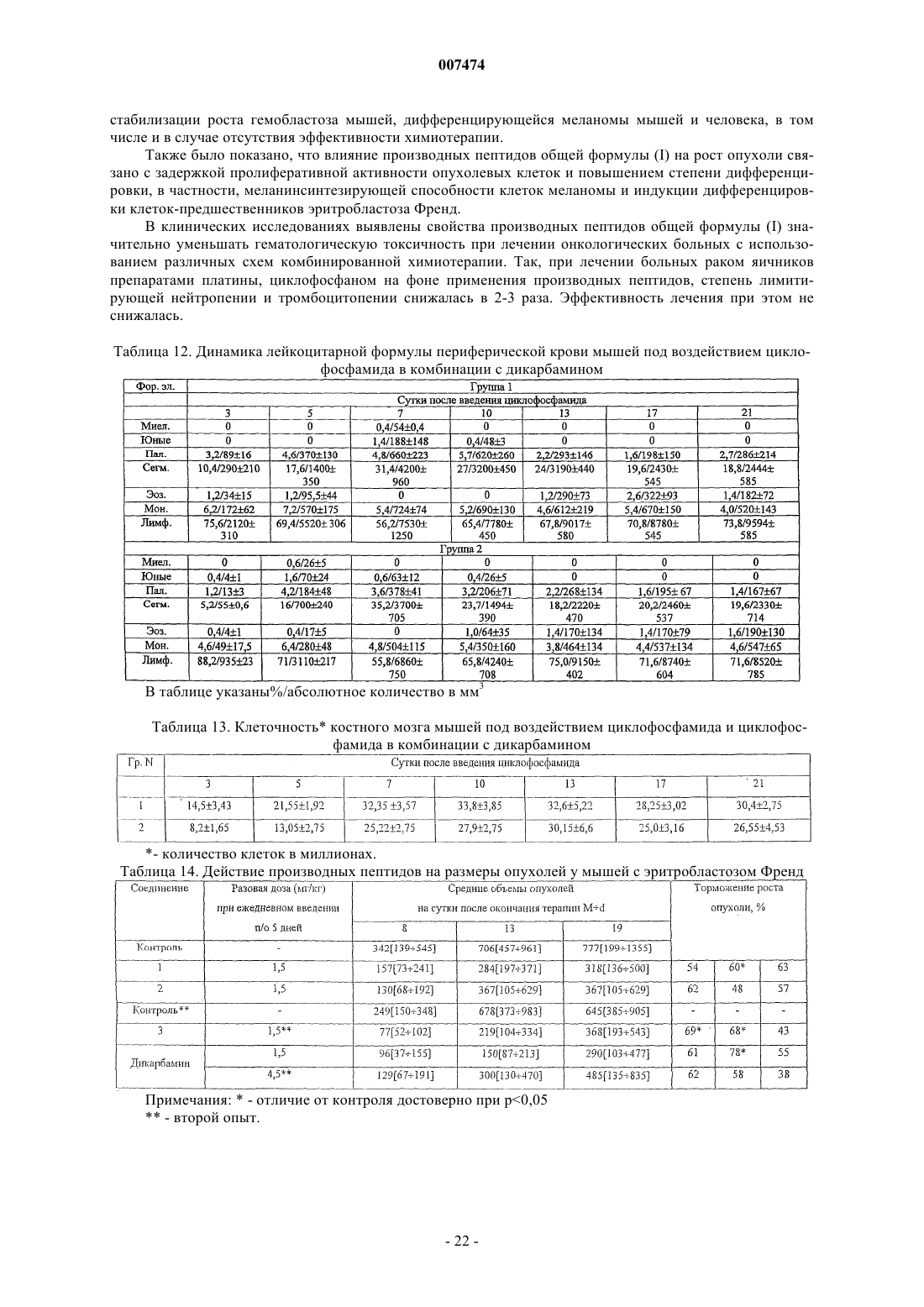
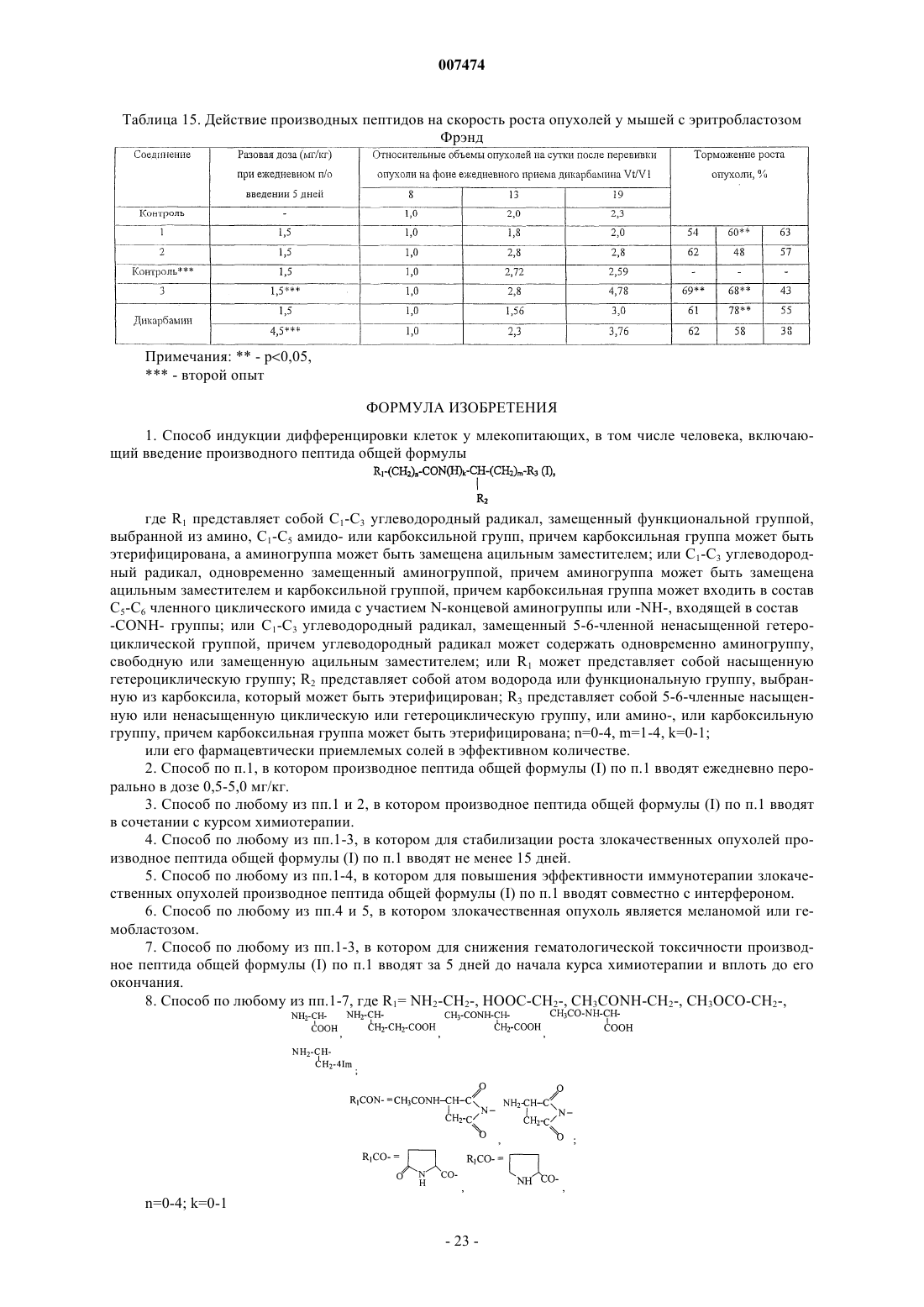
8. Способ по любому из пп.1-7, где R1= NH2-CH2-, HOOC-CH2-, CH3CONH-CH2-, СН3ОСО-СН2-,
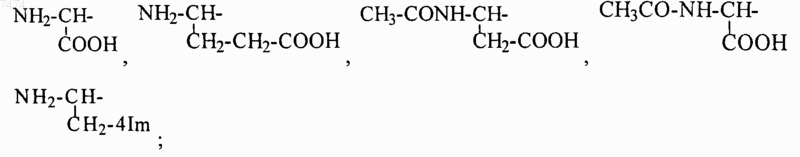
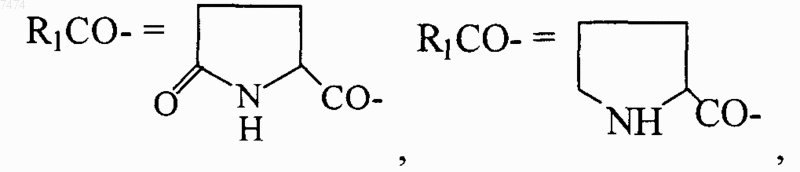
n=0-4; k=0-1
R2=H, COOH,COOCH3;
NH2, COOH, -COOCH3, m=l-4.
9. Способ по любому из пп.1-8, где производное пептида представлет собой соединение формулы
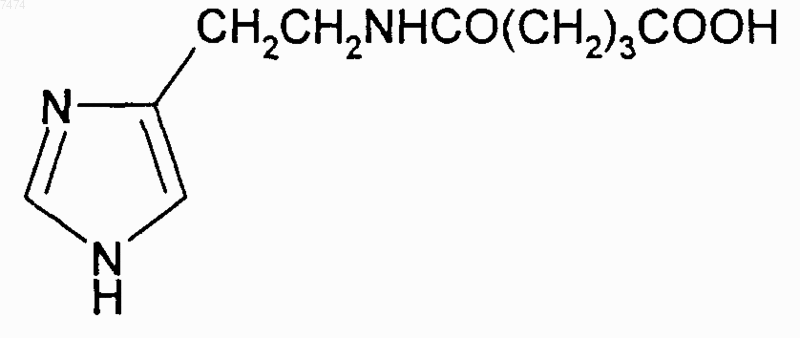
10. Применение производного пептида общей формулы
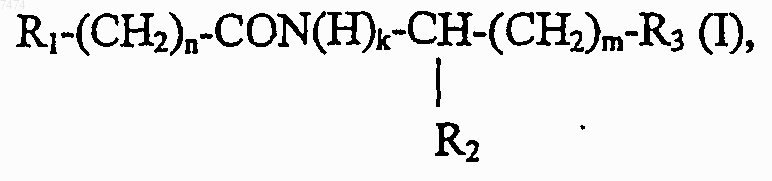
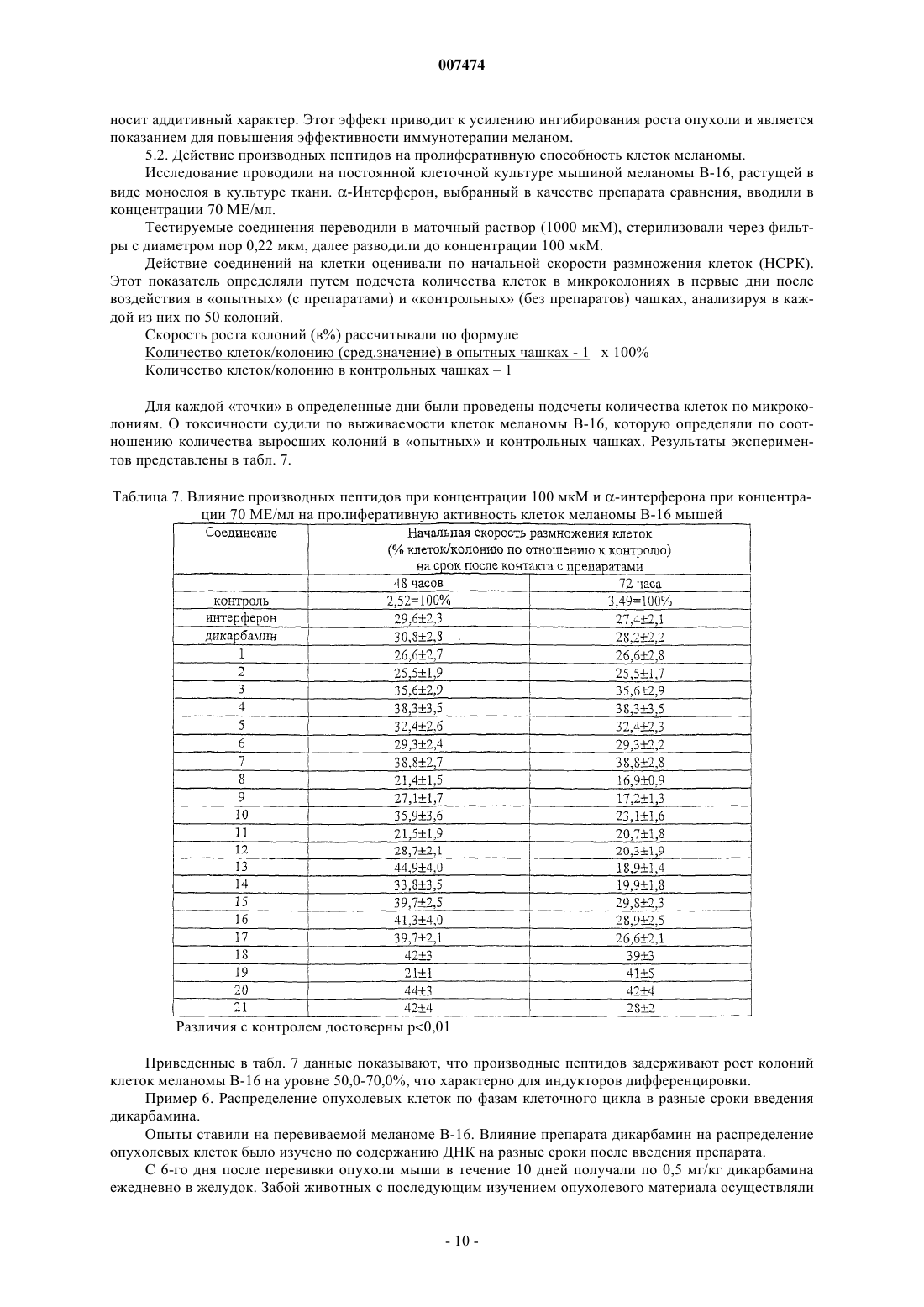
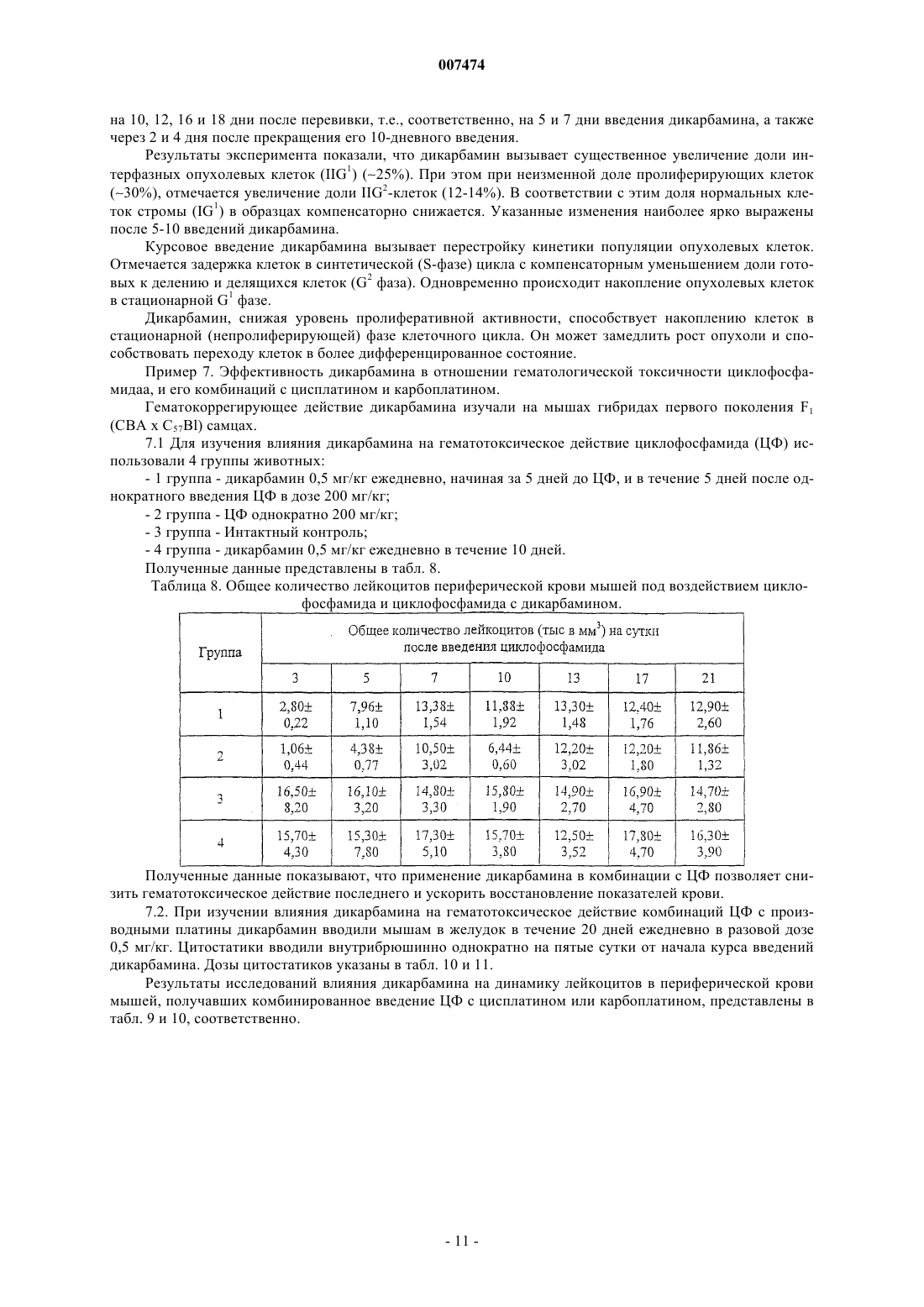
где R1 представляет собой С1-С3 углеводородный радикал, замещенный функциональной группой, выбранной из амино, С1-С5 амидо- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована или входить в состав С5-С6 циклического имида с участием N-концевой аминогруппы или -NH-, входящей в состав -CONH- группы, а аминогруппа может быть замещена ацильным заместителем; или С1-С3 углеводородный радикал, одновременно замещенный амино- и карбоксильной группой; или С1-С3 углеводородный радикал, замещенный 5-6-членной насыщенной или ненасыщенной циклической и гетероциклической группой, причем углеводородный радикал может содержать одновременно аминогруппу, свободную или замещенную ацильным заместителем; R2 представляет сбой атом водорода или функциональную группу, выбранную из карбоксила, который может быть этерифицирован; R3 представляет собой 5-6-членные насыщенные или ненасыщенные циклические или гетероциклические группы, атом водорода или С1-С3 углеводородный радикал, замещенный функциональной группой, выбранной из амино- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована, а аминогруппа может быть замещена ацильным заместителем или эфиром угольной кислоты; n=0-4, m=l-4, k=0-l; или их фармацевтически приемлемых солей для производства лекарственного средства для индукции дифференцировки клеток у млекопитающих.
11. Применение производного пептида общей формулы (I), определенного в п.10, в сочетании с курсом химиотерапии для снижения гематотоксичности.
12. Применение производного пептида общей формулы (I), определенного в п.10, для стабилизации роста злокачественных опухолей.
13. Применение производного пептида общей формулы (I), определенного в п.10, в сочетании с интерфероном для повышения эффективности иммунотерапии.
14. Применение по любому из пп.10-13, где R1= NH2-CH2-, НООС-СН2-, CH3CONH-CH2-, СН3ОСО-СН2-,
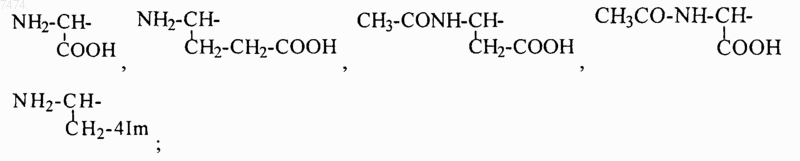
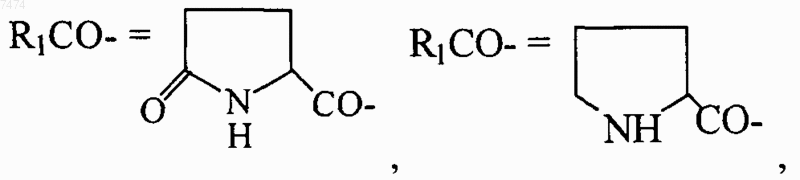
n=0-4; k=0-1
R2=H, COOH,COOCH3;
NH2, COOH, -COOCH3,m=1-4.
15. Применение по любому из пп.10-14, где пептид общей формулы (I) представляет собой соединение формулы
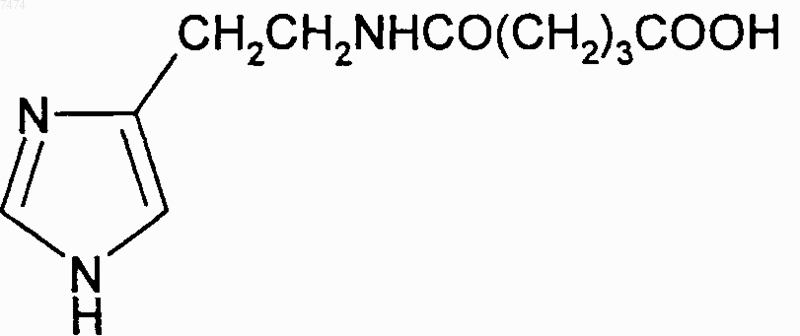
Текст
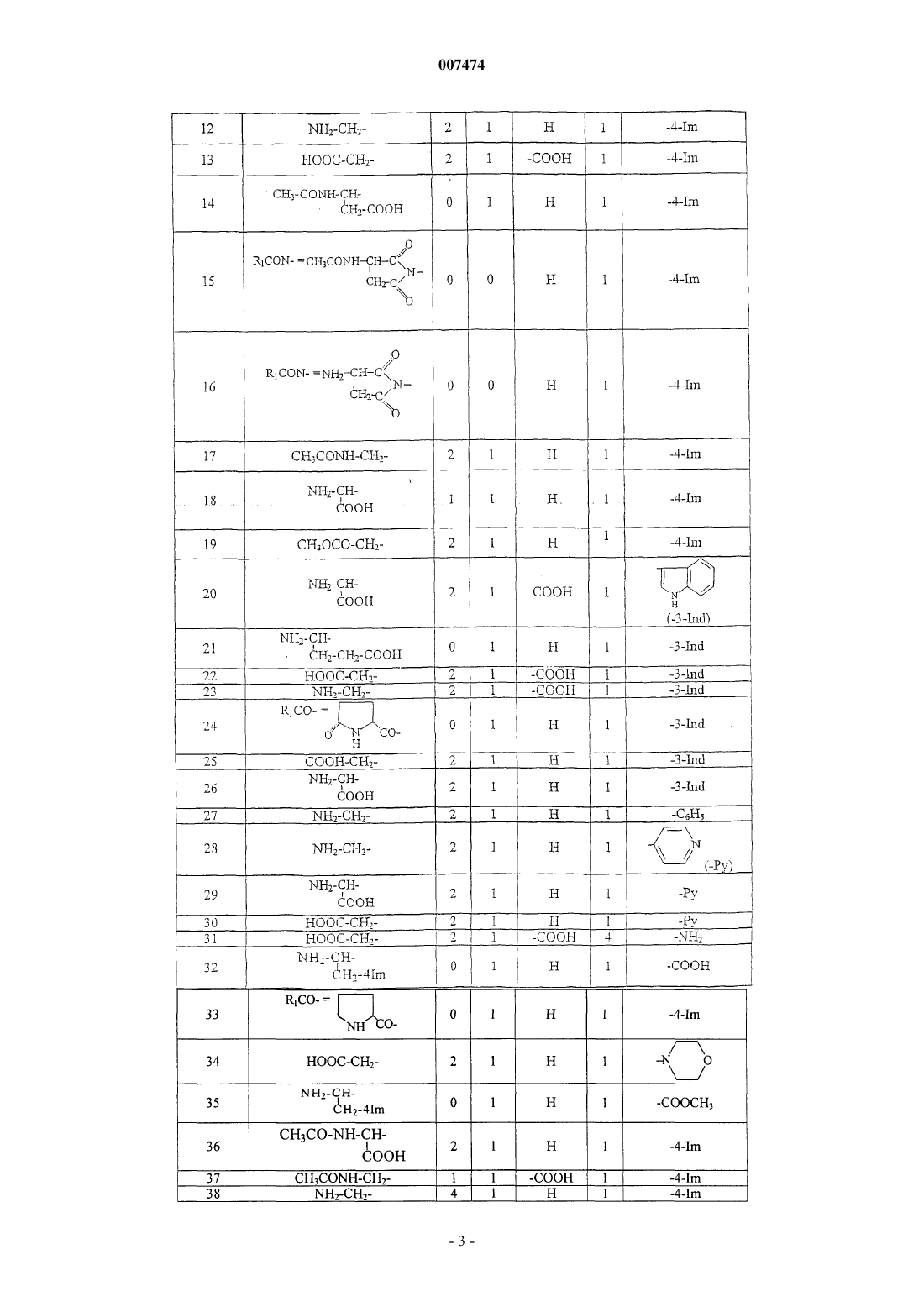
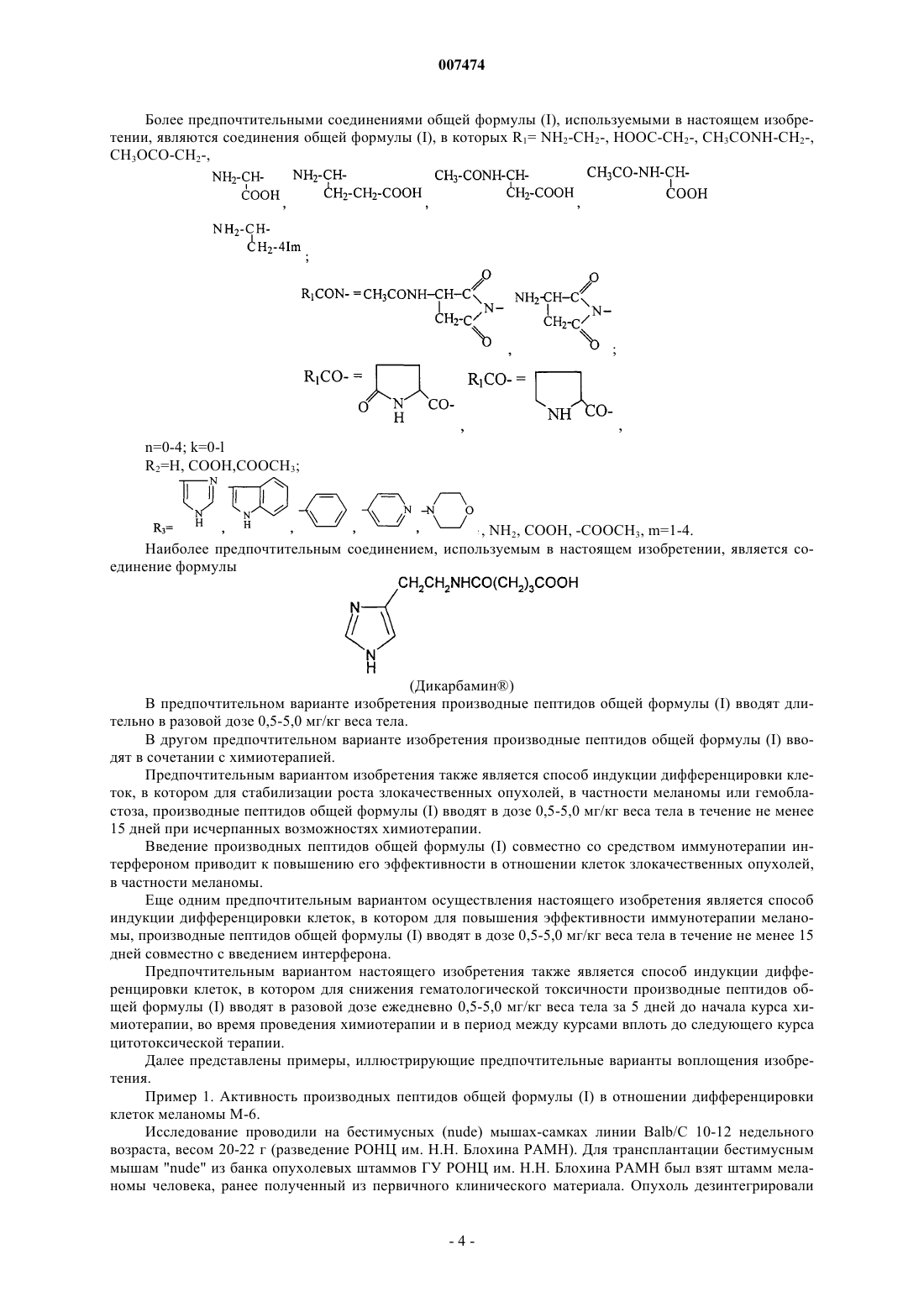
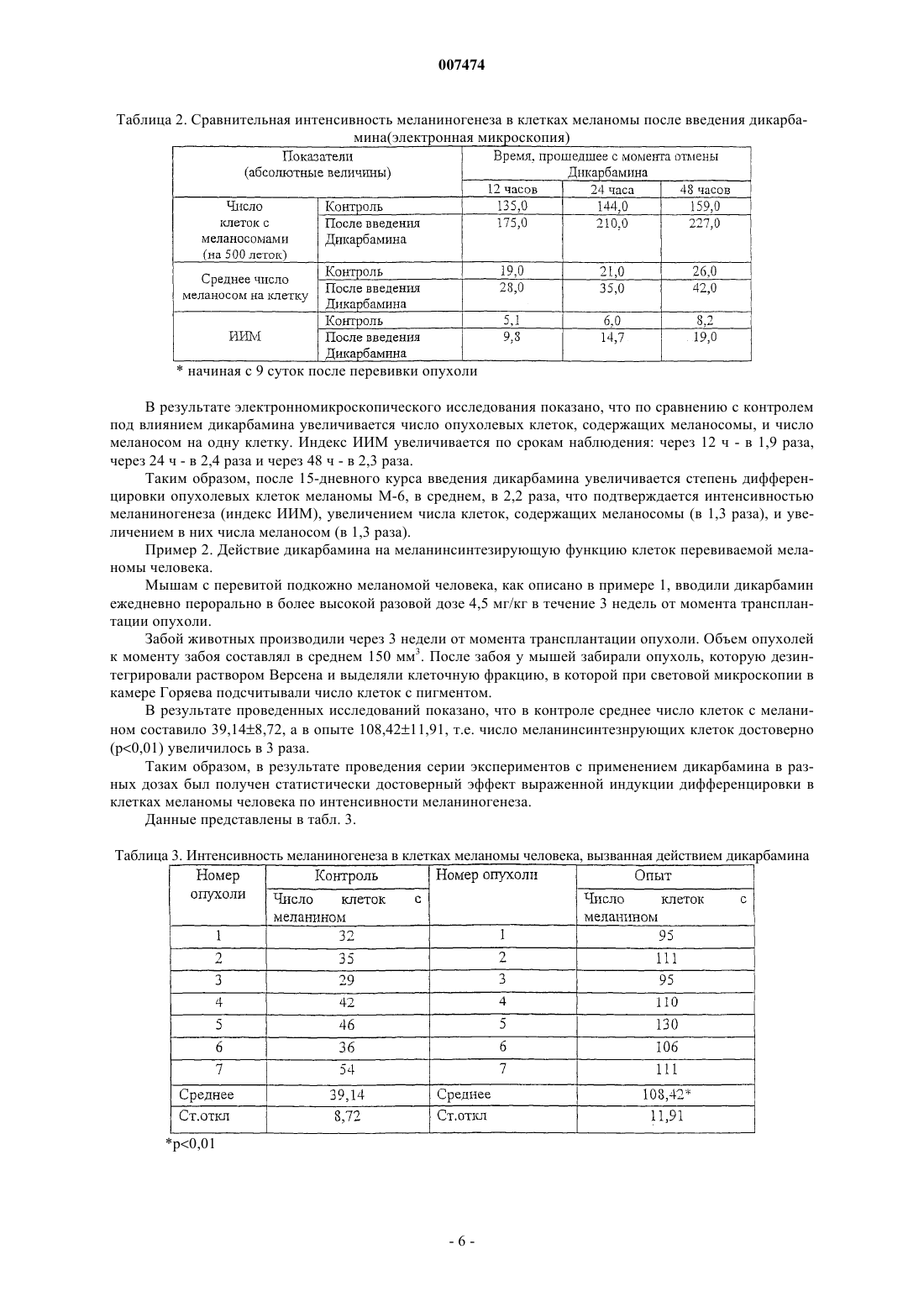
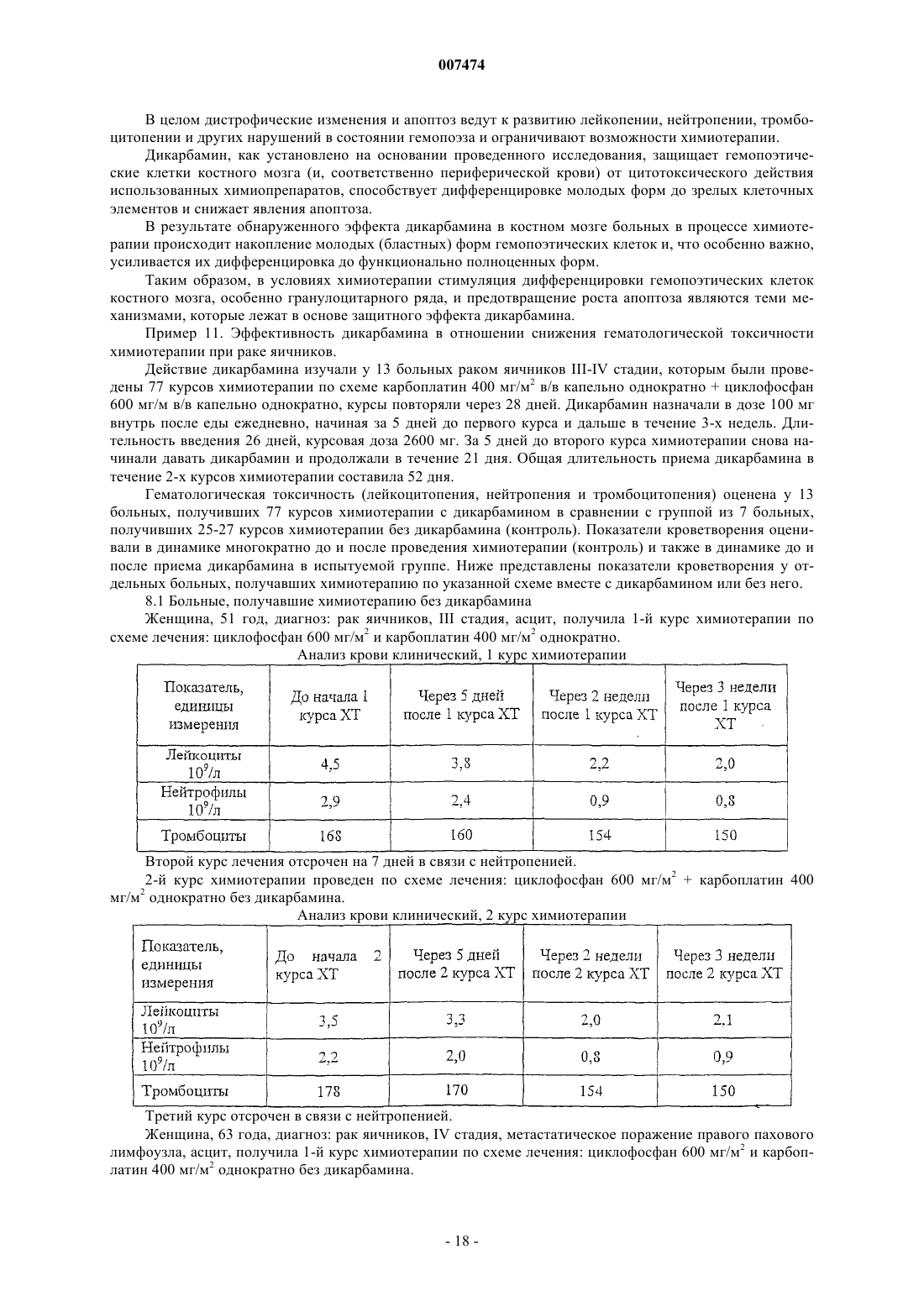
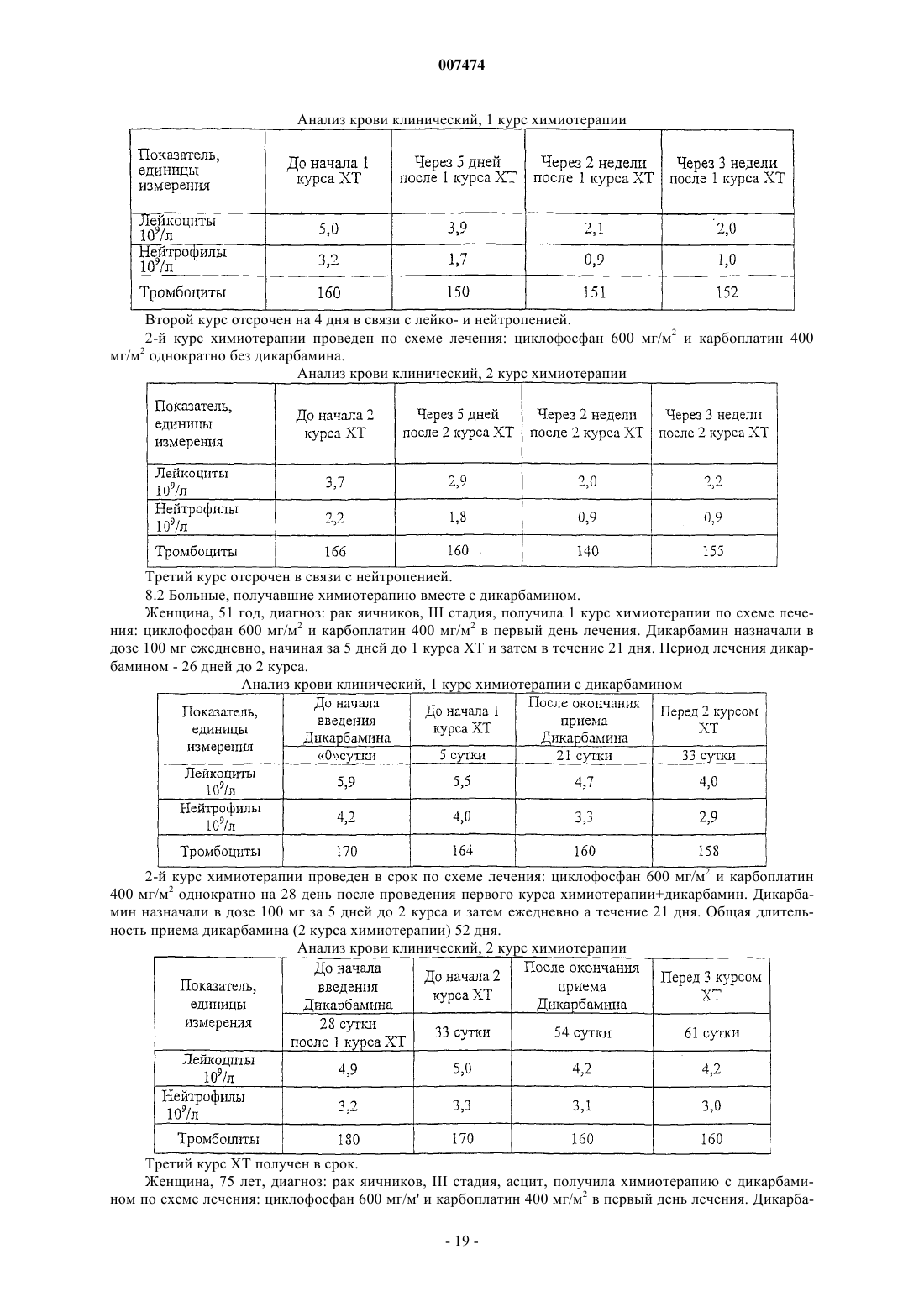
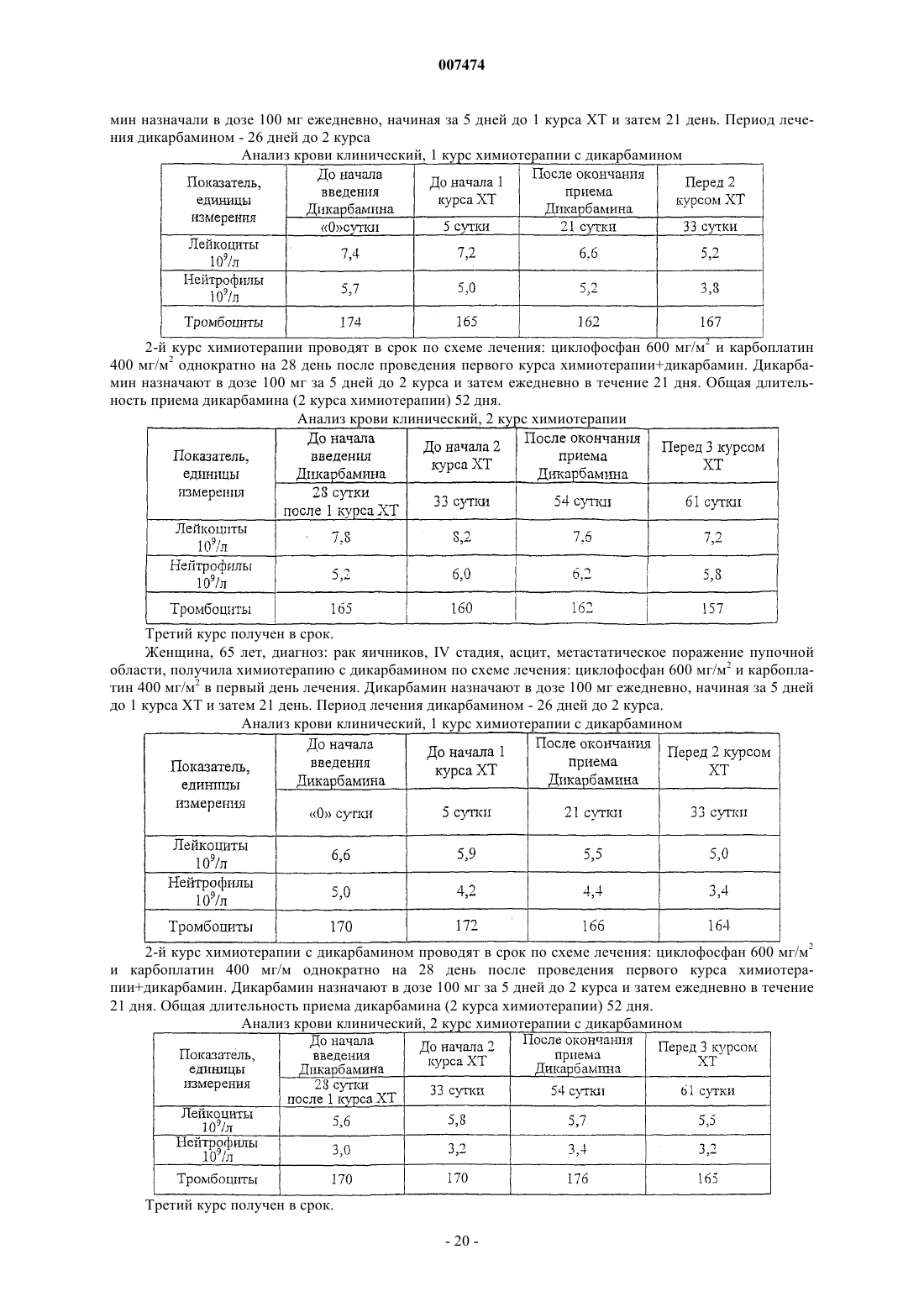
007474 Изобретение относится к медицине и, в частности, к лечению онкологических заболеваний и может быть использовано при лечении опухолей различного генеза. Изобретение относится к способу индукции дифференцировки клеток с применением производных пептидов в качестве агента, индуцирующего дифференцировку клеток, и, в частности, к их использованию в противоопухолевой нецитотоксической терапии. Известно, что отсутствие способности к дифференцировке у большей части опухолевых клеток приводит к безудержному росту опухоли. Поэтому одним из новых подходов к противоопухолевой нецитотоксической терапии является поиск средств как специфической, так и неспецифической индукции дифференцировки клеток. Под индукцией дифференцировки клеток понимают способность различных веществ восстанавливать (или запускать) утраченные или сниженные в результате различных причин функции: прохождение клеткой нормального клеточного цикла, синтез биологически активных жизненно важных веществ в ней и т.п. Вещества или соединения, механизм действия которых не связан с одной конкретной функцией клетки и которые могут вызывать ее дифференцировку по нескольким параметрам, можно отнести к неспецифическим индукторам дифференцировки. Известны способы индукции дифференцировки опухолевых клеток путем введения ретиноидов или-2-интерферона [Cancer Res., 40, 3345-3350, 1980]. В качестве средства продления ремиссии после индукционной или постремиссионной терапии острого промиелоцитарного лейкоза используется индуктор дифференцировки клеток политрансретиноевая кислота (ПТРК). Дифференцировка клеток под воздействием производных ретиноевой кислоты ведет к стабилизации роста опухолевых клеток [Абелев Г.И. Дифференцировка и опухолевый фенотип в клетках лейкозов и лимфом. В кн.: Клиническая онкогематология (под ред. М.А. Волковой), Москва, Медицина,2001, гл. 11, стр.116-123]. Использование препаратов -интерферона при лечении меланомы в качестве средства иммунотерапии также связано с индукцией дифференцировки опухолевых клеток, в которых повышается способность к адгезии и меняется антигенный профиль. Проведение интерферонотерапии вызывает снижение прогрессии опухолевого роста, а также предупреждает развитие и скорость метастазирования [AtzpodienJ., Kirchner H. Cancer, cytokines, and cytotoxic cells: interleukin-2 in the immunotherapy of human neoplasms.,Klin. Wochenschr., 1990, v.68, p. l-7]. В последние годы вошли в клиническую практику препараты, вызывающие дифференцировку кроветворных клеток, поврежденных в результате цитотоксической химиотерапии. Эти препараты представляют собой различные цитокины, полученные из костного мозга, такие как гематогормоны: гранулоцитарный колониестимулирующий фактор, гранулоцитарно-макрофагальный колониестимулирующий фактор и др. Их применение при лечении различных опухолей человека приводит к ускорению созревания клеток костного мозга и предупреждает гематологический цитотоксический эффект химиопрепаратов [Crawford J., Ozer Н., Stoller R. et al. Phase II of clinical investigation of GM-CSF by the patients of SCLCwith the dose-intensive chemotherapy.-The New England Journal of Medicine, 1991, v.325, 3, p.164-170]. Таким образом, индукция дифференцировки опухолевых клеток является одним из ведущих механизмов стабилизации роста новообразований, повышения эффекта иммунотерапии и коррекции гематологической токсичности химиопрепаратов. Авторами настоящего изобретения было обнаружено, что производные пептидов общей формулы (I) являются мощными индукторами дифференцировки клеток и могут быть использованы в качестве агентов для нецитотоксической терапии онкологических заболеваний, в частности, меланомы и гемобластозов, а также в качестве гематокоррегирующих агентов. Данные соединения описаны в международной заявке PCT/RU98/00215 как обладающие антиоксидантным, антиастматическим, антигипоксическим, противовоспалительным,противовирусным, антибактериальным, липидрегулирующим, антиметастатическим, а также другими видами терапевтического действия. Соединения циклической структуры аспартил-гистамина и ацетиласпартилгистамина описаны в работе Kvamme, E.; Reichelt, K.L.; Edminson, P.D.; et al. N-substituted peptides in brain. Fed. Eur. Biochem. Society Meet., [Proc]. 1975, 41, 127-136. Настоящее изобретение относится к способу индукции дифференцировки клеток, включающему введение в качестве активного агента эффективного количества соединения общей формулы или их фармацевтически приемлемых солей, где R1 представляет собой С 1-С 3 углеводородный радикал,замещенный функциональной группой, выбранной из амино, С 1-С 5 амидо- или карбоксильной групп,причем карбоксильная группа может быть этерифицирована, а аминогруппа может быть замещена ацильным заместителем; или С 1-С 3 углеводородный радикал, одновременно замещенный аминогруппой,причем аминогруппа может быть замещена ацильным заместителем и карбоксильной группой, причем карбоксильная группа может входить в состав С 5-С 6 членного циклического имида с участием Nконцевой аминогруппы или -NH-, входящей в состав -CONH- группы; или С 1-С 3 углеводородный радикал, замещенный 5-6-членной ненасыщенной гетероциклической группой, причем углеводородный радикал может содержать одновременно аминогруппу, свободную или замещенную ацильным заместителем; или R1 может представляет собой насыщенную гетероциклическую группу; R2 представляет сбой атом водорода или функциональную группу, выбранную из карбоксила, который может быть этерифицирован; R3 представляет собой 5-6-членные насыщенную или ненасыщенную циклическую или гетероциклическую группу, или амино-, или карбоксильную группу, причем карбоксильная группа может быть этерифицирована;n=0-4, m=1-4, k=0-l. В предпочтительном варианте настоящее изобретение относится к способу индукции дифференцировки клеток, включающему введение в качестве активного агента эффективного количества 4-[N-(2(имидазол-4-ил)этил)карбамоил]масляной кислоты (Дикарбамин). Предпочтительными соединениями общей формулы "(I)," используемыми в настоящем изобретении являются соединения общей формулы (I), представленные в следующей таблице:-3 007474 Более предпочтительными соединениями общей формулы (I), используемыми в настоящем изобретении, являются соединения общей формулы (I), в которых R1= NH2-CH2-, HOOC-CH2-, CH3CONH-CH2-,CH3OCO-CH2-,(Дикарбамин) В предпочтительном варианте изобретения производные пептидов общей формулы (I) вводят длительно в разовой дозе 0,5-5,0 мг/кг веса тела. В другом предпочтительном варианте изобретения производные пептидов общей формулы (I) вводят в сочетании с химиотерапией. Предпочтительным вариантом изобретения также является способ индукции дифференцировки клеток, в котором для стабилизации роста злокачественных опухолей, в частности меланомы или гемобластоза, производные пептидов общей формулы (I) вводят в дозе 0,5-5,0 мг/кг веса тела в течение не менее 15 дней при исчерпанных возможностях химиотерапии. Введение производных пептидов общей формулы (I) совместно со средством иммунотерапии интерфероном приводит к повышению его эффективности в отношении клеток злокачественных опухолей,в частности меланомы. Еще одним предпочтительным вариантом осуществления настоящего изобретения является способ индукции дифференцировки клеток, в котором для повышения эффективности иммунотерапии меланомы, производные пептидов общей формулы (I) вводят в дозе 0,5-5,0 мг/кг веса тела в течение не менее 15 дней совместно с введением интерферона. Предпочтительным вариантом настоящего изобретения также является способ индукции дифференцировки клеток, в котором для снижения гематологической токсичности производные пептидов общей формулы (I) вводят в разовой дозе ежедневно 0,5-5,0 мг/кг веса тела за 5 дней до начала курса химиотерапии, во время проведения химиотерапии и в период между курсами вплоть до следующего курса цитотоксической терапии. Далее представлены примеры, иллюстрирующие предпочтительные варианты воплощения изобретения. Пример 1. Активность производных пептидов общей формулы (I) в отношении дифференцировки клеток меланомы М-6. Исследование проводили на бестимусных (nude) мышах-самках линии Balb/C 10-12 недельного возраста, весом 20-22 г (разведение РОНЦ им. Н.Н. Блохина РАМН). Для трансплантации бестимусным мышам "nude" из банка опухолевых штаммов ГУ РОНЦ им. Н.Н. Блохина РАМН был взят штамм меланомы человека, ранее полученный из первичного клинического материала. Опухоль дезинтегрировали-4 007474 раствором Версена с прижизненной окраской трипановым синим и перевивали мышам под кожу по 1,6 млн клеток на мышь. Дикарбамин вводили мышам ежедневно в дозе 1,0 мг/кг в желудок с помощью металлического зонда, начиная за 4 дня до перевивки опухоли, и затем в течение 10-11 дней (курс введения - до 15 дней). Через 12, 24 и 48 ч после последнего введения препарата мышей забивали эфирным наркозом. В опыте использовали 4 группы мышей:- 2 группа - вводили дикарбамин и забивали мышей через 12 ч после окончания его введения.- 3 группа - вводили дикарбамин и забивали мышей через 24 ч после окончания его введения.- 4 группа - вводили дикарбамин и забивали мышей через 48 ч после окончания его введения. Для контроля за степенью дифференцировки и пролиферации меланомы М-6 в группах контрольных животных и в группах с дикарбамином определяли 4 морфологических показателя, такие как число клеток с пигментом и число клеток с признаками апоптоза (способность к дифференцировке), число митозов (пролиферативная активность) и площадь некроза. Эти показатели определяли в динамике и соотносили к общей морфологической картине опухолевого роста, как интегральному признаку. С этой целью у мышей забирали опухоль, помещали в формалин и проводили гистологическую обработку для световой микроскопии. Полученные данные представлены в табл. 1. Таблица 1. Морфологические показатели меланомы М-6 (световая микроскопия) Проведенное исследование позволило установить, что перевиваемая бестимусным мышам меланома человека на 9 сутки образует опухоль, состоящую из полиморфных клеток, которые растут сплошными полями с незначительным развитием стромы. В опухоли встречаются небольшие участки некроза,которые несколько увеличиваются к 48 ч (до 3-5% площади среза) по сравнению со сроками забоя 12, 24 ч (соответственно, 1-2% и 2-3%). Во все периоды роста в опухоли наблюдается (3-5%) митозов. Апоптоз выражен слабо. Клетки, содержащие пигмент, встречаются редко, их число в течение первых суток не превышает 1-2% и только через 48 ч роста увеличивается до 2-3%. Таким образом, интенсивность меланиногенеза в этот период незначительная. Полученная характеристика позволяет сделать вывод о том,что меланома является быстро растущей опухолью, практически утратившей способность к дифференцировке как по степени апоптоза, так и, прежде всего, по основной функциональной способности - меланиногенезу. Оценку влияния дикарбамина на дифференцировку клеток меланомы по интенсивности меланиногенеза проводили путем подсчета числа клеток с меланином в срезах опухоли. С этой целью у мышей забирали опухоль, помещали в глутаральдегид и проводили гистологическую обработку для электронной микроскопии. В полученных срезах рассчитывали индекс интенсивности меланиногенеза (ИИМ), который отражает степень дифференцировки клеток: ИИМ==ПК х ПМ,где ПК- количество клеток, содержащих меланосомы; ПМ - среднее количество меланосом на клетку. Анализ интенсивности меланиногенеза, проведенный по этому показателю, представлен в табл. 2.-5 007474 Таблица 2. Сравнительная интенсивность меланиногенеза в клетках меланомы после введения дикарбамина(электронная микроскопия) начиная с 9 суток после перевивки опухоли В результате электронномикроскопического исследования показано, что по сравнению с контролем под влиянием дикарбамина увеличивается число опухолевых клеток, содержащих меланосомы, и число меланосом на одну клетку. Индекс ИИМ увеличивается по срокам наблюдения: через 12 ч - в 1,9 раза,через 24 ч - в 2,4 раза и через 48 ч - в 2,3 раза. Таким образом, после 15-дневного курса введения дикарбамина увеличивается степень дифференцировки опухолевых клеток меланомы М-6, в среднем, в 2,2 раза, что подтверждается интенсивностью меланиногенеза (индекс ИИМ), увеличением числа клеток, содержащих меланосомы (в 1,3 раза), и увеличением в них числа меланосом (в 1,3 раза). Пример 2. Действие дикарбамина на меланинсинтезирующую функцию клеток перевиваемой меланомы человека. Мышам с перевитой подкожно меланомой человека, как описано в примере 1, вводили дикарбамин ежедневно перорально в более высокой разовой дозе 4,5 мг/кг в течение 3 недель от момента трансплантации опухоли. Забой животных производили через 3 недели от момента трансплантации опухоли. Объем опухолей к моменту забоя составлял в среднем 150 мм 3. После забоя у мышей забирали опухоль, которую дезинтегрировали раствором Версена и выделяли клеточную фракцию, в которой при световой микроскопии в камере Горяева подсчитывали число клеток с пигментом. В результате проведенных исследований показано, что в контроле среднее число клеток с меланином составило 39,148,72, а в опыте 108,4211,91, т.е. число меланинсинтезнрующих клеток достоверно(р 0,01) увеличилось в 3 раза. Таким образом, в результате проведения серии экспериментов с применением дикарбамина в разных дозах был получен статистически достоверный эффект выраженной индукции дифференцировки в клетках меланомы человека по интенсивности меланиногенеза. Данные представлены в табл. 3. Таблица 3. Интенсивность меланиногенеза в клетках меланомы человека, вызванная действием дикарбамина-6 007474 Пример 3. Влияние дикарбамина на динамику роста перевиваемой меланомы человека Мел-6 Исследование проводили на бестимусных nude мышах-самках линии Balb/C 10-12 недельного возраста весом 20-22 г, (разведение РОНЦ им. И.Н. Блохина РАМН). Для трансплантации бестимусным мышам из банка опухолевых штамов ГУ РОНЦ им. Н.Н. Блохина РАМН брали штамм меланомы человека Мел-6, ранее полученный из первичного клинического материала. Дикарбамин в разовых дозах 1,5 мг/кг и 4,5 мг/кг вводили ежедневно перорально в двух группах мышей в течение 3 недель от момента возникновения опухоли (с 15 по 36 день от момента трансплантации опухоли). Измерение опухоли было проведено на 18, 25, 33, 39, 46 и 53 дни от момента трансплантации. Оценку действия Дикарбамина проводили по динамике роста опухоли в течение 8 недель при многократном измерении объемов опухолей V по формулеV = Lsh (мм 3) где L - длина в мм, s - ширина в мм, h - высота в мм. Затем вычисляли соотношение объемов опухолей Vt/Vt-1, которое выражали в процентах, и обрабатывали статистически по методу Стьюдента для расчета достоверности. Полученные данные представлены в табл. 4. Таблица 4. Влияние препарата дикарбамин на рост меланомы человека М-6 у бестимусных мышей- среднее значение со средним отклонением,- расчет достоверности производился только для данных процентного изменения объема опухоли. Полученные данные показали задержку максимального прироста опухолевой массы на 7 дней относительно контроля. В сравнении с контрольной группой на 25 день от момента трансплантации выявлены статистически значимые различия по скорости роста опухоли в группе мышей, получавших дикарбамин в разовых дозах 4,5 мг/кг, что соответствует 10-дневному курсу введения дикарбамина и курсовой дозе 45 мг/кг. В этой группе средний объем опухоли увеличился на 166,093,0%, тогда как в контроле этот показатель составил 329,088,9% (р 0,015). Пример 4. Влияние дикарбамина в комбинации с химиотерапией на рост перевиваемой меланомы человека М-6, трансплантированной бестимусным мышам. Исследование проводили по методике, описанной в примере 3. Дикарбамин вводили ежедневно перорально в разовой дозе 4,5 мг/кг в течение 3 недель от момента возникновения опухоли (с 15 по 36 день). В группах комбинированного лечения препарат дикарбамин также вводили ежедневно в разовой дозе 4,5 мг/кг в течение 3 недель (15-36 дни) в сочетании с однократным введением противоопухолевых цитостатиков - цисплатина в дозе 6 мг/кг в/в (25 день) и аранозы в дозе 40 мг/кг в/б (27 день). Терапию цитостатиками начинали при среднем объеме опухолей 20062 мм 3. На 18, 25, 33, 39, 46 и 53 дни от момента трансплантации проведено измерение объемов опухолей и рассчитана величина Vt/Vt-1 которую выражали в процентах. Полученные данные представлены в табл. 5.-7 007474 Таблица 5. Динамика роста меланомы человека М-6 под действием комбинированной химиотерапии противоопухолевыми цитостатиками и дикарбамином-ежедневно; -р 0,05 Из представленных данных следует, что дикарбамин в использованном режиме введения задерживает рост опухоли на начальных этапах, что видно по уменьшению прироста опухолевой массы на 25 сутки 166,093,0% в сравнении с контролем, где прирост составил 329,088,9%. Таким образом, были воспроизведены результаты по действию препарата дикарбамин на рост меланомы (см. пример 3). Комбинированная химиотерапия препаратами араноза и цисплатин в указанных режимах оказалась неэффективна: прирост опухоли на этот срок был больше контрольной величины - 413,0276,0%. Это свидетельствует об отсутствии чувствительности использованного штамма меланомы человека Мел-6 к данной схеме химиотерапии. Введение в схему неэффективной химиотерапии препарата Дикарбамин приводило к значительному статистически достоверному (р 0,05) уменьшению прироста опухолевой массы на 25 сутки на 182,060,0%, что доказывает его эффективность при использовании в случае отсутствия эффекта химиотерапии. Пример 5. Действие производных пептидов общей формулы (I) на пролиферативную способность клеток меланомы на фоне введения интерферона. Изучали действие Дикарбамина на пролифератпвную способность клеток меланомы на фоне введения -интерферона (Интрона, ИН) Надо отметить, что и сам дикарбамин обладает способностью замедлять пролиферативную активность меланомных клеток, не изменяя их выживаемости. Исследование проводили на двух постоянных клеточных культурах, растущих в виде монослоя в культуре ткани - на клетках мышиной меланомы В-16 и клетках меланомы человека М-5. ИН вводили в концентрациях 70-700 МЕ/мл. Препарат дикарбамин (Д) переводили в маточный раствор (1000 мкМ),стерилизовали через фильтры с диаметром пор 0,22 мкм, далее разводили до концентраций 0,01 и 1,0 мкМ. Действие препаратов на клетки оценивали по начальной скорости размножения клеток (НСРК). Этот показатель (НСРК), который обычно называют скоростью роста колоний, определяли путем подсчета количества клеток в микроколониях в первые дни после воздействия в опытных (с препаратами) и контрольных (без препаратов) чашках, анализируя в каждой из них по 50 колоний. На каждую точку приходилось не менее трех чашек Петри с растущими колониями клеток при добавлении определенных концентраций изучаемых препаратов. Скорость роста колоний (в%) рассчитывали по формуле: Количество клеток/колонию (сред.значение) в опытных чашках - 1X 100% Количество клеток/колонию в контрольных чашках- 1 Для каждой точки в определенные дни были проведены подсчеты количества клеток по микроколониям. О токсичности препаратов в выбранном диапазоне концентраций судили по выживаемости клеток,которую определяли по соотношению количества выросших колоний в опытныхи контрольных чашках. Результаты экспериментов представлены в табл. 6.-8 007474 Таблица 6. Влияние дикарбамина и -интерферона на пролиферативную активность клеток меланомы В 16 мышей и меланомы М-5 человека Из таблицы видно, что в контроле с меланомой М-5 показатель НСРК сохранялся на уровне 100% в течение 96 ч. В образцах с клетками М-5 при добавлении -интерферона в концентрации 7,0 МЕ/мл через 48 ч показатель НСРК увеличивался до 111,3% и замедлялся лишь через 72 и 96 ч до 94,8 и 73,0%, соответственно. При добавлении -интерферона в концентрации 70 МЕ/мл показатель НСРК замедлялся через 48 ч - до 53,7%, через 72 ч - до 51,9%, а через 96 ч - до 48,8%. Т.е. максимальный ингибирующий эффект интерферона в концентрации 70 МЕ/мл достигал 50% НСРК. При добавлении дикарбамина в концентрации 0,01 мкМ показатель НСРК замедлялся через 48 ч до 82,4%, через 72 ч до 73,6%, а через 96 ч - до 70,2%, а при добавлении 1,0 мкМ показатель НСРК замедлялся через 48 ч до 69,0%, а через 72 ч - до 50,0%. Таким образом, максимальный ингибирующий эффект дикарбамина достигал также 50% показателя НСРК и был получен при концентрации препарата 1,0 мкМ. В опытах на меланоме В-16 при использовании -интерферона в концентрации 70,0 МЕ/мл показатель НСРК замедлялся через 72 ч до 50,0% а при добавлении дикарбамина в двух указанных концентрациях показатель НСРК замедлялся через 48 ч до 52,9 и 44,6%, соответственно, а через 72 ч - до 61,0 и 44,6%, соответственно. Существенное снижение показателя НСРК до 38,0 и 29,8% получено только при добавлении -интерферона в концентрации 700 МЕ/мл. Таким образом, проведенные эксперименты показали, что препараты -интерферон и дикарбамин задерживают рост колоний клеток меланомы М-5 и меланомы В-16 на уровне 40,0-50,0%, что характерно для индукторов дифференцировки. Более выраженное влияние на показатель НСРК можно получить только в случае увеличения концентрации -интерферона в 100 раз. Совместное добавление к клеткам М-5 -интерферона в концентрации 70,0 МЕ/мл и дикарбамина показало, что во всех случаях показатель НСРК снижался до 30,7-24,0-31,0% соответственно срокам регистрации. Наибольший эффект получен на меланоме В-16 при совместном применении -интерферона в концентрации 700 МЕ/мл и дикарбамина в обеих концентрациях: показатель НСРК снижался через 48 ч до 24,9 и 29,8%, а через 72 ч до 22,0 и 16,0%, соответственно. Таким образом, дикарбамин аналогично -интерферону замедляет пролиферацию клеток меланомы В-16 мышей и меланомы человека М-5 и не проявляет токсичности (по показателю выживаемости). Действие дикарбамина, как показано в приведенных примерах, характерно для индукторов дифференцировки и в комбинации с известным индуктором дифференцировки -интерфероном на меланомных клетках-9 007474 носит аддитивный характер. Этот эффект приводит к усилению ингибирования роста опухоли и является показанием для повышения эффективности иммунотерапии меланом. 5.2. Действие производных пептидов на пролиферативную способность клеток меланомы. Исследование проводили на постоянной клеточной культуре мышиной меланомы В-16, растущей в виде монослоя в культуре ткани. -Интерферон, выбранный в качестве препарата сравнения, вводили в концентрации 70 МЕ/мл. Тестируемые соединения переводили в маточный раствор (1000 мкМ), стерилизовали через фильтры с диаметром пор 0,22 мкм, далее разводили до концентрации 100 мкМ. Действие соединений на клетки оценивали по начальной скорости размножения клеток (НСРК). Этот показатель определяли путем подсчета количества клеток в микроколониях в первые дни после воздействия в опытных (с препаратами) и контрольных (без препаратов) чашках, анализируя в каждой из них по 50 колоний. Скорость роста колоний (в%) рассчитывали по формуле Количество клеток/колонию (сред.значение) в опытных чашках - 1 х 100% Количество клеток/колонию в контрольных чашках 1 Для каждой точки в определенные дни были проведены подсчеты количества клеток по микроколониям. О токсичности судили по выживаемости клеток меланомы В-16, которую определяли по соотношению количества выросших колоний в опытных и контрольных чашках. Результаты экспериментов представлены в табл. 7. Таблица 7. Влияние производных пептидов при концентрации 100 мкМ и -интерферона при концентрации 70 МЕ/мл на пролиферативную активность клеток меланомы В-16 мышей Различия с контролем достоверны р 0,01 Приведенные в табл. 7 данные показывают, что производные пептидов задерживают рост колоний клеток меланомы В-16 на уровне 50,0-70,0%, что характерно для индукторов дифференцировки. Пример 6. Распределение опухолевых клеток по фазам клеточного цикла в разные сроки введения дикарбамина. Опыты ставили на перевиваемой меланоме В-16. Влияние препарата дикарбамин на распределение опухолевых клеток было изучено по содержанию ДНК на разные сроки после введения препарата. С 6-го дня после перевивки опухоли мыши в течение 10 дней получали по 0,5 мг/кг дикарбамина ежедневно в желудок. Забой животных с последующим изучением опухолевого материала осуществляли- 10007474 на 10, 12, 16 и 18 дни после перевивки, т.е., соответственно, на 5 и 7 дни введения дикарбамина, а также через 2 и 4 дня после прекращения его 10-дневного введения. Результаты эксперимента показали, что дикарбамин вызывает существенное увеличение доли интерфазных опухолевых клеток (IIG1) (25%). При этом при неизменной доле пролиферирующих клеток(30%), отмечается увеличение доли IIG2-клеток (12-14%). В соответствии с этим доля нормальных клеток стромы (IG1) в образцах компенсаторно снижается. Указанные изменения наиболее ярко выражены после 5-10 введений дикарбамина. Курсовое введение дикарбамина вызывает перестройку кинетики популяции опухолевых клеток. Отмечается задержка клеток в синтетической (S-фазе) цикла с компенсаторным уменьшением доли готовых к делению и делящихся клеток (G2 фаза). Одновременно происходит накопление опухолевых клеток в стационарной G1 фазе. Дикарбамин, снижая уровень пролиферативной активности, способствует накоплению клеток в стационарной (непролиферирующей) фазе клеточного цикла. Он может замедлить рост опухоли и способствовать переходу клеток в более дифференцированное состояние. Пример 7. Эффективность дикарбамина в отношении гематологической токсичности циклофосфамидаа, и его комбинаций с цисплатином и карбоплатином. Гематокоррегирующее действие дикарбамина изучали на мышах гибридах первого поколения F1(CBA x C57Bl) самцах. 7.1 Для изучения влияния дикарбамина на гематотоксическое действие циклофосфамида (ЦФ) использовали 4 группы животных:- 1 группа - дикарбамин 0,5 мг/кг ежедневно, начиная за 5 дней до ЦФ, и в течение 5 дней после однократного введения ЦФ в дозе 200 мг/кг;- 4 группа - дикарбамин 0,5 мг/кг ежедневно в течение 10 дней. Полученные данные представлены в табл. 8. Таблица 8. Общее количество лейкоцитов периферической крови мышей под воздействием циклофосфамида и циклофосфамида с дикарбамином. Полученные данные показывают, что применение дикарбамина в комбинации с ЦФ позволяет снизить гематотоксическое действие последнего и ускорить восстановление показателей крови. 7.2. При изучении влияния дикарбамина на гематотоксическое действие комбинаций ЦФ с производными платины дикарбамин вводили мышам в желудок в течение 20 дней ежедневно в разовой дозе 0,5 мг/кг. Цитостатики вводили внутрибрюшинно однократно на пятые сутки от начала курса введений дикарбамина. Дозы цитостатиков указаны в табл. 10 и 11. Результаты исследований влияния дикарбамина на динамику лейкоцитов в периферической крови мышей, получавших комбинированное введение ЦФ с цисплатином или карбоплатином, представлены в табл. 9 и 10, соответственно.- 11007474 Таблица 9. Влияние дикарбамина на гематотоксичность циклофосфамида в комбинации с цисплатином Представленные данные показывают, что уже к 5 суткам в группе мышей, получавших цитостатики в максимальных дозах на фоне дикарбамина, количество лейкоцитов достигало нижней границы физиологической нормы, а к 7 суткам практически восстанавливалось до исходного уровня. Без дикарбамина восстановление наблюдалось только к 21 суткам опыта. У мышей, получавших цитостатики в максимальных дозах без дикарбамина, отмечена гибель на 3; 4 и 7 сутки эксперимента. У животных, получавших цитостатики в максимальных дозах на фоне дикарбамина, отмечалась только отсроченная гибель на 8 и 16 сутки. Таблица 10. Влияние дикарбамина на гематотоксичность циклофосфамида в комбинации с карбоплатином Представленные данные показывают (табл. 10), что в случае применения дикарбамина вместе с карбоплатином и циклофосфаном в летальных дозах динамика лейкоцитов в периферической крови и сроки гибели животных аналогичны данным, представленным в табл. 9.- 12007474 Таким образом, дикарбамин тормозит развитие лейкоцитопении во всех исследованных режимах,ускоряет восстановление общего количества лейкоцитов и отодвигает срок гибели мышей при применении цитостатиков в летальных дозах. 7.3. При изучении влияния производных пептидов общей формулы (I) на гематотоксическое действие комбинаций ЦФ с карбоплатином, соединения вводили мышам в желудок в дозе 0,5 мг/кг ежедневно в течение 10 дней. На пятые сутки после начала введения тестируемых соединений мышам внутрибрюшинно вводили ЦФ в дозе 200 мг/кг и карбоплатин в дозе 15 мг/кг, однократно. После этого введение тестируемых соединений продолжали еще 5 дней. Перед началом введения тестируемых соединений у мышей брали кровь из хвоста для подсчета общего количества лейкоцитов. На 3, 5 и 7 сутки после введения циклофосфамида с карбоплатином у мышей также брали кровь для подсчета общего количества лейкоцитов. Каждая группа насчитывала по 15 животных. В качестве контроля использовали группу мышей, получавших только цитостатики. Представленные в табл. 11 данные показывают, что производные пептидов общей формулы (I тормозят развитие лейкоцитопении, ускоряют восстановление общего количества лейкоцитов. Таблица 11. Влияние производных пептидов общей формулы (I) на гематотоксичность комбинации циклофосфамида с карбоплатином- достоверно при Р 0,05 7/1. Дифференцировочный эффект дикарбамина подтверждают исследованием лейкоцитарной формы периферической крови мышей под воздействием циклофосфамида в комбинации с дикарбамином в сравнении с введением только циклофосфамида. Используют две группы мышей. Первой группе вводят дикарбамин в дозе 0,5 мг/кг за 5 дней перед и 5 дней после введения ЦФ в дозе 200 мг/кг. Второй группе мышей вводят только ЦФ в дозе 200 мг/кг. Результаты исследований показаны в табл. 12 и 13. Представленные в табл. 12 и 13 данные показывают, что восстановление периферической крови идет за счет выброса зрелых форм, что подтверждает дифференцировочный эффект дикарбамина. Особенно это видно на 3 и 5 сутки по формуле периферической крови и клеточности костного мозга (табл. 12 и 13). В группе с дикарбамином в периферической крови отсутствуют миелоциты и палочкоядерные нейтрофилы в группе без дикарбамина эти форменные элементы присутствуют (табл. 12). Пример 8. Уменьшение скорости роста и размеров подкожно перевитого эритробластоза Френд(ЭБФ) у мышей под влиянием производных пептидов. Исследования проводили на 100 самцах мышей гибридов BDF1, которые были разделены на группы по 10 мышей в каждой. Линейных мышей DBA2 использовали для пассирования ЭБФ in vivo. Штамм эритробластоза Френд получали из банка опухолевых штаммов ГУ РОНЦ им.Н.Н.Блохина РАМН, дважды пассировали внутрибрюшинно, используя 3-8 генерации при подкожной перевивке. Перевивку проводили взвесью клеток в количестве 1x106 в 0,3 мл питательной среды 1999.- 13007474 Растворы испытуемых соединений вводили мышам в желудок с помощью зонда ежедневно с 3 по 7 сутки после перевивки опухолей. Эффективность лечения оценивали по торможению роста опухоли (ТРО,%) и средней продолжительности жизни (СПЖ). Увеличение продолжительности жизни определяли по общепринятому критерию Т/С (%), которое рассчитывали как соотношение СПЖ в опытных и контрольных группах. Скорость роста опухоли Vt/V1 рассчитывали по динамике изменения средних объемов опухолей. Данные исследований по влиянию производных пептидов на размеры опухоли и на скорость роста опухоли представлены в табл. 14 и 15, соответственно. Полученные результаты показывают, что производные пептидов вызывают торможение роста подкожно перевитого ЭБФ в течение 19 дней после окончания терапии. Указанный эффект начинал регистрироваться сразу после окончания введения соединений в разовой дозе 1,5 мг/кг и сохранялся на достоверном уровне (р 0,05) до 13 суток. Скорость роста опухоли при этом стабилизировалась в течение недели после отмены соединений. В результате проведенных исследований установлено, что соединения общей формулы обладают ингибирующим действием на развитие подкожного узла ЭБФ. Полученные данные позволяют считать,что исследованные соединения могут быть использованы для терапии гемобластозов человека. Пример 9. Действие дикарбамина и 2-интерферона (Реаферона) на опухолевые клетки эритробластоза Френд. Исследовали эритробластоз Френд, который перевивали мышам-самкам линии ДВА 2 подкожно клетками селезенки. Было проведено 4 серии опытов. 1 серия - контрольные животные без лечения, вводился физраствор, 2 серия - вводили реаферон в дозе 100 тыс. МЕ/кг ежедневно п/к с 3 по 7 сутки после перевивки, 3 серия - вводили дикарбамин в разовой дозе 4,5 мг/кг per os с 3 по 7 сутки после перевивки, 4 серия - вводили дикарбамин и реаферон одновременно в аналогичной схеме. Материал для световой микроскопии брали у забитых животных на 3, 7 и 14 день после окончания лечения или введения физраствора, для электронной микроскопии - на 7 и 14 день. Для гистологического исследования кусочки опухоли фиксировали в 10% нейтральном формалине и заливали в парафин, полученные срезы окрашивали гематоксилинэозином и исследовали на содержание гликогена (полисахаридов) с помощью ШИК-реакции, на содержание РНК по Браше, на липиды и железо. Срезы просматривали и фотографировали в световом микроскопе "Поливар" (Австрия). Для электронно-микроскопического исследования кусочки опухоли фиксировали в 2,5% растворе глутаральдегида и 1% четырехокиси осмия, заливали в ЭПОН-812. Полутонкие и ультратонкие срезы готовили на ультратоме ЛКБ-Ш (Швеция). Полученные полутонкие срезы окрашивали толуидиновым синим и просматривали в световом микроскопе. Ультратонкие срезы докрашивали уранил ацетатом и цитратом свинца, просматривали и фотографировали в электронном микроскопе ДЖЕОЛ 1200 ЕХ-11(Япония). Для количественной оценки при электронно-микроскопическом исследовании просчитывали процентное содержание клеток, число клеток различных типов дифференцировки (бластные клетки, лимфоциты и гранулярные лейкоциты). При гистологическом исследовании оценивали процент митозов и апоптозно измененных клеток, а также площади некрозов ко всей поверхности среза. Гистологическое исследованиеI серия. Контрольные животные без лечения. При гистологическом исследовании обнаружено, что опухолевые клетки крупные, полиморфные,ядра их светлые, цитоплазма развита умеренно. Размер клеток иногда колеблется, и встречаются отдельные более мелкие клетки, но основная масса клеток - крупные. Опухолевые клетки образуют сплошные разрастания. В отдельных опухолях встречаются участки некроза, окружающие сохранившиеся поля опухолевых клеток. Площадь некрозов не превышала 10-15% поверхности среза. В большинстве опухолевых клеток реакция Браше на РНК сильно выражена, реже слабая или отсутствует (в отдельных мелких клетках). ШИК-реакция имела диффузный характер, реакция на железо была положительной лишь в единичных клетках. В опухоли среди крупных клеток встречались митозы (до 1-1,5%) и клетки с признаками апоптоза(до 0,5%) По мере роста опухоли увеличивалась площадь некрозов до 20-30% поверхности среза, нарастало количество митозов (до 1,5-2%), активность апоптоза не изменилась. Количество крупных полиморфных клеток значительно преобладало во все сроки.- 14007474 Опухоли имеют обычное гистологическое строение. Среди крупных полиморфных клеток, как и в контроле, более мелкие клетки с гиперхромным ядром. Площадь некрозов к 14 дню составляет 40-50% поверхности среза, митотическая активность равна 0,5-1%, апоптоз к 7 дню увеличивался до 1-2%, но к 14 дню снижался до 1-1,5%.III серия. Введение дикарбамина. Отмечается увеличение количества мелких опухолевых клеток с гиперхромными ядрами. Количество крупных полиморфных клеток значительно преобладает. Площадь некрозов существенно не изменялась по сравнению с картиной в 1 серии. Митотическая активность так же оставалась в пределах контрольных цифр. Частота апоптоза на 3 и 7 день несколько снижалась (до 0,1-0,5% на 7 день).IV серия. Введение одновременно дикарбамина и реаферона. Площадь некрозов и митотическая активность по сравнению с изменениями во II серии без существенных сдвигов. Апоптоз на 3 день снижается до 0,2-0,5%, на 7 и 14 день он составляет 0,5% (как в контроле). В опухоли значительно преобладают крупные полиморфные бластного типа клетки. Электронномикроскопическое исследование.I серия. Контрольные животные без лечения. При электронно-микроскопическом исследовании в опухоли обнаружены главным образом крупные полиморфные низкодифференцированные бластного типа клетки. Ядра в этих клетках округлой или несколько неправильной формы, иногда с неровной поверхностью. Хроматин в них обычно распределен диффузно, лишь в некоторых отмечается образование расположенного маргинально гетерхроматина. Ядра занимают обычно большую часть цитоплазмы, в которой преобладают рибосомы, единичные митохондрии, иногда структуры шероховатого эндоплазматического ретикулума. Бластные клетки составляют 90-95% всей популяции опухоли. Кроме бластных клеток в опухоли встречаются лимфоциты различной степени зрелости - лимфобласты, лимфоциты (крупные, средние, мелкие). Ядра в этих клетках округлые, овальные, часто с неровной поверхностью, содержат гетерохроматин в виде крупных скоплений, встречаются ядрышки. Цитоплазма развита умеренно, в ней много рибосом, других органелл мало, иногда встречаются плотные гранулы. Гранулярные лейкоциты мелкие, в цитоплазме видны гранулы, характерные для нейтрофилов, реже эозинофилов. Ядра в клетках сегментированные или с глубокими втяжениями. Иногда видны клетки с гранулами в цитоплазме, неправильным ядром и выпячиваниями в виде отростков плазматической мембраны (моноциты). В опухоли встречались свободно лежащие эритроциты. В опухоли преобладают главным образом крупные бластные клетки (до 90-95%). Лимфоидные клетки встречаются в пределах 4-8%, гранулярные лейкоциты составляют 1-2%. Существенных сдвигов в соотношении различных типов клеток по мере роста опухоли после прививки не отмечалось.II серия. Введение реаферона. Общее ультраструктурное строение опухолевых клеток различного типа сохраняется. Количество крупных бластных клеток не снижается, лимфоидных клеток до 4-8%, гранулярных лейкоцитов до 1-2%. В опухоли имеются отдельные эритроциты.III серия. Введение дикарбамина. Ультраструктурное строение различных типов опухолевых клеток остается прежним. Изменяется их количественное соотношение и несколько повышается уровень дифференцировки. Количество крупных бластного типа клеток стекается до 70-80%, количество лимфоцитов и гранулоцитов увеличивается соответственно до 18-25% и 2-5%. В опухоли встречаются отдельные эритроциты. Наиболее постоянно обнаруженные изменения встречаются на 7 день после окончания лечения.IV серия. Введение реаферона и дикарбамина. Ультраструктурное строение опухолевых клеток различного типа практически соответствует тому,что описано выше (см. 1 серию). Количество крупных бластных клеток колеблется в пределах 70-80%. Число лимфоцитов достигает 18-25%, количество лейкоцитов остается на уровне 2-5%. Встречаются эритроциты, лежащие среди других клеток. Обнаруженные изменения наиболее выражены, как и в предыдущих сериях, на 7 день. Таким образом, дикарбамин, введенный мышам с эритробластозом Френд per os в дозе 4,5 мг/кг ежедневно в течение 5 дней, как установлено, вызывает дифференцировку незрелых опухолевых клеток,главным образом в направлении образования лимфоидных элементов различного уровня созревания и, в меньшей степени, в сторону образования гранулоцитов, а также клеток эритроидного ряда. По сравнению с опухолями контрольных животных количество незрелых опухолевых клеток при применении дикарбамина снижалась с 90-95 до 70-80%, т.е. на 15-20%, а количество лимфоцитов увеличивалось с 4-8 до 18-25%, т.е. в 4 раза. Менее значительно увеличивалось количество клеток гранулоцитарного ряда (соответственно с 12% примерно до 2-5%).- 15007474 Следует подчеркнуть, что наиболее часто изменения были обнаружены на 7 день после окончания лечения. На 14 день после окончания лечения эти изменения стабилизировались. Реаферон при подкожном введении в течение 5 дней ежедневно в дозе 100 тыс.МЕ/кг вызывал в опухоли увеличение площади некрозов (с 15-20% в контроле до 40-50% в опыте - на 7 день после окончания лечения и с 20-30 до 40-50% на 14 день). Несколько снижалась частота митозов (с 1,5-2 до 0,5-1%) и возрастало число клеток с признаками апоптоза (с 0,5 до 1-2% -на 7 день после окончания лечения). Дифференцировка опухолевых клеток практически не изменялась. При одновременном введении дикабрамина и реаферона в тех же дозах и в те же сроки обнаружено суммирование эффекта каждого из препаратов. В опухолях наблюдалось усиление дифференцировки бластных незрелых клеток, характерное для действия одного дикабрамина, а также нарастание площади некрозов и снижение числа митозов, что имелось при введении одного реаферона. Таким образом, установлено, что дикарбамин способен усиливать дифференцировку незрелых опухолевых гемопоэтических клеток эристобластоза Френд в разных направлениях, в частности, с образованием опухолевых клеток лимфоидного и миелоидного ряда. Дифференцировочное действие дикарбамина является его общим свойством, т.к. ранее оно наблюдалось на примере изучения меланомы. Пример 10. Электронномшсроскопическое исследование механизма защитного действия дикарбамина в отношении гемопоэтических клеток костного мозга и периферической крови, больных раком яичников при химиотерапии. В предыдущих исследованиях, посвященных изучению механизма действия препарата дикарбамин на костный мозг, было обнаружено, что у животных в экспериментальных условиях in vivo данный препарат защищает костный мозг от неблагоприятного цитотоксического влияния циклофосфамида, снижая апоптоз в нормальных гемопоэтических клетках. На пунктатах костного мозга и периферической крови 10 больных раком яичников III-IV стадии получены аналогичные данные. Больных делили на две равные группы: I группа - больные, получавшие только химиотерапию; и II группа - больные, получавшие химиотерапию на фоне введения дикарбамина. В I и II группе больные получали циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 в первый день лечения, повторные курсы проводили с интервалом в 3-4 недели. В среднем одна больная получила 6 курсов без дикарбамина и 5,7 курса с дикарбамином. Во II группе больные получали химиотерапию на фоне дикарбамина в разовой дозе 100 мг, начиная за 5 дней перед первым курсом, и далее до начала следующего курса в той же дозе. Средняя продолжительность применения дикарбамина между двумя курсами 24,5 дня. Средняя суммарная доза 2,5 гр. Для электронно-микроскопического исследования у больных брали пунктаты костного мозга и периферическую кровь до начала химиотерапии и в конце курса лечения с дикарбамином или без него. Свежие пунктаты костного мозга помещали на предметное стекло и многократно помешивали стеклянной палочкой до получения небольших плотных фрагментов. Последние фиксировали в 2,5% растворе глутаральдегида, дополнительно фиксировали в 1% растворе четырехокиси осмия, после промывки фосфатным буфером рН 7,4 обезвоживали в спиртах восходящей концентрации и заключали в смесь эпоксидных смол ЭПОН-812. Полутонкие и ультратонкие срезы готовили на ультрамикротоме ЛКБ-III(Австрия). Полутонкие срезы окрашивали метиленовым или толуидиновым синим, ультратонкие срезы контрастировали водным раствором уранилацетата и цитратом свинца. Периферическую кровь, содержащую гепарин, центрифугировали в течение 1 ч при 3000 об./мин. Затем на поверхность образовавшейся пленки наливали 2,5% раствор глутаральдегида на 10-15 мин,снимали пленку и далее обрабатывали, как описано выше. Тонкие срезы просматривали в световом микроскопе Поливар (Австрия), полутонкие - в электронном микроскопе ДЖЕОЛ-1200 СХ-11 (Япония). 1. Контрольные исследования до начала химиотерапии и введения дикарбамина. Больные из I и II группы. В пунктатах костного мозга, взятого до начала лечения, определяются гемопоэтические клетки различной степени зрелости и направления дифференцировки, часть клеток с признаками вакуолизации и дистрофии. Встречаются бластные недифференцированные клетки крупных размеров с узким ободком цитоплазмы, содержащим, главным образом, рибосомы. Основную часть цитоплазмы в этих клетках занимает округло-овальной формы ядро с диффузным хроматином и отдельными ядрышками. Часть клеток дифференцируется в направлении гранулоцитарного ряда лейкоцитов различного типа и степени дифференцировки. Видны промиелоциты и миелоциты с округло-овальными ядрами, диффузным хроматином, содержащие в цитоплазме различное количество специфических гранул. Вокруг этих клеток часто располагаются эритроциты и более зрелые гранулоциты.- 16007474 Часто видны скопления более дифференцированных гранулоцитов: метамиелоцитов палочкоядерных и сегментоядерных. В их цитоплазме имеются специфические гранулы различного типа,характерные для нейтрофилов, эозинофилов, базофилов. Среди гранулоцитов располагаются лимфоидные клетки разной степени дифференцировки (маленькие, средние, крупные - лимфобластные). Встречается много зрелых эритроцитов, часто различной формы, а так же нормобласты, содержащие ядра и тромбоциты. 2. Костный мозг после химиотерапии циклофосфаном и карбоплатином - I группа. В пунктатах костного мозга, взятых после курса химиотерапии, в сохранившихся гемопоэтических клетках различного типа (гранулоциты, лимфоциты, нормоциты, эритроциты, тромбоциты) встречаются признаки дистрофии и низкой степени зрелости. В бластных клетках цитоплазма содержит рибосомы, часто вакуолизирована. Ядра крупные с диффузным хроматином или скоплениями гетерохроматина, иногда неправильной формы с втяжениями. В промиелоцитах и миелоцитах количество специфических гранул незначительное, цитоплазма часто с выраженными дистрофическими изменениями. В сохранившихся гранулоцитах типа палочкоядерных и сегментоядерных так же наблюдаются дистрофические изменения и незначительное количество специфических гранул. Часто имеющиеся гранулы так же дистрофически изменены, вакуолизированы. Сохранившиеся нормобласты часто неправильной формы с отростками и выпячиваниями цитоплазмы. Следует подчеркнуть, что в пунктатах костного мозга, особенно среди гранулоцитов, встречались клетки с признаками апоптоза. В таких клетках отмечалась маргинация гетерохроматина, явления фрагментации ядра и цитоплазмы, образование апоптозных тел. 3. Костный мозг после химиотерапии циклофосфаном и карбоплатином на фоне введения дикарбамина - II группа. В пунктатах костного мозга больных, которым химиотерапия проводилась на фоне получения дикарбамина, встречаются гемопоэтические клетки различной степени и типа дифференцировки (гранулоциты, лимфоциты, тромбоциты, нормобласты). Клетки бластного типа крупные, содержат округлые ядра с диффузным хроматином и отдельными ядрышками, их цитоплазма узкая, в ней видны рибосомы, отдельные митохондрии, иногда единичные первичные плотные гранулы. Промиелоцитов и миелоцитов много, они содержат округлые или овальные ядра с диффузным или конденсированным хроматином, в их цитоплазме достаточно много специфических гранул - первичных(темных) и меньше зрелых (более зрелых). Палочкоядерные и сегментоядерные лейкоциты так же встречаются часто. Они имеют вогнутое(бобовидное) или сегментированное ядро, в цитоплазме обилие специфических гранул, преимущественно нейтрофильного типа, реже эозинофильного с кристаллоидными структурами. Лимфоциты различной степени дифференцировки содержат в цитоплазме митохондрии, структуры шероховатого эндоплазматического ретикулума, иногда единичные включения в виде единичных гранул. Клетки гранулоцитарного типа, лимфоциты часто образуют компактные скопления. Наряду с эритроцитами встречаются нормобласты разной степени дифференцировки и относительно обычной формы. Клетки с признаками апоптоза встречаются редко. При исследовании гемопоэтических клеток периферической крови были обнаружены те же закономерности их строения, что описаны выше для элементов костного мозга. Проведенное сравнительное электронно-микроскопическое исследование гемопоэтических клеток костного мозга и периферической крови, больных раком яичников до начала и после комбинированной химиотерапии (циклофосфан+карбоплатин) и в процессе химиотерапии на фоне приема дикарбамина позволило установить механизмы его защитного эффекта от цитотоксического влияния использованных препаратов. В результате исследования найдено, что использованные в данной работе химиопрепараты вызывают выраженное цитотоксическое действие на различные типы гемопоэтических клеток гранулоцитарного, лимфоидного, эритроидного ряда. Это цитотоксическое действие проявляется в виде развития в клетках костного мозга (и соответственно периферической крови) дистрофических изменений в цитоплазме и гибели специфических гранул. Особенно данные нарушения касаются гранулоцитарных и, в меньшей степени, лимфоидных клеток на ранних стадиях их дифференцировки - образования бластных клеток, промиелоцитов, миелоцитов, лимфобластов, а также затрагивают эритроидный ряд, что ведет к недостаточности накопления дифференцированных функционально полноценных форм гемопоэтических клеток. Кроме того, как было обнаружено в элементах гранулоцитарного ряда, усиливается генетически запрограммированная клеточная гибель - апоптоз.- 17007474 В целом дистрофические изменения и апоптоз ведут к развитию лейкопении, нейтропении, тромбоцитопении и других нарушений в состоянии гемопоэза и ограничивают возможности химиотерапии. Дикарбамин, как установлено на основании проведенного исследования, защищает гемопоэтические клетки костного мозга (и, соответственно периферической крови) от цитотоксического действия использованных химиопрепаратов, способствует дифференцировке молодых форм до зрелых клеточных элементов и снижает явления апоптоза. В результате обнаруженного эффекта дикарбамина в костном мозге больных в процессе химиотерапии происходит накопление молодых (бластных) форм гемопоэтических клеток и, что особенно важно,усиливается их дифференцировка до функционально полноценных форм. Таким образом, в условиях химиотерапии стимуляция дифференцировки гемопоэтических клеток костного мозга, особенно гранулоцитарного ряда, и предотвращение роста апоптоза являются теми механизмами, которые лежат в основе защитного эффекта дикарбамина. Пример 11. Эффективность дикарбамина в отношении снижения гематологической токсичности химиотерапии при раке яичников. Действие дикарбамина изучали у 13 больных раком яичников III-IV стадии, которым были проведены 77 курсов химиотерапии по схеме карбоплатин 400 мг/м 2 в/в капельно однократно + циклофосфан 600 мг/м в/в капельно однократно, курсы повторяли через 28 дней. Дикарбамин назначали в дозе 100 мг внутрь после еды ежедневно, начиная за 5 дней до первого курса и дальше в течение 3-х недель. Длительность введения 26 дней, курсовая доза 2600 мг. За 5 дней до второго курса химиотерапии снова начинали давать дикарбамин и продолжали в течение 21 дня. Общая длительность приема дикарбамина в течение 2-х курсов химиотерапии составила 52 дня. Гематологическая токсичность (лейкоцитопения, нейтропения и тромбоцитопения) оценена у 13 больных, получивших 77 курсов химиотерапии с дикарбамином в сравнении с группой из 7 больных,получивших 25-27 курсов химиотерапии без дикарбамина (контроль). Показатели кроветворения оценивали в динамике многократно до и после проведения химиотерапии (контроль) и также в динамике до и после приема дикарбамина в испытуемой группе. Ниже представлены показатели кроветворения у отдельных больных, получавших химиотерапию по указанной схеме вместе с дикарбамином или без него. 8.1 Больные, получавшие химиотерапию без дикарбамина Женщина, 51 год, диагноз: рак яичников, III стадия, асцит, получила 1-й курс химиотерапии по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 однократно. Анализ крови клинический, 1 курс химиотерапии Второй курс лечения отсрочен на 7 дней в связи с нейтропенией. 2-й курс химиотерапии проведен по схеме лечения: циклофосфан 600 мг/м 2 + карбоплатин 400 2 мг/м однократно без дикарбамина. Анализ крови клинический, 2 курс химиотерапии Третий курс отсрочен в связи с нейтропенией. Женщина, 63 года, диагноз: рак яичников, IV стадия, метастатическое поражение правого пахового лимфоузла, асцит, получила 1-й курс химиотерапии по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 однократно без дикарбамина. Второй курс отсрочен на 4 дня в связи с лейко- и нейтропенией. 2-й курс химиотерапии проведен по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 однократно без дикарбамина. Анализ крови клинический, 2 курс химиотерапии Третий курс отсрочен в связи с нейтропенией. 8.2 Больные, получавшие химиотерапию вместе с дикарбамином. Женщина, 51 год, диагноз: рак яичников, III стадия, получила 1 курс химиотерапии по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 в первый день лечения. Дикарбамин назначали в дозе 100 мг ежедневно, начиная за 5 дней до 1 курса XT и затем в течение 21 дня. Период лечения дикарбамином - 26 дней до 2 курса. Анализ крови клинический, 1 курс химиотерапии с дикарбамином 2-й курс химиотерапии проведен в срок по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 однократно на 28 день после проведения первого курса химиотерапии+дикарбамин. Дикарбамин назначали в дозе 100 мг за 5 дней до 2 курса и затем ежедневно а течение 21 дня. Общая длительность приема дикарбамина (2 курса химиотерапии) 52 дня. Анализ крови клинический, 2 курс химиотерапии Третий курс XT получен в срок. Женщина, 75 лет, диагноз: рак яичников, III стадия, асцит, получила химиотерапию с дикарбамином по схеме лечения: циклофосфан 600 мг/м' и карбоплатин 400 мг/м 2 в первый день лечения. Дикарба- 19007474 мин назначали в дозе 100 мг ежедневно, начиная за 5 дней до 1 курса XT и затем 21 день. Период лечения дикарбамином - 26 дней до2 курса Анализ крови клинический, 1 курс химиотерапии с дикарбамином 2-й курс химиотерапии проводят в срок по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 однократно на 28 день после проведения первого курса химиотерапии+дикарбамин. Дикарбамин назначают в дозе 100 мг за 5 дней до 2 курса и затем ежедневно в течение 21 дня. Общая длительность приема дикарбамина (2 курса химиотерапии) 52 дня. Анализ крови клинический, 2 курс химиотерапии Третий курс получен в срок. Женщина, 65 лет, диагноз: рак яичников, IV стадия, асцит, метастатическое поражение пупочной области, получила химиотерапию с дикарбамином по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м 2 в первый день лечения. Дикарбамин назначают в дозе 100 мг ежедневно, начиная за 5 дней до 1 курса XT и затем 21 день. Период лечения дикарбамином - 26 дней до 2 курса. Анализ крови клинический, 1 курс химиотерапии с дикарбамином 2-й курс химиотерапии с дикарбамином проводят в срок по схеме лечения: циклофосфан 600 мг/м 2 и карбоплатин 400 мг/м однократно на 28 день после проведения первого курса химиотерапии+дикарбамин. Дикарбамин назначают в дозе 100 мг за 5 дней до 2 курса и затем ежедневно в течение 21 дня. Общая длительность приема дикарбамина (2 курса химиотерапии) 52 дня. Анализ крови клинический, 2 курс химиотерапии с дикарбамином Третий курс получен в срок.- 20007474 8.3 Сравнительные данные по гематологической токсичности у пациентов, получавших химиотерапию и получавших или не получавших дикарбамин, представлены в табл. 16 и 17. Таблица 16. Число (%) больных с гематологической токсичностью, получавших химиотерапию без дикарбамина Полученные данные показывают, что лимитирующая гематологическая токсичность III-IV стадии без применения дикарбамина (табл. 16) достигает по лейкопении более 23,0%, нейтропении - 42,6% и тромбоцитопении - 20,0%. В группе больных, получающих дикарбамин, частота возникновения лейко-, нейтро- и тромбоцитопении была значительно меньше (табл. 17). Гематологическая токсичность уменьшалась до 12,9%, т.е. в 1,8 раза, нейтропения - в 2,6 раза, тромбоцитопения - в 2,2 раза. Таким образом, применение дикарбамина приводило к снижению всех перечисленных видов гематологической токсичности. Ниже представлены данные, подтверждающие, что введение дикарбамина не снижает эффективность лечения цитостатическими агентами, а напротив, несколько усиливает достигаемый эффект. Эффективность лечения оценивали в группах пациентов после 2-х курсов химиотерапии, которые не получали или получали дикарбамин по описанной выше схеме. Оценку эффективности проводили по общепринятым параметрам: ПР-полная ремиссия, ЧР - частичная ремиссия, СБ - стабилизация, Прогр. прогрессирование. Полученные данные представлены в табл. 18. Таблица 18. Эффективность лечения больных по схеме циклофосфан + карбоплатин с дикарбамином Представленные данные показывают, что в группе больных, получавших химиотерапию без дикарбамина, контроль роста опухоли (ПР+ЧР) составил 49,9%. В группе больных, получавших химиотерапию с введением дикарбамина, эффективность лечения составила 73,2%. Таким образом, применение дикарбамина при лечении больных, получающих химитерапию, приводит к снижению основных видов гематологической токсичности без уменьшения эффективности лечения. Представленные выше экспериментальные и клинические данные с очевидностью доказывают эффективность производных пептидов общей формулы (I) как неспецифических индукторов дифференцировки, которая при применении производных пептидов совместно с миелосупрессивной химиотерапией проявляется в снижении степени и числа нейтропений, а при самостоятельном применении приводит к- 21007474 стабилизации роста гемобластоза мышей, дифференцирующейся меланомы мышей и человека, в том числе и в случае отсутствия эффективности химиотерапии. Также было показано, что влияние производных пептидов общей формулы (I) на рост опухоли связано с задержкой пролиферативной активности опухолевых клеток и повышением степени дифференцировки, в частности, меланинсинтезирующей способности клеток меланомы и индукции дифференцировки клеток-предшественников эритробластоза Френд. В клинических исследованиях выявлены свойства производных пептидов общей формулы (I) значительно уменьшать гематологическую токсичность при лечении онкологических больных с использованием различных схем комбинированной химиотерапии. Так, при лечении больных раком яичников препаратами платины, циклофосфаном на фоне применения производных пептидов, степень лимитирующей нейтропении и тромбоцитопении снижалась в 2-3 раза. Эффективность лечения при этом не снижалась. Таблица 12. Динамика лейкоцитарной формулы периферической крови мышей под воздействием циклофосфамида в комбинации с дикарбамином В таблице указаны%/абсолютное количество в мм 3 Таблица 13. Клеточность костного мозга мышей под воздействием циклофосфамида и циклофосфамида в комбинации с дикарбамином- количество клеток в миллионах. Таблица 14. Действие производных пептидов на размеры опухолей у мышей с эритробластозом Френд Примечания:- отличие от контроля достоверно при р 0,05- второй опыт.- 22007474 Таблица 15. Действие производных пептидов на скорость роста опухолей у мышей с эритробластозом Фрэнд Примечания:- р 0,05, - второй опыт ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ индукции дифференцировки клеток у млекопитающих, в том числе человека, включающий введение производного пептида общей формулы где R1 представляет собой С 1-С 3 углеводородный радикал, замещенный функциональной группой,выбранной из амино, С 1-С 5 амидо- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована, а аминогруппа может быть замещена ацильным заместителем; или С 1-С 3 углеводородный радикал, одновременно замещенный аминогруппой, причем аминогруппа может быть замещена ацильным заместителем и карбоксильной группой, причем карбоксильная группа может входить в составC5-С 6 членного циклического имида с участием N-концевой аминогруппы или -NH-, входящей в состав-CONH- группы; или С 1-С 3 углеводородный радикал, замещенный 5-6-членной ненасыщенной гетероциклической группой, причем углеводородный радикал может содержать одновременно аминогруппу,свободную или замещенную ацильным заместителем; или R1 может представляет собой насыщенную гетероциклическую группу; R2 представляет собой атом водорода или функциональную группу, выбранную из карбоксила, который может быть этерифицирован; R3 представляет собой 5-6-членные насыщенную или ненасыщенную циклическую или гетероциклическую группу, или амино-, или карбоксильную группу, причем карбоксильная группа может быть этерифицирована; n=0-4, m=1-4, k=0-1; или его фармацевтически приемлемых солей в эффективном количестве. 2. Способ по п.1, в котором производное пептида общей формулы (I) по п.1 вводят ежедневно перорально в дозе 0,5-5,0 мг/кг. 3. Способ по любому из пп.1 и 2, в котором производное пептида общей формулы (I) по п.1 вводят в сочетании с курсом химиотерапии. 4. Способ по любому из пп.1-3, в котором для стабилизации роста злокачественных опухолей производное пептида общей формулы (I) по п.1 вводят не менее 15 дней. 5. Способ по любому из пп.1-4, в котором для повышения эффективности иммунотерапии злокачественных опухолей производное пептида общей формулы (I) по п.1 вводят совместно с интерфероном. 6. Способ по любому из пп.4 и 5, в котором злокачественная опухоль является меланомой или гемобластозом. 7. Способ по любому из пп.1-3, в котором для снижения гематологической токсичности производное пептида общей формулы (I) по п.1 вводят за 5 дней до начала курса химиотерапии и вплоть до его окончания. 8. Способ по любому из пп.1-7, где R1= NH2-CH2-, HOOC-CH2-, CH3CONH-CH2-, СН 3 ОСО-СН 2-,NH2, COOH, -COOCH3, m=l-4. 9. Способ по любому из пп.1-8, где производное пептида представлет собой соединение формулы 10. Применение производного пептида общей формулы где R1 представляет собой С 1-С 3 углеводородный радикал, замещенный функциональной группой,выбранной из амино, С 1-С 5 амидо- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована или входить в состав С 5-С 6 циклического имида с участием N-концевой аминогруппы или -NH-, входящей в состав -CONH- группы, а аминогруппа может быть замещена ацильным заместителем; или С 1-С 3 углеводородный радикал, одновременно замещенный амино- и карбоксильной группой; или С 1-С 3 углеводородный радикал, замещенный 5-6-членной насыщенной или ненасыщенной циклической и гетероциклической группой, причем углеводородный радикал может содержать одновременно аминогруппу, свободную или замещенную ацильным заместителем; R2 представляет сбой атом водорода или функциональную группу, выбранную из карбоксила, который может быть этерифицирован; R3 представляет собой 5-6-членные насыщенные или ненасыщенные циклические или гетероциклические группы, атом водорода или С 1-С 3 углеводородный радикал, замещенный функциональной группой, выбранной из амино- или карбоксильной групп, причем карбоксильная группа может быть этерифицирована, а аминогруппа может быть замещена ацильным заместителем или эфиром угольной кислоты; n=0-4, m=l-4,k=0-l; или их фармацевтически приемлемых солей для производства лекарственного средства для индукции дифференцировки клеток у млекопитающих. 11. Применение производного пептида общей формулы (I), определенного в п.10, в сочетании с курсом химиотерапии для снижения гематотоксичности. 12. Применение производного пептида общей формулы (I), определенного в п.10, для стабилизации роста злокачественных опухолей. 13. Применение производного пептида общей формулы (I), определенного в п.10, в сочетании с интерфероном для повышения эффективности иммунотерапии. 14. Применение по любому из пп.10-13, где R1= NH2-CH2-, НООС-СН 2-, CH3CONH-CH2-, СН 3 ОСОСН 2-,NH2, COOH, -COOCH3,m=1-4. 15. Применение по любому из пп.10-14, где пептид общей формулы (I) представляет собой соединение формулы
МПК / Метки
МПК: A61P 35/00, A61K 38/00
Метки: дифференцировки, индукции, клеток, способ
Код ссылки
<a href="https://eas.patents.su/25-7474-sposob-indukcii-differencirovki-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Способ индукции дифференцировки клеток</a>
Предыдущий патент: Способ лечения панкреатита и способ профилактики септических осложнений острого некротизирующего панкреатита
Следующий патент: Производные арилоксифенила и арилсульфанилфенила
Случайный патент: Секция радиатора водяного отопления