Способ поддержания ремиссии язвенного колита у пациентов
Формула / Реферат
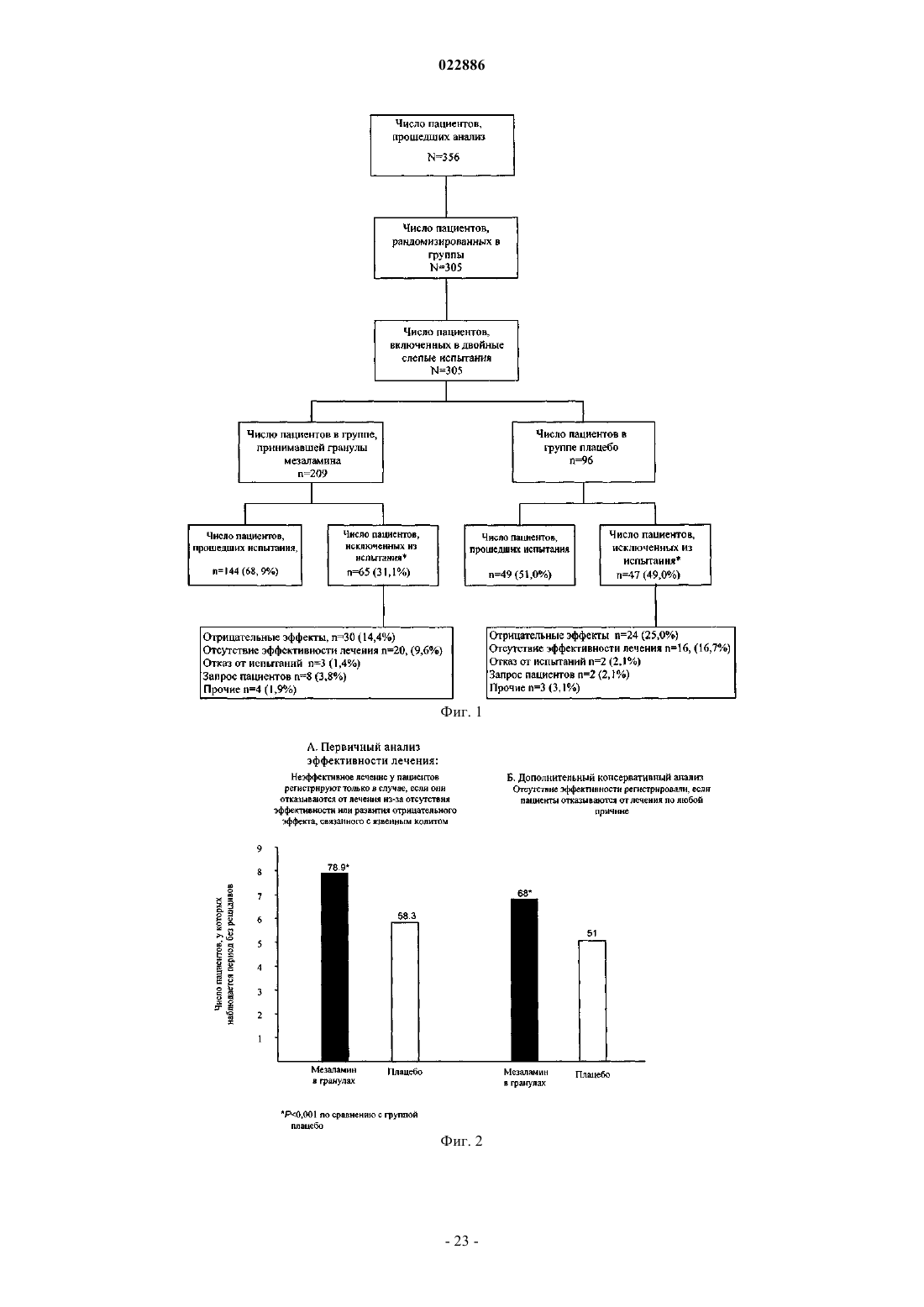
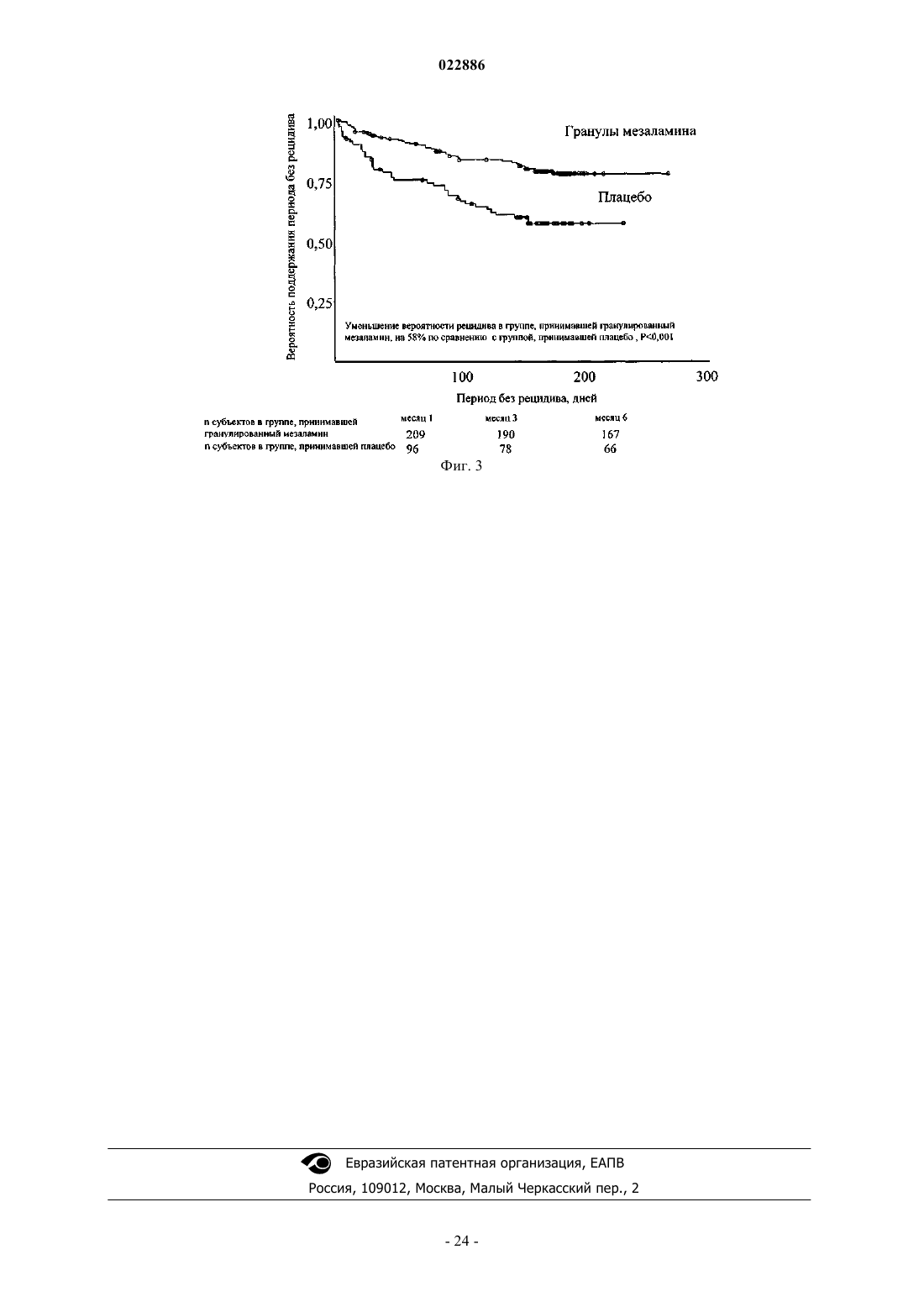
1. Способ поддержания ремиссии язвенного колита у пациентов, включающий введение пациенту один раз в день утром без приема пищи четырех капсул в желатиновой оболочке, содержащих 0,375 г дозы лекарственной формы гранулированного мезаламина с замедленным и пролонгированным высвобождением, где гранулированная форма мезаламина включает внутреннее ядро из полимерной матрицы, содержащее месаламин, которое окружено внешним слоем с ароматизаторами, промежуточным слоем и внутренним энтеросолюбильным слоем с рН-зависимым высвобождением, где внутренний слой растворяется при рН приблизительно 6, но при этом является устойчивым к растворению в желудке, причем этот способ поддерживает ремиссию язвенного колита у пациента в течение периода не менее 6 месяцев, указанная лекарственная форма не вводится совместно с антацидами, а ремиссия определяется по модифицированному индексу активности заболевания по Сатерленду (ИАБ) в баллах 0 или 1; и где от 85 до 90% месаламина достигает терминального отдела подвздошной кишки и толстой кишки.
2. Способ по п.1, при котором замедленное и пролонгированное высвобождение включает высвобождение месаламина в подвздошной кишке и продолжение высвобождения месаламина в терминальном отделе подвздошной кишки и в толстой кишке.
3. Способ по п.1 или 2 для применения у пациентов в возрасте 18 лет и старше.
Текст
СПОСОБ ПОДДЕРЖАНИЯ РЕМИССИИ ЯЗВЕННОГО КОЛИТА У ПАЦИЕНТОВ В изобретении описан способ поддержания ремиссии язвенного колита у пациентов, включающий введение пациенту утром без приема пищи четырех желатиновых капсул в твердой оболочке, содержащих 0,375 г дозы в сутки, лекарственной формы гранулированного мезаламина с замедленным и пролонгированным высвобождением, где гранулированная форма мезаламина содержит внутреннее ядро из полимерной матрицы с месаламином, которое окружено внешним слоем с ароматизаторами, промежуточным слоем и внутренним энтеросолюбильным рН-зависимым слоем с замедленным высвобождением при рН приблизительно 6, но при этом устойчивым к растворению в желудке, причем этот способ поддерживает ремиссию язвенного колита у пациента в течение периода не менее 6 месяцев, а указанная лекарственная форма не вводится совместно с антацидами, и где от 85 до 90% месаламина достигает терминального отдела подвздошной кишки и толстой кишки. При этом ремиссия определяется по модифицированному индексу активности заболевания по Сатерленду (ИАБ) в баллах 0 или 1.(71)(73) Заявитель и патентовладелец: ДР. ФАЛЬК ФАРМА ГМБХ (DE) Перекрестная ссылка на родственные заявки Заявка на данное изобретение относится к предварительным заявкам US61/102807 и 61/109708,поданным 3 октября 2008 г. и 30 октября 2008 г. соответственно. Эти заявки включены в данное описание в качестве ссылки в полном объеме. Уровень техники Язвенный колит (ЯК) является идиопатическим неспецифическим воспалительным заболеванием слизистой оболочки толстого кишечника, характеризующимся хроническим возвратно-ремитирующим течением. Период острого язвенного колита характеризуется хронической диареей, ректальными кровотечениями и болями в брюшной полости. Объем стула напрямую коррелирует с тяжестью заболевания, так как с усилением воспаления слизистой оболочки толстой кишки происходит значительное снижение абсорбции воды и электролитов. Недостаток воды и электролитов может привести к обезвоживанию, потере массы тела и нарушению уровня электролитов в сыворотке. Воспаление слизистой оболочки приводит к эрозии, которая может вызвать, в конечном счете, ректальные кровотечения. По мере прогрессирования заболевания часто развиваются анемия и гипоальбуминемия. Воспаление слизистой оболочки также может привести к спазмам гладкой мускулатуры, что, в свою очередь, сопровождается позывами к дефекации и тенезмам. Систематические проявления включают анорексию, потерю массы тела, усталость, лихорадку, увеличение скорости оседания эритроцитов (СОЭ), артрит, глазные воспаления, тревогу, тахикардию и отклонения функциональных проб печени (ФПП). ЯК также может оказывать значительное влияние на психологию и социальное поведение пораженных субъектов. Этиология и патогенез ЯК зависят от множества факторов и полностью не изучены. По одной из теорий данное заболевание развивается в результате патологической активации иммунной системы слизистой оболочки, что приводит к воспалительной ответной реакции. Предполагают, что в развитии патологической активации играют роль генетическая предрасположенность и/или факторы окружающей среды. ЯК наиболее широко распространен в Северной Европе и Соединенных Штатах Америки, в меньшей степени распространен на Ближнем Востоке и в Южном полушарии и редко встречается в Южной Америке, Азии и Африке. Годовой показатель заболеваемости колеблется от 10,4 до 12,0 случаев на 100000 человек с распространенностью от 35 до 100 случаев на 100000 человек. Хотя ЯК может развиваться в любом возрасте, максимальная заболеваемость приходится на возраст от 15 до 25 лет и от 55 до 65 лет. Заболеваемость язвенным колитом на 30% выше у женщин и максимальная заболеваемость характерна для еврейского населения. Цель лечения ЯК заключается в индукции и поддержании ремиссии,а также в повышении качества жизни. Периоды ремиссии у субъектов с язвенным колитом (время, в течение которого не наблюдается симптомов заболевания) могут составлять месяцы или годы, однако, в конечном счете, у большинства субъектов могут снова развиваться симптомы заболевания. Активное лечение обозначает лечение в период проявления активных симптомов заболевания. Поддерживающее лечение заключается в поддержании их состояния при полном или частичном отсутствии заболевания. Поддерживающее лечение лекарственными средствами необходимо проводить в течение продолжительного периода времени. Клиническая эффективность перорального введения соединений мезаламина при лечении ЯК обусловлена доставкой инактных молекул к слизистой оболочке толстого кишечника без разложения лекарственного средства в процессе пищеварения. В настоящее время для лечения мезаламином перорально используют 3 типа систем доставки: (1) система, включающая ковалентно-связанное через азо-связь лекарственное средство, которое высвобождается в толстой кишке под действием бактерий толстой кишки(асазол мезаламин, таблетки пролонгированного действия), обеспечивающие высвобождение лекарственного средства при достижении требуемой величины рН в желудочно-кишечном тракте, и (3) системы пролонгированного действия (пентаза в капсулах). Проблемы, характерные для других составов, включают изменение скорости высвобождения для одного и того же состава мезаламина, например, преждевременное высвобождение, вероятность демпинга дозы и чувствительность к факторам, которые могут вызвать повышение кислотности рН в желудке и преждевременное высвобождение мезаламина (например, при приеме пищи). Примеры составов мезаламина описаны в патентах US 6277412 и 6551620 и в заявке на патент US 2003/0133983. Множество субъектов, страдающих от заболеваний кишечника (ЗК), таких как язвенный колит, дивертикулит, болезнь Крона и воспалительное заболевание кишечника, практически не поддаются лечению с использованием современных составов лекарственных средств. Краткое изложение сущности изобретения Настоящее изобретение относится к способу поддержания ремиссии язвенного колита у пациентов,который включает введение пациенту утром без приема пищи четырех желатиновых капсул в твердой оболочке, содержащих 0,375 г дозы в сутки лекарственной формы гранулированного мезаламина с замедленным и пролонгированным высвобождением, где гранулированная форма мезаламина включает внутреннее ядро из полимерной матрицы, содержащее месаламин, которое окружено внешним слоем с ароматизаторами, промежуточным слоем и внутренним энтеросолюбильным рН-зависимым слоем с замедленным высвобождением при рН приблизительно 6, но при этом устойчивым к растворению в желудке, причем этот способ поддерживает ремиссию язвенного колита у пациента в течение периода не менее 6 месяцев, указанная лекарственная форма не вводится совместно с антацидами, а ремиссия определяется по модифицированному индексу активности заболевания по Сатерленду (ИАБ) в баллах 0 или 1; где от 85 до 90% месаламина достигает терминального отдела подвздошной кишки и толстой кишки. В предпочтительном варианте осуществления изобретения замедленное и пролонгированное высвобождение включает высвобождение месаламина в подвздошной кишке и продолжение высвобождения месаламина в терминальном отделе подвздошной кишки и в толстой кишке. Причем указанный способ предпочтителен для применения у пациентов в возрасте 18 лет и старше. Краткое описание фигур На фиг. 1 показана схема распределения пациентов. На фиг. 2 показан процент пациентов с продолжительностью периода без рецидивов в течение 6 месяцев/при завершении лечения. На фиг. 2 А показан первичный анализ эффективности лечения, неэффективное лечение у пациентов регистрируют только в случае, если они отказываются от лечения из-за отсутствия эффективности или развития отрицательного эффекта, связанного с язвенным колитом. На фиг. 2 Б отсутствие эффективности регистрировали, если пациенты отказываются от лечения по любой причине. На фиг. 3 показана оценка методом Каплана-Майера периода до рецидива в ходе лечения в популяции с учетом назначенного лечения (ITT). Подробное описание Следует понимать, что представленное выше описание приведено только для иллюстрации изобретения и не ограничивают его объем. Как показано ниже в разделе "Примеры", по данным двух клинических испытаний рандомизированным двойным слепым методом с контролем плацебо в фазе III, у большего числа субъектов в группе,в которой вводили гранулированный мезаламин (ГМ), не наблюдались рецидивы в течение более продолжительного периода, т.е. в течение 6 месяцев, по сравнению с субъектами из группы плацебо (79% по сравнению с 62%, р 0,001). После лечения ГМ также снижался риск развития ЯК на 52% (соотношение рисков рецидива в группах ГМ/плацебо составляет 0,48 (доверительный интервал (ДИ) 95% 0,35, 0,66. Данные испытания проводили для оценки возможного влияния прогностических факторов, которые следует учитывать при развитии рецидива ЯК и поддержании ответной реакции на ГМ. В двух независимых, рандомизированных, двойных слепых испытаниях с контролем плацебо субъектов с регистрированной ремиссией ЯК (индекс активности заболевания по Сатерленду (ИАБ) в баллах: ректальное кровотечение 0, внешний вид слизистой оболочки 2) рандомизировали в 2 группы в соотношении 2:1, в первой группе вводили гранулированный мезаламин в капсулах в дозе 1,5 г, во второй группе вводили плацебо один раз в сутки в течение 6 месяцев. Первичным параметром эффективности является доля пациентов, у которых не наблюдался рецидив в течение 6 месяцев лечения (рецидив оценивали по индексу ИАБ: ректальное кровотечение 1 и внешний вид слизистой оболочки 2, причем при обострении ЯК или при ухудшении симптомов ЯК субъектов исключали из клинических испытаний или начинали медикаментозное лечение ЯК). Оценивали прогностические факторы поддерживания ремиссии, включая исходные демографические характеристики и характеристики заболевания, в том числе: возраст, пол, общий индекс ИАБ и следующие показатели в баллах: частота стула, внешний вид слизистой оболочки, оценка состояния пациента врачом-исследователем, предварительное лечение кортикостероидами, время до последнего обострения, указанные параметры оценивали с учетом ковариантного анализа. Обе группы характеризовались аналогичными исходными и демографическими характеристиками(n=373 в группе ГМ, n=189 в группе плацебо). Независимые показатели рецидива включали общий индекс ИАБ (р=0,0217), частоту стула в баллах (р=0,0106), внешний вид слизистой оболочки в баллах(р=0,0007), оценку ЯК врачом-исследователем в баллах (р=0,0136), данные по стране (р=0,0018) и предварительное лечение 5-ASA (р=0,0066). С учетом вышеуказанных прогностических факторов, при введении ГМ в дозе 1,5 г один раз в сутки значительно снижается риск рецидива на 52% по сравнению с группой плацебо (отношение шансов 0,48, ДИ 95%, 0,322-0,711, р = 0,0003). Наиболее значимым прогностическим фактором поддержания ремиссии в настоящем ковариантном анализе является индекс ИАБ внешнего вида слизистой оболочки (р=0,0014). Кроме того, было установлено, что в группе пациентов, которым вводили гранулированный меза-2 022886 ламин в дозе 1,5 г один раз в сутки, наблюдается более высокая эффективность лечения по сравнению с группой плацебо, т.е. поддерживается ремиссия ЯК в более продолжительный период (79% пациентов по сравнению с 58% пациентов в группе плацебо, отсутствие рецидива в течение 6 месяцев) (Р 0,001). У большинства субъектов, которым вводили гранулированный мезаламин, через 6 месяцев наблюдались клинически положительные изменения активности заболевания по оценке состояния заболевания врачом-исследователем по сравнению с плацебо (78% по сравнению с 64% (Р=0,005. Для субъектов, которым вводили гранулированный мезаламин, характерна также большая вероятность поддерживания периода без рецидивов в течение 6 месяцев (77% по сравнению с 56% (Р 0,001. В результате дополнительных испытаний было установлено, что фармакокинетический профиль и системная абсорбция гранул мезаламина являются сопоставимыми при их введении один или два раза в сутки. Кроме того, по данным других испытаний суммарная системная абсорбция гранул мезаламина составляет низкую величину и в основном не изменяется после приема пищи с высоким содержанием жира перед введением мезаламина. Возможность введения гранул мезалазина во время или после приема пищи, а также введение один раз в сутки может повысить согласие пациента с курсом лечения и повысить эффективность лечения. Если в настоящем описании изобретения элемент указан в единственном числе, то такое определение включает элемент во множественном числе, если не указано иное. В настоящем описании изобретения союз "или" обозначает "и/или", если не указано иное. Кроме того, использование термина "включающий", а также других его вариантов, таких как "включают" и "включали", не ограничивает объем изобретения. Термины "элемент" или "компонент" включают элементы и компоненты, включающие одну единицу и элементы и компоненты, которые включают более одной подъединицы, если не указано иное. Применение термина "часть" может подразумевать часть компонента или целый компонент. Заголовки разделов приводятся только для упрощения чтения и не ограничивают объем изобретения. Все документы или фрагменты документов, цитированные в настоящем изобретении, включают, но,не ограничиваясь только ими, патенты, заявки на выдачу патентов, статьи, книги, монографии, которые в полном объеме включены в настоящее описание изобретения в качестве ссылок. Термин "введение" или"введенный" включают способы введения состава гранулированного мезаламина субъекту для осуществления требуемой функции лекарственного средства. Фармацевтические препараты представлены в форме капсул. На состав гранулированного мезаламина можно наносить покрытие из определенных материалов или включать состав в определенный материал для защиты от воздействия окружающей среды, которая может отрицательно влиять на требуемую функцию лекарственного средства. Состав гранулированного мезаламина можно вводить в отдельности или в комбинации с любым другим агентом или агентами, или в комбинации с фармацевтически приемлемым носителем, или с агентами и фармацевтически приемлемым носителем. Специалисту в данной области представляется очевидным, что вводимая доза in vivo изменяется в зависимости от возраста, массы тела и вида млекопитающих, нуждающихся в лечении, а также от конкретных соединений и от назначения и способа введения указанных соединений. Специалист в данной области медицины может определить эффективную дозу, необходимую для достижения требуемого эффекта, с использованием обычных фармакологических методов. Как правило, клиническое применение лекарственных средств для лечения человека начинают с более низких доз и затем увеличивают до достижения требуемого эффекта."Носители", как описано в данном контексте, включают фармацевтически приемлемые носители,эксципиенты или стабилизирующие добавки, нетоксичные в отношении к клеткам или млекопитающим,которые вводят в испытанных дозах и концентрациях. В большинстве случаев физиологически приемлемый носитель обозначает водный буферный раствор с соответствующей величиной рН. Примеры физиологически приемлемых носителей включают буферные вещества, такие как фосфат, цитрат и другие органические кислоты, антиоксиданты, которые включают аскорбиновую кислоту, низкомолекулярные пептиды (менее 10 остатков), белки, такие как сывороточный альбумин, желатин или иммуноглобулины,гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин и аспарагин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, которые включают глюкозу, маннозу или декстрины, хелатирующие агенты, такие как ЭДТУ, альдиты, такие как маннит или сорбит, солеобразующие противоионы, такие как натрий, и/или неионогенные ПАВ, такие как твин и полиэтиленгликоль (ПЭГ). Термин "эффективное количество" обозначает количество в дозе, и период времени, которые необходимы для достижения требуемого эффекта, например, достаточные для лечения или профилактики ЯК или других заболеваний, связанных с мезаламином, у пациента или субъекта. Эффективное количество состава гранулированного мезаламина зависит от таких факторов, как тяжесть заболевания, возраст и масса тела субъекта и способность гранулированного мезаламина вызывать ответную реакцию у субъекта. Курсы лечения можно оптимизировать таким образом, чтобы обеспечить оптимальную терапевтическую ответную реакцию. Эффективное количество также обозначает количество состава гранулированного мезаламина, при введении которого терапевтически благоприятный эффект состава превышает его токсичные или отрицательные действия (например, побочные действия). Термины "снижение интенсивности симптомов", "улучшение" или аналогичные термины относят-3 022886 ся, например, к детектируемым улучшению или изменению, соответствующих улучшению состояния субъекта или, по крайней мере, у меньшинства субъектов, например, по крайней мере у 2, 5, 10, 15, 20,25, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95, 98, 100% субъектов или в диапазоне примерно любых двух из этих значений. Такие улучшение или изменение могут наблюдаться у пациентов после лечения гранулированным мезаламином по сравнению с субъектами, страдающими от того же или аналогичного заболевания с аналогичными симптомами, но которым не вводили гранулированный мезаламин. Снижение интенсивности заболевания, состояния, симптома или параметра анализа определяют субъективно или объективно, например, самим субъектом(ами), клиницистом или по результатам соответствующих клинических анализов или испытаний, которые включают, например, оценку качества жизни, замедление прогрессирования заболевания(й) или состояний(я), снижение тяжести заболевания(й) или состояния(й) или пригодные метод(ы) анализа для определения уровня или активности(ей) биомолекулы(л), клетки(ок) или выявления симптомов ЯК у субъекта. Снижение интенсивности симптомов является временным, длительным или постоянным или может изменяться в различные временные периоды в ходе введения или после введения субъекту состава гранулированного мезаламина или этот термин используется при анализе или другом методе, описанном в данном контексте или в цитированном документах, например, в течение периодов времени, описанных в данном контексте или в течение от приблизительно 1 ч после введения или применения состава гранулированного мезаламина до приблизительно 28 дней или 1, 3, 6 или 9 месяцев или более после проведения указанного курса лечения. Как описано в данном контексте, "пациент" включает организмы, страдающие от заболеваний кишечника или другого заболевания, которые поддаются лечению гранулированным мезаламином или в ином случае на которое оказывается положительное действие после введения гранулированного мезаламина, как описано в данном контексте, т.е. на человека или нечеловекообразных животных. Предпочтительным пациентом является человек. Термин "нечеловекообразные животные" по настоящему изобретению включает всех позвоночных, например млекопитающих, например грызунов, например мышей, и не млекопитающих, таких как низшие приматы, например овцы, собаки, крупнорогатый скот, куры, земноводные, рептилии и т.п. Субъекты, предрасположенные к заболеваниям кишечника, включают субъектов, включенных в группу риска развития заболевания кишечника. В одном варианте состав гранулированного мезаламина, описанный в данном контексте и который применяли в способах по настоящему изобретению, можно оптимизировать для высвобождения основного количества активного агента - мезаламина (по сравнению с препаратом Asacol и другими составами мезаламина) непосредственно в участке лечения (например, в терминальном отделе подвздошной кишки и толстой кишке) в течение более длительного времени для снижения системной доставки по сравнению с некапсулированными гранулами мезаламина. В другом варианте мезаламин высвобождается в течение более приблизительно 7 ч. Состав гранулированного мезаламина, например, включает твердую желатиновую оболочку капсулы, которая содержит состав гранулированного мезаламина, который включает, например, внутреннее ядро мезаламина из полимерной матрицы, которое окружено внешним слоем с ароматизаторами, промежуточным слоем и внутренним энтеросолюбильным рН-зависимым слоем с замедленным высвобождением. Внутренний слой растворяется, например, при рН 6, но при этом не растворяется в желудке, в котором рН желудочного сока натощак составляет 1, а при приеме пищи приблизительно 4. Растворение внутреннего слоя и ядра из полимерной матрицы, содержащей гранулированный мезаламин, обеспечивает механизм высвобождения, по которому мезаламин, активный терапевтический агент, равномерно и медленно высвобождается и распределяется в просвете толстой кишки. Профиль высвобождения и дополнительные фармакокинетические данные свидетельствуют о том, что капсулы состава гранулированного мезаламина характеризуются относительно низкой скоростью и степенью системной абсорбции, и что от 85 до 90% лекарственного средства достигает патологического участка. Прямое и пролонгированное направленное высвобождение активного агента из состава гранулированного мезаламина при введении субъектам, страдающим от ЯК, обеспечивает высокую эффективность подержания ремиссии. Рецидив или неэффективность лечения, как описано в данном контексте, включает индекс ректального кровотечения, равный 1 или более, определенный методом ИАБ по Сатерленду, и индекс внешнего вида слизистой оболочки, равный 2 или более, определенный методом ИАБ по Сатерленду. Состав гранулированного мезаламина. Составы мезаламина описаны в патентах US 6277412, US 6551620 и заявках US 2003/0133983, заявитель Dr. Falk Pharma GmbH. Патенты US 6277412, 6551620 и заявка на патент US 2003/0133983 включены в настоящее описание изобретение в полном объеме в качестве ссылок. В одном варианте состав гранулированного мезаламина включает, например, мезаламин, аспартам,лимонную кислоту, коллоидный диоксид кремния, стеарат магния, микрокристаллическую целлюлозу,повидон, эмульсию симетикона, тальк, диоксид титана, триэтилцитрат, ванильный ароматизатор, сополимер метакриловой кислоты и метиметакриалата (соотношение сомономеров 1:1), сополимер этилакри-4 022886 лата и метилметакрилата и гипромеллозу. Причем инкапсулированный состав гранулированного мезаламина затем помещают в капсулы, например, твердые желатиновые капсулы размера "00". Каждый состав гранулированного мезаламина в капсулах содержит, например, гранулы, заполненные мезаламином в полимерной матрице, на которые нанесено энтеросолюбильное покрытие, растворяющееся при рН 6 и выше. Инертные ингредиенты капсул с составом гранулированного мезаламина могут включать один или более вспомогательных веществ, например, коллоидный диоксид кремния,стеарат магния, микрокристаллическую целлюлозу, эмульсию симетикона, сополимер этилакрилата и метилметакрилата - ноноксинол 100 (дисперсия), гипромеллозу, сополимер метакриловой кислоты,тальк, диоксид титана, триэтилцитрат, аспартам, безводную лимонную кислоту, повидон, ванильный ароматизатор и пищевые чернила черного цвета. Согласно способам, описанным в данном контексте, композиция составов гранулированного мезаламина может содержаться в твердой капсуле с замедленным и пролонгированным высвобождением для перорального применения. Каждая капсула может содержать, например, 0,375 г мезаламина USP (5 аминосалициловая кислота, 5-ASA) в качестве противовоспалительного лекарственного средства. Структурная формула мезаламина представлена ниже: Молекулярная масса: 153,135. Брутто формула: C7H7NO3. Составы гранулированного мезаламина по способу, описанному в данном контексте, включают, например, гранулированный мезаламин, на который нанесено рН-зависимое покрытие, растворяющееся при рН 6 или выше, который высвобождается в терминальном отделе подвздошной кишки и толстой кишке, и ядро из полимерной матрицы, из которого мезаламин высвобождается медленно и равномерно в просвете толстой кишки, терминальном отделе подвздошной кишки и толстой кишке. Таким образом,состав является формой с замедленным высвобождением мезаламина, так как мезаламин начинает высвобождаться только при достижении терминального отдела подвздошной кишки, и также с пролонгированным высвобождением мезаламина, так как распределение мезаламина продолжается непрерывно в течение всего периода прохождения через терминальный отдел подвздошной кишки и толстой кишки. Такой профиль высвобождения, прежде всего, предпочтителен при лечении таких заболеваний кишечника, как неспецифический колит, болезнь Крона и дивертикулит. Состав может также включать инертные ингредиенты, например, капсулы, содержащие коллоидный диоксид кремния, стеарат магния, микрокристаллическую целлюлозу, 30% эмульсию симетикона(по сухой массе), 2% дисперсию поли(этилакрилатметилметакрилата) - ноноксинол 100 (по сухой массе,Eudragit NE40D), гипромеллозу, сополимер метакриловой кислоты и метилметакрилата в соотношении 1:1 (Eudragit L100), тальк, диоксид титана, триэтилцитрат, аспартам, безводную лимонную кислоту, повидон (К 25), ванильный ароматизатор и пищевые чернила черного цвета. В настоящее время механизм действия 5-ASA неизвестен, и без учета какой-либо теории можно предположить, что оказывается местное действие, а не системное действие. Продуцирование метаболитов арахидоновой кислоты в слизистой оболочке кишки, которое происходит по циклооксигеназному пути, например, по пути простаноидов, а также по липогеназному пути, например, при действии лейкотриенов и гидроксиэйкозатетраеновых кислот, усиливается у субъектов с хроническим воспалительным заболеванием кишечника, и вероятно, что 5-ASA подавляет воспаление за счет блокирования продуцирования метаболитов арахидоновой кислоты. Способ поддержания ремиссии. Описанные в данном контексте способ поддержания ремиссии язвенного колита заключается во введении субъекту состава гранулированного мезаламина. Введение состава гранулированного мезаламина обеспечивает поддержание ремиссии заболевания, например, ЯК в активной фазе или ЯК в фазе ремиссии. Терапевтически эффективные количество согласно предложенному способу включает 4 капсулы,которые содержат приблизительно 375 мг мезаламина. Как описано в данном контексте, терапевтически эффективное количество обозначает количество,которое проявляет эффективность при введении человеку или нечеловекообразному субъекту, так как оказывает благоприятный терапевтический эффект, такой как снижение интенсивности симптомов язвенного колита или поддерживает ремиссию язвенного колита у субъекта. В отдельных вариантах изобретения состав гранулированного мезаламина вводят субъекту один раз в сутки. Более подробно примеры дозировок состава гранулированного мезаламина в количестве приблизительно 1,5 или 3 г/сутки описаны в разделе "Примеры". Другие соответствующие дозировки для лечения способами по настоящему изобретению определяются медицинскими работниками или самим субъектом. Количество указанного состава гранулированного мезаламина для введения один раз в сутки можно увеличить или снизить в зависимости от факторов, таких как масса тела, возраст, состояние здоровья,пол или состояние субъекта. Специалист в данной области может определить требуемую дозировку на основании указанных данных. Гранулированный мезаламин вводят субъекту в виде фармацевтически приемлемого состава. В еще одном варианте пациенту вводят гранулированный мезаламин, как описано в патентах US 6277412, US 6551620 или заявке US 2003/0133983, причем гранулированный мезаламин предпочтительно содержится в капсуле. Состав гранулированного мезаламина может представлять собой капсулу с пролонгированным высвобождением, содержащую, например, 0,375 г мезаламина. Состав гранулированного мезаламина может представлять собой капсулы с замедленным и пролонгированным высвобождением, содержащие,например, 0,375 г мезаламина. При введении состава гранулированного мезаламина поддерживается ремиссия язвенного колита. Ремиссия после введения гранулированного мезаламина поддерживается, например, у взрослых и детей. Взрослые субъекты, как описано в данном контексте, включают, например, субъектов в возрасте 18 лет и старше. Состав гранулированного мезаламина также можно вводить для лечения язвенного колита в активной фазе. В другом варианте состав гранулированного мезаламина вводят до значимого снижения интенсивности заболевания. В еще одном варианте состав гранулированного мезаламина вводят в период активной фазы заболевания и продолжают для поддержания ремиссии. Состав гранулированного мезаламина включает 4 стандартные лекарственные формы (например,капсулы) для введения один раз в сутки. Введение один раз в сутки обозначает введение, например, утром, после полудня или вечером или на ночь. Утро включает, например, временной интервал между приблизительно 3 ч утра до приблизительно полудня. Утро также может обозначать, например, время после пробуждения после сна и до полудня. Состав гранулированного мезаламина можно вводить без приема пищи. Например, его можно вводить после еды, но его не рекомендуется вводить с антацидными средствами, так как антацидные препараты могут влиять на растворимость состава гранулированного мезаламина. Примеры Необходимо отметить, что объем настоящего изобретения не ограничивается примерами, описанными выше, а также описанными конкретными вариантами и что возможны различные эквивалентные изменения, очевидные специалистам в данной области, которые не выходят за пределы объема прилагаемой формулы изобретения. Пример 1. Фармакокинетика. Абсорбция. Фармакокинетику 5-ASA и его метаболита, N-ацетил-5-аминосалициловой кислоты (N-Ac-5-ASA),оценивали после однократного и многократного введения натощак состава гранулированного мезаламина в дозе 1,5 г в перекрестных испытаниях с участием здоровых субъектов. В период многократного введения каждый субъект принимал по четыре капсулы, содержащие по 0,375 г гранулированного мезаламина (суммарная доза 1,5 г) каждые 24 ч (один раз в сутки) в течение 7 дней. Стабильное состояние достигается в день 6 по результатам определения концентрации лекарственного средства в плазме крови. После введения однократной или многократной дозы состава гранулированного мезаламина максимальная концентрация в плазме наблюдается через приблизительно 4 ч после введения дозы. В стабильном состоянии наблюдается умеренное увеличение системного воздействия (1,5-кратное и 1,7-кратное)(AUC0-24) в отношении 5-ASA и N-Ac-5-ASA по сравнению с субъектами, которым вводили однократную дозу состава гранулированного мезаламина. Фармакокинетические параметры после введения однократной дозы состава гранулированного мезаламина натощак в дозе 1,5 г в стабильном состоянии здоровым субъектам представлены в табл. 1. Таблица 1 Средние величины (стандартное отклонение) фармакокинетических параметров для мезаламина (5ASA) и N-Ac-5-ASA в плазме после однократного и многократного введения состава гранулированного мезаламина в дозе 1,5 г здоровым субъектам В отдельных испытаниях (n = 30) было установлено, что при введении дозы натощак - по данным комбинированной кумулятивной экскреции 5-ASA и N-Ac-5 -ASA с мочой - наблюдается систематическая абсорбция на уровне приблизительно 32%11% (среднее значениестандартное отклонение) от введенной дозы в течение 96 ч после введения состава. Влияние пищи с высоким содержанием жира на абсорбцию гранулированного мезаламина (аналогичные гранулы содержались в капсулах) оценивали в группе из 30 здоровых субъектов. Субъекты принимали гранулированный мезаламин в пакетиках (20,8 г) в дозе 1,6 г гранул мезаламина натощак или после приема пищи с высоким содержанием жира в ходе перекрестных испытаний. Было установлено,что в сытом состоянии время достижения максимальной концентрации действующего вещества (tmax) как для 5-ASA, так и для N-Ac-5-ASA увеличилось на 4 и 2 ч соответственно. Пища с высоким содержанием жира не изменяет максимальную концентрацию действующего вещества (Cmax) для 5-ASA, однако комбинированная кумулятивная экскреция 5-ASA с мочой увеличивается на 27% при приеме пищи с высоким содержанием жира. Высокое содержание жира не влияет на общую степень абсорбции N-Ac-5-ASA. Так как состав гранулированного мезаламина и гранул мезаламина в пакетиках являются биоэквивалентными, состав гранулированного мезаламина можно вводить без учета приема пищи. Распределение. По данным испытаний in vitro, 436% и 781% мезаламина и N-Ac-5-ASA соответственно, в концентрации 2,5 мкг/мл связываются с белками плазмы. Было установлено, что степень связывания N-Ac5-ASA с белками не изменяется в диапазоне концентраций N-Ac-5-ASA от 1 до 10 мкг/мл. Метаболизм. Основным метаболитом мезаламина является N-ацетил-5-аминосалициловая кислота (N-Ac-5-ASA),которая образуется под действием фермента N-ацетилтрансферазы в слизистой оболочке кишечника и в печени. Выведение. После введения однократной и многократной дозы состава гранулированного мезаламина средний период полураспада для 5-ASA составил от 9 до 10 ч и от 12 до 14 ч для N-Ac-5-ASA. Было установлено,что абсорбируется приблизительно 32% введенной дозы, при этом приблизительно 2% выводится в неизменном виде вместе с мочой и 30% дозы выводится в форме N-Ac-5-ASA. Испытание межлекарственного взаимодействия in vitro. В испытании in vitro использовали микросомы печени человека, 5-ASA и его метаболит N-Ac-5ASA. Было установлено, что мезаламин и его метаболит не ингибируют основные ферменты CYP(CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4). Более того, мезаламин и его метаболит не ингибируют метаболизм и других лекарственных препаратов, которые являются субстратами CYP1A2, CYP2C9,CYP2C19, CYP2D6 или CYP3A4. Канцерогенез, мутагенез, нарушение репродуктивной функции. Мезаламин, введенный с кормом, не проявлял канцерогенную активность у крыс в дозе более 480 мг/кг/сут или у мышей в дозе 2000 мг/кг/сут. Указанные дозы приблизительно в 2,6 и 5,4 раз выше рекомендованных доз гранулированного мезаламина в капсулах для человека, которые составляют 1,5 г/сутки (30 мг/кг при массе тела 50 кг массы тела или 1110 мг/м 2), соответственно, в расчете на площадь поверхности тела. Мезаламин не обладал мутагенностью по данным теста Эймса, теста прямых мутаций на клетках мышиной лимфомы (L5178Y/TK+/-), анализа обмена сестринских хроматид в костном мозге китайских хомячков и микроядерного теста костного мозга мышей. Изучение репродуктивности животных не выявило признаков нарушения фертильности или репродуктивной функции у крыс при введении мезаламина в дозах вплоть до 320 мг/кг при пероральном введении (приблизительно в 1,7 раза выше ре-7 022886 комендуемой дозы для человека в расчете на площадь поверхности тела). Токсикологические и/или фармакологические испытания на животных. Почечная токсичность. При испытаниях на животных было установлено, что при испытаниях на токсичность у крыс при пероральном введении в течение 13 и 26 недель и испытаниях на токсичность у собак при пероральном введении в течение 26 и 52 недель, основным органом-мишенью мезаламина являются почки. Пероральные дозы 40 мг/кг/сутки (приблизительно в 0,20 раза выше дозы для человека в расчете на площадь поверхности тела) вызывают тубулярные нарушения от минимальных до незначительных и в дозах 160 мг/кг/сутки (приблизительно в 0,90 раз выше дозы для человека в расчете на площадь поверхности тела) или выше у крыс вызывают очаги поражения в почках, включая тубулярную дегенерацию, тубулярную минерализацию и папиллярный некроз. Пероральные дозы 60 мг/кг/сутки (приблизительно в 1,1 раза выше дозы для человека в расчете на площадь поверхности тела) или выше у собак также вызывают очаги поражения в почках, включая тубулярную атрофию, инфильтрацию интерстициальных эндокриноцитов, хронический нефрит и папиллярный некроз. Передозировка. Мезаламин в однократных пероральных дозах 800 мг/кг (приблизительно в 2,2 раза выше рекомендуемой дозы для человека, в расчете на площадь поверхности тела) и 1800 мг/кг (приблизительно в 9,7 раза выше рекомендуемой дозы для человека; в расчете на площадь поверхности тела) вызывает гибель мышей и крыс, соответственно, в результате токсичности в желудочно-кишечном тракте и почках. Пример 2. Поддержание ремиссии язвенного колита гранулированным мезаламином у субъектов, прошедших курс лечения другими препаратами 5-ASA. В следующем эксперименте было установлено, что у субъектов, которым вводили гранулированный мезаламин в дозе 1,5 г один раз в сутки, поддерживается период ремиссии язвенного колита по сравнению с субъектами группы плацебо и субъектами, которым другие препараты мезаламина заменяли на гранулированный мезаламин (78% в период без рецидивов по сравнению с 59% (Р 0,001. У этих субъектов повышалась вероятность отсутствия рецидивов через 6 месяцев по сравнению с субъектами из группы плацебо (вероятность кумулятивного периода без рецидивов 77% по сравнению с 50% (Р 0,001. Субъекты (n=487) с зарегистрированной ремиссией ЯК (по данным оценки индекса активности болезни (ИАБ) по Сатерленду) принимали гранулированный мезаламин в дозе 1,5 г (4 капсулы по 375 мг) или плацебо один раз в сутки в течение 6 месяцев. У субъектов, принимавших гранулированный мезаламин, были получены следующие результаты. Приблизительно у 8 из 10 субъектов наблюдался период ремиссии ЯК через 6 месяцев (78% по сравнению с 59% в группе плацебо (Р 0,001. В подгрупповом анализе принимало участие 305 субъектов, которые проходили предварительный курс лечения 5-ASA, и указанные субъекты характеризовались большей вероятностью поддержания периода без рецидивов через 6 месяцев лечения (77% по сравнению с 50% (Р 0,001. Пример 3. Согласие пациентов с курсом лечения гранулированным мезаламином. Незначительная часть субъектов, которым вводили гранулированный мезаламин (28%), по сравнению с субъектами, принимавшими плацебо (43%), была исключена из испытаний из-за рецидива заболевания (12% по сравнению с 20% в группе плацебо) или побочных эффектов (11% по сравнению с 16% в группе плацебо). Основные отрицательные эффекты как в группе, принимавшей мезаламин, так и в группе плацебо, включали обострение ЯК (11% по сравнению с 24%), головную боль (11% по сравнению с 8%), и диарею (8% по сравнению с 7%). Частота отрицательного действия на почки, печень и поджелудочную железу являлась незначительной и сопоставимой с группой плацебо: 6% в группе субъектов,принимавших гранулированный мезаламин, и 5% в группе субъектов, принимавших плацебо. Тяжелые отрицательные эффекты наблюдались у незначительного числа испытуемых в обеих группах (1% в группе ГМ и 2% в группе плацебо), также не сообщалось о привыкании к гранулированному мезаламину. Пример 4. Влияние пищи на абсорбцию и распределение составов гранулированного мезаламина. В ходе других фармакокинетических испытаний оценивали влияние пищи на абсорбцию 5-ASA. Здоровые субъекты принимали гранулированный мезаламин в дозе 1,6 г (20,8 г) натощак или после приема пищи с высоким содержанием жира в перекрестных испытаниях. Tmax для мезаламина и N-Ac-5ASA увеличивалось после приема пищи с высоким содержанием жира. На основании необработанных данных (правило 80%:125%) концентрация Cmax в плазме для мезаламина и N-Ac-5-ASA является равнозначной при приеме вместе с пищей и натощак. Незначительное увеличение AUC0-inf и AUC0-last (11% и 16% соответственно) было зафиксировано в случае введения мезаламина после приема пищи с высоким содержанием жира. Прием пищи с высоким содержанием жира не влиял на суммарную эффективность лечения и степень абсорбции мезаламина. Было установлено, что приблизительно 80% дозы гранулированного мезаламина, введенной перо-8 022886 рально, распределяется в толстой кишке, сигмовидной кишке и прямой кишке. Пример 5. Испытания субъектов в стадии ремиссии язвенного колита. В испытании принимало участие 562 взрослых субъекта в стадии ремиссии язвенного колита. Активность язвенного колита оценивали с использованием модифицированного индекса активности заболевания по Сатерленду (ИАБ), который представляет собой сумму баллов при оценке 4 показателей: частота стула, ректальное кровотечение, внешний вид слизистой оболочки по результатам эндоскопического испытания и оценка активности заболевания врачом-исследователем. Каждый показатель оценивали по 3-балльной шкале от 0 до 3, максимально возможное значение для ИАБ составляет 12 баллов. Перед испытаниями приблизительно у 80% испытуемых общий ИАБ составлял 0 или 1,0 балл Субъектов рандомизировали в две группы в соотношении 2:1 и вводили им состав гранулированного мезаламина в дозе 1,5 г или плацебо один раз в сутки утром в течение 6 месяцев. Рецидив, как описано в данном контексте, определяли по следующим показателям, например, ректальные кровотечения составляли 1 балл или более, внешний вид слизистой оболочки 2 балла или более (по системе ИАБ). При анализе популяции с учетом назначенного лечения (популяция ITT) проводили сравнение процента субъектов, у которых наблюдался период без рецидива в течение 6 месяцев лечения. В обоих испытаниях число субъектов (в %), у которых наблюдался период без рецидива в течение 6 месяцев, возрастало в группе,принимавшей гранулированный мезаламин, по сравнению с группой плацебо. Таблица 2 Число субъектов (в %), принимавших гранулированный мезаламин, у которых наблюдался период без рецидива в течение 6 месяцев по данным испытаний Пример 6. Определение концентрации состава мезаламина по сравнению с коммерческим препаратом ASACOL в плазме в стабильном состоянии. Было установлено, что концентрации 5-ASA и N-Ac-5-ASA в плазме в стабильном состоянии (Cmax) при приеме 1 раз в сутки повышаются после введения состава гранулированного мезаламина по сравнению с приемом 2 раза в сутки. Время достижения максимальной концентрации лекарственного средства в случае введения состава гранулированного мезаламина 1 раз в сутки снижалось по сравнению с введением 2 раза в сутки для 5ASA (средняя величина 3,96 по сравнению с 11,00 ч соответственно) и для N-Ac-5-ASA (средняя величина 5,21 по сравнению с 11,68 ч соответственно). В ходе 3 испытаний по 3 периода лечения, каждый из которых завершался фазой промывки в течение минимум 7 дней, лекарственные составы вводили перорально и были получены следующие результаты: период лечения A: Asacol в дозе 800 мг (таблетки, 2400 мг) 2 раза в сутки в течение 4 дней,период лечения Б: состав гранулированного мезаламина в дозе 800 мг 2 раза в сутки в течение 4 дней, или период лечения В: состав гранулированного мезаламина в дозе 1600 мг (2800 мг) один раз в сутки в течение 4 дней. Субъектов лечили в периоды А, Б и В, каждый продолжительностью 4 дня. Концентрация в плазме. Можно предположить, что в связи с тем, что у ряда субъектов в кале был обнаружен невысвободившийся Asacol, наблюдается вариабельность между субъектами по системному воздействию 5-ASA и N-Ac-5-ASA, которое определяли в стабильном состоянии по величинам Cmax и AUC в день 4 в группе,принимавшей Asacol, по сравнению с группой, принимавшей состав гранулированного мезаламина. Указанная вариабельность в величинах Cmax между субъектами повышалась в группе, принимавшей Asacol (коэффициент вариации (KB) = 129,7%), по сравнению с группой, принимавшей состав гранулированного мезаламина 2 раза в сутки и 1 раз в сутки (KB = 39,0% в группе, принимавшей состав гранулированного мезаламина 2 раза в сутки и 55,0% в группе, принимавшей состав гранулированного мезаламина 1 раз в сутки). Та же самая закономерность в вариабельности наблюдалась между субъектами и по величинам AUC для 5-ASA и N-Ac-5-ASA. В табл. 3 представлены фармакокинетические значения в мкмолях. В ходе указанных испытаний было установлено, что концентрация 5-ASA и N-Ac-5-ASA в плазме в стабильном состоянии (Cmax) увеличивалась в группе, принимавшей состав гранулированного мезаламина 1 раз в сутки по сравнению с группой, принимавшей состав гранулированного мезаламина 2 раза в сутки (153 и 118% соответственно,р = 0,022 для 5-ASA). Концентрации в плазме принимали за стабильное состояние, так как значения T1/2 для 5-ASA и N-Ac-5-ASA (после введения субъектам состава гранулированного мезаламина в дозе 1600 мг натощак) составляли 5,49 ч и 10,05 ч соответственно. Время достижения максимальной концентрации лекарственного средства для состава гранулированного мезаламина при введении 1 раз в сутки снижалось при введении 1 раз в сутки по сравнению с введением 2 раза в сутки как для 5-ASA (средняя величина 3,96 по сравнению с 11,00 ч соответственно),так и для N-Ac-5-ASA (средняя величина 5,21 по сравнению с 11,68 ч соответственно). Таблица 3 Фармакокинетические параметры для 5-ASA и N-Ac-5-ASA в плазме в различные периоды лечения (в день 4), (среднее значениеСО, в мкмолях) Эффекты смешанной модели ANOVA для логарифмических значений Смакс и AUC значения Р для Смакс и AUC, связанных с соотношением геометрических значений при сравнении с другим периодом лечения. б Значения AUCC приведены для периодов лечения А и Б, значения AUC0-24 приведены для периода лечения В. в Указан доверительный интервал (ДИ) при сравнении средних величин ниже и выше 90% для всех периодов лечения. Таблица 4 Фармакокинетические параметры для 5-ASA и N-Ac-5-ASA в плазме в различные периоды лечения (день 4) (средняя величина СО, в мкг) Эффекты смешанной модели ANOVA для логарифмических значений Смакс и AUC значения Р для Смах и AUC со средним геометрическим отношением. б Значения Смакс и AUC значения Р пересчитаны из мкмоль/л и мкмольч/л в мкг/мл и мкгч/мл при умножении на коэффициент 0,153. в Значения Смакс и AUC пересчитаны из мкмоль/л и мкмольч/л в мкг/мл и мкгч/мл при умножении на коэффициент 0,195. г Значения AUC значения Р для периодов лечения А и Б: AUCC, для периода лечения В: AUC0-24. AUCC = AUC0-12(1 + (AUC12-24/AUC0-12. д Среднее значение (интервал).Asacol вводили в дозе 800 мг 2 раза в сутки в течение 4 дней, состав гранулированного мезаламина вводили в дозе 800 мг 2 раза в сутки в течение 4 дней. Состав гранулированного мезаламина также вводили в дозе 1600 мг 1 раз в сутки в течение 4 дней. Целые или частично разрушенные таблетки Asacol были обнаружены в образцах кала и извлечены из кала у приблизительно 50% субъектов, которые проходили курс лечения в период A (Asacol). По этой причине, а также из-за невозможности выявить различие между количеством высвобождающегося мезаламина и общим количеством в кале мезаламина,при этом количественное сравнение между периодом A (Asacol) и периодом лечения с использованием состава гранулированного мезаламина не проводили. В результате сравнительных испытаний состава гранулированного мезаламина при введении 1 раз в сутки и 2 раза в сутки было установлено, что системное воздействие 5-ASA и N-Ac-5-ASA является сопоставимым. Однако максимальная концентрация 5-ASA в плазме повышается при введении 1 раз в сутки (соотношение = 153, р = 0,022), а время достижения максимальной концентрации в плазме снижается(3,96 по сравнению с 11,00 ч). Время достижения максимальной концентрации значительно больше для состава гранулированного мезаламина при введении 2 раза в сутки по сравнению с составом гранулированного мезаламина при введении 1 раз в сутки (среднее значение 16 ч по сравнению с 3 ч для 5-ASA иN-Ac-5-ASA соответственно). Так как время при введении 2 раза в сутки регистрировали с момента введения первой порции дозы,а вторую дозу вводили через 12 ч, то средняя величина Тмакс= 16 ч обозначает, что максимальная концентрация в плазме достигается приблизительно через 4 ч после введения второй дозы. Эти величины согласуются со временем достижения максимальной концентрации в плазме через 3 ч после введения однократной дозы 1 раз в сутки. Проводили также испытания для оценки влияния курса лечения после введения состава гранулированного мезаламина в дозе 1600 мг (1 раз в сутки или 2 раза в сутки) по сравнению с введением Asacol по 800 мг 2 раза в сутки, по следующим параметрам: кумулятивное выведение с фекалиями, кумулятивное выведение с мочой и системное воздействие 5-ASA и N-Ac-5-ASA. Каждый период лечения продолжался в течение 4 дней с последующим периодом отмывки организма в течение не менее 7 дней. Целые или частично разрушенные таблетки Asacol были обнаружены в образцах кала и извлечены из кала у приблизительно 50% субъектов, которые проходили курс лечения в период A (Asacol). Было установлено, что в группе, принимавшей состав гранулированного мезаламина 1 раз в сутки, максимальная концентрация 5-ASA в плазме повышается (соотношение = 153, р = 0,022), а время достижения максимальной концентрации действующего вещества снижается (3,96 по сравнению с 11,00 ч). Время достижения максимальной концентрации повышается при введении состава гранулированного мезаламина 2 раза в сутки по сравнению с режимом дозировки состава гранулированного мезаламина 1 раз в сутки (средняя величина 16 ч по сравнению с 3 ч для 5-ASA и N-Ac-5-ASA соответственно). Было установлено, что пеллеты гранулированного мезаламина характеризуются безопасностью и достаточно высокой переносимостью при введении здоровым взрослым добровольцам перорально 1 раз в сутки (1600 мг). Концентрации 5-ASA и N-Ac-5-ASA в стабильном состоянии, определенные по величине Cmax повышались после введения 1 раз в сутки по сравнению с 2 раза в сутки. Концентрации в плазме принимали за стабильное состояние, так как значения Т 1/2 для 5-ASA и NAc-5-ASA после введения субъектам (состава гранулированного мезаламина РК 1002 в дозе 1600 мг натощак) составляли 5,49 ч и 10,05 ч соответственно. Время достижения максимальной концентрации лекарственного средства для состава гранулированного мезаламина при введении 1 раз в сутки снижалось по сравнению с введением 2 раза в сутки для 5-ASA (средняя величина 3,96 ч по сравнению с 11,00 ч соответственно) и для N-Ac-5-ASA (средняя величина 5,21 ч по сравнению с 11,68 ч соответственно). Пример 7. Сравнение режимов дозировки и действие на ремиссию язвенного колита. Лечение I: пероральное введение гранул Salofalk по 1,5 г один раз в сутки утром в день 1 и в дни 4-10. Введение в день 2 и день 3 не осуществляли. Лечение II: пероральное введение гранул Salofalk по 3,0 г один раз в сутки утром в день 1 и в дни 4-10. Введение в день 2 и день 3 не осуществляли. Лечение III: пероральное введение гранул Salofalk по 0,5 г 3 раза в сутки дни 1-6. Последнюю дозу вводили утром в день 7. Лечение IV: пероральное введение гранул Salofalk по 1,0 г 3 раза в сутки и в дозе 1 раз в сутки в дни с 1 по 6. Последнюю дозу вводили утром в день 7. Лечение в дозе 3 г состава гранулированного мезаламина 1 раз в сутки и в дозе 1 г состава гранулированного мезаламина 3 раза в сутки характеризуется достаточно высокой эффективностью у больных с активным язвенным колитом, а эффективность лечения в дозе 3 г состава гранулированного мезаламина 1 раз в сутки (в виде однократной дозы утром) сопоставима с эффективностью лечения в дозе 1 г состава гранулированного мезаламина 3 раза в сутки. Для испытуемых гранулы Salofalk оказались более предпочтительными по сравнению таблетками, использованными ранее. Подавляющее большинство субъектов предпочло курс лечения 1 раз в сутки по сравнению с введением 3 раза в сутки. Лечение составом гранулированного мезаламина в дозе 3 г один раз в сутки характеризуется безопасностью и достаточно высокой переносимостью. Не было зарегистрировано никаких отрицательных явлений в отношении безопасности и переносимости по сравнению с введением 1 г состава гранулированного мезаламина 3 раза в сутки. Таблица 5 Показатели клинической ремиссии по результатам промежуточных и заключительных испытаний популяций по протоколу РР и популяции с учетом назначенного лечения (ITT) Предел не меньшей эффективности: 15%.Состав гранулированного мезаламина в дозе 3 г 1 раз в сутки - 1 г 3 раза в сутки,асимптотический доверительный интервал. Таблица 6 Показатели клинической ремиссии по результатам заключительногоанализа Предел не меньшей эффективности: 15%.Состав гранулированного мезаламина в дозе 3 г 1 раз в сутки - 1 г 3 раза в сутки. Таблица 7 Показатели клинической ремиссии (анализа популяции ITT) по результатам заключительного анализа Предел не меньшей эффективности: 15%.Состав гранулированного мезаламина в дозе 3 г 1 раз в сутки - 1 г 3 раза в сутки. Показатели клинической ремиссии при обследовании после завершения испытаний/исключения из испытаний повышаются у субъектов, принимавших состав гранулированного мезаламина в дозе 3 г 1 раз в сутки, по сравнению с субъектами, принимавшими состав гранулированного мезаламина в дозе 1 г 3 раза в сутки, по результатам анализа популяций РР и ITT. По данным заключительного анализа (асимптотическое смещение 2 при сравнении 2 показателей) значение р составляет 0,0001 для обеих популяций РР и ITT всех подлежащих оценке субъектов. Дозы и способ введения: 3,0 г мезаламина (гранулы Salofalk по 1500 мг) один раз в сутки. Субъектам вводили перорально: 2 пакетика, каждый из которых содержит 1,5 г мезаламина, утром и 1 пакетик, содержащий 1,0 г плацебо, в полдень и вечером. Показатели клинической ремиссии по результатам обследования при посещении врача при завершении/исключении из испытаний повышаются у субъектов, принимавших состав гранулированного мезаламина в дозе 3 г 1 раз в сутки, по сравнению с субъектами, принимавшими состав гранулированного мезаламина в дозе 1 г 3 раза в сутки. При сравнении полученных данных было установлено, что как при приеме состава гранулированного мезаламина в дозе 3 г 1 раз в сутки, так и приеме состава гранулированного мезаламина в дозе 1 г 3 раза в сутки наблюдается эффективное лечение у субъектов, страдающих от язвенного колита, при этом при введении состава гранулированного мезаламина в дозе 3 г утром 1 раз в сутки наблюдается сопоставимая эффективность состава гранулированного мезаламина, как и при введении в дозе 1 г 3 раза в сутки. Клиническая ремиссия (ИКА, индекс клинической активности) - эффекты, обусловленные тяжестью заболевания (ИКА) в исходном состоянии. Было установлено, что показатели клинической ремиссии повышаются у субъектов с ИКА 8 в исходном состоянии, по сравнению с субъектами с ИКА 8 в исходном состоянии в обеих популяциях РР и ITT. При сравнении полученных результатов было установлено, что показатели ремиссии повышаются у субъектов, принимавших состав гранулированного мезаламина в дозе 3 г 1 раз в сутки, по сравнению с субъектами, принимавшими состав гранулированного мезаламина в дозе 1 г 3 раза в сутки в подгруппе субъектов с ИКА 8 в исходном состоянии. Такие различия показателей ремиссии у субъектов с ИКА 8 в исходном состоянии не наблюдаются. Таблица 8 Показатели клинической ремиссии в зависимости от локализации заболевания Было установлено, что показатели клинической ремиссии в основном не зависят от локализации заболевания. Более высокие показатели ремиссии зарегистрированы у субъектов, страдающих от проктосигмоидита, и у субъектов, страдающих от субтотального панколита, по сравнению с субъектами с левосторонним колитом в популяциях РР и ITT. Сравнение групп, прошедших курс лечения, свидетельствует о том, что показатели ремиссии повышаются у субъектов, принимавших состав гранулированного меза- 13022886 ламина в дозе 3 г 1 раз в сутки, по сравнению с субъектами, принимавшими состав гранулированного мезаламина в дозе 1 г 3 раза в сутки в подгруппе субъектов, страдающих от проктосигмоидита. Без учета какой-либо теории, можно предположить, что курс лечения 1 раз в сутки обеспечивает доставку большего количества активного вещества в более отдаленные отделы толстой кишки. Как у субъектов с левосторонним колитом, так и у субъектов с субтотальным панколитом показатели ремиссии повышаются в группе, принимавшей состав гранулированного мезаламина в дозе 3 г 1 раз в сутки, по сравнению с группой, принимавшей состав гранулированного мезаламина в дозе 1 г 3 раза в сутки. Время до первой регрессии клинических симптомов (время до наступления события). При анализе среднего времени (стандартное отклонение) до первой регрессии клинических симптомов (согласно методу Lfberg:3 дефекации/сутки, все без следов крови) не наблюдается никаких различий между курсами лечения в популяции РР (состав гранулированного мезаламина в дозе 3 г 1 раз в сутки: 14,9 (14,5) дней, n = 147, состав гранулированного мезаламина в дозе 1 г 3 раза в сутки: 15,0 (13,3) дней, n = 149) и популяции ITT (состав гранулированного мезаламина в дозе 3 г 1 раз в сутки: 14,9 (14,6) дней, n = 161, состав гранулированного мезаламина в дозе 1 г 3 раза в сутки: 15,0 (13,5) дней, n = 158). Анализ времени до наступления события свидетельствует о том, что среднее время до наступления первой регрессии клинических симптомов снижается у пациентов, принимавших состав гранулированного мезаламина в дозе 3 г 1 раз в сутки, по сравнению с субъектами, которым вводили состав гранулированного мезаламина в дозе 1 г 3 раза в сутки. Таблица 9 Время до наступления первой регрессии клинических симптомов(анализ времени до наступления события) Пример 8. Влияние прогностических факторов на поддержание ремиссии язвенного колита у пациентов, принимавших гранулированный мезаламин в дозе 1,5 г 1 раз в сутки. Было установлено, что при введении гранулированного мезаламина (ГМ) один раз в сутки в дозе 1,5 г увеличивается продолжительность периода без рецидивов. В ходе двух двойных слепых клинических испытаний с контролем плацебо в фазе III (рандомизированные контрольные испытания, РКИ) было установлено, что у большего числа пациентов, которым вводили гранулированный мезаламин в дозе 1,5 г, наблюдался период без рецидива в течение 6 месяцев по сравнению с группой плацебо (79,4% по сравнению с 63,0%, отношение рисков, 2,261, 95% ДИ, 1,535-3,331, р 0,0001). Пациентам вводили ГМ в дозе 1,5 г (четыре капсулы по 375 мг ГМ). В данных испытаниях исследовали потенциальное влияние прогностических факторов, которые можно учитывать при оценке рецидивов ЯК и защитного действия ГМ, по сравнению с плацебо. Пациентов (n=562) из двух независимых РКИ с зарегистрированной ремиссией ЯК (модифицированный индекс активности заболевания по Сатерленду (ИАБ) в баллах: ректальное кровотечение 0,внешний вид слизистой оболочки 2) рандомизировали в соотношении 2:1, первая группа принимала ГМ в дозе 1,5 г один раз в сутки (n=373), вторая группа принимала плацебо (n=189) в течение 6 месяцев. В качестве первичного параметра эффективности оценивали долю пациентов, у которых наблюдался период без рецидива через 6 месяцев лечения (рецидив определяли по индексу ректального кровотечения в баллах 1 и внешнему виду слизистой оболочки 2 согласно ИАБ, по обострению ЯК или симптомам ЯК, в результате которых пациентов исключали из испытаний, или при необходимости начала медикаментозного лечения ЯК). Прогностические факторы, которые можно учитывать при оценке рецидивов ЯК, включают исходные демографические данные и характеристики заболевания, такие как возраст, пол,общий индекс ИАБ, частота стула, внешний вид слизистой оболочки, оценка состояния пациента врачом-исследователем, время до наступления последнего обострения и продолжительность заболевания. Для оценки результатов использовали ковариантный анализ. Для участия в клинических испытаниях использовали данные пациентов с аналогичными демографическими данными и исходным состоянием. Независимые прогностические факторы рецидива включают индекс ИАБ (р=0,0217), частота стула (р=0,0106), внешний вид слизистой оболочки (р=0,0007) и общую оценку ЯК врачом-исследователем (р=0,0136). После анализа указанных прогностических факторов в мультивариантном анализе было установлено, что наиболее значимым прогностическим фактором для поддержании ремиссии является индекс ИАБ внешнего вида слизистой оболочки (р=0,0032). Влияние ГМ на поддержание ремиссии проявлялось в увеличении случаев достижения периода без рецидивов у пациентов по сравнению с плацебо (отношение рисков, 2,089, 95% ДИ, 1,407-3,103, р = 0,0003). После контроля прогностических факторов введение ГМ в дозе 1,5 г один раз в сутки приводило к значительному защитному действию для поддержания продолжительного периода ремиссии ЯК в течение 6 месяцев лечения. Наиболее значимым прогностическим фактором является индекс внешнего вида слизистой оболочки в исходном состоянии. Даже при наличии значимых прогностических факторов, ГМ оказывает значительное влияние на увеличение числа пациентов, у которых наблюдается период без рецидивов по сравнению с группой плацебо. Пример 9. Продолжительный период поддержания в отсутствие рецидивов с использованием гранулированного мезаламина (в дозе 1,5 г) у пациентов, которых предварительно лечили кортикостероидами, связан со снижением отрицательных явлений и эффектов, связанных с ЯК. Было также установлено, что у большего числа пациентов, которых предварительно лечили кортикостероидами и которым вводили гранулированный мезаламин один раз в сутки, по сравнению с группой пациентов, принимавших плацебо, наблюдался период без рецидива в течение 6 месяцев (77% по сравнению с 55%, р 0,004). Пациентам вводили ГМ в дозе 1,5 г (4 капсулы по 375 мг). Следует отметить,что у пациентов в период ремиссии ЯК, принимавших кортикостероиды, часто возникают рецидивы симптомов при постепенном снижении дозы стероидов или вскоре после прекращения приема стероидов. Проводили также текущий анализ полученных данных от указанных субъектов после лечения стероидами в течение 24 месяцев, в ходе клинических испытаний с открытой этикеткой (ИОЭ) для оценки долгосрочного влияния ГМ на симптомы ЯК и другие параметры безопасности. Пациентов (n=562) из двух независимых РКИ с зарегистрированной ремиссией ЯК (модифицированный индекс активности заболевания по Сатерленду (ИАБ) в баллах: ректальное кровотечение 0,внешний вид слизистой оболочки 2) рандомизировали в соотношении 2:1, первая группа принимала ГМ в дозе 1,5 г один раз в сутки (n=373), вторая группа принимала плацебо (n=189) в течение 6 месяцев. В ходе этих испытаний 158 (ГМ, n=105, плацебо, n=53) пациентов, страдающих ЯК, предварительно принимали кортикостероиды (30 дней до анализа: 78% принимали стероиды перорально, 23% с помощью клизмы и 4% в виде пены/суппозиториев) с целью лечения обострений ЯК или для поддержания ремиссии ЯК. 74 субъекта продолжали лечить составом ГМ в ходе ИОЭ в течение до 30 месяцев. В субпопуляции, которую лечили кортикостероидами, ГМ снижал риск развития нежелательных отрицательных эффектов и симптомов ЯК (кровавый стул, синдром раздраженного кишечника) в течение 6 месяцев по результатам испытаний двойным слепым методом (отношение рисков 0,508, 95% ДИ 0,307, 0,842, р=0,0086) в ходе ИОЭ. Указанная низкая вероятность рецидивов ЯК и симптомов ЯК наблюдается в ходе ИОЭ. Уровень отрицательных эффектов сопоставим при лечении составом ГМ и составляет в отношении отрицательных эффектов, связанных с лечением, 3,0 по сравнению с 2,1, в отношении тяжелых отрицательных эффектов 0,025 по сравнению с 0,06, и в отношении отрицательных эффектов, приводящих к досрочному исключению из клинических испытаний 0,075 по сравнению с 0,06 в ходе ИОЭ, а также уровень отрицательных эффектов снижался для субъектов, принимавших состав ГМ в ходе ИОЭ. Среднее согласие пациентов с курсом лечения при введении препарата 1 раз в сутки составляло 96,7% в течение 6 месяцев по результатам испытаний двойным слепым методом и 96,3% по результатам ИОЭ. У пациентов с ЯК, которых предварительно лечили кортикостероидами и которые принимали ГМ(в дозе 1,5 г 1 раз в сутки), в ходе ИОЭ снижался уровень нежелательных отрицательных эффектов, связанных с ЯК, и такой низкий риск наблюдался в течение 30 месяцев лечения в ходе ИОЭ. Пациенты (n=209 ГМ, n=96 плацебо) в стадии ремиссии язвенного колита (модифицированный индекс активности заболевания по Сатерленду (ИАБ) ректальное кровотечение=0, внешний вид слизистой оболочки 2) принимали гранулированный мезаламин в дозе 1,5 г или плацебо один раз в сутки в течение 6 месяцев. Первичным параметром эффективности является доля пациентов с продолжительностью периода без рецидивов через 6 месяцев (завершение лечения). Рецидив определяли по индексу ИАБ в баллах: ректальное кровотечение 1 и внешний вид слизистой оболочки 2, обострение язвенного колита или необходимость медикаментозного лечения ЯК. Доля пациентов с продолжительностью периода без рецидивов в течение 6 месяцев (завершение лечения) повышается в группе, принимавшей ГМ, по сравнению с плацебо (78,9% по сравнению с 58,3%,Р 0,001) по результатам анализа популяции ITT, а также по результатам стандартного дополнительного метода анализа с учетом всех пациентов, досрочно исключенных из клинических испытаний по любой причине, включая развитие рецидивов (68% по сравнению с 51%, Р 0,001). Было также установлено, что статистически значимые различия (р 0,008) в пользу ГМ по сравнению с плацебо относятся также почти ко всем вторичным параметрам эффективности, включая число пациентов (в %) на каждом уровне изменения относительно исходного состояния следующих параметров: ректальное кровотечение, оценка врача-исследователя тяжести заболевания и частота стула по индексу ИАБ через 1, 3 и 6 месяцев/или при завершении лечения, среднее изменение относительно исходного состояния по индексу ИАБ через 6 месяцев/при завершении лечения, число пациентов (в %), прошедших курс лечения, и продолжительность периода без рецидивов. Для остальных вторичных параметров эффективности, число пациентов (в %) на каждом уровне изменения относительно исходного состояния по индексу ИАБ, т.е.: внешний вид слизистой оболочки, полученные численные результаты также свидетельствуют в пользу ГМ (однако уровень значимости достаточно низкий, Р 0,05 (Р=0,098. Отрицательные эффекты наблюдались только у 10% пациентов в каждой группе лечения: ухудшение язвенного колита (11% при введении гранул мезаламина и 27% при введении плацебо) и головная боль (11% при введении гранул мезаламина и 7% при введении плацебо). Пример 10. Введение гранулированного мезаламина в капсулах один раз в сутки является эффективным. Было установлено, что ГМ в дозе 1,5 г при введении 1 раз в сутки проявляет эффективность с благоприятным профилем безопасности при продолжительном поддержании ремиссии язвенного колита по сравнению с плацебо. Пациентам вводили ГМ в дозе 1,5 г (4 капсулы по 375 мг ГМ). Лечение ГМ обеспечивает поддержание ремиссии приблизительно у 80% пациентов (165 из 209) в течение 6 месяцев. Язвенный колит является воспалительным заболеванием кишечника, которое характеризуется хроническим возвратно-ремитирующим течением, вызывает снижение качества жизни и снижение трудоспособности, а также повышает риск заболеваемости и смертности от других заболеваний органов пищеварения, в том числе и от рака толстой кишки. Длительное поддержание ремиссии симптомов и воспаления слизистой оболочки является первостепенной задачей лечения. Эффективное поддержание ремиссии снижает риск осложнений и необходимость хирургического вмешательства, улучшает качество жизни и функциональную активность пациентов. В основе лечения для индукции и поддержания ремиссии у пациентов, страдающих от язвенного колита, лежит применение 5-аминосалициловой кислоты (5-ASA,мезаламин), которая действует местно на слизистую оболочку желудочно-кишечного тракта и подавляет множество воспалительных процессов. Разработан ряд агентов для перорального введения, 5-ASA, которые отличаются по типу систем для доставки, с целью максимального увеличения эффективности доставки в толстую кишку и минимизации системной абсорбции. Зависимые от времени и рН системы доставки в настоящее время выпускаются в виде пролекарств, содержащих азо-связь, из которых высвобождается 5-ASA в толстой кишке под воздействием бактерий. С целью поддержания ремиссии язвенного колита, агенты 5-ASA обычно вводят в виде множества доз согласно различным курсам лечения, что может вызывать несогласие пациентов с лечением, что является в свою очередь основной причиной рецидива язвенного колита. В одном варианте осуществления гранулированный мезаламин вводили один раз в сутки по 4 капсулы с пролонгированным высвобождением, содержащие 0,375 г мезаламина в каждой капсуле. Желатиновые капсулы растворяются в желудке, высвобождая тысячи гранул. Покрытие каждой гранулы, обеспечивающее замедленное высвобождение, растворяется при рН 6, которое обычно характерно для желудочно-кишечного тракта. Как только покрытие каждой гранулы мезаламина с замедленным высвобождением растворяется, ядро из полимерной матрицы, обеспечивающее пролонгированное высвобождение мезаламина, набухает и постепенно высвобождает мезаламин вдоль толстой кишки. Однократная суточная доза мезаламина высвобождает тысячи гранул, обеспечивая значительную площадь для высвобождения мезаламина и защиту в течение 24 ч. Мужчины и женщины (за исключением беременных и кормящих) в возрасте 18 лет были включены в клинические испытания при условии, что подтверждается диагноз язвенного колита от легкой до умеренной тяжести в период ремиссии по крайней мере в течение 1 месяца, но не более 12 месяцев, и в истории болезни зарегистрирован по крайней мере один случай обострения с симптомами, требующими вмешательства в течение от 1 до 12 месяцев до анализа и при условии, что участникам испытания не вводили стероиды или иммунодепрессантные препараты в течение 30 дней до начала анализа. Ремиссию определяли по следующим показателям: индекс ректального кровотечения равен 0 (отсутствие кровотечения) и по результатам ректороманоскопии индекс внешнего вида слизистой оболочки равен 0 (целостность слизистой оболочки с целыми или поврежденными сосудами) или 1 (эритема, нарушение сосудистого рисунка, гранулярность, отсутствие кровотечения слизистой оболочки) по модифицированному индексу активности заболевания по Сатерленду (ИАБ, описанному ниже. Критерии исключения включают признаки нарушения иммунной функции, назначение лечения иммунодепрессантами или кортикостероидами в течение 30 дней до анализа, предшествующая хирургическая операция на кишечнике, за исключением удаления аппендицита, положительные результаты серологического анализа на вирус иммунодефицита человека или гепатитов В или С, наличие инфекционных, ишемических или иммунологических заболеваний, включая заболевания желудочно-кишечного тракта, заболевания почек при уровне кератинина в сыворотке крови или мочевины (азота) в крови, в 1,5 раза превышающем значения верхней границы нормы, заболевания печени при уровнях, превышающих показатели верхней границы нормы для аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ) или общего билирубина. От всех пациентов было получено письменное информированное согласие с участием в испытаниях. Протоколы указанного рандомизированного испытания двойным слепым методом с контролем плацебо в фазе III были утверждены Экспертным советом организации. Испытания включают этап ана- 16022886 лиза, который заканчивается за неделю до начала этапа рандомизации, после которой следует фаза лечения в течение 6 месяцев. Пациентов, которые соответствовали критериям включения в испытания в течение фазы анализа, рандомизировали в группы в соотношении 2:1, одной группе вводили ГМ в дозе 1,5 г один раз в сутки (4 капсулы по 0,375 г мезаламина в каждой), другой группе вводили плацебо двойным слепым методом в фазе лечения в течение 6 месяцев. Фаза лечения включает 4 посещения врача в клинике с момента рандомизации (исходное состояние) в день 1 и в конце месяцев 1, 3 и 6 для оценки тяжести заболевания и обследования пациентов для выявления отрицательных эффектов. Кроме того, в конце месяца 6 (или по факту досрочного исключения из клинических испытаний) проводили анализ методом ректороманоскопии. Активность заболевания оценивали по индексу (ИАБ) в баллах по следующим параметрам: частота стула, ректальное кровотечение, внешний вид слизистой оболочки и оценка врачом-исследователем тяжести заболевания в шкале от 0 до 3 баллов, причем суммарный индекс не может превышать 12 баллов. Все 4 параметра в баллах ИАБ оценивали в начале анализа и в конце месяца 6 (или по факту досрочного исключения из клинических испытаний), суммарный индекс ИАБ, за исключением индекса внешнего вида слизистой оболочки, оценивали в день 1 (исходное состояние) и в конце месяцев 1 и 3. Лекарственные препараты, запрещенные к применению в ходе проведения фазы клинических испытаний, включают, но не ограничиваясь только ими, иммунодепрессанты, нестероидные противовоспалительные лекарственные препараты для лечения хронических заболеваний, кортикостероиды, антибиотики для перорального применения за исключением принимаемых курсами от 7 до 10 дней при заболеваниях, не связанных с язвенным колитом, регуляторы работы желудочно-кишечного тракта на основе подорожника и 5-ASA, отличные от препаратов,применяемых в настоящем испытании. Незапланированные визиты пациентов к врачу осуществлялись при ощущении в какой-либо момент в ходе испытаний пациентом обострения заболевания, включая ректальное кровотечение. У таких пациентов диагностировали рецидив и их исключали из испытаний по результатам ректороманоскопии по индексу ИАБ в баллах: внешний вид слизистой оболочки 2 и ректальное кровотечение 1. Полученные данные анализировали для популяции ITT, которую определяли как число рандомизированных пациентов, которые принимали, по крайней мере, 1 дозу исследуемого лекарственного препарата. Первичным параметром эффективности являлось число пациентов (в %), у которых наблюдался период без рецидива через 6 месяцев лечения. Рецидив или неэффективное лечение регистрировали, если индексы ИАБ составляли: ректальное кровотечение 1 и внешний вид внешнего вида слизистой оболочки 2, в случае обострения язвенного колита или при необходимости применения препаратов, ранее используемых для лечения обострения язвенного колита. В другом испытании использовали аналогичный,но менее всесторонний метод выявления рецидивов. В первичном анализе эффективности досрочное исключение из клинических испытаний не обозначало рецидив, за исключением тех случаев, когда причиной досрочного исключения служило отсутствие эффективности лечения или отрицательные эффекты,связанные с язвенным колитом. Для пациентов, досрочно исключенных из клинических испытаний по другим причинам, для выявления рецидива использовали оценку состояния по индексу ИАБ. Сравнение эффективности лечения в группах проводили по первичному параметру с использованием критерия Кохрана-Мантеля-Хенселя внутри каждой страны. При подсчете объема выборки было установлено, что у 200 пациентов в группе, которым вводили ГМ, и у 100 пациентов в группе, которым вводили плацебо, статистическая мощность испытания (=0,10) составляет 90%, что является основанием для исключения нулевой гипотезы об отсутствии различия между группами лечения, при этом двусторонний уровень значимости составлял 5% (=0,05), распределение пациентов 2:1 и показатель периода без рецидивов составляет 70% пациентов, которым вводили ГМ, и 50%, которым вводили плацебо. Вторичным параметром эффективности являлось число пациентов (в %) на каждом уровне изменения исходного состояния по следующим параметрам: ректальное кровотечение, внешний вид слизистой оболочки, оценка врачом-исследователем тяжести заболевания и частота стула в баллах ИАБ в конце месяцев 1, 3 и 6/при завершении лечения, при этом среднее изменение исходного состояния в баллах ИАБ в конце месяца 6/при завершении лечения, число пациентов (в %), у которых зарегистрировано эффективное лечение (т.е. ИАБ наблюдался на уровне 2, а балл для каждого индивидуального параметра не превышал 1, и индекс ректального кровотечения равен 0 в конце месяца 6/при завершении лечения,причем период без рецидива определяли по числу дней от даты начала приема лекарственных препаратов в испытаниях и датой регистрации первого рецидива или досрочного исключения из клинических испытаний плюс 1 день. Метод переноса вперед данных последнего наблюдения (ПВДПН) использовали для получения отсутствующих вторичных параметров эффективности для пациентов, которых исключили из клинических испытаний. Статистический анализ вторичных параметров проводили определенным иерархическим методом до идентификации заранее недостоверных значений Р (Р 0,05), после чего проводили оценку факторной структуры параметров. Различие в эффективности в группах лечения оценивали с использованием критериев Кохрана-Мантеля-Гензеля по каждой стране для качественных переменных, и с использованием ковариантного анализа (ANCOVA), с учетом исходных параметров и страны для среднего изменения исходного состояния по индексу ИАБ в конце месяца 6/при завершении лечения. Для оценки продолжительности периода без рецидивов, модель пропорциональной регрессии рисков Кокса, моделированную с учетом страны, использовали для выявления различий эффективности в группах лечения, при этом методы Каплана-Мейера использовали для расчета кумулятивной вероятности периода без рецидивов в течение месяцев 1, 3 и 6. Критерий Хи-квадрат использовали для идентификации тойнедели, в течение которой группу, принимавшую ГМ, отделяли от группы плацебо в отношении вероятности периода без рецидивов. Данные по оценке безопасности суммировали методом описательной статистики для популяции безопасности, которую определяли как число рандомизированных пациентов, получивших по крайней мере 1 дозу исследуемого лекарственного препарата и прошедших по крайней мере 1 обследование для оценки безопасности после начала испытаний. Основными показателями безопасности являются число пациентов (в %), у которых в результате лечения были выявлены отрицательные явления (определяют как любой неблагоприятный симптом, наблюдавшийся в день 1 или после дня 1 или если такой симптом уже существовал и ухудшился после дня 1), серьезные отрицательные явления (определяют как отрицательные явления, повлекшие за собой смерть, потерю трудоспособности или недееспособность с угрозой для жизни, или требуется длительная госпитализация, или были зарегистрированы врожденная аномалия или врожденный порок), отрицательные явления, в результате которых возникла необходимость в досрочном исключении из клинических испытаний по результатам клинических лабораторных анализов. Демографические, исходные клинические характеристики и степень согласия пациентов с курсом лечения оценивали методами описательной статистики, степень согласия рассчитывали по формуле: 100(число выданных капсул - число возвращенных капсул)/(4 дней приема капсул). В испытаниях участвовало 356 субъектов, из них 305 рандомизировали для проведения лечения(ГМ n=209, плацебо n=96). Все 305 рандомизированных пациентов, принимавших по крайней мере 1 дозу исследуемого препарата, были включены в популяцию ITT. Пять (5) из указанных 305 пациентов не соответствовали критериям безопасности при обследовании после начала лечения, таким образом, уже только 300 пациентов были включены в популяцию безопасности. На фиг. 1 представлена схема распределения пациентов. Частота досрочного исключения из клинических испытаний снижена в группе, принимавшей ГМ (31,1%), по сравнению с группой, принимавшей плацебо (49,0%). Наиболее общие причины досрочного исключения из клинических испытаний - развитие отрицательных явлений и отсутствие эффективности лечения. Зарегистрированы аналогичные демографические и исходные характеристики заболевания для группы, принимавшей ГМ, и группы плацебо (табл. 10). Большинство пациентов включало белых американцев, причем мужчины в группе ГМ составляли 44,0% и в группе плацебо 55,2%. Среднее время с момента последнего обострения язвенного колита составляло 25,6 недель в обеих группах, а средняя продолжительность ремиссии составляла приблизительно 16 недель. Средний исходный индекс (ИАБ) составлял 0,8 (СО 0,8) в группе, принимавшей ГМ, и 1,0 (СО 1,3) в группе, принимавшей плацебо. Таблица 10 Демографические характеристики и исходные характеристики заболевания Пациенты могут принадлежать к 1 расе или более и таким образом могут быть включены в 1 категорию или более. Средняя величина степени согласия с курсом лечения в ходе всего периода лечения составляла 96,2% (СО 11,6) для группы, принимавшей ГМ, и 96,7% (СО 6,4) для группы, принимавшей плацебо. По данным анализа эффективности лечения, доля пациентов, у которых наблюдался период без рецидива в конце месяца 6/при завершении лечения, значительно повышалась в группе, принимавшей ГМ,по сравнению с группой, принимавшей плацебо (78,9% по сравнению с 58,3%, Р 0,001) (фиг. 2 А). В настоящем анализе пациентов, досрочно исключенных из клинических испытаний, не включали в число пациентов с рецидивом, но их учитывали, если было подтверждено исключение из клинических испытаний по причине неэффективности лечения или развития отрицательных явлений, связанных с язвенным колитом. Кроме того, по результатам стандартных дополнительных анализов (по которым оценивают всех пациентов, досрочно исключенных из клинических испытаний по любой причине и включенных в группу пациентов с рецидивом), доля пациентов, у которых наблюдался период без рецидива в конце месяца 6/при завершении лечения, значительно повышается в группе, принимавшей ГМ, по сравнению с группой, принимавшей плацебо (68% по сравнению с 51%, Р 0,001), (фиг. 2 Б). Отношение рисков рецидива в группе, принимавшей ГМ, относительно рисков рецидива в группе,принимавшей плацебо, свидетельствует о снижении риска рецидивов для группы, принимавшей ГМ, по сравнению с группой, принимавшей плацебо, через 6 месяцев лечения (фиг. 3). По статистически значимым данным, группа ГМ через одну неделю лечения отличается в отношении вероятности периода без рецидивов от группы плацебо. Результаты анализа числа пациентов свидетельствуют о том, что у одного пациента из 5 пациентов, принимавших ГМ, осуществляется профилактика рецидива язвенного колита. Были установлены другие статистически значимые вторичные параметры эффективности, свидетельствующие о преимуществе лечения ГМ в капсулах по сравнению с плацебо, которые включают долю пациентов на каждом уровне изменения исходных параметров (в баллах ИАБ): ректальное кровотечение(Р=0,008), оценка врачом-исследователем тяжести заболевания (Р=0,005) и частота стула (Р=0,005), доля пациентов, лечение которых классифицировалось как эффективное (Р=0,003), общий балл среднего изменения исходных значений в баллах (ИАБ) общий балл (Р=0,001) и вероятность поддержания периода без рецидивов в течение 6 месяцев (Р 0,001) (табл. 11). Для остальных вторичных параметров эффективности, т.е. для доли пациентов на каждом уровне изменения исходных значений в баллах (ИАБ) для внешнего вида слизистой оболочки, численные результаты свидетельствуют о преимуществе ГМ, однако полученные данные являются не достоверными на уровне Р 0,05 (Р=0,098), (табл. 11). Число пациентов (в %), у которых зарегистрирован индекс отрицательных явлений 1, составляет 64% в каждой группе, прошедшей курс лечения. У 10% пациентов с зарегистрированными отрицательными явлениями в каждой группе установлены ухудшение состояния язвенного колита (11% ГМ, 27% плацебо) и головная боль (11% ГМ, 7% плацебо). В табл. 12 представлен список отрицательных явлений,развивающихся в ходе лечения (у 3% пациентов в группе лечения), причем число случаев развития отрицательных явлений возрастает в группе, принимавшей ГМ, по сравнению с группой плацебо. Таблица 12 Отрицательные явления, зарегистрированные в ходе лечения (у 3% пациентов в группе лечения), причем число случаев развития отрицательных явлений возрастает в группе, принимавшей ГМ, по сравнению с группой плацебо В обеих группах, прошедших курс лечения, в редких случаях наблюдались отрицательные явления,- 20022886 поражающие поджелудочную железу, почки или печень. Зарегистрирован только 1 случай отрицательного явления, связанного с поджелудочной железой: острый приступ панкреатита легкой тяжести, который не был связан с испытаниями ГМ. Наблюдались редкие случаи отрицательных явлений, связанных с почками и печенью. Было зарегистрировано увеличение уровня некоторых печеночных ферментов в результате лечения, причем такие отрицательные явления наблюдались реже у пациентов, принимавших ГМ, по сравнению с пациентами,принимавшими плацебо: 1% пациентов по сравнению с 4% пациентов (увеличение уровня ACT), 0% по сравнению с 4% (увеличение уровня АЛТ) и 1% по сравнению с 2% (увеличение уровня щелочной фосфатазы). В ходе рандомизированных испытаний двойным слепым методом, описанном в данном контексте,было установлено, что при введении гранулированного мезаламина в дозе 1,5 г в виде капсул по 375 мг каждая один раз в сутки в течение 6 месяцев, наблюдается значительная защита от рецидивов язвенного колита по сравнению с группой, принимавшей плацебо. Приблизительно у 8 из 10 пациентов (78,9%),принимавших капсулы ГМ, наблюдался период без рецидивов в ходе всего периода лечения в течение 6 месяцев по сравнению с 58,3% пациентов из группы плацебо. Через 6 месяцев лечения ГМ снижал риск развития рецидива на 58% по сравнению с плацебо. Существенный защитный эффект ГМ подтверждается результатами двух анализов: анализ первичных параметров эффективности, в котором пациентов, досрочно исключенных из клинических испытаний, не включали в группу с рецидивом, только если они не отказались от участия в клинических испытаниях по причине отсутствия эффективности лечения или развития отрицательных явлений, связанных с язвенным колитом, а также стандартный дополнительный анализ, в котором учитывают всех пациентов, досрочно исключенных из клинических испытаний по любой причине, связанной с рецидивом. Анализ вторичных параметров эффективности также подтверждает результаты анализа первичных параметров эффективности и свидетельствует о значительном увеличении вероятности периода без рецидивов в течение 6 месяцев, а также свидетельствует об улучшении показателей в баллах, таких как ректальное кровотечение, оценка врачом-исследователем тяжести заболевания и частота стула при лечении ГМ по сравнению с плацебо. В указанных испытаниях также повышается показатель согласия с курсом лечения при введении ГМ 1 раз в сутки. Показатель согласия с курсом лечения при приеме 1 раз в сутки превышал 95% в течение 6 месяцев лечения. В указанных испытаниях, кроме увеличения эффективности лечения по сравнению с плацебо, ГМ характеризуется и более благоприятным профилем безопасности. В отношении отрицательных явлений,зарегистрированных у 5% пациентов в каждой группе лечения, единственным наблюдаемым отрицательным явлением (2% чаще в группе ГМ по сравнению с плацебо) является головная боль (11% ГМ,7% плацебо). Частота отрицательных явлений, которые приводили к досрочному исключению из клинических испытаний, приблизительно в 2 раза ниже в группе, принимавшей ГМ (15%), по сравнению с группой, принимавшей плацебо (28%). Частота отрицательных явлений, поражающих поджелудочную железу, печень и почки- о которых сообщается, хотя и редко, при лечении другими лекарственными формами мезаламина-находится на низком уровне в обеих группах и не отличается для групп ГМ и плацебо. Хотя в ходе испытаний допускалось применение антацидных препаратов, только 5 пациентов сообщили о приеме антацидных препаратов в группе ГМ. При введении капсул ГМ один раз в сутки наблюдается более благоприятный профиль безопасности и повышенная эффективность лечения по сравнению с плацебо, а также продолжительный период поддержания ремиссии язвенного колита, причем у 8 из 10 пациентов поддерживался период ремиссии в течение 6 месяцев лечения, и при лечении ГМ в значительной степени улучшались показатели, такие как ректальное кровотечение, оценка врачом-исследователем тяжести заболевания и частота стула, по сравнению с группой плацебо. Покрытие для замедленного высвобождения растворяется при рН 6, при этом происходит пролонгированное высвобождение ядра. Затем пролонгированное высвобожденное ядро из каждой гранулы обеспечивает медленное высвобождение 5-ASA вдоль всей толстой кишки. Пример 11. Влияние прогностических факторов на поддержание ремиссии язвенного колита у пациентов после лечения гранулами мезаламина в дозе 1,5 г 1 раз в сутки. В данном примере исследовали потенциальный эффект прогностических факторов в отношении рецидива ЯК и защитного действия гранулированного мезаламина по сравнению с плацебо, с использованием обобщенных данных клинических испытаний, описанных выше в данном контексте. В данном примере ремиссию определяли как сумму следующих показателей в баллах ИАБ: данные ректороманоскопии (индекс внешнего вида слизистой оболочки) по шкале от 0 до 1 балла и ректальное кровотечение = 0. Результаты представлены в табл. 13 и 14. Таблица 13 Анализ прогностических факторов в отношении поддержания ремиссии ЯК Таблица 14 Анализ прогностических факторов в отношении поддержания ремиссии ЯК Как представлено в табл. 13 и 14, при введении гранулированного мезаламина в дозе 1,5 г один раз в сутки наблюдается значительное улучшение защитных свойств, при продолжительном поддержании ремиссии ЯК в течение 6 месяцев лечения после учета прогностических факторов. Полученные данные свидетельствуют о том, что наиболее значимым прогностическим фактором является индекс внешнего вида слизистой оболочки в исходном состоянии. Эквиваленты. Специалист в данной области может оценить или провести стандартные эксперименты с целью оптимизации конкретных вариантов осуществления изобретения, описанных в данном документе. Такие эквиваленты включены в объем следующих пунктов формулы изобретения. Включение документов в качестве ссылок. Содержание всех ссылок, патентов, заявок на выдачу патентов и опубликованных патентов, цитированных в настоящем описании изобретения, в полном объеме включено в данное описание в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ поддержания ремиссии язвенного колита у пациентов, включающий введение пациенту один раз в день утром без приема пищи четырех капсул в желатиновой оболочке, содержащих 0,375 г дозы лекарственной формы гранулированного мезаламина с замедленным и пролонгированным высвобождением, где гранулированная форма мезаламина включает внутреннее ядро из полимерной матрицы,содержащее месаламин, которое окружено внешним слоем с ароматизаторами, промежуточным слоем и внутренним энтеросолюбильным слоем с рН-зависимым высвобождением, где внутренний слой растворяется при рН приблизительно 6, но при этом является устойчивым к растворению в желудке, причем этот способ поддерживает ремиссию язвенного колита у пациента в течение периода не менее 6 месяцев,указанная лекарственная форма не вводится совместно с антацидами,а ремиссия определяется по модифицированному индексу активности заболевания по Сатерленду(ИАБ) в баллах 0 или 1; и где от 85 до 90% месаламина достигает терминального отдела подвздошной кишки и толстой кишки. 2. Способ по п.1, при котором замедленное и пролонгированное высвобождение включает высвобождение месаламина в подвздошной кишке и продолжение высвобождения месаламина в терминальном отделе подвздошной кишки и в толстой кишке. 3. Способ по п.1 или 2 для применения у пациентов в возрасте 18 лет и старше.
МПК / Метки
МПК: A01N 37/36
Метки: поддержания, колита, ремиссии, язвенного, пациентов, способ
Код ссылки
<a href="https://eas.patents.su/25-22886-sposob-podderzhaniya-remissii-yazvennogo-kolita-u-pacientov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ поддержания ремиссии язвенного колита у пациентов</a>
Предыдущий патент: Устройство отображения
Следующий патент: Способ и система получения информации о нелинейных свойствах горных пород с помощью формирования луча акустической энергии
Случайный патент: Устройство для хранения сжиженного газа (варианты)