Оксазин(ти)оновые соединения в качестве фунгицидов
Номер патента: 6634
Опубликовано: 24.02.2006
Авторы: Гипзер Андреас, Розе Инго, Райнхаймер Йоахим, Лоренц Гизела, Аммерманн Эберхард, Шивекк Франк, Шэфер Петер, Гроте Томас, Штратманн Зигфрид, Спикман Джон-Брайан
Формула / Реферат
1. Оксазин(ти)оновые соединения общей формулы I

в которой переменные Z, A, n, R1, R2 и R3 имеют следующие значения:
Z обозначает кислород,
A обозначает аннелированное бензольное кольцо,
n обозначает 0 или 1,
R1 обозначает C1-C6алкил, необязательно замещенный C1-C4алкоксигруппой или C3-C8циклоалкилом, C2-C6алкенил, C1-C6галогеналкил или C2-C6галогеналкенил,
R2 обозначает C1-C3алкил или циклопропилметил,
R3 обозначает галоген, C1-C6алкил или C1-C6алкоксигруппу,
а также приемлемые для сельского хозяйства соли этих оксазин(ти)оновых соединений формулы I.
2. Соединения по п.1, где R1 обозначает C1-C6алкил, C2-C6алкенил, C1-C6галогеналкил, C2-C6галогеналкенил, C1-C4алкокси-C1-C4алкил или C3-C8циклоалкил-C1-C4алкил.
3. Соединения по любому из предыдущих пунктов, где n обозначает 1.
4. Соединения по любому из предыдущих пунктов, где R3 обозначает C1-C4алкил или галоген.
5. Применение соединений формулы I и его приемлемых для сельского хозяйства солей по п.1 для борьбы с фитопатогенными грибами.
6. Средства, содержащие фунгицидно эффективное количество по меньшей мере одного соединения формулы I и/или по меньшей мере одной приемлемой для сельского хозяйства соли соединения формулы I по п.1, а также по меньшей мере один наполнитель.
7. Способ борьбы с фитопатогенными грибами, заключающийся в том, что грибы или подвергаемые опасности поражения грибами материалы, растения, семена или почву обрабатывают фунгицидно эффективным количеством по меньшей мере одного соединения формулы I по п.1 и/или соли соединения формулы I.
Текст
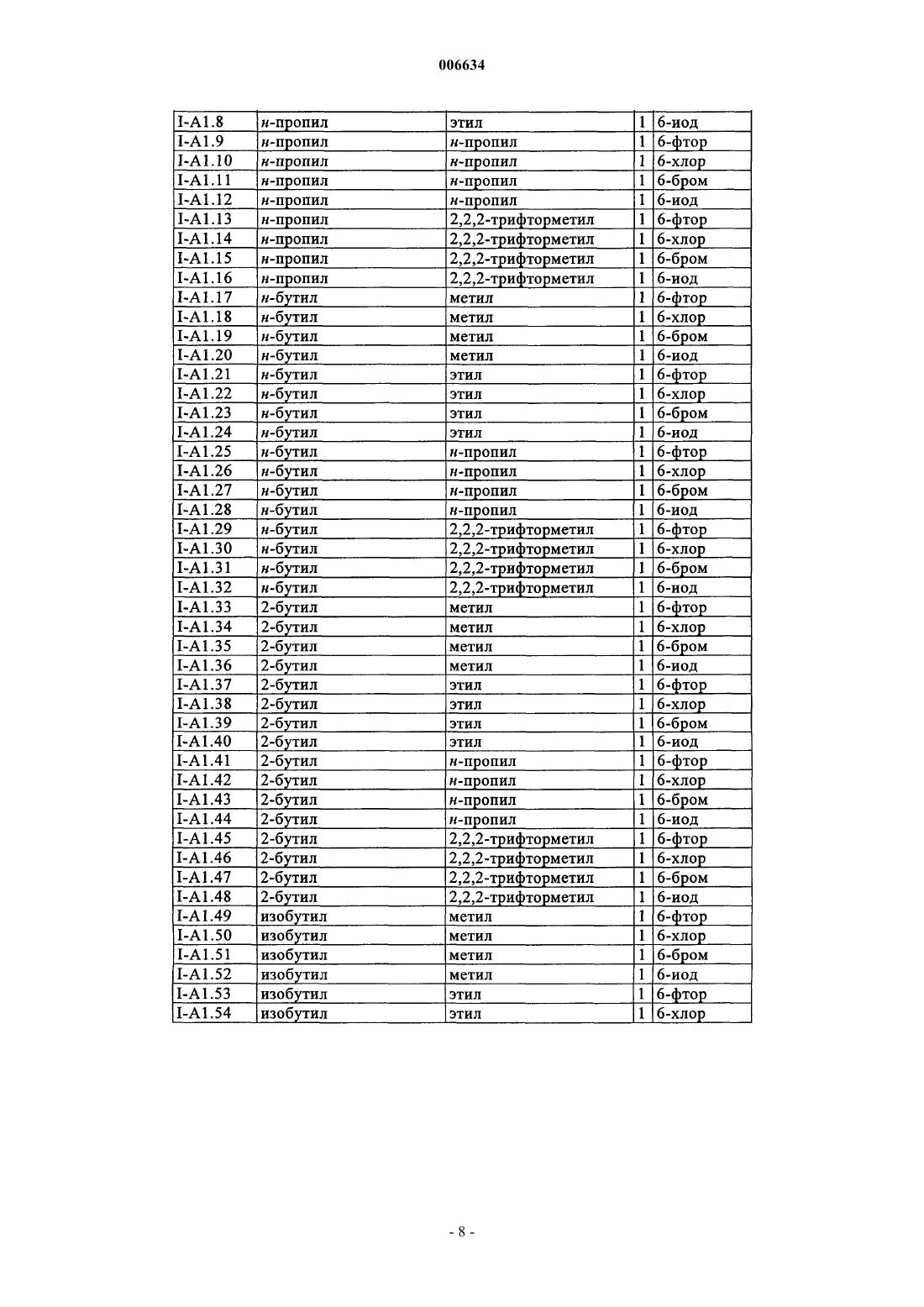
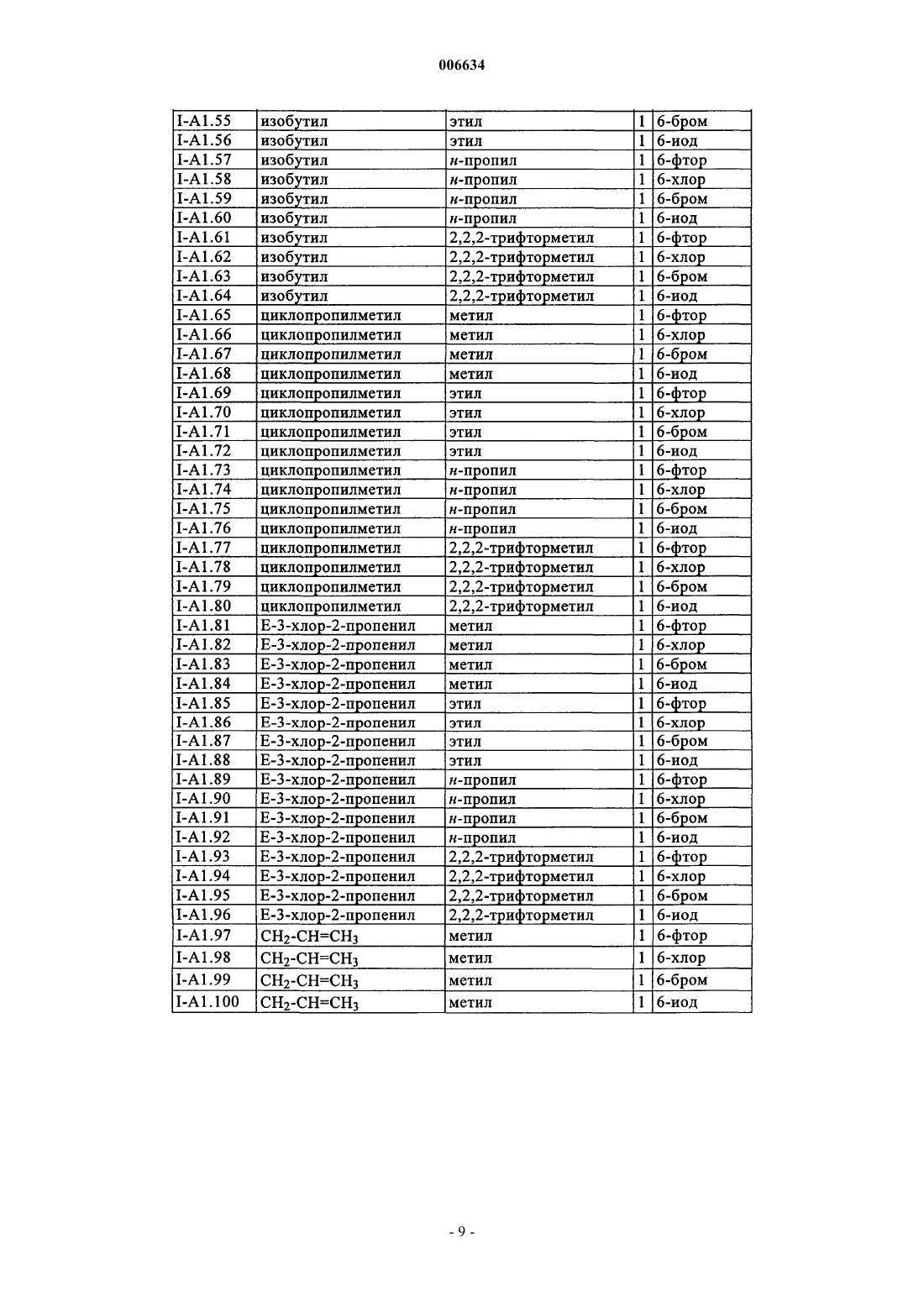
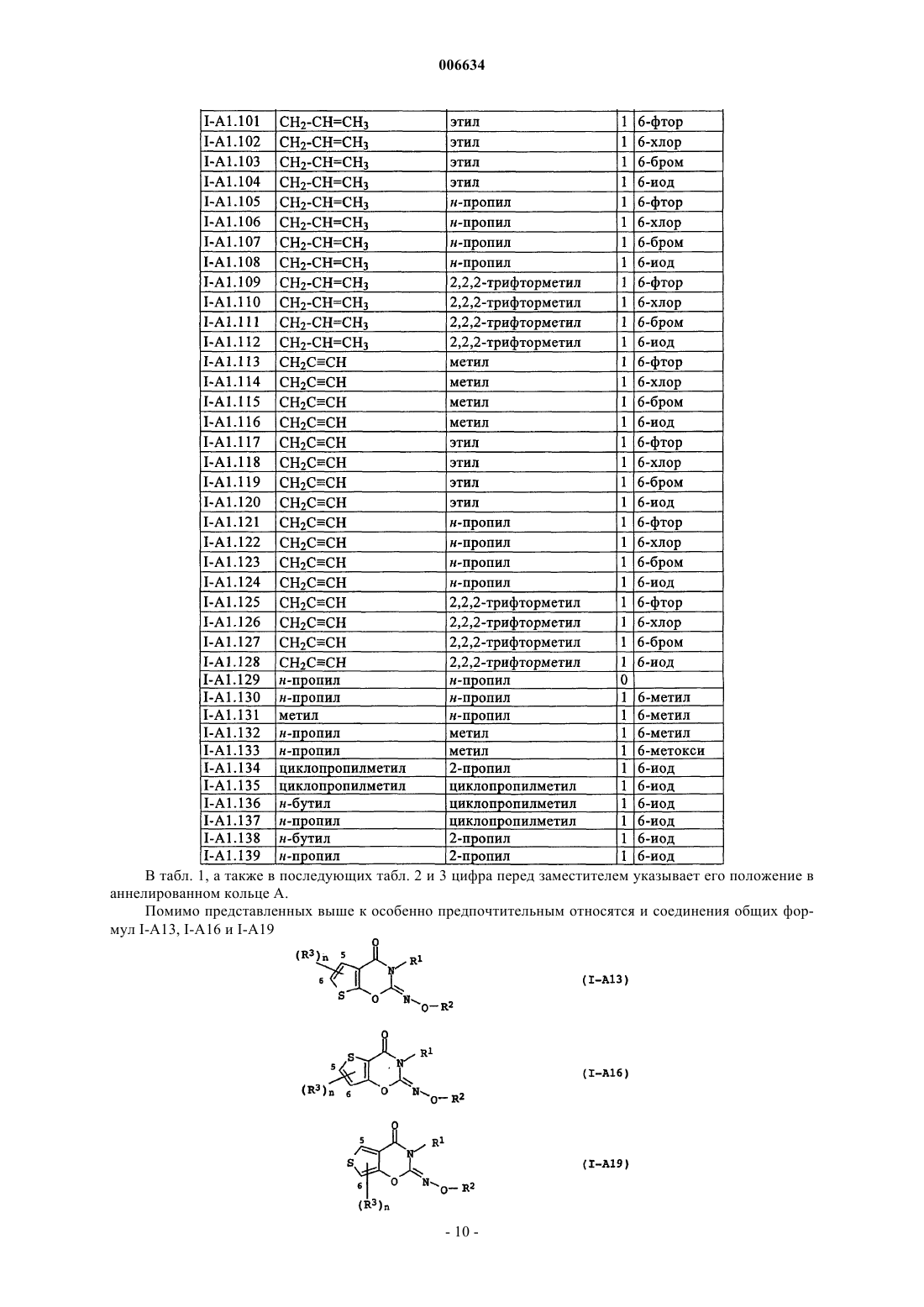
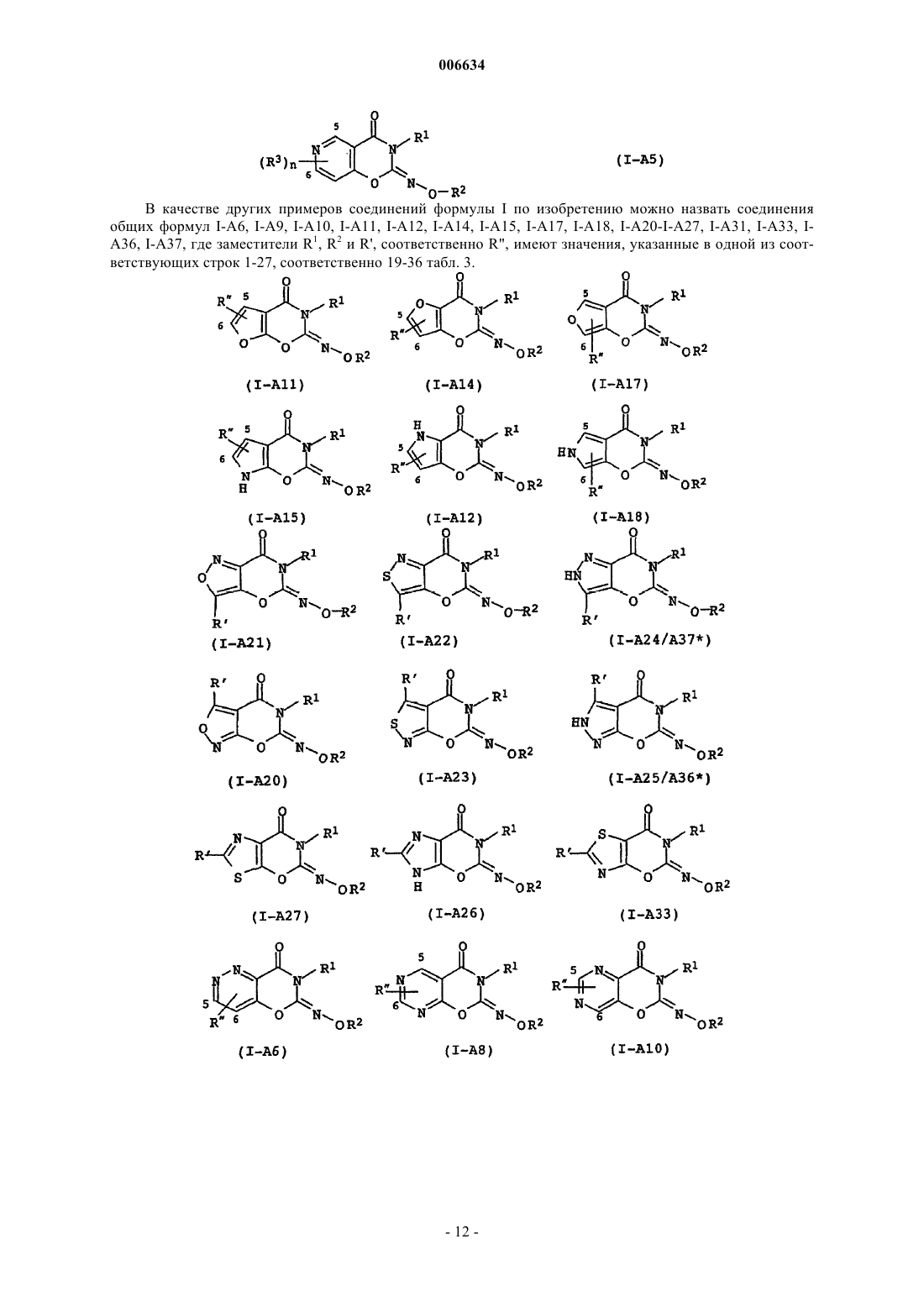
006634 Настоящее изобретение относится к новым оксазин(ти)оновым соединениям и их применению для борьбы с фитопатогенными грибами, а также к средствам борьбы с фитопатогенными грибами, содержащим фунгицидно эффективное количество этих оксазин(ти)оновых соединений. Из заявки DE-A 2218301 известны обладающие фунгицидным действием бензо-1-окса-3-азин-4-оны и бензо-1-тиа-3-азин-4-оны, которые в положении 2 содержат трифторметилиминогруппу. Из заявки WO 00/51992 известны обладающие фунгицидным действием азиноновые соединения формул А и В где Q обозначает кислород или серу, Z обозначает кислород, серу или N-алкилиминогруппу, G обозначает аннелированное бензольное кольцо или аннелированный ароматический гетероцикл и где R1 и R2 обозначают, в частности, необязательно замещенный алкил. Однако такие свойства этих известных из уровня техники фунгицидов на основе оксазинонов как не вполне удовлетворительная активность и/или избирательность действия по отношению к фитопатогенным грибам требуют безусловного совершенствования. Исходя из вышеизложенного в основу настоящего изобретения была положена задача предложить новые фунгициды, которые позволяли бы более эффективно бороться с фитопатогенными грибами, чем это было возможно до настоящего времени. При создании изобретения предусматривалось, в частности,что новые фунгициды должны обладать высокой активностью по отношению к фитопатогенным грибам. Указанная задача решается согласно изобретению благодаря оксазин(ти)оновым соединениям приведенной ниже общей формулы I. Изобретение относится в соответствии с этим к оксазин(ти)оновым соединениям общей формулы IZ обозначает кислород,А обозначает аннелированное бензольное кольцо,n обозначает 0 или 1,R1 обозначает C1-С 6 алкил, необязательно замещенный С 1-С 4 алкоксигруппой или С 3-С 8 циклоалкилом, С 2-С 6 алкенил, C1-С 6 галогеналкил или С 2-С 6 галогеналкенил,R2 обозначает C1-С 3 алкил или циклопропилметил,R3 обозначает галоген, C1-С 6 алкил или C1-С 6 алкоксигруппу,а также к приемлемым для сельского хозяйства солям этих оксазин(ти)оновых соединений формулы I. Заявленное изобретение также относится к применению соединений формулы I и их солей для борьбы с фитопатогенными грибами,к средствам, содержащим соединения формулы I и/или их соли в фунгицидно эффективном количестве, предпочтительно вместе по меньшей мере с одним носителем,к способу борьбы с фитопатогенными грибами, заключающемуся в том, что грибы или подвергаемые угрозе заражения грибами материалы, растения, семена или почву обрабатывают фунгицидно эффективным количеством по меньшей мере одного соединения формулы I по п.1 и/или соли соединения формулы I. Кроме того, в связи с заявленным изобретением обсуждаются следующие соединения общей формулы I:Z обозначает кислород или серу,А обозначает аннелированный через два С-атома с оксазин(ти)оновым кольцом 5- или 6-членный карбоцикл либо 5- или 6-членный гетероцикл с 1, 2 или 3 гетероатомами, выбранными из N, О и S,n обозначает число от 0 до 4,R1 обозначает водород, C1-С 6 алкил, C2-С 6 алкенил, C2-С 6 алкинил, каждый из которых необязательно замещен группой O-R4, C(O)O-R5, NR6R7, C(O)NR6R7, S-R8, С 3-С 8 циклоалкилом, фенилом либо 5- или 6-1 006634 членным, насыщенным либо ненасыщенным гетероциклилом с 1 -3 гетероатомами, выбранными из N, О и S, при этом фенил и гетероциклил являются необязательно одно-, дву- или тризамещенными, C1-С 6 галогеналкил, C2-С 6 галогеналкенил или C2-С 6 галогеналкинил,R2 обозначает C1-С 3 алкил, C1-С 3 галогеналкил или циклопропилметил,R3 обозначает галоген, цианогрупппу, C1-С 6 алкил, C1-С 6 галогеналкил, C1-С 6 алкоксигруппу или C1 С 6 галогеналкоксигруппу, при этомR4 и R5 независимо друг от друга обозначают водород, C1-С 6 алкил, C2-С 6 алкенил, C2-С 6 алкинил, C1 С 6 галогеналкил, C2-С 6 галогеналкенил, C2-С 6 галогеналкинил, гидрокси-C1-С 4 алкил, гидроксикарбонилC1-С 4 алкил, C1-С 4 алкокси-С 1-С 4 алкил или C1-С 4 алкоксикарбонил-C1-С 4 алкил,R6 и R7 независимо друг от друга обозначают водород, C1-С 6 алкил, C1-С 6 алкоксигруппу, C2-С 6 алкенил, C2-С 6 алкинил, C1-С 6 галогеналкил, C1-С 6 галогеналкоксигруппу, C2-С 6 галогеналкенил, C2-С 6 галогеналкинил, гидрокси-C1-С 4 алкил, гидроксикарбонил-C1-С 4 алкил, C1-С 4 алкокси-C1-С 4 алкил или C1-С 4 алкоксикарбонил-C1-С 4 алкил,R6 и R7 вместе с атомом азота, с которым они связаны, могут образовывать также 5-, 6- либо 7 членный насыщенный N-гетероцикл, который может содержать еще один гетероатом, выбранный из N,О и S, и/или может быть замещен 1-4 C1-С 6 алкильными группами,R8 обозначает C1-С 6 алкил, C2-С 6 алкенил, C2-С 6 алкинил, C1-С 6 галогеналкил, C2-С 6 галогеналкенил,C2-С 6 галогеналкинил, гидрокси-C1-С 4 алкил, гидроксикарбонил-C1-С 4 алкил, С 1-С 4 алкокси-C1-С 4 алкил илиC1-С 4 алкоксикарбонил-C1-С 4 алкил,а также приемлемые для сельского хозяйства соли этих соединений формулы I. В отношении двойной связи иминогруппы соединения формулы I могут быть представлены как в Еконфигурации, т.е. кислород оксазинонового кольца и кислород у иминного азота находятся в трансположении относительно двойной связи C=N, так и в Z-конфигурации (цис-положение кислорода оксазинонового кольца и кислорода у иминного азота). Объектом изобретения являются как Е- и Z-изомеры соединений формулы I, так и их смеси. Заместители R1-R3 могут иметь один либо несколько центров хиральности. В этих случаях они представлены в виде смесей энантиомеров или диастереомеров. Объектом изобретения являются как чистые энантиомеры или диастереомеры, так и их смеси. Указанные при раскрытии значений заместителей R1, R2, R3, R4, R5, R6, R7 и R8 либо в качестве групп в циклоалкильных, фенильных или гетероциклических кольцах органические части молекул представляют собой, как и понятие "галоген", общие понятия, используемые при конкретном названии отдельных членов групп. Все углеродные цепи, т.е. все алкильные, галогеналкильные, алкокси-, галогеналкокси-, алкоксикарбонильные, (галоген)алкенильные и (галоген)алкинильные группы, а также соответствующие члены более крупных групп, такие как фенилалкил, циклоалкилалкил, алкоксиалкил, алкоксикарбонилалкил и т.п., могут иметь прямую либо разветвленную цепь, при этом показателем Cn-Сm обозначается соответственно возможное число атомов углерода в группе. Галогенированные заместители несут предпочтительно от 1 до 5 идентичных или разных атомов галогена. Конкретно приняты среди прочих следующие обозначения: галоген представляет собой фтор, хлор, бром, иод;C1-С 3 алкил представляет собой метил, этил, н-пропил, 1-метилэтил (=изопропил);C1-С 6 алкил представляет собой указанный выше C1-С 3 алкил, а также, например, н-бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, н-гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил,1,2,2-триметилпропил, 1-этил-1-метилпропил или 1-этил-2-метилпропил, предпочтительно метил, этил,н-пропил, 1-метилэтил, н-бутил, 1,1-диметилэтил, н-пентил или н-гексил;C1-С 3 галогеналкил представляет собой указанный выше алкил с 1-3 С-атомами, частично либо полностью замещенный фтором, хлором, бромом и/или иодом, предпочтительно фтором и/или хлоромC1-С 6 галогеналкил представляет собой указанный выше алкил с 1-6, предпочтительно 1-4 С-атомами, частично либо полностью замещенный фтором, хлором, бромом и/или иодом, т.е., например, одну из вышеназванных для C1-С 3 галогеналкила групп, а также 4-фторбутил, 4-хлорбутил, 4-бромбутил, нонафторбутил, 5-фтор-1-пентил, 5-хлор-1-пентил, 5-бром-1-пентил, 5-иод-1-пентил, 5,5,5-трихлор-1-пентил,ундекафторпентил, 6-фтор-1-гексил, 6-хлор-1-гексил, 6-бром-1-гексил, 6-иод-1-гексил, 6,6,6-трихлор-1 гексил или додекафторгексил. Особенно предпочтительными среди них являются трифторметил, трихлорметил, дихлорфторметил, дифторметил, дифторхлорметил и 2,2,2-трифторэтил;-2 006634 С 1-С 4 алкоксигруппа представляет собой ОСН 3, ОС 2 Н 5, н-пропокси, ОСН(СН 3)2, н-бутокси,ОСН(СН 3)-С 2 Н 5, ОСН 2-СН(СН 3)2 или ОС(СН 3)3, предпочтительно ОСН 3, ОС 2 Н 5 или ОСН(СН 3)2;C1-С 6 алкоксигруппа представляет собой указанную выше C1-С 4 алкоксигруппу, а также н-пентил, 1 метилбутилокси, 2-метилбутилокси, 3-метилбутилокси, 2,2-диметилпропилокси, 1-этилпропилокси, нгексилокси, 1,1-диметилпропилокси, 1,2-диметилпропилокси, 1-метилпентилокси, 2-метилпентилокси, 3 метилпентилокси, 4-метилпентилокси, 1,1-диметилбутилокси, 1,2-диметилбутилокси, 1,3-диметилбутилокси, 2,2-диметилбутилокси, 2,3-диметилбутилокси, 3,3-диметилбутилокси, 1-этилбутилокси, 2-этилбутилокси, 1,1,2-триметилпропилокси, 1,2,2-триметилпропилокси, 1-этил-1-метилпропилокси или 1-этил-2 метилпропилокси, предпочтительно метокси, этокси, н-пропилокси, 1-метилэтил, н-бутокси, 1,1-диметилэтилокси, н-пентилокси или н-гексилокси;C1-С 4 галогеналкоксигруппа представляет собой указанную выше C1-С 4 алкоксигруппу, частично либо полностью замещенную фтором, хлором, бромом и/или иодом, предпочтительно фтором, т.е., например, OCH2F, OCHF2, ОСF3, ОСН 2 Сl, ОСН(Сl)2, ОС(Сl)3, хлорфторметокси, дихлорфторметокси, хлордифторметокси, 2-фторэтокси, 2-хлорэтокси, 2-бромэтокси, 2-иодэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси, 2-хлор-2-фторэтокси, 2-хлор-2,2-дифторэтокси, 2,2-дихлор-2-фторэтокси, 2,2,2-трихлорэтокси,OC2F5, 2-фторпропокси, 3-фторпропокси, 2,2-дифторпропокси, 2,3-дифторпропокси, 2-хлорпропокси, 3 хлорпропокси, 2,3-дихлорпропокси, 2-бромпропокси, 3-бромпропокси, 3,3,3-трифторпропокси, 3,3,3-трихлорпропокси, 2,2,3,3,3-пентафторпропокси, (OCF2-C2F5), 1-(СН 2F)-2-фторэтокси, 1-(СН 2 Сl)-2-хлорэтокси, 1-(СН 2 Вr)-2-бромэтокси, 4-фторбутокси, 4-хлорбутокси, 4-бромбутокси или нонафторбутокси, предпочтительно OCHF2, ОСF3, дихлорфторметокси, хлордифторметокси или 2,2,2-трифторэтокси;C1-С 6 галогеналкоксигруппа представляет собой указанную выше C1-С 6 алкоксигруппу, частично либо полностью замещенную фтором, хлором, бромом и/или иодом, предпочтительно фтором, т.е., например, одну из вышеназванных С 1-С 4 галогеналкоксигрупп, а также 5-фтор-1-пентилокси, 5-хлор-1-пентилокси, 5-бром-1-пентилокси, 5-иод-1-пентилокси, 5,5,5-трихлор-1-пентилокси, ундекафторпентилокси, 6 фтор-1-гексилокси, 6-хлор-1-гексилокси, 6-бром-1-гексилокси, 6-иод-1-гексилокси, 6,6,6-трихлор-1 гексилокси или додекафторгексилокси; фенил-C1-С 4 алкил представляет собой C1-С 4 алкил, несущий фенильное кольцо, например, бензил,1-фенилэтил, 2-фенилэтил, 1-фенилпроп-1-ил, 2-фенилпроп-1-ил, 3-фенилпроп-1-ил, 1-фенилбут-1-ил, 2 фенилбут-1-ил, 3-фенилбут-1-ил, 4-фенилбут-1-ил, 1-фенилбут-2-ил, 2-фенилбут-2-ил, 3-фенилбут-2-ил,4-фенилбут-2-ил, 1-(фенилметил)эт-1-ил, 1-(фенилметил)-1-(метил)эт-1-ил или 1-(фенилметил)проп-1 ил, предпочтительно бензил или 2-фенилэтил;C1-С 4 алкокси-C1-С 4 алкил представляет собой замещенный указанной выше C1-С 4 алкоксигруппойC1-С 4 алкил, т.е., например, СН 2-ОСН 3, CH2-OC2H5, н-пропоксиметил, СН 2-ОСН(СН 3)2, н-бутоксиметил,(1-метилпропокси)метил, (2-метилпропокси)метил, СН 2-ОС(СН 3)3, 2-(метокси)этил, 2-(этокси)этил, 2-(нпропокси)этил, 2-(1-метилэтокси)этил, 2-(н-бутокси)этил, 2-(1-метилпропокси)этил, 2-(2-метилпропокси)этил, 2-(1,1-диметилэтокси)этил, 2-(метокси)пропил, 2-(этокси)пропил, 2-(н-пропокси)пропил, 2-(1 метилэтокси)пропил, 2-(н-бутокси)пропил, 2-(1-метилпропокси)пропил, 2-(2-метилпропокси)пропил, 2(1,1-диметилэтокси)пропил, 3-(метокси)пропил, 3-(этокси)пропил, 3-(н-пропокси)пропил, 3-(1-метилэтокси)пропил, 3-(н-бутокси)пропил, 3-(1-метилпропокси)пропил, 3-(2-метилпропокси)пропил, 3-(1,1-диметилэтокси)пропил, 2-(метокси)бутил, 2-(этокси)бутил, 2-(н-пропокси)бутил, 2-(1-метилэтокси)бутил,2-(н-бутокси)бутил, 2-(1-метилпропокси)бутил, 2-(2-метилпропокси)бутил, 2-(1,1-диметилэтокси)бутил,3-(метокси)бутил, 3-(этокси)бутил, 3-(н-пропокси)бутил, 3-(1-метилэтокси)бутил, 3-(н-бутокси)бутил, 3(1-метилпропокси)бутил, 3-(2-метилпропокси)бутил, 3-(1,1-диметилэтокси)бутил, 4-(метокси)бутил, 4(этокси)бутил, 4-(н-пропокси)бутил, 4-(1-метилэтокси)бутил, 4-(н-бутокси)бутил, 4-(1-метилпропокси) бутил, 4-(2-метилпропокси)бутил или 4-(1,1-диметилэтокси)бутил, предпочтительно СН 2-ОСН 3, СН 2 ОС 2 Н 5, 2-метоксиэтил или 2-этоксиэтил; гидрокси-C1-С 4 алкил представляет собой C1-С 4 алкил, предпочтительно С 2-С 4 алкил, несущий ОНгруппу, например гидроксиметил, 2-гидроксиэт-1-ил, 2-гидроксипроп-1-ил, 3-гидроксипроп-1-ил, 1-гидроксипроп-2-ил, 2-гидроксибут-1-ил, 3-гидроксибут-1-ил, 4-гидроксибут-1-ил, 1-гидроксибут-2-ил, 1 гидроксибут-3-ил, 2-гидроксибут-3-ил, 1-гидрокси-2-метилпроп-3-ил, 2-гидрокси-2-метилпроп-3-ил или 2-гидроксиметилпроп-2-ил, прежде всего, 2-гидроксиэтил; гидроксикарбонил-С 1-С 4 алкил представляет собой C1-С 4 алкил, предпочтительно С 2-С 4 алкил, несущий СООН-группу, например гидроксикарбонилметил, 2-гидроксикарбонилэт-1-ил, 2-гидроксикарбонилпроп-1-ил, 3-гидроксикарбонилпроп-1-ил, 1-гидроксикарбонилпроп-2-ил, 2-гидроксикарбонилбут-1 ил, 3-гидроксикарбонилбут-1-ил, 4-гидроксикарбонилбут-1-ил, 1-гидроксикарбонилбут-2-ил, 1-гидроксикарбонилбут-3-ил, 2-гидроксикарбонилбут-3-ил, 1-гидроксикарбонил-2-метилпроп-3-ил, 2-гидроксикарбонил-2-метилпроп-3-ил или 2-гидроксикарбонил-1-метилпроп-2-ил, прежде всего, 2-гидроксикарбонилэтил;(C1-С 4 алкокси)карбонил-C1-С 4 алкил представляет собой замещенный (C1-С 4 алкокси)карбонилом,таким как СО-ОСН 3, СО-ОС 2 Н 5, СО-ОСН 2-С 2 Н 5, СО-ОСН(СН 3)2, н-бутоксикарбонил, СО-ОСН(СН 3)С 2 Н 5, СО-ОСН 2-СН(СН 3)2 или СО-ОС(СН 3)з, предпочтительно СО-ОСН 3 или СО-ОС 2 Н 5, C1-С 4 алкил, т.е.,например, СН 2-СО-ОСН 3, СН 2-СО-ОС 2 Н 5, СН 2-СО-ОСН 2-С 2 Н 5, СН 2-СО-ОСН(СН 3)2, н-бутоксикарбонил-3 006634 метил, СН 2-СО-ОСН(СН 3)-С 2 Н 5, СН 2-СО-ОСН 2-СН(СН 3)2, СН 2-СО-ОС(СН 3)3, 1-(СО-ОСН 3)этил, 1-(СООС 2 Н 5)этил, 1-(СО-ОСН 2-С 2 Н 5)этил, 1-[СН(СН 3)2]этил, 1-(н-бутоксикарбонил)этил, 1-[1-метилпропоксикарбонил]этил, 1-[2-метилпропоксикарбонил]этил, 2-(СО-ОСН 3)этил, 2-(СО-ОС 2 Н 5)этил, 2-(СО-ОСН 2 С 2 Н 5)этил, 2-[СО-ОСН(СН 3)2]этил, 2-(н-бутоксикарбонил)этил, 2-[1-метилпропоксикарбонил]этил, 2-[2 метилпропоксикарбонил]этил, 2-[СО-ОС(СН 3)3]этил, 2-(СО-ОСН 3)пропил, 2-(СО-ОС 2 Н 5)пропил, 2-(СООСН 2-С 2 Н 5)пропил, 2-[СО-ОСН(СН 3)2]пропил, 2-(н-бутоксикарбонил)пропил, 2-[1-метилпропоксикарбонил]пропил, 2-[2-метилпропоксикарбонил]пропил, 2-[СО-ОС(СН 3)3]пропил, 3-(СО-ОСН 3)пропил, 3-(СООС 2 Н 5)пропил, 3-(СО-ОСН 2-С 2 Н 5)пропил, 3-[СО-ОСН(СН 3)2]пропил, 3-(н-бутоксикарбонил)пропил, 3[1-метилпропоксикарбонил]пропил, 3-[2-метилпропоксикарбонил]пропил, 3-[СО-ОС(СН 3)3]пропил, 2(СО-ОСН 3)бутил, 2-(СО-ОС 2 Н 5)бутил, 2-(СО-ОСН 2-С 2 Н 5)бутил, 2-[СО-ОСН(СН 3)2]бутил, 2-(н-бутоксикарбонил)бутил, 2-[1-метилпропоксикарбонил]бутил, 2-[2-метилпропоксикарбонил]бутил, 2-[СО-ОС(СН 3)3] бутил, 3-(СО-ОСН 3)бутил, 3-(СО-ОС 2 Н 5)бутил, 3-(СО-ОСН 2-С 2 Н 5)бутил, 3-[СО-ОСН(СН 3)2]бутил, 3-(нбутоксикарбонил)бутил, 3-[1-метилпропоксикарбонил] бутил, 3-[2-метилпропоксикарбонил]бутил, 3[СО-ОС(СН 3)3]бутил, 4-(СО-ОСН 3)бутил, 4-(СО-ОС 2 Н 5)бутил, 4-(СО-ОСН 2-С 2 Н 5)бутил, 4-[СО-ОСН(СН 3)2]бутил, 4-(н-бутоксикарбонил)бутил, 4-[1-метилпропоксикарбонил]бутил, 4-[2-метилпропоксикарбонил]бутил или 4-[СО-ОС(СН 3)з]бутил, предпочтительно СН 2-СО-ОСН 3, СН 2-СО-ОС 2 Н 5, 1-(СО-ОСН 3) этил или 1-(СО-ОС 2 Н 5)этил; С 2-С 6 алкенил представляет собой прямоцепочечные либо разветвленные углеводородные группы с 2-6, предпочтительно 3-4, атомами углерода и двойной связью в любом положении, например этенил(винил), проп-1-ен-1-ил, аллил, 1-метилэтенил, 1-бутен-1-ил, 1-бутен-2-ил, 1-бутен-3-ил, 2-бутен-1-ил, 1 метилпроп-1-ен-1-ил, 2-метилпроп-1-ен-1-ил, 1-метилпроп-2-ен-1-ил, 2-метилпроп-2-ен-1-ил, н-пентен-1 ил, н-пентен-2-ил, н-пентен-3-ил, н-пентен-4-ил, 1-метилбут-1-ен-1-ил, 2-метилбут-1-ен-1-ил, 3-метилбут-1-ен-1-ил, 1-метилбут-2-ен-1-ил, 2-метилбут-2-ен-1-ил, 3-метилбут-2-ен-1-ил, 1-метилбут-3-ен-1-ил,2-метилбут-3-ен-1-ил, 3-метилбут-3-ен-1-ил, 1,1-диметилпроп-2-ен-1-ил, 1,2-диметилпроп-1-ен-1-ил, 1,2 диметилпроп-2-ен-1-ил, 1-этилпроп-1-ен-2-ил, 1-этилпроп-2-ен-1-ил, н-гекс-1-ен-1-ил, н-гекс-2-ен-1-ил,н-гекс-3-ен-1-ил, н-гекс-4-ен-1-ил, н-гекс-5-ен-1-ил, 1-метилпент-1-ен-1-ил, 2-метилпент-1-ен-1-ил, 3-метилпент-1-ен-1-ил, 4-метилпент-1-ен-1-ил, 1-метилпент-2-ен-1-ил, 2-метилпент-2-ен-1-ил, 3-метилпент-2 ен-1-ил, 4-метилпент-2-ен-1-ил, 1-метилпент-3-ен-1-ил, 2-метилпент-3-ен-1-ил, 3-метилпент-3-ен-1-ил, 4 метилпент-3-ен-1-ил, 1-метилпент-4-ен-1-ил, 2-метилпент-4-ен-1-ил, 3-метилпент-4-ен-1-ил, 4-метилпент-4-ен-1-ил, 1,1-диметилбут-2-ен-1-ил, 1,1-диметилбут-3-ен-1-ил, 1,2-диметилбут-1-ен-1-ил, 1,2-диметилбут-2-ен-1-ил, 1,2-диметилбут-3-ен-1-ил, 1,3-диметилбут-1-ен-1-ил, 1,3-диметилбут-2-ен-1-ил, 1,3-диметилбут-3-ен-1-ил, 2,2-диметилбут-3-ен-1-ил, 2,3-диметилбут-1-ен-1-ил, 2,3-диметилбут-2-ен-1-ил, 2,3 диметилбут-3-ен-1-ил, 3,3-диметилбут-1-ен-1-ил, 3,3-диметилбут-2-ен-1-ил, 1-этилбут-1-ен-1-ил, 1-этилбут-2-ен-1-ил, 1-этилбут-3-ен-1-ил, 2-этилбут-1-ен-1-ил, 2-этилбут-2-ен-1-ил, 2-этилбут-3-ен-1-ил, 1,1,2 триметилпроп-2-ен-1-ил, 1-этил-1-метилпроп-2-ен-1-ил, 1-этил-2-метилпроп-1-ен-1-ил или 1-этил-2-метилпроп-2-ен-1-ил; С 2-С 6 алкинил представляет собой прямоцепочечные либо разветвленные углеводородные группы с 2-6, предпочтительно 3-4, атомами углерода и тройной связью в любом положении, например этинил иC3-С 6 алкинил, такой как проп-1-ин-1-ил, проп-2-ин-1-ил, н-бут-1-ин-1-ил, н-бут-1-ин-3-ил, н-бут-1-ин-4 ил, н-бут-2-ин-1-ил, н-пент-1-ин-1-ил, н-пент-1-ин-3-ил, н-пент-1-ин-4-ил, н-пент-1-ин-5-ил, н-пент-2-ин 1-ил, н-пент-2-ин-4-ил, н-пент-2-ин-5-ил, 3-метилбут-1-ин-3-ил, 3-метилбут-1-ин-4-ил, н-гекс-1-ин-1-ил,н-гекс-1-ин-3-ил, и-гекс-1-ин-4-ил, н-гекс-1-ин-5-ил, н-гекс-1-ин-6-ил, н-гекс-2-ин-1-ил, н-гекс-2-ин-4-ил,н-гекс-2-ин-5-ил, н-гекс-2-ин-6-ил, н-гекс-3-ин-1-ил, н-гекс-3-ин-2-ил, 3-метилпент-1-ин-1-ил, 3-метилпент-1-ин-3-ил, 3-метилпент-1-ин-4-ил, 3-метилпент-1-ин-5-ил, 4-метилпент-1-ин-1-ил, 4-метилпент-2 ин-4-ил или 4-метилпент-2-ин-5-ил, предпочтительно проп-2-ин-1-ил; С 2-С 6 галогеналкенил представляет собой указанный выше C2-С 6 алкенил, предпочтительно C3-С 4 алкенил, частично либо полностью, предпочтительно одно-, дву- или тризамещенный галогеном, прежде всего, фтором, хлором и/или бромом, т.е., например, 2-хлорвинил, 2-хлораллил, Е- и Z-3-хлораллил, Е- иZ-3-бромаллил, Е- и Z-2,3-дибромаллил, 3,3-дибромаллил, 2,3,3-трибромаллил, а также Е- и Z-2,3-дибромбут-2-енил; С 2-С 6 галогеналкинил представляет собой указанный выше C2-С 6 алкинил, предпочтительно C3 С 4 алкинил, частично либо полностью, предпочтительно одно-, дву- или тризамещенный галогеном, прежде всего, фтором, хлором и/или бромом, т.е., например, 1,1-дифторпроп-2-ин-1-ил, 1,1-дифторбут-2-ин 1-ил, 4-фторбут-2-ин-1-ил, 4-хлорбут-2-ин-1-ил, 5-фторпент-3-ин-1-ил или 6-фторгекс-4-ин-1-ил;C3-С 8 циклоалкил представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил;C3-С 8 циклоалкил-C1-С 4 алкил представляет собой C1-С 4 алкил, несущий C3-С 8 циклоалкильную группу, например циклопропилметил, 1-циклопропилэтил, 2-циклопропилэтил, 1-циклопропилпроп-1-ил, 2 циклопропилпроп-1-ил, 3-циклопропилпроп-1-ил, 1-циклопропилбут-1-ил, 2-циклопропилбут-1-ил, 3 циклопропилбут-1-ил, 4-циклопропилбут-1-ил, 1-циклопропилбут-2-ил, 2-циклопропилбут-2-ил, 3-циклопропилбут-2-ил, 3-циклопропилбут-2-ил, 4-циклопропилбут-2-ил, 1-(циклопропилметил)эт-1-ил, 1-4 006634N, O и S, можно назвать ненасыщенный, прежде всего, ароматический гетероциклил, например фурил, такой как 2-фурил и 3-фурил, тиенил, такой как 2-тиенил и 3-тиенил, пирролил, такой как 2-пирролил и 3-пирролил, изоксазолил, такой как 3-изоксазолил, 4-изоксазолил и 5-изоксазолил, изотиазолил, такой как 3-изотиазолил, 4 изотиазолил и 5-изотиазолил, пиразолил, такой как 3-пиразолил, 4-пиразолил и 5-пиразолил, оксазолил,такой как 2-оксазолил, 4-оксазолил и 5-оксазолил, тиазолил, такой как 2-тиазолил, 4-тиазолил и 5-тиазолил, имидазолил, такой как 2-имидазолил и 4-имидазолил, оксадиазолил, такой как 1,2,4-оксадиазол-3 ил, 1,2,4-оксадиазол-5-ил и 1,3,4-оксадиазол-2-ил, тиадиазолил, такой как 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил и 1,3,4-тиадиазол-2-ил, триазолил, такой как 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил и 1,2,4 триазол-4-ил, пиридинил, такой как 2-пиридинил, 3-пиридинил и 4-пиридинил, пиридазинил, такой как 3-пиридазинил и 4-пиридазинил, пиримидинил, такой как 2-пиримидинил, 4-пиримидинил и 5-пиримидинил, кроме того, 2-пиразинил, 1,3,5-триазин-2-ил и 1,2,4-триазин-3-ил, прежде всего, пиридил, пиримидил, фуранил и тиенил; насыщенный гетероциклил, например тетрагидрофуран-2-ил, тетрагидрофуран-3-ил, тетрагидротиофен-2-ил, тетрагидротиофен-3-ил, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, 1,3-диоксолан-2-ил, 1,3-диоксолан-4-ил, 1,3-оксатиолан-2-ил, 1,3-оксатиолан-4-ил, 1,3-оксатиолан-5-ил, 1,3-оксазолидин-2-ил, 1,3-оксазолидин-3-ил, 1,3-оксазолидин-4-ил, 1,3-оксазолидин-5-ил, 1,2-оксазолидин-2-ил,1,2-оксазолидин-3-ил, 1,2-оксазолидин-4-ил, 1,2-оксазолидин-5-ил, 1,3-дитиолан-2-ил, 1,3-дитиолан-4-ил,пирролидин-1-ил, пирролидин-2-ил, пирролидин-5-ил, тетрагидропиразол-1-ил, тетрагидропиразол-3-ил,тетрагидропиразол-4-ил, тетрагидропиран-2-ил, тетрагидропиран-3-ил, тетрагидропиран-4-ил, тетрагидротиопиран-2-ил, тетрагидротиопиран-3-ил, тетрагидротиопиран-4-ил, пиперидин-1 -ил, пиперидин-2-ил,пиперидин-3-ил, пиперидин-4-ил, 1,3-диоксан-2-ил, 1,3-диоксан-4-ил, 1,3-диоксан-5-ил, 1,4-диоксан-2 ил, 1,3-оксатиан-2-ил, 1,3-оксатиан-4-ил, 1,3-оксатиан-5-ил, 1,3-оксатиан-6-ил, 1,4-оксатиан-2-ил, 1,4-оксатиан-3-ил, морфолин-2-ил, морфолин-3-ил, морфолин-4-ил, гексагидропиридазин-1-ил, гексагидропиридазин-3-ил, гексагидропиридазин-4-ил, гексагидропиримидин-1-ил, гексагидропиримидин-2-ил, гексагидропиримидин-4-ил, гексагидропиримидин-5-ил, пиперазин-1-ил, пиперазин-2-ил, пиперазин-3-ил,гексагидро-1,3,5-триазин-1-ил и гексагидро-1,3,5-триазин-2-ил. Заместители у фенила, соответственно у гетероциклила, обычно выбраны из группы, включающей галоген, С 1-С 4 алкил, С 1-С 4 галогеналкил, С 1-С 4 алкоксигруппу, С 1-С 4 галогеналкоксигруппу, метилендиоксигруппу, CN и С 1-С 4 алкилкарбонил. В формуле I переменная А, соответственно структурный элемент обозначает аннелированный через два С-атома с оксазин(ти)оновым кольцом 5-или 6-членный карбоцикл либо 5- или 6-членный гетероцикл с 1, 2 или 3 гетероатомами, выбранными из N, О и S. В представленном графическом изображении переменной А обеими звездочкамиобозначены положения тех-5 006634 С-атомов, которые являются общими для оксазин(ти)онового кольца и аннелированного с ним кольца. В качестве примеров аннелированных 5- или 6-членных карбоциклов наряду с бензолом можно назвать также циклогексен, 1,3-и 1,4-циклогександиен и циклопентен. В качестве примеров аннелированных 5 или 6-членных гетероциклов можно назвать вышеуказанные гетероароматические группы, содержащие два соседних углеродных члена цикла, а также их ди- или тетрагидропроизводные, которые содержат по меньшей мере еще одну двойную углерод-углеродную связь, например пиридин, пиразин, пиридазин,пиримидин, фуран, дигидрофуран, тиофен, диоксид тиофена, 2,3- и 2,5-дигидротиофен, диоксид 2,3- и 2,5-дигидротиофена, пиррол, дигидропиррол, 1,3-диоксолан, изоксазол, оксазол, 2,3-дигидрооксазол,изотиазол, тиазол, пиразол, пиразолин, имидазол, 2,3-дигидроимидазол, 1,2,3-триазол, 1,1-диоксо-2,3-дигидроизотиазол, 2,3-дигидро-1,4-диоксин, 2,3-дигидро-1,4-оксазин, 2,4-, соответственно 2,6-дигидро-1,3 оксазин, 2,3-дигидро-1,4-тиазин и 2,4-дигидро-1,3-тиазин. Предпочтительные аннелированные кольца А являются ароматическими и выбраны, прежде всего,из группы представленных ниже колец формул А 1-А 37 При этом соответственно кольца А 24 и А 37, А 25 и А 36, а также А 26 и А 31 являются таутомерами относительно друг друга. В предлагаемых согласно изобретению соединениях общей формулы I кольца А, например А 1-А 37,могут быть незамещенными или же, в зависимости от числа свободных валентностей, иметь 1, 2, 3 или 4,предпочтительно 1 или 2, идентичных либо отличных друг от друга заместителя R3. Количество заместителей R3 при этом указывает индекс n. В кольцах формул А 12, А 15, А 18, А 24, А 25, А 26, А 31, А 36 и А 37-6 006634 расположенный у азота атом водорода также может быть заменен на заместитель R3, который в этом случае представляет собой алкил или галогеналкил. Предпочтительно 6-членные кольца А, такие как бензол или пиридин, несут в положении 6 (метаположение относительно атома углерода, несущего группу C=Z) заместитель R3, при условии, что в этом положении отсутствует гетероатом. С учетом фунгицидной эффективности соединений формулы I заместители Z, R1, R2, R3 и индекс n независимо друг от друга, предпочтительно, однако, в комбинации друг с другом, имеют следующие значения:Z обозначает кислород,R1 представляет собой С 1-С 6 алкил, С 2-С 6 алкенил, С 1-С 6 галогеналкил, С 2-С 6 галогеналкенил, С 1-С 6 алкил, замещенный группой OR4 или С 3-С 8 циклоалкил-С 1-С 4 алкилом, при этом R4 имеет указанные выше значения и представляет собой, прежде всего, С 1-С 4 алкил, а R1 представляет собой, прежде всего, С 3 С 6 алкил, С 3-С 4 алкенил, С 3-С 4 алкинил или С 3-С 6 циклоалкилметил,R2 представляет собой С 1-С 3 алкил, С 1-С 3 фторалкил, С 1-С 3 фтор/хлоралкил или циклопропилметил,R3 представляет собой С 1-С 4 алкил, прежде всего, метил, С 1-С 4 галогеналкил, прежде всего, дифторметил, трифторметил или 2,2,2-трифторэтил, С 1-С 4 галогеналкоксигруппу, прежде всего, дифторметоксигруппу, или особенно предпочтительно галоген, наиболее предпочтительно хлор, бром или иод,n обозначает 1, 2, 3 или 4, прежде всего, 1 или 2. Аннелированный цикл А выбран, прежде всего, из группы, включающей бензол (формула А 1), пиридин (формулы А 2-А 5) и тиофен (формулы А 13, А 16 и А 19). Если R1 представляет собой замещенный группой COOR5 алкил, алкенил или алкинил, то R5 обозначает предпочтительно С 1-С 4 алкил. Если R1 представляет собой замещенный группой C(O)NR6R7 С 1 С 6 алкил, -алкенил или -алкинил, то R6 обозначает предпочтительно водород или С 1-С 4 алкил, а R7 обозначает предпочтительно водород. Если R1 представляет собой замещенный группой NR6R7 С 1-С 6 алкил,-алкенил или -алкинил, то R6 и R7 независимо друг от друга обозначают предпочтительно водород или С 1-С 4 алкил либо R6 и R7 вместе с атомом азота, с которым они связаны, образуют морфолиновое, пиперидиновое, пиперазиновое или пирролидиновое кольцо. Если R1 представляет собой замещенный группой SR8 С 1-С 6 алкил, -алкенил или -алкинил, то R8 обозначает предпочтительно С 1-С 4 алкил. К особенно предпочтительным соединениям формулы I относятся соединения общей формулы I-A1R1 представляет собой С 1-С 6 алкил, С 2-С 6 алкенил, С 1-С 6 галогеналкил, С 2-С 6 галогеналкенил, С 1-С 4 алкокси-С 1-С 4 алкил или С 3-С 6 циклоалкил-С 1-С 4 алкил, прежде всего, С 3-С 6 алкил, С 3-С 4 алкенил, С 3-С 4 галогеналкенил, С 1-С 4 алкоксиалкил и С 3-С 6 циклоалкилметил,R2 представляет собой С 1-С 3 алкил или С 1-С 3 галогеналкил,R3 представляет собой С 1-С 4 алкил, С 1-С 4 галогеналкил, прежде всего дифторметил, трифторметил или 2,2,2-трифторэтил, С 1-С 4 галогеналкоксигруппу, прежде всего, дифторметоксигруппу, или особенно предпочтительно галоген, наиболее предпочтительно хлор, бром или иод,n обозначает 1 или 2. Особенно предпочтительными являются соединения формулы I-A1, в которых один из заместителей R3 находится в положении 6. К особенно предпочтительным относятся также такие соединения формулы I-A1, в которых R2 представляет собой циклопропилметил, а R1, R3 и n имеют указанные выше значения. В качестве примеров наиболее предпочтительных соединений формулы I-A1 можно назвать соединения I-A1.1 - I-A1.128, где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке нижеприведенной табл. 1. Таблица 1 В табл. 1, а также в последующих табл. 2 и 3 цифра перед заместителем указывает его положение в аннелированном кольце А. Помимо представленных выше к особенно предпочтительным относятся и соединения общих формул I-A13, I-A16 и I-A19R1 представляет собой С 1-С 6 алкил, С 2-С 6 алкенил, С 1-С 6 галогеналкил, С 2-С 6 галогеналкенил, С 1-С 4 алкокси-С 1-С 4 алкил или С 3-С 6 циклоалкил-С 1-С 4 алкил, прежде всего, С 3-С 6 алкил, С 3-С 4 алкенил, С 3-С 4 галогеналкенил, С 1-С 4 алкоксиалкил и С 3-С 6 циклоалкилметил,R2 представляет собой С 1-С 3 алкил или С 1-С 3 галогеналкил,R3 представляет собой С 1-С 4 алкил, прежде всего, метил, С 1-С 4 галогеналкил, прежде всего, дифторметил, трифторметил или 2,2,2-трифторэтил, С 1-С 4 галогеналкоксигруппу, прежде всего, дифторметоксигруппу, или особенно предпочтительно галоген, наиболее предпочтительно хлор, бром или иод,n обозначает 1 или 2. Особенно предпочтительными являются также такие соединения формул I-A13, I-A16 и I-A19, в которых R2 представляет собой циклопропилметил, а R1, R3 и n имеют указанные выше значения. В качестве примеров особенно предпочтительных соединений общих формул I-A13, I-A16 и I-A19 можно назвать соединения, где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке табл. 2 (соединения I-A13.1-I-A13.18, I-A16.1-I-A16.18 и I-A19.1-I-A19.18). Таблица 2 В качестве примеров предпочтительных соединений формулы I можно назвать далее соединения общих формул I-A2 (соединения I-A2.1-I-A2.18), где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке табл. 2. В качестве примеров предпочтительных соединений формулы I можно назвать далее соединения общих формул I-A3 (соединения I-A3.1-I-A3.18), где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке табл. 2. В качестве примеров предпочтительных соединений формулы I можно назвать далее соединения общих формул I-A4 (соединения I-A4.1 - I-A4.18), где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке табл. 2. В качестве примеров предпочтительных соединений формулы I можно назвать далее соединения общих формул I-A5 (соединения I-A5.1 - I-A5.18), где заместители R1, R2 и R3 имеют значения, указанные в соответствующей строке табл. 2. В качестве других примеров соединений формулы I по изобретению можно назвать соединения общих формул I-A6, I-A9, I-A10, I-A11, I-A12, I-A14, I-A15, I-A17, I-A18, I-A20-I-A27, I-A31, I-A33, IA36, I-A37, где заместители R1, R2 и R', соответственно R", имеют значения, указанные в одной из соответствующих строк 1-27, соответственно 19-36 табл. 3. Оксазиноновые соединения формулы I можно получать аналогично одному из описанных в литературе способов (см. сборники Chemische Berichte, том 97, с. 3012 (1964), том 98, с. 144 (1965, представленному на схеме 1. Переменные R1, R2, R3, n и А на этой схеме 1 имеют указанные выше значения, a Y обозначает нуклеофильно вытесняемую уходящую группу. Схема 1- 13006634 В этих целях 2-гидроксииминооксазиноны общей формулы II последовательно алкилируют с получением в результате соединений формулы I. Если R1 и R2 имеют идентичные значения, то алкилирование можно осуществлять по одностадийному механизму. В противном случае алкилирование осуществляют в две последовательно проводимых стадии. Обычно сначала взаимодействием соединений формулы II с алкилирующим агентом R1-Y осуществляют алкилирование по атому кольцевого азота соединения II, после чего атакуется атом кислорода гидроксииминогруппы (показано на схеме 1). В зависимости от особенностей используемых веществ и условий реакции указанные стадии можно проводить в обратной последовательности, получая сначала оксазиноновые соединения формулы I, где R1 обозначает Н, a Z обозначает О, которые затем алкилируют с помощью алкилирующего агента R1-Y с получением соединения формулы I, где R1 не обозначает Н, а Z обозначает О (на схеме 1 не показано). Специалисты в данной области с помощью простых предварительных опытов могут сами легко определить, в какой именно последовательности следует работать для получения соединения формулы I. В качестве алкилирующих агентов могут рассматриваться соединения, в которых R1, соответствен 2 но R , связаны с соответствующей, т.е. нуклеофильно вытесняемой, уходящей группой. Из числа обычных в таких случаях уходящих групп можно назвать среди прочих хлор, бром, иод, метилсульфонилокси-, фенилсульфонилокси-, толуолсульфонилокси- и трифторметилсульфонилоксигруппу. Как правило,алкилирующий агент используют, по меньшей мере, в требуемых стехиометрических, т.е. в эквимолярных, количествах, предпочтительно в количестве 1-2 моля на моль соединения формулы II, соответственно III. Летучие алкилирующие агенты можно использовать также в большем избытке. Если R1 и R2 идентичны и алкилирование кольцевого азота и гидроксильной функциональной группы предусматривается инициировать одновременно, то на моль соединения формулы II целесообразно использовать соответственно по меньшей мере 2 моля алкилирующего агента. Процесс алкилирования предпочтительно проводить в присутствии соответствующего основания. В качестве такого основания пригодны, в принципе, все основные соединения, способные депротонировать амидную группу или гидроксильную группу гидроксииминофункции соединения формулы II или III. К ним относятся алкоголяты, амиды, гидриды, гидроксиды, карбонаты и гидрокарбонаты щелочных или щелочно-земельных металлов, прежде всего лития, калия, натрия или кальция. Примерами подобных соединений являются натриевые или кальциевые алкоголяты метанола, этанола, н-пропанола, изопропанола, н-бутанола и трeт-бутанола, а также гидрид натрия, гидрид кальция, амид натрия, амид калия, карбонат натрия, карбонат калия, карбонат цезия, карбонат кальция, гидрокарбонат натрия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидроксид лития и диизопропиламид лития. Приемлемы далее третичные амины, такие как триэтиламин, пиридин и пр. Кроме того, пригодными для использования являются металлоорганические соединения лития, такие как метиллитий, н-бутиллитий, н-гексиллитий,фениллитий, или соединения Гриньяра, например метана, этана, бутана, гексана, циклогексана или бензола. Основание предпочтительно применять, по меньшей мере, в эквимолярном количестве в пересчете на соединение формулы II, соответственно III. Молярное соотношение между основанием (рассчитанное как эквиваленты основания) и соединением формулы II, соответственно III, составляет при этом, прежде всего, от 1:1 до 1:5. Третичные амины могут использоваться также в большем избытке, например в качестве растворителей или сорастворителей. Реакцию предпочтительно проводить в органическом растворителе. В качестве растворителей могут служить в принципе все обычно используемые при алкилировании растворители, которые способны растворять реагенты в достаточной степени, оставаясь сами при этом инертными. Предпочтительны в этих целях апротонно полярные растворители, например кетоны, такие как ацетон или метилэтилкетон,ацетонитрил, диметилсульфоксид, амиды, такие как диметилформамид, диметилацетамид, N-метилпирролидон, и циклические мочевины, кроме того, простые алифатические и алициклические эфиры, такие как метил-трет-бутиловый эфир, диизопропиловый эфир, диметоксиэтан, диметиловый эфир дигликоля,диоксан и тетрагидрофуран, а также ароматические углеводороды, такие как толуол, ксилол или хлорбензол, и смеси названных растворителей. Требуемая для алкилирования температура в зависимости от реакционной способности используемых веществ и алкилирующих агентов может находиться в диапазоне от -80 до +150 С. Предпочтительно проводить алкилирование при температурах в диапазоне от -20 до +110 С. Последующую переработку продукта обменной реакции для получения целевого соединения формулы I можно осуществлять по обычным в таких случаях методам. Как правило, сначала проводят экстракционную переработку или с помощью обычных методов, например перегонкой, удаляют используемый растворитель. Вместе с тем, целевое соединение формулы I после разбавления реакционной смеси водой можно экстрагировать из этой смеси с помощью летучего органического растворителя, который затем, в свою очередь, удаляют путем перегонки. Возможен и иной подход, а именно: осаждать целевое соединение из реакционной смеси за счет добавления воды. При этом получают сырой продукт, содержащий требуемый ценный продукт формулы I. Для последующей очистки этого сырого продукта можно использовать обычные методы, такие как кристаллизация или хроматография, например, на оксидах- 14006634 алюминия или силикагелях. В равной мере полученные по вышеописанному способу вещества можно хроматографировать на оптически чистых адсорбатах с целью получения чистых энантиомеров. По завершении алкилирования кетогруппу в соединении I с помощью обычных сульфурирующих агентов "S" можно превращать в тиокарбонильную функциональную группу, получая в результате оксазинтионовые соединения формулы I, где Z обозначает S. С этой целью соединения формулы I подвергают взаимодействию с обычным сульфурирующим агентом, например Р 2S5 или реагентом Лавессона(Lawesson) [2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид]. Реакцию предпочтительно проводить в инертном органическом растворителе, например в одном из вышеуказанных простых эфиров или в ароматических углеводородах либо в смесях таких растворителей, при температурах в интервале от 0 до 150 С. Соответствующие методы известны из патента US 3755582, каковая публикация включена в этой части в настоящее описание в качестве ссылки. Исходные соединения формулы II можно получать по методике, описанной в указанной выше литературе и показанной на схеме 2, исходя при этом из эфиров -, соответственно opтoгидроксикарбоновой кислоты формулы IV. Соединение формулы II находится в равновесном состоянии по отношению к его таутомеру формулы IV, что для последующего алкилирования играет лишь второстепенную роль. В формулах IV и V R представляет собой, например, С 1-С 4 алкильную группу, прежде всего метильную группу. Схема 2 На первой стадии эфир -, соответственно ортогидроксикарбоновой кислоты формулы IV, взаимодействием с цианирующим агентом, таким как бромциан или хлорциан, превращают в цианат формулыV. Цианирующий агент используют, как правило, в стехиометрическом, т.е. эквимолярном, количестве в пересчете на соединение формулы IV, причем допускаются определенные отклонения от точной стехиометрии, предпочтительно, однако, не превышающие 20 мол.%. Наиболее целесообразно осуществлять цианирование, как правило, при температурах в интервале от -80 до +100 С, предпочтительно в интервале от -40 до +60 С. Реакцию предпочтительно проводить в присутствии вспомогательного основания,при этом в качестве вспомогательных оснований приемлемы основания, используемые при алкилировании (указаны выше). Предпочтительными основаниями являются третичные амины. Основание предпочтительно использовать в эквимолярном количестве в пересчете на соединение формулы IV, причем допускаются некоторые отклонения от точной стехиометрии. Процесс цианирования соединений формулы IV проводят, как правило, в органическом растворителе. В качестве органических растворителей пригодны, в принципе, все используемые в подобных случаях растворители, способные при реакции растворять реагенты в достаточной степени, оставаясь сами при этом инертными. К ним относятся, прежде всего апротонные полярные растворители, например кетоны,такие как ацетон или метилэтилкетон, нитрилы, такие как ацетонитрил, диметилсульфоксид, амиды, такие как диметилформамид, диметилацетамид или N-метилпирролидон, циклические мочевины, простые алифатические и алициклические эфиры, такие как диэтиловый эфир, диизопропиловый эфир, метилтрет-бутиловый эфир, диметоксиэтан, диметиловый эфир дигликоля, диоксан или тетрагидрофуран, а также ароматические углеводороды, такие как толуол, ксилол или хлорбензол, и смеси названных растворителей. Циклизацию (замыкание цикла) с образованием 2-гидроксииминооксазинона формулы II осуществляют взаимодействием соединения формулы V с гидроксиламином, соответственно с одной из его обычных солей, например хлоридом или сульфатом. Гидроксиламин предпочтительно использовать при этом в стехиометрическом, т.е., по меньшей мере, эквимолярном, количестве, причем допускается также избыток гидроксиламина, предпочтительно, однако, не превышающий 50 мол.% в пересчете на стехиометрию реакции. Температура реакции находится, как правило, в диапазоне от -20 до +150 С, предпочтительно в диапазоне от +20 до 110 С. Циклизацию соединения формулы V осуществляют обычно в органическом растворителе, например в одном из вышеуказанных растворителей либо в их смеси с водой. Предпочтительны в качестве растворителей спирты, прежде всего С 1-С 3 алканолы, такие как метанол, этанол, н- или изопропанол и их смеси между собой, а также их смеси с водой. Целесообразной может оказаться замена в ходе реакции- 15006634 одного растворителя на другой. Так, в частности, положительным зарекомендовал себя вариант, в котором реакцию начинали в органическом растворителе, предпочтительно в одном из вышеназванных спиртов, а завершали реакцию в воде. При необходимости эффективность обменной реакции можно повысить за счет добавления в ее ходе соответствующего основания. В этих целях можно использовать среди прочих карбонаты, гидрокарбонаты и гидроксиды щелочных и щелочно-земельных металлов, например гидрокарбонат натрия, карбонат натрия, гидроксид натрия, гидроксид калия, карбонат калия, гидроксид кальция и карбонат кальция, а также третичные амины, такие как триэтиламин или пиридин. Вместо гидроксиламина или его солей можно применять также, как это показано на схеме 3, Оалкилированные гидроксиламины R2-O-NH2 либо их соли, например галогениды или сульфаты, с получением в результате оксазинонов формулы I, где R1 представляет собой Н. Условия такой реакции аналогичны условиям проведения реакции с использованием гидроксиламина. Схема 3 В качестве фунгицидов предлагаемые в изобретении соединения формулы I могут применяться в их нейтральном виде или в виде соответствующей соли, при этом приемлемы как кислотно-аддитивные соли, так и соли анионов соединений I с обычными в данных случаях катионами. Под приемлемыми для сельского хозяйства солями имеются в виду, прежде всего, соли тех катионов или кислотно-аддитивные соли тех кислот, катионы, соответственно анионы, которых не оказывают отрицательного воздействия на фунгицидную эффективность соединений формулы I. С учетом этого в качестве катионов можно рекомендовать, прежде всего, ионы щелочных металлов, предпочтительно натрия и калия, щелочно-земельных металлов, предпочтительно кальция, магния и бария, и переходных металлов, предпочтительно марганца, меди, цинка и железа, а также ион аммония, который при необходимости может нести от одного до четырех С 1-С 4 алкильных заместителей и/или один фенильный либо бензильный заместитель, предпочтительно ион диизопропиламмония, тетраметиламмония, тетрабутиламмония, триметилбензиламмония, кроме того, ионы фосфония, ионы сульфония, предпочтительно три(С 1-С 4 алкил)сульфония, и ионы сульфоксония, предпочтительно три(С 1-С 4 алкил)сульфоксония. Анионами пригодных для использования кислотно-аддитивных солей являются, в первую очередь,хлорид, бромид, фторид, гидросульфат, сульфат, дигидрофосфат, гидрофосфат, фосфат, нитрат, гидрокарбонат, карбонат, гексафторсиликат, гексафторфосфат, бензоат, а также анионы С 1-С 4 алкановых кислот, предпочтительно формиат, ацетат, пропионат и бутират. Их можно образовывать реакцией соединения формулы I с кислотой, продуцирующей соответствующий анион, предпочтительно с хлористоводородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой или азотной кислотой. Новые оксазин(ти)оновые соединения формулы I и их соли отличаются исключительно высокой эффективностью против широкого спектра фитопатогенных грибов и могут применяться в качестве фунгицидов, предназначенных для обработки листьев и почвы. Они обладают частично существенно высокой системной подвижностью и эффективностью после обработки почвы и, прежде всего, после обработки листьев. Особое значение придается им для борьбы с многочисленными грибами, поражающими различные культурные растения, такие как пшеница, рожь, ячмень, овес, рис, кукуруза, травы, бананы, хлопчатник,соя, кофе, сахарный тростник, виноград, плодово-ягодные культуры, декоративные растения и овощные культуры, такие как огурцы, бобовые, томаты, картофель и тыквенные, а также поражающими семена этих культур. В первую очередь, они пригодны для борьбы с болезнями растений, обусловленными поражением следующими фитопатогенными грибами: виды Alternaria на овощных и плодовых культурах,Botrytis cinerea (серая гниль) на землянике, овощных культурах, декоративных растениях и виноградной лозе,Cercospora arachidicola на земляном орехе,Erysiphe cichoracearum и Sphaerotheca fuliginea на тыквенных культурах,Erysiphe graminis (настоящая мучнистая роса) на зерновых,виды Fusarium и Verticillium на различных культурах,виды Helminthosporium на зерновых,виды Mycosphaerella на бананах и земляном орехе,Phytophthora infestans на картофеле и томатах,Plasmopara viticola на виноградной лозе,- 16006634Podosphaera leucotricha на яблоневых,Pseudocercosporella herpotrichoides на пшенице и ячмене,виды Pseudoperonospora на хмеле и огурцах,виды Puccinia на зерновых,Pyricularia oryzae на рисе,виды Rhizoctonia на хлопчатнике, рисе и дернине,Septoria nodorum на пшенице,Sphaerotheca fuliginea (мучнистая роса огурцов) на огурцах,Uncinula necator на виноградной лозе,виды Ustilago на зерновых и сахарном тростнике, а также виды Venturia (парша) на яблоневых и грушах. Кроме того, соединения формулы I могут применяться для защиты материалов (например, древесины, дисперсий, предназначенных для нанесения покрытий, волокон или тканей) и защиты складированных запасов от поражения такими вредоносными грибами, как Paecilomyces variotii. Методика применения соединений формулы I заключается, в принципе, в том, что грибы или подвергаемые опасности поражения грибами растения, семена, материалы или почву обрабатывают фунгицидно эффективным количеством действующих веществ. Такую обработку можно проводить как до, так и после поражения материалов, растений или семян грибами. Фунгицидные средства содержат, как правило, от 0,1 до 95 мас.%, предпочтительно от 0,5 до 90 мас.%, действующего вещества. Нормы расхода при применении для защиты растений в зависимости от требуемого эффекта составляют от 0,01 до 2,0 кг действующего вещества на га. При обработке семенного материала нормы расхода действующего вещества составляют, как правило, от 0,001 до 0,1 г, предпочтительно от 0,01 до 0,05 г/кг, семян. При применении для защиты материалов, соответственно для защиты складированных запасов,нормы расхода действующего вещества определяются спецификой обрабатываемых объектов и требуемым эффектом. Обычные нормы расхода в рассматриваемых случаях могут составлять от 0,001 г до 2 кг,предпочтительно от 0,005 г до 1 кг, действующего вещества на кубометр обрабатываемого материала. Из соединений формулы I можно приготавливать обычные композиции, например растворы, эмульсии, суспензии, пылевидные препараты, порошки, пасты и гранулы. Выбор конкретной препаративной формы зависит, в основном, от соответствующей цели применения, но, в любом случае, должно быть обеспечено максимально тонкое и равномерное распределение соединения по изобретению. Указанные композиции приготавливают по обычной технологии, например "разжижением" (увеличением объема) действующего вещества за счет добавления растворителей и/или наполнителей, при необходимости с использованием эмульгаторов и диспергаторов, при этом в случае воды, служащей разбавителем, могут использоваться также и другие органические растворители в качестве вспомогательных агентов растворения. В качестве вспомогательных веществ для указанных целей пригодными являются,главным образом, растворители, такие как ароматические углеводороды (например, ксилол), хлорированные ароматические углеводороды (например, хлорбензолы), парафины (например, фракции минеральных масел, получаемые при переработке нефти), спирты (например, метанол и бутанол), кетоны (например, циклогексанон), амины (например, этаноламин и диметилформамид) и вода; наполнители, такие как природная мука горных пород (например, каолины, глиноземы, тальк и мел) и синтетическая мука горных пород (например, высокодисперсная кремниевая кислота и силикаты); эмульгаторы, такие как неионные и анионные эмульгаторы (например, простой эфир полиоксиэтилена и жирного спирта, алкилсульфонаты и арилсульфонаты), и диспергаторы, такие как отработанный лигнинсульфитный щелок и метилцеллюлоза. В качестве поверхностно-активных веществ могут использоваться соли щелочных и щелочноземельных металлов, аммониевые соли лигнинсульфоновой кислоты, нафталинсульфоновой кислоты,фенолсульфоновой кислоты, дибутилнафталинсульфоновой кислоты, алкиларилсульфонаты, алкилсульфаты, алкилсульфонаты, сульфаты жирных спиртов и жирные кислоты, а также их соли щелочных и щелочно-земельных металлов, соли сульфатированного гликолевого эфира жирных спиртов, продукты конденсации сульфированного нафталина и производных нафталина с формальдегидом, продукты конденсации нафталина, соответственно нафталинсульфоновой кислоты, с фенолом и формальдегидом, октилфеноловый эфир полиоксиэтилена, этоксилированный изооктилфенол, октилфенол, нонилфенол, полигликолевый эфир алкилфенола, трибутилфенилполигликолевый эфир, алкилариловые полиэфиры спиртов, изотридециловый спирт, конденсаты жирных спиртов и этиленоксида, этоксилированное касторовое масло, алкиловый эфир полиоксиэтилена, этоксилированный полиоксипропилен, ацеталь полигликолевого эфира и лаурилового спирта, сложные сорбитовые эфиры, отработанный лигнинсульфитный щелок и метилцеллюлоза. Для приготовления предназначенных для непосредственного опрыскивания растворов, эмульсий,паст или масляных дисперсий могут использоваться фракции минеральных масел, получаемые при переработке нефти, с температурой кипения от средней до высокой, такие как керосин или дизельное масло,- 17006634 кроме того, каменноугольные масла, а также масла растительного или животного происхождения, алифатические, циклические и ароматические углеводороды, например бензол, толуол, ксилол, парафин,тетрагидронафталин, алкилированные нафталины или их производные, метанол, этанол, пропанол, бутанол, хлороформ, тетрахлорметан, циклогексанол, циклогексанон, хлорбензол, изофорон, сильно полярные растворители, например диметилформамид, диметилсульфоксид, N-метилпирролидон, а также вода. Порошковые препараты, препараты для опыливания и опудривания можно приготавливать путем смешения либо совместного размола действующих веществ с твердым носителем. Гранулы, например гранулы в оболочке, импрегнированные гранулы и гомогенные гранулы, можно получать путем связывания действующих веществ с твердыми носителями. Такими твердыми носителями могут служить минеральные земли, такие как кремниевые кислоты, силикагель, силикаты, тальк, каолин, известняк, известь, мел, болюс, лесс, глина, доломит, диатомовая земля, сульфат кальция и магния,оксид магния, измельченные синтетические вещества, удобрения, такие как сульфат аммония, фосфат аммония, нитрат аммония, мочевина и продукты растительного происхождения, такие как мука зерновых, мука из древесной коры, древесная мука и мука из ореховой скорлупы, целлюлозные порошки или иные твердые носители. Концентрация действующих веществ по изобретению в готовых к применению композициях может варьироваться в широких пределах. Как правило, такие композиции содержат от 0,01 до 95 мас.%, предпочтительно от 0,1 до 90 мас.%, действующего вещества. Действующие вещества при этом применяют со степенью чистоты от 90 до 100%, предпочтительно от 95 до 100% (согласно ЯМР-спектру). Ниже представлены в качестве примеров некоторые композиции и технология их приготовления.I. 5 мас.ч. соединения по изобретению тщательно смешивают с 95 мас.ч. тонкодисперсного каолина. Таким путем получают препарат для опыливания, содержащий 5 мас.% действующего вещества.II. 30 мас.ч. соединения по изобретению тщательно смешивают со смесью из 92 мас.ч. порошкообразного геля кремниевой кислоты и 8 мас.ч. парафинового масла, предварительного нанесенного на поверхность этого геля кремниевой кислоты. Таким путем получают композицию действующего вещества с хорошей адгезионной способностью (содержание действующего вещества 23 мас.%).III. 10 мас.ч. соединения по изобретению растворяют в смеси, состоящей из 90 мас.ч. ксилола, 6 мас.ч. продукта присоединения 8-10 молей этиленоксида к 1 молю N-моноэтаноламида олеиновой кислоты, 2 мас.ч. кальциевой соли додецилбензолсульфокислоты и 2 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 9 мас.%).IV. 20 мас.ч. соединения по изобретению растворяют в смеси, состоящей из 60 мас.ч. циклогексанона, 30 мас.ч. изобутанола, 5 мас.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 5 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла (содержание действующего вещества 16 мас.%).V. 80 мас.ч. соединения по изобретению тщательно смешивают с 3 мас.ч. натриевой соли диизобутилнафталинсульфокислоты, 10 мас.ч. натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 7 мас.ч. порошкообразного геля кремниевой кислоты и затем размалывают в молотковой мельнице (содержание действующего вещества 80 мас.%).VI. 90 мас.ч. соединения по изобретению смешивают с 10 мас.ч. N-метилпирролидона и таким путем получают раствор, пригодный для применения в виде мельчайших капель (содержание действующего вещества 90 мас.%).VII. 20 маc.ч. соединения по изобретению растворяют в смеси, состоящей из 40 маc.ч. циклогексанона, 30 маc.ч. изобутанола, 20 маc.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 10 маc.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла. После сливания в воду и тонкого равномерного распределения раствора в 100000 маc.ч. воды получают соответствующую водную дисперсию, содержащую 0,02 мас.% действующего вещества.VIII. 20 маc.ч. соединения по изобретению тщательно смешивают с 3 маc.ч. натриевой соли диизобутилнафталинсульфокислоты, 17 маc.ч. натриевой соли лигнинсульфокислоты из отработанного сульфитного щелока и 60 маc.ч. порошкообразного геля кремниевой кислоты и затем размалывают в молотковой мельнице. После тонкого и равномерного распределения смеси в 20000 маc.ч. воды получают раствор для опрыскивания, содержащий 0,1 мас.% действующего вещества.IX. 10 маc.ч. соединения по изобретению растворяют в 63 мас.ч. циклогексанона, 27 маc.ч. диспергатора (например, в смеси из 50 маc.ч. продукта присоединения 7 молей этиленоксида к 1 молю изооктилфенола и 50 мас.ч. продукта присоединения 40 молей этиленоксида к 1 молю касторового масла). Затем этот исходный раствор за счет распределения в воде разбавляют до требуемой концентрации, например до концентрации в пределах от 1 до 100 част./млн. Действующие вещества могут применяться как таковые в виде их композиций или приготовленных из них препаратов, например в виде предназначенных для непосредственного опрыскивания или распыления водных растворов, порошков, суспензий или дисперсий, эмульсий, масляных дисперсий, паст,препаратов для опыливания, для опудривания или в виде гранул, при этом можно использовать самые разные методы, такие как мелкокапельное опрыскивание, тонкое распыление (в виде тумана), опылива- 18006634 ние, опудривание или полив. Методика обработки и используемые формы зависят от цели применения,но во всех случаях должно быть обеспечено максимально тонкое и равномерное распределение действующих веществ по изобретению. Водные формы применения могут приготавливаться из эмульгирующихся концентратов, паст или смачивающихся порошков (порошки для опрыскивания, масляные дисперсии). Для приготовления эмульсий, паст и масляных дисперсий действующие вещества можно как таковые либо в растворенном в масле или растворителе виде гомогенизировать в воде с использованием в этих целях смачивателей, прилипателей, диспергаторов или эмульгаторов. Вместе с тем можно работать и по-другому, а именно из действующей субстанции, соответствующего смачивателя, прилипателя, диспергатора или эмульгатора и необязательно растворителя либо масла приготавливать концентраты, пригодные для разбавления водой. Концентрация действующих веществ в готовых для применения композициях может, как указывалось выше, варьироваться в широких пределах. Как правило, эта концентрация составляет от 0,0001 до 10%. Во многих случаях для достижения требуемого эффекта достаточными оказываются низкие количества действующего вещества формулы I, содержащегося в готовой к применению композиции, например от 2 до 200 част./млн. В равной степени предпочтительны и композиции с концентрацией действующего вещества в пределах от 0,01 до 1%. Действующие вещества могут успешно применяться и в так называемом способе ультрамалообъемной обработки, заключающемся в том, что при этом возможно использование композиций, содержащих более 95 мас.% действующего или даже только само действующее вещество без каких-либо добавок. К действующим веществам могут добавляться масла различного типа, гербициды, фунгициды, другие средства борьбы с вредителями, бактерициды, при этом такие добавки можно вводить также непосредственно перед практическим применением (т.е. непосредственно в баковую смесь). Указанные средства можно примешивать к средствам по изобретению в массовом соотношении от 1:10 до 10:1. Предлагаемые в изобретении средства при их применении в качестве фунгицидов могут быть также представлены в комбинации совместно с другими действующими веществами, с такими, например, как гербициды, инсектициды, регуляторы роста, фунгициды, или с удобрениями. При применении соединений формулы I, соответственно содержащих их средств в виде фунгицидов в смеси с другими фунгицидами, во многих случаях удается расширить спектр фунгицидного действия. Ниже представлен перечень фунгицидов, совместно с которыми могут применяться соединения по изобретению, причем данный перечень служит только для пояснения таких комбинационных возможностей, не ограничивая при этом объем изобретения. К таким сокомпонентам смесей относятся сера, дитиокарбаматы и их производные, такие как ферридиметилдитиокарбамат, диметилдитиокарбамат цинка, этиленбисдитиокарбамат цинка, этиленбисдитиокарбамат марганца, этилендиаминбисдитиокарбамат марганца-цинка, тетраметилтиурамдисульфиды, аммиачный комплекс (N,N-этиленбисдитиокарбамат) цинка, аммиачный комплекс (N,N'-пропиленбисдитиокарбамат)цинка, (N,N'-пропиленбисдитиокарбамат)цинка, N,N'-полипропиленбис(тиокарбамоил)дисульфид,нитропроизводные, такие как динитро-(1-метилгептил)фенилкротонат, 2-втор-бутил-4,6-динитрофенил-3,3-диметилакрилат, 2-втор-бутил-4,6-динитрофенилизопропилкарбонат, диизопропиловый эфир 5-нитроизофталевой кислоты,гетероциклические вещества, такие как 2-гептадецил-2-имидазолинацетат, 2,4-дихлор-6-(о-хлоранилино)-s-триазин, O,O-диэтилфталимидофосфонотиоат, 5-амино-1-[бис(диметиламино)фосфинил]-3 фенил-1,2,4-триазол, 2,3-дициано-1,4-дитиоантрахинон, 2-тио-1,3-дитиоло[4,5-b]хиноксалин, метиловый эфир 1-(бутилкарбомил)-2-бензимидазолкарбаминовой кислоты, 2-метоксикарбонил-аминобензимидазол, 2-(фурил-(2-бензимидазол, 2-(тиазолил-(4-бензимидазол, N-(1,1,2,2-тетрахлорэтилтио)тетрагидрофталимид, N-трихлорметилтиотетрагидрофталимид, N-трихлорметилтиофталимид,диамид N-дихлорфторметилтио-N',N'-диметил-N-фенилсерной кислоты, 5-этокси-3-трихлорметил 1,2,3-тиадиазол, 2-роданметилтиобензтиазол, 1,4-дихлор-2,5-диметоксибензол, 4-(2-хлорфенилгидразоно)-3-метил-5-изоксазолон, пиридин-2-тио-1-оксид, 8-гидроксихинолин, соответственно его медная соль,2,3-дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин, 2,3-дигидро-5-карбоксанилидо-6-метил-1,4-оксатиин-4,4-диоксид, анилид 2-метил-5,6-дигидро-4 Н-пиран-3-карбоновой кислоты, анилид 2-метилфуран-3 карбоновой кислоты, анилид 2,5-диметилфуран-3-карбоновой кислоты, анилид 2,4,5-триметилфуран-3 карбоновой кислоты, циклогексиламид 2,5-диметилфуран-3-карбоновой кислоты, амид N-циклогексилN-метокси-2,5-диметилфуран-3-карбоновой кислоты, анилид 2-метилбензойной кислоты, анилид 2-иодбензойной кислоты, N-фopмил-N-мopфoлин-2,2,2-тpиxлopэтилaцeтaль, пиперазин-1,4-диилбис-1-(2,2,2 трихлорэтил)формамид, 1-(3,4-дихлоранилино)-1-формиламино-2,2,2-трихлорэтан, 2,6-диметил-N-тридецилморфолин, соответственно его соли, 2,6-диметил-N-циклододецилморфолин, соответственно его соли, N-[3-(n-тpeт-бутилфенил)-2-метилпропил]-цис-2,6-диметилморфолин, N-[3-(n-тpeт-бутилфенил)-2 метилпропил]пиперидин, 1-[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, 1-[2(2,4-дихлорфенил)-4-н-пропил-1,3-диоксолан-2-илэтил]-1 Н-1,2,4-триазол, N-(н-пpoпил)-N-(2,4,6-трихлорфеноксиэтил)-N'-имидазолилмочевина, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанон, 1-(4-хлорфенокси)-3,3-диметил-1-(1 Н-1,2,4-триазол-1-ил)-2-бутанол, (2RS,3RS)-1-[3-(2-хлорфенил)2-(4-фторфенил)оксиран-2-илметил]-1 Н-1,2,4-триазол, -(2-хлорфенил)(4-хлорфенил)-5-пиримидин- 19006634 метанол, 5-бутил-2-диметиламино-4-гидрокси-6-метилпиримидин, бис(n-хлорфенил)-3-пиридинметанол,1,2-бис(3-этоксикарбонил-2-тиоуреидо)бензол, 1,2-бис(3-метоксикарбонил-2-тиоуреидо)бензол,стробилурины, такие как метил-Е-метоксиимино-[-(о-толилокси)-о-толил]ацетат, метил-Е-2-2-[6(2-цианофенокси)пиримидин-4-илокси]фенил-3-метоксиакрилат, метил-Е-метоксиимино-[-(2-феноксифенил)]ацетамид, метил-Е-метоксиимино-[-(2,5-диметилфенокси)-о-толил]ацетамид, метил-Е-2-2-[(2 трифторметилпиридил-6)оксиметил]фенил-3-метоксиакрилат, метиловый эфир (Е,Е)-метоксиимино-2[1-(3-трифторметилфенил)этилиденаминоокси-метил]фенилуксусной кислоты, метил-N-(2-[1-(4-хлорфенил)-1 Н-пиразол-3-ил]оксиметилфенил)-N-метоксикарбамат,анилинопиримидины, такие как N-(4,6-диметилпиримидин-2-ил)анилин, N-[4-метил-6-(1-пропинил) пиримидин-2-ил]анилин, N-[4-метил-6-циклопропилпиримидин-2-ил]анилин,фенилпирролы, такие как 4-(2,2-дифтор-1,3-бензодиоксол-4-ил)пиррол-3-карбонитрил,амиды коричной кислоты, такие как морфолид 3-(4-хлорфенил)-3-(3,4-диметоксифенил)акриловой кислоты, а также различные фунгициды, такие как додецилгуанидинацетат, 3-[3-(3,5-диметил-2-оксициклогексил)-2 гидроксиэтил]глутаримид, гексахлорбензол, DL-метил-N-(2,6-диметилфенил)-N-фуроил(2)-аланинат, метиловый эфир DL-N-(2,6-диметилфенил)-N-(2'-метоксиацетил)аланина, N-(2,6-диметилфенил)-N-хлорацетил-D,L-2-аминобутиролактон, метиловый эфир DL-N-(2,6-диметилфенил)-N-(фенилацетил)аланина,5-метил-5-винил-3-(3,5-дихлорфенил)-2,4-диоксо-1,3-оксазолидин, 3-[3,5-дихлорфенил-(5-метил-5-метоксиметил]-1,3-оксазолидин-2,4-дион, 3-(3,5-дихлорфенил)-1-изопропилкарбомилгидантоин, имид N-(3,5-дихлорфенил)-1,2-диметилциклопропан-1,2-дикарбоновой кислоты, 2-циано-[N-(этиламинокарбонил)-2-метоксиимино]ацетамид, 1-[2-(2,4-дихлорфенил)пентил]-1 Н-1,2,4-триазол, 2,4-дифтор(1 Н-1,2,4-триазолил-1-метил)бензгидриловый спирт, N-(3-хлор-2,6-динитро-4-трифторметилфенил)-5-трифторметил-3 хлор-2-аминопиридин, 1-бис(4-фторфенил)метил-силил)метил)-1 Н-1,2,4-триазол. Ниже изобретение более подробно поясняется на примерах, которые не ограничивают его объем. Примеры по получению Пример 1. O-Метил-(6-хлор-3-пропил-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксим (соединение I-A1.2). 1.1. Метиловый эфир 2-цианато-5-хлорбензойной кислоты. К 21,0 г (0,198 моля) бромциана в 200 мл ацетона при -20 С добавляли при перемешивании 20,0 г(0,198 моля) триэтиламина. По истечении 5 мин к этой смеси добавляли 36,9 г (0,198 моля) метилового эфира 5-хлор-2-гидроксибензойной кислоты и перемешивали в течение последующих 30 мин при -20 С. Затем проводили фильтрацию, фильтр промывали 200 мл ацетона и объединенные органические фазы концентрировали в вакууме. В результате получили 34,4 г указанного в заголовке соединения в виде желтого твердого вещества, которое непосредственно использовали на последующей стадии. 1.2. 6-Хлор-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он-2-оксим. 34,4 г (0,163 моля) метилового эфира 2-цианато-5-хлорбензойной кислоты в 400 мл метанола перемешивали совместно с 11,3 г (0,163 моля) гидроксиламингидрохлорида в течение 1 ч при комнатной температуре. Затем растворитель удаляли в вакууме и остаток промывали диэтиловым эфиром. После добавления раствора 20,5 г гидрокарбоната натрия в 400 мл воды сырой продукт перемешивали в течение 16 ч, отфильтровывали, повторно перемешивали в течение 16 ч с 500 мл воды, отфильтровывали и сушили. В результате получили 12,3 г 6-хлор-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он-2-оксима. 1.3. 6-Хлор-3-пропил-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он-2-оксим. Раствор 5,0 г (23,5 ммоля) 6-хлор-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он-2-оксима в 100 мл диметилформамида при комнатной температуре смешивали при перемешивании с 0,94 г (23,5 ммоля) 60%-ного гидрида натрия. Затем добавляли 4,3 г (35 ммолей) бромпропана и в течение 16 ч перемешивали при комнатной температуре. Полученную таким путем смесь сливали в 100 мл водного раствора дигидрофосфата натрия (10%-ного) и четырежды экстрагировали метил-трет-бутиловым эфиром порциями по 100 мл. Объединенные экстракты промывали 100 мл насыщенного раствора поваренной соли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали хроматографией на силикагеле с помощью циклогексана/этилового эфира уксусной кислоты. В результате получили 1,8 г указанного в заголовке соединения с температурой плавления 144 С. 1.4. O-Метил-(6-хлор-3-пропил-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксим. К 80 мг (2,1 ммоля) 60%-ного гидрида натрия в 10 мл диметилформамида при комнатной температуре и при перемешивании сразу же добавляли раствор 500 мг (2,0 ммоля) 6-хлор-3-пропил-4 Н-1,3 бенз[е]оксазин-4(3 Н)-он-2-оксима в 20 мл диметилформамида. Затем к этой смеси добавляли 430 мг(3,0 ммоля) метилиодида и в течение 16 ч перемешивали при комнатной температуре. Полученную смесь сливали в 50 мл водного раствора дигидрофосфата натрия (10%-ного) и четырежды экстрагировали метил-трет-бутиловым эфиром порциями по 50 мл. Объединенные экстракты промывали 30 мл насыщенного раствора поваренной соли, сушили над сульфатом натрия и концентрировали в вакууме. Указанное в заголовке соединение получили при этом в виде сырого продукта, который с целью его очистки последовательно промывали диэтиловым эфиром и н-гексаном. Таким путем получили 230 мг указанного в заголовке соединения с температурой плавления 158 С.- 20006634 Пример 2. О-Метил-(6-иод-3-пропил-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксим (соединение I-A1.4). 2.1. О-Метил-(6-иод-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксим. 2,0 г (6,6 ммоля) метилового эфира 2-цианато-5-иодбензойной кислоты, 0,55 г (6,6 ммоля) O-метилгидроксиламингидрохлорида и 0,55 г (6,6 ммоля) гидрокарбоната натрия в течение 1 ч совместно перемешивали в 20 мл метанола при комнатной температуре. Затем растворитель удаляли под вакуумом и остаток помещали в 10 мл 10 мас.%-ного едкого натра. Через 5 мин с помощью 10 мас.%-ной соляной кислоты значение рН устанавливали равным 6-8. Выпавший в осадок продукт отфильтровывали, промывали и сушили в вакууме. В результате получили белое твердое вещество с выходом 2,08 г. 1 Н-ЯМР (d6-ДМСО, наблюдается наличие 2 изомеров) =3,70 (s); 7,12 и 7,18 (d); 8,00 (m); 8,05 (s); 11,35 и 11,70 (s). 2.2. O-Метил-(6-иод-3-пропил-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксим. 2,94 г (9,2 ммоля) O-метил-(6-иод-4 Н-1,3-бенз[е]оксазин-4(3 Н)-он)-2-оксима в 50 мл диметилсульфоксида смешивали при комнатной температуре и при перемешивании с 1,24 г (1,1 ммоля) третбутилзла. калия и продолжали перемешивать в течение 5 мин, при этом температура повышалась до 30 С. Затем добавляли 1,40 г (1,1 ммоля) бромпропана и в течение 16 ч перемешивали при комнатной температуре. Затем смесь сливали в 100 мл водного раствора дигидрофосфата натрия и трижды экстрагировали метил-трет-бутиловым эфиром порциями по 100 мл. Объединенные экстракты 1 раз промывали 30 мл раствора дигидрофосфата натрия и 1 раз 30 мл насыщенного раствора поваренной соли, далее сушили над сульфатом натрия и концентрировали в вакууме. Выход составил 2,2 г белого твердого вещества. 1H-ЯМР (CDCl3) =0,95 (t); 1,75 (m); 3,90 (s); 3,93 (q); 7,00 (d); 7,87 (d); 8,32 (s). Аналогичным путем получали представленные ниже в табл. 4 действующие вещества общей формулы I-A1.- 21006634 Примеры по применению Примеры действия против фитопатогенных грибов Фунгицидная эффективность соединений общей формулы I была подтверждена в ходе проведения следующих опытов. Действующие вещества применяли в виде их водных композиций, содержавших действующее вещество в концентрациях 250, 63, 16 и 4 част./млн. Соответствующую водную композицию приготавливали за счет разбавления исходного раствора, содержавшего 10 мас.% действующего вещества, 63 мас.% циклогексанона и 27 мас.% эмульгатора (20 маc.ч. Nekanil LN (Lutensol AP6, смачиватель с эмульгирующим и диспергирующим действием на основе этоксилированных алкилфенолов) и 10 маc.ч. Wettol ЕМ (неионный эмульгатор на основе этоксилированного касторового масла, водой в количестве, необходимом для достижения требуемой концентрации. Пример по применению 1. Защитное действие против мучнистой росы огурцов. Листья выращенных в сосудах проростков огурцов сорта "Chinesische Schlange" в фазе семядолей обильно, вплоть до появления капель, опрыскивали водной композицией соответствующего действующего вещества. Через 20 ч после высыхания осадка на опрыснутых растениях эти растения инокулировали водной суспензией спор мучнистой росы огурцов (Sphaerotheca fuliginea). Затем растения в течение 7 дней выдерживали в теплице при температурах в интервале от 20 до 24 С и при относительной влажности воздуха 60-80%. В завершение визуально определяли в процентном отношении степень поражения грибом площади поверхности семядолей. В этом опыте, как было установлено, растения, обработанные композицией действующего вещества из примера 1 (соединение I-A1.2 в табл. 1) даже при его минимальной концентрации 4 част./млн, не были поражены, тогда как степень поражения необработанных растений достигала 90%. При повышении норм расхода результаты оказались аналогичными, что и в первом случае при концентрации 4 част./млн. В остальном применение других представленных в табл. 4 соединений позволило получить результаты,указанные в нижеследующей табл. 5. Таблица 5 Пример по применению 2. Защитное действие против мучнистой росы пшеницы (возбудитель Erysiphe(син. Blumeria) graminis forma specialis tritici). Первые полностью сформировавшиеся листья выращенных в сосудах проростков пшеницы сорта"Kanzler" обильно, вплоть до появления капель, опрыскивали водной композицией соответствующего действующего вещества, приготовленной из исходного раствора, содержавшего 10% действующего вещества, 85% циклогексанона и 5% эмульгатора, и через 24 ч после высыхания осадка на опрыснутых растениях эти растения опыляли спорами мучнистой росы пшеницы (возбудитель Erysiphe (син.Blumeria) graminis forma specialis tritici). Затем опытные растения помещали в теплицу и выдерживали при температурах в интервале от 20 до 24 С и при относительной влажности воздуха 60-90%. По истечении 7 дней визуально определяли в процентном отношении степень поражения грибом общей площади поверхности листьев. Полученные результаты приведены в табл. 6. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Оксазин(ти)оновые соединения общей формулы IZ обозначает кислород,А обозначает аннелированное бензольное кольцо,n обозначает 0 или 1,R1 обозначает C1-С 6 алкил, необязательно замещенный C1-С 4 алкоксигруппой или C3-С 8 циклоалкилом, C2-С 6 алкенил, C1-С 6 галогеналкил или C2-С 6 галогеналкенил,R2 обозначает C1-С 3 алкил или циклопропилметил,R3 обозначает галоген, C1-С 6 алкил или C1-С 6 алкоксигруппу,а также приемлемые для сельского хозяйства соли этих оксазин(ти)оновых соединений формулы I. 2. Соединения по п.1, где R1 обозначает C1-С 6 алкил, C2-С 6 алкенил, C1-С 6 галогеналкил, C2-С 6 галогеналкенил, C1-С 4 алкокси-C1-С 4 алкил или C3-С 8 циклоалкил-C1-С 4 алкил. 3. Соединения по любому из предыдущих пунктов, где n обозначает 1. 4. Соединения по любому из предыдущих пунктов, где R3 обозначает C1-С 4 алкил или галоген. 5. Применение соединений формулы I и его приемлемых для сельского хозяйства солей по п.1 для борьбы с фитопатогенными грибами. 6. Средства, содержащие фунгицидно эффективное количество по меньшей мере одного соединения формулы I и/или по меньшей мере одной приемлемой для сельского хозяйства соли соединения формулы I по п.1, а также по меньшей мере один наполнитель. 7. Способ борьбы с фитопатогенными грибами, заключающийся в том, что грибы или подвергаемые опасности поражения грибами материалы, растения, семена или почву обрабатывают фунгицидно эффективным количеством по меньшей мере одного соединения формулы I по п.1 и/или соли соединения формулы I.
МПК / Метки
МПК: A01N 43/86, C07D 265/24, C07D 513/04, A01N 43/90, C07D 498/04
Метки: оксазин(ти)оновые, качестве, фунгицидов, соединения
Код ссылки
<a href="https://eas.patents.su/24-6634-oksazintionovye-soedineniya-v-kachestve-fungicidov.html" rel="bookmark" title="База патентов Евразийского Союза">Оксазин(ти)оновые соединения в качестве фунгицидов</a>
Предыдущий патент: Замещенные 3-гетероциклилом производные бензоила
Следующий патент: Молекулярные метки для систем органических растворителей
Случайный патент: Производные пиридазин-3-она, их использование в качестве гербицидов и промежуточные соединения для их получения.