Производные 1,3-оксазин-4-она в качестве гербицидов
Номер патента: 1145
Опубликовано: 30.10.2000
Авторы: Крэмп Майкл Колин, Усуи Йосихиро, Хаясизаки Кейити
Формула / Реферат
1. Производное 1,3-оксазин-4-она формулы (I)
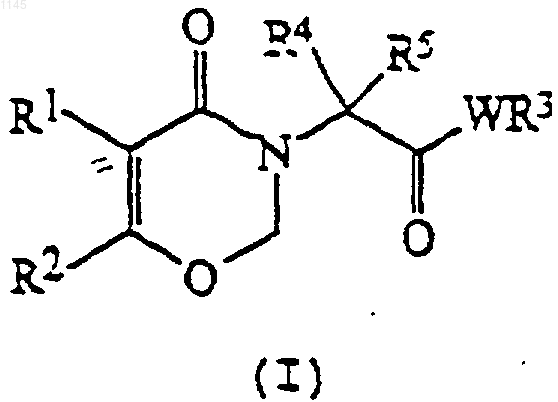
где R1 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, метокси и необязательно галогенированного метила
R2 представляет неразветвленный или разветвленный алкил с одним-четырьмя углеродными атомами, замещенный одной или несколькими группами R8, которые могут быть одинаковыми или разными, или группу, выбранную из циано, -СНО, -COR7, -СО2Н, -CO2R7, -COSR7, -CONR9R10, -CH=NOH, -CH=NOR7, -CH=NOCOR7, -CH=NNR9R10, -CH2CN, -CH2NO2 и оксиранила;
R3 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, гидрокси, низшего алкила, галогеналкила,
R4 и R5 независимо представляет низший алкил;
W представляет -NH-;
R7 представляет низший алкил или галогеналкил;
n представляет ноль, один или два;
q представляет один или два;
R8 представляет члена группы, состоящей из галогена, -ОН,
OR7, -OCOR7, -S(O)nR7 и -NR9R10;
R9 и R10 независимо представляют водород, низший алкил или галогеналкил;
или его сельскохозяйственно приемлемая соль.
2. Соединение по п.1, в котором R1 представляет фенил, необязательно замещенный одной или несколькими группами галогена.
3. Соединение по п.2, в котором R1 представляет фенил.
4. Соединение по любому из пп.1-3, в котором R8 представляет -S(O)nR7 (где R7 представляет алкил) или галоген.
5. Соединение по п.4, в котором R7 представляет метил.
6. Соединение по любому из пп.1-3, в котором R2 представляет метил, замещенный фтором, метокси, этокси и -S(O)nСН3.
7. Соединение по п.1, в котором R3 представляет фенил, необязательно замещенный одной или двумя группами (которые могут быть одинаковыми или разными), выбранными из галогена и галогеналкила.
8. Соединение по п.1, в котором каждый из R4 и R5 представляет метил.
9. Соединение по п.1, которое представляет собой:
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-метилсульфонилметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-метилтиометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метилтиометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-дифторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-бромметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-[2,5-дифторфенил)-2-(6-бромметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(6-хлорметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-хлорметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторфенил)-2-(6-хлорметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(5-хлор-2-метилфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-хлорфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2-фтор-5-трифторметилфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(6-этоксиметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-этоксиметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-этоксиметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2-фтор-5-трифторметилфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,4,5-трифторфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дифторфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2-хлор-3,5-дифторфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-хлорфенил)-2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-[6-(3-хлорпропил)-2,3-дигидрооксофенил-Н-1,3-оксазин-3-ил]-2-метилпропанамид,
N-(3-хлорфенил)-2-[6-(3-хлорпропил)-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил]-2-метилпропанамид,
N-(3-трифторметилфенил)-2-[6-(3-хлорпропил)-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил]-2-метилпропанамид,
N-(2,5-дифторфенил)-2-[6-(3-хлорпропил)-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил]-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-метилсульфинилметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метилсульфинилметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-хлорфенил)-2-(2,3-дигидро-6-иодметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-хлорфенил)-2-(6-бромметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-бромметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-хлорфенил)-2-(6-дибромметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-метилтиометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-этилтиометил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-этилтиометил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(6-ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-ацетоксиметил)-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метиламинометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3-трифторметилфенил)-2-(2,3-дигидро-6-диметиламинометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-диметиламинометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-метиламинометил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-формил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-ацетил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(6-ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-гидроксииминоме-тилен-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-этоксииминометилен-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-метоксииминометилен-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-метоксииминометилен-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-ацетоксииминометилен-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-аминоиминометилен-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(2,3-дигидро-6-метиламиноиминометилен-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-(6-циано-2,3-дигидро-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид,
N-(3,5-дихлорфенил)-2-[2,3-дигидро-6-(1-гидроксиэтил)-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил]-2-метилпропанамид или
N-(2,5-дифторфенил)-2-(2,3-дигидро-6-формил-4-оксо-5-фенил-4Н-1,3-оксазин-3-ил)-2-метилпропанамид.
10. Гербицидная композиция, включающая эффективное количество активного ингредиента - производного 1,3-оксазин-4-она в сочетании с сельскохозяйственно-приемлемым разбавителем или носителем и/или поверхностно-активным веществом, отличающаяся тем, что в качестве указанного производного содержит соединение 1,3-оксазин-4-она по любому из пп.1-9 или его сельскохозяйственно-приемлемую соль.
11. Способ борьбы с сорняками в очаге, включающий внесение в указанный очаг эффективного количества производного 1,3-оксазин-4-она, отличающийся тем, что в качестве производного 1,3-оксазин-4-она используют соединение по любому из пп.1-9 или его сельскохозяйственно-приемлемую соль.
12. Способ по п.11, отличающийся тем, что указанным очагом является площадь, которая используется или должна использоваться для выращивания культур, и эффективное количество составляет от 0,001 до 1,0 кг/га.
13. Соединение формулы
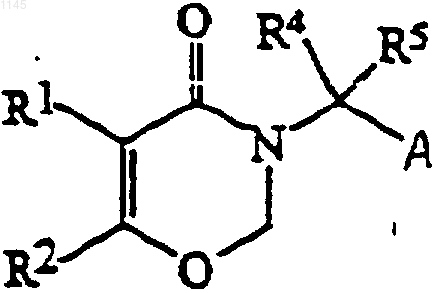
где R1, R2, R4 и R5 - такие как определено в п.1, а группа А выбрана из групп СООН и СОСl.
Текст
1 Предпосылки создания изобретения 1. Область, к котoрой относится изобретение Настоящее изобретение относится к новым производным 1,3-оксазин-4-она, к содержащим их гербицидным композициям и к новым промежуточным соединениям для получения указанных производных. 2. Описание известного уровня техники Некоторые типы производных 1,3-оксазин 4-она, такие, как 2,3-дигидро-6-метил-3-(1 метил-1-фенилэтил)-5-фенил-4 Н-1,3-оксазин-4 он, и их гербицидная активность раскрыты, например, в международных патентных публикацияхWO 93/15064 иWO 95/10510. Однако соединения, описанные в вышеуказанных публикациях, отличаются от соединений по настоящему изобретению, поскольку ни одно из них не имеет кислотно-амидного заместителя в группе, присоединенной к атому азота в 3-положении 1,3-оксазинового кольца. Краткое описание сущности изобретения В соответствии с настоящим изобретением предлагается производное 1,3-оксазин-4-она формулы (I):R1 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, гидрокси, низшего алкила,галогеналкила,алкокси,галогеналкокси,-S(O)nR7, -CO2R7, -COR7, циано, нитро,-O(CH2)qCO2R7 и фенокси;R2 представляет: неразветвленный или разветвленный алкил с одним-десятью углеродными атомами, замещенный одной или несколькими группами R8,которые могут быть одинаковыми или разными,неразветвленную или разветвленную необязательно галогенированную алкенильную или алкинильную группу, имеющую до десяти углеродных атомов,или группу, выбранную из циано, -СНО,-COR7, -СО 2 Н, -CO2R7, -COSR7, -CONR9R10,-CH=NOH,-CH=NOR7,-CH=NOCOR7,9 10R3 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, гидрокси, низшего алкила,галогеналкила,алкокси,галогеналкокси,-S(O)nR7, -CO2R7, -COR7, циано, нитро,-O(CH2)qCO2R7 и фенокси; или R3 представляет первое пятисемичленное гетероароматическое кольцо,имеющее от одного до четырех гетероатомов в кольце (которые могут быть одинаковыми или разными), выбранных из азота, кислорода и се 001145 2 ры, причем это первое кольцо является необязательно сконденсированным с фенильным кольцом или со вторым пяти-семичленным гетероароматическим кольцом, имеющим от одного до четырех гетероатомов (которые могут быть одинаковыми или разными), выбранных из азота, кислорода и серы, с образованием бициклической кольцевой системы, в которой любое кольцо является необязательно замещенным одной-четырьмя группами (которые могут быть одинаковыми или разными), выбранными из галогена, гидрокси, низшего алкила, галогеналкила, алкокси, галогеналкокси, -S(O)nR7, -CO2R7,-COR7, циано, нитро, -O(CH2)qCO2R7 и фенокси,и связано (первое кольцо) с атомом азота группы NR6 через один из углеродных атомов в кольце;R4 и R5 независимо представляет низший алкил;R7 представляет низший алкил или галогеналкил;q представляет один или два;R9 и R10 независимо представляют водород, низший алкил или галогеналкил; или его сельскохозяйственно приемлемая соль, обладающая ценными свойствами. Термин "сельскохозяйственно приемлемые соли" означает соли, катионы или анионы которых известны и признаны в данной области пригодными для образования солей, применяемых в сельском хозяйстве или садоводстве. Эти соли предпочтительно являются водорастворимыми. Подходящие соли с основаниями включают соли щелочных металлов (например, натрия и калия), щелочно-земельных металлов(например, диэтаноламина, триэтаноламина,октиламина, морфолина и диоктилметиламина). Подходящие кислотно-аддитивные соли, например образованные соединениями формулы(I), содержащими аминогруппу, включают соли с неорганическими кислотами, например гидрохлориды, сульфаты, фосфаты и нитраты, и соли с органическими кислотами, например уксусной кислотой. В некоторых случаях группы R1, R2, R4, R5,6R , R7, R9 и R10 могут привести к образованию стереоизомеров и геометрических изомеров. Настоящее изобретение охватывает все такие формы. Следующие термины в данном описании имеют такие общие определения:"низший алкил" означает неразветвленную или разветвленную алкильную группу, имеющую один-шесть углеродных атомов;"галогеналкил" означает неразветвленную или разветвленную алкильную группу с однимшестью углеродными атомами, замещенную одним или несколькими галогенами;"алкокси" означает неразветвленную или разветвленную алкоксигруппу, имеющую одиншесть углеродных атомов;"галогеналкокси" означает неразветвленную или разветвленную алкоксигруппу с однимшестью углеродными атомами, замещенную одним или несколькими галогенами;"галоген" означает атом фтора, хлора,брома или иода. Далее в описании раскрыт ряд предпочтительных (по их гербицидными свойствам) классов соединений формулы (I). Предпочтительными являются соединения указанной выше формулы (I), в которой R1 представляет фенил, необязательно замещенный одной или несколькими группами, выбранными из галогена, низшего алкила и галогеналкила. Более предпочтительно R1 представляет фенил. Другим предпочтительным классом соединений формулы (I) являются соединения, в которых R2 представляет неразветвленный или разветвленный алкил с одним-четырьмя углеродными атомами, замещенный одной-тремя группами R8, которые могут быть одинаковыми или разными. Более предпочтительно R2 представляет метил, замещенный одной-тремя группами R8, которые могут быть одинаковыми или разными.(где R7 представляет алкил, наиболее предпочтительно метил) или галоген. Предпочтительными являются соединения,в которых R2 представляет метил, замещенный фтором, метокси, этокси и S(O)nСН 3. Особенно предпочтительными являются соединения формулы (I), в которых R6 представляет водород. Предпочтительными также являются соединения указанной выше формулы (I), в которых R3 представляет фенил, необязательно замещенный одной или двумя группами (которые могут быть одинаковыми или разными), выбранными из галогена (например, фтора) и галогеналкила (например, трифторметила). Особенно предпочтительными являются соединения формулы (I), в которых каждый изR4 и R5 представляет метил. Особенно предпочтительным классом соединений формулы (I) являются соединения, в которых:R1 представляет фенил, необязательно замещенный одной или несколькими группами(которые могут быть одинаковыми или разными), выбранными из галогена, метокси и необязательно галогенированного метила;R3 представляет фенильное кольцо, замещенное одной-тремя группами (которые могут быть одинаковыми или разными), выбранными из галогена, необязательно галогенированного метила и NO2;R7 представляет необязательно галогенированный метил. Особенно предпочтительным классом соединений формулы (I) являются соединения, в которых:R2 представляет метильную группу, замещенную группой R8,неразветвленный или разветвленный алкил, содержащий от одного до трех углеродных атомов, который является замещенным одним или несколькими атомами галогена,или группу, выбранную из циано, -СНО,-CH=NOH,-CH=NOR7,-СН=N-ОСОСН 3,9R3 представляет фенильное кольцо, замещенное одной-тремя группами (которые могут быть одинаковыми или разными), выбранными из галогена или необязательно галогенированного метила;R7 представляет метил или этил;-S(O)nСН 3. Составляют часть настоящего изобретения также следующие соединения, сведенные в таблицу, где Me означает метил, Et означает этил,Ph означает фенил: Следующие соединения из приведенной выше таблицы являются предпочтительными:N-(3,5-дихлорфенил)-2-(2,3-дигидро-6 метоксииминометилен-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид,N-(2,5-дифторфенил)-2-(2,3-дигидро-6 метоксииминометилен-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид,N-(3,5-дихлорфенил)-2-(6-ацетоксииминометилен-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид,N-(3,5-дихлорфенил)-2-(6-аминоиминометилен-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид,N-(3,5-дихлорфенил)-2-(2,3-дигидро-6 метиламиноиминометилен-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропанамид,N-(3,5-дихлорфенил)-2-(6-циано-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид,N-(3,5-дихлорфенил)-2-[2,3-дигидро-6-(1 гидроксиэтил)-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил]-2-метилпропанамид,N-(2,5-дифторфенил)-2-(2,3-дигидро-6 формил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамид. Соединения приведенной выше формулы(I) могут быть получены путем применения или модификации известных способов (т.е. способов, уже использованных ранее или описанных в литературе). Следует понимать, что в описанных далее процессах порядок последовательных операций может быть иным и что для получения целевых соединений могут потребоваться подходящие защитные группы. В соответствии с одним из отличительных признаков настоящего изобретения соединения формулы (I) могут быть получены путем осуществления взаимодействия формулы (II):(III) 3 6 где R и Rтакие, как определены выше. Реакцию обычно осуществляют в присутствии основания, например третичного амина, такого, как триэтиламин, и в инертном растворителе, таком,как дихлорметан, при температуре от 0 С до температуры кипения растворителя при нагревании с обратным холодильником. В соответствии с другим признаком настоящего изобретения соединения формулы (I),в которых R2 представляет 3-хлорпропил, могут быть получены путем осуществления взаимодействия соединения формулы (IV):R2 заменен на циклопропил, с хлорирующим агентом с последующим взаимодействием с амином формулы (III). Реакция может быть осуществлена в соответствии с условиями процесса, описанного выше. В этой модификации кислые условия реакции хлорирования приводят к преобразованию циклопропильной группы R2 в 3-хлорпропильное соединение. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R1, R2, R3, R4 и R5 -такие, как определены выше, и W представляет -NH-, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (V): где R1, R2, R4, R5 - такие, как определены выше,и TMS означает триметилсилил, с хлорирующим агентом, например оксалилхлоридом, с образованием in situ (на месте) соединения формулы (II), которое затем подвергают взаимодействию с амином формулы (III) в соответствии с описанным выше процессом. Этот процесс пригоден для получения промежуточного соединения (II) в некислотных условиях, как описано в J. Organic Chemistry (1978), том 43,страницы 3972-3974. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых W представляет NR6 и R6 представляет водород, низший алкил, галогеналкил, алкенил или алкинил, могут также быть получены путем осуществления взаимодействия соединения приведенной выше формулы (IV), где R1,R2, R4 и R5 - такие, как определены выше, с амином приведенной выше формулы (III), где R3 такой, как определено выше, и R6 представляет водород, низший алкил, галогеналкил, алкенил или алкинил, в присутствии агента конденсации,напримерN,N'-дициклогексилкарбодиимида, возможно, в присутствии основания,например 4-диметиламинопиридина, и в инертном растворителе, таком, как дихлорметан, при температуре от 0 С до 60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R6 представляет атом водорода и R1,R2, R3, R4 и R5 - такие, как определены выше,могут также быть получены путем осуществления взаимодействия карбоновой кислоты приведенной выше формулы (IV) с фенилкарбаматом формулы PhO2C-NHR3, где R3 - такой, как определено выше, в присутствии основания, предпочтительно 1,8-диазабицикло[5.4.0]ундец-7 ена, в инертном растворителе (например, 1,4 диоксане) при температуре от 20 С до 100 С. Соединения формулы (I), в которых W представляет NR6 и R6 представляет атом водо 11 рода, могут также быть получены путем осуществления взаимодействия сложного триметилсилилового эфира приведенной выше формулы(V), где R1, R2, R4 и R5 - такие, как определены выше, и TMS означает триметилсилил, с амином формулы -NH2R3, где R3 - такой, как определено выше. Реакцию обычно осуществляют в присутствии каталитического количества соли титана(IV), предпочтительно полученной на месте в результате реакции хлорида титана (IV) и трифторметансульфоната серебра (I), и в присутствии ангидрида, предпочтительно 4-трифторметилбензойного ангидрида, в инертном растворителе, например, дихлорметане при температуре от 0 до 60 С. Этот процесс пригоден для слабо нуклеофильных аминов и описан в Chem.and T. Mukaiyama. Соединения формулы (I) могут быть получены путем взаимопревращения из других соединений формулы (I), например, так, как описано ниже. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -СНО, могут быть получены путем окисления соответствующих соединений формулы (I), в которых R2 представляет -СН 2 ОН, с использованием, например,хлорхромата пиридиния в дихлорметане при температуре в пределах от 0 С до температуры кипения с обратным холодильником. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R1, R3, R4, R5 и W -такие, как определены выше, и R2 представляет -COR7, могут быть получены путем окисления соответствующих соединений формулы (I), в которых R2 представляет -CH(OH)R7, с использованием,например, хлорхромата пиридиния в дихлорметане при температуре в пределах от 0 С до температуры кипения с обратным холодильником. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет оксиранильную группу, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с реагентом переноса метиленовой группы, предпочтительно диметилсульфоксонийметилидом, в растворителе, предпочтительно диметилсульфоксиде (ДМСО), при температуре от 10 С до 60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет алкенил, необязательно замещенный галогеном, и в которых двойная связь находится между двумя углеродными атомами, ближайшими к 1,3-оксазин-4 оновому кольцу, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 12 представляет -СНО или -COR7, с фосфораном,обычно образованным в результате реакции из соли фосфония формулы Ph3P+CHR11aY-, где Y представляет хлор, бром или иод, R11 и R11a представляют водород или необязательно галогенированный алкил, содержащий от одного до восьми углеродных атомов, при условии, что общее число атомов углерода в объединенных алкильных группах R7, R11 и R11a не превышает восьми. Реакцию обычно проводят в присутствии сильного основания, например нбутиллития, в инертном растворителе, например тетрагидрофуране, при температуре от 0 С до температуры кипения с обратным холодильником, причем реакцию проводят в инертной атмосфере. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH(OH)R12, где R12 представляет C1-C9 алкильную группу, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с реактивом Гриньяра формулы R12Mg-X, где R12 такой, как определено выше, и Х представляет бром или иод. Реакция может быть осуществлена в инертном растворителе, например простом эфире или тетрагидрофуране, при температуре от 20 до 60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -СН 2 ОН, могут быть получены путем гидролиза соответствующего соединения формулы (I), в котором R2 представляет -СН 2 ОС(O)R7, где R7 - такой, как определено выше. Предпочтительно R7 представляет метил, и гидролиз осуществляют с использованием основания, например карбоната калия, в водно-спиртовом растворе при температуре от 0 до 50 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет дифторметил, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с трифторидом диэтиламиносеры в инертном растворителе, например дихлорметане, при температуре 0-60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CF2R7, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -COR7, с трифторидом диэтиламиносеры в инертном растворителе,например, дихлорметане, при температуре 060 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH2I, могут быть получены путем осуществления взаимодействия 13 соответствующего соединения формулы (I), в котором R2 представляет -CH2Br или -CH2Cl, с иодидом натрия или калия в инертном растворителе, предпочтительно ацетоне, при температуре в пределах от температуры окружающей среды до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -С(Z)R12aR12b, Z представляет бром, хлор или иод и R12a и R12b представляют водород или необязательно галогенированную алкильную группу, содержащую до девяти углеродных атомов, при условии, что общее число углеродных атомов в объединенных алкильных группах R12a и R12b не превышает девяти, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет- СНR12aR12b, с галогенирующим агентом,предпочтительно N-бромсукцинимидом, Nхлорсукцинимидом и N-иодсукцинимидом, в инертном растворителе, например, тетрахлорметане, необязательно в присутствии инициатора радикалов, например азобисизобутиронитрила, или при облучении источником света с вольфрамовой нитью и при температуре в пределах от температуры окружающей среды до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет C1-С 10 алкильную группу, замещенную группой -SR7, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором группа -SR7 заменена на уходящую группу, предпочтительно хлор или бром, с тиолом формулыR7SH или щелочнометаллической солью тиола R7SM, где М представляет литий или натрий. Реакцию осуществляют в инертном растворителе, например, N,Nдиметилформамиде, при температуре 0-60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет C1-С 10 алкильную группу, замещенную группой -OC(O)R7, где R7 такой, как определено выше, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором группа -OC(O)R7 заменена на уходящую группу, с солью формулы R7-CO2-M1+, где M1 представляет натрий или калий. Уходящая группа предпочтительно представляет собой хлор или бром. Реакцию обычно осуществляют в инертном растворителе, предпочтительно N,Nдиметилформамиде, при температуре в пределах от температуры окружающей среды до 120 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CO2R7, могут быть получены путем этерификации соответствующего соединения формулы (I), в котором R2 14 представляет -СО 2 Н, для замены атома водорода группой R7. Реакцию предпочтительно осуществляют со спиртом формулы R7OH и диэтилазодикарбоксилатом в инертном растворителе, например, эфире, при температуре от 0 С до температуры кипения растворителя. В соответствии с другим вариантом превращение может быть осуществлено путем хлорирования соответствующего соединения формулы (I), в котором R2 представляет -СО 2 Н, с использованием, например, оксалилхлорида в инертном растворителе,например, дихлорметане или 1,2-дихлорэтане,необязательно в присутствии катализатора, такого, как N,N-диметилформамид, при температуре от 20 С до температуры кипения смеси при нагревании с обратным холодильником для получения соответствующего хлорангидрида кислоты, который затем подвергают взаимодействию со спиртом формулы R7OH в инертном растворителе, например, тетрагидрофуране, при температуре от 0C до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет C1-С 10 алкильную группу, замещенную группой -OR7, где группаR7 - такая, как определена выше, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором группа -OR7 заменена гидроксигруппой, с алкилгалогенидом, предпочтительно иодидом формулы R7-I. Реакцию обычно проводят в присутствии оксида серебра (I) в инертном растворителе, например, ацетонитриле, при температуре в пределах от температуры окружающей среды до температуры кипения с обратным холодильником или, что не обязательно,в присутствии слабого основания, например карбоната калия. Общий процесс описан в J.Org. Chem. 40, 206 (1975). Могут быть также получены соединения формулы (I), в которых R2 представляет C1-С 10 алкильную группу, замещенную на -OR7, путем осуществления взаимодействия соответствующего соединения формулы (I), в котором -OR7 заменена гидроксигруппой, со спиртом формулы R7 ОH в присутствии триалкилфосфина, например, три-н-бутилфосфина, и 1,1'-(азодикарбонил)пиперидина в инертном растворителе (например, толуоле при температуре от 20C до температуры кипения с обратным холодильником). Реакция описана byJ. R. Falck в Tetrahedron Letters 35, 5997 (1994). В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH=N-OH, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с гидрохлоридом гидроксиламина в присутствии слабого основания (например, ацетата натрия) в инертном растворителе (например, этаноле) при температуре в пределах от температуры окру 15 жающей среды до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH=N-OR7, где R7 такой, как определено выше, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с O-алкилгидроксиламином формулы R7O-NH2, который может быть в форме соли, например гидрохлорида, в присутствии слабого основания (например, ацетата натрия) в инертном растворителе (например, этаноле) при температуре в пределах от температуры окружающей среды до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH=N-OCOR7, гдеR7 - такой, как определено выше, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -CH=N-OH, с хлорангидридом кислоты формулы R7COCl в инертном растворителе, например тетрагидрофуране, при температуре от 0 С до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH=N-NR9R10, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СНО, с гидразином формулы R9R10N-NH2 в инертном растворителе (например, этаноле), при температуре от 20 С до температуры кипения растворителя. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет циано, могут быть получены путем дегидратации соответствующего соединения формулы (I), в котором R2 представляет CH=N-OH. Процесс может быть выполнен путем осуществления взаимодействия с трифторуксусным ангидридом, уксусным ангидридом или оксихлоридом фосфора при температуре от 20 С до температуры кипения смеси при нагревании с обратным холодильником. Дегидратация может быть также осуществлена в соответствии с процессом, описанным в Synthesis (1983), стр. 741, путем проведения реакции с ацетатом меди (II) в смеси ацетонитрила и воды при температуре от 20 С до температуры кипения смеси при нагревании с обратным холодильником. В соответствии с еще одним признаком настоящего изобретения сложные тиоловые эфиры формулы (I), в которых R2 представляет-COSR7, где R7 - такой, как определено выше,могут быть получены путем хлорирования соответствующего соединения формулы (I), в котором R2 представляет -СО 2 Н, с использованием 16 хлорирующего агента (например, оксалилхлорида) в инертном растворителе (например, дихлорметане или 1,2-дихлорэтане), возможно, в присутствии катализатора, такого, как N,Nдиметилформамид, при температуре от 20 С до температуры кипения смеси с обратным холодильником с получением соответствующего хлорангидрида кислоты, который затем подвергают взаимодействию с тиолом формулы R7SH,где R7 - такой, как определено выше, в инертном растворителе, например тетрагидрофуране, при температуре в пределах от 0 С до температуры кипения растворителя при нагревании с обратным холодильником. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CH2F, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СН 2 ОН, с трифторидом диэтиламиносеры в инертном растворителе,например, дихлорметане, при температуре 060 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CHFR7, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -CH(OH)R7, с трифторидом диэтиламиносеры в инертном растворителе, например, дихлорметане, при температуре 0-60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CONR9R10, где R9 иR10 - такие, как определены выше, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R2 представляет -СO2 Н, с хлорирующим агентом для получения описанным выше способом хлорангидрида карбоновой кислоты,который затем подвергают взаимодействию с амином формулы R9R10NH, где R9 и R10 - такие,как определены выше, в инертном растворителе,например, эфире или тетрагидрофуране, при температуре от 0 С до температуры кипения смеси при нагревании с обратным холодильником. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R2 представляет -CO2H, могут быть получены путем окисления соответствующего соединения формулы (I), в котором R2 представляет -СНО, с использованием способов,описанных у R. С. Larock в Comprehensive Organic Transformations, стр. 838, например, осуществлением взаимодействия с дихроматом пиридиния в N,N-диметилформамиде при температуре 0-60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R1, R3, R4, R5 и W - такие, как опреде 17 лены выше, и R2 представляет C1-С 10 алкильную группу, замещенную группой -NR9R10, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором группа -NR9R10 замещена уходящей группой, предпочтительно хлором или бромом, с амином формулы R9R10NH. Реакцию обычно осуществляют в инертном растворителе,например, этаноле, при температуре 0-60 С. В соответствии с еще одним признаком настоящего изобретения соединения формулы (I),в которых R6 представляет низший алкил, алкенил, алкинил, -COR7 или -CO2R7, могут быть получены путем осуществления взаимодействия соответствующего соединения формулы (I), в котором R6 представляет водород, с соединением формулы R61-Х 1, где R61 представляет низший алкил, алкенил, алкинил, -COR7 или -CO2R7 и X1 представляет уходящую группу. Предпочтительно Х 1 представляет галоген, особенно хлор. Реакцию обычно осуществляют в присутствии основания (например, гидрида натрия) в инертном растворителе (например, N,Nдиметилформамиде) при температуре от 0 до 60C. В соответствии с ещ одним признаком настоящего изобретения соединения формулы (I),в которых n представляет один или два, обычно получают путем окисления атома серы соответствующего соединения, в котором n представляет ноль или один. Окисление атома серы обычно осуществляют с использованием, например 3 хлорпербензойной кислоты в инертном растворителе, таком, как дихлорметан, при температуре от -40 С до комнатной температуры. Промежуточные соединения при получении соединений по настоящему изобретению могут быть получены путем применения или приспосабливания известных способов, например, таких, как описанные ниже. Хлорангидриды кислот формулы (II) могут быть получены путем осуществления взаимодействия соединения формулы (IV) с хлорирующим агентом, например, оксалилхлоридом,в инертном растворителе, таком, как дихлорметан или 1,2-дихлорэтан, необязательно в присутствии катализатора, такого, как N,N-диметилформамид, при температуре от -20 С до температуры кипения смеси при нагревании с обратным холодильником. Хлорангидриды кислот формулы (II) могут быть также получены путем осуществления взаимодействия карбоновой кислоты вышеприведенной формулы (IV) со смесью трифенилфосфина и тетрахлорида углерода, например, в соответствии с методом, описанным Ли (Lee) вJ. Am. Chem. Soc. (1966), 88, 3440. Кислоты формулы (IV) могут быть получены гидролизом сложного эфира формулы где R1, R2, R4 и R5 - такие, как определены выше,и R8a - представляет алкильную группу, предпочтительно метил или этил. Реакцию осуществляют в присутствии основания, например, гидроксида натрия или калия в растворителе, например водном спирте, при температуре от 0C до температуры кипения растворителя при нагревании с обратным холодильником. Кислоты формулы (IV) могут быть также получены путем осуществления взаимодействия сложного бензилового эфира формулы (VII): где R1, R2, R4 и R5 - такие, как определены выше,и Bz означает бензил, с бромидом алюминия и анизолом в присутствии нитрометана в инертном растворителе при температуре 0-50 С. Сложные трет-бутилдиметилсилиловые эфиры формулы (V), где R1, R2, R4 и R5 - такие, как определено выше, и TMS заменен трет-бутилдиметилсилильной группой, могут быть получены путем переэтерификации сложного бензилового эфира формулы (VII) с использованием третбутилдиметилсилана. Реакцию осуществляют в присутствии палладиевого катализатора, например, Pd(OAc)2, и основания, например, триэтиламина, в инертном растворителе, например,дихлорметане, при 0-60 С по методу, описанному в Tetrahedron Letters (1986), том 27, с. 3753-3754. Сложные триметилсилиловые эфиры формулы (V) могут быть получены, возможно in situ(на месте), путем осуществления взаимодействия соединения приведенной выше формулы(IV) с хлортриметилсиланом в инертном растворителе, например, эфире, при температуре в пределах от 0 С до температуры кипения растворителя. Сложные эфиры формулы (VI) или (VII) могут быть получены путем осуществления взаимодействия соединения формулы (VIII): где R1 и R2 - такие, как определены выше, с имином формулы CH2=NC(R4) (R5)CO2R8a или формулы CH2=NC(R4) (R5) CO2Bz соответственно, где R4, R5, R8a и Bz - такие, как определены выше. Реакция может быть осуществлена в присутствии или в отсутствие растворителя при температуре от 90 до 200 С или температуре кипения растворителя. При использовании инертного растворителя, например ксилола, получающийся ацетон предпочтительно удаляют путем перегонки. 19 Сложные эфиры формулы (VI) или (VII) могут быть также получены путем осуществления взаимодействия соединения формулы (IX):R2C(O)-CH(R1)-CO2R13 (IX) 1 2 где R и R - такие, как определены выше, и R13 представляет алкильную группу (предпочтительно метил или этил), с имином формулыCH2=NC(R ) (R )CO2Bz соответственно, где R4,R5, R8a и Bz - такие, как определено выше. Реакцию осуществляют с использованием условий,аналогичных тем, которые используют для получения соединений формулы (VI) или (VII) из соединений вышеприведенной формулы (VIII). Имины, имеющие формулу CH2=NC(R4) 5(R )CO2Bz, могут быть получены путем осуществления взаимодействия сложного эфира аминокислоты, имеющего формулу H2N-C(R4)(R5)CO2R8a или формулу H2N-C(R4)(R5)CO2Bz соответственно, где R4, R5, R8a и Bz - такие, как определено выше, с формальдегидом, предпочтительно в виде водного раствора, при температуре в пределах от температуры окружающей среды до 60 С. Промежуточные соединения формулы (II),(IV), (V), (VI) и (VII) являются новыми соединениями и как таковые составляют еще один признак настоящего изобретения. Соединения формул (III), (VIII) и (IX) известны или могут быть получены известными способами, например такими, как описанные в публикацииWO 93/15064 международного патента. Следующие далее неограничивающие примеры иллюстрируют изобретение. Пример 1. К перемешанному раствору N-(2,5 дифторфенил)-2-(2,3-дигидро-6-метилтиометил 4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамида (1,00 г) в дихлорметане, охлажденному в водяной бане со льдом, прибавляли м-хлорпероксибензойную кислоту (чистота 75%, 2,55 г). Смесь перемешивали при температуре окружающей среды в течение 2 ч, вливали в насыщенный раствор бикарбоната натрия и экстрагировали дихлорметаном. Органический раствор промывали по очереди насыщенным раствором бикарбоната натрия и рассолом (раствором соли), сушили (сульфат магния) и выпаривали растворитель при пониженном давлении. Остаток очищали путем хроматографии на силикагеле с элюированием смесью гексанэтилацетат, что дало N-(2,5-дифторфенил)-2(2,3-дигидро-6-метилсульфонилметил-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид(соединение 1, 0,21 г) в виде белого твердого вещества, т. пл, 160-162 С. Пример 2. К перемешанному раствору 2-(2,3 дигидро-6-метилтиометил-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропановой кислоты(13,00 г) в N,N-диметилформамиде при 20 С прибавляли раствор дициклогексилкарбодиимида (10,04 г) в N,N-диметилформамиде. К раствору при 20 С прибавляли 2,5-дифторанилин(7,84 г) и перемешивали раствор при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли этилацетатом, после чего вливали в воду и путем фильтрования удаляли высокодисперсную взвесь. Органический слой промывали по очереди 0,5 М хлороводородной кислотой, рассолом, 1,0 М карбонатом натрия и рассолом и затем сушили (сульфат магния). Органический раствор выпаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле с элюированием дихлорметаном, что дало N-(2,5-дифторфенил)2-(2,3-дигидро-6-метилтиометил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид(соединение 3, 1,35 г) в виде желтого твердого вещества, ЯМР (СDСl3) 1,68 (с, 6 Н), 2,10 (с, 3 Н),3,22 (с, 2 Н), 5,30 (с, 2 Н), 6,64-6,76 (м, 1 Н), 6,957,05 (м, 1 Н), 7,25-7,38 (м, 5 Н), 8,11-8,21 (м, 2 Н). Аналогичным образом было также получено следующее соединение: N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метилтиометил-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 4) в виде оранжевого масла, ЯМР (СDСl3) 1,72 (с, 6 Н), 2,10 (с, 3 Н), 3,23(0,70 г) в дихлорметане прибавляли оксалилхлорид (0,22 мл), а затем 1 каплю диметилформамида. Реакционную смесь перемешивали при температуре окружающей среды в течение 30 мин и затем охлаждали до 0 С. К раствору прибавляли по очереди триэтиламин (0,36 мл), 3 аминобензотрифторид (0,34 г) и затем триэтиламин (0,36 мл). Реакционную смесь перемешивали при 0C в течение 30 мин и при температуре окружающей среды в течение 2 ч, после чего промывали по очереди водой, 2 М хлороводородной кислотой, водой, 1 М раствором карбоната натрия и водой. Органический раствор сушили (сульфат магния) и выпаривали при пониженном давлении с получением N-(3-трифторметилфенил)-2-(6-дифторметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамида (соединение 2, 0,25 г) в виде бежевого твердого вещества, т. пл. 58-60 С. Аналогичным образом были получены следующие соединения:N-(3,5-дихлорфенил)-2-(6-бромметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 15) в виде белого твердого вещества, т. пл. 122-125 С;N-(3,5-дихлорфенил)-2-(2,3-дигидро-6 метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропанамид (соединение 111) в виде белого твердого вещества, т. пл. 120,5122 С;N-(2,5-дифторфенил)-2-(2,3-дигидро-6 метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропанамид (соединение 35) в виде желтого твердого вещества, т. пл. 113114,5 С;N-(3-трифторметилфенил)-2-(2,3-дигидро 6-метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 33) в виде твердого вещества кремового цвета, т. пл. 103-104,5 С;N-(3,5-дихлорфенил)-2-(6-фторметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 112) в виде желтого твердого вещества, т. пл. 161-162,5 С;N-(2,5-дифторфенил)-2-(6-хлорметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 25) в виде твердого вещества персикового цвета, т. пл. 135,5-137 С;N-(3,5-дихлорфенил)-2-(6-хлорметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 114) в виде бежевого твердого вещества, т. пл. 159-162 С;N-(3-трифторфенил)-2-(6-хлорметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 24) в виде оранжевого твердого вещества, т. пл. 161,5163 С;N-(5-хлор-2-метилфенил)-2-(2,3-дигидро 6-метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 124) в виде твердого вещества кремового цвета, т. пл. 116,5-117,5 С;N-(3-хлорфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 34) в виде желтого твердого вещества, т. пл. 92,5-94,5 С;N-(2-фтор-5-трифторметилфенил)-2-(2,3 дигидро-6-метоксиметил-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропанамид (соединение 36) в виде белого твердого вещества, т. пл. 89-90,5 С;N-[2,5-дифторфенил)-2-(6-этоксиметил 2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамид (соединение 125) в виде желтого твердого вещества, т. пл. 110-112,5 С;N-(3,5-дихлорфенил)-2-(6-этоксиметил 2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамид (соединение 126) в виде белого твердого вещества, т. пл. 129,5-131 С;(СDСl3)1,65 (с, 6 Н), 4,8 (д, 2 Н), 5,35 (с, 2 Н),7,1-7,3 (м, 9 Н). Следующие четыре соединения были получены из 2-(6-циклопропил-2,3-дигидро-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановой кислоты, причем в ходе реакции циклопропильное кольцо раскрывали добавлением НСl (образованной в ходе реакции) с образованием соответствующих 6-(3-хлорпропил) замещенных производных оксазинона:-20 С прибавляли мхлорпероксибензойную кислоту (чистота 75%,0,54 г). Смесь перемешивали при -20 С в течение 1 ч, разбавляли дихлорметаном, промывали 1 М раствором карбоната натрия, сушили (сульфат магния) и выпаривали при пониженном давлении растворитель. Остаток растирали с диэтиловым эфиром, получив в результате N(2,5-дифторфенил)-2-(2,3-дигидро-6-метилсульфинилметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил]-2-метилпропанамид (соединение 5, 0,51 г) в виде белого твердого вещества, т. пл. 124-128 С. Аналогичным образом получили следующее соединение:N-(3-трифторметилфенил)-2-(2,3-дигидро 6-метилсульфинилметил-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил]-2-метилпропанамид (соединение 6) в виде белого твердого вещества, т. пл. 105-107 С. Пример 5. Смесь N-(3-хлорфенил)-2-(6-бромметил 2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил]-2-метилпропанамида (соединение 8, 0,2 г) и иодида натрия (0,065 г) в ацетоне нагревали с обратным холодильником в течение 18 ч, после чего выпаривали с получением остатка, который вновь растворяли в эфире. Эфирный раствор промывали по очереди насыщенным водным раствором тиосульфата натрия и водой, сушили(сульфат магния) и выпаривали при пониженном давлении с получением остатка, который очищали путем хроматoграфии на сухих колонках с силикагелем с элюированием смесью этилацетатдихлорметан, что дало N-(3-хлорфенил)-2-(2,3-дигидро-6-иодметил-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил]-2-метилпропанамид(соединение 9, 0,04 г) в виде белого твердого вещества, т. пл. 134,6-136,6 С; Пример 6. Смесь N-(3-хлорфенил)-2-(2,3-дигидро-6 метил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил]-2 метилпропанамида (1,0 г), N-бромсукцинимида(0,45 г), азобисизобутиронитрила (10 мг) в тетрахлориде углерода нагревали при 65 С в течение 2 ч. Повторно добавляли N-бромсукцинимид (0,1 г) и нагревали раствор при 65 С в течение еще 2 ч. Затем раствору давали остыть и удаляли при пониженном давлении растворитель с получением коричневого остатка, который очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью этилацетатдихлорметан, что дало N-(3 хлорфенил)-2-(6-бромметил-2,3-дигидро-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил]-2-метилпропанамид (соединение 8, 0,1 г) в виде белого твердого вещества, т. пл. 89,8-90,8 С. Аналогичным образом получили следующие соединения:(СDСl3)1,72 (с, 6 Н), 5,3 (с, 2 Н), 6,09 (с, 1 Н),7,03-7,08 (м, 1 Н), 7,16-7,5 (м, 7 Н), 7,63 (т, 1 Н),7,97 (шс, 1 Н). Пример 7. К перемешанной суспензии тиометоксида натрия (0,18 г) в тетрагидрофуране прибавлялиN-(3,5-дихлорфенил)-2-(6-бромметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 15, 1,0 г). Смесь перемешивали при комнатной температуре в течение 1 ч, вливали в смесь эфира и воды и эфирный слой промывали раствором (0,5 М) гидроксида натрия и рассолом, сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем, с элюированием смесью дихлорметанизогексан, а затем смесью изогексан-этилацетат,что дало N-(3,5-дихлорфенил)-2-(2,3-дигидро-6 метилтиометил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропанамид (соединение 99, 0,63 г) в виде белого твердого вещества, т. пл. 129130 С. Аналогичным образом получили следующие соединения:N-(3,5-дихлорфенил)-2-(6-этилтиометил)2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамид (соединение 100) в виде белого твердого вещества, т. пл 104,5-105,5 С; иN-(3-трифторметилфенил)-2-(6-этилтиометил)-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 101) в виде белого твердого вещества, т. пл. 128129 С. Пример 8. К перемешанному растворуN-(3 трифторметилфенил)-2-(6-ацетоксиметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамида (0,8 г) в метаноле прибавляли порциями раствор карбоната калия (0,33 г) в воде. Смесь перемешивали еще 4 ч при комнатной температуре, выпаривали и остаток растворяли в смеси эфира и воды. Органический слой сушили (сульфат магния), выпаривали и остаток очищали путем хроматографии на сухих колонках с элюированием эфиром, что дало N(3-трифторметилфенил)-2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 102, 0,31 г) в виде смолы, ЯМР (CDCl3)1,7 (с, 6 Н), 4,1 (д,2 Н), 5,3 (с, 2 Н), 7,1-7,3 (м, 2 Н), 7,55 (м, 1 Н), 7,75(м, 1 Н), 8,3 (с, 1 Н). Аналогичным образом получили следующие соединения:N-[2,5-дифторфенил)-2-(2,3-дигидро-6 гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропанамид (соединение 130) в виде желтого твердого вещества, т. пл. 69,571,5 С. Это соединение использовали также для получения соединения 129 (см. пример 18). Пример 9. СмесьN,N-диметилформамиде в течение 3 ч. Охлажденный раствор разбавляли эфиром, промывали водой, сушили (сульфат магния) и выпаривали в вакууме с получением N-(3-трифторметилфенил)-2-(6-ацетоксиметил)-2,3-дигидро-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамида (соединение 103, 0,81 г) виде белого твердого вещества, т. пл. 76,5-77,5 С. Аналогичным образом получили следующее соединение:N-(3,5-дихлорфенил)-2-(6-ацетоксиметил)2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамид (соединение 104) в виде желтого твердого вещества, т. пл. 125-126 С. Пример 10. К перемешанной суспензииN-(3 трифторметилфенил)-2-(6-бромметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамида (0,5 г) в этаноле прибавляли метиламин (2 мл 33%-ного раствора в этаноле). Смесь перемешивали при комнатной температуре в течение 1 ч. Раствор разбавляли (этилацетат), промывали (вода), сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью метанол-гексан,получив в результате N-(3-трифторметилфенил)-2-(2,3-дигидро-6-метиламинометил-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 105, 0,21 г) в виде оранжевой смолы, ЯМР (СDСl3)1,6 (с, 6 Н), 2,25 (с,3 Н), 3,25 (с, 2 Н), 5,3 (с, 2 Н), 7,1-7,3 (м, 8 Н), 7,55(м, 1 Н), 7,75 (с, 1 Н), 8,45 (с, 1 Н). Аналогичным образом получили следующие соединения:N-(3,5-дихлорфенил)-2-(2,3-дигидро-6 метиламинометил-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид (соединение 108) в виде твердого вещества кремового цвета,т. пл. 60-66 С. Пример 11. К суспензии хлорхромата пиридиния (0,45 г) в дихлорметане, перемешанной при комнатной температуре прибавляли раствор N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-гидроксиметил 4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамида (0,6 г) в дихлорметане. Через 1,5 ч смесь разбавляли этилацетатом, промывали водой, сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием этилацетатом, что дало N-(3,5-дихлорфенил)-2(2,3-дигидро-6-формил-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид (соединение 109, 0,35 г) в виде желтого твердого вещества, т. пл. 144-146 С. Аналогичным образом, но из N-(3,5 дихлорфенил)-2-[2,3-дигидро-6-(1-гидроксиэтил)-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил]-2 метилпропанамида и в дополнительном присутствии порошковидного молекулярного сита 4 А получили N-(3,5-дихлорфенил)-2-(6-ацетил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 127) в виде желтого твердого вещества, т. пл. 92-95 С. Пример 12. К раствору трет-бутилдиметилсилил 2-(6 ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропаноата (0,92 г) в дихлорметане прибавляли оксалилхлорид (0,2 мл), а затем N,N-диметилформамид (1 каплю). Смесь перемешивали 0,5 ч и прибавляли раствор 2,5-дифторанилина (0,3 г). Через 0,3 ч прибавляли триэтиламин (0,6 мл), перемешивали раствор в течение 1 ч и затем выпаривали его. Остаток растворяли в этилацетате, промывали водой, хлороводородной кислотой (2 М) и раствором бикарбоната натрия, сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием этилацетатом, что дало N(2,5-дифторфенил)-2-(6-ацетоксиметил-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 110, 0,18 г) в виде смолы, ЯМР (СDСl3)1,5 (с, 6 Н), 2,1 (с,3 Н), 4,6 (с, 2 Н), 5,4 (с, 2 Н), 6,65 (м, 1 Н), 6,95 (м,1 Н), 7,2-7,4 (м, 5 Н), 8,05 (с, 1 Н), 8,1 (м, 1 Н). Аналогичным образом получили N-(2 хлор-5-метилфенил)-2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамид (соединение 122) в виде оранжевого твердого вещества, т. пл. 87-90 С. Пример 13. К перемешанному раствору N-(3,5 дихлорфенил)-2-(6-формил-2,3-дигидро-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамида (1,5 г) в этаноле при комнатной темпера 27 туре прибавляли гидроксиламингидрохлорид(0,31 г), а затем ацетат натрия (0,37 г). Через 10 мин выпавшее в осадок твердое вещество отфильтровывали, промывали этанолом и водой и высушивали, получив в результате N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-гидроксииминометилен-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 115, 0,53 г), т. пл. 207,5-209,5 С. Аналогичным образом, но с использованием соответствующего производногоN-(3,5-дихлорфенил)-2-(6-этоксииминометилен-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 116) в виде твердого вещества кремового цвета, т. пл. 184,5-186,5 С;N-(2,5-дифторфенил)-2-(2,3-дигидро-6 метоксииминометилен-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид (соединение 128) в виде белого твердого вещества, т. пл. 189,5-190,5 С. Пример 14. К перемешанному раствору N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-гидроксииминометилен-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамида (0,4 г) в пиридине (3 мл) при -5 С прибавляли уксусный ангидрид (3 мл). Через 1,5 ч смесь вливали в воду со льдом и экстрагировали этилацетатом. Экстракт промывали хлороводородной кислотой (2 М) и рассолом,сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью гексанэтилацетат, что дало N-(3,5 дихлорфенил)-2-(6-ацетоксииминометилен-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 118, 0,32 г) в виде не совсем белого твердого вещества, т. пл. 125-127 С. Пример 15. К перемешанному раствору N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-формил-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамида (0,5 г) в этаноле при комнатной температуре прибавляли гидрат гидразина (0,06 мл). Через 0,5 ч выпаривали растворитель и остаток растворяли в этилацетате и промывали водой и рассолом, сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью гексан-этилацетат, что дало N-(3,5 дихлорфенил)-2-(6-аминоиминометилен-2,3 дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропанамид (соединение 119, 0,19 г) в 28 виде бледно-желтого твердого вещества, т. пл. 153-155 С. Аналогичным образом получили N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-метиламиноиминометилен-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамид (соединение 121) в виде бежевого твердого вещества, т. пл. 146-149 С. Пример 16. К перемешанному раствору N-(3,5 дихлорфенил)-2-(2,3-дигидро-6-гидроксииминометилен-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропанамида (0,4 г) в пиридине (4 мл) при -5C прибавляли трифторуксусный ангидрид (3 мл). Через 0,5 ч добавляли лед и этилацетат и смесь перемешивали в течение 1 ч. Органическую фазу промывали водой, сушили(сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью гексанэтилацетат, что дало N-(3,5-дихлорфенил)-2-(6 циано-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамид (соединение 120, 0,16 г) в виде белого твердого вещества, т. пл. 132,5-135 С. Пример 17. К перемешанному раствору N-(3,5 дихлорфенил)-2-(6-формил-2,3-дигидро-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамида (1,0 г) в сухом тетрагидрофуране под инертной атмосферой при 5 С прибавляли по каплям метилмагнийбромид (1,7 мл 3 М раствора в эфире). Через 1 ч выдерживания при этой температуре прибавляли насыщенный раствор хлорида аммония и этилацетат. Органическую фазу промывали рассолом, сушили (сульфат магния) и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью дихлорметанэтилацетат и в результате получили N-(3,5 дихлорфенил)-2-[2,3-дигидро-6-(1-гидроксиэтил)-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил]-2 метилпропанамид (соединение 123, 0,27 г) в виде твердого вещества кремового цвета, т. пл. 85-88 С. Пример 18. Раствор N-(2,5-дифторфенил)-2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропанамида (1,0 г) в дихлорметане прибавляли к перемешанной смеси хлорхромата пиридиния (0,8 г) и порошкообразного молекулярного сита 4 А (1,6 г) в дихлорметане. Спустя 2 ч смесь очищали непосредственно путем хроматографии на сухих колонках с силикагелем с элюированием дихлорметаном и получили в результате N-(2,5 дифторфенил)-2-(2,3-дигидро-6-формил-4-оксо 5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид (соединение 129, 0,83 г) в виде бледнозеленого твердого вещества, т. пл. 76-77,5 С. Ссылочный пример 1. К перемешанному раствору этил 2-(2,3 дигидро-6-метилтиометил-4-оксо-5-фенил-4 Н 29 1,3-оксазин-3-ил)-2-метилпропаноата (68 г) в смеси этанола и 1,4-диоксана прибавляли раствор гидроксида натрия (16,43 г) в воде. Раствор нагревали при 60 С в течение 6 ч, давали ему остыть и удаляли при пониженном давлении растворитель с получением оранжевого масла,которое растворяли в воде. Водный раствор промывали дихлорметаном, подкисляли до рН 1 концентрированной хлороводородной кислотой,экстрагировали дихлорметаном и экстракт сушили сульфатом магния и выпаривали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле с элюированием смесью дихлорметан-этилацетат и в результате получили 2-(2,3-дигидро-6-метилтиометил-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту (24,2 г) в виде желтого твердого вещества, т. пл. 136-137 С. Аналогичным образом получили следующие соединения: 2-(2,3-дигидро-6-метил-4-оксо-5-фенил 4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту в виде белого твердого вещества, т. пл. 200,5-201,5 С; и 2-(6-циклопропил-2,3-дигидро-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту, т. пл. 188,5-189,5 С. Ссылочный пример 2. Раствор 2,2-диметил-6-метилтиометил-6 фенил-4 Н-1,3-диоксин-4-она (51,64 г) и этил 2(N-метиленамино)-2-метилпропаноата (30,98 г) в ксилоле нагревали в масляной бане в течение 2 ч, причем температуру масляной бани поддерживали на уровне 180 С. Образованный во время реакции ацетон удаляли путем отгонки и для сохранения концентрации на том же уровне добавляли равный объем ксилола. Давали раствору остыть и выпаривали его при пониженном давлении с получением этил 2-(2,3-дигидро-6 метилтиометил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропаноата в виде оранжевого масла (68 г), ЯМР (CDCl3)1,23 (т, 3 Н), 1,56 (с,6 Н), 2,09 (с, 3 Н), 3,21 (с, 2 Н), 4,16 (кв, 2 Н), 5,35(с, 2 Н), 7,25-7,4 (м, 5 Н). Аналогичным образом получили следующие соединения: бензил 2-(6-ацетоксиметил-2,3-дигидро-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат в виде белого твердого вещества (2,7 г),т. пл. 105-106C; этил 2-(2,3-дигидро-6-метил-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат в виде оранжевого масла, ЯМР (CDCl3)1,22 (т,3 Н), 1,58 (с, 6 Н), 1,90 (с, 3 Н), 4,12 (кв, 2 Н), 5,28(с, 2 Н), 7,2-7,48 (м, 5 Н); и трет-бутил 2-(6-ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропаноат в виде желтого твердого вещества, т.пл. 125-125,7 С. Ссылочный пример 3.(168,8 г) в N,N-диметилформамиде при 10 С прибавляли порциями тиометоксид натрия(39,75 г). После перемешивания при температуре окружающей среды в течение 18 ч раствор вливали в воду и экстрагировали этилацетатом. Органический раствор промывали по очереди водой и рассолом и сушили (сульфат магния). Органический раствор выпаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле с элюированием смесью гександихлорметан, что дало 2,2 диметил-6-метилтиометил-5-фенил-4 Н-1,3 диоксин-4-он (103,3 г) в виде желтого твердого вещества, ЯМР (CDCI3)1,80 (с, 6 Н), 2,12 (с,3 Н), 3,20 (с, 2 Н), 7,26-7,41 (м, 5 Н). Ссылочный пример 4. Перемешанную суспензию 2-амино-2 метилпропановой кислоты (165 г) в этаноле при 0 С насыщали газообразным хлороводородом. Смесь нагревали с обратным холодильником в течение 4 ч и выпаривали при пониженном давлении растворитель с получением этил 2-амино 2-метилпропаноатгидрохлорида в виде белого твердого вещества. К суспензии этого твердого вещества в воде медленно прибавляли карбонат натрия (100 г), а затем 40%-ный водный раствор формальдегида (150 г), и перемешивали суспензию в течение 3 ч. Смесь экстрагировали эфиром, органический раствор промывали водой,сушили (сульфат магния) и выпаривали при пониженном давлении растворитель, получив в результате этил 2-(N-метиленамино)-2-метилпропаноат (137,8 г) в равновесии с его тримером 1,3,5-три(1-этоксикарбонил-1-метилэтил)гексагидротриазином в виде бесцветного масла, ИК(жидкая пленка) 2980 (s), 1725 (vs), 1250 (s),1140 (vs). Аналогичным образом получили следующее соединение: трет-бутил 2-(N-метиленамино)-2-метилпропаноат в виде желтой жидкости, ИК (жидкая пленка) 2978 (m), 1725 (s), 1370 (m), 1250 (m),1135 (vs) см-1. Ссылочный пример 5. К перемешанному раствору бензил 2-(6 дифторметил-2,3-дигидро-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропаноата (1,93 г) и анизола (3,1 г) в дихлорметане при 0 С под инертной атмосферой прибавляли порциями раствор трибромида алюминия (3,85 г) в нитрометане. Реакционную смесь перемешивали при 0 С в течение 10 мин и при температуре окружающей среды в течение 2 ч и разбавляли дихлорметаном. Дихлорметановый раствор промывали по очереди 2 М хлороводородной кислотой и водой. Органический раствор экстрагировали 1 М раствором бикарбоната натрия, после чего водный экстракт промывали диэтиловым эфиром и подкисляли до рН 1 посредством 2 М хлороводородной кислоты. Кислый раствор экстрагировали этилацетатом, экстракт сушили(сульфат магния) и выпаривали при пониженном давлении с получением 2-(6-дифторметил 2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропановой кислоты (0,70 г) в виде розового твердого вещества, т. пл. 149-151 С. Аналогичным образом получили следующее соединение: 2-(6-бромметил-2,3-дигидро-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту в виде желтого твердого вещества, ЯМР (CDCl3)1,55 (с, 6 Н), 3,8 (с, 2 Н), 5,3 (с,2 Н), 7,3 (м, 5 Н). Ссылочный пример 6. К перемешанному раствору бензил 2-(6 формил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропаноата (2,0 г) в дихлорметане при 0 С прибавляли диэтиламиносератрифторид (1,3 мл). Раствор перемешивали при 0 С в течение 0,5 ч и при температуре окружающей среды в течение 3 ч. Раствор вливали в насыщенный водный раствор хлорида аммония, органическую фазу сушили (сульфат магния) и выпаривали при пониженном давлении с получением бензил 2-(6-дифторметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропаноата (2,1 г) в виде желтой смолы,ЯМР (CDCl3) 1,55 (с, 6 Н), 4,95 (с, 2 Н), 5,2 (с,2 Н), 5,95 (т, 1 Н), 7,15-7,4 (м, 10 Н). Ссылочный пример 7. К перемешанной суспензии хлорхромата пиридиния (0,9 г) в дихлорметане при температуре окружающей среды прибавляли в течение 5 мин раствор бензил 2-(2,3-дигидро-6 гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропаноата (1,0 г) в дихлорметане. После перемешивания в течение 1 ч реакционную смесь разбавляли дихлорметаном и промывали водой. Органический раствор сушили(сульфат магния) и выпаривали из него при пониженном давлении растворитель, получив в результате бензил 2-(6-формил-2,3-дигидро-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат (0,85 г) в виде оранжевой смолы, ЯМР(шс, 5 Н), 7,3-7,4 (м, 5 Н), 9,25 (С, 1 Н). Ссылочный пример 8. К перемешанному раствору бензил 2-(6 ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропаноата (2,70 г) в метаноле при 0 С прибавляли порциями раствор карбоната калия (0,96 г) в воде. Смесь перемешивали при температуре окружающей среды в течение 1 ч и выпаривали при пониженном давлении растворитель. Остаток подкисляли 2 М хлороводородной кислотой, экстрагировали диэтиловым эфиром, экстракт сушили (сульфат магния) и, выпарив при пониженном давлении растворитель, получили бензил 2-(2,3-дигидро 6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат (2,51 г) в виде жел 001145 32 той смолы. ЯМР (CDCl3)1,6 (с, 6 Н), 4,15 (с,2 Н), 5,1 (с, 2 Н), 5,3 (с, 2 Н), 7,26-7,42 (м, 10 Н). Аналогичным образом получили следующее соединение: трет-бутил 2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропаноат в виде твердого вещества кремового цвета, т. пл. 115-116,5 С. Ссылочный пример 9. К перемешанному раствору бензил 2 амино-2-метилпропаноата (28,0 г) в диэтиловом эфире при температуре окружающей среды прибавляли в течение 10 мин 37%-ный водный раствор формальдегида (17,3 г). Двухфазную смесь перемешивали в течение 2 1/2 ч, после чего разбавляли диэтиловым эфиром и промывали рассолом. Эфирный раствор сушили(сульфат магния) и выпаривали из него при пониженном давлении растворитель, получив в результате бензил 2-(N-метиленамино)-2 метилпропаноат (29,4 г) в равновесии с его тримером 1,3,5-три(1-бензилоксикарбонил-1-метилэтил)гексагидротриазином в виде бесцветного масла, ИК (жидкая пленка) 2980 (m), 1725 (vs),1250 (m), 1135 (vs). Ссылочный пример 10. Смесь 2-(2,3-дигидро-6-метил-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановой кислоты (27,5 г) и трифенилфосфина (34,5 г) в тетрахлорметане (173 мл) и дихлорметане нагревали с обратным холодильником в течение 45 мин. Реакционную смесь охлаждали в ледяной бане и добавляли к ней по каплям с перемешиванием 3-хлоранилин (12,8 г) и затем триэтиламин (14,0 мл). Смесь перемешивали при температуре окружающей среды в течение 2 ч и выпаривали при пониженном давлении. Остаток суспендировали в этилацетате и путем фильтрования удаляли нерастворимый материал. Фильтрат выпаривали при пониженном давлении и остаток очищали путем хроматографии на силикагеле с элюированием смесью этилацетатгексан, в результате чего получили N-(3 хлорфенил)-2-(2,3-дигидро-6-метил-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропанамид(18,8 г) в виде белого твердого вещества, т. пл. 146,5-149,9 С. Аналогичным образом получили N-(3 трифторметилфенил)-2-метил-2-(6-метил-5 фенил-2,3-дигидро-4-оксо-4 Н-1,3-оксазин-3-ил) пропанамид, т.пл. 113,5-114,5 С. Ссылочный пример 11. Следуя процедуре, описанной в примере 3,получили следующее промежуточное соединение: N-(3-трифторметилфенил)-2-(2,3-дигидро 6-метил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамид в виде белого твердого вещества, т. пл. 148,8-141,6 С. Ссылочный пример 12. К раствору бензил 2-(2,3-дигидро-6 гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 33 3-ил)-2-метилпропаноата (61,1 г) в смеси эфира и тетрагидрофурана при -78 С прибавляли в течение 0,5 ч раствор трибромида фосфора (5,1 мл) в эфире. Затем смесь перемешивали при 10 С в течение 4 ч и при комнатной температуре в течение 1 ч, после чего промывали водой,сушили сульфатом магния и выпаривали. Очищение остатка путем хроматографии на сухих колонках с силикагелем дало бензил 2-(6 бромметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3 оксазин-3-ил)-2-метилпропаноат (46,1 г), ЯМР(с, 2 Н), 7,2 (с, 5 Н). Ссылочный пример 13. Смесь ацетата палладия (II) (25 мг), третбутилдиметилсилана (1,25 мл) и триэтиламина(0,05 мл) в дихлорметане перемешивали при комнатной температуре в инертной атмосфере в течение 0,25 ч. Прибавляли раствор бензил 2-(6 ацетоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропаноата (1,0 г) и продолжали перемешивать еще 18 ч. Смесь фильтровали (hyflo) и выпаривали с получением трет-бутилдиметилсилил 2-(6-ацетоксиметил 2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3 ил)-2-метилпропаноата (0,92 г) в виде желтого масла, ЯМР (CDCl3)0,25 (с, 9 Н), 1,5 (с, 6 Н),2,0 (с, 3 Н), 4,5 (с, 2 Н), 5,2 (с, 2 Н), 7,0-7,3 (м, 5 Н). Аналогичным образом получили следующие соединения: трет-бутилдиметилсилил 2-(2,3-дигидро-6 метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин 3-ил)-2-метилпропаноат в виде желтого масла,ЯМР (CDCl3)0,15 (с, 6 Н), 0,79 (с, 9 Н), 1,43 (с,6 Н), 3,22 (с, 3 Н), 3,83 (с, 2 Н), 5,22 (с, 2 Н), 7,1-7,3(м, 5 Н); и трет-бутилдиметилсилил 2-(6-этоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат в виде бледножелтого масла, который сразу же использовали на следующей стадии, поскольку он был не очень устойчив. Ссылочный пример 14. Смесь трет-бутил 2-(2,3-дигидро-6-метоксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропаноата (2,6 г) и трифторуксусной кислоты (2,05 г) перемешивали в дихлорметане в течение 20 ч при 35 С. Еще добавляли трифторуксусной кислоты (0,82 г) и раствор нагревали с обратным холодильником в течение 24 ч. Охлажденную смесь разбавляли дихлорметаном и экстрагировали раствором карбоната натрия. Водный экстракт подкисляли 2 М раствором хлороводородной кислоты, экстрагировали этилацетатом, сушили сульфатом магния и выпаривали. Остаток растворяли в этилацетате и выпаривали (три раза), опять растворяли в гексане и выпаривали с получением 2-(2,3 дигидро-6-метоксиметил-4-оксо-5-фенил-4 Н 1,3-оксазин-3-ил)-2-метилпропановой кислоты(1,74 г) в виде белого твердого вещества, т. пл. 135-138 С. Аналогичным образом получили следующие соединения: 2-(6-фторметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту, т. пл. 176-177,5 С (разл.); и 2-(6-хлорметил-2,3-дигидро-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановую кислоту в виде твердого вещества кремового цвета, т. пл. 157,5-158,5 С (разл.). Ссылочный пример 15. Смесь трет-бутил 2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)2-метилпропаноата (4,0 г), метилиодида (32,7 г) и оксида серебра (I) (4,27 г, свежеприготовленный) перемешивали и нагревали с обратным холодильником в сухом ацетонитриле в течение 16 ч. Добавляли еще метилиодида (7,1 г) и оксида серебра (I) (1,19 г) и продолжали нагревание еще 5 ч. Смесь охлаждали, фильтровали и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием гексаном и в результате получили трет-бутил 2-(2,3-дигидро-6-метоксиметил-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат (2,95 г) в виде белого твердого вещества,т. пл. 106-106,8 С. Аналогичным образом получили следующие соединения: бензил 2-(2,3-дигидро-6-метоксиметил-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат в виде желтого масла, ЯМР ( CDCl3)1,53 (с, 6 Н), 3,22 (с, 3 Н), 3,85 (с, 2 Н), 5,05 (с,2 Н), 5,23 (с, 2 Н), 7,15-7,25 (м, 10 Н); бензил 2-(6-этоксиметил-2,3-дигидро-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропаноат в виде желтого твердого вещества, т. пл. 65-67 С. Ссылочный пример 16. К перемешанному раствору трет-бутил 2(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил 4 Н-1,3-оксазин-3-ил)-2-метилпропаноата (3,5 г) в дихлорметане при -78C прибавляли диэтиламиносератрифторид (1,27 мл). Спустя 0,5 ч раствору давали согреться до комнатной температуры и перемешивали 16 ч. Смесь вливали в насыщенный раствор хлорида аммония и органическую фазу промывали рассолом, сушили сульфатом магния и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью (1:1) дихлорметан-гексан и в результате получили третбутил 2-(6-фторметил-2,3-дигидро-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпро-паноат(1,31 г) в виде белого твердого вещества, т. пл. 80,5-82,5 С. Ссылочный пример 17. К перемешанному раствору N-хлорсукцинимида (1,08 г) в тетрагидрофуране прибавляли по каплям раствор трифенилфосфина (1,82 г) в тетрагидрофуране. Через 10 мин прибавляли 35 раствор трет-бутил 2-(2,3-дигидро-6-гидроксиметил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропаноата (2,0 г) в тетрагидрофуране. Смесь перемешивали всю ночь и распределяли между эфиром и водой, после чего органическую фазу промывали рассолом, сушили сульфатом магния и выпаривали. Остаток очищали путем хроматографии на сухих колонках с силикагелем с элюированием смесью (2:1) дихлорметан-гексан и в результате получили третбутил 2-(6-хлорметил-2,3-дигидро-4-оксо-5 фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноат(1,49 г) в виде белого твердого вещества, т. пл. 128-129 С. Ссылочный пример 18. К перемешанному раствору третбутилдиметилсилил 2-(6-этоксиметил-2,3-дигидро-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропаноата (2,1 г) в смеси тетрагидрофурана и метанола (1:1) при комнатной температуре прибавляли раствор карбоната калия (0,57 г) в воде. Через 1 ч прибавляли хлороводородную кислоту (2 М) до получения нейтральной среды и выпаривали этанол. Остаток распределяли между этилацетатом и хлороводородной кислотой (2 М) и органическую фазу промывали рассолом, сушили сульфатом магния и выпаривали с получением 2-(6-этоксиметил-2,3-дигидро-4 оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2-метилпропановой кислоты (1,35 г) в виде белого твердого вещества, т. пл. 160-161 С. Ссылочный пример 19. Смесь метил 3-циклопропил-3-оксо-2 фенилпропаноата (6,54 г) и этил 2-(Nметиленамино)-2-метилпропаноата нагревали с обратным холодильником в ксилоле в присутствии молекулярного сита 5 (33 г) в течение 7 ч. Смесь выпаривали и очищали путем хроматографии на силикагеле с элюированием смесью(7,56 г) в виде масла, ЯМР (CDCl3)0,7-0,78 (м,2 Н), 0,95-1,01 (м, 2 Н), 1,22 (т, 3 Н), 1,54 (с, 6 Н),1,52-1,61 (м, 1 Н), 4,14 (кв, 2 Н), 5,17 (с, 2 Н), 7,217,42 (м, 5 Н). Ссылочный пример 20. К раствору метил 3-циклопропил-3 гидрокси-2-фенилпропаноата (13,66 г) в ацетоне, перемешиваемому при 0 С, прибавляли по каплям реактив Джонса (65 мл), полученный из триоксида хрома (9,4 г), серной кислоты (8,4 мл) и воды. После выдерживания в течение 1 ч при 0 С и 2 ч при комнатной температуре смесь резко охлаждали добавлением метанола и выпаривали. К остатку добавляли воду, экстрагировали эфиром, сушили сульфатом магния и выпаривали. Остаток очищали путем хроматографии на силикагеле с элюированием смесью (3:1) гексанэтилацетат,получив в результате 3 циклопропил-3-оксо-2-фенилпропаноат (11,5 г) 36 в виде масла, ЯМР (CDCl3)0,8-0,96 (м, 2 Н),1,02-1,17 (м, 2 Н), 1,88-1,99 (м, 1 Н), 3,76 (с, 3 Н),4,87 (с, 1 Н), 7,27-7,43 (м, 5 Н). Ссылочный пример 21. К смеси диизопропиламина (7,8 г) в тетрагидрофуране, перемешиваемой при -78 С, прибавляли н-бутиллитий (46 мл 1,69 М раствора). Через 1 ч прибавляли при -78 С раствор циклопропилкарбоксальдегида (4,91 г) в тетрагидрофуране и смесь перемешивали в течение 0,5 ч. Затем прибавляли раствор хлорида аммония и смесь экстрагировали эфиром, сушили сульфатом магния и выпаривали. Остаток очищали путем хроматографии на силикагеле с элюированием смесью (2:1) гексанэтилацетат, получив в результате метил 3-циклопропил-3-гидрокси 2-фенилпропаноат (10,3 г) в виде масла, ЯМР(с, 3 Н), 3,74, 3,78 (д, 1 Н), 7,25, 7,44 (м, 5 Н). В соответствии с еще одним аспектом изобретения предлагаются также пригодные для гербицидного применения композиции, содержащие одно или несколько производных 1,3 оксазин-4-она формулы (I) или их сельскохозяйственно приемлемые соли в сочетании с (а предпочтительно гомогенно диспергированные в них) одним или несколькими совместимыми сельскохозяйственно приемлемыми разбавителями или носителями и/или поверхностноактивными веществами [т.е. разбавителями или носителями и/или поверхностно-активными веществами, которые обычно считают в данной области подходящими для применения в гербицидных композициях и которые совместимы с соединениями формулы (I)]. Использованный термин "гомогенно диспергированные" охватывает композиции, в которых соединения формулы (I) растворены в других компонентах. Термин "гербицидные композиции" использован в широком смысле и включает не только композиции, готовые к применению в качестве гербицидов, но и концентраты, которые перед применением нужно разбавлять. В соответствии с предпочтительным вариантом композиции содержат от 0,05 до 90% (по массе) одного или нескольких соединений формулы (I). Гербицидные композиции могут содержать как разбавитель или носитель, так и поверхностно-активное (например, смачивающее,диспергирующее или эмульгирующее) вещество. Поверхностно-активные вещества, которые могут присутствовать в гербицидных композициях по настоящему изобретению, могут быть ионогенными или неионогенными, как, например, сульфорицинолеаты, производные четвертичного аммония, продукты на основе конденсатов этиленоксида с алкил- или полиарилфенолами, например, нонил- или октилфенолами,или сложными эфирами карбоновых кислот на основе ангидросорбитолов, которые были пре 37 вращены в растворимые путем этерификации свободных гидроксигрупп конденсацией с этиленоксидом, соли щелочных и щелочноземельных металлов на основе сложных эфиров серной кислоты и сульфоновых кислот, такие как динонил- и диоктилсульфоносукцинаты натрия, и соли щелочных и щелочно-земельных металлов на основе высокомолекулярных производных сульфоновой кислоты, такие как лигносульфонаты натрия и кальция и алкилбензолсульфонаты натрия и кальция. Подходящие гербицидные композиции по настоящему изобретению могут содержать до 10% по массе (например, от 0,05% до 10% по массе) поверхностно-активного вещества, но при необходимости гербицидные композиции по настоящему изобретению могут содержать более высокий процент поверхностно-активного вещества, например до 15% по массе в жидких эмульгирующихся концентратах суспензии и до 25% по массе в жидких водорастворимых концентратах. Примерами подходящих твердых разбавителей (наполнителей) или носителей являются силикат алюминия, мелкодисперсный диоксид кремния, тальк, мел, кальцинированный оксид магния, кизельгур, трикальцийфосфат, пробковая мука, адсорбирующая углеродная сажа и глины, такие, как каолин и бентонит. Твердые композиции (которые могут иметь форму дуста,гранул или смачивающихся порошков) предпочтительно приготавливают путем измельчения соединений формулы (I) с твердыми наполнителями или путем пропитывания твердых наполнителей или носителей растворами соединений формулы (I) в летучих растворителях,выпаривания растворителей и, если нужно, измельчения продуктов с целью получения порошков. Гранулированные препараты могут быть получены путем осуществления поглощения соединений формулы (I) (растворенных в подходящих растворителях, которые могут, при желании, быть летучими) твердыми наполнителями или носителями в гранулированной форме и, если нужно, выпаривания растворителей или путем гранулирования композиций в форме порошка, полученных так, как описано выше. Твердые гербицидные композиции, в частности смачивающиеся порошки и гранулы, могут содержать смачивающие или диспергирующие агенты (например, описанных выше типов), которые могут также служить (в случае, когда они находятся в твердой форме) в качестве наполнителей или носителей. Жидкие композиции по настоящему изобретению могут быть в форме водных, органических или водно-органических растворов, суспензий и эмульсий, которые могут включать поверхностно-активное вещество. Подходящие жидкие разбавители для введения в жидкие композиции включают воду, гликоли, простые эфиры гликолей, тетрагидрофуран, спирт, аце 001145 38 тофенон, циклогексанон, изофорон, N-алкилпирролидоны, толуол, ксилол, минеральные,животные и растительные масла, этерифицированные растительные масла и легкие ароматические и нафтеновые фракции нефти (и смеси указанных разбавителей). Поверхностно-активные вещества, которые могут присутствовать в жидких композициях, могут быть ионогенными и неионогенными (например, описанных выше типов) и могут также служить, будучи в жидкой форме, в качестве разбавителей или носителей. Порошки, диспергирующиеся гранулы и жидкие композиции в форме концентратов могут быть разведены водой или другими подходящими разбавителями, например минеральными или растительными маслами, в частности в случае жидких концентратов, в которых разбавителем или носителем является масло, для получения композиций, готовых к применению. При желании жидкие композиции с соединением формулы (I) можно использовать в форме самоэмульгирующихся концентратов, содержащих активные вещества, растворенные в эмульгирующих агентах или в растворителях,содержащих эмульгирующие агенты, совместимые с активными веществами, и простое добавление таких концентратов в воду дает композиции, готовые к применению. Жидкие концентраты, в которых разбавителем или носителем является масло, можно использовать без дополнительного разбавления,используя технологию электростатического распыления. Гербицидные композиции по настоящему изобретению при необходимости могут содержать также традиционные вспомогательные вещества, такие, как адгезивы, защитные коллоиды, загустители, пропиточные вещества,вещества, усиливающие растекание (спрэдеры),стабилизаторы, пассивирующие агенты, средства против слживания, красящие вещества и ингибиторы коррозии. Эти вспомогательные вещества могут также служить в качестве носителей или разбавителей. Если не указано иное,то указанные далее процентные содержания взяты по массе. Предпочтительными гербицидными композициями по настоящему изобретению являются: концентраты водных суспензий, содержащие от 10 до 70 % одного или нескольких соединений формулы (I), от 2 до 10% поверхностно-активного вещества, от 0,1 до 5% загустителя и от 15 до 87,9% воды; смачивающиеся порошки, содержащие от 10 до 90% одного или нескольких соединений формулы (I), от 2 до 10% поверхностно-активного вещества и от 8 до 88% твердого наполнителя или носителя; водорастворимые или вододиспергируемые порошки, содержащие от 10 до 90% одного или нескольких соединений формулы (I), от 2 до 40% карбоната натрия и от 0 до 88% твердого наполнителя; 39 жидкие водорастворимые концентраты,содержащие от 5 до 50%, например, 10-30%,одного или нескольких соединений формулы (I),от 0 до 25% поверхностно-активного вещества и от 10 до 90%, например, 45-85%, смешивающегося с водой растворителя, например триэтиленгликоля, или смеси смешивающегося с водой растворителя и воды; жидкие концентраты эмульгирующихся суспензий, содержащие от 10 до 70% одного или нескольких соединений формулы (I), от 5 до 15% поверхностно-активного вещества, от 0,1 до 5% загустителя и от 10 до 84,9% органического растворителя, например минерального масла; вододиспергируемые гранулы, содержащие от 1 до 90%, например 25-75%, одного или нескольких соединений формулы (I), от 1 до 15%, например 2-10%, поверхностно-активного вещества и от 5 до 95%, например 20-60%, твердого наполнителя, например, глины, гранулированной добавлением воды с образованием пасты и затем высушенной, и эмульгирующиеся концентраты, содержащие от 0,05 до 90%, предпочтительно от 1 до 60%, одного или нескольких соединений формулы (I), от 0,01 до 10%, предпочтительно от 1 до 10%, поверхностно-активного вещества и от 9,99 до 99,94%, предпочтительно от 39 до 98,99%, органического растворителя. Гербицидные композиции по настоящему изобретению могут также содержать соединения формулы (I) в сочетании (предпочтительно гомогенно диспергированные в них) с одним или несколькими другими пестицидно активными соединениями и, при необходимости, одним или несколькими совместимыми пестицидно приемлемыми разбавителями или носителями, поверхностно-активными веществами и традиционными вспомогательными веществами,описанными выше. Примеры других пестицидно активных соединений, которые могут быть введены в гербицидные композиции по настоящему изобретению или использованы в сочетании с ними,включают гербициды, например для расширения диапазона уничтожаемых видов сорняков,например алахлорN-(2,4-дифторфенил)-2-[3-(трифторметил)фенокси]-3-пиридин-карбоксамид,тралкоксидим 2-[1-(этоксиимино)пропил]-3 гидрокси-5-мезитилциклогекс-2-енон, хлодинафоп 2-[4-(5-хлор-3-фтор-2-пиридилокси) фенокси]пропионовая кислота, сульцотрион [2(2-хлор-4-метилсульфонилбензоил)циклогексан 1,3-дион], флуртамон 5-метиламино-2-фенил 4-[3-(трифторметил)фенил]-3(2 Н)-фуранон,ахлонифен (2-хлор-6-нитро-3-феноксианилин) и сульфонилмочевины (например, никосульфурон); инсектициды, например синтетические пиретроиды, например, перметрин и циперметрин,и фунгициды, например карбаматы, например, метил N-(1-бутилкарбамоилбензимидазол-2-ил)карбамат, и триазолы, например,1-(4-хлорфенокси)-3,3-диметил-1-(1,2,4-триазол-1-ил)бутан-2-он. Пестицидно активные соединения и другие биологически активные материалы, которые могут быть включены в гербицидные композиции по настоящему изобретению или использованы в сочетании с ними (например, те, что указаны выше) и которые являются кислотами, могут быть при необходимости использованы в виде обычных производных, например, щелочно-металлических и аминных солей и сложных эфиров. В соответствии с настоящим изобретением предлагается также продукт производства, содержащий по крайней мере одно производное 1,3-оксазин-4-она формулы (I) или, когда это является предпочтительным, гербицидную композицию, такую, как описанные выше, а предпочтительно гербицидный концентрат (который нужно разбавлять перед применением), содержащий, по крайней мере, одно производное 1,3 оксазин-4-она, имеющее формулу (I), в контейнере для указанного производного или производных формулы (I) или указанной гербицидной композиции и инструкции, физически объединенные с упомянутым контейнером, по способу применения указанного производного или производных формулы (I) или гербицидной композиции, находящихся в контейнере, для регулирования роста сорняков. Обычно используют контейнеры традиционных типов, традиционно применяемых для хранения химических веществ, твердых при нормальных температурах,окружающей среды, и гербицидных композиций, в частности в форме концентратов, например банки и бочки из металла (который может быть покрыт внутри лаком) и пластических материалов, бутыли из стекла и пластмассы и (когда содержимым контейнера являются твердые,например гранулированные, гербицидные композиции) коробки, например из картона, пласт 41 массы и металла, или мешки. Обычно контейнеры имеют вместимость, достаточную для содержания такого количества производного 1,3 оксазин-4-она или гербицидной композиции,которое достаточно для обработки, по крайней мере, одного акра (0,4047 га) земли для регулирования роста сорняков, но не превышают размеров, удобных для традиционных способов погрузки-выгрузки и транспортировки. Инструкции физически объединяют с контейнером,например печатают непосредственно на контейнере или на прикрепленной к нему этикетке или бирке. В них обычно дают указания на то, что содержимое контейнера (после разбавления,если это необходимо) нужно вносить для регулирования роста сорняков при норме между 0,5 г и 5000 г активного материала на гектар описанными выше способами для описанных выше целей. Следующие далее примеры иллюстрируют гербицидные композиции по настоящему изобретению. В описании имеются следующие торговые названия (товарные знаки): Этилан, Сопрофор, Сопропон, Родорсил, Атагель, Синпероник, Сольвессо, Аркопон, Тиксосил. Пример С 1. Концентрат суспензии содержит: Производное оксазинона (соединение 1) 20% Этилан ВСР(противовспенивающий агент) 0,01% Пропиленгликоль (антифриз) 5,0% Атагель 50 (противоосадитель) 2,0% Вода До 100% Аналогичные концентраты суспензии могут быть получены путем замены соединения 1 другими производными оксазинона, представленными формулой (I). Пример С 2. Концентрат эмульсии содержит: Производное оксазинона (соединение 1) 10% Синпероник NPE1800Nметилпирролидин. Аналогичные концентраты эмульсии могут быть получены путем замены соединения 1 другими производными оксазинона, представленными формулой (I). Пример С 3. Смачивающийся порошок содержит: Производное оксазинона (соединение 1) 20,0% Арилан SX хлопьевидный(диспергирующее вещ.) 1,0% Тиксосил 38 (улучшитель текучести) 3,0% Каолин 68,0% Пример С 4. Смачивающийся порошок содержит: Производное оксазинона (соединение 1) 20% Глина 70% Лигносульфат кальция 7% Продукт конденсации алкилнафталинсульфоновой кислоты и формалина 3% Указанную смесь перемешивали и размалывали с помощью струйной мельницы, получив в результате 100 частей смачивающегося порошкообразного препарата. Аналогичные смачивающиеся порошки могут быть получены путем замены соединения 1 другими производными оксазинона, представленными формулой (I). В соответствии с настоящим изобретением предлагается также способ регулирования (подавления) роста сорняков (т.е. нежелательной растительности) в очаге, включающий внесение в очаг гербицидно эффективного количества, по крайней мере, одного производного 1,3-оксазин 4-она формулы (I) или его сельскохозяйственно приемлемой соли. Для этой цели производные 1,3-оксазин-4-она обычно используют в виде гербицидных композиций (т.е. в сочетании с совместимыми разбавителями или носителями и/или поверхностно-активными веществами,пригодными для использования в гербицидных композициях), например, так, как описано ниже. Соединения формулы (I) проявляют гербицидную активность против двудольных (т.е. широколистных) и однодольных (т. е. травы) сорняков при довсходовом и/или послевсходовом применении. Термин "довсходовое применение" подразумевает внесение в почву, в которой находятся семена или ростки сорняков до появления ростков над поверхностью почвы. Термин "послевсходовое применение" подразумевает нанесение препарата на надземные или открытые части сорняковых растений. Например, соединения формулы (I) могут быть применены для регулирования роста: широколистных сорняков, например Abutilon Theophrasti, Amaranthus retroflexus, Bidens 43 Количество вносимых соединений формулы (I) изменяется в зависимости от природы сорняков, используемых композиций, времени внесения, климатических и почвенных условий и (при использовании для регулирования роста сорняков в местах выращивания сельскохозяйственных культур) природы сельскохозяйственных культур). При внесении в районе растениеводства норма внесения должна быть достаточной для регулирования роста сорняков без значительного постоянного вредного воздействия на сельскохозяйственную культуру. В общем,при учете указанных факторов хорошие результаты дают нормы внесения в пределах от 1 г до 1000 г активного материала на гектар. Однако,нужно понимать, что можно использовать более высокие или более низкие нормы внесения в зависимости от встречающихся конкретных проблем борьбы с сорняками. Соединения формулы (I) можно применять для избирательного регулирования роста сорных растений, например, для регулирования роста вышеуказанных видов сорняков путем довсходового или послевсходового применения,направленного или ненаправленного (например,путем направленного или ненаправленного опрыскивания), в районе засоренности сорняками,который используется или должен использоваться для выращивания сельскохозяйственных культур, например, злаков (например, пшеницы,ячменя, овсов, кукурузы и риса), сои культурной, кормовых (конских) бобов, фасоли, гороха,люцерны, хлопка, арахиса, льна, лука, моркови,капусты, масличного рапса, подсолнечника, сахарной свеклы, и на постоянном или сеяном пастбище до или после посева культуры или до или после появления всходов культуры. Для избирательного подавления сорняков в очаге засоренности ими, являющемся местом, которое используется или должно использоваться для выращивания сельскохозяйственных культур,например культур, указанных выше, особенно подходящими являются нормы внесения в пределах от 10 г до 500 г, предпочтительно от 25 г до 250 г активного материала на гектар. Соединения по настоящему изобретению особенно полезны для борьбы с мелкосемянными видами трав, такими, как Alopecurus myosuroides, Poa annua и Apera spica-venti. Соединения формулы (I) могут быть также использованы для регулирования роста сорняков, в частности указанных выше, путем довсходового или послевсходового применения в заложенных плодовых садах и других местах,где растут деревья, например в лесах и парках, и на плантациях, например, сахарного тростника,масличных пальм и каучуконосов. Для этой цели их можно наносить направленно или ненаправленно (например, путем направленного или ненаправленного опрыскивания) на сорняки или на почву, где ожидается их появление, до или после посадки деревьев или плантаций при 44 нормах внесения в пределах от 50 до 5000 г,предпочтительно от 50 до 2000 г, а наиболее предпочтительно от 100 до 1000 г активного материала на гектар. Соединения формулы (I) можно применять также для регулирования роста сорняков, в частности указанных выше, в местах, которые не являются районами выращивания сельскохозяйственных культур, но в которых, тем не менее,борьба с сорняками желательна. Примеры таких зон, не используемых для выращивания культур, включают аэродромы,промышленные зоны, железные дороги, обочины шоссейных дорог, береговые кромки рек,оросительных каналов и других водных путей,участки, покрытые кустарником, площадь,вспаханная под пар, или неосвоенная площадь,в частности, где желательно регулировать рост сорняков для уменьшения пожарной опасности. При использовании для таких целей, когда часто является желательным полный гербицидный эффект, активные соединения обычно вносят при более высоких нормах, чем в районах выращивания культур, описанных выше. Точная норма зависит от характера обрабатываемой растительности и от требуемого эффекта. Особенно подходящим для этой цели является довсходовое или послевсходовое внесение,предпочтительно довсходовое, направленно или ненаправленно (например, путем направленного или ненаправленного опрыскивания) при норме от 50 до 5000 г, предпочтительно от 50 до 2000 г, а наиболее предпочтительно от 100 до 1000 г активного материала на гектар. При использовании для регулирования роста сорняков путем довсходового применения соединения формулы (I) могут быть внесены в почву, где ожидается появление сорняков. Понятно, что при использовании соединений формулы (I) для регулирования роста сорняков путем послевсходового применения, т.е. путем нанесения на надземные или открытые части появившихся сорняков, соединения формулы (I) обычно также входят в контакт с почвой и потому могут оказывать довсходовое угнетающее действие на сорняки, позднее прорастающие в почве. При необходимости подавления сорняков в течение особенно длительного времени внесение соединений формулы (I) может быть повторено. Способ применения гербицидных соединений Метод А испытания.a) Общие сведения. Подходящие количества соединений, используемых для обработки растений, растворяли в ацетоне, получив в результате растворы,эквивалентные нормам внесения до 1000 г испытуемого соединения на гектар (г/га). Эти растворы вносили с помощью стандартного лабораторного гербицидного опрыскивателя с пода 45 чей эквивалента 290 л разбрызгиваемой жидкости на гектар площади.b) Подавление сорняков: довсходовое. Семена высевали в квадратные (со стороной 70 мм и глубиной 75 мм) пластмассовые горшки с нестерильной почвой. Количество семян на горшок было следующим: Виды сорняков Приблиз. число семян/горшок 1) Широколистные сорнякиCyperus esculentus 3 Культура 1) Широколистная Хлопок 3 Соя 3 2) Злак Кукуруза 2 Рис 6 Пшеница 6 Соединения по настоящему изобретению наносили, как описано в (а) на поверхность почвы, содержащей семена. Отдельный горшок с каждой культурой и каждым сорняком подвергали каждой обработке, причем имелись контрольные горшки, не опрысканные и опрысканные только ацетоном. После обработки горшки помещали на капиллярные маты в стеклянной теплице и поливали водой сверху. Спустя 20-24 дня после опрыскивания производили визуальную оценку повреждения культуры. Результаты выражали в процентах уменьшения роста или повреждения культуры или сорняков по сравнению с растениями в контрольных горшках. с) Подавление сорняков: послевсходовое. Сорные и культурные растения высевали прямо в компост Джона Иннеса (John Innes) в квадратных (со стороной 70 мм и глубиной 75 мм) горшках, кроме Amaranthus, который пикировали в фазе прорастания и переносили в горшки, опрысканные неделей раньше. Затем растения растили в вегетационном домике до состояния готовности к опрыскиванию соединениями, используемыми для обработки растений. Число растений на горшок было следующим: 1) Широколистные сорняки Виды сорняков 2) Злаковые сорняки Виды сорняков 1) Широколистные культуры Культуры Хлопок Соя 2) Злаковые культуры Культуры Кукуруза Рис Пшеница Соединения, используемые для обработки растений, наносили на растения так, как описано в (а). Отдельный горшок с каждой культурой и видами сорняков подвергали каждой обработке, причем имелись контрольные горшки, не опрысканные и опрысканные только ацетоном. После обработки горшки помещали на капиллярные маты в стеклянной теплице и поливали один раз сверху через 24 ч и затем путем регулируемого подпочвенного орошения. Спустя 20-24 дня после опрыскивания производили визуальную оценку повреждения культуры и регулирования сорняков. Результаты выражали в процентах уменьшения роста или повреждения культуры или сорняков по сравнению с растениями в контрольных горшках. Метод В испытания (нанесение на листья растений рисового поля). Порции почвы рисового поля и химического удобрения помещали в пластмассовые горшки площадью 130 см 2 и в каждый горшок добавляли подходящее количество воды с последующим достаточным перемешиванием,чтобы получить подобие рисового поля. Рассаду риса в фазе двух листьев (c.v. Koshihikari), выращенную заранее в теплице, пересаживали,делая одно гнездо на горшок, причем каждое гнездо содержало два саженца риса. Высевали много семян Nobie (Echinochloa(Lindernia procumbens) и Hotarui (Scirpus juncoides). Каждый горшок заполняли водой глубиной до 3 см. После прорастания семян Nobie (Echinochloa oryzicola) до фазы 1,5 листьев в теплице приготавливали способом, описанным в примере С 4 состава, смачивающийся порошок, разводили его подходящим количеством воды, чтобы обеспечить содержание активных компонентов 47 5 кг или 1 кг на га, и наносили с помощью пипетки. Спустя 21 день после химической обработки производили визуальную оценку повреждения культуры и регулирования сорняков. Результаты выражали в процентах уменьшения роста или повреждения культуры или сорняков по сравнению с растениями в контрольных горшках. Метод С испытания (послевсходовое нанесение на растения риса в теплице). В пластмассовые горшки площадью 170 см 2 закладывали почву рисового поля, добавляли подходящее количество воды и химические удобрения и перемешивали до состояния затопленного рисового поля. Саженцы риса (сорт Koshihikari), выращенные заранее в теплице до фазы двух листьев, пересаживали в каждый горшок (два саженца на горшок). Затем в каждый горшок засевали заданное количество семян Echinochloa oryzicola, Monochoria vaginalis, Lindernia procumbens и Scirpus juncoides и добавляли воду до глубины 3 см. После вырастания растений в теплице до состояния, когда Echinochloa oryzicola достигало фазы 1,5 листьев, приготавливали растворы описанных в примерах соединений в 100% ацетоне, так, что растворы содержали активные компоненты в количестве, эквивалентном 75,300 и 1200 г/га. Растворы вносили каплями с помощью пипетки. Спустя 21 день после химической обработки производили визуальную оценку гербицидных эффектов на каждый сорняк и фитотоксичности по отношению к растениям риса. Результаты выражали в процентах уменьшения роста или повреждения культуры или сорняков по сравнению с растениями в контрольных горшках. Метод D испытания.a) Общие сведения. Как в описанном выше методе А, но растворы вносили из автоматизированного опрыскивателя с производительностью, эквивалентной 720 л разбрызгиваемой жидкости на гектар.b) Регулирование сорняков: довсходовое. Семена высевали в квадратные (со стороной 70 мм и глубиной 75 мм) пластмассовые горшки с нестерильной почвой (3 вида на горшок). Количество семян на горшок было следующим: Виды сорняков Приблиз. число семян на вид 1) Широколистные сорнякиApera spica-venti 20 (щепотка) Культура 1) Широколистная Хлопок 3 Соя 2 2) Злак Кукуруза 2 Рис 5 Пшеница 5 Соединения по настоящему изобретению наносили на поверхность почвы, содержащей семена, так, как описано в (а). Горшки, содержащие представленные виды, подвергали каждой обработке, причем имелись контрольные горшки, не опрысканные и опрысканные только ацетоном. После обработки горшки помещали на капиллярные маты в стеклянной теплице и поливали водой сверху. Спустя 17 дней после опрыскивания производили визуальную оценку повреждения культуры. Результаты выражали в процентах уменьшения роста или повреждения культуры или сорняков по сравнению с растениями в контрольных горшках. При довсходовом или послевсходовом применении в методе А испытания при 1000 г/га или менее, соединения 2-7, 15, 24, 25, 31, 33-37,99-114, 116, 117, 119, 121-129 и 131-141 по настоящему изобретению дали, по крайней мере,80%-ное снижение роста одного или нескольких видов сорняков. При норме внесения 1000 г/га в методе В испытания соединения 8 и 141 по настоящему изобретению дали, по крайней мере,90%-ное снижение роста одного или нескольких видов сорняков. При норме внесения 1200 г/га или менее в методе С испытания соединения 1-7, 13, 15, 24,25, 31, 33-37, 99-104, 106-128, 131-133 и 137-140 по настоящему изобретению дали по крайней мере 80%-ное снижение роста одного или нескольких видов сорняков. При довсходовом или послевсходовом применении в методе D испытания при дозе 700 г/га соединение 9 по настоящему изобретению дало по крайней мере 80%-ное снижение роста одного или нескольких видов сорняков. При уровнях применения, токсичных для сорняков, указанные соединения были избирательны в отношении, по крайней мере, одного из видов культурных растений.R1 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, метокси и необязательно галогенированного метилаR2 представляет: неразветвленный или разветвленный алкил с одним-четырьмя углеродными атомами, замещенный одной или несколькими группами R8,которые могут быть одинаковыми или разными,или группу, выбранную из циано, -СНО,-COR7, -СО 2 Н, -CO2R7, -COSR7, -CONR9R10,-CH=NOH,-CH=NOR7,-CH=NOCOR7,9 10R3 представляет фенил, необязательно замещенный одной-пятью группами (которые могут быть одинаковыми или разными), выбранными из галогена, гидрокси, низшего алкила,галогеналкила,R4 и R5 независимо представляет низший алкил;R7 представляет низший алкил или галогеналкил;q представляет один или два;R9 и R10 независимо представляют водород, низший алкил или галогеналкил; или его сельскохозяйственно приемлемая соль. 2. Соединение по п.1, в котором R1 представляет фенил, необязательно замещенный одной или несколькими группами галогена. 3. Соединение по п.2, в котором R1 представляет фенил. 4. Соединение по любому из пп.1-3, в котором R8 представляет -S(O)nR7 (где R7 представляет алкил) или галоген. 5. Соединение по п.4, в котором R7 представляет метил. 6. Соединение по любому из пп.1-3, в котором R2 представляет метил, замещенный фтором, метокси, этокси и -S(O)nСН 3. 7. Соединение по п.1, в котором R3 представляет фенил, необязательно замещенный одной или двумя группами (которые могут быть одинаковыми или разными), выбранными из галогена и галогеналкила.N-(2,5-дифторфенил)-2-(2,3-дигидро-6 формил-4-оксо-5-фенил-4 Н-1,3-оксазин-3-ил)-2 метилпропанамид. 10. Гербицидная композиция, включающая эффективное количество активного ингредиента- производного 1,3-оксазин-4-она в сочетании с сельскохозяйственно-приемлемым разбавителем или носителем и/или поверхностно-активным веществом, отличающаяся тем, что в качестве указанного производного содержит соединение 1,3-оксазин-4-она по любому из пп.1-9 или его сельскохозяйственно-приемлемую соль. 11. Способ борьбы с сорняками в очаге,включающий внесение в указанный очаг эффек 54 тивного количества производного 1,3-оксазин-4 она, отличающийся тем, что в качестве производного 1,3-оксазин-4-она используют соединение по любому из пп.1-9 или его сельскохозяйственно-приемлемую соль. 12. Способ по п.11, отличающийся тем, что указанным очагом является площадь, которая используется или должна использоваться для выращивания культур, и эффективное количество составляет от 0,001 до 1,0 кг/га. 13. Соединение формулы где R1, R2, R4 и R5 - такие как определено в п.1, а группа А выбрана из групп СООН и СОСl.
МПК / Метки
МПК: C07F 7/18, C07D 265/06, A01N 43/86
Метки: гербицидов, производные, 1,3-оксазин-4-она, качестве
Код ссылки
<a href="https://eas.patents.su/28-1145-proizvodnye-13-oksazin-4-ona-v-kachestve-gerbicidov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1,3-оксазин-4-она в качестве гербицидов</a>
Предыдущий патент: 3-арилурацилы и их применение
Следующий патент: Способ лечения индивидуума, страдающего от заболевания, в патогенезе которого существенную роль играет неоваскуляризация












