Рецептор baff (bcma), иммунорегуляторный агент
Номер патента: 4635
Опубликовано: 24.06.2004
Авторы: Шнайдер Паскаль, Маккэй Фабьенн, Чопп Юрг, Томпсон Джеффри, Амброуз Кристин, Браунинг Джеффри
Формула / Реферат
1. Способ ингибирования роста B-клеток у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
2. Способ ингибирования продукции иммуноглобулина у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
3. Способ ингибирования роста и созревания B-клеток, индуцированных дендритными клетками, у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, включающей в себя полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
4. Способ лечения аутоиммунного заболевания, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
5. Способ лечения гипертонии у животного, включающий в себя стадию введения терапевтически эффективного количества ингибитора роста B-клеток, выбранного из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
6. Способ лечения почечных заболеваний у животного, включающий в себя стадию введения терапевтически эффективного количества ингибитора роста B-клеток, выбранного из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
7. Способ лечения B-клеточных лимфопролиферативных заболеваний у животного, включающий в себя стадию введения терапевтически эффективного количества ингибитора роста B-клеток, выбранного из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
8. Способ по пп.1-7, где указанный полипептид BCMA является растворимым.
9. Способ по п.8, где растворимый полипептид BCMA содержит внеклеточный домен BCMA.
10. Способ по п.9, где указанный внеклеточный домен BCMA слит с иммуноглобулином.
11. Способ по пп.1-7, где указанный полипептид BCMA выбран из группы, состоящей из
a) выделенного полипептида BCMA с нативной последовательностью, содержащей аминокислотные остатки 1-184 последовательности SEQ ID NO:1 или ее фрагмента;
b) выделенного полипептида BCMA, имеющего по меньшей мере 80%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида BCMA, содержащей аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;
c) выделенного полипептида BCMA, имеющего по меньшей мере 90%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида BCMA, содержащей аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;
d) выделенного полипептида BCMA, содержащего аминокислотные остатки 1-51 последовательности SEQ ID NO:1, или его фрагмента; и
e) выделенного полипептида BCMA, содержащего аминокислотные остатки 8-41 последовательности SEQ ID NO:1, или его фрагмента.
12. Способ по пп.1-7, где указанным гомологом антитела против BCMA является моноклональное антитело.
13. Способ по пп.1-7, где указанный гомолог антитела против BCMA содержит BCMA-IgG.
14. Способ по пп.1-7, где указанным животным является млекопитающее.
15. Способ по п.14, где указанным млекопитающим является человек.
16. Способ нормализации, подавления или изменения иммунного ответа, участвующего в пути передачи сигнала между BCMA и BAFF, где указанный способ включает в себя стадию введения эффективного количества композиции, выбранной из группы, состоящей из
(a) полипептида BCMA или его фрагмента;
(b) химерной молекулы, содержащей полипептид BCMA или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и
(c) гомолога антитела против BCMA.
17. Способ ингибирования воспаления, включающий в себя стадию введения терапевтически эффективного количества антитела против BCMA или его активного фрагмента.
18. Способ ингибирования воспаления, включающий в себя стадию введения терапевтически эффективного количества антитела против BCMA или его эпитопа.
19. Фармацевтическая композиция, содержащая терапевтически эффективное количество выделенного полипептида BCMA или его фрагмента и фармацевтически приемлемый носитель.
20. Фармацевтическая композиция по п.19, где указанный выделенный полипептид BCMA выбран из группы, состоящей из
a) выделенной нативной последовательности полипептида BCMA, содержащей аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или ее фрагмента;
b) выделенного полипептида BCMA, имеющего по меньшей мере 80%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида BCMA, содержащего аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;
c) выделенного полипептида BCMA, имеющего по меньшей мере 90%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида BCMA, содержащего аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;
d) выделенного полипептида BCMA, содержащего аминокислотные остатки 1-51 последовательности SEQ ID NO:1, или его фрагмента; и
e) выделенного полипептида BCMA, содержащего аминокислотные остатки 8-41 последовательности SEQ ID NO:1, или его фрагмента.
21. Фармацевтическая композиция по п.19, где указанный фрагмент полипептида BCMA содержит внеклеточный домен BCMA, слитый с иммуноглобулином.
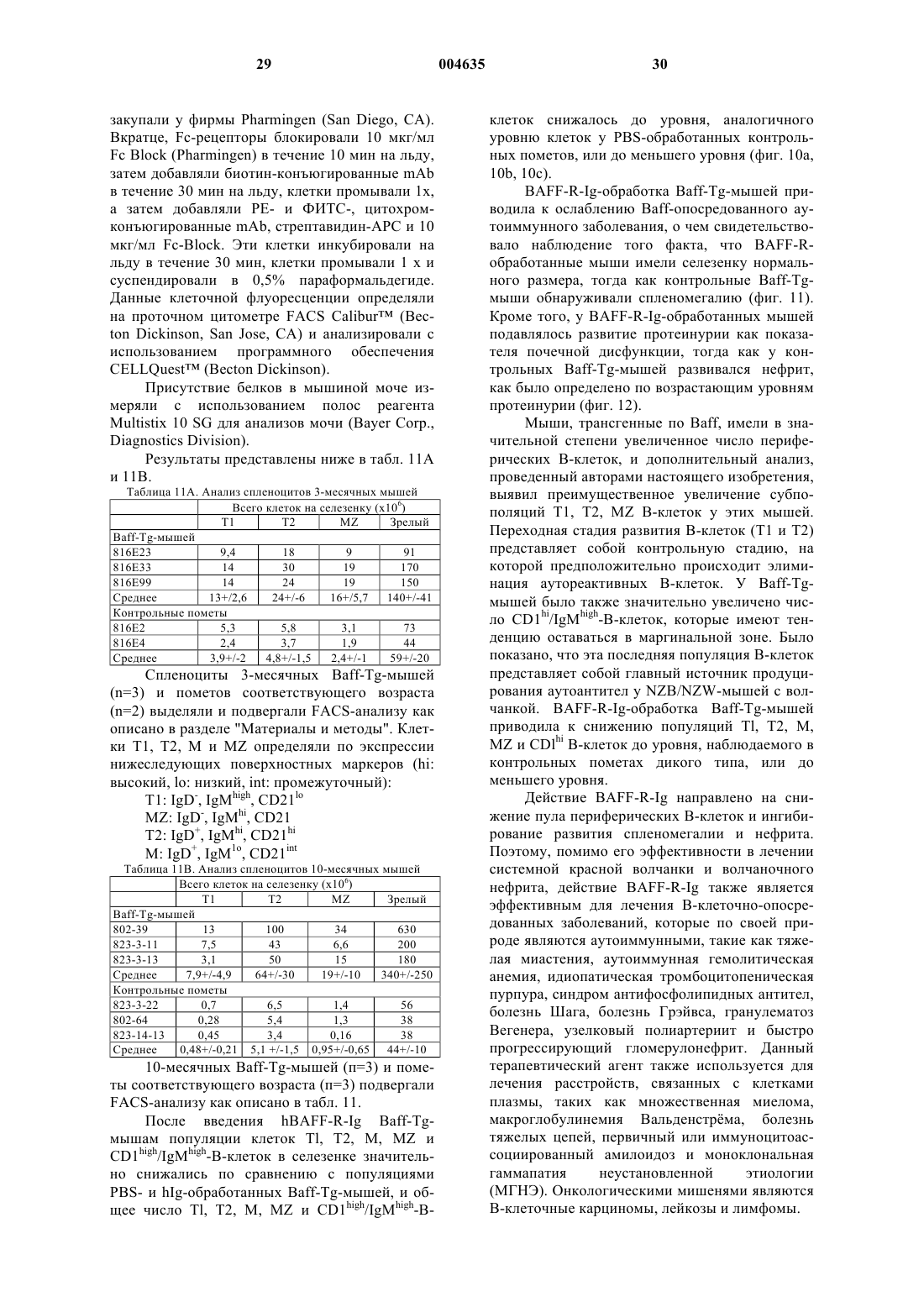
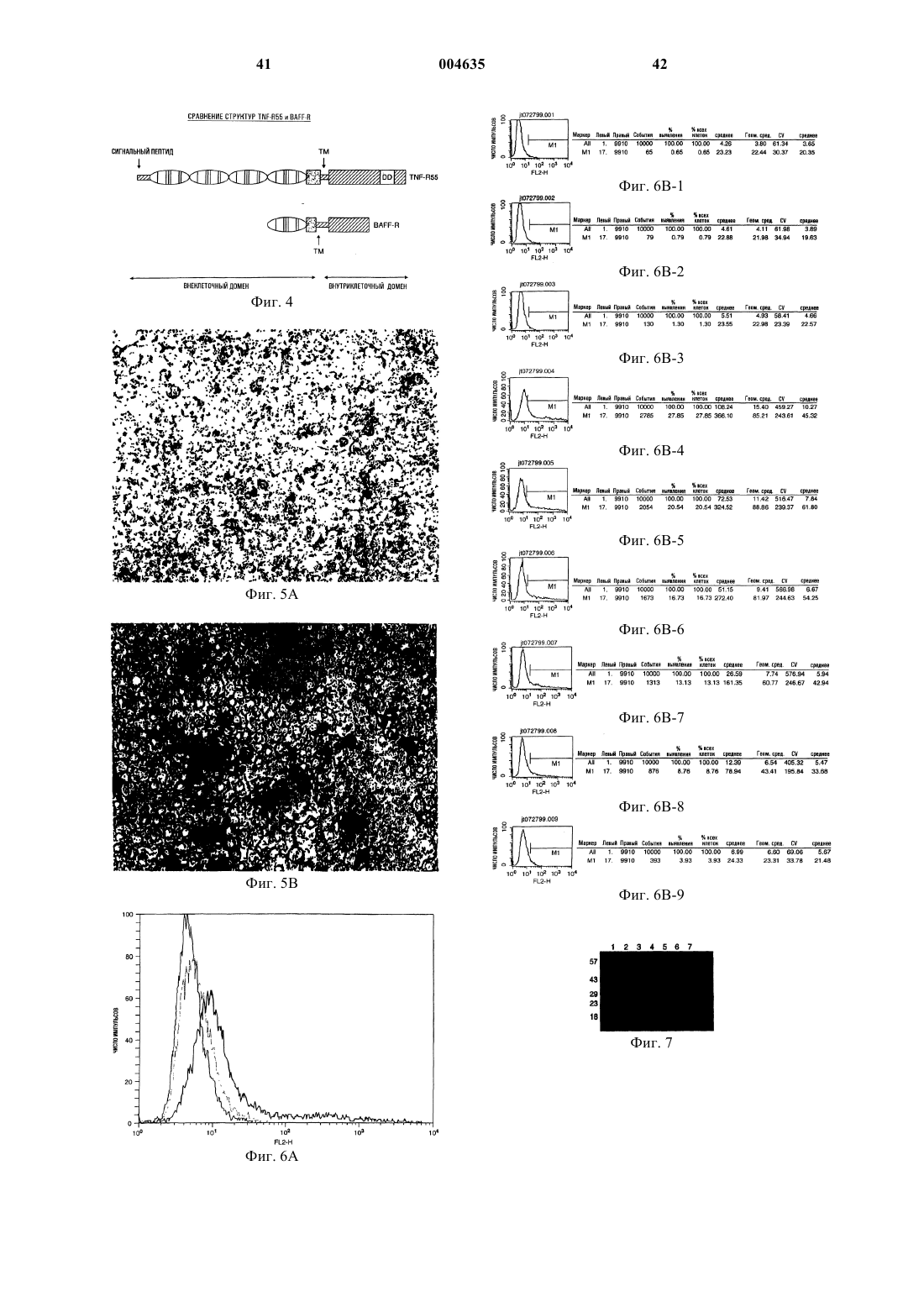
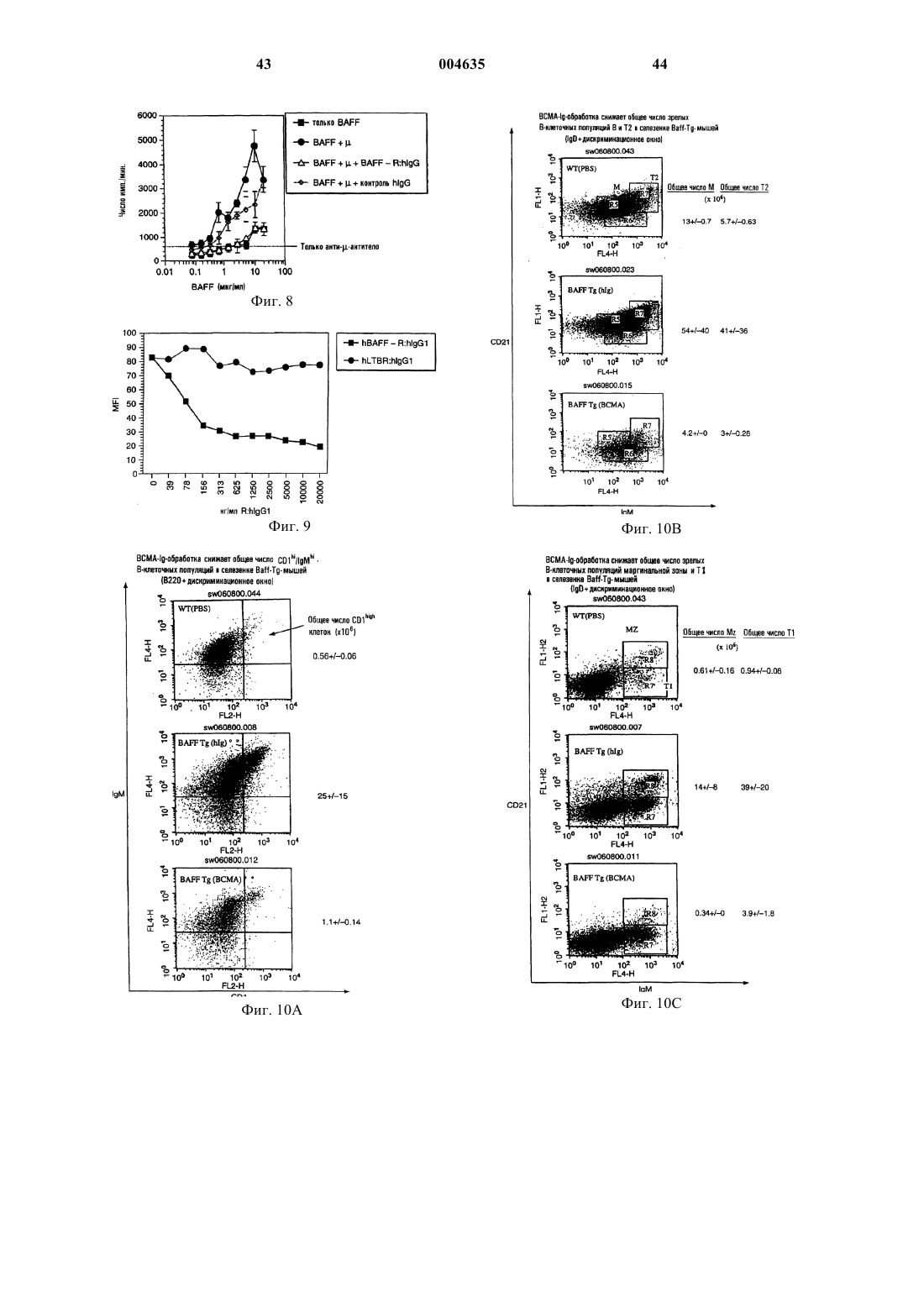
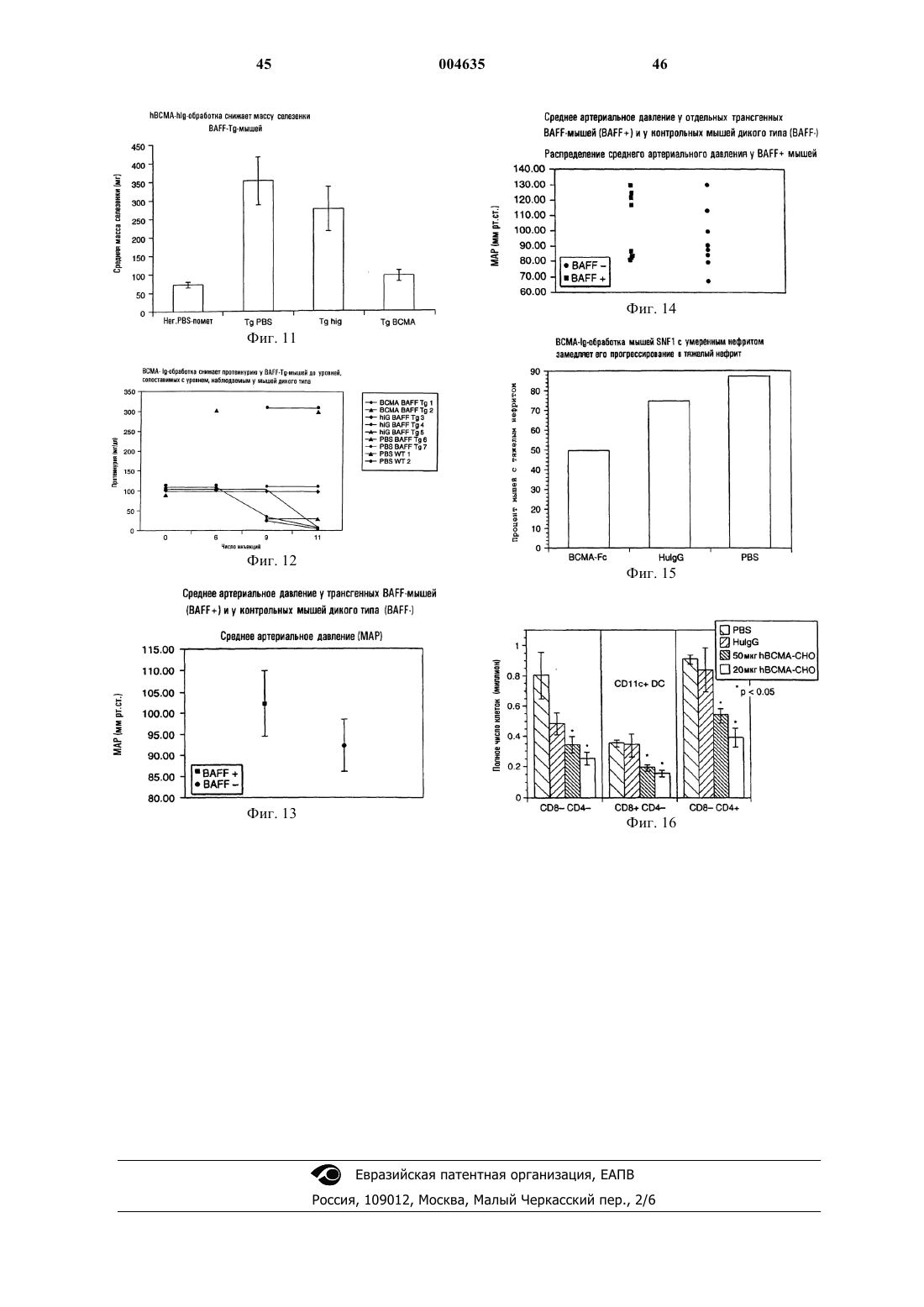
Текст
1 Область, к которой относится изобретение Настоящее изобретение относится к использованию рецептора для BAFF, фактора активации -клеток, принадлежащего к семейству факторов некроза опухоли ("TNF"), и к его блокирующим агентам для стимуляции или ингибирования экспрессии В-клеток и иммуноглобулинов. Этот рецептор обладает противораковыми и иммунорегуляторными свойствами, а также используется для лечения иммуносупрессорных расстройств, таких как ВИЧ-инфекции. Кроме того, этот рецептор и его блокирующие агенты играют определенную роль в развитии гипертонии и родственных ей расстройств. Кроме того, клетки, трансфицированные геном указанного рецептора, могут быть использованы в генной терапии для лечения опухолей, лимфом, аутоиммунных болезней или наследственных генетических нарушений, в которых участвуют В-клетки. Блокирующие агенты, такие как рекомбинантные варианты или антитела, специфичные для указанного рецептора, применяются также в качестве иммунорегуляторных агентов. Рассматривается также использование рецептора для BAFF в качестве стимулятора Вклеток для лечения иммуносупрессорных заболеваний, включая, например, его использование для трансплантации органов пациентам (например, трансплантата костного мозга), а также для восстановления после лечения рака в целях стимуляции продуцирования В-клеток. Рассматривается также использование рецептора дляBAFF в качестве адъюванта и/или костимулятора для усиления и/или восстановления Вклеточных уровней приблизительно до нормальных уровней. Растворимые формы указанного рецептора для BAFF, которые блокируют В-клеточную функцию, могут быть также использованы для ингибирования заболеваний,опосредованных В-клетками. Предшествующий уровень техники Настоящее изобретение относится к новому рецептору семейства TNF. Был идентифицирован новый рецептор BAFF-R (или "ВСМА"). Семейство TNF состоит из пар лигандов и их специфических рецепторов, называемых лигандами семейства TNF и рецепторами семейства TNF (BazzoniBeutler, 1996). Указанное семейство участвует в регуляции иммунной системы и, возможно, других неиммуннологических систем. Данная регуляция часто происходит на уровне "главного переключения", так,что передача сигнала членами семейства TNF может приводить к большому числу последующих событий, наиболее характерных для TNF.TNF может инициировать общий протективный воспалительный ответ организма на инвазию чужеродного агента, что приводит к изменению фетотипа адгезивных молекул, участвующих в транспорте клеток, к продуцированию хемокинов для направления специфических клеток в конкретные участки и к примированию различ 004635 2 ных эффекторных клеток. Таким образом, регуляция этих каскадов реакций может иметь клиническое применение. Индуцирование различных клеточных ответов, опосредованных указанными цитокинами семейства TNF, очевидно инициируется их связыванием со специфическими клеточными рецепторами. Были идентифицированы по крайней мере два различных рецептора TNF, имеющие молекулярную массу приблизительно 55 кДа (TNFR1) и 75 кДа (TNFR2) [Hohman et al., J.Biol. Chem. 264: 14927-14934 (1989)Brockhaus et al., PNAS, 87:3127-3131 (1990)]. Широкий полиморфизм был ассоциирован с обоими генами рецептора TNF. Оба TNFR имеют общую типичную структуру рецепторов клеточной поверхности, включая внеклеточные,трансмембранные и внутриклеточные домены. Указанная внеклеточная часть TNFR типа 1 и типа 2 содержит повторяющийся мотив аминокислотной последовательности, состоящий из доменов, богатых четырьмя цистеинами (CDR). Аналогичный повторяющийся мотив CDR присутствует и в некоторых других белках клеточной поверхности, включая рецептор фактора роста нервной ткани, антагониста антигенаCD40, присутствующего на В-клетках и т.п. Благодаря своей способности легко превращаться в гибридные белки иммуноглобулинов рецепторы представляют собой мощный инструмент для выявления каскадов биологических реакций. Такие димерные растворимые формы рецепторов являются хорошими ингибиторами событий, опосредуемых либо секретированными, либо поверхностными лигандами. Путем связывания с этими лигандами они могут препятствовать взаимодействию лигандов с клеточно-ассоциированными рецепторами, которые могут передавать сигнал. Эти гибридные белки"рецептор-Ig" являются ценными не только с экспериментальной точки зрения, но и в случаеTNF-R-Ig, они могут быть успешно использованы клинически для лечения заболеваний кишечника, ревматоидного артрита и острого клинического синдрома, сопровождающего введение ОКТ 3 (Eason et al., 1996; Feldmann et al.,1996; van Dullemen et al., 1995). Можно ожидать,что манипуляции по отношению ко многим событиям, опосредованным передачей сигнала через рецепторы семейства TNF, будет иметь широкое применение для лечения иммунных болезней, а также широкого ряда заболеваний человека, которые имеют патологические осложнения, обусловленные нарушениями иммунной системы. Растворимая форма недавно открытого рецептора, остеопротегерина, может блокировать потерю массы костной ткани, а поэтому события, регулируемые передающим сигнал рецептором семейства TNF, не обязательно должны быть ограничены регуляцией иммунной системы. Антитела к этому рецептору могут блокировать связывание лиганда, а 3 следовательно, они могут также иметь клиническое применение. Такие антитела часто являются долгоживущими и могут иметь некоторое преимущество по сравнению с гибридными белками "рецептор-Ig", которые имеют более короткое время полужизни в кровотоке. Хотя ингибирование опосредованного рецептором каскада реакций представляет собой наиболее широко распространенное терапевтическое применение этих рецепторов, однако,сначала, такое применение состояло в активации рецепторов TNF, что указывало на перспективность его клинического применения (AggarwalNatarajan, 1996). Активация рецепторовTNF может инициировать клеточную гибель, а поэтому их применение для лечения опухолей является еще более привлекательным (Eggermont et al., 1996). Этот рецептор может быть активирован либо путем введения лиганда, т.е.,лиганда, участвующего в каскаде природных реакций, либо определенных антител, которые могут перекрестно реагировать с данным рецептором и также являются сильными агонистами. Эти антитела имеют определенное преимущество в онкологии, поскольку они могут существовать в кровотоке в течение продолжительного периода времени, тогда как лиганды имеют обычно короткое время полужизни в кровотоке. Поскольку многие из этих рецепторов могут быть экспрессированы более селективно в опухолях, или они могут только передавать сигнал гибели или дифференцировки клеток в опухоли,то антитела-агонисты могут быть хорошим оружием в борьбе против рака. Аналогичным образом, многие позитивные иммунологические события опосредуются рецепторами TNF, например, воспалительные реакции хозяина, продуцирование антител и т.п., а поэтому антителаагонисты могут обладать благоприятным действием в других не-онкологических применениях. Парадоксально, но ингибирование метаболического пути может оказаться клинически эффективным для лечения опухолей. Так, например, Fas-лиганд экспрессируется некоторыми опухолями и эта экспрессия может приводить к гибели Fas-положительных лимфоцитов,что, тем самым, позволяет опухоли "ускользать" от надзора иммунной системы. В этом случае ингибирование Fas-системы может затем давать возможность иммунной системе взаимодействовать с опухолью другими путями, доступ к которым в настоящее время представляется возможным (GreeneWare, 1997). Краткое описание изобретения Авторами настоящего изобретения был идентифицирован кДНК-клон, который кодирует полипептид, обозначенный в настоящей заявке "BAFF-R" или "ВCMА", который связывается с фактором некроза опухоли, BAFF, фактором активации В-клеток, принадлежащим к семейству факторов некроза опухоли ("TNF"). BAFF представляет собой ту же самую молекулу, опи 004635 4 санную ранее в WO/9912964, которая вводится в настоящее описание посредством ссылки. В одном из вариантов своего осуществления настоящее изобретение относится к способам использования BAFF-R. Указанными способами являются способы ингибирования роста В-клеток, индуцированного дендритными клетками роста и созревания Вклеток, или продуцирования иммуноглобулина у животных с использованием полипептидаBAFF-R. Настоящее изобретение также включает способы стимуляции роста В-клеток, роста и созревания В-клеток, индуцированного дендритными клетками, или продуцирования иммуноглобулина у животного с использованием полипептида BAFF-R, или ко-стимуляции роста В-клеток, роста и созревания В-клеток, индуцированного дендритными клетками, или продуцирования иммуноглобулина у животного с использованием полипептида BAFF-R и антитела против Т, лиганда CD40 или лиганда противCD40. В другом варианте своего осуществления настоящее изобретение относится к способам с использованием BAFF-R для лечения аутоиммунных болезней, гипертонии, сердечнососудистых расстройств, почечных заболеваний,лимфопролиферативных заболеваний, ассоциированных с В-клетками, иммуносупрессорных заболеваний, заболеваний, ассоциированных с трансплантацией органов и ВИЧ-инфекций. Настоящее изобретение также относится к способам использования агентов для нормализации,подавления или изменения иммунного ответа,участвующего в пути передачи сигнала междуBAFF-R и его лигандом, и к способам ингибирования воспаления путем введения антитела против BAFF-R или его эпитопа. Способы настоящего изобретения предпочтительно осуществляют путем введения терапевтически эффективного количества полипептида BAFF-R, химерной молекулы, содержащей полипептид BAFF-R, слитый с гетерологичной аминокислотной последовательностью,или гомолога антитела против BAFF-R. В одном из вариантов своего осуществления, настоящее изобретение относится к фармацевтическим композициям, содержащим полипептид BAFF-R и фармацевтически приемлемый носитель. В другом варианте своего осуществления настоящее изобретение относится к химерным молекулам, содержащим полипептид BAFF-R,слитый с гетерологичной полипептидной или аминокислотной последовательностью. Примером такой химерной молекулы является BAFFR, слитый с Fc-областью иммуноглобулина или последовательностью меченого эпитопа. В другом варианте своего осуществления настоящее изобретение относится к антителу,которое специфически связывается с полипеп 5 тидом BAFF-R. Это антитело является, но не обязательно, моноклональным антителом. Краткое описание графического материала На фиг.1 показана последовательность нуклеиновой кислоты (SEQ ID NO:2) кДНКBAFF-R (ВСМА) человека и выведенная из нее аминокислотная последовательность (SEQ IDNO:1). Возможный сайт инициации трансляции находится в любом из остатков нуклеиновой кислоты (нуклетидов) 219 или 228; богатый цистеином домен (CRD) находится в остатках нуклеиновой кислоты 240-341 SEQ ID NO:2(аминокислотные остатки 8-41 SEQ ID NO:1); а возможная трансмембранная область находится в остатках нуклеиновой кислоты 375-459 SEQID NO:2. На фиг. 2 показана последовательность нуклеиновой кислоты (SEQ ID NO:4) и выведенная из нее аминокислотная последовательность (SEQ ID NO:3) pJST538, плазмиды, кодирующей BAFF-R-Fc: остатки нуклеиновой кислоты 1-69, мышиная сигнальная последовательность каппа-цепи IgG; остатки нуклеиновой кислоты 70-222, BAFF-R (остатки нуклеиновой кислоты 1-153); остатки нуклеиновой кислоты 223-906, IgG человека. На фиг. 3 показана последовательность нуклеиновой кислоты pJST535, плазмиды, кодирующей полноразмерный BAFF-R человека, и выведенная из нее аминокислотная последовательность. На фиг. 4 показано сравнение структурыTNF-R55 и BAFF-R. На фиг. 5 показаны клетки 293EBNA,трансфицированные либо (а) СН 269 (1,0 мкг),либо (b) pJST535 (0,1 мкг), плазмидой, экспрессирующей полноразмерный BAFF-R и окрашенной 0,5 мкг/мл flag-hBAFF в формате анализа на планшетах. На фиг. 6(а) показано FACS-перекрывание клеток 293EBNA, трансфицированных pJST535 и окрашенных следующим образом: без лиганда(розовая) или flag-hBAFF (зеленая). Затем все образцы окрашивали анти-flag М 2, а затем ослиным антителом против мышиных IgG, как описано в способах в примере 2. На фиг. 6(b) показаны FACS-гистограммы со статистическими данными одного и того же эксперимента. Окрашивание осуществлялось следующим образом: (1) не окрашивали, (2) только 7AAD, (3) во 2-ой стадии и только 7AAD, (4) 9 мкг/мл flag-hBAFF, (5) 3 мкг/млBAFF-R-Fc, как описано в способах в примере 4. Стандарты молекулярных масс в кДа помечены в левой части фигуры. Дорожки: (1) 12,5 нг 6 мл BAFF-R-Fc-кондиционированной среды, (4) иммунопреципитация flag-hTWEAK с использованием 0,5 мл BAFF-R-Fc-кондиционированной среды, (5) иммунопреципитация без лиганда с использованием 0,5 мл BAFF-R-Fcкондиционированной среды, (6) иммунопреципитация flag-hBAFF с использованием 0,5 мл кондиционированной среды от нетрансфицированных 293EBNA, (7) иммунопреципитацияflag-hTWEAK с использованием 0,5 мл кондиционированной среды от нетрансфицированных 293EBNA. На фиг. 8 показан график результатов анализа пролиферации спленоцитов, на котором представлены кривые, отражающие число импульсов в минуту (имп./мин), включенных в клетки мышиных спленоцитов, в зависимости от количества добавленного BAFF человека(мкг/мл). На фиг. 9 показан график результатов анализа блокирования BAFF, в котором изучается связывание BAFF с Raji-клетками, и приведены кривые данных считывания MFI (средней интенсивности флуоресценции), в зависимости от количества R:hIgGl (нг/мл). На фиг. 10(а) показаны графики экспрессии IgM в зависимости от CD1 в FACS-анализеBaff-Tg-мышей, которым вводили h-Ig (средняя панель) или hBCMA-Ig (нижняя панель), и однопометных контрольных мышей дикого типа,которым вводили PBS-инъекции (верхняя панель), как описано в примере 11. На фиг. 10(b) показаны графики экспрессии CD21 в зависимости от IgM в FACS-анализе на выявление (по дискриминационным окнам)IgD-положительных популяций для Baff-Tgмышей, которым вводили h-Ig (средняя панель) или hBCMA-Ig (нижняя панель), и для однопометных контрольных мышей дикого типа, которым вводили PBS-инъекции (верхняя панель),как описано в примере 11. На фиг. 10(с) показаны графики экспрессии CD21 в зависимости от IgM в FACS-анализе на выявление (по дискриминационным окнам)IgD-отрицательных популяций для Baff-Tgмышей, которым вводили h-Ig (средняя панель) или hBCMA-Ig (нижняя панель) и для однопометных контрольных мышей дикого типа, которым вводили PBS-инъекции (верхняя панель),как описано в примере 11. На фиг. 11 показаны массы селезенок для всех групп Baff-Tg-мышей (выражены как масса в мг +/- стандартное отклонение). На фиг. 12 показан график зависимости протеинурии (мг/дл) от числа инъекций дляBaff-Tg-мышей, обработанных PBS, hIg,hBCMA-Ig и для однопометных контрольных мышей. На фиг. 13 показан график среднего артериального давления (мм рт.ст.) у Baff-Tg-мышей и у контрольных мышей дикого типа. 7 На фиг. 14 показан график значений артериального давления (мм рт.ст.) у отдельныхBaff-Tg-мышей и у контрольных мышей дикого типа. На фиг. 15 показана гистограмма процентного отношения мышей SNF1, которые обнаруживали тяжелый нефрит после обработкиBAFF-R-Ig (BCMA-Ig), HuIgG или PBS. На фиг.16 показан график общего числа клеток CD11c + DC (в миллионах) у мышей,обработанных in vivo 20 мкг BCMA-Ig, 50 мкгBCMA-Ig, HuIgG или PBS. Были оценены клеточные популяции CDllc + DC: (1) CD8a-CD4-,(2) CD8a+CD4 и (3) CD8a-CD4+. Подробное описание 1. Определения Термины "BAFF-R" и "ВСМА", используемые в настоящем описании, охватывают нативную последовательность BAFF-R и вариантыBAFF-R (которые будут подробно определены ниже). BAFF-R может быть выделен из ряда источников, таких, например, как некоторые типы тканей мыши или человека, или из других источников, либо он может быть получен рекомбинантными методами или методами синтеза."Нативная последовательность BAFF-R" включает в себя полипептид, имеющий такую же аминокислотную последовательность, что иBAFF-R, происходящий из природных источников. Такая нативная последовательность BAFFR может быть выделена из природных источников, либо она может быть продуцирована рекомбинантными методами или методами синтеза. Существуют природные усеченные или секретированные формы BAFF-R (например, растворимые формы, содержащие, например, последовательность внеклеточного домена), природные варианты (например, альтернативно сплайсированные формы) и природные аллельные варианты BAFF-R. В одном из вариантов осуществления изобретения нативная последовательность BAFF-R представляет собой зрелую или полноразмерную нативную последовательность полипептида BAFF-R, содержащую аминокислоты 1-184 последовательность SEQ ID"BAFF-R-ECD" означает форму BAFF-R, которая в основном не содержит трансмембранных и цитоплазматических доменов BAFF-R. Обычно внеклеточный домен BAFF-R имеет менее, чем 1% из таких трансмембранных и цитоплазматических доменов, а предпочтительно менее, чем 0,5% таких доменов. BAFF-R-ECD содержит, но не обязательно, аминокислотные остатки 8-41SEQ ID NO:1 или аминокислотные остатки 4-51SEQ ID NO:1 или аминокислотные остатки 1-53SEQ ID NO:1. В предпочтительном варианте осуществления изобретения BAFF-R-ECD содержит аминокислотные остатки 1-51 SEQ ID 8 осуществления изобретения BAFF-R-ECD содержит аминокислотные остатки 1-50 SEQ IDBAFF-R настоящего изобретения, идентифицируют в соответствии с критериями, обычно используемыми для идентификации гидрофобного домена такого типа. Точные границы трансмембранного домена могут варьироваться, но, по всей вероятности, не более, чем по 5 аминокислотам на любом конце домена, конкретно упомянутого в настоящем описании. В соответствии в этим, BAFF-R-ECD может, но не обязательно, включать в себя аминокислоты 8-41BAFF-R, определяемый ниже и имеющий по меньшей мере примерно 80%-ную идентичность аминокислотной последовательности с BAFF-R,имеющим выведенную аминокислотную последовательность, показанную в SEQ ID NO:1 для полноразмерной нативной последовательностиBAFF-R или с последовательностью BAFF-RECD. Такими вариантами BAFF-R являются,например, полипептиды BAFF-R, в которых на конце или С-конце последовательности SEQ IDNO:1 добавлены или делетированы один или несколько аминокислотных остатков. Обычно вариант BAFF-R имеет по меньшей мере примерно 80%-ную или 85%-ную, более предпочтительно - по меньшей мере примерно 90%ную, и даже более предпочтительно - по меньшей мере примерно 95%-ную идентичность аминокислотной последовательности с аминокислотной последовательностью SEQ ID NO:1."Процент (%) идентичности аминокислотной последовательности" по отношению к последовательностям BAFF-R, идентифицированным в настоящем изобретении, определяют как процент аминокислотных остатков в последовательности-кандидате, которая является идентичной аминокислотным остаткам в последовательности BAFF-R, после сопоставления первичных последовательностей и введения пробелов, если это необходимо для достижения максимального процента идентичности последовательности, и не принимая во внимание какиелибо консервативные замены, сделанные в процессе идентификации последовательностей. Сопоставление первичных последовательностей в целях определения процента индентичности аминокислотной последовательности может быть достигнуто различными способами, известными специалистам, например, с использованием широко доступного программного обеспечения, такого как BLAST, ALIGN илиMegalign (DNASTAR). Каждый специалист может определить соответствующие параметры для проведения сопоставительного анализа,включая любые алгоритмы, необходимые для достижения максимального сопоставления по всей длине сравниваемых последовательностей. 9 Используемый здесь термин "меченый эпитоп" относится к химерному полипептиду,содержащему BAFF-R или последовательность его домена, слитую с "полипептидной меткой". Полипептидная метка имеет достаточное число остатков для получения эпитопа, против которого может быть продуцировано антитело или который может быть идентифицирован какимлибо другим агентом, но при этом достаточно коротким, таким, чтобы он не препятствовал активности BAFF-R. Полипептидная метка предпочтительно также должна быть абсолютно уникальной, так, чтобы антитело в основном не вступало в перекрестную реакцию с другими эпитопами. Подходящие полипетпидные метки в основном имеют по меньшей мере 6 аминокислотных остатков, а обычно от приблизительно 8 до 50 аминокислотных остатков (предпочтительно, примерно от 10 до 20 остатков). Термин "выделенный", используемый для описания различных упомянутых здесь полипептидов, относится к полипептиду, который был идентифицирован и выделен и/или восстановлен из компонента его природного окружения. Примесными компонентами его природного окружения являются материалы, которые обычно препятствуют диагностическому или терапевтическому применению данного полипептида и которыми могут быть ферменты, гормоны и другие белковые или не-белковые растворенные вещества. В предпочтительных вариантах осуществления изобретения указанный полипептид может быть очищен (1) до степени,достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающейся чашкой или (2) до гомогенности с помощью электрофореза в ПААГ с ДСН в невосстанавливающих или восстанавливающих условиях с использованием кумасси синего или предпочтительно серебрянного красителя. Выделенным полипептидом является полипептид in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природного окружения BAFF-R в них не присутствует. Однако обычно выделенный полипептид может быть получен по меньшей мере за одну стадию очистки. Термин "антитело" используется в самом широком смысле и конкретно включает в себя моноклональные антитела против BAFF-R(включая антитела-агонисты,антителаантагонисты и нейтрализующие антитела) и композиции антител против BAFF-R с полиэпитопной специфичностью. Используемый здесь термин "моноклональное антитело" означает антитело, полученное из популяции в основном гомогенных антител, т.е. отдельные антитела,составляющие эту популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. 10 Используемый здесь термин "очищенный препарат" или "в основном чистый препарат" полипептида означает полипептид, который был выделен из других белков, липидов и нуклеиновых кислот, являющихся его природным окружением. Предпочтительно, указанный полипептид также выделяют из других веществ, например, антител, матриксов и т.п., которые используют для его очистки. Используемые здесь термины "лечение","курс лечения" и "терапия" означают лечебную терапию, профилактическую терапию и превентивную терапию. Используемые здесь термины "пептиды","белки" и "полипептиды" являются взаимозаменяемыми. Используемый здесь термин "биологически активный" относится к in vivo или in vitroактивности, которая может быть осуществлена непосредственно или опосредованно. Биологически активные фрагменты BAFF-R могут иметь, например, 70% аминокислотную гомологию, более предпочтительно по меньшей мере 80%, а наиболее предпочтительно - по меньшей мере 90%-гомологию с активным сайтом рецептора. Идентичность или гомология по отношению к рецептору определена здесь как процент аминокислотных остатков в последовательности-кандидате, которая идентична остаткамBAFF-R в SEQ ID NO:1 или которая идентична определенной области аминокислотных остатков в SEQ ID NO:1. Используемый здесь термин "млекопитающее" означает любое животное, классифицированное как млекопитающее, включая человека, коров, лошадей, собак, мышей и кошек. В предпочтительном варианте осуществления изобретения таким млекопитающим является человек. Для осуществления настоящего изобретения могут быть использованы, если это не оговорено особо, стандартные методы клеточной биологии, клеточного культивирования, молекулярной биологии, трансгенной биологии,микробиологии, рекомбинантных ДНК и иммунологии, которые известны специалистам. Указанные методы описаны в литературе. Далее приводится подробное описание предпочтительных вариантов осуществления настоящего изобретения. Настоящее изобретение относится к использованию BAFF-R и родственных BAFF-R молекул для эффективного роста и созревания В-клеток и секреции иммуноглобулина. Настоящее изобретение также относится к использованию BAFF-R и родственных BAFF-R молекул для вырабатывания эффективных ответов иммунной системы, необходимых при расстройствах, связанных с иммунными нарушениями. Кроме того, настоящее изобретение относится к лечению рака и иммунных расстройств посредством использова 11 ния гена BAFF-R или родственного BAFF-R методами генной терапии.BAFF-R и его гомологи, продуцированные хозяевами, трансформированными последовательностями настоящего изобретения, а также нативный BAFF-R, очищенный известными методами или продуцированный из известных аминокислотных последовательностей, могут быть использованы в ряде методов противоракового, противоопухолевого и иммунорегуляторного применения. Они также могут быть использованы в терапии и в методах, направленных на лечение других болезней. В другом своем аспекте, настоящее изобретение относится к использованию полипептида, кодируемого выделенной нуклеиновой кислотой, кодирующей BAFF-R, в "антисмысловой" терапии. Используемый здесь термин"антисмысловая" терапия относится к введению или генерированию in situ олигонуклеотидов или их производных, которые специфически гибридизуются в клеточных условиях с клеточной мРНК и/или ДНК, кодирующей нужный лиганд, в целях ингибирования экспрессии кодированного белка, т.е. ингибирования транскрипции и/или трансляции. Связывание может происходить по комплементарным стандартным парам оснований или, например, в случае связывания с ДНК-дуплексами, посредством специфических взаимодействий в большой бороздке двойной спирали. В общих чертах, "антисмысловая" терапия относится к ряду методов,обычно используемых специалистами, и включает в себя любую терапию, которая основана на специфическом связывании с олигонуклеотидными последовательностями. Антисмысловая конструкция настоящего изобретения может быть доставлена, например,в виде экспрессирующей плазмиды, которая,при ее транскрибировании в клетке, продуцирует РНК, комплементарную по меньшей мере части клеточной мРНК, кодирующей BAFFлиганд. Альтернативно, антисмысловая конструкция может представлять собой олигонуклеотидный зонд, генерируемый ex vivo. Такие олигонуклеотидные зонды предпочтительно представляют собой модифицированные олигонуклеотиды, которые являются резистентными к эндогенным нуклеазам и, таким образом, являются стабильными in vivo. Примерами нуклеиновокислотных молекул, используемых в качестве антисмысловых олигонуклеотидов, являются фосфорамидаты, фосфотиоатные и метилфосфонатные аналоги ДНК (см., например,5176996, 5264564 и 5256775). Кроме того, общие подходы для конструирования олигомеров,используемых в антисмысловой терапии, были описаны, например, Van Der Krol et al., (1998)Biotechniques 6:958-976; и Stein et al. (1998) Cancer Res. 48:2659-2668, которые вводятся в настоящее описание посредством ссылки.BAFF-R согласно изобретению, обсуждаемый выше, является членом семейства рецепторов TNF. Указанный белок, его фрагменты и гомологи могут иметь широкое терапевтическое и диагностическое применение. Полипептиды согласно изобретению специфически взаимодействуют с BAFF, полипептидом, ранее описанным в заявке WO99/12964,которая вводится в настоящее описание посредством ссылки. Однако описанные здесь пептиды и методы позволяют идентифицировать молекулы, которые специфически взаимодействуют сBAFF-R или с его фрагментами. В некоторых своих вариантах заявленное изобретение относится к способам использования пептидов, происходящих от BAFF-R, способных связываться с BAFF. Фрагменты BAFFR могут быть продуцированы несколькими способами, например, рекомбинантно, с помощью ПЦР, путем протеолитического расщепления или химического синтеза. Внутренние или концевые фрагменты полипептида могут быть генерированы путем удаления одного или нескольких нуклеотидов от одного конца или от обоих концов нуклеиновой кислоты, кодирующей данный полипептид. Экспрессия мутагенизированной ДНК приводит к продуцированию полипептидных фрагментов. Химерные молекулы, используемые в настоящем изобретении, могут быть также продуцированы известными методами. В настоящем изобретении рассматривается использование химерных молекул, содержащих полипептидBAFF-R (или его вариант), слитый с гетерологичной аминокислотной последовательностью,такой как домен IgG-Fc иммуноглобулина. Указанные химерные молекулы предпочтительно являются растворимыми и содержат растворимый полипептид BAFF-R. В предпочтительном варианте осуществления изобретения указанная химерная молекула содержит аминокислотные остатки 1-50 SEQ ID NO:1, слитые с Fcдоменом. Полипептидные фрагменты могут быть также химически синтезированы известными методами, такими как стандартный твердофазный синтез с использованием f-moc- или t-bocхимии Мерифильда. Так, например, пептиды и ДНК-последовательности согласно изобретению могут быть произвольно разделены на фрагменты нужной длины без перекрывания фрагментов, либо они могут быть разделены на перекрывающиеся фрагменты нужной длины. Такие методы более подробно описаны ниже. Генерирование растворимых форм BAFF-R Растворимые формы BAFF-R часто могут эффективно передавать сигнал, а поэтому они могут быть введены в качестве лекарственного средства, которое в данном случае имитирует природную мембранную форму. Предполагается, что заявленный здесь BAFF-R секретируется в природе как растворимый цитокин, однако 13 если это не имеет место, этот ген можно снова сконструировать для усиления секреции. Для создания растворимой секретированной формыBAFF-R необходимо удалить - на уровне ДНК N-концевые трансмембранные области и определенную часть области-"стебля" и заменить их лидерной последовательностью типа I или лидерной последовательностью альтернативного типа II, которая обеспечивает эффективное протеолитическое расщепление в выбранной экспрессионной системе. Каждый специалист может варьировать количество области-"стебля",присутствующего в секреторной экспрессионной конструкции в целях оптимизации как свойств связывания лиганда, так и эффективности эскпрессии. Так, например, конструкции,содержащие все возможные длины "стебля", т.е.N-концевые усечения, могут быть получены так,чтобы продуцировались белки от аминокислоты 1 до аминокислоты 51. В результате анализов такого типа должна быть установлена оптимальная длина последовательности "стебля". В предпочтительных вариантах осуществления изобретения растворимый полипептидBAFF-R представляет собой выделенный полипептид с нативной последовательностью BAFFR, содержащий аминокислотные остатки 1-51SEQ ID NO:1 или его фрагмент; выделенный полипептид BAFF-R, имеющий по крайней мере 80%-ную (а более предпочтительно, 90%-ную) идентичность аминокислотной последовательности с нативной последовательностью полипептида BAFF-R, содержащий аминокислотные остатки 1-51 SEQ ID NO:1, или его фрагмент; выделенный полипептид BAFF-R с нативной последовательностью, содержащий аминокислотные остатки 1-50 SEQ ID NO:1 или его фрагмент; или выделенный полипептид BAFFR, содержащий аминокислотные остатки 8-41BAFF-R Настоящее изобретение также относится к антителам, специфически реагирующим с заявленным BAFF-R или с его ко-рецепторами. Антисыворотка или моноклональные антитела против белка/против пептида могут быть получены стандартными методами (см., например,Antibodies: A Laboratory Manual, ed. by Harlowand Lane (Cold Spring Harbor Press:1988. Млекопитающее, такое как мышь, хомяк или кролик, может быть иммунизировано иммуногенной формой данного пептида. Методами сообщения иммуногенности белку или пептиду являются конъюгирование с носителями или другие методы, хорошо известные специалистам. Иммуногенная часть BAFF-R или его корецепторы могут быть введены в присутствии адъюванта. Ход иммунизации может быть прослежен путем детекции титров антител в плазме или сыворотке. Для оценки уровней антител могут быть предприняты стандартный методELISA или другие иммуноанализы с использованием иммуногена в качестве антигена. В предпочтительном варианте осуществления изобретения, рассматриваемые антитела являются иммуноспецифичными для антигенных детерминант BAFF-R или его корецепторов, например, антигенных детерминант полипептида SEQ ID NO:1 или его близкородственного человеческого или не-человеческого гомолога (например, имеющего 70, 80 или 90%ную гомологию, а более предпочтительно по крайней мере 95 %-ную гомологию). В другом предпочтительном варианте осуществления изобретения антитела против BAFF-R или против BAFF-ко-рецептора в основном не вступают в перекрестную реакцию (то есть реагируют специфически) с белком, который, например,менее, чем на 80% гомологичен SEQ ID NO:1; а предпочтительно, менее, чем на 90% гомологичен SEQ ID NO:1; а наиболее предпочтительно менее, чем на 95% гомологичен SEQ ID NO:1. Термин "в основном не вступающий в перекрестную реакцию" относится к антителу, имеющему аффинность связывания негомологичного белка, которая составляет менее, чем 10%, более предпочтительно - менее, чем 5%, и даже более предпочтительно - менее, чем 1% от аффинности связывания белка с последовательностьюSEQ ID NO:1. Используемый здесь термин "антитело" охватывает его фрагменты, которые также специфически реагируют с BAFF-R или с его рецепторами. Антитела могут быть фрагментированы стандартными методами, и их фрагменты могут быть подвергнуты скринингу для выяснения возможности их использования в способе,описанном выше для целых антител. Так, например, F(ab')2-фрагменты могут быть генерированы путем обработки антитела пепсином. Полученный F(ab')2-фрагмент может быть обработан для восстановления дисульфидных мостиков с продуцированием Fab'-фрагментов. Кроме того, антитела настоящего изобретения содержат биоспецифические и химерные молекулы, обладающие активностью против BAFF-R или против BAFF-ко-рецептора. Так, например,моноклональные и поликлональные антитела(Аb), направленные против BAFF-R и их корецепторов, и фрагменты антител, такие как Fab' и F(ab')2, могут быть использованы для блокирования действия BAFF-R и его соответствующих ко-рецепторов. Различные формы антител могут быть также получены стандартными методами рекомбинантных ДНК (WinterMilstein, Nature 349: 293-299 (1991), эта работа вводится в настоящее описание посредством ссылки). Так,например, могут быть сконструированы химерные антитела, в которых антиген-связывающий домен, происходящий от антитела животного,присоединен к константному домену человека(например, Cabilly et al., патент США 4816567, 15 который вводится в настоящее описание посредством ссылки). Химерные антитела могут снижать наблюдаемые иммуногенные ответы,вырабатываемые антителами животного, при их использовании в клинической терапии пациента. Кроме того, могут быть синтезированы рекомбинантные "гуманизированные антитела",которые распознают BAFF-R или его корецепторы. "Гуманизированные" антитела представляют собой химеры, включающие в себя главным образом последовательности IgG человека, в которые были встроены области, ответственные за специфическое связывание с антигеном. Животных иммунизируют нужным антигеном, выделяют соответствующие антитела и удаляют часть последовательностей вариабельной области, ответственных за специфическое связывание с антигеном. Области связывания с антигеном, происходящие от животного, затем клонируют в соответствующее положение генов антитела человека, в которых были делетированы области связывания с антигеном. "Гуманизированные" антитела позволяют минимизировать использование гетерологичных (например,межвидовых) последовательностей в антителах человека, и тем самым снижают вероятность вырабатывания иммунного ответа у индивидуумов, проходящих курс лечения. Конструирование рекомбинантных антител различных классов может быть также осуществлено путем продуцирования химерных или "гуманизированных" антител, содержащих вариабельные домены и константные домены человека (CH1, CH2, СН 3), выделенные из иммуноглобулинов различных классов. Так, например, антитела с повышенными валентностями антиген-связывающего центра могут быть рекомбинантно продуцированы путем клонирования антиген-связывающего центра в векторы,несущие константные области цепи антитела человека (Arulanandam et al., J. Exp. Med.,177:1439-1450 (1993), эта работа вводится в настоящее описание посредством ссылки). Кроме того, для изменения аффинностей связывания рекомбинантных антител с их антигенами могут быть использованы стандартные методы рекомбинантных ДНК путем модификации аминокислотных остатков, находящихся вблизи от антиген-связывающих центров. Аффинность связывания "гуманизированного" антитела с антигеном может быть увеличена посредством мутагенеза на основе молекулярного моделирования. (Queen et al., Proc. Natl. Acad.Sci. 86:10029-33 (1989), эта работа вводится в настоящее описание посредством ссылки. Генерирование аналогов. Продуцирование модифицированных ДНК и пептидных последовательностей. Аналоги BAFF-R могут отличаться от природного BAFF-R по своим аминокислотным последовательностям или по присутствию или 16 осутствию тех или иных последовательностей,или по тому или другому признаку. Модификации, не относящиеся к последовательностям,включают в себя in vivo или in vitro химическую дериватизацию BAFF-R. Модификациями, не относящимися к последовательностям, являются, но не ограничиваются ими, изменения в ацетилировании, метилировании, фосфорилировании, карбоксилировании или гликозилировании. Предпочтительными аналогами являютсяBAFF-R или его биологически активные фрагменты, последовательности которых отличаются от последовательности SEQ ID NO:1 благодаря одной или нескольким заменам консервативных аминокислот, либо благодаря одной или нескольким заменам, делециям или вставкам неконсервативных аминокислот, которые не разрушают активность BAFF-лиганда. Консервативными заменами обычно являются замены одной аминокислоты на другую с аналогичными свойствами, например, замены внутри следующих групп: валин, глицин; глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота,глутаминовая кислота; аспарагин, глутамин; серин, треонин; лизин, аргинин; и фенилаланин,тирозин. Применения Полноразмерный ген BAFF-R (SEQ IDNO:2) или его части могут быть использованы в качестве гибридизационных зондов для библиотеки кДНК в целях выделения, например, других генов, которые имеют нужную последовательность, идентичную последовательностиBAFF-R, описанной в SEQ ID NO:2. Нуклеотидные последовательности, кодирующие BAFF-R,могут быть также использованы для конструирования гибридизационных зондов для картирования гена, кодирующего BAFF-R, и для генетического анализа индивидуумов с генетическими нарушениями. Скринирующие анализы могут быть разработаны для обнаружения основных соединений, имитирующих биологическую активность BAFF-R. Такими скринирующими анализами являются анализы, применимые для высокопроизводительного скрининга химических библиотек, что делает их особенно подходящими для идентификации небольших молекул-кандидатов на лекарственное средство. Указанными небольшими молекулами являются синтетические органические или неорганические соединения. Нуклеиновые кислоты, кодирующие BAFF-R или его модифицированные формы, могут быть также использованы для генерирования трансгенных животных или "нокаут"-животных, которые, в свою очередь, могут быть использованы для разработки и скрининга терапевтически эффективных реагентов. Как описано в настоящей заявке, в одном из своих вариантов, настоящее изобретение относится к способам стимуляции роста В-клеток,роста и созревания В-клеток, индуцированных дендритными клетками, или продуцирования 17 иммуноглобулина у животного с использованием полипептида BAFF-R, или ко-стимуляции роста В-клеток, роста и созревания В-клеток,индуцированных дендритными клетками, или продуцирования иммуноглобулина у животного с использованием полипептида BAFF-R и антитела против антигена Т, лиганда CD40 или антиСD40-лиганда. Подходящими являются также способы ингибирования роста В-клеток, роста и созревания В-клеток, индуцированных дендритными клетками, или продуцирования иммуноглобулина у животного с использованием полипептида BAFF-R. В другом варианте своего осуществления настоящее изобретение относится к способам использования BAFF-R для лечения аутоиммунных болезней, гипертонии, сердечнососудистых расстройств, почечных заболеваний,лимфопролиферативных заболеваний, ассоциированных с В-клетками, иммуносупрессорных заболеваний, нарушений при трансплантации органов, воспалений и ВИЧ-инфекций. Подходящими также являются методы использования агентов для лечения, подавления или модификации иммунного ответа, участвующего в пути передачи сигнала между BAFF-R и его лигандом. В одном из своих вариантов настоящее изобретение относится к фармацевтическим композициям, содержащим полипептид BAFF-R и фармацевтически приемлемый носитель. Подходящие носители для полипептида BAFF-R и их композиции описаны, например, в Remington's Pharmaceutical Sciences, 16th ed., 1980, MackPublishing Co., edited by Oslo et al. Обычно для приготовления изотонической композиции используют соответствующее количество фармацевтически приемлемой соли. Примерами такого носителя являются буферы, такие как физиологический раствор, раствор Рингера и раствор декстрозы. рН данного раствора предпочтительно составляет примерно от 5 до 8, а более предпочтительно - примерно от 7,4 до 7,8. Кроме того, могут быть использованы носители для приготовления препаратов пролонгированного высвобождения, такие как полупроницаемые матрицы из твердых гидрофобных полимеров,где указанные матрицы могут быть изготовлены в виде изделия определенной формы, например,в виде липосом, пленок или микрочастиц. Для каждого специалиста очевидно, что некоторые носители могут быть более предпочтительными в зависимости, например, от пути введения и концентрации вводимого полипептида BAFF-R. Введение может быть осуществлено посредством инъекции (например, внутривенной,внутрибрюшинной, подкожной, внутримышечной) или другими методами, такими как инфузия, которая обеспечивает доставку лекарственного препарата в кровоток в эффективной форме. 18 Для осуществления настоящего изобретения могут быть использованы, если это не оговорено особо, стандартные методы клеточной биологии, культивирования клеток, молекулярной биологии, микробиологии, рекомбинантных ДНК, химии белков и иммунологии, которые известны специалистам. Указанные методы описаны в литературе. См., например, MolecularHarbor Laboratory Press, 1986. Нижеследующие примеры приводятся для иллюстрации настоящего изобретения и не должны рассматриваться как его ограничение. Примеры Пример 1. Детекция связывания BAFF сBAFF-R с использованием анализа на планшетах. В этом примере описано связывание BAFF с BAFF-R-трансфицированными клетками с использованием анализа на планшетах. Полноразмерный BAFF-R человека генерировали из polyA + РНК BJAB с использованием набора для предварительной амплификацииSuperscriptII (Life Technologies) в целях генерирования кДНК-матрицы и амплифицировали посредством Pful с использованием праймеров,комплементарных 5'- и 3'-кодирующим последовательностям BAFF-R. ПЦР-продукт был клонирован в СН 269, производное рСЕР 4 (Invitrogen). Полученный клон обозначали pJST535. Эмбриональные клетки почек человека, содержащие ген EBNA-1 (293EBNA), высевали в 6 луночные планшеты, сенсибилизированные фибронектином, и трансфицировали липофектамином (Life Technologies) с использованием либо pJST535 при различных разведениях, либо СН 2 69 в качестве фонового контроля. Через 48 ч после трансфекции трансфицированные клетки анализировали на их способность к связыванию с растворимым flag-hBAFF (аминокислоты 19 проводили при комнатной температуре. Кондиционированные среды отсасывали из лунок, и клетки промывали буфером ВНА (20 мМHEPES, рН 7,0, 0,5 мг/мл BSA, 0,1 % NaN3) и инкубировали в присутствии 0,5 мкг/мл FLAGhBAFF, разведенном в PBS, содержащем 1 мМ МgСl2, 1 мМ СаСl2 и 0,1% NaN3. После инкубирования в течение 1 ч раствор BAFF удаляли, и клетки промывали ВНА. Затем клетки инкубировали в течение 30 мин в растворе PBS, содержащем 1 мкг/мл моноклонального антитела против FLAG, M2 (Sigma). Этот раствор отсасывали, и клетки промывали ВНА. Затем клетки инкубировали в течение 30 мин в разведении 1:3000 конъюгированного с щелочной фосфатазой козьего F(ab')2 против мышиного IgG (Jackson ImmunoResearch). Этот раствор отсасывали,и клетки промывали ВНА. Для снижения фонового окрашивания, вызываемого эндогенной щелочной фосфатазой, клетки инкубировали в течение 15 мин в 2,5 мМ левамизола (VectorLaboratories), разведенного в 100 мМ NaCl, 100 мМ Трис-С 1, рН 9,5 и 5 мМ МgСl2. Для хромогенной детекции щелочной фосфатазы, раствор ингибитора отсасывали, и клетки инкубировали с раствором быстрого красного и нафтолфосфата (Pierce). Окрашивание наблюдали и фотографировали на микроскопе низкой мощности. Осаждение быстрого красного красителя наблюдали во всех лунках, трансфицированныхBAFF-R-экспрессирующей плазмидой, pJST535. Частота сигнала, титрованного как количество плазмиды, трансфицированной в клетки, снижалась. При этом для клеток, трансфицированных контрольным экспрессирующим вектором,СН 269, какого-либо окрашивания не наблюдалось. Не наблюдалось также окрашивания и на любых трансфицированных клетках, у которых,по схеме окрашивания, отсутствовали flaghBAFF или в случае, когда flag-hBAFF был заменен на другой лиганд, член семейства TNF,FLAG-меченный LIGHT. Поэтому окрашиваниеFASC. В этом примере описана детекция связывания BAFF с BAFF-R-трансфицированными клетками с использованием анализа FASC. Плазмиду, кодирующую полноразмерныйBAFF-R, pJST535, трансфицировали в клетки 293EBNA с использованием FuGene6 (Boehringer Mannhiem). Через 24 или 48 ч после трансфекции клетки удаляли из планшетов с использованием 5 мМ EDTA в PBS и подсчитывали. Эти клетки два раза промывали FASCбуфером (PBS, содержащим 10% фетальную бычью сыворотку, 0,1% NaN3 и 10 мкг/мл hIgG(Jackson ImmunoResearch), а затем 2,5 х 105 клеток инкубировали в течение 1 ч на льду вместе с 20 концентрациях в пределах от 9 мкг/мл до 0,037 мкг/мл. Эти клетки промывали FASC-буфером и инкубировали с моноклональным антителом против FLAG, M2, при концентрации 5 мкл/мл в течение 30 мин на льду. Эти клетки промывалиFASC-буфером и инкубировали в течение 30 мин на льду в растворе, содержащем разведенный 1:100 R-фикоэритрин, конъюгированный сF(ab')2-фрагментом ослиного антитела против мышиных IgG и 10 мкг/мл 7-AAD. После промывки клеток FASC-буфером их ресуспендировали в FASC-буфере, содержащем 1% параформальдегида. В результате FASC-анализа 7-AADположительные клетки (погибшие) были отсортированы. Результаты FASC-анализа показали, что фракция клеток, трансфицированных BAFF-R,способна связываться с BAFF. При концентрации BAFF 9 мкг/мл примерно 28% клеток связываются с BAFF со средней интенсивностью флуоресценции (MFI) 366. При использовании одного РЕ-меченного ослиного антимышиного реагента значительного сдвига клеток не наблюдали. Только 1,3% клеток имели MFI=23,5,при этом среднее значение для всех клеток составляло 5,5. Сигнал отBAFF-Rтрансфицированных клеток давал титры со снижающимися количествами BAFF. При 100 нг/мл, 8,76% клеток имели MFI=78,9. Пример 3. FASC-анализы на BAFF/BAFFR-взаимодействие, включающие маркер GFP. В этом примере описана способностьpJST535 и репортерной плазмидой GFP, как описано в примере 2. Репортерная плазмида кодирует заякоренную на мембране молекулуGFP. С использованием ко-трансфекции двух плазмид авторы настоящего изобретения проанализировали процент трансфицированных клеток, которые способны связываться с BAFF. Эти клетки удаляли из планшетов и подвергали связыванию с BAFF и детекции, как описано в примере 2. И снова, 7-AAD включали для того,чтобы выявить погибшие клетки. Образцы анализировали с помощью FASC и строили кривые. Верхний правый квадрант представляет клетки со связанным(фикоэритринположительные) и экспрессирующие GFP. Хотя не все GFP-трансфицированные клетки обнаруживали связанный BAFF, однако в верхнем правом квадранте присутствовала значительная фракция клеток по сравнению с контролем. В этом верхнем правом квадранте имелось тридцать три процента трансфицированных клеток, тогда как контроль давал 8 процентов. Возможно, что для определенного уровня экспрессии BAFF-R необходимо, чтобыBAFF связывался с данными клетками. Возможно также, что для высокоаффинного взаи 21 модействия нужен ко-рецептор, и что этот рецептор является ограничивающим на клетках 293EBNA. Пример 4. Иммунопреципитация flaghBAFF с использованием гибрида BAFF-R-Fc. В этом примере описано специфическое взаимодействие flag-hBAFF с BAFF-R-Fc, молекулой, состоящей из цистеин-богатого доменаCRD BAFF-R генерировали с помощью ОТ-ПЦР из polyA + РНК BJAB, как описано в примере 1 с использованием 3'-олиго-праймера,комплементарного нуклеотидам 132-152 кодирующей последовательности hBAFF-R. Полученный ПЦР-фрагмент клонировали в СН 269 ниже сигнальной последовательности каппацепи мышиного IgG и выше Fc-части IgG человека. Эту контрукцию обозначали pJST538. Конструкцию pJST538 или СН 269 трансфицировали в клетки 293EBNA с помощью липофектамина. Кондиционированную среду и клеточные экстракты собирали через 20 часов после трансфекции. Клетки солюбилизировали в 20 мМ Триса, рН 7,5/50 мМ NaCl/0,5% NP40/0,5% дезоксихолиновой кислоты и дебрис центрифугировали. Аликвоту кондиционированных сред и клеточных экстрактов объединяли с равным объемом 2 х ДСН-редуцирующего буфера, кипятили и подвергали электрофорезу в ДСН-ПААГ и вестерн-переносу. Для подтверждения экспрессии мембрану зондировали разведенным 1:3000 мышиным антителом против человеческих IgG, конъюгированным с пероксидазой хрена (ПХ), в 5% обезжиренном сухом молоке вTBST при комнатной температуре в течение 30 мин, и промывали TBST. Блоты проявляли с использованием ЭХЛ (Amersham) и экспонировали с пленкой. Иммунопреципитацию осуществляли путем инкубирования 25 нг flag-hBAFF или flaghTWEAK с 0,5 мл кондиционированной среды от клеток 293EBNA, трансфицированных либоpJST538, либо СН 269, при 4 С в течение 1 ч при помешивании, с последующим добавлением 30 мкл Белка А-Сефарозы (Pharmacia) и непрерывным помешиванием в течение ночи. Гранулы Белка А-Сефарозы дважды промывали PBS и ресуспендировали в 2 х ДСН-восстанавливающем буфере для образца. После электрофореза в ДСН-ПААГ и вестерн-переноса, блоты инкубировали с 5 мкг/мл моноклонального антитела против flag M2 (Sigma), в 5%-ном обезжиренном сухом молоке в TBST при комнатной температуре в течение 1 ч. Блоты промывали TBST и инкубировали с разведенным 1:3000 козьим антителом против мышиных IgG, конъюгированным с ПХ (Jackson Immunoresearch) , в 5% обезжиренном сухом молоке в TBST при комнатной температуре в течение 30 мин. Блоты проявляли с использованием ЭХЛ (Amersham) и экспонировали с пленкой. 22 После трансфекции pJST538 в клетки 293EBNA экспрессию белка с молекулярной массой приблизительно 43 кДа определяли в клеточном экстракте и в кондиционированной среде путем Вестерн-блот-анализа с использованием мышиного античеловеческого IgG (Jackson Immunoresearch), что указывало на то, что гибрид BAFF-R-Fc был эффективно экспрессирован и секретирован. При иммунопреципитациях полосу наблюдали только в результате инкубирования BAFFR-Fc и Flag-hBAFF. Эта полоса мигрировала вместе с непосредственно загруженным образцом flag-hBAFF. Ни одна из других дорожек не продуцировала сигнал, что указывало на то, что слияние BAFF-R-Fc с flag-hBAFF является специфическим. Пример 5. Генерирование растворимых форм рецептора. Для получения ингибитора рецептора в целях его введения человеку необходима кДНКпоследовательность внеклеточного домена рецептора человека. Если мышиная форма является известной, библиотеки кДНК человека скринируют с использованием мышиной кДНКпоследовательности, и такие манипуляции являются рутинными для специалистов в этой области. С использованием кДНК-последовательности человека можно сконструировать олигонуклеотидные праймеры для ПЦРамплификации внеклеточного домена рецептора в отсутствии трансмембранных и внутриклеточных доменов. Обычно большинство аминокислот включают между последним дисульфидом,связанным с "доменом TNF", и трансмембранным доменом. Для оптимизации активности полученного растворимого рецептора количество областей "стебля" можно варьировать. Этот амплифицированный участок должен быть сконструирован так, чтобы он включал в себя подходящие сайты рестрикции, что позволило бы его клонировать в различные С-концевые Igслитые химерные векторы. Альтернативно, у 3'конца можно встроить стоп-сигнал и получить растворимую форму рецептора, не прибегая к технике с использованием Ig-слитой химеры. Полученные векторы могут быть экспрессированы в большинстве систем, используемых в биотехнологии, включая дрожжи, клетки насекомых, бактериальные клетки и клетки млекопитающих, и такие примеры существуют для экспрессии всех типов экспрессии. При необходимости, для оптимизации или удаления взаимодействий между FcR и комплементом, различные домены Fc человека могут быть связаны. Альтернативно, мутированные формы этихFc-доменов могут быть использованы для селективного удаления взаимодействий междуN-связанных cахаров к домену Fc, что имеет некоторые преимущества. 23 Пример 6. Генерирование антителагонистов и антител-антагонистов. Вышеописанные растворимые формы рецепторов могут быть использованы для иммунизации мышей и для получения моноклональных антител стандартными методами. Полученные mAbs, которые идентифицируются методами ELISA, могут быть затем скринированы на их агонистическую активность либо как растворимые антитела, либо как антитела, иммобилизованные на пластиковой подложке, в различных клеточных анализах in vitro. Часто гибель клеточной линии НТ 29 представляет собой удобную систему, которая является чувствительной к передаче сигнала через множество рецепторов TNF. Если эта линия не имеет нужного рецептора, то полноразмерный рецептор может быть стабильно трансфицирован в клеточную линию НТ 29, что позволило бы в данном случае проводить анализ на цитотоксичность. Альтернативно, указанные клетки могут быть использованы в аппарате Cytosensor, с тем,чтобы определить, может ли активация данного рецептора выявить изменение рН, указывающее на событие передачи сигнала. Рецепторы семейства TNF передают сигнал в таком формате достаточно хорошо, и этот способ не требует знания о действительных биологических событиях,запускаемых данным рецептором. Для клинического применения mAbs-агонисты должны быть"гуманизированными". Эта процедура может быть также использована для определенияmAbs-антагонистов. Такие mAbs должны быть определены по отсутствию агонистической активности и по способности ингибировать взаимодействие рецептора с лигандом, прослеживаемой с помощью ELISA, метода классического связывания или метода BIAcore. И наконец,индуцирование секреции хемокина различными клетками в ответ на антитело-агонист может быть положено в основу скринирующего анализа. Пример 7. Скрининг ингибиторов взаимодействия "рецептор-лиганд". С использованием слитого белка "рецептор-Ig" можно подвергнуть скринингу любые комбинаторные библиотеки на предмет определения молекул, которые могут непосредственно связываться с рецептором. Эти молекулы затем могут быть протестированы в форматированном"рецептор-Ig" и растворимой формы лиганда на их способность ингибировать взаимодействие рецептора с лигандом. Указанный ELISA может быть использован непосредственно для скрининга библиотек различных природных продуктов, например, на присутствие ингибирующих соединений. Этот рецептор может быть трансфицирован в клеточную линию, такую как линия НТ 29 для разработки биологического анализа (в данном случае цитотоксичности), кото 004635 24 рый может быть затем положен в основу скринирующего анализа. Пример 8. BAFF-R-IgG приводит к снижению числа В-клеток у нормальных мышей. 8-Недельных самок мышей BALB/c закупали в лаборатории Джексона (The JacksonPBS, либо 400 мкг человеческого гибридного белка BAFF-R-huIgG1 (hBAFF-R-Ig) (поставляемого Teresa Cachero, Biogen), либо 400 мкг очищенного человеческого(Sandoz, Basel, Switzerland) на дни -8, -5, -1 и +2. Мышам вводили 100 мкл 10% овечьих эритроцитов (SRBC) (Colorado Serum Company,Denver, CO) на день 0. После умерщвления кровь посредством сердечной пункции собирали в пробирки, содержащие EDT, и эритроциты подвергали лизису в гипотоническом буфере. Кровь также собирали без EDTA для получения сыворотки. Из селезенки и мезентериальных лимфоузлов(МЛУ) приготавливали суспензии из одиночных клеток, и эритроциты лизировали в гипотоническом буфере. Проточную цитометрию осуществляли с использованием РЕ-конъюгированного антитела против CD45R/B220, антитела против синдекана/СD138 и антитела против В 7.2 иFc Block (Pharmingen) в течение 15 мин на льду,а затем добавляли РЕ- и ФИТС-конъюгированные моноклональные антитела (mAb) и инкубировали на льду в течение 20-30 мин. Клетки промывали 1 х и суспендировали в 0,5% параформальдегиде. Данные клеточной флуоресценции определяли на проточном цитометреDickinson). После обработки hBAFF-R-Ig наблюдалось приблизительно 50% снижение числа В-клеток в периферической крови и в рассматриваемых периферических лимфоидных органах.B220highIgMlow-B-клетки, по оценкам, составляли 23,4% и 21,5% клеток в PBSобработанных и HuIgG-обработанных мышах,соответственно, тогда как эта популяция уhBAFF-R-Ig-обработанных мышей была представлена только 9,9%-ми клеток. Очевидно, что число клеток плазмы (синдекан/СD138+) слегка уменьшалось, составляя 5,7% и 4,8% в кровиPBS-обработанных и HuIgG-обработанных мышей, соответственно, тогда как у hBAFF-R-Igобработанных мышей оно составляло 3,9%. Молекула В 7.2 была активирована на 3,1% и 4,5% В 220+-клеток у PBS-обработанных и HuIgGобработанных мышей, соответственно, а уhBAFF-R-Ig-обработанных мышей она была активирована на 1,9% клеток. В селезенке число В 220high-В-клеток заметно снижалось у hBAFF-R-Ig-обработанных мышей и составляло 18,8%, тогда как у PBSобработанных и HuIgG-обработанных мышей оно составляло 36,7% и 40%, соответственно. Спад наблюдался у обеих IgMhigh и IgМlowсубпопуляций (см. табл. 8 А) . Каких-либо изменений в новообразованном В-клеточном компартменте в селезенке, B220lowIgMhigh, не наблюдалось (данные не приводятся). Число клеток плазмы (синдекан/СО 138+) слегка уменьшалось и составляло 3,3% и 3,4% в селезенкеhBAFF-R-Ig-обработанных мышей оно составляло 2,4%. В МЛУ наблюдалось снижение числа В 220+-В-клеток, которое составляло 14,1% уPBS-обработанных и HuIgG-обработанных мышей оно составляло 26,7% и 35,8%, соответственно. Данные систематизированы в табл. 8 А. Таблица 8 А. Популяция В-клеток y hBAFF-R-Ig-, PBS- иhBAFF-R-Ig 14,1 5,9 1 Мышей обрабатывали как описано в разделе "Материалы и методы", и данные приведены как процентстандартное отклонение Сниженный процент В 7.2+-В-клеток из числа клеток крови и плазмы в крови и селезенке hBAFF-R-Ig-обработанных мышей после иммунизации SRBC дает основание предположить,что имеет место ингибирование активации и/или созревания В-клеток, и потенциально повышенная элиминация активированных Вклеток. Очень небольшой процент антигенспецифических В-клеток должен быть активирован и они должны реагировать на любой антиген, в данном случае на SRBC. Поскольку hBAFF-RIg-обработка приводит к такому резкому снижению процента В-клеток во всех оцениваемых тканях, 50%, то очевидно, что активностьhBAFF-R-Ig также направлена на покоящиеся зрелые В-клетки. Поэтому предполагается, что слитый белокBAFF-R может быть использован в качестве терапевтического лекарственного средства для лечения В-клеточно-опосредованных заболеваний. Указанными заболеваниями являются аутоиммунные заболевания, такие как системная красная волчанка, тяжелая миастения, аутоим 004635 26 мунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, синдром антифосфолипидных антител, болезнь Шага, болезнь Грэйвса, гранулематоз Вегенера, узелковый полиартериит и быстро прогрессирующий гломерулонефрит. Данный терапевтический агент также используется для лечения расстройств,связанных с клетками плазмы, таких как множественная миелома, макроглобулинемия Вальденстрма, болезнь тяжелых цепей, первичный или иммуноцитоассоциированный амилоидоз и моноклональная гаммапатия неустановленной этиологии (МГНЭ). Онкологическими мишенями являются В-клеточные карциномы, лейкозы и лимфомы. Пример 9. Блокирование BAFF-индуцированной пролиферации В-клеток in vitro с использованием растворимого BAFF-R. В этом примере авторами изобретения было показано, что растворимый гибридный белокBAFF-R:hIgGl способен блокировать BAFFиндуцированную пролиферацию В-клеток в мышиных спленоцитах. Спленоциты мышей Balb/C (5 х 105 клеток/мл) выделяли и культивировали в 96 луночном планшете в 100 мкл RPMI (Life Technologies), в которую были добавлены 10% фетальная телячья сыворотка (JRH), 2 мМ глутамин, 100 единиц/мл пенициллина и 100 мг/мл стрептомицина (Life Technologies). Затем добавляли различные количества BAFF человека, 10 мкг/мл человеческого BAFF-R:hIgGl или человеческого Ig, а также 10 мкг/мл антимышиной поверхностной тяжелой -цепи (Jackson ImmunoResearch). После выдерживания в культуре в течение 48 ч при 37 С клетки подвергали импульсному мечению 1 мкКи/лунку [метил-3 Н]тимидина (Dupont NEN) в течение 24 ч и собирали с использованием коллектора клеток Tomtec (Orange, CT). Радиоактивность измеряли на жидком сцинтилляционном счетчике Betaplate(Pharmacia Biotech). На фиг. 8 показаны результаты анализа пролиферации спленоцитов. На этой фигуре показано число импульсов в минуту (имп./мин.),включенных в клетки спленоцитов мышей, в зависимости от количества добавленного реагента BAFF. Уровень антиантитела или слитого белка, либо контрольного hIgG поддерживался постоянным при 10 мкг/мл. Заштрихованные квадраты означают уровень пролиферации,индуцированный лишь BAFF. Заштрихованные кружки означают пролиферацию клеток с использованием BAFF и антиантитела. Кривая с незаштрихованными треугольниками означает ингибирование, наблюдаемое при добавленииBAFF-R:hIgGl. Незаштрихованный ромб означает ингибирование, наблюдаемое с использованием контрольного Ig человека. Добавление BAFF вместе с анти-антителом приводит к пролиферации спленоцитов мышей in vitro. Уровень 3 Н-тимидина,включенного в эти клетки, значительно превышает уровень, полученный при добавлении к спленоцитам либо только BAFF, либо только антиантитела. Обработка спленоцитов толькоBAFF приводит лишь к включению 3 Нтимидина в очень высоких концентрациях. Добавление только антиантитела не приводит к пролиферации. При добавлении к спленоцитам 10 мкг/мл контрольного человеческого Ig с увеличивающимися количествами BAFF и 10 мкг/мл антиантитела происходит умеренное снижение уровня пролиферации. В противоположность этому, в данном анализе при введении 10 мкг/мл человеческого гибридного белкаBAFF-R:hIgGl при тех же условиях, уровень пролиферации снижался до уровня, наблюдаемого в случае обработки лишь одним BAFF. Это указывает на то, что гибридный белок BAFFR:hIgGl обладает способностью к ингибированию пролиферации спленоцитов, индуцированных BAFF и антиантителом. Пример 10. Блокирование связыванияBAFF с Raji-клетками с использованием BAFFR:hIgGl. В этом примере описано предварительное инкубирование BAFF со слитым белком BAFFR:hIgGl, приводящее к снижению связыванияBAFF с В-клеточной линией лимфомы Raji. В этом FACS-анализе 200 нг/мл FLAGмеченного человеческого BAFF предварительно инкубировали либо с человеческим BAFFR:hIgGl, либо с человеческим LTR:hIgGl, при двукратных разведениях в пределах от 20 мкг/мл до 39 нг/мл, либо без слитого белка, в течение 30 мин на льду. Инкубирование проводили в FACS-буфере, содержащем PBS без Са 2+ или Мg2+ с добавлением 10% FCS (JRH) и 0,05%-ного азида натрия. После предварительного инкубирования смесь BAFF-слитый белок добавляли к 5 х 106 Raji-клеток(АТСС)/мл. Это инкубирование проводили в течение 30 мин на льду, а затем, клетки промывали 2 мл FACSбуфера при 4 С. Для детекции связанного BAFF к клеткам добавляли 5 мкг/мл антитела М 2 против FLAG (Sigma) и инкубировали в течение 30 мин на льду. Полученные клетки снова промывали, как описано выше, а затем инкубировали при разведении 1:100 с РЕ-конъюгированным ослиным антителом против мышиных Ig (Jackson Immuno Research) в течение 30 мин на льду. После повторной промывки FACS-буфером эти клетки фиксировали с использованием 1% параформальдегида и считывали на FACS (Becton DickinsonCo.). На фиг. 9 показаны результаты анализа на блокирование BAFF. На этой фигуре показаны данные считывания MFI (средней интенсивности флуоресценции), полученные в результате 28 проведения FАСS-анализа, указывающего на связывание BAFF с Raji-клетками. Заштрихованные квадраты соответстуют данным, полученным при предварительном инкубированииBAFF-R:hIgGl с BAFF перед связыванием с этими клетками. Кружки показывают кривую,полученную после добавления неспецифического слитого человеческого белка LTR:hIgGl кBAFF. На оси х представлено количество слитого белка, добавленного к 200 нг/мл BAFF перед инкубированием с клетками. Если слитый белок не был предварительно инкубирован с человеческим BAFF, то средняя интенсивность флуоресценции (MFI) образца составляла 80. Если человеческий LTR:hIgGl предварительно инкубировали с BAFF, даже при 20 мкг/мл, то детекция связывания BAFF с клетками Raji не изменялась. Однако если человеческий BAFF-R:hIgGl предварительно инкубировали с BAFF, то MFI значительно снижалась до 2-25 даже при 625 нг/мл слитого белка. Фоновое значение MFI в данном эксперименте составляло 7. Таким образом, BAFF-R:hIgGl является очень эффективным для блокирования связывания BAFF с клетками Raji. Пример 11. BAFF-R-IgG способствует ослаблению аутоиммунных расстройств типа красной волчанки у трансгенных мышей. В этом примере описано действие BAFF-R,направленное на снижение пула периферических В-клеток и ингибирование развития спленомегалии и нефрита. В данном эксперименте использовали пятимесячных трансгенных (Тg) BAFF-мышей(C57BL/6) и пометы соответствующего возраста. BAFF-Tg-мыши обнаруживали лимфатические расстройства и их аутоиммунный фенотип был аналогичен таковому при системной красной волчанке (Mackay et al., 1999). Этот фенотип соответствовал популяциям с повышенным числом периферических В-клеток, включая "переходные" клетки 1 (Т 1) и 2 (Т 2), зрелые клетки(М), клетки маргинальной зоны (MZ) и клеткиCD1high/ IgMhigh-B-клетки. Мышам внутрибрюшинно вводили PBS,400 мг очищенного человеческого IgG (hIg)(Sandoz, Basel, Switzerland)(3/группу) или 400 мкг слитого белка BAFF-R-huIgGl (hBCMAIg)(2/группу), происходящего из СНО, в дни 0,4, 7, 11, 14, 18, 21, 25, 28, 32, 35, а на 40-й день мышей умерщвляли. Сразу после умерщвления определяли вес селезенки, и после лизиса эритроцитов в гипотоническом буфере приготавливали суспензию из одиночных клеток. Проточную цитометрию осуществляли с использованием ФИТС-конъюгированного антитела против CD21/CD35, РЕконъюгированного антитела против IgD и против CD1, конъюгированного с цитохромом антитела против CD45R/B220 и конъюгированного с биотином антитела против IgM. Все mAbsFc Block (Pharmingen) в течение 10 мин на льду,затем добавляли биотин-конъюгированные mАb в течение 30 мин на льду, клетки промывали 1 х,а затем добавляли РЕ- и ФИТС-, цитохромконъюгированные mАb, стрептавидин-АРС и 10 мкг/мл Fc-Block. Эти клетки инкубировали на льду в течение 30 мин, клетки промывали 1 х и суспендировали в 0,5% параформальдегиде. Данные клеточной флуоресценции определяли на проточном цитометре FACS Calibur (Becton Dickinson, San Jose, CA) и анализировали с использованием программного обеспеченияCELLQuest (Becton Dickinson). Присутствие белков в мышиной моче измеряли с использованием полос реагентаMultistix 10 SG для анализов мочи (Bayer Corp.,Diagnostics Division). Результаты представлены ниже в табл. 11 А и 11 В. Таблица 11 А. Анализ спленоцитов 3-месячных мышей Всего клеток на селезенку (х 106) Т 1 Т 2(n=2) выделяли и подвергали FACS-анализу как описано в разделе "Материалы и методы". Клетки Т 1, Т 2, М и MZ определяли по экспрессии нижеследующих поверхностных маркеров (hi: высокий, lо: низкий, int: промежуточный):M: IgD+, IgM1o, CD21int Таблица 11 В. Анализ спленоцитов 10-месячных мышей Всего клеток на селезенку (х 106) Т 1 Т 2 10-месячных Baff-Tg-мышей (п=3) и пометы соответствующего возраста (п=3) подвергалиCD1high/IgMhigh-B-клеток в селезенке значительно снижались по сравнению с популяциями 30 клеток снижалось до уровня, аналогичного уровню клеток у PBS-обработанных контрольных пометов, или до меньшего уровня (фиг. 10 а,10b, 10c).BAFF-R-Ig-обработка Baff-Tg-мышей приводила к ослаблению Baff-опосредованного аутоиммунного заболевания, о чем свидетельствовало наблюдение того факта, что BAFF-Rобработанные мыши имели селезенку нормального размера, тогда как контрольные Baff-Tgмыши обнаруживали спленомегалию (фиг. 11). Кроме того, у BAFF-R-Ig-обработанных мышей подавлялось развитие протеинурии как показателя почечной дисфункции, тогда как у контрольных Baff-Tg-мышей развивался нефрит,как было определено по возрастающим уровням протеинурии (фиг. 12). Мыши, трансгенные по Baff, имели в значительной степени увеличенное число периферических В-клеток, и дополнительный анализ,проведенный авторами настоящего изобретения,выявил преимущественное увеличение субпополяций T1, T2, MZ В-клеток у этих мышей. Переходная стадия развития В-клеток (Т 1 и Т 2) представляет собой контрольную стадию, на которой предположительно происходит элиминация аутореактивных В-клеток. У Baff-Tgмышей было также значительно увеличено число CD1hi/IgMhigh-B-клеток, которые имеют тенденцию оставаться в маргинальной зоне. Было показано, что эта последняя популяция В-клеток представляет собой главный источник продуцирования аутоантител у NZB/NZW-мышей с волчанкой. BAFF-R-Ig-обработка Baff-Tg-мышей приводила к снижению популяций Tl, T2, М,MZ и CDlhi В-клеток до уровня, наблюдаемого в контрольных пометах дикого типа, или до меньшего уровня. Действие BAFF-R-Ig направлено на снижение пула периферических В-клеток и ингибирование развития спленомегалии и нефрита. Поэтому, помимо его эффективности в лечении системной красной волчанки и волчаночного нефрита, действие BAFF-R-Ig также является эффективным для лечения В-клеточно-опосредованных заболеваний, которые по своей природе являются аутоиммунными, такие как тяжелая миастения, аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, синдром антифосфолипидных антител,болезнь Шага, болезнь Грэйвса, гранулематоз Вегенера, узелковый полиартериит и быстро прогрессирующий гломерулонефрит. Данный терапевтический агент также используется для лечения расстройств, связанных с клетками плазмы, таких как множественная миелома,макроглобулинемия Вальденстрма, болезнь тяжелых цепей, первичный или иммуноцитоассоциированный амилоидоз и моноклональная гаммапатия неустановленной этиологии(МГНЭ). Онкологическими мишенями являются В-клеточные карциномы, лейкозы и лимфомы. 31 Пример 12. Среднее артериальное давление у трансгенных BAFF-мышей. В этом эксперименте описано измерение кровяного давления у трансгенных BAFFмышей. Наблюдения, сделанные во время оценки фенотипа трансгенных BAFF-мышей, указывали на вероятность гипертонии у этих мышей.Baff-Tg-мышей, описанных выше, анестезировали кетамином. Левую сонную артерию обнажали посредством надреза на шее. В эту сонную артерию вставляли катетер для измерения кровяного давления и частоты сердечных сокращений. Катетер подсоединяли к датчику давления, и кровяное давление измеряли с использованием системы сбора данных (Po-NeMah Data Acquisition system and Gouldpolygraph). Исходя из формы зубцов пульсового давления, систолического давления, диастолического давления определяли среднее давление и частоту сердечных сокращений. При этом использовали две группы мышей: трансгенныхBAFF-мышей (n=8) и контрольных мышей дикого типа (n=9). На фиг. 13 представлено среднее артериальное давление (MAP в мм рт.ст.) для двух групп. Как показано, трансгенные BAFF-мыши имели среднее MAP 1028 мм рт.ст. Контрольные мыши имели среднее MAP 926 мм рт.ст. Таким образом, у BAFF-мышей обнаруживалось увеличение MAP на 10 мм рт.ст. по сравнению с контролем, хотя это значение не является статистически значимым (ANOVA). Более подробный анализ этих данных представлен на фиг. 14. На этой фигуре представлены результаты анализов, полученных от отдельных животных. У контрольных мышей дикого типа (BAFF-) распределение данных соответствует типичному биномиальному распределению. В противоположность этому, давление у трансгенных BAFF-мышей (BAFF+) было таким, как если бы они были подразделены на две группы, где одна группа имела давление в диапазоне 120-130 мм рт.ст., а другая группа имела давление в диапазоне 80-90 мм рт.ст. Трансгенные BAFF-мыши как популяция имели тенденцию к гипертонии по сравнению с мышами негативного контроля. Анализ отдельных уровней артериального давления показал,что трансгенные BAFF-мыши разделялись на две субпопуляции, причем одна из них имела высокое кровяное давление, а другая имела нормальное кровяное давление. В соответствии с этим, введение растворимого BAFF-R, гибридного белка или гомолога антитела может ослаблять эффекты гипертонии. Пример 13. BAFF-R-Ig-обработка мышейSNF1 с установленным заболеванием замедляет прогрессирование болезни с развитием тяжелого нефрита. Самкам мышей со склонностью к волчанке(30-100 мг/дл протеинурии), вводили i.p. 200 мкг гибридного белка человеческого BAFF-RhuIgG (hBCMA-Ig), человеческого IgG (HuIgG)(Sandoz) или 200 мкл PBS еженедельно в течение 8 недель. Мочу каждой мыши еженедельно анализировали на протеинурию с использованием Albustix (Bayer Corp., Terrytown, NY). Протеинурия свыше 100 мг/мл оценивалась как тяжелый нефрит. BAFF-R-Ig был продуцирован во временно трансфицированных клетках EBNA 293. Кондиционированные среды от клеток 293,сверхэкспрессирующих hBCMA-Ig, загружали на колонку с белком А. Белок элюировали 25 мМ фосфатом, 100 мМ NaCl, pH 2,8, а затем нейтрализовали 1/20 объема 0,5 М NaPO4, pH 8,6. Фракции, отобранные, исходя из ОП 280,подвергали электрофорезу в восстанавливающем и невосстанавливающем ДСН-ПААГ и Вестерн-блоттингу для идентификации очищенного белка. Через три недели после обработки было установлено, что тяжелый нефрит обнаруживался у 50% мышей, обработанных BAFF-R-Ig,и у 75% и 87,5% мышей, которым вводилиBAFF, BCMA-Ig, может блокировать опосредованные В-клетками аутоиммунные заболевания,такие как волчаночный нефрит, что приводит к заметному ослаблению прогрессирования данного заболевания. Пример 14. BAFF-R-Ig-Обработка нормальных мышей, приводящая к снижению числа дендритных клеток селезенки (ДКС) и их атипической локализации в селезенке. 7-Недельным самкам мышей BALB/chBCMA-Ig очищали из супернатантов культуры стабильно трансфицированной клеточной линии СНО. Через 8 дней после последней инъекции выделяли селезенки и расщепляли коллагеназой(Sigma, cat. C-5138) в течение 1 ч при 37 С. Затем получали суспензию из одиночных клеток, эритроциты (RBC) лизировали в гипотоническом буфере, и клетки промывали 3 х в PBS. Спленоциты приготавливали для проточного цитометрического анализа путем окрашивания клеток биотинилированным антителом противCD8a и FITC-конъюгированным антителом против CD4 для оценки ДК-популяций. В отдельном эксперименте самкам мышейBALB/c (N=3) i.p. вводили 100 мкг hBCMA-Ig 1x/неделю в течение 4 недель, после чего селезенки мгновенно замораживали в ОСТ с использованием 2-метилбутана, охлажденного на СО 2. Криосрезы разрезали и фиксировали в ацетоне. Срезы инкубировали с биотинилированным ан 33 тителом против CD11c, затем со стрептавидином-АР и субстратом BCIP (Pierce) для визуализации ДК, а после этого с mAb MOMA-1, а затем с ПХ-конъюгированным антителом против крысиных IgG (Jackson ImmunoResearch) и субстратом 3,3'-диаминобензидина (Sigma, St.Louis МО, cat. D-1293) для визуализации металлофильных макрофагов, и с биотинилированным антителом против CD35, затем со стрептавидинАР и субстратом (набор субстрата щелочной фосфатазы I, Vector catSK-5100) для визуализации фолликулярных дендритных клеток(р 0,05 по т-критерию Стьюдента) в CD11c + ДК селезенки по сравнению с HuIgG- и PBSобработанными контролями. Это уменьшение было очевидным для всех оцениваемых CD11cCD8a-CD4+ (фиг. 16, табл. 14 А). Таблица 14 А. BAFF-R-Ig-обработка приводит к снижению числа ДК селезенки 20 мкг 50 мкг ВСМА-Ig ВСМА-Ig среднее число CD11 + DCs (х 106)SD 0,810,15 0,490,07 0,260,04 0,350,05 0,360,02 0,350,07 0,160,02 0,20,02 0,920,02 0,840,15 0,40,06 0,550,04 Это снижение числа ДК селезенки, которые являются критическими антигенпредставляющими клетками, может влиять на активацию В-клеток, их созревание и гуморальный иммунитет. Замороженные срезы мышиной селезенки получали, как описано в разделе "Материалы и Методы". BCMA-Ig-обработанные мыши обнаруживали атипический профиль ДК-хоминга при окрашивании антителом против CD11c. ДК обычно локализуются в Т-клеточной области белой пульпы селезенки и в маргинальной зоне,концентрируясь в канальцах, образующих сетчатую структуру маргинальной зоны. Однако ДК у BCMA-Ig-обработанных мышей были обнаружены по всему периметру маргинальной зоны, и существует некоторая вероятность того,что они затем могут мигрировать в белую пульпу селезенки (данные не показаны). Поэтому блокирование взаимодействия BAFF/BAFF-R с растворимым рецептором BAFF очевидно препятствует характеру хоминга ДК, что может повлиять на их способность функционировать в качестве антигенпредставляющих клеток, и, тем самым, повлиять на активацию В-клеток, их созревание и гуморальный иммунитет. Кроме того, в селезенках BCMA-Igобработанных мышей отсутствовали CD35+FDC, как было определено с помощью иммуногистохимического анализа (данные не показаны). Поскольку FDC осуществляет презентацию антигена В-клеткам в зародышевых центрах(ЗЦ), отсутствие таких клеток может оказывать 34 негативное влияние на структуру ЗЦ и аффинную зрелость В-клеток. Каждому специалисту очевидно, что в полипептидах, композициях и в способах настоящего изобретения могут быть сделаны различные модификации и изменения, не выходящие за рамки существа или объема настоящего изобретения. Таким образом, предполагается, что настоящее изобретение охватывает внесенные в него модификации и изменения, при условии,что они не выходят за рамки объема прилагаемой формулы изобретения и ее эквивалентов. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ ингибирования роста В-клеток у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 2. Способ ингибирования продукции иммуноглобулина у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 3. Способ ингибирования роста и созревания В-клеток, индуцированных дендритными клетками, у животного, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, включающей в себя полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 4. Способ лечения аутоиммунного заболевания, включающий в себя стадию введения терапевтически эффективного количества композиции, содержащей соединение, выбранное из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 5. Способ лечения гипертонии у животного, включающий в себя стадию введения терапевтически эффективного количества ингибитора роста В-клеток, выбранного из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 6. Способ лечения почечных заболеваний у животного, включающий в себя стадию введения терапевтически эффективного количества ингибитора роста В-клеток, выбранного из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 7. Способ лечения В-клеточных лимфопролиферативных заболеваний у животного,включающий в себя стадию введения терапевтически эффективного количества ингибитора роста В-клеток, выбранного из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(с) гомолога антитела против ВСМА. 8. Способ по пп.1-7, где указанный полипептид ВСМА является растворимым. 9. Способ по п.8, где растворимый полипептид ВСМА содержит внеклеточный домен ВСМА. 10. Способ по п.9, где указанный внеклеточный домен ВСМА слит с иммуноглобулином. 11. Способ по пп.1-7, где указанный полипептид ВСМА выбран из группы, состоящей изa) выделенного полипептида ВСМА с нативной последовательностью, содержащей аминокислотные остатки 1-184 последовательностиb) выделенного полипептида ВСМА,имеющего по меньшей мере 80%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида ВСМА, содержащей аминокислотные остатки 1184 последовательности SEQ ID NO:1, или его фрагмента;c) выделенного полипептида ВСМА,имеющего по меньшей мере 90%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида ВСМА, содержащей аминокислотные остатки 1184 последовательности SEQ ID NO:1, или его фрагмента;d) выделенного полипептида ВСМА, содержащего аминокислотные остатки 1-51 последовательности SEQ ID NO:1, или его фрагмента; иe) выделенного полипептида ВСМА, содержащего аминокислотные остатки 8-41 последовательности SEQ ID NO:1, или его фрагмента. 12. Способ по пп.1-7, где указанным гомологом антитела против ВСМА является моноклональное антитело. 13. Способ по пп.1-7, где указанный гомолог антитела против ВСМА содержит BCMAIgG. 14. Способ по пп.1-7, где указанным животным является млекопитающее. 15. Способ по п.14, где указанным млекопитающим является человек. 16. Способ нормализации, подавления или изменения иммунного ответа, участвующего в пути передачи сигнала между ВСМА и BAFF,где указанный способ включает в себя стадию введения эффективного количества композиции,выбранной из группы, состоящей из(a) полипептида ВСМА или его фрагмента;(b) химерной молекулы, содержащей полипептид ВСМА или его фрагмент, слитый с гетерологичной аминокислотной последовательностью; и(c) гомолога антитела против ВСМА. 17. Способ ингибирования воспаления,включающий в себя стадию введения терапевтически эффективного количества антитела против ВСМА или его активного фрагмента. 18. Способ ингибирования воспаления,включающий в себя стадию введения терапевтически эффективного количества антитела против ВСМА или его эпитопа. 19. Фармацевтическая композиция, содержащая терапевтически эффективное количество выделенного полипептида ВСМА или его фрагмента и фармацевтически приемлемый носитель. 39 20. Фармацевтическая композиция по п.19,где указанный выделенный полипептид ВСМА выбран из группы, состоящей изa) выделенной нативной последовательности полипептида ВСМА, содержащей аминокислотные остатки 1-184 последовательностиb) выделенного полипептида ВСМА,имеющего по меньшей мере 80%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида ВСМА, содержащего аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;c) выделенного полипептида ВСМА,имеющего по меньшей мере 90%-ную идентичность аминокислотной последовательности с нативной последовательностью полипептида ВСМА, содержащего аминокислотные остатки 1-184 последовательности SEQ ID NO:1, или его фрагмента;d) выделенного полипептида ВСМА, содержащего аминокислотные остатки 1-51 последовательности SEQ ID NO:1, или его фрагмента; иe) выделенного полипептида ВСМА, содержащего аминокислотные остатки 8-41 последовательности SEQ ID NO:1, или его фрагмента. 21. Фармацевтическая композиция по п.19,где указанный фрагмент полипептида ВСМА содержит внеклеточный домен ВСМА, слитый с иммуноглобулином.
МПК / Метки
МПК: A61K 38/17, C07K 14/715, C12N 15/12
Метки: bcma, агент, иммунорегуляторный, рецептор
Код ссылки
<a href="https://eas.patents.su/24-4635-receptor-baff-bcma-immunoregulyatornyjj-agent.html" rel="bookmark" title="База патентов Евразийского Союза">Рецептор baff (bcma), иммунорегуляторный агент</a>
Предыдущий патент: Лечение и диагностика рака
Следующий патент: Уплотнение для фасада и/или крыши
Случайный патент: Устройство для осуществления текущего контроля физиологических функций и состояний пользователя