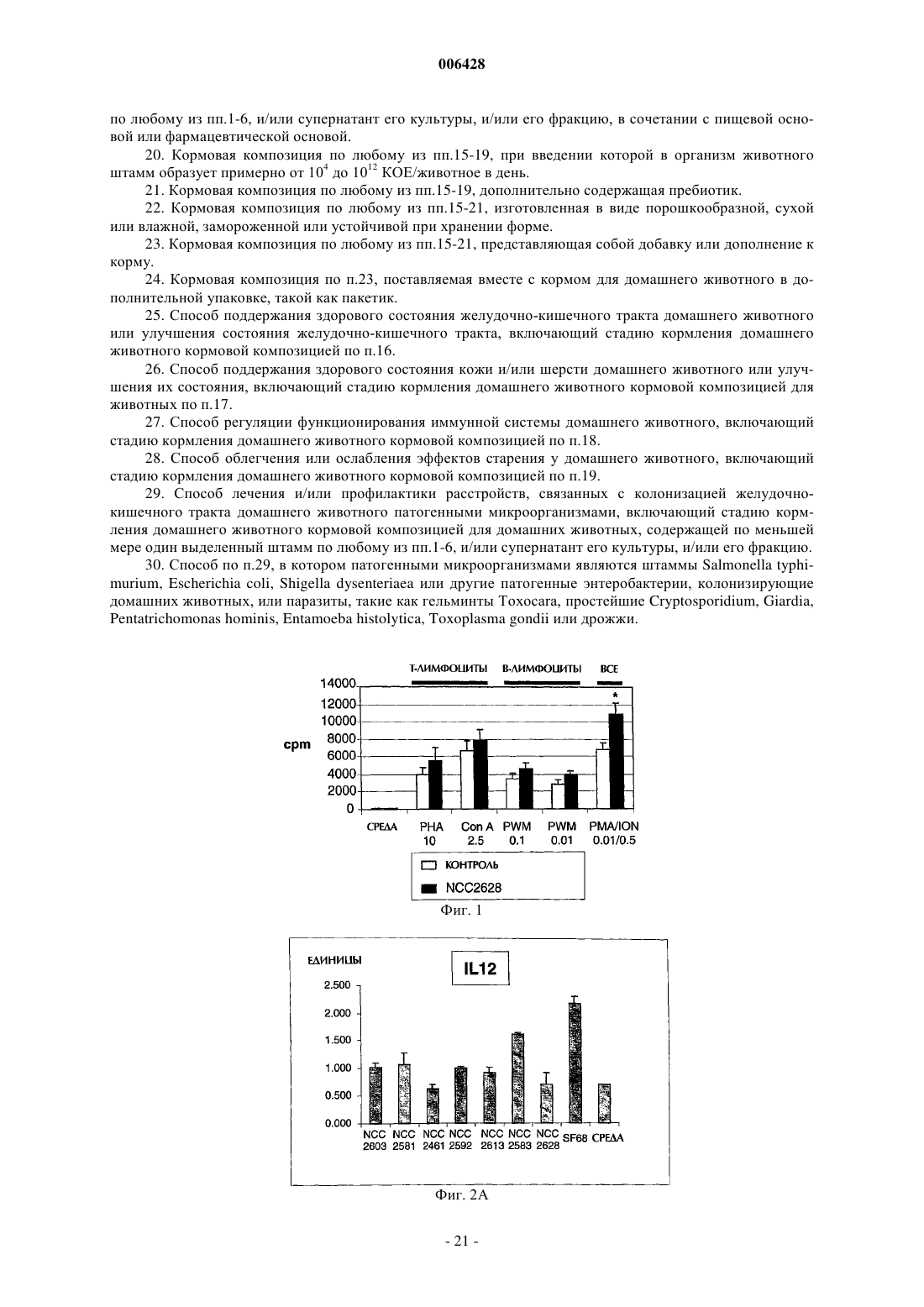
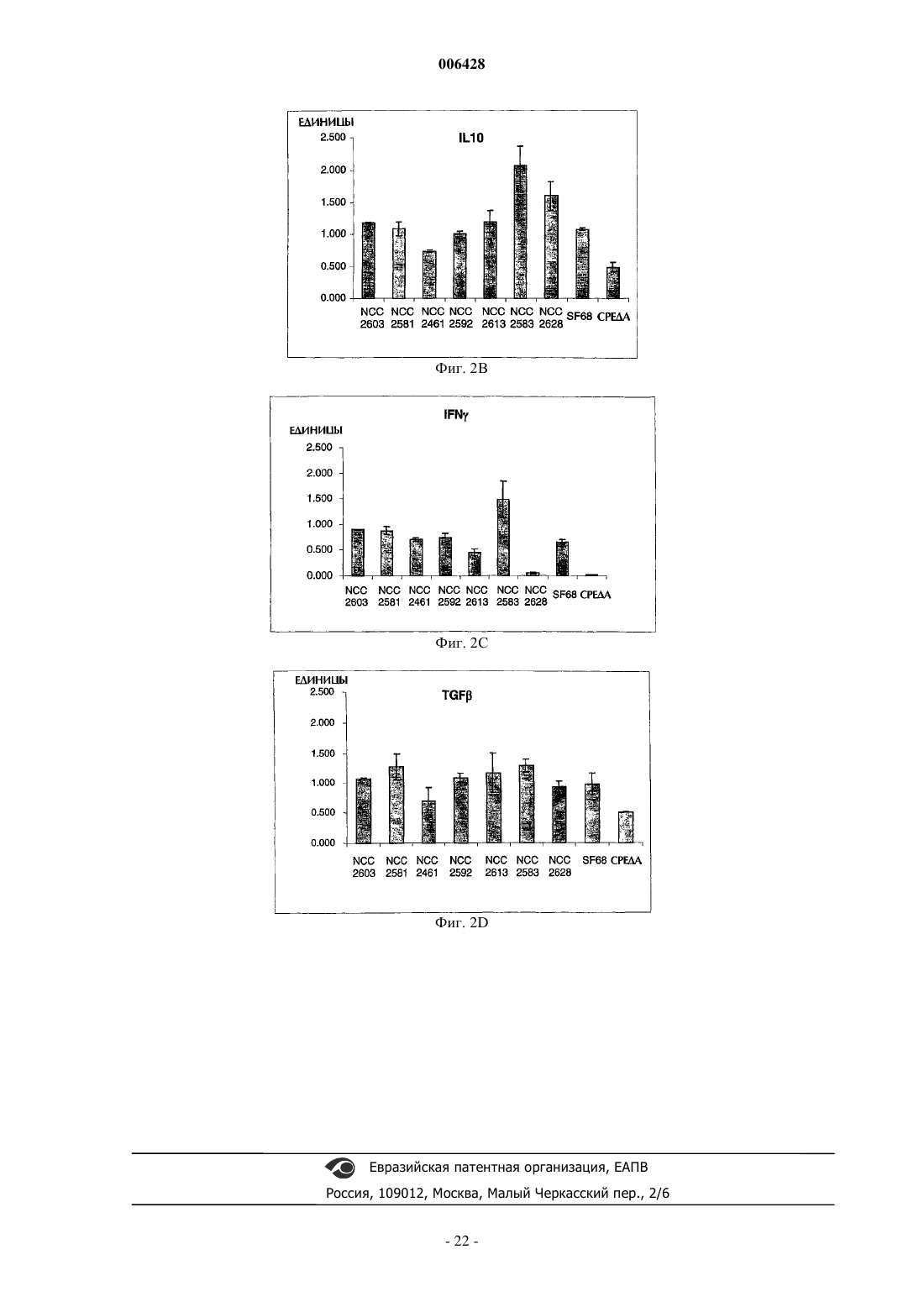
Штаммы молочно-кислых бактерий и их применение
Номер патента: 6428
Опубликовано: 29.12.2005
Авторы: Кавадини Кристоф, Беньяку Жалиль, Вон Дер Вейд Тьерри, Реньеро Роберто, Шиффрин Эдуардо, Руссо Виржини, Цинк Ральф, Роша Флоранс, Перес Пабло
Формула / Реферат
1. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2581 (CNCM 1-2448), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
2. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2592 (CNCM 1-2450), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
3. Выделенный штамм молочно-кислых бактерий Lactobacillus rhamnosus NCC 2583 (CNCM 1-2449), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
4. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2603 (CNCM 1-2451), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
5. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2613 (CNCM 1-2452), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
6. Выделенный штамм молочно-кислых бактерий Lactobacillus acidophilus NCC 2628 (CNCM 1-2453), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его.
7. Выделенный штамм по любому из пп.1-6, обладающий способностью к росту с продуцированием по меньшей мере 106 КОЕ/мл в присутствии до 2% солей жёлчных кислот.
8. Выделенный штамм по любому из пп.1-7, обладающий способностью продуцировать по меньшей мере 106 КОЕ/мл в течение примерно 2 ч при pH примерно от 3,4 до 4,2.
9. Применение выделенного штамма молочно-кислых бактерий по любому из пп.1-6, и/или супернатанта его культуры, и/или его фракции для получения композиции, предназначенной для поддержания или улучшения здоровья домашнего животного.
10. Применение по п.9, согласно которому при введении указанной композиции в организм животного штамм образует примерно от 104 до 1012 КОЕ/животное в день.
11. Применение по любому из пп.9 и 10 для получения композиции, предназначенной для лечения и/или профилактики расстройств, связанных с колонизацией желудочно-кишечного тракта домашнего животного патогенными микроорганизмами.
12. Применение по любому из пп.9-11 для получения композиции, предназначенной для регуляции функционирования иммунной системы домашнего животного.
13. Применение по любому из пп.9-11 для получения композиции, предназначенной для поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния.
14. Применение по любому из пп.9-11 для получения композиции, предназначенной для облегчения или ослабления эффектов старения у домашнего животного.
15. Кормовая композиция для домашних животных, содержащая по меньшей мере один выделенный штамм молочно-кислых бактерий по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой.
16. Кормовая композиция для домашних животных, предназначенная для подержания здорового состояния желудочно-кишечного тракта домашнего животного или улучшения состояния желудочно-кишечного тракта, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой.
17. Кормовая композиция для домашних животных, предназначенная для поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой.
18. Кормовая композиция для домашних животных, предназначенная для регуляции функционирования иммунной системы домашнего животного, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой.
19. Кормовая композиция для домашних животных, предназначенная для облегчения или ослабления эффектов старения у домашнего животного, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой.
20. Кормовая композиция по любому из пп.15-19, при введении которой в организм животного штамм образует примерно от 104 до 1012 КОЕ/животное в день.
21. Кормовая композиция по любому из пп.15-19, дополнительно содержащая пребиотик.
22. Кормовая композиция по любому из пп.15-21, изготовленная в виде порошкообразной, сухой или влажной, замороженной или устойчивой при хранении форме.
23. Кормовая композиция по любому из пп.15-21, представляющая собой добавку или дополнение к корму.
24. Кормовая композиция по п.23, поставляемая вместе с кормом для домашнего животного в дополнительной упаковке, такой как пакетик.
25. Способ поддержания здорового состояния желудочно-кишечного тракта домашнего животного или улучшения состояния желудочно-кишечного тракта, включающий стадию кормления домашнего животного кормовой композицией по п.16.
26. Способ поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния, включающий стадию кормления домашнего животного кормовой композицией для животных по п.17.
27. Способ регуляции функционирования иммунной системы домашнего животного, включающий стадию кормления домашнего животного кормовой композицией по п.18.
28. Способ облегчения или ослабления эффектов старения у домашнего животного, включающий стадию кормления домашнего животного кормовой композицией по п.19.
29. Способ лечения и/или профилактики расстройств, связанных с колонизацией желудочно-кишечного тракта домашнего животного патогенными микроорганизмами, включающий стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию.
30. Способ по п.29, в котором патогенными микроорганизмами являются штаммы Salmonella typhimurium, Escherichia coli, Shigella dysenteriaea или другие патогенные энтеробактерии, колонизирующие домашних животных, или паразиты, такие как гельминты Toxocara, простейшие Cryptosporidium, Giardia, Pentatrichomonas hominis, Entamoeba histolytica, Toxoplasma gondii или дрожжи.
Текст
006428 Область техники, к которой относится изобретение Настоящее изобретение относится к области биотехнологии и, в частности, к новым молочно-кислым бактериям и, в частности, к микроорганизмам родов Lactobacillus, Bifidobacterium и Streptococcus(Enterococcus), выделенных и отобранных за их пробиотический потенциал. Настоящее изобретение также относится к их применению при получении композиций корма для домашних животных, предназначенных для улучшения здоровья домашних животных, и к композициям, содержащим такие микроорганизмы. Также описываются способы поддержания или улучшения здоровья домашних животных путем кормления их кормом, содержащим такие микроорганизмы. Уровень техники Хорошее состояние домашних животных тесно связано с их питанием. Правильное кормление должно привести к соответствующим и здоровым домашним животным. Кроме питательной ценности,состав корма влияет на равновесие кишечной микрофлоры и может привести к желудочно-кишечным расстройствам или предотвратить их. Поэтому знания о желудочно-кишечном тракте и процессе переваривания пищи у здоровых животных существенно для понимания практики кормления. Например, плотоядные животные, такие как кошки и собаки, отличаются коротким пищеварительным трактом и высокой скоростью прохождения комков корма. Из составных частей желудочно-кишечной микрофлоры кошек и собак можно выделить вид Bacteroides, вид Clostridium, Enterobacteriaceae, вид Bifidobacterium, вид Lactobacillus, вид Streptococcus, видStaphylococcus и дрожжи. Количество и состав такой эндогенной флоры имеет склонность скорее к стабильности, хотя возраст и, в меньшей степени, питание могут изменить ее. Кислотность желудочного сока, жлчь, перистальтика кишечника и местный иммунитет являются факторами, считающимися важными при регуляции бактериальной флоры в тонкой кишке человека и других млекопитающих. Часто желудочно-кишечные расстройства у кошек и собак связывают с избыточным ростом бактерий и образованием эндотоксинов, продуцируемых патогенными бактериями. На протяжении последних нескольких лет исследования сосредоточены на некоторых важных штаммах молочнокислых бактерий и их возможном применении в качестве пробиотических средств. Пробиотики считаются жизнеспособными микробными препаратами, улучшающими здоровье млекопитающих путем поддержания в кишечнике естественной микрофлоры. Предполагается, что пробиотики закрепляются на слизистой оболочке кишечника, колонизируют кишечный тракт и посредством этого предотвращают закрепление в нем вредных микроорганизмов. Предпосылкой такого действия является то, что они достигают слизистой оболочки кишок в надлежащей и жизнеспособной форме и, в особенности, не разрушаются под влиянием низкого рН, превалирующего в желудке. В частности, физиология пищеварительного тракта кошек и собак отличается от физиологии пищеварительного тракта человека. Например, средний рН в желудке составляет примерно 3,4 у собак и 4,2 у кошек. Хотя в US 5968569 описывается включение пробиотического микроорганизма в корм домашних животных на основе злаков, ни в данной работе, ни в других доступных работах нет сведений, касающихся конкретных штаммов, позитивно влияющих на здоровье животных. Следовательно, существует потребность в новых бактериальных штаммах, в частности, адаптированных для домашних животных, и выбираемых за их высокие пробиотические свойства, благоприятные для здоровья домашних животных, и во включении указанных штаммов в состав корма. Сущность изобретения Согласно своему первому аспекту изобретение относится к новому пробиотическому микроорганизму из молочнокислых бактерий, выбранному за его способность выживать и колонизировать желудочно-кишечный тракт домашних животных и проявлять благоприятную пробиотическую активность в отношении здоровья домашних животных. Пробиотический штамм можно выбрать из числа лактобацилл, бифидобактерий и энтерококков. Пробиотический штамм можно выбрать из группы, состоящей из Lactobacillus reuteri, Lactobacillusfaecium и вида Enterococcus. В предпочтительном варианте воплощения изобретения пробиотический штамм выбирают из группы, состоящей из Lactobacillus reuteri (NCC2581; CNCM I-2448), Lactobacillus reuteri (NCC2592; CNCM I2450), Lactobacillus rhamnosus (NCC2583; CNCM I-2449), Lactobacillus reuteri (NCC2603; CNCM I-2451),Lactobacillus reuteri (NCC2613; CNCM I-2452), Lactobacillus acidophilus (NCC2628; CNCM I-2453), Bifidobacterium adolescentis (например, NCC2627), вида Bifidobacterium NCC2657 или Enterococcus faeciumSF68 (NCIMB 10415). Новый бактериальный штамм можно использовать в количестве примерно от 104 до 1012 КОЕ/животное в день, и предпочтительно примерно от 105 до 1011 КОЕ/животное в день, наиболее предпочтительно примерно от 107 до 1010 КОЕ/животное в день. В одном своем варианте изобретение относится к применению бактериального штамма, описанного выше, и/или супернатанта его культуры, и/или его фракции для получения композиции, предназначенной-1 006428 для лечения и/или профилактики расстройств, связанных с колонизацией желудочно-кишечного тракта домашних животных патогенными микроорганизмами. Если в контексте нет ясных иных указаний, при упоминании "штамма" следует иметь в виду и супернатант его культуры и/или его фракции. В другом варианте изобретение относится к применению бактериального штамма, описанного выше, и/или супернатанта его культуры и/или его фракции для получения композиции, предназначенной для регуляции иммунной реакции домашних животных. Термин "регуляция" иммунной реакции означает, что бактериальные штаммы, описанные выше, и/или супернатанты их культур и/или их фракции обладают способностью или стимулировать некоторые иммунные функции, важные для здоровья домашнего животного, или модулировать другие иммунные функции, которые потенциально могут вовлекаться в иммунные расстройства, такие как воспаление, аллергия и т.п. Стимуляции или модуляции таких иммунных функций можно достичь, используя различные сочетания бактериальных штаммов, описанных выше, и/или супернатантов их культур и/или их фракций. Изобретение также относится к способу поддержания или улучшения здоровья желудочнокишечного тракта, кожи, и/или шерсти, или иммунной системы домашнего животного, включающему стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм, описанный выше. Кроме того, изобретение относится к способу лечения и/или профилактики расстройств, связанных с колонизацией желудочно-кишечного тракта домашних животных патогенными микроорганизмами,включающему стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм по настоящему изобретению. Изобретение также относится к способу регуляции иммунной реакции у домашних животных,включающему стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм по настоящему изобретению. Изобретение также относится к способу облегчения или ослабления действия возраста на домашнее животное, включающему стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм по настоящему изобретению. Указанные выбранные микроорганизмы оказывают на домашних животных особое благоприятное действие в желудочно-кишечном тракте, на их кожу и/или шерсть, на их иммунную систему и на эффекты старения. Они обладают особенно благоприятным влиянием на кишечные патогенные микроорганизмы, такие как штаммы Salmonella typhimurium, Escherichia coli, Shigella dysenteriaea, или другие патогенные энтеробактерии, колонизирующие желудочно-кишечный тракт домашних животных, или на паразитов, таких как гельминты (вид Тохосаrа), простейшие (вид Cryptosporidium, вид Giardia, Pentatrichomonas hominis,Entamoeba histolytica, Toxoplasma gondii) или дрожжи. В сочетании с кормом такие микроорганизмы, в частности, проявляют свое пробиотическое благоприятное действие на поедаемость, переваривание и здоровье кишечника, иммунную функцию и санитарное состояние, причем на последнее - путем снижения объема фекалий и по меньшей мере частичного дезодорирования фекалий собак. Таким образом, согласно второму варианту изобретения, кормовая композиция для домашних животных содержит микроорганизмы, обладающие пробиотической активностью в отношении домашних животных и способных выживать и колонизировать желудочно-кишечный тракт домашнего животного, поедающего ее. Соответственно, изобретение относится к кормовой композиции для домашних животных, предназначенной для здорового состояния желудочно-кишечного тракта домашних животных, содержащей по меньшей мере один выделенный пробиотический штамм, описанный выше, и/или супернатант его культуры и/или его фракции, связанный с пищевым носителем или фармацевтической основой. Изобретение также относится к кормовой композиции для домашних животных, предназначенной для регуляции иммунной реакции домашних животных, содержащей по меньшей мере один выделенный пробиотический штамм, описанный выше, и/или супернатант его культуры и/или его фракции, связанный с пищевым носителем или фармацевтической основой. Изобретение также относится к кормовой композиции для домашних животных, предназначенной для ослабления или уменьшения влияния возраста на домашних животных, содержащей по меньшей мере один выделенный пробиотический штамм, описанный выше, и/или супернатант его культуры и/или его фракции, связанный с пищевым носителем или фармацевтической основой. Наконец, изобретение относится к кормовой композиции для домашних животных, предназначенной для здорового состояния кожи и/или шерстяного покрова домашних животных, содержащей по меньшей мере один выделенный пробиотический штамм, описанный выше, и/или супернатант его культуры и/или его фракции, связанный с пищевым носителем или фармацевтической основой. В одном из вариантов воплощения изобретения пищевой носитель содержит сбалансированную по питательным элементам кормовую композицию для домашних животных. Указанная композиция содержит предпочтительно количество выделенного штамма, супернатанта его культуры и/или его фракции,достаточное для эффективного обеспечения указанного профилактического действия, когда композицию скармливают домашнему животному в виде готовой муки.-2 006428 Далее в описании аббревиатура "КОЕ" ("колониеобразующая единица") обозначает число бактериальных клеток, полученное путем определения количества микроорганизмов на агровых пластинках. Кроме того, "NCC" обозначает Коллекцию культур Nestle (Nestle Research Center, Vers-chez-lesBlanc, Лозанна, Швейцария). Что касается первой цели настоящего изобретения, авторы скринировали и отобрали, с учетом их физиологических и технологических свойств, 20 лактобацилл и 18 бифидобактерий, выделенных из фекалий кошек и собак. Первый скрининг на возможные пробиотические применения проводили in vitro (см. примеры 1 и 2), определяли характеристики роста, толерантность к кислотности желудочного сока при различных рН и различных концентрациях жлчных солей, присутствующих в двенадцатиперстной кишке, подобных обнаруживаемым у кошек и собак. Кроме того, ясно показана хорошая выживаемость лиофилизованных клеток в двух различных криозащитных средах при 4 и 20 С, что определялось с помощью ускоренного испытания на хранение. Указанные штаммы можно охарактеризовать коротким временем генерации, высоким числом микроорганизмов (свыше 108 КОЕ/мл) во время их стационарной фазы и стабильностью с высоким числом через 8 и 24 ч после инокуляции, устойчивостью к лиофилизации с последующим хранением в любых условиях, устойчивостью к физиологическим концентрациям жлчи, обнаруженным в двенадцатиперстной кишке (2% жлчи) и их слабым угнетением при выращивании в присутствии до 4% жлчи. Кроме того, при выборе бактерий, характерных для исследуемой разновидности, учитывались результаты анализа ДНК. Штаммы, предназначенные для улучшения здоровья кошек и собак, можно вырастить по меньшей мере до 106 КОЕ/мл в присутствии до 2% солей жлчных кислот. Штаммы также можно вырастить по меньшей мере до 106 КОЕ/мл через 2 ч в интервале рН от примерно 3,4 до примерно 4,2. Бактериальные штаммы согласно изобретению можно выбрать из группы, состоящей из Lactobacillus reuteri, Lactobacillus acidophilus, Lactobacillus animalis, Lactobacillus ruminis, Lactobacillus johnsonii,Lactobacillus casei, Lactobacillus paracasei, Lactobacillus rhamnosus, Lactobacillus fermentum, вида Bifidobacterium, Enterococcus faecium, вида Enterococcus. Следующие штаммы, а именно, Lactobacillus reuteri NCC2581, Lactobacillus rhamnosus NCC2583,Lactobacillus reuteri NCC2592, Lactobacillus reuteri NCC2603, Lactobacillus reuteri NCC2613 и Lactobacillusacidophilus NCC2628, депонированы, например, по Будапештскому договору, в Национальной коллекции культур микроорганизмов, 25 rue du doctor Roux, 7524 Paris, France, 19 апреля 2000, под обозначениямиCNCM I-2448, CNCM I-2449, CNCM I-2450, CNCM I-2451, CNCM I-2452 и CNCM I-2453, соответственно. Все ограничения, такие как доступность указанных депозитов, будут сняты после первой публикации данной заявки или другой заявки, утверждающей преимущество приоритета данной заявки. Биохимические характеристики выбранных штаммов- Сбраживание сахаров D-глюкозы, лактозы, сахарозы, D-рафинозы. Три лактобациллы, полученные от кошек (NCC2581, NCC2592, NCC2583), три лактобациллы от собак (NCC2603, NCC2613, NCC2628), одна бифидобактерия от кошек (NCC2627) и одна бифидобактерия от собак (NCC2657) испытывались далее на их возможную пробиотическую активность в организме домашних животных (см. примеры 3 и 4). В другом варианте своего воплощения настоящее изобретение относится к применению бактериальных штаммов, описанных выше, для получения кормовой композиции, способной улучшать или поддерживать здоровье домашних животных. Их можно применять в их жизнеспособной форме, инактивированной форме, в виде супернатанта культуры или их фракций, например, клеточных стенок, пептидогликана, цитоплазмы, очищенных белков, функциональных фракций, биологически активных молекул. Их предпочтительно применять в количестве примерно от 104 до 1011 КОЕ/г и предпочтительно примерно от 105 до 1010 КОЕ/г, наиболее предпочтительно примерно от 106 до 109 КОЕ/г. В предпочтительном варианте их можно применять как пищевые добавки с тем, чтобы улучшить качество корма для домашних животных, и их можно включать в количестве примерно от 104 до 1011 КОЕ/г. В качестве пищевых добавок их можно инкапсулировать или можно получить в форме порошка и упаковать в сочетании или отдельно от основной муки во влажном или сухом состоянии. Например, порошок, содержащий выбранные микроорганизмы по изобретению, или компоненты, или частицы супернатанта их культур, или выбранные фракции можно упаковать в пакетики в форме порошка, или в гель,или в жидкость, или в другой подходящий носитель. Такие отдельно упакованные единицы можно предоставить вместе с основной мукой или в виде упаковок с несколькими единицами для применения с основной мукой или обработкой согласно инструкциям изготовителя. В другом примере пробиотический(ие) штамм(ы) можно предоставить в виде многокамерной упаковки вместе со вторым поедаемым компонентом, например влажной или со средним содержанием влаги крупной крупкой или партией муки грубого помола, в эластичном мешке. Первая камера в мешке может содержать пробиотический штамм,а вторая отдельная герметично закрытая камера - второй поедаемый компонент. Указанные выбранные микроорганизмы оказывают особое благоприятное действие на домашних животных в желудочно-кишечном тракте, на их кожу и/или шерсть, на их иммунную систему, на состояние здоровья зубов или ротовой полости, на их кости и на эффекты старения. Также обнаружено, что они улучшают поедаемость корма, переваривание, иммунную функцию и санитарное состояние (снижение объема фекалий и частичное дезодорирование фекалий собак) у домашних животных. Настоящее изобретение также относится к кормовой композиции для домашних животных для улучшения или поддержания здоровья животных, содержащей по меньшей мере один пробиотический штамм, обладающий вышеуказанными признаками, в сочетании с пищевым носителем или фармацевтической основой.-4 006428 По меньшей мере один бактериальный штамм, обладающий вышеуказанными признаками, и/или супернатант его культуры, и/или его фракцию, и/или его фракции можно давать домашнему животному в качестве добавки к его обычному рациону или в качестве компонента полного корма для домашних животных, содержащего необходимые питательные вещества. Композиция полного содержащего необходимые питательные вещества корма для домашних животных по изобретению может находиться в форме сухого порошка или в виде влажного замороженного или устойчивого при хранении продукта. Такие корма для домашних животных можно получить способами, известными в технике, при условии, что когда требуется активность микроорганизма, предпринимаются меры, обеспечивающие выживание микроорганизма. Кроме штаммов бактерий и/или их ферментационной среды такие корма для домашних животных могут содержать любой один или несколько источников крахмала, белка и липидов. Подходящими источниками крахмала являются, например, зерна и бобы, такие как кукуруза, рис,пшеница, ячмень, овес, соя, и их смеси. Подходящие источники белка можно выбрать из числа любых источников животных или растительных белков, например мяса и мясной муки, муки из мяса птицы, рыбной муки, соевых белковых концентратов, молочных белков, глютена и т.п. Для более старых животных предпочтителен источник белка, содержащий высококачественный белок. Подходящими источниками липидов являются различные виды мяса, животные жиры и растительные жиры. Выбор источников крахмала, белка и липидов будет в значительной степени определяться потребностями животного в питательных веществах, соображениями поедаемости и типом применяемого продукта. Корм для более старых домашних животных предпочтительно содержит пропорционально меньше жиров, чем корма для более молодых домашних животных. Кроме того, источники крахмала могут включать один или несколько компонентов из числа риса, ячменя, пшеницы и кукурузы. Кроме того, в корм для домашних животных при желании можно включать различные другие ингредиенты, например сахар, соль, пряности, приправы, витамины, минеральные вещества, ароматизаторы, жиры и т.п. В случае сухих кормов для домашних животных подходящим способом (их получения) является пропаривание с экструзией, хотя можно использовать сушку и другие подходящие способы. При пропаривании с экструзией сухой корм, как правило, получают в форме муки грубого помола. Если используют пребиотический углевод, пребиотик можно смешивать с другими ингредиентами сухого корма до переработки. Подходящий способ описывается в заявке на европейский патент ЕР 0850569, включенной в данное описание в качестве ссылки. Если используют пробиотический микроорганизм, и желательна его активность в конечном продукте, организм лучше всего нанести на или подмешать в сухой корм для домашних животных. Подходящий способ описывается в заявке на европейский патент ЕР 0862863,включенной в данное описание в качестве ссылки. Когда выживание микроорганизма не требуется, его можно добавлять в смесь для экструзии, так же как, при желании, и супернатант его культуры или фракции. В случае влажных кормов для получения продуктов, имитирующих мясо, можно использовать способы, описанные в патентах US 4781939 и US 5132137. Оба патента включены в данное описание в качестве ссылок. Также можно использовать другие процедуры для получения продуктов типа кусков, например варку в паровой печи. С другой стороны, продукты в виде кусков можно получить, эмульгируя подходящий мясной материал для получения мясной эмульсии, добавляя подходящее желирующее вещество и нагревая мясную эмульсию перед заполнением ею консервных банок или других емкостей. Как и в случае получения сухих кормов, когда выживание выбранного вида пробиотика не является существенным, его можно добавлять в кормовую смесь перед варкой или нагреванием или на любой подходящей и удобной стадии способа получения. Количество пробиотика в корме для домашних животных составляет предпочтительно менее примерно 20 мас.% и предпочтительнее менее примерно 10 мас.%. Например, пребиотик может составлять от примерно 0,1 мас.% до примерно 5 мас.% корма для домашних животных. В случае кормов, в которых в качестве пребиотика используют цикорий, цикорий можно включать в таком количестве, чтобы он составлял от примерно 0,5 мас.% до примерно 10 мас.% кормовой смеси, предпочтительнее от примерно 1 мас.% до примерно 5 мас.%. Корма для домашних животных могут содержать другие активные вещества, такие как длинноцепные жирные кислоты. Подходящими длинноцепными жирными кислотами являются альфа-линолевая кислота, гамма-линолевая кислота, линолевая кислота, эйкозапентановая кислота и докозагексановая кислота. Жиры рыб являются подходящим источником эйкозапентановой кислоты и докозагексановой кислоты. Масло бурачника, масло из семян черной смородины и энотеровое масло являются подходящими источниками гамма-линолевой кислоты. Сафлоровое масло, подсолнечное масло, кукурузное масло и соевое масло являются подходящими источниками линолевой кислоты. При необходимости в корма для домашних животных добавляют минеральные вещества и витамины, с тем чтобы корма стали кормами с полным набором питательных веществ.-5 006428 Кроме того, при желании бактериальный штамм можно инкапсулировать, например, в сахарную матрицу, жировую матрицу или полисахаридную матрицу. На него также можно нанести покрытие, как описывается в ЕР 862863. Новый пробиотический штамм используют предпочтительно таким образом, что корм для домашних животных содержит предпочтительно примерно от 104 до 1010 клеток пробиотического микроорганизма на грамм корма для домашних животных, предпочтительнее примерно от 106 до 108 клеток пробиотического микроорганизма на грамм. Корм для домашних животных может содержать примерно от 0,005 до 10 мас.% пробиотического микроорганизма от массы смеси. Его содержание составляет, предпочтительно примерно от 0,02 до 6 мас.% и наиболее предпочтительно примерно от 1 до 6 мас.%. Количество корма, потребляемое домашним животным для получения благоприятного эффекта, будет зависеть от размера домашнего животного, вида домашнего животного и возраста домашнего животного. Однако количество корма для домашнего животного, как правило, должно быть адекватным для обеспечения ежесуточного количества по меньшей мере одного штамма молочно-кислых бактерий в примерно 103 - 1014 КОЕ и/или эквивалентного количества сбраживаемой среды. Предпочтительно назначают в день примерно 109-1011 КОЕ собакам или 107-1010 КОЕ кошкам. Композиция по настоящему изобретению обладает высокой пробиотической активностью, и/или обнаружено, что она особенно эффективна для улучшения и/или поддержания здоровой пищеварительной функции у домашних животных и улучшения и поддержания в здоровом состоянии желудочнокишечного тракта, кожи, и/или шерсти, и/или иммунной системы домашних животных. Такая композиция также оказывает благоприятное воздействие на явления старения у кошек и собак. Настоящее изобретение не ограничивается по объему конкретными вариантами его воплощения,описанными в данном описании. Примерам предшествует краткое описание фигур. Перечень фигур Фиг. 1. Пролиферация мононуклеарных клеток периферической крови собак (РВМС) после стимуляции митогенами или эфирами форбола. РВМС от взрослых собак, которых в течение 4 недель кормили с L. acidophilus NCC2628 (темные столбики) или без него (светлые столбики), стимулируют различными митогенами в дозах (мкг/мл), указанных на диаграмме. Митогенами являются РНА (фитогемаглютин),СоnА (канканавалин А), PWM (митоген Поквида), и эфир форбола представляет собой РМА/ионо (миристат-ацетат форбола и иономицин).= Р 0,05, критерий Стъюдента. Фиг. 2. Цитокины, продуцированные лейкоцитами собаки, стимулированными различными штаммами пробиотиков. Лейкоциты от здоровых взрослых собак стимулируют в течение 18 ч различными штаммами лактобацилл, полученными от домашних животных. Контрольные культуры содержат только среду (отрицательный контроль) или изолят лактобацилл человека ST11 (положительный контроль). Идентификацию цитокинов осуществляют методом RT-PCR. Их количественное определение осуществляют путем сканирования агарозных гелей, окрашенных этидиум бромидом, и определения соответственных отображений каждой полосы с использованием программного обеспечения NIH Image. Результаты выражают в виде среднего двух независимых экспериментов в произвольных единицах. (A) IL-12, (В)IL-10, (С) IFN, (D) TGF. Сведения, подтверждающие возможность осуществления изобретения Пример 1. Штаммы и условия культивирования. Ряд штаммов (из коллекции культур Nestle = NCC) скринируют на их возможное пробиотическое применение для кошек и собак. В частности, оценивают возможности роста, устойчивость при лиофилизации с последующим хранением, толерантность к кислотности в желудке и различным концентрациям солей жлчных кислот, обнаруженным в желудочно-кишечном тракте кошек и собак, для 20 лактобацилл и 18 бифидобактерий, выделенных из фекалий кошек и собак и представленных в табл.1. Таблица 1. Коды и характеристики бактерий, выбранных для анализов Все 20 лактобацилл и 18 бифидобактерий получают от кошек и собак, которых держат на разном питании, как показано в табл.1. Начальную идентификацию проводят по морфологическим и физиологическим характеристикам. Используют системы API-50CH и Rapid-ID32A (BioMerieux) для лактобацилл и бифидобактерий, соответственно. Чистые штаммы замораживают и депонируют при -80 С в Коллекции культур, Nestic (NCC). Все бактерии для анализов культивируют в питательной среде. Образец каждого реактивированного штамма хранят при -80 С в 1 мл криозащитной среды (40% глицерина + 60% LL). Культуры поддерживают путем еженедельного субкультивирования 1% инокулума в 10 мл среды для выращивания и анаэробной инкубации при 37 С. Лактобациллы выращивают в MRS в течение 18 ч. Бифидобактерии выращивают или в MRS с добавлением 0,05% (мас./об.) гидрохлорида L-цистеина (MRS-C) в течение 32 ч или в BHI с добавлением 0,05% (мас./об.) гидрохлорида L-цистеина (BHI-C) в течение 48 ч, исходя из 5% инокулума. Все культуры между переносами хранят при +4 С. Анаэробиоз получают, как правило, с использованием анаэробной системы водород-диоксид углерода (GasPak, Becton Dickinson, США). Бифидобактерии во время их хранения всегда держат в таких анаэростатах. Пример 2. Отбор бактериальных штаммов. Данный скрининг in vitro основан на характеристиках продуцирования для промышленного применения жизнеспособных клеток, их способности выживать в условиях подавления или во вредных условиях желудочно-кишечного тракта и их геномном различии. Различие штаммов или геномное подобие таких неохарактеризованных штаммов учитывают с использованием RAPD и риботипирования. Материалы и методы Бактериальный рост Необходимо идентифицировать штаммы, способные быстро продуцировать большое число клеток. Цикл их бактериального роста можно охарактеризовать короткой лагфазой, малым временем генерации,высоким максимальным числом бактерий и длительной стационарной фазой. Поэтому штаммы сравнивают, рассматривая их жизнеспособность: продолжительность их лагфазы, их время генерации (в часах) и их максимальное число, что соответствует наиболее важным свойствам.-7 006428 Для лактобацилл Предварительно инкубированные при 37 С 200 мл питательной среды MRS инокулируют 1% свежей субкультуры. Образцы в один мл собирают каждый час после инокуляции в течение восьми часов Последний образец берут через 24 ч. Один мл каждого образца разводят серийно 10 раз в TS для подсчета. Культуры выращивают в агаре с MRS (метод посева наливом (pour-plating в анаэробных условиях при 37 С в течение 48 ч. Все бляшки с числом колоний от 30 до 350 регистрируют в виде колониеобразующих единиц (КОЕ) на мл культуры и затем рассматривают для подсчета. Для бифидобактерий в (MRS-C) При предварительных анализах проводят подсчет всех штаммов в питательной среде MRS-C иTPYG. Результаты выражают в КОЕ/мл. Кривые роста устанавливают, определяя число клеток при выращивании в MRS-C через 0, 4, 12, 24, 32 и 48 ч, согласно протоколу, описанному для лактобацилл. Для того, чтобы определить влияние субкультуральной среды и оптимизации обезгаживания среды для выращивания, осуществляют такой анализ субкультуры, хранившейся в BHI-C 48 ч при 4 С, и инокулированной в MRS-C,субкультуры, хранившейся в BHI-C 48 ч при 4 С, и инокулированной в тщательно обезгаженнуюMRS-C (удаление кислорода оптимизируют путем двукратного автоклавирования среды и хранения ее в анаэростатах),свежей субкультуры в MRS и инокулированной в тщательно обезгаженную и хранившуюся до эксперимента в анаэробных условиях MRS-C. Таблица 2. Среды для испытаний на бактериальный рост Твердые среды получают путем добавления агара Bacto, Difco (15 гл-1). Среды автоклавируют при 121 С в течение 15 мин. Жидкие среды для бифидобактерий или хранят в анаэробных условиях, или обезгаживают перед применением. Устойчивость к среде с желудочным рН и к жлчи При поедании животным, для того чтобы проявить благоприятную активность в желудочнокишечном тракте животного, микроорганизмы должны выживать в условиях, существующих в желудке и в двенадцатиперстной кишке. Величина рН в желудке и соли жлчных кислот являются основными компонентами, ответственными за регуляцию бактериальной флоры. Поэтому необходимо проанализировать степень устойчивости штаммов к кислой среде и желчи. Физиология пищеварительного тракта кошек и собак отличается от физиологии пищеварительного тракта человека. Средний рН составляет 3,4 и 4,2 для собак и кошек соответственно. Для таких анализов рекомендуется воспроизведенная жлчь домашних животных (табл. 4). Концентрация жлчи в тонкой кишке в ходе переваривания корма изменяется в интервале 0,5-2%. В соответствии с экстремальными величинами рН, найденными для кошек и собак, число жизнеспособных организмов после 10-минутного пребывания при рН 2,6 и после двухчасового пребывания или при рН 3,4 (штаммы, полученные от собак), или рН 4,2 (штаммы, полученные от кошек) должно составлять не менее 106 КОЕ/мл. Устойчивость к среде с желудочным рН Все лактобациллы инокулируют в количестве 1% в питательную среду MRS и выращивают в анаэробных условиях при 37 С в течение ночи. Бифидобактерии, инокулированные в количестве 5% в BHIC, выращивают в течение 48 ч при 37 С в анаэробных условиях. Культуры распределяют в 2 мл пробирки для аналитических качественных реакций (Eppendorf) и центрифугируют при 3500 g в течение 10 мин при 20 С. Клетки три раза промывают раствором Рингера. Устойчивость к кислой среде желудка анали-8 006428 зируют in vitro в трех образцах модельного желудочного сока с уровнем рН 2,6, 3,4 и 4,2, полученных с помощью НСl (Merck). Для стерилизации фильтрованием используют фильтры одноразового использования (Nalgene). Выживание каждой бактериальной суспензии исследуют, добавляя по одному мл в серию образцов по пять мл модельного желудочного сока (разные рН), с добавлением 1,5 мл 0,5% раствораNaCl. Образцы инкубируют при 37 С и подсчитывают число выживших организмов после пребывания в течение 0, 1, 5 и 10 мин в желудочном соке с рН 2,6,в течение 0, 1, 30, 60, 120 и 180 мин в желудочном соке с рН или 3,4 (для штаммов, полученных от собак), или 4,2 (для штаммов, полученных от кошек). Образцы разводят фосфатным буфером (рН 7,0),высевают на агар с MRS-C и подсчитывают. Таблица 3. Модельный желудочный сок Устойчивость к солям жлчных кислот Определяют изменение числа жизнеспособных лактобацилл, растущих в течение 18 ч в присутствии различных концентраций модельной жлчи домашних животных. Числа для двух жизнеспособных бацилл считают существенно различающимися, когда отклонение их lоg10 составляет выше 0,25. Каждый штамм характеризуют двумя переменными: максимальной концентрацией испытываемых солей жлчных кислот, при которой не обнаруживают существенного отличия от контроля,степенью снижения жизнеспособности при повышении концентрации жлчи в среде для выращивания. Штаммы, характеризующиеся потерей, превосходящей 1 оg10 числа их жизнеспособных организмов,когда концентрация жлчи возрастает поэтапно на 1%, считаются чувствительными к жлчи. Снижение,превосходящее 1 оg10 на единицу для клеток в присутствии 0 и 2% жлчи и на единицу на дополнительный процент содержания жлчи (свыше 2%), считается приемлемым. Кроме того, для того чтобы получить эффект в желудочно-кишечном тракте, следует отбирать только штаммы, продуцирующие при выращивании в присутствии солей жлчных кислот в концентрации до 2% более 106 КОЕ/мл. Модельную жлчь от кошек и собак получают так, как указано в табл. 4, и перед применением стерилизуют фильтрованием. При первом анализе лактобациллы выращивают в анаэробных условиях в течение 24 ч при 37 С в питательной среде MRS и переносят в свежую питательную среду MRS с добавлением 0, 0,1, 0,3, 0,5, 1, 2 и 4% стерильной модельной жлчи домашних животных еще на 18 ч. Образцы для подсчета серийно разводят 10 раз в TS. Разведения 103 и 105 высевают на агар с MRS с использованием WASP ("Whitley Automatic Spiral Plater"; Don Whitley Scientific Limited, Англия). Высушенные чашки переворачивают крышкой вниз и инкубируют 48 ч при 37 С в анаэростатах.Flosh et al. (1972) определяют подавление как существенное, когда log для испытываемого образца снижается по сравнению с результатами для контроля по меньшей мере на 2. На основании этого все лактобациллы, чувствительные к содержанию жлчи при первом анализе, и две лактобациллы, устойчивые к 4% жлчи, проверяют подобным образом в присутствии 0, 1, 1,5, 2, 2,5, 3 и 4% жлчи. Второе испытание нацелено на воспроизводимость и определение того, существенно ли снижается число жизнеспособных бактерий при повышении концентрации жлчи. С другой стороны, замечено, что такие штаммы устойчивы к жлчи в течение указанного 18 часового периода. Строят кривые роста в присутствии солей жлчных кислот для того, чтобы определить, нарушаются или нет лаг-фаза и скорость роста. Анализы проводят с лактобациллами, выращиваемыми в питательной среде MRS с добавлением 1% модельной жлчи домашних животных, согласно протоколу, описанному ранее для определения роста. Бифидобактерии субкультивируют и выращивают в течение 32 ч при 37 С в анаэробных условиях с использованием питательной среды MRS-C с добавлением 0, 1, 2, 3 и 4% модельной жлчи домашних животных. При разведениях 103, 104 и 105 применяют тот же метод подсчета, что и для лактобации. Таблица 4. Модельная жлчь домашних животных-9 006428 Выживание штаммов Lactobacillus при лиофилизации и последующем хранении Оценивают выживание. Число жизнеспособных бактерий менее 105 КОЕ/мл рассматривают как слишком низкое. В случае каждого штамма 100 мл питательной среды MRS инокулируют 3% свежей субкультуры. Культуры выращивают в течение 16 ч при 37 С. Предполагается, что условия без доступа воздуха (закрытые емкости) являются достаточно анаэробными. Число жизнеспособных клеток подсчитывают с использованием метода высева на чашку описанного ранее. Культуры собирают методом центрифугирования при 3500 х g при +7 С в течение 20 мин (центрифуга RC3C, Sorvale Instrument) и ресуспендируют в 10 мл двух разных криозащитных сред. Каждый штамм ресуспендируют в двух разных криопротекторах. Проводят подсчет для концентрированных бактериальных суспензий (метод высева на чашку) и распределяют их в сосуды (0,5 мл на ампулу). Образцы замораживают при -196 С в жидком азоте и сушат в вакууме в течение 18 ч. После лиофилизации через впускной клапан сублимационной сушилки вводят азот и все ампулы запаивают. Все сосуды хранят при+4 С и +20 С в течение 6 месяцев. Число жизнеспособных клеток на ампулу (для каждой бактерии и суспензионной среды) определяют ежемесячно. В рамках отбора возможных пробиотиков для кошек и собак в табл.5 приводятся результаты такого скрининга in vitro 20 лактобацилл и 18 бифидобактерий, основанного на возможностях их роста, устойчивости к лиофилизации с последующим хранением и устойчивости к среде с желудочным рН и концентрацией жлчи, найденным в желудочно-кишечном тракте кошек и собак. Лактобациллы (20) классифицируют согласно критериям, определенным как существенные в данном исследовании. Четыре штамма показали хорошие результаты в отношении своих характеристик роста, устойчивости к среде с желудочным рН, устойчивости к жлчи и своему выживанию во время хранения после лиофилизации, а именно, L. reuteri NCC2581 (CNCM I-2448), L. reuteri NCC2592 (CNCM I2450), L. reuteri NCC2603 (CNCM I-2451) и L. reuteri NCC2613 (CNCM I-2452). Их свойства удовлетворяют следующим параметрам: время генерации менее одного часа при выращивании в MRS; короткая лаг-фаза (менее двух часов); высокое число жизнеспособных бактерий (свыше 108 КОЕ/мл) во время стационарной фазы цикла роста и стабильное через 8 и 24 ч после инокуляции; штаммы устойчивы при лиофилизации и последующем шестимесячном хранении при 4 С и 20 С; штаммы устойчивы к предельным концентрациям жлчи, возможно, имеющимся в желудочнокишечном тракте кошек и собак (2%); не происходит существенного подавления в присутствии в среде до 4% жлчи; штаммы толерантны к среде с рН 2,6 в течение по меньшей мере 10 мин и могут оставаться на уровнях свыше 108 КОЕ/мл; штаммы устойчивы к желудочному соку со средним рН в течение по меньшей мере двух часов. Поэтому для исследований на возможную пробиотическую активность отобраны две лактобациллы,полученные от кошек (L. reuteri NCC2581 и L. reuteri NCC2592), и две лактобациллы, полученные от собак (L. reuteri NCC2603 и L. reuteri NCC2613). Штаммы NCC2581, NCC2592, NCC2603 и NCC2613 идентифицированы как L. reuteri по идентификации API 50CH. Однако, риботипирование показывает, чтоNCC2581 и NCC2592 имеют очень близкие особенности, как и NCC2603 и NCC2613, что указывает, таким образом, на близкое родство. Штамм NCC2581 имеет очень хорошие характеристики по росту, аNCC2603 имеет лучшую устойчивость к жлчи, чем NCC2613. Результаты, относящиеся к восьми бифидобактериям, выделенным из фекалий кошек, допускают отбор по их характеристикам роста, переносимости ими желудочного рН и их чувствительности к жлчи. Штамм NCC2623 не имеет ни одного нужного свойства и поэтому не рекомендован для дальнейших исследований. С другой стороны, штамм NCC2627 удовлетворяет всем критериям: его время генерации менее одного часа при выращивании в MRS-C; лаг-фаза такая же короткая, как у лактобацилл; число жизнеспособных бактерий во время стационарной фазы цикла роста высокое; штамм устойчив к предельным концентрациям жлчи, возможно, имеющимся в желудочнокишечном тракте кошек и собак (2%); не происходит существенного подавления в присутствии в среде до 4% жлчи; штамм переносит рН 2,6 в течение по меньшей мере 10 мин и может сохраняться на уровнях свыше 108 КОЕ/мл; штаммы устойчивы к желудочному соку со средним рН в течение по меньшей мере 2 ч. Штамм NCC2627 значительно более устойчив, чем NCC2623 и NCC2635, в то время как указанные три штамма по риботипированию имеют очень близкие особенности, что указывает на возможное близкое родство (ферментативное расщепление двумя рестриктазами EcoRI и EcoRV). Десять бифидобактерий, полученных от собак, при характеризации риботипированием соответствуют только двум характерным образцам. Поэтому анализы на устойчивость к жлчи проводят только для четырех штаммов (для двух из каждой группы): NCC2657, NCC2660, NCC2671 и NCC2677. Указан- 10006428 ные четыре штамма все устойчивы к максимальной концентрации жлчи, которую можно обнаружить invivo (2%), а в штаммах число жизнеспособных клеток NCC2660 и NCC2657 не снижается, когда штаммы подвергают воздействию среды с максимальным содержанием жлчи (4%). Как вывод, все бифидобактерии, выделенные из фекалий собак, довольно устойчивы к высоким концентрациям жлчи. С учетом характеристик роста указанные десять бактерий можно, таким образом, разделить на две группы: штаммы, устойчивые к жлчи и с хорошими характеристиками роста - NCC2657, NCC2651,NCC2663 и NCC2667; штаммы, устойчивые к жлчи, но с характеристиками роста, которые в случае промышленного производства нуждаются в оптимизации - NCC2660, NCC2671, NCC2677, NCC2647, NCC2654 иNCC2674. Полные результаты по устойчивости к среде с предельными значениями желудочного рН, обнаруженными в процессе переваривания у кошек и собак, должны позволить лучше определить штаммы, отбираемые для дальнейших исследований. Только штамм NCC2651 не удовлетворяет критериям отбора по устойчивости к среде с нужным рН. Таблица 5. Итоговая С учетом полученных результатов можно выбрать один штамм бифидобактерий, полученный от кошек, и три бифидобактерий, полученные от собак (соответственно, NCC2627, NCC2657, NCC2663 и В пробирки разливают по 9 мл среды и автоклавируют при 121 С в течение 15 мин. Наконец, для дальнейших исследований отбирают 8 штаммов из 38 (см. пример 3): три лактобациллы, полученные от кошек (NCC2581, NCC2592, NCC2583), три лактобациллы от собак (NCC2603,NCC2613, NCC2628), одну бифидобактерию от кошек (NCC2627) и одну бифидобактерию от собак(NCC2657). Указанные штаммы характеризуются малыми временами генерации, высокими числами жизнеспособных бактерий (свыше 108 КОЕ/мл) во время стационарной фазы и сохранением высоких чисел через 8 и 24 ч после инокуляции, устойчивостью при лиофилизации с последующим хранением в любых условиях, устойчивостью к предельным концентрациям жлчи, обнаруженным в двенадцатиперстной кишке(2% жлчи), и низким их подавлением при выращивании в присутствии до 4% жлчи. Кроме того, при отборе бактерий, представляющих исследуемое многообразие, учитывают результаты анализов ДНК. Пример 3. Эффективность колонизации в организме кошек.L. reuteri NCC2581, L. reuteri NCC2592, L. rhamnosus NCC2583 и вид Bifidobacterium NCC2627 испытывают в опытах по кормлению с тем, чтобы оценить их способность выживать при прохождении желудочно-кишечного тракта кошки. Шестнадцать котов и кошек, настолько одинаковых, насколько возможно, подвергают в течение 3 дней адаптации к рациону из тушного мяса Friskies Grand. Протокол кормления включает 7 дней с"Friskies Grand Menu" и 7 дней испытания с "Friskies Grand Menu", содержащим один из вышеуказанных штаммов L. reuteri NCC2581 (рацион A), L. reuteri NCC2592 (рацион В), L. rhamnosus NCC2583 (рацион С) и вид Bifidobacterium NCC2627 (рацион D). Рационы распределяли как указано далее. Указанные штаммы получают в достаточном количестве и в устойчивой лиофилизованной форме для того, чтобы проверить указанные восемь различных бактерий на выживание штамма в желудочнокишечном тракте подопытных животных. Все штаммы смешивают с 4 г трегалозы для того, чтобы добавлять достаточный объем носителя для смешивания полученных штаммов с основным кормом для животных. Штаммы бактерий получают в отдельных пластиковых пробирках (109 КОЕ/день), и ежедневно добавляют в часть корма, чтобы иметь уверенность в том, что все бактерии будут съедены. Получают образцы свежих фекалий для анализа на членов бактериальной популяции и сравнивают с базовым уровнем (без добавления бактерий). Фекалии собирают в день 7 и 8 (базовый уровень),14 и 15,21 и 22 (базовый уровень),28 и 29. Для получения образца фекалий в по меньшей мере 0,1 г используют стерильный ректальный зонд. Этот образец точно взвешивают и 0,1 г смешивают с 10 мл физиологического раствора (раствора Рингера), содержащего 10% глицерина. Затем такой раствор переносят в 1-мл пробирки, стабильные при низкой температуре, и замораживают в жидком азоте. Затем все образцы хранят до анализа при -80 С. Подсчитывают число эндогенных популяций лактобацилл, Bacteroides, Entrobacteriaceae, энтерококов, бифидобактерий и Clostridium perfringens. Бактерии детектируют на селективных или полуселективных средах. Осуществляют стократные серийные разведения в растворе Рингера, содержащем 0,5% цистеина, из разведении в интервале от -2 до -8 высевают на чашки Петри с различными селективными средами и инкубируют (см. таблицу, приведенную ниже).Wadsworth Anaerobic Bacteriology Mannual, V. Suter, D. Citron and S. Finegold, Third Ed.Фосфомицин (79,5 мг/л) + сульфаметоксазол (0,93 мг/л) + триметоприм (5 мг/мл).Агар NN от Lowbury and Lilly, 1995. Число жизнеспособных бактерий, выраженное в виде log по основанию 10, приведено в табл.7. Таблица 7. Число жизнеспособных бактерий в фекалиях у кошек (среднеест.откл, n = 8)- 12006428 Во время обработки наблюдается повышение числа лактобацилл в фекалиях из-за поедания указанных пробиотических бактерий. Не наблюдается значительного повышения числа Entrobacteriaceae, что отражает тот факт, что в кишечной экосистеме не имеется повреждений, связанных с применением указанных пробиотиков. Пример 4. Эффективность колонизации в организме собак.L. reuteri NCC2603, L. reuteri NCC2613, L. acidophilus NCC2628 и вид Bifidobacterium NCC2657 испытывают в опытах по кормлению с тем, чтобы оценить их способность выживать при прохождении желудочно-кишечного тракта собаки. Данному специфическому испытанию подвергают десять собак, 5 кобелей и 5 сук, в возрасте 4-7 лет. Протокол кормления включает 5 дней адаптации с "Friskies Vitality" без цикория и 5 дней испытания с "Friskies Vitality" без цикория, и 3 дня адаптации и 5 дней испытания с "Friskies Vitality" без цикория, с добавлением бактерий L. reuteri NCC2603 (рацион Е), L. reuteri NCC2613 (рацион F), L. acidophilusNCC2628 (рацион G) и вида Bifidobacterium NCC26527 (рацион Н). Рационы распределяли как указано далее. Указанные штаммы получают в достаточном количестве и в устойчивой лиофилизованной форме для того, чтобы проверить указанные восемь разных бактерий на выживание штамма в желудочнокишечном тракте подопытных животных. Все штаммы смешивают с 4 г трегалозы для того, чтобы добавлять достаточный объем носителя для смешивания полученных штаммов с основным кормом для животных. Штаммы бактерий получают в отдельных пластиковых пробирках (509 КОЕ/день) и ежедневно добавляют в часть корма, чтобы иметь уверенность в том, что все бактерии будут съедены. Получают образцы свежих фекалий для анализа на членов бактериальной популяции и сравнивают с базовым уровнем (без добавления бактерий). Фекалии собирают в день 7 и 8 (базовый уровень),14 и 15,21 и 22 (базовый уровень),28 и 29. Для получения образца фекалий в по меньшей мере 0,1 г используют стерильный ректальный зонд. Этот образец точно взвешивают и 0,1 г смешивают с 10 мл физиологического раствора (раствора Рингера), содержащего 10% глицерина. Затем данный раствор переносят в 1-мл пробирки, стабильные при низкой температуре, и замораживают в жидком азоте. Затем все образцы хранят до анализа при -80 С. Бактерии подсчитывают в тех же средах, которые описаны в примере 3. Число жизнеспособных бактерий, выраженное в виде log по основанию 10, приведено в табл.8. Таблица 8. Число жизнеспособных бактерий в фекалиях у собак (среднеест.откл, n = 5) Во время обработки не наблюдается значительных изменений числа лактобацилл в фекалиях из-за поедания указанных пробиотических бактерий за исключением штамма L. acidophilus NCC2628. В условиях испытания ингибирующее действие на С. perfringens не существенно, так как базовый уровень С.perfringens очень низкий. Не наблюдается значительного повышения числа Entrobacteriaceae, что отражает тот факт, что в кишечной экосистеме не имеется нарушений, связанных с применением указанных пробиотиков. Пример 5. Влияние лактобацилл и их фракций на жизнеспособность Giardia intestinalis. Исследуется действие супернатантов культуральных фильтратов штаммов лактобацилл, полученных от кошек и собак. Материалы и методы Бактериальные штаммы и культуры. Микроорганизмы, принадлежащие к роду Lactobacillus, получают из Коллекции культур Nestle и выращивают в среде MTYI. Супернатанты, содержащие фракции лактобацилл, нейтрализуют до рН 6 и стерилизуют фильтрованием.- 13006428 Контроль получают, подкисляя среду MTYI молочной кислотой до той же величины рН, какая характерна для бактериальных культур. Затем рН доводят до 6 с помощью 0,1 N раствора NaOH. Источники исследуемого штамма и рН супернатантов и контроля приводятся в табл.9. Таблица 9 Паразиты. Штамм Giardia intestinalis WB (ATCC 30957) закупают у Американской коллекции типовых культур (Роквилл, США). Трофозоитов выращивают в среде TYI-S-33, модифицированной по Кейстеру, содержащей в 1 л 20 г казеинового гидролизата (Difco), 10 г дрожжевого экстракта (BBL), 10 г декстрозы (Merck), 0,75 г бычьей жлчи (Difco), 2 г NaCl (Merck), 2 г гидрохлорида L-цистеина (Sigma),0,2 г натриевой соли аскорбиновой кислоты (Fluka), 0,6 г К 2 НРO4 (Merck), 22,8 мг двойного цитрата железа(3) и аммония (Sigma), 100 мл бычьей сыворотки взрослого животного (Sigma), 15 мл пенициллина/стрептомицина (Gibco, 1000 МЕ/мл, 1000 мкг/мл). Перед стерилизацией фильтрованием (размер пор 0,22 мкм) доводят рН до 6,9 с помощью 5 N раствора NaOH. Паразитов выращивают в полистирольных колбах для выращивания культур тканей (LUX, MilesLaboratories, Inc. naperville IL 60540), наполненных 40 мл культуральной среды. Субкультуры получают,отбрасывая супернатант с незакрепившимися паразитами, добавляя 5 мл охлажденной на льду культуральной среды, инкубируя на ледяной бане в течение 10 мин для того, чтобы отделить закрепившихся трофозоитов, и инокулируя 0,2 мл полученной суспензии в свежую среду. Инкубацию осуществляют при 37 С в темноте. Анализ на пролиферацию. По 200 мкл суспензий трофозоитов (1,4 х 105 паразитов/мл) смешивают со 100 мкл супернатантов или контролей и добавляют 1 мкКи 3H-тимидина. Образцы инкубируют при 37 С в течение 24 ч в 96-луночных культуральных планшетах (Nunc Brand Products). Затем паразитов собирают и оценивают включение тимидина. Включение тимидина приведено в табл. 10. Штамм NCC 2628, полученный от собаки, сильно ингибируют пролиферацию штамма WB (91%). Другие исследованные штаммы не ингибируют рост трофозоитов. Таблица 10. Влияние фильтратов культуральных супернатантов на пролиферацию штамма Giardia intestinalis Как следует из результатов эксперимента, образующиеся функциональные фракции, полученные во время роста L. acidophilus NCC 2628, обладают очень сильным ингибирующим действием на рост Giardiaintestinalis. Пример 6. Ингибирующее действие штаммов лактобацилл по изобретению на кишечные патогенные бактерии. Для того чтобы идентифицировать штаммы с сильными антагонистическими свойствами против патогенных бактерий в тонкой кишке, проводят эксперименты по совместному культивированию на модельной системе, имитирующей условия в тонкой кишке собаки (рН, состав и концентрация жлчи, муцин, панкреатин). Модельный кишечный сок тонкой кишки собаки содержит воспроизведенную жлчь собаки (0,345 г/л таурохенодезоксихолата, Sigma, Германия; 0,7 г/л тауродезоксихолата, Sigma, Германия; 3,04 г/л таурохолата, Sigma, Германия; 0,006 г/л холата, Fluka, Швейцария), свиной муцин (1,9 г/л,- 14006428Sigma, Германия), свиной панкреатин (2,42 г/л, Sigma, Германия) и раствор электролита (5 г/л NaCl, 0,6 г/л КСl, 0,25 г/л CaCl2, все Merck, Германия). рН сока доводят до 6,50,5 с помощью 0,1 N раствораNaOH. Штаммы и условия культивирования Патогенные бактерии тонкой кишки Отбирают четыре потенциально патогенных штамма: S. typhimurium SL1344, Е. coli ЕТЕС 08:Н 9 и Е. coli 0149:K88 (патогенный изолят собаки) и клинический изолят Sh. dysenteriae (человеческого происхождения, любезно предоставлен Centre Hospitalier Vaudoise - CHUV, Лозанна, Швейцария). За исключением S. typhimurium SL1344, размножаемого в питательной среде Luria Bertani (Difco, США), все enterobacteriaceae выращивают в питательной среде Brain Heart Infusion (Difco, США) при 37 С при встряхивании (240 об/мин). Молочно-кислые бактерии Широкий ряд лактобацилл, источником которых являются собаки и кошки, включая L. acidophilusreuteri NCC2592 (CNCM I-2450), отбирают в Коллекции культур Nestle (NCC, Nestec, Швейцария) и скринируют на модели тонкой кишки собаки на выживание, физиологическую активность и ингибирующее действие на вышеуказанные патогенные бактерии в тонкой кишке. Лактобациллы культивируют в анаэробных условиях (anaerocult, Oxoid, Англия) в питательной среде Man Rogosa Sharp (Difco, США) при 37 С. Определение числа жизнеспособных клеток Образцы разводят стерильным фосфатным буфером (NaH2PO4, рН 7, 0,2 М) и 10-кратные разведения высевают на поверхность агаровых чашек: на агар с MRS (Difco, США) в случае лактобацилл, агарSalmonella-Shigella (Oxoid, Англия) в случае S. typhimurium и Sh. dysenteriae и агар с сорбитом Mac Conkey (Oxoid, Англия) в случае Е. coli. Агаровые чашки инкубируют 48 ч при 37 С в анаэробных условиях в случае лактобацилл и 24 ч при 37 С в случае enterobacteriaceae. При опытах по совместному культивированию рост enterobacteriacea на агаре с MRS подавляют путем добавления полимиксина (Oxoid, Англия). Эксперименты по совместному культивированию молочнокислых бактерий (LAB) и патогенных организмов Эксперименты по совместному культивированию потенциальных пробиотиков LAB и патогенных штаммов осуществляют при 37 С в 20 мл (пробирки Фалькона) модельного кишечного сока тонкой кишки собаки, обогащенного различными источниками углерода (сахар, корм для домашних животных) для благоприятствования метаболической активности культур. LAB инокулируют в количестве 108 КОЕ/мл,патогенные бактерии - 102 КОЕ/мл, 104 КОЕ/мл и 106 КОЕ/мл. Образцы берут в разные моменты времени в течение 8 ч и число жизнеспособных клеток определяют путем поверхностного посева 10-кратных разведений на соответствующие среды. Опыты по совместному культивированию осуществляют в разных условиях, включая обогащение модельного кишечного сока тонкой кишки собаки декстрозой (5 г/л) и различными концентрациями коммерчески доступного экструдированного сухого корма для домашних животных (5, 25 или 100 г/л;Friskies ALPO Complete, США). Последний гомогенизируют (Stomacher Lab Blender) и суспендируют в растворе электролита. Все эксперименты осуществляют двукратно. Пример 6. Эксперименты по совместному культивированию четырех молочнокислых бактерий и четырех потенциально патогенных штаммов Е. coli ЕТЕС 08:Н 9, Е. coli 0149:K88, S. typhimurium SL1344 и Sh. dysenteriae осуществляют в модельном кишечном соке двенадцатиперстной кишки собаки, обогащенном 5 г/л декстрозы (Difco). Лактобациллы инокулируют в количестве 108 КОЕ/мл, а индикаторные грамотрицательные штаммы - в количестве 102 КОЕ/мл. Результаты приведены в табл. 11. Таблица 11. Совместное культивирование LAB и потенциально патогенных бактерий в модельном кишечном соке тонкой кишки собаки, обогащенном декстрозой- 15006428 Все четыре исследуемые лактобациллы демонстрируют антимикробную активность, но только L.acidophilus NCC2628 (CNCM I-2453) и L. rhamnosus NCC2583 (CNCM I-2449) демонстрируют высокую активность против всех испытываемых патогенных бактерий. Оба штамма не только способны ингибировать рост патогенных бактерий, но также способны полностью инактивировать патогенные бактерии,содержащиеся в экспериментальной системе (жизнеспособных клеток не остается). Пример 7. Эксперименты по совместному культивированию лактобацилл [(L. acidophilus NCC2628(CNCM I-2453), L. rhamnosus NCC2583 (CNCM I-2449)] и S. typhimurium SL1344 осуществляют в модельном кишечном соке двенадцатиперстной кишки собаки, обогащенном коммерчески доступным экструдированным сухим кормом для домашних животных (5, 25 или 100 г/л; Friskies ALPO Complete,США). Лактобациллы инокулируют в количестве 108 КОЕ/мл, а индикаторные грамотрицательные штаммы - в количестве 102 КОЕ/мл. Результаты приведены в табл. 12. Таблица 12. Совместное культивирование LAB и потенциально патогенных бактерий в модельном кишечном соке тонкой кишки собаки, обогащенном сухим кормом для домашних животных Результаты демонстрируют высокие возможности, особенно L. acidophilus NCC2628 (CNCM I2453), в отношении ингибирования роста и даже полной инактивации патогенных бактерий в тонкой кишке в условиях, весьма близких к практическим, таких как смесь модельного кишечного сока и корма. Антимикробная активность L. acidophilus NCC2628 очень высокая даже при низких уровнях добавления коммерческого корма для домашних животных, служащего для организма источником сбраживаемых сахаров. В отличие от такого результата, полученного для L. acidophilus NCC2628, эффективность L.rhamnosus NCC2583 (CNCM I-2449) зависит от уровня обогащения кормом таким образом, что повышение антимикробной активности наблюдают при повышении количества корма для домашних животных,добавляемого в экспериментальную систему. Пример 8. Эксперименты по совместному культивированию L. acidophilus NCC2628 (CNCM I-2453) и S. typhimurium SL1344 при различных уровнях инокуляции осуществляют в модельном кишечном соке двенадцатиперстной кишки собаки, обогащенном декстрозой (5 г/л; Difco). L. acidophilus NCC2628(CNCM I-2453) инокулируют в количестве 108 КОЕ/мл и S. typhimurium SL1344 инокулируют в количестве 102 КОЕ/мл, 104 КОЕ/мл и 106 КОЕ/мл. Результаты приведены в табл.13. Таблица 13. Совместное культивирование L. acidophilus NCC2628 (CNCM I-2453) и S. typhimurium SL1344 при различных уровнях инокуляции Антимикробная активность L. acidophilus NCC2628 (CNCM I-2453) достаточно высокая для того,чтобы полностью инактивировать S. typhimurium SL1344 даже в высокой начальной концентрации. Пример 9. Иммунная стимуляция in vivo на собаках. Иммунностимулирующий потенциал предварительно выделенных штаммов пробиотиков проверяют при клиническом испытании с использованием штамма L. acidophilus NCC2628. Методы Пролиферация мононуклеарных клеток периферической крови (РВМС) собаки после стимуляции различными митогенами- 16006428 Данному испытанию подвергают 20 собак в возрасте 4-7 лет. Протокол кормления включает недельную адаптацию с "Friskies Vitality" без цикория и 4 недели испытания с "Friskies Vitality" без цикория с добавлением бактерий L. acidophilus NCC2628.L. acidophilus NCC2628 получают в достаточном количестве и в стабильной лиофилизованной форме для того, чтобы проверить выживание штамма в желудочно-кишечном тракте подопытных животных. Бактерии смешивают с 4 г трегалозы для того, чтобы добавлять достаточный объем носителя для смешивания полученных бактерий с основным кормом для животных. Бактерии получают в отдельных пластиковых пробирках (59 КОЕ/день) и ежедневно добавляют в часть корма, чтобы иметь уверенность в том,что все бактерии будут съедены. Образцы крови у собак берут через четыре недели после введения пробиотика. Кровь фракционируют на колонке Vaccutainer (Becton Dickinson, Mountain View, CA). Извлекают PBMC согласно рекомендациям изготовителя. Клетки стимулируют различными митогенами или эфирами форбола, индуцирующими сильную пролиферацию Т-клеток (конканавалин A (con А), фитогемаглутинин (РНА или В-клеток (митоген Поквида (PWM и всех клеток (миристат-ацетат форбола/иономицин (РМА/ионо. С митогенами или эфирами форбола (соответствующие дозы указаны на фигуре 1) в 96-луночных планшетах с плоскодонными лунками (Nunc) инкубируют 105 клеток на лунку в конечном объеме 200 мкл культуральной средыRPMI-1640 с добавлением 10% фетальной телячьей сыворотки и антибиотков. Клетки выдерживают во влажной атмосфере с 5% CO2 при 37 С в течение 48 ч. Еще в течение 18 ч клетки метят импульсами 1 мкКи [3 Н]-тимидина (Amersham Pharmacia Biotech, Швейцария). Затем клетки собирают на нитроцеллюлозных фильтрах (Packard), и определяют количество связанного [3 Н]тимидина путем подсчета импульсов (TopCount; Packard, Швейцария). Пролиферацию клеток вычисляют в виде среднего (числа импульсов в минуту (чим, с.р.m.) (ст.откл) при трехкратном повторе. Результаты Фиг. 1. Наблюдается четкое усиление пролиферации клеток в ответ на все митогены в группе собак,которых кормили L. acidophilus NCC2628, по сравнению с контрольной группой. Такое усиление существенно в культурах, стимулируемых эфирами форбола с добавлением иономицина. Такие результаты показывают, что лимфоидные клетки собак, питавшихся пробиотиком, более реакционноспособны после активации in vitro, и наводят на мысль, что иммунная система собак, питавшихся пробиотиком, стимулируется. Пример 10. Модуляция in vitro иммунных функций штаммами лактобацилл, полученных от домашних животных. Путем скрининга in vitro отбирают различные штаммы лактобацилл, полученных от домашних животных, описанные выше, для определения их иммунномодулирующего потенциала. С этой целью измеряют их способность индуцировать провоспалительные цитокины (IL-12, IFN-) и/или противовоспалительные цитокины (IL-10, TGF-) (Anand А.С., Adya С.М., 1999, Trop. Gastroentrol., 20(3):97-106; Spellberg В., Edwards J.E.Jr., 2001, Clin. Infect. Dis., 32(1):76-102). Данное измерение имеет целью отбор возможных штаммов-кандидатов по причине сильных антипатогенных или противораковых иммунных функций, а также антагонистических функций против патологий кишечника собак, таких как аллергия и воспаление (воспалительные болезни кишечника). Получают дополнительные культуры только с одной средой (отрицательный контроль), со штаммом Enterococcus faecium SF68 (NICMB 10415, CerbiosPharma, Швейцария) и с изолятом лактобацилл человека ST11 (NCC 2461, CNCM I-2116) (положительный контроль). Метод Профили цитокинов, индуцированные различными штаммами пробиотиков в лейкоцитах собак. Кровь здоровых взрослых собак обрабатывают 5 мин при комнатной температуре буфером для лизинга АСК (150 мМ NH4Cl, 1 мМ КНСО 3 и 0,1 мМ Na2-ЭДТК в Н 2O, рН = 7,4). Лейкоциты дважды промывают средой RPMI (без антибиотиков) и высевают в количестве 2106 клеток/мл в 24-луночные культуральные планшеты. В каждую лунку добавляют 1 мл бактериальной суспензии (описанной ниже), содержащей 106 КОЕ. Для контрольной обработки к лейкоцитам добавляют только среду. Образцы инкубируют 18 ч при 37 С и 5% СO2. Затем лейкоциты собирают, промывают PBS и центрифугируют. Клеточный осадок лизируют в 500 мкл реагента тризола (Gibco BRL). Из клеточных лизатов экстрагируют РНК с использованием набора Nucleospin RNA (Machery-Nagel). Осуществляют амплификацию цитокинов собаки с использованием генного набора АВ (Merck). Ссылки для праймеров приводятся ниже (все получены отMicrosynth). Денситометрический анализ полос PCR, обнаруженных в окрашенных бромидом этидия агарозных гелях, осуществляют с использованием программного обеспечения NIH Image. Все полосы нормализуют по соответствующей полосе продукта PCR -актина, полученной с каждым образцом(внутренний контроль), и результаты выражают в виде произвольных единиц, отражающих плотность изображения каждой полосы продукта PCR цитокина (фиг. 2).- 17006428 Получение бактерий. Различные штаммы лактобацилл выращивают в среде MRS в течение приблизительно 8 ч до тех пор, пока они не достигнут идентичной плотности. Бактерии разводят в среде RPMI без антибиотиков до конечной концентрации 106 КОЕ/мл. Праймеры, используемые для RT PCR цитокинов Результаты Фиг. 2. Результаты показывают, что профили цитокинов, индуцированные лактобациллами, зависят от штамма. Например, штамм NCC2628 индуцирует высокие уровни IL-10 и TGF, что подчеркивает возможности указанного определенного штамма в отношении иммунной модуляции воспалительных расстройств, таких как аллергия и воспалительные болезни кишечника. Напротив, штамм NCC2583 индуцирует высокие уровни IFN- и IL-12, что делает такой штамм хорошим кандидатом на случай антипатогенной или противораковой активности. Пример 11. В исследовании используют три сухих корма для домашних животных. Их обозначают "А", "В" и"С". Корм "А" представляет собой полный сухой корм для домашних животных с необходимыми питательными веществами, доступный под маркой ALPO (ALPO является зарегистрированным товарным знаком SOCIETE DES PRODUITS NESTLE S.A., Швейцария). Корм "В" представляет собой такой же полный сухой корм для домашних животных с необходимыми питательными веществами, как корм А, но с добавлением порошкообразной смеси выбранных пробиотических микроорганизмов, добавляемой из пакетика. Смесь содержит по существу равные количества L. acidophilus NCC2628 и вида bifidobacterium NCC2657. Ею посыпают корм при каждой подаче,причем добавляемая доза составляет примерно 108 КОЕ/день. Корм для домашних животных "С" представляет собой полный сухой корм для домашних животных с необходимыми питательными веществами, по существу, идентичный корму "А", но содержащий 1,2 мас.% высушенного супернатанта культуры Enterococcus faecium SF68 (NICMB 10415). В данном исследовании используют 30 собак. Собак предварительно кормят в течение 8 недель с использованием корма А. Затем собак делят на 3 группы по 10 собак в каждой, обозначают группы А, В и С и дают рационы под соответствующими названиями в течение 8 недель. Собаки имеют свободный доступ к воде и их кормят один раз в сутки. Распространение перхоти в шерстяном покрове определяет оценочная комиссия из 30 членов в начале испытания и затем спустя 7 недель. Собак перед оценкой комиссией чистят, и члены комиссии не сравнивают замечания в ходе оценки. При такой оценке собак представляют каждому члену комиссии в 20 разных парах. Членов комиссии просят указать в своих протоколах, какая собака из представленной пары имеет (1) меньше перхоти,(2) более высокий блеск шерстяного покрова и (3) шерстяной покров с меньшим запахом. Общее состояние шерстяного покрова у всех собак визуально и на ощупь настолько хорошее, насколько можно ожидать у нормальных здоровых собак. Однако обнаружено, что собаки, которых кормят рационом С, имеют заметно меньше перхоти, чем собаки, которых кормят контрольным кормом А. Собаки на рационе В имеют заметно более блестящий шерстяной покров и обнаруживают менее заметный запах шерстяного покрова, чем собаки на рационе А. Обнаружено, что указанные характеристики статистически существенно не отличаются при сравнении с собаками в группе В. Пример 12. Кормовая смесь содержит до примерно 58 мас.% кукурузы, примерно 6 мас.% кукурузного глютена, примерно 25 мас.% мяса и остальное составляют мука, соли, витамины и минеральные вещества. Кормовую смесь загружают в аппарат для предварительного кондиционирования и увлажняют. К такой смеси добавляют порошок, содержащий смесь следующих штаммов Lactobacillus: Lactobacillusfaecium SF68 (NICMB 10415). Порошок по существу равномерно диспергируют в смеси. Затем такую увлажненную кормовую смесь загружают в варочный котел с экструдером и желатинизируют. Желатинизированную основу, выходящую из экструдера, проталкивают через головку и экструдируют. Экструдат нарезают на кусочки, подходящие для кормления собак, сушат при примерно 110 С в течение примерно 20 мин и охлаждают, и получают гранулы. Куски экструдата проверяют на бактериальную активность добавленных штаммов. Ничего не обнаруживают.- 18006428 Пример 13. В данном исследовании используют 24 собаки. В указанное число входят более молодые и более старые животные, причем возраст последних составляет 8-12 лет. У отобранных более старых собак обнаруживаются внешние признаки воспаления суставов, соответствующие их возрасту, и собаки временами испытывают некоторые трудности при движении. Некоторые движения оказываются болезненными. Такие симптомы часто наблюдают у более старых собак и полагают, что они связаны с артритическим состоянием. В данном исследовании используют три сухих корма для домашних животных, обозначаемых А, В и С. Корм А представляет собой полный сухой корм для домашних животных с необходимыми питательными веществами (ALPO Beefy Dinner). Этот корм является контрольным кормом. Всех выбранных 24 животных предварительно в течение 8 недель кормят с использованием корма для домашних животных А. Затем собак делят на 3 группы А, В и С по 8 собак в каждой группе и с тем же соотношением более молодых и более старых животных в каждой группе. Затем каждую группу в течение 8 недель кормят соответствующими кормами, указанными далее. Корм В представляет собой полный сухой корм для домашних животных с необходимыми питательными веществами, по существу, идентичный корму А, но содержащий слой, составляющий до 2% его массы, причем слой содержит микроорганизмы Enterococcus faecium SF68 (NICMB 10415). Количество корма, даваемого ежедневно каждой собаке, рассчитывают в соответствии с массой ее тела таким образом, что дозировка микроорганизмов составляет 109 КОЕ/день. Корм С содержит экструдированные кусочки, полученные выше в примере 12. Количество корма,даваемого ежедневно каждой собаке, рассчитывают в соответствии с массой ее тела таким образом, что дозировка микроорганизмов составляет 1011 КОЕ/день. Собаки имеют свободный доступ к воде и их кормят один раз в день. К ошейнику каждой собаки прикрепляют измеритель активности и проводят измерения ежедневно. Собаки также оцениваются на активность визуально персоналом питомника. Состояние всех собак визуально и на ощупь настолько хорошее, насколько можно ожидать у нормальных здоровых собак. Однако собаки в группах, получавших рационы В и С, заметно более активны,чем собаки на рационе А. Показатели измерителя подтверждают такие наблюдения. Кроме того, оказывается, что у более старых собак в группах В и С после пребывания на рационах В и С в период испытания обнаруживается меньше внешних признаков локального воспаления суставов. Кроме того, оказывается, что собаки испытывают меньше боли при физическом движении и более подвижны, чем прежде. Можно сделать вывод, что рационы В и С обеспечивают ослабление в отношении некоторых признаков старения и улучшают подвижность у более старых собак. Пример 14. Сухой корм для кошек. Получают кормовую смесь, содержащую до примерно 58 мас.% кукурузы, примерно 6 мас.% кукурузного глютена, примерно 23 мас. % куриной муки и остальное составляют соли, витамины и минеральные вещества. Кормовую смесь загружают в аппарат для предварительного кондиционирования и увлажняют. Затем такую увлажненную кормовую смесь загружают в варочный котел с экструдером и желатинизируют. Желатинизированную основу, выходящую из экструдера, проталкивают через головку и эктрудируют. Экструдат нарезают на кусочки, подходящие для кормления кошек, сушат при примерно 110 С в течение примерно 20 мин и охлаждают, и получают гранулы. В этот момент для применения к гранулам подготавливают порошок из одного или нескольких штаммов вида Lactobacillus Lactobacillus rhamnosusSF68 (NICMB 10415). Порошка подготавливают достаточно для потребления его кошкой в количестве примерно 107-109 КОЕ/день. Часть порошка смешивают с первой массой гранул и упаковывают в мешки. Другую часть порошка определяют и смешивают с жидким носителем, который затем разбрызгивают по второй массе гранул. Гранулы упаковывают в мешки после того, как покрытие высохнет в достаточной степени при 50-60 С в течение нескольких минут. Пример 15. Консервированный корм для домашних животных и добавка. Получают смесь из 73% тушек домашней птицы, свиного легкого и коровьей печени (измельченной), 16% пшеничной муки, 2% красителей, витаминов и неорганических солей. Полученную смесь эмульгируют при 12 С и экструдируют в форме густой каши, которую затем пропаривают при температуре 90 С. Ее охлаждают до 30 С и нарезают на куски. Такие куски (45%) смешивают с 55% заливки,полученной из 98% воды, 1% красителя и 1% гуаровой камеди. Смесью заполняют банки из белой жести и стерилизуют при 125 С в течение 40 мин. В качестве пробиотической добавки, смешиваемой с кормом для домашних животных перед подачей, поставляют дополнительные упаковки в форме пакетиков со штаммами видов Lactobacillus Lactobacillus rhamnosus NCC2583 (CNCM I-2449), Lactobacillus acidophilusNCC2628 (CNCM I-2453) или Enterococcus faecium SF68 (NICMB 10415). Соответствующее количество для домашнего животного составляет примерно 106-1012 КОЕ/день, в зависимости от того, кошка это или собака, и физических факторов, таких как масса тела. Это предоставляется в виде приложения, которое можно отсоединить от банки, вместе с инструкциями по кормлению. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2581 (CNCM 1-2448),обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 2. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2592 (CNCM 1-2450),обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 3. Выделенный штамм молочно-кислых бактерий Lactobacillus rhamnosus NCC 2583 (CNCM 12449), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 4. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2603 (CNCM 1-2451),обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 5. Выделенный штамм молочно-кислых бактерий Lactobacillus reuteri NCC 2613 (CNCM 1-2452),обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 6. Выделенный штамм молочно-кислых бактерий Lactobacillus acidophilus NCC 2628 (CNCM 12453), обладающий высокой пробиотической активностью в организме домашнего животного, способный выживать в желудочно-кишечном тракте домашнего животного и колонизировать его. 7. Выделенный штамм по любому из пп.1-6, обладающий способностью к росту с продуцированием по меньшей мере 106 КОЕ/мл в присутствии до 2% солей жлчных кислот. 8. Выделенный штамм по любому из пп.1-7, обладающий способностью продуцировать по меньшей мере 106 КОЕ/мл в течение примерно 2 ч при рН примерно от 3,4 до 4,2. 9. Применение выделенного штамма молочно-кислых бактерий по любому из пп.1-6, и/или супернатанта его культуры, и/или его фракции для получения композиции, предназначенной для поддержания или улучшения здоровья домашнего животного. 10. Применение по п.9, согласно которому при введении указанной композиции в организм животного штамм образует примерно от 104 до 1012 КОЕ/животное в день. 11. Применение по любому из пп.9 и 10 для получения композиции, предназначенной для лечения и/или профилактики расстройств, связанных с колонизацией желудочно-кишечного тракта домашнего животного патогенными микроорганизмами. 12. Применение по любому из пп.9-11 для получения композиции, предназначенной для регуляции функционирования иммунной системы домашнего животного. 13. Применение по любому из пп.9-11 для получения композиции, предназначенной для поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния. 14. Применение по любому из пп.9-11 для получения композиции, предназначенной для облегчения или ослабления эффектов старения у домашнего животного. 15. Кормовая композиция для домашних животных, содержащая по меньшей мере один выделенный штамм молочно-кислых бактерий по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой. 16. Кормовая композиция для домашних животных, предназначенная для подержания здорового состояния желудочно-кишечного тракта домашнего животного или улучшения состояния желудочнокишечного тракта, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой. 17. Кормовая композиция для домашних животных, предназначенная для поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой. 18. Кормовая композиция для домашних животных, предназначенная для регуляции функционирования иммунной системы домашнего животного, содержащая по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой. 19. Кормовая композиция для домашних животных, предназначенная для облегчения или ослабления эффектов старения у домашнего животного, содержащая по меньшей мере один выделенный штамм- 20006428 по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию, в сочетании с пищевой основой или фармацевтической основой. 20. Кормовая композиция по любому из пп.15-19, при введении которой в организм животного штамм образует примерно от 104 до 1012 КОЕ/животное в день. 21. Кормовая композиция по любому из пп.15-19, дополнительно содержащая пребиотик. 22. Кормовая композиция по любому из пп.15-21, изготовленная в виде порошкообразной, сухой или влажной, замороженной или устойчивой при хранении форме. 23. Кормовая композиция по любому из пп.15-21, представляющая собой добавку или дополнение к корму. 24. Кормовая композиция по п.23, поставляемая вместе с кормом для домашнего животного в дополнительной упаковке, такой как пакетик. 25. Способ поддержания здорового состояния желудочно-кишечного тракта домашнего животного или улучшения состояния желудочно-кишечного тракта, включающий стадию кормления домашнего животного кормовой композицией по п.16. 26. Способ поддержания здорового состояния кожи и/или шерсти домашнего животного или улучшения их состояния, включающий стадию кормления домашнего животного кормовой композицией для животных по п.17. 27. Способ регуляции функционирования иммунной системы домашнего животного, включающий стадию кормления домашнего животного кормовой композицией по п.18. 28. Способ облегчения или ослабления эффектов старения у домашнего животного, включающий стадию кормления домашнего животного кормовой композицией по п.19. 29. Способ лечения и/или профилактики расстройств, связанных с колонизацией желудочнокишечного тракта домашнего животного патогенными микроорганизмами, включающий стадию кормления домашнего животного кормовой композицией для домашних животных, содержащей по меньшей мере один выделенный штамм по любому из пп.1-6, и/или супернатант его культуры, и/или его фракцию. 30. Способ по п.29, в котором патогенными микроорганизмами являются штаммы Salmonella typhimurium, Escherichia coli, Shigella dysenteriaea или другие патогенные энтеробактерии, колонизирующие домашних животных, или паразиты, такие как гельминты Тохосаrа, простейшие Cryptosporidium, Giardia,Pentatrichomonas hominis, Entamoeba histolytica, Toxoplasma gondii или дрожжи.
МПК / Метки
МПК: C12N 1/20, A61K 35/74, A23K 1/00
Метки: применение, штаммы, бактерий, молочно-кислых
Код ссылки
<a href="https://eas.patents.su/23-6428-shtammy-molochno-kislyh-bakterijj-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Штаммы молочно-кислых бактерий и их применение</a>
Предыдущий патент: Способ получения 3, 5-дифторанилина
Следующий патент: Композиция для предупреждения или восстановления возрастных функциональных дефицитов у млекопитающих и способ ее применения
Случайный патент: Упаковка тонких слоев для остекления