Производные пирролидин-2-она и их применение при лечении остеопороза
Номер патента: 5293
Опубликовано: 30.12.2004
Авторы: Ки Хуажу, Лефкер Брюс Аллен, Томпсон Дейвид Дуэйн, Кэмерон Кимберли О'киф
Формула / Реферат
1. Способ лечения состояния, которое представлено низкой костной массой, у млекопитающего, при котором указанному млекопитающему вводят селективный агонист рецептора EP4, представляющий собой соединение формулы I

или фармацевтически приемлемую соль указанного соединения, где
Q представляет собой COOR3, CONHR4 или тетразол-5-ил;
A представляет собой простую или цис-двойную связь;
B представляет собой простую или транс-двойную связь;
=U представляет собой
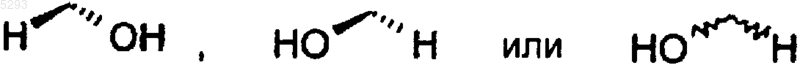
R2 представляет собой a-тиенил, фенил, фенокси, однозамещенный фенил или однозамещенный фенокси, причем указанные заместители представляют собой хлоро, фторо, фенил, метокси, трифторметил или (C1-C3)алкил;
R3 представляет собой водород, (C1-C5)алкил, фенил или парабифенил;
R4 представляет собой COR5 или SO2R5; и
R5 представляет собой фенил или (C1-C5)алкил;
или 7-{2R-[3-гидрокси-4-(3-феноксифенил)бут-1-енил]-5-оксопирролидин-1-ил}гептановую кислоту, или 7-{2S-[3-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-ил}гептановую кислоту.
2. Способ по п.1, где Q представляет собой 5-тетразолил и =U представляет собой

3. Способ по п.2, где указанное соединение формулы I представляет собой 5R-(3S-гидрокси-4-фенил-бут-1-енил)-1-[6-(1H-тетразол-5-ил)гексил]пирролидин-2-он, 5S-(3R-гидрокси-4-фенилбутил)-1-[6-(1H-тетразол-5-ил)гексил]пирролидин-2-он, 5S-(4-(3-хлорфенил)-3R-гидроксибутил)-1-(6-(2H-тетразол-5-ил)гексилпирролидин-2-он или 5S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-1-(6-(2H-тетразол-5-ил)гексил)пирролидин-2-он.
4. Способ по п.1, где Q представляет собой COOH и =U представляет собой
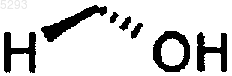
5. Способ по п.4, где указанное соединение представляет собой 7-(2S-(3R-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановую кислоту, 7-[2R-(3S-гидрокси-4-фенил-бут-1-енил)-5-оксопирролидин-1-ил]гептановую кислоту, 7-{2S-[3R-гидрокси-4-(3-трифторметоксифенил)бутил]-5-оксопирролидин-1-ил}гептановую кислоту, 7-{2S-[3R-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-ил}гептановую кислоту, 7-(2S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-5-оксопирролидин-1-ил)гептановую кислоту или 7-{2S-[4-(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-ил}гептановую кислоту.
6. Способ по любому из пп.1-5, где указанное состояние представляет собой остеопороз, хрупкость костей, остеопорозный перелом, дефект кости, детскую идиопатическую потерю кости, потерю альвеолярной кости, потерю нижнечелюстной кости, перелом кости, остеотомию, потерю кости, связанную с периодонтитом, или врастание протеза.
7. Способ по любому из пп.1-6, при котором указанную композицию вводят системно или местно.
8. Соединение, выбранное из 7-{2S-[3R-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-ил}гептановой кислоты; 7-(2S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-5-оксопирролидин-1-ил)гептановой кислоты; 7-{2S-[4-(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-ил}гептановой кислоты; 5S-[4-(3-хлорфенил)-3R-гидроксибутил]-1-[6-(2H-тетразол-5-ил)гексил]пирролидин-2-она и 5S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-1-(6-(2H-тетразол-5-ил)гексил)пирролидин-2-она.
9. Фармацевтическая композиция, содержащая соединение по п.8 и фармацевтически приемлемый разбавитель или носитель.
10. Применение соединения по п.8 в качестве лекарства.
Текст
1 Предшествующий уровень техники Данное изобретение относится к способам и фармацевтическим композициям, содержащим агонисты простагландина, которые являются полезными для предупреждения потери кости,восстановления или нарастания костной массы и для усиления заживления кости, включая лечение состояний, которые представлены низкой костной массой и/или дефектами костей у позвоночных, и в частности млекопитающих,включая людей. Данное изобретение конкретно относится к способам и фармацевтическим композициям, содержащим агонисты простагландина, селективные по отношению к рецептору ЕР 4. Остеопороз представляет собой системное заболевание скелета, характеризующееся низкой костной массой и разрушением костной ткани, с последующим увеличением хрупкости костей и подверженности перелому. В США это состояние поражает более чем 25 млн человек и вызывает более чем 1,3 млн переломов каждый год,включая 500000 переломов позвоночника,250000 переломов бедра и 240000 переломов запястья ежегодно. Переломы бедра представляют собой наиболее серьезное последствие остеопороза, причем 5-20% пациентов умирают в течение 1 года, и более 50% выживших пациентов становятся нетрудоспособными. Пожилые имеют наибольший риск остеопороза, и поэтому предсказывают, что эта проблема существенно возрастет со старением населения. Прогнозируют, что число случаев переломов по всему миру увеличится в 3 раза в течение ближайших 60 лет, а в одном исследовании оценили, что в 2050 году во всем мире будет 4,5 млн переломов бедра. Женщины имеют больший риск остеопороза, чем мужчины. Женщины испытывают резкое ускорение потери кости в течение 5 лет после менопаузы. Другие факторы, которые увеличивают риск, включают в себя курение, злоупотребление алкоголем, малоподвижный образ жизни и низкое потребление кальция. В настоящее время существует два основных типа фармацевтической терапии для лечения остеопороза. Первый представляет собой применение антирезорбтивных соединений для снижения резорбции костной ткани. Примером антирезорбтивного агента является эстроген. Известно, что эстроген снижает вероятность переломов. Кроме того, Black et al. в ЕР 0605193 А 1 сообщают, что эстроген, в частности, при пероральном приеме снижает уровни ЛПНП (липопротеинов низкой плотности) в плазме и повышает уровни полезных липопротеинов высокой плотности (ЛПВП). Однако эстроген не способствует обратному восстановлению кости до уровней молодого возраста в установившемся остеопорозном скелете. Кроме того, долговременная терапия эстрогеном влечет за собой различные расстройства,включая увеличение риска рака матки, рака эн 005293 2 дометрия и, возможно, рака молочной железы,что заставляет многих женщин избегать этого лечения. Значительные нежелательные эффекты, связанные с терапией эстрогеном, подтверждают необходимость в разработке альтернативных терапий для остеопороза, которые обладают желательным воздействием на сывороточные ЛПНП, но не вызывают нежелательных эффектов. Вторым типом фармацевтической терапии для лечения остеопороза является применение анаболических агентов для стимуляции остеогенеза и увеличения костной массы. Ожидают,что данный класс агентов восстанавливает кости установившегося остеопорозного скелета. Некоторые агонисты простагландинов раскрыты в GB 1478281, GB 1479156 и в патентах США 4175203, 4055596, 4175203, 3987091 и 3991106, как являющиеся полезными в качестве, например, почечных вазодилататоров. В патенте США 4033996 раскрыты некоторые 8-аза-9-оксо(и диоксо)-тиа-11,12-секопростагландины, которые являются полезными в качестве почечных вазодилататоров, для предупреждения тромбообразования, для индукции высвобождения гормона роста, а также в качестве регуляторов иммунного ответа. Во французском патенте 897566 раскрыты некоторые производные аминокислот для лечения неврологических, психических или сердечно-сосудистых заболеваний. В J. Org. Chem. 26; 1961; 1437 раскрыта Nацетил-N-бензилпарааминофенилмеркаптоуксусная кислота. В патенте США 4761430 раскрыты некоторые арилбензолсульфонамидные соединения в качестве липид-понижающих агентов. В патенте США 4443477 раскрыты некоторые сульфонамидофенилкарбоновые кислоты в качестве липид-понижающих агентов. В патенте США 3528961 раскрыты некоторые производные -капролактама в качестве красителей. В патенте США 3780095 раскрыты некоторые ацилированные анилинокарбоновые кислоты в качестве желчегонных средств. В патенте США 4243678 раскрыты некоторые ацилгидрокарбиламиноалкановые кислоты как обладающие пользой при лечении язв желудка, в качестве ингибиторов экскреции сальных желез, а также для борьбы с кожным воспалением. В патенте США 4386031 раскрыты некоторые N-бензоиланилиноалканкарбоновые кислоты в качестве противоаллергических агентов, ингибиторов тромботической агрегации,противовоспалительных агентов и липид-понижающих агентов. Кроме остеопороза, примерно 20-25 млн женщин и все возрастающее число мужчин страдают обнаружимыми переломами позво 3 ночника вследствие сниженной костной массы,и, кроме того, сообщают о 250000 переломов бедра ежегодно только в одной Америке. Последнее состояние связано с 12%-ной смертностью в течение первых 2 лет и с 30%-ной долей пациентов, нуждающихся в медицинском уходе на дому после перелома. Хотя уже это является значительным, ожидают, что экономические и медицинские последствия периода выздоровления вследствие медленного или неправильного заживления этих переломов костей будут возрастать вследствие старения населения в целом. Показано, что эстрогены (Bolander et al.,38th Annual Meeting Orthopedic Research Society,1992) улучшают качество заживления переломов конечностей. Следовательно, заместительная терапия эстрогеном должна быть эффективной в качестве способа лечения при репарации перелома. Однако согласие пациента при терапии эстрогеном является относительно низким вследствие его побочных эффектов, включая возобновление месячных, мастодинию, повышенный риск рака матки, осознаваемый повышенный риск рака молочной железы и сопутствующее применение прогестинов. Кроме того,мужчины склонны отказываться от применения лечения эстрогеном. Существует необходимость в терапии, которая была бы полезной для пациентов, страдающих изнуряющими переломами костей, и которая увеличила бы согласие пациента. Продемонстрировано, что простагландин Е 2 (PGE2) может восстанавливать потерянную костную массу в модели овариэктомированных крыс (OVX), модели постменопаузального остеопороза, Kе, H.Z. et al., Bone, 23: 249-255,1998. Однако имеются тяжелые побочные эффекты, связанные с PGE2, Jee, W.S.S. and Ma,Y.F., Bone, 21: 297-304, 1997. Хотя имеется множество терапий остеопороза, существует постоянная необходимость и проводятся постоянные исследования в данной области техники в отношении альтернативных терапий остеопороза. Кроме того, существует необходимость в терапиях, направленных на заживление переломов костей. Также существует необходимость в терапии, которая может стимулировать возобновление роста костей в областях скелета, где имеются дефекты, такие как дефекты, вызванные или индуцированные,например, опухолями кости. Кроме того, существует необходимость в терапии, которая может стимулировать возобновление роста кости в областях скелета, где показаны костные трансплантаты. Краткое изложение сущности изобретения Данное изобретение относится к способу лечения состояния, которое представлено низкой костной массой, у млекопитающего, при котором указанному млекопитающему вводят селективный агонист рецептора ЕР 4, представляющий собой соединение формулы I или фармацевтически приемлемую соль указанного соединения, гдеQ представляет собой COOR3, CONHR4 или тетразол-5-ил; А представляет собой простую или цисдвойную связь; В представляет собой простую или трансдвойную связь;R2 представляет собой -тиенил, фенил,фенокси, однозамещенный фенил или однозамещенный фенокси, причем указанные заместители представляют собой хлоро, фторо, фенил,метокси, трифторметил или (C1-С 3)алкил;R5 представляет собой фенил или (С 1-С 5) алкил; или 7-2R-[3-гидрокси-4-(3-феноксифенил)бут-1-енил]-5-оксопирролидин-1-илгептановую кислоту, или 7-2S-[3-гидрокси-4-(3-феноксифенил)бутил]-5-оксо-пирролидин-1-илгептановую кислоту. Предпочтительной группой селективных агонистов рецептора ЕР 4 формулы I для применения в способах по данному изобретению являются те соединения формулы I, где Q представляет собой 5-тетразолил и =U представляет собой с образованием соединений, имеющих формулу IA, Особенно предпочтительные соединения,входящие в эту группу, включают в себя 5R-(3Sгидрокси-4-фенил-бут-1-енил)-1-[6-(1 Н-тетразол 5-ил)гексил]пирролидин-2-он, 5S-(3R-гидрокси-4 фенилбутил)-1-[6-(1 Н-тетразол-5-ил)гексил]пирролидин-2-он, 5S-(4-(3-хлорфенил)-3R-гидроксибутил)-1-(6-(2 Н-тетразол-5-ил)гексилпирролидин 2-он или 5S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-1-(6-(2 Н-тетразол-5-ил)гексил)пирролидин-2-он. Другой предпочтительной группой селективных агонистов рецептора ЕР 4 формулы I для применения в способах по данному изобрете 5 нию являются те соединения формулы I, где Q представляет собой СООН и =U представляет собой Особенно предпочтительные соединения,входящие в данную группу, включают в себя 7(2S-(3R-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)-гептановую кислоту, 7-[2R-(3S-гидрокси-4-фенил-бут-1-енил)-5-оксопирролидин 1-ил]гептановую кислоту, 7-2S-[3R-гидрокси 4-(3-трифторметоксифенил)бутил]-5-оксопирролидин-1-илгептановую кислоту, 7-2S-[3R-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановую кислоту, 7-(2S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-5-оксопирролидин-1-ил)гептановую кислоту или 7-2S[4-(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановую кислоту. В частности, данное изобретение относится к таким способам, где указанное состояние представляет собой остеопороз, хрупкость костей, остеопорозный перелом, дефект кости, детскую идиопатическую потерю кости, потерю альвеолярной кости, потерю нижнечелюстной кости, перелом кости, остеотомию, потерю кости, связанную с периодонтитом, или врастание протеза. В предпочтительных способах по данному изобретению селективный агонист рецептора ЕР 4 вводят системно, например перорально,подкожно, внутримышечно или посредством аэрозоля. В других предпочтительных способах по данному изобретению агонист ЕР 4 вводят местно. Кроме того, данное изобретение относится к соединению, выбранному из 7-2S-[3R-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановой кислоты; 7-(2S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)-5-оксопирролидин-1-ил)гептановой кислоты; 7-2S-[4(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановой кислоты; 5S-[4-(3-хлорфенил)-3R-гидроксибутил]-1-[6-(2 Н-тетразол-5 ил)гексил]пирролидин-2-она и 5S-(3R-гидрокси 4-(3-трифторметилфенил)бутил)-1-(6-(2 Н-тетразол-5-ил)гексил)пирролидин-2-она. Данное изобретение также относится к фармацевтической композиции, содержащей указанное выше соединение и фармацевтически приемлемый разбавитель или носитель. Данное изобретение также относится к применению указанного выше соединения в качестве лекарства. Способы по данному изобретению являются особенно полезными, когда указанное состояние представляет собой хрупкость костей. Способы по данному изобретению также являются особенно полезными, когда указанное состояние представляет собой остеопороз. Способы по данному изобретению также являются особенно полезными, когда указанное 6 состояние представляет собой перелом кости или остеопорозный перелом. Предпочтительно лечат женщин после менопаузы и мужчин в возрасте старше 60 лет. Также предпочтительными являются индивидуумы независимо от возраста, которые имеют значительно сниженную костную массу, то есть более высокую, чем 1,5 стандартных отклонения,или равную 1,5 стандартным отклонениям ниже нормальных уровней для молодого возраста. В способах по данному изобретению состояния, которые представлены низкой костной массой, включают в себя такие состояния, как,например, остеопороз, детская идиопатическая потеря кости, потеря альвеолярной кости, потеря нижнечелюстной кости, перелом кости, остеотомия, потеря кости, связанная с периодонтитом, и врастание протеза. Способы лечения вторичного остеопороза также включены в способы по данному изобретению. Вторичный остеопороз включает в себя остеопороз, индуцированный глюкокортикоидами, остеопороз, индуцированный гипертиреозом, остеопороз, индуцированный иммобилизацией, остеопороз, индуцированный гепарином, и остеопороз, индуцированный иммуносупрессией, у позвоночного, например млекопитающего (включая человека). Эти способы осуществляютпосредством введения указанному позвоночному, например млекопитающему, количества агониста простагландина, селективного по отношению к рецептору ЕР 4, или фармацевтически приемлемой соли указанного агониста простагландина, селективного по отношению к рецептору ЕР 4, которое лечит вторичный остеопороз. Еще один аспект данного изобретения относится к способам укрепления костного трансплантата, включая позвоночный синостоз, усиление вытяжения длинной кости, усиление заживления кости после лицевой реконструкции,верхнечелюстной реконструкции и/или нижнечелюстной реконструкции у позвоночного, например у млекопитающего (включая человека),при котором указанному позвоночному, например млекопитающему, которое было подвергнуто лицевой реконструкции, верхнечелюстной реконструкции или нижнечелюстной реконструкции, вводят усиливающее кость количество агониста простагландина, селективного по отношению к рецептору ЕР 4, или фармацевтически приемлемой соли указанного агониста простагландина, селективного по отношению к рецептору ЕР 4. Активные агонисты простагландина, селективные по отношению к рецептору ЕР 4,по данному изобретению можно применять местно в участке реконструкции кости, либо их можно вводить системно. Предпочтительная дозировка составляет от примерно 0,001 до примерно 100 мг/кг/сутки селективных агонистов рецептора ЕР 4 либо фармацевтически приемлемой соли указанного 7 соединения. Особенно предпочтительная дозировка составляет от примерно 0,01 до примерно 10 мг/кг/сутки селективного агониста рецептора ЕР 4 или фармацевтически приемлемой соли указанного соединения. Выражение состояние(ия), которое(ые) представлено(ны) низкой костной массой относится к состоянию, при котором уровень костной массы является более низким, чем специфичный для данного возраста нормальный уровень, как определено в стандартах Всемирной Организации Здравоохранения Assessment ofHealth Organization Technical Series 843. Cостояние(ия), которое(ые) представлено(ны) низкой костной массой включают первичный и вторичный остеопороз, как описано выше. Включены также периодонтальное заболевание,потеря альвеолярной кости, постостеотомия и детская идиопатическая потеря кости. Выражение состояние(ия), которое(ые) представлено(ны) низкой костной массой также включает в себя длительные осложнения остеопороза,такие как искривление позвоночника, прекращение роста и операции протезирования. Выражение состояние(ия), которое(ые) представлено(ны) низкой костной массой также относится к позвоночному, например млекопитающему, о котором известно, что оно имеет значительно более высокую, чем средняя, вероятность развития таких заболеваний, как описано выше, включая остеопороз (например, женщины после менопаузы, мужчины в возрасте старше 50 лет). Другие применения наращивания или увеличения костной массы включают в себя восстановление кости, повышение скорости заживления перелома кости, заместительную хирургию костных трансплантатов в целом,увеличение доли успешных костных трансплантаций, заживление кости после лицевой реконструкции, либо верхнечелюстной реконструкции, либо нижнечелюстной реконструкции,врастание протеза, позвоночный синостоз или вытяжение длинной кости. Способы по данному изобретению можно также применять в сочетании с ортопедическими устройствами, такими как каркасы для сращения позвоночника, металлоконструкции для сращения позвоночника, устройства внутренней и внешней фиксации кости, винты и штифты. Специалистам в данной области техники будет понятно, что термин костная масса в действительности относится к костной массе на единицу площади, которую иногда (хотя это не строго корректно) называют минеральной костной плотностью. Термин лечение, лечить или терапия, как он использован здесь, включает в себя предупреждающую (например, профилактическую), паллиативную и лечебную терапию. 8 Под фармацевтически приемлемым подразумевают, что носитель, наполнитель, разбавитель, эксципиенты и/или соль должны быть совместимы с другими ингредиентами препарата и не являться вредными для его реципиента. Выражение фармацевтически приемлемая соль относится к нетоксичным анионным солям, содержащим анионы, таким как (но не ограниченным ими) хлорид, бромид, йодид, сульфат, бисульфат, фосфат, ацетат, малеат, фумарат, оксалат, лактат, тартрат, цитрат, глюконат,метансульфонат и 4-толуолсульфонат. Это выражение также относится к нетоксичным катионным солям, таким как (но не ограниченным ими) соли натрия, калия, кальция, магния, аммония или протонированного бензатина (N,N'дибензилэтилендиамина), холина, этаноламина,диэтаноламина, этилендиамина, мегламина (Nметилглюкамина), бенетамина (N-бензилфенетиламина), пиперазина или трометамина (2-амино-2-гидроксиметил-1,3-пропандиола). Результатом способов по данному изобретению является остеогенез, приводящий в результате к пониженной частоте переломов. Данное изобретение вносит значительный вклад в данную область техники благодаря разработке способов, которые усиливают остеогенез, приводящий в результате к предупреждению, замедлению и/или регрессии остеопороза и родственных костных расстройств. Другие признаки и преимущества будут понятны из описания и формулы изобретения, в которых описано данное изобретение. Подробное описание изобретения В качестве селективного агониста рецептора ЕР 4 по данному изобретению можно использовать любой селективный агонист рецептора ЕР 4. Селективными агонистами ЕР 4 являются соединения, которые имеют ИК 50 для рецепторов ЕР 1, ЕР 2 и ЕР 3, которая по меньшей мере в 10 раз выше, чем ИК 50 для рецептора подтипа ЕР 4. Например, 7-(2-(3-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановая кислота является агонистом PGE2, селективным по отношению к рецептору ЕР 4, имеющим ИК 50 связывания рецептора ЕР 4, составляющую 16 нМ. Для всех других подтипов рецептора ЕР, включая подтипы рецептора ЕР 1, ЕР 2 и ЕР 3, ИК 50 для 7-(2-(3-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановой кислоты выше, чем 3200 нМ. Соединения формулы I можно получить,как раскрыто в переуступленном должным образом патенте США 4177346, который включен в данное изобретение путем ссылки. Селективные агонисты рецептора ЕР 4, используемые в способах по данному изобретению, все являются адаптированными для терапевтического применения в качестве агентов,которые стимулируют остеогенез и увеличение костной массы у позвоночных, например млекопитающих, и в частности людей. Поскольку остеогенез тесно связан с развитием остеопоро 9 за и родственных костных расстройств, агонисты, используемые в способах по данному изобретению, благодаря их действию на кость предупреждают, останавливают остеопороз и/или приводят к регрессии остеопороза. Пригодность селективных агонистов ЕР 4,используемых в способах по настоящему изобретению в качестве лекарственных агентов при лечении состояний, которые представлены низкой костной массой (например, остеопороза), у позвоночных, например млекопитающих (особенно людей, и в частности женщин) доказана активностью этих агонистов в общепринятых анализах, включая анализ на связывание рецептора, анализ циклического АМФ, анализ in vivo и анализ заживления перелома, все из которых описаны ниже. Кроме того, такие анализы предоставляют методики, посредством которых активности селективных агонистов ЕР 4 можно сравнивать друг с другом и с активностями других известных соединений и композиций. Результаты этих сравнений являются полезными для определения уровней дозировки у позвоночных, например у млекопитающих, включая людей, для лечения таких заболеваний. Анализ in vivo Активность анаболических костных агентов в стимулировании остеогенеза и увеличении костной массы можно протестировать у интактных самцов или самок крыс, самцов крыс (подвергнутых орхидэктомии) или самок крыс (подвергнутых овариэктомии), с дефицитом половых гормонов. В данном исследовании можно использовать самцов или самок крыс различного возраста (как, например, в возрасте 3 месяца). Крысы являются либо интактными, либо кастрированными (овариэктомированными или орхидэктомированными), и им подкожно инъецируют или вводят через зонд агонисты простагландина в различных дозах (таких как 1, 3 или 10 мг/кг/ сутки) в течение 30 суток. У кастрированных крыс лечение начинают на следующие сутки после операции (с целью предупреждения потери кости) или в то время, когда потеря кости уже возникла (с целью восстановления костной массы). Во время исследования всем крысам дают свободный доступ к воде и гранулированному коммерческому корму (Teklad Rodent Diet 8064, Harlan Teklad, Madison, WI), содержащему 1,46% кальция, 0,99% фосфора и 4,96 ЕД/г витамина D3. Всем крысам делают подкожные инъекции 10 мг/кг кальцеина на 12-ые и 2-ые сутки перед умерщвлением. Крыс умерщвляют. Определяют следующие конечные параметры. Измерения минеральных элементов в бедренной кости. Правую бедренную кость от каждой крысы удаляют при аутопсии и сканируют, используя двухэнергетическую рентгеновскую абсорбциометрию (ДРА, QDR 1000/W, Hologic Inc.,Waltham, MA), оборудованную программным(Hologic Inc., Waltham, MA). Размер поля сканирования составляет 5,08 х 1,902 см, разрешение составляет 0,0254 х 0,0127 см, и скорость сканирования составляет 7,25 мм/с. Анализируют сканированные изображения бедренной кости и определяют площадь кости, содержание минеральных элементов в кости (ВМС) и минеральную костную плотность (BMD) целой бедренной кости (WF), дистальных бедренных метафизов (DFM), тела бедренной кости (FS) и проксимального отдела бедренной кости (PF). Гистоморфометрические анализы большеберцовой кости. Правую большеберцовую кость удаляют при аутопсии, освобождают от мышц и разрезают на три части. Проксимальный отдел большеберцовой кости и тело большеберцовой кости фиксируют в 70%-ном этаноле, обезвоживают при градуированных концентрациях этанола,обезжиривают в ацетоне, затем заключают в метилметакрилат (Eastman Organic Chemicals,Rochester, NY). Фронтальные срезы метафизов проксимального отдела большеберцовой кости с толщиной 4 и 10 мкм нарезают, используя микротом Reichert-Jung Polycut S. Срезы толщиной 4 мкм окрашивают модифицированным красителем трихромом Массона (Masson's Trichrome),тогда как срезы толщиной 10 мкм оставляют неокрашенными. Один срез 4 мкм и один срез 10 мкм от каждой крысы используют для гистоморфометрии губчатого вещества кости. Поперечные срезы тела большеберцовой кости с толщиной 10 мкм нарезают, используя микротом Reichert-Jung Polycut S. Эти срезы используют для гистоморфометрического анализа кортикального слоя кости. Гистоморфометрия губчатого вещества кости. Систему гистоморфометрии Bioquant OS/2(RM Biometrics, Inc., Nashville, TN) используют для статических и динамических гистоморфометрических измерений вторичной спонгиозы метафизов проксимального отдела большеберцовой кости между 1,2 и 3,6 мм дистально к ростовому эпифизарно-пластинчатому соединению. Первые 1,2 мм метафизарного участка большеберцовой кости необходимо исключить,чтобы ограничить измерения вторичной спонгиозой. Срезы толщиной 4 мкм используют для определения показателей, относящихся к объему кости, структуре кости и резорбции кости,тогда как срезы толщиной 10 мкм используют для определения показателей, относящихся к остеогенезу и обновлению кости.(I) Измерения и расчеты, относящиеся к объему и структуре губчатой кости:(1) Суммарная метафизарная площадь (TV, мм 2): метафизарная площадь между 1,2 и 3,6 мм дистально к ростовому эпифизарно-пластинчатому соединению. (2) Площадь губчатой кости (BV, мм 2): 11 суммарная площадь трабекул в пределах TV.(3) Периметр губчатой кости (BS, мм): длина суммарного периметра трабекул. (4) Объем губчатой кости (BV/TV, %): BV/TVх 100. (5) Трабекулярное число кости (TBN, /мм): 1,199/2 хBS/TV.(6) Толщина губчатой кости (ТВТ, мкм):(2000/1,199)х(BV/BS). (7) Трабекулярное разделение кости (TBS, мкм): (2000 х 1,199)х(TV-BV).(II) Измерения и расчеты, относящиеся к резорбции кости: (1) Число остеокластов (OCN,): суммарное число остеокластов в пределах суммарной метафизарной площади. (2) Периметр остеокластов (ОСР, мм): длина трабекулярного периметра, покрытого остеокластами.(III) Измерения и расчеты, относящиеся к остеогенезу и обновлению кости: (1) Периметр одинарного мечения кальцеиновой меткой (SLS,мм): суммарная длина трабекулярного периметра,меченного одной кальцеиновой меткой. (2) Периметр двойного мечения кальцеиновой меткой(DLS, мм): суммарная длина трабекулярного периметра, меченного двумя кальцеиновыми метками. (3) Ширина между метками (ILW, мкм): среднее расстояние между двумя кальцеиновыми метками. (4) Периметр минерализации в процентах (PMS, %): (SLS/2+DLS)/BSх 100. (5) Скорость минеральной аппозиции (MAR, мкм/сутки):(SLS/2+DLS)xMAR/BS. (7) Скорость обновления кости (BTR, %/у): (SLS/2+DLS)xMAR/BVх 100. Гистоморфометрия кортикального слоя кости. Для статических и динамических гистоморфометрических измерений кортикального слоя кости тела большеберцовой кости используют систему гистоморфометрии Bioquant OS/2(RM Biometrics, Inc., Nashville, TN). Измеряют суммарную площадь ткани, площадь костномозговой полости, периостальный периметр, эндокортикальный периметр, периметр одинарного мечения, периметр двойного мечения и ширину между метками как на периостальной, так и на эндокортикальной поверхности, и рассчитывают площадь кортикального слоя кости (суммарная площадь ткани - площадь костно-мозговой полости), площадь кортикального слоя кости в процентах (площадь кортикального слоя кости/суммарная площадь ткани х 100), площадь костномозговой полости в процентах (площадь костномозговой полости/суммарная площадь ткани х 100), периостальный и эндокортикальный периметр мечения в процентах [(периметр одинарного мечения/2+периметр двойного мечения)/суммарный периметр х 100], скорость минеральной аппозиции (ширина между метками/интервалы) и скорость остеогенеза [скорость минеральной аппозиции х [(периметр одинарно 005293 12 го мечения/2+периметр двойного мечения)/суммарный периметр]. Статистические расчеты. Статистику можно вычислить, используя пакеты программ StatView 4.0 (Abacus Concepts,Inc., Berkeley, CA). Для сравнения различий между группами используют тест дисперсионного анализа (ANOVA), а затем критерий ФишераBonita Ave, Berkeley, CA 94704-1014). Определение повышения уровня цАМФ в клеточных линиях 293-S со стабильной сверхэкспрессией рекомбинантных рецепторов ЕР 4 человека. кДНК, представляющие полноразмерные открытые рамки считывания рецепторов ЕР 4 человека, получают путем обратно-транскриптазной полимеразной цепной реакции, используя олигонуклеотидные праймеры на основе опубликованных последовательностей (1) и РНК из первичных легочных клеток человека(ЕР 4) в качестве матриц. кДНК клонируют во множественный сайт клонирования pcDNA3Blvd., San Diego, CA 92121) и используют для трансфекции эмбриональных почечных клеток человека 293-S посредством кальций-фосфатной копреципитации. Колонии, устойчивые к G418,выращивают и тестируют на специфичное связывание [3H]PGE2. Трансфектанты, демонстрирующие высокие уровни специфичного связывания [ЗH]PGE2, дополнительно характеризуют с помощью анализа Скэтчарда (Scatchard), чтобы определить Вmах и Kd для PGE2. Линии, отобранные для скрининга соединений, имеют примерно 256400 рецепторов на клетку иKd=2,9 нМ для PGE2 (EP4). Конститутивная экспрессия рецептора в родительских клетках 293-S является незначительной. Клетки поддерживают в среде RPMI с добавлением фетальной телячьей сыворотки (конечная концентрация 10%) иG418 (конечная концентрация 700 мкг/мл). цАМФ-ответы в линиях 293-S/EP4 определяют с помощью отделения клеток от культуральных колб в 1 мл забуференного фосфатом физиологического раствора (PBS) с дефицитом Са и Мg, посредством энергичного встряхивания, добавления свободной от сывороткиRPMI до конечной концентрации 1 х 106 клеток/мл и добавления 3-изобутил-1-метилксантина (IBMX) до конечной концентрации 1 мМ. 1 мл клеточной суспензии немедленно делят на аликвоты в индивидуальные микроцентрифужные пробирки с завинчивающимися крышками объемом 2 мл и инкубируют в течение 10 мин без крышек при 37 С, 5% СО 2, относительной влажности 95%. Тестируемое соединение затем добавляют к клеткам в разведениях 1:100, так чтобы конечные концентрации ДМСО или этанола составляли 1%. Немедленно после добавления соединения пробирки закрывают крышками,перемешивают переворачиванием 2 раза и ин 13 кубируют при 37 С в течение 12 мин. Затем образцы подвергают лизису путем инкубации при 100 С в течение 10 мин и немедленно охлаждают на льду в течение 5 мин. Клеточный дебрис осаждают путем центрифугирования при 1000 хg в течение 5 мин и очищенные лизаты переносят в свежие пробирки. Концентрации цАМФ определяют, используя имеющийся в продаже набор для радиоиммунологического анализа цАМФRIA (NEK-033, DuPont/NEN Research Products,549 Albany St., Boston, MA 02118), после разведения очищенных лизатов 1:10 в буфере для анализа цАМФ RIA (включенном в набор). Обычно клетки обрабатывают 6-8 концентрациями соединения, которое нужно тестировать,при приращениях 1 log. Расчеты ЕС 50 осуществляют на калькуляторе, используя анализ линейной регрессии на линейных участках кривых доза-ответ. Ссылки 1. Regan, J.W. Bailey, T.J. Pepperl, D.J.Defined ЕР 2 Subtype. Mol. Pharmacology 46: 213220. Анализ на связывание с рецепторами простагландина Е 2. Препарат мембран. Все операции проводят при 4 С. Трансфицированные клетки, экспрессирующие рецепторы простагландина Е 2 типа 1 (EP1), типа 2 (ЕР 2),типа 3 (ЕР 3) или рецепторы типа 4 (ЕР 4), собирают и суспендируют до 2 млн клеток на мл в буфере А [50 мМ Трис-НСl (рН 7,4), 10 мМ(Boehringer Mannheim Corp., Indianapolis, IN), 10 мкМ пептида фосфорамидон (Sigma, St. Louis,МО), 1 мкМ пептида пепстатин A (Sigma, St.(Sigma, St. Louis, МО), 100 мкМ пептида антипаин (Sigma, St. Louis, МО)]. Клетки подвергают лизису путем обработки ультразвуком с помощью Branson Sonifier (модель 250, Branson Ultrasonics Corporation, Danbury, CT) в двух вспышках по 15 с. Не подвергшиеся лизису клетки и дебрис удаляют путем центрифугирования при 100 хg в течение 10 мин. Затем мембраны собирают путем центрифугирования при 45000 хg в течение 30 мин. Осажденные мембраны ресуспендируют до 3-10 г белка на мл буфера А, причем концентрацию белка определяют способом Брэдфорда [Bradford, М., Anal.Biochem., 72, 248 (1976)]. Ресуспендированные мембраны хранят замороженными при -80 С до использования. Анализ на связывание. Замороженные мембраны, полученные как описано выше, подвергают оттаиванию и разбавляют до 0,5 мг/мл (для ЕР 2 крысы) или 0,3 мг/мл (для ЕР 4 крысы) в описанном выше буфе 005293 14 ре А. Один объем препарата мембран объединяют с 0,05 объема тестируемого соединения или буфера и одним объемом 3 нМ 3Hпростагландина E2 (TRK 431, Amersham, Arlington Heights, IL) в буфере А. Эту смесь (суммарный объем 205 мкл) инкубируют в течение 1 ч при 25 С. Затем мембраны выделяют путем фильтрования через фильтры из стекловолокна типа GF/C (1205-401, Wallac, Gaithersburg,MD), используя сборник Tomtec (модель MachII/96, Tomtec, Orange, CT). Мембраны со связанным 3H-простагландином E2 улавливаются фильтром, тогда как буфер и несвязанный 3Hпростагландин E2 проходит через фильтр в отходы. Затем каждый образец промывают 3 раза по 3 мл 50 мМ Трис-НСl (рН 7,4), 10 мМMgCl2, 1 мМ ЭДТА. Затем фильтры высушивают путем нагревания в микроволновой печи. Чтобы определить количество 3H-простагландина, связанного с мембранами, высушенные фильтры помещают в пластиковые пакеты со сцинтилляционной жидкостью и считают на считывающем устройстве LKB 1205 Betaplate(Wallac, Gaithersburg, MD). ИК 50 определяют на основании концентрации тестируемого соединения, необходимой для замещения 50% специфично связанного 3H-простагландина E2. Клетки 293S, экспрессирующие рецепторы либо ЕР 2, либо ЕР 4 простагландина Е 2 крысы,получают согласно способам, известным специалистам в данной области техники. Типично праймеры ПЦР (полимеразной цепной реакции),соответствующие 5'- и 3'-концам опубликованного полноразмерного рецептора, получают согласно хорошо известным способам, раскрытым выше, и их применяют в обратнотранскриптазной полимеразной цепной реакции(ОТ-ПЦР), используя суммарную РНК из почек крысы для обоих рецепторов ЕР 2 и ЕР 4. Полноразмерную кодирующую последовательность для рецептора ЕР 2 крысы получают,как раскрыто в Nemoto et al., Prostaglandins,1997, 54, 713-725. Полноразмерную кодирующую последовательность для рецептора ЕР 4 крысы получают, как раскрыто в Sando et al.,Biochem. Biophys. Res. Comm., 1994, 200, 13291333. Эти полноразмерные рецепторы используют для получения клеток 293S, экспрессирующих рецепторы ЕР 2 и ЕР 4. Полноразмерную кодирующую последовательность для рецептора EP1 получают, как раскрыто в Funk et al., Journal of Biological Chemistry, 1993, 268, 26767-26772. Полноразмерную кодирующую последовательность для рецептора ЕР 2 получают, как раскрыто в Regan et al.,Molecular Pharmacology, 1994, 46, 213-220. Полноразмерную кодирующую последовательность для рецептора ЕР 3 получают, как раскрыто вRegan et al., British Journal of Pharmacology,1994, 112, 377-385. Полноразмерную кодирующую последовательность для рецептора ЕР 4 получают, как раскрыто в Bastien, Journal ofBiological Chemistry, 1994, 269, 11873-11877. Эти полноразмерные рецепторы используют для получения клеток 293S, экспрессирующих рецепторы EP1, ЕР 2, ЕР 3 и ЕР 4. Клетки 293S, экспрессирующие рецепторы простагландина Е 2 человека, либо EP1, либо ЕР 2,либо ЕР 3, либо ЕР 4, получают согласно способам, известным специалистам в данной области техники. Типично праймеры ПЦР (полимеразной цепной реакции), соответствующие 5'- и 3'концам опубликованного полноразмерного рецептора, получают согласно хорошо известным способам, раскрытым выше, и их применяют в реакции ОТ-ПЦР, используя суммарную РНК из почек человека (для EP1), легких человека (для ЕР 2), легких человека (для ЕР 3) или лимфоцитов человека (для ЕР 4) в качестве источника. Продукты ПЦР клонируют перекрывающимся способом ТА в pCR2.1 (Invitrogen, Carlsbad, CA) и идентичность клонированного рецептора подтверждают секвенированием ДНК. Клетки 293S (Mayo, Dept. Of Biochemistry,Northwestern Univ.) трансфицируют клонированным рецептором в pcDNA3 путем электропорации. Стабильные клеточные линии, экспрессирующие рецептор, устанавливают после отбора трансфицированных клеток G418. Клональные клеточные линии, экспрессирующие максимальное число рецепторов, выбирают согласно анализу на связывание 3H-PGE2 целыми клетками, используя немеченый PGE2 в качестве конкурента. Анализы заживления перелома Анализ на эффекты по заживлению перелома после системного введения Методика перелома. Крыс Sprague-Dawley в возрасте 3 месяца анестезируют кетамином. Делают надрез 1 см на переднемедиальной стороне проксимального участка большеберцовой кости или бедра. Ниже описана методика операции на большеберцовой кости. Надрез проводят до кости и просверливают отверстие 1 мм на расстоянии 4 мм проксимально к дистальной стороне бугристости большеберцовой кости и 2 мм медиально к переднему гребню. Интрамедуллярный внутрикостный остеосинтез проводят с помощью трубки 0,8 мм из нержавеющей стали (максимальная нагрузка 36,3 N, максимальный коэффициент упругости 61,8 N/мм, тестированные в таких же условиях, как в костях). Расширение медуллярного канала не проводят. Стандартизованный закрытый перелом производят на 2 мм выше соединения большеберцовой и малоберцовой костей путем сгибания в трех точках, используя специально сконструированные регулируемые щипцы с тупоконечными зажимами. Для минимизирования повреждения мягкой ткани соблюдают осторожность, чтобы не сместить перелом. Кожу соединяют однонитчатыми нейлоновыми швами. Операцию проводят в стерильных условиях. Радиографии всех переломов снимают 16 немедленно после внутрикостного остеосинтеза и крыс с переломами вне пределов определенной диафизарной области или со смещенными остеосинтезами исключают. Оставшихся животных делят случайным образом на следующие группы по 10-12 животных на каждую подгруппу на момент времени для тестирования заживления перелома. Первая группа получает ежесуточно через зонд носитель (вода:100% этанол=95:5) в дозе 1 мл/крысу, тогда как другие получают ежесуточно через зонд от 0,01 до 100 мг/кг/сутки тестируемого соединения (1 мл/крысу), в течение 10, 20, 40 и 80 суток. На 10-е, 20-е, 40-е и 80-е сутки 10-12 крыс из каждой группы анестезируют кетамином и умерщвляют кровопусканием. Обе большеберцовые-малоберцовые кости извлекают путем рассечения и снимают все мягкие ткани. Кости от 5-6 крыс на каждую группу хранят в 70%-ном этаноле для гистологического анализа, а кости от других 5-6 крыс на каждую группу хранят в забуференном растворе Рингера (+4 С, рН 7,4) для проведения радиографии и биомеханического тестирования, которое осуществляют. Гистологический анализ. Способы гистологического анализа сломанной кости опубликованы ранее Mosekilde andHealing in Rats: A Histological Description. Bone,14:19-27, 1993). В кратком изложении, место перелома отпиливают на 8 мм в каждую сторону от линии перелома, заключают без декальцификации в метилметакрилат и нарезают фронтальные срезы на микротоме Reichert-Jung Polycut с толщиной 8 мкм. Среднефронтальные срезы,окрашенные трихромом Массона (включая как большеберцовую, так и малоберцовую кости),используют для визуализации клеточного и тканевого ответа на заживление перелома при лечении и без него. Срезы, окрашенные красителем Сириус красный (Sirius red), используют для демонстрации характеристик структуры костной мозоли и для различия между тканевидной костью и пластинчатой костью в месте перелома. Проводят следующие измерения: (1) щель перелома - измеряют как кратчайшее расстояние между концами кортикального слоя кости в переломе; (2) длина костной мозоли и диаметр костной мозоли; (3) суммарный объем кости области костной мозоли; (4) костная ткань на площадь ткани внутри области костной мозоли; (5) фиброзная ткань в костной мозоли и(6) площадь хряща в костной мозоли. Биомеханический анализ. Способы биомеханического анализа опубликованы ранее Bak и Andreassen (The Effects ofInt 45: 292-297, 1989). В кратком изложении,радиографии всех переломов снимают перед биомеханическим тестом. Механические свойства заживающих переломов анализируют с помощью методики деструктивного трех- или 17 четырехточечного сгибания. Определяют максимальную нагрузку, жесткость, усилие при максимальной нагрузке, деформацию при максимальной нагрузке и максимальное напряжение. Анализ на эффекты по заживлению перелома после местного введения Методика перелома. В данном исследовании используют самок или самцов гончих собак в возрасте примерно 2 года, под анестезией. Поперечные радиальные переломы производят путем медленной непрерывной нагрузки при сгибании в трех точках, как описано Lenehan et al. (Lenehan, T.M.; Balligand,M.; Nunamaker, D.M.; Wood, F.E.: Effects ofEHDP on Fracture Healing in Dogs. J. Orthop. Res. 3:499-507; 1985). Через место перелома протягивают проволоку, чтобы гарантировать полное анатомическое расхождение кости. После этого локальной доставки агонистов простагландина в место перелома достигают посредством медленного высвобождения соединения, доставляемого с помощью гранул медленного высвобождения или путем введения соединений в подходящем препарате, таком как паста, гель,раствор или суспензия, в течение 10, 15 или 20 недель. Гистологический анализ. Способы гистологического анализа сломанной кости опубликованы ранее Peter et al.in Rats: A Histological Description. Bone, 14:1927, 1993). В кратком изложении, после умерщвления место перелома отпиливают на 3 см в каждую сторону от линии перелома, заключают без декальцификации в метилметакрилат и нарезают на микротоме Reichert-Jung Polycut с толщиной фронтальных срезов 8 мкм. Среднефронтальные срезы, окрашенные трихромом Массона (включая как большеберцовую, так и малоберцовую кости), используют для визуализации клеточного и тканевого ответа на заживление перелома при лечении и без него. Срезы,окрашенные Сириус красным, используют для демонстрации характеристик структуры костной мозоли и для различия между тканевидной костью и пластинчатой костью в месте перелома. Проводят следующие измерения: (1) щель перелома - измеряют как кратчайшее расстояние между концами кортикального слоя кости в переломе; (2) длина костной мозоли и диаметр костной мозоли; (3) суммарный объем кости области костной мозоли; (4) костная ткань на площадь ткани внутри области костной мозоли; 18 Способы биомеханического анализа опубликованы ранее Bak и Andreassen (The Effects ofDogs. J. Orthop. Res. 14:74-70, 1996). В кратком изложении, радиографии всех переломов снимают перед биомеханическим тестом. Механические свойства заживающих переломов анализируют с помощью методик деструктивного трех- или четырехточечного сгибания. Определяют максимальную нагрузку, жесткость, усилие при максимальной нагрузке, деформацию при максимальной нагрузке и максимальное напряжение. Введение селективных агонистов рецептора ЕР 4 согласно способам по данному изобретению можно осуществлять любым методом, который доставляет селективный агонист рецептора ЕР 4 системно и/или местно (то есть в место перелома кости, остеотомии или ортопедической операции). Эти способы включают в себя пероральные пути, парентеральные, интрадуоденальные пути и так далее. Как правило, соединения по данному изобретению вводят перорально, но можно использовать парентеральное введение (например, внутривенное, внутримышечное, чрескожное, подкожное, ректальное или интрамедуллярное), например, если пероральное введение является не подходящим для мишени или если пациент не способен глотать лекарство. Способы по данному изобретению используют для лечения и ускорения заживления переломов костей и остеотомии посредством местного применения (например, в местах переломов костей или остеотомии) селективных агонистов рецептора ЕР 4. Селективные агонисты рецептора ЕР 4 по данному изобретению применяют в местах переломов костей или остеотомии, например, либо путем инъекции соединения в подходящем растворителе (например,масляном растворителе, таком как арахисовое масло) в пластинку роста хряща, либо, в случаях открытых операций, путем местного нанесения в них соединения в подходящем наполнителе,носителе или разбавителе, таком как костный воск, деминерализованный костный порошок,полимерные костные цементы, костные пломбировочные материалы и так далее. Альтернативно, местное применение может быть достигнуто посредством нанесения раствора или дисперсии соединения в подходящем носителе или разбавителе на поверхность твердых или полутвердых имплантатов или включения в твердые или полутвердые имплантаты, традиционно применяемые в ортопедической хирургии, такие как дакроновая сетка, гель-пена и кость kiel,либо протезы. 19 В любом случае, количество и время введения соединений будут, несомненно, зависеть от субъекта, которого лечат, от тяжести болезни, от способа введения и от мнения лечащего врача. Таким образом, вследствие вариабельности от пациента к пациенту, указанные в описании изобретения дозировки являются руководством, а врач может титровать дозы лекарственного соединения для достижения лечения (например, нарастания костной массы), которые этот врач считает подходящими для пациента. С учетом степени желаемого лечения врач должен сопоставить ряд факторов, таких как исходный уровень костной массы, возраст пациента, наличие прежде существовавшего заболевания, а также наличие других заболеваний (например,сердечно-сосудистого заболевания). Как правило, используют такое количество селективного агониста рецептора ЕР 4, которое является достаточным для нарастания костной массы до уровня, который находится выше порогового значения перелома кости (как подробно описано в Исследовании Всемирной Организации Здравоохранения, цитируемом выше в данном описании). Соединения, представляющие собой селективные агонисты рецептора ЕР 4, используемые в способах по данному изобретению, как правило, вводят в форме фармацевтической композиции, содержащей по меньшей мере одно из соединений по данному изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Таким образом, селективный агонист рецептора ЕР 4 можно вводить индивидуально в любой традиционной пероральной, интраназальной, парентеральной, ректальной или чрескожной лекарственной форме. Для перорального введения фармацевтическая композиция может принимать форму растворов, суспензий, таблеток, пилюль, капсул,порошков и тому подобного. Таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и фосфат кальция,применяют вместе с различными разрыхлителями, такими как крахмал и, предпочтительно,картофельный или маниоковый крахмал, и некоторые комплексные силикаты, вместе со связывающими агентами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто являются очень полезными для целей таблетирования. Твердые композиции подобного типа применяют также в качестве наполнителей в мягких и твердых заполненных желатиновых капсулах; предпочтительные материалы в этой связи также включают в себя лактозу или молочный сахар, а также полиэтиленгликоли высокой молекулярной массы. Когда для перорального введения желательны водные суспензии и/или эликсиры, композиции по данному изобретению можно комбинировать 20 с различными подслащивающими агентами,корригирующими агентами, красящими агентами, эмульгирующими агентами и/или суспендирующими агентами, а также с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные подобные их комбинации. Для целей парентерального введения можно применять растворы в кунжутном или арахисовом масле либо в водном пропиленгликоле, а также стерильные водные растворы соответствующих водорастворимых солей. Такие водные растворы можно соответствующим образом забуферить, если необходимо, а жидкий разбавитель сначала сделать изотоническим достаточным количеством физиологического раствора или глюкозы. Эти водные растворы являются особенно подходящими для целей внутривенных, внутримышечных, подкожных и внутрибрюшинных инъекций. В этой связи все применяемые стерильные водные среды можно легко получить с помощью стандартных методик, хорошо известных специалистам в данной области техники. Для целей чрескожного (например, местного) введения изготавливают разбавленные стерильные водные или частично водные растворы (обычно в концентрации примерно от 0,1 до 5%), то есть подобные описанным выше парентеральным растворам. Способы изготовления различных фармацевтических композиций с определенным количеством активного ингредиента известны специалистам в данной области техники или будут понятны им в свете данного описания. Для примеров способов изготовления фармацевтических композиций см. Remington's PharmaceuticalSciences, Mack Publishing Company, Easton, Pa.,19th Edition (1995). Протокол исследования Целью данного исследования является определение того, может ли селективный агонист рецептора ЕР 4, и конкретно 7-(2-(3-гидрокси-4 фенилбутил)-5-оксопирролидин-1-ил)гептановая кислота, восстанавливать костную массу в модели OVX крыс. Самок крыс Sprague-Dawley подвергали овариэктомии (OVX) в возрасте 3,5 месяца. Через 10 месяцев после OVX этим крысам делали подкожную инъекцию носителя или 7-(2-(3 гидрокси-4-фенилбутил)-5-оксопирролидин-1 ил)гептановой кислоты в дозе 30 мг/кг/сутки в течение 28 сут. Этих крыс подвергали аутопсии. Правую бедренную кость от каждой крысы удаляли при аутопсии и сканировали, используя двухэнергетическую рентгеновскую абсорбциометрию (DEXA, QDR 1000/W, Hologic Inc.,Waltham, MA), оборудованную программным обеспечением Regional High Resolution Scan(Hologic Inc., Waltham, MA). Размер поля сканирования составлял 5,08 х 1,902 см, разрешение составляло 0,0254 х 0,0127 см, и скорость сканирования составляла 7,25 мм/с. Анализировали 21 сканированные изображения бедренной кости. Определяли содержание минеральных элементов в кости (ВМС) и минеральную костную плотность (BMD) целой бедренной кости (WF),дистальных бедренных метафизов (DFM) и тела бедренной кости (FS) согласно способу, описанному в H.Z. Ke et al., Droloxifene, a New Estrogen Antagonist/Agonist, Prevents Bone Loss inOvariectomized Rats. ENDOCRINOLOGY 136: 2435-2441, 1995. Результаты исследования и обсуждение По сравнению с OVX крысами, которым вводили носитель, OVX крысы, которых лечили 7-(2-(3-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановой кислотой, проявляли суммарное значение ВМС бедренной кости, увеличенное на 17%, суммарное значение BMD бедренной кости, увеличенное на 13%, значение ВМС дистальной бедренной кости, увеличенное на 8%, значение BMD дистальной бедренной кости, увеличенное на 8%, значение ВМС тела бедренной кости, увеличенное на 20%, и значение BMD тела бедренной кости, увеличенное на 18%. У крыс, которых лечили 7-(2-(3-гидрокси 4-фенилбутил)-5-оксопирролидин-1-ил)гептановой кислотой, не наблюдали никаких РGЕ 2 подобных побочных эффектов. Эти данные показывают, что 7-(2-(3-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановая кислота, представляющая собой селективный PGE2 агонист рецептора ЕР 4, стимулирует остеогенез и восстанавливает кость у OVX крыс со стабильно нарушенным остеогенезом. Общие экспериментальные методики ЯМР-спектры регистрировали на спектрометре Varian Unity 400 (Varian Co., Palo Alto,California) при температуре примерно 23 С при 400 МГц для протонных ядер. Химические сдвиги выражены в долях на миллион. Формы пиков обозначены следующим образом: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; bs=шиpoкий синглет. Масс-спектры химической ионизации при атмосферном давлении(APCI, atmospheric pressure chemical ionization) получили на спектрометре Fisons Platform II. При описании интенсивности хлор- или бромсодержащих ионов наблюдали ожидаемое отношение интенсивности (примерно 3:1 для 35Cl/37Cl-содержащих ионов и 1:1 для 79 Вr/81 Вrсодержащих ионов), и дана интенсивность только иона более низкой массы. Хроматографию среднего давления проводили, используя систему очистки Biotage (Biotage,Dyax Corporation, Charlottesville, Virginia) под давлением азота. Флэш-хроматографию проводили либо с силикагелем Baker (40 m) (J.T.(ЕМ Sciences, Gibbstown, N.J.) в стеклянных колоннах при низком давлении азота. Радиальную хроматографию проводили, используя(20 х 20 см) (Analtech, Inc., Newark, DE). Диметилформамид (ДМФ), тетрагидрофуран (ТГФ) и дихлорметан (СН 2 Сl2), используемые в качестве растворителей реакционной смеси, были безводными по степени чистоты, поставляемыеAldrich Chemical Company (Milwaukee, Wisconsin). Термин концентрировали относится к удалению растворителя при давлении водного аспиратора на роторном испарителе. Сокращение ч ставят для обозначения времени. Термин ТБАФ относится к тетрабутиламмония фториду. Термин ДМАП относится к диметил аминопиридину. Термины дихлорметан и метиленхлорид являются синонимами, и их используют взаимозаменяемо на протяжении всего описания, а также в примерах и подготовительных примерах. Пример 1. 7-2S-[4-(3-Хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановая кислота.(2,66 г, 9,63 ммоль) в ТГФ (35 мл) при 0 С добавляли порциями NaH (60% мас./мас. в масле,426 мг, 10,7 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 40 мин. Эту реакционную смесь охлаждали до 0 С, и добавляли раствор 7-(2R-формил-5-оксопирролидин-1-ил)гептановой кислоты этилового эфира (предположительно 10,6 ммоль,получен согласно способу, описанному в подготовительном примере 7, но с использованием других количеств реагентов) в ТГФ, и эту реакционную смесь перемешивали в течение 18 ч. Добавляли АсОН и эту реакционную смесь разбавляли ЕtOАс. Органический раствор промывали последовательно насыщенным растворомNaHCO3 (2x), водой (1 х) и рассолом (1 х). Органический раствор высушивали (МgSO4), фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления, элюируя 15%-ным ацетоном в толуоле с получением 7-2R-[4-(3-хлорфенил)-3-оксо-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этилового эфира (2,26 г). 1 23 Стадия Б. 7-2R-[4-(3-Хлорфенил)-3S-гидрокси-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир. К раствору 7-2R-[4-(3-хлорфенил)-3-оксобут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этилового эфира (2,1 г, 5,0 ммоль) в безводном CH2Cl2 (200 мл) добавляли (R)-2 метил-СВS-оксазаборолидин (1 М в толуоле, 5 мл,5 ммоль) и этот раствор охлаждали до -45 С. Эту реакционную смесь перемешивали в течение 20 мин и добавляли катехолборан (1 М в ТГФ, 15 мл, 15 ммоль). Эту реакционную смесь перемешивали в течение 18 ч при -45 С. Добавляли водную HCl (1 н., 100 мл) и эту реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Кислотный водный слой отделяли и органический раствор промывали охлажденным на льду 1 н. NaOH (2x), затем рассолом (1 х). Органический раствор высушивали(MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 1:1 ЕtOАс:гексаны до 80% ЕtOАс в гексанах) получили 7-2R-[4-(3 хлорфенил)-3S-гидрокси-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (800 мг) в виде смеси 3S:3R диастереомеров спирта в соотношении примерно 6:1 по 1H ЯМР. 1(m, 13H); МС 422,3 (М+1). Стадия В. 7-2S-[4-(3-Хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир. К раствору 7-2R-[4-(3-хлорфенил)-3Sгидрокси-бут-1-енил]-5-оксопирролидин-1-ил гептановой кислоты этилового эфира (800 мг,1,90 ммоль) в ЕtOН (50 мл) добавляли 10%-ный палладий на углероде (80 мг). Эту реакционную смесь гидрогенировали на встряхивателе Парра при 310,26 кПа (45 фунт/кв.дюйм) в течение 4,5 ч. Катализатор удаляли фильтрованием через Celite с помощью ЕtOН. С помощью очистки путем хроматографии среднего давления (от 1:1 ЕtOАс:гексаны до 4:1 ЕtOАс/гексаны) получили 7-2S-[4-(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (625 мг). 1(m, 1 Н), 4,10 (m, 2H), 3,84 (m, 1H), 3,61 (m, 2H),2,90 (m, 1H), 2,78 (dd, 1H), 2,68 (m, 1H), 2,472,25 (m, 4H), 2,12 (m, 1H), 1,92-1,22 (m, 17H); МС 424,3 (М+1). Стадия Г. 7-2S-[4-(3-Хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановая кислота. К раствору 7-2S-[4-(3-хлорфенил)-3Rгидроксибутил]-5-оксопирролидин-1-илгептановой кислоты этилового эфира (595 мг, 1,40 ммоль) в ЕtOН (25 мл) добавляли 2 н. NaOH (6 мл). 24 Эту реакционную смесь перемешивали в течение 24 ч при комнатной температуре и концентрировали в вакууме до примерно 3/4 исходного объема. Добавляли водную 1 н. HCl до получения рН примерно 2. Этот водный раствор промывали метиленхлоридом (3 х). Объединенные органические слои промывали водой, затем рассолом. Органический раствор высушивали Стадия А. 7-2-Оксо-5R-[3-оксо-4-(3-трифторметилфенил)-бут-1-енил]пирролидин-1-ил гептановой кислоты этиловый эфир. Следуя методике, описанной для примера 1, стадия А, анион, полученный из [2-оксо-3-(3 трифторметилфенил)пропил]фосфоновой кислоты диметилового эфира (4,16 г, 13,40 ммоль) иNaH (60%-ный в масле, 590 мг, 14,7 ммоль),подвергали взаимодействию с 7-(2R-формил-5 оксопирролидин-1-ил)гептановой кислоты этиловым эфиром (предположительно 14,74 ммоль) в течение 24 ч. С помощью очистки путем хроматографии среднего давления (градиент растворителя от 20% EtOAc в гексанах до EtOAc) получили 7-2-оксо-5R-[3-оксо-4-(3-трифторметилфенил)-бут-1-енил]пирролидин-1-илгептановой кислоты этиловый эфир (4,29 г). 1(М+1), 452,2 (М-1). Стадия Б. 7-2R-[3S-Гидрокси-4-(3-трифторметилфенил)-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир. К раствору 7-2-оксо-5R-[3-оксо-4-(3 трифторметилфенил)-бут-1-енил]пирролидин-1 илгептановой кислоты этилового эфира (1,5 г,3,31 ммоль) и (R)-2-метил-СВS-оксазаборолидина (1 М в толуоле, 0,5 мл, 0,5 ммоль) в CH2Cl2(100 мл) при -45 С добавляли по каплям катехолборан (1 М в ТГФ, 9,9 мл, 9,9 ммоль). Этот раствор перемешивали в течение 24 ч при -45 С и добавляли 1 н. HCl. Эту реакционную смесь перемешивали при комнатной температуре в течение 1 ч и разделяли слои. Водный раствор промывали CH2Cl2 (2x) и объединенные органи 25 ческие слои промывали последовательно охлажденным на льду 0,5 н. NaOH и рассолом (2 раза). Органический раствор высушивали (МgSO4),фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 50% EtOAc в гексанах, до 60% EtOAc в гексанах, до 80% EtOAc в гексанах, до EtOAc,до 5% МеОН в CH2Cl2) получили 7-2R-[3S-гидрокси-4-(3-трифторметилфенил)-бут-1-енил]-5 оксопирролидин-1-илгептановой кислоты этиловый эфир (1,23 г) в виде смеси 3S:3R диастереомеров спирта в соотношении примерно 5,5:1 по ВЭЖХ-анализу. 1(dd, 1H), 5,50 (dd, 1H), 4,44 (m, 1H), 4,09 (q, 2H),4,01 (m, 1H), 3,44 (m, 1 Н), 2,90 (d, 2H), 2,71 (m,1 Н), 2,37-2,12 (m, 5H), 1,70-1,21 (m, 13H); МС 456,3 (М+1), 454,3 (М-1). Стадия В. 7-2S-[3R-Гидрокси-4-(3-трифторметилфенил)бутил]-5-оксопирролидин-1 илгептановой кислоты этиловый эфир. Следуя методике, описанной для примера 1, стадия В, раствор 7-2R-[3S-гидрокси-4-(3 трифторметилфенил)-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этилового эфира (1,18 г, 2,59 ммоль) в ЕtOН (50 мл) гидрогенировали в присутствии 10%-ного палладия на углероде (120 мг) при 275,79-310,26 кПа (40-45 фунт/кв.дюйм) на встряхивателе Парра в течение 24 ч. С помощью очистки путем хроматографии среднего давления (от 50% ЕtOАс в гексанах, до ЕtOАс, до 1% МеОН в CH2Cl2, до 3% МеОН в CH2Cl2, до 5% МеОН в CH2Cl2, до 10% МеОН в CH2Cl2) получили 7-2S-[3R-гидрокси 4-(3-трифторметилфенил)бутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир(q, 2H), 3,86 (m, 1H), 3,60 (m, 2H), 2,89 (m, 2H),2,76 (m, 1H), 2,33 (m, 4H), 2,11 (m, 1H), 1,80 (m,1H), 1,68-1,21 (m, 16H). Стадия Г. 7-2S-[3R-Гидрокси-4-(3-трифторметилфенил)бутил]-5-оксопирролидин-1 илгептановая кислота. Следуя методике, описанной для примера 1, стадия Г, 7-2S-[3R-гидрокси-4-(3-трифторметилфенил)бутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (1,93 г, 4,22 ммоль) подвергали гидролизу 6 н. NaOH (26 мл) в ЕtOН (52 мл) в течение 24 ч. С помощью очистки путем хроматографии среднего давления(16 мл) добавляли NаНСО 3 (325 мг, 3,87 ммоль) в воде (3 мл). Эту реакционную смесь перемешивали в течение 5 ч и концентрировали в вакууме. Остаток подвергали азеотропной перегонке с CH2Cl2 (3 х) с получением натриевой соли соединения, указанного в заголовке примера 2 (1,698 г). 1 Стадия А. 7-2R-[4-(3-Хлорфенил)-3-оксобут-1-енил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 1, стадия А, анион, полученный из [3-(3-хлорфенил)-2-оксопропил]фосфоновой кислоты диметилового эфира (3,35 г, 12,12 ммоль) и NaH(60%-ный в масле, 533 мг, 13,3 ммоль), подвергали взаимодействию с 7-(2R-формил-5-оксопирролидин-1-ил)гептаннитрилом (предположительно 13,3 ммоль) в течение 18 ч. С помощью очистки путем хроматографии среднего давления(m, 4H), 1,24 (m, 2H). Стадия Б. 7-2S-[4-(3-Хлорфенил)-3-оксобутил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 1, стадия В, 7-2R-[4-(3-хлорфенил)-3-оксо-бут 1-енил]-5-оксопирролидин-1-илгептаннитрил(860 мг, 2,31 ммоль) в МеОН (40 мл) гидрогенировали в присутствии 10%-ного палладия на углероде (86 мг) в течение 1 ч. С помощью очистки путем радиальной хроматографии (от гексанов до 20% ЕtOАс в гексанах, до 70% ЕtOАс в гексанах) получили 7-2S-[4-(3-хлорфенил)-3 оксобутил]-5-оксопирролидин-1-илгептаннитрил (730 мг). Стадия В. 7-2S-[4-(3-Хлорфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил.(730 мг, 1,87 ммоль) в МеОН (30 мл) при 0 С добавляли NaBH4 (35 мг, 0,921 ммоль). Эту реакционную смесь перемешивали при 0 С в течение 45 мин и добавляли воду. Летучие вещества удаляли в вакууме и остаточный водный раствор разбавляли метиленхлоридом. Органический раствор промывали водой, затем рассолом, высушивали (MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:EtOAc до ЕtOАс, до 3% МеОН в CH2Cl2) получили 7-2S-[4-(3-хлорфенил)-3-гидроксибутил]5-оксопирролидин-1-илгептаннитрил (730 мг). 1(96 мг, 3,87 ммоль) в толуоле (30 мл) нагревали с обратным холодильником в течение 18 ч. Летучие вещества удаляли в вакууме и остаток разбавляли CH2Cl2. Органический раствор промывали 1 н. HCl, затем рассолом. Органический раствор высушивали (МgSО 4), фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления, элюируя от ЕtOАс до 2% МеОН в CH2Cl2, до 7% МеОН вCH2Cl2 с получением TMS-комплекса. Этот остаток разбавляли МеОН, и добавляли 2 н. HCl, и этот раствор перемешивали в течение 40 мин. Этот раствор разбавляли CH2Cl2 и органический слой промывали водой, затем рассолом. Органический раствор высушивали (MgSO4), фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления, элюируя от ЕtOАс до 7% МеОН в CH2Cl2 с получением 5S-[4-(3-хлорфенил)-3-гидроксибутил]-1[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-она 28 Стадия А. 7-2-Оксо-5R-[3-оксо-4-(3-трифторметилфенил)-бут-1-енил]пирролидин-1-ил гептаннитрил. Следуя методике, описанной для примера 1, стадия А, анион, полученный из [2-оксо-3-(3 трифторметилфенил)пропил]фосфоновой кислоты диметилового эфира (2,68 г, 8,64 ммоль) иNaH (60%-ный в масле, 400 мг, 10 ммоль), подвергали взаимодействию с 7-(2R-формил-5-оксопирролидин-1-ил)гептаннитрилом (предположительно 10 ммоль) в течение 18 ч. С помощью очистки путем хроматографии среднего давления (от 30% ЕtOАс в гексанах до 80% ЕtOАс в гексанах) получили 7-2-оксо-5R-[3-оксо-4-(3 трифторметилфенил)-бут-1-енил]пирролидин-1 илгептаннитрил (1,2 г). 1-45 С добавляли по каплям катехолборан (1 М в ТГФ, 8,4 мл, 8,4 ммоль). Эту реакционную смесь перемешивали при -45 С в течение 18 ч и добавляли 1 н. HCl. Эту реакционную смесь перемешивали при комнатной температуре в течение 40 мин и разделяли слои. Органический раствор промывали холодным 1 н. NaOH (3 раза). Органический раствор промывали последовательно 1 н. HCl, водой и рассолом. Органический раствор высушивали (МgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до 80% ЕtOАс в гексанах) получили 7-2R-[3S-гидрокси-4-(3-трифторметилфенил)-бут-1-енил]-5-оксопирролидин-1-илгептаннитрил (820 мг) в виде 3S:3R диастереомеров спирта в соотношении примерно 2,5:1 по 1H ЯМР. 1(m, 2H); МС 409,2 (М+1). Стадия В. 7-2S-[3R-Гидрокси-4-(3-трифтopмeтилфeнил)бутил]-5-окcoпирролидин-1-ил гептаннитрил. Следуя методике, описанной для примера 1, стадия В, 7-2R-[3S-гидрокси-4-(3-трифторметилфенил)-бут-1-енил]-5-оксопирролидин-1 илгептаннитрил (810 мг) в МеОН (40 мл) гидрогенировали в присутствии 10%-ного палладия на углероде (100 мг) при 344,74 кПа (50 фунт/ 29 кв.дюйм) в течение 18 ч на встряхивателе Парра. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до ЕtOАс, до 3% МеОН в CH2Cl2) получили 7-2S[3R-гидрокси-4-(3-трифторметилфенил)бутил]5-оксопирролидин-1-илгептаннитрил (720 мг). 1(m, 4H), 2,11 (m, 1H), 1,78 (m, 1H), 1,65-1,37 (m,11 Н), 1,30 (m, 2H); МС 411,2 (М+1). Стадия Г. 5S-[3R-Гидрокси-4-(3-трифторметилфенил)бутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-он. Следуя методике, описанной для примера 3, стадия Г, 7-2S-[3R-гидрокси-4-(3-трифторметилфенил)бутил]-5-оксопирролидин-1-илгептаннитрил (710 мг, 1,73 ммоль) подвергали взаимодействию с азидотриметилсиланом (399 мг,3,46 ммоль) и дибутилоловооксидом (43 мг, 1,7 ммоль) в толуоле (25 мл), нагревали с обратным холодильником в течение 18 ч. Летучие вещества удаляли в вакууме и остаток разбавлялиCH2Cl2. Органический раствор промывали 1 нHCl (2 раза), водой (1 раз) и рассолом (1 раз). Органический раствор высушивали (MgSO4),фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления,элюируя от ЕtOАс до 2% МеОН в CH2Cl2, до 8% МеОН в CH2Cl2, с получением 5S-[3R-гидрокси 4-(3-трифторметилфенил)бутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-она (450 мг). 1H ЯМР (CDCl3)7,44 (m, 4H), 3,87 (m,1H), 3,65 (m, 1H), 3,50 (m, 1H), 3,01-2,73 (m, 5H),2,42 (m, 2H), 2,16 (m, 1H), 1,86-1,23 (m, 14H); МС 454,4 (М+1), 452,4 (М-1). Стадия Д. Натриевая соль 5S-[3Rгидрокси-4-(3-трифторметилфенил)бутил]-1-[6(2 Н-тетразол-5-ил)гексил]пирролидин-2-он. Следуя методике, описанной для примера 2, стадия Д, 5S-[3R-гидрокси-4-(3-трифторметилфенил)бутил]-1-[6-(2 Н-тетразол-5-ил)гексил] пирролидин-2-он (428 мг, 0,944 ммоль) обрабатывают NaHCO3 (79 мг, 0,94 ммоль) с получением натриевой соли. 1NaH (60% мас./мас. в масле, 16 мг, 0,41 ммоль) в ДМФ (10 мл). Через 1,5 ч добавляли 7-бромгептаннитрил (78 мг, 0,41 ммоль) в ДМФ (5 мл) и эту реакционную смесь перемешивали при 90 С в течение 2,5 ч. Добавляли воду (20 мл) и водный раствор промывали ЕtOАс (4 х 15 мл). Объединенные органические растворы промывали водой (2 х 15 мл), высушивали (МgSO4),фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления(m, 2H), 2,29 (m, 4H), 2,06 (m, 1H), 1,74-1,23 (m,13H), 0,85 (s, 9H), 0,04 (m, 3 Н), 0,19 (m, 3H); MC 475,1 (М+1). Стадия Б. 7-2-[4-(4-Фторфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил. К раствору 7-2-[3-(трет-бутилдиметилсиланилокси)-4-(4-фторфенил)бутил]-5-оксопирролидин-1-илгептаннитрила (158 мг, 0,333 ммоль) в ТГФ (20 мл) при 0 С добавляли ТБАФ (1 М в ТГФ, 0,50 мл, 0,50 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 3 ч и добавляли насыщенный водный NaHCО 3. Летучие вещества удаляли в вакууме. Остаточный водный раствор промывалиCH2Cl2 (4 х 5 мл) и объединенные органические растворы высушивали (МgSО 4), фильтровали и концентрировали. Остаток очищали путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до ЕtOАс) с получением 7-[2-[4-(4 фторфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрила (82 мг). 1(m, 1H), 2,64 (m, 1H), 2,34 (m, 4H), 2,12 (m, 1H),1,68-1,24 (m, 14H); МС 361,2 (М+1). Стадия В. 5-[4-(4-Фторфенил)-3-гидроксибутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-он. Следуя методике, описанной для примера 3, стадия Г, 7-2-[4-(4-фторфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил(71 мг, 0,197 ммоль) подвергали взаимодействию с азидотриметилсиланом (45 мг, 0,394 ммоль) и дибутилоловооксидом (5 мг, 0,02 ммоль) в толуоле (10 мл), нагревали с обратным холодильником в течение 16 ч. Добавляли дополнительные количества азидотриметилсилана (200 мг) и дибутилоловооксида (50 мг) и эту реакционную смесь нагревали с обратным холодильником в течение 5 ч. Эту реакционную смесь подкисляли 1 н. HCl до рН=2 (5 мл) и водный раствор промывали ЕtOАс (4 х 10 мл). Объединенные органические растворы высушивали (МgSO4),фильтровали и концентрировали. С помощью 31 очистки путем хроматографии среднего давления (от ЕtOАс до 39:1 ЕtOАс:МеОН, до 19:1 ЕtOАс:МеОН) получили соединение, указанное в заголовке примера 5 А (39 мг). 1 Стадия А. 7-2-[4-Бифенил-3-ил-3-(третбутилдиметилсиланилокси)бутил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 5, стадия А, анион, полученный из 5-[4-(бифенил-3-ил-3-(трет-бутилдиметилсиланилокси) бутил]пирролидин-2-она (239,1 мг, 0,564 ммоль) и NaHMDS (1 М в ТГФ, 0,67 мл, 0,67 ммоль),алкилировали 7-бромгептаннитрилом (118 мг,0,620 ммоль) при 70 С в течение 24 ч. С помощью очистки путем хроматографии среднего давления (от СН 2 Сl2 до 1% МеОН в CH2Cl2, до 2% МеОН в CH2Cl2, до 4% МеОН в СH2 Сl2) получили 7-2-[(4-бифенил-3-ил-3-(трет-бутилдиметилсиланилокси)бутил]-5-оксопирролидин-1 илгептаннитрил (187 мг). МС 533,3 (М+1). Стадия Б. 7-[2-(4-Бифенил-3-ил-3-гидроксибутил)-5-оксопирролидин-1-ил]гептаннитрил. Следуя методике, описанной для примера 5, стадия Б, 7-2-[4-бифенил-3-ил-3-(трет-бутилдиметилсиланилокси)бутил]-5-оксопирролидин 1-илгептаннитрил (187 мг, 0,351 ммоль) подвергали удалению защиты с помощью ТБАФ (1 М в ТГФ, 0,53 мл, 0,53 ммоль). Добавление проводили при 0 С и эту реакционную смесь перемешивали при комнатной температуре в течение 24 ч. С помощью очистки путем хроматографии среднего давления (от CH2Cl2 до 1% МеОН в(m, 4H), 2,14 (m, 1H), 1,73-1,25 (m, 14 Н). Стадия В. 5-(4-Бифенил-3-ил-3-гидроксибутил)-1-[6-(2 Н-тетразол-5-ил)-гексил]пирролидин-2-он. Следуя методике, описанной для примера 3, стадия Г, 7-[2-(4-бифенил-3-ил-3-гидроксибутил)-5-оксопирролидин-1-ил]гептаннитрил (109 мг, 0,260 ммоль) подвергали взаимодействию с азидотриметилсиланом (0,69 мл, 0,52 ммоль) и 32 дибутилоловооксидом (11 мг, 0,044 ммоль) в толуоле (5,3 мл), нагревали с обратным холодильником в течение 72 ч. Эту реакционную смесь охлаждали и добавляли воду. Эту смесь подкисляли 1 н. HCl до рН=2 (5 мл) и водный раствор промывали 5% МеОН в СН 2 Сl2 (3 раза). Объединенные органические растворы высушивали (МgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:EtOAc до ЕtOАс, до 2% МеОН в CH2Cl2, до 4% МеОН в Стадия А. 7-2-[3-(трет-Бутилдиметилсиланилокси)-4-(3-фторфенил)бутил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 5, стадия А, анион, полученный из 5-[3-(третбутилдиметилсиланилокси)-4-(3-фторфенил)бутил]пирролидин-2-она (250 мг, 0,684 ммоль) иNaHMDS (1 М в ТГФ, 0,80 мл, 0,80 ммоль), алкилировали 7-бромгептаннитрилом (142 мг,0,748 ммоль) при 70 С в течение 72 ч. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до EtOAc, до 5% МеОН в СH2 Сl2) получили 7-2-[3-(трет-бутилдиметилсиланилокси)-4-(3-фторфенил)бутил]-5 оксопирролидин-1-илгептаннитрил (261,7 мг). 1(m, 2H), 2,36 (m, 4H), 2,11 (m, 1H), 1,72-1,26 (m,13H), 0,89 (s, 9H), 0,09 (s, 6H); МС 475,3 (М+1). Стадия Б. 7-2-[4-(3-Фторфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 5, стадия Б, 7-2-[3-(трет-бутилдиметилсиланилокси)-4-(3-фторфенил)бутил]-5-оксопирролидин 1-илгептаннитрил (261,7 мг, 0,551 ммоль) подвергали удалению защиты с помощью ТБАФ (1 М в ТГФ, 0,83 мл, 0,83 ммоль). Добавление проводили при 0 С и эту реакционную смесь перемешивали при комнатной температуре в течение 24 ч. С помощью очистки путем хроматографии среднего давления (от CH2Cl2 до 1% МеОН в(m, 14H); МС 361,3 (М+1). Стадия В. 5-[4-(3-Фторфенил)-3-гидроксибутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-он. Следуя методике, описанной для примера 6, стадия В, 7-2-[4-(3-фторфенил)-3-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил(141,3 мг, 0,392 ммоль) подвергали взаимодействию с азидотриметилсиланом (0,210 мл, 1,57 ммоль) и дибутилоловооксидом (29 мг, 0,116 ммоль) в толуоле (8 мл), нагревали с обратным холодильником в течение 72 ч. С помощью очистки путем хроматографии среднего давления-45 С добавляли (R)-2-метил-СВS-оксазаборолидин (1 М в толуоле, 1,3 мл, 1,3 ммоль). После перемешивания в течение 20 мин добавляли по каплям катехолборан (1 М в ТГФ, 13 мл, 13 ммоль). Эту реакционную смесь перемешивали при-45 С в течение 16 ч и добавляли 1 н. HCl. Эту реакционную смесь нагревали до комнатной температуры и разделяли слои. Органический раствор промывали холодным 1 н. NaOH (3 раза). Органический раствор промывали последовательно 1 н. HCl, водой и рассолом. Органический раствор высушивали (МgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до 20% МеОН в CH2Cl2) получили 7-2R-[3S-гидрокси-4-(3-хлорфенил)-бут 1-енил]-5-оксопирролидин-1-илгептаннитрил(М+1). Стадия Б. 7-2S-[4-(3-Хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептаннитрил. Следуя методике, описанной для примера 4, стадия В, 7-2R-[3S-гидрокси-4-(3-хлорфенил)бут-1-енил]-5-оксопирролидин-1-илгептаннитрил (536 мг) в ЕtOН (30 мл) гидрогенировали в присутствии 10%-ного палладия на углероде(60 мг) в течение 3,5 ч. С помощью очистки путем хроматографии среднего давления (от 1:1 гексаны:ЕtOАс до 20% МеОН в CH2Cl2) получили 7-2S-[4-(3-хлорфенил)-3R-гидроксибутил]5-оксопирролидин-1-илгептаннитрил (440 мг). 1(dd, 1H), 2,66 (dd, 1H), 2,39-2,29 (m, 4H), 2,11 (m,1H), 1,78 (m, 1H), 1,68-1,39 (m, 11H), 1,29 (m,2H); МС 377,2 (М+1). Стадия В. S-[4-(3-Хлорфенил)-3R-гидроксибутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-он. Следуя методике, описанной для примера 3, стадия Г, смесь 7-2S-[4-(3-хлорфенил)-3Rгидроксибутил]-5-оксо-пирролидин-1-илгептаннитрила (420 мг, 1,114 ммоль), триметилсилил азида (257 мг, 2,23 ммоль) и дибутилоловооксида (56 мг) в толуоле (30 мл), нагревали с обратным холодильником в течение 16 ч. Летучие вещества удаляли в вакууме и остаток растворяли в МеОН и перемешивали с 3 н. HCl в течение 3 ч. Эту реакционную смесь разбавляли водой иCH2Cl2 и разделяли слои. Органический слой промывали водой, затем рассолом. Органический раствор высушивали (MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления (от ЕtOАс до 2% МеОН в СН 2 Сl2, до 7% МеОН в СН 2 Сl2) получили 5S-[4-(3-хлорфенил)-3R-гидроксибутил]-1-[6-(2 Н-тетразол-5-ил)гексил]пирролидин-2-он (311 мг). 1 Стадия А. 7-2-Оксо-5R-[3-оксо-4-(3-феноксифенил)-бут-1-енил]-пирролидин-1-илгептановой кислоты этиловый эфир. Следуя методике, описанной для примера 1, стадия А, анион, полученный из [2-оксо-3-(3 феноксифенил)пропил]фосфоновой кислоты диметилового эфира (633 мг, 1,98 ммоль) и NaH(60%-ный в масле, 70 мг, 1,74 ммоль), подверга 35 ли взаимодействию с 7-(2R-формил-5-оксопирролидин-1-ил)гептановой кислоты этиловым эфиром (предположительно 1,58 ммоль) в течение 24 ч. С помощью очистки путем хроматографии среднего давления (ЕtOАс) получили 72-оксо-5R-[3-оксо-4-(3-феноксифенил)-бут-1 енил]пирролидин-1-илгептановой кислоты этиловый эфир (215 мг). 1(dd, 1H), 6,19 (d, 1H), 4,13 (m, 1H), 4,08 (q, 2H),3,79 (s, 2H), 3,51 (m, 1H), 2,68 (m, 1H), 2,35 (m,2H), 2,24 (m, 3H), 1,75 (m, 1H), 1,54 (m, 2H),1,43-1,20 (m, 9H). Стадия Б. 7-2R-[3-Гидрокси-4-(3-феноксифенил)-бут-1-енил]-5-оксопирролидин-1-ил гептановой кислоты этиловый эфир. Следуя методике, описанной для примера 3, стадия В, 7-2-оксо-5R-[3-оксо-4-(3-феноксифенил)-бут-1-енил]пирролидин-1-илгептановой кислоты этиловый эфир (215 мг, 0,451 ммоль) подвергали взаимодействию с NaBH4 (17 мг,0,45 ммоль) в ЕtOН (3 мл) при 0 С в течение 4 ч. С помощью очистки путем хроматографии среднего давления (ЕtOАс) получили 7-2R-[3 гидрокси-4-(3-феноксифенил)-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (167 мг). 1(m, 2H), 5,72 (m, 1H), 5,45 (m, 1H), 4,37 (m, 1H),4,10 (q, 2H), 3,47 (m, 1H), 2,82 (m, 3H), 2,35 (m,2H), 2,26 (t, 2H), 2,15 (m, 1H), 1,70-1,21 (m, 13H). Стадия В. 7-2R-[3-Гидрокси-4-(3-феноксифенил)-бут-1-енил]-5-оксопирролидин-1-ил гептановая кислота. Следуя методике, описанной для примера 1, стадия Г, 7-2R-[3-гидрокси-4-(3-феноксифенил)-бут-1-енил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (29 мг, 0,060 ммоль) подвергали гидролизу 2 M NaOH в ЕtOН (4,0 мл) при комнатной температуре в течение 24 ч с получением соединения, указанного в заголовке Стадия А. 7-2S-[3-Гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир. Следуя методике, описанной для примера 1, стадия В, смесь 7-2R-[3-гидрокси-4-(3-фе 005293 36 ноксифенил)бут-1-енил]-5-оксопирролидин-1-ил гептановой кислоты этилового эфира (139 мг,0,290 ммоль), МеОН (30 мл) и 10%-ного палладия на углероде (14 мг) гидрогенировали на встряхивателе Парра при 344,74 кПа (50 фунт/ кв.дюйм) в течение 18 ч. С помощью очистки путем хроматографии среднего давления (1:1 гексаны:ЕtOАс) получили 7-2S-[3-гидрокси-4(3-феноксифенил)бутил]-5-оксопирролидин-1 илгептановой кислоты этиловый эфир (86 мг). 1(m, 1H), 6,99 (m, 2 Н), 6,93 (m, 1H), 6,87 (m, 2H),4,09 (q, 2H), 3,80 (m, 1H), 3,58 (m, 2H), 2,82 (m,2H), 2,64 (m, 1H), 2,42-2,24 (m, 4H), 2,10 (m, 1H),1,77 (m, 1H), 1,66-1,21 (m, 16H). Стадия Б. 7-2S-[3-Гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановая кислота. Следуя методике, описанной для примера 1, стадия Г, 7-2S-[3-гидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановой кислоты этиловый эфир (86 мг, 1,79 ммоль) подвергали гидролизу 2 н. NaOH в МеОН (4 мл) в течение 18 ч с получением соединения, указанного в заголовке (62 мг). 1Asymmetry, 1996, 7, 2113) (20,00 г, 87,19 ммоль) в ДМФ (50 мл). Эту реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч и добавляли раствор 7-бромгептаннитрила (16,574 г, 87,19 ммоль) в ДМФ (50 мл). Эту реакционную смесь перемешивали при 90 С в течение 3 ч. Эту реакционную смесь охлаждали до комнатной температуры и добавляли воду(750 мл). Водный раствор промывали ЕtOАс(4 х 250 мл). Объединенные органические растворы промывали водой (2 х 250 мл), высушивали (MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, элюируя градиентом растворителей (от 9:1 гексаны:ЕtOАс до 7:3 гексаны: ЕtOАс, до 1:1 гексаны:ЕtOАс), получили 7-[2R(трет-бутилдиметилсиланилоксиметил)-5-оксопирролидин-1-ил]гептаннитрил (22,46 г). 1 Н ЯМР (CDCl3)3,69-3,55 (m, 4H), 2,99 37 Стадия Б. 7-(2R-Гидроксиметил-5-оксопирролидин-1-ил)гептаннитрил. Раствор тетрабутиламмония фторида (1 М в ТГФ, 100,0 мл, 100,0 ммоль) медленно добавляли к раствору 7-[2R-(трет-бутилдиметилсиланилоксиметил)-5-оксопирролидин-1-ил]гептаннитрила (22,39 г, 66,13 ммоль) в ТГФ (400 мл) при 0 С. Эту реакционную смесь нагревали до комнатной температуры и перемешивали в течение 4 ч. Добавляли насыщенный водный раствор NаНСО 3 (250 мл) и летучие вещества удаляли в вакууме. Остаточный водный раствор промывали СН 3 Сl (4 х 200 мл). Объединенные органические растворы высушивали (MgSO4),фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, элюируя градиентом растворителей (от 9:1 гексаны:ЕtOАс до 4:1 гексаны:ЕtOАс, до 7:3 гексаны:ЕtOАс, до 6:4 гексаны:ЕtOАс, до 1:1 гексаны:ЕtOАс, до ЕtOАс, до 9:1 ЕtOАс:МеОН),получили 7-(2R-гидроксиметил-5-оксопирролидин-1-ил)гептаннитрил (14,922 г). 1(m, 3H), 3,00 (m, 1H), 2,46 (m, 1H), 2,36-2,27 (m,3 Н), 2,08 (m, 1H), 1,93 (m, 1H), 1,77 (m, 1H),1,68-1,43 (m, 6H), 1,32 (m, 2 Н); МС 225,1 (М+1). Подготовительный пример 2. 7-(2R-Гидроксиметил-5-оксопирролидин-1-ил)гептановой кислоты этиловый эфир. Стадия А. 7-[2R-(трет-Бутилдиметилсиланилоксиметил)-5-оксопирролидин-1-ил]гептановой кислоты этиловый эфир. Следуя методике, описанной для подготовительного примера 1, стадия А, анион, полученный из 5R-(трет-бутилдиметилсиланилоксиметил)пирролидин-2-она (30,000 г, 130,8 ммоль) и NaH (60%-ный в масле, 5,756 г, 143,9 ммоль) в ДМФ (600 мл), подвергали взаимодействию с этил-7-бромгептаноатом (32,559 г, 137,3 ммоль) в течение 3 ч при 90 С. С помощью очистки путем хроматографии среднего давления, элюируя градиентом растворителей (от 9:1 гексаны:ЕtOАс до 4:1 гексаны:ЕtOАс, до 7:3 гексаны:ЕtOАс, до 6:4 гексаны:ЕtOАс), получили 7[2R-(трет-бутилдиметилсиланилоксиметил)-5 оксопирролидин-1-ил]гептановой кислоты этиловый эфир (39,46 г). 1(m, 1H), 1,81 (m, 1H), 1,65-1,26 (m, 8H), 1,23 (t,3 Н), 0,86 (s, 9H), 0,03 (s, 6 Н); МС 386,2 (М+1). Стадия Б. 7-(2R-Гидроксиметил-5-оксопирролидин-1-ил)гептановой кислоты этиловый эфир. Следуя методике, описанной для подготовительного примера 1, стадия Б, 7-[2R-(трет-бутилдиметилсиланилоксиметил)-5-оксопирролидин-1-ил]гептановой кислоты этиловый эфир(39,46 г, 102,3 ммоль) подвергали удалению защиты с помощью ТБАФ (1 М в ТГФ, 154,0 мл,154,0 ммоль) при продолжительности реакции 2,5 ч. С помощью очистки путем хроматографии 38 среднего давления, элюируя градиентом растворителей (от 9:1 гексаны:ЕtOАс до 6:4 гексаны:ЕtOАс, до 1:1 гексаны:ЕtOАс, до ЕtOАс, до 19:1 ЕtOАс:МеОН), получили 7-[2R-гидроксиметил-5-оксопирролидин-1-ил)гептановой кислоты этиловый эфир (25,41 г). 1(m, 3 Н), 2,08 (m, 1H), 1,93 (m, 1H), 1,71 (m, 1H),1,63-1,27 (m, 8H), 1,23 (t, 3 Н); МС 272,2 (М+1). Подготовительный пример 3. [2-Оксо-3-(3 трифторметилфенил)пропил]фосфоновой кислоты диметиловый эфир. Стадия А. N-Метокси-N-метил-2-(3-трифторметилфенил)ацетамид. К раствору N,O-диметилгидроксиламина гидрохлорида (1,577 г, 16,2 ммоль) в ДМФ (25 мл) и CH2Cl2 (25 мл) при 0 С добавляли триэтиламин (2,25 мл). После перемешивания в течение 5 мин добавляли 3-трифторметилфенилуксусную кислоту (3,0 г, 14,7 ммоль), НОВТ (1-гидроксибензотриазола гидрат) (3,177 г, 23,5 ммоль) и DEC (2-диэтиламиноэтилхлорида гидрохлорид,3,10 г, 16,2 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 18 ч и концентрировали в вакууме. Остаток разбавляли ЕtOАс и органический раствор промывали последовательно 1 н. NaOH (2 раза), водой и рассолом. Органический раствор высушивали (МgSO4), фильтровали и концентрировали в вакууме. Путем хроматографии среднего давления (от 20% ЕtOАс в гексанах до 50% ЕtOАс в гексанах) получили N-метокси-N-метил-2-(3 трифторметилфенил)ацетамид. Стадия Б. [2-Oксо-3-(3-трифторметилфенил)пропил]фосфоновой кислоты диметиловый эфир. К раствору диметилметилфосфоната (9,4 г,75,8 ммоль) в толуоле (80 мл) при -78 С медленно добавляли н-бутиллитий (n-BuLi) (2,5 М в гексанах, 28 мл, 70 ммоль). Эту реакционную смесь перемешивали в течение 1 ч и медленно добавляли раствор N-метокси-N-метил-2-(3-трифторметилфенил)ацетамида (14,39 г) в толуоле(50 мл). Эту реакционную смесь перемешивали в течение 2,5 ч и добавляли АсОН (40 мл). Эту реакционную смесь нагревали до комнатной температуры и добавляли воду. Органический слой промывали водой, затем рассолом. Органический раствор высушивали (МgSO4), фильтровали и концентрировали в вакууме. Путем хроматографии среднего давления (от CH2Cl2 до 2% МеОН в CH2Cl2) получили соединение, указанное в заголовке подготовительного примера 3 (9,37 г). 1 39 Заменяя соответствующие исходные материалы, соединение, указанное в заголовке подготовительного примера 4, получили, следуя методике, аналогичной описанной для подготовительного примера 3. Подготовительный пример 5. [3-(3-Хлорфенил)-2-оксопропил]фосфоновой кислоты диметиловый эфир. К раствору диметилметилфосфоната (17,93 г,144 ммоль) в ТГФ (270 мл) при -78 С медленно добавляли n-BuLi (2,5 М, 64,2 мл, 160,6 ммоль). Эту реакционную смесь перемешивали в течение 1 ч и медленно добавляли (3-хлорфенил)уксусной кислоты метиловый эфир (26,93 г, 146 ммоль). Эту реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. Добавляли АсОН (15 мл) и летучие вещества удаляли в вакууме. Остаток разбавляли CH2Cl2 и органический раствор осторожно промывали насыщенным водным NаНСО 3(3 раза). Органический слой высушивали (MgSO4),фильтровали и концентрировали в вакууме. С помощью очистки путем хроматографии среднего давления (от 20% ЕtOАс в гексанах до ЕtOАс) получили соединение, указанное в заголовке (9,28 г). Подготовительный пример 6. Тетрагидропирролизин-3,5-дион. Соединение, указанное в заголовке подготовительного примера 6, получили, следуя методике, описанной в патенте США 4663464. Подготовительный пример 7. 7-(2R-Формил-5-оксопирролидин-1-ил)гептановой кислоты этиловый эфир. К раствору 7-(2R-гидроксиметил-5-оксопирролидин-1-ил)гептановой кислоты этилового эфира (1,63 г, 6,01 ммоль) в бензоле (50 мл) добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (3,46 г, 18,03 ммоль) и ДМСО (1,5 мл, 24,04 ммоль). Этот раствор охлаждали до 0 С и добавляли пиридиния трифторацетат (1,28 г, 6,61 ммоль). Эту реакционную смесь перемешивали при 0 С в течение 15 мин,а затем при комнатной температуре в течение 2 ч. Этот раствор декантировали от масляного остатка. Остаток промывали бензолом (3 х) и объединенные бензольные промывки концентрировали в вакууме с получением 7-(2R-формил-5 оксопирролидин-1-ил)гептановой кислоты этилового эфира, который использовали без дальнейшей очистки. Подготовительный пример 8. 4-(3-2-[4 Бифенил-3-ил-3-(трет-бутилдиметилсиланилокси)бутил]-5-оксопирролидин-1-илпропил)бензойной кислоты метиловый эфир. Стадия А. 5-(3-Бром-3-оксобутил)пирролидин-2-он. К раствору тетрагидропирролизин-3,5-диона (5 г, 36 ммоль) в CH2Cl2 (320 мл) при 0 С добавляли по каплям 3-бромбензилмагния бромид (0,25 М в Et2O, 155 мл, 38,8 ммоль). Этот раствор перемешивали при 0 С в течение 2 ч и гасили насыщенным водным хлоридом аммо 005293 40 ния. Добавляли водную 1 н. HCl до достижения рН=3. После нагревания до комнатной температуры водный раствор экстрагировали CH2Cl2(3 х). Объединенные органические экстракты высушивали (МgSО 4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до ЕtOАс,до 5% МеОН в CH2Cl2), получили 5-(3-бром-3 оксобутил)пирролидин-2-он (7,84 г). 1(bs, 1 Н), 3,67 (s, 2H), 3,60 (m, 1H), 2,52 (t, 2 Н),2,32 (m, 2 Н), 2,20 (m, 1H), 1,88-1,60 (m, 3H). Стадия Б. 5-(3-Бром-3-гидроксибутил)пирролидин-2-он. К раствору 5-(3-бром-3-оксобутил)пирролидин-2-она (7,84 г, 25,3 ммоль) в ЕtOН (130 мл) при 0 С добавляли NаВН 4 (480 мг, 12,6 ммоль) и эту реакционную смесь перемешивали при 0 С в течение 2,5 ч. Эту реакционную смесь гасили насыщенным водным хлоридом аммония. Добавляли воду и CH2Cl2. Водный слой промывали СН 2 Сl2 (3 х) и объединенные органические экстракты высушивали (MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до ЕtOАс, до 1% МеОН в CH2Cl2, до 3% МеОН в CH2Cl2, до 5% МеОН в СН 2 Сl2, до 8% МеОН в СH2 Сl2), получили 5-(3-бром-3 гидроксибутил)пирролидин-2-он (6,76 г). 1(86 мл) добавляли трет-бутилдиметилсилилхлорид (3,59 г, 23,8 ммоль), а затем имидазол (2,95 г,43,3 ммоль) и ДМАП (264 мг, 2,16 ммоль). Эту реакционную смесь перемешивали в течение 24 ч и гасили насыщенным водным хлоридом аммония. Водный раствор промывали ЕtOАс (3 х) и объединенные органические экстракты высушивали (MgSO4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от CH2Cl2 до 1% МеОН в CH2Cl2, до 3% МеОН в CH2Cl2, до 5% МеОН в CH2Cl2, до 8% МеОН в СH2 Сl2), получили 5-[3-бром-3(трет-бутилдиметилсиланилокси)бутил]пирролидин-2-он (7,45 г). 1 41 К раствору 5-[3-бром-3-(трет-бутилдиметилсиланилокси)бутил]пирролидин-2-она (750 мг,1,76 ммоль) в ДМЭ (15 мл) добавляли фенилбороновую кислоту (236 мг, 1,93 ммоль). Добавляли ацетат палладия (26,8 мг, 0,088 ммоль) и триортотолилфосфин (39,5 мг, 0,176 ммоль), а затем раствор Nа 2 СО 3 (37,3 мг, 3,52 ммоль) в воде(1,8 мл). Эту реакционную смеcь нагревали с обратным холодильником в течение 24 ч. Эту реакционную смесь охлаждали и летучие вещества удаляли в вакууме. Остаток разбавляли рассолом и ЕtOАс. Водный раствор промывали ЕtOАс (3 х) и объединенные органические экстракты высушивали (МgSО 4), фильтровали и концентрировали. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до ЕtOАс, до 1% МеОН в CH2Cl2, до 3% МеОН в CH2Cl2, до 5% МеОН в CH2Cl2), получили 5[4-бифенил-3-ил-3-(трет-бутилдиметилсиланилокси)бутил]пирролидин-2-он (717,3 мг). 1(d, 3H); МС 424,3 (М+1). Подготовительный пример 9. 5-[3-(третБутилдиметилсиланилокси)-4-(3-фторфенил)бутил]пирролидин-2-он. Стадия А. 5-[4-(3-Фторфенил)-3-оксобутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия А, тетрагидропирролизин-3,5-дион (2 г, 14 ммоль) подвергали взаимодействию с 3-фторбензилмагния хлоридом (0,25 М в Et2 О, 62 мл, 15,5 ммоль) в течение 2,5 ч. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до 2:1 EtOAc: гексаны, до ЕtOАс, до 2% МеОН в CH2Cl2, до 10% МеОН в CH2Cl2), получили 5-[4-(3-фторфенил)-3-оксобутил]пирролидин-2-он (2,1730 г). 1(m, 2H), 1,65 (m, 1H). Стадия Б. 5-[4-(3-Фторфенил)-3-гидроксибутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия Б, 5-[4-(3-фторфенил)-3-оксобутил]пирролидин-2-он (2,17 г, 8,71 ммоль) восстанавливали NaBH4 (165 мг, 4,35 ммоль). С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до ЕtOАс, до 1% МеОН в CH2Cl2, до 3% МеОН в CH2Cl2, до 6% МеОН в СН 2 Сl2), получили 5-[4-(3-фторфенил)-3-гидроксибутил]пирролидин-2-он (2,23 г). 1(m, 1H), 2,67 (m, 1H), 2,33-2,21 (m, 3 Н), 1,92 (d,J=4,15 Гц, 1H), 1,75-1,40 (m, 5H); МС 252,2 (М+1). Стадия В. 5-[3-(трет-Бутилдиметилсиланилокси)-4-(3-фторфенил)бутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия В, 5-[4-(3-фторфенил)-3-гидроксибутил]пирролидин-2-он (2,23 г,8,87 ммоль) подвергали взаимодействию с третбутилдиметилсилилхлоридом (1,47 г, 9,76 ммоль). С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от 1:1 гексаны:ЕtOАс до ЕtOАс, до 1% МеОН в СН 2 Сl2, до 2% МеОН в CH2Cl2, до 4% МеОН в СН 2 Сl2), получили 5-[3-(трет-бутилдиметилсиланилокси)-4-(3-фторфенил)бутил]пирролидин-2-он (2,84 г). 1(m, 2H), 2,30 (m, 2H), 2,25 (m, 1 Н), 1,70-1,38 (m,5H), 0,84 (s, 9H), 0 (s, 3 Н), -0,2 (s, 3 Н). Подготовительный пример 10. 5-[3-(третБутилдиметилсиланилокси)-4-(4-фторфенил)бутил]пирролидин-2-он. Стадия А. 5-[4-(4-Фторфенил)-3-оксобутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия А, тетрагидропирролизин-3,5-дион (1,41 г, 10,1 ммоль) подвергали взаимодействию с 4-фторбензилмагния хлоридом (0,25 М в Et2 О, 50 мл, 12,5 ммоль) в течение 5 ч. С помощью очистки путем хроматографии среднего давления (2% МеОН в(t, 2H), 2,34-2,15 (m, 3 Н), 1,82-1,61 (m, 3 Н). Стадия Б. 5-[4-(4-Фторфенил)-3-гидроксибутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия Б, 5-[4-(4-фторфенил)-3-оксобутил]пирролидин-2-он (2,64 г,ммоль) восстанавливали NaBH4 (400 мг) при комнатной температуре в течение 1 ч. Добавляли дополнительное количество NaBH4 (150 мг) и эту реакционную смесь перемешивали в течение 20 ч. С помощью очистки путем хроматографии среднего давления, используя градиент растворителей (от СН 2 Сl2 до 2% МеОН в(m, 1H), 2,64 (m, 1H), 2,32-2,18 (m, 4 Н), 1,721,47 (m, 5H). Стадия В. 5-[3-(трет-Бутилдиметилсиланилокси)-4-(4-фторфенил)бутил]пирролидин-2-он. Следуя методике, описанной для подготовительного примера 8, стадия В, 5-[4-(4-фторфенил)-3-гидроксибутил]пирролидин-2-он (1,95 г, 43 7,79 ммоль) подвергали взаимодействию с третбутилдиметилсилилхлоридом (1,47 г, 9,76 ммоль). С помощью очистки путем хроматографии среднего давления (1% МеОН в CH2Cl2) получили 5[3-(трет-бутилдиметилсиланилокси)-4-(4-фторфенил)бутил]пирролидин-2-он. 1(m, 2 Н), 2,36-2,24 (m, 3 Н), 1,70-1,38 (m, 5 Н),0,84 (s, 9H), -0,05 (d, 3H), -0,2 (d, 3H). Подготовительный пример 11. [2-Оксо-3(3-феноксифенил)пропил]фосфоновой кислоты диметиловый эфир. Заменяя соответствующие исходные материалы, соединение, указанное в заголовке подготовительного примера 11, получили, следуя методике, аналогичной описанной для соединения подготовительного примера 5. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения состояния, которое представлено низкой костной массой, у млекопитающего, при котором указанному млекопитающему вводят селективный агонист рецептора ЕР 4, представляющий собой соединение формулы I или фармацевтически приемлемую соль указанного соединения, гдеQ представляет собой COOR3, CONHR4 или тетразол-5-ил; А представляет собой простую или цисдвойную связь; В представляет собой простую или трансдвойную связь;R2 представляет собой -тиенил, фенил,фенокси, однозамещенный фенил или однозамещенный фенокси, причем указанные заместители представляют собой хлоро, фторо, фенил,метокси, трифторметил или (C1-С 3)алкил;R5 представляет собой фенил или (С 1-С 5) алкил; или 7-2R-[3-гидрокси-4-(3-феноксифенил) бут-1-енил]-5-оксопирролидин-1-илгептановую кислоту, или 7-2S-[3-гидрокси-4-(3-феноксифе 44 нил)бутил]-5-оксопирролидин-1-илгептановую кислоту. 2. Способ по п.1, где Q представляет собой 5-тетразолил и =U представляет собой 3. Способ по п.2, где указанное соединение формулы I представляет собой 5R-(3S-гидрокси 4-фенил-бут-1-енил)-1-[6-(1 Н-тетразол-5-ил)гексил]пирролидин-2-он, 5S-(3R-гидрокси-4-фенилбутил)-1-[6-(1 Н-тетразол-5-ил)гексил]пирролидин 2-он, 5S-(4-(3-хлорфенил)-3R-гидроксибутил)-1(6-(2 Н-тетразол-5-ил)гексилпирролидин-2-он или 5S-(3R-гидрокси-4-(3-трифторметилфенил)бутил)1-(6-(2 Н-тетразол-5-ил)гексил)пирролидин-2-он. 4. Способ по п.1, где Q представляет собой СООН и =U представляет собой 5. Способ по п.4, где указанное соединение представляет собой 7-(2S-(3R-гидрокси-4-фенилбутил)-5-оксопирролидин-1-ил)гептановую кислоту, 7-[2R-(3S-гидрокси-4-фенил-бут-1-енил)-5-оксопирролидин-1-ил]гептановую кислоту, 7-2S[3R-гидрокси-4-(3-трифторметоксифенил)бутил]5-оксопирролидин-1-илгептановую кислоту, 72S-[3R-гидрокси-4-(3-феноксифенил)бутил]-5 оксопирролидин-1-илгептановую кислоту, 7-(2S(3R-гидрокси-4-(3-трифторметилфенил)бутил)5-оксопирролидин-1-ил)гептановую кислоту или 7-2S-[4-(3-хлорфенил)-3R-гидроксибутил]-5 оксопирролидин-1-илгептановую кислоту. 6. Способ по любому из пп.1-5, где указанное состояние представляет собой остеопороз,хрупкость костей, остеопорозный перелом, дефект кости, детскую идиопатическую потерю кости, потерю альвеолярной кости, потерю нижнечелюстной кости, перелом кости, остеотомию, потерю кости, связанную с периодонтитом, или врастание протеза. 7. Способ по любому из пп.1-6, при котором указанную композицию вводят системно или местно. 8. Соединение, выбранное из 7-2S-[3Rгидрокси-4-(3-феноксифенил)бутил]-5-оксопирролидин-1-илгептановой кислоты; 7-(2S-(3Rгидрокси-4-(3-трифторметилфенил)бутил)-5-оксопирролидин-1-ил)гептановой кислоты; 7-2S[4-(3-хлорфенил)-3R-гидроксибутил]-5-оксопирролидин-1-илгептановой кислоты; 5S-[4-(3-хлорфенил)-3R-гидроксибутил]-1-[6-(2 Н-тетразол-5 ил)гексил]пирролидин-2-она и 5S-(3R-гидрокси 4-(3-трифторметилфенил)бутил)-1-(6-(2 Н-тетразол-5-ил)гексил)пирролидин-2-она. 9. Фармацевтическая композиция, содержащая соединение по п.8 и фармацевтически приемлемый разбавитель или носитель. 10. Применение соединения по п.8 в качестве лекарства.
МПК / Метки
МПК: A61P 19/10, C07D 207/26, A61K 31/4015
Метки: лечении, остеопороза, пирролидин-2-она, производные, применение
Код ссылки
<a href="https://eas.patents.su/23-5293-proizvodnye-pirrolidin-2-ona-i-ih-primenenie-pri-lechenii-osteoporoza.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пирролидин-2-она и их применение при лечении остеопороза</a>
Предыдущий патент: Жевательная резинка с покрытием, способ ее изготовления и применение для ее покрытия одного или более активных веществ в форме твердых частиц
Следующий патент: Полиморфные формы/гидраты дигидрохлорида n-[4-(3-хлор-4-фторфениламино)-7-(3-морфолин-4-илпропокси)хиназолин-6-ил]-акриламида
Случайный патент: Цеолитный катализатор и его использование для конверсии углеводородов



























