Пептиды, связывающиеся с рецептором инсулиноподобного фактора роста 1
Формула / Реферат
1. Выделенный полипептид, содержащий полипептид с последовательностью, представленной в SEQ ID NO: 1-13.
2. Выделенный полинуклеотид, содержащий полинуклеотид, кодирующий полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1-13.
3. Выделенный полинуклеотид, содержащий полинуклеотид с последовательностью, представленной в SEQ ID NO: 14-26, или его комплементарной последовательностью.
4. Выделенный вектор, содержащий полинуклеотид с последовательностью, представленной в SEQ ID NO: 14-26.
5. Вектор по п.4, представляющий собой вектор экспрессии.
6. Выделенная клетка-хозяин, содержащая вектор по п.4.
7. Выделенный слитый белок, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 1-13, слитый со вторым полипептидом.
8. Слитый белок по п.7, где второй полипептид является иммуноглобулином или его фрагментом.
9. Способ экспрессии полипептида, включающий стадии:
a) обеспечения клетки-хозяина по п.6 и
b) культивирования клетки-хозяина в условиях, достаточных для экспрессии полипептида с последовательностью, приведенной в SEQ ID NO: 1-13.
10. Способ доставки терапевтического агента через клетки эндотелия, включающий:
a) конъюгацию терапевтического агента с полипептидом, содержащим полипептид с последовательностью, приведенной в SEQ ID NO: 1, 2, 4, 8 или 12, с образованием конъюгата;
b) приведение конъюгата в контакт с клетками эндотелия и
c) измерение количества конъюгата, доставленного через клетки эндотелия.
11. Способ по п.10, где клетки эндотелия образуют гематоэнцефалический барьер.
Текст
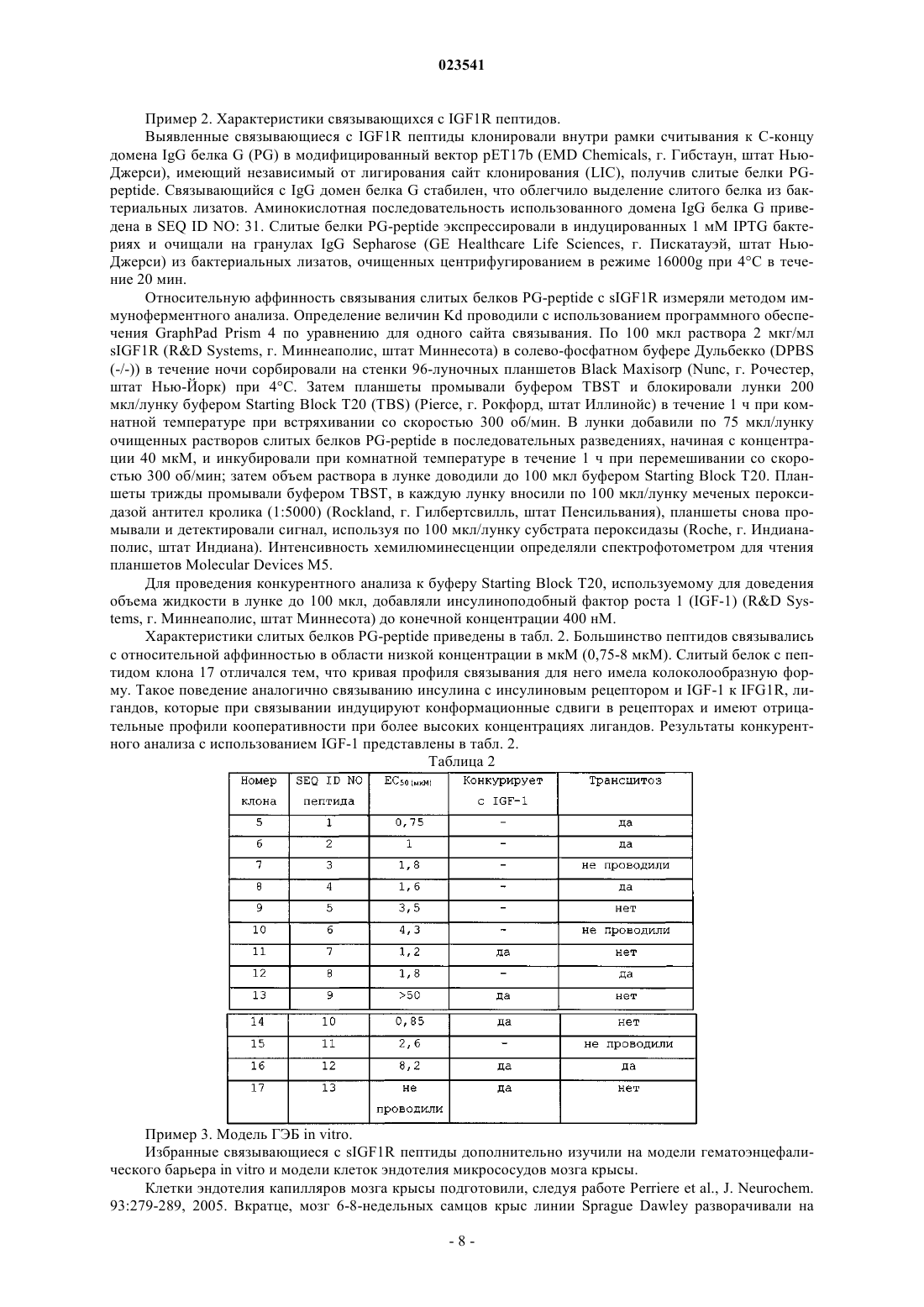
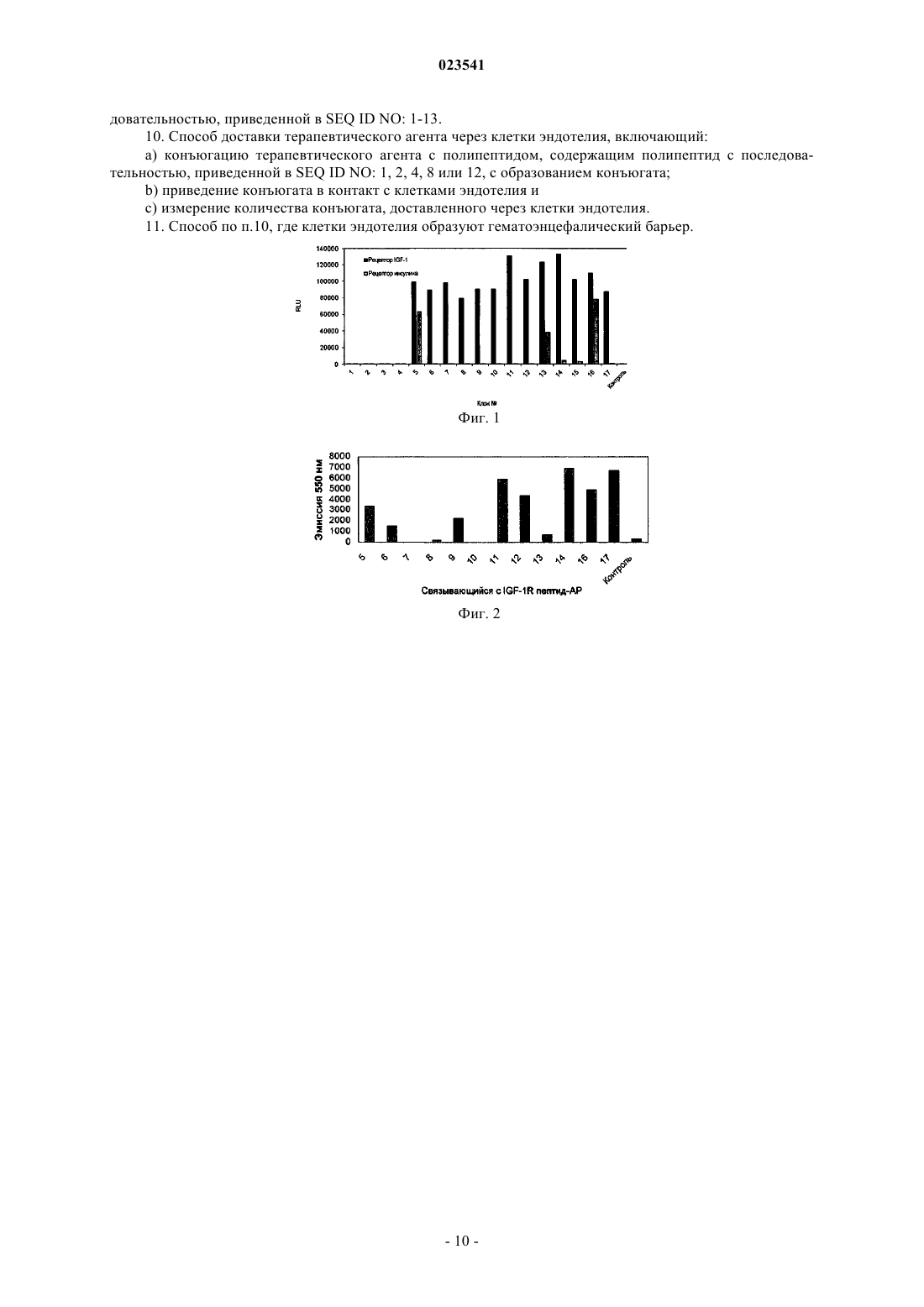
ПЕПТИДЫ, СВЯЗЫВАЮЩИЕСЯ С РЕЦЕПТОРОМ ИНСУЛИНОПОДОБНОГО ФАКТОРА РОСТА 1 Раскрываются полипептиды, связывающиеся с рецептором инсулиноподобного фактора роста 1, и полинуклеотиды,кодирующие такие полипептиды. Также раскрываются способы получения полипептидов с использованием клеточных систем экспрессии и бесклеточных систем, а также способы использования полипептидов для получения слитых белков. Раскрытые полипептиды могут обеспечивать возможность доставки терапевтических агентов через гематоэнцефалический барьер (ГЭБ). Область техники, к которой относится изобретение Настоящее изобретение относится к пептидам, связывающимся с рецептором инсулиноподобного фактора роста 1, кодирующим их полинуклеотидам, а также способам их получения и применения. Предпосылки создания изобретения Последние достижения в области биомедицинских исследований и высокопроизводительного скрининга лекарственных препаратов позволили предложить множество потенциальных терапевтических агентов для лечения заболеваний, связанных с центральной нервной системой. Однако многие из потенциальных терапевтических агентов оказываются неудовлетворительными при тестировании in vivo из-за недостаточно эффективного транспорта через гематоэнцефалический барьер (ГЭБ). Терапевтические агенты могут транспортироваться через ГЭБ несколькими способами, включая насыщаемые транспортные системы, адсорбционный трансцитоз, когда транспортируемый терапевтический агент интернализуется клеткой в ГЭБ и доставляется на аблюминальную поверхность для высвобождения во внутриклеточный жидкостный компартмент мозга, трансмембранную диффузию, причем терапевтический агент растворяется в липидном бислое, из которого состоят мембраны составляющих ГЭБ клеток, а также внеклеточные пути, когда терапевтический агент использует остаточную проницаемость ГЭБ. Опробовано несколько подходов к модификации терапевтических агентов для изменения их проникающей способности через ГЭБ, включая конъюгацию с белками, естественно проникающими через ГЭБ, такими как инсулин, инсулиноподобный фактор роста 1 и 2 (IGF-1, IGF-2), лептин и трансферрин(заявка на патент СШАUS 2007/0081992), сшивку полипептидов с катионизированными антителами,связывающимися с определенными клеточными рецепторами, такими как инсулиновый рецептор (патент США 7388079) или трансферриновый рецептор (патент США 6329508; Zhang and Pardridge, BrainRes. 889:49-56, 2001); связывание терапевтических агентов с синтетическими полимерами, такими как поли(бутилцианоакрилат) или полиакриламид, покрытый полисорбатом 80 (заявка на патент США 2002/0009491, заявка на патент США 2002/0013266; заявка на патент США 2006/0051317), и использование липосом или иммунолипосом. Для всех используемых сегодня подходов к повышению эффективности транспорта терапевтических агентов через ГЭБ характерна невысокая эффективность из-за конкуренции с эндогенными лигандами, недостаточного транспорта терапевтического агента в паренхиму мозга и деградации терапевтических агентов вследствие доставки его в лизосомы. Таким образом, существует потребность в разработке способов транспорта терапевтических агентов через ГЭБ. Краткое описание фигур На фиг. 1 показано связывание отдельных лизатов фагов с IGF1R и IR. На фиг. 2 показано связывание слитого с АР белка с IGF1R. Краткое описание изобретения Один аспект настоящего изобретения представляет собой выделенный полипептид, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 1-13. Другой аспект настоящего изобретения представляет собой выделенный полинуклеотид, содержащий полинуклеотид, кодирующий полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1-13. Другой аспект настоящего изобретения представляет собой выделенный полинуклеотид, содержащий полинуклеотид с последовательностью, приведенной в SEQ ID NO: 14-26, или его комплементарной последовательностью. Другой аспект настоящего изобретения представляет собой выделенный вектор, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 14-26. Другой аспект настоящего изобретения представляет собой выделенную клетку-хозяина, содержащую вектор, составляющий предмет настоящего изобретения. Другой аспект настоящего изобретения представляет собой выделенный слитый белок, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 1-13, слитый со вторым полипептидом. Другой аспект настоящего изобретения представляет собой способ экспрессии полипептида, включающий стадии:a. обеспечения клетки-хозяина, составляющей предмет настоящего изобретения; иb. культивирования клетки-хозяина в условиях, достаточных для экспрессии полипептида с последовательностью, приведенной в SEQ ID NO: 1-13. Другой аспект настоящего изобретения представляет собой способ доставки терапевтического агента через клетки эндотелия, включающий:a) конъюгацию терапевтического агента с полипептидом, содержащим полипептид с последовательностью, приведенной в SEQ ID NO: 1, 2, 4, 8 или 12, с образованием конъюгата;c) измерение количества конъюгата, доставленного через клетки эндотелия. Подробное описание изобретения Все упоминаемые в данном описании публикации, включая, без ограничений, патенты и заявки,включены в настоящий документ путем ссылки, как если бы они были полностью изложены непосредственно в настоящем документе. Используемые в настоящем описании и в формуле изобретения формы единственного числа включают ссылки на множественные объекты, если иное не следует явно из контекста. Так, например, ссылка на "полипептид" подразумевает ссылку на один или более полипептидов и включает их эквиваленты,известные специалистам в данной области. Все используемые в настоящем документе технические и научные термины, если только не дано иное их определение, имеют общепринятое значение, понятное любому специалисту в области настоящего изобретения. В настоящем документе описаны примеры композиций и способов, хотя для проверки или реализации на практики настоящего изобретения могут быть использованы любые композиции и способы, подобные или эквивалентные описанным в настоящем документе. Термин "полипептид" обозначает молекулу, содержащую по меньшей мере два аминокислотных остатка, связанных пептидной связью с образованием полипептида. Малые полипептиды, содержащие менее 50 аминокислотных остатков, могут называться "пептидами". Полипептиды могут также называться "белками". Термин "полинуклеотид" обозначает молекулу, содержащую цепочку нуклеотидов, ковалентно связанных через сахарофосфатный остов или через другую эквивалентную ковалентную химическую структуру. Двухцепочечные и одноцепочечные молекулы ДНК и РНК представляют собой типичные примеры полинуклеотидов. Термин "комплементарная последовательность" обозначает вторую выделенную полинуклеотидную последовательность, антипараллельную первой выделенной полинуклеотидной последовательности и содержащую нуклеотиды, комплементарные нуклеотидам первой полинуклеотидной последовательности. Как правило, такие "комплементарные последовательности" при контакте с первой выделенной полинуклеотидной последовательностью в соответствующих условиях способны к образованию двухцепочечных полинуклеотидных молекул, таких как двухцепочечные молекулы ДНК или двухцепочечные молекулы РНК. Термин "вектор" обозначает полинуклеотид, который может удваиваться в биологической системе или перемещаться между такими системами. Полинуклеотиды-векторы, как правило, содержат элементы, такие как точки начала репликации, сигнал полиаденилирования или маркеры выбора, обеспечивающие дупликацию или сохранение таких полинуклеотидов в биологической системе. Примерами упомянутых биологических систем могут служить клетки, вирусы, животные, растения и реконструированные биологические системы, использующие биологические компоненты, способные к удвоению вектора. Полинуклеотидами, содержащими вектор, могут быть молекулы ДНК или РНК, либо их гибриды. Термин "вектор экспрессии" обозначает вектор, который можно использовать в биологической системе или реконструированной биологической системе для прямой трансляции полипептида, закодированного полинуклеотидной последовательностью, присутствующей в векторе экспрессии. Используемый в настоящем документе термин "гематоэнцефалический барьер" или "ГЭБ" обозначает границу раздела между кровью периферической системы кровообращения и головным и спинным мозгом, которая образована плотными соединениями в эндотелиальных плазматических мембранах капилляров мозга и создает исключительно плотный барьер, ограничивающий транспорт молекул в мозг,даже таких малых, как молекула мочевины с молекулярной массой 60 Да. Гематоэнцефалический барьер в головном мозге, гематоспинномозговой барьер в спинном мозге и гематоретинальный барьер в сетчатке представляют собой непрерывные капиллярные барьеры в центральной нервной системе (ЦНС) и собирательно именуются гематоэнцефалическим барьером. Термин "антитело" обозначает молекулу, которая специфически связывается с антигеном, и включает димерные, тримерные и мультимерные антитела, а также химерные, гуманизированные и полностью человеческие антитела. Кроме того, антитело может представлять собой целое антитело или функциональный фрагмент молекулы антитела, такой как фрагмент, сохраняющий по меньшей мере ее функцию связывания с антигеном, включающие Fab, F(ab'), F(ab')2, scFv, dsFv и диатела. Например, фрагменты антитела могут быть получены с использованием протеолитических ферментов (например, целое антитело расщепляется папаином для получения фрагментов Fab, a обработка пепсином дает фрагментыF(ab')2). Технологии получения и применения различных антител хорошо известны в данной областиNatl. Acad. Sci. 86:10029-10033, 1989). Например, полностью человеческие моноклональные антитела, не-2 023541 включающие никаких последовательностей, не относящихся к человеку, могут быть получены с помощью трансгенных по человеческому иммуноглобулину мышей или с помощью библиотек фаговых дисплеев (Lonberg et al., Nature 368:856-859, 1994; Fishwild et al., Nature Biotech, 14:845-851, 1996; Mendez etMeth. 265:67-84, 2001). Молекула или препарат антитела "специфически связывается" с заданным антигеном, если они связываются с данным антигеном с более высокой аффинностью и специфическим, в противоположность неспецифическому, образом по сравнению с другим, отличающимся от первого, антигеном. Другими словами, "специфическое связывание" молекулы или препарата антитела можно использовать для различения двух разных полипептидов. Используемый в настоящем документе термин "рецептор инсулиноподобного фактора роста 1", или"IGF1R", обозначает IGF1R человека (GenBank: NP000866) с аминокислотной последовательностью,приведенной в SEQ ID NO: 27. Для получения зрелого белка про-полипептид IGF1R расщепляется на альфа- и бета-цепи. Альфа-цепь включает аминокислотные остатки 31-740 последовательности SEQ IDNO: 27, а бета-цепь включает аминокислотные остатки 741-1367 последовательности SEQ ID NO: 27. Используемый в настоящем документе термин "растворимый IGF1R", или "sIGF1R", обозначает внеклеточный домен IGF1R (аминокислотные остатки 31-932 последовательности SEQ ID NO: 27). Растворимый IGF1R может представлять собой внеклеточный домен нерасщепленного про-полипептида или внеклеточный домен зрелого IGF1R (аминокислотные остатки 31-740, образующие альфа-цепь, и аминокислотные остатки 741-932, образующие внеклеточную часть бета-цепи). Используемый в настоящем документе термин "конъюгат" обозначает химерную молекулу, содержащую пептид, составляющий предмет настоящего изобретения, с аминокислотной последовательностью, приведенной в SEQ ID NO: 1-13, и терапевтический агент. Термин "конъюгированный" или"конъюгирование" означает, что терапевтический(-ие) агент(-ы) и пептиды, составляющие предмет настоящего изобретения, физически связаны друг с другом, например, ковалентными химическими связями, физическими силами, такими как силы ван-дер-Ваальса или гидрофобные взаимодействия, путем инкапсулирования, встраивания или комбинаций этих способов. Терапевтический(-ие) агент(-ы) и пептиды, составляющие предмет настоящего изобретения, могут быть связаны друг с другом химическими связями через спиртовую, кислотную, карбонильную тиоловую или аминогруппу с использованием хорошо известных способов химического синтеза (см., например, заявку на патент СШАUS2010/0028370). Терапевтический агент может быть связан с пептидами, составляющими предмет настоящего изобретения, через группу-линкер. Примерами линкеров являются глицин-обогащенные линкеры, такие как Gly3SerGly3Ser (SEQ ID NO: 28) или Gly4SerGly4SerGly4Ser (SEQ ID NO: 29). Если терапевтический агент и пептиды, составляющие предмет настоящего изобретения, конъюгированы друг с другом через ковалентную связь или пептид и терапевтический агент представляет собой полипептид, то такой конъюгат как целое называется "слитый белок". Таким образом, термин "слитый белок" обозначает полипептид, образованный из двух (или) более гетерологичных полипептидов, которые обычно не сливаются вместе в одной аминокислотной последовательности. Слитые белки могут в целом быть получены с использованием способов на основе рекомбинантных нуклеиновых кислот, т.е. путем транскрипции и трансляции продукта слияния рекомбинантных генов, где слияние включает сегмент, кодирующий полипептид, составляющий предмет настоящего изобретения, и сегмент, кодирующий гетерологичный полипептид. Используемый в настоящем документе термин "терапевтический агент" обозначает молекулу, вводимую субъекту для получения желаемого терапевтического эффекта. Субъектов является человек или животное, включая млекопитающих и приматов. Примеры терапевтических агентов включают белки,антитела, пептиды, малые молекулы или полинуклеотиды. Терапевтические агенты также могут представлять собой токсины или радиоизотопы, когда предполагаемый терапевтический эффект состоит, например, в уничтожении раковых клеток. В настоящем изобретении представлены выделенные полипептиды, которые связываются с IGF1R,полинуклеотиды, кодирующие полипептиды, векторы, содержащие полинуклеотиды, выделенные клетки-хозяева, полипептиды, которые могут быть получены при экспрессии полинуклеотидов, способы экспрессии полипептидов, составляющие предмет настоящего изобретения, и способы использования полинуклеотидов и полипептидов, составляющих предмет настоящего изобретения. Полипептиды, составляющие предмет настоящего изобретения, связываются с IGF1R и путем трансцитоза переносятся через клетки эндотелия. Поскольку IFG1R экспрессируется на клетках эндотелия в гематоэнцефалическом барьере (ГЭБ), полипептиды, составляющие предмет настоящего изобретения, могут обеспечивать возможность доставки терапевтических агентов через ГЭБ. Один аспект настоящего изобретения представляет собой выделенный полипептид, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 1-13. Полипептиды, составляющие предмет настоящего изобретения, могут быть получены путем химического синтеза, такого как твердофазный синтез пептидов, в автоматическом синтезаторе пептидов. В альтернативном варианте осуществления полипептиды, составляющие предмет настоящего изобретения,-3 023541 могут быть получены на основе полинуклеотидов, кодирующих эти полипептиды с использованием бесклеточных систем экспрессии, таких как системы экспрессии на основе лизата ретикулоцитов, системы экспрессии на основе экстракта из пшеничных зародышей и системы экспрессии на основе экстрактаEscherichia coli. Полипептиды, составляющие предмет настоящего изобретения, также могут быть получены путем экспрессии и выделения из клеток-носителей нуклеотидной последовательности, составляющей предмет настоящего изобретения, с использованием хорошо известных специалистам способов,таких как рекомбинантная экспрессия легко выделяемых полипептидов с аффинными метками. Специалисту в данной области также известны иные способы получения полипептидов, составляющих предмет настоящего изобретения. Другой аспект настоящего изобретения представляет собой выделенный слитый белок, содержащий полипептид с последовательностью, приведенной в SEQ ID NO: 1-13, слитый со вторым полипептидом. Указанный второй полипептид может представлять собой лидерную последовательность или секреторную последовательность. Указанный второй полипептид может представлять собой терапевтический агент, слитый с пептидами, составляющими предмет настоящего изобретения. Терапевтический агент и составляющий предмет настоящего изобретения пептид могут быть слиты друг с другом различными способами. С-Конец или N-конец пептида, составляющего предмет настоящего изобретения, может быть непосредственно связан с N-концом или С-концом, соответственно, терапевтического агента через амидную связь или пептидный линкер. Терапевтические агенты могут быть связаны с пептидом, составляющим предмет настоящего изобретения, с использованием хорошо известного в данной области химического кросс-сочетания. Другой аспект настоящего изобретения представляет собой выделенный полинуклеотид, содержащий полинуклеотид, кодирующий полипептид, составляющий предмет настоящего изобретения. Составляющие предмет настоящего изобретения полинуклеотиды могут быть получены путем химического синтеза, такого как твердофазный синтез полинуклеотидов, в автоматическом синтезаторе полинуклеотидов. В альтернативном варианте осуществления полинуклеотиды, составляющие предмет настоящего изобретения, могут быть получены с использованием других способов, таких как ПЦРдупликация, векторная дупликация или способы манипуляции ДНК с использованием рестрикционных ферментов. Способы производства или получения полинуклеотидов с известной заданной последовательностью хорошо известны специалистам в данной области. Полинуклеотиды, составляющие предмет настоящего изобретения, также могут содержать по меньшей мере одну некодирующую последовательность, такую как транскрибируемые, но нетранслируемые последовательности, сигналы терминации, сайты связывания рибосомы, последовательности,стабилизирующие мРНК, интроны и сигналы полиаденилирования. Полинуклеотидные последовательности также могут включать в себя дополнительные последовательности, кодирующие дополнительные аминокислоты. Такие дополнительные полинуклеотидные последовательности могут, например, кодировать маркер или метку, например, гексагистидиновый пептид (Gentz et al., Proc. Natl. Acad. Sci. (США) 86:821-284, 1989) или гемаглютининовую пептидную метку (Wilson et al., Cell 37:767-778, 1984), облегчающие очистку слитых белков. Примерами полинуклеотидов являются полинуклеотиды с последовательностью, приведенной в SEQ ID NO: 14-26. Другой вариант осуществления настоящего изобретения представляет собой вектор, содержащий выделенный полинуклеотид с последовательностью, приведенной в SEQ ID NO: 14-26. Векторы, составляющие предмет настоящего изобретения, используют для сохранения полинуклеотидов, удвоения полинуклеотидов или индукции экспрессии полипептидов, кодируемых вектором, составляющим предмет настоящего изобретения, в биологических системах, включая реконструированные биологические системы. Векторы могут иметь хромосомальное, эписомальное и вирусное происхождение. К ним могут относиться векторы, полученные из бактериальных плазмид, бактериофагов, транспозонов, эписом дрожжей, вставочных элементов, хромосомальных элементов дрожжей, бакуловирусов, паповавирусов,таких как SV40, вирусов коровьей оспы, аденовирусов, вирусов птичьей оспы, вирусов псевдобешенства,пикорнавирусов и ретровирусов, а также векторы, полученные из комбинаций указанных выше элементов, такие как космиды и фагмиды. Векторы, составляющие предмет настоящего изобретения, могут быть приготовлены в виде микрочастиц с вспомогательными веществами, липидами, буферными веществами или иными эксципиентами,в зависимости от конкретного применения. В одном варианте осуществления настоящего изобретения вектор представляет собой вектор экспрессии. Векторы экспрессии, как правило, включают в себя элементы последовательности нуклеиновых кислот, которые позволяют контролировать, регулировать, активировать или допускать экспрессию полипептидов, кодируемых данным вектором. Указанные элементы могут содержать сайты связывания энхансера транскрипции, сайты инициации РНК-полимеразы, сайты связывания рибосом и другие сайты,способствующие экспрессии закодированных полипептидов в данной системе экспрессии. Указанные системы экспрессии могут представлять собой хорошо известные специалистам в данной области клеточные или бесклеточные системы. Также хорошо известны элементы последовательности нуклеиновых кислот и последовательности исходного вектора, пригодные для использования в процессе экспрессии-4 023541 закодированных полипептидов. Пример полученного на основе плазмиды вектора экспрессии, который можно использовать для экспрессии полипептидов, составляющих предмет настоящего изобретения,содержит точку начала репликации Е. coli, ген хлорамфеникол-ацетилтрансферазы (CAT), промотор Т 7 бактериофага, сигнальную последовательность pelB и последовательность терминатора Т 7. Другой вариант осуществления настоящего изобретения представляет собой выделенную клеткухозяина, содержащую вектор, составляющий предмет настоящего изобретения. Типичные примеры клеток-хозяев включают клетки архей; бактериальные клетки, такие как Streptococci, Staphylococci, Enterococci, Е. coli, Streptomyces, цианобактерии, В. subtilis и 5. aureus; клетки грибов, такие как Kluveromyces,Saccharomyces, Basidomycete, Candida albicans или Aspergillus; клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9; клетки животных, такие как СНО, COS, HeLa, C127, 3 Т 3, ВНК, 293, CV-1, клетки меланомы Боуэса и миеломы; и клетки растений, такие как клетки голосемянных или покрытосемянных растений. Клетки-хозяева для реализации способов, составляющих предмет настоящего изобретения, могут быть представлены в виде отдельных клеток или популяций клеток. Популяции клеток могут представлять собой популяцию выделенных или культивированных клеток либо популяцию клеток, присутствующих в матриксе, таком как ткань. Введение полинуклеотида, такого как вектор, в клетку-хозяина можно осуществить способами, хорошо известными специалистам в данной области (Davis et al., Basic Methods in Molecular Biology, 2-е изд., AppletonLange, г. Норуолк, штат Коннектикут, 1994; Sambrook et al., Molecular Cloning: A Laboratory Manual, 3-е изд., Cold Spring Harbor Laboratory Press, Колд-Спринг-Харбор, штат Нью-Йорк, 2001). К этим способам относятся трансфекция с использованием фосфата кальция, трансфекция с обработкойDEAE-декстраном, микроинъекция, трансфекция через катионные липиды, электропорация, трансдукция, введение при соскабливании, баллистическое введение и инфицирование. Структура полипептидов или фрагментов, составляющих предмет настоящего изобретения, может быть модифицирована для таких целей, как повышение специфичности, стабильности, растворимости субстрата и т.п. Например, можно получить модифицированный полипептид, в котором последовательность аминокислот изменена, например, путем аминокислотной замены, делеции или вставки. Ожидается, что выделенная замена лейцина на изолейцин или валин, аспартата на глутамат, треонина на серин,или другая аналогичная замена аминокислоты на близкую по структуре аминокислоту (т.е. консервативные мутации) в большинстве, но не во всех, случаях не окажет большого влияния на биологическую активность получаемой молекулы. Консервативными называют замены, проводимые внутри семейства аминокислот с близкой структурой боковых цепей. Генетически кодируемые аминокислоты можно разделить на четыре семейства: (1) кислотные (аспартат, глутамат); (2) основные (лизин, аргинин, гистидин); (3) неполярные (аланин, валин,лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан); и (4) незаряженные полярные (глицин,аспарагин, глутамин, цистеин, серин, треонин, тирозин). Фенилаланин, триптофан и тирозин иногда объединяют в одну группу ароматических аминокислот. Альтернативно, набор аминокислот может быть разделен на следующие группы: (1) кислые (аспартат, глутамат); (2) основные (лизин, аргинин, гистидин), (3) алифатические (глицин, аланин, валин, лейцин, изолейцин, серин, треонин), причем серин и треонин можно необязательно сгруппировать в отдельную группу алифатических гидроксильных аминокислот; (4) ароматические (фенилаланин, тирозин, триптофан); (5) амидные (аспарагин, глутамин); и (6) серосодержащие (цистеин и метионин) (Stryer (ред.), Biochemistry, 2-е издание, WH Freeman and Co.,1981). Чтобы быстро определить возможность получения функционального гомолога в результате изменения аминокислотной последовательности полипептида или его фрагмента, можно оценить способность модифицированного полипептида или фрагмента вызывать отклик аналогично немодифицированному полипептиду или фрагменту с использованием описанных в настоящем документе тестов. Пептиды, полипептиды или белки с более чем одной заменой также могут быть легко проверены аналогичным образом. Полипептиды, составляющие предмет настоящего изобретения, можно также приготовить в виде смеси с фармацевтически приемлемым носителем или разбавителем. Для этих целей можно использовать различные водные носители, например, 0,4%-ый солевой раствор, 0,3%-ый глицин и т.п. Указанные растворы стерильны и обычно не содержат твердых примесей. Стерилизацию указанных растворов можно проводить с использованием общепринятых, хорошо известных способов стерилизации (например,фильтрованием). Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для имитирования физиологических условий, например, агенты для корректировки и поддержания рН. Концентрация полипептидов, составляющих предмет настоящего изобретения, в такой фармацевтической композиции может значительно варьироваться, например, от менее чем приблизительно 0,5%, обычно по меньшей мере приблизительно 1%, до 15 или 20 вес.%, и определяется, в первую очередь, на основании объема жидкости, ее вязкости и иных факторов в соответствии с конкретным выбранным режимом введения. Специалисты в данной области легко определят соответствующие терапевтически эффективные дозировки. Определенную дозировку можно, при необходимости, вводить повторно через соответствующие промежутки времени, выбранные лечащим врачом или иным специалистом в соответствующей области(например, медицинской сестрой, ветеринаром или ветеринарным фельдшером) в период лечения. Полипептиды, составляющие предмет настоящего изобретения, могут быть лиофилизированы для хранения и впоследствии перед использованием восстановлены в соответствующем носителе. Этот способ зарекомендовал себя как эффективный для стандартных белковых препаратов. Способы лиофилизации и восстановления хорошо известны специалистам. Другой вариант осуществления настоящего изобретения представляет собой способ экспрессии полипептида, включающий стадии обеспечения клетки-хозяина, составляющей предмет настоящего изобретения; и культивирования клетки-хозяина в условиях, достаточных для экспрессии по меньшей мере одного полипептида, составляющего предмет настоящего изобретения. Клетки-хозяева могут культивироваться в любых условиях, обеспечивающих поддержание или увеличение численности данного типа клеток и достаточных для экспрессии полипептида. Условия культивирования, среды и соответствующие способы обработки, достаточные для экспрессии полипептидов,хорошо известны специалистам в данной области. Например, многие типы клеток млекопитающих можно культивировать в аэробных условиях при 37 С с использованием соответствующим образом буферизованной среды DMEM, тогда как клетки бактерий, дрожжей и другие виды клеток можно культивировать при 37 С в условиях соответствующей атмосферы в среде LB. Экспрессия полипептида в рамках способов, составляющих предмет настоящего изобретения, может быть подтверждена с использованием различных хорошо известных способов. Например, экспрессия полипептида может быть подтверждена с использованием проявляющих реагентов, таких как антитела, с использованием, например, FACS-анализа или иммунофлуоресцентных способов детектирования или электрофорезом в ПААГ с додецилсульфатом натрия, или ВЭЖХ. Другой аспект настоящего изобретения представляет собой способ доставки терапевтического агента через клетки эндотелия, включающий:a) конъюгацию терапевтического агента с полипептидом, содержащим полипептид с последовательностью, приведенной в SEQ ID NO: 1, 2, 4, 8 или 12, с образованием конъюгата;c) измерение количества конъюгата, доставленного через клетки эндотелия. Полипептиды, составляющие предмет настоящего изобретения, облегчают доставку терапевтического агента через клетки эндотелия путем связывания полипептидов, составляющих предмет настоящего изобретения, с IGF1R. Пептиды выбирают таким образом, чтобы конъюгированный с ними терапевтический агент не препятствовал связыванию полипептидов, составляющих предмет настоящего изобретения, с IGF1R. В настоящем изобретении описана конъюгация белка с молекулярной массой приблизительно 100 кДа (921 аминокислота) с полипептидами, составляющими предмет настоящего изобретения,без потери трансцитозной активности. Другие полипептиды сравнимых размеров, вероятно, также могут быть успешно конъюгированы с полипептидами, составляющими предмет настоящего изобретения, и доставляться через клетки эндотелия в мозг. Эффективность доставки конъюгата через клетки эндотелия может быть измерена in vitro или in vivo с помощью хорошо известных способов. Типичные измерения in vitro можно провести с использованием поляризованных монослоев клеток эндотелия, измеряя трансцитоз конъюгата с применением, например, антител к конъюгату. Измерения in vivo можно провести у пациента с использованием, например, радиоактивно меченых конъюгатов, измеряя их распределение в мозге после введения. Между результатами измерения in vitro и in vivo наблюдали хорошую корреляцию. Например, в работе Perrier et al. продемонстрирована хорошая корреляция (R=0,94) между коэффициентами проницаемости ряда соединений и соответствующими коэффициентами переноса через гематоэнцефалический барьер in vivo у грызунов при использовании совместных культур астроцитов и клеток эндотелия мозга крыс (Perrier etal., Brain Res. 1150:1-13, 2007). Настоящее изобретение далее будет описано со ссылкой на конкретные неограничивающие примеры. Пример 1. Выявление связывающихся с IGF1R пептидов. Фаговый пэннинг. Библиотеки фагов pIX со случайными пептидами генерировали следуя способам, описанным в заявке на патент СШАUS2010/0021477, и использовали их в качестве источника пептидов, связывающихся с IGF1R человека. На данной библиотеке провели пэннинг в растворе по биотинилированной форме очищенного растворимого IGF1R (sIGF1R) с гексагистидиновой меткой на С-конце (RDSystems, г. Миннеаполис, штат Миннесота) в течение трех циклов. Биотинилирование sIGF1R проводили с помощью реагента EZ-Link Sulfo-NHS-LC-Biotin формата No-Weigh в микротрубках (Pierce, г. Рокфорд, штат Иллинойс). Из-за большого размера sIGF1R (330 кДа) для 1 цикла очистки использовали гранулы Tetralink Avidin благодаря их приблизительно 10-кратной связывающей способности, по сравнению с магнитными гранулами Dynal. Каждый из 384 полученных в результате пэннинга отдельных фаголизатов проверили на специфичность связывания с sIGF1R, используя фаговый твердофазный иммуноферментный анализ (ИФА). Вкратце, на стенки лунок иммунологических планшетов Black Maxisorp (Nunc, г. Рочестер, штат Нью-6 023541 Йорк) сорбировали по 100 мкл/лунку 5 мкг/мл раствора sIGF1R (RD Systems, г. Миннеаполис, штат Миннесота), затем добавляли в лунки по 25 мкл фаголизата и определяли прохождение реакции с помощью антитела anti-M13-HRP (EMD Biosciences, г. Гибстаун, штат Нью-Джерси) и субстрата пероксидазы (Roche, г. Индианаполис, штат Индиана), фиксируя сигнал спектрофотометром для чтения планшетов TEKAN. В качестве отрицательного контроля использовали неродственный белок, достоверно не проходящий через ГЭБ. Положительные лизаты определяли как клоны, для которых специфический сигнал sIGF1R втрое превышал фоновый сигнал отрицательного контроля. Всего было получено 13 клонов с уникальными пептидными последовательностями, достоверно связывающиеся с sIGF1R (табл. 1). 3 из этих 13 клонов (клоны 5, 13 и 16) перекрестно взаимодействовали с рецепторами инсулина. Пептиды из клонов 5-14, 16 и 17 клонировали внутри рамки считывания как слитые белки пептида и щелочной фосфатазы-His6 (peptide-AP) в модифицированный вектор рЕТ 20b+, содержащий клонированный ген хлорамфеникол-ацетилтрансферазы (CAT). Полученные слитые белки типа peptide-AP экспрессировали в бактериях и очищали с помощью системы очистки Ni-NTA (EMD Biosciences, г. Гибстаун, штат Нью-Джерси) согласно инструкциям производителя. Аминокислотная последовательность использованной щелочной фосфатазы приведена в SEQ ID NO: 30. Таблица 1 а. Полипептидные последовательности выявленных связывающихся с IGF1R пептидов Эффективность связывания очищенных слитых белков peptide-AP с sIGF1R оценивали методом иммуноферментного анализа (ИФА) по связыванию с иммобилизованным sIGF1R. Вкратце, бактерии,трансформированные каждым из векторов экспрессии слитых белков peptide-AP, выращивали в течение ночи, и на следующий день культуры центрифугировали при скорости 4500 об/мин и температуре 4 С. Супернатант собирали, и 75 мкл каждого супернатанта тестировали на связывание с 2 мкг/мл sIGF1R,иммобилизованного на планшетах для иммуноферментного анализа. Связанные пептиды определяли с помощью субстрата Attophos (Roche, г. Индианаполис, штат Индиана) согласно рекомендациям производителя с использованием спектрофотометра для чтения планшетов Molecular Devices M5. Слитые белки пептидных клонов 7 и 10 экспрессировались плохо. Все остальные слитые белки peptide-AP связывались с sIGF1R (фиг. 2). Таблица 1b. Полинуклеотидные последовательности связывающихся с IGF1R пептидов-7 023541 Пример 2. Характеристики связывающихся с IGF1R пептидов. Выявленные связывающиеся с IGF1R пептиды клонировали внутри рамки считывания к С-концу домена IgG белка G (PG) в модифицированный вектор pET17b (EMD Chemicals, г. Гибстаун, штат НьюДжерси), имеющий независимый от лигирования сайт клонирования (LIC), получив слитые белки PGpeptide. Связывающийся с IgG домен белка G стабилен, что облегчило выделение слитого белка из бактериальных лизатов. Аминокислотная последовательность использованного домена IgG белка G приведена в SEQ ID NO: 31. Слитые белки PG-peptide экспрессировали в индуцированных 1 мМ IPTG бактериях и очищали на гранулах IgG Sepharose (GE Healthcare Life Sciences, г. Пискатауэй, штат НьюДжерси) из бактериальных лизатов, очищенных центрифугированием в режиме 16000g при 4 С в течение 20 мин. Относительную аффинность связывания слитых белков PG-peptide с sIGF1R измеряли методом иммуноферментного анализа. Определение величин Kd проводили с использованием программного обеспечения GraphPad Prism 4 по уравнению для одного сайта связывания. По 100 мкл раствора 2 мкг/мл(-/- в течение ночи сорбировали на стенки 96-луночных планшетов Black Maxisorp (Nunc, г. Рочестер,штат Нью-Йорк) при 4 С. Затем планшеты промывали буфером TBST и блокировали лунки 200 мкл/лунку буфером Starting Block T20 (TBS) (Pierce, г. Рокфорд, штат Иллинойс) в течение 1 ч при комнатной температуре при встряхивании со скоростью 300 об/мин. В лунки добавили по 75 мкл/лунку очищенных растворов слитых белков PG-peptide в последовательных разведениях, начиная с концентрации 40 мкМ, и инкубировали при комнатной температуре в течение 1 ч при перемешивании со скоростью 300 об/мин; затем объем раствора в лунке доводили до 100 мкл буфером Starting Block T20. Планшеты трижды промывали буфером TBST, в каждую лунку вносили по 100 мкл/лунку меченых пероксидазой антител кролика (1:5000) (Rockland, г. Гилбертсвилль, штат Пенсильвания), планшеты снова промывали и детектировали сигнал, используя по 100 мкл/лунку субстрата пероксидазы (Roche, г. Индианаполис, штат Индиана). Интенсивность хемилюминесценции определяли спектрофотометром для чтения планшетов Molecular Devices M5. Для проведения конкурентного анализа к буферу Starting Block T20, используемому для доведения объема жидкости в лунке до 100 мкл, добавляли инсулиноподобный фактор роста 1 (IGF-1) (RD Systems, г. Миннеаполис, штат Миннесота) до конечной концентрации 400 нМ. Характеристики слитых белков PG-peptide приведены в табл. 2. Большинство пептидов связывались с относительной аффинностью в области низкой концентрации в мкМ (0,75-8 мкМ). Слитый белок с пептидом клона 17 отличался тем, что кривая профиля связывания для него имела колоколообразную форму. Такое поведение аналогично связыванию инсулина с инсулиновым рецептором и IGF-1 к IFG1R, лигандов, которые при связывании индуцируют конформационные сдвиги в рецепторах и имеют отрицательные профили кооперативности при более высоких концентрациях лигандов. Результаты конкурентного анализа с использованием IGF-1 представлены в табл. 2. Таблица 2 Пример 3. Модель ГЭБ in vitro. Избранные связывающиеся с sIGF1R пептиды дополнительно изучили на модели гематоэнцефалического барьера in vitro и модели клеток эндотелия микрососудов мозга крысы. Клетки эндотелия капилляров мозга крысы подготовили, следуя работе Perriere et al., J. Neurochem. 93:279-289, 2005. Вкратце, мозг 6-8-недельных самцов крыс линии Sprague Dawley разворачивали на-8 023541 хроматографической бумаге 3 ММ для удаления оболочек головного мозга, разрезали сагиттально, отсекали белое вещество и оставляли только кору, которую затем тщательно измельчали. Измельченную кору головного мозга переносили в полипропиленовую коническую пробирку объемом 50 мл, содержащую 20 мл модифицированной по способу Дульбекко среды Игла (DMEM) с добавлением 39 ед./мл ДНКазы I(Worthington, г. Лейквуд, штат Нью-Джерси) и 0,7 мг/мл коллагеназы типа 2 (Worthington, г. Лейквуд,штат Нью-Джерси) в конечной концентрации, и инкубировали при 37 С, осторожно перемешивая, в течение 1,25 ч. После быстрого центрифугирования полученную пеллету повторно растворяли в 20 мл 20% раствора BSA (Sigma, г. Сент-Луис, штат Миссури) в DMEM, центрифугировали, и выделенную обогащенную микрососудами пеллету расщепляли второй раз в 20 мл среды DMEM с добавлением 39 ед./мл ДНКазы I и 1 мг/мл коллагеназы/диспазы (Roche, г. Индианаполис, штат Индиана) при 37 С в течение 1 ч. Продукт расщепления быстро центрифугировали, полученную в результате пеллету повторно растворяли в 2 мл среды DMEM и затем наносили поверх 33% непрерывного градиента Percoll, центрифугировали, и обогащенную фракцию микрососудов извлекали и еще раз быстро центрифугировали. Пеллету с клетками повторно растворяли в 10 мл полной среды для выращивания клеток эндотелия микрососудов мозга крыс (DMEM, 20% полученной из плазмы сыворотки (PDS), 100 мкг/мл гепарина, 2 мМ Lглутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 0,25 мкг/мл амфотерицина) и высевали на 10 см чашки Петри на 4 ч при 37 С в атмосфере 5% CO2. Через 4 ч оставшиеся незакрепленными клетки отсасывали пипеткой и подсчитывали в гемацитометре с трипановым синим. Клетки высевали в верхней камере мембран Transwell (размер пор 0,4 мкм, диаметр 1,12 см, Corning, г. Актон, штат Массачусетс), обработанных 400 мкг/мл коллагена типа IV (Sigma, г. Сент-Луис, штат Миссури) и 100 мкг/мл фибронектина (Sigma, г. Сент-Луис, штат Миссури) с плотностью 6105 клеток/мл, 500 мкл на лунку. В нижнюю камеру помещали 1 мл питательной среды. В обе камеры добавляли 4 мкг/мл пуромицина(Clontech, г. Маунтин-Вью, штат Калифорния) и инкубировали планшеты при 37 С в атмосфере 5% СО 2 в течение ночи. На следующий день питательную среду заменяли на свежую полную культуральную среду с добавлением 4 мкг/мл пуромицина, и клетки снова помещали в инкубатор на ночь. На следующий день питательную среду заменяли на свежую полную культуральную среду, замену производили еще раз через два дня. Культуры клеток оценивали визуально до достижения степени слияния колоний 100%, приблизительно через 6-7 дней после посева. Разработанная in vitro модель ГЭБ имела высокое трансэндотелиальное электрическое сопротивление (100 Ом-см 2), измеренное с помощью системы Millicell-ERS (Millipore, г. Биллерика, штат Массачусетс), и очень низкую проницаемость для Naфлуоресцеина (приблизительно 1-510-6 см/с) В верхнюю камеру с моделью ГЭБ in vitro добавляли 25 мкг очищенных слитых белков peptide-AP,и трансцитозированные слитые белки peptide-AP определяли через 15 и 30 минут в нижней камере с помощью иммуноферментного анализа. Вкратце, 75 мкл каждого образца переносили на планшеты, покрытые моноклональными антителами мыши к антибактериальной щелочной фосфатазе в концентрации 5 мкг/мл (Sigma, г. Сент-Луис, штат Миссури). Планшет инкубировали в течение 1 ч, промывали, проявляли сигнал с помощью субстрата Attophos (Roche, г. Индианаполис, штат Индиана) согласно рекомендациям производителя и измеряли результат с использованием спектрофотометра для чтения планшетовMolecular Devices M5 с длиной волны возбуждения 440 нм и длиной волны излучения 550 нм. Полученные результаты приведены в табл. 2. После приведенного полного описания настоящего изобретения специалисту в данной области будет понятно, что возможны множество изменений и модификаций, не выходящих за пределы сущности или объема прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный полипептид, содержащий полипептид с последовательностью, представленной вSEQ ID NO: 1-13. 2. Выделенный полинуклеотид, содержащий полинуклеотид, кодирующий полипептид, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1-13. 3. Выделенный полинуклеотид, содержащий полинуклеотид с последовательностью, представленной в SEQ ID NO: 14-26, или его комплементарной последовательностью. 4. Выделенный вектор, содержащий полинуклеотид с последовательностью, представленной в SEQID NO: 14-26. 5. Вектор по п.4, представляющий собой вектор экспрессии. 6. Выделенная клетка-хозяин, содержащая вектор по п.4. 7. Выделенный слитый белок, содержащий полипептид с последовательностью, приведенной в SEQID NO: 1-13, слитый со вторым полипептидом. 8. Слитый белок по п.7, где второй полипептид является иммуноглобулином или его фрагментом. 9. Способ экспрессии полипептида, включающий стадии:b) культивирования клетки-хозяина в условиях, достаточных для экспрессии полипептида с после-9 023541 довательностью, приведенной в SEQ ID NO: 1-13. 10. Способ доставки терапевтического агента через клетки эндотелия, включающий:a) конъюгацию терапевтического агента с полипептидом, содержащим полипептид с последовательностью, приведенной в SEQ ID NO: 1, 2, 4, 8 или 12, с образованием конъюгата;c) измерение количества конъюгата, доставленного через клетки эндотелия. 11. Способ по п.10, где клетки эндотелия образуют гематоэнцефалический барьер.
МПК / Метки
МПК: A61K 39/00, A61K 38/00, C12P 21/06, C12P 21/04
Метки: фактора, рецептором, пептиды, роста, инсулиноподобного, связывающиеся
Код ссылки
<a href="https://eas.patents.su/23-23541-peptidy-svyazyvayushhiesya-s-receptorom-insulinopodobnogo-faktora-rosta-1.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды, связывающиеся с рецептором инсулиноподобного фактора роста 1</a>
Предыдущий патент: Гидравлический регулирующий клапан для потока текучей среды
Следующий патент: Функциональная измерительная группа для распределительной подстанции среднего напряжения
Случайный патент: Производные 3 (5)-аминопиразола, способ их получения и их применение в качестве противоопухолевых средств