Эффективная реакция энантиоселективного присоединения, использующая цинкорганический реагент
Формула / Реферат
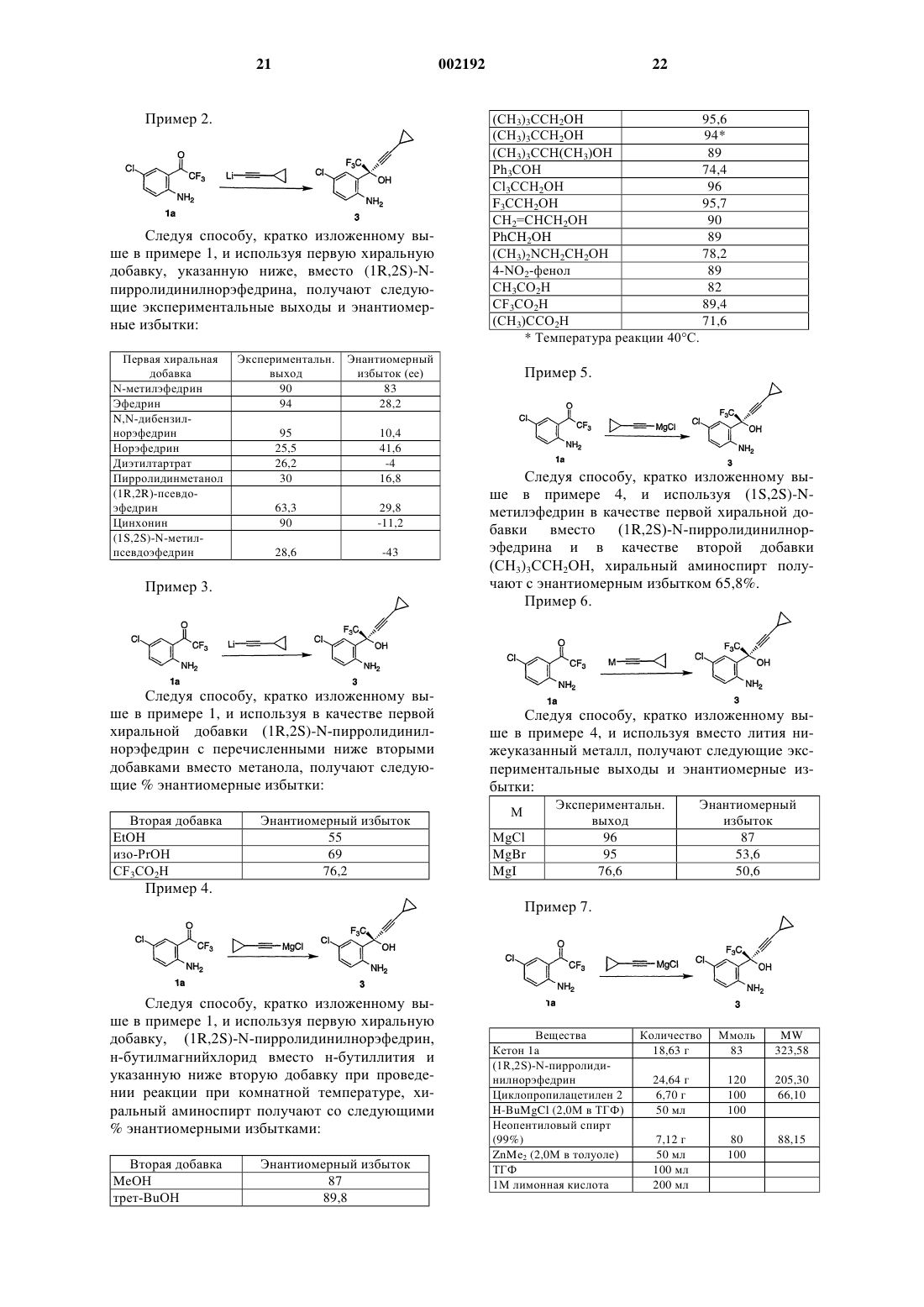
1. Способ получения соединения формулы I
или его энантиомера, где
А обозначает
a) C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NН(С1-С6-алкил), Н(С1-С6-алкил)2, CONH2, CONH(C1-С6-алкил), CON(C1-С6 -алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-C6-алкокси;
b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 и R4;
R1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH (C1-C6-алкил), N(C1-C6-aлкил)2, CONH2, CONH(C1-C6-aлкил), СОN(С1-С6-алкил)2, NHCONH2, NНСОNН(С1-С6-алкил), NHCON(C1-C6-алкил)2, арил, СО2-C1-C6-алкил, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С7-циклоалкил или C1-C6-алкокси, где С1-С6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-C6-алкокси, NO2 или галогеном (Cl, Br, F, I);
R5 обозначает
a) Н,
b) C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NН(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, СОNН(С1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
c) С1-С4-перфторалкил;
R6 обозначает С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NН(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(С1-С6-алкил), NHCON(C1-C6-алкил)2, СO2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
включающий стадии
a) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, содержащей один или более способных к обмену протонов, или, в альтернативном случае, к смеси первой хиральной добавки, содержащей один и только один способный к обмену протон, и второй добавки, в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50шС с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;
b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70шС с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или, в альтернативном случае, без этой дополнительной стадии, где первая хиральная добавка содержит более одного способного к обмену протона, или где вторую добавку вводят на стадии а);
c) смешивания хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; a X1 обозначает Cl, Br, I, F или СF3SO2; в растворителе в интервале температур от -20 до около 60шС с получением хирального цинкорганического комплекса и
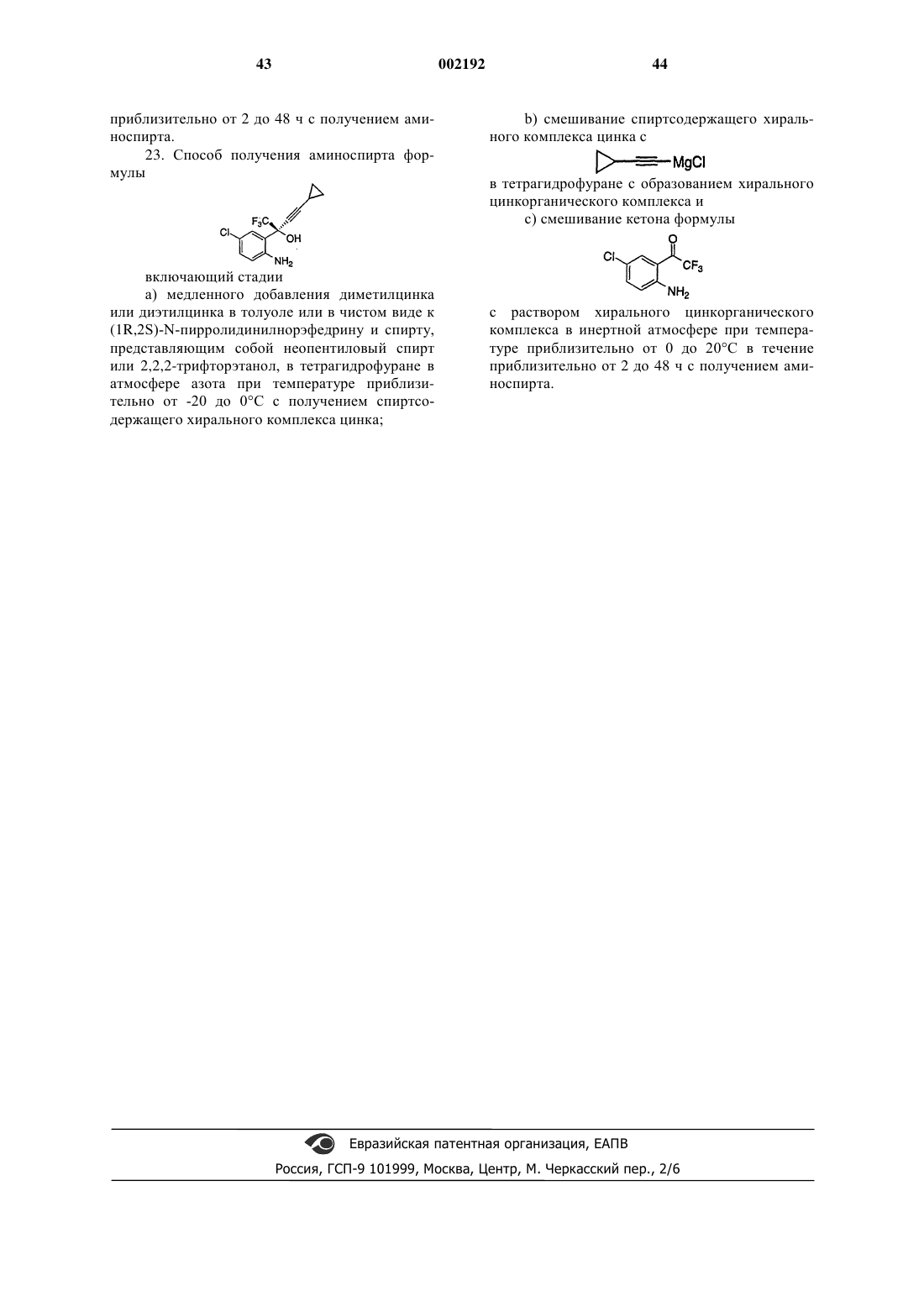
d) смешивания карбонилсодержащего соединения формулы
необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60шС в течение приблизительно от 1 до 72 ч.
2. Способ по п.1 получения соединения формулы I
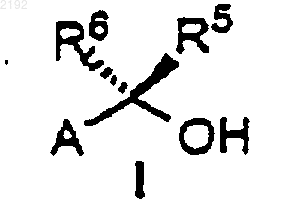
или его энантиомера, где
А обозначает
a) C1-С6-алкил, С2-С6-алкенилили С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-С6-алкил), N(С1-С6-алкил)2, CONH2, CONH(C1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или С1-С6-алкокси;
b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 и R4;
R1, R2, R3 и R4 независимо обозначают галоген (Сl, Br, F, I), CF3, CN, NO2, NH2, NH(C1-C6-алкил), N(С1-С6-алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, арил, CO2-C1-С6-алкил, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С7-циклоалкил или C1-С6-алкокси, где C1-С6-алкил, незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-С6-алкокси, NO2 или галогеном (Cl, Br, F, I);
R5 обозначает
a) Н,
b) C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-С6-алкил), N(C1-С6-алкил)2, CONH2, CONH(C1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-С6-алкил), NHCON(C1-С6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
c) С1-С4-перфторалкил;
R6 обозначает С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NН(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, СОNH(С1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-C6-алкил, С3-С7-циклоалкил или C1-C6-алкокси;
включающий стадии
a) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50шС с получением хирального комплекса цинка;
b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70шС с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон;
c) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; a X1 обозначает Cl, Br, I, F или CF3SO2; в растворителе в интервале температур от -20 до около 60шС с получением хирального цинкорганического комплекса и
d) смешивания карбонилсодержащего соединения формулы
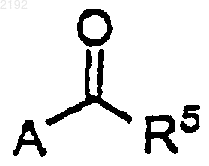
необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60шС в течение приблизительно от 1 до 72 ч.
3. Способ по п.1 получения соединения формулы I
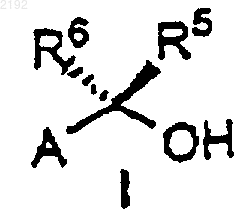
или его энантиомера, где
А обозначает
a) C1-С6-алкил, С2-С6-алкенил или С2-С6-aлкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6-алкил), N(С1-С6-алкил)2, CONH2, СОNН(С1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-С6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 и R4;
R1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6-алкил), N(С1-С6-алкил)2, CONH2, СОNН(С1-С6-алкил), СОN(С1-С6-алкил)2, NHCONH2, NНСОNН(С1-С6-алкил), NHCON(C1-C6-алкил)2, арил, СО2-C1-С6-алкил, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С7-циклоалкил или C1-С6-алкокси, где C1-C6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-С6-алкилом, C1-С6-алкокси, NO2 или галогеном (Cl, Br, F, I);
R5 обозначает
a) Н,
b) C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3, CN, NO2, NH2, NH(C1-С6-алкил), N(C1-C6-aлкил)2, CONH2, CONH(C1-C6-aлкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-aлкил), NHCON(C1-C6-aлкил)2, CO2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
c) С1-С4-перфторалкил;
R6 обозначает С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(С1-С6-алкил), N(C1-C6-aлкил)2, CONH2, CONH(C1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-С6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
включающий стадии
a) медленного добавления диалкилцинка в растворителе или в чистом виде к смеси первой хиральной добавки, содержащей один и только один способный к обмену протон, и второй добавки в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50шС с получением второй добавки, содержащей хиральный комплекс цинка;
b) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6М, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; a X1 обозначает Cl, Br, I, F или СF3SO2; в растворителе в интервале температур от -20 до около 60шС с получением хирального цинкорганического комплекса и
c) смешивания карбонилсодержащего соединения формулы
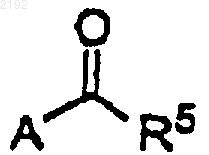
необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60шС в течение приблизительно от 1 до 72 ч.
4. Способ по п.1, отличающийся тем, что первая хиральная добавка имеет формулу
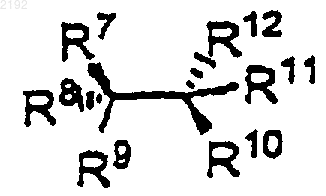
или ее энантиомер или диастереомер, а заместители определяются следующим образом:
R9 и R10 независимо обозначают ОН, NH2, NHR17, N(R17)2, или
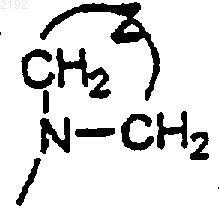
R7, R8, R11 и R12 независимо обозначают
a) Н,
b) СF3,
c) CN,
d) CONH2,
e) СОNН(С1-С6-алкил),
f) CON(С1-С6-алкил)2,
g) CO2-C1-С6-алкил,
h) С3-С7-циклоалкил,
i) C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Сl, Вr, F, I), СF3, CN, NO2, NH2, NН(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СО2-C1-C6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
j) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу;
k)
так что один и только один из R7, R8, R11 или R12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром;
R10 вместе с R11 или R12 может представлять

так что другой из радикалов R11 или R12 обозначает водород; или
R9 вместе с R7 или R8 может представлять
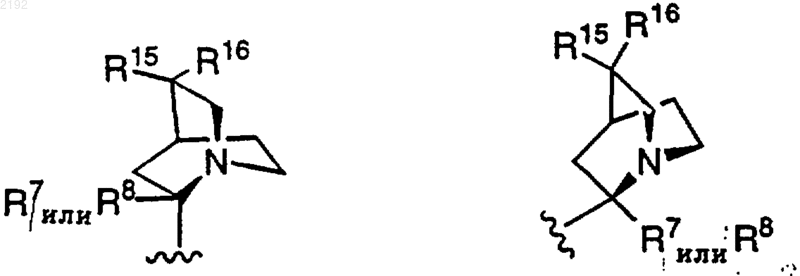
так что другой из радикалов R7 или R8 обозначает водород;
R13 обозначает Н, C1-С6-алкил или фенил;
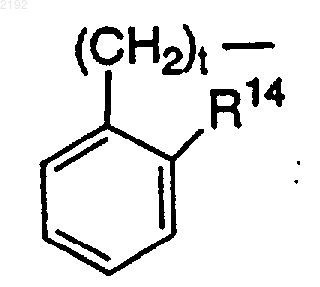
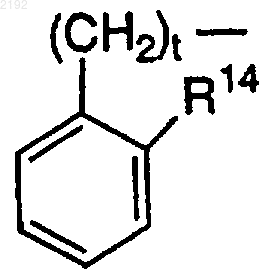
R14 обозначает Н, за исключением случая, когда R7 или R8 и R14 вместе могут образовывать углерод-углеродную связь, когда t равно 1 или 2, а R11 или R12 обозначает
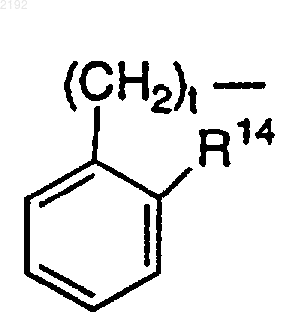
или
R7 или R8 и R14 вместе могут обозначать -(CH2)s-, когда t равно 0 и R11 или R12 обозначает
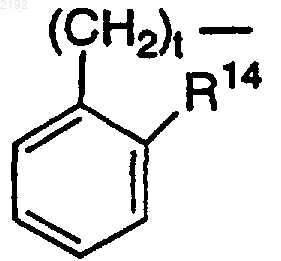
R15 или R16 обозначает C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6-алкил), N(C1-C6-алкил)2, CONH2, CONH(C1-С6-алкил), СОN(С1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-С6-алкил)2, СО2-С1-С6-алкил, С3-С7-циклоалкил или C1-C6-алкокси; так что другой радикал из R15 или R16 обозначает водород;
R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил;
Z обозначает
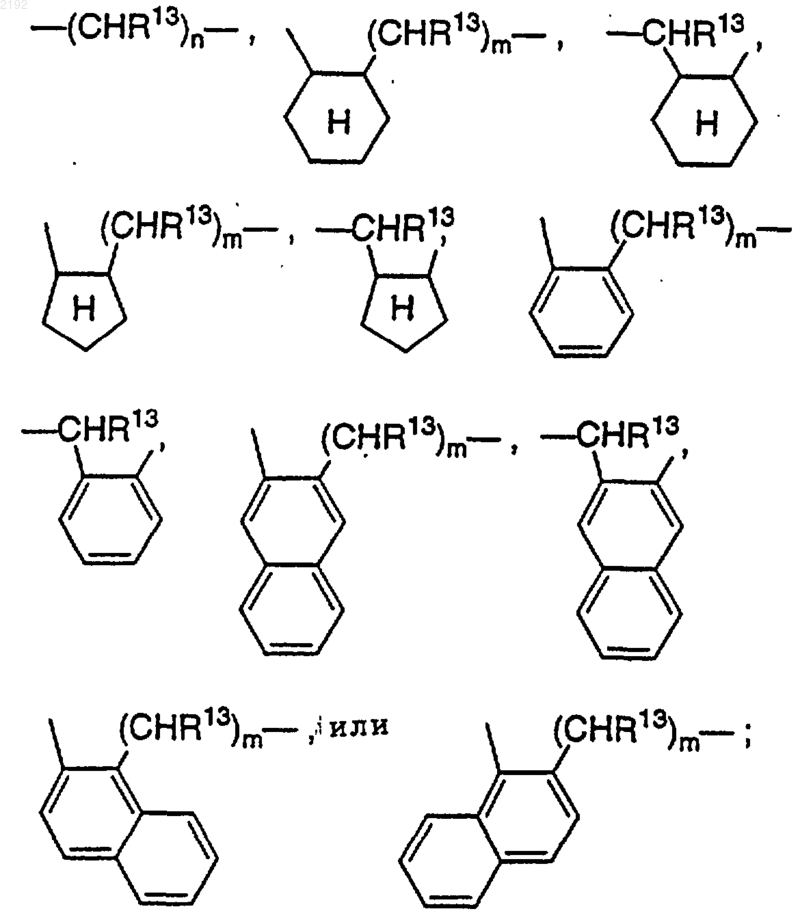


n обозначает 1, 2 или 3;
m обозначает 0 или 1;
t обозначает 0, 1 или 2 и
s обозначает 1 или 2.
5. Способ по п.4, отличающийся тем, что диалкилцинк определяется как [С1-С6-алкил]2Zn.
6. Способ по п.5, отличающийся тем, что вторая добавка определяется как ROH, RSH, RCO2H, RSО3Н, HХ, RCONH2 или арил NН2; и R обозначает C1-C6-алкил, С2-С6-алкенил, С2-С6-алкинил, арил, где арил определяется как фенил или нафтил, и гетероарил, где гетероарил определяется как 5- или 6-членный ароматический цикл, замещенный одним или двумя гетероатомами, которые выбирают из О, S, N, и каждый из которых незамещен или замещен одним, двумя или тремя заместителями, которые выбирают из группы, включающей NO2, Cl, Br, I, F, СF3, C1-С6-алкил, C1-C6-алкокси и N[C1-C6-алкил]2; а Х обозначает Cl, Br, I или F.
7. Способ по п.6, отличающийся тем, что в нем в качестве растворителя используют полярный или неполярный апротонный растворитель или смесь указанных растворителей.
8. Способ по п.7, отличающийся тем, что первую хиральную добавку выбирают из группы, включающей (1R,2S)-N-пирролидинилнорэфедрин, N-метилэфедрин, эфедрин, N,N-дибензилнорэфедрин, норэфедрин, диэтилтартрат, (1R,2R)-псевдоэфедрин и (1S,2S)-метилпсевдоэфедрин.
9. Способ по п.8, отличающийся тем, что диалкилцинк представляет собой диэтилцинк и диметилцинк.
10. Способ по п.9, отличающийся тем, что вторая добавка определяется как МеОН, трет-ВuОН, (СН3)3ССН2ОН, (СН3)3ССН(СН3)ОН, Рh3СОН, Сl3ССН2ОН, F3ССН2ОН, СН2=СНСН2ОН, РhСН2ОН, (СН3)2NCH2CH2OH, 4-NO2-фенол, СН3СО2Н, СF3СO2Н и (СН3)ССО2Н.
11. Способ по п.10, отличающийся тем, что растворитель обозначает тетрагидрофуран (ТГФ), бензол, хлорбензол, о-, м-, п-дихлорбензол, дихлорметан, толуол, гексан, циклогексан, пентан, метил-трет-бутиловый эфир (МТВЕ), диэтиловый эфир, N-метилпирролидин (NMP) или смеси указанных растворителей.
12. Способ получения аминоспирта формулы
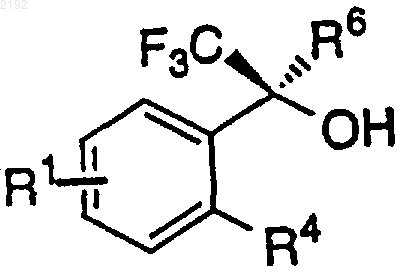
где R1 обозначает галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-С6-алкил), N(С1-С6-алкил)2, CONH2, СОNН(С1-С6-алкил), СОN(С1-С6-алкил)2, NHCONH2, NНСОNН(С1-С6-алкил), NHCON(C1-C6-алкил)2, арил, CO2-C1-C6-алкил, C1-С6-алкил, С2-С6-алкенил, С2-С6-алкинил, С3-С7-циклоалкил или C1-С6-алкокси, где C1-C6-алкил незамещен или замещен арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-С6-алкокси, NO2 или галогеном (Cl, Br, F, I);
R4 обозначает NH2 или NH(C1-С6-алкил), где C1-C6-алкил является незамещенным или замещенным арилом, арил обозначает фенил или нафтил, незамещенный или замещенный C1-С6-алкилом, C1-С6-алкокси, NO2 или галогеном (Cl, Br, F, I);
R6 обозначает С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3, CN, NO2, NH2, NН(С1-С6-алкил), N(С1-С6-алкил)2, CONH2, CONH(C1-С6-алкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2, СO2-C1-С6-алкил, С3-С7-циклоалкил или C1-C6-алкокси;
включающий стадии
а) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, содержащей один или более способных к обмену протонов, или, в альтернативном случае, к смеси первой хиральной добавки, содержащей один и только один способный к обмену протон, и второй добавки в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50шС с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;
b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70шС с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или в альтернативном случае, без этой дополнительной стадии, где первая хиральная добавка содержит более одного способного к обмену протона, или где вторую добавку вводят на стадии а);
c) смешивания хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6М, где М обозначает Na, К, Li, MgX1, ZnX1, CuX1 или B(X1)2; a X1 обозначает Сl, Br, I, F или СF3SO2; в растворителе с получением хирального цинкорганического комплекса и
d) смешивания кетона формулы

необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около 0 до около 60шС в течение приблизительно от 1 до 72 ч.
13. Способ по п.12, отличающийся тем, что первая хиральная добавка имеет формулу
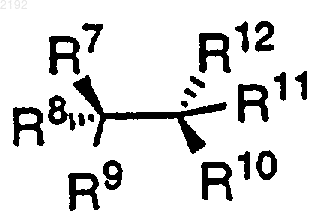
или ее энантиомер или диастереомер, а заместители определяются следующим образом:
R9 и R10 независимо обозначают ОН, NH2, NHR17, N(R17)2, или

R7, R8, R11 и R12 независимо обозначают
a) Н,
b) СF3,
c) CN,
d) CONH2,
e) СОNН(С1-С6-алкил),
f) CON(С1-С6-алкил)2,
g) СО2-C1-C6-алкил,
h) С3-С7-циклоалкил,
i) C1-C6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3, CN, NO2, NH2, NН(С1-С6-алкил), N(C1-C6-aлкил)2, CONH2, CONH(C1-C6-aлкил), CON(C1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-aлкил)2, СО2-C1-С6-алкил, С3-С7-циклоалкил или C1-С6-алкокси;
j) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу;
k)
так что один и только один из R7, R8, R11 или R12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром;
R10 вместе с R11 или R12 может представлять

так что другой из радикалов R11 или R12 обозначает водород или
R9 вместе с R7 или R8 может представлять

так что другой из радикалов R7 или R8 обозначает водород;
R13 обозначает Н, C1-C6-алкил или фенил;
R14 обозначает Н, за исключением случая, когда R7 или R8 и R14 вместе могут образовывать углерод-углеродную связь, когда t равно 1 или 2, a R11 или R12 обозначает
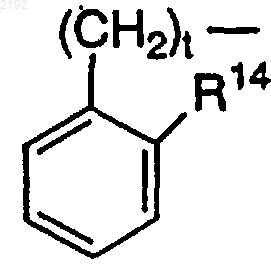
или
R7 или R8 и R14, рассматриваемые вместе, могут обозначать -(СН2)s-, когда t равно 0 и R11 или R12 обозначает

R15 или R16 обозначает C1-C6-алкил, С2-С6-алкенил или С2-С6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6-алкил), N(C1-C6-алкил)2, CONH2, CONH(C1-С6-алкил), СОN(С1-С6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил), NHCON(C1-C6-aлкил)2, СО2-С1-С6-алкил, С3-С7-циклоалкил или C1-C6-алкокси; так что другой радикал из R15 и R16 обозначает водород;
R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил;
Z обозначает
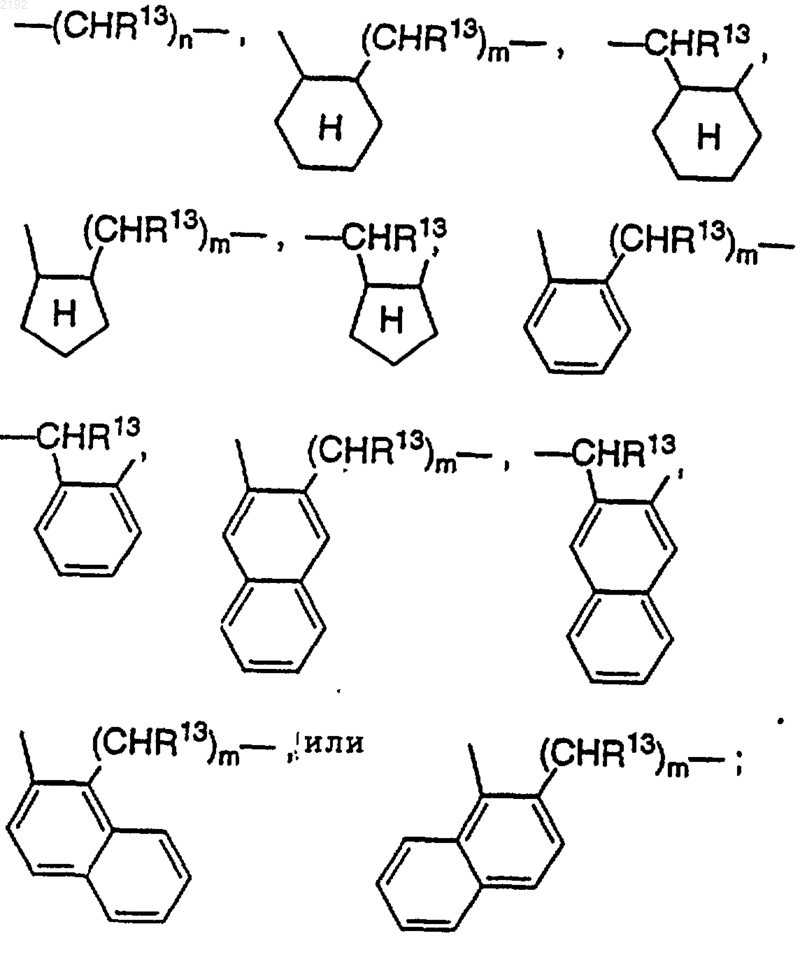
n обозначает 1, 2 или 3;
m обозначает 0 или 1;
t обозначает 0, 1 или 2 и
s обозначает 1 или 2.
14. Способ по п.13, отличающийся тем, что диалкилцинк определяется как [С1-С6-алкил]2Zn.
15. Способ по п.14, отличающийся тем, что вторая добавка определяется как ROH, RSH, RCO2H, RSO3H, HX, RCONH2 или арил NН2; и R обозначает C1-C6-алкил, С2-С6-алкенил, С2-С6-алкинил, арил, где арил определяется как фенил или нафтил, и гетероарил, где гетероарил определяется как 5- или 6-членный ароматический цикл, замещенный одним или двумя гетероатомами, которые выбирают из О, S, N, и каждый из которых незамещен или замещен одним, двумя или тремя заместителями, которые выбирают из группы, включающей NO2, Cl, Br, I, F, СF3, C1-C6-алкил, C1-C6-алкокси и N[C1-C6-алкил]2; а Х обозначает Cl, Br, I или F.
16. Способ по п.15, отличающийся тем, что в качестве растворителя используют как полярный или неполярэыщ апротонный растворитель или смеси указанных растворителей.
17. Способ по п.16, отличающийся тем, что первую хиральную добавку выбирают из группы, включающей (1R,2S)-N-пирролидинилнорэфедрин, N-метилэфедрин, эфедрин, N,N-дибензилнорэфедрин, норэфедрин, диэтилтартрат, (1R,2R)-псевдоэфедрин и (1S,2S)-метилпсевдоэфедрин.
18. Способ по п.17, отличающийся тем, что диалкилцинк представляет собой диэтилцинк и диметилцинк.
19. Способ по п.18, отличающийся тем, что вторая добавка определяется как МеОН, трет-ВuОН, (СН3)3ССН2ОН, (СН3)3ССН(СН3)ОН, Рh3СОН, Сl3ССН2ОН, F3CСН2ОН, СН2=СНСН2ОН, РhСН2ОН, (СН3)2NCH3CH2OH, 4-NO2-фенол, СН3СО2Н, СF3СО2Н и (СН3)ССO2Н.
20. Способ по п.19, отличающийся тем, что растворитель выбирают из группы, включающей тетрагидрофуран (ТГФ), бензол, хлорбензол, о-, м-, п-дихлорбензол, дихлорметан, толуол, гексан, циклогексан, пентан, метил-трет-бутиловый эфир (МТВЕ), диэтиловый эфир, N-метилпирролидин (NMP) или смеси указанных растворителей.
21. Способ по п.20, отличающийся тем, что металлоорганический реагент имеет формулу R6M, где R6 обозначает С2-С6-алкинил; М обозначает Li или MgX1; а Х1 обозначает Cl, Br, I или F или СF3SО2.
22. Способ получения аминоспирта формулы
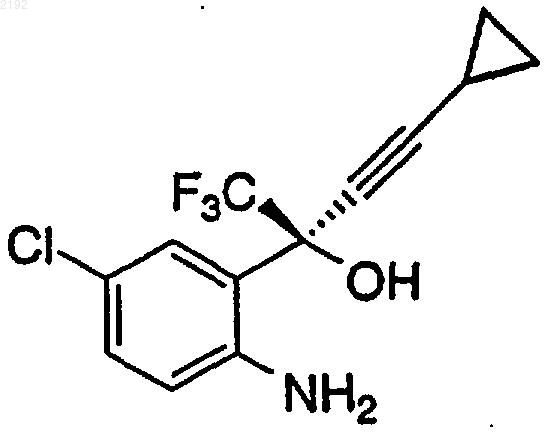
включающий стадии
a) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к (1R,2S)-N-пирролидинилнорэфедрину в тетрагидрофуране в атмосфере азота при температуре приблизительно от около -20 до около 0шС с получением хирального комплекса цинка;
b) добавления спирта, который представляет собой неопентиловый спирт или 2,2,2-трифторэтанол, к хиральному комплексу цинка и нагревание до образования спиртсодержащего хирального комплекса цинка;
c) смешивания спиртсодержащего хирального комплекса цинка с
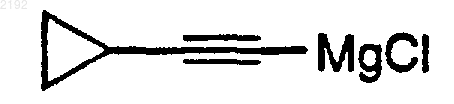
в тетрагидрофуране до образования хирального цинкорганического комплекса и
d) смешивания кетона формулы
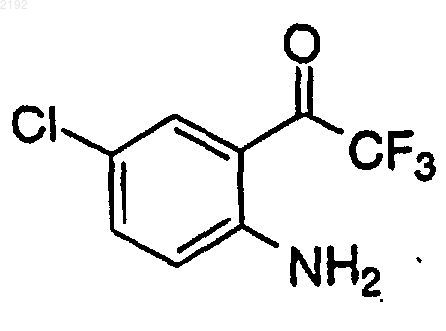
с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от 0 до 20шС в течение приблизительно от 2 до 48 ч с получением аминоспирта.
23. Способ получения аминоспирта формулы
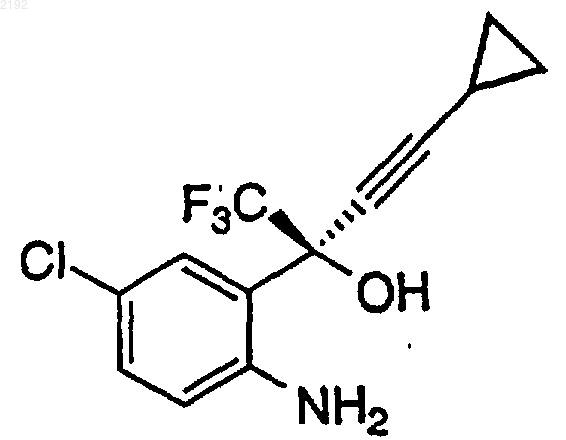
включающий стадии
a) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к (1R,2S)-N-пирролидинилнорэфедрину и спирту, представляющим собой неопентиловый спирт или 2,2,2-трифторэтанол, в тетрагидрофуране в атмосфере азота при температуре приблизительно от -20 до 0шС с получением спиртсодержащего хирального комплекса цинка;
b) смешивание спиртсодержащего хирального комплекса цинка с

в тетрагидрофуране с образованием хирального цинкорганического комплекса и
с) смешивание кетона формулы
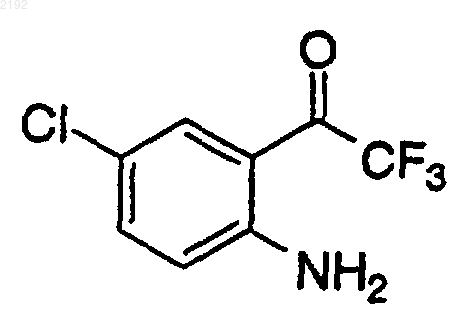
с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от 0 до 20шС в течение приблизительно от 2 до 48 ч с получением аминоспирта.
Текст
1 Ключевой стадией синтеза ингибитора обратной транскриптазы, (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1 бензоксазин-2-она, известного также как DMP266, является хиральное присоединение к 2 трифторметилкарбонил-4-хлоранилину с использованием нуклеофила, хиральной добавки,нехиральной добавки и цинкорганического реагента. Синтез DMP-266 и структурно подобных ингибиторов обратной транскриптазы описан в патенте США 5.519.021 и соответствующей РСТ международной патентной заявке WO 95/20389,опубликованной 3 августа 1995. Кроме того,асимметричный синтез энантиомерного бензоксазинона путем высокоэнантиоселективного присоединения ацетиленида и последующей циклизацией описан в Thompson, et al., Tetrahedron Letters 1995, 36, 8937-8940, а также в РСТ публикации, WO 96/37457 от 28 ноября 1996. Кроме того, подано несколько заявок, в которых обсуждаются различные аспекты синтеза(-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1-бензоксазин-2-она,включающие 1) способ получения хирального спирта, WO 98/30543 от 14 июля 1998; 2) хиральная добавка, WO 98/30540 от 16 июля 1998; 3) реакция циклизации, WO 98/34928 от 13 августа 1999; и способ кристаллизации из антирастворителя, WO 98/33782 от 16 августа 1998. Известно образование вторичных спиртов при энантиоселективном присоединении диалкилов цинка к алифатическим и ароматическим альдегидам. Soai et al., J. Org. Chem. 1991, 56: 4264-4268, описывают хиральное присоединение диалкилов цинка к алифатическим и ароматическим альдегидам, катализируемое N,Nдиалкилнорэфедрином и приводящее к вторичным алкиловым спиртам высокой оптической чистоты. Soai et al., Chem. Rev. 1992, 92: 833856, описывают энантиоселективное присоединение цинкорганических реагентов к альдегидам, раскрывая, например, получение вторичных спиртов путем энантиоселективного присоединения диалкилов цинка к альдегидам, катализируемое алкалоидами хинного дерева Леджера, и камфора-, пролин-, эфедрин- и норэфедринпроизводными хиральных аминоспиртов. Noyori et al., Agew. Chem. Int. Ed. Engl. 1991, 30: 49-69 описывают промотированное аминоспиртом алкилирование альдегидов (преимущественно бензальдегидов) соединениями диалкилцинка. Bohm et al., Angew. Chem. Int.Ed. Engl. 1996, 35; 1657-1659, обнаружили, что энантиоселективное алкилирование 3-формилпиридина диизопропилцинком катализируется за счет образующегося вторичного изопропилового спирта; т.е. путем асимметричного автокатализа. Ltjens et al., Tetr.Asymm. 1995, 6: 26752678 описывает энантиоселективное получение ацетиленовых спиртов из соответствующего 2 альдегида с помощью содержащих функциональные группы соединений диалкилцинка. Присоединения ацетиленида лития также описаны в статье Huffman et al., J. Org. Chem. 1995, 60: 1590-1594, изучивших энантиоселективное присоединение ацетиленида к циклическим кетиминам. WO-A-96/137457 описывает опосредованное N-замещенным норэфедрином присоединение литийциклолропилацетиленида к карбонильной группе в азотзащищенном 2 трифторметилкарбонил-4-хлоранилине. Настоящее изобретение описывает эффективный способ хирального присоединения циклопропилацетилена к кетону формулы использующий хиральный цинкорганический комплекс, для получения аминоспирта формулы Настоящее изобретение относится к эффективному способу получения соединения формулы Ia) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, СO2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Сl, Br, F, I), CF3, CN, NO2, NH2, NH(C1C6-алкил), N(С 1-С 6-алкил)2, CONH2, СОNН(С 1 С 6-алкил), CON(С 1-С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2,арил, CO2-C1-С 6-алкил, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-С 6-алкокси, где C1-С 6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-С 6-алкилом, С 1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I);b) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Сl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-C6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;c) С 1-С 4-перфторалкил,R6 обозначает C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенный или моноили дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br,F, I), CF3, CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1 С 6-алкил)2,CONH2,CONH(C1-C6-алкил),CON(C1-С 6-алкил)2, NHCONH2, NHCONH(C1 С 6-алкил), NHCON(C1-C6-алкил)2, СО 2-C1-С 6 алкил, С 3-С 7-циклоалкил или C1-C6-алкокси; включающему стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке или, в альтернативном случае,к смеси первой хиральной добавки и второй добавки, в растворителе в инертной атмосфере при температуре приблизительно от -78 до 50 С с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или, в альтернативном случае, где первая хиральная добавка содержит более одного способного к обмену протона, или вторую добавку вводят на стадии а), тогда эту дополнительную стадию опускают;c) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или CF3SO2; в растворителе при интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса; и необязательно, растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от -20 до около 60 С в течение приблизительно от 1 до 72 ч. Настоящее изобретение относится к эффективному способу получения соединения формулы I или его энантиомера, где А обозначает а) C1-С 1-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), CF3, CN, NO2, NH2, NH(C1 С 6-алкил), N(C1-C6-алкил)2, CONH2, СОNН(С 1 С 6-алкил), CON(C1-C6-алкил)2, NHCONH2, NНNHCON(C1-C6-алкил)2,СОNН(С 1-С 6-алкил),арил, СО 2-C1-C6-алкил, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-C6-алкокси; где C1-C6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-C6-алкокси, NO2 или галогеном (Cl, Br, F, I);a) Н,b) C1-С 6-алкил, С 2-C6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, CO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;R6 обозначает C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенный или моноили дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br,F, I), CF3, CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1 С 6-алкил)2,CONH2,CONH(C1-С 6-алкил),CON(C1-С 6-алкил)2, NHCONH2, NHCONH(C1 С 6-алкил), NHCON(C1-C6-алкил)2, CO2-C1-C6 алкил, С 3-С 7-циклоалкил или C1-С 6-алкокси; включающему стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, или, в альтернативном случае,к смеси первой хиральной добавки и второй добавки, в растворителе в инертной атмосфере при температуре приблизительно от -78 до 50 С с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с целью получения второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или, в альтернативном случае, где первая хиральная добавка содержит более одного способного к обмену протона, или вторую добавку вводят на стадии а), тогда эту дополнительную стадию опускают;c) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или CF3SO2; в растворителе в интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса; и необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. Вариант выполнения настоящего изобретения относится к эффективному способу получения соединения формулы Ia) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(C1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1C6-алкил), N(С 1-С 6-алкил)2, CONH2, CONH(C1C6-алкил),CON(C1-C6-алкил)2,NHCONH2,NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2,арил, СО 2-C1-С 6-алкил, C1-C6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-C6-алкокси; где C1-C6-алкил является незамещенным или замещенным арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-C6 алкокси, NO2 или галогеном (Cl, Br, F, I);a) Н,b) C1-С 6-алкил, С 2-С 6-алкенил или С 2-C6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(C1-C6-aлкил), N(C1-C6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, CO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;c) C1-C4-перфторалкил,R6 обозначает C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенный или моноили дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br,F, I), СF3, CN, NO2, NH2, NН(С 1-С 6-алкил), Н(С 1 С 6-алкил)2,CONH2,CONH(C1-C6-алкил),CON(C1-С 6-алкил)2, NHCONH2, NНСОNН(С 1 С 6-алкил), NHCON(C1-C6-алкил)2, СО 2-C1-С 6 алкил, С 3-C7-циклоалкил или C1-C6-алкокси; включающий стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением хирального комплекса цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон;c) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где M обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или СF3SO2; в растворителе в интервале температур от -20 до около 60 С с целью получением хирального цинкорганического комплекса; и необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. Другой вариант выполнения настоящего изобретения состоит в эффективном способе получения соединения формулы I или его энантиомера, где А обозначает а) C1-C6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизаме 7 щенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, CO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), CF3, CN, NO2, NH2, NH(C1 С 6-алкил), N(C1-C6-aлкил)2, CONH2, СОNН(С 1 С 6-алкил), CON(C1-C6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2,арил, СO2-C1-С 6-алкил, C1-C6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-C6-алкокси; где C1-C6-алкил незамещен или замещен арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-С 6-алкилом, C1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I);a) Н,b) C1-C6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-С 6-алкил)2, CO2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;R6 обозначает C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенный или моноили дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br,F, I), СF3, CN, NO2, NH2, NH(C1-C6-aлкил), N(C1C6-aлкил)2,CONH2,CONH(C1-С 6-алкил),CON(C1-С 6-алкил)2, NHCONH2, NHCONH(C1C6-aлкил), NHCON(C1-C6-алкил)2, CO2-C1-С 6 алкил, С 3-С 7-циклоалкил или C1-С 6-алкокси; включающий стадии а) медленного добавления диалкилцинка в растворителе или в чистом виде к смеси первой хиральной добавки и второй добавки в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением второй добавки, содержащей хиральный комплекс цинка;b) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или CF3SO2; в растворителе в интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса; и необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. Вышеуказанный способ, где первая хиральная добавка имеет формулу или ее энантиомер или диастереомер, а заместители определяются следующим образом:a) Н,b) СF3,c) CN,d) CONH2,e) СОNН(С 1-С 6-алкил),f) CON(С 1-С 6-алкил)2,g) СO2-C1-С 6-алкил,h) С 3-С 7-циклоалкил,i) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;j) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу; так что один и только один из R7, R8, R11 или R12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром; так, что другой из радикалов R11 или R12 обозначает водород; или так, что другой из радикалов R7 или R8 обозначает водород;R14 обозначает Н, за исключением случая,когда R7 или R8 и R14 вместе могут обозначать углерод-углеродную связь, когда t равно 1 или 2, а R11 или R12 обозначаетR15 или R16 обозначает C1-С 6-алкил, С 2-С 6 алкенил или С 2-С 6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген(Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6 алкил), N(C1-C6-алкил)2, СОNH2, CONH(C1-С 6 алкил),СОN(С 1-С 6-алкил)2,NHCONH2,NHCONH(C1-C6-алкил), NНСОN(С 1-С 6-алкил)2,СО 2-С 1-С 6-алкил, С 3-С 7-циклоалкил или C1-C6 алкокси; так что другой радикал из R15 или R16 обозначает водород;R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил; обозначает шестичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-С 6-алкилом; обозначает пятичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-C6-алкилом;s обозначает 1 или 2. Типичными примерами первой хиральной добавки являются (1R,2S)-N-пирролидинилнорэфедрин (также упоминаемый в Chemical Abstract Registry как [R-(R,S)]метилфенил 1-пирролидинэтанол), N-метилэфедрин, эфедрин, N,N-дибензилнорэфедрин, норэфедрин,диэтилтартрат, пирролидинметанол, (1R,2R)псевдоэфедрин, цинхонин, (1S,2S)-метилпсевдоэфедрин. Диалкилцинк определяется как [С 1-С 6 алкил]2Zn и предпочтительно как диметилцинк или диэтилцинк. В представленных примерах диметилцинк или диэтилцинк были закуплены в виде растворов в толуоле или гексане, однако,реагент может быть использован в чистом виде. Вторая добавка определяется как спирт,ROH, тиол, RSH, карбоновая кислота, RCO2H,сульфокислота, RSО 3 Н, галоидводород, НХ,карбоксамид, RCONH2 и анилин, арилNН 2, а R обозначает C1-C6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, арил, где арил определяется как фенил или нафтил, и гетероарил, где гетероарил определяется как 5- или 6-членный ароматический цикл, замещенный одним или двумя гетероатомами, которые выбирают из О, S, N, и каждый из которых является незамещенным или замещенным одним, двумя или тремя заместителями, которые выбирают из группы, включающейNO2, Cl, Br, I, F, СF3, C1-С 6-алкил, C1-C6-алкокси и N[C1-C6-алкил]2, а Х обозначает Cl, Br, I или F. Предпочтительные вторые добавки определяются как МеОН, трет-ВuОН, (СН 3)3 ССН 2 ОН,Сl3 ССН 2OН,(СН 3)3 ССН(СН 3)ОН, Рh3 СОН,F3 ССН 2 ОН,СН 2=СНСН 2OН,PhCH2OH,(СН 3)2NСН 2 СН 2OН, 4-NO2-фенол, СН 3 СO2 Н,СF3 СO2 Н и (СН 3)ССO2 Н. Вторая добавка является необязательной, когда первая хиральная добавка содержит, по меньшей мере, два способных к обмену протона. К примеру, первая хиральная добавка, такая как эфедрин, норэфедрин, псевдоэфедрин, диэтилтартрат, или те первые хиральные добавки, где R9 и R10 независимо обозначают ОН и NH2; могут быть использованы без введения второй добавки. Также в объем определения второй добавки входит добавка,которая может также быть хиральной. Растворитель определяется как полярный или неполярный апротонный растворитель или смеси этих растворителей, такой как тетрагидрофуран (ТГФ), бензол, хлорбензол, о-, м-, пдихлорбензол, дихлорметан, толуол, гексан,циклогексан, пентан, метил-трет-бутиловый(МТВЕ),диэтиловый эфир,Nметилпирролидин (NMP) или смеси указанных растворителей. Предпочтительно растворитель(и) выбирают из группы, которая включает тетрагидрофуран, толуол и гексан. Вариант выполнения изобретения описывает способ получения аминоспирта формулы где R1 обозначает галоген (Cl, Br, F, I), СF3, CN,NO2, NH2, NH(C1-C6-алкил), N(C1-С 6-алкил)2,CONH2,СОNН(С 1-С 6-алкил),СОN(С 1-C6 алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, арил, CO2-C1-C6-алкил,C1-C6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3 С 7-циклоалкил или C1-С 6-алкокси, где C1-C6 алкил незамещен или замещен арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1C6-алкокси, NO2 или галогеном (Сl, Br, F, I);R4 обозначает NH2 или NH(C1-C6-алкил),где C1-C6-алкил является незамещенным или замещенным арилом, арил обозначает фенил или нафтил, незамещенный или замещенный C1C6-алкилом, C1-C6-алкокси, NO2 или галогеномR6 обозначает C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, незамещенный или моноили дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br,F, I), CF3, CN, NO2, NH2, NH(C1-C6-aлкил), N(С 1 С 6-алкил)2,CONH2,CONH(C1-С 6-алкил),CON(C1-С 6-алкил)2, NHCONH2, NHCONH(C1 С 6-алкил), NHCON(C1-C6-алкил)2, CO2-C1-С 6 алкил, С 3-С 7-циклоалкил или C1-C6-алкокси; включающий стадии а) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, или, в альтернативном случае,к смеси первой хиральной добавки и второй добавки, в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или, в альтернативном случае, где первая хиральная добавка содержит более одного способного к обмену протона, или вторую добавку вводят на стадии а), тогда эту дополнительную стадию опускают; с) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обо 002192a X1 обозначает Cl, Br, I, F или СF3SO2; в растворителе с получением хирального цинкорганического комплекса; и необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около 0 до около 60 С в течение приблизительно от 1 до 72 ч. Вышеуказанный способ, где первая хиральная добавка имеет формулу или ее энантиомер или диастереомер, а заместители определяются следующим образом:a) H,b) СF3,c) CN,d) CONH2,e) СОNН(С 1-С 6-алкил),f) CON(С 1-С 6-алкил)2,g) СО 2-C1-С 6-алкил,h) С 3-С 7-циклоалкил,i) C1-C6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Сl, Вr, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-С 6-алкил)2, СO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;j) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу; так, что один и только один из R7, R8, R11 илиR12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром; так, что другой из радикалов R11 или R12 обозначает водород или так, что другой из радикалов R7 или R8 обозначает водород;R14 обозначает Н, за исключением случая,когда R7 или R8 и R14 вместе могут обозначать углерод-углеродную связь, когда t равно 1 или 2, а R11 или R12 обозначаетR15 или R16 обозначает C1-C6-алкил, С 2-С 6 алкенил или С 2-С 6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген(Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6 алкил), N(C1-C6-алкил)2, CONH2, CONH(C1-C6 алкил),СОN(С 1-С 6-алкил)2,NHCONH2,NHCONH(C1-С 6-алкил), NНСОN(С 1-С 6-алкил)2,СО 2-С 1-С 6-алкил, С 3-С 7-циклоалкил, C1-C6 алкокси; так что другой радикал из R15 или R16 обозначает водород;R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил; обозначает шестичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-C6-алкилом; обозначает пятичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный С 1-С 6-алкилом;s обозначает 1 или 2. Вышеуказанный способ, где диалкилцинк определяется как [C1-С 6-алкил]2Zn. Вышеуказанный способ, где вторая добавка определяется как ROH, RSH, RCO2H, RSO3H,HX, RCONH2 или ArNH2; где R обозначает C1 С 6-алкил, Аr, гетероарил и СF3, и Аr обозначает арил, который определяется как фенил или нафтил, незамещенный или замещенный NO2, Cl,Br, I, F, CF3, C1-C6-алкилом, C1-C6-алкокси; а Х обозначает Cl, Вг, I или F. В вышеуказанном способе используют полярный или неполярный апротонный растворитель. В вышеуказанном способе первую хиральную добавку выбирают из группы, включающей(1R,2S)-N-пирролидинилнорэфедрин, N-метилэфедрин, эфедрин, N,N-дибензилнорэфедрин,норэфедрин,диэтилтартрат,пирролидинметанол, (1R,2R)-псевдоэфедрин, цинхонин,(1S,2S)-метилпсевдоэфедрин. В вышеуказанном способе в качестве диалкилцинка используют диэтилцинк или диметилцинк. В вышеуказанном способе вторую добавку выбирают из группы, включающей МеОН, третВuОН, (СН 3)3 ССН 2 ОН, (СН 3)3 ССН(СН 3)ОН,Рh3 СОН,Сl3 ССН 2 ОН,F3 ССН 2 ОН,СН 2=СНСН 2OH, PhCH2OH, (СН 3)2NCH2CH2OH,4-NО 2-фенол,СН 3 СО 2 Н,СF3 СО 2 Н и(СН 3)ССО 2 Н. Растворитель определяется как полярный или неполярный апротонный растворитель или смеси этих растворителей, такой как тетрагидрофуран (ТГФ), бензол, хлорбензол, о-, м-, пдихлорбензол, дихлорметан, толуол, гексан,циклогексан, пентан, метил-трет-бутиловый эфир(МТВЕ),диэтиловый эфир,Nметилпирролидин (NMP) или смеси указанных растворителей. Предпочтительно растворитель(и) выбирают из группы, которая включает тетрагидрофуран, толуол и гексан. Вышеуказанный способ, в котором используют металлоорганический реагент, R6M,где R6 обозначает С 2-С 6-алкинил; М обозначает 15 Дополнительным вариантом выполнения изобретения является способ получения аминоспирта формулыa) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к(1R,2S)-N-пирролидинилнорэфедрину в тетрагидрофуране в атмосфере азота при температуре приблизительно от около -20 до около 0 С с получением хирального комплекса цинка;b) добавления спирта, который представляет собой неопентиловый спирт или 2,2,2 трифторэтанол, к хиральному комплексу цинка и нагревание до образования спиртсодержащего хирального комплекса цинка;c) смешивания спиртсодержащего хирального комплекса цинка с в тетрагидрофуране до образования хирального цинкорганического комплекса; и с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около 0 до около 20 С в течение приблизительно от 2 до 48 ч с получением аминоспирта. Дополнительным вариантом выполнения изобретения является способ получения аминоспирта формулыa) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к(1R,2S)-N-пирролидинилнорэфедрину и спирт,представляющий собой неопентиловый спирт или 2,2,2-трифторэтанол, в тетрагидрофуране в атмосфере азота при температуре приблизительно от около -20 до около 0 С, получая спиртсодержащий хиральный комплекс цинка;b) смешивания спиртсодержащего хирального комплекса цинка с в тетрагидрофуране до образования хирального цинкорганического комплекса и с) смешивания кетона формулы с раствором хирального цинкорганического комплекса в инертной атмосфере при темпера 002192 16 туре приблизительно от около 0 до около 20 С в течение приблизительно от 2 до 48 ч с получением аминоспирта. Термин инертная атмосфера означает аргон или азот, предпочтительно азот. Под температурой окружающей среды понимается температура в интервале от 20 до около 35 С. Соединения по изобретению имеют асимметрические центры, и настоящее изобретение включает все их оптические изомеры и смеси. Как используют здесь, термин алкил включает алкильные группы с определенным числом атомов углерода либо линейной, разветвленной, либо циклической конфигурации. Примеры алкила включают метил, этил, пропил, изопропил, бутил, втор- и трет-бутил, пентил, гексил, гептил, циклопропил, циклобутил,циклопентил, циклогексил, циклогептил, норборнил и тому подобные. Алкокси обозначает алкильную группу с указанием числом атомов углерода, присоединенную через кислородный мостик, такую как метокси, этокси, пропокси,бутокси и пентокси. Предполагается, что алкенил и алкинил включает углеводородные цепи с определенным числом углеродных атомов либо линейной, либо разветвленной конфигурации и, по крайней мере, одну двойную или тройную связь, которая может располагаться в любом месте вдоль цепи. Примеры алкенила включают этенил, пропенил, бутенил, пентенил, диметилпентенил и тому подобные и включают, где применимы, Е и Z формы. Примеры алкинила включают этинил,пропинил, бутинил, пентинил и диметилпентинил. Галоген, как использован здесь, означает фтор, хлор, бром и иод. Термин арил определяется как кольцо фенила, дифенила или нафтила, необязательно замещенное перечисленными выше заместителями по любым доступным атомам углерода. Арил может также быть замещен конденсированным 5-, 6- или 7-членным циклом, содержащим один или два кислорода и оставшиеся атомы цикла, являющиеся углеродными, конденсированный 5-, 6- или 7-членный цикл выбирают из группы, включающей диоксоланил, дигидрофуранил, дигидропиранил и диоксанил. Подразумевается, что термин гетероарил, как он использован здесь, включает нижеперечисленное 5- или 6-членное ароматическое ядро, замещенное одним или двумя гетероатомами, которые выбирают из О, S, N, и незамещенное или замещенное одним, двумя или тремя заместителями, которые выбирают из группы, включающей Br, Cl, F, I, (C1-C6)-алкокси,циано, нитро, гидрокси, СНО, CO2H, COC1-С 6 алкил, СO2 С 1-С 6-алкил, CONR1R2, NR1R2,NR1CОС 1-С 6-алкил, любые два соседних заместителя могут объединяться, образуя 5-, 6- или 7 членный конденсированный цикл, содержащий 1 или 2 атома кислорода и остальные атомы углерода, или любые два соседних заместителя 17 могут вместе образовывать бензоконденсированный цикл. Гетероарильные группы в объеме настоящего описания включают, но не ограничиваются акридинилом, карбазолилом, циннолинилом, хиноксалинилом, пирразолилом, индолилом, бензотриазолилом, фуранилом, тиенилом, бензотиенилом, бензофуранилом, хинолинилом, изохинолинилом, пиразинилом, пиридазинилом, пиридинилом, пиримидинилом и пирролилом, которые являются незамещенными или замещенными, как указано выше. Схема 1 описывает в общих чертах основные стадии синтеза (-)-6-хлор-4-циклопропилэтинил-4-трифторметил-1,4-дигидро-2 Н-3,1 бензоксазин-2-она (DMP-266). Стадия хирального присоединения предусматривает энантиоселективное присоединение циклопропилацетиленида по трифторметилкетону соединения 1. С образовавшегося п-метоксибензил(РМВ)-защищенного аминоспирта, 2, затем снимают защиту, получая аминоспирт, 3. Затем аминоспирт циклизуют, используя хлорформиат и основание, получая DMP-266. Схема 1 Схема 2 описывает в общих чертах получение DMP-266 способом по изобретению, состоящего в реакции хирального присоединения. Новая реакция хирального присоединения предусматривает исключение последующей защиты-снятия защиты, описанной в схеме 1. Схема 2 18 Реакция I схемы 3 описывает способ по настоящему изобретению, относящийся к синтезу хирального промежуточного соединения, используемого при получении DMP-266. Эта реакция демонстрирует возможность использования порядка 1,2 эквивалента циклопропилацетилена и хиральной добавки, что значительно меньше, чем в способах, известных из уровня техники. Испытаны многочисленные хиральные добавки, дающие высокие выходы с промышленно выпускаемым лигандом, таким как Nметилэфедрин и N-пирролидинилнорэфедрин. Общая реакция хирального присоединения указана в реакции II этой схемы. Этот способ позволяет эффективно ввести хиральный спирт заданной конфигурации, при этом образуется соответствующий хиральный цинкорганический комплекс. Настоящее изобретение раскрывает способ получения хирального цинкорганического комплекса, который включает нуклеофил по выбору, R6M. Этот реагент, который генерируют insitu (на месте), затем реагирует с прохиральным кетоном, образуя хиральный спирт. Получение спирта 3 требует использования порядка 1,0-1,5 эквивалентов хиральной добавки и нуклеофила или предпочтительно около 1,2 эквивалента хиральной добавки и около 1,0 эквивалента нуклеофила. Реакция может протекать приблизительно при температуре от около -78 до около 70 С и предпочтительно при температуре от около -20 до около 60 С в отличии от способа, известного из уровня техники, использующим низкотемпературные условия (-65 С). Диалкилцинк обычно добавляют при температуре приблизительно от около -20 до около 0 С. Вторую добавку обычно вводят приблизительно при температуре окружающей среды, затем смесь нагревают до температуры порядка 60 С, получая хиральный цинкорганический комплекс. Металлорганический реагент (R6M) добавляют к хиральному цинкорганическому комплексу приблизительно при комнатной температуре. К этому хиральному нуклеофил-цинкорганическому комплексу добавляют прохиральный кетон приблизительно при 0-20 С. Получение хирального цинкорганического комплекса может быть проведено путем медленного добавления диалкилцинка к смеси первой хиральной добавки и второй добавки, или же иначе, путем медленного добавления диалкилцинка к первой хиральной добавке и затем введением второй добавки в раствор хирального комплекса цинка. Предпочтительный вариант выполнения способа по данному изобретению включает медленное добавление раствора диалкилцинка к раствору, содержащему хиральную добавку и вторую добавку, поддерживая температуру реакции между 0 и 30 С. Спустя приблизительно 1 ч получают металлорганический реагент, такой как хлор-магний-циклопропилацетиленид, и добавляют к хиральному цинкорганическому комплексу. Затем к этому раствору хирального цинкорганического комплекса добавляют кетоанилин приблизительно при -10 С. Реакционную смесь перемешивают в течение около 35 ч при температуре приблизительно от 0 до -10 С,нагревают до комнатной температуры, перемешивают около 3 ч и затем реакцию гасят основанием. Кроме того, этот способ может быть проиллюстрирован как каталитический способ получения заданного хирального спирта, использующего каталитическое количество хиральной добавки. Схема 3 Последующие примеры предназначены для иллюстрации настоящего изобретения. Эти примеры приведены для пояснения изобретения и не могут рассматриваться как ограничивающие объем настоящего изобретения и приложенных пунктов. Пример 1. Циклизация аминоспирта, 3, для получения 1,4-дигидро-2 Н-3,1-бензоксазин-2-она, 4,кратко описана в приведенной ниже схеме 4. Реакция может быть выполнена по одностадийному или же двухстадийному способу с возможным выделением промежуточного карбамата, 5, в зависимости от используемого хлорформиата. В одностадийном способе показано, что арилхлорформиаты образуют менее стабильные карбаматы, которые при обработке их водным основанием циклизуются до продукта. Напротив, алкилхлорформиат дает алкилкарбамат,основной промежуточный продукт, пригодный для выделения и очистки перед проведением стадии циклизации. Разработан практически осуществимый двухстадийный способ получения DMP-266, основанный на стабильности алкилкарбаматов, который включает получение промежуточного алкилкарбамата, 5, с последующей циклизацией карбамата до желаемого продукта, 4. Кроме того, показано, что может быть также использован фосген. В сухой толуол (40 мл) загружают (1R,2S)N-пирролидинилнорэфедрин (9,85 г, 48 ммоль) и диметилцинк (2,0 М в толуоле) в атмосфере азота. Смесь перемешивают в течение 1 ч. Добавляют метанол (9,72 мл, 48 ммоль). Через 0,5 ч смесь с помощью канюли переносят в приготовленную суспензию н-бутиллития (2,5 М, 16 мл) и циклопропилацетилена (2,64 г, 40 ммоль) в толуоле (40 мл). Через 0,5 ч добавляют раствор кетона 1 а (4,48 г, 20 ммоль). Смесь перемешивают в течение 7 ч. Обработка водой и кристаллизация дает 4,8 г белого твердого вещества (83% выход при выделении и 83% энантиомерный избыток). Следуя способу, кратко изложенному выше в примере 1, и используя первую хиральную добавку, указанную ниже, вместо (1R,2S)-Nпирролидинилнорэфедрина, получают следующие экспериментальные выходы и энантиомерные избытки: Первая хиральная добавка Экспериментальн. Энантиомерный выход избыток (ее) 90 83 94 28,2 95 25,5 26,2 30 Следуя способу, кратко изложенному выше в примере 1, и используя в качестве первой хиральной добавки (1R,2S)-N-пирролидинилнорэфедрин с перечисленными ниже вторыми добавками вместо метанола, получают следующие % энантиомерные избытки: Вторая добавка Следуя способу, кратко изложенному выше в примере 4, и используя (1S,2S)-Nметилэфедрин в качестве первой хиральной добавки вместо (1R,2S)-N-пирролидинилнорэфедрина и в качестве второй добавки(СН 3)3 ССН 2OН, хиральный аминоспирт получают с энантиомерным избытком 65,8%. Пример 6. Следуя способу, кратко изложенному выше в примере 4, и используя вместо лития нижеуказанный металл, получают следующие экспериментальные выходы и энантиомерные избытки: М МgСl Следуя способу, кратко изложенному выше в примере 1, и используя первую хиральную добавку, (1R,2S)-N-пирролидинилнорэфедрин,н-бутилмагнийхлорид вместо н-бутиллития и указанную ниже вторую добавку при проведении реакции при комнатной температуре, хиральный аминоспирт получают со следующими В высушенную в сушильном шкафу колбу вносят высушенный над молекулярными ситами ТГФ (100 мл) и (1R,2S)-N-пирролидинилнорэфедрин (24,64 г, 120 ммоль) в атмосфере азота. Смесь охлаждают до -20 С и достаточно медленно, чтобы поддерживать температуру ниже 0 С, добавляют диметилцинк (2,0 М в толуоле, 50 мл, 100 ммоль). Затем через 30 мин при температуре окружающей среды добавляют неопентиловый спирт (7,12 г, 80 ммоль). Смесь нагревают при 60 С в течение 1 ч и охлаждают до комнатной температуры. В другой сухой колбе получают раствор хлормагнийциклопропилацетиленида по реакции циклопропилацетилена (6,70 г, 100 ммоль) и нбутилмагнийхлорида (2,0 М в ТГФ, 50 мл, 100 ммоль). Затем раствор переносят к цинковому реагенту с помощью канюли. Спустя 20 мин добавляют кетоанилин 1 а (18,63 г, 8,33 ммоль). Реакционную смесь разбавляют гексаном (100 мл) и через 7 ч реакцию гасят 1 н. лимонной кислотой (200 мл). Два слоя разделяют. Водный слой сохраняют для регенерации норэфедрина. Органический слой концентрируют до 50 мл и добавляют толуол (100 мл). Раствор концентрируют снова до 50 мл для полного удаления ТГФ. Медленно добавляют гептан (80 мл). Твердый продукт собирают фильтрованием и промывают гептаном (30 мл), получая 22,62 г(выход 94%, 96% ее (энантиомерный избыток соединения 3 в виде белого твердого вещества. Пример 8. В высушенную в сушильном шкафу колбу вносят высушенный над молекулярными ситами ТГФ (50 мл) и (1R,2S)-N-пирролидинилнорэфедрин (12,32 г, 60 ммоль) в атмосфере азота. Смесь охлаждают до -20 С и достаточно медленно, чтобы поддерживать температуру ниже 0 С, добавляют диметилцинк (2,0 М в толуоле, 25 мл, 50 ммоль). Затем, через 30 мин при температуре окружающей среды добавляют неопентиловый спирт (3,56 г, 40 ммоль). Смесь нагревают при 60 С в течение 1 ч и охлаждают до комнатной температуры. В другой сухой колбе получают раствор хлормагний 24 циклопропилацетиленида по реакции циклопропилацетилена (3,31 г, 50 ммоль) и нбутилмагнийхлорида (2,0 М в ТГФ, 25 мл, 50 ммоль). Затем раствор переносят к цинковому реагенту с помощью канюли. Через 20 мин раствор охлаждают до 0 С и добавляют кетоанилин 1 а (9,32 г, 41,7 ммоль). Реакционную смесь разбавляют гексаном (50 мл) и через 48 ч реакцию гасят 1 н. лимонной кислотой (100 мл). Два слоя разделяют. Водный слой сохраняют для регенерации норэфедрина. Органический слой концентрируют до 25 мл и добавляют толуол (50 мл). Раствор концентрируют снова до 25 мл для полного удаления ТГФ. Медленно добавляют гептан (35 мл). Твердый продукт собирают фильтрованием и промывают гептаном (10 мл),получая 11,3 г (выход 94%, 99% ее) соединения 3 в виде белого твердого вещества. 1 В высушенную в сушильном шкафу колбу вносят высушенный над молекулярными ситами ТГФ и (1R,2S)-N-пирролидинилнорэфедрин в атмосфере азота. Смесь охлаждают до -20 С и достаточно медленно, чтобы поддерживать температуру ниже 0 С, добавляют диметилцинк. Затем через 30 мин при температуре окружающей среды добавляют неопентиловый спирт. Смесь нагревают при 60 С в течение 1 ч и охлаждают до комнатной температуры. В другой сухой колбе получают раствор хлормагний-5 хлорпентинида по реакции 5-хлорпентина и нбутилмагнийхлорида. Затем раствор переносят к цинковому реагенту с помощью канюли. Через 20 мин добавляют кетоанилин 1 а. Реакционную смесь разбавляют гексаном (10 мл) и через 7 ч реакцию гасят 1 н. лимонной кислотой (20 мл). Два слоя разделяют. Органический слой концентрируют до 3 мл и добавляют толуол (10 мл). Раствор концентрируют снова до 3 мл для полного удаления ТГФ. Медленно добавляют гептан (6 мл). Твердый продукт собирают фильтрованием и промывают гептаном (2 мл),получая 1,27 г (выход 93%, 95% ее) соединения 3 в виде белого твердого вещества. 1 В сухой толуол загружают метанол и толуол. Смесь охлаждают до -78 С и добавляют диметилцинк, в атмосфере азота. Смеси дают нагреться до комнатной температуры и перемешивают в течение 1 ч. Добавляют (1R,2S)-Nпирролидинилнорэфедрин. Через 0,5 ч смесь смешивают с предварительно полученной суспензией н-бутиллития и циклопропилацетилена в толуоле (40 мл) посредством канюли. Спустя 0,5 ч добавляют кетон 1. Смесь перемешивают в течение 7 ч и реакцию гасят избытком 1 М лимонной кислоты. Проба органического раствора показывает выход 83 и 20% ее. К раствору трифторэтанола и (1R,2S)-Nпирролидинилнорэфедрина в ТГФ (9 л) в атмосфере азота добавляют раствор диэтилцинка в гексане при 0 С достаточно медленно, для того чтобы поддерживать температуру ниже 30 С. Смесь перемешивают при комнатной температуре в течение 0,51 ч. В другой сухой колбе получают раствор хлормагний-циклопропилацетиленида следующим образом: к чистому циклопропилацетилену при 0 С добавляют достаточно медленно, так чтобы поддерживать температуру в интервале 30 С,нбутилмагнийхлорид. Раствор перемешивают при 0 С в течение 40 мин и переносят к цинковому реагенту с помощью канюли, используя 0,36 л ТГФ для промывки. Смесь охлаждают до-10 С и добавляют кетоанилин 1 а. Смесь перемешивают при температуре в интервале от -2 до-8 С в течение 35 ч, нагревают до комнатной температуры, перемешивают 3 ч и реакцию гасят 30% карбонатом натрия за 1,5 ч. Смесь перемешивают 4 ч и твердый продукт удаляют фильтрацией и промывают ТГФ (2-ным объемом осадка на фильтре). Влажный твердый продукт, все еще содержащий 18 вес.% пирролидинил-норэфедрина, сохраняют для дальнейшего исследования. Фильтрат и промывные воды объединяют и обрабатывают 30% лимонной кислотой. Два слоя разделяют. Органический слой промывают водой (1,5 л). Объединенные водные слои экстрагируют 2,5 л толуола и оставляют для регенерации норэфедрина. Экстракт толуола объединяют с органическим раствором и концентрируют до 2,5 л. Толуол непрерывно подают и отгоняют до тех пор, пока ГХ (газовая хроматография) не покажет отсутствие ТГФ. Конечный объем ограничивают 3,9 л. Добавляют в течение 1 ч гептан (5,2 л). Суспензию охлаждают до 0 С, выдерживают в течение 1 ч и фильтруют. Твердый продукт промывают гептаном (2-ным объемом осадка на фильтре) и сушат, получая 1,234 кг (выход 95,2%) аминоспирта 3 в виде белого кристаллического вещества. Веществу соответствует 99,8 А% чистота и 99,3% ее (энантиомерный избыток). Пример 12. К раствору трифторэтанола, (1R,2S)-Nпирролидинилнорэфедрина в ТГФ (60 мл) в атмосфере азота добавляют раствор диэтилцинка в гексане при 0 С достаточно медленно, для того чтобы поддерживать температуру ниже 30 С. Смесь перемешивают при комнатной температуре в течение 0,51 ч. В другой сухой колбе получают раствор литий-циклопропилацетиленида следующим образом: к раствору циклопропилацетилена в ТГФ (80 мл) при 0 С добавляют достаточно медленно, так чтобы поддерживать температуру в интервале 30 С,раствор н-бутиллития. Смесь перемешивают при 0 С в течение 40 мин. Затем цинковый реагент переносят в мутный раствор литийацетиленида с помощью канюли, используя 10 мл ТГФ для промывки. Смесь выдерживают в течение 0,5 ч и добавляют кетоанилин 1. Смесь перемешивают при комнатной температуре 15,5 ч, ЖХВР-анализ этого раствора показывает выход порядка 74% и 89% ее. Пример 13. В трехгорлую круглодонную колбу, снабженную механической мешалкой, линией подачи азота и термопарой, загружают твердый аминоспирт 3, МТВЕ (метил-трет-бутиловый эфир)(500 мл) и водный КНСО 3 (45 г в 654 мл Н 2 О). Добавляют твердый 4-нитрофенилхлорформиат,4 порции, при 25 С. Во время добавления контролируют рН раствора. Во время реакции рН поддерживают между 8,5 и 4 и в конце поднимают до 8,0. Смесь перемешивают при 20-25 С 2 ч. Добавляют в течение 20 мин водный КОН(2 н.) до тех пор, пока рН водного слоя не достигнет 11,0. Слои разделяют и к МТВЕ слою добавляют 500 мл раствора соли. 0,1 н. Уксусную кислоту добавляют до тех пор, пока рН раствора не достигнет 6-7. Слои разделяют и органическую фазу промывают раствором соли (500 мл). Здесь смесь растворяют, переходя на EtOH/IPA (изо г 100 В трехгорлую круглодонную колбу, снабженную механической мешалкой, линией подачи азота и термопарой, загружают твердый аминоспирт 3 а, толуол (500 мл) и водный КНСО 3(86,5 г в 500 мл Н 2 О). Добавляют раствор фосгена в толуоле при 25 С и смесь перемешивают при 20-25 С 2 ч. Слои разделяют и органическую фазу промывают раствором соли (500 мл). Здесь смесь растворяют, переходя на EtOH/IPA, и кристаллизуют, как указано в примерах 16 и 17. Пример 15. В трехгорлую круглодонную колбу, снабженную механической мешалкой, линией подачи азота и термопарой, загружают твердый аминоспирт 3 а, МТВЕ (500 мл) и водный КНСО 3(86,5 г в 500 мл Н 2 О). Газообразный фосген медленно пропускают через раствор при 25 С до завершения реакции. Слои разделяют и органическую фазу промывают раствором соли (500 мл). Здесь смесь растворяют, переходя на EtOH/IPA, и кристаллизуют, как указано в примерах 16 и 17. Пример 16. Кристаллизация DMP-266 из 30% 2 пропанола в воду с использованием соотношения 15 мл растворителя на грамм DMP-266 и применением регулируемого введения антирастворителя в объеме 400 г. 400 г исходного вещества DMP-266 растворяют в 1,8 л 2-пропанола. Раствор фильтруют для удаления посторонних веществ. К раствору за 30-60 мин добавляют 1,95 л деионизо 29 ванной (DI) воды. К раствору добавляют 10-20 г затравки DMP-266 (форма II влажного осадка на фильтре). Затравочный слой выдерживают около 1 ч. Для перемешивания суспензии предпочтительно использовать Intermig мешалки. При необходимости (при наличии чрезвычайно длинных кристаллов или густой суспензии),суспензию измельчают мокрой в течение 15-60 с. К суспензии в течение 4-6 ч добавляют 2,25 лDI воды. При необходимости (при наличии чрезвычайно длинных кристаллов или густой суспензии), суспензию измельчают мокрой в течение 15-60 с во время добавления. Суспензию выдерживают от 2 до 16 ч до установления постоянной концентрации продукта в супернатанте. Суспензию фильтруют, отделяя на фильтре влажный кристаллический осадок. Влажный осадок на фильтре промывают, 1-2 объемами слоя, 30% 2-пропанолом в воде и затем дважды, каждый раз 1 объемом слоя, DI водой. Промытый влажный осадок на фильтре сушат в вакууме при 50 С. Пример 17. Кристаллизация DMP-266 из 30% 2 пропанола в воду с использованием соотношения 15 мл растворителя на грамм DMP-266 и использованием полунепрерывного способа в объеме 400 г. 400 г исходного вещества DMP-266 растворяют в 1,8 л 2-пропанола. Суспензию остатков получают, смешивания в кристаллизаторе 20 г формы II DMP-266 в 0,3 л 30% (в отношении объемов) 2-пропанола в воде или в оставшейся от предыдущей кристаллизации части суспензии. Растворенную партию и 4,2 л DI воды непрерывно загружают к суспензии остатков с постоянной скоростью в течение 6 ч, чтобы поддерживать постоянный состав растворителей в кристаллизаторе. Для перемешивания суспензии предпочтительно использовать Intermig мешалки. Во время добавления суспензию измельчают мокрой, когда длина кристаллов становится чрезвычайно большой или суспензия становится слишком густой. Суспензию выдерживают от 2 до 16 ч до установления постоянной концентрации продукта в супернатанте. Суспензию фильтруют, отделяя на фильтре влажный кристаллический осадок. Влажный осадок на фильтре промывают, 1-2 объемами слоя, 30% 2 пропанолом в воде и затем дважды, каждый раз 1 объемом слоя, DI водой. Промытый влажный осадок на фильтре сушат в вакууме при 50 С. Пример 18. Получение аминоспирта 3 и модернизированный способ повышения энантиомерного избытка (ее).ZnEt2 (0,892 М в гексане) ТГФ 30% К 2 СО 3 1 М лимонная кислота Гептан Изопропилацетат (IPAc) 12 н. НСl трет-Бутил-метиловый эфир (МТВЕ) Толуол(1R,2S)-N-пирролидинилнорэфедрина (1,35 кг,6,58 моль) в ТГФ (9 л), в атмосфере азота, при 0 С. Полученную смесь перемешивают при комнатной температуре в течение приблизительно 30 мин. В другой сухой колбе получают раствор хлормагний-циклопропилацетиленида следующим образом. К раствору нбутилмагнийхлорида в ТГФ (2 М, 2,68 л, 5,37 моль) добавляют чистый циклопропилацетилен при 0 С достаточно медленно, поддерживая температуру 25 С. Раствор перемешивают при 0 С в течение 12 ч. Затем раствор хлормагнийциклопропилацетиленида нагревают до комнатной температуры и переносят к цинковому реагенту с помощью канюли за 5 мин, с последующим ополаскиванием колбы 0,36 л ТГФ. Полученную смесь выдерживают при 30 С в течение 0,5 ч и затем охлаждают до 20 С. Добавляют кетоанилин 1 (1,00 кг, 4,47 моль) за одну порцию в виде твердого вещества и образовавшуюся смесь перемешивают при 20-28 С в течение 3 ч. Реакцию гасят 30% водным карбонатом калия (1,2 л) и смесь выдерживают 1 ч. Твердый отработанный продукт фильтруют и промывают ТГФ (3-ным объемом осадка на фильтре). Фильтрат и промывные воды объединяют и переходят к IPAc в качестве растворителя.IPAc раствор продукта 3 и пирролидинилнорэфедрина промывают лимонной кислотой(3,5 л) и водой (1,5 л). Объединенные водные слои экстрагируют IPAc (2 л) и оставляют для регенерации норэфедрина. К объединенным органическим слоям добавляют 12 н. НСl (405 мл, 4,88 моль), получая разбавленную суспензию аминоспирта-НСl-соли. Смесь выдерживают 30 мин при 25 С и затем азеотропно сушат. Суспензию выдерживают при 25 С 30 мин и фильтруют. Осадок на фильтре промывают 2,5 л IPAc и сушат при 25 С в вакууме/азоте в течение 24 ч, что дает 1,76 кг влажной HCl-соли. Соль растворяют в смеси МТВЕ (6 л) и водн. Nа 2 СО 3 (1,18 кг в 6,25 л воды). Слои раз 31 деляют и органический слой промывают 1,25 л воды. Затем органический слой растворяют,переходя на толуол. Добавляют гептан (5 л) в течение 1 ч при 25 С. Суспензию охлаждают до 0 С, выдерживают в течение 1 ч и фильтруют. Твердый продукт промывают гептаном (2-ным объемом осадка на фильтре) и сушат, получая 1,166 кг(общий выход 90%) аминоспирта 3 в виде белого кристаллического твердого вещества. Регенерация норэфедрина Водный раствор подщелачивают до рН 13,используя 50% водн. NaOH, и экстрагируют гептаном (2 л). Раствор в гептане промывают водой (1 л) и концентрируют, удаляя остаточные IPAc и воду. Конечный объем доводят приблизительно до 3 л. Раствор в гептане охлаждают до -20 С, выдерживают 2 ч и фильтруют. Твердое вещество промывают охлажденным гептаном (1 объемом осадка на фильтре) и сушат, получая 1,269 кг твердого продукта (регенерация 94%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулыa) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), Н(С 1-С 6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6 -алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1C6-алкил), N(C1-C6-aлкил)2, CONH2, CONH(C1C6-aлкил), СОN(С 1-С 6-алкил)2, NHCONH2, NНNHCON(C1-C6-алкил)2,СОNН(С 1-С 6-алкил),арил, СО 2-C1-C6-алкил, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-C6-алкокси, где С 1-С 6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-C6-алкокси, NO2 или галогеном (Cl, Br, F, I);R6 обозначает С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, СO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси; включающий стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, содержащей один или более способных к обмену протонов, или, в альтернативном случае, к смеси первой хиральной добавки, содержащей один и только один способный к обмену протон, и второй добавки, в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или, в альтернативном случае, без этой дополнительной стадии, где первая хиральная добавка содержит более одного способного к обмену протона, или где вторую добавку вводят на стадии а);c) смешивания хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К,Zn, MgX1, CuX1 или B(X1)2; a X1 обозначает Cl,Br, I, F или СF3SO2; в растворителе в интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса иd) смешивания карбонилсодержащего соединения формулы необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. 2. Способ по п.1 получения соединения формулы Ia) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(C1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или С 1-С 6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Сl, Br, F, I), CF3, CN, NO2, NH2, NH(C1C6-алкил), N(С 1-С 6-алкил)2, CONH2, CONH(C1C6-алкил),CON(C1-С 6-алкил)2,NHCONH2,NHCONH(C1-C6-алкил), NHCON(C1-C6-алкил)2,арил, CO2-C1-С 6-алкил, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-С 6-алкокси, где C1-С 6-алкил, незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I);a) Н,b) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(C1-С 6-алкил), N(C1-С 6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-С 6-алкил),NHCON(C1-С 6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;R6 обозначает С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, СОNH(С 1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси; включающий стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением хирального комплекса цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей 34 хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон;c) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6M, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или CF3SO2; в растворителе в интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса иd) смешивания карбонилсодержащего соединения формулы необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. 3. Способ по п.1 получения соединения формулы Ia) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6aлкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(C1-C6-алкил), N(С 1-С 6 алкил)2, CONH2, СОNН(С 1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-С 6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;b) фенил, дифенил или нафтил, незамещенный или замещенный одним-четырьмя заместителями, которые выбирают из R1, R2, R3 иR1, R2, R3 и R4 независимо обозначают галоген (Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1C6-алкил), N(С 1-С 6-алкил)2, CONH2, СОNН(С 1 С 6-алкил), СОN(С 1-С 6-алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2,арил, СО 2-C1-С 6-алкил, C1-С 6-алкил, С 2-С 6 алкенил, С 2-С 6-алкинил, С 3-С 7-циклоалкил илиC1-С 6-алкокси, где C1-C6-алкил незамещенный или замещенный арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-С 6-алкилом, C1-С 6-алкокси, NO2 или галогеном (Cl, Br, F, I);a) Н,b) C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3,CN, NO2, NH2, NH(C1-С 6-алкил), N(C1-C6aлкил)2, CONH2, CONH(C1-C6-aлкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-aлкил), 35R6 обозначает С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), СF3,CN, NO2, NH2, NH(С 1-С 6-алкил), N(C1-C6aлкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-С 6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси; включающий стадииa) медленного добавления диалкилцинка в растворителе или в чистом виде к смеси первой хиральной добавки, содержащей один и только один способный к обмену протон, и второй добавки в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением второй добавки, содержащей хиральный комплекс цинка;b) смешивания второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6 М, где М обозначает Li, Na, К, Zn, MgX1, CuX1 или B(X1)2; aX1 обозначает Cl, Br, I, F или СF3SO2; в растворителе в интервале температур от -20 до около 60 С с получением хирального цинкорганического комплекса иc) смешивания карбонилсодержащего соединения формулы необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около -20 до около 60 С в течение приблизительно от 1 до 72 ч. 4. Способ по п.1, отличающийся тем, что первая хиральная добавка имеет формулу или ее энантиомер или диастереомер, а заместители определяются следующим образом: 36 щенный заместителем, который выбирают из группы, включающей галоген (Сl, Вr, F, I), СF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-C6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СО 2-C1-C6-алкил, С 3-С 7 циклоалкил или C1-С 6-алкокси;j) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу; так что один и только один из R7, R8, R11 или R12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром; так что другой из радикалов R11 или R12 обозначает водород; или так что другой из радикалов R7 или R8 обозначает водород;R14 обозначает Н, за исключением случая,когда R7 или R8 и R14 вместе могут образовывать углерод-углеродную связь, когда t равно 1 или 2, а R11 или R12 обозначаетR15 или R16 обозначает C1-С 6-алкил, С 2-С 6 алкенил или С 2-С 6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген(Cl, Br, F, I), СF3, CN, NO2, NH2, NH(C1-C6 алкил), N(C1-C6-алкил)2, CONH2, CONH(C1-С 6 алкил),СОN(С 1-С 6-алкил)2,NHCONH2,NHCONH(C1-C6-алкил), NHCON(C1-С 6-алкил)2, 37 СО 2-С 1-С 6-алкил, С 3-С 7-циклоалкил или C1-C6 алкокси; так что другой радикал из R15 или R16 обозначает водород;R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил; обозначает шестичленный цикл, ненасыщенный или насыщенный, необязательно,замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-C6-алкилом; обозначает пятичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-C6-алкилом;s обозначает 1 или 2. 5. Способ по п.4, отличающийся тем, что диалкилцинк определяется как[С 1-С 6 алкил]2Zn. 6. Способ по п.5, отличающийся тем, что вторая добавка определяется как ROH, RSH,RCO2H, RSО 3 Н, HХ, RCONH2 или арил NН 2; иR обозначает C1-C6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, арил, где арил определяется как фенил или нафтил, и гетероарил, где гетероарил определяется как 5- или 6-членный ароматический цикл, замещенный одним или двумя гетероатомами, которые выбирают из О, S, N, и каждый из которых незамещен или замещен одним,двумя или тремя заместителями, которые выбирают из группы, включающей NO2, Cl, Br, I, F,СF3, C1-С 6-алкил, C1-C6-алкокси и N[C1-C6 алкил]2; а Х обозначает Cl, Br, I или F. 7. Способ по п.6, отличающийся тем, что в нем в качестве растворителя используют полярный или неполярный апротонный растворитель или смесь указанных растворителей. 38 8. Способ по п.7, отличающийся тем, что первую хиральную добавку выбирают из группы, включающей (1R,2S)-N-пирролидинилнорэфедрин, N-метилэфедрин, эфедрин, N,Nдибензилнорэфедрин, норэфедрин, диэтилтартрат, (1R,2R)-псевдоэфедрин и (1S,2S)-метилпсевдоэфедрин. 9. Способ по п.8, отличающийся тем, что диалкилцинк представляет собой диэтилцинк и диметилцинк. 10. Способ по п.9, отличающийся тем, что вторая добавка определяется как МеОН, третВuОН, (СН 3)3 ССН 2 ОН, (СН 3)3 ССН(СН 3)ОН,Сl3 ССН 2 ОН,F3 ССН 2 ОН,Рh3 СОН,СН 2=СНСН 2 ОН, РhСН 2 ОН, (СН 3)2NCH2CH2OH,4-NO2-фенол,СН 3 СО 2 Н,СF3 СO2 Н и(СН 3)ССО 2 Н. 11. Способ по п.10, отличающийся тем, что растворитель обозначает тетрагидрофуран(NMP) или смеси указанных растворителей. 12. Способ получения аминоспирта формулы где R1 обозначает галоген (Cl, Br, F, I), СF3, CN,NO2, NH2, NH(C1-С 6-алкил), N(С 1-С 6-алкил)2,CONH2,СОNН(С 1-С 6-алкил),СОN(С 1-С 6 алкил)2, NHCONH2, NНСОNН(С 1-С 6-алкил),NHCON(C1-C6-алкил)2, арил, CO2-C1-C6-алкил,C1-С 6-алкил, С 2-С 6-алкенил, С 2-С 6-алкинил, С 3 С 7-циклоалкил или C1-С 6-алкокси, где C1-C6 алкил незамещен или замещен арилом, арил обозначает фенил, дифенил или нафтил, незамещенный или замещенный C1-C6-алкилом, C1 С 6-алкокси, NO2 или галогеном (Cl, Br, F, I);R4 обозначает NH2 или NH(C1-С 6-алкил),где C1-C6-алкил является незамещенным или замещенным арилом, арил обозначает фенил или нафтил, незамещенный или замещенный C1 С 6-алкилом, C1-С 6-алкокси, NO2 или галогеномR6 обозначает С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3,CN, NO2, NH2, NН(С 1-С 6-алкил), N(С 1-С 6 алкил)2, CONH2, CONH(C1-С 6-алкил), CON(C1 С 6-алкил)2, NHCONH2, NHCONH(C1-C6-алкил),NHCON(C1-C6-алкил)2, СO2-C1-С 6-алкил, С 3-С 7 циклоалкил или C1-C6-алкокси; включающий стадии а) медленного добавления диалкилцинка в растворителе или в чистом виде к первой хиральной добавке, содержащей один или более способных к обмену протонов, или, в альтернативном случае, к смеси первой хиральной до 39 бавки, содержащей один и только один способный к обмену протон, и второй добавки в растворителе в инертной атмосфере при температуре приблизительно от около -78 до около 50 С с получением хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка;b) добавления второй добавки к хиральному комплексу цинка и нагревание реакционной смеси приблизительно от около 10 до около 70 С с получением второй добавки, содержащей хиральный комплекс цинка, где первая хиральная добавка содержит один и только один способный к обмену протон, или в альтернативном случае, без этой дополнительной стадии, где первая хиральная добавка содержит более одного способного к обмену протона, или где вторую добавку вводят на стадии а);c) смешивания хирального комплекса цинка или второй добавки, содержащей хиральный комплекс цинка, с металлоорганическим реагентом формулы R6 М, где М обозначает Na, К, Li,MgX1, ZnX1, CuX1 или B(X1)2; a X1 обозначает Сl, Br, I, F или СF3SO2; в растворителе с получением хирального цинкорганического комплекса и необязательно растворенного в растворителе, с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от около 0 до около 60 С в течение приблизительно от 1 до 72 ч. 13. Способ по п.12, отличающийся тем, что первая хиральная добавка имеет формулуj) R7 и R8 или R11 и R12, взятые вместе, могут представлять =O, образуя кетонную, амидную, кислотную или сложноэфирную группу; так что один и только один из R7, R8, R11 или R12 может иметь это значение, за исключением случая, когда, по меньшей мере, один из двух углеродов, содержащих R7, R8, R9, R10, R11 и R12 является хиральным центром; так что другой из радикалов R11 или R12 обозначает водород или так что другой из радикалов R7 или R8 обозначает водород;R14 обозначает Н, за исключением случая,когда R7 или R8 и R14 вместе могут образовывать углерод-углеродную связь, когда t равно 1 или 2, a R11 или R12 обозначает или ее энантиомер или диастереомер, а заместители определяются следующим образом:a) Н,b) СF3,c) CN,d) CONH2,e) СОNН(С 1-С 6-алкил),f) CON(С 1-С 6-алкил)2,g) СО 2-C1-C6-алкил,h) С 3-С 7-циклоалкил,i) C1-C6-алкил, С 2-С 6-алкенил или С 2-С 6 алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген (Cl, Br, F, I), CF3,R15 или R16 обозначает C1-C6-алкил, С 2-С 6 алкенил или С 2-С 6-алкинил, незамещенный или моно- или дизамещенный заместителем, который выбирают из группы, включающей галоген 41 алкокси; так что другой радикал из R15 и R16 обозначает водород;R17 обозначает C1-C6-алкил, незамещенный или замещенный арилом, или арил, где арил определяется как фенил или нафтил; обозначает шестичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-С 6-алкилом; обозначает пятичленный цикл, ненасыщенный или насыщенный, необязательно замещенный одним или двумя гетероатомами,которые выбирают из N, О или S, необязательно замещенный C1-C6-алкилом;s обозначает 1 или 2. 14. Способ по п.13, отличающийся тем, что диалкилцинк определяется как[С 1-С 6 алкил]2Zn. 15. Способ по п.14, отличающийся тем, что вторая добавка определяется как ROH, RSH,RCO2H, RSO3H, HX, RCONH2 или арил NН 2; иR обозначает C1-C6-алкил, С 2-С 6-алкенил, С 2-С 6 алкинил, арил, где арил определяется как фенил или нафтил, и гетероарил, где гетероарил определяется как 5- или 6-членный ароматический цикл, замещенный одним или двумя гетероатомами, которые выбирают из О, S, N, и каждый из которых незамещен или замещен одним,двумя или тремя заместителями, которые выбирают из группы, включающей NO2, Cl, Br, I, F,СF3, C1-C6-алкил, C1-C6-алкокси и N[C1-C6 алкил]2; а Х обозначает Cl, Br, I или F. 16. Способ по п.15, отличающийся тем, что в качестве растворителя используют как полярный или неполярный апротонный растворитель или смеси указанных растворителей. 17. Способ по п.16, отличающийся тем, что первую хиральную добавку выбирают из груп 002192 42 пы, включающей (1R,2S)-N-пирролидинилнорэфедрин, N-метилэфедрин, эфедрин, N,Nдибензилнорэфедрин, норэфедрин, диэтилтартрат, (1R,2R)-псевдоэфедрин и (1S,2S)-метилпсевдоэфедрин. 18. Способ по п.17, отличающийся тем, что диалкилцинк представляет собой диэтилцинк и диметилцинк. 19. Способ по п.18, отличающийся тем, что вторая добавка определяется как МеОН, третВuОН, (СН 3)3 ССН 2 ОН, (СН 3)3 ССН(СН 3)ОН,Рh3 СОН,Сl3 ССН 2 ОН,F3CСН 2 ОН,СН 2=СНСН 2 ОН, РhСН 2 ОН, (СН 3)2NCH3CH2OH,СН 3 СО 2 Н,СF3 СО 2 Н и 4-NO2-фенол,(СН 3)ССO2 Н. 20. Способ по п.19, отличающийся тем, что растворитель выбирают из группы, включающей тетрагидрофуран (ТГФ), бензол, хлорбензол, о-, м-, п-дихлорбензол, дихлорметан, толуол, гексан, циклогексан, пентан, метил-третбутиловый эфир (МТВЕ), диэтиловый эфир, Nметилпирролидин (NMP) или смеси указанных растворителей. 21. Способ по п.20, отличающийся тем, что металлоорганический реагент имеет формулуR6M, где R6 обозначает С 2-С 6-алкинил; М обозначает Li или MgX1; а Х 1 обозначает Cl, Br, I или F или СF3SО 2. 22. Способ получения аминоспирта формулыa) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к(1R,2S)-N-пирролидинилнорэфедрину в тетрагидрофуране в атмосфере азота при температуре приблизительно от около -20 до около 0 С с получением хирального комплекса цинка;b) добавления спирта, который представляет собой неопентиловый спирт или 2,2,2 трифторэтанол, к хиральному комплексу цинка и нагревание до образования спиртсодержащего хирального комплекса цинка;c) смешивания спиртсодержащего хирального комплекса цинка с в тетрагидрофуране до образования хирального цинкорганического комплекса и с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от 0 до 20 С в течение приблизительно от 2 до 48 ч с получением аминоспирта. 23. Способ получения аминоспирта формулыa) медленного добавления диметилцинка или диэтилцинка в толуоле или в чистом виде к(1R,2S)-N-пирролидинилнорэфедрину и спирту,представляющим собой неопентиловый спирт или 2,2,2-трифторэтанол, в тетрагидрофуране в атмосфере азота при температуре приблизительно от -20 до 0 С с получением спиртсодержащего хирального комплекса цинка;b) смешивание спиртсодержащего хирального комплекса цинка с в тетрагидрофуране с образованием хирального цинкорганического комплекса и с) смешивание кетона формулы с раствором хирального цинкорганического комплекса в инертной атмосфере при температуре приблизительно от 0 до 20 С в течение приблизительно от 2 до 48 ч с получением аминоспирта.
МПК / Метки
МПК: C07C 215/58, C07D 265/18
Метки: использующая, присоединения, эффективная, реагент, реакция, цинкорганический, энантиоселективного
Код ссылки
<a href="https://eas.patents.su/23-2192-effektivnaya-reakciya-enantioselektivnogo-prisoedineniya-ispolzuyushhaya-cinkorganicheskijj-reagent.html" rel="bookmark" title="База патентов Евразийского Союза">Эффективная реакция энантиоселективного присоединения, использующая цинкорганический реагент</a>
Предыдущий патент: Состав и способ для снижения шума и/или загрязнения в системе жидкостного охлаждения двигателя
Следующий патент: Ингалятор для порошкообразных лекарственных средств
Случайный патент: Способ введения таксана пациенту, нуждающемуся в лечении таксаном, способ лечения человека таксаном