Полиглутаминовые кислоты, функционализированные катионными и гидрофобными группами, и их применения, в частности терапевтические применения
Формула / Реферат
1. Полиаминокислота, содержащая остатки глутаминовой кислоты, где некоторые остатки глутаминовой кислоты несут боковую катионную группу, которая, если она может быть депротонирована, имеет pKa, большее или равное 7, причем указанные катионные группы являются одинаковыми или различными и соответствуют следующей формуле:
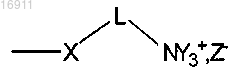
в которой X представляет собой O, NH;
Y представляет собой независимо Н или CH3;
Z представляет собой хлорид, сульфат, фосфат или ацетат;
L представляет собой линейный (C2-C6)алкилен, необязательно замещенный функциональной карбоксильной группой -CORa, где Ra представляет собой гидрокси, алкокси или аминоалкильную группу;
или выбраны из группы радикалов формулы
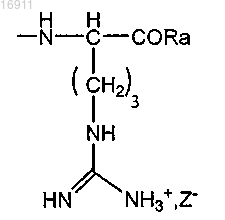
где Ra представляет собой гидрокси-, алкокси- или аминоалкильную группу;
Z- представляет собой хлорид, сульфат, фосфат или ацетат;
или
где Z- представляет собой хлорид, сульфат, фосфат или ацетат,
а другие остатки глутаминовой кислоты несут боковые гидрофобные группы (GH), которые являются одинаковыми или различными и выбраны из группы, состоящей из
линейных или разветвленных C8-C30-алкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S;
C8-C30-алкиларилов или арилалкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S; и
C8-C30-(поли)циклических соединений, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S,
а также ее фармацевтически приемлемые соли.
2. Полиаминокислота по п.1, где боковые катионные группы формулы
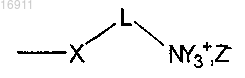
выбраны из следующей группы радикалов:
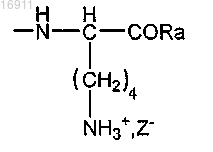
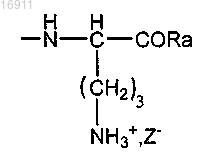
где Ra представляет собой гидрокси-, алкокси- или аминоалкильную группу;
Z- представляет собой хлорид, сульфат, фосфат или ацетат,
или

где Z- представляет собой хлорид, сульфат, фосфат или ацетат.
3. Полиаминокислота по п.1 или 2, которая является катионной при pH 4-5 и нейтральной или слабо заряженной при нейтральных значениях pH.
4. Полиаминокислота по п.1 или 2, где боковые катионные группы привиты к остаткам глутаминовой кислоты через амидную или сложноэфирную связь.
5. Полиаминокислота по любому из предыдущих пунктов, которая состоит из L-глутамата или гомополимеров L-глутаминовой кислоты, присоединенных к полиаминокислоте по ее карбоксильным группам в альфа-положении.
6. Полиаминокислота по любому из предыдущих пунктов, которая содержит в среднем по меньшей мере три гидрофобные группы (GH) на полимерную цепь.
7. Полиаминокислота по любому из предыдущих пунктов, где другие остатки глутаминовой кислоты несут боковые неионизируемые группы, отличающиеся от гидрофобных групп (GH), причем указанные неионизируемые группы могут быть одинаковыми или различными.
8. Полиаминокислота по п.7, где указанной неионизируемой группой является гидроксиэтиламиногруппа.
9. Полиаминокислота по любому из предыдущих пунктов, где другие остатки глутаминовой кислоты несут группу, которая является неионизируемой при нейтральных pH, отличную от гидрофобных групп (GH), причем указанные группы, неионизируемые при нейтральных pH, являются одинаковыми или различными.
10. Полиаминокислота по п.9, где неионизируемая группа, которая является неионизируемой при нейтральных pH, имеет следующую формулу:
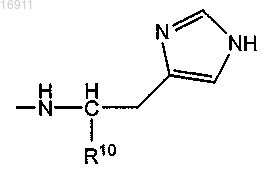
в которой -R10 представляет собой -H, -CO2H, остаток сложного алкилового эфира, -CH2OH, -C(=O)-NH2,
-C(=O)-NH-CH3 или -C(=O)-N(CH3)2.
11. Полиаминокислота по любому из предыдущих пунктов, которая несет по меньшей мере одну привитую полиалкиленовую группу, присоединенную к остатку глутаминовой кислоты.
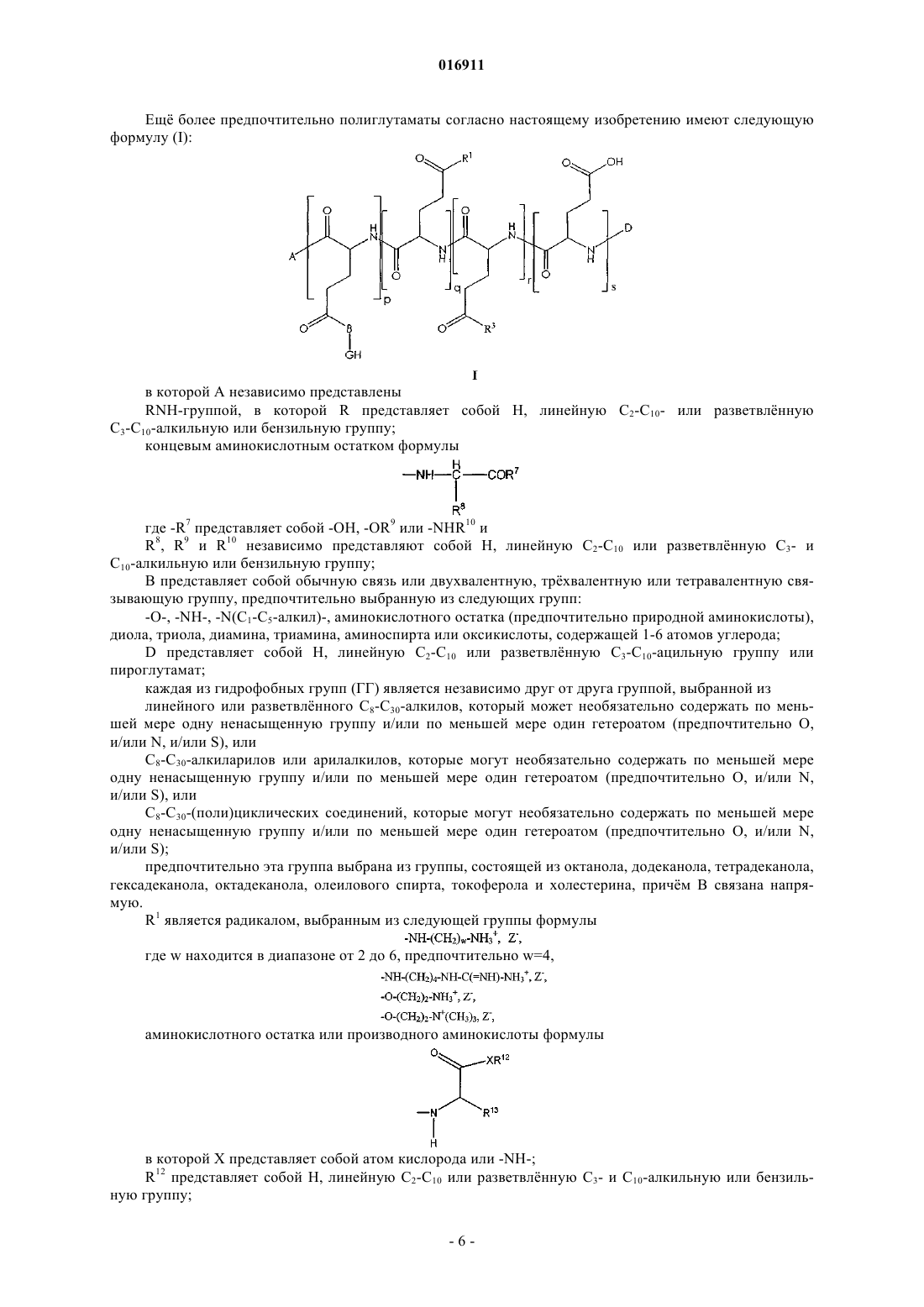
12. Полиаминокислота по любому из предыдущих пунктов, которая имеет следующую формулу:
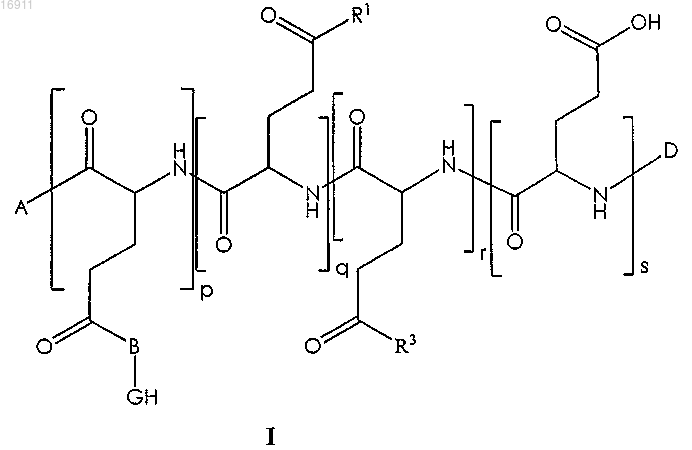
в которой А независимо представляет собой
RNH-группу, где R представляет собой H, линейную C2-C10- или разветвленную C3-C10-алкильную или бензильную группу,
концевой аминокислотный остаток формулы

в которой -R7 представляет собой -OH, -OR9 или -NHR10,
R8, R9 и R10 независимо представляют собой H, линейную C2-C10- или разветвленную C3- и C10-алкильную или бензильную группу;
B представляет собой простую связь или двухвалентную, трехвалентную или четырехвалентную связывающую группу, выбранную из следующих групп:
-O-, -NH-, -N(C1-C5-алкил)-, аминокислотного остатка, диола, триола, диамина, триамина, аминоспирта или гидроксикислоты, содержащей 1-6 атомов углерода;
D представляет собой Н, линейную C2-C10- или разветвленную C3-C10-ацильную группу или пироглутамат;
каждая из гидрофобных групп (GH) является независимо друг от друга группой, выбранной из
линейного или разветвленного C8-C30-алкила, который может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S, или
C8-C30-алкиларила или арилалкила, который может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N, S, или
C8-C30-(поли)циклического соединения, которое может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S;
R1 является группой, имеющей одну из следующих формул:
где w находится в диапазоне 2-6,
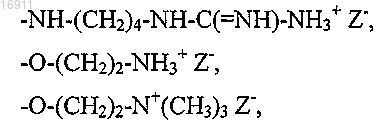
или является аминокислотным остатком или производным аминокислоты формулы
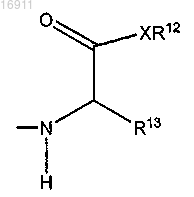
в которой X представляет собой атом кислорода или -NH-;
R12 представляет собой Н, линейную C2-C10- или разветвленную C3- и C10-алкильную или бензильную группу;
R13 представляет собой
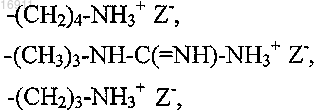
где противоион Z- является хлоридом, сульфатом, фосфатом или ацетатом;
R3 представляет собой гидроксиэтиламиногруппу, алкиленгликоль, полиалкиленгликоль или группу формулы
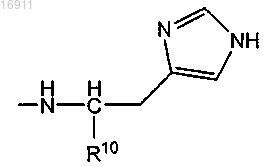
где -R10 представляет собой -H, -CO2H, остаток сложного алкилового эфира, -СН2ОН, -C(=O)-NH2, -C(=O)-NH-CH3 или -C(=O)-N(CH3)2;
p, q, r и s являются положительными целыми числами;
(p)/(p+q+r+s) определяется как молярная степень прививки гидрофобных групп (GH) и варьирует от 2 до 99 мол.% при условии, что каждая цепь сополимера содержит в среднем по меньшей мере три гидрофобные привитые группы;
(q)/(p+q+r+s) определяется как молярная степень прививки катионных групп и варьирует от 1 до 99 моль.%;
(p+q+r+s) варьирует от 10 до 1000;
(r)/(p+q+r+s) варьирует от 0 до 98 мол.%;
(s)/(p+q+r+s) варьирует от 0 до 98 мол.%,
или ее фармацевтически приемлемая соль.
13. Косметическая композиция, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12.
14. Диетическая композиция, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12.
15. Композиция препаратов для защиты растений, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12.
16. Фармацевтическая композиция, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12.
17. Композиция по п.16, содержащая по меньшей мере одно активное начало.
18. Композиция по п.17, где активное начало ассоциировано с полиаминокислотой(ми), содержащей остатки глутаминовой кислоты, модифицированные катионными группами, одной или более связями, отличными от ковалентных химических связей.
19. Композиция по любому из пп.16-18, где активное начало выбрано из группы, состоящей из ДНК, фрагмента ДНК, РНК и олиго-РНК.
20. Композиция по любому из пп.16-19, представляющая собой коллоидную суспензию наночастиц, и/или микрочастиц, и/или мицелл полиаминокислоты, содержащей остатки глутаминовой кислоты, модифицированные катионными группами, в водной или масляной фазе.
21. Композиция по п.20, в которой суспензия представляет собой коллоидный раствор наночастиц в водной фазе при кислых pH, которые осаждаются при физиологических значениях pH.
22. Способ получения лекарственного средства для перорального, назального, пульмонального, вагинального, офтальмологического, подкожного, внутривенного, внутримышечного, внутрикожного, внутрибрюшинного или внутрицеребрального введения, причем активным началом лекарственного средства являются белки, гликопротеины, белки, связанные с одной или несколькими цепями полиалкиленгликоля, пептиды, полисахариды, липосахариды, олигонуклеотиды, полинуклеотиды и гидрофобные, гидрофильные или амфифильные низкомолекулярные органические соединения, который предусматривает использование по меньшей мере одной полиаминокислоты по любому из пп.1-12 и/или композиции по любому из пп.16-21.
Текст
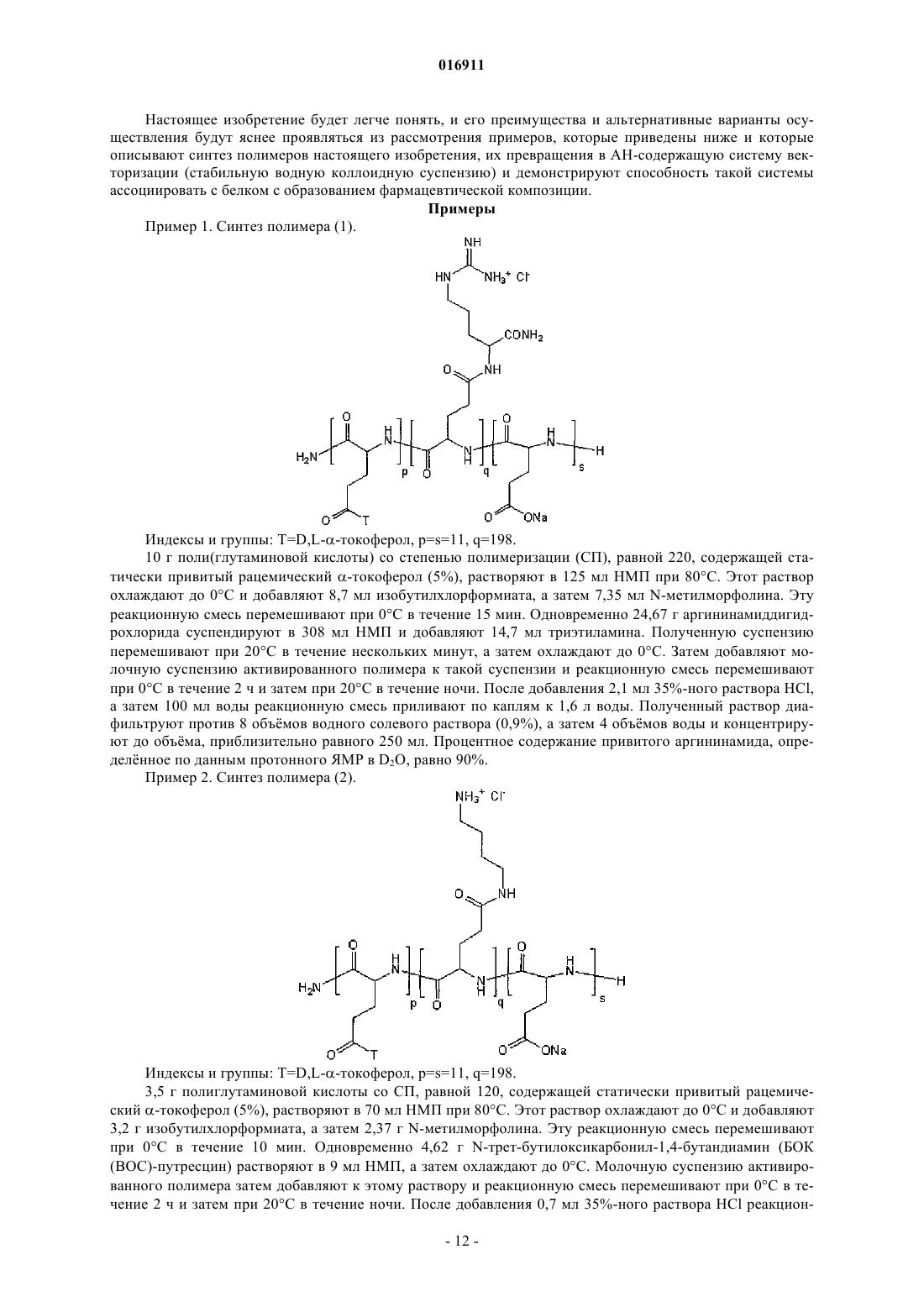
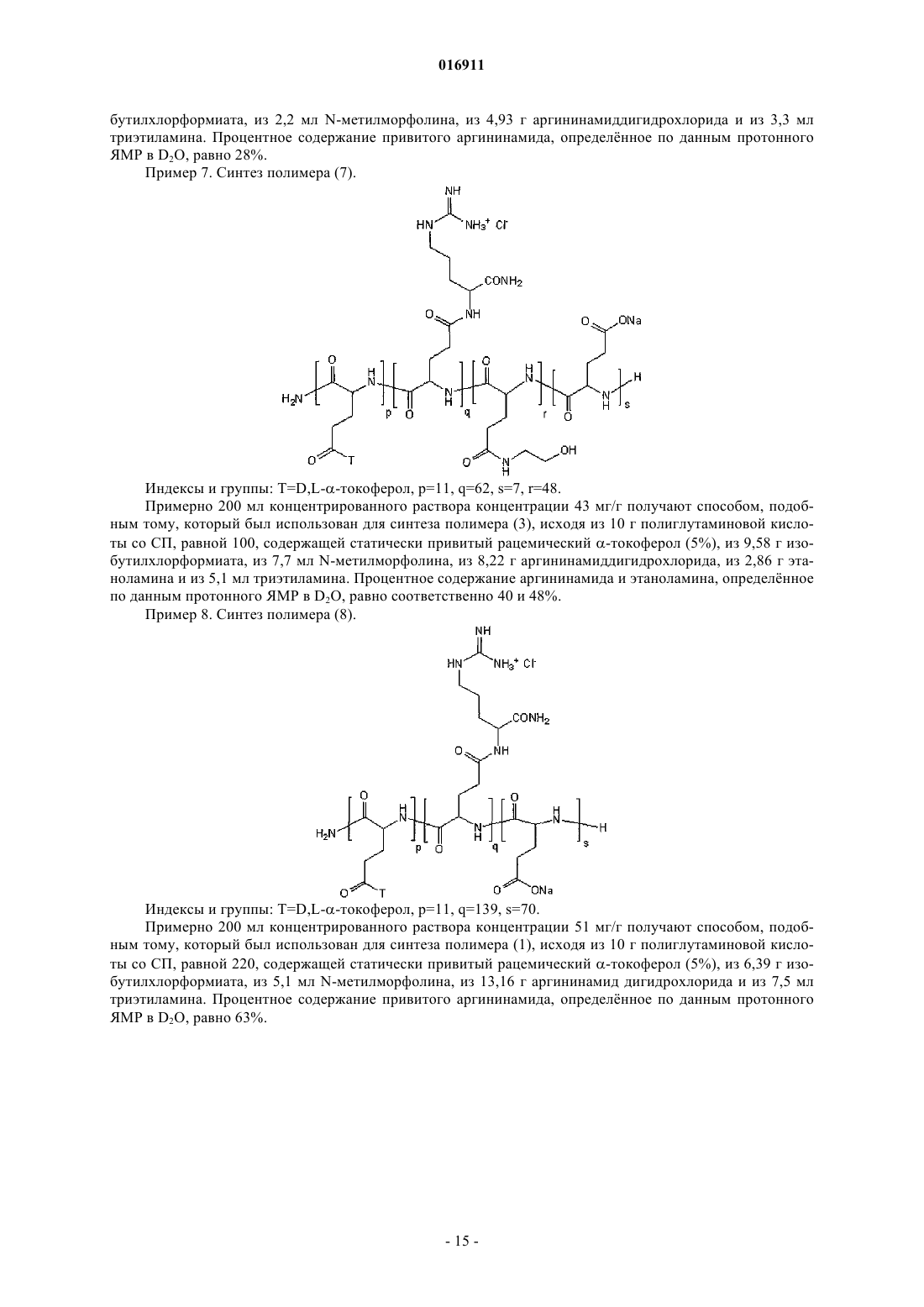
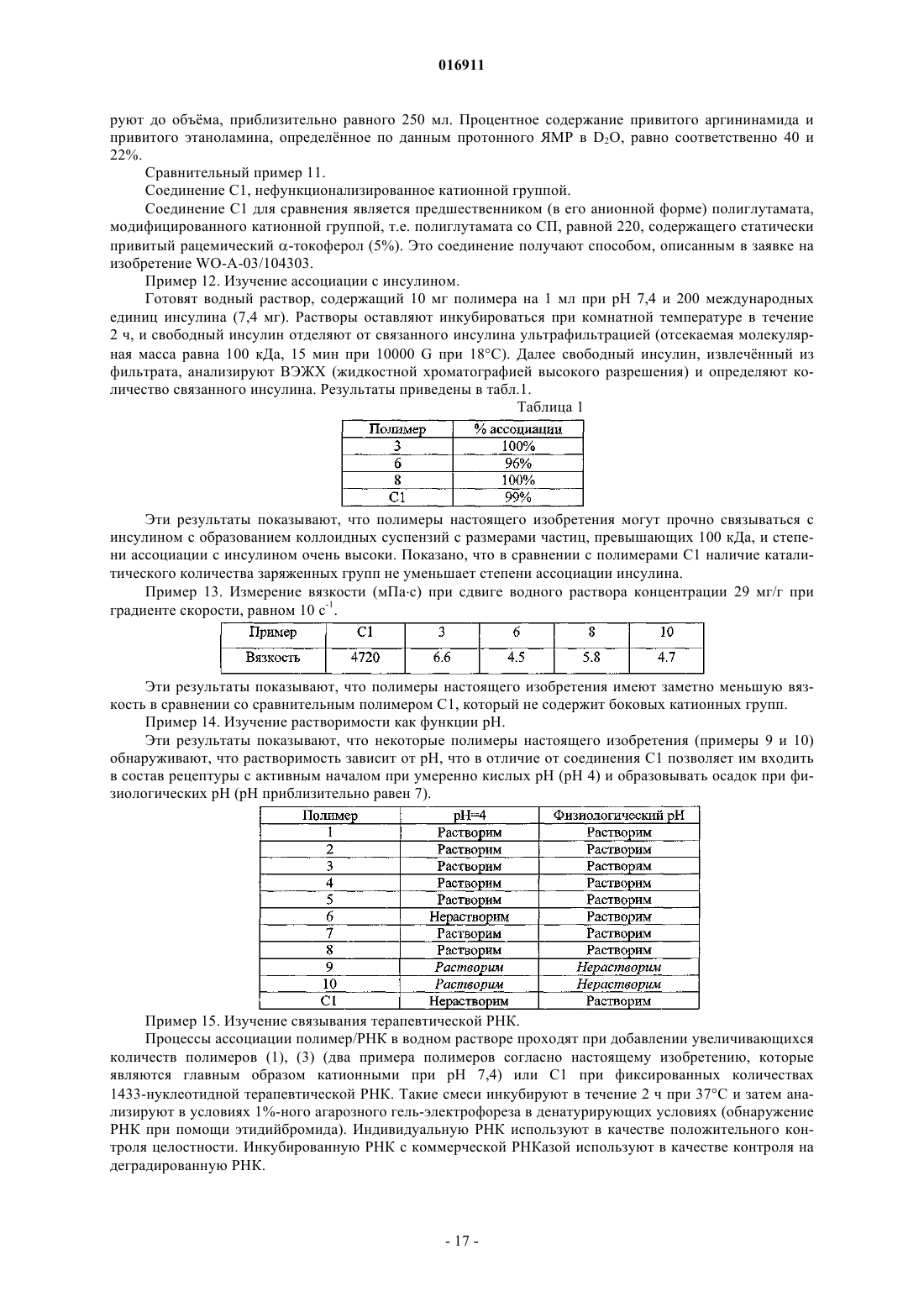
Изобретение относится к новым биодеградируемым материалам на основе модифицированных полиаминокислот, используемым, в частности, для векторизации активного начала. Изобретение также направлено на новые композиции, включающие фармацевтические, косметические,диетические пищевые продукты или препараты для защиты растений, основанные на этих полиаминокислотах. Целью изобретения является предоставление нового полимерного материала,который может быть использован в качестве исходного продукта для векторизации активного начала и который удовлетворяет всем требованиям: биосовместимости, биодеградируемости,способности легко ассоциировать или растворять многочисленные активные начала и высвобождать эти активные начала in vivo. Эта цель достигается настоящим изобретением, которое связано с новыми полиглутаматами, модифицированными катионными группами, которые, если они могут быть депротонированы, имеют pKa, равный или больший 7, и гидрофобными группами,содержащими от 8 до 30 атомов углерода. Такие полиглутаматы, модифицированные катионными группами, легко и рентабельно превращают в частицы для векторизации активных начал, причм эти частицы сами способны образовывать стабильные водные коллоидные суспензии. Такие модифицированные полиглутаматы имеют то преимущество, что они являются менее вязкими, чем другие аналогичные полимеры, в то же время сохраняя способность ассоциировать с белками,например с инсулином. Некоторые из них растворимы в воде при кислых pH и становятся нерастворимыми при физиологическом pH (7,4) и поэтому должны осаждаться при подкожном введении, в месте инъекции. Шан Йу-Пинг, Брейн Оливье, Бонне Гонне Сесиль (FR) Агуреев А.П. (RU) 016911 Область техники, к которой относится изобретение Настоящее изобретение относится к новым биодеградируемым материалам, содержащим сополиаминокислоты, применяемым при векторизации активного начала (АН). Данное изобретение также направлено на получение новых фармацевтических, косметических композиций, композиций диетических пищевых продуктов или препаратов для защиты растений, содержащих эти модифицированные полиаминокислоты. Эти композиции могут относиться к типу, который делает возможным векторизацию АН, и предпочтительно доступны в форме эмульсий, мицелл, наночастиц, микрочастиц, гелей, имплантатов или плнок. Подходящие АН являются преимущественно биологически активными соединениями, которые могут быть введены в организм животного или человека при использовании перорального, парентерального, назального, глазного, подкожного, внутривенного, внутримышечного, внутрикожного, внутрибрюшинного, внутримозгового или трансбуккального способа и т.п. АН, к которым изобретение относится в наибольшей степени, но без ограничений, представляют собой белки, гликопротеины, пептиды, полисахариды, липополисахариды, олиго- или полинуклеотиды и органические молекулы. Однако рассматриваются также косметические продукты или препараты для защиты растений, такие как гербициды, инсектициды, фунгициды и т.п. Уровень техники В области векторизации АН, в особенности медицинские АН, необходимо защитить их от разложения (гидролиза, ферментативного расщепления и т.п.), и/или контролировать скорость их выведения для поддержания терапевтического уровня в течение определнного периода времени, и/или транспортировать их (при их одновременной защите) к месту воздействия. С этой целью изучено несколько типов полимеров и некоторые из них являются даже коммерчески доступными. Примеры таких полимеров включают в себя полимолочную кислоту, полимолочную/полигликолевую кислоту, полиоксиэтилен/полиоксипропилен, полиаминокислоты или полимеры полисахаридов. Эти полимеры используют в качестве исходных продуктов, например, для получения массивных имплантатов, микрочастиц, наночастиц, везикул, мицелл или гелей. Не говоря о том, что эти полимеры используют для получения таких систем, они также должны быть биосовместимыми, нетоксичными, неиммуногенными и рентабельными, и они должны быть способными легко выводиться из организма, т.е. должны быть биодеградируемыми. Что касается последнего аспекта, ещ важнее, чтобы биодеградация в организме приводила к образованию нетоксичных продуктов. Ниже для иллюстрации известного уровня техники, относящегося к полимерам, используемым в качестве исходных продуктов для получения систем векторизации АН, упоминаются различные патенты,заявки на патент и научные статьи. В патенте US-B-4652441 описаны полилактидные микрокапсулы, инкапсулирующие гормонLH-RH. Эти микрокапсулы получают приготовлением эмульсии вода-масло-вода, содержащей водный внутренний слой, содержащий гормон, вещество (желатину), которое фиксирует последний, масляный полилактидный слой и водный внутренний слой (поливиниловый спирт). Выведение АН происходит за время более двух недель после подкожной инъекции. В патенте US-B-6153193 описаны композиции на основе амфифильных мицелл поли(оксиэтилен)/поли(оксипропилена) для векторизации противораковых агентов, например доксорубицина.Akiyoshi et al. (J. Controlled Release, 1998, 54, 313-320) описывает пуллуланы, которым придают гидрофобность прививкой холестерина и которые образуют наночастицы в воде. Такие наночастицы,способные обратимо образовывать комплекс с инсулином, образуют стабильные коллоидные суспензии. В патенте US-B-4351337 описаны амфифильные сополиаминокислоты на основе лейцина и глутамата, которые могут быть использованы для получения имплантатов или микрочастиц для контролируемого выведения активных начал. Выведение активных начал может происходить в течение очень длительного периода времени в зависимости от скорости разложения полимера. В патенте US-B-4888398 описаны полимеры на основе полиглутамата или полиаспартата и необязательно полилейцина с алкилоксикарбонилметильными группами, расположенными статистически вдоль цепи полиаминокислотной цепи. Такие полиаминокислоты, модифицированные по боковым группам,например метоксикарбонилметильными группами, могут быть использованы в форме биодеградируемых имплантатов, включающих АН для замедленного высвобождения. В патенте US-B-5904936 описаны наночастицы, полученные из блок-сополимера полилейцин/полиглутамат, способные образовывать стабильные коллоидные суспензии и способные спонтанно присоединяться к биологически активным белкам, не вызывая их денатурации. Далее активные белки контролируемо выводятся in vivo в течение длительного времени. В патенте US-B-5449513 описаны амфифильные блок-сополимеры, содержащие блок полиоксиэтилена и блок полиаминокислоты, например поли(-бензил-L-аспартат). Такие полиоксиэтилен/полибензиласпартатные сополимеры образуют мицеллы, способные инкапсулировать гидрофобные активные молекулы, например доксорубицин или индометацин.-1 016911 В заявке на патент WO-A-99/61512 описаны полилизины и полиорнитины с гидрофобной группой(пальмитиновая кислота, связанная с полилизином или -орнитином) и гидрофильной группой (полиоксиэтилен). Такие полимеры, например полилизин, модифицированный цепями полиоксиэтилена и пальмитоила, образуют в присутствии холестерина везикулы, способные инкапсулировать доксорубицин или ДНК. Эти полимеры на основе полилизинов являются катионными в физиологических условиях. В заявке на патент EP-A-963758 описаны полиаминокислоты, функционализированные катионными группами. Такие полимеры способны образовывать комплексы с нуклеиновой кислотой и могут быть использованы в генной терапии. Катионные группы представляют собой аминопроизводные, не являющиеся производными аминокислот, и полиаминокислоты не содержат гидрофобных групп.Yang et al. (Biotechnology Letters, 2005, 27, 977-982) описали полиаспартаты, функционализированные линейными алкильными группами и олигоаргининами. Такие полимеры образуют в воде наночастицы размером от 8 до 40 нм и способны интернализироваться клетками. Считают, что такие частицы могут быть использованы для векторизации гидрофобных молекул. В этой же самой области заявитель описал в нескольких заявках на патент полимеры на основе полиглутамата (анионные полимеры) с близкими свойствами. В заявке на патент WO-A-03/104303 описаны анионные полиаминокислоты, функционализированные -токоферолом. В заявке на патент WO-A-2004/013206 описаны анионные полиаминокислоты, содержащие гидрофобные группы, где такие группы связаны с полимерной цепью связью, содержащей две амидные функциональные группы, и в особенности с помощью лизина или орнитина в качестве спейсера. В заявке на патент WO-A-2004/060968 описаны полиаминокислоты, функционализированные по меньшей мере одной олигоаминогруппой, входящей в состав лейцина, изолейцина, валина и/или фенилаланина. В статье W.C. Shen, "Acid-sensitive dissociation between poly(lysine) and histamine-modifiedpoly(glutamate) as a model for drug-releasing from carriers in endosomes", Biochim. Biophys. Acta, 1034 (1),122-124, 1990 описан полиглутамат, на 40% функционализированный гистамином. Однако в этом документе не описаны какие-либо гидрофобизованные производные исходного полиглутамата. Кроме того,описанный полимер осаждается при pH 4-5 и растворим при физиологических значениях pH. Единственное возможное применение может быть связано с образованием комплексов с рН-чувствительным полилизином. Такие комплексы образуются благодаря электростатическим взаимодействиям. В частности,при физиологических pH образуется комплекс полиглутамат-гистамин/полилизин, в то время как он распадается при pH 4-5, значения которых совпадают с pH внутри эндосомы. Таким образом, даже несмотря на то что много технических растворов было разработано и описано в качестве прототипов для векторизации медицинских активных начал, трудно удовлетворить всем требованиям и необходимо усовершенствование. Более конкретно, настоящее изобретение относится к биодеградируемым полиаминокислотам, которые можно превратить в коллоидные нано- или микрочастицы для векторизации, которые могут легко подвергаться ассоциации с активными началами. Раскрытие изобретения В данном контексте одной из существенных целей настоящего изобретения является обеспечение новых амфифильных сополиглутаматов, содержащих как положительные заряды при нейтральных pH или pH, близких к нейтральности, так и гидрофобных групп в качестве подвешенных (или висящих) цепей. Такие полимеры являются усовершенствованием относительно тех полимеров, которые описаны в патентах или заявках на патент, упомянутых выше, в терминах векторизации активного начала, например, терапевтического пептида или белка, ДНК, РНК или малой молекулы. Другой целью настоящего изобретения является то, чтобы такие полимеры могли быть использованы при векторизации активных начал (АН) и оптимально удовлетворяли всем техническим условиям требований, а именно, в частности:a) способность легко и рентабельно образовывать стабильные водные коллоидные суспензии, легко ассоциировать с многочисленными активными началами и выводить эти активные начала in vivo;d) гидролитическая устойчивость. Эта цель, наряду с другими, достигается в настоящем изобретении, которое относится к полиаминокислотам или их фармацевтически приемлемым солям, содержащим остатки глутаминовой кислоты,где каждый из нескольких остатков глутаминовой кислоты нест подвешенную катионную группу, которая, если она может быть депротонирована, имеет pKa, равный или больший 7, причм указанные катионные группы идентичны или отличаются друг от друга, и где каждый из других остатков глутаминовой кислоты нест подвешенную гидрофобную группу ГГ (GH), причм указанные гидрофобные группы (ГГ) идентичны или отличаются друг от друга.-2 016911 В следующем далее описании, за исключением особо указанных случаев, термин "катионная группа" обычно обозначает катионные группы, которые не могут быть депротонированы, и катионные группы, которые могут быть депротонированы и которые имеют pKa, равный или больший 7. Подразумевается, что термин "фармацевтически приемлемые соли" полиаминокислоты согласно настоящему изобретению охватывает все полиаминокислоты с противоионами, связанными с ионизированными функциональными группами полимеров. Подразумевается, что в следующем далее описании термин "малая молекула" означает молекулу молекулярной массы меньше 1 кДа. За исключением особо указанных случаев алкильные группы содержат от 1 до 10 атомов углерода. Таким образом, согласно настоящему изобретению каждый полиглутамат функционализирован множеством подвешенных катионных групп, которые являются идентичными или отличаются друг от друга и подвешенных гидрофобных групп (ГГ), которые являются идентичными или отличаются друг от друга. В настоящем изобретении термин "многообразие" означает, что полиглутамат функционализирован по меньшей мере 1% катионных групп (молярный % по отношению к остаткам глутаминовой кислоты) и до 99%; в среднем по меньшей мере двумя подвешенными гидрофобными группами (ГГ) на молекулу. Возможно, согласно настоящему изобретению полиглутаминовая кислота должна содержать помимо подвешенных гидрофобных групп (ГГ) гидрофобные группы (ГГ), которые присоединены по меньшей мере к одному концу цепей сополимера. В настоящем изобретении выражение "носить" означает, что присоединнная группа является подвешенной, т.е. указанная группа является боковой группой по отношению к остаткам глутаминовой кислоты и является заместителем при функциональной карбонильной группе в -положении остатка глутаминовой кислоты, который нест е. Полиглутаматы настоящего изобретения также несут катионные группы. Такие группы предпочтительно присоединены к остаткам глутаминовой кислоты амидной или сложноэфирной связью. Согласно альтернативному варианту осуществления настоящего изобретения каждый из других остатков глутаминовой кислоты может нести подвешенную неионизируемую группу, отличающуюся от гидрофобных групп (ГГ), причм указанные неионизируемые группы могут быть одинаковыми или отличаться друг от друга. Такой подвешенной неионизируемой группой может быть, например, гидроксиэтиламиногруппа. Согласно другому альтернативному варианту осуществления настоящего изобретения каждый из других остатков глутаминовой кислоты может нести также в -положении по отношению к карбонилу группу, которая является неионизируемой при нейтральном pH, отличную от гидрофобных групп (ГГ),причм указанные группы, неионизируемые при нейтральном pH, являются одинаковыми или отличаться друг от друга. Например, такая группа может иметь следующую формулу: в которой -R10 представляет собой -H, -CO2H, сложный алкиловый эфир (предпочтительно -COOMe или -COOEt), -CH2OH, -C(=O)-NH2, -C(=O)-NH-CH3 или -C(=O)-N(CH3)2. Полиглутаматы, одновременно несущие катионные группы и гидрофобные группы и необязательно неионогенные группы (неионизируемые или неионизируемые при нейтральном pH), могут также содержать отрицательные заряды (при нейтральном pH), возникающие при ионизации подвешенных групп полиглутаминовой кислоты, которые не были функционализированы. Заявитель разработал синтез нового семейства полимеров на основе полиглутамата, несущего катионные группы и функционализированного множеством гидрофобных групп, которые образуют стабильные коллоидные системы. Возможность приводить в соответствие заполнение полимера со степенью функционализации может оказаться очень эффективной для снижения вязкости полимера, для более легкой инъекции или более легкого применения на стадии разработки композиции; обеспечения хорошей ассоциации с нейтральными, анионными или катионными началами. Таким образом, полимеры настоящего изобретения могут быть анионными, катионными или нейтральными и способными ассоциировать с заряженными или незаряженными активными началами; катионными при умеренно кислых pH (pH 4-5) и нейтральными или слабо заряженными при нейтральном pH. В этом случае такая зависимость от pH позволяет им после ассоциации с активным началом в растворе при pH 4-5 образовывать осадок в физиологической среде. Кроме того, полимеры настоящего изобретения могут легко расщепляться в присутствии ферментов, что приводит к образованию нетоксичных катаболитов/метаболитов (аминокислот).-3 016911 В рамках толкования изобретения и на протяжении настоящего документа термин "ассоциация" или"ассоциировать", использованный для характеристики взаимоотношения между одним или более активных начал и модифицированными полиглутаматами, означает, что активное начало или активные начала связано(ы) или присоединено к полиглутамату(ам), в частности, за счт гидрофобных взаимодействий и/или инкапсулировано полиглутаматом(ми). Преимущественно полиаминокислоты согласно настоящему изобретению представляют собой гомополимеры L-глутамата или L-глутаминовой кислоты; предпочтительно в пределах полиаминокислоты эти остатки связаны по их карбоксильным группам в альфа-положении. Катионные группы, которые могут быть использованы для функционализации звеньев глутамата,являются одинаковыми или отличаются друг от друга и имеют следующую общую формулу:Y представляет собой независимо H или CH3;L представляет собой линейные (C2-C6)алкилены, необязательно замещнные функциональной карбоксильной группой или их производные. Согласно предпочтительному варианту осуществления настоящего изобретения катионные группы получаются из соединений, выбранных из группы, состоящей из лизина, орнитина, аргинина и их производных, холина, этаноламина (соединнных атомом кислорода), путресцина и агматина. Производные лизина, орнитина, аргинина могут, например, представлять собой этиловые и метиловые эфиры, амиды и метилированные амиды. Таким образом, катионные группы, которые могут быть использованы в настоящем изобретении,могут быть выбраны из следующей группы:-4 016911 Например, катионные группы, которые могут быть использованы в настоящем изобретении, могут иметь следующую формулу (где название исходных веществ указано под каждой группой):-OMe, -OEt, -NH2, -NHCH3 или -N(CH3)2 группу. Согласно предпочтительному варианту осуществления настоящего изобретения полиаминокислоты настоящего изобретения содержат по меньшей мере три гидрофобные группы (ГГ) на полимерную цепь. Преимущественно по меньшей мере одна из гидрофобных групп ГГ входит в состав гидрофобного привитого фрагмента, содержащего по меньшей мере одну спейсерную связывающую группу (или единицу) (спейсер), при помощи которой гидрофобная группа ГГ присоединена к цепи полиглутамата (например, основной цепи полиглутамата). Такая связывающая группа может содержать по меньшей мере одну обычную ковалентную связь, и/или по меньшей мере одну амидную связь, и/или по меньшей мере одну сложноэфирную связь. Например, связывающая группа может относиться к группе, состоящей, в частности, из "аминокислотных" остатков, отличающихся от мономерного звена исходного полиглутамата, производных аминоспирта, производных полиамина (например, диамина), производных полиола (например, диола) и производных оксикислоты. Прививка ГГ к цепи полиглутамата может включать в себя использование предшественников ГГ,которые могут быть присоединены к цепи полиглутамата. Предшественники ГГ могут быть, на практике и без ограничений, выбраны из группы, состоящей из спиртов и аминов, причм такие соединения могут быть легко функционализированы специалистами в данной области техники. Прививка ГГ раскрыта более подробно в описании процесса получения модифицированных полиаминокислот согласно настоящему изобретению. Согласно предпочтительному варианту осуществления настоящего изобретения гидрофобная группа ГГ гидрофобного привитого фрагмента содержит от 8 до 30 атомов углерода. Такие гидрофобные группы ГГ преимущественно и тщательно выбраны из группы, состоящей из линейных или разветвлнных C8-C30-алкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом;C8-C30-алкиларилов или арилалкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом; иC8-C30-(поли)циклических соединений, которые необязательно могут содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом. Связывающие группы, которые образуют вместе с ГГ гидрофобные привитые фрагменты, могут представлять собой ди-, три- или тетравалентные связывающие группы (действительно, даже пентавалентные и более). В случае двухвалентной связывающей группы гидрофобная связывающая группа содержит одну ГГ группу, в то время как трхвалентная связывающая группа придат двойственную природу гидрофобной связывающей группе, другими словами, привитой фрагмент ведт себя как ГГ, состоящий из двух "ветвей". Примеры трхвалентных связывающих групп включают в себя, но не ограничиваются, "аминокислотные" остатки, например "глутаминовую кислоту", или остатки полиола, например глицерина. Таким образом, двумя подходящими, но неограничивающими примерами гидрофобных связывающих групп, содержащих двойные ГГ, являются диалкилглицерины и диалкилглутаматы. Гидрофобные группы ГГ могут, например, быть получены из групп, выбранных из группы, состоящей из октанола, додеканола, тетрадеканола, гексадеканола, октадеканола, олеилового спирта, токоферола и холестерина. Согласно предпочтительному варианту осуществления настоящего изобретения полиглутаматы согласно изобретению могут нести по меньшей мере одну привитую группу типа полиалкилен- (предпочтительно полиэтилен) гликоля, присоединнного к остатку глутамата. Предпочтительно основная цепь полиглутамата согласно настоящему изобретению содержит звенья-5 016911 Ещ более предпочтительно полиглутаматы согласно настоящему изобретению имеют следующую формулу (I):C3-C10-алкильную или бензильную группу; концевым аминокислотным остатком формулыR8, R9 и R10 независимо представляют собой H, линейную C2-C10 или разветвлнную C3- иC10-алкильную или бензильную группу; В представляет собой обычную связь или двухвалентную, трхвалентную или тетравалентную связывающую группу, предпочтительно выбранную из следующих групп:D представляет собой Н, линейную C2-C10 или разветвлнную C3-C10-ацильную группу или пироглутамат; каждая из гидрофобных групп (ГГ) является независимо друг от друга группой, выбранной из линейного или разветвлнного C8-C30-алкилов, который может необязательно содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом (предпочтительно O,и/или N, и/или S), илиC8-C30-алкиларилов или арилалкилов, которые могут необязательно содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом (предпочтительно O, и/или N,и/или S), илиC8-C30-(поли)циклических соединений, которые могут необязательно содержать по меньшей мере одну ненасыщенную группу и/или по меньшей мере один гетероатом (предпочтительно O, и/или N,и/или S); предпочтительно эта группа выбрана из группы, состоящей из октанола, додеканола, тетрадеканола,гексадеканола, октадеканола, олеилового спирта, токоферола и холестерина, причм B связана напрямую.R1 является радикалом, выбранным из следующей группы формулы где w находится в диапазоне от 2 до 6, предпочтительно w=4, аминокислотного остатка или производного аминокислоты формулы в которой X представляет собой атом кислорода или -NH-;R3 представляет собой гидроксиэтиламиногруппу, алкиленгликоль, полиалкиленгликоль или группу формулы где -R10 представляет собой -H, -CO2H, сложные алкиловые эфиры (предпочтительно -COOMe илиp, q, r и s являются положительными целыми числами;(p)/(p+q+r+s) определяется как молярная степень прививки гидрофобных групп (ГГ) и варьирует от 2 до 99 мол.% и предпочтительно от 5 до 50 мол.% при условии, что каждая цепь сополимера содержит в среднем по меньшей мере три гидрофобные привитые группы;(q)/(p+q+r+s) определяется как молярная степень прививки катионных групп и варьирует от 1 до 99 мол.%;(s)/(p+q+r+s) варьирует от 0 до 98 мол.%,и их фармацевтически приемлемые соли. Предпочтительно гидрофобные группы (ГГ) и катионные группы расположены статистически как подвешенные группы. В основном общую формулу (I), описанную выше, не следует рассматривать как описывающую исключительно блок-сополимеры, но также и статистические сополимеры или мультиблок-сополимеры. Кроме того, предпочтительно, чтобы молярная степень прививки гидрофобных звеньев полиглутамата согласно настоящему изобретению находилась в диапазоне 2-99% и предпочтительно 5-50% при условии, что каждая полимерная цепь содержит в среднем по меньшей мере три гидрофобные привитые группы. Соотношение (q)/(p+q+r+s) для полиглутамата согласно настоящему изобретению означает, что они могут содержать приблизительно от 1 до приблизительно 97 мол.% групп, содержащих катионный заряд. Соотношение (s)/(p+q+r+s) для полиглутамата согласно настоящему изобретению означает, что они могут быть анионными, нейтральными или катионными при нейтральных pH. Согласно другому предпочтительному варианту осуществления настоящего изобретения полимеры согласно настоящему изобретению имеют молекулярную массу от 2000 до 200000 г/моль и предпочтительно от 5000 до 100000 г/моль. Очевидно, настоящее изобретение также охватывает смеси модифицированных полиаминокислот,как было указано выше. Стоит отметить, что полиглутаматы настоящего изобретения могут быть использованы в нескольких направлениях в зависимости от природы гидрофобных групп и катионных групп, а также от заряда и степени полимеризации полиглутамата. Способы образования полимера для инкапсулирования активного начала в различных формах, рассмотренные в настоящем изобретении, известны специалистам в данной области техники. Для дальнейших деталей см., например, несколько этих, особенно важных ссылок:"Handbook of Pharmaceutical Controlled Release Technology", edited by D.L. Wise, Marcel Dekker, Inc.,2000. ISBN: 0-8247-0369-3. Полиглутаматы настоящего изобретения (в форме частиц или нет) могут легко ассоциировать с активными началами или их инкапсулировать, например белки, пептиды, ДНК, РНК или малые молекулы. Предпочтительным способом образования является способ, который описан в патенте US-B-6630171,известный заявителю, который состоит в диспергировании сополимера в воде и инкубации раствора в присутствии активного начала (АН). Коллоидный раствор частиц векторизации, состоящий из полиглутамата согласно настоящему изобретению, может быть далее профильтрован через фильтр диаметром 0,2 мкм и затем непосредственно инъецирован пациенту.-7 016911 В тех случаях, когда полимер является катионным и растворимым при кислых pH благодаря избытку катионных зарядов и этот заряд частично или полностью нейтрализован при нейтральном pH, говорят,что такой полимер зависит от pH. Таким образом, такой тип полимеров может быть использован для формирования осадка после введения в подкожную ткань. Следует понять, что остальные функциональные карбоксильные группы модифицированного полиглутамата являются или нейтральными (в форме COOH), или ионизированными (в форме аниона COO-),в зависимости от pH и состава. Таким образом, оба индекса i) для остатков глутамата или глутаминовой кислоты, ii) для полиглутаминовой кислоты или полиглутамата могут быть взаимозаменяемы. В водных растворах противоионами могут быть катионы металла, например натрия, кальция или магния, или органические катионы, такие как триэтаноламин, трис-(гидроксиметил)аминометан или полиамин, например полиэтиленимин. Если противоион является двухвалентным, он может образовывать соль с двумя замкнутыми одновалентными анионными группами. Противоион катионных групп предпочтительно выбирают из группы, состоящей из хлорида, сульфата фосфата или ацетата. Если он является двухвалентным, противоион может образовывать соль с двумя замкнутыми одновалентными катионными группами. Таким образом, в настоящем описании термин "фармацевтически приемлемые соли" полимера объединяет все полимеры с противоионами, ассоциированными с ионизированными функциональными группами полимера. Полная или частичная нейтрализация зарядов может быть также предусмотрена для некоторых структур, в которых сосуществуют положительные и отрицательные заряды. Полимер, имеющий одинаковое число положительных зарядов и отрицательных зарядов, (изоэлектрическая точка) может существовать в отсутствие как противоаниона, так и противокатиона. Сополимеры настоящего изобретения могут быть получены, например, при использовании способов, известных специалистам в данной области техники. Прежде всего, следует вспомнить, что наиболее часто используемая техника получения полиаминокислот -типа основана на полимеризации ангидридов(1987). Производные НКА предпочтительно представляют собой NCA-Glu-O-R3 (R3=метил, этил или бензил). Полимеры впоследствии гидролизуют в условиях, подходящих для получения полимера в кислотной форме. Эти способы стимулированы описанием, приведнным в патенте FR-A-2801226, предоставленным заявителю. Некоторые полимеры, которые могут быть использованы согласно настоящему изобретению, например поли(-L-глутаминовая кислота), поли(-D-глутаминовая кислота), поли(-D,L-глутамат) и поли(-L-глутаминовая кислота) различных молекулярных масс, коммерчески доступны. Предпочтительно сополимеры настоящего изобретения могут быть синтезированы двумя способами. Во-первых, одновременно или последовательно к поли(L-глутаминовой кислоте) прививают катионную группу (например, аргининамид) и В-ГГ группу (например, додециламин). Эта реакция может протекать в растворителе, например ДМФ, ДМСО или НМП, согласно следующей схеме. В вышеописанном механизме, когда q отличен от нуля, предшественник группы R1, например этаноламин, присоединнный через азот, вводят при синтезе одновременно с катионной группой.-8 016911 В тех случаях, когда катионная группа содержит две функциональные аминогруппы, не различающиеся химически (например, линейный диамин), она может быть введена в форме, в которой одна из двух функциональных групп защищена. К вышеописанной схеме затем добавляют конечную стадию отщепления защитной группы. Поли(L-глутаминовая кислота) может быть синтезирована путм, описанным в заявке на патентFR-A-2801226. В тех случаях, когда группа НВ-ГГ присоединена через сложноэфирную функциональную группу, проще сначала привить группу НВ-ГГ обычной реакцией конденсации с использованием карбодиимида, перед прививкой катионной группы. В вышеописанном механизме, когда q от отличен нуля, предшественник группы R1, например этаноламин, присоединнный через азот, вводят при синтезе одновременно с катионной группой. В тех случаях, когда катионная группа содержит две функциональные аминогруппы, не различающиеся химически (например, линейный диамин), она может быть введена в форме, в которой одна из двух функциональных групп защищена. К вышеописанной схеме затем добавляют конечную стадию отщепления защитной группы. Полимеризационные процессы и реакции конденсации являются обычными способами, хорошо известными специалистам в данной области техники (см., например, патенты или заявки на патент заявителя, упомянутые выше). Эти способы будут понятнее при описании примеров. Экспериментально обнаружено, что степень полимеризации определяется молярным отношением мономера к инициатору. Конденсацию гидрофобной привитой группы с кислотной группой полимера легко осуществляют взаимодействием полиаминокислоты в присутствии карбодиимида в качестве конденсирующего агента и необязательно, катализатора, например 4-диметиламинопиридина, и в подходящем растворителе, например диметилформамиде (ДМФ), N-метилпирролидоне (НМП) или диметилсульфоксиде (ДМСО). Карбодиимидом является, например, дициклогексилкарбодиимид или диизопропилкарбодиимид. Для образования амидной связи могут быть также использованы конденсирующие агенты, например хлорформиаты(см., например, примеры конденсирующих агентов в работе Bodanszky, "Principles of Peptide Synthesis",Springer Verlag, 1984). Степень прививки контролируют химически по стехиометрическому соотношению компонентов и реагентов или по времени проведения реакции. Гидрофобные привитые группы,функционализированные аминокислотами, отличными от входящих в состав полимера, получают обычным пептидным синтезом или прямой конденсацией в присутствии кислотных катализаторов. Эти способы хорошо известны специалистам в данной области техники. В соответствии с другим его аспектом настоящее изобретение направлено на фармацевтические,косметические композиции, композиции диетических пищевых продуктов или препаратов для защиты растений, которые содержат по меньшей мере один полиглутамат, как описано выше, и, необязательно,по меньшей мере одно активное начало, которое может быть терапевтическим, косметическим, или быть активным началом композиции диетических пищевых продуктов или композиции для защиты растений. Согласно преимущественному варианту осуществления настоящего изобретения активное начало ассоциирует с полиаминокислотой(ми), модифицированными катионной группой при помощи одной или нескольких связей, отличных от (а) ковалентной химической связи(ей).-9 016911 В частности, способы ассоциации одного или нескольких АН с модифицированными полиаминокислотами согласно настоящему изобретению описаны в патенте US-B-6630171. Они состоят во включении по меньшей мере одного активного начала в жидкую среду, содержащую частицы векторизации ЧВ(VP), так, чтобы получилась коллоидная суспензия ЧВ, заряженных или ассоциированных с одним или несколькими активным началом(ами) (АН). Такое включение, которое приводит к захвату АН частицами векторизации (ЧВ), может быть осуществлено следующим образом: растворением АН в воде и последующим добавлением ЧВ либо в форме коллоидной суспензии, либо в форме изолированных ЧВ (лиофилизата или осадка); добавлением АН либо в растворе, либо в виде предварительно приготовленной рецептуры к коллоидной суспензии ЧВ, необязательно приготовленных во время использования диспергированием сухих ЧВ в подходящем растворителе, например воде. Предпочтительно активное начало выбирают из группы, состоящей из белков, гликопротеинов,белков, связанных с одной или несколькими цепями полиалкиленгликоля [предпочтительно полиэтиленгликоля ПЭГ (PEG): "Пэгилированные белки"], пептидов, полисахаридов, липосахаридов, олигонуклеотидов, полинуклеотидов и их смесей, и ещ более предпочтительно из подгруппы эритропоэтинов,например эпоэтина альфа, эпоэтина бета, дарбепоэтина, раффимера гемоглобина, их аналогов или их производных; окситоцина, вазопрессина, адренокортикотропного гормона, эпидермального фактора роста, тромбоцитарного стимулирующего фактора роста (PDGF), факторов, которые стимулируют гемопоэз и их смеси, антигенов крови, например альтеплазы, тенектеплазы, фактора VII(a) или VII; гемоглобина,цитохромов, альбуминов, пролактина, лулиберина, гормона, высвобождающего лютеинизирующий гормон (LHRH) и аналогов, например лейпролида, гозерелина, трипторелина, бусерелина или нафарелина; антагонистов LHRH, конкурентов LHRH, гормонов роста человека, свиньи или быка (GHs), релизингфактора гормонов роста, инсулина, соматостатина, глюкагона, интерлейкинов или их смесей (IL-2, IL-11,IL-12), интерферонов, например интерферон альфа, альфа-2b, бета, бета-1a или гамма; гастрина, тетрагастрина, пентагастрина, урогастрона, секретина, кальцитонина, энкефалина, эндоморфинов, ангиотензинов, релизинг-гормона тиротропина (TRH), фактора некроза опухоли (TNF), ростового фактора нервов(NGF), факторов роста, например беклапермина, трафермина, анцестима или ростового фактора кератиноцита, гранулоцитарного колониестимулирующего фактора (G-CSF), гранулоцитарного макрофагстимулирующего фактора (GM-CSF), макрофагколониестимулирующего фактора (M-CSF), гепариназы,морфогенетического белка кости (BMP), hANP, глюкагоноподобного пептида (GLP-1), VEG-F, рекомбинантного поверхностного антигена гепатита B (rHBsAg), ренина, цитокинов, брадикинина, бацитрацинов, полимиксинов, колистинов, тироцидина, грамицидинов, этанерцепта, имиглюцеразы, дротрекогина альфа, циклоспоринов и синтетических аналогов, фармацевтически активных модификаций и фрагментов ферментов, цитокинов, антител, антигенов и вакцин и антител, например ритуксимаба, инфликсимаба, трастузумаба, адалимумаба, омализумаба, тозитумомаба, эфализумаба и цетуксимаба. Другими подходящими активными началами являются полисахариды (например, гепарин) и олигоили полинуктеотиды, ДНК, РНК, иРНК, антибиотики и живые клетки. Другая категория подходящих активных начал содержит фармацевтически активные вещества,влияющие на центральную нервную систему, например рисперидон, зуклопентиксол, флуфеназин, перфеназин, флупентиксол, галоперидол, флуспирилен, кветиапин, клозапин, амисульприд, сульпирид, зипразидон и т.п. Согласно альтернативной форме активное начало является гидрофобной, гидрофильной или амфифильной малой органической молекулой. В рамках толкования данного описания "малой" молекулой является, в частности, малая молекула небелковой природы. Примеры АН, которые могут ассоциировать с полиаминокислотами согласно настоящему изобретению, находящимися или не находящимися в форме (нано- или микро)частиц, включают в себя, но не ограничиваются белки, например инсулин, интерфероны, гормоны роста, интерлейкины, эритропоэтины или цитокины; пептиды, например леупролид или циклоспорин; малые молекулы, например, принадлежащие к семейству антрациклинов, таксоидов или камфотецинов; и их смеси. Предпочтительно активное начало выбирают по меньшей мере из одного из следующих семейств активных веществ: агентов для лечения алкоголизма, агентов для лечения болезни Альцгеймера, анестетиков, агентов для лечения акромегалии, анальгетиков, противоастматических средств, агентов для лечения аллергий, противораковых агентов, противовоспалительных агентов, антикоагулянтов и антитромботических средств, антиконвульсантов, противоэпилептических средств, противодиабетических средств,противорвотных средств, противоглаукомных средств, антигистаминных средств, противоинфекционных средств, антибиотиков, противогрибковых средств, противовирусных средств, антипаркинсонических средств, антихолинергических средств, противокашлевых средств, ингибиторов карбоангидразы,сердечно-сосудистых агентов, гиполипедимических средств, антиаритмических средств, сосудорасши- 10016911 ряющих средств, антиангинальных средств, антигипотензивных средств, вазопротекторов, ингибиторов холинэстеразы, агентов для лечения нарушения центральной нервной системы, стимуляторов центральной нервной системы, контрацептивов, промоторов рождаемости, стимуляторов и ингибиторов родовой деятельности, агентов для лечения муковисцидоза, агонистов рецепторов допамина, агентов для лечения эндометриоза, агентов для лечения эректильных дисфункций, агентов для лечения фертильности, агентов для лечения желудочно-кишечных нарушений, иммуномодуляторов и иммунодепрессантов, агентов для лечения нарушений памяти, агентов для лечения мигрени, мышечных релаксантов, аналогов нуклеозидов, агентов для лечения остеопороза, парасимпатомиметиков, простагландинов, психотерапевтических агентов, успокаивающих средств, снотворных средств и транквилизаторов, нейролептиков, анксиолитиков, психостимуляторов, антидепрессантов, агентов для лечения дерматологических заболеваний, стероидов и гормонов, амфетаминов, анорексигенных средств, неанальгетических болеутоляющих средств,барбитуратов, бензодиазепинов, слабительных средств, психотропных средств и любых комбинаций этих продуктов. Согласно одному из вариантов осуществления композиция настоящего изобретения находится в виде геля, раствора, эмульсии, мицелл, наночастиц, имплантатов, порошка, суспензии или плнки. Согласно одной из особенно предпочтительных форм, нагруженных или ненагруженных активным началом(ми), она является стабильной коллоидной суспензией частиц полиаминокислоты, и/или микрочастиц, и/или мицелл в водной или масляной фазе. Микрочастицы могут быть получены различными способами, например коацервацией в присутствии агрегирующего агента (двухвалентных или трхвалентных ионов или полиэлектролитов), осаждением путм изменения pH или ионной силы, экстракцией/упариванием или атомизацией. В частности, композицией согласно настоящему изобретению может быть коллоидный раствор наночастиц в водной фазе при кислых pH, который осаждается при физиологических pH. Преимущественно полиаминокислота настоящего изобретения, имеющая избыток катионных зарядов, может быть сконденсирована с анионным активным началом, например ДНК, фрагментом ДНК,РНК или олиго-РНК, в форме нано- или микрочастиц и эти частицы могут быть интернализированы в клетку. Согласно другому варианту осуществления композиция настоящего изобретения находится в виде раствора в биологически совместимом растворителе и может быть инъецирована подкожно или внутримышечно или в опухоль. Композиция согласно настоящему изобретению, поскольку она является фармацевтической композицией, может быть введена перорально, парентерально, назально, вагинально, офтальмологически, подкожно, внутривенно, внутримышечно, внутрикожно, внутрибрюшинно, внутрицеребрально или трансбуккально или через лгкие. Можно также ожидать, что композиция находится в виде раствора в биологически совместимом растворителе или в смеси биологически совместимых растворителей, способных инъецироваться подкожно или внутримышечно или в опухоль. Согласно другому варианту осуществления композиция может необязательно содержать вспомогательное вещество для регулирования pH и/или осмолярности и/или для повышения стабильности (антиоксиданты) и/или в качестве противомикробного агента. Такие вспомогательные вещества хорошо известны специалистам в данной области техники (имеется ссылка в работе: Injectable Drug Development,P.K. Gupta et al., Interpharm Press, Denver, Colorado, 1999). Настоящее изобретение также направлено на способ получения лекарственных соединений, в частности, для перорального, назального, вагинального, офтальмологического, подкожного, внутривенного,внутримышечного, внутрикожного, внутрибрюшинного или внутрицеребрального введения, в котором активные начала таких лекарственных соединений могут представлять собой, в частности, белки, гликопротеины, белки, связанные с одной или несколькими цепями полиалкиленгликоля [например, полиэтиленгликоль ПЭГ (PEG); далее этот термин будет использован как "Пэгилированные белки"], пептиды,полисахариды, липополисахариды, олигонуклеотиды, полинуклеотиды и гидрофобные, гидрофильные и амфифильные органические молекулы; и/или питательных веществ; и/или косметических продуктов или продуктов для защиты растений; где способ состоит, главным образом, в использовании по меньшей мере одной полиаминокислоты, как описано выше, и/или композиции, описанной выше. Настоящее изобретение также относится к терапевтическому способу лечения, состоящему в основном во введении композиции, как описано в настоящем сообщении, перорально, парентерально, назально, вагинально, офтальмологически, подкожно, внутривенно, внутримышечно, внутрикожно, внутрибрюшинно, внутрицеребрально или трансбуккально или через лгкие. Согласно отдельной альтернативной форме настоящего изобретения этот терапевтический способ лечения состоит в основном в применении композиции, как это описано выше, в виде раствора в биологически совместимом растворителе и затем может быть инъецирована подкожно или внутримышечно или в опухоль, предпочтительно так, чтобы она образовывала осадок на месте инъекции.- 11016911 Настоящее изобретение будет легче понять, и его преимущества и альтернативные варианты осуществления будут яснее проявляться из рассмотрения примеров, которые приведены ниже и которые описывают синтез полимеров настоящего изобретения, их превращения в АН-содержащую систему векторизации (стабильную водную коллоидную суспензию) и демонстрируют способность такой системы ассоциировать с белком с образованием фармацевтической композиции. Примеры Пример 1. Синтез полимера (1). Индексы и группы: T=D,Lтокоферол, p=s=11, q=198. 10 г поли(глутаминовой кислоты) со степенью полимеризации (СП), равной 220, содержащей статически привитый рацемический -токоферол (5%), растворяют в 125 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 8,7 мл изобутилхлорформиата, а затем 7,35 мл N-метилморфолина. Эту реакционную смесь перемешивают при 0C в течение 15 мин. Одновременно 24,67 г аргининамиддигидрохлорида суспендируют в 308 мл НМП и добавляют 14,7 мл триэтиламина. Полученную суспензию перемешивают при 20C в течение нескольких минут, а затем охлаждают до 0C. Затем добавляют молочную суспензию активированного полимера к такой суспензии и реакционную смесь перемешивают при 0C в течение 2 ч и затем при 20C в течение ночи. После добавления 2,1 мл 35%-ного раствора HCl,а затем 100 мл воды реакционную смесь приливают по каплям к 1,6 л воды. Полученный раствор диафильтруют против 8 объмов водного солевого раствора (0,9%), а затем 4 объмов воды и концентрируют до объма, приблизительно равного 250 мл. Процентное содержание привитого аргининамида, определнное по данным протонного ЯМР в D2O, равно 90%. Пример 2. Синтез полимера (2). Индексы и группы: T=D,Lтокоферол, p=s=11, q=198. 3,5 г полиглутаминовой кислоты со СП, равной 120, содержащей статически привитый рацемический -токоферол (5%), растворяют в 70 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 3,2 г изобутилхлорформиата, а затем 2,37 г N-метилморфолина. Эту реакционную смесь перемешивают при 0C в течение 10 мин. Одновременно 4,62 г N-трет-бутилоксикарбонил-1,4-бутандиамин (БОК(ВОС)-путресцин) растворяют в 9 мл НМП, а затем охлаждают до 0C. Молочную суспензию активированного полимера затем добавляют к этому раствору и реакционную смесь перемешивают при 0C в течение 2 ч и затем при 20C в течение ночи. После добавления 0,7 мл 35%-ного раствора HCl реакцион- 12016911 ную смесь приливают по каплям к 317 мл воды. pH полученного раствора доводят до 7,4 при помощи 1N раствора гидроксида натрия, а затем диализуют против водного солевого раствора (0,9%), а затем воды. Полученную суспензию лиофилизуют, что приводит к получению 4,1 г белого порошка. Этот порошок повторно растворяют в ТГФ и раствор перемешивают при 20C в течение 2 ч, а затем приливают по каплям к остатку воды, в то время как pH доводят приблизительно до 7 при помощи 1N раствора гидроксида натрия. Полученный раствор диафильтруют против 8 объмов водного солевого раствора (0,9%), а затем 4 объмов воды, и концентрируют до объма приблизительно равного 50 мл. Процентное содержание привитого БОК-путресцина, определнное по данным протонного ЯМР в D2O, равно 90%. Пример 3. Синтез полимера 3. Индексы и группы: T=D,Lтокоферол, p=11, q=88, s=22 ; r=99. 10 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический -токоферол (5%), растворяют в 125 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 9,1 мл изобутилхлорформиата, а затем 7,71 мл N-метилморфолина. Эту реакционную смесь перемешивают при 0C в течение 15 мин. Одновременно 8,2 г аргининдигидрохлорида суспендируют в 103 мл НМП и добавляют 9,31 мл триэтиламина. К полученной суспензии также добавляют 1,6 мл этаноламина и затем перемешивают при 20C в течение нескольких минут, а затем охлаждают до 0C. Молочную суспензию активированного полимера затем добавляют к этой суспензии и реакционную смесь перемешивают при 0C в течение 2 ч. Добавляют 1,2 мл этаноламина и затем перемешивание проводят при 20C в течение ночи. После добавления 2,1 мл 35%-ного раствора HCl, а затем 200 мл воды реакционную смесь приливают по каплям к 700 мл воды, в то время как pH доводят до 7,4. Полученный раствор подвергают диафильтрации против 8 объмов водного солевого раствора (0,9%), а затем 4 объмов воды и концентрируют до объма, приблизительно равного 250 мл. Процентное содержание привитого аргининамида и привитого этаноламина, определнных по данным протонного ЯМР в D2O, равн соответственно 40 и 45%. Пример 4. Синтез полимера (4). Индексы и группы: T=D,Lтокоферол, p=6, q=59, s=3, r=52. 5 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический-токоферол (5%), растворяют в 63 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 4,3 мл изобутилхлорформиата, а затем 3,7 г N-метилморфолина. Эту реакционную смесь перемешивают- 13016911 при 0C в течение 10 мин. Одновременно 3,15 г N-трет-бутилоксикарбонил-1,4-бутанамин (БОКпутресцин) растворяют в 39 мл НМП и затем охлаждают до 0C. Этот раствор добавляют к молочной суспензии активированного полимера и реакционную смесь перемешивают при 0C в течение 2 ч. Добавляют 2 мл этаноламина и затем перемешивание проводят при комнатной температуре в течение ночи. После добавления 1,04 мл 35%-ного раствора HCl реакционную смесь приливают по каплям к 407 мл воды. pH полученной суспензии доводят до 7,4 1N раствором гидроксида натрия, а затем е диализуют(предельная отсекаемая молекулярная масса равна 1 кДа) против водного солевого раствора (0,9%), а затем воды. Полученную суспензию лиофилизуют, что приводит к образованию белого порошка. Этот порошок вновь растворяют в 100 мл ТФА и раствор перемешивают при 20C в течение 1 ч 15 мин, а затем приливают по каплям к остатку воды (500 мл), в то время как pH доводят приблизительно до 7 при помощи 1N раствора гидроксида натрия. После добавления 600 мл этанола полученный раствор дифильтруют против 8 объмов водного солевого раствора (0,9%), а затем 4 объма воды и концентрируют до объма, приблизительно равного 100 мл. Процентное содержание привитого БОК-путресцина и привитого этаноламина, определнное по данным протонного ЯМР в D2O, равно соответственно 49 и 43%. Пример 5. Синтез полимера (5). Индексы и группы: T=D,Lтокоферол, p=5, q= 83, s=12. Примерно 300 мл концентрированного раствора концентрации 48 мг/г получают способом, подобным тому, который был использован для синтеза полимера (1), исходя из 10 г полиглутаминовой кислоты со СП, равной 100, содержащей статически привитый рацемический -токоферол (5%) из 9,6 г изобутилхлорформиата, из 7,7 мл N-метилморфолина, из 24,7 г аргининамиддигидрохлорида и из 14,7 мл триэтиламина. Процентное содержание привитого аргининамида, определнное по данным протонного ЯМР в D2O, равно 83%. Пример 6. Синтез полимера (6). Индексы и группы: T=D,Lтокоферол, p=11, q=62, s=147. Примерно 250 мл концентрированного раствора концентрации 43 мг/г получают способом, подобным тому, который был использован для синтеза полимера (1), исходя из 10 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический -токоферол (5%), из 2,9 г изо- 14016911 бутилхлорформиата, из 2,2 мл N-метилморфолина, из 4,93 г аргининамиддигидрохлорида и из 3,3 мл триэтиламина. Процентное содержание привитого аргининамида, определнное по данным протонного ЯМР в D2O, равно 28%. Пример 7. Синтез полимера (7). Индексы и группы: T=D,Lтокоферол, p=11, q=62, s=7, r=48. Примерно 200 мл концентрированного раствора концентрации 43 мг/г получают способом, подобным тому, который был использован для синтеза полимера (3), исходя из 10 г полиглутаминовой кислоты со СП, равной 100, содержащей статически привитый рацемический -токоферол (5%), из 9,58 г изобутилхлорформиата, из 7,7 мл N-метилморфолина, из 8,22 г аргининамиддигидрохлорида, из 2,86 г этаноламина и из 5,1 мл триэтиламина. Процентное содержание аргининамида и этаноламина, определнное по данным протонного ЯМР в D2O, равно соответственно 40 и 48%. Пример 8. Синтез полимера (8). Индексы и группы: T=D,Lтокоферол, p=11, q=139, s=70. Примерно 200 мл концентрированного раствора концентрации 51 мг/г получают способом, подобным тому, который был использован для синтеза полимера (1), исходя из 10 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический -токоферол (5%), из 6,39 г изобутилхлорформиата, из 5,1 мл N-метилморфолина, из 13,16 г аргининамид дигидрохлорида и из 7,5 мл триэтиламина. Процентное содержание привитого аргининамида, определнное по данным протонного ЯМР в D2O, равно 63%. Индексы и группы: T=D,Lтокоферол, p=11, q=121, s=88. 5 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический-токоферол (5%), растворяют в 63 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 2,38 мл изобутилхлорформиата, а затем 2,02 мл N-метилморфолина. Эту реакционную смесь перемешивают при 0C в течение 15 мин. Одновременно 4,93 г аргининамиддигидрохлорида суспендируют в 62 мл НМП и добавляют 2,8 мл триэтиламина. Полученную суспензию перемешивают при 20C в течение нескольких минут и затем охлаждают до 0C. Затем молочную суспензию активированного полимера добавляют к этой суспензии и реакционную смесь перемешивают при 0C в течение 2 ч, а затем при 20C в течение 4 ч. После добавления 1,04 мл 35%-ного раствора HCl, а затем 50 мл воды реакционную смесь приливают по каплям к 500 мл водного раствора кислоты (pH 3), поддерживая pH приблизительно при 3-4 при помощи 1N раствора HCl. Полученный раствор подвергают диафильтрованию против 8 объмов водного солевого раствора (0,9%), а затем 4 объма воды и концентрируют до объма, приблизительно равного 250 мл. Процентное содержание привитого аргининамида, определнное по данным протонного ЯМР в D2O, равно 55%. Пример 10. Синтез полимера (10). Индексы и группы: T=D,Lтокоферол, p=11, q=88, s=73, r=48. 10 г полиглутаминовой кислоты со СП, равной 220, содержащей статически привитый рацемический -токоферол (5%), растворяют в 125 мл НМП при 80C. Этот раствор охлаждают до 0C и добавляют 5,6 мл изобутилхлорформиата, а затем 4,8 мл N-метилморфолина. Эту реакционную смесь перемешивают при 0C в течение 15 мин. Одновременно 7,4 г аргининамиддигидрохлорида суспендируют в 93 мл НМП и затем добавляют 4,7 мл триэтиламина и 1,2 мл этаноламина. Полученную суспензию перемешивают при 20C в течение нескольких минут и затем охлаждают до 0C. Затем молочную суспензию активированного полимера добавляют к этой суспензии и реакционную смесь перемешивают при 0C в течение 2 ч, а затем при 20C в течение ночи. После добавления 2,07 мл 35%-ного раствора HCl, а затем 200 мл воды реакционную смесь вливают по каплям в 670 мл воды, подкисленной HCl до pH 3, поддерживая pH приблизительно при 3 при помощи 1N раствора HCl. Полученный раствор подвергают диафильтрации против 8 объмов водного солевого раствора (0,9%), а затем 4 объмов воды и концентри- 16016911 руют до объма, приблизительно равного 250 мл. Процентное содержание привитого аргининамида и привитого этаноламина, определнное по данным протонного ЯМР в D2O, равно соответственно 40 и 22%. Сравнительный пример 11. Соединение C1, нефункционализированное катионной группой. Соединение C1 для сравнения является предшественником (в его анионной форме) полиглутамата,модифицированного катионной группой, т.е. полиглутамата со СП, равной 220, содержащего статически привитый рацемический -токоферол (5%). Это соединение получают способом, описанным в заявке на изобретение WO-A-03/104303. Пример 12. Изучение ассоциации с инсулином. Готовят водный раствор, содержащий 10 мг полимера на 1 мл при pH 7,4 и 200 международных единиц инсулина (7,4 мг). Растворы оставляют инкубироваться при комнатной температуре в течение 2 ч, и свободный инсулин отделяют от связанного инсулина ультрафильтрацией (отсекаемая молекулярная масса равна 100 кДа, 15 мин при 10000 G при 18C). Далее свободный инсулин, извлечнный из фильтрата, анализируют ВЭЖХ (жидкостной хроматографией высокого разрешения) и определяют количество связанного инсулина. Результаты приведены в табл.1. Таблица 1 Эти результаты показывают, что полимеры настоящего изобретения могут прочно связываться с инсулином с образованием коллоидных суспензий с размерами частиц, превышающих 100 кДа, и степени ассоциации с инсулином очень высоки. Показано, что в сравнении с полимерами C1 наличие каталитического количества заряженных групп не уменьшает степени ассоциации инсулина. Пример 13. Измерение вязкости (мПас) при сдвиге водного раствора концентрации 29 мг/г при градиенте скорости, равном 10 с-1. Эти результаты показывают, что полимеры настоящего изобретения имеют заметно меньшую вязкость в сравнении со сравнительным полимером C1, который не содержит боковых катионных групп. Пример 14. Изучение растворимости как функции pH. Эти результаты показывают, что некоторые полимеры настоящего изобретения (примеры 9 и 10) обнаруживают, что растворимость зависит от pH, что в отличие от соединения C1 позволяет им входить в состав рецептуры с активным началом при умеренно кислых pH (pH 4) и образовывать осадок при физиологических pH (рН приблизительно равен 7). Пример 15. Изучение связывания терапевтической РНК. Процессы ассоциации полимер/РНК в водном растворе проходят при добавлении увеличивающихся количеств полимеров (1), (3) (два примера полимеров согласно настоящему изобретению, которые являются главным образом катионными при pH 7,4) или C1 при фиксированных количествах 1433-нуклеотидной терапевтической РНК. Такие смеси инкубируют в течение 2 ч при 37C и затем анализируют в условиях 1%-ного агарозного гель-электрофореза в денатурирующих условиях (обнаружение РНК при помощи этидийбромида). Индивидуальную РНК используют в качестве положительного контроля целостности. Инкубированную РНК с коммерческой РНКазой используют в качестве контроля на деградированную РНК.- 17016911 Эти результаты показывают, что, когда изучаемую РНК инкубируют с полимерами (1) или (3), количество РНК, которое мигрирует в соответствии с ожидаемыми размерами при электрофорезе, постепенно уменьшается с увеличением количества используемого полимера и исчезает выше определнной величины, причм другие полосы не появляются. В отличие от этого, в смеси, содержащей компонент C1, количество мигрирующей РНК не меняется даже при большом избытке полимера. Во-вторых, добавляемое к РНК количество полимера (1) или (3) позволяет полностью связать РНК(условия, при которых РНК больше не видно на ожидаемой калибровке геля), и эти смеси инкубируют в течение 2 ч при 37C. Через 2 ч при 37C к этим смесям добавляют увеличивающиеся количества соединения C1 и проводят новую инкубацию в течение 16 ч при 37C. Полученные смеси анализируют 1%-ным электрофорезом в агарозном геле в денатурирующих условиях (обнаружение РНК этидийбромидом). Эти результаты показывают, что при ожидаемом размере увеличение количества РНК коррелирует с количеством полимера C1, добавляемого к смеси РНК/полимер (1) или (3). Эти результаты показывают, что некоторые полимеры согласно настоящему изобретению, полностью катионные при pH 7.4, могут связываться с модельной РНК, содержащей 1433 нуклеотида и что эта ассоциация с полностью анионным полимером обратима. Кроме того, входящая в состав композиции РНК не деградирует. Пример 16. Изучение скрещивания модельного олигонуклеотида с клеточной мембраной. В среде Opti-MEM, не содержащей эмбриональной сыворотки телнка, олигонуклеотиды РНК,состоящие из 30 оснований с меченым Cy3, смешивают с некоторым количеством полимера (3) или (7),близким к минимальному количеству, необходимому для полного связывания олигонуклеотида. Такую смесь вводят в контакт с гепатокарциномными клетками человека Huh-7, выращенными на 24-луночном планшете с 25000 клеток/лунке. Через 4 ч после инкубации клеток при 37C, 5% CO2 добавляют среду DMEM с 20%-ным содержанием эмбриональной сыворотки телнка (FCS), так, чтобы конечная концентрация FCS была равна 10%. Через 24 ч после инкубации с олигонуклеотид/полимерной смесью клетки промывают, их мембраны метят биотинилированным конканавалином и затем клетки фиксируют в течение 3 мин параформальдегидом при 3,7%. После двух промываний PBS буфером клетки инкубируют с DAPI (ядерной ДНК) в течение 10 мин,промывают 3 раза PBS и затем инкубируют с AlexaFluor488 - меченым стрептавидином, при помощи которого обнаруживают биотинилированный конканавалин. Клетки анализируют конфокальной микроскопией. Локализация клеток возможна по наблюдению за AlexaFluor488 - окрашенным стрептавидином,при помощи которого обнаруживают биотинилированный конканавалин. Клетки анализируют конфокальной микроскопией. Локализация клеток возможна при наблюдении их мембран, окрашенных AlexaFluor488 и их ядер, окрашенных DAPI. Захват Cy3-меченого олигонуклеотида клеткой проявляется по флуоресценции Су 3 (возбуждение при 550 нм, эмиссия при 570 нм). Эти результаты показывают, что Cy3-меченый олигонуклеотид обнаружен в цитоплазме клетокHuh-7, когда эти клетки инкубируют в присутствии олигонуклеотида и полимера (3) или (7). Для сравнения, когда олигонуклеотид инкубируют один или с полимером C1, в клетках не обнаруживают Cy3 меченого олигонуклеотида. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полиаминокислота, содержащая остатки глутаминовой кислоты, где некоторые остатки глутаминовой кислоты несут боковую катионную группу, которая, если она может быть депротонирована, имеетpKa, большее или равное 7, причм указанные катионные группы являются одинаковыми или различными и соответствуют следующей формуле: в которой X представляет собой O, NH;Y представляет собой независимо Н или CH3;L представляет собой линейный (C2-C6)алкилен, необязательно замещнный функциональной карбоксильной группой -CORa, где Ra представляет собой гидрокси, алкокси или аминоалкильную группу; или выбраны из группы радикалов формулыZ- представляет собой хлорид, сульфат, фосфат или ацетат; или где Z- представляет собой хлорид, сульфат, фосфат или ацетат,а другие остатки глутаминовой кислоты несут боковые гидрофобные группы (GH), которые являются одинаковыми или различными и выбраны из группы, состоящей из линейных или разветвлнных C8-C30-алкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S;C8-C30-алкиларилов или арилалкилов, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S; иC8-C30-(поли)циклических соединений, которые необязательно могут содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S,а также ее фармацевтически приемлемые соли. 2. Полиаминокислота по п.1, где боковые катионные группы формулы выбраны из следующей группы радикалов: где Z- представляет собой хлорид, сульфат, фосфат или ацетат. 3. Полиаминокислота по п.1 или 2, которая является катионной при pH 4-5 и нейтральной или слабо заряженной при нейтральных значениях pH. 4. Полиаминокислота по п.1 или 2, где боковые катионные группы привиты к остаткам глутаминовой кислоты через амидную или сложноэфирную связь. 5. Полиаминокислота по любому из предыдущих пунктов, которая состоит из L-глутамата или гомополимеров L-глутаминовой кислоты, присоединнных к полиаминокислоте по е карбоксильным- 19016911 группам в альфа-положении. 6. Полиаминокислота по любому из предыдущих пунктов, которая содержит в среднем по меньшей мере три гидрофобные группы (GH) на полимерную цепь. 7. Полиаминокислота по любому из предыдущих пунктов, где другие остатки глутаминовой кислоты несут боковые неионизируемые группы, отличающиеся от гидрофобных групп (GH), причм указанные неионизируемые группы могут быть одинаковыми или различными. 8. Полиаминокислота по п.7, где указанной неионизируемой группой является гидроксиэтиламиногруппа. 9. Полиаминокислота по любому из предыдущих пунктов, где другие остатки глутаминовой кислоты несут группу, которая является неионизируемой при нейтральных pH, отличную от гидрофобных групп (GH), причм указанные группы, неионизируемые при нейтральных pH, являются одинаковыми или различными. 10. Полиаминокислота по п.9, где неионизируемая группа, которая является неионизируемой при нейтральных pH, имеет следующую формулу: в которой -R10 представляет собой -H, -CO2H, остаток сложного алкилового эфира, -CH2OH,-C(=O)-NH2, -C(=O)-NH-CH3 или -C(=O)-N(CH3)2. 11. Полиаминокислота по любому из предыдущих пунктов, которая нест по меньшей мере одну привитую полиалкиленовую группу, присоединнную к остатку глутаминовой кислоты. 12. Полиаминокислота по любому из предыдущих пунктов, которая имеет следующую формулу: в которой -R7 представляет собой -OH, -OR9 или -NHR10,R8, R9 и R10 независимо представляют собой H, линейную C2-C10- или разветвлнную C3- иB представляет собой простую связь или двухвалентную, трхвалентную или четырхвалентную связывающую группу, выбранную из следующих групп:D представляет собой Н, линейную C2-C10- или разветвлнную C3-C10-ацильную группу или пироглутамат; каждая из гидрофобных групп (GH) является независимо друг от друга группой, выбранной из линейного или разветвлнного C8-C30-алкила, который может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O, N и S, илиC8-C30-алкиларила или арилалкила, который может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранный из O,N, S, илиC8-C30-(поли)циклического соединения, которое может необязательно содержать по меньшей мере одну ненасыщенную углерод-углеродную группу и/или по меньшей мере один гетероатом, выбранныйR1 является группой, имеющей одну из следующих формул: где w находится в диапазоне 2-6, или является аминокислотным остатком или производным аминокислоты формулы в которой X представляет собой атом кислорода или -NH-;R3 представляет собой гидроксиэтиламиногруппу, алкиленгликоль, полиалкиленгликоль или группу формулы где -R10 представляет собой -H, -CO2H, остаток сложного алкилового эфира, -СН 2 ОН, -C(=O)-NH2,-C(=O)-NH-CH3 или -C(=O)-N(CH3)2;p, q, r и s являются положительными целыми числами;(p)/(p+q+r+s) определяется как молярная степень прививки гидрофобных групп (GH) и варьирует от 2 до 99 мол.% при условии, что каждая цепь сополимера содержит в среднем по меньшей мере три гидрофобные привитые группы;(q)/(p+q+r+s) определяется как молярная степень прививки катионных групп и варьирует от 1 до 99 моль.%;(s)/(p+q+r+s) варьирует от 0 до 98 мол.%,или е фармацевтически приемлемая соль. 13. Косметическая композиция, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12. 14. Диетическая композиция, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12. 15. Композиция препаратов для защиты растений, включающая в себя по меньшей мере одну полиаминокислоту, содержащую остатки глутаминовой кислоты, модифицированные катионными группами,по любому из пп.1-12. 16. Фармацевтическая композиция, включающая в себя по меньшей мере одну полиаминокислоту,содержащую остатки глутаминовой кислоты, модифицированные катионными группами, по любому из пп.1-12. 17. Композиция по п.16, содержащая по меньшей мере одно активное начало. 18. Композиция по п.17, где активное начало ассоциировано с полиаминокислотой(ми), содержащей остатки глутаминовой кислоты, модифицированные катионными группами, одной или более связями, отличными от ковалентных химических связей. 19. Композиция по любому из пп.16-18, где активное начало выбрано из группы, состоящей из ДНК, фрагмента ДНК, РНК и олиго-РНК. 20. Композиция по любому из пп.16-19, представляющая собой коллоидную суспензию наночастиц,и/или микрочастиц, и/или мицелл полиаминокислоты, содержащей остатки глутаминовой кислоты, мо- 21016911 дифицированные катионными группами, в водной или масляной фазе. 21. Композиция по п.20, в которой суспензия представляет собой коллоидный раствор наночастиц в водной фазе при кислых pH, которые осаждаются при физиологических значениях pH. 22. Способ получения лекарственного средства для перорального, назального, пульмонального, вагинального, офтальмологического, подкожного, внутривенного, внутримышечного, внутрикожного,внутрибрюшинного или внутрицеребрального введения, причм активным началом лекарственного средства являются белки, гликопротеины, белки, связанные с одной или несколькими цепями полиалкиленгликоля, пептиды, полисахариды, липосахариды, олигонуклеотиды, полинуклеотиды и гидрофобные,гидрофильные или амфифильные низкомолекулярные органические соединения, который предусматривает использование по меньшей мере одной полиаминокислоты по любому из пп.1-12 и/или композиции по любому из пп.16-21.
МПК / Метки
МПК: C08G 69/10, C08G 69/48, A61K 47/34
Метки: функционализированные, группами, частности, гидрофобными, терапевтические, катионными, применения, полиглутаминовые, кислоты
Код ссылки
<a href="https://eas.patents.su/23-16911-poliglutaminovye-kisloty-funkcionalizirovannye-kationnymi-i-gidrofobnymi-gruppami-i-ih-primeneniya-v-chastnosti-terapevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Полиглутаминовые кислоты, функционализированные катионными и гидрофобными группами, и их применения, в частности терапевтические применения</a>
Предыдущий патент: Противокоррозионная синергетическая система (варианты)
Следующий патент: Производные арилоазол-2-илцианоэтиламина, способ их получения и способ их применения
Случайный патент: Минеральные волокна и их применение