Иммуногенная композиция для защиты крупного рогатого скота от инфекций респираторной и репродуктивной систем и ее применение
Формула / Реферат
1. Иммуногенная композиция, содержащая модифицированный живой бычий вирус герпеса (БВГ-1); модифицированный живой вирус парагриппа 3 типа (PI3); модифицированный живой бычий респираторный синцитиальный вирус (БРСВ); вирус бычьей вирусной диареи 1 типа (ВБВД-1); вирус бычьей вирусной диареи 2 типа (ВБВД-2) и ветеринарно-приемлемый носитель, где указанный носитель содержит сапонин, сапонинсодержащую эмульсию масло-в-воде и/или Quil A, Amphigen и холестерин.
2. Композиция по п.1, отличающаяся тем, что указанный носитель является микрофлюидизированным.
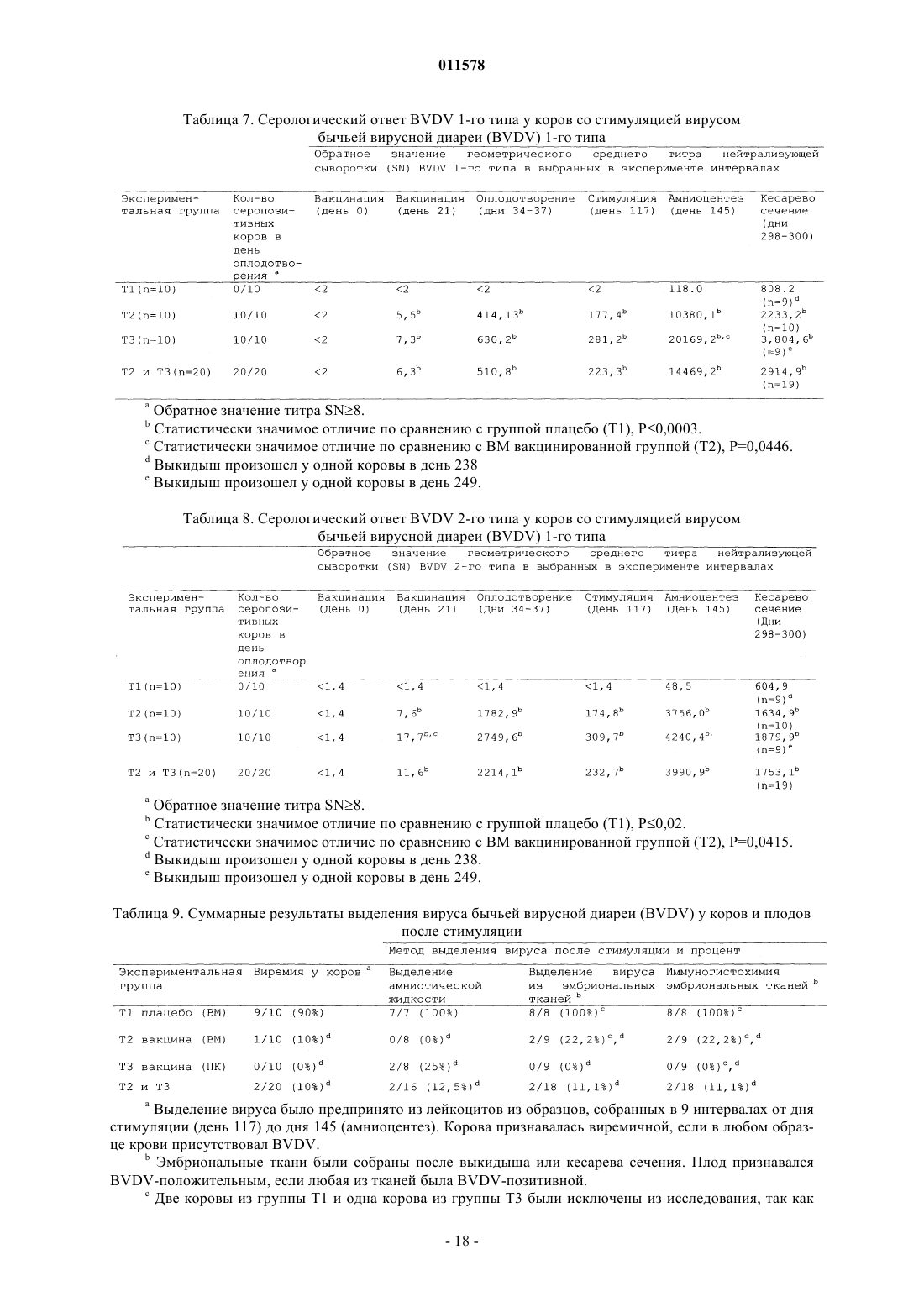
3. Композиция по п.1, отличающаяся тем, что указанный вирус бычьей вирусной диареи 1 типа (ВБВД-1) и вирус бычьей вирусной диареи 2 типа (ВБВД-2) являются цитопатическими.
4. Композиция по п.3, отличающаяся тем, что указанный вирус бычьей вирусной диареи 1 типа (ВБВД-1) является штаммом ВБВД 5960 (приобретенным в Национальном Центре болезней животных (NADC) Министерства сельского хозяйства США (USDA), Ames, Iowa).
5. Композиция по п.3, отличающаяся тем, что указанный вирус бычьей вирусной диареи 2 типа (ВБВД-2) является штаммом ВБВД 53637 (ATCC РТА-4859).
6. Композиция по любому из предшествующих пунктов, отличающаяся тем, что дополнительно содержит по меньшей мере один антиген, выбранный из группы, включающей Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis и Campylobacter fetus.
7. Применение иммунологически эффективного количества композиции по любому из пп.1-5 для получения вакцины для индуцирования иммунного ответа у животного против по меньшей мере одного из следующих вирусов:
(a) бычьего вируса герпеса 1 типа;
(b) вируса бычьей вирусной диареи 1 типа;
(c) вируса бычьей вирусной диареи 2 типа;
(d) вируса парагриппа 3 типа (PI3) и
(e) бычьего респираторного синцитиального вируса (БРСВ).
8. Применение иммунологически эффективного количества композиции по п.6 для получения вакцины для индуцирования иммунного ответа у животного против по меньшей мере одного из следующих патогенов:
(a) бычьего вируса герпеса 1 типа;
(b) вируса бычьей вирусной диареи 1 типа;
(c) вируса бычьей вирусной диареи 2 типа;
(d) вируса парагриппа 3 типа (PI3) или
(e) бычьего респираторного синцитиального вируса (БРСВ);
(f) Campylobacter fetus и
(g) Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis, Leptospira Bratislava, Neospora caninum, Trichomonus fetus, Mycoplasma bovis, Haemophilus somnus, Mannheimia haemolytica и Pasturella multocida.
9. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения или лечения инфекции плода у животного.
10. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения персистирующей инфекции плода у животного.
11. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения или лечения персистирующей инфекции ВБВД у животного.
12. Применение по любому из пп.9-11, где указанным животным является корова, теленок или бычок.
13. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для профилактики персистирующей инфекции или лечения персистентно инфицируемых телят.
14. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения у животного выкидыша, вызванного вирусами, указанными в п.7.
Текст
011578 Область техники, к которой относится изобретение Данное изобретение касается комбинированных вакцин и их применения для лечения или предотвращения заболеваний или нарушений, обусловленных инфицированием вирусом бычьей вирусной диареи (ВБВД) 1 и 2 типа, бычьим вирусом герпеса 1-го типа (БВГ-1), бычьим респираторным синцитиальным вирусом (БРСВ), вирусом парагриппа (PI3), Campylobacter fetus, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardjo-prajitno, Leptospira icterohaemmorrhagiae, Leptospiraborgpetersenii hardjo-bovis и Leptospira interrogans Pomona, путем введения животному эффективного количества комбинированной вакцины. Комбинированная вакцина может представлять собой инактивированную целую клетку или ее часть, либо быть модифицированным живым препаратом. Уровень техники Пять вирусных агентов, связанных с комплексом бычьей респираторной болезни (БРБ) - бычий вирус герпеса 1-го типа (БВГ-1), также известный как вирус инфекционного бычьего ринотрахеита (ВИБР),вирус бычьей вирусной диареи (ВБВД) 1-го и 2-го типа, бычий респираторный синцитиальный вирус(БРСВ) и вирус парагриппа (PI3) - обусловливают инфекции респираторной и репродуктивной систем,что имеет высокую экономическую значимость для скотоводческой и молочной промышленности во всем мире. БРБ обусловливает возникновение широкого ряда клинических синдромов, включая острое начало респираторной болезни и выкидыш. Респираторная форма БРБ характеризуется воспалением,опуханием, кровоизлиянием и некрозом слизистых оболочек респираторного тракта и может сопровождаться сильной лихорадкой, отсутствием аппетита, депрессией, выделениями из носа, затрудненным дыханием и воспалением (морды). Выкидыши, индуцированные вирусами ИБР и ВБВД, могут происходить во всех трех триместрах, но в основном во время второй половины беременности, и часто без проявления других клинических признаков (Ellis et al. (1996) JAVMA 208: 393-400; Ellsworth et al. (1994) In: Proceedings, 74th Conference of Research Workers in Animal Disease: 34). Бычий вирус герпеса 1-го типа (BHV-1) является членом подсемейства alphaherpesviridae и вызывает развитие различных клинических форм заболеваний крупного рогатого скота, включая респираторные и генитальные инфекции, конъюнктивит, энцефалит и выкидыши. В ранее предпринятых попытках подавления инфекции BHV-1 использовали вакцины, содержащие живой аттенуированный вирус (Gerber,J.D., et al., 1978, Am. J. Vet. Res. 39: 753-760; Mitchell, D., 1974, Can. Vet. Jour. 15: 148-151), инактивированный вирус, (Frerichs, G.N., et al., 1982, Vet. Rec. 111: 116-122) и вирусные субъединицы, такие, например, как один из трех основных гликопротеинов BHV-1, обозначаемых в данной области как gI, gIII иgIV (Babiuk, L.A., et al., 1987, Virology 159: 57-66; van Drunen, S., et al., 1993, Vaccine 11: 25-35) . Кроме того, была показана способность рекомбинантной, уменьшенной версии гликопротеина gIV BHV-1 (обозначаемой в данной области как BHV-1 tgIV) индуцировать иммунный ответ слизистой против BHV-1(van Drunen, S., et al., 1994, Vaccine, 12: 1295-1302). Однако признанные в данной области вакцины BHV1 противопоказаны для применения у стельного скота, серопозитивного или серонегативного, и также противопоказаны для применения у телят, вскармливаемых стельными коровами.BVDV 1-го и 2-го типа участвует в развитии различных клинических синдромов. Исследования показали, что вирус вызывает выраженное первичное респираторное заболевание; что постоянно инфицированный (PI) скот является основным источником инфекции для восприимчивых телят; и что BVDV инфицирует депо белых клеток, обусловливая полный и основательный дефицит иммунной системы.Food Animal Practice. Trenton, NJ Veterinary Learning Systems-113-121; Meyling et al. (1987) Agric Pestivirus Infect Rumin 225-231. Выкидыш или мумифицирование плода может происходить, когда стельный скот инфицируется, особенно в течение первого триместра. Bolin et al. (1989) Am J. Vet Res 52: 10331037. Заболевание слизистой является другим распространенным летальным проявлением бычьей вирусной диареи (BVD), развивающимся после раннего инфицирования плода нецитопатическим биотипомBVDV, развития иммунотолерантности к вирусу, рождения персистентно инфицированного (PI) теленка и его последующего суперинфицирования цитопатическим биотипом BVDV. Bolin et al. (1989) Am J. VetRes 52: 1033-1037. BVDV 2-го типа, в основном обозначаемый как геморрагический BVDV, обнаруживается в основном в молочных стадах и является доминирующим штаммом, обнаруживаемым в большинстве регионов Соединенных Штатов в случаях BVD-выкидышей и респираторных заболеваний. Van Oirschot et al. (1999) Vet Micro 64: 169-183.BVDV относится к роду pestivirus и семейству Flaviviridae. Он тесно связан с вирусами, вызывающими пограничную болезнь у овец и классическую свиную лихорадку. У инфицированного скота наблюдается заболевание слизистой, которое характеризуется повышенной температурой, диареей, кашлем и язвами слизистой пищеварительного тракта (Olafson, et al., Cornell Vet. 36: 205-213 (1946); Ramsey,et al., North Am. Vet. 34: 629-633 (1953. Вирус BVD способен проникать сквозь плаценту стельного скота и приводить к рождению PI телят (Malmquist, J. Am. Vet. Med. Assoc. 152: 763-768 (1968); Ross, et al.,J. Am. Vet. Med. Assoc. 188: 618-619 (1986. Указанные телята являются иммунотолерантными к вирусу в течение всей жизни. Они являются источником вспышек заболеваний слизистой (Liess, et al., Dtsch.Tieraerztl. Wschr. 81: 481-487 (1974) и весьма предрасположены к инфицированию микроорганизмами,вызывающими такие заболевания, как пневмония или кишечные заболевания (Barber, et al., Vet. Rec. 117:-1 011578 459-464 (1985). В отношении BVDV на основании исследований роста вируса в культивируемых клетках были выделены два биотипа: вирусы, которые индуцируют в инфицированных клетках цитопатический эффект(ср), и вирусы, не индуцирующие цитопатический эффект (ncp) (Lee et al., Am. J. Vet. Res. 18: 952-953;Gillespie et al., Cornell Vet. 50: 73-79, 1960). Цитопатические варианты могут появляться у PI животных,преинфицированных нецитопатическими вирусами (Howard et al., Vet. Microbiol. 13: 361-369,1987; Corapiet al., J. Virol. 62: 2823-2827, 1988). На основании генетического различия в 5'-нетранслируемом участке(NTR) и антигенных различий в поверхностном гликопротеине Е 2 вирионов вирусов BVD можно предположить существование двух основных генотипов: тип I и II. BVDV 1-го типа представляет собой классические или традиционные вирусные штаммы, которые обычно вызывают умеренную диарею у иммунокомпетентных животных, тогда как BVDV 2-го типа являются неожиданно появляющимися вирусами с высокой вирулентностью, которые могут приводить к тромбоцитопении, геморрагии и острой летальной болезни (Corapi et al., J. Virol. 63: 3934-3943; Bolin et al., Am. J. Vet. Res. 53: 2157-2163; Pellerin et al.,Virology 203: 260-268, 1994; Ridpath et al., Virology 205: 66-74, 1994; Carman et al., J. Vet. Diagn. Invest. 10: 27-35, 1998). Типы I и II вирусов BVDV имеют особую антигенность, определяемую набором моноклональных антител (Mab) и перекрестной нейтрализацией с использованием вирус-специфической антисыворотки, полученной из организма животных (Corapi et al., Am. J. Vet. Res. 51: 1388-1394, 1990). Вирусы любого из генотипов могут существовать в виде одного из двух биотипов, ср и ncp вирусов. Исследования животных, инфицированных вирусом BVD, позволяют предположить, что вирусыBVD индуцируют у животных как В-клеточный, так и Т-клеточный иммунный ответ (Donis et al., Virology 158: 168-173, 1987; Larsson et al., Vet. Microbiol. 31: 317-325, 1992; Howard et al. , Vet. Immunol. Immunopathol. 32: 303-314, 1992; Lambot et al., J. Gen. Virol. 78: 1041-1047, 1997; Beer et al., Vet. Microbiology. 58: 9-22, 1997). Ряд вакцин BVDV были созданы с использованием химически инактивированных BVD-вирусных изолятов (Fernelius et al., Am. J. Vet. Res. 33: 1421-1431,1972; Kolar et al., Am. J. Vet. Res. 33: 1415-1420,1972; McClurkin et al., Arch. Virol. 58: 119, 1978). Для первичной иммунизации требуются множественные дозы инактивированных вирусных вакцин. Некоторые инактивированные вакцины BVDV обеспечивают защиту только от инфицирования BVDV типа I (Beer et al., Vet. Microbiology. 77: 195-208, 2000). Защита плода не была достигнута с помощью инактивированных вакцин BVDV из-за короткой продолжительности иммунитета и неэффективной перекрестной защиты (Bolin, Vet. Clin. North Am. Food Anim.Pract. 11: 615-625, 1995). Модифицированные живые вирусные вакцины (MLV), с другой стороны, предлагают более высокий уровень защиты. Недавно лицензированные вакцины MLV BVDV получают, используя аттенуированные вирусы, полученные при повторном пассаже в бычьи или свиные клетки (Coggins et al., CornellVet. 51: 539-, 1961; Philips et al. , Am. J. Vet. Res. 36: 135-, 1975), или используя химически модифицированные вирусы, которые проявляют чувствительный к температуре фенотип (Lobmann et al., Am. J. Vet.Res. 45: 2498-, 1984; 47: 557-561, 1986). Разовой дозы MLV вакцины достаточно для иммунизации, и у вакцинированного скота продолжительность иммунитета может насчитывать годы. Однако ввиду того,что данные вакцины были разработаны с использованием штаммов вируса BVDV типа I, защита существует только против вируса типа I. Более того, доступные вакцины BVDV не показаны для применения у стельного скота или телят, вскармливаемых стельными коровами. Вирус PI3, действуя отдельно, обычно вызывает только умеренную болезнь; однако вирус делает дыхательные пути восприимчивыми к вторичной инфекции с более патогенными организмами, включая вирус IBR, BRSV и BVDV, приводя к классическому синдрому сыпного тифа. Из всех известных вирусов, вызывающих респираторное заболевание у скота, PI3-вирус является наиболее распространенным.BRSV имеет сродство к нижнему отделу респираторного тракта, и выраженность инфекции определяется главным образом ответом иммунной системы на ключевые вирусные белки. Bolin et al. (1990) AmJ Vet Res 51: 703. Зараженный скот в основном проявляет неспецифические признаки, включая серозные выделения из носа и глаз, умеренную, часто двухфазную, лихорадку и сухой кашель. У более тяжело пораженного скота развивается жесткий кашель, затрудненное дыхание с открытым ртом и пенистой слюной вокруг рта, и может это сопровождаться отказом от еды и питья. Ellis et al. (1996) JAVMA 208: 393-400. Лептоспироз, вызываемый спирохетами рода Leptospira, является экономически важной зооносной инфекцией домашнего скота. Leptospira borgpetersenii серотип hardjo (L. hardjo) и L. interrogans серотипpomona (L. pomona) являются двумя серотипами, наиболее часто связанными с лептоспирозом скота во всем мире. В одном исследовании скота в США 29% реагировали серологически с L. hardjo и 23% с L.pomona. Лептоспиры попадают в организм через слизистые оболочки или поврежденную кожу и распространяются с кровью. Они проявляют сродство к почкам и половым путям и реже - к стекловидному телу глаза и центральной нервной системе. Наиболее обычными путями инфицирования являются прямой или непрямой контакт с инфицированной мочой, молоком или плацентарными жидкостями, но также известны венерический и трансовариальный пути передачи. Лептоспиральное инфицирование скота может-2 011578 приводить к острой лихорадке, отсутствию молока, выкидышу или рождению недоношенных и слабых инфицированных телят и может влиять на проблемы размножения и низкий уровень оплодотворения. Инфекции можно лечить антибиотиками, но их действие может быть не выраженным у нелактирующих или нестельных животных. У такого скота проявляется острая или хроническая инфекция почек, приводящая к распространению вирулентных организмов по мочеполовой системе, и это, в свою очередь, может привести к инфицированию других животных или их хозяев. Иммунитет к лептоспирам имеет специфичность в отношении серотипа, и, хотя вакцины были доступны в течение многих лет, большинство из них вызывало только слабый и короткий иммунитет. Таким образом, существует потребность в создании комбинированных вакцин, обеспечивающих защиту от огромного разнообразия антигенов, которые безопасны для стельных и кормящих коров и их потомства и отвечающих требованиям пищевого рынка и рынка говядины. Данное изобретение обеспечивает создание вакцин для лечения и предотвращения большинства инфекционных факторов респираторных и репродуктивных заболеваний у таких животных, как коровы и телята. Данное изобретение далее обеспечивает иммуногенные композиции и способы лечения и предотвращения заболеваний или нарушений у животных. Сущность изобретения Данное изобретение обеспечивает способ лечения или предотвращения заболевания или нарушений у животных, вызванных инфицированием, по меньшей мере, BVDV 1-го и 2-го типа, BHV-1, PI3, BRSV,Campylobacter fetus, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardjo-prajitno,Leptospira icterohaemmorrhagiae, Leptospira borgpetersenii hardjo-bovis и Leptospira interrogans pomona,который подразумевает введение животному эффективного количества комбинированной вакцины. Данный способ обеспечивает защиту животных, таких как коровы, в частности молочный скот, от респираторной инфекции и заболеваний репродуктивной системы. Данный способ обеспечивает защиту животных, таких как беременные коровы, от выкидышей, обусловленных IBR, и постоянных эмбриональных инфекций, обусловленных BVDV 1-го и 2-го типа. Данный способ обеспечивает защиту животных, таких как лактирующие коровы и телята, вскармливаемые стельными коровами, от постоянных эмбриональных инфекций, обусловленных BVDV 1-го и 2-го типа. Таким образом, данный способ обеспечивает защиту половозрелых животных, стельных и лактирующих животных. Комбинированная вакцина, применимая в данных способах, может представлять собой вакцину, состоящую из целых клеток или их частей (например, модифицированный живой препарат). Комбинированная вакцина, введенная в соответствии с данным изобретением, может включать в себя дополнительные компоненты, такие как адъювант и, необязательно, два и более антигена. Второй антиген выбирают из следующих, но не ограничиваясь ими, бычий вирус герпеса 1-го типа (BHV-1), вирус бычьей вирусной диареи (BVDV 1-го и 2-го типа), бычий респираторный синцитиальный вирус (BRSV), вирус парагриппа (PI3), Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis, Leptospirabratislava, Campylobacter fetus, Neospora caninum, Trichomonus fetus, Mycoplasma bovis, Haemophilus somnus, Mannheimia haemolytica и Pasturella multocida. Подробное описание изобретения Данное изобретение обеспечивает способ лечения или предотвращения у животных заболевания или нарушения, обусловленного инфицированием IBR, BVDV, PI3, BRSV, Campylobacter fetus и/илиLeptospirae, путем введения животному эффективного количества комбинированной вакцины. В определенных воплощениях, вакцины, используемые в способе согласно изобретению, содержат модифицированную живую вакцину и фармацевтически приемлемый носитель или модифицированную живую вакцину и адъювант. Для ясности раскрытия и без намерения ограничить его, подробное описание согласно изобретению разделено на следующие подразделы, в которых описаны или проиллюстрированы определенные признаки, воплощения или применения согласно изобретению. Определения и аббревиатура Используемый здесь термин "лечение или предотвращение" в зависимости от заболевания или нарушения означает снижение или устранение риска инфицирования вирулентным вирусом BVDV 1-го и 2-го типа; IBR; PI3; BRSV; кампилобактериями и/или Leptospira, улучшение или облегчение симптомов инфекции или ускорение выздоровления после инфекции. Лечение может быть признано успешным, если имеет место снижение количества вирусов или бактерий, снижение инфицированности легких, снижение ректальных температур и/или увеличение потребления пищи и/или роста. Лечение также может быть признано успешным, если происходит снижение инфицированности плода и выделения мочи из-за поражения, например, серотипами hardjo и pomona Leptospira. Способ согласно изобретению эффективен, например, в предотвращении или снижении числа выкидышей, обусловленных IBR и инфекциями, обусловленными BVDV 1-го и 2-го типа, и снижении ректальных температур. Данное изобретение рассматривается, следовательно, как с точки зрения обеспечения защиты эмбрионов от IBR и инфекций, обусловленных BVDV 1-го и 2-го типа, так и с точки зрения защиты эмбрионов от герпеса и пестивирусов. Данное изобретение также рассматривается с точки зре-3 011578 ния обеспечения защиты от постоянной эмбриональной инфекции, такой как персистирующая инфекцияBVDV. Под термином "персистентная инфекция плода" подразумевается инфекция на ранних стадиях развития плода (например, 45-125 дней беременности), которая приводит к рождению животных, иммунотолерантных к BVDV, и к сохранению активной репликации BVDV и размножения на высоком уровне, которое часто сохраняется в течение месяцев или лет, служа перманентным источником BVDV в стаде. Эти постоянно инфицируемые животные также испытывают риск развития летальной болезни слизистой при суперинфицировании цитопатическим вирусным биотипом. Термин "комбинированная вакцина" означает бивалентную или мультивалентную комбинацию антигенов, включая модифицированные живые антигены и/или инактивированные антигены. В соответствии с данным изобретением, комбинированная вакцина может содержать живые инфекционные IBR, PI3,BRSV и инактивированный BVDV 1-го и 2-го типа, один или более антигенов, таких как, но не ограничиваясь ими, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis, Leptospirabratislava, Campylobacter fetus, Neospora caninum, Trichomonus fetus, Mycoplasma bovis, Haemophilus somnus, Mannheimia haemolytica и Pasturella multocida, ветеринарно-приемлемый носитель и адъювант. В предпочтительном воплощении компонент модифицированного живого IBR является чувствительным к температуре. В другом предпочтительном воплощении компонент BVDV 2-го типа является цитопатическим (cpBVD-2 штамм 53637-ATCC No. РТА-4859) и компонент BVDV 1-го типа является цитопатическим 5960 (cpBDV-1 штамм 5960-Национальный центр заболеваний животных, Департамент сельского хозяйства Соединенных Штатов, Амес, Айова). В данном изобретении также рассматривается нецитопатический штамм BVDV 1-го и 2-го типа. В другом предпочтительном воплощении, модифицированные живые антигены высушены, лиофилизированы или помещены в стеклянные флаконы. В соответствии с данным изобретением комбинированная вакцина может содержать инактивированный BVDV 1-го и 2-го типа, один или более антигенов, таких как, но не ограничиваясь ими, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis, Leptospira bratislava, Campylobacter fetus, Neospora caninum, Trichomonus fetus, Mycoplasma bovis, Haemophilus somnus, Mannheimiahaemolytica и Pasturella multocida, ветеринарно-приемлемый носитель и адъювант. Используемый здесь термин "комбинированная вакцина" также относится к многокомпонентной композиции, содержащей по меньшей мере один модифицированный живой антиген, по меньшей мере один второй антиген и адъювант, который предотвращает или снижает риск инфицирования и/или который улучшает симптомы заболевания. В предпочтительном воплощении второй антиген инактивирован. В предпочтительном воплощении источником комбинированной вакцины является PregSure 5 (Pfizer,Inc.), PregSure 5-L5(Pfizer, Inc.) и PregSure 5-VL5 (Pfizer, Inc.). Особенно предпочтительным источником комбинированной вакцины является PregSure 5-VL5. Защитные свойства композиции комбинированной вакцины обычно достигаются индуцированием у объекта либо клеточного, либо гуморального иммунного ответа, или их комбинации. Вообще устранение или снижение случаев инфицирования BVDV, IBR и/или PI3, улучшение симптомов или ускоренное выведение вирусов из инфицированных субъектов являются показателями защитных эффектов композиции комбинированной вакцины. Вакцинные композиции согласно изобретению обеспечивают защиту как от инфекций, обусловленных BVDV либо одного, либо обоих типов, так и от выкидышей, обусловленныхBHV-1 (IBR) и респираторных инфекций, обусловленных PI3 и BRSV. Данный способ лечения животного или предотвращения у него заболевания или нарушения, обусловленного инфицированием IBR, BVDV, PI3, BRSV, Campylobacter fetus и/или Leptospirae, путем введения комбинированной вакцины также приводится здесь как способ вакцинации. Термин "комбинированная вакцина", который может быть использован в данном способе, может включать в себя, например, инактивированный полный или частичный клеточный препарат С. fetus и/илиLeptospira, инактивированный BVDV 1-го и 2-го типа и/или один или более модифицированных живых антигенов, таких как BHV-1, PI3 и/или BRSV. В одном воплощении, вакцинные композиции согласно изобретению содержат эффективное количество одного или более вышеописанных вирусов BVDV, предпочтительно штамм 53537 (ATCC РТА 4859) cpBVD-2; штамм 5960 cpBVD-1 (cpBVD-1 штамм 5960-Национальный центр заболеваний животных, Департамент сельского хозяйства Соединенных Штатов, Амес, Айова); мутантный штамм RBL 106RBL 103 PI3 ts (RIT, Риксензарт, Бельгия); штамм 375 BRSV (Институт ветеринарных медицинских исследований, Амес, Айова). Очищенные вирусы BVDV могут использоваться непосредственно в композиции или, предпочтительно, вирусы BVD могут быть дополнительно аттенуированы путем химической инактивации или серийных посевов in vitro. Обычно вакцина содержит примерно от 1103 до 11010 колониеобразующих бляшек или единиц вируса, с ветеринарно-приемлемым носителем и адъювантом, в объеме от 0,5 до 5 мл, предпочтительно около 2 мл. Точное количество вируса в вакцинной композиции,эффективное для обеспечения защитного эффекта, может быть определено квалифицированным ветери-4 011578 нарным врачом. Ветеринарно-приемлемые носители, подходящие для использования в вакцинных композициях, могут быть любыми из описанных здесь и ниже. Обычным путем введения может быть внутримышечная или подкожная инъекция количества примерно от 0,1 до 5 мл вакцины. Вакцинные композиции согласно изобретению могут также содержать дополнительные активные ингредиенты, такие как другие вакцинные композиции против BVDV, например те, которые описаны в WO 9512682, WO 9955366, патенте США 6060457, патенте США 6015795, патенте США 6001613 и патенте США 5593873. Вакцинация может быть завершена после однократной инокуляции или множества инокуляций. Если требуется, у инокулированных животных может быть собрана сыворотка и проверена на наличие антител к вирусу BVD. В другом воплощении данного изобретения вакцинные композиции используются для лечения инфекций BVDV. Соответственно, данное изобретение обеспечивает способы лечения инфекций у животных субъектов, обусловленных вирусами BVD 1-го или 2-го типа или сочетанием 1-го и 2-го типа, путем введения животному терапевтически эффективного количества BVD вируса согласно изобретению. В другом воплощении вакцинные композиции согласно изобретению эффективны в увеличении плодовитости стада и в снижении риска передачи заболевания от скота к скотоводам. Термин животные субъекты включает в себя любое животное, чувствительное к заражениюBVDV, BHV, PI3, BRSV или Leptospira, например, такое как корова, овца и свинья. В воплощении данных способов вакцинную композицию согласно изобретению вводят скоту предпочтительно внутримышечно или подкожно, хотя также могут быть использованы и другие пути введения, такие, например, как пероральный, интраназальный (например, аэрозоль или другое введение без применения иглы), введение в лимфатические узлы, внутрикожный, внутрибрюшинный, ректальный или вагинальный пути введения или комбинации. Для обеспечения оптимальной иммунизации может потребоваться поддерживающие режимы и может быть подобран режим дозирования. Под термином "иммуногенный" подразумевается способность вируса BVD стимулировать у животного иммунный ответ на вирусы BVD 1-го или 2-го типа или на вирусы BVD обоих, 1-го и 2-го, типов. Иммунный ответ может быть клеточным, опосредованным главным образом цитотоксическими Тклетками, или гуморальным, опосредованным главным образом хелперными Т-клетками, которые, в свою очередь, активируют В-клетки, приводя к продукции антител. В соответствии с данным изобретением до использования в иммунногенной композиции, вирусы предпочтительно аттенуированы химической инактивацией или серийными пассажами в клеточной культуре. Квалифицированным специалистам в данной области хорошо известны способы аттенуирования. Предпочтительным вирусом, включенным в состав иммуногенной композиции согласно изобретению, является BVDV ср 53637 (ATCC No. РТА-4859). Другим предпочтительным вирусом, включенным в состав иммуногенной композиции согласно изобретению, является BVDV 5960. Дополнительным предпочтительным вирусом, включенным в состав иммуногенной композиции согласно изобретению, является мутантный штамм RBL 106 штамма IBR ts. Другим предпочтительным вирусом, включенным в состав иммуногенной композиции согласно изобретению, является мутантный штамм RBL 103 PI3 ts. Еще одним предпочтительным вирусом, включенным в состав иммуногенной композиции согласно изобретению, является штамм BRSV 375. Иммуногенные композиции согласно изобретению могут также включать в себя дополнительные активные ингредиенты, такие как другие иммуногенные композиции против BVDV, например, те, которые описаны в одновременно рассматриваемой заявке No. 08/107,908, WO 9512682, WO 9955366, патенте США 6060457, патенте США 6015795, патенте США 6001613 и патенте США 5593873. Кроме того, иммуногенные и вакцинные композиции согласно изобретению могут содержать один или более ветеринарно приемлемых носителей. Используемый здесь термин "ветеринарно-приемлемый носитель" включает в себя любые и все растворители, дисперсионную среду, покрытия, адъюванты, стабилизирующие агенты, разбавители, консерванты, антибактериальные и противогрибковые агенты, изотонические агенты, агенты, замедляющие адсорбцию, и тому подобное. Разбавители могут включать в себя воду, солевой раствор, декстрозу, этанол, глицерин и тому подобное. Изотонические агенты могут включать в себя хлорид натрия, декстрозу, маннит, сорбит и, кроме прочего, лактозу. Стабилизаторы включают в себя, кроме прочего, альбумин. Адъюванты включают в себя, но не ограничиваясь ими,адъювантную систему RIBI (Ribi Inc.), квасцы, гель гидроксида алюминия, холестерин, эмульсии масло в воде, эмульсии вода-в-масле как, например, полные и неполные адъюванты Фройнда, блок-сополимеры(Cambridge Biotech Inc., Cambridge MA), GPI-0100 (Galenica Pharmaceuticals, Inc., Birmingham, AL) или другие сапониновые фракции, монофосфориллипид A, Avridine липид-аминный адъювант, термолабильный энтеротоксин из E. coli (рекомбинантный или иной), холерный токсин или, кроме прочего, мурамилдипептид. Иммуногенные композиции могут также содержать один или более других иммуномодулирующих агентов, таких, например, как интерлейкины, интерфероны или другие цитокины. Иммуногенные композиции могут также содержать Гентамицин и Мертиолат. При условии, что количества и-5 011578 концентрации адъювантов и добавок, применимые в контексте данного изобретения, могут быть легко определены квалифицированным специалистом, в данном изобретении рассматриваются композиции,содержащие примерно от 50 до 2000 мкг адъюванта и предпочтительно примерно 500 мкг/2 мл дозу вакцинной композиции. В другом предпочтительном воплощении, в данном изобретении рассматриваются вакцинные композиции, содержащие примерно от 1 мкг/мл и до примерно 60 мкг/мл антибиотика и более предпочтительно менее чем примерно 30 мкг/мл антибиотка. Иммуногенные композиции согласно изобретению могут быть получены в различных формах, в зависимости от пути введения. Например, иммуногенные композиции могут быть получены в виде стерильных водных растворов или дисперсий, подходящих для использования в виде инъекций, или получены в виде лиофилизированных форм с использованием метода сушки вымораживанием. Лиофилизированные иммуногенные композиции обычно хранят при температуре примерно 4C, и они могут быть восстановлены в стабилизирующем растворе, например в солевом растворе и HEPES, в присутствии или в отсутствие адъюванта. Иммуногенные композиции согласно изобретению могут быть введены животным субъектам для индукции иммунного ответа на вирусы BVD 1-го или 2-го типа, или на оба - 1-й и 2-й тип вирусов BVD. Соответственно, другое воплощение данного изобретения обеспечивает способы стимуляции иммунного ответа на BVD-вирусы 1-го и 2-го типа или на комбинацию вирусов BVD 1-го и 2-го типа путем введения животному субъекту эффективного количества описанной выше иммуногенной композиции согласно изобретению. Термин "животные субъекты включает в себя любое животное, чувствительное к заражению BVDV, такое как корова, овца и свинья. В соответствии со способами согласно изобретению предпочтительная иммуногенная композиция для введения животному субъекту содержит вирус BVDV ср 53637 и/или вирус BVDV ср 5960. Иммуногенную композицию, содержащую вирус BVDV, предпочтительно аттенуированнную химической инактивацией или серийным пассажем в культуру, вводят скоту предпочтительно внутримышечно или подкожно, хотя также могут быть использованы и другие способы введения, такие, например, как пероральный, интраназальный способ, введение в лимфатические узлы, внутрикожный, внутрибрюшинный, ректальный или вагинальный пути введения или их комбинация. Протоколы иммунизации могут быть оптимизированы с помощью методик, хорошо известных в данной области. Животным может быть введена разовая доза или, альтернативно, может быть произведено две и более инокуляций с интервалами от двух до десяти недель. В зависимости от возраста животного иммуноген или вакцинная композиция могут быть введены повторно. Например, в данном изобретении рассмотрена вакцинация здорового скота до шестимесячного возраста и ревакцинация в возрасте шести месяцев. В другом примере в соответствии с данным изобретением рассматривается вакцинация скота в предслучный период за 5 недель до спаривания и повторно примерно за 2 недели до спаривания для защиты плода от инфекции, обусловленной BVDV 1-го и 2-го типа. Полугодовая ревакцинация разовой дозой комбинированной вакцины также рассматривается для предотвращения BVDV-инфекции плода. Выраженность и природа иммунного ответа, индуцированного у скота, может быть оценена с использованием ряда подходов. Например, у инокулированных животных может быть собрана сыворотка и проверена на наличие антител, специфичных в отношении вирусов BVDV, например, в традиционном методе нейтрализации вируса. Используемый здесь термин "скот" касается крупного рогатого скота, включая бычков, быков, коров и телят, но, не ограничиваясь ими. Используемый здесь термин скот относится к стельным и лактирующим жвачным животным. Предпочтительно способ согласно изобретению применяется к млекопитающему, не являющемуся человеком; предпочтительно к лактирующей или стельной корове и ее плоду. Термин "терапевтически эффективное количество" или "эффективное количество" относится к количеству комбинированной вакцины, достаточному для индукции иммунного ответа у животного, которому оно вводится. Иммунный ответ может включать в себя без ограничения индукцию клеточного и/или гуморального иммунитета. Количество вакцины, которое является терапевтически эффективным,может варьировать в зависимости от используемого вируса, состояния скота и/или степени инфекции и может быть определено ветеринарным врачом. Инактивированные (часть клетки или цельная клетка) и модифицированные живые вакцины Инактивированные или модифицированные живые вакцины для применения в способе согласно изобретению могут быть получены с использованием ряда способов, известных в данной области. Например, изоляты BVDV могут быть получены непосредственно из матки инфицированной коровы с использованием известных методик. Изоляты BVDV могут быть инактивированы с использованием ряда известных способов, например путем обработки бактериального изолята бинарным этиленимином (BEI), как описано в патенте США 5565205, или путем инактивации формалином, глутаральдегидом, нагревом, облучением, BPL или другими инактивирующими агентами, известными в данной области. Вакцинный продукт в дополнение к инактивированным вирусным изолятам может также содержать-6 011578 соответствующее количество одного или более обычно используемых адъювантов. Подходящие адъюванты могут включать в себя, но не ограничиваясь перечисленным, минеральные гели, например гидроксид алюминия; поверхностно-активные вещества, такие как лизолецитин; гликозиды, например производные сапонина, такие как Quil A или GPI-0100; полиолы pluronic; полианионы; неионные блокполимеры, например, Pluronic F-127 (B.A.S.F., USA) ; пептиды; минеральные масла, например MontanideISA-50 (Seppic, Paris, France), карбопол, Amphigen, AmphigenMark II (Hydronics, USA), Alhydrogel, масляные эмульсии, например эмульсия минерального масла, такого как BayolF/Arlacel A, и воды, или эмульсия растительного масла, воды и эмульгатора, такая как лецитин; квасцы; бычьи цитокины; холестерин и комбинации адъювантов. В предпочтительном воплощении, содержащая сапонин эмульсия масло-в-воде обычно микрофлюидизирована. Особенно предпочтительным источником BVDV 1-го типа для использования в вакцине и способе согласно изобретению является PregSure (PFIZER INC.), содержащий штамм BVDV 5960 (приобретенный в Национальном Центре болезней животных (NADC), USDA, Ames, IA). Особенно предпочтительным источником BVDV 2-го типа для использования в вакцине и способе согласно изобретению является PregSure (PFIZER INC.), содержащий штамм BVDV 53637 (ATCC РТА-4859), приобретенный в Университете Гуэльфа, Гуэльф, Онтарио. Предпочтительными являются штаммы 5960 и 53637, инактивированные BEI и дополненные коммерчески доступным адъювантом, предпотительно Quil A-Cholesterol-Amphigen (Hydronics, США). Предпочтительная доза иммуногенных и вакцинных композиций согласно изобретению составляет около 2,0 мл. В способы и композиции согласно изобретению могут быть включены консерванты. Консерванты,рассматриваемые в данном изобретении, включают в себя гентамицин и мертиолат. Может быть также добавлен носитель, предпочтительно PBS. В данной области известно приготовление модифицированных живых вакцин, например, путем аттенуирования вирулентных штаммов пересевания в культуре. Инактивированные изоляты BVDV можно также комбинировать со следующими бактериями и вирусами, включая, но не ограничиваясь ими, бычий вирус герпеса 1-го типа (BHV-1), бычий респираторный синцитиальный вирус (BRSV), вирус парагриппа (PI3), Campylobacter fetus, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardjo-prajitno, Leptospira icterohaemmorrhagiae, Leptospiraborgpetersenii hardjo-bovis и Leptospira interrogans pomona. Дозирование и способы введения В соответствии с данным изобретением эффективное количество комбинированной вакцины, введенной скоту, включая стельных коров и телят, вскармливаемых стельными коровами, обеспечивает эффективный иммунитет против заболевания и эмбриональной инфекции, связанной с вирусом бычьей вирусной диареи (1-го и 2-ого типа). В одном воплощении, комбинированную вакцину вводят телятам двумя дозами с интервалом примерно 3-4 недели. Например, первое введение осуществляют, когда животное находится в возрасте примерно 1-3 месяца. Второе введение осуществляется спустя примерно 1-4 недели после первого введения комбинированной вакцины. В предпочтительно воплощении первое введение осуществляют примерно за 5 недель до спаривания животных. Второе введение осуществляют примерно за 2 недели до спаривания. Введение соответствующих доз вакцины предпочтительно осуществляют ежегодно. В другом предпочтительном воплощении животные, вакцинированные до достижения возраста примерно 6 месяцев, должны быть ревакцинированы после 6-месячного возраста. Введение соответствующих доз вакцины предпочтительно осуществляется ежегодно. Эффективное количество комбинированной вакцины зависит от ингредиентов вакцины и графика введения. Обычно при использовании вируса бычьей вирусной диареи при приготовлении комбинированной вакцины количество вакцины, содержащей примерно от 103 до 1010 колониеобразующих единиц на дозу BVDV и предпочтительно примерно от 105 до 108 колониеобразующих единиц на дозу BVDB (1 го и 2-го типа), эффективно при введении животному дважды в течение периода примерно 3-4 недели. Предпочтительно, если комбинированная вакцина, обеспечивающая эффективный иммунитет, содержит примерно от 105 до 108 колониеобразующих единиц/доза BVDV (1-го и 2-го типа) и более предпочтительно, примерно 106 колониеобразующих единиц/доза, при введении животному дважды в течение периода примерно от 3 до 4 недель. Первое введение осуществляют примерно за 5 недель до начала спаривания. Второе введение осуществляют примерно за 2 недели до начала спаривания. Введение соответствующих доз вакцины предпочтительно проводят ежегодно. Животные, вакцинированные до достижения возраста примерно 6 месяцев, должны быть ревакцинированы после 6-месячного возраста. Введение соответствующих доз вакцины предпочтительно осуществляется ежегодно. В соответствии с данным изобретением, когда вводят предпочтительный продукт, PregSure 5(Pfizer, Inc.), PregSure 5 вводят предпочтительно дважды, каждый раз в количестве примерно от 0,5 до 5,0 мл, предпочтительно примерно от 1,5 до 2,5 мл и более предпочтительно примерно 2 мл. Когда вводят предпочтительный продукт PregSure 5-L5 или PregSure 5-VL5, PregSure 5-L5 или PregSure 5VL5 вводят предпочтительно дважды, каждый раз в количестве примерно от 0,5 до 10,0 мл, предпочтительно примерно от 3 до 7 мл и более предпочтительно примерно 5 мл. Первое введение осуществляют-7 011578 примерно за 5 недель до начала спаривания. Второе введение осуществляют примерно за 2 недели до начала спаривания. Введение соответствующих доз вакцины предпочтительно проводят ежегодно. Животные, вакцинированные до достижения возраста примерно 6 месяцев, должны быть ревакцинированы после 6-месячного возраста. Введение соответствующих доз вакцины предпочтительно осуществляется ежегодно. В соответствии с данным изобретением введение может быть осуществлено несколькими известными путями, включая пероральный, интраназальный, местно, трансдермальный и парентеральный (например, внутривенный, внутрибрюшинный, внутрикожный, подкожный или внутримышечный). Предпочтительным путем введения является подкожный или внутримышечный способ. В данном изобретении рассматривается также разовое первичное введение дозы с последующей ежегодной ревакцинацией, которая устраняет необходимость введения дополнительных доз телятам до ежегодной ревакцинации для создания и/или сохранения иммунитета против инфекции. Комбинированная вакцина, введенная в соответствии с данным изобретением, может содержать дополнительные компоненты, такие как адъювант (например, минеральные гели, например, гидроксид аллюминия; поверхностно-активные вещества, такие как холестерин, лизолецитин; гликозиды, например,производные сапонина, такие как Quil A, QS-21 или GPI-0100; полиолы pluronic; полианионы; неионные блок-полимеры, например Pluronic F-127; пептиды; минеральные масла, например, Montanide ISA-50,карбопол, Амфиген, Алгидрогель, масляные эмульсии, например эмульсия минерального масла, такого как BayolF/Arlacel A, и воды, или эмульсия минерального масла, воды и эмульгатора, такая как лецитин; квасцы; бычьи цитокины и комбинации адъювантов). В соответствии с данным изобретением введение скоту эффективного количества комбинированной вакцины в возрасте примерно 3 месяцев обеспечивает эффективный иммунитет против респираторных инфекций и репродуктивных заболеваний и уменьшает число выкидышей. Данное изобретение также обеспечивает способ иммунизации скота, включая, но не ограничиваясь ими, коров, телят и телок до спаривания, от инфекции, обусловленной BVDV (1-го и 2-го типа), и респираторного заболевания, связанного с IBR, BVDV (1-го и 2-го типа), PI3, BRSV, кампилобактериозом и лептоспирозом, включающий в себя введение животному по меньшей мере одной дозы, а предпочтительно двух доз комбинированной вакцины для иммунизации животного против инфекции, обусловленной BVD (1-го и 2-го типа), IBR, PI3, BRSV, Leptospira canicola, Leptospira grippotyphosa, Leptospiraborgpetersenii hardjo-bovis, Leptospira bratislava, и Campylobacter fetus. В предпочтительном воплощении, вакцину вводят подкожно. В другом предпочтительном воплощении, вакцину вводят внутримышечно. Более того, предпочтительно, если вакцина содержит примерно от 2 до 7 мл, предпочтительно примерно от 5 мл, каждый мл содержит примерно от 103 до 1010 колониеобразующих единиц/доза вируса. В другом предпочтительном воплощении вакцина содержит примерно 2 мл, где каждый мл содержит примерно от 103 до 1010 колониеобразующих единиц/доза вируса. Комбинированную вакцину желательно вводить животному дважды; один раз в возрасте примерно от 1 до 3 месяцев и один раз примерно через 1-4 недели. В данном изобретении также рассматриваются полугодовые ревакцинации разовой дозой и ревакцинация до периода спаривания. Данное изобретение также обеспечивает способ защиты скота от инфекции эмбриона и персистентной инфекции эмбриона, включая введение животному по меньшей мере одной дозы, а предпочтительно,двух доз комбинированной вакцины для иммунизации плода против инфекции, обусловленной BVD (1 го и 2-го типа), IBR, PI3, BRSV, Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjobovis, Leptospira bratislava и Campylobacter fetus. Комбинированную вакцину желательно вводить животному однократно примерно за 5 недель до спаривания и однократно примерно за 2 недели до спаривания. В данном изобретении рассматривается введение эффективного количества комбинированной вакцины животным, предпочтительно скоту, для лечения или предупреждения нарушений, включая персистентные инфекции плода и репродуктивные нарушения, такие как выкидыши у таких животных. Данное изобретение далее проиллюстрировано, но не ограничено следующими примерами. Пример 1. Материалы и методы. Животные. Пятьдесят шесть BVDV-серонегативных (то есть имеющих титры нейтрализующей сыворотки [SN]1:2) коров, пригодных для оплодотворения, получали из различных источников и содержали в условиях изоляции в процессе изучения. Каждое животное идентифицировали по двойным биркам в ушах, по одной в каждом ухе. Новые бирки прикреплялись в случаях, когда животное теряло ушную бирку. До изучения, экспериментальных животных инокулировали коммерческими вакцинами от лептоспироза, кампилобактериоза (вибриоза) и клостридиальных инфекций. Экспериментальных животных содержали под наблюдением практикующего ветеринара, который ежедневно их клинически контролировал. Тест-вакцина. Тест-вакцина была мультивалентна, вакцину модифицированного живого инфекционного бычьего ринотрахеита (IBR)-парагриппа 3 (PI3)-респираторного синцитиального вируса (RSV) в-8 011578 высушенном виде разводили инактивироаванной жидкой вакциной BVDV, комбинированной с адъювантом. (Pfizer Inc, New York, NY). Компонент BVDV, содержащий минимум BVDV-1 и -2 иммунизирующих доз, совмещали со стерильным адъювантом. Эффективность иммунизирующих агентов BVDV устанавливали расчетом геометрического среднего титра (GMT) для 8 повторных титрований основной массы жидкости, используемой для приготовления вакцины. После разведения вакцину IBR-PI3-BRSVBVDV вводили в дозах объемом 2 мл либо внутримышечно (BM), либо подкожно (ПК). Высушенную вакцину IBR-PI3-RSV восстанавливали в стерильной воде, используемой в качестве плацебо, и вводили внутримышечно. Стимулирующий вирус. В качестве стимулирующего агента использовали природный изолят нецитопатическиого BVDV 2-го типа (Штамм 94 В-5359, предоставленный Hana Van Campen, Ветеринарная лаборатория штата Вайоминг, Университет штата Вайоминг). Подлинность вируса подтверждали анализом SN и полимеразной цепной реакцией с обратной транскриптазой (ОТ-ПЦР). Анализ OT-ПЦР был положительным для нуклеотидных последовательностей BVDV 2-го типа для белка р 125 и 5'нетранслируемого участка и отрицательным для консервативных последовательностей gp53 и р 80 BVDV 1-го типа. Эффективность вводимого вируса устанавливали при GMT 103,2 TCID50/мл путем 2 повторных титрований, проведенных непосредственно до и после введения. Вводимый инокулят впрыскивали интраназально в объеме дробной дозы 4 мл, по 2 мл в каждую ноздрю. Серологические анализы. Титры нейтрализующей сыворотки BVDV 1-го и 2-го типа определяли путем анализа с использованием константного вируса и уменьшающихся количеств сыворотки на бычьей клеточной культуре. Серийные разведения сыворотки объединяли либо с 50-300 TCID50 цитопатического BVDV 1-го типа, штамм 5960, либо со сходным количеством цитопатического BVDV 2-го типа,штамм 125 с. Выделение вируса. Выделение вируса после стимуляции (PC) BVDV в бычьей клеточной культуре проводили из периферической крови коров, амниотической жидкости, эмбриональной крови и эмбриональных тканей. BVDV-позитивную клеточную культуру определяли методом непрямой иммунофлуоресценции, используя козьи анти-BVDV-поликлональные антитела. Также предпринимались попытки выделения BVDV из эмбриональных тканей с использованием ранее описанных иммуногистохимических методов (Haines DM, Clark EG и Dubovi EJ. Vet Pathol 1992; 29: 27-32). Кровь у коров отбирали из яремной вены аликвотами по 5-10 мл и помещали в гепаринсодержащие пробирки для получения лейкоцитов, используемых при выделении вируса. Амниотическую жидкость собирали под местной анестезией путем левосторонней лапаротомии и аспирации 3-5 мл образца из уретры. После кесарева сечения или спонтанного выкидыша, глаза, селезенку, тимус и 3 части мозга (ствол мозга/средний мозг, полушария и мозжечок) асептически извлекали из каждого плода. Супернатант из гомогенизированных эмбриональных тканей использовали при выделении вируса в клеточной культуре. Для целей иммуногистохимической оценки эмбриональные ткани погружали в парафин и дважды тестировали, используя асцитные разведения 1:800 и 1:600, содержащие анти-BVDV моноклональные антитела. Анализ биометрических данных. В вакцинированных группах животных (Т 2 и Т 3) для демонстрации защиты после стимуляции должно быть показано статистически значимое снижение возникновения инфекции BVDV 2-го типа у взрослых особей и эмбрионов по сравнению с контрольной группой плацебо (T1). Точный тест Фишера использовали для сравнения степени (1) виремии у коров в течение первых 14 дней после стимуляции, (2) выделения BVDV из амниотической жидкости, (3) выделения BVDV из эмбриональных тканей и крови плода после спонтанного выкидыша или кесарева сечения и (4) BVDVпозитивной иммуногистохимии эмбриональных тканей. Титры нейтрализующей сыворотки проанализировали с помощью смешанной линейной модели с повторяющимися измерениями. Значения наименьших квадратов из анализа расхождений использовали для расчета геометрического среднего титра (GMT), где исключены данные SN для коров, которых не стимулировали. Значение вероятности Р 0,05 использовали для определения статистической значимости. Исследование защиты эмбрионов. 56 экспериментальных коров рандомизировали по трем экспериментальным группам, в BM группу плацебо (T1), внутримышечно вакцинированную группу (Т 2) и подкожно вакцинированную группу (Т 3), как указано в таблице 1. Коров инокулировали вакциной или плацебо в экспериментальный день 0 и день 21. Во всех случаях в день 0 инокуляцию проводили в левую часть шеи, а в день 21 инокуляцию проводили в правую часть шеи. В день 1 коровам давали корм с ацетатом меленгестрола (сверху) в течение 14 дней. В день 32 все коровы получали BM иньекцию простагландина (Lutalyse, PharmaciaUpjohn, Kalamazoo, MI) для синхронизации течки. Коров с течкой искусственно осеменяли сертифицированной BVDV-отрицательной спермой. В день 100, приблизительно на 65-й день беременности, ректальной пальпацией установливали статус стельности коров. В день 105 из каждой экспериментальной группы выбирали 23 коровы с подтвержденной стельностью рандомизированно (7 контролей, 8 внутримышечно вакцинированных животных и 8 подкожно вакцинированных животных), перемещали в ближайшее изолированное помещение,(Midwest Veterinary Services, Oakland, NE) и объединяли. В день 119 23 экспериментальным коровам-9 011578 вводили вирулентный BVDV путем интраназальной инокуляции. Образцы крови собирали в день стимуляции и с 8 интервалами после стимуляции, в дни 119, 121, 123, 125, 127, 129, 133, 140 и 147 (дни после стимуляции 0, 2, 4, 6, 8, 10, 14, 21, и 28) с целью выделения BVDV и серологического анализа. В день 147 (через 28 дней после стимуляции) проводили левостороннюю лапаротомию и из каждой коровы извлекали амниотическую жидкость. В день 297, приблизительно за 7-14 дней до ожидаемых родов, экспериментальных коров перевозили в помещения университета в Небраске, в Департаменте ветеринарии и биомедицинского обслуживания, для кесарева сечения. Непосредственно до хирургического вмешательства у каждой коровы собирали образцы крови для анализа SN. После кесарева сечения (в дни 300-301) от каждого плода отбирали образцы крови. Эмбрионы умерщвляли и асептически собирали ткани с целью выделения BVDV. В некоторых случаях, когда происходили спонтанные выкидыши, образцы крови брали у самки при обнаружении выкидыша и две недели спустя. Парные образцы крови подвергали серологическому исследованию (Ветеринарный Диагностический Центр университета в Небраске, Линкольн, NE), выкидыши исследовали на предмет содержания BVDV (Центр исследований Pfizer, Линкольн, NE) и проводили гистопатологическую оценку эмбриональных тканей (Saskatoon Veterinary Biodiagnostics, Saskatoon, SK,Canada). Результаты Никаких неблагоприятных событий не происходило во время или сразу после введения 2 доз вакцин. Все коровы были серонегативными в отношении BVDV 1-го и 2-го типа до вакцинации (день 0),что свидетельствует о том, что экспериментальные животные были иммунологически интактны в отношении BVDV в начале изучения. Значения GMT для BVDV 1-го типа показаны в таблице 2. У пятнадцати из 16 вакцинированных сероконверсия происходит после 2 доз вакцин. Корова номер 61 (Т 3-группа) имела титры SN BVDV 1-го типа 1:2 в день 0, 1:19 в день 21 и 1:2 в день 33 и в день 119. ЗначенияGMT для BVDV 2-го типа показаны в табл. 3. У всех вакцинированных животных, включая корову 61,сероконверсия происходит после второй дозы. (Корова 61 имела титры SN BVDV 2-го типа 2 в день 0,1:19 в день 21, 1:2,048 в день 33, и 1:431 в день 119.) В период оплодотворения (дни 32-41) вакцинированные коровы (за исключением коровы 61) имели титры SN BVDV 1-го типа, которые варьировали от 1:64 до 1:13,777. Вакцинированные коровы имели титры SN BVDV 2-го типа, которые при оплодотворении варьировали от 1:64 до 1:6,889. После вакцинации различие в значениях GMT для внутримышечно обработанной группы (Т 2) по сравнению с подкожно обработанной группой (Т 3) не было статистически значимым в период за 2 интервала до введения, и после введения. Все коровы в группе плацебо (T1) оставались серонегативными в отношении BVDV 1-го и 2-го типа до момента введения (день 119), что свидетельствует о том, что исследование не было скомпрометировано случайными воздействиями. Все коровы в группе плацебо серологически реагировали на стимуляцию, что свидетельствует о том, что жизненная реакция имеет место у каждого животного. В группе плацебо после стимуляции GMT дляBVDV 1-го типа был значительно более низким, чем реакции, известные из анамнеза, полученные в любой из вакцинированных групп (таблица 2, день 147). Плацебо коровы также имели после стимуляции низкие GMT для BVDV 2-го типа по сравнению с любой из вакцинированных групп, но различие было статистически значимым только по сравнению с BM вакцинированными животными (T2). Двадцать три коровы в 3 экспериментальных группах, в отношении которых было подтверждено,что они являются стельными и стимулированными, подвергали амниоцентезу (таблица 1). Между временем проведения амниоцентеза (день 147) и кесарева сечения (день 300-301) у 7 коров были выкидыши, у 4 из группы Т 2 и у 3 из группы Т 3. Кроме того, во время кесарева сечения было установлено, что 3 оплодотворенных коровы (1 корова из группы плацебо T1 и 2 коровы из группы Т 3) не являлись стельными. У данных 3 коров была подтверждена беременность при ректальной пальпации в день 100, приблизительно через 65 дней после оплодотворения, что свидетельствует о том, что произошел последующий выкидыш или резорбция плода. Ввиду того, что эмбриональные ткани от 3 коров с неудавшимися беременностями не были доступны для оценки, данные животные были исключены из исследования. В день 259, корова номер 67 из группы плацебо T1 погибла, и из нее извлекли плод для выделения BVDV. Таким образом, в итоге исследования 12 из 23 коров, подвергшихся стимуляции, претерпели кесарево сечение. 12 плодов после кесарева сечения и 7 плодов после зыкидышей и плод от мертвой коровы (в совокупности 20) оценивали на содержание BVDV. У коровы 38 из группы Т 2 произошел выкидыш в день 156 (на сроке 123 дня беременности и 37 дней после введения). Парные образцы сыворотки не были оценены, но корова 38 была негативной в отношении содержания BVDV в периферической крови и амниотической жидкости. Плод был подвергнут значительному автолизу. При гистопатологической и бактериологической оценке плода было выявлено гнойное воспаление хорионической и субхорионической соединительных тканей. Из легкого, печени и торакальной жидкости был выделен Staphylococcus hyicus. Был получен негативный изолят BVDV и иммуногистохимические результаты, демонстрирующие, что плод не был инфицирован в результате стимуляции. У трех коров из группы Т 3 (номера 21, 27 и 40) произошел выкидыш в дни 158 или 159 (на сроке- 10011578 125-127 дней беременности и 39 или 40 дней после стимуляции). Свидетелей выкидышей не оказалось,поэтому эмбрионы-выкидыши не могут быть отнесены к какой-либо определенной корове. Они были обозначены как неидентифицированные плоды 1, 2 или 3. Неизвестный плод 1 был мумифицирован с повреждениями, гистологически типичными для неоспороза. Неизвестный плод 2 был подвержен автолизу, с множественным гнойным и некротизирующим плацентитом и большим количеством бактериальных кокков, смешанных с воспалительным экссудатом. Staphylococcus hyicus был выделен из легкого,почки, печени, содержимого желудка и плаценты. Неизвестный плод 3 был мацерирован и подвержен автолизу. Staphylococcus sp был выделен из легкого, почки, печени и содержимого желудка. Для всех тканей из 3 неизвестных плодов были получены отрицательные изоляты BVDV и иммуногистохимические результаты. Все 3 самки после стимуляции были BVDV негативными при исследовании периферической крови. Коровы 21 и 40 были, вероятно, негативными в отношении BVDV в амниотической полости, но корова 27 имела BVDV-позитивный образец амниотической жидкости. Парные образцы сыворотки крови самок не были оценены. У коровы 45 из группы Т 2 произошел выкидыш в день 160 (на сроке 128 дней беременности и через 41 день после стимуляции). Отмечен всесторонний эмбриональный автолиз. Staphylococcus sp был выделен из легкого, почки, печени, содержимого желудка и плаценты. Был обнаружен плацентит с множественными очагами тромбоза и гнойным васкулитом. Серологические анализы торакальной жидкости наIBR, бычью вирусную диарею (BVD) и лептоспироз были отрицательными. Были получены отрицательные изоляты BVDV и иммуногистохимические результаты для всех эмбриональных тканей. У коровы 66 из группы Т 2 произошел выкидыш в день 195 (на сроке 160 дней беременности и 76 дней после введения). Наблюдалось выраженное гнойное воспаление плацентарной lamina propria, идущей от поверхности плода. Из содержимого желудка и плаценты культивировали E. coli и Proteusvulgaris. Серологические результаты парных образцов сыворотки и торакальной жидкости не подтвердили этиологию IBR, BVD или лептоспироза. Были получены отрицательные изоляты BVDV и иммуногистохимические результаты для всех эмбриональных тканей. У коровы 31 из группы Т 2 произошел выкидыш в день 295 (на сроке 262 дней беременности и через 176 дней после введения). Гистопатологический анализ выявил диффузный некрогнойный плацентит,некроз хорионического эпителия и интенсивное нейтрофильное воспаление. Грамотрицательные коккобактерии и палочковидные бактерии культивировали из очага воспаления. Парные серологические результаты не подтвердили этиологию IBR, BVD или лептоспироза. Были получены отрицательные изоляты BVDV и иммуногистохимические результаты для всех эмбриональных тканей. Позитивные BVDV-изоляты были получены после стимуляции из образцов периферической крови и амниотической жидкости, полученных от коровы 67 из группы плацебо T1, которая погибла до завершения исследования. Все эмбриональные ткани из этой коровы дали положительные изоляты BVDV и иммуногистохимические результаты. Образцы крови, собранные у 12 эмбрионов после кесарева сечения, анализировали по титрам SNBVDV 1-го и 2-го типа. Ни один из эмбрионов 5 коров из группы плацебо или 7 вакцинированных животных не был серопозитивным в отношении BVDV ни 1-го, ни 2-го типа. Результаты выделения вируса после стимуляции представлены в таблице 4 . Все 7 коров из группы плацебо T1 имели BVDV-виремию, подтверждая серологические результаты, показывающие, что жизнеспособная стимуляция имела место у каждого из невакцинированных животных. Образцы крови от всех 16 вакцинированных животных групп Т 2 и Т 3 отрицательные в отношении BVDV-виремии в каждом из 8 образцов после стимуляции. Различие уровня виремии после стимуляции у вакцинированных животных в группах Т 2 и Т 3 по сравнению с контролями было статистически значимым (P0,0001). Амниотическая жидкость у 2 из 16 (12,5 процентов) вакцинированных животных была BVDVположительной по сравнению с 7 из 7 (100 процентов) коровами из группы плацебо T1, отличие статистически значимо (P0,0001). Образцы амниотической жидкости вакцинированных животных из группы Т 3 у 27 и 60 были положительными. Плод коровы 27 был BVDV-отрицательным в отношении содержания вируса и на основе данных иммуногистохимических методов. Эмбриональные ткани 1 из 14 вакцинированных животных (7,1%), 60 коров из группы Т 3 былиBVDV-положительными. Этот результат сравнивали с содержанием BVDV в 6 из 6 (100 процентов) эмбрионах от коров из группы плацебо T1, отличие статистически значимо (P0,0001). Результаты содержания BVDV были либо все положительными, либо все отрицательными для эмбриональных тканей,полученных из каждого плода. Иммуногистохимические результаты BVDV были положительными для эмбриональных тканей 1 из 14 (7,1 процентов) вакцинированных животных из групп Т 2 и Т 3 (60 коров из группы Т 3) . Все эмбриональные ткани 6 из 6 (100 процентов) коров из группы плацебо T1 были BVDV-иммуногистохимически положительными, значительно большая доля (P0,0001) по сравнению с вакцинированными животными. Иммуногистохимические результаты BVDV были либо все положительными, либо все отрицательными для эмбриональных тканей, полученных из каждого плода. В табл. 5 указан источник выделения вируса и титры SN 2 вакцинированных коров до введения с- 11011578 позитивными результатами выделения BVDV. Серологические данные показывают, что вакцинированные животные 27 и 60 из группы Т 3 иммунологически реагировали на вакцинацию. Корова 27 имела при стимуляции более низкий титр SN BVDV 2-го типа, чем GMT для группы Т 3, но различие было незначимым. Внутримышечная и подкожная вакцинация совместно обеспечили 92,9-процентную эффективность против эмбриональной BVDV-2 инфекции с отрицательными результатами выделения BVDV, имеющими место в эмбриональных тканях у 13 из 14 вакцинированных коров (табл. 4). Данное значение сравнивалось со значением 88,9-процентной степенью защиты (16 из 18 вакцинированных животных былиBVDV-отрицательными) в более раннем тесте этой же вакцины против стимуляции эмбриона BVDV-1(см. пример 2) . В обоих этих исследованиях 100-процентное эмбриональное инфицирование происходило у невакцинированных коров из группы плацебо, и это подтверждает то, что вакцинированные животные были подвергнуты жесткой иммунной стимуляции. Стимулирующий вирус выделяли из амниотической жидкости 2 вакцинированных животных, коровы 27 и 60 (таблица 5). В результате обе эти коровы были признаны BVDV-положительными, даже, несмотря на то, что они были отрицательными в отношении виремии в каждый из 8 интервалов после стимуляции. Выделение вируса, как и иммуногистохимические методы высокой специфичности и чувствительности, не обнаружили BVDV в выкидыше коровы 27, таким образом, данную корову следует определить как BVDV-отрицательную. Выкидыш данного плода был возможен из-за процесса BVDVинфекции у самки. Для подтверждения результатов были использованы два метода для достижения защиты коров (виремия и выделение вируса из амниотической жидкости) и их плодов (иммуногистохимия и выделение вируса в культуре ткани). Наиболее стабильный результат использовали для определения уровня защиты. Таким образом, уровень защиты у вакцинированных коров был признан скорее равным 87,5% (14 из 16), что соответствует процентному содержанию коров, отрицательных в отношении выделенного из амниотической жидкости вируса, нежели 100%, соответствующим процентному содержанию коров с отрицательной виремией. Ни один из опубликованных результатов исследований стимуляции иммунитета не давал 100-процентную защиту плода у вакцинированных животных, в противоположность стимуляции, которая давала 100-процентное инфицирование у невакцинированных контролей. Даже модифицированная живая вирусная вакцина (MLV) , обычно не оцениваемая на стельных коровах, обеспечивает не более 83 процентов защиты от эмбриональной BVDV-1-инфекции в одном исследовании (Cortese VS,Grooms, DL,Ellis J, et al. (1998) Am J Vet Res. 59: 1409-1413). Таблица 1. Экспериментальные группы и конечный статус стельности коров в исследовании со стимуляцией вирусом бычьей вирусной диареи (BVDV) 2-го типа ВМ=внутримышечная вакцинация. ПК=подкожная вакцинация. а Физическая смерть установлена для коровы 67 из группы T1 (день 259).b Выкидыши наблюдались у коров 38 из группы Т 2 (день 156), 45 (день 160), 66 (день 195), 31 (день 295) и у коров 21, 27 и 40 из группы Т 3 (дни 158 или 159). с Для всех коров с неудачными беременностями была подтверждена беременность в день 100, приблизительно через 65 дней после оплодотворения.- 12011578 Таблица 2. Серологический ответ BVDV 1-го типа у коров со стимуляцией вирусом бычьей вирусной диареи (BVDV) 2-го типа Обратное значение титра SN8. Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0002. с Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0001. Таблица 3. Серологический ответ BVDV 2-го типа у коров со стимуляцией вирусом бычьей вирусной диареи (BVDV) 2-го типа Обратное значение титра SN8. Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0064. с Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0005.d Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0001.e Статистически значимое отличие по сравнению с группой плацебо (T1), P=0,0128.f Статистически значимое отличие по сравнению с группой плацебо (T1), P=0,023.- 13011578 Таблица 4. Суммарные результаты выделения вируса бычьей вирусной диареи (BVDV) у коров и плодов после стимуляции Выделение вируса было предпринято из лейкоцитов из образцов, собранных в 9 интервалах со дня 119 (введение) до дня 147 (амниоцентез). Корова признавалась виремичной, если в любом образце крови присутствовал BVDV.b Эмбриональные ткани были собраны после выкидыша или кесарева сечения. Плод признавался виремичным, если любая из тканей была позитивна. с Одна корова из группы T1 и две коровы из группы Т 3 исключены из исследования, так как они не были стельными во время кесарева сечения и выкидыши не наблюдались.d Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0001. Таблица 5. Титры нейтрализующей сыворотки (SN) у самок и результаты стимуляции в случаях, когда у вакцинированных коров или их эмбрионов выделяли вирус бычьей вирусной диареи (BVDV)AF=амниотическая жидкость; FT=эмбриональная ткань; IHC=иммуногистохимия эмбриональной ткани; GMT=геометрическое среднее титра; N/А=не применяли. Пример 2. Материалы и методы. Животные. Пятьдесят девять серонегативных (то есть имеющих титры нейтрализующей сыворотки[SN]1:2) крепких и половозрелых коров и бычков получали из многих источников и содержали в изолированных помещениях для изучения в Небраске в течение изучения. Каждое животное идентифицировали по двойным биркам в ушах, по одной в каждом ухе. Новые бирки прикреплялись в случаях, когда животное теряло ушную бирку. До исследования экспериментальных животных инокулировали коммерческими вакцинами от лептоспироза, кампилобактериоза (вибриоза) и клостридиальных инфекций. Экспериментальных животных содержали под наблюдением практикующего ветеринара, который ежедневно их клинически контролировал. Тест-вакцина. Тест-вакцина была мультивалентна, вакцину модифицированного живого инфекционного бычьего ринотрахеита (IBR)-парагриппа 3 (PI3)-респираторного синцитиального вируса (RSV) в высушенном виде разводили инактивированной жидкой вакциной BVDV (CattleMaster/PregSure 5, PfizerInc, New York, NY). Компонент BVDV совмещали со стерильным адъювантом. Эффективность иммунизирующего антигена BVDV устанавливали расчетом геометрического среднего титра (GMT) для 8 повторных титрований основной массы жидкости, используемой для приготовления вакцины. После разведения IBR-PI3-BRSV-BVDV-вакцину вводили в дозах объемом 2 мл либо внутримышечно (BM), либо подкожно (ПК). Высушенную IBR-PI3-RSV-вакцину восстанавливали в стерильной воде, используемой в качестве плацебо. Стимулирующий вирус. В качестве стимулирующего агента использовали нецитопатический природный изолят BVDV 1-го типа (штамм 816317, предоставленный доктором E. J. Dubovi, New York StateCollege of Veterinary Medicine, Cornell University). Подлинность вируса подтверждали анализом SN и полимеразной цепной реакцией с обратной транскриптазой (ОТ-ПЦР). Анализ OT-ПЦР был положительным для нуклеотидных последовательностей BVDV 1-го типа для белков gp53 и р 80 и 5 нетранслируемого участка и отрицательным для последовательности р 125 BVDV 2-го типа. Эффективность вводимого вируса была установлена при GMT 103,2 TCID50/мл путем 2 повторных титрований, проведенных непосредственно до и после стимуляции. Стимулирующий инокулят впрыскивали интраназально в объеме дробной дозы 4 мл, по 2 мл в каждую ноздрю. Серологические анализы. Титры нейтрализующей сыворотки для BVDV 1-го и 2-го типа были определены путем анализа с постоянным вирусом и уменьшающимся количеством сыворотки в бычьей- 14011578 клеточной культуре. Серийные разведения сыворотки объединяли либо с 50-300 TCID50 цитопатическогоBVDV 1-го типа, штамма 5960, либо со сходным количеством цитопатического BVDV 2-го типа, штамма 125 с. Выделение вируса. Выделение BVDV после стимуляции (ПС) в бычьей клеточной культуре проводили из периферической коровьей крови, амниотической жидкости и эмбриональных тканей. BVDVпозитивную клеточную культуру определяли методом непрямой иммунофлуоресценции, используя антиBVDV-поликлональные козьи антитела. Также предпринимались попытки выделения BVDV из эмбриональных тканей с использованием ранее описанных иммуногистохимических методов. Haines DM, ClarkEG, и Dubovi EJ. Vet Pathol 1992; 29: 27-32. Кровь у коров отбирали из яремной вены аликвотами по 5-10 мл и помещали в гепаринсодержащие пробирки для получения лейкоцитов, используемых при выделении вируса. Амниотическую жидкость собирали под местной анестезией путем левосторонней лапаротомии и аспирацией 3-5 мл образца из уретры. После кесарева сечения или спонтанного выкидыша асептически извлекали из каждого плода глаза, 3 части мозга, селезенку и тимус. Супернатант гомогенизированных эмбриональных тканей использовали при выделении вируса в клеточной культуре. Для целей иммуногистохимической оценки эмбриональные ткани погружали в парафин и дважды тестировали, используя 1:800 и 1:600 асцитические разведения, содержащие анти-BVDV-моноклональные антитела. Биометрические данные анализа. В вакцинированных группах животных (Т 2 и Т 3) для демонстрации защиты после стимуляции, должно быть показано статистически значимое снижение степени материнской и эмбриональной инфицированности по сравнению с контрольной группой плацебо (T1). Для сравнения степени виремии у коров и нахождения BVDV в амниотической жидкости в эмбриональных тканях использовали точный тест Фишера и иммуногистохимию эмбриональных тканей. Титры нейтрализующей сыворотки анализировали с помощью смешанной линейной модели с повторяющимися измерениями. Значения наименьших квадратов из анализа расхождений использовали для расчета геометрического среднего титра, где исключены данные SN для коров, которых не стимулировали. Значение вероятности P0,05 использовали для определения статистической значимости. Исследование защиты эмбрионов. 59 экспериментальных животных рандомизированно определяли в одну из трех экспериментальных групп, во BM группу плацебо (T1), BM вакцинированную группу (Т 2) и ПК вакцинированную группу (Т 3) , как указано в табл. 6. Коров инокулировали либо вакциной, либо плацебо в экспериментальный день 0 и день 21. Во всех случаях в день 0 инокуляцию проводили в левую часть шеи, а в день 21 инокуляцию проводили в правую часть шеи. В день 32 все коровы получали в виде BM инъекции простагландина (Lutalyse, PharmaciaUpjohn,Kalamazoo, MI) для синхронизации течки. Коров с течкой искусственно осеменяли сертифицированнойBVDV-отрицательной спермой. В день 96, приблизительно, на 60 день беременности, путем ректальной пальпации установливали статус стельности коров. В день 103, 10 коров с подтвержденной стельностью рандомизированно выбирали из каждой экспериментальной группы и перемещали в ближайшее изолированное помещение (Midwest Veterinary Services, Oakland, NE) . В день 117 этих 30 коров стимулировали вирулентным BVDV путем интраназальной инокуляции. С целью выделения BVDV образцы крови собирали в день стимуляции и с 8 интервалами после стимуляции в дни 119, 121, 123, 125, 127, 131, 138 и 145. В день 145 (28 дней после стимуляции) проводили левостороннюю лапаротомию и у каждой коровы производили отбор амниотической жидкости. В день 295, приблизительно за 7-14 дней до ожидаемого отела, экспериментальных коров перевозили в помещения университета в Небраске в отделение ветеринарии и биомедицинского обслуживания для кесарева сечения. Непосредственно до хирургического вмешательства у каждой коровы отбирали образец крови для анализа SN. После кесарева сечения (в дни 298-300) у каждого плода отбирали образец крови. Эмбрионов затем умерщвляли и асептически собирали ткани для выделения BVDV. В некоторых случаях, когда происходили спонтанные выкидыши, образцы крови отбирали у самки при обнаружении выкидыша и две недели спустя. Парные образцы крови и выкидыши подвергали серологическому исследованию образцов крови (Ветеринарный Диагностический Центр Университета в Небраске, Линкольн, NE), выделению вируса из эмбриональных тканей (Центр Исследований Pfizer, Линкольн, NE) и гистопатологической оценке эмбриональных тканей (Saskatoon Veterinary Biodiagnostics,Saskatoon, SK, Canada). Результаты Индивидуальные значения SN для 30 коров, используемых в тесте защиты эмбрионов, были серонегативными в отношении BVDV 1-го и 2-го типа в день 0, что подтверждает то, что данные экспериментальные животные были иммунологически интактны в отношении стимуляции BVDV в начале изучения. Значения GMT (табл. 7 и 8) показывают, что внутримышечная вакцинация (группы Т 2) и подкожная(группы Т 3) выявила серологический ответ после введения двух доз. У всех коров группы Т 2 и Т 3 происходила сероконверсия (титр SN1:8) в отношении BVDV 1-го типа и BVDV 2-го типа после второй дозы вакцины. В период оплодотворения (день 34-37) титры SN BVDV 1-го типа варьировали от 1:27 до 1:2,900, а титры SN BVDV 2-го типа варьировали от 1:609 до 1:13,777. После вакцинации значения GMT- 15011578 подкожно обработанной группы было значительно выше по сравнению с внутримышечно обработанной группой в каждый из интервалов до стимуляции, но отличия не были статистически значимыми. Через двадцать восемь дней после стимуляции (день 145) значения GMT для BVDV 1-го типа (табл. 7) показали статистически значимое отличие в пользу подкожно вакцинированных животных (группа Т 3) по сравнению с внутримышечно вакцинированными животными (группа Т 2). Все коровы в группе плацебо (T1) оставались серонегативными в отношении 1-го и 2-го типаBVDV к моменту стимуляции (день 117), что свидетельствует о том, что исследование не было скомпрометировано случайными воздействиями. Все коровы плацебо серологически реагировали на стимуляцию, но их GMT реакции на BVDV 1-го и 2-го типа в день 145 были значительно ниже, чем реакции, известные из анамнеза, полученные в любой из вакцинированных групп (табл. 7 и 8). Между временем проведения амниоцентеза (день 145) и кесарева сечения (день 298-300) у 2 коров были выкидыши, у 1 из группы T1 и у другой из группы Т 3. Кроме того, во время кесарева сечения было установлено, что 4 оплодотворенных коровы (2 коровы из группы плацебо T1 и по 1 корове из групп Т 2 и Т 3) не были стельными. У этих 4 коров путем ректальной пальпации была подтверждена беременность в день 96, приблизительно через 60 дней после оплодотворения, что говорит о том, что произошел ненаблюдаемый выкидыш или резорбция плода. Ввиду того, что эмбриональные ткани от 4 коров с неудачными беременностями не были доступны для оценки, эти животные были исключены из исследования. Таким образом, в итоге исследования 24 из 30 коров, подвергшихся стимуляции, претерпели кесарево сечение, и в совокупности 26 плодов либо после кесарева сечения, либо после выкидышей было оценено на содержание BVDV (табл. 6). У коровы номер 1317 из группы плацебо T1 произошел выкидыш в день 238 (на сроке 201 день беременности и через 121 день после стимуляции). Гистопатологическая и бактериологическая оценка плода выявила пневмонию, некроз хорионического эпителия и Corynebacterium sp., выделенный из желудка и плаценты. Парные серологические образцы из коровы не подтвердили наличия IBR, BVD или лептоспироза как причину выкидыша. Позитивные результаты наличия BVDV были получены в клеточной культуре для периферической крови коровы, собранной в 6-й, 8-й и 10-й дни после стимуляции; для амниотической жидкости; мозга плода, глаза и тимуса, но не для селезенки. Эмбриональный мозг, глаз,тимус и селезенка были иммуногистохимически позитивными в отношении BVDV. Выделение вируса и серологические признаки в данном случае показывают, что в результате стимуляции у самки с виремией произошел выкидыш BVDV-инфицированного плода. У коровы номер 1331 из вакцинированной группы Т 3 произошел выкидыш в день 249 (на сроке 212 дней беременности и через 132 дня после стимуляции). Гистопатологическая и бактериологическая оценка плода выявила диффузную гнойную пневмонию. Культуры содержимого желудка и легкого были сильно заросшими колиформными бактериями. Парные серологические образцы, взятые у коровы после выкидыша, не подтвердили наличия IBR, BVD или лептоспироза как причину выкидыша. Попытки выделения BVDV в клеточной культуре были отрицательными для периферической крови коровы, собранной во все 9 интервалов после стимуляции, и для амниотической жидкости и мозга плода, глаза селезенки и тимуса. Иммуногистохимические результаты для эмбриональных тканей были отрицательными. Однако совокупность эмбриональных тканей была позитивной в отношении выделения BVDV в клеточной культуре. Спорные результаты дают основания предполагать, что возможность заражения эмбриональных тканей существует либо за счет контакта с кормом, заселенным стимулирующими вирусомBVDV, либо за счет фомитов в помещении для вскрытия трупов, где BVDV был выделен ранее. Отсутствие виремии у самки после стимуляции, позитивный статус сероконверсии и отрицательный результат выделения BVDV для определенных эмбриональных органов подтверждает вывод, что данный плод не был инфицирован BVDV в результате стимуляции. Образцы крови, собранные от каждого плода после кесарева сечения, были оценены в отношении титров SN для BVDV 1-го и 2-го типов. Ни один из 7 плодов после кесарева сечения из группы плацебо T1 не был серопозитивеным ни в отношении BVDV 1-го типа ни 2-го типа. Пять из 17 плодов после кесарева сечения из групп Т 2 и Т 3 вакцинированных животных были серопозитивными в отношении BVDV 1-го типа. Четыре плода имелиSN титры 1-го типа либо 1:2, либо 1:4, и плод коровы 1421 из группы Т 2 имел титр SN 1-го типа, составляющий 1:181, и 2-го типа, составляющий 1:512. Результаты выделения вируса после стимуляции представлены в таблице 9. Девять из 10 коров из группы плацебо T1 имели BVDV-виремию, что свидетельствует о том, что произошла жизнеспособная стимуляция. Образцы крови от 19 из 20 вакцинированных животных из групп Т 2 и Т 3 были отрицательными в отношении BVDV-виремии в каждом из 8 образцов после стимуляции. Вакцинированная корова 1421 из группы Т 2 была BVDV-позитивной в день 123, через 6 дней после стимуляции, и родила плод,который был серопозитивным, как отмечалось выше, но негативным в отношении выделения вируса. Пятипроцентный уровень виремии после стимуляции у вакцинированных животных групп T2 и Т 3 был значительно ниже по сравнению с 90-процентным уровнем у контрольных животных (P0,0001). Эмбриональные ткани 2 из 18 вакцинированных животных (11,1 процентов), коровы 1301 и 1335 группы Т 2 были позитивными в отношении выделения BVDV. По сравнению с выделением BVDV в 8 из- 16011578 8 (100%) тканей из коров в группе плацебо T1 наблюдалось статистически значимое отличие (P0,0001). Результаты выделения BVDV были либо позитивными, либо негативными для всех подвергнутых анализу эмбриональных тканей, с одним исключением, коровы 1317 из группы T1, у которой 3 из 4 образцов эмбриональной ткани были позитивными. Амниотическая жидкость у 2 из 20 (10%) вакцинированных животных была BVDV положительна по сравнению с 10 из 10 (100%) Т 1-коровами из группы плацебо, статистически значимое отличие(P0,0001). Образцы амниотической жидкости Т 2-вакцинированных животных 1301 и 1335 были положительны. Иммуногистохимические результаты были BVDV-положительными для эмбриональных тканей у 2 коров 1301 и 1335 из 18 (11,1 процентов) вакцинированных животных группы Т 2. Все эмбриональные ткани, оцененные для данных вакцинированных коров, были положительными. Это согласуется с результатами выделения BVDV для тех же двух коров, когда предпринималась попытка выделения вируса из амниотической жидкости и эмбриональных тканей с использованием методов клеточной культуры. Все эмбриональные ткани у 8 из 8 (100%) коров плацебо группы T1 были BVDV-положительными, это составило значительно большую долю (P0,0001) по сравнению с вакцинированными животными. Серологический статус до стимуляции трех вакцинированных коров с положительными результатами выделения BVDV показан в таблице 10. Коровы 1301 и 1335, родившие BVDV-положительных эмбрионов, и корова 1421, которая была виремична, все данные животные иммунологически отреагировали на вакцинацию. Шестнадцать из 18 плодов (88,9 процентов) от вакцинированных коров были невосприимчивы к стимуляции, которая приводила к 100-процентной эмбриональной инфекции у невакцинированных контролей. Интраназальная стимуляция не только напоминает естественный путь инфицирования, но дозировка намного больше той, которая может быть при естественном заражении. Сила стимуляции также превысила уровень, который в предыдущем исследовании, как было обнаружено, таким же образом приводит к экспериментальной виремии BVDV 1-го типа и эмбриональной инфекции. Ficken M, Jeevaraerathnam S, Wan Welch SK, et al.: BVDV fetal infections with selected isolates. In: Proceedings of the International Symposium on Bovine Viral Diarrhea Virus, a Fifty-Year Review. Ithaca, NY, 1996; 110-112. Нецитопатический стимулирующий штамм использовали ввиду того, что этот биотип связан с персистентной инфекцией и инфекцией иммунотолерантных плодов. Cortese VS: Bovine virus diarrhea virus and mucosaldisease. In: Current Veterinary Therapy 4, Food Animal Practice. Philadelphia, PA: WB Saunders, 1999; 286291. Серологические данные подтвердили вакцинную антигенность внутримышечного и подкожного путей введения. У всех вакцинированных коров происходила сероконверсия обоих типов BVDV и значительный, известный из анамнеза, ответ на стимуляцию (таблицы 7 и 8), приводящий к тому, что титрыGMT сохранились до конца исследования, 6 месяцев спустя. Три вакцинированные коровы, отнесенные к группе с положительным результатом выделения вируса, также проявляли сероконверсию после вакцинации (табл. 10). Полученные с помощью кесарева сечения телята от серопозитивных коров 1301 и 1335 были положительны в отношении выделения BVDV. Выделение вируса у серопозитивных коров или их плодов предполагает, что гуморальные антитела могут коррелировать с защитой, но это не единственный определяющий фактор. Могут быть также вовлечены клеточные или механизмы слизистой. Таблица 6. Экспериментальные группы и конечный статус стельности коров в исследовании со стимуляцией вирусом бычьей вирусной диареи (BVDV) 1-го типа ВМ=внутримышечная вакцинация; ПК=подкожная вакцинация. Выкидыши наблюдались у коровы из группы T1 в день 238 и у коровы из группы Т 3 в день 249.b Для всех коров с неудачными беременностями была подтверждена беременность в день 96, приблизительно через 60 дней после оплодотворения. а- 17011578 Таблица 7. Серологический ответ BVDV 1-го типа у коров со стимуляцией вирусом бычьей вирусной диареи (BVDV) 1-го типа Обратное значение титра SN8. Статистически значимое отличие по сравнению с группой плацебо (T1), P0,0003. с Статистически значимое отличие по сравнению с BM вакцинированной группой (Т 2), P=0,0446. Таблица 8. Серологический ответ BVDV 2-го типа у коров со стимуляцией вирусом бычьей вирусной диареи (BVDV) 1-го типа Обратное значение титра SN8. Статистически значимое отличие по сравнению с группой плацебо (T1), P0,02. с Статистически значимое отличие по сравнению с BM вакцинированной группой (Т 2), P=0,0415. Таблица 9. Суммарные результаты выделения вируса бычьей вирусной диареи (BVDV) у коров и плодов после стимуляции Выделение вируса было предпринято из лейкоцитов из образцов, собранных в 9 интервалах от дня стимуляции (день 117) до дня 145 (амниоцентез). Корова признавалась виремичной, если в любом образце крови присутствовал BVDV.b Эмбриональные ткани были собраны после выкидыша или кесарева сечения. Плод признавалсяBVDV-положительным, если любая из тканей была BVDV-позитивной. с Две коровы из группы T1 и одна корова из группы Т 3 были исключены из исследования, так как- 18011578 они не были стельными во время кесарева сечения и выкидыши не наблюдались.d Статистически значимое отличие по сравнению с группой плацебо (T1), P0,008. Таблица 10. Титры нейтрализующей сыворотки (SN) у коров до стимуляции в случаях, когда у вакцинированных коров или их плодов выделяли вирус бычьей вирусной диареи (BVDV)CV=коровья виремия; N/A=не применяли; GMT=геометрическое среднее титра. Пример 3. Две группы, состоящие из 16 особей, вакцинировали дважды подкожно с интервалом в 3 недели 2 мл комбинированных вакцин L. hardjo./L. Pomona, приготовленных из двух адъювантных композиций: 1) 2,5% Amphigen с Quil А/холестерин, каждого по 250 мкг/мл, и 2) Amphigen/AI-gel. Вакцины состояли из убитых лептоспир, из которых были удалены среды культивирования, таким образом, что уровень свободного эндотоксина был низким. Температуру тела, реакцию в месте введения и общие наблюдения за здоровьем записывали после обеих инъекций. Системных эффектов не наблюдалось, и местные реакции были минимальны и признаны клинически приемлемыми. Шестнадцати дополнительным особям вводили солевой раствор в качестве контроля. Через четыре недели после вакцинации скот стимулировали инстилляцией в глаз и вагинальной инстилляцией количеством 5106 лептоспир в течение 3 последующих дней. Половину каждой экспериментальной группы стимулировали серовариантом hardjo, а другую половину -серовариантом pomona. Два контроля pomona были удалены из исследования по не указанным причинам, было оставлено 6 животных в этой группе. Мочу собирали еженедельно и образцы почек собирали при вскрытии трупа, через 8 недель после стимуляции образцы оценивали в культуре с помощью ПЦР и флуоресцентной микроскопии с антителами (ФА). После стимуляции L. Hardjo жизнеспособные микроорганизмы определяли в моче и/или культурах почек у 100% (8/8) невакцинированных контролей, в то время как позитивных культур никогда не получали ни у одного из вакцинированных животных (0/16). После стимуляции L. Pomona 67% (4/6) невакцинированных контролей стали инфицированными на основе данных в культуре моча/почка, но ни одно из вакцинированных животных не было когда-либо позитивным при исследованиях в культуре почки или мочи (0/16). Ввиду того, что лептоспироз передается через зараженную мочу, способность предотвращать или снижать выделение мочи является полезным показателем эффективности вакцины. Обе вакцинные композиции снижали выделение лептоспир с мочой в статистически значимых количествах по сравнению с контролями. Данные демонстрируют существенную пользу от вакцинации бивалентными вакцинами L.hardjo/L. Pomona, содержащими какой-либо адъювант; это свидетельствует о защите скота от инфицирования лептоспирами при вакцинации убитыми формалином комбинированными бактериями. Пример 4. Материалы и методы. Животные. Пятьдесят шесть BVDV и Leptospira-серонегативных (то есть имеющих BVDV титры нейтрализующей сыворотки [SN] 1:2 и серовариантов Leptospira hardjo и pomona [МАТ]1:20) приблизительно 7-месячных телят получали из многих источников и содержали в изолированных помещениях для исследования в Небраске в течение изучения. Каждое животное идентифицировали по двойным биркам в ушах, по одной в каждом ухе. Новые бирки прикрепляли в случаях, когда животное теряло ушную бирку. До исследования, экспериментальных животных вакцинировали против клостридиальных заболеваний и агентов бычьего респираторного заболевания (исключая BVD). Экспериментальных животных содержали под наблюдением практикующего ветеринара, который ежедневно их клинически контролировал. Тест-вакцины. Экспериментальные тест-вакцины представляли собой жидкие вакцины, содержащие либо инактивированные формалином L. hardjo-bovis или L. pomona, или оба сероварианта, и инактивированные вирусы BVD 1-го и 2-го типа. Компоненты BVDV совмещали со стерильным адъювантом. Эффективность иммунизирующих антигенов BVDV устанавливали расчетом геометрического среднего титра для 8 повторных титрований основной массы жидкости, используемой для приготовления вакцины. Эффективность иммунизирующих антигенов Leptospira устанавливали в соответствии с методикой модели летальности хомяков. Адъюванты экспериментальных тест-вакцин объединяли либо с 2,5% Amphigen (об./об.) и Quil А/холестерин каждого по 100 мкг/мл, с или без 2% (об./об.) гидроксида аллюминия; 2,5% Amphigen (об./об.) с Quil А/бромид диметилдиоктадециламмония (DDA) каждого по 100 мкг/мл, с или без 2% (об./об.) гидроксида аллюминия. Экспериментальные тест-вакцины вводили в коли- 19011578 честве 5 мл подкожно. Моновалентный бактерин L. hardjo-bovis использовали в качестве положительного контроля по инструкциям производителя. Плацебо-вакцину, содержащую физиологический раствор,использовали в качестве отрицательного контроля. Стимулирующие бактерии. Leptospira borgpetersenii серовариант hardjo типа hardjo-bovis штамм 203(Национальный центр болезней животных, Ames, lowa), использовали в качестве стимулирующего агента. Стимулирующий материал L. hardjo-bovis получали первым пассажем организмов, которые были выделены из мочи скота экспериментально инфицированного L. hardjo-bovis. Стимулирующий материал вводили раз в день в течение трех последующих дней. В каждый день стимуляции общее количество,составляющее 2 мл стимулирующего материала, содержащего приблизительно 2,5106 организмов L.hardjo-bovis/мл, вводили крест-накрест в три анатомических участка. Путем стимуляции была инстилляция в конъюнктивальный мешок каждого глаза (1/2 мл в каждый) и во влагалище (1 мл). Серологические анализы. Титры нейтрализующей сыворотки для BVDV 1-го и 2-го типа определяли анализом с постоянным вирусом и уменьшающимся количеством сыворотки в бычьей клеточной культуре. Серийные разведения сыворотки объединяли либо с 50-300 TCID50 цитопатического BVDV 1 го типа штамма 5960, либо со сходным количеством цитопатического BVDV 2-го типа штамма 125 с. Сывороточные микроскопические титры агглютинации (MAT) для L. hardjo-bovis и L. pomona проводили с использованием стандартного теста в квалифицированном ветеринарном диагностическом центре (Cornell University College of Veterinary Medicine Diagnostic Laboratory). Выделение Leptospira. Образцы мочи и гомогенаты почечной ткани (взяты из левой и правой почек) анализировали на наличие Leptospira. Культуры мочи и почек анализировали на наличие Leptospira раз в неделю вплоть до 8 недель, используя стандартные методики. Методики с флуоресцентными антителами к Leptospira (ФА) осуществляли, используя стандартный тест в квалифицированном ветеринарном диагностическом центре (Cornell University College of Veterinary Medicine Diagnostic Laboratory). Анализ биометрических данных. Для демонстрации защиты после стимуляции, в вакцинированных группах должно быть показано статистически значимое снижение процента инфицирования Leptospira(таблица 11) (Т 02, Т 03, Т 04 и Т 05) по сравнению с контрольной группой плацебо (T1). Данные по контаминации почек и выделению мочи суммировали при обсчете и в момент времени. Сравнения обсчетов делали в зависимости от процента животных с обнаруженной Leptospira в почке. Сравнения обсчетов делали в зависимости от процента животных с обнаруженной Leptospira в моче. Для вышеуказанных анализов применяли точный метод Фишера. Продолжительность выхода Leptospira в моче сравнивали,используя основную линейную смешанную модель. Значение вероятности P0,05 использовалось для определения статистической значимости. Исследование защиты от Leptospir. 36 экспериментальных животных рандомизированно определяли в одну из шести экспериментальных групп, как указано в таблице 11. В день 0 и день 21 каждому животному, обозначенному Т 01-Т 05, вводили однократно по 5 мл ПК дозы соответствующей экспериментальной тест- или плацебо-вакцины. В день 0 и день 28 каждому животному, обозначенному Т 06, вводили подкожно однократно по 3 мл дозы позитивной контрольной вакцины. В дни 57-59 всех животных стимулировали L. hardjo-bovis штаммом 203, как указано выше. Для определения титров BVDV 1-го и 2-го типа образцы крови собирали у каждого животного в дни 0, 21, 35, 56, 84 и 111. Для выделения лептоспиры образцы мочи собирали у каждого животного в дни 1, 56, 70, 77, 84, 91,98 и 105, как описано выше. Животных умерщвляли в дни 112 и 113 и анализировали почки на присутствие лептоспир, как описано выше. Результаты Значения GMT (таблица 12) показывают, что все животные, получавшие комбинированные вакцины BVDV-Leptospira (Т 02, Т 03, T04 и Т 05), проявляют серологический ответ после введения двух вакцинных доз. У всех животных в группах Т 02, Т 03, Т 04 и Т 05 происходила сероконверсия (титр SN1:8) в отношении BVDV 1-го типа после второй дозы вакцины. У всех животных в группах Т 02, Т 04 и Т 05 происходила сероконверсия (титр SN1:8) в отношении BVDV 2-го типа после второй дозы вакцины. Все коровы в группе плацебо (T01) или в группе, получавшей вакцину L. Hardjo-bovis, оставались серонегативными в отношении 1-го и 2-го типа BVDV, свидетельствуя о том, что исследование не было скомпрометировано случайными воздействиями. В конечном итоге, данные серологии BVDV впервые показывают, что комбинированные вакцины, содержащие инактивированные BVDV 1-го и 2-го типа и инактивированные L. hardjo-bovis и L. Pomona с четырьмя различными адъювантами, могут индуцировать защитный ответ против BVDV заболевания у скота, при этом известно в данной области, что BVDV титр SN1:8 у коровы показывает защиту от заболевания с BVDV. Результаты содержания Leptospira в моче и почках (таблица 13) показывают, что все животные, получавшие комбинированные вакцины BVDV-Leptospira (T02, Т 03, Т 04 и Т 05), были негативными при вскрытии трупа в отношении культуры мочи (CX) (таблица 13, колонка 2) во все восемь моментов времени и в отношении культуры почек (таблица 13, колонка 8) (день 112 или 113) . Коровы, которые полу- 20011578 чали моновалентную вакцину Leptospira (T06, положительный контроль), были сходным образом защищены от инфекции Leptospira. B противоположность этому, коровы, получавшие плацебо-вакцину (T01,отрицательный контроль), были инфицированы культурой на основе мочи (таблица 13, колонка 2) и почки (таблица 13, колонка 8), показывая, что исследование вакцинной стимуляции было адекватным. В конечном итоге, данные по выделению L. hardjo-bovis и L. Pomona впервые показывают, что комбинированные вакцины, содержащие инактивированные BVDV 1-го и 2-го типа и инактивированные L. hardjobovis и L. Pomona с четырьмя различными адъювантами, могут индуцировать защитный ответ против заболевания Leptospira у скота. Таблица 11. Экспериментальные группы телят в исследовании комбинированной вакцины BVDV-Leptospira Таблица 12. Обратное значение геометрического среднего титра нейтрализующей сыворотки BVDV 1-го и 2-го типа и ряды (-) в день 35 Таблица 13. Результаты эффективности комбинированных вакцин BVDV-Leptospira против стимуляции L. hardjo-bovis Значения в колонке, не имеющие общего индекса, значительно отличались (Р 0,05). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Иммуногенная композиция, содержащая модифицированный живой бычий вирус герпеса (БВГ 1); модифицированный живой вирус парагриппа 3 типа (PI3); модифицированный живой бычий респираторный синцитиальный вирус (БРСВ); вирус бычьей вирусной диареи 1 типа (ВБВД-1); вирус бычьей- 21011578 вирусной диареи 2 типа (ВБВД-2) и ветеринарно-приемлемый носитель, где указанный носитель содержит сапонин, сапонинсодержащую эмульсию масло-в-воде и/или Quil A, Amphigen и холестерин. 2. Композиция по п.1, отличающаяся тем, что указанный носитель является микрофлюидизированным. 3. Композиция по п.1, отличающаяся тем, что указанный вирус бычьей вирусной диареи 1 типа(ВБВД-1) и вирус бычьей вирусной диареи 2 типа (ВБВД-2) являются цитопатическими. 4. Композиция по п.3, отличающаяся тем, что указанный вирус бычьей вирусной диареи 1 типа(ВБВД-1) является штаммом ВБВД 5960 (приобретенным в Национальном Центре болезней животных(NADC) Министерства сельского хозяйства США (USDA), Ames, Iowa). 5. Композиция по п.3, отличающаяся тем, что указанный вирус бычьей вирусной диареи 2 типа(ВБВД-2) является штаммом ВБВД 53637 (ATCC РТА-4859). 6. Композиция по любому из предшествующих пунктов, отличающаяся тем, что дополнительно содержит по меньшей мере один антиген, выбранный из группы, включающей Leptospira canicola, Leptospira grippotyphosa, Leptospira borgpetersenii hardio-prajitno, Leptospira icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis и Campylobacter fetus. 7. Применение иммунологически эффективного количества композиции по любому из пп.1-5 для получения вакцины для индуцирования иммунного ответа у животного против по меньшей мере одного из следующих вирусов:(a) бычьего вируса герпеса 1 типа;(b) вируса бычьей вирусной диареи 1 типа;(c) вируса бычьей вирусной диареи 2 типа;(e) бычьего респираторного синцитиального вируса (БРСВ). 8. Применение иммунологически эффективного количества композиции по п.6 для получения вакцины для индуцирования иммунного ответа у животного против по меньшей мере одного из следующих патогенов:(a) бычьего вируса герпеса 1 типа;(b) вируса бычьей вирусной диареи 1 типа;(c) вируса бычьей вирусной диареи 2 типа;(e) бычьего респираторного синцитиального вируса (БРСВ);icterohaemmorrhagia, Leptospira interrogans pomona, Leptospira borgpetersenii hardjo-bovis, Leptospira Bratislava, Neospora caninum, Trichomonus fetus, Mycoplasma bovis, Haemophilus somnus, Mannheimia haemolytica и Pasturella multocida. 9. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения или лечения инфекции плода у животного. 10. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения персистирующей инфекции плода у животного. 11. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения или лечения персистирующей инфекции ВБВД у животного. 12. Применение по любому из пп.9-11, где указанным животным является корова, теленок или бычок. 13. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для профилактики персистирующей инфекции или лечения персистентно инфицируемых телят. 14. Применение эффективного количества композиции по любому из пп.1-6 для получения лекарственного средства для предотвращения у животного выкидыша, вызванного вирусами, указанными в п.7.
МПК / Метки
МПК: A61K 39/02, A61K 39/265, A61K 39/155, A61K 39/12, A61K 39/295
Метки: защиты, респираторной, систем, иммуногенная, рогатого, крупного, применение, репродуктивной, композиция, инфекций, скота
Код ссылки
<a href="https://eas.patents.su/23-11578-immunogennaya-kompoziciya-dlya-zashhity-krupnogo-rogatogo-skota-ot-infekcijj-respiratornojj-i-reproduktivnojj-sistem-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуногенная композиция для защиты крупного рогатого скота от инфекций респираторной и репродуктивной систем и ее применение</a>
Предыдущий патент: Паровой риформинг
Следующий патент: Композиция с пролонгированным высвобождением венлафаксина
Случайный патент: Фунгицидные смеси на основе азолопиримидиниламинов