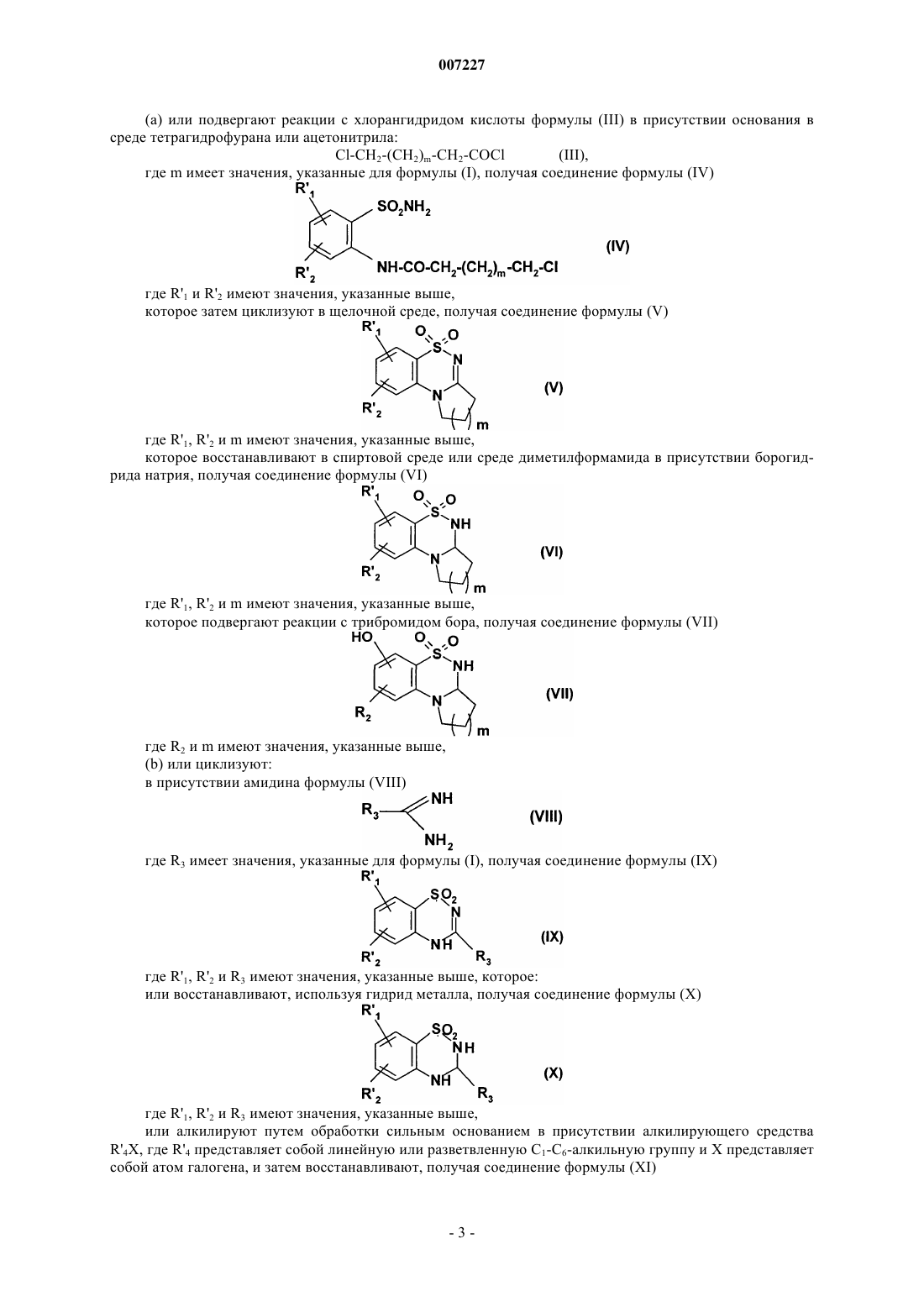
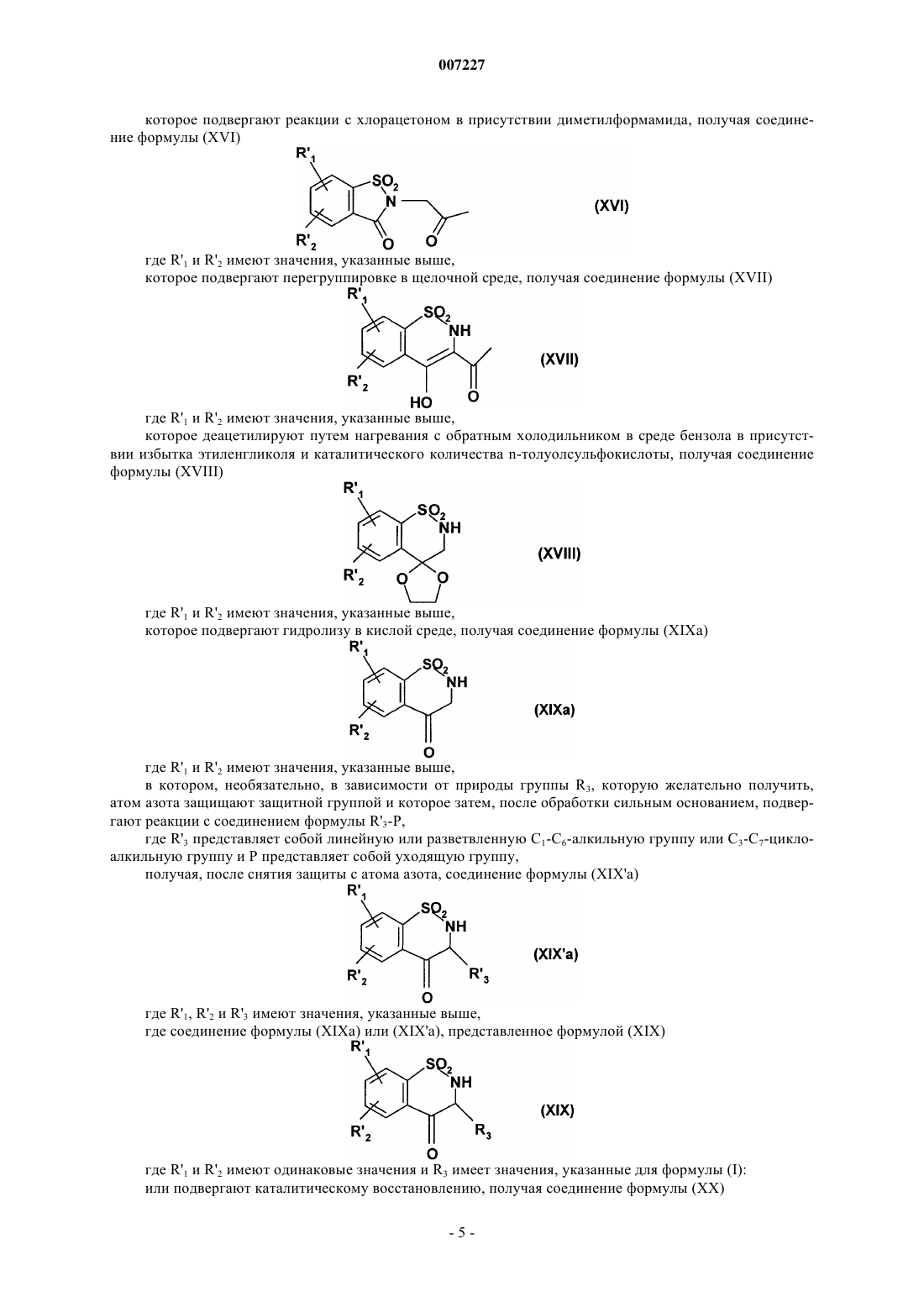
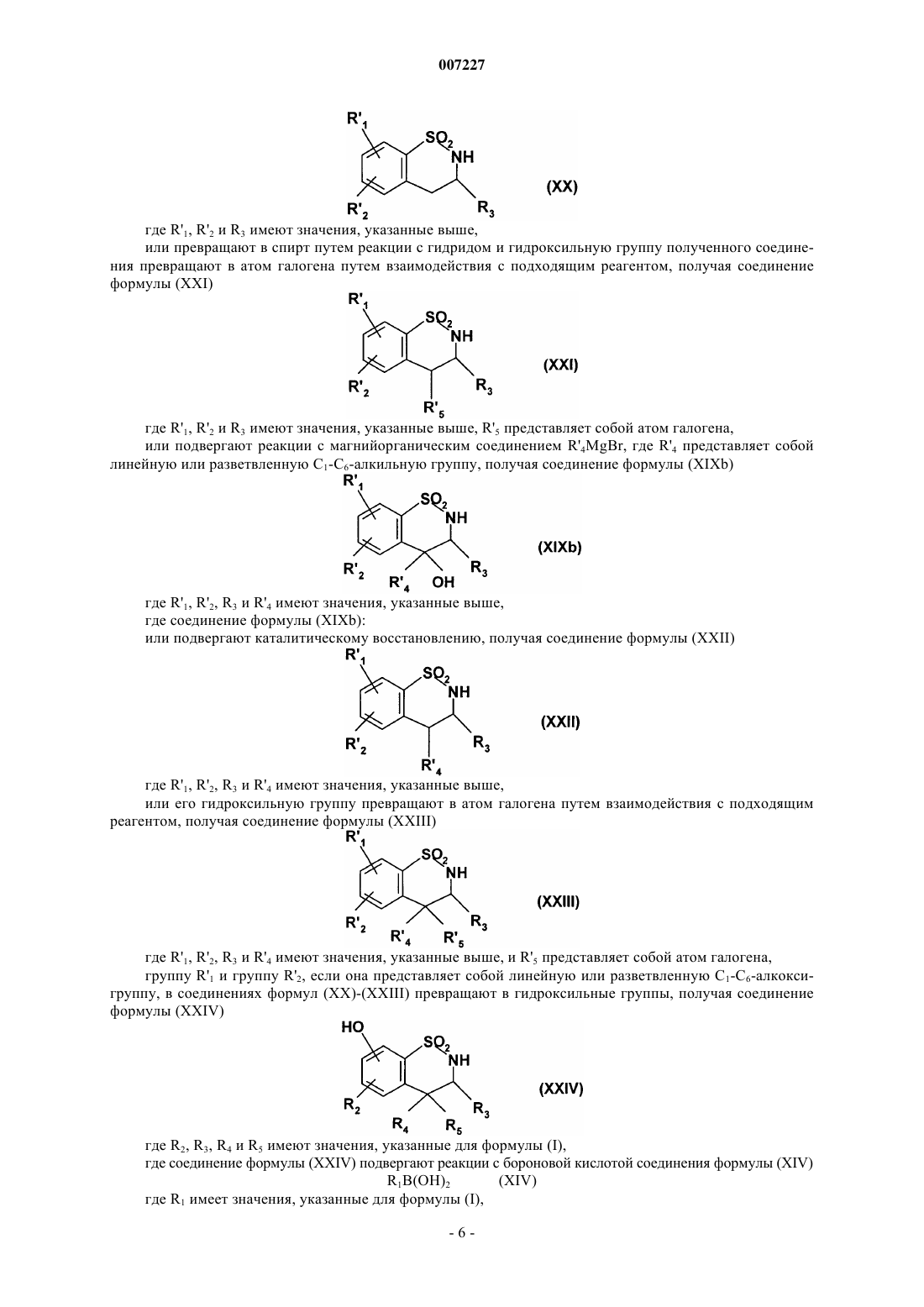
Соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Формула / Реферат
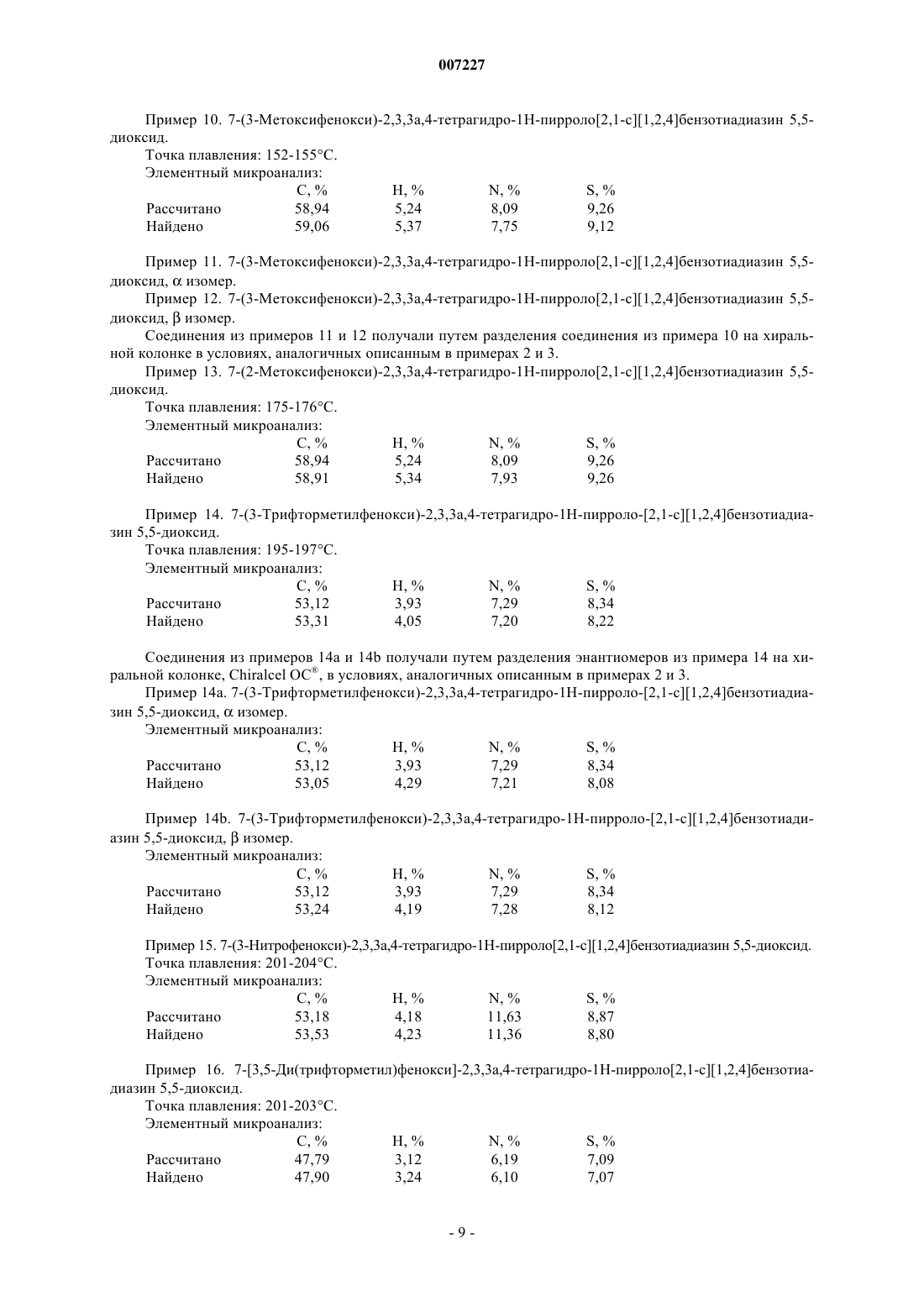
1. Соединения формулы (I)
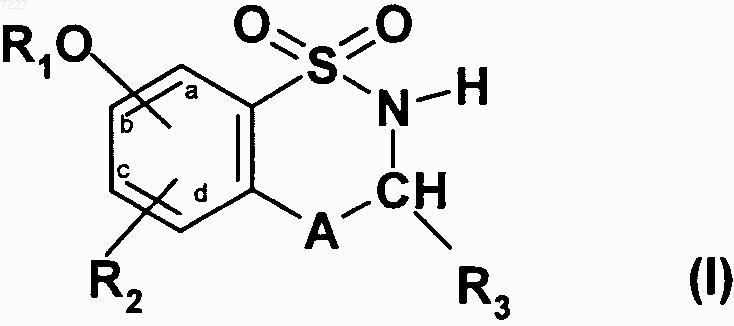
где R1 представляет собой арильную или гетероарильную группу,
R2 представляет собой атом водорода, атом галогена или гидроксильную группу,
А представляет собой CR4R5 группу или NR4 группу,
R3 представляет собой атом водорода, линейную или разветвленную С1-С6-алкильную группу или С3-С7-циклоалкильную группу,
R4 представляет собой атом водорода или линейную или разветвленную С1-С6-алкильную группу, или
А представляет собой атом азота и вместе со смежной группой -CHR3- образует кольцо 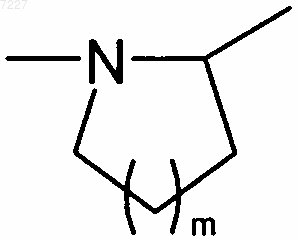 ,
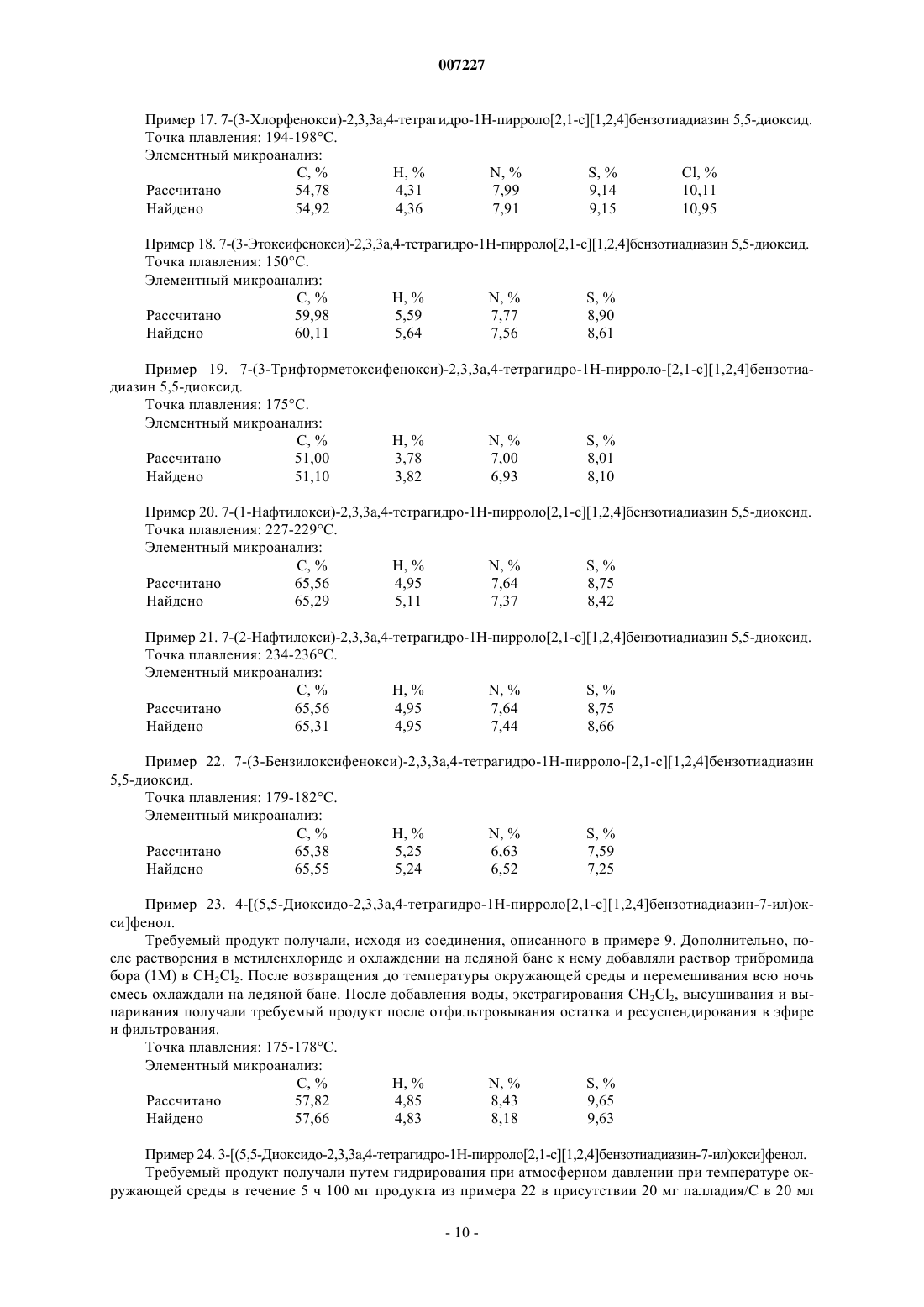
,
где m представляет собой 1, 2 или 3,
R5 представляет собой атом водорода или атом галогена,
их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием,
где подразумевается, что
"арильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, необязательно замещенную одной или более одинаковых или разных групп: галогеном, линейным или разветвленным С1-С6-алкилом (необязательно замещенным одной или более гидроксильными группами), линейным или разветвленным С1-С6-алкокси, линейным или разветвленным С1-С6-пергалоалкилом, линейным или разветвленным С1-С6-алкоксикарбонилом, линейным или разветвленным С1-С6-алкилтио, карбокси, линейным или разветвленным С1-С6-ацилом, линейным или разветвленным С1-С6-пергалоалкокси, гидрокси, циано, нитро, амино (необязательно замещенным одной или более линейной или разветвленной С1-С6-алкильной или линейной или разветвленной С1-С6-ацильной группами), аминокарбонилом (необязательно замещенным одной или более линейной или разветвленной С1-С6-алкильными группами), аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С1-С6-алкильными группами), моно- или ди-(С1-С6-алкилсульфонил)амино, моно- или ди-(трифторметилсульфонил)амино, PO(ORa)(ORb) (где Ra, Rb, которые могут быть одинаковыми или разными, представляют собой атом водорода или линейную или разветвленную С1-С6-алкильную группу), бензилокси, или фенилом (необязательно замещенным одной или более одинаковыми или разными группами: галогеном, линейным или разветвленным С1-С6-алкилом, линейным или разветвленным С1-С6-пергалоалкилом, гидрокси или линейным или разветвленным С1-С6-алкокси),
"гетероарильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, содержащую один, два или три одинаковых или разных гетероатома, выбранных из азота, кислорода и серы, необязательно замещенную одной или более одинаковыми или разными группами: галогеном, линейным или разветвленным С1-С6-алкилом, линейным или разветвленным С1-С6-алкокси, линейным или разветвленным С1-С6-пергалоалкилом, линейным или разветвленным С1-С6-алкоксикарбонилом, карбокси, линейным или разветвленным С1-С6-ацилом, линейным или разветвленным С1-С6-пергалоалкокси, гидрокси, циано, нитро, амино (необязательно замещенным одной или более линейной или разветвленной С1-С6-алкильными группами), аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С1-С6-алкильными группами) или С1-С6-алкилсульфониламино.
2. Соединения формулы (I) в соответствии с п.1, где R2 представляет собой атом водорода.
3. Соединения формулы (I) в соответствии с п.1 или 2, где группа OR1 находится в положении b фенила.
4. Соединения формулы (I) в соответствии с любым из пп.1, 2 и 3, где R1 представляет собой необязательно замещенную фенильную группу.
5. Соединения формулы (I) в соответствии с любым из пп.1-4, где А представляет собой атом азота и вместе со смежной группой -CHR3- образует кольцо 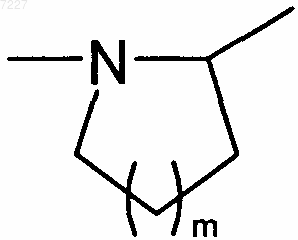 , где m представляет собой 1, 2 или 3, предпочтительно 1.
, где m представляет собой 1, 2 или 3, предпочтительно 1.
6. Соединение формулы (I) в соответствии с п.1, которое представляет собой 7-(3-метилфенокси)-2,3,3а,4-тетрагидро-1Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид, а также его изомеры.
7. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[(5,5-диоксидо-2,3,3а,4-тетрагидро-1Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензойную кислоту, а также ее изомеры.
8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5,5-диоксидо-2,3,3а,4-тетрагидро-1Н-пирроло[2,1-с][1,2,4]бензотиазин-7-ил)окси]анилин, а также его изомеры.
9. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-[3-(5,5-диоксидо-2,3,3а,4-тетрагидро-1H-пирридо[2,1-с][1,2,4]бензотиазин-7-ил)окси]фенил]метансульфонамид, а также его изомеры.
10. Соединение формулы (I) в соответствии с п.1, которое представляет собой этилгидро 3-[(5,5-диоксидо-2,3,3а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилфосфонат, а также его изомеры.
11. Способ получения соединений формулы (I) по п.1, характеризующийся тем, что в качестве исходного вещества применяют соединение формулы (II)'
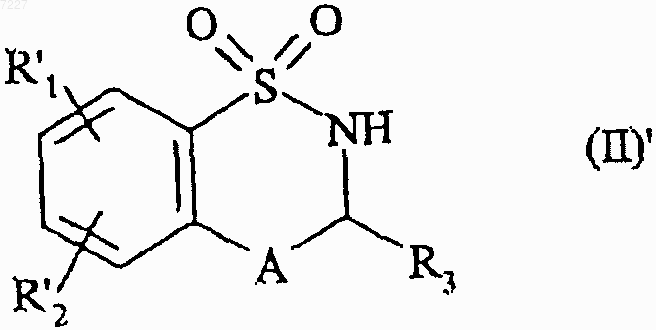
где А и R3 имеют значения, указанные в п.1,
R'1 представляет собой линейную или разветвленную (С1-С6)алкоксигруппу,
R'2 представляет собой атом водорода, атом галогена или линейную или разветвленную (С1-С6)алкоксигруппу,
которое подвергают взаимодействию с трибромидом бора, получая соединение формулы (III)'
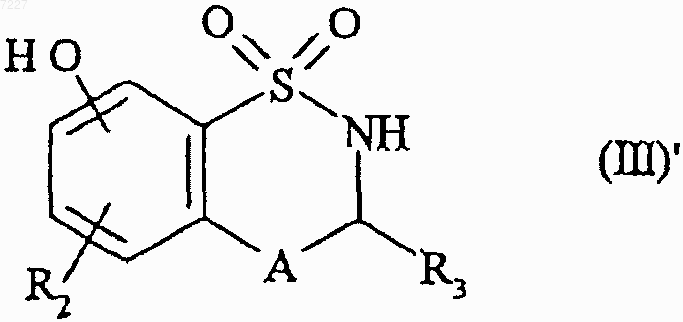
где A, R2 и R3 имеют значения, указанные в п.1,
которое, в свою очередь, подвергают взаимодействию с бороновой кислотой соединения формулы (IV)'
R1В(ОН)2 (IV),'
где R1 имеет значения, указанные для формулы (I),
с получением соединения формулы (I)
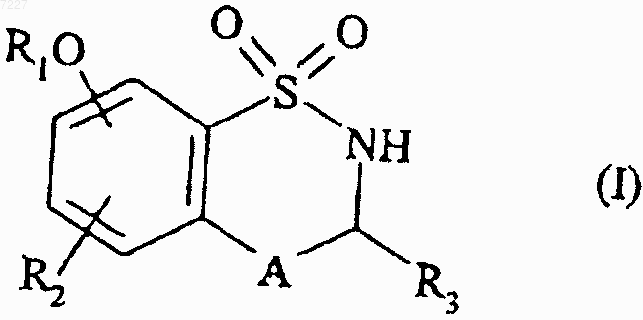
которое при необходимости очищают в соответствии с обычными способами очистки, разделяют при необходимости на изомеры в соответствии с обычными способами разделения и превращают при необходимости в их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Фармацевтические композиции, которые содержат в качестве активного компонента соединение в соответствии с любым из пп.1-10 в сочетании с одним или более фармацевтически приемлемыми инертными, нетоксичными наполнителями или носителями.
13. Фармацевтические композиции в соответствии с п.12, которые содержат в качестве активного компонента соединение в соответствии с любым из пп.1-10 для применения в качестве лекарственных средств, таких как АМРА модуляторы.
Текст
007227 Настоящее изобретение относится к новым соединениям бензотиазина и бензотиадиазина, к способу их получения и к фармацевтическим композициям, которые их содержат. В настоящее время известно, что инициирующие аминокислоты, особенно глутамат, играют очень важную роль в физиологических процессах приспосабливаемости нейронов к воздействиям внешней среды и в механизмах, лежащих в основе обучения и памяти. Патофизиологические исследования свидетельствуют о том, что нарушение в глутаматэргической нейротрансмиссии тесно связано с развитием болезни Альцгеймера (Neuroscience and Biobehavioral reviews, 1992, 16, 13-24; Progress in Neurobiology,1992, 39, 517-545). Кроме того, во многих исследованиях в последние годы показано, что существуют подтипы рецепторов инициирующих аминокислот и их функциональное взаимодействие (Molecular Neuropharmacology,1992, 2, 15-31). Среди этих рецепторов рецептор АМРА (-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота) в наибольшей степени вовлечен в процессы физиологической возбудимости нейронов, и в особенности в те процессы, которые связаны с запоминанием. Например, было показано, что обучаемость связана с увеличением связывания АМРА с его рецептором в гиппокампе, одном из участков головного мозга, который отвечает за процессы памяти и распознавания. Также в последнее время описаны ноотропные средства, такие как анирацетам, в качестве положительных модуляторов рецепторов АМРА нейронов (Journal of Neurochemistry, 1992, 58, 1199-1204). В литературе описаны соединения, имеющие бензамидную структуру, в качестве средств, имеющих такой же механизм действия и улучшающих память (Synapse, 1993, 15, 326-329). Из этих новых фармакологических средств наиболее активным является, в частности, соединение ВА 74. Дополнительно, в патентной заявке ЕР 692 484 описано соединение бензотиадиазина, которое способствует току, вызываемому АМРА, и в международной патентной заявке WO 99/42456 также описаны частные соединения бензотиадиазина в качестве модуляторов рецепторов АМРА. Соединения бензотиазина и бензотиадиазина, раскрытые в настоящем изобретении, кроме того, что являются новыми, неожиданно обнаруживают фармакологическое действие на ток, вызываемый АМРА,которое существенно выше по сравнению с соединениями, обладающими подобной структурой, описанными в уровне техники. Они являются пригодными в качестве модуляторов АМРА для лечения или предотвращения нарушений памяти и распознавания, которые связаны с возрастом, с синдромами тревоги или депрессии, с прогрессирующими нейродегенеративными заболеваниями, с болезнью Альцгеймера, с болезнью Пика (предстарческая органическая атрофия мозга), с хореей Хантингтона, с шизофренией, с последствиями острых нейродегенеративных заболеваний, с последствиями ишемии и с последствиями эпилепсии. В частности, настоящее изобретение относится к соединениям формулы (I) где R1 представляет собой арильную или гетероарильную группу,R2 представляет собой атом водорода, атом галогена или гидроксильную группу,А представляет собой CR4R5 группу или NR4 группу,R3 представляет собой атом водорода, линейную или разветвленную С 1-С 6-алкильную группу или С 3-С 7-циклоалкильную группу,R4 представляет собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу, или А представляет собой атом азота и, вместе со смежной группой -CHR3- образует кольцо,где m представляет собой 1, 2 или 3,R5 представляет собой атом водорода или атом галогена,к их изомерам и их аддитивным солям с фармацевтически приемлемой кислотой или основанием,где подразумевается, что"арильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, необязательно замещенную одной или более одинаковых или разных групп: галогеном, линейным или разветвленным С 1-С 6-алкилом (необязательно замещенным одной или более гидроксильных групп), линейным или разветвленным С 1-С 6 алкокси, линейным или разветвленным С 1-С 6-пергалоалкилом, линейным или разветвленным С 1-С 6-алкоксикарбонилом, линейным или разветвленным С 1-С 6-алкилтио, карбокси, линейным или разветвленным С 1-С 6-ацилом, линейным или разветвленным С 1-С 6-пергалоалкокси, гидрокси, циано, нитро, амино(необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильной или линейной или разветвленной С 1-С 6-ацильной группами), аминокарбонилом (необязательно замещенным одной-1 007227 или более линейной или разветвленной С 1-С 6-алкильными группами), аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами), моно- или ди-(С 1-С 6-алкилсульфонил)амино, моно- или ди-(трифторметилсульфонил)амино, PO(ORa)(ORb) (где Ra,Rb, которые могут быть одинаковыми или разными, представляют собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу), бензилокси, или фенилом (необязательно замещенным одной или более одинаковых или разных групп: галогеном, линейным или разветвленным С 1-С 6-алкилом, линейным или разветвленным С 1-С 6-пергалоалкилом, гидрокси или линейным или разветвленным С 1-С 6-алкокси),"гетероарильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, содержащую один, два или три одинаковых или разных гетероатома, выбранных из азота, кислорода и серы, необязательно замещенную одной или более одинаковых или разных групп: галогеном, линейным или разветвленным С 1-С 6 алкилом, линейным или разветвленным С 1-С 6-алкокси, линейным или разветвленным С 1-С 6-пергалоалкилом, линейным или разветвленным С 1-С 6-алкоксикарбонилом, карбокси, линейным или разветвленным С 1-С 6-ацилом, линейным или разветвленным С 1-С 6-пергалоалкокси, гидрокси, циано, нитро, амино(необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами),аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами), или С 1-С 6-алкилсульфониламино. Среди фармацевтически приемлемых кислот можно отметить, но не ограничиваясь только ими, соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфокислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно отметить, но не ограничиваясь только ими,гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Группа R1 О- предпочтительно находится в положении b фенила. Предпочтительно R1 представляет собой арильную группу, в частности необязательно замещенный фенил. Если арильная группа представляет собой замещенную фенильную группу, заместитель предпочтительно находится в мета-положении. Предпочтительно группа R2 представляет собой атом водорода. Предпочтительными соединениями по изобретению являются соединения, в которых А представля ет собой атом азота и вместе со смежной группой -CHR3- образует кольцо, где m представляет собой 1, 2 или 3, и предпочтительно 1. Предпочтительными соединениями по изобретению являются: 7-(3-метилфенокси)-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид,3-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензойная кислота,3-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиазин-7-ил)окси]анилин,N-[3-(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирридо[2,1-с][1,2,4]бензотиазин-7-ил)окси]фенил]метансульфонамид,этилгидро 3-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси] фенилфосфонат,и их изомеры. Изобретение также относится к способу получения соединений формулы (I). Способ получения соединений формулы (I), в которой А представляет собой NR4 группу или А представляет собой атом азота и вместе со смежной группой -CHR3- образует кольцо, где m представляет собой 1, 2 или 3, характеризуется тем, что в качестве исходного вещества применяют соединение формулы (II) где R'1 представляет собой линейную или разветвленную С 1-С 6-алкоксигруппу,R'2 представляет собой атом водорода, атом галогена или линейную или разветвленную С 1-С 6-алкоксигруппу,которое:(а) или подвергают реакции с хлорангидридом кислоты формулы (III) в присутствии основания в среде тетрагидрофурана или ацетонитрила: Сl-СН 2-(СН 2)m-СН 2-СОСl(III),где m имеет значения, указанные для формулы (I), получая соединение формулы (IV) где R'1 и R'2 имеют значения, указанные выше,которое затем циклизуют в щелочной среде, получая соединение формулы (V) где R'1, R'2 и m имеют значения, указанные выше,которое восстанавливают в спиртовой среде или среде диметилформамида в присутствии борогидрида натрия, получая соединение формулы (VI) где R'1, R'2 и m имеют значения, указанные выше,которое подвергают реакции с трибромидом бора, получая соединение формулы (VII) где R2 и m имеют значения, указанные выше,(b) или циклизуют: в присутствии амидина формулы (VIII) где R3 имеет значения, указанные для формулы (I), получая соединение формулы (IX) где R'1, R'2 и R3 имеют значения, указанные выше, которое: или восстанавливают, используя гидрид металла, получая соединение формулы (X) где R'1, R'2 и R3 имеют значения, указанные выше,или алкилируют путем обработки сильным основанием в присутствии алкилирующего средстваR'4X, где R'4 представляет собой линейную или разветвленную С 1-С 6-алкильную группу и Х представляет собой атом галогена, и затем восстанавливают, получая соединение формулы (XI) где R'1, R'2, R3 и R'4 имеют значения, указанные выше, или в присутствии альдегида формулы (XII) где R3 имеет значения, указанные для формулы (I),получая соединение формулы (X), описанное выше,группу R'1 и группу R'2, если она представляет собой линейную или разветвленную С 1-С 6-алкоксигруппу, в соединении формулы (X) или (XI) превращают в гидроксильные группы, получая соединение формулы (XIII) где R2, R3 и R4 имеют значения, указанные для формулы (I),где соединение формулы (VII) или (XIII) подвергают реакции с бороновой кислотой соединения формулы (XIV)(XIV) где R1 имеет значения, указанные для формулы (I),получая соединение формулы (I/a1) или (I/a2), частный случай соединений формулы (I): где R1, R2, R3 и R4 имеют значения, указанные для формулы (I), где R1, R2 и m имеют значения, указанные для формулы (I),где соединения формулы (I/a1) или (I/a2): подвергают, при необходимости, обычным превращениям для заместителей группы R1,при необходимости, очищают в соответствии с обычными способами очистки, необязательно разделяют на изомеры в соответствии с обычными способами разделения и превращают, если это является желательным, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Способ получения соединений формулы (I), в которой А представляет собой CR4R5 группу, характеризуется тем, что в качестве исходного вещества применяют соединение формулы (XV) где R'1 представляет собой линейную или разветвленную С 1-С 6-алкоксигруппу,R'2 представляет собой атом водорода, атом галогена или линейную или разветвленную С 1-С 6-алкоксигруппу,-4 007227 которое подвергают реакции с хлорацетоном в присутствии диметилформамида, получая соединение формулы (XVI) где R'1 и R'2 имеют значения, указанные выше,которое подвергают перегруппировке в щелочной среде, получая соединение формулы (XVII) где R'1 и R'2 имеют значения, указанные выше,которое деацетилируют путем нагревания с обратным холодильником в среде бензола в присутствии избытка этиленгликоля и каталитического количества n-толуолсульфокислоты, получая соединение формулы (XVIII) где R'1 и R'2 имеют значения, указанные выше,которое подвергают гидролизу в кислой среде, получая соединение формулы (XIXa) где R'1 и R'2 имеют значения, указанные выше,в котором, необязательно, в зависимости от природы группы R3, которую желательно получить,атом азота защищают защитной группой и которое затем, после обработки сильным основанием, подвергают реакции с соединением формулы R'3-Р,где R'3 представляет собой линейную или разветвленную С 1-С 6-алкильную группу или С 3-С 7-циклоалкильную группу и Р представляет собой уходящую группу,получая, после снятия защиты с атома азота, соединение формулы (XIX'a) где R'1 и R'2 имеют одинаковые значения и R3 имеет значения, указанные для формулы (I): или подвергают каталитическому восстановлению, получая соединение формулы (XX) где R'1, R'2 и R3 имеют значения, указанные выше,или превращают в спирт путем реакции с гидридом и гидроксильную группу полученного соединения превращают в атом галогена путем взаимодействия с подходящим реагентом, получая соединение формулы (XXI) где R'1, R'2 и R3 имеют значения, указанные выше, R'5 представляет собой атом галогена,или подвергают реакции с магнийорганическим соединением R'4MgBr, где R'4 представляет собой линейную или разветвленную С 1-С 6-алкильную группу, получая соединение формулы (XIXb) где R'1, R'2, R3 и R'4 имеют значения, указанные выше,где соединение формулы (XIXb): или подвергают каталитическому восстановлению, получая соединение формулы (XXII) где R'1, R'2, R3 и R'4 имеют значения, указанные выше,или его гидроксильную группу превращают в атом галогена путем взаимодействия с подходящим реагентом, получая соединение формулы (XXIII) где R'1, R'2, R3 и R'4 имеют значения, указанные выше, и R'5 представляет собой атом галогена,группу R'1 и группу R'2, если она представляет собой линейную или разветвленную С 1-С 6-алкоксигруппу, в соединениях формул (XX)-(XXIII) превращают в гидроксильные группы, получая соединение формулы (XXIV) где R2, R3, R4 и R5 имеют значения, указанные для формулы (I),где соединение формулы (XXIV) подвергают реакции с бороновой кислотой соединения формулы (XIV)(XIV) где R1 имеет значения, указанные для формулы (I),-6 007227 получая соединение формулы (I/b), частный случай соединений формулы (I): где R1, R2, R3, R4, R5 имеют значения, указанные для формулы (I),где соединение формулы (I/b) подвергают, при необходимости, обычным превращениям для заместителей группы R1,очищают, при необходимости, в соответствии с обычными способами очистки, необязательно разделяют на изомеры в соответствии с обычными способами разделения и превращают, если это является желательным, в аддитивные соли с фармацевтически приемлемой кислотой или основанием. Изобретение также относится к фармацевтическим композициям, которые содержат в качестве активного компонента соединение формулы (I) с одним или более подходящими, инертными, нетоксичными наполнителями. Среди фармацевтических композиций согласно изобретению особенно можно отметить те, которые являются пригодными для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, лепешки, суппозитории, кремы, мази, кожные гели, составы для инъекций, суспензии для питья и т.д. Полезная дозировка может адаптироваться в зависимости от природы и тяжести расстройства, пути введения и возраста и веса пациента. Дозировка находится в пределах от 1 до 500 мг в сутки на одно или больше введений. Примеры, представленные далее, приведены только с целью иллюстрации и никоим образом не ограничивают изобретение. Используемые исходные вещества являются известными продуктами или их получают в соответствии с известными способами. Структуры соединений, описанных в примерах, были определены в соответствии с обычными спектрофотометрическими способами (инфракрасная спектрометрия, ядерный магнитный резонанс, массспектрометрия и т.п.). Пример 1. 7-Фенокси-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид. Стадия А. N-[2-(Аминосульфонил)-4-метоксифенил]-4-хлорбутанамид. 144 ммоль триэтиламина и затем, по каплям, раствор, содержащий 135 ммоль хлорида 4-хлорбутановой кислоты в 30 мл тетрагидрофурана (ТГФ), добавляли к раствору, содержащему 96,4 ммоль 2-амино-5 метоксибензолсульфонамида в 200 мл ТГФ. После перемешивания в течение ночи при температуре окружающей среды ТГФ выпаривали и остаток ресуспендировали в воде. После экстрагирования этилацетатом органическую фазу промывали и высушивали. После выпаривания получали ожидаемый продукт в виде масла. Стадия В. 5,5-Диоксо-7-метокси-2,3-дигидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин. Продукт, полученный на вышеописанной стадии, перемешивали всю ночь при температуре окружающей среды в 320 мл водного 1 н. раствора гидроксида натрия. После добавления 50 мл этилацетата и интенсивного перемешивания требуемый продукт, который выпадал в осадок, отфильтровывали, промывали и высушивали. Стадия С. 5,5-Диоксидо-7-метокси-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин. 106,5 ммоль борогидрида натрия добавляли к суспензии, содержащей 35,5 ммоль продукта, полученного на вышеописанной стадии, в 40 мл диметилформамида (ДМФА). После перемешивания в течение ночи при температуре окружающей среды реакционную смесь охлаждали и затем к вышеописанной смеси добавляли 150 мл ледяного раствора 1 н. соляной кислоты. Требуемый продукт осаждали и отфильтровывали. Точка плавления: 193-198 С. Стадия D. 5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ол. 79,3 ммоль трибромида бора по каплям добавляли к суспензии, содержащей 26,7 ммоль продукта,полученного на вышеописанной стадии, в 350 мл дихлорметана, выдерживая при -60 С в атмосфере азота. Температуру поддерживали в течение 1 ч и затем температуру доводили до температуры окружающей среды и перемешивали всю ночь. После охлаждения реакционной смеси на ледяной бане добавляли 100 мл воды и образованную двухфазную систему интенсивно перемешивали. Образованную таким образом суспензию фильтровали. Полученное белое твердое вещество промывали водой, эфиром и высушивали, получая требуемый продукт. Точка плавления: 237-242 С. Стадия Е. 7-Фенокси-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бeнзотиадиазин 5,5-диоксид. Суспензию, содержащую 0,832 ммоль соединения, полученного на вышеописанной стадии, 1,66 ммоль фенилбороновой кислоты, 1,25 ммоль ацетата меди, 2,5 ммоль пиридина и 100 мг молекулярного сита перемешивали в течениe 5 ч в 20 мл метиленхлорида (СH2 Сl2). После добавления 20 мл СH2 Сl2 суспен-7 007227 зию фильтровали. После выпаривания фильтрата остаток очищали на силикагелевой колонке, используя в качестве элюента смесь метиленхлорида/этилацетата (95/5), и получалитребуемый продукт. Точка плавления: 259-243 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 60,74 5,10 8,85 10,13 Найдено 60,67 5,06 8,65 10,22 Пример 2. 7-Фенокси-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид,изомер. Пример 3. 7-Фенокси-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид,изомер. Соединения примеров 2 и 3 получали путем разделения изомеров из примера 1 на хиральной колонке, Chiralcel ОС, используя в качестве элюирующего растворителя смесь 1000/0,5 изопропанола/диэтиламина. После разделения каждый энантиомер очищали путем хроматографирования на силикагелевой колонке, используя в качестве элюента смесь дихлорметана/этилацетата (20/10). Пример 4. 8-Фенокси-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид. Соединение из следующего примера получали в соответствии с методикой, описанной в примере 1,используя подходящее исходное вещество. Точка плавления: 184-187 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 60,74 5,10 8,85 10,14 Найдено 60,24 5,04 8,69 10,09 Соединения из следующих примеров получали в соответствии с методикой, описанной в примере 1,используя подходящие бороновые кислоты на стадии Е. Пример 5. 4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензнитрил. Точка плавления: 242-245 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 58,94 5,24 8,09 9,26 Найдено 59,06 5,37 7,75 9,12 Пример 11. 7-(3-Метоксифенокси)-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5 диоксид,изомер. Пример 12. 7-(3-Метоксифенокси)-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5 диоксид,изомер. Соединения из примеров 11 и 12 получали путем разделения соединения из примера 10 на хиральной колонке в условиях, аналогичных описанным в примерах 2 и 3. Пример 13. 7-(2-Метоксифенокси)-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5 диоксид. Точка плавления: 175-176 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 53,12 3,93 7,29 8,34 Найдено 53,31 4,05 7,20 8,22 Соединения из примеров 14 а и 14b получали путем разделения энантиомеров из примера 14 на хиральной колонке, Chiralcel ОС, в условиях, аналогичных описанным в примерах 2 и 3. Пример 14 а. 7-(3-Трифторметилфенокси)-2,3,3 а,4-тетрагидро-1H-пирроло-[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид,изомер. Элементный микроанализ: С, % Н, %S, % Рассчитано 65,38 5,25 6,63 7,59 Найдено 65,55 5,24 6,52 7,25 Пример 23. 4-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенол. Требуемый продукт получали, исходя из соединения, описанного в примере 9. Дополнительно, после растворения в метиленхлориде и охлаждении на ледяной бане к нему добавляли раствор трибромида бора (1 М) в СН 2 Сl2. После возвращения до температуры окружающей среды и перемешивания всю ночь смесь охлаждали на ледяной бане. После добавления воды, экстрагирования СН 2 Сl2, высушивания и выпаривания получали требуемый продукт после отфильтровывания остатка и ресуспендирования в эфире и фильтрования. Точка плавления: 175-178 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,82 4,85 8,43 9,65 Найдено 57,66 4,83 8,18 9,63 Пример 24. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенол. Требуемый продукт получали путем гидрирования при атмосферном давлении при температуре окружающей среды в течение 5 ч 100 мг продукта из примера 22 в присутствии 20 мг палладия/С в 20 мл- 10007227 этанола и 10 мкл концентрированной соляной кислоты. После фильтрации и выпаривания остаток ресуспендировали в эфире и получали требуемый продукт после фильтрации. Точка плавления: 205-208 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,74 4,85 7,48 8,56 Найдено 57,49 5,02 7,31 8,37 Пример 27. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензойная кислота. 300 мг продукта из примера 26 суспендировали в 5 мл 1 н. NaOH. После перемешивания в колбе с обратным холодильником в течение 1 ч и подкисления 1 н. соляной кислоты получали требуемый продукт после фильтрации. Точка плавления: 271-274 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 56,66 4,47 7,77 8,90 Найдено 56,58 4,68 7,70 8,84 Пример 28. 4-Метил-7-фенокси-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Стадия А. 7-Метокси-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. Перемешивали одну ночь при 80 С суспензию 3,0 г 2-амино-5-метоксибензолсульфонамида в присутствии 1,31 г гидрохлорида формамидина и 2,27 мл триэтиламина в 50 мл толуола. Толуол выпаривали в вакууме. Остаток ресуспендировали в воде и осадок отфильтровывали. Точка плавления: 253-257 С. Стадия В. 7-Метокси-4-метил-4 Н-1,2,4-бензотиадиазин 1,1-диоксид. 2,88 г продукта, полученного на вышеописанной стадии, добавляли порциями к суспензии 9 мл ДМФА, содержащей 570 мг 60% NaH в минеральном масле. Смесь перемешивали в течение 30 мин до получения черного раствора. Затем к нему по каплям добавляли 929 мкл йодометана. Продолжали перемешивать в течение 1 ч и реакционную смесь осаждали путем добавления воды. Осадок отфильтровывали и промывали водой и затем эфиром, получая требуемый продукт. Точка плавления: 205-209 С. Стадия С. 7-Метокси-4-метил-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. 1,19 г борогидрида натрия добавляли к суспензии 2,37 г продукта, полученного на вышеописанной стадии, в 40 мл этанола. Смесь постепенно становилась гомогенной. После взаимодействия в течение 1 ч при температуре окружающей среды смесь охлаждали на ледяной бане и нейтрализовали путем добавления 1 н. НСl. Белый осадок перемешивали в течение 15 мин и указанный в заглавии продукт отфильтровывали. Точка плавления: 126-128 С. Стадия D. 4-Метил-3,4-дигидро-2 Н-1,2,4-бензотиадиазин-7-ол 1,1-диоксид. 79,3 ммоль трибромида бора по каплям добавляли к суспензии, содержащей 2 г продукта, полученного на вышеописанной стадии, в 200 мл дихлорметана, выдерживая при -60 С в атмосфере азота. Температуру поддерживали в течение 1 ч и затем температуру доводили до температуры окружающей среды и перемешивали всю ночь. После охлаждения реакционной смеси на ледяной бане добавляли 100 мл воды и образованную двухфазную систему интенсивно перемешивали. Образованную таким образом суспензию фильтровали. Полученное твердое вещество промывали водой, эфиром и высушивали, получая требуемый продукт. Точка плавления: 168-172 С.- 11007227 Стадия Е. 4-Метил-7-фенокси-3,4-дигидро-2 Н-1,2,4-бензотиадиазин 1,1-диоксид. Требуемый продукт получали в соответствии с методикой, описанной на стадии Е в примере 1, исходя из соединения, описанного на стадии выше. Точка плавления: 141-145 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,92 4,86 9,65 11,04 Найдено 57,97 4,95 9,45 11,36 Соединения из примеров 29-32 получали в соответствии с методикой, описанной в примере 28, используя подходящие исходные вещества. Пример 29. 4-Этил-7-фенокси-3,4-дигидро-2H-1,2,4-бензотиадиазин 1,1-диоксид. Точка плавления: 179-181 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,47 5,43 8,38 9,59 Найдено 57,17 5,40 8,01 9,41 Пример 33. 7-Фенокси-3,4-дигидро-2 Н-1,2-бензотиазин 1,1-диоксид. Стадия А. 6-Метокси-2-(2-оксопропил)-1,2-бензизотиазол-3(2 Н)-он 1,1-диоксид. 360 мг 6-метокси-1,1-диоксо-1,2-дигидробензо[d]изотиазол-3-она добавляли небольшими порциями к суспензии 72 мг 60% NaH в минеральном масле в 1,6 мл безводного диметилформамида. После перемешивания в течение 30 мин при температуре окружающей среды реакционная смесь становилась гомогенной, и к ней добавляли 162 мкл хлорацетона. Реакционную смесь нагревали при 110 С в течение 30 мин. Ее оставляли охладиться до температуры окружающей среды и затем смесь осаждали путем добавления воды. Осадок отфильтровывали, промывали несколько раз водой, отфильтровывали при отсасывании и высушивали в вакууме. Точка плавления: 185-191 С. Стадия В. 2-Ацетил-7-метокси-2 Н-1,2-бензотиазин-4-ол 1,1-диоксид. Раствор этанолата натрия в этаноле получали путем растворения 1,08 г натрия в 23 мл этанола в колбе с обратным холодильником. Температуру раствора доводили до 40 С и к нему при перемешивании добавляли 6,30 г продукта со стадии А. Реакционная смесь становилась густой. Добавляли 5 мл этанола,продолжая перемешивать, и нагревали дополнительно в течение 10 мин при 50-55 С. Затем реакционную смесь охлаждали на ледяной бане и подкисляли 3 н. НСl и образованный желтый осадок отфильтровывали. Точка плавления: 162-166 С. Стадия С. 7-Метокси-2,3-дигидро-4 Н-1,2-бензотиазин-4,4-этилендиокси 1,1-диоксид. 5,35 г продукта, полученного на вышеописанной стадии, 200 мг паратолуолсульфокислоты и 5,6 мл этиленгликоля перемешивали в колбе с обратным холодильником в 200 мл бензола в круглодонной колбе, в которой установлено устройство Dean-Stark. После нагревания в колбе с обратным холодильником в течение 72 ч бензол выпаривали в вакууме. Остаток растворяли в этилацетате и органическую фазу- 12007227 промывали водой и затем насыщенным NaCl. Высушивали, фильтровали и выпаривали, получая таким образом масло, которое кристаллизовали из смеси этилового эфира/изопропилового эфира. Точка плавления: 100-110 С. Стадия D. 7-Метокси-2,3-дигидро-4 Н-1,2-бензотиазин-4-он 1,1-диоксид. Раствор 2,63 г продукта, полученного на вышеописанной стадии, в смеси 50 мл метанола и 50 мл 3 н. НСl перемешивали в колбе с обратным холодильником в течение 15 мин. Метанол выпаривали в вакууме и водную фазу экстрагировали эфиром. Органическую фазу высушивали и обрабатывали животным углем. После фильтрации и выпаривания остаток ресуспендировали в изопропиловом эфире и твердое вещество отфильтровывали. Точка плавления: 124-127 С. Стадия Е. 7-Метокси-3,4-дигидро-2 Н-1,2-бензотиазин 1,1-диоксид. 1,77 г продукта, полученного на вышеописанной стадии, в 40 мл уксусной кислоты гидрировали под давлением 5 бар при 70 С в присутствии 1,75 г 10% Pd/C. Смесь оставляли охладиться до температуры окружающей среды и катализатор отфильтровывали. Фильтрат выпаривали досуха и остаток хроматографировали на диоксиде кремния, использую систему 95/5 метиленхлорида/этилацетата в качестве элюента, получая требуемый продукт. Точка плавления: 144-145 С. Стадия F. 3.4-Дигидро-2 Н-1,2-бензотиазин-7-ол 1,1-диоксид. 14,1 мл 1 М раствора ВВr3 в метиленхлориде по каплям добавляли к раствору 1 г продукта, полученного на вышеописанной стадии, в 45 мл метиленхлорида, охлажденного до -35 С. Смесь оставляли нагреться до температуры окружающей среды. После перемешивания в течение 3 ч при температуре окружающей среды, реакционную смесь вливали в воду при 5 С и экстрагировали этилацетатом. Органические фазы объединяли, промывали насыщенным NaCl, высушивали, фильтровали и выпаривали. Получали твердое вещество, которое ресуспендировали в небольшом количестве изопропилового эфира. Указанный в заглавии продукт отфильтровывали. Точка плавления: 173-177 С. Стадия G. 7-Фенокси-3,4-дигидро-2 Н-1,2-бензотиазин 1,1-диоксид. Исходя из соединения, описанного на стадии выше, получали требуемый продукт в соответствии с методикой, описанной на стадии Е примера 1. Точка плавления: 129-132 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 61,07 4,76 5,09 11,65 Найдено 61,40 4,85 5,11 11,40 Соединения из примеров 34-38 получали в соответствии с методикой, описанной в примере 1, используя подходящую арилбороновую кислоты на стадии Е. Пример 34. 7-(3-Метилсульфанилфенокси)-2,3,3 а,4-тетрагидро-1 Н-пирроло-[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид. Точка плавления: 160 С. Элементный микроанализ: С, % Н, %Br, % Рассчитано 48,62 3,82 7,09 8,11 20,21 Найдено 48,95 3,82 7,03 8,13 20,02 Пример 39. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]-бензотиадиазин-7-ил)окси]бензамид. Раствор 0,71 ммоль оксалилхлорида, разведенного 1 мл СН 2Cl2, по каплям добавляли к суспензии 5 мл СН 2Cl2 и 10 мкл ДМФА, содержащей 0,46 ммоль кислоты, полученной в примере 27. Всю смесь перемешивали в течение 1,5 ч при температуре окружающей среды и выпаривали досуха. Параллельно, раствор 5 мл СН 2Cl2 насыщали аммиаком и затем к нему по каплям добавляли хлоридангидрид, полученный выше, растворенный в 3 мл СН 2Cl2. После перемешивания в течение 2 ч при температуре окружающей среды реакционную смесь разводили СН 2Cl2 и органическую фазу промывали при отсасывании 1 н. НСl,водой и насыщенным NaCl. После высушивания (MgSO4) и удаления растворителя путем выпаривания остаток растирали в порошок в смеси изопропилового эфира и этилового эфира. Белое твердое вещество отфильтровывали, получая требуемый продукт. Точка плавления: 139-142 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 56,81 4,77 11,69 8,92 Найдено 56,39 4,88 11,22 8,65 Пример 40. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]-N,N-диметилбензамид. Это соединение получали в соответствии с протоколом примера 39, заменяя аммиак диметиламином в присутствии пиридина. Точка плавления: 199-202 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 58,9 5,46 10,85 8,28 Найдено 58,97 5,54 10,66 7,86 Пример 41. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]-N-метилбензамид. Это соединение получали в соответствии с протоколом примера 39, заменяя аммиак метиламином в присутствии пиридина. Точка плавления: 130-135 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,88 5,13 11,25 8,59 Найдено 58,08 5,45 10,56 8,26 Пример 42. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиазин-7-ил)окси]анилин. Продукт из примера 15 (2,19 ммоль) растворяли в смеси 100 мл этилацетата и 50 мл этанола; добавляли 100 мг 10% палладия на угле и гидрировали при атмосферном давлении в течение 1 ч. Катализатор отфильтровывали, фильтрат выпаривали досуха и остаток осаждали из эфира, получая требуемый продукт после фильтрации. Точка плавления: 221-226 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,99 5,17 12,68 9,68 Найдено 57,90 5,28 12,44 9,59 Пример 43. N-3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил) окси]фенил-N-(метилсульфонил)метансульфонамид. 0,90 ммоль триэтиламина, DMAP на кончике шпателя и затем, по каплям, 0,90 ммоль ангидрида метансульфокислоты, разведенного 8 мл СН 2 Сl2, добавляли к раствору 0,45 ммоль амина из примера 42 в- 14007227 30 мл СН 2 Сl2. Через одну ночь при температуре окружающей среды реакционную смесь промывали (1 н. НСl, насыщенный NaCl), высушивали (MgSO4). Два образованных продукта очищали при помощи хроматографии на диоксиде кремния, элюируя градиентом СН 2 Сl2 100%СН 2 Сl2/МеОН 95/5. Первый элюированный продукт соответствует диметилсульфонилированному указанному в заглавии продукту. Второе, монометилсульфонилированное соединение, соответствует продукту, описанному в следующем примере. Точка плавления: 214-215 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 44,34 4,34 8,62 19,73 Найдено 44,72 4,55 8,55 19,84 Пример 44. N-3-(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирридо[2,1-с][1,2,4]бензотиазин-7-ил)окси]фенил]метансульфонамид. Как указано в примере выше, указанный в заглавии продукт соответствует второму продукту, выделенному при хроматографировании в указанных условиях. Точка плавления: 117-120 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 49,86 4,68 10,26 15,66 Найдено 50,13 4,77 10,06 15,34 Пример 45. N-3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил) окси]фенилэтансульфонамид. Это соединение получали в соответствии с методикой примера 43, используя подходящий хлорсульфонил. Точка плавления: 169 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 51,05 5,00 9,92 15,14 Найдено 50,9 4,97 9,87 15,00 Пример 46. N-3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил) окси]фенилпропан-2-сульфонамид. Это соединение получали в соответствии с методикой примера 43, используя подходящий хлорсульфонил. Точка плавления: 179 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 52,16 5,30 9,60 14,66 Найдено 51,88 5,33 9,87 14,71 Пример 47. N-3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил) окси]фенилбензолсульфонамид. Это соединение получали в соответствии с методикой примера 43, используя подходящий хлорсульфонил. Точка плавления: 142-145 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 56,04 4,49 8,91 13,60 Найдено 56,33 4,62 8,60 13,67 Пример 48. N-3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил) окси]фенилацетамид. Это соединение получали в соответствии с методикой примера 43, используя уксусный ангидрид. Точка плавления: 251-253 С. Элементный микроанализ: С, % Н, %- 15007227 Пример 49. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензолсульфонамид. Стадия А. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси] бензолсульфонилхлорид. Раствор 2 мл ледяной уксусной кислоты и 340 мкл воды насыщали SO2 путем барботирования с газом SO2 в течение 15 мин. Параллельно, при 5 С готовили раствор 1,51 ммоль амина из примера 42 в смеси 1,3 мл ледяной уксусной кислоты и 2,4 мл концентрированной НСl. Раствор 1,7 ммоль нитрита натрия, предварительно растворенного в 1 мл воды, по каплям добавляли к этому раствору и реакционную смесь перемешивали в течение 30 мин при 5 С. К раствору добавляли 0,6 ммоль CuCl22H2 О, который насыщали SO2, и полученную суспензию охлаждали до 5 С. Раствор диазония, полученный выше,по каплям добавляли к последней. Смесь перемешивали в течение 1 ч при 5 С и затем в течение 1,5 ч,пока температура не соответствовала температуре окружающей среды. Реакционную смесь вливали в лед и осадок отфильтровывали и промывали водой. После высушивания получали требуемый продукт в виде бежевого порошка. Стадия В. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси] бензолсульфонамид. 0,48 ммоль продукта, полученного на вышеописанной стадии А, в смеси 10 мл 28% гидроксида аммония, 2 мл воды и 1 мл ацетона перемешивали всю ночь при температуре окружающей среды. Наблюдалось медленное превращение в раствора, и через одну ночь получали мутный оранжевый раствор. Раствор вливали в 1 н. НСl, предварительно охлажденную на ледяной бане. Полученную суспензию перемешивали в течение 10 мин и неочищенный продукт восстанавливали путем фильтрации. Очищали при помощи хроматографии на диоксиде кремния, используя смесь 90/10 СН 2 Сl2/ацетон в качестве элюента. Точка плавления: 197-200 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 48,6 4,33 10,63 16,22 Найдено 48,81 4,49 10,23 16,27 Пример 50. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]-N-пропилбензолсульфонамид. Это соединение получали путем взаимодействия продукта со стадии А примера 49 с подходящим амином. Точка плавления: 86-91 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 52,16 5,30 9,60 14,66 Найдено 52,96 5,30 9,33 14,41 Пример 51. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]-N-изопропилбензолсульфонамид. Это соединение получали путем взаимодействия продукта со стадии А примера 49 с подходящим амином. Точка плавления: 151-155 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 52,16 5,30 9,60 14,66 Найдено 52,41 5,50 9,68 14,66 Пример 52. Диэтил 3-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7 ил)окси]фенилфосфонат. Смесь 5,40 ммоль бромового соединения из примера 38, 16,2 ммоль диэтилфосфита, 16,2 ммоль триэтиламина, 1,62 ммоль Pd[P(Ph)3]4 перемешивали всю ночь при 110 С в 4 мл ДМФА в потоке азота. ДМФА выпаривали, остаток ресуспендировали в этилацетате и органическую фазу промывали 1 н. раствором NaOH, водой, насыщенным NaCl. После высушивания и выпаривания в вакууме получали твердую фракцию, которую кристаллизовали из эфира, получая требуемый продукт. Точка плавления: 148-152 С Элементный микроанализ: С, % Н, %- 16007227 Пример 53. Этилгидро 3-[(5,5-диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло-[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилфосфонат. 0,66 ммоль продукта из примера 52 в 3 мл 1 н. NaOH перемешивали в течение 8 ч при 70 С. Реакционный раствор подкисляли 1 н. НСl и белый осадок отфильтровывали, получая требуемый продукт. Точка плавления: 177-182 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 50,94 4,99 6,60 7,56 Найдено 50,85 5,02 6,58 7,65 Пример 54. 3-[(5,5-Диоксидо-2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилфосфоновая кислота. Ацетонитрил (20 мл), 0,66 ммоль продукта из примера 52 и 1,98 ммоль бромтриметилсилана перемешивали в колбе с обратным холодильником в течение 1 ч. Растворитель и избыток реагента выпаривали в вакууме и остаток ресуспендировали в растворе в 10 мл метанола. После перемешивания в течение 30 мин раствор выпаривали досуха и остаток ресуспендировали в 1 н. НСl. Получали смолу, которую кристаллизовали путем добавления небольшого количества СН 2 Сl2. Требуемый продукт восстанавливали путем фильтрации. Точка плавления: 166-169 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 48,49 4,32 7,07 8,09 Найдено 48,34 4,29 7,00 8,06 Пример 55. 7-(3-Метилфенокси)-3,4-дигидро-2 Н-1,2-бензотиазин 1,1-диоксид. Полученный путем сочетания продукта, полученного на стадии F примера 33 и 3-метилфенилбороновой кислоты в соответствии с методикой, описанной на стадии Е примера 1. Точка плавления: 116-118 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 62,26 5,23 4,84 11,08 Найдено 62,69 5,17 4,94 10,90 Соединения из примеров 56-61 получали в соответствии с методикой, описанной в примере 28, используя этилйодид на стадии В и подходящую арилбороновую кислоту на стадии Е. Пример 56. 4-Этил-7-[(3-метилсульфанил)фенокси]-3,4-дигидро-2 Н-[1,2,4]бензотиадиазин 1,1-диоксид. Точка плавления: 127-130 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 61,42 6,06 8,43 9,65 Найдено 61,37 6,09 8,25 9,36 Пример 62. 3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил)окси]анилин. Это соединение получали путем восстановления нитропродукта из примера 15 в соответствии с методикой, описанной в примере 42. Точка плавления: 128-132 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 56,41 5,37 13,16 10,04 Найдено 56,84 5,53 12,89 10,17 Пример 63. N-3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил)окси]фенил 1,1,1-трифторметансульфонамид. Это соединение получали путем взаимодействия амина из примера 62 с ангидридом трифторметансульфокислоты в условиях, описанных в примере 43. Точка плавления: 136-138 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 42,57 3,57 9,31 14,21 Найдено 43,24 3,76 9,10 14,33 Пример 64. 1-3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2 Н-1,2,4-бензотиадиазин-7-ил)окси]фенилэтанол. К 0,8 мл безводного этанола добавляли небольшими порциями 0,42 ммоль NaBH4, затем 0,21 ммоль продукта из примера 59. Раствор перемешивали в течение 20 мин при температуре окружающей среды. Реакционную смесь охлаждали на ледяной бане и подкисляли путем прибавления по каплям 1 н. НСl. Реакционную смесь экстрагировали этилацетатом и органическую фазу промывали (вода, насыщенный Пример 65. 3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил)окси]бензойная кислота. Это соединение получали в соответствии с методикой, описанной в примере 27. Точка плавления: 228-230 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 55,16 4,63 8,04 9,20 Найдено 54,89 4,69 7,89 9,32 Пример 66. 3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2H-1,2,4-бензотиадиазин-7-ил)окси]бензамид. Это соединение получали путем амидирования продукта из примера 65 в соответствии с методикой из примера 39. Точка плавления: 8 5-90 С. Элементный микроанализ: С, % Н, %- 18007227 Пример 67. 3-[(4-Этил-1,1-диоксидо-3,4-дигидро-2 Н-1,2,4-бензотиадиазин-7-ил)окси]-N,N-диметилбензамид. Это соединение получали путем амидирования продукта из примера 65 в соответствии с методикой из примера 40. Точка плавления: 65-70 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 57,58 5,64 11,19 8,54 Найдено 57,54 5,78 10,55 8,20 Пример 68. 3-Фенокси-6,6 а,7,8,9,10-гексагидропиридо[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид. Это соединение получали в соответствии с методикой, описанной в примере 1, используя хлорид 5 хлорпропановой кислоты на стадии А. Точка плавления: 211-213 С. Элементный микроанализ: С, % Н, %S, % Рассчитано 61,80 5,49 8,48 9,70 Найдено 61,61 5,45 8,35 9,79 Фармакологические исследования соединений по изобретению Исследования возбуждающих токов, вызванных АМРА, на ооцитах лягушки а) Способ. Получали мРНК из коры головного мозга самцов крыс Wistar при помощи способа с использованием тиоцианата гуанидина/фенола/хлороформа. Выделяли поли-(А+) мРНК путем хроматографии на олиго-dT целлюлозе и вводили в дозе 50 нг на ооцит. Ооциты инкубировали 2-3 дня при 18 С, чтобы позволить проявиться экспрессии рецепторов, и затем хранили при 8-10 С. Электрофизиологическую регистрацию осуществляли в камере Plexiglass при 20-24 С в среде OR2(J. Exp. Zool., 1973, 184, 321-334) при помощи 2-электродного "voltage-clamp" метода, третий электрод,помещенный в ванну, был контрольным, как описано в ссылке. Все соединения применяли при помощи инкубационной среды и электрический ток измеряли в конце периода введения. АМРА использовали в концентрации 10 мкМ. Для каждого исследуемого соединения определяли концентрацию, которая вызывает двукратное увеличение (ЕС 2 Х) или пятикратное увеличение (ЕС 5 Х) интенсивности тока, вызванного одним АМРА (5-50 нА). б) Результаты. Соединения по изобретению в значительной степени усиливают возбуждающие действие АМРА, и их активность существенно выше по сравнению с активностью сравнительных соединений. Соединение из примера 3, в частности, обеспечивает ЕС 2 Х при концентрации 0,8 мкМ и ЕС 5 Х при концентрации 3,6 мкМ. Что касается соединения из примера 29, то оно обеспечивает ЕС 2 Х при концентрации 1,4 мкМ и ЕС 5 Х при концентрации 4,5 мкМ. Фармацевтическая композиция Состав для приготовления 1000 таблеток, каждая из которых содержит дозу 100 мг: где R1 представляет собой арильную или гетероарильную группу,R2 представляет собой атом водорода, атом галогена или гидроксильную группу,А представляет собой CR4R5 группу или NR4 группу,R3 представляет собой атом водорода, линейную или разветвленную С 1-С 6-алкильную группу или С 3-С 7-циклоалкильную группу,- 19007227R4 представляет собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу,,А представляет собой атом азота и вместе со смежной группой -CHR3- образует кольцо где m представляет собой 1, 2 или 3,R5 представляет собой атом водорода или атом галогена,их изомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием,где подразумевается, что"арильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, необязательно замещенную одной или более одинаковых или разных групп: галогеном, линейным или разветвленным С 1-С 6-алкилом (необязательно замещенным одной или более гидроксильными группами), линейным или разветвленным С 1-С 6-алкокси, линейным или разветвленным С 1-С 6-пергалоалкилом, линейным или разветвленным С 1 С 6-алкоксикарбонилом, линейным или разветвленным С 1-С 6-алкилтио, карбокси, линейным или разветвленным С 1-С 6-ацилом, линейным или разветвленным С 1-С 6-пергалоалкокси, гидрокси, циано, нитро,амино (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильной или линейной или разветвленной С 1-С 6-ацильной группами), аминокарбонилом (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами), аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами), моноили ди-(С 1-С 6-алкилсульфонил)амино, моно- или ди-(трифторметилсульфонил)амино, PO(ORa)(ORb) (гдеRa, Rb, которые могут быть одинаковыми или разными, представляют собой атом водорода или линейную или разветвленную С 1-С 6-алкильную группу), бензилокси, или фенилом (необязательно замещенным одной или более одинаковыми или разными группами: галогеном, линейным или разветвленным С 1 С 6-алкилом, линейным или разветвленным С 1-С 6-пергалоалкилом, гидрокси или линейным или разветвленным С 1-С 6-алкокси),"гетероарильная группа" обозначает ароматическую моноциклическую группу или бициклическую группу, в которой по крайней мере одно из колец является ароматическим, содержащую один, два или три одинаковых или разных гетероатома, выбранных из азота, кислорода и серы, необязательно замещенную одной или более одинаковыми или разными группами: галогеном, линейным или разветвленным С 1-С 6-алкилом, линейным или разветвленным С 1-С 6-алкокси, линейным или разветвленным С 1-С 6 пергалоалкилом, линейным или разветвленным С 1-С 6-алкоксикарбонилом, карбокси, линейным или разветвленным С 1-С 6-ацилом, линейным или разветвленным С 1-С 6-пергалоалкокси, гидрокси, циано, нитро,амино (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами), аминосульфонилом (необязательно замещенным одной или более линейной или разветвленной С 1-С 6-алкильными группами) или С 1-С 6-алкилсульфониламино. 2. Соединения формулы (I) в соответствии с п.1, где R2 представляет собой атом водорода. 3. Соединения формулы (I) в соответствии с п.1 или 2, где группа OR1 находится в положении b фенила. 4. Соединения формулы (I) в соответствии с любым из пп.1, 2 и 3, где R1 представляет собой необязательно замещенную фенильную группу. 5. Соединения формулы (I) в соответствии с любым из пп.1-4, где А представляет собой атом азота, где m представляет собой 1, 2 или 3,и вместе со смежной группой -CHR3- образует кольцо предпочтительно 1. 6. Соединение формулы (I) в соответствии с п.1, которое представляет собой 7-(3-метилфенокси)2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин 5,5-диоксид, а также его изомеры. 7. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-[(5,5-диоксидо 2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]бензойную кислоту, а также ее изомеры. 8. Соединение формулы (I) в соответствии с п.1, которое представляет собой 3-(5,5-диоксидо 2,3,3 а,4-тетрагидро-1 Н-пирроло[2,1-с][1,2,4]бензотиазин-7-ил)окси]анилин, а также его изомеры. 9. Соединение формулы (I) в соответствии с п.1, которое представляет собой N-[3-(5,5-диоксидо 2,3,3 а,4-тетрагидро-1H-пирридо[2,1-с][1,2,4]бензотиазин-7-ил)окси]фенил]метансульфонамид, а также его изомеры. 10. Соединение формулы (I) в соответствии с п.1, которое представляет собой этилгидро 3-[(5,5 диоксидо-2,3,3 а,4-тетрагидро-1H-пирроло[2,1-с][1,2,4]бензотиадиазин-7-ил)окси]фенилфосфонат, а также его изомеры. 11. Способ получения соединений формулы (I) по п.1, характеризующийся тем, что в качестве исходного вещества применяют соединение формулы (II)' где А и R3 имеют значения, указанные в п.1,R'1 представляет собой линейную или разветвленную (С 1-С 6)алкоксигруппу,R'2 представляет собой атом водорода, атом галогена или линейную или разветвленную (С 1 С 6)алкоксигруппу,которое подвергают взаимодействию с трибромидом бора, получая соединение формулы (III)' где A, R2 и R3 имеют значения, указанные в п.1,которое, в свою очередь, подвергают взаимодействию с бороновой кислотой соединения формулыR1 В(ОН)2 где R1 имеет значения, указанные для формулы (I),с получением соединения формулы (I) которое при необходимости очищают в соответствии с обычными способами очистки, разделяют при необходимости на изомеры в соответствии с обычными способами разделения и превращают при необходимости в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Фармацевтические композиции, которые содержат в качестве активного компонента соединение в соответствии с любым из пп.1-10 в сочетании с одним или более фармацевтически приемлемыми инертными, нетоксичными наполнителями или носителями. 13. Фармацевтические композиции в соответствии с п.12, которые содержат в качестве активного компонента соединение в соответствии с любым из пп.1-10 для применения в качестве лекарственных средств, таких как АМРА модуляторы.
МПК / Метки
МПК: C07D 285/00, C07D 513/04, A61K 31/549, C07D 279/02, A61K 31/5415, A61P 25/00
Метки: фармацевтические, соединения, способ, бензотиазина, композиции, получения, бензотиадиазина, которые, содержат
Код ссылки
<a href="https://eas.patents.su/22-7227-soedineniya-benzotiazina-i-benzotiadiazina-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-kotorye-ih-soderzhat.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат</a>
Предыдущий патент: Производные имидазохинолина
Следующий патент: Аэрозольная композиция для ингаляции, содержащая соль тиотропия
Случайный патент: Надувной снегоступ и рюкзак для его хранения