Способ лечения с использованием конъюгатов лиганд-иммуноген
Формула / Реферат
1. Способ усиления опосредованной эндогенным иммунным ответом специфической элиминации популяции патогенных клеток у животного-хозяина, несущего указанную популяцию, где члены указанной клеточной популяции имеют доступные для лиганда сайты связывания, причем указанный способ включает в себя стадию введения указанному хозяину композиции конъюгата лиганд-иммуноген, включающей в себя комплекс лиганда и иммуногена, где указанный иммуноген характеризуется тем, что он распознается эндогенным или экзогенным антителом у хозяина, или характеризуется тем, что он напрямую распознается иммунной клеткой у хозяина; и соединения, способного стимулировать эндогенный иммунный ответ, причем указанное соединение не связывается с конъюгатом лиганд-иммуноген.
2. Способ по п.1, где лиганд выбран из группы, состоящей из фолиевой кислоты и других лигандов, связывающихся с фолатным рецептором.
3. Способ по п.1, где иммуноген представляет собой органическую молекулу, выбранную из флуоресцеина или динитрофенила.
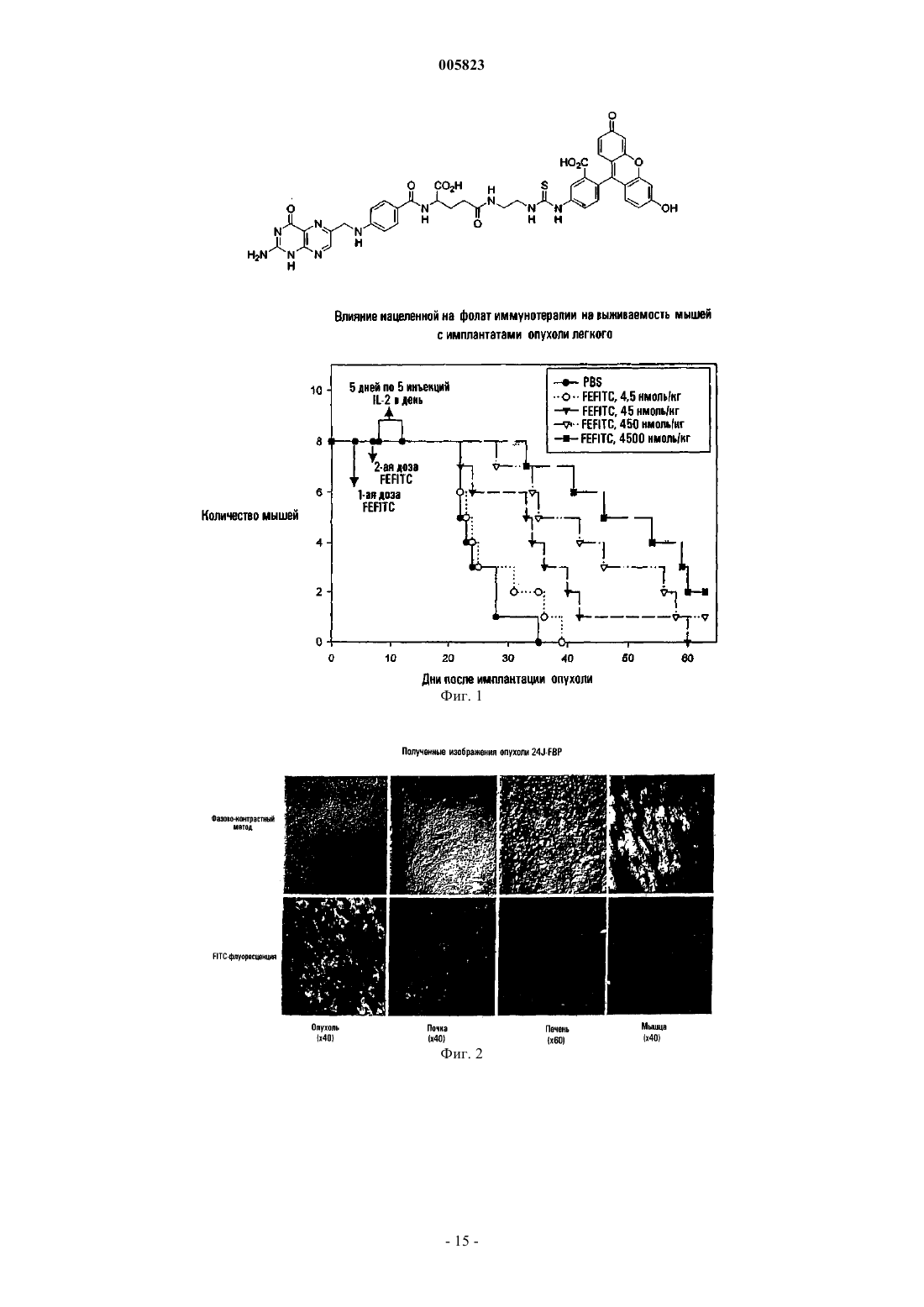
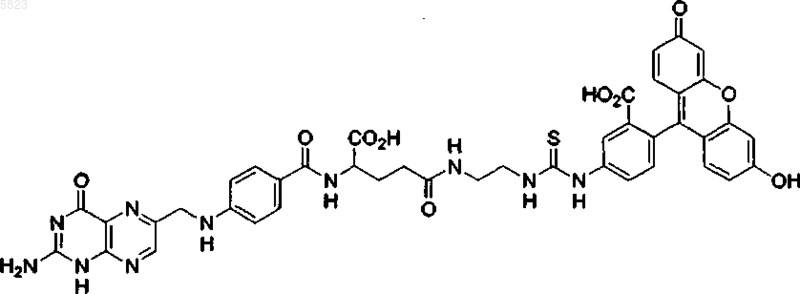
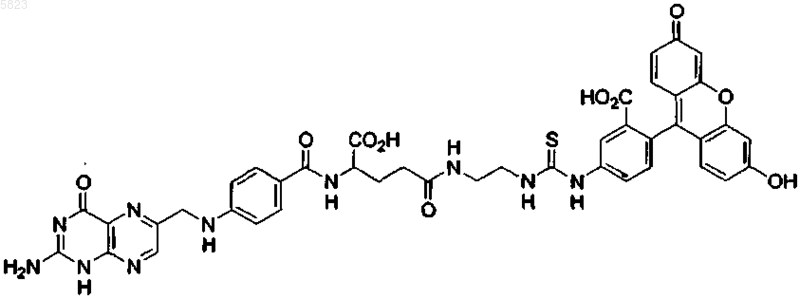
4. Способ по п.1, где конъюгат лиганд-иммуноген имеет следующую формулу:
5. Фармацевтическая композиция, содержащая терапевтически эффективные количества конъюгата лиганд-иммуноген, способного специфически связываться с популяцией патогенных клеток у животного-хозяина, для специфической элиминации указанных клеток под действием приобретенного или врожденного иммунного ответа, под действием совместно вводимых антител или напрямую под действием иммунных клеток у хозяина, соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген, и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция, включающая в себя количество конъюгата лиганд-иммуноген, эффективное для мечения популяции патогенных клеток у животного-хозяина, для специфической элиминации в результате эндогенного иммунного ответа или с помощью совместно вводимых антител, где конъюгатом лиганд-иммуноген является флуоресцеинизотиоцианат или динитрофенил, конъюгированный с фолиевой кислотой посредством связанного с гамма-карбоксилом этилендиаминового мостика (фолат-FITC), и фармацевтически приемлемый носитель.
7. Применение конъюгата фолат-FITC в производстве лекарственного средства для мечения популяции патогенных клеток у животного-хозяина для специфической элиминации в результате эндогенного иммунного ответа или с помощью совместно вводимых антител.
8. Применение по п.7, где фолат-FITC имеет следующую формулу:
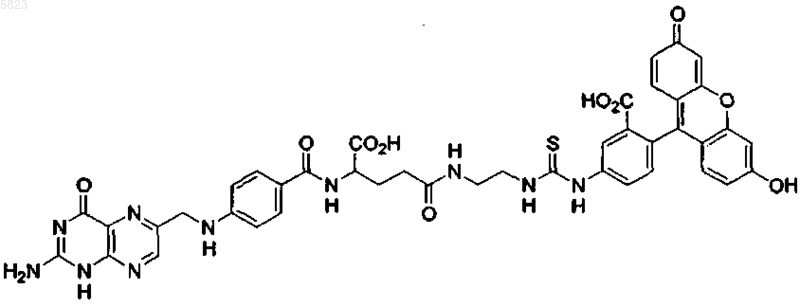
9. Конъюгат фолат-FITC формулы
Текст
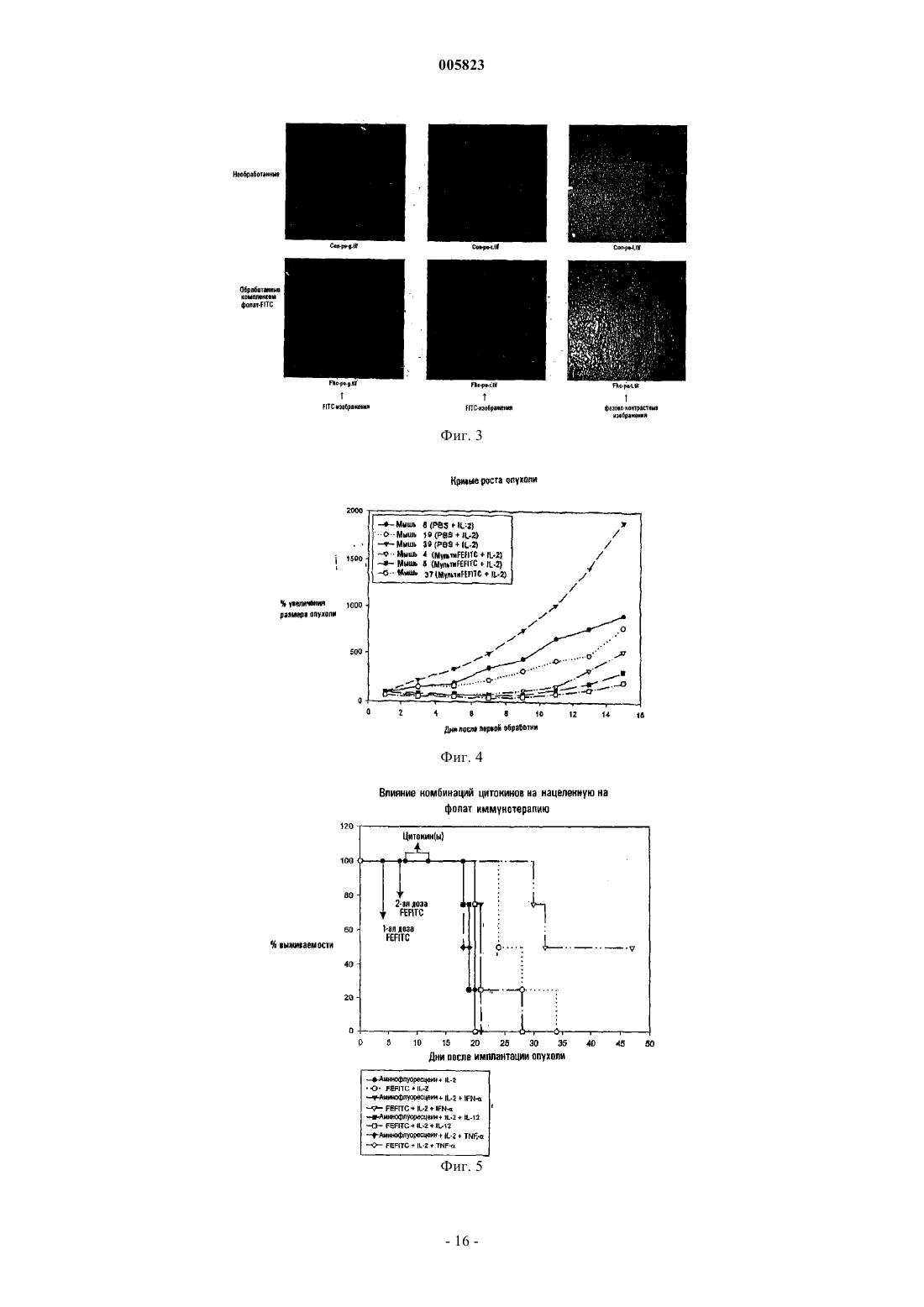
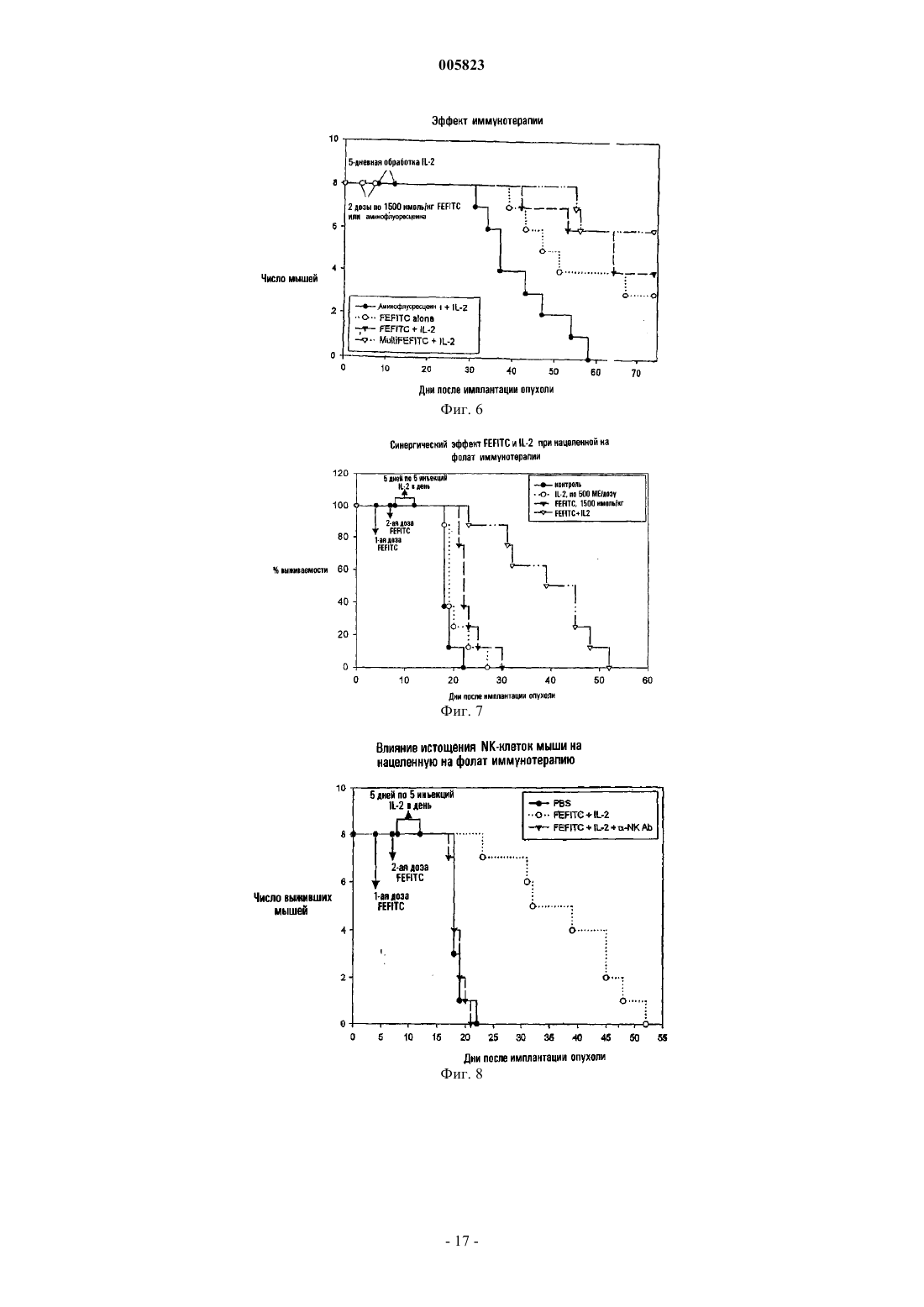
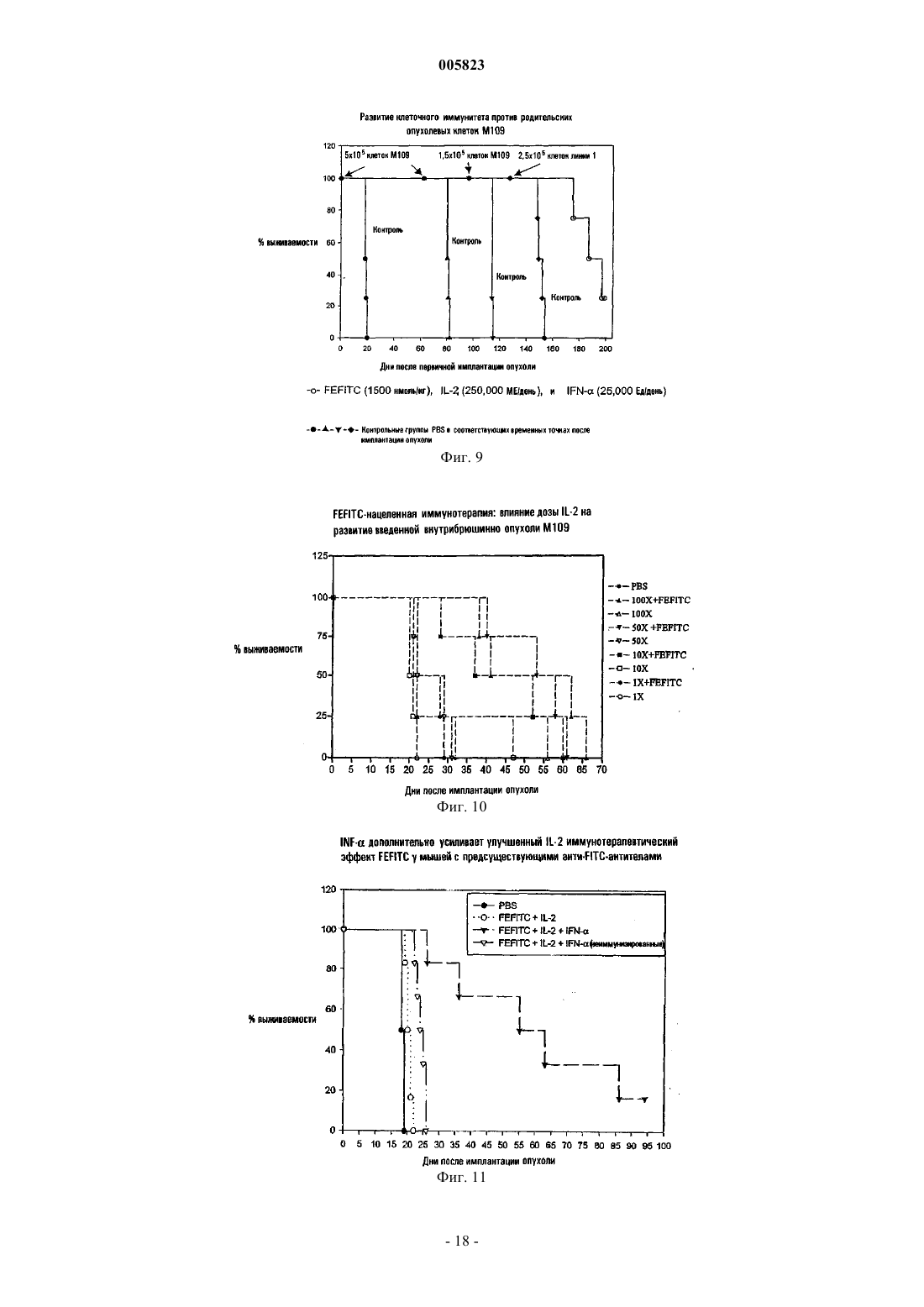
005823 Область изобретения Данное изобретение связано со способом и фармацевтической композицией для применения при лечении болезненных состояний, характеризующихся наличием патогенных клеточных популяций. Более конкретно, нацеленные на клетку комплексы лиганд-иммуноген вводятся заболевшему хозяину,предпочтительно в комбинации со стимулятором иммунной системы или другим терапевтическим фактором, для усиления и/или ориентации иммунных ответов хозяина на патогенные клетки. Основа и краткое содержание изобретения Иммунная система млекопитающих обеспечивает средство узнавания и элиминации опухолевых клеток, иных патогенных клеток и инвазирующих чужеродных патогенов. Хотя в норме иммунная система обеспечивает сильную систему защиты, все еще существует множество примеров, когда раковые клетки, иные патогенные клетки или инфекционные агенты обходят иммунный ответ хозяина и пролиферируют или персистируют с сопутствующим патогенным эффектом у хозяина. Химиотерапевтические агенты и радиационная терапия были предприняты для элиминации реплицирующихся неоплазм. Однако большинство, если не все, из доступных в настоящее время химиотерапевтических агентов и режимов радиационной терапии вызывает побочные эффекты, поскольку их действие связано с разрушением не только раковых клеток, но и с их воздействием также и на нормальные клетки хозяина, такие как клетки гематопоэтической системы. Более того, химиотерапевтические агенты имеют ограниченную эффективность воздействия в случаях, когда у хозяина развивается лекарственная толерантность. Чужеродные патогены могут также пролиферировать в организме хозяина "в обход" компетентного иммунного ответа или же тогда, когда иммунная система хозяина подорвана в результате лекарственной терапии или других проблем со здоровьем. Несмотря на то что было развито множество терапевтически активных соединений, многие патогены являются резистентными или же приобретают резистентность к указанным терапевтическим средствам. Способность раковых клеток и инфекционных организмов развивать резистентность к терапевтическим агентам, а также неблагоприятные побочные эффекты доступных в настоящее время противораковых лекарственных средств диктуют необходимость создания новых терапевтических средств, специфических в отношении патогенных клеточных популяций и имеющих пониженную токсичность в целом для организма хозяина. Исследователями разработаны терапевтические протоколы по разрушению раковых клеток путем специфического нацеливания цитотоксических соединений на такие клетки. В таких протоколах используются токсины, конъюгированные с лигандами, которые связываются с уникальными рецепторами раковых клеток или же с такими рецепторами, экспрессия которых на поверхности раковых клеток повышена с тем, чтобы минимизировать доставку токсина к нормальным клеткам. С использованием такого подхода удалось разработать определенные иммунотоксины, состоящие из антител, направленных на специфические рецепторы, находящиеся на патогенных клетках, при этом указанные антитела связаны с токсинами, такими как рицин, экзотоксином Pseudomonas, дифтерийным токсином и фактором некроза опухоли. Указанные иммунотоксины нацелены на опухолевые клетки, несущие специфические рецепторы, узнаваемые антителом (Olsnes, S., Immunol. Today, 10, pp. 291-295,1989; Melby, E.L., Cancer Res., 53(8), pp. 1755-1760, 1993; Better, M.D., публикация РСТ под номером WO 91/07418, опубликованная 30 мая 1991 г.). Другим подходом для селективного нацеливания на популяции раковых клеток или чужеродных патогенов в организме хозяина является усиление иммунного ответа хозяина против патогенных клеток,что дает возможность избежать необходимости введения соединений, которые могут также проявлять независимую токсичность в отношении организма хозяина. Одной из опубликованных стратегий такого рода иммунотерапии является стратегия связывания антител, например, полученных с помощью генной инженерии мультимерных антител, с поверхностью опухолевых клеток с тем, чтобы расположить константную область антител на поверхности клеток и, таким образом, индуцировать гибель опухолевых клеток в результате различных процессов, опосредованных иммунной системой (De Vita, V.Т., BiologicTherapy of Cancer, 2d ed. Philadelphia, Lippincott, 1995; Soulillou, J. P., U.S. Patent 5,672,486). Однако такой подход оказался осложненным трудностями, связанными с определением опухолеспецифических антигенов. Другим подходом, связанным с усилением иммунокомпетентности системы хозяина, является нацеливание антитела против рецептора Т-клеток или антитела против Fc-рецептора на поверхность опухолевых клеток для промоции прямого связывания иммунных клеток с опухолями (Kranz, D.M., U.S. Patent 5,547,668). Был описан также подход на основе использования вакцин и в таком подходе упор был сделан на вакцину, содержащую антигены, слитые с цитокинами, где цитокин модифицировал иммуногенность вакцинного антигена, и, таким образом, происходила стимуляция иммунного ответа в отношении патогенного агента (Pillai, S., публикация РСТ под номером WO 91/11146, опубликованная 7 февраля 1991 г.). Такой способ основан на непрямой модуляции вызываемого иммунного ответа. Другим подходом для уничтожения нежелательных клеточных популяций являлось использование IL-2 или Fabфрагментов антитимоцитарного глобулина, связанного с антигенами, для элиминации нежелательных Тклеток; однако, если учесть опубликованные экспериментальные данные, этот способ давал возможность элиминировать только 50% клеточной популяции-мишени, а также приводил к неспецифической элиминации клеток in vivo (т.е. 50% лимфоцитов периферической крови, которые не являлись Т-клетками, ока-1 005823 зывались также уничтоженными (Pouletty, Р., публикация РСТ под номером WO 97/37690, опубликованная 16 октября 1997 г.). Таким образом, остается актуальной потребность в терапии, направленной на лечение болезненных состояний, характеризующихся наличием патогенных клеточных популяций в пораженном организме хозяина. Настоящее изобретение направлено на способ элиминации патогенных клеточных популяций в организме хозяина путем усиления распознавания иммунной системой хозяина таких клеточных популяций и усиления ответа на такие клеточные популяции. Антигенность клеточных патогенов эффективно увеличивалась с целью усиления элиминации популяции патогенных клеток, опосредованной эндогенным иммунным ответом. В этом способе удается избежать или же минимизировать использование цитотоксических или противомикробных терапевтических агентов. Этот способ включает в себя введение конъюгата лиганд-иммуноген, где указанный лиганд специфически связывается с популяцией патогенных клеток in vivo, которая исключительно экспрессирует, преимущественно экспрессирует или же экспрессирует в повышенных количествах лиганд-связывающий фрагмент, а конъюгированный с лигандом иммуноген вызывает продукцию антител или более предпочтительно распознается эндогенными или совместно вводимыми экзогенными антителами в организме животного-хозяина. Опосредованная иммунной системой элиминация патогенных клеток вызвана связыванием конъюгированного с лигандом иммуногена с рецептором, переносчиком или другим представленным на поверхности протеином, экспрессируемым исключительно, экспрессируемым в повышенных количествах или преимущественно экспрессируемым патогенной клеткой. Представленный на поверхности протеин, исключительно экспрессируемый, экспрессируемый в повышенных количествах или преимущественно экспрессируемый патогенной клеткой, является рецептором, не представленным или представленным в малых количествах на непатогенных клетках, что обеспечивает средство для специфической элиминации патогенных клеток. По меньшей мере один дополнительный терапевтический фактор, например стимулятор иммунной системы, агент, вызывающий гибель клеток, усилитель проникновения в опухоль, химиотерапевтический агент, цитотоксическая иммунная клетка или противомикробный агент могут быть совместно введены животному-хозяину для усиления терапевтической эффективности. В одном из аспектов настоящий способ включает в себя стадии введения лигандов, способных к высокоаффинному специфическому связыванию in vivo с протеинами клеточной поверхности, исключительно экспрессируемыми, преимущественно экспрессируемыми или экспрессируемыми в повышенных количествах на популяции патогенных клеток-мишеней, при этом указанные лиганды конъюгированы с иммуногеном, против которого врожденный или приобретенный иммунитет уже существует или может быть вызван в организме животного-хозяина, и необязательно совместное введение по меньшей мере одного терапевтического фактора, который является активатором эндогенного иммунного ответа или цитотоксическим соединением. В одном из предпочтительных аспектов настоящий способ включает в себя введение животному-хозяину композиции, содержащей конъюгат лиганд-иммуноген, где лиганд представляет собой лиганд, связывающий рецептор фолиевой кислоты или другого фолата. Лиганд является конъюгированным, например, путем ковалентного связывания с иммуногеном, способным вызывать антительный ответ в организме животного-хозяина, или более предпочтительно с иммуногеном, способным связываться с предсуществующими эндогенными антителами (вследствие врожденного или приобретенного иммунитета), или совместно вводимыми антителами (т.е. путем пассивной иммунизации) в организме животного-хозяина. По меньшей мере один дополнительный терапевтический фактор, не способный специфически связываться с комплексом лиганд-иммуноген, но способный стимулировать или усиливать эндогенный иммунный ответ, агент, вызывающий гибель клеток, усилитель проникновения в опухоль, такой как воспалительный или провоспалительный агент, химиотерапевтический агент, цитотоксическая иммунная клетка или противомикробный агент могут быть введены животному-хозяину в сочетании с введением конъюгатов лиганд-иммуноген. В соответствии с другим аспектом данного изобретения обеспечивается способ усиления эндогенной опосредованной иммунным ответом специфической элиминации популяции патогенных клеток в организме животного-хозяина, несущего указанную популяцию, где члены указанной клеточной популяции имеют избыточное количество сайтов связывания лиганда. Этот способ включает в себя стадию введения указанному хозяину композиции конъюгата лиганд-иммуноген, включающей в себя комплекс лиганда и иммуногена, где указанный иммуноген отличается тем, что он распознается эндогенным или экзогенным антителом у хозяина или напрямую распознается иммунной клеткой хозяина, и по меньшей мере одной дополнительной композиции, включающей в себя терапевтический фактор, причем указанный фактор выбран из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, цитотоксической иммунной клетки и соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген. В соответствии с альтернативным аспектом данного изобретения обеспечивается способ усиления эндогенной опосредованной иммунным ответом специфической элиминации популяции патогенных клеток в организме животного-хозяина, несущего указанную популяцию, где указанная клеточная популяция экспрессирует сайт связывания лиганда. Этот способ включает в себя стадии введения хозяину ком-2 005823 позиции, включающей в себя комплекс указанного лиганда и иммуногена, введения хозяину антител,направленных на иммуноген, и введения указанному хозяину по меньшей мере одного дополнительного терапевтического фактора, причем указанный фактор выбран из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, противомикробного агента, цитотоксической иммунной клетки и стимулятора эндогенного иммунного ответа, который не связывается с комплексом лиганд-иммуноген. В одном из предпочтительных аспектов данного изобретения обеспечивается способ усиления эндогенной опосредованной иммунным ответом специфической элиминации популяции патогенных клеток в организме животного-хозяина, несущего указанную популяцию, где указанная клеточная популяция преимущественно экспрессирует, исключительно экспрессирует или экспрессирует в повышенных количествах рецептор фолиевой кислоты. Этот способ включает в себя стадию введения указанному хозяину композиции, включающей в себя ковалентно связанный конъюгат иммуногена, где иммуноген отличается тем, что он распознается эндогенным или экзогенным антителом у хозяина или напрямую распознается иммунной клеткой хозяина, и лиганд, содержащий фолиевую кислоту или аналог фолиевой кислоты,имеющий глутамильную группу, где ковалентная связь с иммуногеном осуществляется только через карбоксигруппу глутамильной группы. В другом аспекте хозяину вводится по меньшей мере одна дополнительная композиция, содержащая терапевтический фактор, где указанный фактор выбран из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, противомикробного агента, цитотоксической иммунной клетки и соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген. Еще в одном аспекте данного изобретения обеспечивается способ усиления эндогенной опосредованной иммунным ответом специфической элиминации популяции патогенных клеток в организме животного-хозяина, несущего указанную популяцию, где указанная клеточная популяция преимущественно экспрессирует, исключительно экспрессирует или экспрессирует в повышенных количествах рецептор фолиевой кислоты. Этот способ включает в себя стадию введения указанному хозяину композиции,включающей в себя ковалентно связанный конъюгат иммуногена, где иммуноген отличается тем, что он распознается эндогенным или экзогенным антителом у хозяина или напрямую распознается иммунной клеткой хозяина, и лиганд, содержащий фолиевую кислоту или аналог фолиевой кислоты, имеющий глутамильную группу, где ковалентная связь с иммуногеном осуществляется только через карбоксигруппу глутамильной группы. В другом аспекте хозяину вводится по меньшей мере одна дополнительная композиция, содержащая терапевтический фактор, где указанный фактор выбран из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, противомикробного агента, цитотоксической иммунной клетки и соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген. Еще в одном аспекте данного изобретения популяция патогенных клеток-мишеней представляет собой популяцию раковых клеток. В другом аспекте популяция патогенных клеток-мишеней представляет собой популяцию инфицированных вирусом эндогенных клеток. В другом аспекте популяция клетокмишеней представляет собой популяцию экзогенных организмов, таких как бактерии, микоплазма,дрожжи или грибы. Конъюгат лиганд-иммуноген связывается с поверхностью опухолевых клеток или патогенных организмов и "метит" клетки, принадлежащие популяции клеток-мишеней, иммуногеном,таким образом производя запуск иммунно-опосредованного ответа, направленного на популяцию меченых клеток. Антитела, вводимые хозяину при пассивной иммунизации, или антитела, существующие в системе хозяина из предсуществующего врожденного или приобретенного иммунитета, связываются с иммуногеном и запускают эндогенные иммунные ответы. Связывание антитела со связанным с клеткой конъюгатом лиганд-иммуноген приводит к комплемент-опосредованной цитотоксичности, антителозависимой клеточно-опосредованной цитотоксичности, опсонизации антитела и фагоцитозу, к индуцированной антителом кластеризации рецептора, сигнализирующей о гибели клетки или о переходе ее в покоящееся состояние, или к любому другому гуморальному или клеточному иммунному ответу, стимулированному связыванием антитела со связанными с клеткой конъюгатами лиганд-иммуноген. В случаях, когда антиген может быть напрямую распознан иммунными клетками без предварительной опсонизации антитела, может происходить непосредственное уничтожение патогенных клеток. Элиминация чужеродных патогенов или инфицированных или неопластических эндогенных клеток может быть дополнительно усилена путем введения терапевтического фактора, способного стимулировать эндогенный иммунный ответ, агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, цитотоксической иммунной клетки или противомикробного агента. В одном из аспектов цитотоксическая иммуная клетка представляет собой популяцию цитотоксических иммунных клеток, которая выделена, размножена ex vivo, а затем инъецирована обратно животномухозяину. В другом аспекте изобретения используется иммуностимулятор, причем иммуностимулятором может служить интерлейкин, такой как IL-2, IL-12 или IL-15, или интерферон (IFN), такой как IFN-,-3 005823IFN- или IFN-, или GM-CSF. В другом аспекте иммуностимулятором может быть композиция цитокинов, содержащая комбинации цитокинов, таких как IL-2, IL-12 или IL-15 в комбинации с IFN-, IFN-,или IFN-, и GM-CSF, или любую их эффективную комбинацию, или же любую другую комбинацию цитокинов. Еще в одном из аспектов данного изобретения обеспечивается фармацевтическая композиция, содержащая терапевтически эффективные количества конъюгата лиганд-иммуноген, способного специфически связываться с популяцией патогенных клеток в организме животного-хозяина, для промоции специфической элиминации указанных клеток в результате приобретенного или врожденного иммунного ответа, совместного введения антител или непосредственно под действием иммунной клетки у хозяина,терапевтический фактор, выбранный из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, противомикробного агента, цитотоксической иммунной клетки и соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген, и фармацевтически приемлемый носитель. В одном из аспектов фармацевтическая композиция представлена в виде дозировки для парентерального введения с пролонгированным высвобождением. В другом аспекте терапевтический фактор представляет собой иммуностимулятор, содержащий соединение, выбранное из группы, состоящей из интерлейкинов, таких как IL-2, IL-12, IL-15, интерферонов, таких как IFN-, IFN-, или IFN-, и GM-CSF или их комбинации. Подробное описание изобретения Разработаны способы терапевтического лечения животного-хозяина, больного раком, или животного-хозяина, инфицированного патогенными организмами. Результатом применения указанных способов является усиление опосредованной иммунным ответом элиминации патогенных клеточных популяций путем изменения/мечения антигенности патогенных клеток, что приводит к их распознаванию и элиминации иммунной системой хозяина. В указанном способе используется конъюгат лиганд-иммуноген,способный к высокоаффинному связыванию с раковыми клетками или другими патогенными агентами. Высокоаффинное связывание может быть присущим лиганду и оно может быть также модифицировано(усилено) с помощью химически модифицированного лиганда или за счет особой химической связи между лигандом и иммуногеном, которая присутствует в конъюгате. В указанном способе может применяться также комбинированная терапия путем использования конъюгата лиганд-иммуноген и дополнительного терапевтического фактора, способного стимулировать эндогенный иммунный ответ, агента,вызывающего гибель клеток, химиотерапевтического агента, усилителя проникновения в опухоль, цитотоксической иммунной клетки или противомикробного агента для усиления опосредованной иммунным ответом элиминации патогенных клеточных популяций. Способ согласно изобретению используется для усиления опосредованной эндогенным иммунным ответом элиминации популяции патогенных клеток у животного-хозяина, являющегося носителем популяции патогенных клеток. Данное изобретение применимо к популяциям патогенных клеток, которые вызывают различные патологии, такие как рак и инфекционные заболевания. Таким образом, популяция патогенных клеток может быть популяцией раковых клеток, т.е. туморогенных, включая доброкачественные опухоли и злокачественные опухоли, или же она может быть нетуморогенной популяцией клеток. Популяция раковых клеток может возникнуть спонтанно или в результате таких процессов как мутации, возникающие в линии зародышевых клеток животного-хозяина, или соматические мутации, или же они могут быть химически индуцированными, индуцированными вирусами или излучением. Изобретение может быть использовано для лечения таких раковых заболеваний, как карциномы, саркомы, лимфомы, болезнь Ходжкина, меланомы, мезотелиомы, лимфома Беркитта, назофарингеальные карциномы,лейкемии и миеломы. Популяция раковых клеток может включать в себя, не ограничиваясь ими, оральный рак, рак щитовидной железы, эндокринный рак, рак кожи, рак желудка, рак пищевода, рак гортани,рак поджелудочной железы, рак кишечника, рак мочевого пузыря, рак мозга, рак яичника, рак шейки матки, рак матки, рак молочной железы, рак яичка, рак предстательной железы, рак прямой кишки, рак почки, рак печени и рак легкого. Популяция патогенных клеток может также представлять собой экзогенный патоген или клеточную популяцию, несущую экзогенный патоген, например вирус. Настоящее изобретение применимо к таким экзогенным патогенам, как бактерии, грибы, вирусы, микоплазма и паразиты. Инфекционные агенты,которые подлежат лечению в соответствии с настоящим изобретением, представляют собой любые известные инфекционные организмы, которые являются причиной патогенеза у животного, включая такие организмы, как бактерии, которые являются грамотрицательными или грамположительными кокками или бациллами, ДНК- и РНК-вирусами, включая, но не ограничиваясь ими, ДНК-вирусы, такие как вирусы папилломы, парвовирусы, аденовирусы, герпес-вирусы и вирусы коровьей оспы, и РНК-вирусы, такие как аренавирусы, коронавирусы, риновирусы, респираторные синтициальные вирусы, вирусы гриппа,пикорнавирусы, парамиксовирусы, реовирусы, ретровирусы и рабдовирусы. Особый интерес представляют собой бактерии, которые резистентны к антибиотикам, такие как антибиотикрезистентные видыStreptococcus и виды Staphylococcus, или бактерии, которые чувствительны к антибиотикам, но вызыва-4 005823 ют рекуррентные инфекции, которые лечат антибиотиками, и в результате могут возникнуть резистентные организмы. Такие организмы могут быть подвергнуты лечению под действием конъюгатов лигандиммуноген согласно изобретению в комбинации с более низкими дозами антибиотиков, чем те дозы, которые обычно вводятся больному, чтобы избежать развития подобных резистентных к действию антибиотиков бактериальных штаммов. Настоящее изобретение применимо также к любой грибковой инфекции, видам микоплазмы, паразитам или другим инфекционным организмам, которые вызывают заболевание у животных. Примерами грибковых инфекций, которые могут быть подвергнуты лечению с помощью способов согласно настоящему изобретению, включают в себя грибы, которые растут наподобие плесени или подобные дрожжам, включая, например, грибки, которые вызывают такие заболевания, как дерматомикоз, гистоплазмоз, бластомикоз, аспергиллоз, криптококкоз, споротрихоз, кокцидиоидомикоз,паракокцидиоидомикоз и кандидии. Настоящее изобретение может быть использовано для лечения паразитарных инфекций, включая, но не ограничиваясь ими, инфекции, вызываемые соматическими гельминтами, шистосомой, тканевыми аскаридами, амебами и Plasmodium, видами Trypanosoma, Leishmania и Toxoplasma. Паразитами, представляющими особый интерес, являются те, которые экспрессируют фолатные рецепторы и связывают фолат; однако, литература изобилует ссылками на лиганды, обладающие высокой аффинностью к инфекционным организмам. Например, пенициллины и цефалоспорины, известные своей антибиотической активностью и специфическим связыванием с предшественниками бактериальной клеточной стенки, могут сходным образом быть использованы в качестве лигандов для получения конъюгатов лиганд-иммуноген для применения в соответствии с настоящим изобретением. Конъюгаты лиганд-иммуноген согласно изобретению могут быть направлены также на клеточную популяцию, несущую эндогенные патогены, где патоген-специфические антигены преимущественно экспрессированы на поверхности клеток, несущих указанные патогены, и действовать в качестве рецепторов для лиганда с лиганд-специфическим связыванием с антигеном. Способ согласно изобретению может быть использован как в клинической медицине для лечения человека, так и в ветеринарии. Таким образом, животные-хозяева, являющиеся носителями популяции патогенных организмов и леченые конъюгатами лиганд-иммуноген, могут быть человеком или, в случае применений в ветеринарной практике, могут быть лабораторными, сельскохозяйственными, домашними или дикими животными. Данное изобретение может быть применимо к животным-хозяевам, включая в их число, но ими не ограничиваясь, человека, лабораторных животных, таких как грызуны (например, мыши, крысы, хомяки и т.д.), кролики, обезьяны, шимпанзе, домашние животные, такие как собаки, кошки и кролики, сельскохозяйственные животные, такие как коровы, лошади, свиньи, овцы, козы, и дикие животные в неволе, такие как медведи, панды, львы, тигры, леопарды, слоны, зебры, жирафы, гориллы, дельфины и китообразные. Конъюгаты лиганд-иммуноген предпочтительно вводятся животному-хозяину парентерально, например интрадермально, подкожно, внутримышечно или внутривенно. Альтернативно, конъюгат может быть введен животному-хозяину другими используемыми в медицине способами и в любой эффективной дозе и соответствующей терапевтической лекарственной форме, включая лекарственные формы с пролонгированным высвобождением, которые также могут быть использованы. Способ согласно изобретению может применяться в комбинации с хирургическим удалением опухоли, с радиационной терапией,химиотерапией или в сочетании с биологическими методами терапии, такими как другие способы иммунотерапии, включая в их число, но ими не ограничиваясь, терапию моноклональными антителами, лечение с помощью иммуномодулирующих агентов, адоптивный перенос иммунных эффекторных клеток,лечение с помощью гематопоэтических факторов роста, цитокинов, а также вакцинации. В соответствии с настоящим изобретением, конъюгаты лиганд-иммуноген могут быть выбраны из широкого разнообразия лигандов и иммуногенов. Лиганды должны быть способны к специфической элиминации популяции патогенных клеток в организме животного-хозяина за счет преимущественной экспрессии рецептора этого лиганда на поверхности патогенных клеток, доступного для связывания лиганда. Приемлемые лиганды включают в себя фолиевую кислоту, аналоги фолиевой кислоты и другие молекулы, связывающиеся с рецептором фолата, другие витамины, пептидные лиганды, идентифицируемые на основе скрининга библиотек, опухолеспецифические пептиды, опухолеспецифические аптамеры, опухолеспецифические углеводы, опухолеспецифические моноклональные или поликлональные антитела, Fab- или scFv (т.е. одноцепочечная вариабельная область) фрагменты или антитела, такие, например, как Fab-фрагменты антитела, направленного на ЕрnА 2 или другие белки, специфически экспрессируемые или доступные исключительно на поверхности метастатических раковых клеток, малые органические молекулы, полученные из комбинаторных библиотек, факторы роста, такие как EGF, FGF, инсулин и инсулиноподобные факторы роста, и гомологичные полипептиды, соматостатин и его аналоги,трансферрин, липопротеиновые комплексы, желчные соли, селектины, стероидные гормоны, пептиды,содержащие Arg-Gly-Asp, ретиноиды, различные галектины, лиганды -опиоидных рецепторов, лиганды рецепторов холецистокинина А, лиганды, специфические в отношении рецепторов ангиотензина AT1 или АТ 2, лиганды -рецептора, активируемого пролифератором пероксисом, -лактамные антибиотики,малые органические молекулы, включая противомикробные лекарственные средства, и другие молекулы,-5 005823 которые специфически связываются с рецептором, преимущественно экспрессируемым на поверхности опухолевых клеток или инфекционных организмов, или фрагменты любых из указанных молекул. Представляющими интерес в случае лигандов, которые связываются с инфекционными организмами, являются любые молекулы, такие как антибиотики или другие лекарственные средства, которые известны своей способностью предпочтительного связывания с микроорганизмом. Данное изобретение приложимо также к лигандам, которые являются молекулами, такими как противомикробные лекарственные средства,сконструированные таким образом, чтобы они могли встроиться в связывающий карман отдельного рецептора, на основе кристаллографической структуры этого рецептора, или другого белка клеточной поверхности, и где такие рецепторы преимущественно экспрессированы на поверхности опухолей, бактерий, вирусов, микоплазм, грибков, паразитов или других патогенов. В предпочтительном варианте данного изобретения также подразумевается, что могут быть использованы лиганды, связывающиеся с любыми опухолевыми антигенами или другими молекулами, преимущественно экспрессируемыми на поверхности опухолевых клеток. Сайт связывания лиганда может включать в себя рецепторы для любой молекулы, способной специфически связываться с рецептором, где рецептор или другой протеин преимущественно экспрессирован на популяции патогенных клеток, включая, например, рецепторы к факторам роста, витаминам, пептидам, включая опиоидные пептиды, гормонам, антителам, углеводам и малым органическим молекулам. Связывающий сайт может быть также сайтом связывания для любой молекулы, такой как антибиотик или другое лекарственное средство, где указанный сайт отличается тем, что он преимущественно представлен на микроорганизмах. Например, обсуждаемыми сайтами связывания могут быть сайты связывания -лактамных антибиотиков, таких как пенициллин, в клеточной стенке бактерий, или сайты связывания противовирусного агента, исключительно представленные на поверхности вируса. Данное изобретение также приложимо к сайтам связывания лигандов, таких как противомикробные лекарственные средства, сконструированные таким образом, чтобы встроиться в связывающий сайт рецептора, на основе кристаллографической структуры этого рецептора, и где такой рецептор преимущественно экспрессирован на поверхности патогенных клеток или организмов. Подразумевается также, что в способе согласно изобретению опухолеспецифические антигены могут функционировать в качестве связывающих сайтов для лигандов. Примером опухолеспецифического антигена, который может функционировать в качестве связывающего сайта для конъюгатов лиганд-иммуноген, является внеклеточный эпитоп белков-членов эфринового семейства белков, таких как EphA2. Экспрессия ЕрhА 2 в нормальных клетках ограничена межклеточными контактами, но на опухолевых метастатических клетках EphA2 распределен по всей клеточной поверхности. Таким образом, EphA2 на метастатических клетках должен быть доступен для связывания, например, с Fab-фрагментом антитела, конъюгированного с иммуногеном, в то время как этот протеин не должен быть доступен для связывания с Fab-фрагментом на поверхности нормальных клеток, и результатом этого является то, что конъюгат лиганд-иммуноген является специфическим для метастатических раковых клеток. Кроме того, в данном изобретении подразумевается применение комбинаций конъюгатов лиганд-иммуноген с тем, чтобы максимизировать нацеливание на патогенные клетки, чтобы добиться их элиминации в результате врожденного или приобретенного иммунного ответа или под действием совместно вводимых антител. Приемлемыми иммуногенами для применения в настоящем изобретении являются иммуногены, которые способны вызвать продукцию антител у животного-хозяина или которые прежде вызывали у животного-хозяина продукцию антител, в результате чего возник предсуществующий иммунитет, или которые составляют часть системы врожденного иммунитета. Альтернативно, антитела, направленные против иммуногена, могут быть введены животному-хозяину для установления пассивного иммунитета. Подходящие для применения в данном изобретении иммуногены включают в себя антигены или антигенные пептиды, против которых был развит предсуществующий иммунитет в результате проводимых в норме плановых вакцинаций или прежнего естественного контакта с такими агентами, как антигены полиовируса, столбняка, тифа, краснухи, кори, эпидемического паротита, коклюша, туберкулеза и гриппа,и -галактозильные группы. В таких случаях конъюгаты лиганд-иммуноген будут использованы для того, чтобы направить ранее приобретенный гуморальный или клеточный иммунитет на популяцию патогенных клеток в организме животного-хозяина на элиминацию чужеродных клеток или патогенных организмов. Остальные подходящие иммуногены включают в себя антигенные пептиды, в ответ на которые у животного-хозяина развился новый иммунитет в результате иммунизации против неприродного антигена или гаптена (например, флуоресцеина изотиоцианата или динитрофенила), и антигены, против которых существует врожденный иммунитет (например, суперантигены и дипептид мурамила). Лиганды и иммуногены согласно изобретению могут быть конъюгированы с помощью любого известного в данной области метода формирования комплекса. Это может включать в себя ковалентное,ионное или водородное связывание лиганда с иммуногеном либо напрямую, либо непрямым образом через связывающую группу, такую как двухвалентный линкер. Обычно конъюгат образуется в результате ковалентного связывания лиганда с иммуногеном через образование амидных, сложноэфирных или иминосвязей между кислотой, альдегидом, гидроксигруппой, аминогруппой или группой гидразона на-6 005823 соответствующих компонентах комплекса. В предпочтительном воплощении данного изобретения лигандом является фолиевая кислота, аналог фолиевой кислоты или любая другая связывающаяся с фолатным рецептором молекула, а фолатный лиганд конъюгирован с иммуногеном посредством процедуры, в которой используется трифторуксусный ангидрид для получения -эфиров фолиевой кислоты через птероилазидное промежуточное соединение. В результате этой предпочтительной процедуры происходит синтез фолатного лиганда, конъюгированного с иммуногеном только посредством -карбоксигруппы фолатных групп глутаминовой кислоты, где -конъюгат связывается с фолатным рецептором с высокой аффинностью, дающей возможность образования смесей -конъюгата и -конъюгата. Альтернативно,чистые -конъюгаты могут быть получены из промежуточных соединений, в которых -карбоксигруппа селективно блокирована, -конъюгат сформирован, а -карбоксигруппа впоследствии деблокирована с помощью известных в данной области методов органического синтеза и процессов. Также успешно могут быть использованы и другие витамины в качестве лигандов для получения конъюгатов в соответствии с данным изобретением. Например, конъюгаты лиганд-иммуноген могут быть образованы с биотином и рибофлавином, так же как и с фолатом (cм. патенты США под номерами 5,108,921, 5,416,016, и 5,635,382, включенные в данное описание в виде ссылки). Конъюгаты лиганд-иммуноген согласно изобретению усиливают опосредованную эндогенным иммунным ответом элиминацию популяции патогенных клеток. Эндогенный иммунный ответ может включать в себя гуморальный ответ, клеточно-опосредованный иммунный ответ и любой другой иммунный ответ, эндогенный для организма животного-хозяина, включая опосредованный комплементом лизис клеток, антителозависимую клеточно-опосредованную цитотоксичность (ADCC), опсонизацию антител,ведущую к фагоцитозу, кластеризацию рецепторов при связывании антител, ведущую в результате к сигналу апоптоза, антипролиферации или дифференцировки, и прямое распознавание иммунной клеткой доставленного антигена/гаптена. Также подразумевается, что в эндогенном иммунном ответе будет использована секреция цитокинов, которая регулирует такие процессы, как размножение и миграция иммунных клеток. Эндогенный иммунный ответ может включать в себя участие таких типов иммунных клеток, как В-клетки, Т-клетки, включая хелперные и цитотоксические Т-клетки, макрофаги, природные киллеры, нейтрофилы, LAK-клетки и им подобные. Гуморальный иммунный ответ может быть ответом, индуцированным такими процессами, как нормальная плановая вакцинация или активная иммунизация природным антигеном, или неприродным антигеном, или гаптеном (например, флуоресцеинизотиоцианатом), неприродным антигеном, индуцирующим новый иммунитет. Активная иммунизация включает в себя множество инъекций неприродного антигена или гаптена, вводимых по схеме, помимо нормальной плановой вакцинации, для индукции нового иммунитета. Гуморальный ответ может также быть результатом врожденного иммунитета, когда животное-хозяин обладает предсуществующим природным иммунитетом, таким как иммунитет к галактозильным группам. Альтернативно, пассивный иммунитет может быть установлен путем введения животному-хозяину антител, таких как природные антитела, полученные из сыворотки, или моноклональные антитела, которые могут быть, а могут и не быть, антителами, полученными генно-инженерным путем, включая гуманизированные антитела. Использование конкретного количества антительного реагента для развития пассивного иммунитета и использование конъюгатов лиганд-иммуноген, где пассивно вводимые антитела направлены на иммуноген, должно обеспечить преимущество стандартного набора реагентов для использования в тех случаях, когда предсуществующий титр антител пациента к другим потенциальным антигенам терапевтически бесполезен. Пассивно вводимые антитела могут быть "вводимыми совместно" с конъюгатом лиганд-иммуноген, а совместное введение определяется как введение антител до, одновременно или после введения конъюгата лиганд-иммуноген. Подразумевается, что предсуществующие антитела, индуцированные антитела или пассивно вводимые антитела будут направлены на опухолевые клетки или инфекционные организмы в результате преимущественного связывания конъюгатов лиганд-иммуноген с этими инвазирующими клетками или организмами, и что патогенные клетки будут уничтожаться в результате комплемент-опосредованного лизиса, ADCC, антителозависимого фагоцитоза или антительной кластеризации рецепторов. Цитотоксический процесс может также включать в себя и другие типы иммунных ответов, таких как клеточноопосредованный иммунитет, а также вторичные иммунные ответы, которые возникают, когда привлеченные антигенпредставляющие клетки фагоцитируют нежелательные клетки и представляют природные опухолевые антигены или антигены чужеродных патогенов иммунной системе для элиминации клеток или организмов, несущих эти антигены. По меньшей мере одна дополнительная композиция, включающая в себя терапевтический фактор,может быть введена хозяину в качестве адъюванта или в комбинации с описанной выше методологией,чтобы усилить опосредованную иммунным ответом элиминацию популяции патогенных клеток, или же может быть введен более чем один дополнительный терапевтический фактор. Терапевтический фактор может быть отобран из соединения, способного стимулировать эндогенный иммунный ответ, химиотерапевтического агента, противомикробного агента или другого терапевтического фактора, способного дополнять эффективность вводимого комплекса лиганд-иммуноген. Способ согласно изобретению мо-7 005823 жет быть предпринят путем введения хозяину, помимо описанных выше конъюгатов, соединений или композиций, способных стимулировать эндогенный иммунный ответ, включая, но не ограничиваясь ими,цитокины или факторы роста иммунных клеток, такие как интерлейкины 1-18, фактор стволовых клеток,основный FGF, EGF, G-CSF, GM-CSF,- FLK-2-лиганд, HILDA, MIP-1, TGF-, TGF-, M-CSF, IFN-,IFN-, IFN-, растворимый CD23, LIF и их комбинации. Терапевтически эффективные комбинации указанных цитокинов могут быть использованы также. В предпочтительном воплощении данного изобретения, например, терапевтически эффективные количества IL-2, например, в количествах, варьирующих приблизительно от 5000 МЕ/дозу/день до 500000 МЕ/дозу/день в режиме многократного суточного приема, и IFN-, например, в количествах, варьирующих приблизительно от 7500 МЕ/дозу/день до 150000 МЕ/дозу/день в режиме многократного суточного приема, используются вместе со связанным с фолатом флуоресцеинизотиоцианатом для элиминации патогенных клеток в организме животного-хозяина, несущего такую популяцию клеток. В другом предпочтительном воплощении IL-12 и IFN- используются в терапевтически эффективных количествах, а еще в одном предпочтительном воплощении IL-15 и IFN- используются в терапевтически эффективных количествах. В альтернативном предпочтительном воплощении IL-2, IFN- или IFN- и GM-CSF используются в комбинации. Предпочтительно, если используемый терапевтический фактор(ы), такой как IL-2,IL-12, IL-15, IFN-, IFN- и GM-CSF, включая их комбинации, активирует(ют) природные клеткикиллеры и/или Т-клетки. Альтернативно, терапевтический фактор или комбинации терапевтических факторов, включая интерлейкин в комбинации с интерфероном и GM-CSF, могут активировать другие иммунные эффекторные клетки, такие как макрофаги, В-клетки, нейтрофилы, LAK-клетки и им подобные. В изобретении также предполагается применение любой другой эффективной комбинации цитокинов,включая комбинации других интерлейкинов и интерферонов и колониестимулирующих факторов. Химиотерапевтические агенты, которые сами по себе являются цитотоксическими и могут действовать в качестве агентов, усиливающих проникновение в опухоль, подходящие для применения в способе согласно изобретению, включают в себя аденокортикоиды, алкилирующие агенты, антиандрогены, антиэстрогены, андрогены, эстрогены, антиметаболиты, такие как цитозинарабинозид, пуриновые аналоги,пиримидиновые аналоги, и метотрексат, бусульфан, карбоплатин, хлорамбуцил, цисплатина и другие соединения платины, тамоксифен, таксол, циклофосфамид, растительные алкалоиды, преднизон, гидроксимочевина, тенипозид, антибиотики, такие как митомицин С и блеомицин, азотистый иприт, нитрозомочевина, винкристин, винбластин, воспалительные и провоспалительные агенты, и любой другой из известных в данной области химиотерапевтических агентов. Другие терапевтические агенты, которые могут быть введены в качестве адъювантов при введении конъюгатов согласно изобретению, включают в себя пенициллины, цефалоспорины, ванкомицин, эритромицин, клиндамицин, рифампин, хлорамфеникол, аминогликозиды, гентамицин, амфотерицин В, ацикловир, трифлуридин, ганцикловир, зидовудин,амантадин, рибавирин и любое другое из известных в данной области противомикробных соединений. Элиминация популяции патогенных клеток влечет за собой снижение или элиминацию массы опухоли или патогенных организмов, в чем и выражается терапевтический эффект. В случае опухоли, элиминация может быть элиминацией клеток первичной опухоли или клеток, которые метастазировали, или клеток на стадии диссоциации от первичной опухоли. Профилактическое лечение с целью предотвращения возврата опухоли после ее устранения в результате любого лечения, включая хирургическое удаление опухоли, лучевую терапию, химиотерапию или биологическую терапию, также подразумевается в настоящем изобретении. Под профилактическим лечением может подразумеваться первоначальное лечение конъюгатами лиганд-иммуноген, такое как лечение в режиме многократных суточных доз, и/или оно может подразумевать дополнительное лечение или серию курсов лечения с интервалом в несколько дней или месяцев после первоначального лечения (лечений). Настоящее изобретение направлено также и на фармацевтические композиции, содержащие количество конъюгата лиганд-иммуноген, которое эффективно для "мечения" популяции патогенных клеток у животного-хозяина с целью специфической элиминации под действием эндогенного иммунного ответа или совместно вводимых антител. Композиция, кроме того, содержит количество дополнительного фактора, эффективного для усиления элиминации патогенных клеток, выбранных из группы, состоящей из агента, вызывающего гибель клеток, усилителя проникновения в опухоль, химиотерапевтического агента, противомикробного агента, цитотоксической иммунной клетки и соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лигандиммуноген. Фармацевтическая композиция содержит терапевтически эффективные количества конъюгата лиганд-иммуноген и терапевтический фактор, и этот фактор может содержать цитокин, такой как IL-2,IL-12 или IL-15, или комбинацию цитокинов, включая IL-2, IL-12 или IL-15, и интерфероны, такие какIFN- или IFN-, и комбинации интерферонов, интерлейкинов и колоннестимулирующих факторов, таких как GM-CSF. Используемая суточная доза конъюгата лиганд-иммуноген может существенно варьировать, в зависимости от состояния животного-хозяина, статуса заболевания, подлежащего лечению, молекулярной массы конъюгата, пути его введения и тканевого распределения, и возможности совместного применения-8 005823 других терапевтических приемов лечения, таких как радиационная терапия. Эффективное количество,вводимое больному, берется с учетом площади поверхности тела, массы больного и оценки физического состояния больного. Эффективная доза может колебаться приблизительно от 1 нг/кг до 1 мг/кг, более предпочтительно приблизительно от 1 до 500 мкг/кг и наиболее предпочтительно приблизительно от 1 до 100 мкг/кг. Может быть использован любой эффективный режим введения конъюгата лиганд-иммуноген и терапевтического фактора для переориентировки предсуществующих антител на опухолевые клетки или инфекционные организмы, или для индукции гуморального иммунного ответа на иммуноген. Например,конъюгат лиганд-иммуноген и терапевтический фактор могут быть введены в виде единичной дозы или могут быть разделены на части и вводиться в режиме многократного суточного введения. Кроме того, в качестве альтернативы суточному введению может быть применен колеблющийся (изменяющийся) режим, например, от одного до трех дней в неделю, и для целей, определяющих данное изобретение, такой переменный (пульсирующий) или колеблющийся суточный режим считается эквивалентным ежедневному введению и входящим в объем защиты настоящего изобретения. В предпочтительном воплощении данного изобретения животному-хозяину многократно вводят инъекции конъюгата лиганд-иммуноген и терапевтического фактора для элиминации популяции патогенных клеток. В одном из воплощений животному-хозяину инъекции конъюгата лиганд-иммуноген вводят многократно (предпочтительно приблизительно от 2 вплоть до 50 раз), например, с интервалами от 12 до 72 ч или с интервалами от 48 до 72 ч. Дополнительные инъекции конъюгата лиганд-иммуноген могут быть введены больному с интервалом,насчитывающим дни или месяцы с момента первоначальной инъекции (инъекций), и эти дополнительные инъекции препятствуют повторному проявлению заболевания. Альтернативно, первоначальная инъекция (инъекции) конъюгата лиганд-иммуноген может предотвращать повторное проявление заболевания. Терапевтический фактор может быть введен животному-хозяину до, после или одновременно с конъюгатом лиганд-иммуноген и терапевтический фактор может быть введен в виде составляющей той же самой композиции, содержащей конъюгат, или в составе иной композиции, нежели композиция конъюгата лиганд-иммуноген. Любая такого рода терапевтическая композиция, содержащая терапевтический фактор в терапевтически эффективной дозе, может быть использована при воплощении данного изобретения. Кроме того,могут быть использованы конъюгаты лиганд-иммуноген более чем одного вида. Например, животноехозяин может быть преиммунизировано флуоресцеинизотиоцианатом и динитрофенилом, а затем флуоресцеинизотиоцианатом и динитрофенилом, связанными с одним и тем же или различными лигандами,согласно прописи совместного дозирования. В случае химиотерапевтического и противомикробного агентов, терапевтический фактор может быть введен в субоптимальной дозе вместе с конъюгатом лиганд-иммуноген в комбинационной терапии, чтобы избежать развития у животного-хозяина резистентности к химиотерапевтическому или противомикробному агентам. Конъюгат лиганд-иммуноген и терапевтический фактор предпочтительно вводят в виде парентеральной инъекции, и такие инъекции могут представлять собой внутрибрюшинные инъекции, подкожные инъекции, внутримышечные инъекции, внутривенные инъекции или внутритрахеальные инъекции. Доставка конъюгата лиганд-иммуноген и терапевтического фактора может также осуществляться с помощью медленного насоса. Примеры парентеральных лекарственных форм включают в себя водные растворы активного агента в изотоническом солевом растворе, 5% глюкозе или же других хорошо известных фармацевтически приемлемых жидких носителях, таких как жидкие спирты, гликоли, сложные эфиры и амиды. Парентеральная лекарственная форма согласно изобретению может быть представлена в виде восстанавливаемого лиофилизата, содержащего дозу конъюгата лиганд-иммуноген и терапевтического фактора. В одном из предпочтительных воплощений данного изобретения может быть введена любая из многочисленных лекарственных форм пролонгированного высвобождения, известных в данной области, например биодеградируемые углеводные матриксы, описанные в патентах США под номерами 4,713,249; 5,266,333 и 5,417,982, описания которых включены в настоящее описание в виде ссылки. Пример 1. Влияние конъюгатов флотат-флуоресцеин-изотиоцианат на выживаемость мышей с имплантатами опухоли легкого. Шести-восьминедельных самок мышей Balb/c (весом приблизительно 20-22 г) иммунизировали подкожно путем многократного обкалывания бычьим сывороточным альбумином (BSA), меченным флуоресцеинизотиоцианатом (FITC), с использованием коммерчески доступного адъюванта (например,адъюванта Фрейнда или Max-Gold). После установления того факта, что титры анти-FITC-антитела достаточно высоки у всех мышей (что доказывается результатами анализа ELISA образцов сыворотки мышей), каждому животному путем внутрибрюшинных инъекций вводили 5105 клеток М 109, сингенной линии клеток рака легкого, которая экспрессирует высокие уровни фолатного рецептора. Затем раковым клеткам, веденным в отдельные локусы, предоставляли возможность достичь слияния друг с другом и последующего роста. На 4 и 7 дни после имплантации раковых клеток всех животных внутрибрюшинно инъецировали либо забуференным физиологическим раствором (PBS), либо соответствующим количеством FITC, конъюгированного с фолиевой кислотой посредством связанного с гамма-9 005823 карбоксилом этилендиаминового мостика. Концентрации инъецированного конъюгата фолат-FITC составляли 0 (контроль PBS), 4,5, 45, 450 и 4500 нмоль/кг, причем каждую из указанных концентраций конъюгата фолат-FITC вводили путем инъекции 8 мышам в группе, а общее количество инъецированных мышей составило 40 животных. Затем всем мышам вводили серию пятидневных инъекций (дни с 8-го по 12-й) из 5000 ME рекомбинантного человеческого IL-2 в порядке стимуляции иммунной системы. Эффективность такой иммунотерапии затем оценивали путем мониторинга выживаемости как функции от времени у мышей, обработанных конъюгатом фолат-FITC, по сравнению с контрольными животными. Как показано на фиг. 1, средняя выживаемость мышей, обработанных конъюгатом фолат-FITC, носила дозозависимый характер, при этом средняя выживаемость мышей в контрольной группе составила 23 дня после имплантации опухоли, а выживаемость мышей, обработанных конъюгатом фолат-FITC, существенно возрастала по мере увеличения вводимой дозы конъюгата. Уже доза 45 нмоль/кг конъюгата фолат-FITC оказалась способной вызывать долговременное выживание мышей, при этом эффективность возрастала пропорционально увеличению доз конъюгата. Несмотря на то что было показано, что конъюгат фолат-FITC концентрируется в опухолях, некоторое количество конъюгата фолат-FITC обнаруживалось также в ткани почек (однако в количествах, не сравнимых с уровнями, наблюдаемыми в нормальных тканях). Не было обнаружено какого-либо токсического эффекта в отношении почечной ткани или ткани других нормальных органов при аутопсии, проводимой квалифицированными патологоанатомамиветеринарами. Пример 2. Получение сравнительных изображений нормальных и опухолевых тканей с помощью конъюгатов фолат-флуоресцеинизотиоцианат. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что животных инъецировали опухолевыми клетками 24JK-FBP, а умерщвляли мышей вскоре после того, как инъецировали комплексом фолат-FITC, и из тканей делали тонкие срезы, которые затем изучали методом FITC-иммунофлуоресценции с помощью конфокальной флуоресцентной микроскопии с целью определения локализации комплекса фолат-FITC в определенных тканях, включая почки, печень и мышечные ткани. На фиг. 2 показаны микрографические фазово-контрастные изображения срезов различных тканей в качестве контролей вместе с флуоресцентными микрографическими изображениями. Комплексы фолат-FITC обнаруживались в основном локализованными в опухолевой ткани и в клетках проксимальных почечных канальцев, которые исключительно изобилуют рецепторами фолиевой кислоты. Пример 3. Получение изображений опухолевой ткани с помощью фолата, конъюгированного с флуоресцеинизотиоцианатом, или с помощью меченного фикоэритрином антимышиного козьего IgG. Использованные методики подобны тем, которые описаны в примере 2, за исключением того, что были использованы клетки М 109, а ткани изучали методами FITC-флуоресценции (зеленые изображения) и фикоэритрин (РЕ)-флуоресценции (красные изображения). В случае РЕ-флуоресценции флуоресцентная метка была связана с козьими антимышиными IgG-антителами для использования при определении связывания эндогенных мышиных aнти-FITC-антител с конъюгатами фолат-FITC, которые аккумулируются на опухолевых клетках. Сравнивали опухолевые ткани, обработанные и не обработанные конъюгатами фолат-FITC, при этом оба типа образцов изучали методом фазово-контрастнной микроскопии, как описано в примере 2. С помощью FITC-флуоресценции выявили локализацию конъюгатов фолат-FITC на опухолевых тканях (фиг. 3). Методом РЕ-флуоресценции показали, что эндогенные мышиные aнти-FITC-антитела связываются с конъюгатами фолат-FITC, локализованными на опухолевых клетках. Другие исследования (не показаны) продемонстрировали отсутствие такого IgG-связывания с нормальными тканями, включая почечную ткань. Отсутствие связывания антител с конъюгатами фолатFITC, локализованными в почечных тканях, следует из того факта, что если рецептор фолата находится на апикальной мембране клеток проксимальных канальцев почек, антитела не имеют доступа к этой области почек. Фазово-контрастные изображения (переданные изображения) показывают морфологию обработанных и необработанных опухолевых тканей, выявляя гибель клеток в образцах обработанных опухолевых тканей. Пример 4. Влияние конъюгатов фолат-флуоресцеинизотиоцианат на рост солидных опухолей. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что каждого животного подкожно инъецировали в область плеча клетками М 109 в количестве 1106 (день 0) после первой иммунизации флуоресцеинизотиоцианатом (FITC). Иммунизацию комплексом фолат-FITC после имплантации опухолевых клеток производили в количестве 1500 нмоль/кг комплекса фолат-FITC,вводимого в составе 6 внутрибрюшинных доз с интервалом в 48 ч (дни 7, 9, 11, 13, 15 и 17). Полученные в результате солидные опухоли плеча измеряли и определяли процент увеличения размера опухолей. Кривые роста опухолей, представленные на фиг. 4, показывают, что рост солидных опухолей был в значительной степени ингибирован, когда животных обрабатывали комплексом фолат-FITC в комбинации сIL-2. Пример 5. Эффект обработки комбинациями цитокинов. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что животных в течение 5 дней (дни с 8-го по 12-й) обрабатывали инъекциями, содержавшими 5000 ME ре- 10005823 комбинантного человеческого IL-2 вместе либо с IFN- (5 инъекций в день, по 2,5104 Ед./день), либо сIL-12 (5 инъекций в день, по 0,5 мкг/день), либо с TNF- (3 инъекции в дни 8, 10 и 12 по 2 мкг/день), затем инъецированием 2 доз по 1500 нмоль/кг комплекса фолат-FITC или аминофлуоресцеина в дни 4-й и 7-й после имплантации опухолевых клеток. Более того, в попытках сократить время, необходимое для получения данных по продолжительности срока выживаемости, опухолевые клетки имплантировали внутрибрюшинно вблизи от печени. Следовательно, продолжительность жизни мышей-опухоленосителей в целом была сокращена по сравнению с таковой, показанной в примере 1. Результаты, приведенные на фиг. 5, показывают, что IL-2 сам по себе был более эффективным в промоции продолжительности срока выживаемости животных, чем комбинированная обработка IL-2 и IL-12 или IL-2 и TNF-. И наоборот, комбинированная обработка IL-2 и IFN- оказалась более эффективной в промоции продолжительности срока выживаемости животных, чем обработка одним только IL-2. Аминофлуоресцеин инъецировали вместе с различными комбинациями цитокина в качестве контроля, поскольку это соединение не связано с фолатом и, следовательно, не будет осуществлять переориентировку антифлуоресцеиновых антител на опухолевые клетки. Пример 6. Влияние многократных инъекций конъюгатов фолат-флуоресцеинизотиоцианат. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что животных внутрибрюшинно инъецировали с интервалом в 48 ч (дни 7, 9, 11, 13, 15 и 17 после имплантации опухолевых клеток) 1500 нмоль/кг комплекса фолат-FITC. Результаты показывают (фиг. 6), что многократные инъекции комплексом фолат-FITC способствуют увеличению продолжительности срока выживаемости животных, обработанных комплексом фолат-FITC и IL-2, по сравнению со случаем, когда 2 инъекции комплекса фолат-FITC назначали в дни 4-й и 7-й после имплантации опухолевых клеток. Пример 7. Синергический эффект конъюгатов фолат-флуоресцеинизотиоцианат и IL-2. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что животных инъецировали 1500 нмоль/кг комплекса фолат-FITC, а некоторых животных обрабатывали либо комплексом фолат-FITC, либо отдельно IL-2. Кроме того, опухолевые клетки имплантировали внутрибрюшинно, как описано в примере 5. Этот эксперимент (см. фиг. 7) был предпринят для определения того, является ли действие комплекса фолат-FITC и IL-2 синергическим в промоции продолжительности срока выживаемости мышей-опухоленосителей. Средние времена выживаемости в контрольной группе (n = 8) и в группах (n = 8), обработанных IL-2, комплексом фолат-FITC или комплексом фолат-FITC + IL-2, составляли 18, 19, 22 и 42 дня соответственно. Результаты, приведенные на фиг. 7, показывают, что способность комплекса фолат-FITC и IL-2 вызывать промоцию продолжительности срока выживаемости мышей-опухоленосителей строго синергична, при этом IL-2 как таковой в низких дозах, в отсутствие комплекса фолат-FITC, обладает отрицательным эффектом на выживаемость мышей, тогда как комплекс фолат-FITC влияет на этот показатель лишь незначительно. Пример 8. Вовлечение NK-клеток в синергический эффект конъюгатов фолат-флуоресцеинизотиоцианат и IL-2. Использованные методики подобны тем, которые описаны в примере 7, за исключением того, что группу животных обрабатывали поликлональными кроличьими антителами (Аb) против NK-клеток мыши (антиасиало-GMI; Wako Pure Chemical Industries, Ltd., Richmond, Va.) в комбинации с комплексом фолат-FITC и IL-2. Каждую мышь инъецировали 0,2 мл разведенного 1:10 маточного раствора антитела в 1, 4, 9 и 14 дни после имплантации опухоли с тем, чтобы достичь истощения NK-клеток. Средние времена выживаемости в контрольной группе животных и в группах животных, обработанных комплексом фолат-FITC + IL-2 или комплексом фолат-FITC + IL-2 + -NK-Ab, составляли 18, 42 и 18,5 дней соответственно. Результаты, приведенные на фиг. 8, свидетельствуют о том, что NK-клетки опосредуют синергическое увеличение продолжительности срока выживаемости мышей-опухоленосителей, вызванное комбинированной обработкой комплексом фолат-FITC и IL-2. Пример 9. Развитие клеточного иммунитета против опухолевых клеток M109. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животные были инъецированы PBS (контроль) или были инъецированы совместно комплексом фолат-FITC(1500 нмоль/кг), IL-2 (250000 МЕ/дозу) и IFN- (25000 Ед./дозу) на 7, 8, 9, 11 и 14 дни после имплантации опухолевых клеток. Кроме того, животных сенсибилизировали путем инъецирования им 5105 клеток M109 на 62 день после первоначальной имплантации опухолевых клеток, путем инъецирования 1,5106 клеток М 109 на 96 день после первоначальной имплантации опухолевых клеток, или путем инъецирования 2,5105 клеток линии 1 (мыши Ва 1b/с, спонтанная карцинома легких) на 127 день после первоначальной имплантации опухолевых клеток. Как показано на фиг. 9, средняя продолжительность срока выживаемости у контрольных мышей,которым инъецировали 5105 клеток М 109, составила 18,5 дней. Средняя продолжительность срока выживаемости контрольных мышей, которым инъецировали 1,5106 клеток М 109, составила 18 дней. Средняя продолжительность срока выживаемости контрольных мышей, которым инъецировали 2,5105 клеток линии 1, составила 23,5 дней. Средняя продолжительность срока выживаемости контрольных- 11005823 мышей, которым инъецировали 5105 клеток М 109 и которых обрабатывали комплексом фолат-FITC в комбинации с IL-2 и IFN-, и которых также сенсибилизировали путем введения 5105 клеток M109 на 62-й день, сенсибилизировали клетками M109 в количестве 1,5106 на 96-й день и сенсибилизировали клетками линии 1 в количестве 2,5105 на 127-й день, составила свыше 192 дней. Результаты, приведенные на фиг. 9, свидетельствуют о развитии долговременного, специфического в отношении определенного типа клеток клеточного иммунитета у животных, обработанных комплексом фолат-FITC в сочетании с IL-2 и IFN-. Этот долговременный иммунитет защищал животных, которым были имплантированы клетки M109 и которые получали нацеленную на фолат иммунотерапию, от повторного проявления заболевания при сенсибилизации этих животных последующим инъецированием клетками М 109. Срок выживаемости таких животных после последней сенсибилизации клетками линии 1, возможно, из-за присутствия фолатных рецепторов на поверхности клеток линии 1 в меньшем количестве, чем на клетках M109, и при наличии опухолевых антигенов, распределенных между клетками M109 и клетками линии 1, приводящее к развитию М 109-специфического клеточного иммунного ответа, дающего возможность осуществлять перекличку с клетками линии 1. Пример 10. Эффект дозы IL-2 на срок выживаемости мышей, обработанных конъюгатами фолатфлуоресцеинизотиоцианат. Использованные методики подобны тем, которые описаны в примере 1, за исключением того, что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животные были инъецированы PBS (контроль) или были инъецированы совместно комплексом фолат-FITC(100 х) на 7, 8, 9, 11 и 14 дни после имплантации опухолевых клеток. Кроме того, животных иммунизировали FITC-меченным гемоцианином моллюска (KLH) вместо FITC-меченного BSA. Как показано на фиг. 10, средняя продолжительность срока выживаемости мышей, которым имплантировали клетки M109 и которые были обработаны комплексом фолат-FITC, возрастала с увеличением дозы IL-2 выше дозы IL-2 в 5103 ME. И наоборот, никаких существенных изменений не было отмечено между средней продолжительностью срока выживаемости контрольных мышей (мыши, которым инъецировали клетки M109 и которых обрабатывали PBS) и мышей, обработанных только лишь IL-2. Пример 11. Повышение под действием IFN- срока выживаемости мышей, обработанных конъюгатами фолат-флуоресцеинизотиоцианат и IL-2. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животные были инъецированы PBS (контроль) или были инъецированы совместно комплексом фолатFITC (1500 нмоль/кг) и IL-2 (5000 МЕ/дозу) или комплексом фолат-FITC (1500 нмоль/кг), IL-2 (5000 МЕ/дозу) и IFN- (25000 Ед./дозу) на 7, 8, 9, 11 и 14 дни после имплантации опухолевых клеток. Дополнительную группу мышей инъецировали совместно комплексом фолат-FITC, IL-2 и IFN-, но при этом эти животные не были преиммунизированы FITC-BSA. На фиг. 11 показано, что средний срок выживаемости контрольных мышей, обработанных PBS, составлял 18,5 дней, средний срок выживаемости мышей, обработанных совместно комплексом фолат-FITC и IL-2, составлял 20,5 дней, средний срок выживаемости мышей, обработанных совместно комплексом фолат-FITC, IL-2 и IFN-, составил более 60 дней, а средний срок выживаемости мышей, обработанных совместно комплексом фолат-FITC, IL-2 иIFN-, но не преиммунизированных, составил 24,3 дня. Средний срок выживаемости мышей, инъецированных комплексом фолат-FITC и IL-2, незначительного отличался от такового в группе контрольных мышей, поскольку этих мышей инъецировали IL-2 в количестве 5000 МЕ/дозу, а как описано в примере 10, для увеличения среднего срока выживаемости мышей, обработанных комплексом фолат-FITC на 7, 8,9, 11 и 14 дни, необходимы дозы IL-2, превышающие 5000 ME. Результаты, приведенные на фиг. 11, показывают, что IFN- способствует дополнительному увеличению среднего срока выживаемости, достигаемого в результате обработки мышей, которым были имплантированы опухолевые клетки, комплексом фолат-FITC и IL-2. Пример 12. Влияние истощения CD8+-T-клеток на нацеленную на фолат иммунотерапию. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животные были инъецированы PBS (контроль) или были инъецированы совместно комплексом фолатFITC (1500 нмоль/кг), IL-2 (5000 МЕ/дозу) и IFN- (25000 Ед./дозу) на 7, 8, 9, 11 и 14 дни после имплантации опухолевых клеток. Дополнительные группы мышей были инъецированы совместно аминофлуоресцеином (1500 нмоль/кг), IL-2 и IFN- или комплексом фолат-FITC, IL-2, IFN- и антителом против СD8+-Т-клеток (в виде асцитов и вводились на 2, 3, 7, 11 и 15 дни). Как показано на фиг. 12, антитело против СD8+-Т-клеток ингибирует увеличение среднего срока выживаемости мышей, обработанных комплексом фолат-FITC, IL-2 и IFN-, что указывает на то, что СD8+-Т-клетки играют роль в активации клеточного иммунного ответа, вызванного нацеленной на фолат иммунотерапией. Аминофлуоресцеин инъецировали вмесите с комбинацией цитокинов IL-2, IFN- в качестве контроля, поскольку это соединение не связано с фолатом и не будет способствовать нацеливанию антифлуоресцеиновых антител на- 12005823 опухолевые клетки. На фиг. 12 показано, что аминофлуоресцеин вместе с IL-2 и IFN- является значительно менее эффективным, нежели комплекс фолат-FITC, IL-2 и IFN-, в увеличении среднего срока выживаемости мышей, которым имплантированы клетки М 109. Пример 13. Дополнительное влияние GM-CSF на нацеленную на фолат иммунотерапию, усиленнуюIL-2 и IFN-. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5. Кроме того, как указано на фиг. 13, животных инъецировали многочисленными цитокинами, включая IL2 (5000 МЕ/дозу), IFN- (25000 Ед./дозу) и GM-CSF (3000 Ед./дозу). Цитокины были инъецированы совместно в режиме серийных 5-дневных инъекций в дни от 8-го до 12-го после имплантации клеток М 109,которые сопровождались инъекциями 2 доз в 1500 нмоль/кг комплекса фолат-FITC в дни 4-й и 7-й. Результаты, представленные на фиг. 13, показывают, что средний срок выживаемости мышей, которых обрабатывали PBS, составлял 19 дней, средний срок выживаемости мышей, которых инъецировали IL-2,IFN- и GM-CSF без конъюгата фолат-FITC, составлял 22 дня, средний срок выживаемости мышей, которых инъецировали конъюгатом фолат-FITC, IL-2 и IFN-, составлял 38 дней, и средний срок выживаемости мышей, которых инъецировали конъюгатом фолат-FITC, IL-2, IFN- и GM-CSF, составлял более чем 57,5 дней. Результаты показывают, что GM-CSF дополнительно усиливает нацеленное на фолат уничтожение опухолевых клеток у мышей, обработанных также IL-2 и IFN-. Средний срок выживаемости мышей, которых инъецировали PBS, IL-2, IFN- и GM-CSF, незначительно отличался от такового у контрольных мышей, что указывает на особую важность того, чтобы нацеливание опухолеспецифического иммунного ответа производилось с помощью конъюгата фолат-FITC. Пример 14. Влияние дозы IFN- на выживаемость мышей, обработанных конъюгатами фолатфлуоресцеинизотиоцианат. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животных обрабатывали PBS (контроль) или инъецировали совместно комплексом фолат-FITC (1500 нмоль/кг) и IFN- в дозах 1,5105 МЕ/дозу (6 х), 7,5104 МЕ/дозу (3 х), 2,5104 МЕ/дозу (1 х) и 7,5103 МЕ/дозу (0,3 х). Кроме того, животных иммунизировали FITC-меченным гемоцианином моллюска (KLH) вместо FITC-меченного BSA, и животные были инъецированы конъюгатом фолат-FITC и IFN- на 7, 8,9, 11 и 14 дни после имплантации опухолевых клеток. Как показано на фиг. 14, средний срок выживаемости мышей, которым были имплантированы клетки M109 и которых обрабатывали конъюгатом фолатFITC, возрастал с увеличением дозы IFN-, превышающей 0,8104 МЕ/дозу. Пример 15. Влияние динитрофенила в качестве иммуногена на нацеленную на фолат иммунотерапию. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животных обрабатывали PBS (контроль) или инъецировали совместно динитрофенилом (DNP) (1500 нмоль/кг), IL-2 (5000 МЕ/дозу/день) и IFN- (2,5104 Ед./день) или комплексом фолат-динитрофенил(DNP) (1500 нмоль/кг), IL-2 (5000 МЕ/дозу/день) и IFN- (2,5104 Ед./день) на 7, 8, 9, 11 и 14 после имплантации опухоли. Дополнительно животных иммунизировали DNP-меченным гемоцианином моллюска (KLH). Как показано на фиг. 15, средний срок выживаемости мышей, обработанных комплексом фолат-динитрофенил, IL-2 и IFN-, был выше такового у контрольных мышей (обработанных PBS) или мышей, обработанных DNP, IL-2 и IFN-. Таким образом, динитрофенил также является эффективным иммуногеном для применения в нацеленной на фолат иммунотерапии. Пример 16. Синергический эффект конъюгатов фолат-флуоресцеинизотиоцианат и IFN-. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и животных обрабатывали PBS (контроль), только IFN- (7,5104 Ед./день), только комплексом фолатFITC (1500 нмоль/кг) или же они были инъецированы совместно комплексом фолат-FITC (1500 нмоль/кг) и IFN- (7,5104 Ед./день) на 7, 8, 9, 11 и 14 дни после имплантации опухоли. Дополнительно животных (по 5 мышей на группу) иммунизировали FITC-меченным гемоцианином моллюска (KLH) вместо FITC-меченного BSA. Как показано на фиг. 16, средние сроки выживаемости животных в группах, обработанных PBS (контроль), IFN-, комплексом фолат-FITC или же комплексом фолат-FITC +IFN-, составляли, соответственно, 17, 17, 23 и 33 дня. Эти результаты показывают, что IFN-, наподобие IL-2, действует синергично с комплексом фолат-FITC в промоции продолжительности выживаемости мышей-опухоленосителей. Пример 17. Влияние динитрофенила в качестве иммуногена и цитокинов в высоких концентрациях на продолжительность срока выживаемости мышей. Использованные методики были подобны тем, которые описаны в примере 1, за исключением того,что опухолевые клетки были имплантированы животным внутрибрюшинно, как описано в примере 5, и- 13005823 животных обрабатывали PBS (контроль), или же они были инъецированы совместно PBS, IL-2 (2,5105 Ед./день) и IFN- (7,5104 Ед./день), или же комплексом фолат-динитрофенил (DNP) (1500 нмоль/кг),IL-2 (2,5105 Ед./день) и IFN- (7,5104 Ед./день) на 7, 8, 9, 11 и 14-й дни после имплантации опухоли. Дополнительно животных иммунизировали DNP-меченным гемоцианином моллюска (KLH). Как показано на фиг. 17, средние сроки выживаемости животных, обработанных комплексом фолатдинитрофенил, IL-2 и IFN-, были выше таковых у контрольных мышей (обработанных PBS) или мышей, обработанных PBS, IL-2 и IFN-. Мыши, обработанные комплексом фолат-DNP, IL-2 и IFN- в концентрациях 2,5105 Ед./день и 7,5104 Ед./день, соответственно, были вылечены полностью. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ усиления опосредованной эндогенным иммунным ответом специфической элиминации популяции патогенных клеток у животного-хозяина, несущего указанную популяцию, где члены указанной клеточной популяции имеют доступные для лиганда сайты связывания, причем указанный способ включает в себя стадию введения указанному хозяину композиции конъюгата лиганд-иммуноген, включающей в себя комплекс лиганда и иммуногена, где указанный иммуноген характеризуется тем, что он распознается эндогенным или экзогенным антителом у хозяина, или характеризуется тем, что он напрямую распознается иммунной клеткой у хозяина; и соединения, способного стимулировать эндогенный иммунный ответ, причем указанное соединение не связывается с конъюгатом лиганд-иммуноген. 2. Способ по п.1, где лиганд выбран из группы, состоящей из фолиевой кислоты и других лигандов,связывающихся с фолатным рецептором. 3. Способ по п.1, где иммуноген представляет собой органическую молекулу, выбранную из флуоресцеина или динитрофенила. 4. Способ по п.1, где конъюгат лиганд-иммуноген имеет следующую формулу: 5. Фармацевтическая композиция, содержащая терапевтически эффективные количества конъюгата лиганд-иммуноген, способного специфически связываться с популяцией патогенных клеток у животного-хозяина, для специфической элиминации указанных клеток под действием приобретенного или врожденного иммунного ответа, под действием совместно вводимых антител или напрямую под действием иммунных клеток у хозяина, соединения, способного стимулировать эндогенный иммунный ответ, где указанное соединение не связывается с конъюгатом лиганд-иммуноген, и фармацевтически приемлемый носитель. 6. Фармацевтическая композиция, включающая в себя количество конъюгата лиганд-иммуноген,эффективное для мечения популяции патогенных клеток у животного-хозяина, для специфической элиминации в результате эндогенного иммунного ответа или с помощью совместно вводимых антител, где конъюгатом лиганд-иммуноген является флуоресцеинизотиоцианат или динитрофенил, конъюгированный с фолиевой кислотой посредством связанного с гамма-карбоксилом этилендиаминового мостика(фолат-FITC), и фармацевтически приемлемый носитель. 7. Применение конъюгата фолат-FITC в производстве лекарственного средства для мечения популяции патогенных клеток у животного-хозяина для специфической элиминации в результате эндогенного иммунного ответа или с помощью совместно вводимых антител. 8. Применение по п.7, где фолат-FITC имеет следующую формулу:
МПК / Метки
МПК: A61K 39/00, A61P 35/00
Метки: лечения, конюгатов, использованием, способ, лиганд-иммуноген
Код ссылки
<a href="https://eas.patents.su/22-5823-sposob-lecheniya-s-ispolzovaniem-konyugatov-ligand-immunogen.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения с использованием конъюгатов лиганд-иммуноген</a>
Предыдущий патент: Терапия глиобластомы тимозином -α-1
Следующий патент: Соединения, эффективные в качестве агонистов &beta- 2 – адренорецептора и ингибиторов фосфодиэстеразы pde4
Случайный патент: Стабильные препараты лаквинимода