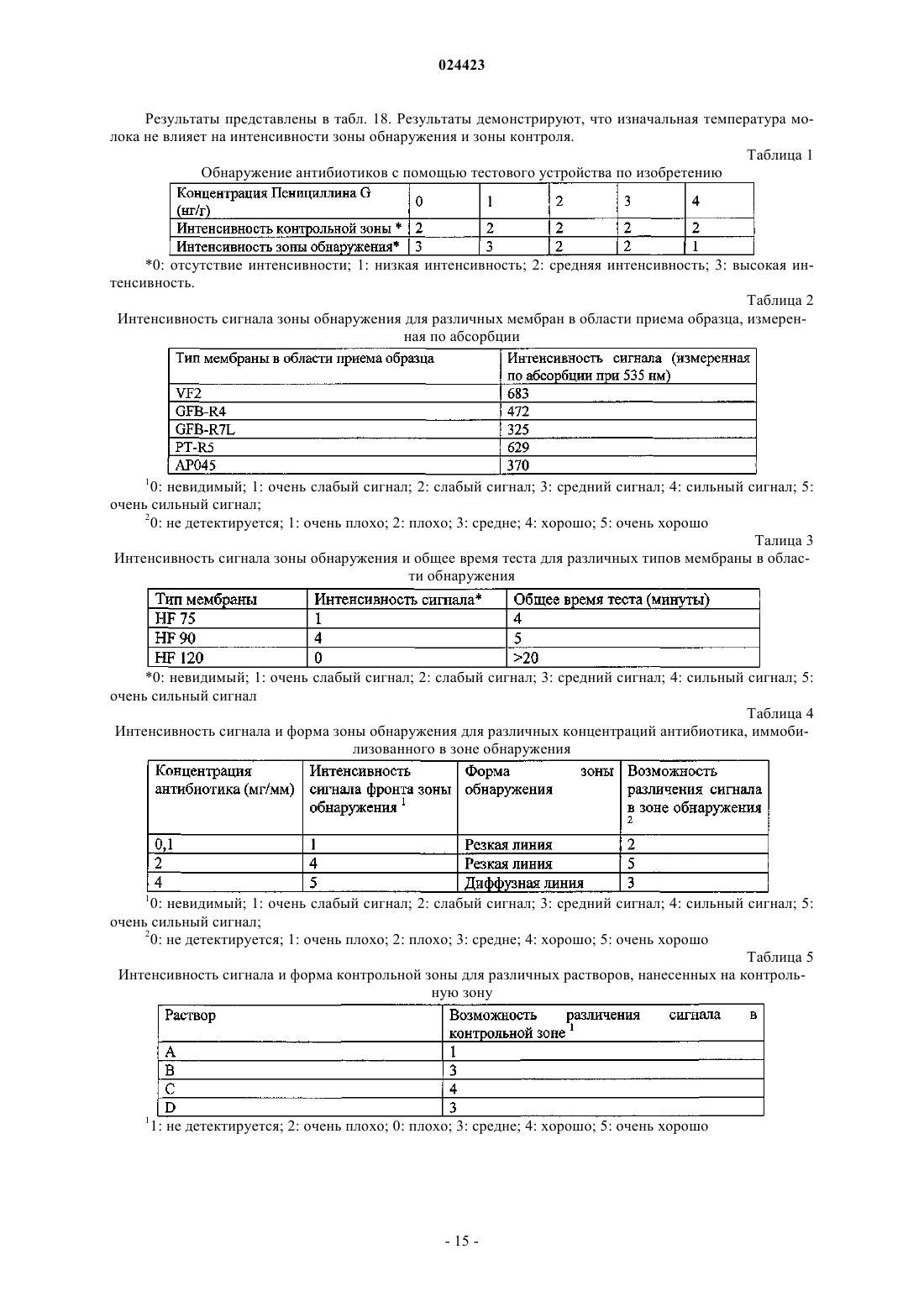
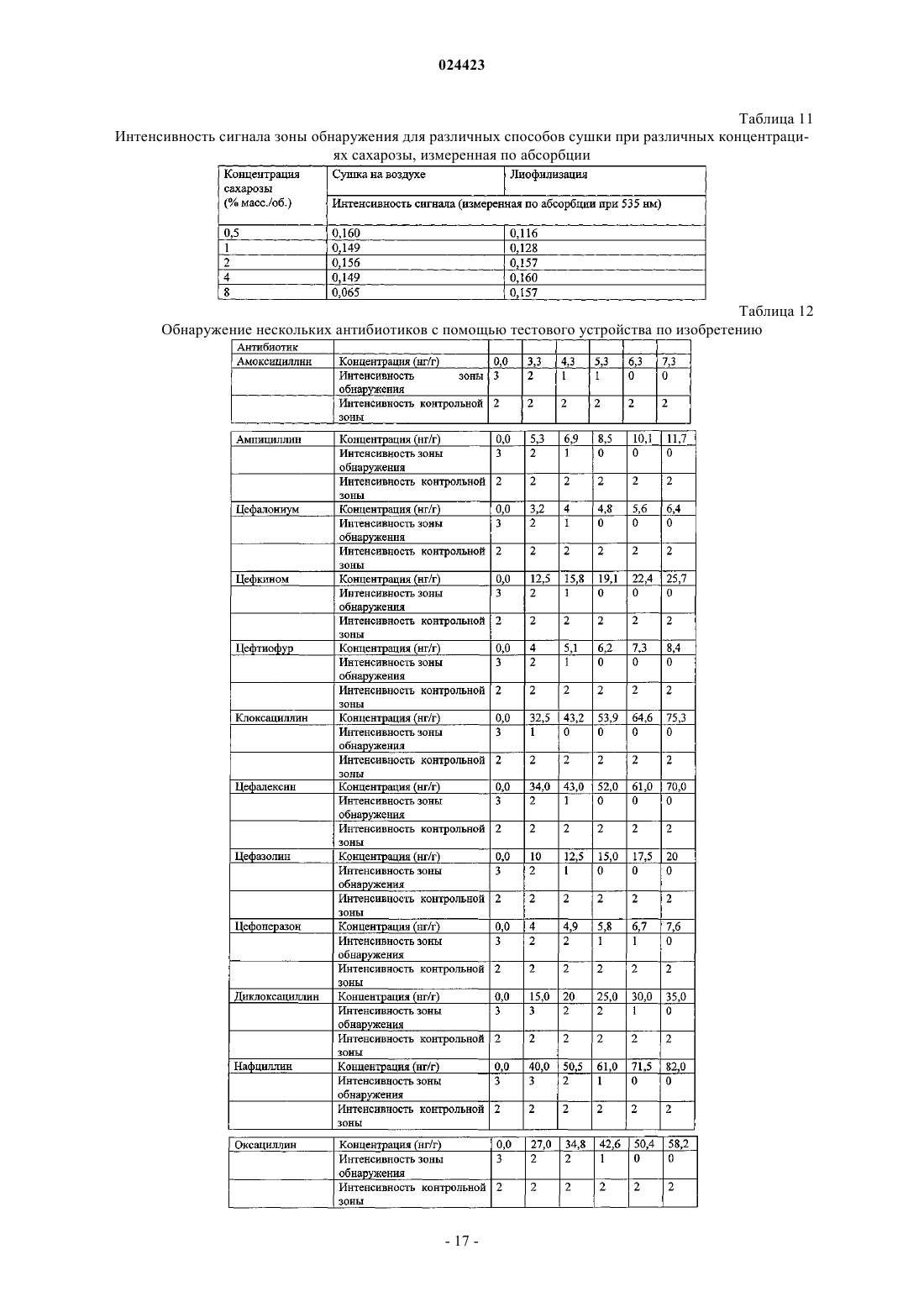
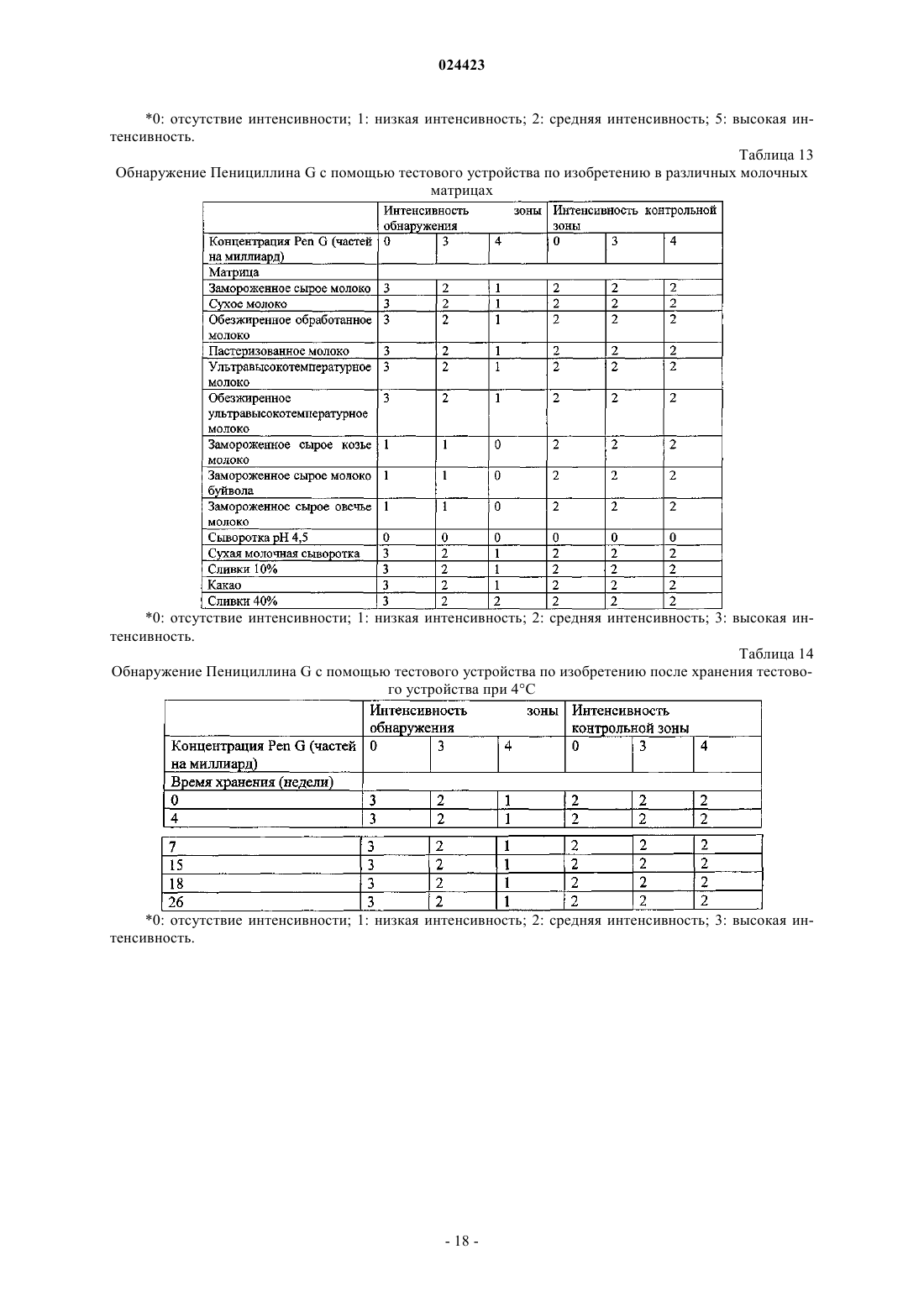
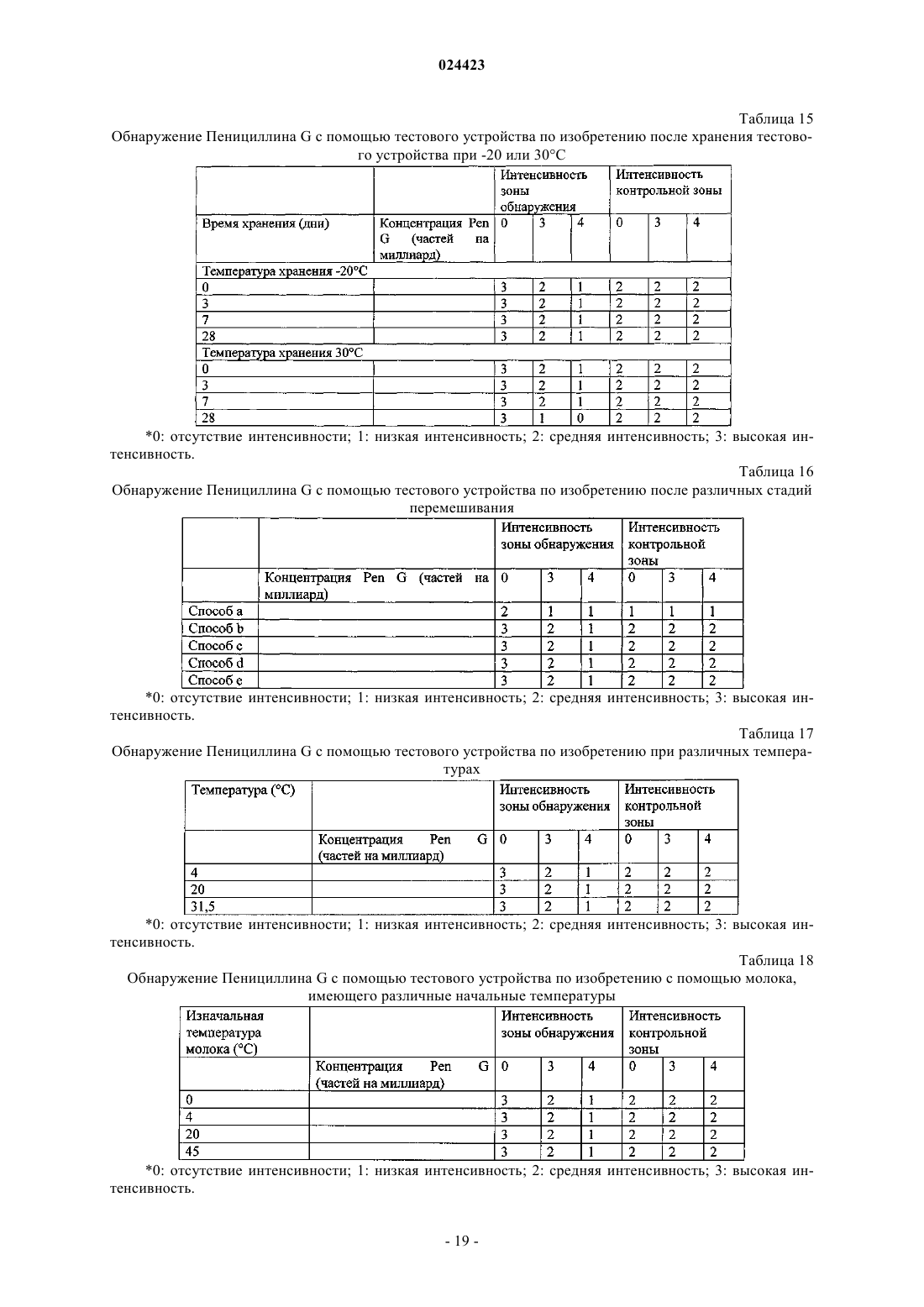
Иммуноанализ для обнаружения антибиотиков
Номер патента: 24423
Опубликовано: 30.09.2016
Авторы: Эннар Стефен Л.А., Франсе Мартье Мария, Косетт Милен Патрис Доминик
Формула / Реферат
1. Способ обнаружения бета-лактамного антибиотика в образце, который включает стадии:
a) контакта жидкого образца с меченым связывающим антибиотик белком из Bacillus stearothermophilus и меченым контрольным реактивом, где меченый связывающий антибиотик белок и меченый контрольный реактив находятся в контейнере, для образования жидкой композиции;
b) обеспечения тестового устройства, имеющего проксимальный и дистальный концы, где указанное тестовое устройство выполнено таким образом, чтобы обеспечить латеральный поток из проксимального в дистальный конец, и где указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца:
i) область приема образца;
ii) область обнаружения, содержащая по меньшей мере две зоны:
i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца;
ii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив;
iii) абсорбирующую область;
c) контакта жидкой композиции с областью приема образца в тестовом устройстве;
d) обеспечения передвижения жидкой композиции из области приема образца через область обнаружения в абсорбирующую область, с тем чтобы позволить жидкой композиции, содержащей меченый связывающий антибиотик белок и меченый контрольный реактив, войти в контакт с зоной обнаружения и контрольной зоной;
e) регистрации сигнала в зоне обнаружения и сигнала в контрольной зоне, где
i) об отсутствии антибиотика в образце свидетельствует наличие сигнала в зоне обнаружения, который более интенсивен, чем сигнал в контрольной зоне, и
ii) о присутствии антибиотика в образце свидетельствует отсутствие сигнала в зоне обнаружения или наличие сигнала в зоне обнаружения, который менее интенсивен, чем сигнал в контрольной зоне.
2. Способ по п.1, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце.
3. Способ по любому из пп.1 и 2, в котором жидкая композиция инкубируется в течение от 30 с до 5 мин перед контактом с тестовым устройством.
4. Способ по любому из пп.1-3, в котором жидкая композиция инкубируется при 40-70°С перед контактом с тестовым устройством.
5. Способ по любому из пп.1-4, в котором меченый связывающий антибиотик белок и меченый контрольный реактив находятся в виде порошка перед тем, как они контактируют с жидким образцом.
6. Способ по любому из пп.1-5, в котором меченый связывающий антибиотик белок получают из чувствительного к антибиотикам микроорганизма.
7. Способ по любому из пп.1-6, в котором метки на связывающем антибиотик белке и контрольном реактиве являются одинаковыми.
8. Способ по любому из пп.1-7, в котором связывающий антибиотик белок и контрольный реактив помечены частицей золота.
9. Способ по любому из пп.1-8, в котором используют контрольный реактив, не способный связаться с антибиотиком в образце.
10. Способ по любому из пп.1-9, в котором тестовое устройство является тестовой полоской.
11. Способ по любому из пп.1-10, в котором иммобилизованный антибиотик связан с твердой подложкой посредством конъюгата спейсер-белок.
12. Способ по любому из пп.1-11, в котором тестовое устройство контактирует с жидкой композицией в течение 1-5 мин при температуре 40-70°С.
13. Способ по любому из пп.1-12, в котором образец является молоком.
14. Тестовое устройство для обнаружения антибиотика в образце, где указанное тестовое устройство имеет проксимальный и дистальный концы, указанное тестовое устройство выполнено таким образом, чтобы обеспечить латеральный поток жидкой композиции, содержащей жидкий образец, меченый связывающий антибиотик белок и меченый контрольный реактив, из проксимального в дистальный конец, указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца:
область приема образца;
область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:
i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, и
ii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив;
абсорбирующую область,
где область приема образца является покрытой поливиниловым спиртом стекловолоконной мембраной.
15. Тестовое устройство по п.14, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце.
16. Набор, содержащий
контейнер, содержащий меченый связывающий антибиотик белок и меченый контрольный реактив, и
тестовое устройство по п.14 или 15.
17. Набор, содержащий
контейнер, содержащий меченый связывающий антибиотик белок из Bacillus stearothermophilus и меченый контрольный реактив, и
тестовое устройство для обнаружения антибиотика в образце, где указанное тестовое устройство, имеющее проксимальный и дистальный концы, выполнено таким образом, чтобы обеспечить латеральный поток жидкой композиции, содержащей жидкий образец, меченый связывающий антибиотик белок и меченый контрольный реактив, из проксимального в дистальный конец, и где указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца:
область приема образца;
область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:
i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, и
ii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив;
абсорбирующую область.
18. Набор по п.17, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце.
Текст
(71)(73) Заявитель и патентовладелец: ДСМ АйПи АССЕТС Б.В. (NL) Настоящее изобретение относится к устройству и способу детекции аналитов в образце. Косетт Милен Патрис Доминик,Эннар Стефен Л.А., Франсе Мартье Мария (NL) Фелицына С.Б. (RU) Область техники, к которой относится изобретение В настоящем изобретении описаны устройство и способ обнаружения аналитов в образце. Уровень техники Антибиотики используются для борьбы с инфекционными заболеваниями как у людей, так и у животных. Хорошо известно, что неправильное использование антибиотиков, такое как введение антибиотиков, когда это не требуется с медицинской точки зрения, или неполные курсы лечения, является наиболее важной причиной развития устойчивости к антибиотикам. Таким образом, способы обнаружения наличия антибиотиков в образцах, таких как, например, молоко, кровь, рыба, корм, мясо, сыворотка, моча, вода и т.п., являются наиболее важными в предотвращении нежелательного распространения антибиотиков. Во многих областях этот способ обнаружения может быть осуществлен адекватно лишь тогда,когда доступен быстрый и простой тест. В общем, существует два типа тестов, подходящих для рутинного мониторинга наличия антибиотиков в образцах. Во-первых, существуют тесты микробного ингибирования, в которых тестовый микроорганизм контактирует с образцом, который тестируют, и наблюдается рост (или ингибирование роста) микроорганизма, например с применением индикатора. Пример такого теста описан в ЕР 0755456 В 1. Основной недостаток тестов микробного ингибирования заключается в том, что тест занимает относительно длительный период времени для получения результатов. Во-вторых, существуют конкурентные иммуноанализы, в которых антибиотик, подвергаемый тестированию, и эталонный антибиотик, присутствующий в тесте, конкурируют за связывание со связывающими белками и/или антителами с аффинностью к данным антибиотикам. Визуализация, как правило, осуществляется посредством мечения. Один из множества таких тестов описан в ЕР 0593112 В 1. Хотя эти типы тестов в общем быстрее, чем тесты микробного ингибирования, они все еще требуют избыточного манипулирования со стороны пользователя и, следовательно, не являются удобными в использовании. В свете вышеуказанного очевидно, что существуют значительные возможности для улучшения в области тестирования антибиотиков, особенно, это касается легкости применения, скорости и простоты применения. Описание чертежей Чертеж является видом сбоку воплощения тестового устройства по настоящему изобретению. Тестовое устройство включает твердую подложку (е), содержащую область приема образца (а), область обнаружения (b), область абсорбции (с) и область для манипулирования (d). Описание изобретения Существует широкий диапазон применений для способов, тестовых устройств и наборов по настоящему изобретению во всей области диагностики и анализа. Они могут быть использованы для обнаружения любого типа аналитов в образце, включая антибиотики, углеводы, пищевые вещества, микроорганизмы, (поли)нуклеотиды, стероиды, гормоны, токсины, (агро)химические агенты, такие как фунгициды, гербициды и пестициды, витамины, лекарственные средства, метаболиты, рецепторы, антитела, аллергены, названы только некоторые из них. В предпочтительном воплощении способов тестовые устройства и наборы по настоящему изобретению используются для обнаружения антибиотиков в образце. Термин "антибиотик" при использовании в данном документе относится к одному или нескольким веществам или химическим компонентам (или метаболитам таких веществ или химических соединений) образца, которые демонстрируют активность против бактерий. В воплощении данного изобретения антибиотик, который подлежит детектиции способом, тестовым устройством и/или набором по настоящему изобретению выбирают из группы, состоящей из семейства бета-лактамных антибиотиков, семейства тетрациклиновых антибиотиков, семейства сульфонамидных антибиотиков, семейства аминогликозидных антибиотиков и семейства хинолоновых антибиотиков. В предпочтительном воплощении изобретения антибиотики детектируемые способом, тестовым устройством и/или набором по настоящему изобретению являются бета-лактамными антибиотиками. Термин "бета-лактамный антибиотик" относится к соединениям (или их метаболитам), которые содержат бета-лактамную субструктуру в своей химической структуре и демонстрируют активность против бактерий. Двумя важными подклассами бета-лактамных антибиотиков являются цефалоспориновые и пенициллиновые антибиотики. Примеры цефалоспориновых антибиотиков являются цефаклор, цефадроксил, цефтиофур, цефалексин, цефапирин и цефрадин. Примеры пенициллиновых антибиотиков являются амоксициллин, ампициллин, клоксациллин, диклоксациллин, флуклоксациллин, оксациллин, пенициллин G, пенициллин V и тикарциллин. Настоящее изобретение относится к способу обнаружения антибиотика в образце, указанный способ включает стадии:a) контакта жидкого образца с меченым связывающим антибиотик белком и меченым контрольным реактивом для образования жидкой композиции;b) обеспечения тестового устройства, имеющего проксимальный и дистальный концы, при этом указанное тестовое устройство выполнено таким образом, чтобы позволить латеральный поток из проксимального в дистальный конец, и указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца к дистальному концу:ii) область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:A. зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, иB. контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив;c) контакта жидкой композиции с областью приема образца в тестовом устройстве;d) передвижения жидкой композиции из области приема образца, через область обнаружения в абсорбирующую область, с тем, чтобы позволить жидкой композиции, содержащей меченый связывающий антибиотик белок и меченый контрольный реактив, контактировать с зоной обнаружения и контрольной зоной;i) об отсутствии антибиотика в образце свидетельствует наличие сигнала в зоне обнаружения, который более интенсивен, чем сигнал в контрольной зоне, иii) о присутствии антибиотика в образце свидетельствует отсутствие сигнала в зоне обнаружения,или наличие сигнала в зоне обнаружения, который менее интенсивен, чем сигнал в контрольной зоне. В первой стадии образец контактирует по меньшей мере с одним меченым связывающим антибиотик белком и по меньшей мере с одним меченым контрольным реактивом. В воплощении образец контактирует более чем с одним меченым связывающим антибиотик белком и/или более чем с одним меченым контрольным реактивом. Меченый связывающий антибиотик белок и меченый контрольный реактив могут находиться в жидкой или твердой форме перед тем, как они контактируют с образцом. Оба агента могут быть в жидкой форме, или оба агента могут быть в твердой форме, или один агент может быть в твердой форме, а другой агент может быть в жидкой форме. Предпочтительно, если оба агента присутствуют в твердой форме, предпочтительно в виде порошка. Твердая форма может быть получена путем сушки или лиофилизации соединений. Порошок может быть ресуспендирован в образце. Если необходимо, полученная жидкая композиция может быть перемешана (например, с помощью вортекса) для улучшенного и/или быстрого ресуспендирования порошка в образце. При необходимости, могут быть добавлены соединения, облегчающие ресуспендирование и/или растворение и/или смешивание меченого связывающего антибиотик белка, меченого контрольного реактива и образца. В предпочтительном воплощении эти соединения находятся с меченым связывающим антибиотик белком и меченым контрольным реактивом перед тем, как они контактируют с образцом. Предпочтительно эти соединения также находятся в твердой форме, например в виде порошка. Подходящие соединения включают, без ограничения перечисленным, буфер, например органический буфер, такой как Tris-буфер, поверхностноактивное вещество, такое как Triton Х-100, белок, такой как бычий сывороточный альбумин, полиол,такой как глицерин, и сахар, например дисахарид, такой как сахароза. В воплощении количество жидкого образца, добавленного к связывающему антибиотик белку и меченому контрольному образцу, составляет от 50 до 1000 мкл, предпочтительно от 75 до 7500 мкл, более предпочтительно от 100 до 500 мкл, в частности от 125 до 250 мкл. После того, как образцы контактируют по меньшей мере с одним меченым связывающим антибиотик белком, и по меньшей мере с одним меченым контрольным реактивом, полученную жидкую композицию можно встряхивать. Встряхивание, как правило, осуществляется в течение от 1 до 20 с, предпочтительно от 5 до 15 с, а период около 10 с является предпочтительным. В воплощении меченый связывающий антибиотик белок и меченый контрольный реактив находятся в контейнере. Предпочтительно, если вышеуказанные соединения также находятся в контейнере. Меченый связывающий антибиотик белок и меченый контрольный реактив могут находиться в различных контейнерах, но предпочтительно они находятся в одном контейнере. Контейнеры, которые могут быть использованы в настоящем изобретении, могут быть пробирками любой формы и размера и быть из любого доступного подходящего материала. Контейнеры также могут быть лунками, такими как те, что являются частью микротитровальных планшетов. В предпочтительном воплощении контейнер содержит меченый связывающий антибиотик белок, меченый контрольный реактив, буфер, например органический буфер, такой как Tris-буфер, поверхностно-активное вещество, такое как Triton Х-100 (предпочтительно в концентрации от 0 до 0,1% мас./об.), белок, такой как бычий сывороточный альбумин, полиол,такой как глицерин, и сахар, например дисахарид, такой как сахароза. В ином случае, меченый связывающий антибиотик белок и меченый контрольный реактив являются частью тестового устройства, например они могут присутствовать в жидкой или твердой форме в области приема образца или в области разделения, расположенной перед областью приема образца или между областью приема образца и областью обнаружения. В этом воплощении вместо того, чтобы добавлять предварительно измеренный объем в контейнер, тестовое устройство может быть выполнено с возможностью погружения в жидкий образец для абсорбции выбранного количества образца. В воплощении образец может быть твердым веществом и жидкостью, содержащими антибиотик(и),который(ые) должен(ны) быть извлечен(ы) из образца. Способы экстракции жидкости из образца зависят от типа образца. Подходящие способы экстракции различных типов образцов известны специалистам в данной области и включают дезинтеграцию твердого образца гомогенизацией, перемешивание на вортексе с микросферами, помол или обработку ультразвуком и/или экстракцию растворителем. В предпочтительном воплощении образец, который контактирует с меченым связывающим антибиотик белком и меченым контрольным реактивом, является жидкостью. В воплощении изобретения образец может быть получен из биологической жидкости, органа, мяса и яиц. Антибиотики также могут присутствовать в пищевых продуктах, в которых эти животные продукты добавлены в качестве ингредиентов. Примерами пищевых продуктов являются молоко; мед; мясо коров; свиней, домашней птицы и рыбы; морепродукты,такие как креветки; обработанные мясные продукты, такие как сосиски; готовые к употреблению продукты; корма; и детское питание. Антибиотики также могут присутствовать в биологических жидкостях или тканях животных, которые являются подходящими для проверки, например инспекциями по проверке качества пищевых продуктов. Примерами являются кровь, ткань печени, мышечная ткань, сердечная ткань, ткань почки, или первичная моча, получаемая из почки, и моча. Моча и кровь доступны для проверки до забоя животного. Антибиотики также могут присутствовать в воде, такой как сточные воды. В предпочтительном воплощении образец является молоком. Молоко может быть получено из крупного рогатого скота (например, коров), лошадей, овец, коз, яков, буйволов, людей, ослов, оленей, бизонов и верблюдов. Антибиотики также могут присутствовать в полуобработанных или обработанных пищевых продуктах, таких как пастеризованные продукты, UHT-продукты, обезжиренное или частично обезжиренное молоко, сыворотка, свежий или созревший сыр, йогурт, сливки, масло, сметана, пахта, названы только некоторые из них. В воплощении жидкая композиция (т.е. жидкой композиции, полученной в стадии а инкубируется в течение от 30 с до 5 мин, предпочтительно от 45 с до 4 мин, более предпочтительно от 50 с до 3 мин,наиболее предпочтительно от 55 с до 2,5 мин и особенно от 1 до 2 мин перед тем, как жидкая композиция контактирует с тестовым устройством. Жидкая композиция инкубируется при температуре от 40 до 70 С, предпочтительно при температуре от 50 до 65 С, более предпочтительно при температуре от 60 до 64 С. В воплощении жидкая композиция, полученная в стадии а), инкубируется после встряхивания. В другом воплощении встряхивание осуществляется после инкубации жидкой композиции, полученной в стадии а). В еще одном воплощении встряхивание осуществляется перед и после инкубации. Время встряхивания перед и после инкубации может быть равным, но также может различаться. В предпочтительном воплощении инкубация продолжается после того, как жидкая композиция контактирует с тестовым устройством. В воплощении тестовое устройство контактирует с жидкой композицией в течение от 1 до 5 мин, предпочтительно от 1,5 до 4 мин, более предпочтительно от 2 до 3 мин при температуре от 40 до 70 С, предпочтительно при температуре от 50 до 65 С, более предпочтительно при температуре от 60 до 64 С. Инкубация может быть проведена с помощью термостатического устройства, такого как водяная баня или инкубатор. В предпочтительном воплощении температуре до и после контакта жидкой композиции с тестовым устройством остается идентичной. Инкубация может быть остановлена, как только сигнал обнаружен в зоне обнаружения и/или в контрольной зоне. Меченый связывающий антибиотик белок может быть любым белком, способным связывать детектируемый антибиотик. Связывающий белок может связывать семейство антибиотиков, которые обладают схожими структурными участками связывания. Подходящие связывающие белки включают, без ограничения перечисленным, антитела (моноклональные, поликлональные или рекомбинантные), фрагменты антител, ферменты, аптамеры, и рецепторы, такие как пенициллинсвязывающий белок. Предпочтительно, если связывающий антибиотик белок является белком, полученным из микроорганизма. В воплощении микроорганизм является чувствительным к антибиотикам микроорганизмом. В воплощении изобретения организм выбирают из группы, состоящей из родов Bacillus, Escherichia и Streptococcus. В предпочтительном воплощении изобретения организм является термофильным. Примерами являютсяBacillus stearothermophilus или Streptococcus thermophilus, а наиболее предпочтительным - Bacillus stearothermophilus. Метки для связывающего антибиотик белка и контрольного реактива могут отличаться, но в предпочтительном воплощении они являются одинаковыми. Могут быть использованы как видимые, так и невидимые метки. Подходящие метки включают, без ограничения перечисленным, флуоресцентные соединения, хромогенные соединения, хемилюминесцентные соединения, радиоактивные соединения, колориметрические соединения, магнитные соединения (например, микросферы или частицы), ферменты,каталитические соединения, вещества, везикулы с метками и частицы, такие как частицы красителя, окрашенные латексные частицы, частицы углерода, металлические частицы, неметаллические частицы,коллоидальные металлические частицы. В предпочтительном воплощении метки являются видимыми метками, предпочтительно коллоидными металлическими частицами и золотыми частицами, например предпочтительно коллоидными золотыми частицами. Метка может быть связана со связывающим антибиотик белком и/или контрольным реактивом любыми подходящими средствами, включая конъюгирование, ковалентное связывание или нековалентное связывание. Метка может быть напрямую связана со связывающим антибиотик белком и/или с контрольным реактивом, или метка может быть связана через конъюгат, например конъюгат биотин-стрептавидина или конъюгат биотин-авидина. В воплощении контрольный реактив неспособен связать антибиотик в образце. В воплощении контрольный агент образует специфическую связывающую пару со связывающим агентом, иммобилизованным в контрольной зоне области обнаружения в тестовом устройстве. Термин "специфическая пара связывания" при использовании в данном документе относится к двум веществам, которые специфически связываются друг с другом. В воплощении тестовое устройство является тестовой полоской. В свете малых объемов жидкого образца, добавленного к меченому связывающему антибиотик белку и меченому контрольному реактиву,рекомендуется, чтобы тестовое устройство размещалось так, чтобы находиться под углом между дном и стенкой. В способе настоящего изобретения, если плотность метки (например, сигнала) в зоне обнаружения выше, чем в контрольной зоне, образец, не содержащий антибиотик или содержащий антибиотик в концентрации ниже, чем заданный порог (другими словами, антибиотик отсутствует в достаточном количестве и тест считается "отрицательным"). Следовательно, если в настоящей заявке упоминается "отсутствие антибиотика в образце", то это означает, что образец не содержит антибиотика или содержит антибиотик в концентрации ниже заданного порога. Однако, когда плотность метки в зоне обнаружения меньше, чем плотность метки в контрольной зоне, антибиотик присутствует в образце в концентрации выше заданного порога (или другими словами антибиотик присутствует в количестве свыше допустимых уровней и тест считается "положительным"). Следовательно, если в настоящей заявке упоминается "наличие антибиотика в образце", то это означает, что образец содержит антибиотик в концентрации выше заданного порога. Когда плотность метки (т.е. сигнал) в зоне обнаружения является столь же интенсивным как плотность метки (т.е. сигнал) в контрольной зоне, антибиотик присутствует в образце в концентрации выше, равном или ниже заданного порога. Это зависит от выбранного порога. "Порог" при использовании в данном документе относится к значению концентрации, выше которого заданный антибиотик следует рассматривать как присутствующий, и ниже которого указанный антибиотик считается отсутствующим. В общем, пороговое значение задано для конкретных антибиотиков в конкретных образцах местными, региональными и межрегиональными инстанциями, но оно также может быть предварительно установлено для определенных исследовательских целей. Сигналы могут быть обнаружены визуально на глаз, но также посредством считывающего сигнал устройства, такого как, например, спектрофотометр, считыватель отражения, флуориметр, камера, магнитный детектор, сцинтиллятор, названы только некоторые из них. Для определения результата осуществления способа настоящего изобретения может быть измерена интенсивность детектируемого уровня в зоне обнаружения. Способ настоящего изобретения может дать результат в виде "да или нет" (т.е. антибиотик отсутствует или отсутствует) или может определять наличие или отсутствие антибиотика выше или ниже определенного порогового значения (который фактически также является результатом "да или нет"). Интенсивность сигнала может быть обратно зависима от концентрации антибиотика в образце. Более того, интенсивность сигнала в зоне обнаружения может сравниваться с интенсивностью сигнала в контрольной зоне для определения результата осуществления способа настоящего изобретения. Различие между интенсивностями различных зон могут даже быть проанализированы считывающим сигнал устройством и использованы для расчета концентрации антибиотика в образце, например путем сравнения результата с ранее определенным значением. Изобретение также относится к тестовому устройству для детекции антибиотика в образце, указанное тестовое устройство, имеющее проксимальный и дистальный концы, указанное тестовое устройство выполнено так, чтобы сделать возможным латеральный поток жидкой композиции, содержащей жидкий образец, меченый связывающий антибиотик белок и меченый контрольный реактив из проксимального в дистальный конец, указанное устройство содержит твердую подложку, которая содержит следующие области в последовательности от проксимального к дистальному концу: область приема образца, область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, иii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив, абсорбирующая область, и необязательно, область для манипулирования."Твердая подложка" при использовании в данном документе, относится к материалу, который используется для обеспечения подложки для различных областей тестового устройства. При использовании для тестового устройства по настоящему изобретению, твердая подложка, как правило, сделана из материала, который является инертным в отношении применения, для которого используется тестовое устройство. Подходящими материалами являются стекло, металлы и различные типы пластиков, такие как, например, полистирол. Твердая подложка может иметь толщину от 0,1 до 1 мм. В воплощении тестовое устройство может быть размещено в неабсорбирующей или ламинированной оправе. Другими словами тестовое устройство включает оправу, определяющие удлиненную полость для получения и удержания тестового устройства. Подходящие оправы известны специалистам в данной области. Крепление областей к основе может быть осуществлено согласно известным методам, таким как склеивание, термокомпрессия и т.п. Тестовые устройства настоящего изобретения, как правило, имеют длину, варьирующую от 10 до 200 мм, предпочтительно от 20 до 150 мм, более предпочтительно от 30 до 100 мм и в частности от 50 до 75 мм, ширину, варьирующую от 1 до 20 мм, предпочтительно от 2 до 15 мм, более предпочтительно от 3 до 10 мм, и толщину, варьирующую от 0,05 до 2 мм, предпочтительно от 0,075 до 1,5 мм, более предпочтительно от 0,1 до 1 мм. Тестовые устройства настоящего изобретения имеют срок хранения по меньшей мере 6 мес., предпочтительно по меньшей мере 9 мес., при хранении при 4 С. В другом воплощении тестовые устройства настоящего изобретения имеют срок хранения вплоть до 10 дней, предпочтительно вплоть до 20 дней, а более предпочтительно вплоть до 28 дней, при хранении при -20 С. В другом воплощении тестовые устройства настоящего изобретения имеют срок хранения вплоть до 1 дня, предпочтительно вплоть до 4 дней, а более предпочтительно вплоть до 7 дней, при хранении при 30 С. "Срок хранения" при использовании в данном документе означает, что чувствительность хранимого тестового устройства не уменьшается. Следовательно, чувствительность хранимого тестового устройства равно чувствительности свежеприготовленного тестового устройства. В воплощении тестовое устройство может храниться при температуре от -20 до 30 С. Предпочтительно тестовое устройство хранится при температуре от 4 до 8 С."Область приема образца" при использовании в данном документе относится к части тестового устройства, которое приводится в прямой контакт с жидкой композицией. Другими словами, область приема образца является частью тестового устройства, которая приводиться в прямой контакт с жидким образцом после того как жидкий образец контактирует с меченым связывающим антибиотик белком и меченым контрольным реактивом. При необходимости, область приема образца может содержать меченый реактив, способный связывать связывающий антибиотик белок и/или контрольный реактив, особенно в случае, когда связывающий антибиотик белок и/или контрольный реактив присутствуют в немеченой форме, когда они контактируют с жидким образцом. Раздел приема образца сделан из пористого материала. В предпочтительном воплощении область приема образца сделана из материала, имеющего размер пор 3-8 м. Предпочтительно область приема образца является покрытой поливиниловым спиртом стекловолоконной мембраной, такой как VF2."Область обнаружения" при использовании в данном документе относится к части тестового устройства, которое в латеральном потоке контактирует с областью приема образца и абсорбирующей областью. Контакт может быть стыковым соединением, но предпочтительно существует перекрытие между областью обнаружения и областью приема образца, и между областью обнаружения и областью абсорбции. Перекрытие может составлять от 1 до 2 мм. Область обнаружения сделана из пористого материала. Предпочтительно область обнаружения является мембраной HF90. Область обнаружения, как правило,содержит одну или большее количество зон, например зону обнаружения для обнаружения наличия или отсутствия антибиотика и контрольную зону, которая функционирует в качестве контрольного участка. Область обнаружения также может иметь две или большее количество областей обнаружения двух и/или большего количества контрольных зон. Зоны обнаружения могут иметь одинаковую функциональность или могут иметь различные функциональности (т.е. захватывающие реактивы в различных зонах обнаружения могут быть способны связывать одно и то же соединение, или могут быть способны связывать различные соединения). То же самое верно для контрольных зон. Одна или большее количество зон могут быть сделаны из пористого материала, отличного от материала области обнаружения. Отдельные зоны могут быть сделаны из различного пористого материала. Предпочтительно, если они сделаны, однако, из одинакового материала. Предпочтительно одна или несколько зон сделаны из одного и того же материала, что и область обнаружения. Если жидкая композиция передвигается через область обнаружения, то она может сначала контактировать с зоной обнаружения, а затем контактировать с контрольной зоной или наоборот. В случае, когда область обнаружения имеет несколько зон обнаружения и/или контрольных зон, любая последовательность зон может быть представлена. Зоны могут иметь множество конфигураций, включая линии, точки или другие конфигурации. В предпочтительном воплощении зоны являются линиями."Латеральный поток" при использовании в настоящем документе, относится к потоку жидкости образца в материале, в котором все растворенные и/или диспергированные компоненты образца транспортируется, по существу, при одинаковых скоростях и с относительно неослабевающим потоком в поперечном направлении через материал. Зона обнаружения и контрольная зона каждая может содержать по меньшей мере один реактив захвата. Предпочтительно, если зона обнаружения и контрольная зона сделаны путем нанесения соответ-5 024423 ствующего захватывающего реактива или смеси захватывающих реактивов на область обнаружения, либо посредством ковалентных связей, либо с помощью других процессов связывания. "Захватывающий реактив" при использовании в данном документе относится к любому реактиву, который может быть использован для создания требуемой функциональности в зоне обнаружения и/или контрольной зоне. Нанесение захватывающего реактива на область обнаружения может быть осуществлена известными способами, такими как распыление, дозирование, окрашивание, рисование, печать, нанесение полосами и т.п. Зоны способны генерировать сигнал, например визуальный цветной сигнал, при наличии или отсутствии комплекса между захватывающим реактивом и его партнером по связыванию. Захватывающий реактив может быть любым природным или неприродным соединением. Примерами подходящих захватывающих реактивов являются антибиотики, антитела, антигены, лиганды, белки,названы только некоторые из них. В предпочтительных воплощениях захватывающий реактив в зоне обнаружения тестового устройства по настоящему изобретению является антибиотиком или его аналогом. В предпочтительном воплощении антибиотик иммобилизован в области обнаружения в концентрации 1-3 мг/мм. Предпочтительно, если антибиотик присутствует в Tris-буфере, если он иммобилизован в области обнаружения. Примерами подходящих антибиотиков или его аналогов являются бета-лактамные антибиотики, например цефалоспорины, такие как, например, 7-амино-цефалоспорановая кислота(7 АСА). Предпочтительно, если антибиотик иммобилизован на тестовом устройстве и способен связывать меченый связывающий антибиотик белок, если указанный меченый связывающий антибиотик белок не связан антибиотиком из образца. Если меченый связывающий антибиотик белок связан антибиотиком из образца, иммобилизованный антибиотик не будет способен связать меченый связывающий антибиотик белок. В предпочтительном воплощении захватывающий реактив в контрольной зоне тестового устройства по настоящему изобретению является представителем связывающей пары, например специфической связывающей пары, такой как пара антиген/антитело. Он также может быть связывающим антитело белком, таким как, например, протеин А. Захватывающий агент может быть представлен в растворе, содержащем дополнительный белок, например бычий сывороточный альбумин, сахар, например дисахарид,такой как сахароза и соль, такая как NaCl, при нанесении на контрольную зону. В предпочтительном воплощении захватывающий агент в контрольной зоне неспособен связать антибиотик в образце и/или меченый связывающий антибиотик белок, независимо от того, связан белок с антибиотиком или нет. Иммобилизация захватывающего агента в детектирующей области может быть проведена известным per se способом, например ковалентной или нековалентной абсорбцией в области обнаружения. Захватывающий реактив также может быть ковалентно конъюгирован с областью обнаружения посредством носителя, такого как, например, бычий сывороточный альбумин (BSA). Необязательно, захватывающий реактив может быть соединен с носителем через спейсер. В качестве спейсера подходят множество бифункциональных соединений. Все способы, доступные для создания связей, например методы связывания, например те, которые известны из пептидной химии, могут быть применены, если они не наносят ущерб захватывающему реактиву. Подходящие спейсеры, носители и методы связывания хорошо известны специалистам в данной области. Контрольная зона дает сигнал независимо от того, присутствует или отсутствует антибиотик в образце и дает указание на то, что тестовое устройство функционирует как требуется. Контрольная зона обеспечивает последовательный сигнал, который не зависит от концентрации антибиотика в образце. Контрольная зона также может быть использована для информирования пользователя о том, что жидкая композиция протекает через тестовое устройство. В этом смысле, контрольная зона может быть использована в качестве контроля потока. Более того, контрольная зона может быть использована для сравнения с зоной обнаружения."Абсорбирующая область" при использовании в данном документе относится к части тестового устройства, которое находится в контакте с латеральным потоком с областью обнаружения и функционирует для стимуляции латерального потока через область обнаружения и способна абсорбировать избыток жидкого образца. Контакт является стыковым соединением, но предпочтительно перекрывается между областью обнаружения и областью абсорбции. Перекрытие может составлять от 1 до 2 мм. Абсорбирующая область сделана из пористого материала. В предпочтительном воплощении абсорбирующая область имеет длину по меньшей мере 1 см."Область для манипулирования" при использовании в данном документе относится к области тестового устройства, которая может быть использовано для удержания и манипуляций тестового устройства без ущерба для результатов теста. "Область для манипулирования" может быть отдельной областью,прикрепленной к твердой подложке, но область для манипулирования может быть частью самой твердой подложки. При необходимости область для манипулирования и абсорбирующая область также могут быть объединены в одну область. В еще одном воплощении настоящего изобретения, тестовое устройство включает элемент, который охватывает один или несколько из числа области приема образца, области обнаружения и области абсорбции. Указанный элемент, который может быть сделан из любого материала, предпочтительно прозрачного пластикового материала, преимущественно обеспечивает защиту указанных областей от отпе-6 024423 чатков пальцев и/или механического разрушения и/или паров и т.п. Одна или большее количество областей может быть покрыто одним элементом, однако также множество элементов необязательно из различных материалов могут быть использованы."Пористый материал" при использовании в данном документе относится к любому материалу, способному обеспечить латеральный поток. Примерами подходящих пористых материалов являются полимерные материалы, такие как поливинил или полиэстер, хлопок, стекловолокно, нитроцеллюлоза, смеси нитроцеллюлозы с полимерными материалами, нейлон, бумага, вискоза и т.п. В воплощении тестовое устройство содержит область обнаружения, которая длиннее чем абсорбирующая область, абсорбирующую область, которая длиннее чем область для манипулирования, и область для манипулирования, которая длиннее, чем область приема образца. Тестовые устройства по настоящему изобретению изготовлены способами, известными специалистам в данной области. Твердые подложки могут иметь форму карт. Они могут быть получены, например с помощью коммерчески доступных ламинаторов. Карты могут быть ламинированы. На карты могут быть прикреплены различные области. Используемые захватывающие реактивы наносятся на область обнаружения в форме растворов, перед или после сборки карт. Эти растворы могут быть нанесены очень точно с помощью коммерчески доступного аппарата, такого как диспенсеры "BioDot, Inc.". Перед и/или после нанесения зоны обнаружения и/или контроля, область обнаружения может быть блокирована, например, распылением блокирующего раствора. Предпочтительные блокирующие растворы содержат буфер, например органический буфер, такой как Tris-буфер, поверхностно-активное вещество, напримерTween, такое как Tween-20, и белок, такой как бычий сывороточный альбумин. Предпочтительно, если блокирующий раствор не распыляется прямо над зоной обнаружения и/или контрольной зоной. Депонированные растворы могут быть сразу выпарены, например путем помещения карты под поток горячего воздуха. После того, как всех области и зоны были нанесены, карты предпочтительно сушат в сухой атмосфере, т.е. в атмосфере, имеющей относительную влажность 50%, 40%, 30%, 20%, 10%, предпочтительно 0%. Для крупномасштабного производства также возможно изготовление рулонов. Затем,карты и рулоны, несущие искомые захватывающие реактивы, могут быть разрезаны на полоски, каждая из этих полосок образует тестовое устройство по изобретению. В ином случае, захватывающие реактивы также могут быть депонированы на область обнаружения до сборки карт или рулонов простым погружением области обнаружения в раствор, содержащий захватывающие реактивы. Настоящее изобретение также направлено на набор, содержащий меченый связывающий антибиотик белок, меченый контрольный реактив, и тестовое устройство по настоящему изобретению. Тестовое устройство предпочтительно храниться в упаковке, содержащей влагопоглотитель. Предпочтительно меченый связывающий антибиотик белок и меченый контрольный реактив присутствуют в контейнере,предпочтительно в одном контейнере. Предпочтительно набор включает более одного контейнера, и более одного тестового устройства, например 10, 20, 30, 40, 50 или даже 100 контейнеров и/или тестовых устройств. Набор по настоящему изобретению также может содержать устройство для взятия пробы. Это устройство, с помощью которого образец, например жидкий образец, может быть добавлены к меченому связывающему антибиотик белку и меченому контрольному реактиву. Примеры включают, без ограничения перечисленным, контейнер (необязательно с маркировкой объема), шприц, пипетку или автоматическую систему пипетирования. Такой шприц или пипетка могут быть разработаны таким образом, чтобы только с одним режимом действия заданный объем мог быть извлечен из жидкого образца для анализа. Кроме того, в данной области известны системы более чем с одним шприцем или пипеткой, которые можно задействовать с помощью одного манипулятора. В случае если набор содержит устройство для взятия образцов, такое как пипетка, то оно может дополнительно содержат наконечники для пипетки. Предпочтительно количество наконечников для пипетки равно количеству контейнеров (например, контейнеров, в которых находятся меченый связывающий антибиотик белок и меченый контрольный реактив) и тестовых устройств. Таким образом, с помощью только одной пипетки различные образцы могут быть нанесены на различные контейнеры. В случае если набор содержит одноразовые пипетки в качестве устройства для взятия образца, количество одноразовых пипеток равно количеству контейнеров (т.е. контейнеры, в которых находятся меченых связывающий антибиотик белок и меченый контрольный реактив) и тестовых устройств. Необязательно, набор дополнительно содержит вставку с инструкциями для применения и/или средствами для установления времени, необходимого для инкубации. Необязательно, набор дополнительно содержит термостатическое устройство, такое как инкубатор или водяная баня, с помощью которых образцы могут храниться при заданной температуре, так что температура, при которой жидкий образец, меченый связывающий антибиотик белок, меченый контрольный реактив и необязательно тестовое устройство должны инкубироваться. Предпочтительно указанное термостатируемое устройство сконструировано таким образом, что оно может удерживать контейнеры, заполненные меченым связывающим антибиотик белком, меченым контрольным реактивом, жидким образцом и необязательно тестовым устройством. Необязательно термостатическое устройство соединено со средством для установления времени, необходимым для инкубации, так что нагревание останавливается после окончания заданного периода. Необязательно, набор также включает устройство для считывания образца, носитель данных, загру-7 024423 женный с помощью компьютерной программы, подходящей для инструктирования компьютера при анализе цифровых данных, полученных из устройства для считывания образца. Воплощения и признаки, описанные выше для способа настоящего изобретения, также относятся к тестовому устройству и набору по настоящему изобретению. Воплощения и признаки, описанные выше для тестового устройства настоящего изобретения, также относятся к способу и набору по настоящему изобретению. Воплощения и признаки, описанные выше для набора настоящего изобретения, также относятся к тестовому устройству и способу по настоящему изобретению. Примеры Пример 1. Получение тестового устройства. Нитроцеллюлозную мембрану HF90 ("Millipore"; длина 25 мм) использовали в качестве области обнаружения. Мембрану приклеивали к полистирольной ламинированной карте (толщина 0,254 мм) в 8 мм от проксимального конца карты. Затем зону обнаружения и контрольную зону наносили на нитроцеллюлозную мембрану. Зону обнаружения наносили распределением 1 мг/мл конъюгата 7ACA-спейсер-BSA в 20 мМ KPO4-буфере (pH 7,5) с помощью рабочей станции "Biodot Dispense workstation XYZ 3050" с переднего края при 0,2 мкл/см. Контрольную зону наносили распределяя 0,15 мг/мл анти-IgY антитела в 20 мМ KPO4-буфере (pH 7,5), содержащем 0,675 мг/мл BSA, 5% мас./об, сахарозы и 20 мМ NaCl с помощью рабочей станции "Biodot Dispense workstation XYZ 3050" с переднего края при 0,8 мкл/см. После сушки зон, нитроцеллюлозную мембрану блокировали путем распыления раствора, содержащего 10 мМ"Biodot Dispense workstation XYZ 3050" с воздушной форсункой 3 х. Раствор распыляли на мембрану с дистанции 2 мм ниже зоны обнаружения. После этого область приема образца (мембрана VF2,"Millipore", длина 1 см) приклеивали в проксимальном конце карты, перекрываясь на 2 мм нитроцеллюлозной мембраной. Абсорбирующую область (мембрана 10038 "Millipore", длина 20 мм) приклеивали в дистальном конце карты с перекрытием 2 мм нитроцеллюлозной мембраны. Полученные карты сушили при 37 С в сухой атмосфере (0% относительная влажность). Карты разрезали на полоски шириной 5,2 мм и хранили в сухой атмосфере (0% относительная влажность). Пример 2. Получение меченого связывающего антибиотик белка и меченого контрольного реактива. Покрытые стрептавидином золотые частицы синтезировали путем реакции коллоидального золота(диаметр 40 нм; 1 OD/мл) с 10 мкг/мл стрептавидина. Затем полученный раствор концентрировали фильтрацией с тангенциальным потоком, отмывали и хранили в Tris-буфере (pH 8) с NaCN. Связывающий пенициллин белок, очищенный из Bacillus stearothermophilus, биотинилировали (1:4) эфиромD-биотинил-эпсилон-аминокапроновой кислоты и N-гидроксисукцинимида. Затем синтезировали конъюгат связывающий пенициллин белок-золото реакцией 1,5 мкг биотинилированного связывающего пенициллин белка с 1 OD покрытых стрептавидином золотых частиц в течение 1 ч, с последующим центрифугированием при 10000g в течение 5 мин и ресуспендированием полученного осадка в 45 нМ бикарбонатном буфере, содержащем 0,1% мас./об. Triton Х-100 (pH 9,6). Покрытые IgY золотые частицы синтезировали реакцией коллоидального золота (диаметр 40 нм; 1 OD/мл с 10 мкг/мл IgY. Затем полученный раствор центрифугировали при 7500g в течение 10 мин и полученный осадок ресуспендировали в Tris-буфере (pH 8), отмывали в другом раунде центрифугирования и ресуспендирования полученного осадка в Tris-буфере (pH 8) и хранили в Tris-буфере (pH 8) сNaCN. После этого 140-200 mOD конъюгата связывающий пенициллин белок-золото и 5-20 mOD конъюгата IgY-золото солюбилизировали в 100 мкл буфере (80 мМ Tris-буфера, содержащего 0,01% мас./об.Triton-X-100, 0,4% мас./об. BSA, 5% об./об. глицерина и 2% мас./об, сахарозы (pH 8,5 и 0,75 мкл раствора разливали по пробиркам и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Пример 3. Обнаружение антибиотиков с помощью тестового устройства. По 150 мкл обогащенного антибиотиком молока добавляли в пробирку, содержащую высушенные конъюгаты. Концентрация пенициллина G в добавленном молоке варьировала от 0 до 4 нг/г (пробирка 1: 0 нг/г; пробирка 1: 1 нг/г; пробирка 2: 2 нг/г; пробирка 3: 3 нг/г; и пробирка 4: 4 нг/г). Полученную жидкую композицию инкубировали в течение 2 мин при 64 С в инкубаторе. Тестовое устройство помещали в пробирку и инкубировали в течение 3 мин при 64 С в инкубаторе. Результат считывали на глаз. Результаты представлены в табл. 1. Результаты демонстрируют, что интенсивность контрольной зоны сохранялась стабильной для любой концентрации пенициллина G в молоке. Сигнал зоны обнаружения четко был менее интенсивный, когда концентрация пенициллина G в молоке была 2 нг/г или выше. В концентрациях 0 нг/г и 1 нг/г интенсивность зоны обнаружения была четко выше, чем интенсивность контрольной зоны. В концентрациях 2 нг/г и 3 нг/г интенсивность сигнала в зоне обнаружения была схожей с интенсивностью сигнала в контрольной зоне. В концентрации 4 нг/г интенсивность зоны обнаружения была значимо ниже, чем интенсивность в контрольной зоне. Пример 4. Влияние температуры инкубации на эффективность тестового устройства. Тестовые устройства были изготовлены как описано в примере 1, при условии, что тестовые устройства не содержали контрольную зону. Меченый связывающий антибиотик белок получали, как опи-8 024423 сано в примере 2. В первом эксперименте меченый связывающий антибиотик белок разводили в 200 мкл сырого молока (конечная концентрация 25 нМ) и инкубировали при 64 С в течение 5 мин. Во втором эксперименте меченый связывающий антибиотик белок разводили в 200 мкл сырого молока (конечная концентрация 25 нМ) и инкубировали при 47,5 С в течение 5 мин. После инкубации тестовое устройство вводили вертикально в каждый молочный раствор и инкубацию продолжали в течение следующих 10 мин. После инкубации интенсивность сигнала зоны обнаружения и количество оставшегося золота в области приема образца оценивали на глаз. Было отмечено значимое отличие в количестве оставшихся меченых связывающих белков в области приема образца. Область приема образца с молоком, инкубированным при 47,5 С, продемонстрировала больше меченого связывающего белка, чем область приема образца с молоком, инкубированным при 64 С. Следовательно, при 64 С поток молока был лучше, чем при 47,5 С. Не отмечено значимых различий в интенсивности меченого связывающего белка в области обнаружения. Пример 5. Влияние длины абсорбирующей области на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 4. Получали тестовые устройства, имеющие абсорбирующую область длиной 2, 2,5 и 5 см. Меченый связывающий антибиотик белок получали, как описано в примере 2. Меченый связывающий антибиотик белок разводили в 200 мкл сырого молока (конечная концентрация 25 нМ) и инкубировали при 47,5 С в течение 5 мин. Затем тестовое устройство, имеющее абсорбирующую область длиной 2 см, имеющее абсорбирующую область длиной 2,5 см или абсорбирующую область длиной 5 см, вертикально вводили в молоко и инкубировали в течение 10 мин при 47,5 С. После инкубации, интенсивность сигнала в зоне обнаружения и количество оставшегося золота в области приема образца детектировали на глаз. Результаты демонстрируют, что ни количество золота, оставшегося в области приема образца, ни интенсивность зоны обнаружения не отличались в зависимости от изменения длины абсорбирующей области и что длина абсорбирующей области может быть уменьшена до 2 см без утраты интенсивности в зоне обнаружения. Кроме того, тестовые устройства получали, как описано в примере 1. Получали тестовые устройства, имеющие абсорбирующую область длиной 0,5 см, длиной 1 см и длиной 2 см. Меченый связывающий антибиотик белок получали, как описано в примере 2. Меченый связывающий антибиотик белок разводили в 150 мкл сырого молока и инкубировали при 64 С в течение 2 мин. Затем, тестовые устройства, имеющие абсорбирующую область длиной 0,5 см,абсорбирующую область длиной 1 см, или абсорбирующую область длиной 2 см вертикально вводили в молоко и инкубировали в течение 3 мин при 64 С. После инкубации, интенсивность сигнала в зоне обнаружения и количество оставшегося золота в области приема образца детектировали на глаз. Результаты демонстрируют, что количество золота, оставшегося в области приема образца равно между тестовыми устройствами, имеющими абсорбирующую область длиной 1 см и тестовыми устройствами, имеющими абсорбирующую область длиной 2 см. Более того, результаты демонстрируют, что интенсивность контрольной зоны и зоны обнаружения тестовых устройств, имеющих абсорбирующую область длиной 1 или 2 см, является высокой. Когда длина абсорбирующей области тестового устройства уменьшена до 0,5 см, интенсивность сигнала контрольной зоны и зоны обнаружения значимо снижалась. Длина абсорбирующей области тестового устройства, следовательно, должна составлять по меньшей мере 1 см для хорошего сигнала в контрольной зоне и зоне обнаружения. Пример 6. Влияние типа мембраны в области приема образца на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1. Область приема образца была изготовлена из мембраны с размером пор 1 мкм, размер пор варьировал в диапазоне от 3 до 8 мкм или размер пор составлял 50 мкм. Меченый связывающий антибиотик белок и меченый контрольный реактив получали,как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты демонстрируют, что нет сигнала в контрольной зоне и зоне обнаружения, если размер пор в области приема образца составлял 1 или 50 мкм. Интенсивность сигнала в зоне контроля и зоне обнаружения детектировалась, когда размер пор области приема образца составлял от 3 до 8 мкм. Область приема образца, имеющего размер пор от 3 до 8 мкм, способна удалить частицы из молока, которые отрицательно влияют на результаты теста. Области приема образца, имеющие размер пор 1 мкм,забиты частицами молока, тогда как области приема образца, имеющие размер пор 50 мкм позволяют частицам молока протекать в область обнаружения и забивать область обнаружения. Пример 7. Влияние типа мембраны в области приема образца на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1. Область приема образца была изготовлена из стекловолоконной мембраны, связанной с поливиниловым спиртом (мембраной VF2), стекловолоконной мембраны (мембрана GBF-R4 или мембрана GBF-R7L), целлюлозной мембраны (мембрана АР 045) или полиэфирной мембраны (мембрана PT-R5). Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3,при условии, что в молоко не вносили антибиотики. После окончания теста, интенсивность сигнала зоны обнаружения измеряли с помощью измерения абсорбции при 535 нм с помощью ридера "ESE-Quant Lateral Flow reader" (Qiagen). Результаты представлены в табл. 2. Они демонстрируют, что интенсивность сигнала зоны обнаружения была сильнее, когда использовалась стекловолоконная мембрана, покрытая поливиниловым спиртом (мембрана VF2), по сравнению с использованием других мембран. Стекловолоконная мембрана, связанная с поливиниловым спиртом является предпочтительной, поскольку позволяет лучше обнаруживать сигнал в области обнаружения. Пример 8. Влияние типа мембраны в области обнаружения на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1. Область обнаружения была изготовлена из мембраны HF75, HF90 или HF120. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии,что в молоко не вносили антибиотики. Результаты представлены в табл. 3. Они демонстрируют, что мембрана HF90 является предпочтительной мембраной для области обнаружения тестового устройства, поскольку зона обнаружения на мембране HF90 дает более сильную интенсивность сигнала, чем зона обнаружения из мембраны HF75 или HF120. Пример 9. Влияние концентрации иммобилизованного антибиотика на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1, при условии, что концентрация антибиотика (конъюгат 7ACA-спейсер-BSA), наносимого на зону детекции, варьировала. Концентрацию антибиотика рассчитывали как количество антибиотика (в мг) на единицу длины (в мм) области обнаружения. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Анализировали интенсивность сигнала и форму зоны обнаружения. Результаты представлены в табл. 4. Они демонстрируют, что сигнал в зоне обнаружения сложно детектировать, если тестовое устройство содержит 0,1 мг/мм или 4 мг/мм антибиотика, иммобилизованного в области обнаружения. Первое дает четкую линию, но имеет низкую интенсивность сигнала, тогда как последнее имеет сильную интенсивность сигнала, но дает размытую линию (т.е. сигнал постепенно исчезает в направлении потока молока), делая сигнал трудным для обнаружения. Напротив, если тестовое устройство включает 2 мг/мм антибиотика, иммобилизованного в области обнаружения, линия является четкой, а интенсивность сигнала является сильной. Это дает очень хорошую детектируемость сигнала в области обнаружения. Пример 10. Влияние типа буфера иммобилизованного антибиотика на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1, с условием, что антибиотик, наносимый на зону обнаружения, был представлен в 20 мМ KPO4-буфере (pH 7,5) или 10 мМ Tris-буфере (pH 8,0). Затем тестовые устройства хранили при 37 С в течение двух недель. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. После хранения тестовых устройств, тест осуществляли, как описано в примере 3 с условием, что в молоко не вносили антибиотики. Анализировали интенсивность сигнала области обнаружения перед и после хранения. Результаты демонстрируют, что интенсивность сигнала зоны обнаружения снижается после хранения в течение двух недель при 37 С (по сравнению с интенсивностью перед хранением) для тестовых устройств, в которых антибиотик, наносимый на зону обнаружения, находился в фосфатном буфере. Интенсивность сигнала зоны обнаружения остается постоянной после хранения в течение двух недель при 37 С (по сравнению с интенсивностью перед хранением) для тестовых устройств, в которых антибиотик,наносимый на зону обнаружения, находился в Tris-буфере. Их этого был сделан вывод, что антибиотик,нанесенный на зону обнаружения, предпочтительно должен находиться в органическом буфере, таком как Tris-буфер и не должен находиться в неорганическом буфере, таком как фосфатный буфер, таком как буфер с KPO4. Пример 11. Влияние типа блокирующего раствора области обнаружения на эффективность тестирующего устройства. Тестирующие устройства получали, как описано в примере 1, при условии, что после сушки зон нитроцеллюлозную мембрану блокировали путем распыления:c) раствора, содержащего 2% мас./об. BSA, 0,05% мас./об. Tween-20 в 2 мМ KPO4 буфере (pH 7,5). Затем тестовые устройства либо использовали прямо в тесте (для анализа интенсивности сигнала перед хранением), либо тестовые устройства хранили при 37 С в течении двух недель (для анализа интенсивности сигнала после хранения) и затем использовали в тесте. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Анализировали интенсивность сигнала области обнаружения перед и после хранения. Результаты демонстрируют, что интенсивность сигнала зоны обнаружения тестовых устройств,блокированных растворами b и с, были схожими перед хранением, тогда как неблокированные тестовые устройства демонстрировали более низкую интенсивностью сигнала. Интенсивность сигнала в зоне обнаружения тестовых устройств, блокированных раствором c, стала слабее после того, как тестовые устройства использовали после хранения при 37 С. Интенсивность сигнала зоны обнаружения тестовых устройств блокированных раствором b была схожа перед и после хранения тестовых устройств при 37 С. Блокировка органическим буфером, таким как Tris, дает стабильную интенсивность зоны обнаружения в течение длительного периода времени. Блокировка органическим буфером, таким как Tris, таким образом, обеспечивает тестовые устройства, имеющие пролонгированный срок хранения. Пример 12. Влияние положения нанесения блокирующего раствора на эффективность тестового устройства. Тестовые устройства либо получали, как описано в примере 1, либо готовили, как описано в примере 1, при условии, что блокирующий раствор, нанесенный на нитроцеллюлозную мембрану после сушки,был распылен прямо на зону обнаружения. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты демонстрируют, что интенсивность сигнала зоны обнаружения и зоны контроля была менее интенсивной (41% и 52% соответственно), когда блокирующий раствор распыляли прямо над зоной обнаружения, по сравнению, со случаем, когда блокирующий раствор не распыляли прямо над зоной обнаружения. Можно сделать вывод, что блокирующий раствор не должен распыляться прямо на зону обнаружения для оптимальной интенсивности сигнала зоны обнаружения. Пример 13. Влияние типа раствора, использованного для нанесения контрольной зоны, на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1, при условии, что раствор, используемый для нанесения на контрольную зону, содержал: а) 0,15 мг/кг анти-IgY антитела, 20 мМ KPO4-буффер (pH 7,5)KPO4-буфер (pH 7.5) Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Анализировали интенсивность сигнала контрольной зоны. Результаты представлены в табл. 5. Они демонстрируют, что сигнал в контрольной зоне отвечает условиям обнаружения, если раствор, используемый для нанесения на контрольную зону содержит IgY в сочетании по меньшей мере с одним дополнительным белком, таким как BSA, по меньшей мере одним сахаром (предпочтительно дисахаридом, таким как сахароза), и по меньшей мере одной солью, такой какNaCl. Кроме того, была изучена важность скорости переноса из контрольной зоны на область обнаружения на эффективность тестового устройства. Результаты демонстрируют, что если скорость распределения по контрольной зоне составляла 0,2 мкл/см или 0,8 мкл/см, полученная контрольная зона была слишком тонкой и не детектируемой. Если распределение по контрольной зоне проходило со скоростью 1,5 мкл/см, детектируемость контрольной зоны была хорошей. Пример 14. Влияние влажности в ходе сушки карт на эффективность тестового устройства. Тестовые устройства либо получали, как описано в примере 1, либо получали, как описано в примере 1 при условии, что полученные карты сушили при 37 С в полусухой атмосфере (относительная влажность около 50%). После приготовления тестовые устройства хранили при 37 С в течение двух недель. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты демонстрируют, что интенсивность сигнала зоны обнаружения менее интенсивна, когда полученные карты сушили при 37 С в полусухой атмосфере (относительная влажность около 50%), чем когда полученные карты сушили при 37 С в сухой атмосфере (относительная влажность 0%). Это говорит о том, что срок хранения тестовых устройств больше, когда тестовые устройства сушат при очень низкой относительной влажности, чем когда тестовые устройства сушат при высокой относительной влажности. Пример 15. Влияние присутствия осушителя в упакованных тестовых устройствах на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1 и разделяли на две части. Первую часть хранили в течение 1 г. при 4 С в закрытой упаковке без осушителя, тогда как вторую часть хранили в течение 1 г. при 4 С в закрытой упаковке с осушителем. После хранения тестовые устройства использовали в тесте. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2. Тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты демонстрируют, что интенсивность сигнала зоны обнаружения сильнее для тестовых устройств, хранимых в упаковке с осушителем, чем для тестовых устройств, хранимых в упаковке без осушителя. Пример 16. Влияние типа солюбилизирующего буфера на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив либо получили, как описано в примере 2, либо получали, как описано в примере 2 при условии, что в качестве солюбилизирующего буфера использовали 70 мМ MOPS-буфер вместо 100 мМ Tris-буфера. Все используемые буферы содержали 0,0025% мас./об. Triton-X-100, 0,4% мас./об. BSA, 5% об./об. глицерина и 2% мас./об. сахарозы и имели pH 8,5 и 0,75 мкл раствора переносили на пробирку и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты представлены в табл. 6. Они демонстрируют, что интенсивность сигнала в зоне обнаружения сильнее, когда меченый связывающий антибиотик белок и меченый контрольный реактив солюбилизированы в Tris-буфере, а не в MOPS-буфере. Из этого можно прийти r выводу, что органические буферы, таких как Tris-буферы, вместо неорганических буферов, например фосфат-содержащих буферов, таких как MOPS-буферы, должны быть включены в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Пример 17. Влияние концентрации Triton X-100 солюбилизирующего буфера на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2 при условии, что использовали буферы с различными концентрациями Triton Х-100. Все использованные буферы содержали 80 мМ Tris, 0,4% мас./об. BSA, 5% об./об. глицерина и 2% мас./об. сахарозы и имели pH 8,5 и 0,75 мкл раствора переносили на пробирку и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты представлены в табл. 7. Они демонстрируют отсутствие интенсивности сигнала зоны обнаружения в отсутствии Triton Х-100. Из этого эксперимента можно сделать вывод, что концентрацияTriton Х-100 в солюбилизирующем буфере должна быть выше 0. Из этого примера можно сделать дополнительный вывод о том, что поверхностно-активное вещество, например неионное поверхностноактивное вещество, такое как Triton Х-100, должно быть включено в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Предпочтительно Triton Х-100 должен быть включен в концентрации выше 0,0025% мас./об., например около 0,01 мас./об.%, в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Пример 18. Влияние концентрации BSA в солюбилизирующем буфере на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2 при условии, что использовали буферы с различными количествами BSA. Все использованные буферы содержали 80 мМ Tris, 0,01% мас./об. Triton Х-100, 5% об./об. глицерина и 2% мас./об. сахарозы и имели pH 8,5 и 0,75 мкл раствора переносили на пробирку и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты представлены в табл. 8. Они демонстрируют, что интенсивность сигнала зоны обнаружения является средней, когда используются буферы с низкими количествами BSA, например 0,2% мас./об. Когда использовали буферы с высокими количествами BSA, например 0,4 или 0,8% мас./об.,интенсивность сигнала была выше. Из этого можно сделать вывод о том, что белок, например альбумин,такой как бычий сывороточный альбумин (BSA) должен быть включен в количествах выше 0,2% мас./об. в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Пример 19. Влияние концентрации глицерина в солюбилизирующем буфере на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2, при условии, что использовали буферы с различными количествами глицерина. Все использованные буферы содержали 80 мМ Tris, 0,01% мас./об. Triton Х-100, 0,4% мас./об. BSA, 2% мас./об. са- 12024423 харозы и имели pH 8,5 и 0,75 мкл раствора переносили на пробирку и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты представлены в табл. 9. Они демонстрируют, что интенсивность сигнала зоны обнаружения слаба в отсутствии глицерина, тогда как в присутствии глицерина интенсивность сигнала составляет от средней до сильной. Результаты также демонстрируют, что оптимальная концентрация глицерина составляет 5 мас./об.%. Из этого примера можно сделать вывод, что полиол, такой как глицерин, должен быть включен в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Предпочтительно количество глицерина составляет около 5% мас./об. Пример 20. Влияние концентрации сахарозы в солюбилизирующем буфере на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2 при условии, что использовали буферы с различными количествами сахарозы. Все использованные буферы содержали 80 мМ Tris, 0,01% мас./об. Triton Х-100, 0,4% мас./об. BSA, 2% об./об. глицерина и имели pH 8,5 и 0,75 мкл раствора переносили на пробирку и сушили в течение 12 ч при 40 С. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. Результаты представлены в табл. 10. Они продемонстрировали, что интенсивность сигнала зоны обнаружения слаба, если использовали низкие количества сахарозы. Результаты также дополнительно демонстрируют, что оптимальная концентрация сахарозы составляет 2% мас./об. Из этого примера можно прийти к выводу, что сахар, например дисахарид, такой как сахароза, должен быть включен в контейнеры (т.е. тестовые пробирки), содержащие меченый связывающий антибиотик белок и меченый контрольный реактив. Предпочтительно количество сахарозы составляет около 2% мас./об. Пример 21. Влияние типа сушки солюбилизирующего буфера на эффективность тестового устройства. Меченый связывающий антибиотик белок и меченый контрольный реактив получали, как описано в примере 2, при условии, что, во-первых, солюбилизационный буфер в пробирках либо сушили в течение 24 ч при 40 С, либо замораживали в жидком азоте (-80 С) в течении 1 ч, а затем сушили в вакууме(0,42 мбар) при температуре 10 С в течение 20 ч, и при условии, что, во-вторых, использовали буферы с различными количествами сахарозы. Полученные пробирки запечатывали. Тестовые устройства получали, как описано в примере 1 и тест осуществляли, как описано в примере 3, при условии, что в молоко не вносили антибиотики. После окончания теста интенсивность сигнала зоны обнаружения измеряли с помощью измерения абсорбции при 535 нм с помощью ридера "ESE-Quant Lateral Flow reader" (Qiagen). Результаты представлены в табл. 11. Они демонстрируют, что интенсивность сигнала зоны обнаружения идентична для солюбилизационных буферов, высушенных в течение 12 ч при 40 С и солюбилизационных буферов, которые лиофилизированы, если солюбилизационные буферы содержат 2% мас./об. сахарозы. При концентрациях сахарозы выше, чем 2% мас./об., лиофилизация дает более высокие интенсивности сигнала, тогда как при концентрациях сахарозы ниже, чем 2% мас./об. сушка на воздухе дает более высокие интенсивности сигнала. Пример 22. Влияние концентрации меченого белка на эффективность тестового устройства. Тестовые устройства получали, как описано в примере 1 и меченый связывающий антибиотик белок, и меченый контрольный реактив получали, как описано в примере 2. В этом примере оценивали влияние концентрации меченого связывающего антибиотик белка в молоке. Меченый связывающий антибиотик белок разводили в 150 мкл сырого молока до конечной концентрации 25 нМ, 50 нМ или 100 нМ и инкубировали при 64 С в течение 2 мин. Затем тестовое устройств вертикально вводили в каждый из молочных растворов и инкубировали в течение 3 мин при 64 С. После инкубации интенсивность сигнала зоны обнаружения и количество оставшегося золота в области приема образца детектировали визуально. Результаты демонстрируют значимое увеличение интенсивности сигнала зоны обнаружения с увеличением концентрации связывающего антибиотик белка в молоке. Оставшийся меченый связывающий антибиотик белок в области приема образца также растет с увеличением концентрации. Пример 23. Чувствительность тестового устройства на различные антибиотики. Тест осуществляли фактически так, как описано в примере 3, при условии, что были протестированы различные антибиотики в различных концентрациях. Результаты представлены в табл. 12. Результаты демонстрируют, что различные бета-лактамовые антибиотики могут быть обнаружены с помощью тестового устройства по настоящему изобретению. Пример 24. Обнаружение антибиотиков с помощью тестового устройства в различных продуктах. Тест осуществляли фактически так, как описано в примере 3. Вместо сырого молока тестировали различные молочные смеси. Все жидкие матрицы измеряли как есть, а все порошки вначале диспергировали в воде. В случае сухого молока диспергировали 20 г в 250 г дистиллированной воды, а в случае сухой сыворотки диспергировали 7,1 г в 100 г воды. Результаты представлены в табл. 13. Результаты демонстрируют, что тестовое устройство может быть использовано для обнаружения антибиотиков в различных молочных матрицах, за исключением сыворотки при pH 4,5. Пример 25. Срок хранения тестового устройства. Тестовое устройство получали, как описано выше в примерах 1 и 2 и хранили при 4 С. В различные периоды времени после получения тестовое устройство использовали для измерения пенициллина G. Тест проводили фактически так, как описано в примере 3. Результаты представлены в табл. 14. Результаты демонстрируют, что хранение вплоть до около 9 мес. при 4 С не влияет на эффективность тестовых устройств. Тестовые устройства по настоящему изобретению имеют период полужизни по меньшей мере 9 мес. Пример 26. Влияние температуры хранения на срок хранения тестового устройства. Тестовые устройства получали, как описано выше в примерах 1 и 2, и хранили при различных температурах (-20 и 30 С). В различные периоды времени после получения тестовое устройство использовали для обнаружения пенициллина G. Тест проводили фактически так, как описано в примере 3. Результаты представлены в табл. 15. Результаты демонстрируют отсутствие влияния на эффективность тестового устройства после хранения при -20 С вплоть до 28 дней. Кроме того, отсутствует влияние на эффективность тестового устройства после хранения при 30 С вплоть до 7 дней. После 28 дней хранения при 30 С наблюдали небольшое снижение интенсивности сигнала зоны обнаружения. Пример 27. Влияние молочной композиции на тестовое устройство. Различные образцы молока от отдельных фермеров Бельгии собирали и декларировали как не содержащие антибиотиков. pH, количество соматических клеток и содержание жира и белка анализировали с помощью устройства "Fossomatic 5000" (Фосс, Дания). Каждый образец разделяли на три подмножества. В каждое подмножество затем вносили 0, 3 или 4 нг/г пенициллина G. После этого тест осуществляли фактически так, как описано в примере 3. Результаты (данные не показаны), демонстрируют, что молочная композиция (образцы молока варьировали по pH от 6,57 до 7,15; по количеству клеток от 20 000 до 6 993 000; по содержанию жира от 0,26% (мас./мас.) до 8,32% (мас./мас.); а по содержанию белка от 3,11% (мас./мас.) до 4,53% (мас./мас. не оказывает влияния на эффективность тестового устройства. Ни один из образцов с 0 нг/г пенициллинаG не был определен как положительный. Пример 28. Влияние стадии перемешивания на тестовое устройство. Тест осуществляли фактически так, как описано в примере 3, при условии, что были применены различные стадии перемешивания. Стадии перемешивания, которые были осуществлены в соответствии со следующими способами: способ а) нет стадий перемешивания; способ b) одну стадию перемешивания (10 с) осуществили после добавления молока к меченому связывающему антибиотик белку и последующей инкубации полученной жидкой композиции, но перед контактом тестового устройства с полученной жидкой композицией; способ с) одну стадию перемешивания (10 с) осуществили после добавления молока к меченому связывающему антибиотик белку, но перед последующей инкубацией полученной жидкой композиции; способ d) первую стадию перемешивания (5 с) осуществили после добавления молока к меченому связывающему антибиотик белку, но перед последующей инкубацией полученной жидкой композиции, а вторую стадию перемешивания (10 с) осуществляли после последующей инкубации полученной жидкой композиции, но перед контактом тестового устройства с полученной жидкой композицией; способ е) первую стадию перемешивания (10 с) осуществляли после добавления молока к меченому связывающему антибиотик белку, но перед последующей инкубации полученной жидкой композиции, а вторую стадию перемешивания (10 с) осуществляли после последующей инкубации полученной жидкой композиции, но перед контактом тестового устройства с полученной жидкой композицией. Результаты представлены в табл. 16. Результаты демонстрируют, что отсутствие перемешивания отрицательно влияет на интенсивность сигнала контрольной зоны и зоны обнаружения. Кроме того, результаты демонстрируют, что нет различия, когда осуществляются одна или две стадии перемешивания. Одна, также как и две стадии перемешивания приводят к высокой интенсивности сигнала контрольной зоны и зоны обнаружения. Пример 29. Влияние температуры на тест. Тест осуществляли фактически так, как описано в примере 3, при условии, что тест осуществляли при различных температурах (4, 20 или 31,5 С). Результаты представлены в табл. 17. Результаты демонстрируют, что температура, при которой тест осуществлен, не влияет на интенсивности зоны обнаружения и зоны контроля. Пример 30. Влияние изначальной температуры молока на тест. Тест осуществляли фактически так, как описано в примере 3, при условии, что тест был осуществлен с молоком, имеющим различные изначальные температуры (0, 4, 20 или 45 С). Молоку позволяли достичь комнатной температуры незадолго до осуществления теста. Результаты представлены в табл. 18. Результаты демонстрируют, что изначальная температура молока не влияет на интенсивности зоны обнаружения и зоны контроля. Таблица 1 Обнаружение антибиотиков с помощью тестового устройства по изобретению 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 3: высокая интенсивность. Таблица 2 Интенсивность сигнала зоны обнаружения для различных мембран в области приема образца, измеренная по абсорбции 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал; 2 0: не детектируется; 1: очень плохо; 2: плохо; 3: средне; 4: хорошо; 5: очень хорошо Талица 3 Интенсивность сигнала зоны обнаружения и общее время теста для различных типов мембраны в области обнаружения 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал Таблица 4 Интенсивность сигнала и форма зоны обнаружения для различных концентраций антибиотика, иммобилизованного в зоне обнаружения 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал; 2 0: не детектируется; 1: очень плохо; 2: плохо; 3: средне; 4: хорошо; 5: очень хорошо Таблица 5 Интенсивность сигнала и форма контрольной зоны для различных растворов, нанесенных на контрольную зону Таблица 6 Интенсивность сигнала зоны обнаружения для различных солюбилизирующих буферов 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал Таблица 7 Интенсивность сигнала зоны обнаружения для буферов с различными концентрациями Triton Х-100 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал Таблица 8 Интенсивность сигнала зоны обнаружения для буферов с различными концентрациями BSA 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал Таблица 9 Интенсивность сигнала зоны обнаружения для буферов с различными концентрациями глицерина 0: невидимый; 1: очень слабый сигнал; 2: слабый сигнал; 3: средний сигнал; 4: сильный сигнал; 5: очень сильный сигнал Таблица 10 Интенсивность сигнала зоны обнаружения для буферов с различными концентрациями сахарозы Таблица 11 Интенсивность сигнала зоны обнаружения для различных способов сушки при различных концентрациях сахарозы, измеренная по абсорбции Таблица 12 Обнаружение нескольких антибиотиков с помощью тестового устройства по изобретению 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 5: высокая интенсивность. Таблица 13 Обнаружение Пенициллина G с помощью тестового устройства по изобретению в различных молочных матрицах 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 3: высокая интенсивность. Таблица 14 Обнаружение Пенициллина G с помощью тестового устройства по изобретению после хранения тестового устройства при 4 С Таблица 15 Обнаружение Пенициллина G с помощью тестового устройства по изобретению после хранения тестового устройства при -20 или 30 С 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 3: высокая интенсивность. Таблица 16 Обнаружение Пенициллина G с помощью тестового устройства по изобретению после различных стадий перемешивания 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 3: высокая интенсивность. Таблица 17 Обнаружение Пенициллина G с помощью тестового устройства по изобретению при различных температурах 0: отсутствие интенсивности; 1: низкая интенсивность; 2: средняя интенсивность; 3: высокая интенсивность. Таблица 18 Обнаружение Пенициллина G с помощью тестового устройства по изобретению с помощью молока,имеющего различные начальные температурыa) контакта жидкого образца с меченым связывающим антибиотик белком из Bacillus stearothermophilus и меченым контрольным реактивом, где меченый связывающий антибиотик белок и меченый контрольный реактив находятся в контейнере, для образования жидкой композиции;b) обеспечения тестового устройства, имеющего проксимальный и дистальный концы, где указанное тестовое устройство выполнено таким образом, чтобы обеспечить латеральный поток из проксимального в дистальный конец, и где указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца:ii) область обнаружения, содержащая по меньшей мере две зоны:i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца;ii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив, иc) контакта жидкой композиции с областью приема образца в тестовом устройстве;d) обеспечения передвижения жидкой композиции из области приема образца через область обнаружения в абсорбирующую область, с тем чтобы позволить жидкой композиции, содержащей меченый связывающий антибиотик белок и меченый контрольный реактив, войти в контакт с зоной обнаружения и контрольной зоной;i) об отсутствии антибиотика в образце свидетельствует наличие сигнала в зоне обнаружения, который более интенсивен, чем сигнал в контрольной зоне, иii) о присутствии антибиотика в образце свидетельствует отсутствие сигнала в зоне обнаружения или наличие сигнала в зоне обнаружения, который менее интенсивен, чем сигнал в контрольной зоне. 2. Способ по п.1, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце. 3. Способ по любому из пп.1 и 2, в котором жидкая композиция инкубируется в течение от 30 с до 5 мин перед контактом с тестовым устройством. 4. Способ по любому из пп.1-3, в котором жидкая композиция инкубируется при 40-70 С перед контактом с тестовым устройством. 5. Способ по любому из пп.1-4, в котором меченый связывающий антибиотик белок и меченый контрольный реактив находятся в виде порошка перед тем, как они контактируют с жидким образцом. 6. Способ по любому из пп.1-5, в котором меченый связывающий антибиотик белок получают из чувствительного к антибиотикам микроорганизма. 7. Способ по любому из пп.1-6, в котором метки на связывающем антибиотик белке и контрольном реактиве являются одинаковыми. 8. Способ по любому из пп.1-7, в котором связывающий антибиотик белок и контрольный реактив помечены частицей золота. 9. Способ по любому из пп.1-8, в котором используют контрольный реактив, не способный связаться с антибиотиком в образце. 10. Способ по любому из пп.1-9, в котором тестовое устройство является тестовой полоской. 11. Способ по любому из пп.1-10, в котором иммобилизованный антибиотик связан с твердой подложкой посредством конъюгата спейсер-белок. 12. Способ по любому из пп.1-11, в котором тестовое устройство контактирует с жидкой композицией в течение 1-5 мин при температуре 40-70 С. 13. Способ по любому из пп.1-12, в котором образец является молоком. 14. Тестовое устройство для обнаружения антибиотика в образце, где указанное тестовое устройство имеет проксимальный и дистальный концы, указанное тестовое устройство выполнено таким образом,чтобы обеспечить латеральный поток жидкой композиции, содержащей жидкий образец, меченый связывающий антибиотик белок и меченый контрольный реактив, из проксимального в дистальный конец,указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца: область приема образца; область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, иii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив; абсорбирующую область,где область приема образца является покрытой поливиниловым спиртом стекловолоконной мембраной. 15. Тестовое устройство по п.14, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце. 16. Набор, содержащий контейнер, содержащий меченый связывающий антибиотик белок и меченый контрольный реактив,и тестовое устройство по п.14 или 15. 17. Набор, содержащий контейнер, содержащий меченый связывающий антибиотик белок из Bacillus stearothermophilus и меченый контрольный реактив, и тестовое устройство для обнаружения антибиотика в образце, где указанное тестовое устройство,имеющее проксимальный и дистальный концы, выполнено таким образом, чтобы обеспечить латеральный поток жидкой композиции, содержащей жидкий образец, меченый связывающий антибиотик белок и меченый контрольный реактив, из проксимального в дистальный конец, и где указанное тестовое устройство содержит твердую подложку, содержащую следующие области в последовательности от проксимального конца до дистального конца: область приема образца; область обнаружения, указанная область обнаружения содержит по меньшей мере две зоны:i) зона обнаружения, содержащая иммобилизованный антибиотик, способный связывать меченый связывающий антибиотик белок, когда указанный связывающий антибиотик белок не является связанным с антибиотиком из образца, иii) контрольная зона, содержащая иммобилизованный связывающий агент, способный связывать меченый контрольный реактив; абсорбирующую область. 18. Набор по п.17, где содержащаяся в тестовом устройстве твердая подложка дополнительно содержит область для манипулирования на дистальном конце.
МПК / Метки
МПК: G01N 33/558
Метки: обнаружения, иммуноанализ, антибиотиков
Код ссылки
<a href="https://eas.patents.su/22-24423-immunoanaliz-dlya-obnaruzheniya-antibiotikov.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуноанализ для обнаружения антибиотиков</a>
Предыдущий патент: Фармацевтически приемлемые сокристаллы n-[2-(7-метокси-1-нафтил)этил]ацетамида и способы их получения
Следующий патент: Эмульсионное водоустойчивое взрывчатое вещество (варианты) и эмульсионный состав для водоустойчивых взрывчатых веществ
Случайный патент: Способ получения хирально чистого n-(транс-4- изопропилциклогексилкарбонил)-d-фенилаланина и его кристаллических модификаций