Процесс получения соединений для применения в качестве ингибиторов sglt2
Номер патента: 24368
Опубликовано: 30.09.2016
Авторы: Хоупис Иоаннис Н., Лемэр Себастьен Франсуа Эмманюэль, Фарина Витторио
Формула / Реферат
1. Способ получения соединения формулы (I-S)
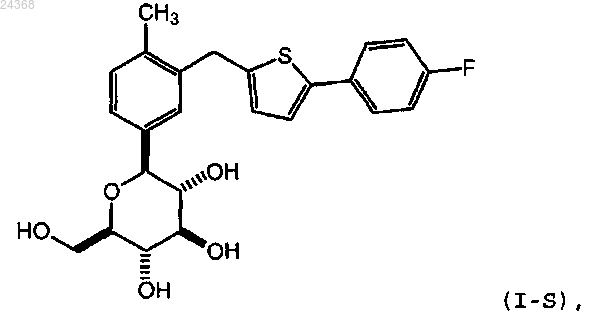
или его сольвата, включающий
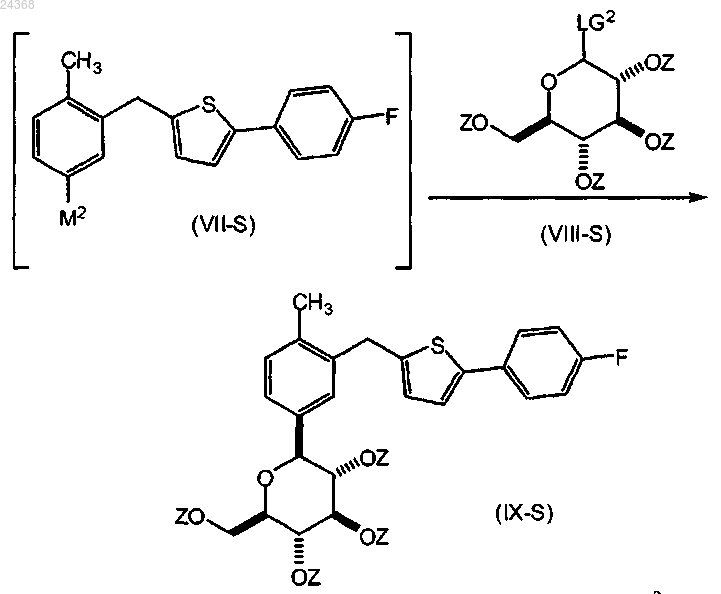
взаимодействие соединения формулы (VII-S), где М2 представляет собой цинксодержащий фрагмент, выбранный из ZnBr, ZnI и трифлата цинка, с соединением формулы (VIII-S), где каждый Z представляет пивалоил и LG2 представляет собой бром; в смеси простого эфира и углеводородного растворителя; где простой эфир выбирают из группы, состоящей из ди-н-бутилового эфира и циклопентилметилового эфира, с образованием соответствующего соединения формулы (IX-S)
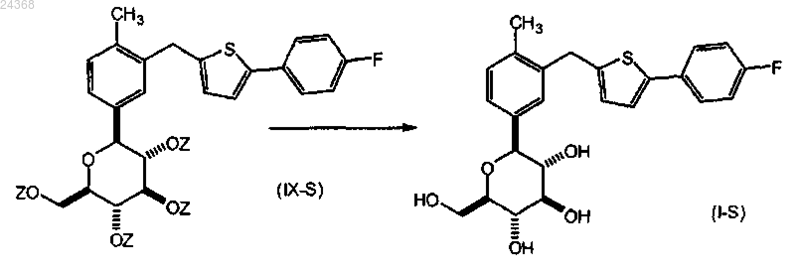
снятие защиты с соединения формулы (IX-S); с образованием соответствующего соединения формулы (I-S).
2. Способ по п.1, в котором М2 представляет собой ZnBr.
3. Способ по п.1, в котором соединение формулы (VIII-S) присутствует в количестве от приблизительно 0,8 до приблизительно 1,25 мол.экв.
4. Способ по п.3, в котором соединение формулы (VIII-S) присутствует в количестве от приблизительно 1,0 до приблизительно 1,1 мол.экв.
5. Способ по п.1, в котором углеводородный растворитель представляет собой толуол.
6. Способ по п.1, в котором соединение формулы (VIII-S) в растворе углеводородного растворителя добавляют к раствору соединения формулы (VII-S) в эфирном растворителе.
7. Способ по п.1, в котором соединение формулы (VII-S) взаимодействует с соединением формулы (VIII-S) при температуре в диапазоне от приблизительно 60 до приблизительно 95°С.
8. Способ по п.1, дополнительно включающий
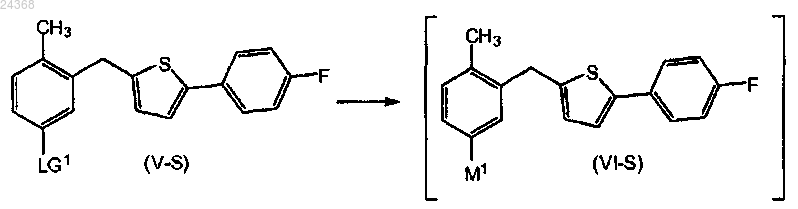
взаимодействие соединения формулы (V-S), в котором LG1 представляет собой уходящую группу, выбранную из брома или йода; с литийорганическим реагентом; в смеси простого эфира в качестве растворителя и углеводородного растворителя, где простой эфир выбран из группы, состоящей из ди-н-бутилового эфира и циклопентилметилового эфира; с получением соединения формулы (VI-S), в котором М1 представляет собой литий
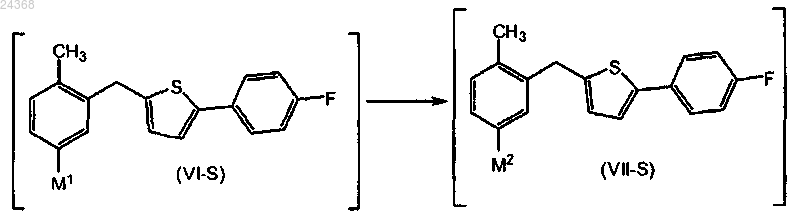
взаимодействие соединения формулы (VI-S) с солью цинка или комплексом амина и галогенида цинка; в смеси простого эфира и углеводородного растворителя, где простой эфир выбран из группы, состоящей из ди-н-бутилового эфира и циклопентилметилового эфира; с получением соответствующего соединения формулы (VII-S).
9. Способ по п.8, в котором литийорганический реагент представляет собой н-гексиллитий.
10. Способ по п.8, в котором литийорганический реагент присутствует в количестве от приблизительно 0,5 до приблизительно 2,0 мол.экв.
11. Способ по п.10, в котором литийорганический реагент присутствует в количестве от приблизительно 1,0 до приблизительно 1,2 мол.экв.
12. Способ по п.8, в котором углеводородный растворитель представляет собой толуол.
13. Способ по п.8, в котором соединение формулы (V-S) взаимодействует с литийорганическим реагентом при температуре в диапазоне от приблизительно -78°С до приблизительно комнатной температуры.
14. Способ по п.8, в котором соль цинка выбирают из группы, состоящей из дибромида цинка (ZnBr2), дийодида цинка (ZnI2) и дитрифлата цинка, и в котором комплекс амина и галогенида цинка выбирается из группы, состоящей из комплекса пиридина и бромида цинка и комплекса N-метилморфолина и бромида цинка.
15. Способ по п.8, в котором соединение формулы (VI-S) взаимодействует с солью цинка и в котором соль цинка представляет собой дибромид цинка.
16. Способ по п.15, где бромид цинка присутствует в количестве в диапазоне от приблизительно 0,33 до приблизительно 1,0 мол.экв.
17. Способ по п.16, в котором дибромид цинка присутствует в количестве приблизительно 0,5 мол.экв.
18. Способ по п.8, в котором соединение формулы (VI-S) взаимодействует с солью цинка в присутствии амина или соли лития.
19. Способ по п.18, в котором амин или соль лития выбираются из группы, состоящей из бромида лития, йодида лития, пиридина, N-метил морфолина, 2,6-лутидина и ТМЭДА, и в котором амин или соль лития предпочтительно присутствуют в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв.
Текст
ПРОЦЕСС ПОЛУЧЕНИЯ СОЕДИНЕНИЙ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ SGLT2 Изобретение направлено на создание нового способа получения соединений формулы (I-S) или сольвата, включающего следующие стадии: взаимодействие соединения формулы (VII-S), где М 2 представляет собой цинксодержащий фрагмент, с соединением формулы (VIII-S), где каждый Z представляет пивалоил и LG2 представляет собой бром; в смеси простого эфира и углеводородного растворителя; где простой эфир выбирают из группы, состоящей из ди-нбутилового эфира и циклопентилметилового эфира, с образованием соответствующего соединения формулы (IX-S) Фарина Витторио, Лемэр Себастьен Франсуа Эмманюэль, Хоупис Иоаннис Н. (BE)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Перекрестные ссылки на смежные изобретения Настоящая заявка истребует приоритет, заявленный в предварительной заявке на патент США 61/251,378, поданной 14 октября 2009 г., содержание которой полностью включено в настоящий документ путем ссылки. Область применения изобретения Настоящее изобретение направлено на новый процесс получения соединений, оказывающих ингибирующее действие на натрий-зависимых переносчиков глюкозы (НЗПГ), присутствующих в кишечнике или почках. Предпосылки создания изобретения Диетотерапия и лечебная физкультура играют важную роль в лечении сахарного диабета. Если данные виды терапии не позволяют в достаточной мере контролировать состояние пациента, для лечения диабета дополнительно применяется инсулин или вводимый перорально противодиабетический препарат. В настоящее время в качестве противодиабетических препаратов применяются бигуанидные соединения, соединения сульфанил-мочевины, вещества, снижающие резистентность к инсулину и ингибиторы а-глюкозидазы. Однако данные противодиабетические препараты имеют ряд побочных эффектов. Например, бигуанидные соединения вызывают лактацидоз, соединения сульфанил-мочевины вызывают значительную гипогликемию, препараты, снижающие резистентность к инсулину, приводят к отекам и сердечной недостаточности, а ингибиторы а-глюкозидазы вызывают вздутие живота и диарею. Учитывая данные обстоятельства, желательно разработать новые препараты для лечения сахарного диабета, не имеющие таких побочных эффектов. Недавно были получены данные о том, что с началом и прогрессивным развитием сахарного диабета связана гипергликемия (так называемая теория глюкозной токсичности). В частности, хроническая гипергликемия приводит к снижению секреции инсулина и чувствительности к нему, в результате чего возрастает концентрация глюкозы в крови, таким образом течение диабета самопроизвольно ухудшается(1985); Rossetti, L. et al., "Glucose Toxicity", Diabetes Care, vol. 13, issue 6, p. 610-630 (1990. Следовательно, при лечении гипергликемии вышеупомянутый порочный круг разрывается, благодаря чему становится возможной профилактика и лечение сахарного диабета. Одним из возможных методов лечения гипергликемии является экскретирование избыточной глюкозы непосредственно в мочу с нормализацией концентрации глюкозы в крови. Например, при ингибировании натрий-зависимого переносчика глюкозы, присутствующего в проксимальных извитых почечных канальцах, блокируется обратное поглощение глюкозы в почках, что способствует экскретированию глюкозы в мочу и снижению уровня глюкозы в крови. Доказано, что при экспериментально индуцированном диабете у животных постоянное подкожное введение флоризина, обладающего ингибиторной активностью в отношении НЗПГ, приводит к нормализации гипергликемии, и глюкоза в крови животного может поддерживаться на нормальном уровне в течение длительного времени, что приводит к улучшению секреции инсулина и резистентности к инсулину; Rossetti, L., et al., Correction of Hyperglycemiain diabetic rats with phlorizin treatment reverses insulin-resistant glucose transport in adipose cells without restoring glucose transporter gene expression", J. Clin. Invest., 1991, vol. 87, p. 561-570). Кроме того, при длительном лечении экспериментально индуцированного диабета при помощи ингибиторов НЗПГ у животных улучшается секреторный инсулиновый ответ, а также чувствительность к инсулину, в отсутствие неблагоприятного воздействия на почки и баланс электролитов в крови, в результате чего профилактируется возникновение и развитие диабетической нефропатии Kenji T. et al.,Na+-Glucose (SGLT) Inhibitors as Antidiabetic Agents. 4. Synthesis and Pharmacological Properties of 4'-Dehydroxyphlorizin Derivatives Substituted on the В Ring", J. Med. Chem., (1999), Vol. 42, p. 5311-5324);Na+-glucose cotransporter inhibitor T-1095", British Journal of Pharmacology, (2001), vol. 132, issue 2, p. 578586; Ueta, K., et al., "Long Term Treatment with the Na+ Glucose Co-transporter Inhibitor T-1095 causes Sustained Improvement in Hyperglycemia and Prevents Diabetic Neuropathy in Goto-Kakizaki Rats", Life Sci.,(2005), vol. 76, issue 23, p. 2655-2668) Исходя из вышесказанного, можно ожидать, что ингибиторы НЗПГ будут улучшать секрецию инсулина и снижать резистентность к инсулину за счет снижения концентрации глюкозы в крови у больных диабетом и дальнейшего предотвращения развития и прогресса сахарного диабета и его осложнений. Изложение сущности изобретения Настоящее изобретение направлено на создание способа получения соединений формулы (I-S) или его сольвата (также известно как 1-(-D-глюкопиранозил)-4-метил-3-[5-(4-фторфенил)-2-(I-S),тиенилметил]бензол); включающего взаимодействие соединения формулы (VII-S), где М 2 представляет собой цинксодержащее соединение, выбранное из ZnBr, ZnI и трифлата цинка, с соединением формулы (VIII-S), где каждая Z представляет пивалоил и LG2 представляет собой бром; в смеси простого эфира и углеводородного растворителя; где простой эфир выбирают из группы, состоящей из ди-н-бутилового эфира и циклопентилметилового эфира, с образованием соответствующего соединения формулы (IX-S) снятие защиты с соединения формулы (IX-S); с образованием соответствующего соединения формулы (I-S). В предпочтительном варианте выполнения способа М 2 представляет собой ZnBr. Согласно настоящему способу соединение формулы (VIII-S) присутствует в количестве от приблизительно 0,8 до приблизительно 1,25 мол.экв. Более предпочтительно соединение формулы (VIII-S) присутствует в количестве от приблизительно 1,0 до приблизительно 1,1 мол.экв. Предпочтительным углеводородным растворителем является толуол. В одном из вариантов выполнения способа соединение формулы (VIII-S) в растворе углеводородного растворителя добавляют к раствору соединения формулы (VII-S) в эфирном растворителе. Предпочтительно взаимодействие соединения формулы (VII-S) с соединением формулы (VIII-S) проводят при температуре в диапазоне от приблизительно 60 до приблизительно 95 С. Способ настоящего изобретения, дополнительно включающий взаимодействие соединения формулы (V-S), в котором LG1 представляет собой уходящую группу,-2 024368 выбранную из брома или йода, с литийорганическим реагентом; в смеси простого эфира в качестве растворителя и углеводородного растворителя; с получением соединения формулы (VI-S), в котором М 1 представляет собой литий взаимодействие соединения формулы (VI-S) с солью цинка или комплексом амина и галогенида цинка; в смеси простого эфира и углеводородного растворителя; с получением соответствующего соединения формулы (VII-S). Предпочтительным литийорганическим реагентом является н-гексиллитий. Предпочтительно литийорганический реагент присутствует в количестве от приблизительно 0,5 до приблизительно 2,0 мол.экв. Еще более предпочтительно литийорганический реагент присутствует в количестве от приблизительно 1,0 до приблизительно 1,2 мол.экв. Простой эфир в качестве растворителя представляет собой ди-н-бутиловый эфир или циклопентилметиловый эфир, а углеводородный растворитель представляет собой толуол. Согласно данному варианту способа соединение формулы (V-S) взаимодействует с литийорганическим реагентом при температуре в диапазоне от приблизительно -78 С до приблизительно комнатной температуры. При этом соль цинка выбирают из группы, состоящей из дибромида цинка (ZnBr2), дийодида цинка (ZnI2) и дитрифлата цинка; и в котором комплекс амина и галогенида цинка выбирается из группы, состоящей из комплекса пиридина и бромида цинка и комплекса N-метилморфолина и бромида цинка. В предпочтительном варианте способа соединение формулы (VI-S) взаимодействует с солью цинка; и в котором соль цинка представляет собой дибромид цинка. Бромид цинка присутствует в количестве в диапазоне от приблизительно 0,33 до приблизительно 1,0 мол.экв. Предпочтительно дибромид цинка присутствует в количестве приблизительно 0,5 мол.экв. Согласно данному варианту способа соединение формулы (VI-S) взаимодействует с солью цинка в присутствии амина или соли лития. При этом амин или соль лития выбираются из группы, состоящей из бромида лития, йодида лития, пиридина, N-метил морфолина, 2,6-лутидина и ТМЭДА; причем амин или соль лития предпочтительно присутствуют в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв. Иллюстрацией изобретения является фармацевтический препарат, состоящий из фармацевтически приемлемого носителя и 1-(-D-глюкопиранозил)-4-метил-3-[5-(4-фторфенил)-2-тиенилметил]бензола,полученного в соответствии с представленным способом, описанным в настоящем документе. Фармацевтический препарат на основе соединения, полученного заявленным способом, получают путем смешивания 1-(-D-глюкопиранозил)-4-метил-3-[5-(4-фторфенил)-2-тиенилметил]бензола, полученного в соответствии со способом настоящего изобретения, описанного в настоящем документе, и фармацевтически приемлемого носителя. Соединение, полученное настоящим способом, может использоваться для лечения заболеваний, опосредованных НЗПГ (включая лечение или задержку развития или возникновения сахарного диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, медленного заживления ран, резистентности к инсулину, гипергликемии, гиперинсулинемии, повышенного уровня жирных кислот в крови, повышенного уровня глицерина в крови, гиперлипидемии,ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза или повышенного давления) путем введения пациенту терапевтически эффективного количества соединения или фармацевтического препарата, указанного выше. Данное соединение также может быть полезным в лечении сахарного диабета 1 и 2 типов путем введения пациенту терапевтически эффективного количества его или фармацевтического препарата, содержащего его, отдельно или в сочетании по меньшей мере с одним из противодиабетических препаратов, препаратов для лечения осложнений диабета, препаратов для лечения ожирения, противогипертонических препаратов, противотромбоцитарных препаратов, противоатеросклеротических препаратов и/или гиполипидемических препаратов. Подробное описание изобретения Настоящее изобретение направлено на создание способа получения соединения формулы (I-S) и его сольватов; как будет описано подробнее. Соединение формулы (I-S) проявляет ингибиторную активность в отношении натрий-зависимого переносчика глюкозы, присутствующего в кишечнике и почках млекопитающих, и могут применяться при лечении сахарного диабета или осложнений диабета,таких как диабетическая ретинопатия, диабетическая нейропатия, диабетическая нефропатия, ожирение и медленное заживление ран. Соединение настоящего изобретения может находиться в виде стереоизомеров и смеси изомеров,каждый отдельный чистый или преимущественно чистый изомер. Например, настоящее соединение может дополнительно иметь один или несколько асимметричных центров на атоме углерода, несущего любой из заместителей. Следовательно, соединение может присутствовать в форме энантиомера или диастереоизомера или их смеси. Если настоящее соединение получено в форме диастереоизомера или энантиомера, их можно разделить традиционным способом, например хроматографией или дробной кристаллизацией. Кроме того, к настоящему соединению (I-S) относятся его сольваты. Следующие сокращения использованы в спецификации, в частности в схемах и примерах:AcOEt = уксусно-этиловый эфир,ЦПМЭ = циклопентилметиловый эфир,ДИ (вода) = деионизированная вода ДМАП = 4-диметиламинопиридин,ВЭЖХ = высокоэффективная жидкостная хроматография,ИПС = изопропиловый спирт 2-Ме-ТТФ = 2-метилтетрагидрофуран,ЖХСД = жидкостная хроматография среднего давления,МТБЭ = метил-т-бутиловый эфир,n-BuLi = н-бутил литий,Pd/C = палладиевый катализатор на углеродном носителе,Pd(OAc)2/Et3SiH = комплекс ацетата палладия и триэтилсилана,RaNi = никель Ренея (алюмоникелевый сплав),КДК = круглодонная колба,ТЭА = триэтиламин,ТГФ = тетрагидрофуран,ТМЭДА = тетраметилэтилендиамин,ТМС = триметилсилил,ТМС-Br = триметилсилилбромид,ТМС-СН 2 = триметилсилил-СН 2-. Если не указано иначе, используемый в настоящем документе термин "изолированная форма" означает, что соединение присутствует в форме, которая отделена от любой твердой смеси с другим соединением (соединениями), системы раствора или биологической среды. В одном варианте осуществления продукт получают по процессу, описанному в настоящем документе, а именно, соединение формулы (IS) в изолированной форме. Если не указано иначе, используемый в настоящем документе термин "преимущественно чистый" означает, что молярная процентная доля примесей в изолированном соединении составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящее изобретение относится к процессу получения соединения формулы (I-S), при этом соединение формулы (I-S) является преимущественно чистым. Если не указано иначе, используемый в настоящем документе термин "преимущественно свободный от соответствующих солевых форм" применительно к описанию соединения формулы (I-S) означает, что молярная доля соответствующих солевых форм в изолированной основной форме соединения составляет менее приблизительно 5 мол.%, предпочтительно менее приблизительно 2 мол.%, более предпочтительно менее приблизительно 0,5 мол.%, наиболее предпочтительно менее приблизительно 0,1 мол.%. В одном из вариантов осуществления настоящее изобретение относится к процессу получения со-4 024368 единения формулы (I-S) является преимущественно свободным от соответствующих солевых форм. Используемый в настоящем документе термин "лечение" и ему подобные включают, если не указано иначе,ведение субъекта или пациента (предпочтительно млекопитающего, более предпочтительно человека) и уход за ним с целью противостояния болезни, патологическому состоянию либо расстройству, и включает введение соединения настоящего изобретения для предупреждения возникновения симптомов или осложнений, облегчения симптомов или осложнений, либо устранения болезни, патологического состояния или расстройства. Термин "профилактика" в настоящем документе, если не указано иное, означает (а) снижение частоты одного или нескольких симптомов; (b) снижение тяжести одного или нескольких симптомов; (с) задержку или предотвращение развития дополнительных симптомов; и/или (d) задержку или предотвращение развития заболевания или состояния. Специалисту в данной области будет понятно, что в тех случаях, когда упоминается способ предупреждения, субъектом, нуждающимся в этом (т.е. субъектом, нуждающимся в предупреждении), следует считать любого субъекта или пациента (предпочтительно млекопитающего, более предпочтительно человека), который ощущает или у которого наблюдается по меньшей мере один симптом заболевания,расстройства или состояния, развитие которое необходимо предупредить. Более того, нуждающийся в предупреждении субъект может также быть субъектом (предпочтительно млекопитающим, более предпочтительно человеком), пока не проявившим никаких симптомов расстройства, болезни или патологического состояния, требующих предупреждения, но имеющим по мнению врача либо другого медицинского специалиста риск развития указанного расстройства, болезни или патологического состояния. Например, субъект может быть подвержен риску развития расстройства, заболевания или патологического состояния (и поэтому нуждаться в предупреждении или превентивном лечении) с учетом его истории болезни, включая, помимо прочего, наследственность, предрасположенность, сопутствующие расстройства или состояния, генетическую предрасположенность и тому подобное. Используемый в настоящем документе термин "субъект" обозначает животное, предпочтительно млекопитающее, более предпочтительно человека, которое являлось объектомлечения, наблюдения или эксперимента. Предпочтительно субъект перенес и/или продемонстрировал по меньшей мере один симптом болезни или расстройства для лечения и/или предупреждения. Используемый в настоящем документе термин "терапевтически эффективное количество" обозначает такое количество активного соединения или фармацевтического агента, которое вызывает биологически или терапевтически значимый ответ со стороны системы тканей/органов, организма животного или человека, ожидаемый исследователем, ветеринаром, врачом или иным клиницистом, и который включает облегчение симптоматики заболевания или патологического состояния, подвергшегося лечению. Используемый в настоящем документе термин "лекарственный препарат/ композиция", как предполагается, обозначает продукт, включающий определенные ингредиенты в определенных количествах,также как любой продукт, являющийся прямым либо опосредованным результатом комбинирования таких специфических ингредиентов в специфических количествах. Соединение формулы (I-S), составляющее предмет настоящего изобретения, проявляет очень высокую ингибиторную активность в отношении натрий-зависимого переносчика глюкозы и очень сильный эффект в отношении снижения концентрации глюкозы в крови. Следовательно, соединение, составляющее предмет настоящего изобретения, может применяться для лечения или задержки развития или возникновения сахарного диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, медленного заживления ран, резистентности к инсулину, гипергликемии, гиперинсулинемии, повышенного уровня жирных кислот в крови, повышенного уровня глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, синдрома X, осложнений диабета, атеросклероза или повышенного давления. В частности, соединение в рамках настоящего изобретения может применяться для лечения и профилактики сахарного диабета (сахарный диабет 1 и 2 типов и т.п.), осложнений диабета(например, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии) или ожирения, а также может применяться для лечения гипергликемии, возникающей после приема пищи. Соединение формулы (I-S) в рамках настоящего изобретения или сольват этого соединения может вводиться перорально или парентерально и может применяться в форме соответствующего фармацевтического препарата. Соответствующие фармацевтические препараты для перорального введения включают, например, твердые лекарственные формы, такие как таблетки, гранулы, капсулы, порошки и т.п. или жидкие лекарственные формы в виде растворов, суспензий, эмульсий и т.п. К соответствующим фармацевтическим препаратам для парентерального введения относятся, например, суппозитории; инъекционные препараты и препараты для внутривенных капельных вливаний на основе дистиллированной воды для инъекций, физиологического раствора или водного раствора глюкозы; или ингаляционные препараты. Дозировка настоящего соединения формулы (I-S) может различаться в зависимости от метода введения, возраста, массы тела, состояния пациента, типа и тяжести заболевания, лечение которого осуществляется, и обычно находится в диапазоне от приблизительно 0,01 до около 300 мг/кг/день, либо в лю-5 024368 бом меньшем диапазоне, предпочтительно в диапазоне от приблизительно 0,1 до приблизительно 50 мг/кг/день, либо в любом меньшем диапазоне, предпочтительно в диапазоне от приблизительно 0,1 до приблизительно 30 мг/кг/день, либо в любом меньшем диапазоне. В одном из вариантов осуществления изобретения соединение формулы (I-S) вводится нуждающемуся в этом субъекту в дозе от приблизительно 0,01 мг/кг в сутки до приблизительно 15 мг/кг в сутки, или в любой дозе в этом диапазоне. Соединение формулы (I-S) может при необходимости использоваться в сочетании с одним или несколькими другими противодиабетическими препаратами, одним или несколькими препаратами для лечения осложнений диабета и (или) одним или несколькими препаратами для лечения других заболеваний. Настоящее соединение и указанные прочие препараты могут вводиться в одной и той же лекарственной форме, в другой лекарственной форме для перорального введения, либо путем инъекции. К другим противодиабетическим препаратам относятся, например, противодиабетические и антигипергликемические препараты, в том числе инсулин, стимуляторы секреции инсулина или средства,повышающие чувствительность к инсулину, другие противодиабетические препараты, механизм действия которых не связан с ингибированием НЗПГ, предпочтительно могут использоваться 1, 2, 3 или 4 из перечисленных иных противодиабетических средств. Конкретными примерами таких препаратов являются бигуанидные соединения, соединения сульфанилмочевины, ингибиторы а-глюкозидазы, агонистыRXR и (или) ингибиторы глюкозо-6-фосфатазы. К препаратам для лечения других заболеваний относятся, например, препарат для лечения ожирения, антигипертензивный препарат, антитромбоцитарный препарат, антисклеротический препарат и/или гиполипидемический препарат. Ингибиторы НЗПГ формулы (I-S) могут при необходимости использоваться в сочетании с препаратами для лечения осложнений диабета. К таким препаратам относятся, например, ингибиторы протеинкиназы С (РКС) и/или ингибиторы ангиотензин-превращающего фермента (АСЕ). Дозировка препаратов может различаться в зависимости от возраста, массы тела и состояния пациентов, от метода введения, лекарственной формы и т.п. Указанные фармацевтические препараты могут перорально вводиться разным видам млекопитающих, включая людей, обезьян, собак и т.д., например, в лекарственной форме в виде таблетки, капсулы,гранулы или порошка, парентерально, в форме препарата для инъекции, интраназально, либо в форме трансдермального пластыря. Специалисту будет понятно, что если не указано иное, с получением необходимого продукта все стадии реакции проводятся согласно известным способам в надлежащих условиях. Специалистам в данной области также будет очевидно, что в техническом описании и в формуле изобретения, представленной в настоящем документе, в случае если реагент или класс/тип реагента (например, основание, растворитель и т.д.) указан для более чем одной стадии процесса, конкретные реагенты выбираются для каждой стадии независимо и могут быть одинаковыми или могут отличаться друг от друга. Например, для двух стадий процесса повторно упоминается в качестве реагента органическое или неорганическое основание, при этом органическое или неорганическое основание, выбранное для первой стадии, может быть тем же самым либо отличаться от органического или неорганического основания, используемого во второй реакции. Далее специалист в данной области определит, что если некоторая реакционная стадия в соответствии с настоящим изобретением может быть проведена в различных растворителях или системах растворителей, то указанная реакционная стадия может также быть проведена и в смеси соответствующих растворителей или систем растворителей. Примеры соответствующих целям настоящего изобретения растворителей, оснований, температур и иных условий проведения реакции и используемых компонентов даются в подробных описаниях ниже. Специалист в данной области определит, что список указанных примеров не призван и ни в коей мере не должен восприниматься как ограничение сущности настоящего изобретения, изложенного в приведенных далее пунктах формулы изобретения. Для большей сжатости описания ряд приводимых в данном документе количественных выражений дается в виде диапазона от приблизительно количества X до приблизительно количества Y. Подразумевается, что при указании диапазона значений диапазон не ограничивается указанными верхней и нижней границами, но включает полный диапазон от приблизительно количества X до приблизительно количества Y, или любое входящее в этот диапазон количество или меньший диапазон. Для достижения более точного описания некоторые из используемых в настоящем документе количественных выражений не сопровождаются термином "приблизительно". Необходимо понимать, что вне зависимости от того, используется ли явно термин "приблизительно" или нет, каждое приводимое в настоящем документе количество, подразумевает действительное численное значение, а также подразумевает разумное приближение к таковому численному значению, основанное на имеющихся у специалиста знаниях, включая приближение, основанное на экспериментальных условиях и (или) измерениях, имеющих отношение к таковому численному значению. Как используется в настоящем документе, если не определено иное, термин "уходящая группа" обозначает заряженный или незаряженный атом либо группу, которая уходит в процессе реакции замещения или переноса. Соответствующие примеры включают, помимо прочего, Br, Cl, I, мезилат, тозилат и им подобные. В ходе процессов получения соединений, составляющих предмет настоящего изобретения, может возникнуть необходимость в защите чувствительных или реакционных групп на любой из рассматриваемых молекул. Для этих целей могут использоваться стандартные защитные группы, например, описанные в книгах Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; and T.W.GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. Введенные защитные группы могут быть в последующем удалены на любой удобной для этого стадии с применением известных специалистам способов. Если не указано иначе, используемый в настоящем документе термин "кислородная защитная группа " означает группу, которая может быть присоединена к атому кислорода для защиты указанного атома от участия в реакции, и которая может быть снята после осуществления указанной реакции. К подходящим защитным группам для кислорода относятся, помимо прочего, ацетил, бензоил, трет-бутилдиметилсилил, триметилсилил (ТМС), MOM, THP и т.п. Прочие примеры подходящих групп, защищающих кислородную группу, могут быть указаны в работах, подобных T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 1991. В тех случаях, когда процесс получения соединения в соответствии с данным изобретением приводят к образованию смеси стереоизомеров, эти изомеры могут быть изолированы при помощи широко известных способов, таких как препаративная хроматография. Соединения могут быть получены в форме рацематов, либо индивидуальные энантиомеры могут быть получены в результате энантиоспецифического синтеза либо посредством разделения. Соединения могут, например, быть разделены на составляющие их энантиомеры при помощи стандартных способов, таких как формирование диастереомерных пар путем образования солей с оптически активными кислотами, как, например, (-)-ди-п-толуоил-Dвиннокаменная кислота и/или (+)-ди-п-толуоил-L-виннокаменная кислота с последующей фракционной кристаллизацией и восстановлением свободного основания. Соединения могут также быть разделены с помощью образования диастереометрических эфиров или амидов с последующим хроматографическим разделением и удалением хирального партнера. В альтернативном осуществлении соединения могут быть разделены при помощи хиральной колонки для HPLC. Специалистам в данной области будет очевидно, что в любом из процессов, описанных в настоящем документе, реакционноспособные заместители в соединении формулы (I-S), такие как гидроксигруппы, оксогруппы, карбоксильные группы и т.п., предпочтительно требуют защиты и последующего снятия защиты в соответствии с известными способами на соответствующих стадиях синтеза. В другом варианте осуществления настоящее изобретение относится к процессу получения соединения формулы (I-S), как описано ниже на схеме 2. Схема 2 В соответствии со схемой соединение формулы (V-S), содержащее соответствующие заместители, в котором LG1 представляет собой подходящую уходящую группу, например бром, йод и т.п., предпочтительно LG1 представляет собой бром или йод, является известным соединением или соединением, получаемым известными методами, взаимодействует с подходящим литийорганическим реагентом, например триметилсилилметиллитием, н-гексиллитием, сек-бутиллитием, н-бутиллитием, т-бутиллитием, метиллитием и т.п., предпочтительно с н-гексиллитием; где литийорганический реагент предпочтительно присутствует в количестве приблизительно 2,0 мол.экв., более предпочтительно в количестве от приблизительно от 0,5 до приблизительно 1,2 мол.экв.; в смеси подходящего простого эфира в качестве растворителя и подходящего углеводородного растворителя, где растворитель является, например, диэтиловым эфиром, диизопропиловым эфиром, ди-н-бутиловым эфиром, МТБЭ, циклопентилметиловым эфиром и т.п., предпочтительно ди-н-бутиловым эфиром или циклопентилметиловым эфиром; и где углеводородный растворитель представляет собой, например, толуол, фторбензол, хлорбензол, трифторбензол и т.п.,предпочтительно толуол; предпочтительно при температуре менее комнатной температуры, предпочтительнее, при температуре от около -78 С до приблизительно комнатной; с получением соответствующего соединения формулы (VI-S), где М 1 представляет собой литий. Предпочтительно, чтобы соединение формулы (VI-S) не выделялось. Соединение формулы (VI-S) взаимодействует с подходящей солью цинка, например бромидом цинка (ZnBr2), йодидом цинка (ZnI2), трифлатом цинка и т.п., предпочтительно ZnBr2; или с комплексом галогенида цинка и амина, например комплексом пиридина и бромида цинка, N-метилморфолина и бромида цинка и т.п.; где соль цинка или комплекс галогенида цинка с амином предпочтительно присутствует в количестве от приблизительно 0,33 до приблизительно 3,0 мол.экв., предпочтительнее, в количестве в диапазоне от приблизительно 0,33 до приблизительно 1,0 мол.экв., более предпочтительно в количестве приблизительно 0,5 мол.экв.; в смеси подходящего простого эфира в качестве растворителя и подходящего углеводородного растворителя, где растворитель является, например, диэтиловым эфиром,диизопропиловым эфиром, ди-н-бутиловым эфиром, МТБЭ, циклопентилметиловым эфиром и т.п.,предпочтительно ди-н-бутиловым эфиром или циклопентилметиловым эфиром; и где углеводородный растворитель представляет собой, например, толуол, фторбензол, хлорбензол, трифторбензол и т.п.,предпочтительно толуол. Предпочтительно использовать ту же смесь растворителей, как на предыдущей стадии реакции; с получением соответствующего соединения формулы (VII), где М 2 представляет собой соответствующие соединения цинка, например, если соль цинка представляет собой ZnBr2, соединение формулы (VII-S), M2-ZnBr; если соль цинка представляет собой ZnI2, соединение формулы (VII-S), M2ZnI; если соль цинка представляет собой дитрифлат цинка, соединение формулы (VII-S), М 2-трифлат цинка. Предпочтительно, чтобы соединение формулы (VII-S) не выделялось. Предпочтительно соединение формулы (VI-S) взаимодействует с солью цинка в присутствии подходящего амина или соли лития, например бромида лития, йодида лития, пиридина, N-метилморфолина,2,6-лютидина, ТМЭДА и т.п.; где амин или соль лития предпочтительно присутствуют в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв. Соединение формулы (VII-S) взаимодействует с соединением формулы (VIII-S), содержащим соответствующие заместители, где LG2 представляет собой подходящую уходящую группу, например бром,хлор, йод и т.п., предпочтительно бром; и где Z представляет собой независимо выбранную группу для защиты кислорода, например Z может представлять собой бензил, бензоил, пивалоил, изобутирил, рметоксибензил и т.п.; предпочтительно, когда все защитные группы Z одинаковы; предпочтительнее,когда все Z представляют собой пивалоил, известное соединение или соединение, полученное известными методами; где соединение формулы (VIII-S) предпочтительно присутствует в количестве от приблизительно 0,5 до приблизительно 3,0 мол.экв., или в любом количестве в этом диапазоне, предпочтительнее, в количестве от приблизительно 0,8 до приблизительно 1,25 мол.экв., или в любом количестве в этом диапазоне, предпочтительно в количестве от приблизительно 1,0 до приблизительно 1,1 мол.экв.; в смеси подходящего простого эфира в качестве растворителя и подходящего углеводородного растворителя, где растворитель является, например, диетиловым эфиром, ди-н-бутиловым эфиром, МТБЭ, 2 метил-ТГФ, циклопентилметиловым эфиром и т.п., предпочтительно ди-н-бутиловым эфиром или циклопентилметиловым эфиром; и где углеводородный растворитель представляет собой, например, толуол,фторбензол, хлорбензол, трифторбензол и т.п., предпочтительно толуол. Предпочтительно использовать ту же смесь растворителей, как на предыдущей стадии реакции; при температуре в пределах от приблизительно комнатной до приблизительно температуры кипения растворителя, предпочтительнее, при температуре от приблизительно 60 до приблизительно 95 С; с образованием соответствующего соединения формулы (IX-S). Предпочтительно, когда соединение формулы (VIII-S) в виде раствора в подходящем углеводородном растворителе, предпочтительнее в подходящем ароматическом углеводороде, например толуоле,ксилоле, фторбензоле, хлорбензоле, трифторбензоле и т.п.; добавляется к раствору соединения (VII) в подходящем эфирном растворителе, кроме ТГФ, например диизопропиловый эфир, 1,4-диоксан, 2-метилТГФ, МТБЭ, циклопентилметиловый эфир (ЦПМЭ), ди-н-бутиловый эфир, более предпочтительно ЦПМЭ или ди-н-бутиловый эфир. Предпочтительно, когда конечная смесь растворителей имеет объемное соотношение простого эфира в качестве растворителя: углеводородного растворителя от приблизительно 1:1 до приблизительно 1:3. Снятие защиты с соединения формулы (IX-S) производится известными способами с образованием соответствующего соединения формулы (I-S). Например, если каждая группа Z представляет собой пи-8 024368 ваноил, снятие защитной группы соединения формулы (IX-S) возможно путем реакции с подходящим алкоксидом или гидроксидом, например метоксидом натрия, этоксидом натрия, гидроксидом лития и т.п., в подходящем растворителе, например метаноле, этаноле и т.п., с получением соответствующего соединения формулы (I-S). Специалисту в данной области известно, что в зависимости от конкретной защитной группы Z для снятия защиты могут использоваться другие реагенты, включая, без ограничений, Pd/C, Pd(OH)2, PdCl2,Pd(OAc)2/Et3SiH, RaNi, подходящую кислоту, основание, фторид и т.п. Предпочтительно, когда соединение формулы (I-S) выделяется известными методами, например экстракцией, фильтрованием или колоночной хроматографией. Предпочтительно, когда соединение формулы (I) далее очищается известными методами, например перекристаллизацией. Соединение настоящего изобретения может использоваться в лекарственных препаратах, содержащих соединение, полученное по описанному в настоящем документе процессу, в комплексе с фармацевтически приемлемым носителем. Лекарственные препараты, содержащие в качестве активного ингредиента настоящее соединение, могут быть приготовлены при помощи тщательного смешивания соединения с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей. Носитель может иметь широкое разнообразие форм, в зависимости от предполагаемого способа введения (например, пероральный, парентеральный). Так, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, стабилизаторы, красители и тому подобные; для твердых пероральных лекарственных форм, таких как порошки, капсулы и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие агенты, смазки,связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. Твердые пероральные препараты также можно покрывать такими веществами, как сахар, или наносить кишечное покрытие, позволяющее модулировать основной участок абсорбции. Для парентерального введения носитель, как правило, состоит из стерильной воды, при этом, в целях улучшения растворимости или консервации, могут добавляться другие ингредиенты. Инъекционно вводимые суспензии или растворы также могут изготавливаться с использованием водных носителей вместе с соответствующими добавками. Для приготовления фармацевтических составов соединение настоящего изобретения в качестве активного ингредиента тщательно смешивается с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом такой носитель может иметь широкое разнообразие форм в зависимости от лекарственной формы, требуемой для предполагаемого способа введения, например пероральной или парентеральной, как, например, внутримышечное введение. При получении композиций для перорального введения можно использовать любое стандартное фармацевтическое средство. Так, для жидких пероральных лекарственных форм, таких как суспензии, эликсиры и растворы, приемлемые носители и добавки включают воду, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и тому подобные; для твердых пероральных лекарственных форм, таких как порошки, капсулы, таблетки в форме капсул и таблетки, приемлемые носители и добавки включают крахмалы, сахара, разбавители, гранулообразующие агенты, смазки, связывающие вещества, добавки для улучшения разрушаемости таблеток и тому подобные. В связи с легкостью назначения таблетки и капсулы представляют собой наиболее удобную в употреблении пероральную дозированную лекарственную форму, в которой с очевидностью используются твердые фармацевтические носители. При желании для таблеток можно применять сахарное или энтеропокрытие с применением стандартных методик. Для парентеральных лекарственных форм носитель, как правило, состоит из стерильной воды,хотя другие ингредиенты, например, в целях улучшения растворимости или консервации могут также включаться в состав. Также могут быть изготовлены инъекционно вводимые суспензии или растворы, в этом случае могут использоваться соответствующие водные носители, суспендирующие агенты и подобные компоненты. Описываемые в настоящем документе фармацевтические составы включают в расчете на единицу дозы, например, таблетку, капсулу, дозу порошка, чайную ложку и т.п., такое количество активного ингредиента, которое необходимо для обеспечения эффективной дозы в соответствии с описанием приведенным выше. Описанные в настоящем документе фармацевтические составы могут включать в расчете на единицу дозы, например, таблетку, капсулу, дозу порошка, инъекцию, суппозиторий,чайную ложку и т.п., в диапазоне от приблизительно 0,01 до приблизительно 1000 мг или в любом входящем в него диапазоне, и могут назначаться в количестве от приблизительно 0,01 до приблизительно 300 мг/кг/сутки либо в иной дозе или в диапазоне в этих пределах, предпочтительно от приблизительно 0,1 до приблизительно 50 мг/кг/сутки либо в иной дозе или в диапазоне в этих пределах. При этом дозы могут изменяться в зависимости от нужд пациентов, тяжести подлежащего лечению состояния и используемого соединения. Применять можно как ежедневный прием, так и постпериодическое дозирование. Предпочтительно использование этих составов в виде дозированных лекарственных форм, например в виде таблеток, пилюль, капсул, дозированных порошков, гранул, стерильных растворов или суспензий для парентерального введения, дозируемых аэрозолей или жидкостей для разбрызгивания, капель ампул, аутоинъекторов или суппозиториев; для перорального, парентерального, интраназального, сублингвального или ректального приема, либо для назначения при помощи ингаляции или вдувания. В ка-9 024368 честве варианта состав может быть представлен в виде лекарственной формы, назначаемой один раз в неделю или в месяц; например, нерастворимая соль активного соединения, такая как деканоат, может быть адаптирована для внутримышечной инъекции с формированием тканевого депо. Для изготовления твердых лекарственных форм, таких как таблетки, основной активный ингредиент смешивается с фармацевтическим носителем, например, обычными ингредиентами, используемыми для приготовления таблеток, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая кислота, стеарат магния, дикальция фосфат или камедь, и другими фармацевтическими разбавителями, например водой, с образованием твердого преформулирующего состава, содержащего гомогенную смесь соединений, описываемых настоящим изобретением, либо их фармацевтически приемлемых солей. Указание на однородность этих предварительных композиций означает, что активный ингредиент распределяется равномерно, так что композиция легко разделятся на одинаково эффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Полученная твердая матричная композиция затем разделяется на дозированные формы описанного выше типа, содержащие от 0,1 до приблизительно 1000 мг или иное количество в указанных пределах активного компонента в соответствии с настоящим изобретением. На таблетки и пилюли новой композиции можно наносить покрытие или иным образом обеспечивать лекарственную форму, обеспечивающую преимущества долгосрочного действия. Например, таблетки и пилюли могут содержать внутренние и внешние компоненты дозы, причем внешние служат оболочкой для первых. Два компонента можно разделить кишечным слоем, противостоящим распаду в желудке и позволяющим провести внутренний компонент нетронутым в двенадцатиперстную кишку или задержать его вывод. Для таких кишечных слоев и покрытий можно использовать различные материалы, в том числе ряд полимерных кислот с такими материалами, как шеллак, цетиловый спирт и ацетат целлюлозы. К жидким формам, в которых новые композиции настоящего изобретения можно вводить перорально или в виде инъекций, относятся водные растворы, соответствующим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое, кунжутное, кокосовое или арахисовое масло, а также эликсиры и аналогичные фармацевтические средства. К приемлемым диспергирующим или приостановливающим веществам для водных суспензий относятся синтетические и натуральные смолы, такие как трагакант, акация, альгинат, декстран, карбоксиметилцеллюлоза натрия, метилцеллюлоза, поливинилпирролидон и желатин. Фармацевтическая композиция может содержать от приблизительно 0,01 до приблизительно 1000 мг соединения, или любое количество в этом диапазоне; предпочтительно от приблизительно 10 до приблизительно 500 мг соединения, или любое количество в этом диапазоне, и может производиться в любой форме, подходящей для выбранного пути введения. Носители включают необходимые и инертные фармацевтические носители, в том числе, помимо прочего, связывающие вещества, добавки для улучшения разрушаемости таблеток, любриканты, ароматизаторы, подсластители, консерванты, красители и оболочки. Композиции для перорального введения включают твердые лекарственные формы, такие как пилюли, таблетки, каплеты, капсулы (причем каждая из перечисленных форм включает в себя варианты для немедленного, отложенного и пролонгированного высвобождения активного компонента), гранулы и порошки, а также жидкие лекарственные формы, такие как растворы, сиропы, эликсиры, эмульсии и суспензии. К пригодным для парентерального введения формам относятся стерильные растворы, эмульсии и суспензии. К преимуществам соединения настоящего изобретения относится возможность вводить его один раз в день или с разделением суточной дозы на две, три или четыре части. Кроме того, соединение настоящего изобретения можно вводить интраназально путем местного применения приемлемых интраназальных носителей или с помощью трансдермальных пластырей, хорошо знакомых большинству специалистов в этой области. При трансдермальном введении высвобождение дозы, естественно, происходит непрерывно, а не дискретно на протяжении всего режима приема препарата. Например, для перорального введения в форме таблетки или капсулы активный компонент лекарства может комбинироваться с пероральным, нетоксичным, фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и им подобными. Более того, в случае необходимости или желания могут использоваться соответствующие связывающие вещества; смазки, дезинтегрирующие агенты, красители могут быть включены в смесь. Подходящие связывающие вещества включают, помимо прочего, крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, подсластитель из кукурузы, природные и синтетические камеди, такие как гуммиарабик, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и им подобные соединения. Дизинтеграторы включают, помимо прочего, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и им подобные. Жидкие формы в соответствующим образом ароматизированных суспендирущем и диспергирующем агентах, таких как синтетические и природные камеди, например трагакант, гуммиарабик, метилцеллюлоза и им подобные. Для парентерального введения желательно применять стерильные суспензии и растворы. При внутривенном введении следует использовать изотонические препараты, как правило,содержащие приемлемые консерванты. Для приготовления фармацевтических составов соединение, приготовленное по описанным в на- 10024368 стоящем документе процессам, являющееся активным ингредиентом, тщательно смешивают с фармацевтическим носителем в соответствии со стандартными фармацевтическими технологиями приготовления смесей, при этом такой носитель может иметь широкое разнообразие форм, в зависимости от лекарственной формы, требуемой для предполагаемого способа введения (например, перорального или парентерального). Соответствующие фармацевтически приемлемые носители хорошо известны специалистам. Описания некоторых из таких фармацевтически приемлемых носителей могут быть найдены в публикации The Handbook of Pharmaceutical Excipients, опубликованной Американской фармацевтической ассоциацией и Фармацевтическим обществом Великобритании. Способы приготовления фармацевтических составов/лекарственных препаратов описаны в многочисленных публикациях, таких как Pharmaceutical Dosage Forms: Tablets, Second Edition, Revised and Expanded, Volumes 1-3, edited by Lieberman et al; Pharmaceutical Dosage Forms: Parenteral Medications, Volumes 1-2, edited by Avis et al; и Pharmaceutical Dosage Forms: Disperse Systems, Volumes 1-2, edited by Lieberman et al; изданных Marcel Dekker, Inc. Соединение, составляющее предмет настоящего изобретения, может вводиться в составе любой из указанных выше композиций и в соответствии со схемой приема, принятой в данной области для лечения заболеваний, описанных в настоящем документе. Оптимальные назначаемые дозы могут легко определяться специалистами и будут варьировать в зависимости от используемого соединения, способа введения, силы препарата и степени выраженности патологического состояния. Кроме того, факторы, связанные с личными особенностями конкретных пациентов, включая возраст, вес тела, особенности диеты и времени введения препарата, в результате приведут к необходимости коррекции назначенных доз препаратов. Специалисту будет понятно, что как in vivo, так и in vitro испытания, проводимые с использованием подходящих, известных и общепринятых клеточных и (или) животных моделей, позволяют предположительно оценивать способность тестируемого соединения оказывать лечебное или профилактическое действие по отношению к данному заболеванию. Специалисту далее будет понятно, что клинические испытания на людях, включая первичные испытания на человеке, оценку эффективности доз, испытания на группах здоровых добровольцев и пациентов, страдающих данным заболеванием, могут осуществляться в соответствии со способами, хорошо известными в медицинской и клинической практике. Следующие примеры приведены, чтобы способствовать пониманию изобретения, но не предназначены и не должны восприниматься как какое-либо ограничение изобретения, изложенного в указанных далее пунктах заявки. В последующих примерах некоторые продукты синтеза указаны как выделенные в виде осадка. Специалистам будет понятно, что термин "остаток" не ограничивает физическое состояние,в котором продукт был получен и может включать, например, твердый продукт, масло, пену, смолу, сироп и тому подобные. В следующих примерах 1-11 демонстрируется способ получения соединения по настоящему изобретению, в то время как примеры 12-16 являются только иллюстративными примерами. Пример 1. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухую круглодонную колбу объемом 250 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (22,20 ммоль; 9,06 г) и растворяли в смеси высушенного и дегазированного толуола (37,00 мл; 32,23 г)/диэтилового эфира (37,00 мл; 26,24 г) при комнатной температуре. После охлаждения до -50 С (изопропанол + баня с сухим льдом) при энергичном перемешивании по каплям добавляли (триметилсилил)метиллитий (1 M в пентане, 37,00 мл) с получением однородной смеси. Через 30 мин после окончания добавления проверяли прохождение реакции, отбирая пробы, и при необходимости добавляли дополнительное количество (триметилсилил)метиллития. Через 15 мин добавляли бромид цинка (22,20 ммоль; 5,00 г) (твердый, сухой, производства Aldrich) одной порцией и давали смеси нагреться до 25 С в течение 1 ч. Через 1 ч перемешивания при комнатной температуре диэтиловый эфир и пентан выпаривали под вакуумом 53,33 кПа (400 мм рт. ст.) при 15 С. Наконец, -D-глюкопиранозилбромид, 2,3,4,6-тетракис(2,2-диметилпропаноат) (10,72 г, 18,50 ммоль) растворяли в дегазированном толуоле (18,50 мл) и добавляли по каплям в течение 10 мин, а затем нагревали полученную смесь до 75 С в течение 21 ч. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 100 мл) и уксусно-этилового эфира (150 мл). Через 10 мин перемешивания разделяли 2 фазы и дважды промывали органический слой водой (100 мл), а затем один раз насыщенным солевым раствором (100 мл). Затем органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного коричневого маслянистого вещества. Маслянистое вещество очищали методом ЖХ среднего давления (патрон: 330 г SiO2, система растворителей: 95/5-85/15 гептана/AcOEt) с получением указанного в заголовке соединения, (2S,3S,4R,5R,6R)2-(3-5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран 3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМР-спектрам указанного в заголовке соединения. Пример 2. В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (1,99 ммоль; 813,71 мг) и растворяли в циклопентилметиловом эфире (ЦПМЭ) (7,2 мл) при комнатной температуре. После охлаждения до -50 С (ацетонитрил + сухой лед при энергичном перемешивании добавляли н-гексиллитий (2,3 М в гексане, 966,31 мкл) по каплям. Через 15 мин добавляли бромид цинка (996,50 мкл; 2 М раствора в ЦПМЭ) и полученной смеси давали нагреться до 15 С в течение 1,5 ч. Затем -D-глюкопиранозилбромид, 2,3,4,6 тетракис(2,2-диметилпропаноат) (1,05 г, 1,81 ммоль) растворяли в дегазированном толуоле (1,81 мл) и добавляли по каплям в течение 10 мин, а затем нагревали полученную смесь до 85 С в течение ночи. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусно-этилового эфира (15 мл). Через 10 мин перемешивания разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем один раз насыщенным солевым раствором (10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом ВЭЖХ, показавшим содержание указанного в заголовке соединения, (2S,3S,4R,5R,6R)-2-(3-5-(4-фторфенил)тиофен 2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМРспектрам указанного в заголовке соединения. Пример 3. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (1,90 ммоль; 775 мг) и растворяли в толуоле(3,45 мл)/диэтиловом эфире (3,45 мл) при комнатной температуре. После охлаждения до -50 С (ацетонитрил + сухой лед) при энергичном перемешивании добавляли по каплям н-гексиллитий (2,3 М в гексане, 920,29 мкл). Через 15 мин добавляли бромид цинка (2,07 ммоль; 466 мг) одной порцией и давали полученной смеси нагреться до 15 С в течение 1,5 ч. Затем полученную смесь охлаждали до 0 С и добавляли по каплям (триметилсилил)метиллитий (1 М в пентане, 1,9 мл). Через 1 ч диэтиловый эфир и гексан выпаривали под вакуумом (53,33 мПа (400 мм рт. ст.) при 15 С. Затем -D-глюкопиранозилбромид,2,3,4,6-тетракис(2,2-диметилпропаноат) (1,73 ммоль; 1,00 г) растворяли в дегазированном толуоле (1,73 мл) и добавляли по каплям в течение 10 мин, а затем нагревали полученную смесь до 85 С в течение но- 12024368 чи. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусно-этилового эфира (15 мл). После перемешивания в течение 10 мин разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем однократно насыщенным солевым раствором(10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом ВЭЖХ, показавшим содержание указанного в заголовке соединения, (2S,3S,4R,5R,6R)-2-(3-5-(4 фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран 3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМР-спектрам указанного в заголовке соединения. Пример 4. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (1,58 ммоль/ 643 мг) и растворяли в толуоле(2,86 мл)/2-метилтетрагидрофуране (2,86 мл) при комнатной температуре. После охлаждения до -50 С(ацетонитрил + сухой лед) при энергичном перемешивании добавляли по каплям н-гексиллитий (2,3 М в гексане; 764 мкл). Через 15 мин бромид цинка (1,72 ммоль; 387 мг) растворяли в 2 метилтетрагидрофуране (859 мкл) и добавляли к смеси в один прием, после чего смеси давали нагреться до 15 С в течение 1,5 ч. Затем -D-глюкопиранозилбромид, 2,3,4,6-тетракис(2,2-диметилпропаноат) (1,43 ммоль; 830 мг) растворяли в дегазированном толуоле (1,43 мл) и добавляли по каплям в течение 10 мин,а затем нагревали полученную смесь до 85 С в течение ночи. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусно-этилового эфира (15 мл). После перемешивания в течение 10 мин разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем однократно насыщенным солевым раствором (10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом количественной ВЭЖХ, показавшим содержание указанного в заголовке соединения (2S,3S,4R,5R,6R)-2-(3-5-(4-фторфенил)тиофен-2 ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМРспектрам указанного в заголовке соединения. Пример 5. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (1,90 ммоль; 775 мг) и растворяли в толуоле(3,45 мл)/диэтиловом эфире (3,45 мл) при комнатной температуре. После охлаждения до -50 С (ацетонитрил + сухой лед) при энергичном перемешивании добавляли н-гексиллитий (2,3 М в гексане, 920 мкл) по каплям. Через 15 мин добавляли бромид цинка (2,07 ммоль; 466 мг) одной порцией и давали полученной смеси нагреться до 15 С в течение 1,5 ч. Через 1 ч диэтиловый эфир и гексан выпаривали под вакуумом (53,33 мПа (400 мм рт. ст.) при 15 С. Затем -D-глюкопиранозилбромид, 2,3,4,6-тетракис(2,2 диметилпропаноат) (1,73 ммоль; 1,00 г) растворяли в дегазированном толуоле (1,73 мл) и добавляли по каплям в течение 10 мин, а затем нагревали полученную смесь до 50 С в течение 2 суток. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусно- 13024368 этилового эфира (15 мл). Через 10 мин перемешивания разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем один раз насыщенным солевым раствором (10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом ВЭЖХ, показавшим содержание указанного в заголовке соединения, (2S,3S,4R,5R,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМР-спектрам указанного в заголовке соединения. Пример 6. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (2,60 ммоль; 1,06 г) и растворяли в толуоле(4,73 мл)/метоксициклопентане (4,73 мл) при комнатной температуре. После охлаждения до -50 С (ацетонитрил + сухой лед) при энергичном перемешивании добавляли н-гексиллитий (2,3 М в гексане, 1,26 мкл) по каплям. Через 15 мин бромид цинка (2,84 ммоль; 639 мг) растворяли в сухом метоксициклопентане (1,40 мл) и добавляли к смеси по каплям, после чего давали смеси нагреться до 15 С в течение 1 ч. Затем -D-глюкопиранозилбромид, 2,3,4,6-тетракис(2,2-диметилпропаноат) (2,36 ммоль; 1,00 г) растворяли в дегазированном толуоле (2,36 мл) и добавляли по каплям в течение 10 мин, а затем нагревали полученную смесь до 75 С в течение 2 суток. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусно-этилового эфира (15 мл). Через 10 мин перемешивания разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем один раз насыщенным солевым раствором (10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом ВЭЖХ, показавшим содержание указанного в заголовке соединения,(2S,3S,4R,5R,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМРспектр соответствовал ранее полученным 1 Н ЯМР-спектрам указанного в заголовке соединения. Пример 7. (2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В сухой реакционный сосуд Шленка объемом 25 мл с механической мешалкой в атмосфере аргона вносили 2-(4-фторфенил)-5-(5-йод-2-метилбензил)тиофен (2,45 ммоль; 1,00 г) и растворяли в нбутиловом эфире (980 мкл)/толуоле (8,8 мл). Затем снижали температуру до -60 С. По каплям добавлялиN-гексиллитий (2,3 М в гексане, 1,20 мл). Через 2 ч однократно добавляли бромид цинка (607 мг) при температуре -60 С. Полученной смеси давали медленно нагреться до 10 С в течение 2 ч. При 10 С, -Dглюкопиранозилбромид, 2,3,4,6-тетракис(2,2-диметилпропаноат) (2,69 ммоль; 1,56 г) растворяли в толуоле (2,69 мл) и добавляли к смеси в течение 1 мин, а затем повышали температуру до 50 С в течение ночи. После этого температуру смеси повышали до 60 С на 1 ч, а затем до 70 С на 2 суток. После охлаждения до комнатной температуры добавляли водный раствор хлорида аммония (1 М, 10 мл) и уксусноэтилового эфира (15 мл). Через 10 мин перемешивания разделяли 2 фазы и дважды промывали органический слой водой (10 мл), а затем один раз насыщенным солевым раствором (10 мл). Органический слой высушивали над сульфатом натрия и выпаривали растворитель под вакуумом с получением прозрачного маслянистого вещества коричневого цвета, которое анализировали методом ВЭЖХ, показавшим содержание указанного в заголовке соединения, (2S,3S,4R,5R,6R)-2-(3-5-(4-фторфенил)тиофен-2-ил)метил)4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноата) в форме одного изомера. 1 Н ЯМР-спектр соответствовал ранее полученным 1 Н ЯМР-спектрам указанного в заголовке соединения. Пример 8. (2R,3R,4S,5R,6R)-6-(Пивалоилоксиметил)тетрагидро-2 Н-пиран-2,3,4,5-тетраил тетракис(2,2-диметилпропаноат)D-глюкозу (25,0 г, 0,139 моль) суспендировали в безводном дихлорметане (416 мл) под слоем азота,а затем перемешивали полученную смесь в течение 5 мин при комнатной температуре, после чего охлаждали до 0 С и перемешивали 10 мин. К полученной смеси добавляли ТЭА (154,7 мл) по каплям в течение 10-15 мин при перемешивании; затем ДМАП (1,25 г, 0,0102 моль) одной порцией. К полученной смеси добавляли пивалоилхлорид (136 мл), разведенный дихлорметаном (83 мл) при 0 С в течение 30 мин. Ледяную баню удаляли и полученную смесь перемешивали при комнатной температуре в течение 20 ч. После этого полученную смесь приливали к дихлорметану (500 мл) и хлористо-водородной кислоте(1,5 М, 375 мл) и разделяли полученные фазы. Органический слой промывали бикарбонатом натрия(550 г в 500 мл деионизованной воды, 1 н.), а затем выпаривали до небольшого объема. К полученному остатку добавляли этанол (95%, 240 мл) и нагревали смесь до температуры кипения растворителя с получением однородной смеси. Полученную смесь охлаждали до 0 С; при этом образовывались белые кристаллы, которые отфильтровывали и высушивали под вакуумом при комнатной температуре с получением указанного в заголовке соединения. Пример 9. (2R,3R,4S,5R,6R)-2-Бром-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис(2,2-диметилпропаноат)(2R,3R,4S,5R,6R)-6-(Пивалоилоксиметил)тетрагидро-2 Н-пиран-2,3,4,5-тетраил тетракис(2,2 диметилпропаноат) (10,0 г, 16,65 ммоль) растворяли в безводном дихлорметане (100 мл) под слоем азота и перемешивали 5 мин при комнатной температуре. Затем к смеси добавляли бромид цинка (0,76 г,3,33 ммоль) и перемешивали полученный желтый раствор 5 мин при комнатной температуре. После этого к смеси добавляли ТМС бромид (10,2 г, 66,58 ммоль), разведенный дихлорметаном (10 мл) в течение примерно 15-20 мин, и перемешивали полученную смесь при комнатной температуре в течение 24 ч. Полученную смесь фильтровали для удаления твердых веществ и охлаждали фильтрат до 0 С. К охлажденному фильтрату добавляли раствор бикарбоната натрия (132 г в 120 мл воды) до конечного рН в диапазоне 7-8. Полученные фазы разделяли, органический слой промывали водой (120 мл), а комбинированные органические слои выпаривали до небольшого объема. К полученному остатку добавляли изопропиловый спирт (39,3 г) и нагревали смесь для растворения. Полученную смесь охлаждали до 0 С; при этом образовывались белые кристаллы, которые отфильтровывали и высушивали под вакуумом при комнатной температуре с получением указанного в заголовке соединения. Стадия А. Получение смеси ариллития. 2-(4-Фторфенил)-5-(5-йод-2-метилбензил)тиофен (12,81 г, 31,37 ммоль) вносили в пробирку Шленка в атмосфере аргона. Безводный толуол (15,7 мл) и безводный ЦПМЭ (9,4 мл) добавляли из шприца без перемешивания и охлаждали полученную смесь до -45 С, а затем перемешивали. Затем к полученной охлажденной смеси добавляли н-гексиллитий (14,3 г, 32,94 ммоль) в форме 2,5 М раствора в гексане(14,3 мл) в течение примерно 5-10 мин и нагревали смесь до -25 С в течение 1 ч. Стадия В. Получение указанного в заголовке соединения. Бромид цинка (3,88 г, 17,25 ммоль) и бромид лития (2,72 г, 34,50 ммоль) высушивали при 200 С под вакуумом в безводном ЦПМЭ (18,6 мл) в пробирке Шленка. Затем смесь добавляли через канюлю при -25 С к смеси ариллития (приготовленной, как описано для стадии А выше) и нагревали полученную смесь до 0 С в течение 1 ч. После этого к полученной смеси добавляли (2R,3R,4S,5R,6R)-2-бром-6(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (20,0 г, 34,50 ммоль) в безводном толуоле (31,4 мл). Ледяную баню удаляли и перемешивали полученную смесь при комнатной температуре в течение 30 мин; а затем нагревали до 65 С в течение 48 ч. Полученную суспензию фильтровали через стеклянную пористую пластинку, промывали толуолом (20 мл) и промывали фильтрат 1 Н. раствором хлорида аммония (100 мл) и водой (100 мл). Толуол отгоняли для уменьшения объема. К оставшемуся объему добавляли метанол (157 мл) и охлаждали смесь до 0 С, при этом образовывались кристаллы, которые отфильтровывали и высушивали под вакуумом при 40 С в течение ночи с получением указанного в заголовке соединения. Пример 11.(2S,3S,4R,5R,6R)-2-(3-5-(4-Фторфенил)тиофен-2-ил)метил)-4-метилфенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (39,0 г, 50,0 ммоль) суспендировали в метаноле (150 мл) при комнатной температуре. Раствор метоксида натрия (9,3 мл) добавляли к полученной суспензии и перемешивали при комнатной температуре, нагревали до 60 С в течение 16 ч и охлаждали. Затем к полученному желтому раствору добавляли воду (50 мл) и затравочные кристаллы указанного в заголовке соединения. Добавляли дополнительную порцию воды (50 мл) и перемешивали смесь при 0 С в течение 1 ч, при этом образовывался осадок, который собирали путем фильтрования с получением указанного в заголовке соединения. Пример 12. (2R,3R,4R,5S,6S)-2-(Пивалоилоксиметил)-6-р-толилтетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) В пробирке Шленка объемом 10 мл в атмосфере аргона добавляли по каплям раствор лития дибутилгексилмагния (0,4 экв., 0,35 ммоль) к смеси 4-йодтолуола (230 мг, 1,04 ммоль) в безводном толуоле(0,43 мл) и безводном н-дибутиловом эфире (0,26 мл) при 0 С. После завершения обмена галоген-металл(по результатам ГХ или ВЭЖХ) по каплям добавляли раствор ZnBr2LiBr в дибутиловом эфире (34 об.%,0,6 экв., 0,52 ммоль). Через 1 ч к смеси цинкорганического соединения добавляли (2R,3R,4S,5R,6R)-2 бром-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (1 экв., 500 мг, 0,86 ммоль), растворенный в безводном толуоле (0,86 мл). Полученную смесь нагревали до 100 С до полного превращения (по результатам ГХ). После охлаждения до комнатной температуры к полученной смеси добавляли 1 М HCl (10 мл). После этого разделяли два слоя. Водный слой экстрагировали уксусноэтиловым эфиром (10 мл). Комбинированный органический слой промывали водой (10 мл), а затем промывали насыщенным солевым раствором (10 мл). Органический слой высушивали путем пропускания через готовую колонку и концентрировали под пониженным давлением с помощью ротационного испарителя. Полученную смесь очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в форме остатка. Пример 13. (2S,3S,4R,5R,6R)-2-(4-Метоксифенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран 3,4,5-триилтрис-(2,2-диметилпропаноат) В пробирке Шенка объемом 10 мл в атмосфере аргона раствор лития дибутилгексилмагния (0,4 экв., 0,35 ммоль) по каплям добавляли к смеси 4-йодтолуола (250 мг, 1,04 ммоль) в безводном толуоле(0,43 мл) и безводном н-дибутиловом эфире (0,26 мл) при 0 С. После завершения обмена галоген-металл по каплям добавляли раствор ZnBr2LiBr в дибутиловом эфире (34 мас.%, 0,6 экв., 0,52 ммоль). Через 1 ч к смеси цинкорганического соединения добавляли (2R,3R,4S,5R,6R)-2-бром-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (1 экв., 500 мг, 0,86 ммоль), растворенный в безводном толуоле (0,86 мл). Полученную смесь нагревали до 100 С до полного превращения (по результатам ГХ). После охлаждения до комнатной температуры к полученной смеси добавляли 1 М HCl (10 мл). После этого разделяли два слоя. Водный слой экстрагировали уксусно-этиловым эфиром(10 мл). Комбинированный органический слой промывали водой (10 мл), а затем промывали насыщенным солевым раствором (10 мл). Органический слой высушивали путем пропускания через готовую набитую колонку и концентрировали с помощью ротационного испарителя под пониженным давлением. Полученную смесь очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в форме остатка. Пример 14. (2S,3S,4R,5R,6R)-2-(2,6-Диметоксифенил)-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран 3,4,5-триил трис-(2,2-диметилпропаноат) В пробирке Шенка объемом 10 мл в атмосфере аргона раствор лития сек-бутиллития (1,2 экв., 4,14 ммоль) по каплям добавляли к смеси 1,3-диметоксибензола (0,54 мл, 4,14 ммоль), растворенного в безводном толуоле (1,72 мл) и безводном н-дибутиловом эфире (1,04 мл) при 0 С. После завершения обмена галоген-металл по каплям добавляли раствор ZnBr2LiBr в дибутиловом эфире (34 мас.%, 0,6 экв., 2,07 ммоль). Через 1 ч к смеси цинкорганического соединения добавляли (2R,3R,4S,5R,6R)-2-бром-6(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (1 экв., 2000 мг, 3,45 ммоль), растворенный в безводном толуоле (3,44 мл). Полученную смесь нагревали до 100 С до полного превращения (по результатам ГХ). После охлаждения до комнатной температуры к полученной смеси добавляли 1 М HCl (40 мл). После этого разделяли два слоя. Водный слой экстрагировали уксусноэтиловым эфиром (40 мл). Комбинированный органический слой промывали водой (40 мл), а затем промывали насыщенным солевым раствором (40 мл). Органический слой высушивали путем пропускания через готовую набитую колонку и концентрировали с помощью ротационного испарителя под пониженным давлением. Полученную смесь очищали методом хроматографии на силикагеле с получением указанного в заголовке соединения в форме остатка. Пример 15. (2R,3R,4R,5S,6S)-2-(Пивалоилоксиметил)-6-(4-(трифторметил)фенил)тетрагидро-2Hпиран-3,4,5-триил трис-(2,2-диметилпропаноат) В пробирке Шенка объемом 10 мл в атмосфере аргона раствор лития дибутилгексилмагния (0,4 экв., 0,35 ммоль) по каплям добавляли к смеси 4-йодтрифторбензола (0,15 мл, 1,04 ммоль) в безводном толуоле (0,43 мл) и безводном н-дибутиловом эфире (0,26 мл) при -50 С. После завершения обмена галоген-металл по каплям добавляли раствор ZnBr2LiBr в дибутиловом эфире (34 мас.%, 0,6 экв., 0,52 ммоль). Через 1 ч к смеси цинкорганического соединения добавляли (2R,3R,4S,5R,6R)-2-бром-6(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (1 экв., 500 мг, 0,86 ммоль), растворенный в безводном толуоле (0,86 мл). Полученную смесь нагревали до 100 С до полного превращения (по результатам ГХ). После охлаждения до комнатной температуры к полученной смеси добавляли 1 М HCl (10 мл). После этого разделяли два слоя. Водный слой экстрагировали уксусноэтиловым эфиром (10 мл). Комбинированный органический слой промывали водой (10 мл), а затем промывали насыщенным солевым раствором (10 мл). Органический слой высушивали путем пропускания через готовую набитую колонку и концентрировали с помощью ротационного испарителя под пониженным давлением. Полученную смесь очищали методом обращенно-фазной хроматографии (Kromasil C18) с получением указанного в заголовке соединения. Пример 16. (2R,3R,4S,5R,6R)-2-(Пивалоилоксиметил)-6-(тиофен-2-ил)тетрагидро-2H-пиран-3,4,5 триил трис-(2,2-диметилпропаноат) В пробирке Шенка объемом 10 мл в атмосфере аргона раствор лития дибутилгексилмагния (0,4 экв., 0,35 ммоль) добавляли по каплям к смеси 2-йодтиофена (230 мг, 1,04 ммоль) в безводном толуоле(0,43 мл) и безводном н-дибутиловом эфире (0,26 мл) при 0 С. После завершения обмена галоген-металл по каплям добавляли раствор ZnBr2LiBr в дибутиловом эфире (34 мас.%, 0,6 экв., 0,52 ммоль). Через 1 ч к смеси цинкорганического соединения добавляли (2R,3R,4S,5R,6R)-2-бром-6-(пивалоилоксиметил)тетрагидро-2 Н-пиран-3,4,5-триил трис-(2,2-диметилпропаноат) (1 экв., 500 мг, 0,8 6 ммоль), растворенный в безводном толуоле (0,86 мл). Полученную смесь нагревали до 100 С до полного превращения (по результатам ГХ). После охлаждения до комнатной температуры к полученной смеси добавляли 1 М HCl (10 мл). После этого разделяли два слоя. Водный слой экстрагировали уксусно-этиловым эфиром(10 мл). Комбинированный органический слой промывали водой (10 мл), а затем промывали насыщенным солевым раствором (10 мл). Органический слой высушивали путем пропускания через готовую набитую колонку и концентрировали с помощью ротационного испарителя под пониженным давлением. Полученную смесь очищали методом обращенно-фазной хроматографии (Kromasil C18) с получением указанного в заголовке соединения. Пример 17. Твердая пероральная форма - пример возможного использования. В качестве конкретного варианта осуществления лекарственной формы для внутреннего применения можно привести следующее: 100 мг соединения, полученного, как описано в примере 11 выше, смешивают с достаточно тонкоизмельченной лактозой, что дает общее количество приблизительно 580-590 мг, что достаточно для заполнения овальной твердой желатиновой капсулы размера О. При том что приведенная выше спецификация соответствует принципам настоящего изобретения,из примеров, приведенных для иллюстрации, становится понятно, что на практике изобретение включает в себя все обычные изменения, адаптации и модификации, которые входят в рамки следующих заявок, и их эквиваленты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I-S) взаимодействие соединения формулы (VII-S), где М 2 представляет собой цинксодержащий фрагмент, выбранный из ZnBr, ZnI и трифлата цинка, с соединением формулы (VIII-S), где каждый Z представляет пивалоил и LG2 представляет собой бром; в смеси простого эфира и углеводородного растворителя; где простой эфир выбирают из группы, состоящей из ди-н-бутилового эфира и циклопентилметилового эфира, с образованием соответствующего соединения формулы (IX-S) снятие защиты с соединения формулы (IX-S); с образованием соответствующего соединения формулы (I-S). 2. Способ по п.1, в котором М 2 представляет собой ZnBr. 3. Способ по п.1, в котором соединение формулы (VIII-S) присутствует в количестве от приблизительно 0,8 до приблизительно 1,25 мол.экв. 4. Способ по п.3, в котором соединение формулы (VIII-S) присутствует в количестве от приблизительно 1,0 до приблизительно 1,1 мол.экв. 5. Способ по п.1, в котором углеводородный растворитель представляет собой толуол. 6. Способ по п.1, в котором соединение формулы (VIII-S) в растворе углеводородного растворителя добавляют к раствору соединения формулы (VII-S) в эфирном растворителе. 7. Способ по п.1, в котором соединение формулы (VII-S) взаимодействует с соединением формулы(VIII-S) при температуре в диапазоне от приблизительно 60 до приблизительно 95 С. 8. Способ по п.1, дополнительно включающий взаимодействие соединения формулы (V-S), в котором LG1 представляет собой уходящую группу,- 19024368 выбранную из брома или йода; с литийорганическим реагентом; в смеси простого эфира в качестве растворителя и углеводородного растворителя, где простой эфир выбран из группы, состоящей из ди-нбутилового эфира и циклопентилметилового эфира; с получением соединения формулы (VI-S), в котором М 1 представляет собой литий взаимодействие соединения формулы (VI-S) с солью цинка или комплексом амина и галогенида цинка; в смеси простого эфира и углеводородного растворителя, где простой эфир выбран из группы,состоящей из ди-н-бутилового эфира и циклопентилметилового эфира; с получением соответствующего соединения формулы (VII-S). 9. Способ по п.8, в котором литийорганический реагент представляет собой н-гексиллитий. 10. Способ по п.8, в котором литийорганический реагент присутствует в количестве от приблизительно 0,5 до приблизительно 2,0 мол.экв. 11. Способ по п.10, в котором литийорганический реагент присутствует в количестве от приблизительно 1,0 до приблизительно 1,2 мол.экв. 12. Способ по п.8, в котором углеводородный растворитель представляет собой толуол. 13. Способ по п.8, в котором соединение формулы (V-S) взаимодействует с литийорганическим реагентом при температуре в диапазоне от приблизительно -78 С до приблизительно комнатной температуры. 14. Способ по п.8, в котором соль цинка выбирают из группы, состоящей из дибромида цинка(ZnBr2), дийодида цинка (ZnI2) и дитрифлата цинка, и в котором комплекс амина и галогенида цинка выбирается из группы, состоящей из комплекса пиридина и бромида цинка и комплекса N-метилморфолина и бромида цинка. 15. Способ по п.8, в котором соединение формулы (VI-S) взаимодействует с солью цинка и в котором соль цинка представляет собой дибромид цинка. 16. Способ по п.15, где бромид цинка присутствует в количестве в диапазоне от приблизительно 0,33 до приблизительно 1,0 мол.экв. 17. Способ по п.16, в котором дибромид цинка присутствует в количестве приблизительно 0,5 мол.экв. 18. Способ по п.8, в котором соединение формулы (VI-S) взаимодействует с солью цинка в присутствии амина или соли лития. 19. Способ по п.18, в котором амин или соль лития выбираются из группы, состоящей из бромида лития, йодида лития, пиридина, N-метил морфолина, 2,6-лутидина и ТМЭДА, и в котором амин или соль лития предпочтительно присутствуют в количестве от приблизительно 1,0 до приблизительно 2,0 мол.экв.
МПК / Метки
МПК: C07F 3/06, C07D 409/14, C07D 409/10
Метки: ингибиторов, применения, качестве, sglt2, соединений, процесс, получения
Код ссылки
<a href="https://eas.patents.su/21-24368-process-polucheniya-soedinenijj-dlya-primeneniya-v-kachestve-ingibitorov-sglt2.html" rel="bookmark" title="База патентов Евразийского Союза">Процесс получения соединений для применения в качестве ингибиторов sglt2</a>
Предыдущий патент: Способ и устройство для интенсификации добычи углеводородов из буровых скважин
Следующий патент: Способ получения автоклавированных пищевых продуктов в контейнере из листового композита с внешним слоем из окрашенного сшитого полимера высокого давления
Случайный патент: Противокоррозионная синергетическая система (варианты)












