Производные сулиндака, их применение и получение
Формула / Реферат
1. Соединение, представленное формулой
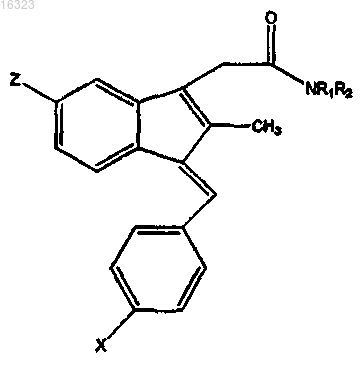
и его фармацевтически приемлемые соли,
где X представляет собой CH3S=O или CH3S;
Z представляет собой галоген;
R1 представляет собой (CH2)mY, где Y выбран из группы, состоящей из водорода, алкила, амино, аминоалкила и замещенного или незамещенного 5- или 6-членного кольца;
R2 представляет собой (CH2)mW, где W выбран из группы, состоящей из амино, аминоалкила и замещенного или незамещенного 5- или 6-членного кольца;
или где как R1, так и R2 связываются друг с другом и связываются с атомом азота с образованием насыщенного или ненасыщенного 5- или 6-членного кольца, которое может необязательно содержать дополнительный гетероатом и может быть необязательно замещено, и m равно целому числу от 0 до 8, причем алкильная группа содержит 1-4 атома углерода, и соединение приобретает результирующий положительный заряд.
2. Соединение по п.1, где X представляет собой CH3S.
3. Соединение по п.1, где X представляет собой CH3S=O.
4. Соединение по п.1, представляющее собой N-[2-(диметиламино)этил]-5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
5. Соединение по п.1, представляющее собой 5-фтор-2-метил-N-[(1-метил-2-пирролидинил)метил]-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
6. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперазинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
7. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперидинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
8. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-[2-(3-пиридинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
9. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-[2-(4-морфолинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
10. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-[2-(1-пирролидинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
11. Соединение по п.1, представляющее собой N-(2-аминоэтил)-5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1Н-инден-3-ацетамид или его фармацевтически приемлемую соль.
12. Соединение по п.1, представляющее собой N-[2-(диметиламино)этил]-5-фтор-2-метил-1-[[4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
13. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-N-(фенилметил)-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
14. Соединение по п.1, представляющее собой 5-фтор-N-(2-фуранилметил)-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
15. Соединение по п.1, представляющее собой 5-фтор-N-[2-(4-имидазолил)этил]-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
16. Соединение по п.1, представляющее собой 5-фтор-N-[2-(N,N-диэтиламино)этил]-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
17. Соединение по п.1, представляющее собой N-[[4-(диметиламино)фенил]метил]-5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
18. Соединение по п.1, представляющее собой N-[[4-(диметиламино)фенил]метил]-(Z)-5-фтор-2-метил-3-[[4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
19. Соединение по п.1, представляющее собой N,2-диметил-(Z)-5-фтор-2-метил-N-[2-(метиламино)этил]-3-[[4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
20. Соединение по п.1, представляющее собой N-[[4-(диметиламино)фенил]-(Z)-5-фтор-2-метил-3-[[4-(метилсульфинил)фенил]метилен]]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.
21.Фармацевтическая композиция, включающая по меньшей мере одно соединение по любому из пп.1-20 и фармацевтически приемлемый носитель.
22. Способ лечения предракового состояния или рака у млекопитающего, включающий введение млекопитающему эффективного количества по меньшей мере одного соединения по любому из пп.1-20.
23. Способ по п.22, где раком является рак толстой кишки.
24. Способ по п.22, где количество соединения для лечения составляет от приблизительно 10 до приблизительно 1000 мг/кг массы тела млекопитающего.
25. Способ по п.22, где количество соединения для лечения составляет от приблизительно 100 до приблизительно 500 мг/кг массы тела млекопитающего.
26. Способ по п.22, где лечение проводят при введении от одного раза в день до приблизительно 3 раз в день в течение 24 месяцев.
27. Способ по п.22, где производное вводят перорально, внутривенно или внутрибрюшинно.
28. Способ по п.23, где млекопитающим является человек.
29. Способ получения соединения по любому из пп.1-20, включающий взаимодействие сулиндака с соединением, представленным формулой NH2(CH2)mNR1R2.
Текст
Предложены производные сулиндака вместе с содержащими их фармацевтическими композициями и применение их для лечения предраковых состояний и рака. Производные сулиндака являются также подходящими для лечения хронических воспалительных состояний. Предложен также способ получения производных. 016323 Описание Перекрестные ссылки на родственные заявки По данной заявке испрошен приоритет USSN 60/755847, зарегистрированной 4 января 2006 г., полное описание которой включено здесь в качестве ссылки. Область техники, к которой относится изобретение Настоящее описание относится к некоторым производным сулиндака и особенно к амидным производным сулиндака. Настоящее изобретение относится также к фармацевтическим композициям, включающим описанные производные сулиндака, а также к способу применения соединений для лечения и предупреждения предраковых состояний и рака у млекопитающего. Настоящее описание раскрывает также способ получения описанных соединений. Уровень техники Хотя при лечении рака наблюдались значительные успехи, он до сих пор остается основной проблемой в области здоровья. Рак считается основной причиной смерти в Соединенных Штатах, вероятно у одного из четырех американцев диагностировано такое заболевание. Среди известных химиотерапевтических лекарственных средств называются только несколько кармустин, доксорубицин, метотрексат, паклитаксел, циклофосфамид, прокарбазин и винбластин. Однако многие химиотерапевтические лекарственные средства вызывают также нежелательные побочные действия у пациента. Признано, что некоторые нестероидные противовоспалительные лекарственные средства (NSAID),как таковые, или в сочетании с химиотерапией или облучением, обладают широким спектром противораковой активности на животных моделях. Репрезентативные примеры описаны в публикациях, включающих: Hial et al., "Alteration of tumor growth by aspirin and indomethacin: studies with two transplantabletumours in mice" J. of Path. 156:341-347. Сулиндак (клинорил) является NSAID, который проявляет противораковую активность. Его считают средством, приносящим пользу при лечении дисплазии, что доказано рядом клинических исследований с участием имеющих врожденный семейный аденоматозный полипоз пациентов, которые обнаружили способность сулиндака вызывать регресс существующих аденом (размер и число) и ингибировать образование новых аденом (полипов). См., например, Waddell et al., "Sulindac for polyposis of the colon". J.sulindac maintenance treatment." Dis. Colon Rectum 38: 813-830, 1995. Обнаружено, что механизм, ответственный за противовоспалительную эффективность, а также токсичность NSAID и селективных ингибиторов COX-2 (желудочно-кишечных, почечных, гематологических, сердечно-сосудистых) включает в себя ингибирование циклооксигеназы (COX)-1 или COX-2. Сулиндак и некоторые другие NSAID являются также токсичными для печени. См., например, Vane, "Modenonsterdoidal antiinflammatory agents" J. Invest. Medicine 43: 516-533, 1995; Tarazi et al., "Sulindacassociated hepatic injury: analysis of 91 cases reported to the Food and Drug Administration" Gastroenterology 104: 569-574, 1993; и Mukherjee et al. "Risk of cardiovascular events associated with selective COX-2 inhibitors", JAMA 286: 954-959, 2001. Большинство исследователей приписывают механизм противораковой активности NSAID противовоспалительной активности, включающей в себя ингибирование COX, хотя имеется доказательство дляCOX-независимого механизма, как указано ниже. Например, описана активность сульфонового метаболита сулиндака, который сохраняет противораковую активность в доклинических и клинических исследованиях, но не ингибирует циклооксигеназу и проявляет меньшую токсичность для GI (желудочнокишечного тракта). См., например, Piazza et al., "Antineoplastic drugs sulindac sulfide and sulfone inhibit celldrugs, apoptosis, and colon-cancer chemoprevention" The Lancet Oncology 3: 166-174, 2002. Имеются публикации, позволяющие предположить, что некоторые химические модификации остатка карбоновой кислоты NSAID могут привести к их повышенной безопасности (т.е. в виде пролекарств или посредством локализованного высвобождения оксида азота). См., например, Mahmud et al., "Aand thioesters of carboxylic acid nonsteroidal antiinflammatory drugs" Pharmaceutical Research 6: 867-873,1989; Salimbeni et al., "New esters of N-arylanthranilic acids" Farmaco 30: 276-86, 1975; и Elliot et al. "A nitric oxide-releasing nonsteroidal antiinflammatory drug accelerates gastric ulcer healing in rats" Gastroenterology 109: 524-530, 1995. Кроме того, в патентах США 5401774, 6166053 и 6200771 предложены некоторые модификации для сулиндаксульфона, который не является NSAID. Ряд амидных и сложноэфирных производных индометацина и меклофенаминовой кислоты, включающих в себя модификации остатка карбоновой кислоты, описаны Marnett et al. Эти соединения описаны как имеющие преимущества в безопасности по сравнению с родительскими NSAID на основе селективности в отношении фермента циклооксигеназы-2. Однако не была описана противораковая активность и не были описаны модификации для повышения противораковой эффективности (активности). См., например, Kalgutkar et al., "Biochemical based design of cyclooxygenase-2 (COX-2) inhibitors: facileand compositions for inhibition of cyclooxygenase activity". Нельзя предсказать, что химические модификации одного семейства NSAID являются применимыми для другого семейства. Например, меклофенамовая кислота относится к семейству фенаматов, тогда как сулиндак принадлежит к семейству уксусной кислоты NSAID и, следовательно, они не являются структурно близкими друг к другу. Кроме того, не все амидные модификации для карбоновой кислоты приводят к повышенной селективности в отношении COX-2, как показано в данном описании. Несмотря на прогресс при лечении рака и других заболеваний, все же сохраняется возможность для разработки улучшенных лекарственных средств, которые являются эффективными для требуемого лечения, в то же время проявляют уменьшенныое побочные действия. Сущность изобретения Настоящее описание относится к производным сулиндака, представленным формулой и их фармацевтически приемлемым солям,где X представляет собой CH3S=O, CH3S, HOS(=O)2 или CH3S(=O)2;R1 представляет собой (CH2)mY, где Y выбран из группы, состоящей из водорода, алкила, амино,аминоалкила и замещенного или незамещенного 5- или 6-членного кольца;R2 представляет собой (CH2)mW, где W выбран из группы, состоящей из амино, аминоалкила и замещенного или незамещенного 5- или 6-членного кольца; или где как R1, так и R2 связаны друг с другом и связаны с атомом азота с образованием насыщенного или ненасыщенного 5-или 6-членного кольца, которое может необязательно содержать дополнительный гетероатом и может быть необязательно замещено. Замещенное или незамещенное 5- или 6-членное кольцо для Y и W может быть насыщенным или ненасыщенным кольцом и включает в себя атомы углерода и необязательно гетероатом, такой как N или O;-2 016323 и m равно целому числу от 0 до 8, более типично 1-8 и еще более типично 2-4. Другой аспект настоящего описания относится к фармацевтическим композициям, содержащим описанные выше соединения. Описаны также способы применения соединений настоящего описания при предраковых состояниях и раковом заболевании у млекопитающего. Другой аспект данного описания относится к способам применения соединений при лечении хронических воспалительных заболеваний, таких как воспалительное заболевание кишечника, и некоторых нейродегенеративных заболеваний, в том числе болезни Альцгеймера. Еще один аспект данного описания относится к способу получения указанных выше соединений. В частности, настоящие соединения можно получить взаимодействием сулиндака с соединением,представленным формулойH2N(CH2)mR1R2. Другие задачи и преимущества настоящего описания станут вполне очевидными для специалиста в данной области из последующего подробного описания, в котором показаны и описаны только предпочтительные варианты осуществления просто путем иллюстрации лучшего способа. Как будет понятно,описание может включать в себя другие и разные варианты осуществления, и его отдельные детали способны создавать модификации в различных очевидных отношениях, не выходящие за пределы описания. Соответственно этому описание должно рассматриваться, по существу, как иллюстративное, а не как ограничивающее. Краткое описание графического материала На фиг. 1A и 1B показана активность производных согласно настоящему описанию по ингибированию роста клеток опухоли толстой кишки HT29 человека по сравнению с сулиндаком; на фиг. 2 - активность производных согласно настоящему описанию по ингибированию роста панели гистологически различных типов опухолевых клеток; на фиг. 3A и 3B - цитостатическая и цитотоксическая активность, соответственно, производного согласно настоящему описанию по сравнению с сулиндаксульфидом; на фиг. 4 - пероральная биологическая доступность производного согласно настоящему изобретению; на фиг. 5A и 5B - пониженная токсичность производных согласно настоящему изобретению в отношении мышей по сравнению с сулиндаком; на фиг. 6 - противоопухолевая активность производного согласно настоящему изобретению для голых мышей, не имеющих вилочковой железы, которым были подкожно имплантированы клетки опухоли толстой кишки HT29 человека. Различные наиболее предпочтительные варианты изобретения Настоящее описание относится к новым производным сулиндака, представленным формулой и их фармацевтически приемлемым солям,где X представляет собой CH3S=O, CH3S, HOS(=O)2 или CH3S(=O)2; и более типично, X представляет собой CH3S=O, CH3S или HOS(=O)2;R1 представляет собой (CH2)mY, где Y выбран из группы, состоящей из водорода, алкила, амино,аминоалкила и замещенного или незамещенного 5- или 6-членного кольца;R2 представляет собой (CH2)mW, где W выбран из группы, состоящей из амино, аминоалкила и замещенного или незамещенного 5- или 6-членного кольца; или где как R1, так и R2 связаны друг с другом и связаны с атомом азота с образованием насыщенного или ненасыщенного 5-или 6-членного кольца, которое может необязательно содержать дополнительный гетероатом, такой как N или O, и может быть необязательно замещенным. Замещенное или незамещенное 5- или 6-членное кольцо для Y и W может быть насыщенным или ненасыщенным кольцом и включает в себя атомы углерода и необязательно гетероатом, такой как N или O;m равно целому числу от 0 до 8, более типично 1-8 и еще более типично 2-4. Примерами 5- или 6-членных циклических групп являются фенил; N-содержащие гетероциклические группы, такие как пирролидинил, пиперидинил, пиперазинил, пиридинил, пирролил, пиразолил,пиразинил, пиримидинил, пиридазинил, имидазолил и имидазолидинил; O-содержащие гетероциклические группы, такие как фуранил и пиранил; гетероциклические группы, содержащие как N, так и O, та-3 016323 кие как морфолинил. Когда такие группы являются замещенными, они обычно замещены алкильной группой, аминогруппой или аминоалкильной группой. Понятно, что, когда части Y и/или W являются замещенной 5- или 6-членной циклической группой, замещение находится в другом положении, чем положение, соединенное с (CH2)m или с N-атомом амидогруппы. Алкильная группа обычно содержит 1-12 атомов углерода. Более обычно алкильная группа содержит 1-4 атома углерода. Примеры подходящих алкильных групп включают в себя метил, этил и пропил. Примеры разветвленных алкильных групп включают в себя изопропил и трет-бутил. Примерами алкилзамещенных ароматических групп (аралкила) являются фенил-C1-3 алкил и бензил. Примерами аминоалкильных групп являются аминометил, аминодиметил, аминоэтил, аминодиэтил, аминопропил и аминодипропил. Примеры фармацевтически приемлемых кислотно-аддитивных солей включают в себя соли, полученные из минеральных кислот, таких как хлористо-водородная, бромисто-водородная, фосфорная, метафосфорная, азотная и серная кислоты, и органических кислот, таких как винная, уксусная, лимонная,яблочная, молочная, фумаровая, бензойная, гликолевая, глюконовая, янтарная и арилсульфоновая, например п-толуолсульфоновая кислота. Соединения согласно настоящему описанию можно получить известными способами, такими как описаны в публикации March's Advanced Organic Chemistry, Reactions, Mechanisms and Structure, Fifth Ed.John WileySons, Inc, 2001, Chapter 10, pp 506-512, описание которой включено здесь в качестве ссылки. Согласно настоящему изобретению обнаружено, что описанные соединения неожиданно и преимущественно можно использовать при лечении рака млекопитающих, особенно колоректального рака человека. Например, диметиламиноэтиламидное производное сулиндака, обозначаемое здесь SRI 21004,проявляет сильное ингибирующее действие in vitro против роста клеток опухоли толстой кишки человека. SRI 21004 и сульфидное производное (N-[2-(диметиламино)этил]-5-фтор-2-метил-1-4(метилсульфид)фенил]метилен]-1H-инден-3-ацетамид, SRI 21009) обнаруживают величины цитотоксичности IC50 (концентрация при 50% ингибировании) 29,18 и 1,47 мкМ, соответственно, по сравнению с величинами IC50 479,40 и 71,22 мкМ для сулиндака и его сульфидного метаболита, соответственно. Такое наблюдение было неожиданным, поскольку химическая модификация приводила к пониженной ингибирующей активности в отношении циклооксигеназы (COX), типов 1 и 2, которая, как широко признано,является ответственной за противоопухолевую активность сулиндака. Однако ингибирование COX и снижение уровня физиологически важных простагландинов является ответственным за токсичностьNSAID и селективных ингибиторов COX-2 (т.е. целекоксиба и рофекоксиба) и эффективно ограничивает их пригодность для лечения рака, которое требует длительное воздействие и высокие дозы. Считается,что описанные здесь соединения имеют преимущества в безопасности и эффективности действия по сравнению с NSAID и селективными ингибиторами COX-2 для рака и возможно других показаний,включающих в себя хроническое воспаление. Такие токсичные действия включают в себя желудочнокишечные, почечные и гематологические нарушения, которые являются результатом ингибированияCOX-1, а также токсичность для сердечно-сосудистой системы, которая вероятно является результатом ингибирования COX-2. Кроме того, полученные модификацией производные данного описания имеют потенциал для проявления пониженной печеночной токсичности, которая является особой проблемой для сулиндака и сульфонового производного сулиндака (эксисулинда). Химической модификацией согласно данному описанию является модификация остатка карбоновой кислоты сулиндака и такая модификация является особенно полезной, поскольку в литературе указывается, что ингибирование COX необходимо для противораковой активности NSAID и что COX-зависимая токсичность является причиной того, что NSAID имеют ограничения при лечении и предупреждении рака. Химическая модификация согласно данному описанию придает результирующий положительный заряд другому отрицательно заряженному соединению, что считают необходимым для ингибирующей циклооксигеназу активности, но, как неожиданно было обнаружено, повышает противораковую активность посредством независимого от циклооксигеназы механизма. Соединения согласно настоящему описанию можно получить по следующим схемам. Общие методики для синтеза производных сулиндака (соединения 1-9). Соединения 1-5 и 7-9 синтезируют способом I и соединение 6 синтезируют способом II. Способ I. Сулиндак (60 мг, 0,17 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона и раствор охлаждают на бане лед/вода (0C). К реакционной смеси добавляют подходящий амин (0,033 мл,0,25 ммоль) с последующим добавлением(гексафторфосфат бензотриазол-1 илокситриспирролидинофосфония; 130 мг, 0,25 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона на протяжении ночи. Добавляют деионизированную воду (5 мл) и реакционную смесь экстрагируют хлороформом (230 мл), промывают H2O (10 мл), сушат над Na2SO4 и концентрируют на роторном испарителе. Образовавшееся масло снова растворяют в толуоле и совместно упаривают для удаления остаточного пиридина. Сырой продукт далее очищают колоночной хроматографией (60-200 меш). Аналитически чистое соединение получают сушкой в вакууме на протяжении ночи,затем при 78C в течение 4 ч. Способ II. Сулиндак (100 мг, 0,28 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона. К раствору последовательно добавляют DCC (86,66 мг, 0,42 ммоль), NHS (48,34 мг, 0,42 ммоль) и амин (0,044 мл, 0,34 ммоль) и реакционную смесь перемешивают в течение 2 дней. Реакцию гасят добавлением деионизированной воды (5 мл). Осажденное вещество (главным образом N,N'-дициклогексилмочевина) удаляют фильтрованием и смесь упаривают на роторном испарителе. Остаток упаривают совместно с толуолом для удаления остаточного пиридина. Сырой продукт очищают колоночной хроматографией (60200 меш) и чистое соединение сушат на протяжении ночи в вакууме, затем при 78C в течение 4 ч. Пример 1. N-[2-(Диметиламино)этил]-5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-1Hинден-3-ацетамид (1) Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%NH4OH (9:1). Продукт получают в виде желтого твердого вещества с выходом 98%. ESI-MC m/z: 427(2H, дд, J=5,7 Гц, 11,2 Гц, -NHCH2CH2N(CH3)2), 3,51 (2H, с, 3-CH2), 2,81 (3H, с, 4'-CH3), 2,33 (2H, т, J = 6,0 Гц,-NHCH2CH2N(CH3)2), 2,13 (6H, с, N(CH3)2, 2,12 (3H, с, 2-CH3). CHN Найдено: C, 67,99; H, 6,45; N, 6,60. Вычислено для C24H27FN2O2S; C, 67,59; H, 6,38; N, 6,57. Пример 2. 5-Фтор-2-метил-N-[(1-метил-2-пирролидинил)метил]-1-4-(метилсульфинил)фенил]метилен]-1Hинден-3-ацетамид (2). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%NH4OH (8:1). Получают желтое твердое вещество с выходом 91%. ESI-MC m/z: 467 [M+H]+. 1-NHCH2CHa, 4"-Ha). CHN Найдено: C, 67,62; H, 6,48; N, 6,22. Вычислено для C27H31FN2O2S0,8 H2O: C,67,40; H, 6,83; N, 5,82. Пример 3. 5-Фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперазинил)этил]-1Hинден-3-ацетамид (3). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%NH4OH (4:1) и дополнительно очищают препаративной TCX с применением смеси CHCl3/MeOH+0,2%NH4OH (5:1). Получают желтое твердое вещество с выходом 58%. ESI-MC m/z: 468 [M+H]+. 1N, 8,55. Пример 4. 5-Фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперидинил)этил]-1Hинден-3-ацетамид (4) Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (9:1). Получают желтое твердое вещество с выходом 89%. ESI-MC m/z: 467 [M+H]+. 1C27H31FN2O2S0,7 H2O: C, 67,67; H, 6,81; N, 5,84. Пример 5. 5-Фтор-2-метил-1-4-метилсульфинил)фенил]метилен]-N-[2-(3-пиридинил)этил]-1Hинден-3-ацетамид (5) Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (95:5) и дополнительно очищают препаративной TCX с применением смеси CHCl3/MeOH (98:2). Получают желтое твердое вещество с выходом 62%. ESI-MC m/z: 461 [M+H]+. 1H ЯМР (ДМСО-d6) :8,38-8,42 (2H, м,4"-H и 6"-H), 8,17 (1H, т, J=4,4 Гц, -NHCH2CH2), 7,78 (2H, д, 3'-H и 5'-H), 7,72 (2H, д, 2'-H и 6'-H), 7,607,56 (1H, м, 2"-H), 7,34 (1H, с, 8-H), 7,27-7,23 (1H, м, 3"-H), 7,16 (1H, дд, J=5,3 Гц, 8,4 Гц, 7-H), 6,70 (1H,ддд, J=2,4 Гц. 9,5 Гц, 11,0 Гц, 6-H), 3,40 (2H, с, 1-CH2), 2,31-3,26 (2H, м, -NHCH2CH2), 2,82 (3H, с, 2-CH3),2,74 (2H, т, J=6,8 Гц, -NHCH2CH2), 2,15 (3H, с, 4'-CH3). CHN Найдено: C, 69,48; H, 5,43; N, 5,87. Вычислено для C27H25FN2O2S0,3 H2O: C, 69,60; H, 5,54; N, 6,01. Пример 6. 5-Фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(4-морфолинил)этил]-1H-инден-3 ацетамид (6). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (95:5). Получают желтое твердое вещество с выходом 75%. ESI-MC m/z: 4 69 [M+H]+. 1H, 6,31; N, 5,89. Пример 7. 5-Фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пирролидинил)этил]1H-инден-3-ацетамид (7). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH(9:1)+0,2% NH4OH. Получают желтое твердое вещество с выходом 95%. ESI-MC m/z: 453 [M+H]+. 1(4H, м, 3-H, 4"-H, -NHCH2CH2), 2,18 (3H, с, 2-CH3), 1,69 (4H, с, 2"-H и 5"-Н). CHN Найдено: C, 66,59; H,6,22; N, 6,04, Вычислено для C26H29FN2O2S0, 8 H2O; C, 66,87; H, 6,60; N, 6,00. Пример 8. N,2-Диметил-N-[2-(диметиламино)этил]-5-фтор-1-(4-этилсульфинил)фенил]метилен]1H-инден-3-ацетамид (8). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (9:1). Получают желтое твердое вещество с выходом 62%. ESI-MC m/z: 441 [M+H]+. 1H ЯМР (ДМСО-d6). Частичная характерная черта двойной связи амидной группы дает два набора резонансов:7,78 (2H, д, J=8,4 Гц, 3'-H, 5'-H), 7,72 (2H, д, J=8,5 Гц, 2'-H, 6'-H), 7,35 (1H, с, 8-H), 7,15 (1H,дд, J=5,5 Гц, 8,46 Гц, 7-H), 7,01-6,95 (1H, м, 4-H), 6,71 (1H, ддд, J=2,5 Гц, 9,5 Гц, 10,9 Гц, 6-H), 3,72 и 3,65(2H, с, 1-CH2), 3,47 и 3,39 (2H, т, J=5,7 Гц, -NHCH2CH2), 3,08 и 2,84 (3H, с, -NCH3), 2,82 (3H, с, 4'-CH3),-6 016323 2,42 и 2,32 (2H, т, J=6,7 Гц, -NHCH2CH2, с, 2-C), 2,20 (3H, H3S, -N(C), 2,13 (6H, H3)2). CHN Найдено: C,67,41; H, 6,51; N, 6,29. Вычислено для C25H29FN2O2S0,3 H2O; C, 67,33; H, 6,69; N, 6,28. Пример 9. N-(2-Аминоэтил)-5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-1H-инден-3 ацетамид (9) Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%NH4OH (9:1). Продукт получают в виде желтого твердого вещества с выходом 95%. ESI-MC m/z: 399(2H, д, J=8,1 Гц, 2'-H, 6'-H), 7,35 (1H, с, 8-H), 7,18-7,10 (2H, м, 4-H, 7-H), 6,70 (1H, ддд, J=2,4 Гц, 9,7 Гц,11,1 Гц, 6-H), 3,43 (2H, с, 3-CH2), 3,05 (2H, дд, J=6,l Гц, 11,9 Гц, -NHCH2CH2NH2), 2,82 (3H, с, 4'-СН 3),2,57 (2H, т, J=6,3 Гц, -NHCH2CH2NH2), 2,18 (3H, с, 2-CH3). CHN Найдено: C, 62,47; H, 6,33; N, 6,33, Вычислено для C22H23FN2O2S1,4 H2O: C, 62,36; H, 6,14; N, 6,61. Пример 10. N-[2-(Диметиламино)этил]-5-фтор-2-метил-1-4(метилтио)фенил]метилен]-1H-инден-3 ацетамид (Общий метод: Olah et al. Synthesis 1978 137). Трифенилфосфин (0,502 г, 1,913 ммоль) и I2 (0,486 г, 1,913 ммоль) перемешивают вместе в ацетонитриле (5 мл) до получения желтой суспензии. К желтой суспензии добавляют сульфоксид примера(0,068 г, 0,16 моль) в ацетонитриле (5 мл) с последующим добавлением порошка NaI (0,358 г, 2,39 ммоль). Реакционную смесь перемешивают в атмосфере аргона на протяжении ночи при комнатной температуре. Реакционную смесь осторожно нагревают в течение 6 ч, чтобы довести реакцию до завершения и затем выдерживают ее при комнатной температуре на протяжении ночи в атмосфере аргона. Реакционную смесь разбавляют эфиром (250 мл), промывают насыщенным раствором Na2S2O3, 5% NaHCO3, H2O,концентрируют, снова растворяют в CHCl3, сушат над Na2SO4 и концентрируют до получения желтого остатка. Сырой продукт очищают колоночной хроматографией с применением смеси хлороформ/метанол 20:1 для заполнения и элюирования колонки силикагеля (230-400 меш). Получают желтое твердое вещество с выходом 44% (29 мг). FABMC m/z: 411 (M+H)+. 1(1H, ушир. с, -NHCH2CH2N(CH3)2), 6,60 (1H, ддд, 6-H), 6,87 (1H, дд, 4-H, J=2,41 Гц, 9,0 Гц), 7,16 (1H, с,10-H), 7,31-7,26 (1H, м, 6'-H), 7,38 (1H, дд, 7-H, J=5,27 Гц, 8,46 Гц), 7,44 (2H, д, 3'-H и 5'-H); спектр подтверждает предлагаемую структуру с некоторым количеством присутствующей H2O. CHN(C24H27N2OSF). Найдено: C, 69,84; H, 6,77; N, 6,89. Вычислено: C, 70,21; H, 6,63; N, 6,82. Кроме того, нижеследующие соединения согласно настоящему описанию можно получить по следующим схемам: Общие методики для синтеза производных сулиндака (соединения 11-15). Соединения 11 и 12 синтезируют способом I, соединение 13 синтезируют способом II, соединение 14 синтезируют способом III и соединение 15 синтезируют способом IV. Способ I. Сулиндак (100 мг, 0,28 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона и раствор охлаждают на бане лед/вода (0C). К реакционной смеси добавляют амин (0,045 мл, 0,42 ммоль) с(гексафторфосфат бензотриазол-1-илокситриспирролидинофосфония; 219 мг, 0,42 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона на протяжении ночи. Добавляют деионизированную воду (5 мл) и реакционную смесь экстрагируют хлороформом (230 мл), промывают H2O (10 мл), сушат над Na2SO4, концентрируют на роторном испарителе. Остаток снова растворяют в толуоле и совместно упаривают для удаления остаточного пиридина. Сырой продукт очищают колоночной хроматографией (60-200 меш). Чистое соединение сушат в вакууме в течение по меньшей мере 48 ч. Способ II. Сулиндак (100 мг, 0,28 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона. К реакционной смеси добавляют амин (77 мг, 0,42 ммоль) с последующим добавлением PyBOP (гексафторфосфат бензотриазол-1-илокситриспирролидинофосфония; 219 мг, 0,42 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона на протяжении ночи. К реакционной смеси добавляют амин (26 мг, 0,14 ммоль) для повышения отношения сулиндака к амину до 1:2. Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 72 ч. К реакционной смеси добавляют деионизированную воду (5 мл) для гашения реакции. Реакционную смесь упаривают вместе с толуолом для удаления остаточного пиридина. Сырой продукт очищают колоночной хроматографией (60-200 меш). Чистое соединение сушат в вакууме в течение по меньшей мере 48 ч. Способ III. Сулиндак (100 мг, 0,28 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона. К реакционной смеси добавляют амин (0,06 мл, 0,42 ммоль) с последующим добавлением PyBOP (гексафторфосфат бензотриазол-1-илокситриспирролидинофосфония; 219 мг, 0,42 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона в течение 72 ч. Добавляют деионизированную воду (5 мл) и реакционную смесь экстрагируют хлороформом (230 мл), промывают H2O (10 мл), сушат над Na2SO4, концентрируют на роторном испарителе. Остаток снова растворяют в толуоле и совместно упаривают для удаления остаточного пиридина. Сырой продукт сушат в вакууме в течение 72 ч. Неочищенный продукт очищают колоночной хроматографией (60-200 меш). Чистое соединение совместно упаривают с этанолом (350 мл). Чистое соединение сушат на осушающем пистолете на протяжении ночи. Способ IV. Сулиндак (100 мг, 0,28 ммоль) растворяют в безводном пиридине (5 мл) в атмосфере аргона. К реакционной смеси добавляют амин (95 мг, 0,42 ммоль) с последующим добавлением PyBOP (гексафторфосфат бензотриазол-1-илокситриспирролидинофосфония; 219 мг, 0,42 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере аргона в течение двух недель. К реакционной смеси добавляют деионизированную воду (5 мл) для гашения реакции. Реакционную смесь упаривают совместно с толуолом для удаления остаточного пиридина. Сырой продукт очищают колоночной хроматографией (60-200 меш). Чистое соединение упаривают совместно с этанолом (250 мл). Чистое соединение сушат на осушающем пистолете на протяжении ночи. Пример 11. 5-Фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-(фенилметил)-1H-инден-3 ацетамид (11). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (98:2). Продукт получают в виде желтого твердого вещества с выходом 91%. ESI-MC m/z: 446 [M+H]+. 1(2H, с, 3-CH2), 2,82 (3H, с, CH3SO-), 2,20, (3H, с, 2-CH3). CHN Найдено: C, 71,48; H, 5,36; N, 3,22. Вычислено для C27H24FNO2S0,4 H2O; C, 71,63; H, 5,52; N, 3,09. Пример 12. 5-Фтор-N-(2-фуранилметил)-2-метил-1-4-(метилсульфинил)фенил]метилен]-1Hинден-3-ацетамид (12). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (95:5) и дополнительно очищают препаративной TCX с применением CHCl3/MeOH (95:5). Получают желтое твердое вещество с выходом 34%. ESI-MC m/z: 436 [M+H]+. 1C25H22FNO3S0, 75 H2O: C, 66,87; H, 5,27; N, 3,12. Пример 13. 5-Фтор-N-[2-(4-имидазолил)этил]-2-метил-1-4-(метилсульфинил)фенил]метилен-1Hинден-3-ацетамид (13). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%-8 016323 Получают желтое твердое вещество с выходом 31% при 54% прореагировавшего вещества. ESI-MC m/z: 450 [M+H]+. 1H ЯМР (ДМСО-d6). Кольцо имидазола дает два набора резонансов:8,16 (1H, ушир. т, J=5,3 Гц,-NHCH2CH2), 7,79 (2H, д, J=8,4 Гц, 3'-H, 5'-H), 7,72 (2H, д, J=8,4 Гц, 2'-H, 6'-H), 7,50 (1H, ушир. с, 2"-H),7,35 (1H, с, 8-H), 7,16 (1H, дд, J=5,3 Гц, 8,4 Гц, 7-H), 7,09 (1H, дд, J=2,5 Гц, 9,4 Гц, 4-H), 6,83 (1H, ушир. с,4"-H), 6,71 (1H, ддд, J=2,5 Гц, 8,4 Гц, 9,5 Гц, 6-H), 3,42 (2H, с, 3-CH2), 3,26 (2H, м, -NHCH2CH2), 2,82 (3H,с, CH3SO-), 2,65 (2H, м, -NHCH2CH2), 2,17 (с, 2-CH3) CHN Найдено: C, 64,22; H, 5,37; N, 8,71, Вычислено для C25H24FN3O2S1,0 H2O; C, 64,22; H, 5,60; N, 8,99. Пример 14. 5-Фтор-N-[2-(N,N-диэтиламино)этил]-2-метил-1-[4-(метилсульфинил)фенил]метилен 1H-инден-3-ацетамид (14) Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH (95:5) и дополнительно очищают препаративной TCX с применением смеси CHCl3/MeOH+1,0% NH4OH (9:1) и препаративной TCX с применением смеси CHCl3/MeOH+1, 0% NH4OH (7:1). Получают желтое твердое вещество с выходом 28%. ESI-MC m/z: 455 [M+H]+. 1N-4-(Диметиламино)фенил]метил]-5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид (15). Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+1,0%NH4OH (95:5) и дополнительно очищают препаративной TCX с применением смеси CHCl3/MeOH (9:1). Получают желтое твердое вещество с выходом 26% при 36% прореагировавшего исходного соединения. Пример 16. 2-[5-Фтор-2-метил-1-4-(метилсульфонил)фенил]метилен]-1H-инден-3-ил]-1-(4 метилпиперазинил)этанон. Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,2%NH4OH (95:5). Продукт получают в виде желтого твердого вещества с умеренным выходом. ESI-MC m/z: 439,23 [M+H]+. 1 Соединения 17, 18, 19 синтезируют способом V и соединение 20 синтезируют способом VI. Способ V. Гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HBTU) (114 мг, 0,2996 ммоль) добавляют к раствору сульфидного производного сулиндака или сулиндака (0,2497 ммоль), подходящего амина (0,2996 ммоль) и Et3N (0,07 мл, 0,4994 ммоль) в сухом ацетонитриле (10 мл) при комнатной температуре в атмосфере аргона. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин. К реакционной смеси добавляют насыщенный раствор соли и экстрагируют CHCl3(230 мл). Объединенные органические экстракты сушат над безводным Na2SO4 и растворитель выпаривают при пониженном давлении. Сырой продукт очищают колоночной флэш-хроматографией (60-200 меш). Способ VI. Дифенилфосфорилазид, DPPA (0,052 мл, 0,2417 ммоль) добавляют к раствору сульфонового производного сулиндака (75 мг, 0,2014 ммоль) и N,N-диметилэтилендиамина (0,026 мл, 0,2417 ммоль) в сухом ДМФA (2 мл) при 0C в атмосфере аргона. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают на протяжении ночи. К реакционной смеси добавляют водный Na2CO3(30 мл) и экстрагируют CHCl3 (230 мл). Объединенные органические экстракты сушат над безводнымNa2SO4 и растворитель выпаривают при пониженном давлении. Сырой продукт очищают колоночной флэш-хроматографией (60-200 меш). Пример 17.N-4-(Диметиламино)фенил]метил]-(Z)-5-фтор-2-метил-3-4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид. Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/петролейный эфир+0,1% NH4OH (4:1. Продукт получают в виде желтого твердого вещества с выходом 98%. ESI-MCJ=9,0 Гц, 4J=2,4 Гц, 4-H), 6,64-6,56 (3H, м, 6-H, 3"-H, 5"-H), 5,75 (1H, ушир. с, NH), 4,32 (2H, д, J=5,6 Гц,NH-CH2), 3,56 (2H, с, -CH2CO), 2,90 (6H, с, N(CH3)2), 2,54 (3H, с, -SCH3), 2,17 (3H, с, 2-CH3). Анал. Вычисл. для C29H29FN2OS: C, 73,70; H, 6,18; N, 5,93. Найдено: C, 73,74; H, 6,17; N, 5,72. Пример 18. N,2-Диметил-(Z)-5-фтор-2-метил-N-[2-(метиламино)этил]-3-4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид. Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,1%NH4OH (97:1). Продукт получают в виде желтого твердого вещества с выходом 82%. ESI-MC m/z: 411,26N-4-(Диметиламино)фенил]-(Z)-5-фтор-2-метил-3-4-(метилсульфинил)фенил]метилен-1H-инден-3-ацетамид Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,1%NH4OH (99:1). Продукт получают в виде желтого твердого вещества с выходом 98%. ESI-MC m/z: 475.21- 10016323 Пример 20. N-[2-(Диметиламино)этил]-(Z)-5-фтор-2-метил-3-4-(метилсульфонил)фенил]метилен]1H-инден-3-ацетамид. Сырой продукт очищают колоночной хроматографией с применением смеси CHCl3/MeOH+0,1%NH4OH (49:1). Продукт получают в виде желтого твердого вещества с выходом 94%. ESI-MC m/z: 443.22C24H27FN2O3S0,25 H2O: C, 64,48; H, 6,20; N, 6,27. Найдено: C, 64,54; H, 6,05; N, 6,29. Пример 21. N-[4-(Диметиламино)фенил]-(Z)-5-фтор-2-метил-3-4-(метилтио)фенил]метилен-1Hинден-3-ацетамид. Сырой продукт очищают колоночной хроматографией с применением смеси 2% MeOH-CHCl3+0,1% NH4OH. Продукт получают в виде желтого твердого вещества с выходом 100%, ESI-MC m/z: 459,25C28H27FN2OS0, 25 H2O: C, 72,62; H, 5,99; N, 6,05. Найдено; C, 72,41; H, 5,61; N, 5,74. Экспериментальные результаты Испытания цитотоксичности in vitro с применением клеточной линии опухоли толстой кишки HT29 человека показывают значительные повышения активности производных сулиндака SRI 21004 (сульфоксида) и SRI 21009 (сульфида) относительно соответствующих форм сулиндака. Ингибирующая рост активность производных SRI и сулиндака, определяемая с применением анализа с включением тритированного тимидина (левая сторона) или анализа жизнеспособности клеток MTS (правая сторона) показаны на фиг. 1A и 1B. Следует отметить повышенную активность производных SRI по сравнению с сулиндаком и его сульфоновыми и сульфидными метаболитами. Следует также отметить, что более высокие концентрации сулиндака и его метаболитов требовались для снижения числа жизнеспособных клеток по сравнению с концентрациями, требуемыми для ингибирования пролиферации, чего не было в случае производных SRI. Это указывает на более высокий потенциал производных SRI по уничтожению клеток опухолей по сравнению с сулиндаком и его метаболитами. На фиг. 2 показана ингибирующая рост активность SRI 21009 на панели гистологически различных типов клеток опухолевых заболеваний. Следует отметить повышенную чувствительность опухолевых клеток, полученных из колоректальных опухолей, по сравнению с другими типами опухолей. На фиг. 3A и 3B показана цитостатическая и цитотоксическая активность, соответственно, SRI 21004 по сравнению с сульфидным производным сулиндака. Цитотоксическую активность определяют как способность обработки снижать число клеток ниже числа, когда начинают лечение, и такая способность является показателем химиотерапевтической эффективности. Цитостаз определяют как способность обработки снижать число клеток относительно необработанных клеток и такая способность является показателем химиопрофилактической эффективности. Следует отметить, что SRI 21004 обнаруживает более высокий потенциал для химиотерапевтической активности по сравнению с сульфидным производным сулиндака и это согласуется с более высокой способностью уничтожать опухолевые клетки,как показано на фиг. 1B. На фиг. 4 показана пероральная биологическая доступность SRI 21009. Достижимые уровни SRI 21009 в плазме после перорального введения его при одной дозе 200 мг/кг превышают величину IC50 для ингибирования роста in vitro. Незначительные количества сульфоксидного, сульфонового и сульфидного производных сулиндака обнаруживают в плазме после введения SRI 21009. На фиг. 5A и 5B показана пониженная токсичность SRI 21009 для мышей по сравнению с сулиндаком. После применения схемы обработки с введением дозы один раз в день установлено, что максимально толерантной дозой сулиндака является 50 мг/кг по сравнению с 300 мг/кг для SRI 21009. На фиг. 6 показана противоопухолевая активность SRI 21009 для голых мышей, не имеющих вилочковой железы, которым подкожным путем имплантировали опухолевые клетки толстой кишки НТ 29 человека. Для данного исследования SRI 21009 вводят перорально один раз каждые два дня при дозе 700 мг/кг. SRI 21009, введенное при дозе 300 мг/кг, является таким же эффективным, как сулиндак при 50 мг/кг, при применении схемы дозирования один раз в день. В табл. A ниже показана пониженная ингибирующая активность в отношении COX-1 и COX-2 SRI 21009 по сравнению с неселективным ингибитором COX (сульфидным производным сулиндака), COX-1 селективным ингибитором (индометацином) и COX-2-селективным ингибитором (рофекоксибом). Ингибирующая активность соединений выражена как величина IC50 (концентрация при 50% ингибировании). Дополнительные производные сулиндаксульфоксида, синтезированные и испытанные на ингибирующую рост активность в отношении опухолевых клеток толстой кишки HT29 человека, показаны ниже в табл. 1. Все производные являются более активными, чем сулиндаксульфоксид, с некоторой проявленной сравнимой или более высокой активностью по сравнению с SRI 21004. Таблица B В приведенной выше таблице указана ингибирующая рост активность сулиндака и группы производных SRI в отношении клеточной линии опухоли толстой кишки HT29 человека. Активность выражена как эффективность величиной IC50 (концентрация для 50% ингибирования). Следует отметить, что соединения с 4-N,N-диметилфениламидной группой данного описания не являются особенно предпочтительными, поскольку они менее активны, чем соединения с 4-диметилбензиламидной группой. Сравните,например, соединения 21590 и 21623 с соединениями 21275 и 21540, соответственно. Кроме того, полагают, что соединение с SCH3 (21623) менее активно, чем соответствующее соединение с SOCH3 (21590),вследствие, по меньшей мере, частично того, что оно является менее гидрофильным, что приводит к отмеченным проблемам растворимости во время биоанализа. Согласно настоящему описанию производные сулиндака можно применять в отдельности или в подходящем сочетании, и можно также применять в комбинации с фармацевтически приемлемыми носителями и другими фармацевтически активными соединениями, такими как различные лекарственные средства для лечения рака, включающие в себя NSAID, и/или вместе с лучевой терапией. Активный агент может присутствовать в фармацевтической композиции в любом подходящем количестве. Фармацевтические композиции могут включать в себя компоненты, обычно применяемые для таких целей. Фармацевтически приемлемые носители, описываемые здесь, например наполнители, адъюванты,эксципиенты или разбавители, являются хорошо известными специалисту в данной области. Фармацевтически приемлемый носитель обычно является химически инертным для активных соединений и не обладает вредными побочными действиями или токсичностью в условиях применения. Фармацевтически приемлемые носители могут включать в себя полимеры и полимерные матрицы. Другой добавкой для фармацевтических композиций может быть циклодекстрин для повышения абсорбции активного агента. Выбор носителя будет определяться отчасти конкретным методом, применяемым для введения композиции. Согласно этому, имеется большое разнообразие подходящих препаратов для фармацевтической композиции настоящего изобретения.- 13016323 Нижеследующие препараты для перорального, аэрозольного, парентерального, подкожного, внутривенного, внутриартериального, внутримышечного, внутрибрюшинного, интратекального, ректального и вагинального введения являются лишь примерными, но никоим образом не ограничивающими данное изобретение. Препараты, подходящие для перорального введения, могут включать в себя (a) водные растворы,содержащие эффективное количество соединения, растворенного в разбавителях, таких как вода, солевой раствор или апельсиновый сок; (b) капсулы, саше, таблетки, лепешки и пастилки, причем каждая содержит предварительно определенное количество активного ингредиента в виде твердых веществ или гранул; (c) порошки, (d) суспензии в подходящей жидкости; и (e) подходящие эмульсии. Жидкие препараты могут включать в себя разбавители, такие как вода, циклодекстрин, диметилсульфоксид и спирты, например этанол, бензиловый спирт, пропиленгликоль, глицерин и полиэтиленовые спирты, включающие в себя полиэтиленгликоль, либо с добавлением, либо без добавления фармацевтически приемлемого поверхностно-активного вещества, суспендирующего агента или эмульгирующего агента. Формы капсул могут быть обычного типа с твердой или мягкой желатиновой оболочкой, содержащие, например, поверхностно-активные вещества, смазывающие вещества и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. Формы таблеток могут включать в себя один или несколько следующих компонентов: лактозу, сахарозу, маннит, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, микрокристаллическую целлюлозу, аравийскую камедь, желатин, гуаровую камедь, коллоидальный диоксид кремния, натриевую соль кроскармеллозы, тальк, стеарат магния, стеарат кальция, стеарат цинка, стеариновую кислоту и другие эксципиенты, красящие агенты, разбавители,буферные агенты, дезинтегрирующие агенты, увлажняющие агенты, консерванты, корригенты и фармацевтически совместимые носители. Формы лепешек могут включать в себя активный ингредиент в корригенте, таком как сахароза и аравийская камедь или трагакант, формы пастилок включают в себя активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь,эмульсии и гели содержат помимо активного ингредиента инертную основу, такую как желатин и глицерин или сахарозу и аравийскую камедь, эмульсии и гели, содержащие помимо активного ингредиента носители, которые известны в данной области. Производные сулиндака по отдельности или в комбинации с другими подходящими компонентами можно изготовлять в составе аэрозольных препаратов, которые вводят посредством ингаляции. Эти аэрозольные препараты можно помещать в пригодные для создания давления пропелленты, такие как дихлордифторметан, пропан и азот. Их можно также изготовлять в виде фармацевтических средств для препаратов, не находящихся под давлением, таких как распылитель или пульверизатор. Препараты, подходящие для парентерального введения, включают в себя водные или неводные,изотонические стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы,бактериостаты и растворенные вещества, которые делают препарат изотоничным с кровью предполагаемого реципиента, и водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты, солюбилизаторы, загущающие агенты, стабилизаторы и консерванты. Соединение можно вводить в физиологически приемлемом разбавителе в фармацевтическом носителе, таком как стерильная жидкость или смесь жидкостей, включая воду, солевой раствор, водную декстрозу и растворы родственных сахаров, спирт, такой как этанол, изопропанол или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль, такой как поли(этиленгликоль) 400, кетали глицерина,такие как 2,2-диметил-1,3-диоксолан-4-метанол, простые эфиры, масло, жирная кислота, эфир жирной кислоты или глицерид, или ацетилированный глицерид жирной кислоты с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент,суспендирующий агент, такой как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, или эмульгирующие агенты и другие фармацевтические адъюванты. Масла, которые можно применять в парентеральных препаратах, включают в себя нефтяные, животные, растительные или синтетические масла. Конкретные примеры масел включают в себя арахисовое, соевое, кунжутное, хлопковое, кукурузное, оливковое масло, вазелин и минеральное масло. Подходящие жирные кислоты для применения в парентеральных препаратах включают в себя олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат являются примерами подходящих эфиров жирных кислот. Подходящие мыла для применения в парентеральных препаратах включают в себя соли жирных кислот щелочных металлов, аммония и триэтаноламина и подходящие детергенты включают в себя: (a) катионогенные детергенты, такие как, например, галогениды диметилдиалкиламмония и галогениды алкилпиридиния, (b) анионогенные детергенты, такие как, например, алкил-, арил- и олефинсульфонаты, алкилолефин, простой эфир и сульфаты моноглицеридов и сульфосукцинаты, (c) неионогенные детергенты, такие как, например, оксиды аминов жирного ряда, алканоламиды жирных кислот и сополимеры полиоксиэтилена и полипропилена, (d) амфотерные детергенты, такие как, например, алкиламинопропионаты и четвертичные аммониевые соли 2 алкилимидазолина и (e) их смеси. Парентеральные препараты обычно содержат от приблизительно 0,5 до приблизительно 25 мас.% активного ингредиента в растворе. В таких препаратах можно применять подходящие консерванты и- 14016323 буферы. Для минимизации или исключения раздражения на месте инъекции такие препараты могут содержать одно или несколько неионогенных поверхностно-активных веществ, имеющих гидрофильныйлипофильный баланс (HLB) приблизительно от 12 до приблизительно 17. Количество поверхностноактивного вещества в таких препаратах бывает от приблизительно 5 до приблизительно 15 мас.%. Подходящие поверхностно-активные вещества включают в себя эфиры полиэтиленсорбитана и жирных кислот, такие как моноолеат сорбитана, и имеющие высокую молекулярную массу аддукты этиленоксида с гидрофобной основой, полученной конденсацией пропиленоксида с пропиленгликолем. Фармацевтически приемлемые эксципиенты являются также хорошо известными специалисту в данной области. Выбор эксципиента будет определяться частично конкретным соединением, а также конкретным методом, применяемым для введения композиции. Согласно этому, имеется большое разнообразие подходящих препаратов для фармацевтической композиции настоящего описания. Нижеследующие методы и эксципиенты являются лишь примерными и никоим образом не ограничивающими изобретение. Фармацевтически приемлемые эксципиенты предпочтительно не препятствуют действию активных ингредиентов и не вызывают отрицательные побочные действия. Подходящие носители и эксципиенты включают в себя растворители, такие как вода, спирт и пропиленгликоль, твердые абсорбенты и разбавители, поверхностно-активные вещества, суспендирующий агент, таблетирующие связывающие вещества, смазывающие вещества, корригенты и красящие агенты. Препараты можно представить в герметизированных контейнерах с одной дозой или многими дозами, таких как ампулы и пузырьки, их можно сохранять в высушенном замораживанием состоянии,требующим только добавления стерильного жидкого эксципиента, например, воды для инъекций, непосредственно перед применением. Полученные экспромтом растворы и суспензии для инъекции можно получить из стерильных порошков, гранул и таблеток. Требования для эффективных фармацевтических носителей для инъецируемых композиций являются хорошо известными среднему специалисту в данной области. См. Pharmaceutics and Pharmacy Practice, J.B. Lippincott Co., Philadelphia, PA, Banker andChalmers, Eds., 238-250 (1982) и ASHP Handbook on Injectable Drugs, Toissel, 4th ed., 622-630 (1986). Препараты, подходящие для местного введения, включают в себя лепешки, включающие в себя активный ингредиент в корригенте, таком как сахароза и аравийская камедь или трагакант, пастилки,включающие в себя активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкости для полоскания рта, включающие в себя активный ингредиент в подходящем жидком носителе; а также кремы, эмульсии и гели, содержащие помимо активного ингредиента носители, которые являются известными в данной области. Кроме того, препараты, подходящие для ректального введения, можно представить в виде суппозиториев, полученных смешиванием активного ингредиента с различными основами, такими как эмульгирующие основы или водорастворимые основы. Препараты, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих помимо активного ингредиента носители, которые, как известно в данной области, являются подходящими. Специалисту в данной области должно быть понятно, что подходящие методы экзогенного введения соединения настоящего описания животному являются доступными и, хотя более чем один путь можно применять для введения конкретного соединения, конкретный путь может обеспечить более быструю и более эффективную реакцию, чем другой путь. Настоящее описание далее предлагает способ лечения предраковых состояний или дисплозии (т.е. интраэпителиальной неоплазии), а также рака у млекопитающего, особенно у людей. Способ включает в себя введение эффективного для лечения количества описанного выше производного сулиндака млекопитающему. Что касается этих применений, данный способ включает в себя введение животному, особенно млекопитающему, и более конкретно, человеку, терапевтически эффективного количества соединения, эффективного при ингибировании неоплазии и роста опухоли и лечении злокачественного заболевания,включающего в себя метастазы, особенно колоректального рака. Данный способ включает в себя также введение терапевтически эффективного количества соединения для лечения предраковых поражений,таких как аденоматозные полипы толстой кишки, и других диспластических поражений кожи (старческий кератоз), мочевого пузыря, шеи, пищевода, полости рта, легких, простаты и молочной железы, иногда называемых интраэпителиальной неоплазией. Описанные соединения и композиции можно вводить для лечения ряда раковых заболеваний,включающих лейкоз и лимфоз, такие как острый лимфобластный лейкоз, острый нелимфобластный лейкоз, хронический лимфобластный лейкоз, хронический миелоидный лейкоз, болезнь Ходжкина, неходжкинская лимфома и множественная миелома, солидные опухоли детского возраста, такие как опухоли мозга, нейробластома, ретинобластома, опухоль Вильмса, костные опухоли и саркомы мягких тканей,обычные солидные опухоли взрослых людей, такие как рак легких, рак молочной железы, рак простаты,раковые заболевания мочевой системы, раковые заболевания матки, раковые заболевания полости рта,панкреатический рак, меланома и другие кожные раковые заболевания, рак желудка, рак яичников, опухоли головного мозга, рак печени, ларингеальный рак щитовидной железы, рак пищевода и тестикуляр- 15016323 ный рак. Настоящее описание относится также к лечению некоторых хронических воспалительных состояний, для которых лечение NSAID приносит пользу, но может быть противопоказано вследствие ингибирования циклооксигеназы (т.е. воспалительного заболевания кишечника) или, как оказывается, для эффективности лечения которых не требуется ингибирования циклооксигеназы, таких как некоторые нейродегенеративные заболевания, включая болезнь Альцгеймера. Доза, вводимая животному, в частности человеку, в контексте настоящего изобретения должна быть достаточной для индуцирования терапевтической реакции у животного на протяжении приемлемого интервала времени. Специалисту в данной области должно быть понятно, что доза будет зависеть от целого ряда факторов, включающих в себя состояние животного, массу тела животного, а также тяжесть и стадию ракового заболевания. Подходящей дозой является доза, которая приведет к концентрации активного агента в опухолевой ткани, которая, как известно, вызывает требуемую реакцию. Предпочтительной дозой является количество, которое приводит к максимальному ингибированию рака без нежелательных побочных действий. Общее количество соединения настоящего описания, вводимого при типичном лечении, обычно бывает между приблизительно 10 и приблизительно 1000 мг/кг массы тела для мышей и между приблизительно 100 и приблизительно 500 мг/кг массы тела и более типично между приблизительно 200 и приблизительно 400 мг/кг массы тела для людей как суточная доза. Указанное общее количество обычно, но не обязательно, вводят в виде последовательных более мелких доз от приблизительно одного раза в день до приблизительно трех раз в день в течение периода приблизительно 24 месяцев и более типично два раза в день на протяжении периода приблизительно 12 месяцев. Размер дозы будет определяться также путем введения, временными рамками и частотой введения,а также наличием, природой и степенью любых отрицательных побочных действий, которые могут сопровождать введение соединения, и требуемым физиологическим действием. Специалисту в данной области должно быть понятно, что различные болезни или патологические состояния, в частности хронические болезни или патологические состояния, могут требовать продолжительного лечения, включающего в себя многочисленные введения соединения. Описанный способ включает в себя также дополнительное введение химиотерапевтического агента,другого, чем производные настоящего изобретения. Для этой цели можно применять любой подходящий химиотерапевтический агент. Химиотерапевтический агент обычно выбирают из группы, состоящей из алкилирующих агентов, антиметаболитов, природных продуктов, противовоспалительных агентов, гормональных агентов, нацеленных на молекулярную мишень лекарственных средств, антиангиогенных лекарственных средств и других разнообразных агентов. Примеры алкилирующих химиотерапевтических агентов включают в себя кармустин, хлорамбуцил,цисплатин, ломустин, циклофосфамид, мелфалан, мехлоретамин, прокарбазин, тиотепу, урациловый аналог горчичного газа, триэтиленмеламин, бусульфан, пипоброман, стрептозоцин, ифосфамид, дакарбазин, карбоплатин и гексаметилмеламин. Примеры химиотерапевтических агентов, которые являются антиметаболитами, включают в себя цитозинарабинозид, фторурацил, гемцитабин, меркаптопурин, метотрексат, тиогуанин, флоксуридин,флударабин и кладрибин. Примеры химиотерапевтических агентов, которые являются природными продуктами, включают в себя актиномицин D, блеомицин, камптотецины, дауномицин, доксорубицин, этопозид, митомицин C,паклитаксел, таксотередоцетаксел, тениспозид, винкристин, винбластин, винорелбин, идарубицин, митоксантрон, митрамицин и деоксикоформицин. Примеры горманальных агентов включают в себя антагонисты рецептора антиэстрогена, такие как тамоксифен и флувестран, ингибиторы ароматазы, такие как анастрозол, антагонисты рецептора андрогена, такие как ципротерон и флутамин, а также агонисты гонадотропин высвобождающего гормона гипоталамуса, такие как лейпролид. Примеры противовоспалительных лекарственных средств включают в себя адренокортикоиды, такие как преднизон, и нестероидные противовоспалительные лекарственные средства, такие как сулиндак и целекоксиб. Примеры нацеленных на молекулярную мишень лекарственных средств включают в себя моноклональные антитела, такие как ритуксимаб, цетуксимаб, трастузумаб, и малые молекулы, такие как иматиниб, эрлотиниб, ортизумиб. Примеры антиангиогенных лекарственных средств включают в себя талидомид и бевацизимаб. Примеры упомянутых выше разнообразных химиотерапевтических агентов включают в себя митотан, триоксид мышьяка, третиноин, талидомид,левамизол, L-аспарагиназу и гидроксимочевину. Применяемый здесь термин включающий (и его грамматические варианты) применяют в смысле имеющий или содержащий, а в не в исключающем смысле состоящий только из. Представленное выше описание иллюстрирует и описывает данную заявку. Кроме того, описание демонстрирует и описывает только предпочтительные варианты осуществления, но, как указано выше,должно быть понятно, что его можно применять в различных других комбинациях, модификациях и условиях и можно производить изменения или модификации в пределах объема идей изобретения, как- 16016323 здесь указано, в соответствии с указанными выше описаниями и/или квалификацией или знаниями в рассматриваемой области. Кроме того, варианты осуществления, описанные здесь выше, предназначены далее для объяснения лучших способов, известных заявителю, и предоставления возможности другим специалистам в данной области применять описание в таких или других вариантах осуществления и с различными модификациями, требуемыми для конкретных приложений или применений. Согласно этому предполагается, что описание не ограничивает изобретение описанной здесь формой. Кроме того,предполагается, что прилагаемая формула изобретения должна истолковываться как включающая альтернативные варианты осуществления. Все публикации и заявки на патенты, цитированные в данном описании, включены здесь в качестве ссылки и для любых и всех целей, как если бы каждая отдельная публикация или заявка на патент была бы специально и отдельно указана как включенная в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой и его фармацевтически приемлемые соли,где X представляет собой CH3S=O или CH3S;R1 представляет собой (CH2)mY, где Y выбран из группы, состоящей из водорода, алкила, амино,аминоалкила и замещенного или незамещенного 5- или 6-членного кольца;R2 представляет собой (CH2)mW, где W выбран из группы, состоящей из амино, аминоалкила и замещенного или незамещенного 5- или 6-членного кольца; или где как R1, так и R2 связываются друг с другом и связываются с атомом азота с образованием насыщенного или ненасыщенного 5- или 6-членного кольца, которое может необязательно содержать дополнительный гетероатом и может быть необязательно замещено, и m равно целому числу от 0 до 8,причем алкильная группа содержит 1-4 атома углерода, и соединение приобретает результирующий положительный заряд. 2. Соединение по п.1, где X представляет собой CH3S. 3. Соединение по п.1, где X представляет собой CH3S=O. 4. Соединение по п.1, представляющее собой N-[2-(диметиламино)этил]-5-фтор-2-метил-1-4(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 5. Соединение по п.1, представляющее собой 5-фтор-2-метил-N-[(1-метил-2-пирролидинил)метил]1-4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 6. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперазинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 7. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пиперидинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 8. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(3-пиридинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 9. Соединение по п.1,представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(4-морфолинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 10. Соединение по п.1,представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-[2-(1-пирролидинил)этил]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 11. Соединение по п.1, представляющее собой N-(2-аминоэтил)-5-фтор-2-метил-1-4(метилсульфинил)фенил]метилен]-1 Н-инден-3-ацетамид или его фармацевтически приемлемую соль. 12. Соединение по п.1, представляющее собой N-[2-(диметиламино)этил]-5-фтор-2-метил-1-4(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль.- 17016323 13. Соединение по п.1, представляющее собой 5-фтор-2-метил-1-4-(метилсульфинил)фенил]метилен]-N-(фенилметил)-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 14. Соединение по п.1, представляющее собой 5-фтор-N-(2-фуранилметил)-2-метил-1-4(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 15. Соединение по п.1, представляющее собой 5-фтор-N-[2-(4-имидазолил)этил]-2-метил-1-4(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 16. Соединение по п.1, представляющее собой 5-фтор-N-[2-(N,N-диэтиламино)этил]-2-метил-1-4(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 17. Соединение по п.1, представляющее собой N-4-(диметиламино)фенил]метил]-5-фтор-2-метил 1-4-(метилсульфинил)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 18. Соединение по п.1, представляющее собой N-4-(диметиламино)фенил]метил]-(Z)-5-фтор-2 метил-3-4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 19. Соединение по п.1, представляющее собой N,2-диметил-(Z)-5-фтор-2-метил-N-[2(метиламино)этил]-3-4-(метилтио)фенил]метилен]-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 20. Соединение по п.1, представляющее собой N-4-(диметиламино)фенил]-(Z)-5-фтор-2-метил-34-(метилсульфинил)фенил]метилен-1H-инден-3-ацетамид или его фармацевтически приемлемую соль. 21. Фармацевтическая композиция, включающая по меньшей мере одно соединение по любому из пп.1-20 и фармацевтически приемлемый носитель. 22. Способ лечения предракового состояния или рака у млекопитающего, включающий введение млекопитающему эффективного количества по меньшей мере одного соединения по любому из пп.1-20. 23. Способ по п.22, где раком является рак толстой кишки. 24. Способ по п.22, где количество соединения для лечения составляет от приблизительно 10 до приблизительно 1000 мг/кг массы тела млекопитающего. 25. Способ по п.22, где количество соединения для лечения составляет от приблизительно 100 до приблизительно 500 мг/кг массы тела млекопитающего. 26. Способ по п.22, где лечение проводят при введении от одного раза в день до приблизительно 3 раз в день в течение 24 месяцев. 27. Способ по п.22, где производное вводят перорально, внутривенно или внутрибрюшинно. 28. Способ по п.23, где млекопитающим является человек. 29. Способ получения соединения по любому из пп.1-20, включающий взаимодействие сулиндака с соединением, представленным формулой NH2(CH2)mNR1R2.
МПК / Метки
МПК: A61K 31/74
Метки: применение, производные, получение, сулиндака
Код ссылки
<a href="https://eas.patents.su/21-16323-proizvodnye-sulindaka-ih-primenenie-i-poluchenie.html" rel="bookmark" title="База патентов Евразийского Союза">Производные сулиндака, их применение и получение</a>












