Конъюгат гаптен-носитель (варианты), антитело и способ его получения, функциональный фрагмент антитела, набор для определения присутствия никотина в образце, вакцинная композиция (варианты) и способ профилактики или лечения никотиновой аддикции (варианты)
Номер патента: 4956
Опубликовано: 28.10.2004
Авторы: Фаттом Али Ибрагим, Нэйсо Роберт Б., Эннифар Софиан
Формула / Реферат
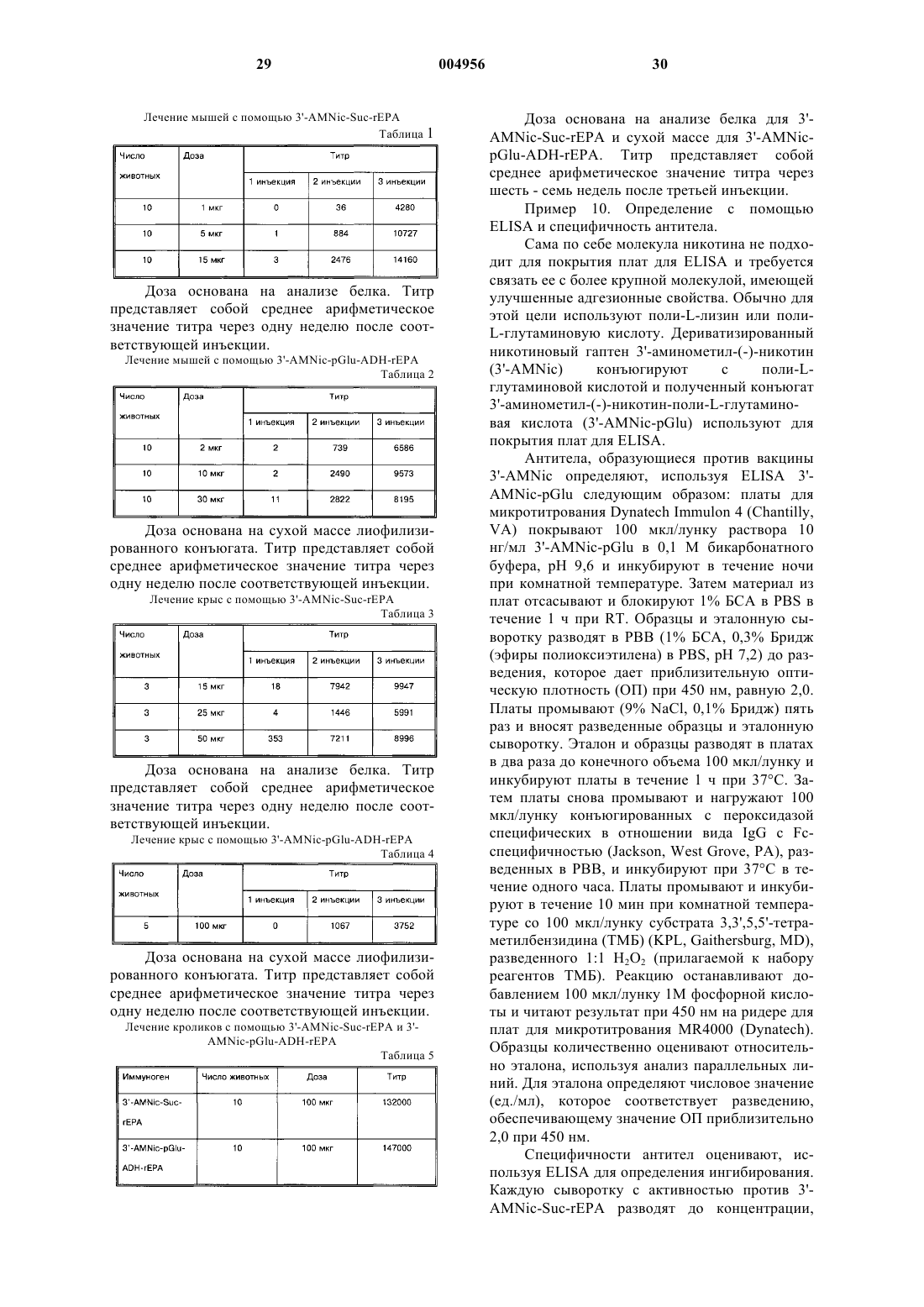
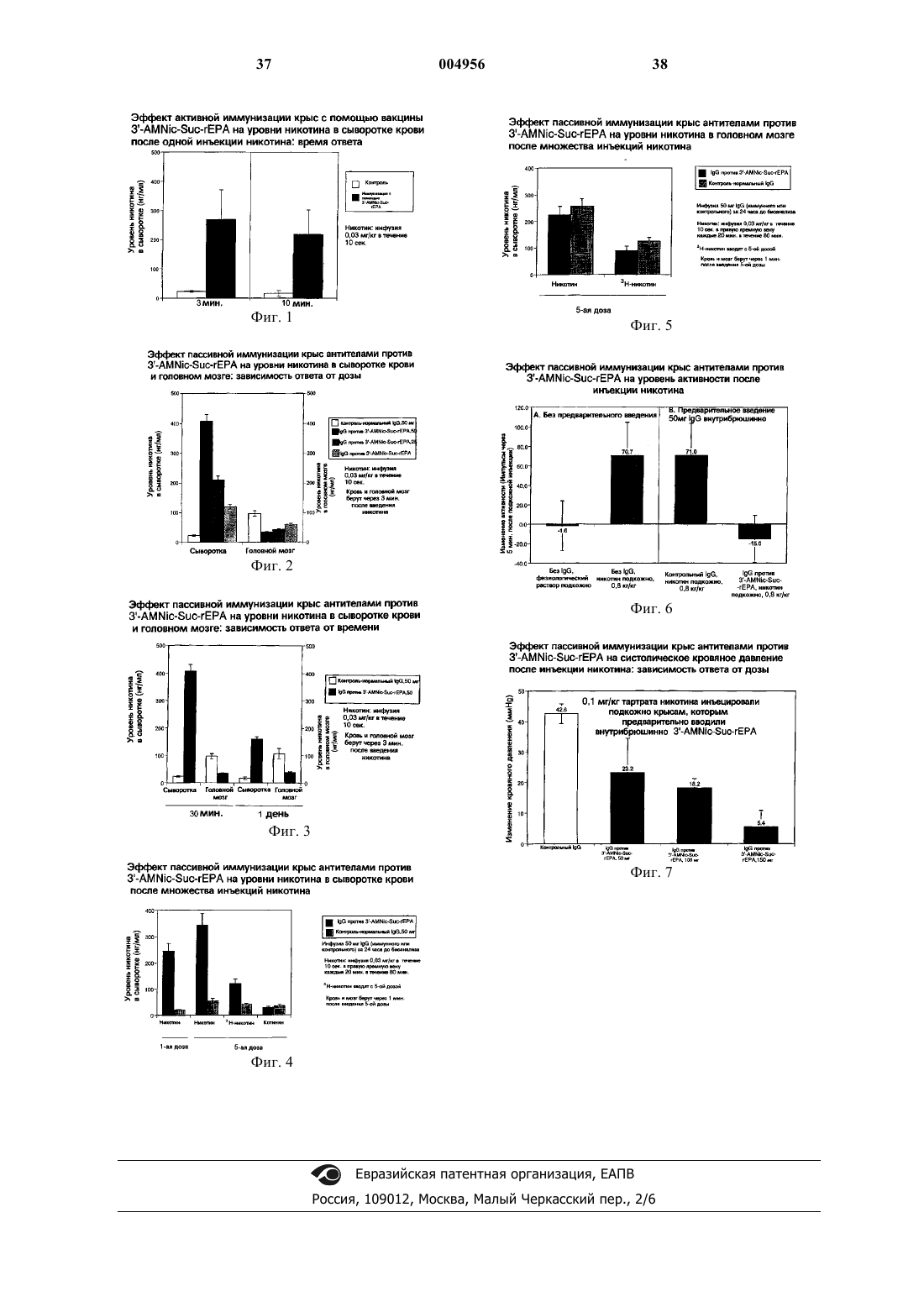
1. Конъюгат гаптен-носитель формулы
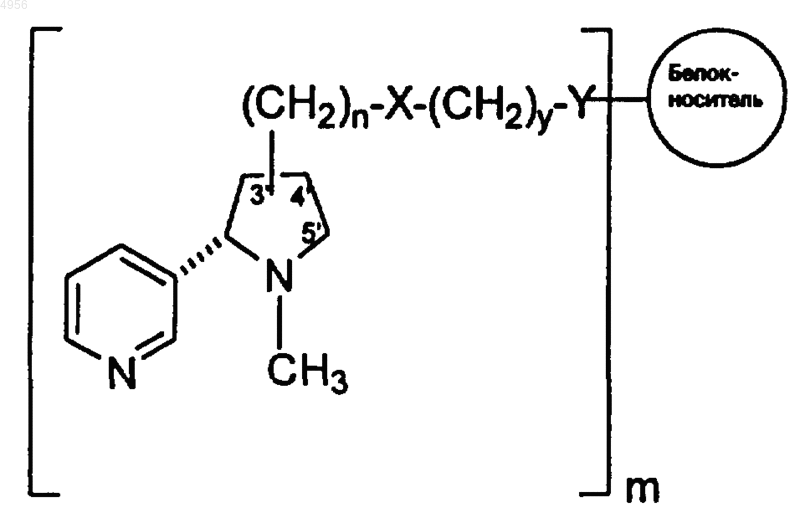
где m составляет 1 - 2500,
n составляет 0-12,
y составляет 1-12,
X выбран из группы, состоящей из NH-CO, CO-NH, CO-NH-NH, NH-NH-CO, NH-CO-NH, CO-NH-NH-CO и S-S;
Y выбран из группы, состоящей из NH-CO, CO-NH, CO-NH-NH, NH-NH-CO, NH-CO-NH, CO-NH-NH-CO и S-S,
а структура -(CH2)n-X-(CH2)y-Y- связана по положению 3', 4' или 51 никотина.
2. Конъюгат по п.1, отличающийся тем, что m составляет 11-17, n равно 1, y равно 2, X представлено NH-CO, Y представлено CO-NH, где структура -(CH2)n-X-(CH2)y-Y- связана по положению 3' никотина.
3. Конъюгат по п.1, отличающийся тем, что m составляет 11-17, n равно 1, y равно 2, X представлено NH-CO, Y представлено CO-NH, где -(CH2)n-X-(CH2)y-Y- связано по положению 4' никотина.
4. Конъюгат по п.1, отличающийся тем, что m составляет 11-17, n равно 1, y равно 2, X представлено NH-CO, Y представлено CO-NH, где -(CH2)n-X-(CH2)y-Y- связано по положению 5' никотина.
5. Конъюгат по п.1, отличающийся тем, что m выбрано из группы, состоящей из 1-20 и 1-200.
6. Конъюгат по любому из пп.1-5, отличающийся тем, что белок-носитель представлен экзопротеином A.
7. Конъюгат гаптен-носитель формулы
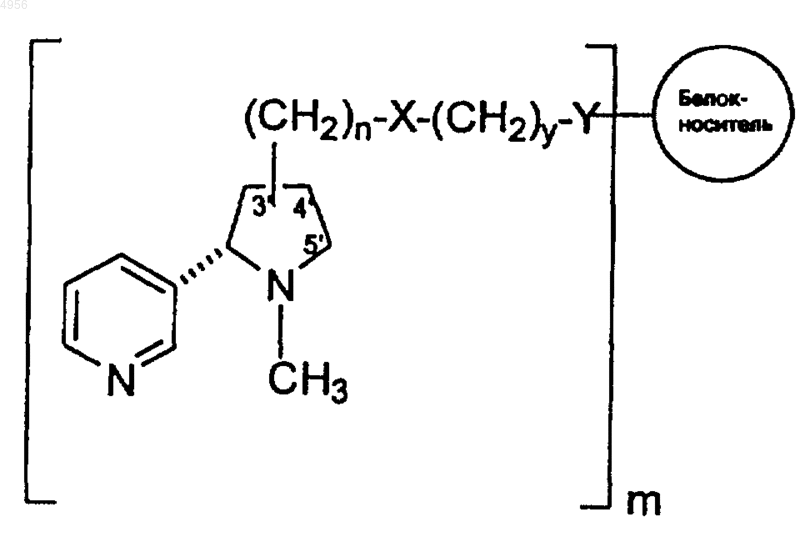
где m составляет 11-17, n равно 1, y равно 2, X представлено NH-CO, Y представлено CO-NH, белок-носитель является экзопротеином A и структура -(CH2)n-X-(CH2)y-Y- связана по положению 3' никотина.
8. Конъюгат гаптен-носитель формулы
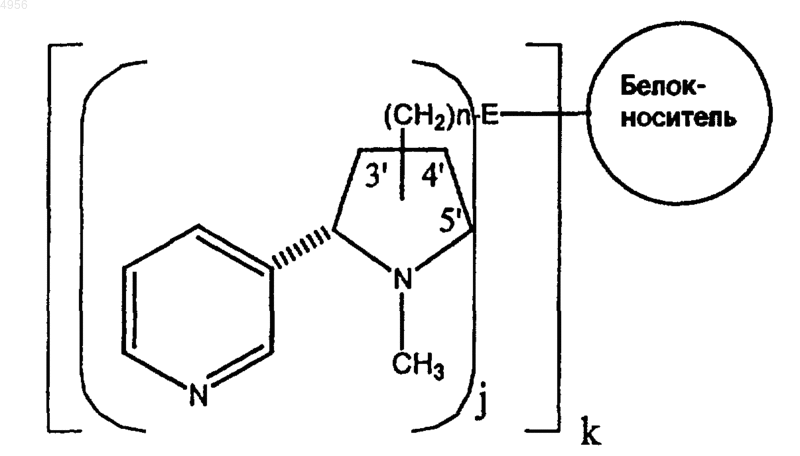
где n составляет 0-12, j составляет 1-1000, k составляет 1-20 и E представляет собой матрикс, содержащий аминокислоту.
9. Конъюгат по п.8, отличающийся тем, что матрикс представлен поли-L-глутаминовой кислотой.
10. Конъюгат гаптен-носитель согласно любому из пп.1-9, полученный с использованием транс-4'-карбокси-(-)котинина в качестве исходного материала.
11. Антитело, образующееся в ответ на конъюгат гаптен-носитель по любому из пп.1-10.
12. Антитело по п.11, отличающееся тем, что оно является моноклональным.
13. Антитело по п.11, отличающееся тем, что оно является поликлональным.
14. Функциональный фрагмент антитела по п.11.
15. Набор для установления присутствия никотина в образце, отличающийся тем, что он содержит антитело или его функциональный фрагмент по любому из пп.11-14.
16. Способ получения антитела, отличающийся тем, что млекопитающего-хозяина иммунизируют конъюгатом гаптен-носитель по любому из пп.1-10.
17. Способ по п.16, отличающийся тем, что полученное антитело является моноклональным.
18. Способ по п.16, отличающийся тем, что полученное антитело является поликлональным.
19. Вакцинная композиция, отличающаяся тем, что она содержит по меньшей мере один конъюгат по любому из пп.1-10.
20. Вакцинная композиция, отличающаяся тем, что она состоит в основном из конъюгата гаптен-носитель по любому из пп.1-10.
21. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптен-носитель по любому из пп.1-10.
22. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптен-носитель по любому из пп.1-10 и по меньшей мере одного адъюванта.
23. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптен-носитель по любому из пп.1-10, по меньшей мере одного адъюванта и по меньшей мере одного наполнителя.
24. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптен-носитель по любому из пп.1-10, по меньшей мере одного адъюванта, по меньшей мере одного наполнителя и по меньшей мере одного вспомогательного агента.
25. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество конъюгата гаптен-носитель по любому из пп.1-10.
26. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество антитела или его функционального фрагмента по любому из пп.11-14.
27. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество конъюгата гаптен-носитель по любому из пп.1-10 и дополнительно соединение, используемое для лечения никотиновой аддикции.
Текст
1 Область техники, к которой относится изобретение Данное изобретение касается лечения и профилактики никотиновой аддикции. В частности, изобретение относится к новым конъюгатам типа гаптен-носитель, которые способны индуцировать образование антител. Данные антитела обладают способностью специфически связывать никотин. Кроме того, в данном изобретении рассматривается профилактика или лечение никотиновой аддикции путем введения конъюгата типа никотин-носитель в фармацевтически приемлемом препарате. В данном изобретении имеется ввиду также применение антител, образующихся в ответ на конъюгат типа гаптен-носитель, для профилактики и лечения никотиновой аддикции. Уровень техники Курение сигарет, сигар и трубок является важной проблемой в США и во всем мире. Курительный табак и некурительный табак богаты никотином, который, как известно, является субстанцией, вызывающей привыкание (аддиктивным веществом). Никотин представляет собой алкалоид, выделенный из растения табака,который обусловливает психоактивный и аддиктивный эффекты курения. Никотин состоит из двух циклов, связанных друг с другом одинарной связью - ароматического шестичленного цикла (пиридина) и алифатического пятичленного цикла (пирролидина). Пирролидин является N-метилированным и связан посредством своего атома углерода в положении 2 с углеродом в положении 3 пиридина. Таким образом,углерод в положении 2 является хиральным и в действительности существует свободное вращение вокруг одинарной связи, которая связывает два цикла. Было установлено, что абсолютной конфигурацией углерода в положении 2 является S-конфигурация. Таким образом, природной конфигурацией никотина является(S)-(-)-никотин. Употребление никотина широко распространено вследствие легкой доступности сигарет, сигар, трубок и некурительного табака. Согласно данным Министерства здоровья и медицинского обслуживания человека США (U.S.Department of Health and Human Services) курение сигарет является единственной причиной,ведущей к смерти, которую можно предотвратить, в США. См. также статью McGinnis и соавт., J. Am. Med. Assoc., т. 270, стр. 2207-2211,(1993). Было также показано, что пассивное курение (воздействие курения другого человека) имеет серьезные вредные эффекты на здоровье,включая обострение астмы. Несмотря на то, что аддиктивная природа никотина хорошо известна, курение сигарет широко распространено. Пиковые уровни никотина в крови (приблизительно 25-50 нг/мл) достигаются через 10-15 мин после курения сигареты. У человека курение сигареты приводит к 2 концентрациям никотина в артериях, превышающим в 10 раз концентрации никотина в венах, поскольку никотин быстро доставляется из легких в сердце (см. статью Henningfield, DrugAlcohol Depend. 33:23-29, (1993. Это приводит к быстрой доставке высоких артериальных концентраций никотина в головной мозг. Имеющиеся данные позволяют предположить, что после прохождения никотина через гематоэнцефалический барьер он связывает холинергические рецепторы, которые в норме активируются нейромедиатором ацетилхолином, участвующим в дыхании, поддержании скорости сердечных сокращений, механизмах памяти, активности и мышечном движении. Когда никотин связывает данные рецепторы, он может воздействовать на нормальную функцию головного мозга путем запуска выхода других нейромедиаторов, таких как допамин. В головном мозге допамин обнаружен в областях, участвующих в проявлении эмоции, мотивации и чувства удовольствия. Именно выход нейромедиаторов,особенно допамина, обусловливает никотиновую зависимость у потребителей табака или при другом способе введения никотина. Вследствие существенного вредного воздействия курения на здоровье курильщики часто пытаются бросить курить. Однако к длительной зависимости от никотина и высокой частоте неудачных попыток бросить курить добавляются аддиктивная природа никотина и доступность сигарет. Симптомы отмены являются неприятными и облегчатся курением. Разработано много лекарственных средств для лечения никотиновой зависимости. Двумя наиболее популярными лекарственными средствами остаются никотиновый чрескожный пластырь и никотин, введенный в жевательную резинку. Данные виды лечения, называемые"никотин-заместительной терапией" (NRT), замещают количество никотина, которое ранее потребитель получал при курении и действуют так, что отучают потребителя от никотина. Однако такой тип лечения имеет ряд недостатков. В частности, отмечен низкий уровень проникновения никотина в кровоток и, вследствие этого, повышенное желание курить. С употреблением никотиновой жевательной резинки связаны такие проблемы, как раздражение рта, воспаление челюсти, тошнота. С применением никотиновых чрескожных пластырей связаны такие проблемы, как раздражения кожи, нарушение сна и нервозность. Вследствие этого требуется альтернативная методология лечения никотиновой зависимости. В литературе признается данная необходимость и имеется ряд попыток создания методологии лечения никотиновой зависимости. Один из способов включает введение антител,которые образуются в ответ на никотин. Однако известно, что низкомолекулярные субстанции,называемые гаптенами, не обладают способно 3 стью вызывать иммунный ответу животныххозяев. Никотин не является исключением и,как маленькая молекула, не является иммуногенным. Для получения ответа антител на гаптен его обычно ковалентно связывают с белкомносителем, и комплекс будет вызывать образование антител, которые распознают гаптен. Например, котинин 4'-карбоновая кислота,ковалентно связанная с гемоцианином блюдечка(ГЦБ), была использована для получения антител к метаболиту никотина котинину. Данные антитела использовали для определения присутствия котинина в физиологических жидкостях. См. статью Bjerke и соавт., J. Immunol. Methods,96, стр. 239-246, (1987). Другие антитела против никотина были приготовлены Castro и соавт. (см. статью в Eur.J. Biochem., 104, стр. 331-340, (1980. Castro и соавт. получили никотиновые гаптены, конъюгированные с бычьим сывороточным альбумином (БСА), где белок-носитель был посредством линкера конъюгирован с никотином по положению 6. Castro и соавт. получили конъюгаты никотина с БСА, которые инъецировали млекопитающим для образования антител. В другой публикации Castro и соавт. (см. статью в Biochem. Biophys. Res. Common., 67, стр. 583-589(1975 описывают два конъюгата никотина с альбумином: N-сукцинил-6-аминоникотинБСА и 6-(-аминокапроамидо)никотинБСА. В данной статье 1975 г. Castro и соавт. также использовали антитела против конъюгата никотин-носитель, 6-(-аминокапроамидо)-никотин-БСА, для определения уровней никотина в крови и моче (см. статью в Res. Commun.Swain и соавт. (см. заявку WO 98/14216) описывают конъюгаты никотин-носитель, в которых гаптен конъюгирован по положению 1, 2,4, 5, 6 или 1' никотина. Показано, что животные,иммунизированные 6-(карбоксиметилуреидо)-никотином, связанным с гемоцианином блюдечка, образовывали антитела, специфические в отношении никотина (см. статью Hieda и соавт., J. Pharm. and Exper. Thera., 283, стр. 1076-1081, (1997. Langone и соавт. получено производное гаптена О-сукцинил-3'гидроксиметил-никотин (см. статью Langone и соавт., Biochemistry, 12, стр. 5025-5030), и антитела против данного конъюгата гаптена и носителя использованы в радиоиммуноанализах (См. статью Langone и соавт., Methods in Enzymology, 84, стр. 628-635, (1982. Конъюгат, полученный Langone, является чувствительным к гидролизу. Кроме того, в работе Abad и соавт.(см. статью Abad и соавт., Anal. Chem., 65, стр. 3227-3231, (1993 описывают конъюгирование 3'-(гидроксиметил)никотин гемисукцината с бычьим сывороточным альбумином с целью получения антител против никотина для измерения содержания никотина в конденсате, полу 004956 4 чаемом при курении сигарет с помощью ELISA(твердофазный иммуноферментный анализ). Исходя из изложенного, в предшествующем уровне техники не описан стабильный конъюгат типа никотин-носитель, который сохраняет хиральную природу никотинового гаптена и связывает гаптен с носителем таким образом, что при этом сохраняется природа никотинового эпитопа(ов). Более того, в уровне техники не описаны и не рекомендуются способы профилактики и лечения никотиновой зависимости с использованием данных конъюгатов.Seeman (см. статью Seeman, Heterocycles, 22,стр. 165-193, (1984 представляет результаты конформационного анализа и исследования химической реакционной способности никотина. Сущность изобретения В связи с потребностью в более эффективной методологии лечения никотиновой аддикции одним из объектов, соответствующих данному изобретению, является получение новых конъюгатов типа никотин-носитель, которые являются стабильными, содержат никотин в его природной (S)-(-)-конформации и в которых используют связь никотин-носитель, сохраняющую природу никотинового эпитопа(ов) и относительную ориентацию двух циклов молекулы никотина. Оба цикла никотина и их относительная ориентация, как полагают, является основными для распознавания никотина антителом в растворе. Данные конъюгаты способны стимулировать продукцию антител, которые способны специфически связывать никотин. С помощью конъюгатов согласно изобретению можно повысить уровни никотина в сыворотке и снизить уровни никотина в головном мозге млекопитающих. Кроме того, с помощью конъюгатов, соответствующих изобретению, можно предотвратить также индуцированные никотином изменения кровяного давления и двигательные эффекты. В другом объекте, соответствующем данному изобретению, представлен способ лечения никотиновой аддикции путем введения конъюгата, соответствующего изобретению, пациенту с привыканием к никотину с целью образования антиникотиновых антител у данного пациента. Таким образом, когда пациент курит (или использует жевательный табак), никотин из данных продуктов будет связываться антиникотиновыми антителами в крови, препятствуя проникновению никотина через гематоэнцефалический барьер и, следовательно, устраняя индуцированные никотином изменения в химическом составе головного мозга, которые являются причиной никотиновой аддикции. В этом плане важно, что конъюгат никотин-носитель вызывает образование антител, которые будут распознавать природную молекулу никотина. Как описано выше, новые конъюгаты никотинноситель, соответствующие изобретению, со 5 храняют хиральность и эпитоп(ы) природного никотина. В изобретении не предлагается какая-либо определенная теория, касающаяся того, как конъюгаты никотина и антитела, продуцируемые в ответ на данные конъюгаты, ингибируют эффекты никотина, употребляемого млекопитающими. Кроме препятствования проникновению никотина через гематоэнцефалический барьер, антитела могут также препятствовать связыванию никотина с другими рецепторами периферической нервной системы посредством простой стерической блокады. Данные цели изобретения достигаются посредством получения конъюгата гаптенноситель формулы (I)Y выбрано из группы, состоящей из NH-CO,CO-NH, CO-NH-NH, NH-NH-CO, NH-CO-NH,CO-NH-NH-CO и S-S, а структура -(CH2)n-X(CH2)y-Y- связана по положению 3', 4' или 5'. В предпочтительном варианте осуществления конъюгата гаптен-носитель, m составляет 11 17, n равно 1, у равно 2, X представлено NH-CO,Y представлено CO-NH, белок-носитель представлен экзопротеином А и структура -(CH2)n-X(CH2)y-Y-связана по положению 3'. В другом предпочтительном варианте осуществления конъюгата гаптен-носитель, m составляет 11 17, n равно 1, у равно 2, X представлено NH-CO,Y представлено CO-NH, белок-носитель представлен экзопротеином А и структура -(CH2)n-X(CH2)y-Y- связана по положению 4'. В следующем предпочтительном варианте осуществления конъюгата гаптен-носитель m составляет 11 17, n равно 1, у равно 2, X представлено NH-СО,Y представлено СО-NH, белок-носитель представлен экзопротеином А и структура -(CH2)n-X(CH2)y-Y- связана по положению 5'. В дополнительном предпочтительном варианте осуществления m выбрано из группы, состоящей из 1-20 и 1-200. Вышеуказанные цели изобретения достигаются также получением конъюгата гаптенноситель формулы (III) 6 в которой n составляет 0-12, j составляет 1-1000,k составляет 1-20 и Е представляет собой матрикс, содержащий аминокислоту. В предпочтительном варианте осуществления матрикс является поли-L-глутаминовой кислотой. Цели могут быть также достигнуты получением антитела, которое образуется в ответ на конъюгат гаптен-носитель формулы (I). В дополнительном варианте осуществления антитело представляет собой функциональный фрагмент. В предпочтительном варианте осуществления антитело представлено моноклональным антителом. В дополнительном варианте осуществления антитело является поликлональным. Цели изобретения могут также достигаться путем получения антитела, которое образуется в ответ на конъюгат гаптен-носитель формулы(III). В дополнительном варианте осуществления антитело представляет собой функциональный фрагмент. В предпочтительном варианте осуществления антитело представлено моноклональным антителом. В дополнительном варианте осуществления антитело является поликлональным. Цели изобретения могут также быть достигнуты путем разработки способа лечения или профилактики никотиновой аддикции у пациента, нуждающегося в данном лечении, который предусматривает введение терапевтически эффективного количества конъюгата гаптенноситель формул (I) или (III). Альтернативно цели изобретения могут быть достигнуты путем разработки способа лечения или профилактики никотиновой аддикции у пациента, нуждающегося в данном лечении, который предусматривает введение терапевтически эффективного количества антитела, появляющегося в ответ на конъюгаты гаптен-носитель формул (I) или (III). Дополнительно цели могут быть достигнуты путем получения вакцинной композиции,которая содержит конъюгат гаптен-носитель формулы (I) или формулы (III). Кроме того,вакцина может далее содержать дополнительное терапевтическое соединение для лечения никотиновой аддикции. Цели могут быть также достигнуты путем разработки способа получения антитела, который предусматривает иммунизацию млекопитающего-хозяина конъюгатом гаптен-носитель формулы (I) или (III). В предпочтительном варианте осуществления продуцируемое антитело является моноклональным антителом. В дополнительном варианте осуществления антитело является поликлональным. Дополнительные цели могут быть достигнуты представлением набора для определения присутствия никотина в образце, содержащем антитело из числа антител, образовавшихся в ответ на конъюгат гаптен-носитель формулы (I) или формулы (III). Данные и другие цели и задачи, очевидные для компетентных специалистов в данной об 7 ласти, были осуществлены посредством изобретения, представленного ниже в подробном описании и прилагаемых пунктах формулы изобретения. Перечень фигур чертежей На фиг. 1 представлена диаграмма, которая показывает воздействие активной иммунизации конъюгированной вакциной 3'-AMNic-Suc-rEPA на уровни никотина в сыворотке крови крыс после одной инъекции никотина. Представлены уровни никотина в сыворотке через 3 и 10 мин после инъекции никотина. На фиг. 2 представлено воздействие пассивной иммунизации антителами против 3'AMNic-Suc-rEPA на уровни никотина в крови и головном мозге крыс. Крысам вводили 12,5, 25 и 50 мг антитела. На фиг. 3 представлены эффекты пассивной иммунизации антителами против 3'-AMNicSuc-rEPA на уровни никотина в сыворотке крови и головном мозге крыс. Уровни никотина измеряли через 30 мин и 1 день после введения антитела и через 3 мин после инъекции никотина. На фиг. 4 представлен эффект пассивной иммунизации антителами против 3'-AMNic-SucrEPA на уровни никотина в сыворотке крови крыс, получающих множество доз никотина. На фиг. 5 представлены эффекты пассивной иммунизации антителами против 3'-AMNicSuc-rEPA на уровни никотина в головном мозге крыс, получающих множество доз никотина. На фиг. 6 представлены эффекты пассивной иммунизации антителами против 3'-AMNicSuc-rEPA на индуцированные никотином двигательные эффекты у крыс. На фиг. 7 представлены эффекты пассивной иммунизации антителами против 3'-AMNicSuc-rEPA на индуцированное никотином повышение систолического кровяного давления. На фигуре показано, что увеличивающиеся количества антител повышают эффективность антител в плане снижения обусловленного никотином повышения кровяного давления. Сведения, подтверждающие возможность осуществления изобретения В данном изобретении представлен конъюгат никотиновый гаптен-носитель для лечения никотиновой аддикции. Конъюгат никотиновый гаптен-носитель имеет формулу (I)CO-NH, CO-NH-NH, NH-NH-CO, NH-CO-NH,CO-NH-NH-CO и S-S; белок-носитель представлен любым подходящим иммуногенным белком или полипептидом. Предпочтительно белокноситель может содержать Т-клеточный эпитоп и структуру -(CH2)n-X-(CH2)y-Y-, связанную по положению 3', 4' или 5' молекулы никотина. В формуле (I) m предпочтительно составляет 1-200. В другом предпочтительном варианте осуществления, m составляет 1-20. В особенно предпочтительном варианте осуществления,m составляет 11-17. В другом предпочтительном варианте осуществления X выбрано из группы, состоящей из NH-CO, CO-NH, CO-NHNH, NH-NH-CO, NH-CO-NH и CO-NH-NH-CO. При значении m больше единицы структура, показанная в скобках, присоединена m раз к различным точкам присоединения белканосителя. Например, при m=2 формула (I) была бы следующей: Поскольку невозможно получить антитела в ответ на сам никотин, в данном изобретении разработан никотиновый гаптен, дериватизированный по положению 3', 4' или 5' никотина. Данная структура связана с белком-носителем с образованием конъюгата гаптен-носитель, который будет вызывать образование антител против молекулы никотина при ее инъекции подходящему млекопитающему-хозяину. В этом плане при создании фармацевтической композиции,содержащей конъюгат гаптен-носитель, для индукции образования антител при введении млекопитающему, белок-носитель должен быть иммуногенным. Предпочтительно, если он будет содержать Т-клеточный эпитоп. Таким образом, когда белок-носитель конъюгируют с никотиновым гаптеном и затем вводят млекопитающему, в организме млекопитающего продуцируются или "возникают" антитела в ответ на никотиновый гаптен. Гаптены и дериватизация(получение производных) Термин "гаптен", как используют в данном изобретении, относится к низкомолекулярному органическому соединению, которое само по себе не обладает способностью вызывать иммунный ответ, но будет вызывать иммунный ответ при присоединении к молекуле-носителю. В предпочтительном варианте осуществления гаптен присоединяют к носителю посредством линкера. Гаптен, соответствующий данному изобретению, представляет собой производное никотина. Данный никотиновый гаптен содержит реакционную функциональную группу, к которой носитель может быть присоединен непосредственно или через линкер, или через матрикс, или через линкер и матрикс. Предпочти 9 тельно, когда никотиновый гаптен присоединен к белку-носителю посредством амидной или дисульфидной связи. Амидные и дисульфидные связи обладают желательным признаком стабильности. Поскольку конъюгаты гаптенноситель, соответствующие изобретению, будут использоваться в качестве вакцин, для увеличения срока хранения вакцины важно, чтобы конъюгаты были стабильными. В предпочтительном варианте осуществления данного изобретения никотиновый гаптен представлен формулой (II)NH2, СООН, СНО или SH, а -(CH2)n-Z может быть присоединено по положению 3', 4' или 5'. Структура Z обладает способностью связываться с носителем непосредственно или через линкер. Конъюгат носитель-гаптен будет индуцировать образование антител при его введении в организм пациента или животного. В особенно предпочтительном варианте осуществления никотиновый гаптен представлен следующей формулой (3'-аминометилникотин) 1. Прямые конъюгаты. Для получения "прямого конъюгата" один никотиновый гаптен непосредственно связывают с носителем с использованием линкера или без линкера. Например, по одному никотиновому гаптену может быть присоединено к каждой доступной аминогруппе на носителе. Основные способы прямого конъюгирования гаптенов с белками-носителями с использованием гомобифункционального или гетеробифункционального перекрестно-связывающего линкера описаны,например, в монографии G.T. Hermanson "Технологии биоконъюгатов" ("Bioconjugate Techniques"), Academic Press, (1996) и работе Dick иBeurret "Конъюгированные вакцины" ("Conjugate Vaccines"). Contribu. Microbiol. Immunol.,Karger, Basal, (1989), т. 10, стр. 48-114. При прямом конъюгировании с использованием бифункциональных перекрестно-сшивающих линкеров молярное соотношение гаптена и белка ограничивается числом функциональных групп,доступных на белке для специфического химического конъюгирования. Например, у белканосителя, имеющего число молекул лизина,равное n, теоретически будет n+1 первичных аминов (включая концевые амины), доступных для реакции с карбоксильной группой линкера. Таким образом, при использовании данной ме 004956 10 тодики прямого конъюгирования продукт будет ограничен возможностью образования n+1 амидных связей, т.е. возможностью присоединения максимум n+1 гаптенов. Компетентный специалист понимает, что соотношение гаптена и носителя будет изменяться в зависимости от концентрации реагентов, используемых для конъюгирования никотинового гаптена с белком-носителем, и природы белка-носителя. Кроме того, в данном препарате конъюгата никотин-носитель соотношение гаптен/носитель будет варьировать в каждом отдельном конъюгате. Например, экзопротеин А теоретически имеет 15 аминогрупп, доступных для конъюгирования с гаптеном. Однако, в настоящем изобретении установлено, что при конъюгировании 3'-аминометил-сукцинилникотина с данным белком число никотиновых гаптенов, присоединенных к каждому экзопротеинуА-носителю, находилось в интервале 1117 в одном препарате конъюгата. Данный интервал был экспериментально определен с использованием газ-фильтрационной хроматографии и измерения повышения УФ-поглощения при 260 нм. К некоторым носителям было присоединено 17 молекул никотина, поскольку никотиновый гаптен может присоединяться к неаминным группам на носителе. Примеры неаминных групп, к которым может присоединяться гаптен, включают без ограничения перечисленным группы -SH и -ОН. Однако вероятность данных побочных реакций является низкой. 2. Конъюгаты с матриксом. Для преодоления ограничений, связанных с числом гаптенов, которое может быть присоединено к носителю при прямом конъюгировании, может быть использован аминокислотный"матрикс". Термин "матрикс" означает аминокислоту, пептид, дипептид или полипептид,включая олигомерные и полимерные полипептиды. Матрикс может быть также представлен линейным или разветвленным полипептидом. Примеры аминокислот, которые могут быть использованы для образования матрикса, включают без ограничения перечисленным аспарагиновую кислоту, лизин, цистеин и L-глутаминовую кислоту. Из данных материалов матрикса могут быть получены полимеры, такие как поли-L-глутаминовая кислота. При использовании такой аминокислоты, как цистеин, тиоловую группу защищают, обеспечивая таким образом связывание гаптена с карбоксильной группой аминокислоты. Компетентному специалисту в данной области должны быть хорошо знакомы типы защитных групп и средства присоединения защитных групп к функциональным группам аминокислот. В качестве обсуждения см. монографию Green "Защитные группы в органической химии" (Protective Groups in Organic 11 Подходящий матрикс имеет соответствующую функциональную группу и его нагружают двумя или более гаптенами. Так, в одном предпочтительном варианте осуществления изобретения никотин-замещенный матрикс конъюгируют с белком-носителем с целью повышения молярного соотношения гаптен : носитель в конъюгате гаптен-носитель. Матрикс играет двойную роль, во-первых, как носитель большого числа гаптенов, и, во-вторых, как перекрестно-сшивающий линкер. Никотинзамещенный матрикс, конъюгированный с белком-носителем представлен формулой (III)(III) в которой n составляет 0-12, j составляет 1-1000,k составляет 1-20, Е представляет собой содержащий аминокислоту матрикс, с которым может быть связан гаптен, а белок-носитель является любым подходящим белком или полипептидом,содержащим Т-клеточный эпитоп. Содержащий аминокислоту матрикс Е может быть представлен аминокислотой, пептидом, дипептидом или полипептидом, включая олигомерные, а также полимерные полипептиды. Матрикс содержит одну или более аминокислот, которые включают без ограничения перечисленным аспарагиновую кислоту, лизин, цистеин и полиLглутаминовую кислоту. В предпочтительном варианте осуществления j составляет 1-200 в другом предпочтительном варианте осуществления j составляет 1-4. Конъюгаты матрикс-носитель способны к образованию мультимерных"решетчатых структур (пространственных решеток)". Такая пространственная решетка представлена на фигуре ниже. Термин "пространственная решетка" используют для обозначения ковалентно связанного комплекса, содержащего множество матриксов, гаптенов, линкеров и белковносителей, которые все ковалентно связаны друг с другом. Поскольку никотин-замещенный матрикс содержит множество молекул никотина, доступных для конъюгирования с носителем, может быть получена решетчатая структура, содержащая множество носителей и множество никотин-замещенных матриксов. В упрощенном виде фрагмент данной решетчатой структуры представляют следующим образом: 12 Компетентному специалисту будет понятно, что пространственная решетка, соответствующая изобретению, содержит конъюгат гаптен-носитель формулы (III). Данный способ конъюгирования с использованием матрикса обеспечивает гибкость и контроль молярных соотношений гаптена и белка независимо от числа функциональных групп на белке, доступных для конъюгирования. Это особенно эффективно при использовании специфического белка-носителя и необходимости получения оптимального соотношения для достижения повышенной иммуногенности конъюгата. Хотя необходимость использования этого отсутствует при применении матрикса,такой линкер может быть использован. Для использования линкера в данном варианте осуществления проводят реакцию никотин-замещенного матрикса с активным соединением линкера. Например, ADH (дигидразид адипиновой кислоты) может быть использован в качестве линкера с конъюгатами матрикса. Белки-носители После приготовления никотинового гаптена его затем конъюгируют с белком-носителем,который будет использован для того, чтобы вызывать образование антител против конъюгата никотин-носитель. Белок-носитель, используемый в предложенном в данном изобретении конъюгате никотин-носитель, представлен как в формулах (I) и (III) и охватывает любой подходящий иммуногенный белок или полипептид."Иммуногенной" молекулой является молекула,способная вызывать иммунный ответ. Предпочтительно, когда белок-носитель будет содержать Т-клеточный эпитоп. Выражением "белокноситель" охватываются также MAP, т.е. мультиантигенные пептиды, которые представляют собой разветвленные пептиды. При использовании MAP густота и валентность гаптена достигает максимума благодаря множеству разветвленных остатков аминокислот. Примеры аминокислот, использованных для получения MAP,включают без ограничения перечисленным лизин. Белок-носитель, соответствующий данному изобретению, содержит молекулу, имеющую по меньшей мере одни Т-клеточный эпитоп,который способен стимулировать Т-клетки субъекта, которые в свою очередь индуцируют образование В-клетками антител против целой молекулы конъюгата гаптен-носитель. Термин"эпитоп", как используют в описываемом изобретении, включает любую детерминанту на антигене, которая является ответственной за его специфическое взаимодействие с молекулой антитела. Эпитопные детерминанты обычно состоят из химически активных поверхностных групп молекул, таких как боковые цепи амино 13 кислот или сахаров, и обладают специфическими характеристиками трехмерной структуры, а также специфическими характеристиками заряда. Считают, что для того, чтобы иметь иммуногенные свойства, белок или полипептид должен обладать способностью стимулировать Тклетки. Однако возможно, что белок-носитель, у которого отсутствует Т-клеточный эпитоп, также бывает иммуногенным. Посредством выбора белка-носителя, который вызывает сильный иммуногенный ответ,разнородную популяцию пациентов можно лечить изобретенными конъюгатами гаптенноситель. Белок-носитель должен быть в достаточной степени чужеродным, чтобы вызывать сильный иммунный ответ на вакцину. Как правило, было бы предпочтительно, чтобы используемый белок-носитель был большой молекулой, которая способна придавать иммуногенность ковалентно связанному гаптену. Особенно предпочтительным белком-носителем является белок, обладающий высокой иммуногенностью по своей природе. Таким образом, весьма желательным является белок-носитель, который обладает высокой степенью иммуногенности и способен обеспечивать максимальный уровень образования антител. Как бычий сывороточный альбумин (БСА),так и гемоцианин блюдечка (ГЦБ) обычно использовали в качестве носителей при разработке конъюгированных вакцин в экспериментах на животных. Однако, данные белки могут не подходить для применения человеком. Белки, которые применялись в препаратах терапевтических конъюгированных вакцин, включают без ограничения перечисленным ряд токсинов патогенных бактерий и их токсоидов. Примеры включают дифтерийный и столбнячный токсины и их терапевтически приемлемые соответствующие токсоиды. Другие кандидаты представляют собой белки, антигенно близкие бактериальным токсинам, которые называют перекрестнореактивными материалами (CRMs). Для приготовления фармацевтических композиций никотинового конъюгата в качестве белка-носителя можно использовать рекомбинантный экзопротеин A Pseudomonas aeruginosa(rEPA), поскольку его структура и биологические активности были хорошо охарактеризованы. Более того, данный рекомбинантный белок был успешно и безопасно использован для человека в конъюгированных вакцинах капсулярного полисахарида Staphylococcus aureus в Национальном институте здоровья и авторами данного изобретения. См. статью Fattom и соавт., Infect. Immun., 61, стр. 1023-1032 (1993). Данный белок был идентифицирован как подходящий белок-носитель, поскольку присущая ему ферментативная активность природного экзотоксина была устранена посредством делеции аминокислоты в положении 553. В результате этого rЕРА имеет такой же иммунологиче 004956 14 ский профиль, как природный экзотоксин А(ЕТА), но не обладает гепатотоксическими свойствами природного ЕТА. Как используют в данной заявке, термин "экзопротеин А" относится к модифицированному негепатотоксическому ЕТА. Пример подобного экзопротеина А имеет делецию аминокислоты в положении 553. Конъюгирование гаптена с белком-носителем Имеется большое число функциональных групп, которые могут быть использованы, с целью облегчения связывания или конъюгирования носителя с маленькой молекулой, такой как гаптен. Они включают функциональные молекулы, такие как карбоновые кислоты, ангидриды, смешанные ангидриды, ацилгалиды, ацилазиды, алкилгалиды, N-малеимиды, сложные аминоэфиры, изоцианаты, амины, тиолы и изотиоцианаты, а также иные молекулы, известные компетентному специалисту. Данные молекулы способны к образованию ковалентной связи с реакционной группой молекулы белка. В зависимости от используемой функциональной молекулы реакционная группа может быть представлена -аминогруппой остатка лизина или тиоловой группой на молекуле белка-носителя или модифицированного белка-носителя, из которой в результате реакции образуется амидная, аминная, тиоэфирная связь или связь по типу амидинмочевины или тиомочевины. Компетентному специалисту было бы понятно, что могут быть использованы другие подходящие активирующие группы и способы конъюгирования. См., например монографию Wong "Химия конъюгирования и перекрестного сшивания белков" ("Chemistry of Protein Conjugation and(1989) т. 10, стр. 48-114. Для конъюгирования гаптенов с белкаминосителями линейные структуры линкера являются предпочтительными относительно циклических или разветвленных линкеров. Предпочтительным линкером является группа сукцинила. Однако линкер может быть циклической структурой так же, как линейной молекулой. Другим примером линкера является ADH. Таким образом конъюгаты никотиновый гаптен-носитель, соответствующие данному изобретению, получают путем реакции одного или более гаптенов с белком-носителем с образованием конъюгата гаптен-носитель, который обладает способностью стимулировать Тклетки, приводя к пролиферации Т-клеток и выходу медиаторов, активирующих специфические В-клетки для стимуляции образования антител в ответ на иммуногенный конъюгат гаптен-носитель. Ряд антител, появляющихся в ответ на конъюгат гаптен-носитель, будут специ 15 фическими в отношении гаптенового фрагмента конъюгата гаптен-носитель. Данное изобретение предусматривает применение различных комбинаций гаптенов с белками-носителями для использования при лечении никотиновой аддикции. Моноклональные и поликлональные антитела Технологии получения моноклональных антител хорошо известны в области техники. Моноклональные антитела можно получить путем инъекции мышам композиции, содержащей конъюгат никотиновый гаптен-носитель, с последующим подтверждением наличия продукции антитела посредством отбора образца сыворотки, удаления селезенки для получения Влимфоцитов, слияния В-лимфоцитов с клетками миеломы для получения гибридом, клонирования гибридом, селекции положительных клонов,которые продуцируют антитела против конъюгата гаптен-носитель, и выделения антител из культур гибридом. Моноклональные антител могут быть выделены и очищены из культур гибридом множеством хорошо отработанных технологий. Данные технологии выделения включают аффинную хроматографию с Протеин-А Сефарозой,гель-хроматографию и ионообменную хроматографию. См., например, Coligan, стр. 2.7.1-2.7.12 и стр. 2.9.1-2.9.3. См. также работу Baines и соавт., "Очистка иммуноглобулина G (IgG)" ("Purification of Immunoglobulin G (IgG)") в монографии "Методы молекулярной биологии"("Methods in Molecular Biology"), т. 10, стр. 79104, The Humana Press, Inc., (1992). Технологии получения поликлональных антител также хорошо известны в области техники. Поликлональные антитела получают согласно стандартным способам, известным в области техники. Для получения поликлонального антитела животному инъецируют иммуногенный материал и собирают богатую антителом сыворотку, в которой содержится смесь антител, направленных против множества эпитопов иммуногена, который был инъецирован. Подходящие для образования антител млекопитающие-хозяева включают без ограничения перечисленным человека, крыс, мышей, кроликов и коз. Согласно данному изобретению могут быть также использованы функциональные фрагменты антител. Фрагменты получают способами, которые включают разложение ферментами, такими как пепсин или папаин, и/или расщепление дисульфидных связей путем химического восстановления. Альтернативно фрагменты антител, охватываемые данным изобретением, могут быть синтезированы с использованием автоматического синтезатора пептидов, такого как синтезаторы, производимые фирмой Applied Biosystems, Multiple PeptideSystems и др., или они могут быть получены 16 вручную с использованием способов, хорошо известных в области техники. См. статью Geysen и соавт., J. Immunol. Methods, 102:259,(1978). Прямое определение последовательностей аминокислот вариабельных участков тяжелой и легкой цепей моноклональных антител,соответствующих изобретению, может быть осуществлено с использованием принятых способов. Фрагмент, соответствующий данному изобретению, может быть фрагментом Fv. Фрагмент Fv антитела состоит из вариабельного участка тяжелой цепи (Vh) антитела и вариабельного участка легкой цепи антитела (VI). При протеолитическом расщеплении антитела можно получить фрагменты Fv с двойной цепью, в которых участки Vh и VI остаются нековалентно связанными и сохраняют способность связывания антигена. Фрагменты Fv включают также рекомбинантные молекулы антитела из одной цепи, в которых вариабельные участки легкой и тяжелой цепи связаны пептидным линкером. См. статью Skerra, и соавт., Science, 240, стр. 1038-41, (1988). Фрагменты антитела, соответствующие изобретению, включают также Fab,Fab', F(ab)2 и F(ab')2, в которых отсутствует фрагмент Fc интактного антитела. Терапевтические способы Поскольку никотин проявляет многие из своих важных эффектов после того, как он проникает через гематоэнцефалический барьер,данное изобретение охватывает терапевтические способы, которые препятствуют проникновению никотина через гематоэнцефалический барьер. В частности, введение конъюгата никотиновый гаптен-носитель пациенту будет приводить к образованию антител против никотина в кровотоке пациента. Альтернативно антиникотиновые антитела, полученные вне организма пациента, которого предполагают лечить, в подходящем млекопитающем-хозяине, могут быть введены пациенту. Если пациент курит, никотин в его крови будет связываться антиникотиновыми антителами, циркулирующими в кровотоке, препятствуя тому, чтобы никотин достиг головного мозга. Вследствие этого, антитела будут препятствовать проявлению физиологических и психологических эффектов никотина,которые возникают в головном мозге. Поскольку курильщик будет испытывать снижение или прекращение данных эффектов, у него/нее будет исчезать желание курить. Такие же терапевтические эффекты ожидаются, если пациент использует некурительный табак, после иммунизации конъюгатом никотиновый гаптенноситель, соответствующим изобретению. Кроме того, конъюгаты и антитела, соответствующие изобретению, могут проявлять свои эффекты путем воздействия на способность никотина стимулировать периферическую нервную систему. 17 Как обсуждалось выше, новые конъюгаты никотин-носитель, соответствующие изобретению, сохраняют нативную хиральность и структуру молекулы никотина. В частности, молекула никотина данных конъюгатов имеет (S)-(-)конфигурацию. Вследствие этого антитела, образуемые в ответ на данный конъюгат, будут обладать специфичностью в отношении природной формы никотина и будут наиболее эффективными при специфическом связывании никотина, который вдыхается при курении или всасывается из некурительного табака, и при ингибировании эффектов данного поглощенного никотина. Кроме того, соответствующие изобретению конъюгаты являются химически стабильными, и стабильность является определяющей для получения вакцины с длительным сроком хранения. Данная вакцинная композиция может быть использована в комбинации с соединениями или другими терапевтическими средствами, которые применяют для лечения аддикции. Это предусматривает введение соединений, которые включают без ограничения перечисленным лекарственные препараты антидепрессанты, такие как цибан и прозак. 1. Введение конъюгата никотиновый гаптен-носитель. Конъюгаты, соответствующие изобретению, подходят для лечения и профилактики привыкания к никотину (никотиновой аддикции). Для лечения никотиновой аддикции конъюгат никотин-носитель, соответствующий изобретению, вводят пациенту, страдающему от никотиновой аддикции. Для профилактики никотиновой аддикции пациентов с риском развития никотиновой аддикции, таких как подростки, лечат конъюгатом, соответствующим изобретению. Непосредственное введение конъюгата пациенту называют "активной иммунизацией". Вакцинная композиция, соответствующая данному изобретению, содержит по меньшей мере один конъюгат никотиновый гаптенноситель в количестве, достаточном для того,чтобы вызвать иммунный ответ против него. Конъюгат никотиновый гаптен-носитель способен сохраняться in vivo в концентрации, достаточной, чтобы быть активным против последующего введения никотина. Исходная вакцинация конъюгатом никотиновый гаптен-носитель, соответствующим данному изобретению, создает высокие титры антител, которые обладают специфичностью в отношении никотина. Компетентному специалисту легко определить терапевтически эффективное количество конъюгата, которое вводят пациенту, нуждающемуся в лечении никотиновой аддикции. Приемлемые интервалы дозировки составляют 1-1000 мкг/дозу. Как правило,пациенту требуется от одной до нескольких недель для образования антител против чужерод 004956 18 ного антигена. Образование антител в крови пациента можно мониторировать с применением методов, хорошо известных компетентному специалисту, таких как ELISA, способы радиоиммуноанализа и вестерн-блоттинг. Терапевтическую эффективность также можно мониторировать путем оценки различных физических эффектов никотина, таких как кровяное давление. Как подробно описано ниже, соответствующие изобретению конъюгаты никотиновый гаптен-носитель могут быть обработаны с целью получения композиции, которую легко можно ввести пациенту. Предпочтительные способы введения включают без ограничения перечисленным интраназальное, внутритрахеальное, пероральное, чрескожное введение, введение через слизистые, подкожную инъекцию и внутривенную инъекцию. Компетентному специалисту будет понятно, что после исходной инъекции может проводиться последующее введение одного или более "бустеров" (добавочных или вспомогательных веществ) конъюгата. Такое бустерное вещество будет повышать выработку антител против конъюгата никотиновый гаптен-носитель, соответствующего изобретению. Вакцинные композиции, соответствующие данному изобретению, могут содержать по меньшей мере один адъювант. Адъювант, используемый в данном изобретении, должен быть выбран таким образом, чтобы не ингибировался эффект белка-носителя. Адъюванты,используемые в данном изобретении, представлены физиологически приемлемыми для человека адъювантами, которые включают без ограничения перечисленным квасцы, QS-21, сапонин и MPLA (монофосфорил-липид А). Вакцинные композиции, соответствующие данному изобретению, необязательно могут содержать один или более фармацевтически приемлемых наполнителей. Наполнители, используемые в настоящее время, включают стерильную воду, растворы солей, такие как физиологический раствор, фосфат натрия, хлорид натрия, спирт, гуммиарабик, растительные масла, бензиловые спирты, полиэтиленгликоль,желатин, маннит, углеводы, стеарат магния,вязкий парафин, сложные эфиры жирных кислот, гидроксиметилцеллюлозы и буферы. Конечно, в данном изобретении используются любые дополнительные наполнители, известные компетентному специалисту. Для того, чтобы ввести конъюгаты гаптенноситель, соответствующие данному изобретению, пациенту, нуждающемуся в лечении или профилактике никотиновой аддикции, их инкорпорируют в фармацевтическую композицию. Если композиция, содержащая конъюгат гаптенноситель, предназначена для применения в виде инъекций, предпочтительным является растворение конъюгата гаптен-носитель в водном со 19 левом растворе при фармацевтически приемлемом рН. Однако возможно использование инъекционной суспензии конъюгата гаптенноситель. Кроме обычных фармацевтически приемлемых наполнителей композиция может содержать необязательные компоненты для обеспечения чистоты, увеличения биодоступности и/или повышения проницаемости. Кроме того, вакцинная композиция необязательно может содержать по меньшей мере один вспомогательный агент, такой как дисперсионная среда, покрытия, микросферы, липосомы, микрокапсулы, липиды, поверхностноактивные вещества, смазывающие агенты, консерванты и стабилизаторы. Безусловно любые дополнительные вспомогательные агенты, известные компетентному специалисту, используют в данном изобретении. Применимыми в данном контексте являются также любые агенты, действие которых обусловливает синергетический эффект данной вакцинной композиции. Фармацевтическая композиция, соответствующая данному изобретению, является стерильной и достаточно стабильной, чтобы выдерживать хранение, распределение и применение. Кроме того, композиция может содержать дополнительные компоненты с целью защиты композиции от заражения микроорганизмами или их роста. Предпочтительно, когда композицию производят в форме лиофилизированного порошка, который предназначен для восстановления фармацевтически приемлемым разбавителем непосредственно перед введением. Способы приготовления стерильных инъекционных растворов хорошо известны компетентному специалисту и включают без ограничения перечисленным вакуумную сушку, сушку вымораживанием и сушку путем центрифугирования. Данные способы обеспечивают получение порошка активного ингредиента вместе с любым дополнительным наполнителем, введенным в премикс. 2. Введение антител, образованных в ответ на конъюгат никотин-носитель. Пассивная иммунизация предусматривает введение поликлонального антитела или моноклонального антитела, которое появилось в ответ на конъюгат никотиновый гаптен-носитель,соответствующий изобретению, или обработку ими. Данные антитела могут вырабатываться животными или человеком. Антитела, полученные в ответ на никотиновый конъюгат, соответствующий изобретению, можно вводить с целью профилактики никотиновой аддикции. Например, данные антитела могут быть введены людям, которых считают находящимися в группе риска развития никотиновой зависимости, таким как подростки. Антитела являются пригодными также для лечения пациента, привыкшего к никотину. Как обсуждалось выше, антитела будут связывать никотин и препятствовать проникновению никотина через гематоэнцефаличе 004956 20 ский барьер. Антитела, образующиеся при введении соответствующего изобретению конъюгата гаптен-носитель, имеют молекулярную массу, лежащую в интервале от приблизительно 150 кД до приблизительно 1000 кД. Компетентный специалист легко определит терапевтически эффективное количество терапевтического антитела, соответствующего изобретению, которое вводят пациенту, нуждающемуся в лечении от никотиновой аддикции. Интервал подходящих доз составляет 11000 мкг/дозу. Терапевтическая композиция, соответствующая данному изобретению, содержит по меньшей мере одно антитело, образующееся в ответ на конъюгат никотин-носитель, соответствующий изобретению. Эти композиции, соответствующие данному изобретению, необязательно могут содержать один или более фармацевтически приемлемых наполнителей. Наполнители, используемые в настоящее время,включают стерильную воду, растворы солей,такие как физиологический раствор, раствор фосфата натрия, хлорида натрия, спирт, гуммиарабик, растительные масла, бензиловые спирты, полиэтиленгликоль, желатин, маннит,углеводы, стеарат магния, вязкий парафин,сложныеэфиры жирных кислот, гидроксиметилцеллюлозу и буферы. Конечно, в данном изобретении используют любые дополнительные наполнители, известные компетентному специалисту. Для того, чтобы ввести антитела, соответствующие данному изобретению, пациенту, нуждающемуся в лечении или профилактике никотиновой аддикции, их инкорпорируют в фармацевтическую композицию. Если композиция,содержащая антитело, предназначена для инъекционного применения, предпочтительным является растворение антитела в водном солевом растворе при фармацевтически приемлемом рН. Однако возможно использование инъекционной суспензии антитела. Кроме обычных фармацевтически приемлемых наполнителей композиция может содержать необязательные компоненты для обеспечения чистоты, увеличения биодоступности и/или повышения проницаемости. Фармацевтическая композиция, содержащая антитело, соответствующее данному изобретению, является стерильной и достаточно стабильной, чтобы выдерживать хранение, распределение и применение. Кроме того, композиция может содержать дополнительные компоненты для защиты композиции от заражения микроорганизмами или их роста. Способы приготовления стерильных инъекционных растворов хорошо известны компетентному специалисту и включают без ограничения перечисленным вакуумную сушку, сушку вымораживанием и сушку путем центрифугирования. Данные способы обеспечивают получение порошка ак 21 тивного ингредиента вместе с любым дополнительным наполнителем, введенным в премикс. Наборы, содержащие антитела,соответствующие изобретению Антитела, соответствующие данному изобретению, используют также для получения набора, который может быть использован для детекции и количественного определения уровней никотина в образце. Набор, соответствующий изобретению,содержит никотинспецифическое антитело, соответствующее изобретению, в подходящем контейнере. Набор для проведения радиоиммуноанализа может также содержать меченый никотин. Никотин в образце определяют по связыванию меченого никотина с антителом с последующим конкурентным вытеснением меченого никотина из антитела тестируемым образцом. Набор для ELISA (твердофазный иммуноферментный анализ) также должен содержать антитело, соответствующее изобретению. ELISA может включать сравнение ингибирования связывания антитела известными количествами никотина с ингибированием образцом, предположительно содержащим никотин. Это позволило бы определить неизвестный уровень никотина в образце путем сравнения образца со стандартной кривой ингибирования для известной концентрации никотина. ВELISA другого типа образец, предположительно содержащий никотин, следует инкубировать в плате для микротитрования, покрытой субстанцией, которая будет связывать никотин. В платы нужно добавить антитела, соответствующие изобретению, и следует добавить связанные с ферментом антитела против антител. Добавление субстрата позволило бы определить количество никотина, связанного с платой. Следующие примеры представлены только для дальнейшей иллюстрации реализации и применения данного изобретения. Объем изобретения не ограничивается следующими примерами. Пример 1. Синтез дериватизированного никотинового гаптена (замещенного по положению 3'). Исходным материалом для синтеза гаптена является транс-4'-карбокси-(-)-котинин, получаемый из коммерческих источников. Модификация процедуры, описанной в статье Cushman и Castagnoli Jr. (J. Org. Chem., 37(8), 1268-1271,(1972 приводит к спирту,транс-3'гидроксиметил-(-)-никотину, полученному путем этерификации кислоты метилом с последующим восстановлением сложного эфира. Затем спирт сульфонируют и замещают сульфонат азидогруппой, которую в концечном итоге восстанавливают до амина. 4 г транс-4'-карбокси-(-)-котинина растворяют в 50 мл 2 н. раствора серной кислоты в сухом метаноле и перемешивают в течение ночи при комнатной температуре. Полученную суспензию фильтруют через фильтровальную бу 004956 22 магу Ватман 1 (Whatman1) и медленно добавляют к 100 мл насыщенного раствора бикарбоната натрия. Сложный эфир экстрагируют дихлорметаном и получают после выпаривания растворителя 4,2 г розового масла. Раствор 3,9 г сложного эфира в тетрагидрофуране (100 мл) по каплям добавляют к суспензии 4 эквивалентов литийалюмогидрида (70 мл) в атмосфере сухого аргона. Суспензию перемешивают в течение двух часов при комнатной температуре. Избыток гибрида разлагают с помощью точного и контролируемого добавления воды при охлаждении на ледяной бане. Полученный белый осадок отфильтровывают,фильтрат сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 2,7 г спирта в виде желтого масла. Спирт (1,9 г) растворяют в 20 мл дихлорметана. Триэтиламин (0,75 мл) и ртолуолсульфонилхлорид (1 г) последовательно добавляют к раствору. Оранжевый раствор перемешивают в течение 24 ч при комнатной температуре. Выпавший в осадок триэтиламин гидрохлорид отфильтровывают на целитном слое, а фильтрат концентрируют при пониженном давлении с получением коричневого масла. Сульфонат очищают на колонке для флешхроматографии с диоксидом кремния, элюируемой 5% метанолом в дихлорметане, и получают 2,1 г желтого масла. Сульфонат (1,8 г) замещают, используя азид натрия (0,8 г) в 50 мл диметилформамида в течение одного часа при 80 С. После упаривания диметилформамида под высоким вакуумом осадок растворяют в дихлорметане, промывают водой и концентрированным солевым раствором и сушат над сульфатом натрия. После упаривания растворителя получают азид (1,1 г) в виде коричневатого масла. При добавлении азида в сухом тетрагидрофуране (20 мл) к суспензии литийалюмогидрида в сухом тетрагидрофуране (50 мл) легко получают желаемый амин, наблюдаемый с помощью тонкослойной хроматографии. Спектры протонного и углеродного ядерно-магнитного резонанса очищенного амина соответствуют ожидаемой структуре. Пример 2. Синтез дериватизированного никотинового гаптена (замещенного по положению 4'). Введение звена ("ножки") с функциональной группой в положение 4' никотина может быть осуществлено путем енолатного алкилирования котинина с последующим восстановлением алкилированного продукта. Могут быть использованы различные алкилирующие агенты,подобные соответствующим образом защищенному 3-бромпропиламину. Например, можно использовать 3-бром-N-карбобензилоксипропиламин или N-(3-бромпропил)фталамид. Защитную группу амина следует удалять после алкилирования и восстановления перед конъю 23 гированием с белком-носителем. Енолатное алкилирование циклических лактамов (содержащих пирролидиноновый цикл) хорошо представлено в литературе (см. в качестве основного обзора раздел, написанный G. Helmchen и соавт., Стереоселективный синтез (StereoselectiveSynthesis) в сборнике Методы органического синтеза Хубена-Вейла (Houben-Weyl-Methods ofMeyers и соавт., J. Am. Chem. Soc, 119, 45644566, (1997) в плане стерического рассмотрения реакции). Имеется также несколько примеров енолатного алкилирования самого котинина (см. статью N.-H. Lin и соавт., J. Med. Chem., 37, стр. 3542-3553, (1994. Интересный способ получения 4'-ацетил-никотина в виде смеси 1:1 двух эпимеров был произведен из исходных кетона(или альдегида) и 2-алкокси-3-алкенамина с использованием тандемной реакции катионной аза-перегруппировки Коупа - циклизации Манниха (см. L.E. Overman, J. Am. Chem. Soc, 105,стр. 6622-6629, (1983. Данную реакцию можно использовать для получения 4'-альдегидникотина, пригодного для конъюгирования. 3-бром-пропиламин гидробромид (4,2 г) суспендируют в 50 мл дихлорметана и добавляют триэтиламин (приблизительно 7 мл) до тех пор, пока не получают прозрачный раствор. Раствор охлаждают до 0 С и по каплям добавляют бензилхлорформиат (2,5 мл). Реакцию продолжают при комнатной температуре в течение 16 ч при перемешивании. Выпавшие в осадок соли отфильтровывают, промывают прозрачный органический слой холодной водой,холодной 1 н. HCl и холодной водой, сушат над сульфатом натрия и упаривают при пониженном давлении до получения желтого масла (2,93 г неочищенного продукта). Котинин (62 мг) и 3-бром-N-карбобензилоксипропиламин (100 мг) по отдельности упаривают вместе с сухим толуолом. Котинин растворяют в 5 мл свежеперегнанного безводного тетрагидрофурана, добавляют 60 мклN,N,N',N'-тетраметилендиамина (TMEDA) и охлаждают раствор до -78 С путем погружения в баню этанол-сухой лед. Раствор котинина добавляют по каплям к раствору диизопропиламида лития (LDA, 200 мкл 2 М раствора в гептантетрагидрофуране) в тетрагидрофуране, предварительно охлажденном до -78 С. Оранжевую смесь перемешивают в течение 15 мин при 78 С, а затем оставляют на ледяной бане (2-6 С) до согревания. Затем реакцию снова охлаждают до-78 С и 3-бром-N-карбобензилоксипропиламин, растворенный в безводном тетрагидрофуране, добавляют по каплям в течение 15 мин. Реакционной смеси позволяют нагреться до -10 С, а затем останавливают реакцию метанолом. Продукт реакции очищают флешхроматографией на колонке с силикагелем. Восстановление амида данного производного коти 004956 24 нина осуществляют с помощью борана с последующей обработкой фторидом цезия в горячем этаноле. Конечный продукт амин получают после удаления карбобензилоксигруппы в кислых условиях. Пример 3. Синтез дериватизированного никотинового гаптена (замещенного по положению 5'). Введение "ножки" с функциональной группой в положение 5' никотина может быть осуществлено путем реакции надлежащим образом защищенных соединений алкиллития с котинином и последующего восстановления цианоборгидридом натрия согласно методикам,аналогичным описанным в статьях Shibagaki и соавт., Heterocycles, 24, стр. 423-428, (1986) иN.-H. Lin и соавт., (1994), supra. Пример 4. Конъюгирование дериватизированного никотинового гаптена с белкомносителем. Рекомбинантный экзопротеин А (rЕРА) связывают с дериватизированным никотиновым гаптеном посредством плеча янтарной кислоты. 15 остатков лизина rЕРА легко сукцинилируются янтарным ангидридом. Затем в типичной реакции конъюгирования готовят раствор концентрации 5-10 мг/мл сукцинилированного рекомбинантного экзопротеина A (Suc-rEPA) в 0,05 М буфере на основе 2-(N-морфолино)этансульфоновой кислоты (MES), содержащем 0,15 М NaCl при рН 6,0. Равную массу 3'-аминометил-(-)никотинового (3'-AMNic) гаптена, растворенного в минимальном количестве дистиллированной воды, добавляют к раствору белка. Перед добавлением рН раствора гаптена подводят до значения 6,0 с помощью 0,1 н. HCl. Наконец,равную массу 1-этил-3-(3-диэтиламино)пропилкарбодиимид гидрохлорида (EDC) добавляют в смесь гаптена и белка и проводят реакцию в течение 30 мин при комнатной температуре при перемешивании. Полученный таким образом конъюгат никотина очищают на колонкеSephadex G-25, элюируя забуференным фосфатом солевым раствором (PBS) при рН 7,4. Выход конъюгата находится в интервале 80-90%. Пример 5. Конъюгирование нагруженного никотином матрикса. В данном примере описывают синтез конъюгата гаптен-носитель, содержащего 3'аминометил-(-)-никотин в качестве дериватизированного гаптена, рекомбинантный экзопротеин А (rЕРА) в качестве белка-носителя, дигидразид адипиновой кислоты (ADH) в качестве линкера и поли-L-глутаминовую кислоту в качестве "матрикса" или полимерного носителя для гаптенов. В данном примере используют поли-Lглутаминовую кислоту, имеющую среднюю молекулярную массу 39900 при полидисперсности 1,15 и степени полимеризации 264. Реакционные количества гаптена и полимера рассчитывают так, чтобы получить степень замещения 25 приблизительно 80%. Это означает, что при достижении 80% замещения, приблизительно 208 единиц гаптена из 264 повторяющихся единиц в средней полимерной молекуле глутаминовой кислоты являются конъюгированными. Данная нагруженная никотином поли-Lглутаминовая кислота имеет следующую формулу: Как можно видеть на фигуре, полимер полиглутаминовой кислоты содержит приблизительно 52 остатка глутамина. Это число может изменяться в зависимости от партии и источника остатка полиаминокислоты, выбранных для матрикса. Здесь на фигуре также указаны 4 никотиновых гаптена на каждую повторяющуюся структуру. Данное число будет варьировать в зависимости от соотношения реагентов, используемых при конъюгировании матрикса и никотинового гаптена. После конъюгирования с дириватизированным никотином непрореагировавшие карбоксильные группы (приблизительно 20%) дериватизируют затем ADH. При конъюгировании данного матрикса с носителем, как описано в примере 6, молярное соотношение нагруженного никотином матрикса и белка составляет 1:1. Так, в данном конъюгате по завершении реакции конъюгирования теоретическое молярное соотношение никотинового гаптена к белку составляло бы 200:1. Действительное соотношение замещения никотина на полиглутаминовой кислоте оценивают с использованием ЯМР-анализа продукта. Интенсивность пика -водорода глутаминовой кислоты по отношению к четырем атомам водорода пиридинового цикла никотина представляет соотношение включенного никотина. Установленное среднее соотношение составляет 143:1 (никотин/белок-носитель). Пример 6. Получение вакцины на основе конъюгата никотина с использованием нагруженного никотином матрикса. А. Нагружение никотинового гаптена на матрикс. 10 мг соли поли-L-глутаминовой кислоты(Sigma, каталожный номер Р-4761) растворяют в 2 мл 0,05 М буфере на основе 2-(N-морфолино) этансульфоновой кислоты (MBS), содержащем 0,15 М NaCl при рН 6,0. 10 мг 3'-аминометил-(-)никотина растворяют в минимальном количестве дистиллированной воды и подводят рН рас 004956 26 твора до значения рН 6,0 с помощью 0,1 н. HCl. Раствор никотинового гаптена добавляют по каплям к раствору полипептида при перемешивании с последующим подведением рН до 6,0. Затем 20 мг твердого 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорида (EDC) добавляют в трех порциях к смеси гаптена и полипептида в течение 20 мин. Реакцию проводят в течение одного часа при комнатной температуре. Продукт реакции (никотин-замещенный матрикс) диализуют против трех замещающих объемов воды и лиофилизируют. 12 мг никотинзамещенной полиглутаминовой кислоты получают в виде белого пушистого продукта.B. Присоединение линкера к никотинзамещенному матриксу. 10 мг никотинзамещенной полиглутаминовой кислоты растворяют в 2 мл буфера MES при рН 6,0. 8 мг дигидразида адипиновой кислоты(ADH) и затем 10 мг EDC добавляют к раствору при перемешивании. Реакцию проводят в течение 1 ч при комнатной температуре. В конце полученный раствор диализуют против трех замещающих объемов буфера MES при рН 6,0.C. Конъюгирование с белком-носителем. 10 мг рекомбинантного экзопротеина А(rЕРА) растворяют в 2 мл 0,05 М буфера MES при рН 5,6, содержащего 0,15 М NaCl. Объем раствора ADH-связанной никотин-замещенной полиглутаминовой кислоты рассчитанный так,что он содержит 7,5 мг данного дериватизированного продукта, добавляют к раствору белка. Твердый EDC добавляют к данной смеси тремя порциями в течение 20 мин при перемешивании при комнатной температуре. Реакцию проводят при комнатной температуре в течение ночи. Полученный в результате конъюгат очищают на колонке Sephadex G-25, элюируемой забуференным фосфатом солевым раствором (PBS) при рН 7,4. При этом получают очищенный препарат конъюгата, в котором конъюгат содержит только (S)-(-)-форму никотина. Пример 7. Характеризация конъюгата никотин-носитель, соответствующего примеру 4. Очищенную конъюгированную вакцину,соответствующую примеру 4, анализируют на колонке для гель-проникающей хроматографии,заполненной Superose 12 и элюируемой PBS при рН 7,4. Молярное соотношение гаптена и белка,составляющее 11 - 17, вычисляют путем определения увеличения УФ-поглощения при 260 нм после инкорпорации никотина относительно поглощения при 280 нм. Данный диапазон устанавливают вычислением соотношения гаптен/ белок-носитель в шести отдельно полученных партиях конъюгата гаптен-носитель (партия 1: 17,2, партия 2: 16,2, партия 3: 13,2; партия 4: 12,0; партия 5: 11,0; партия 6: 17,2). Дальнейший анализ с целью установления данного соотношения с использованием масс-спектрометрии MALDI-TOF дает в основном такие же значения, как те, что получены способом с оп 27 ределением разницы УФ-поглощения. Концентрацию белка конъюгированной вакцины определяют, используя анализ ВСА. Проводят исследование стабильности конъюгата никотинноситель, соответствующего примеру 4. В исследовании используют вакцину, помещенную в стеклянные флаконы емкостью 1 мл при концентрации 0,5 мг/мл, и тестируют стабильность вакцины во флаконах при трех различных температурах: -70 С, 2-8 С и при комнатной температуре. Пример 8. Стабильность конъюгата никотин-носитель, соответствующего примеру 4. Процедура конъюгирования, основанная на образовании амидных, а не сложноэфирных связей между гаптеном-линкером-носителем,представляется наиболее перспективной, как показано на примере определения стабильности конъюгата в течение шести месяцев при -70 С,2-8 С и даже при комнатной температуре. Исследование стабильности состоит из наблюдения и анализа конъюгированной вакцины с использованием следующих аспектов: 1.) Визуальное наблюдение с целью обнаружения каких-либо образующихся частиц(мутность, осадок). 2.) Проверка на предмет какого-либо значительного изменения рН. 3.) Профиль гель-проникающей хроматографии в сочетании с УФ-поглощением при 260 и 280 нм для установления изменения соотношения включения никотина. 4.) Хроматография с обращенной фазой с целью проверки на предмет какого-либо разложения белка-носителя. 5.) SDS-PAGE (электрофорез в полиакриламидном геле с использованием додецилсульфата натрия) с окрашиванием серебром с целью обнаружения какого-либо протеолитического разложения конъюгированного белка. Способ конъюгирования, основанный на образовании амидных связей между гаптеном и линкером, а также между линкером и носителем представляется перспективным, как показано на примере стабильности конъюгата в течение шести месяцев при -70 С и 2-8 С. Пример 9. Доказательство иммуногенности конъюгата с носителем, соответствующего примерам 4 и 6. Две вакцины на основе конъюгата никотиновый гаптен-носитель используют для иммунизации мышей, крыс и кроликов. А. Тесты на животных поликлональных антител. Животных иммунизируют,используя стандартные протоколы. Мышам делают три подкожные инъекции вакцины с интервалами две недели с проведением анализов крови через одну неделю после первой и второй инъекций и забором крови через одну неделю после третьей инъекции. Образцы сыворотки анализируют с помощью ELISA, описанного в примере 10. В 28 способе ELISA используют 3'-AMNic-pGlu, связанный с платами для микротитрования. Крыс иммунизируют вакцинами внутрибрюшинно три раза. Инъекции делают с интервалами две недели с проведением анализов крови через одну неделю после первой и второй инъекций. Крыс обескровливают через одну неделю после третьей инъекции. Для первой инъекции используют полный адъювант Фрейнда, а для последующих инъекций - неполный адъювант Фрейнда. Образцы сыворотки анализируют с помощью ELISA. Кроликов иммунизируют внутримышечно 100 мкг вакцины три раза с интервалами три недели. Исходная инъекция содержит адъювант Фрейнда, при этом последующие инъекции содержат неполный адъювант Фрейнда. Кроликам делают анализ крови через одну неделю после второй и третьей инъекций, чтобы удостовериться в адекватности титров для проведения кровопускания. При достижении адекватного титра, измеренного с помощью ELISA, кроликов переводят на режим еженедельного кровопускания (20-40 мл сыворотки/кролика). Титры антител мониторируют на протяжении всего эксперимента и при необходимости животным вводят бустерную дозу для восстановления уровней антител. Результаты данных исследований иммуногенности представлены в табл. 1-5. В табл. 1 и 2 показаны результаты исследования иммуногенности на мышах. В табл. 1 используемый конъюгат представлен 3'-аминометил-(-)-никотинсукцинил-rЕРА (см. пример 4). В табл. 2 используемый конъюгат представлен 3'аминометил-(-)-никотинполиглутаминовая кислота-ADH-rEPA (см. пример 6). В данных табл. представляют получение высоких титров антител, которые специфически связывают никотин. Кроме того, данные конъюгаты проявляют способность индуцировать бустерный ответ. В табл. 3 и 4 показаны результаты исследования иммуногенности на крысах. В табл. 3 используемый конъюгат представлен 3'-аминометил-(-)-никотинсукцинил-rЕРА (см. пример 4). В табл. 4 используемый конъюгат представлен 3'-аминометил-(-)-никотинполиглутаминовая кислота-ADH-rEPA (см. пример 6). В данных таблицах представляют получение высоких титров антител, которые специфически связывают никотин. Кроме того, данные конъюгаты проявляют способность индуцировать бустерный ответ. В табл. 5 показаны результаты исследования иммуногенности на кроликах. Используя либо 3'-аминометил-(-)-никотинсукцинил-rЕРА(см. пример 4), либо 3'-аминометил-(-)-никотинполиглутаминовая кислота-ADH-rEPA (см. пример 6), получают высокие титры антител против двух конъюгатов. Данные титры остаются повышенными в течение более 6 месяцев. Доза основана на анализе белка. Титр представляет собой среднее арифметическое значение титра через одну неделю после соответствующей инъекции. Лечение мышей с помощью 3'-AMNic-pGlu-ADH-rEPA Таблица 2 Доза основана на сухой массе лиофилизированного конъюгата. Титр представляет собой среднее арифметическое значение титра через одну неделю после соответствующей инъекции. Лечение крыс с помощью 3'-AMNic-Suc-rEPA Таблица 3 Доза основана на анализе белка. Титр представляет собой среднее арифметическое значение титра через одну неделю после соответствующей инъекции. Лечение крыс с помощью 3'-AMNic-pGlu-ADH-rEPA Таблица 4 Доза основана на сухой массе лиофилизированного конъюгата. Титр представляет собой среднее арифметическое значение титра через одну неделю после соответствующей инъекции. Лечение кроликов с помощью 3'-AMNic-Suc-rEPA и 3'AMNic-pGlu-ADH-rEPA Таблица 5 30 Доза основана на анализе белка для 3'AMNic-Suc-rEPA и сухой массе для 3'-AMNicpGlu-ADH-rEPA. Титр представляет собой среднее арифметическое значение титра через шесть - семь недель после третьей инъекции. Пример 10. Определение с помощьюELISA и специфичность антитела. Сама по себе молекула никотина не подходит для покрытия плат для ELISA и требуется связать ее с более крупной молекулой, имеющей улучшенные адгезионные свойства. Обычно для этой цели используют поли-L-лизин или полиL-глутаминовую кислоту. Дериватизированный никотиновый гаптен 3'-аминометил-(-)-никотин(3'-AMNic) конъюгируют с поли-Lглутаминовой кислотой и полученный конъюгат 3'-аминометил-(-)-никотин-поли-L-глутаминовая кислота (3'-AMNic-pGlu) используют для покрытия плат для ELISA. Антитела, образующиеся против вакцины 3'-AMNic определяют, используя ELISA 3'AMNic-pGlu следующим образом: платы для микротитрования Dynatech Immulon 4 (Chantilly,VA) покрывают 100 мкл/лунку раствора 10 нг/мл 3'-AMNic-pGlu в 0,1 М бикарбонатного буфера, рН 9,6 и инкубируют в течение ночи при комнатной температуре. Затем материал из плат отсасывают и блокируют 1% БСА в PBS в течение 1 ч при RT. Образцы и эталонную сыворотку разводят в РВВ (1% БСА, 0,3% Бридж(эфиры полиоксиэтилена) в PBS, рН 7,2) до разведения, которое дает приблизительную оптическую плотность (ОП) при 450 нм, равную 2,0. Платы промывают (9% NaCl, 0,1% Бридж) пять раз и вносят разведенные образцы и эталонную сыворотку. Эталон и образцы разводят в платах в два раза до конечного объема 100 мкл/лунку и инкубируют платы в течение 1 ч при 37 С. Затем платы снова промывают и нагружают 100 мкл/лунку конъюгированных с пероксидазой специфических в отношении вида IgG с Fcспецифичностью (Jackson, West Grove, PA), разведенных в РВВ, и инкубируют при 37 С в течение одного часа. Платы промывают и инкубируют в течение 10 мин при комнатной температуре со 100 мкл/лунку субстрата 3,3',5,5'-тетраметилбензидина (ТМБ) (KPL, Gaithersburg, MD),разведенного 1:1 Н 2 О 2 (прилагаемой к набору реагентов ТМБ). Реакцию останавливают добавлением 100 мкл/лунку 1 М фосфорной кислоты и читают результат при 450 нм на ридере для плат для микротитрования MR4000 (Dynatech). Образцы количественно оценивают относительно эталона, используя анализ параллельных линий. Для эталона определяют числовое значение(ед./мл), которое соответствует разведению,обеспечивающему значение ОП приблизительно 2,0 при 450 нм. Специфичности антител оценивают, используя ELISA для определения ингибирования. Каждую сыворотку с активностью против 3'AMNic-Suc-rEPA разводят до концентрации, 31 вдвое превышающей концентрацию, которая давала бы оптическую плотность приблизительно 2,0 при 450 нм. Используя ELISA для 3'AMNic-pGlu, как описано выше, разбавленную сыворотку, предназначенную для анализа, абсорбируют в соотношении 1:1 (об/об) увеличивающимися количествами тест-антигена (ингибитора) в течение трех часов при 37 С и данный абсорбированный образец тестируют с помощью ELISA, используя неабсорбированную сыворотку в качестве эталона. Процент абсобции относительно неабсорбированного образца определяют для каждого образца. Специфичность сыворотки крыс, содержащей антитела, появившиеся в ответ на 3'AMNic-Suc-rEPA, вычисляют, используя ELISA для определения ингибирования с тартратом никотина в качестве ингибитора. IC50 (50% подавляющая концентрация) для данного антитела составляет 3,5 х 10-6 М. Специфичность сыворотки кроликов, содержащей антитела, появившиеся в ответ на 3'-AMNic-Suc-rEPA, вычисляют, используя ELISA для определения ингибирования с тартратом никотина в качестве ингибитора. IC50 для данного антитела составляет 2,3 х 10-5 М. Пример 11. Аффинность и связывающая способность антитела. Связывающую способность антитела измеряют с помощью равновесного диализа в течение 4 ч при 37 С с использованием 0,7 мл плазмы, полумикрокамер Teflon, мембран Spectrapor 2, задерживающих частицы с молекулярной массой 12-14 кД и буфера Sorenson (0,13 М фосфат, рН 7,4) (см. статью Pentel и соавт., J.Pharmacol. Exp. Ther, 246, стр. 1061-1066,(1987. рН плазмы измеряют в конце каждого цикла равновесного диализа и образцы используют только, если конечное значение рН составляет 7,30 -7,45. Аффинность антитела в отношении никотина вычисляют с использованием радиоимуноанализа в жидкой фазе (см. статью Mueller,Meth. Enzymol, 92, стр. 589-601 (1983. Измерение молекулярной массы IgG дает значение 150 кД. Константы связывания и аффинности, полученные с помощью радиоиммуноанализа, являются следующими. Для сыворотки крыс против 3'-AMNic-Suc-rEPA IC50 (молярное) составляет 1,36 х 10-7. Значение Ks (молярное-I) составляет 2,57 х 107. Концентрация центров связывания составляет 2,61 х 10-6 центров связывания/л и концентрация никотин-специфическогоIgG составляет 0,2 мг/мл. Пример 12. Оценка распределения никотина в плазме и головном мозге в моделях на животных. Соответствующую данному изобретению вакцину оценивают с помощью различных моделей на животных. Модели на крысах позволяют определить эффект активной или пассив 004956 32 ной иммунизации на распределение никотина в плазме и головном мозге. В одном исследовании изучают эффекты пассивной иммунизации на ослабление двигательных эффектов никотина, которые обусловлены действием никотина на центральную нервную систему (ЦНС). В другом эксперименте оценивают действие пассивной иммунизации на эффекты никотина в отношении сердечно-сосудистой системы: оценка систолического кровяного давления. Для оценки данного способа иммунотерапии разрабатывают модель на животном для имитации быстрого поглощения никотина из двух сигарет у человека. Данная модель на животных описана в статье Hieda (см. Hieda, J.Pharmacol. Exp. Ther. 283(3): 1076-1081, (1997. В данной модели крысам вводят 0,03 мг/кг никотина путем внутривенной инфузии в течение 10 с, имитируя быстрое поглощение никотина из легких у курящего человека. Образцы крови берут через 3 и 10 мин после инъекции никотина для измерения уровня никотина в плазме. При необходимости измерения концентраций никотина в головном мозге животных умерщвляют через 3 мин после инъекции и быстро удаляют их головной мозг. Вакцину, соответствующую примеру 4, анализируют на крысах с целью определения ее эффекта в отношении распределения никотина в плазме и головном мозге. А. Активная иммунизация. Крыс иммунизируют никотиновой вакциной с помощью трех внутрибрюшинных инъекций общей массой 25 мкг/инъекцию вакцины(3'-AMNic-Suc-rEPA) с интервалами две недели. У данных животных имеется повышенный уровень никотина в плазме через 3 и 10 мин после инфузии 0,03 мг/кг никотина в течение 10 с по сравнению с неиммунизированными контрольными животными (см. фиг. 1). Таким образом,активная иммунизация является эффективной в плане повышения связывания никотина в плазме. Известно, что самое незначительное снижение количества никотина, достигающего головного мозга, может резко изменить эффекты никотина на поведение. В. Пассивная иммунизация. С помощью пассивной иммунизации возможно определить эффект доза-ответ иммунного IgG на повышение уровней никотина в плазме и снижение уровней никотина в головном мозге. Крысам вводят различные количестваIgG против 3'-AMNic-Suc-rEPA общей массой 12,5 - 50 мг/инъекцию. Как показывают на фиг. 2, имеется четкий эффект доза-ответ - увеличение дозы IgG повышает уровень никотина в сыворотке и снижает уровни никотина в головном мозге. На фиг. 3 показано, что антиникотиновые антитела (против 3'-AMNic-Suc-rEPA) присутствуют и являются активными в сыворотке крыс через 30 мин и 1 день после введения антител в 33 целом 50 мг/инъекцию. На фиг. 3 представлено,что после введения никотина (инфузия 0,03 мг/кг в течение 10 сек) данные антитела являются эффективными в плане снижения концентраций никотина в головном мозге и повышения уровней никотина в плазме через 30 мин и 1 день после введения антител. Другим способом демонстрации эффективности пассивной иммунизации никотиновой вакциной, соответствующей изобретению, является ее способность бороться с последующими инфузиями никотина. В отдельных экспериментах по пассивной иммунизации на крысах множество доз никотина не истощают имеющиеся антитела или не снижают в значительной степени их способность связывать вновь веденный никотин. На фиг. 4 показано, что 50 мг антитела против 3'-AMNic-Suc-rEPA вливают в точке времени ноль. Через 24 ч делают пять инъекций никотина - 0,03 мг/кг никотина вливают в течение 10 сек в правую яремную вену каждые 20 мин в течение 80 мин. В целом делают пять инъекций никотина. Пятую инъекцию никотина делают с 3 Н-никотином. Всю кровь и головной мозг забирают через 1 мин после пятой инъекции. Результаты представлены ниже и графически показаны на фиг. 4 и 5. Данные результаты показывают, что даже после пятой дозы никотина антитела являются эффективными в плане повышения уровней никотина в сыворотке и снижения уровней никотина в головном мозге. Результаты, полученные с 3 Н-никотином, демонстрируют, что антитела являются эффективными в отношении никотина, инъецированного в пятой дозе. Пример 13. Оценка двигательных эффектов никотина. Данный эксперимент разработан для определения того, может ли пассивная иммунизация препятствовать немедленному опосредуемому ЦНС действию никотина. Модель на крысах,используемая в данном эксперименте, разработана д-ром David Malin и описана в работе Malin и соавт. "Никотин-специфические IgG снижают его проникновение в головной мозг и ослабляют его поведенческие и сердечно-сосудистые эф 004956and cardiovascular effects in rats), представленной на Пятом ежегодном собрании Общества исследований никотина и табака (the Fifth Annualand Tobacco), San Diego, CA, 5-7 марта, 1999. Для определения базового значения измеряют эффект подкожной инъекции 0,8 мг/кг тартрата никотина на уровень двигательной активности у крыс. Доза 0,8 мг/кг тартрата никотина является максимальной дозой, которая могла бы быть использована без индукции аномалий движений. Имеется повышение уровня активности после инъекции никотина у крыс, которым предварительно не вводят антитело против 3'AMNic-Suc-rEPA, и у крыс, которым предварительно вводят 50 мг нормального кроличьего сывороточного IgG (см. фиг. 6 А, правый столбик, и фиг. 6 В, левый столбик). Данный эффект супрессируют предварительным введением животным 50 мг иммунного IgG против 3'-AMNicSuc-rEPA (см. фиг. 6 В, правый столбик). Это показывает, что антиникотиновая антисыворотка устраняет стимулирующий эффект никотинаin vivo. Пример 14. Оценка действия никотина на систолическое кровяное давление. В данном эксперименте измеряют другой показатель поведенческого эффекта никотина изменение систолического кровяного давления. Крысам предварительно вводят IgG против 3'AMNic-Suc-rEPA или контрольный IgG. Крысам делают подкожную инъекцию 0,1 мг/кг тартрата никотина. У контрольных крыс показывают повышение систолического кровяного давления до 42,6+ 3,2 мм рт.ст. при введении никотина. При предварительном введении крысам антиникотинового антисывороточного IgG введение никотина является менее эффективным. При введении антиникотиновой сыворотки в повышающихся количествах способность никотина повышать кровяное давление уменьшается. Как показано на фиг. 7, имеется отрицательный прямолинейный тренд кровяного давления как функции дозы IgG. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат гаптен-носитель формулыY выбран из группы, состоящей из NH-CO,CO-NH, CO-NH-NH, NH-NH-CO, NH-CO-NH,CO-NH-NH-CO и S-S,а структура -(CH2)n-X-(CH2)y-Y- связана по положению 3', 4' или 51 никотина. 2. Конъюгат по п.1, отличающийся тем,что m составляет 11-17, n равно 1, у равно 2, X представлено NH-CO, Y представлено CO-NH,где структура -(CH2)n-X-(CH2)y-Y- связана по положению 3' никотина. 3. Конъюгат по п.1, отличающийся тем,что m составляет 11-17, n равно 1, у равно 2, X представлено NH-CO, Y представлено CO-NH,где -(CH2)n-X-(CH2)y-Y- связано по положению 4' никотина. 4. Конъюгат по п.1, отличающийся тем,что m составляет 11-17, n равно 1, у равно 2, X представлено NH-CO, Y представлено CO-NH,где -(CH2)n-X-(CH2)y-Y- связано по положению 5' никотина. 5. Конъюгат по п.1, отличающийся тем,что m выбрано из группы, состоящей из 1-20 и 1-200. 6. Конъюгат по любому из пп.1-5, отличающийся тем, что белок-носитель представлен экзопротеином А. 7. Конъюгат гаптен-носитель формулы где m составляет 11-17, n равно 1, у равно 2, X представлено NH-CO, Y представлено CO-NH,белок-носитель является экзопротеином А и структура -(CH2)n-X-(CH2)y-Y- связана по положению 3' никотина. 8. Конъюгат гаптен-носитель формулы где n составляет 0-12, j составляет 1-1000, k составляет 1-20 и Е представляет собой матрикс,содержащий аминокислоту. 9. Конъюгат по п.8, отличающийся тем,что матрикс представлен поли-L-глутаминовой кислотой. 10. Конъюгат гаптен-носитель согласно любому из пп.1-9, полученный с использованием транс-4'-карбокси-(-)котинина в качестве исходного материала. 36 11. Антитело, образующееся в ответ на конъюгат гаптен-носитель по любому из пп.110. 12. Антитело по п.11, отличающееся тем,что оно является моноклональным. 13. Антитело по п.11, отличающееся тем,что оно является поликлональным. 14. Функциональный фрагмент антитела по п.11. 15. Набор для установления присутствия никотина в образце, отличающийся тем, что он содержит антитело или его функциональный фрагмент по любому из пп.11-14. 16. Способ получения антитела, отличающийся тем, что млекопитающего-хозяина иммунизируют конъюгатом гаптен-носитель по любому из пп.1-10. 17. Способ по п.16, отличающийся тем, что полученное антитело является моноклональным. 18. Способ по п.16, отличающийся тем, что полученное антитело является поликлональным. 19. Вакцинная композиция, отличающаяся тем, что она содержит по меньшей мере один конъюгат по любому из пп.1-10. 20. Вакцинная композиция, отличающаяся тем, что она состоит в основном из конъюгата гаптен-носитель по любому из пп.1-10. 21. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптенноситель по любому из пп.1-10. 22. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптенноситель по любому из пп.1-10 и по меньшей мере одного адъюванта. 23. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптенноситель по любому из пп.1-10, по меньшей мере одного адъюванта и по меньшей мере одного наполнителя. 24. Вакцинная композиция, отличающаяся тем, что она состоит из конъюгата гаптенноситель по любому из пп.1-10, по меньшей мере одного адъюванта, по меньшей мере одного наполнителя и по меньшей мере одного вспомогательного агента. 25. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество конъюгата гаптен-носитель по любому из пп.1-10. 26. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество антитела или его функционального фрагмента по любому из пп.11-14. 27. Способ профилактики или лечения никотиновой аддикции, отличающийся тем, что вводят эффективное количество конъюгата гаптен-носитель по любому из пп.1-10 и дополнительно соединение, используемое для лечения никотиновой аддикции.
МПК / Метки
МПК: A61K 47/48, A61P 25/34
Метки: никотина, композиция, лечения, образце, аддикции, получения, никотиновой, определения, профилактики, способ, набор, гаптен-носитель, антитело, функциональный, присутствия, фрагмент, антитела, вакцинная, варианты, конъюгат
Код ссылки
<a href="https://eas.patents.su/20-4956-konyugat-gapten-nositel-varianty-antitelo-i-sposob-ego-polucheniya-funkcionalnyjj-fragment-antitela-nabor-dlya-opredeleniya-prisutstviya-nikotina-v-obrazce-vakcinnaya-kompoziciya-v.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгат гаптен-носитель (варианты), антитело и способ его получения, функциональный фрагмент антитела, набор для определения присутствия никотина в образце, вакцинная композиция (варианты) и способ профилактики или лечения никотиновой аддикции (варианты)</a>
Предыдущий патент: Новые циклические α-амино-γ-гидроксиамидные соединения, способ их получения и фармацевтические композиции, их содержащие
Следующий патент: Новые разветвленные замещенные аминопроизводные 3-амино-1-фенил-1h[1,2,4]триазола, способы их получения и содержащие их фармацевтические композиции
Случайный патент: Устройство для очистки плазмы дугового испарителя от незаряженных микро- и макрочастиц