Устойчивые композиции 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил) бензо[b] тиофена и его солей
Номер патента: 4871
Опубликовано: 26.08.2004
Авторы: Миннетт Майкл Дин, Тингл Черил Энн, Хартоэр Керри Джон, Башор Фадия Наджар, Рикард Юджин Кларк
Формула / Реферат
1. Фармацевтическая композиция, включающая 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен или его соль; стабилизирующий агент, выбранный из метионина, ацетилцистеина, цистеина или их солей в количестве, достаточном для обеспечения устойчивости к разложению; и фармацевтически приемлемые наполнители.
2. Фармацевтическая композиция по п.1, в которой стабилизирующий агент находится в указанной композиции в количестве примерно от 0,01 до примерно 10% от массы всей композиции.
3. Фармацевтическая композиция по п.2, в которой стабилизирующий агент находится в указанной композиции в количестве примерно от 0,05 до примерно 5,0% от массы всей композиции.
4. Фармацевтическая композиция по одному из пп.1-3, в которой 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен находится в виде гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена.
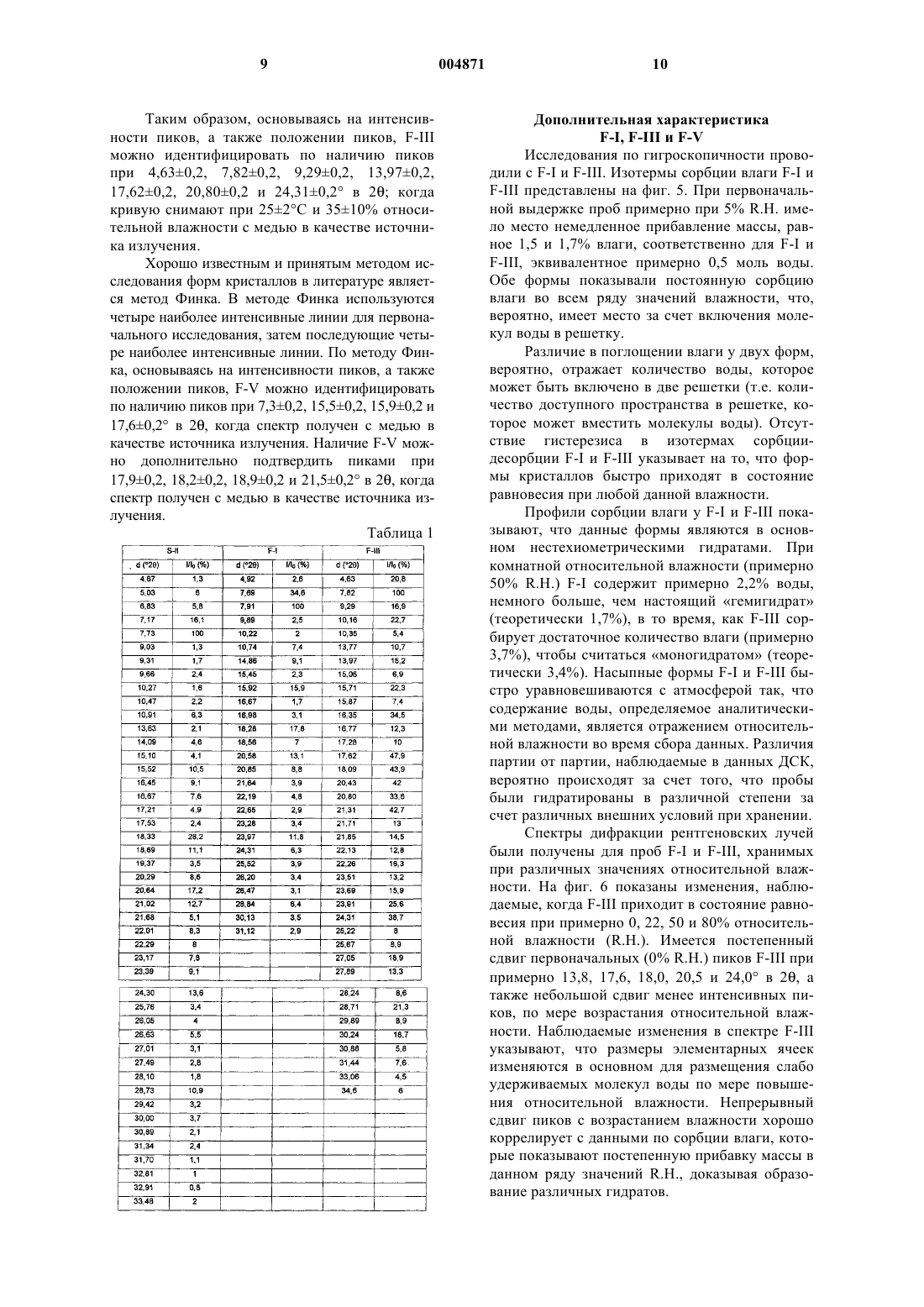
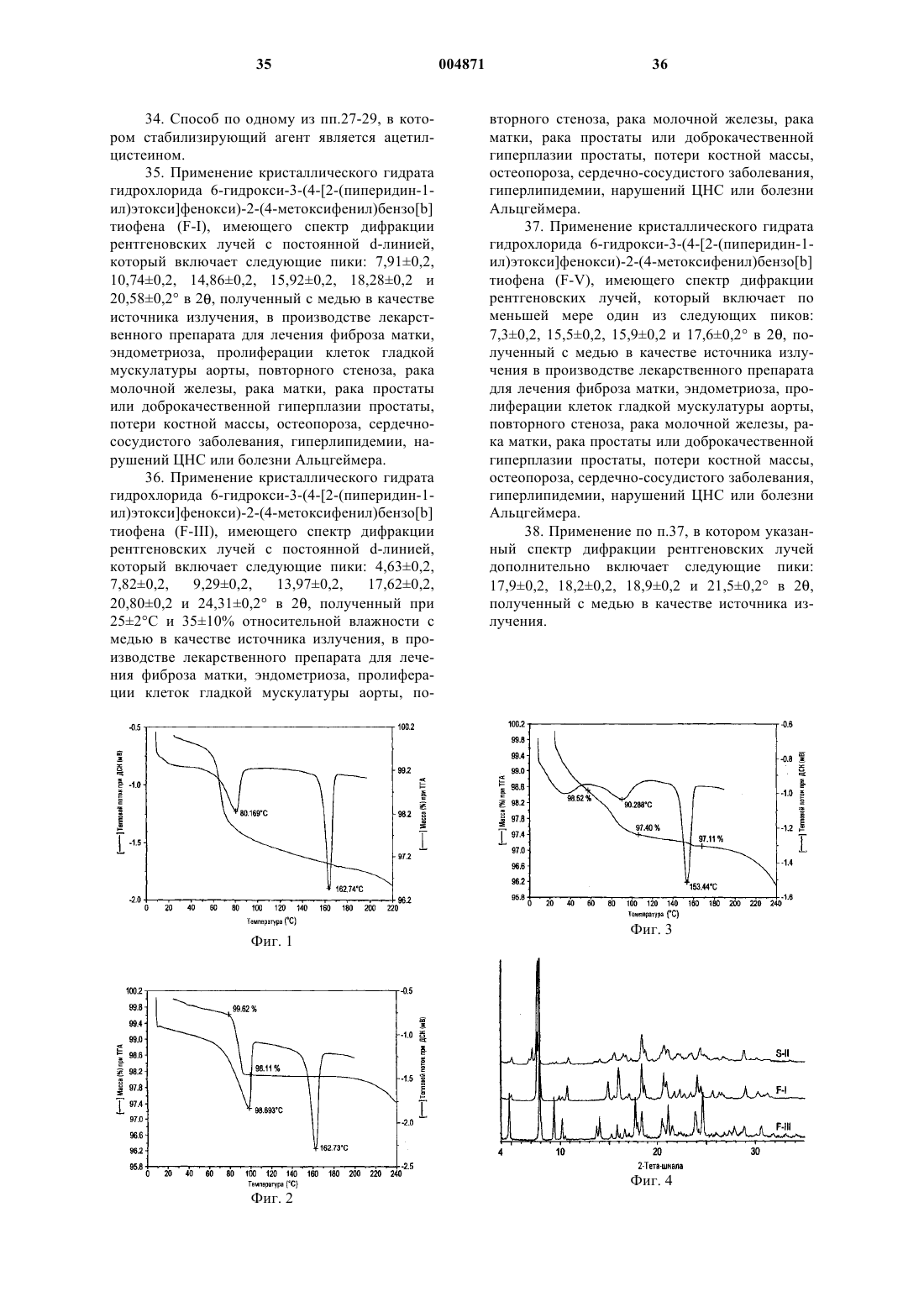
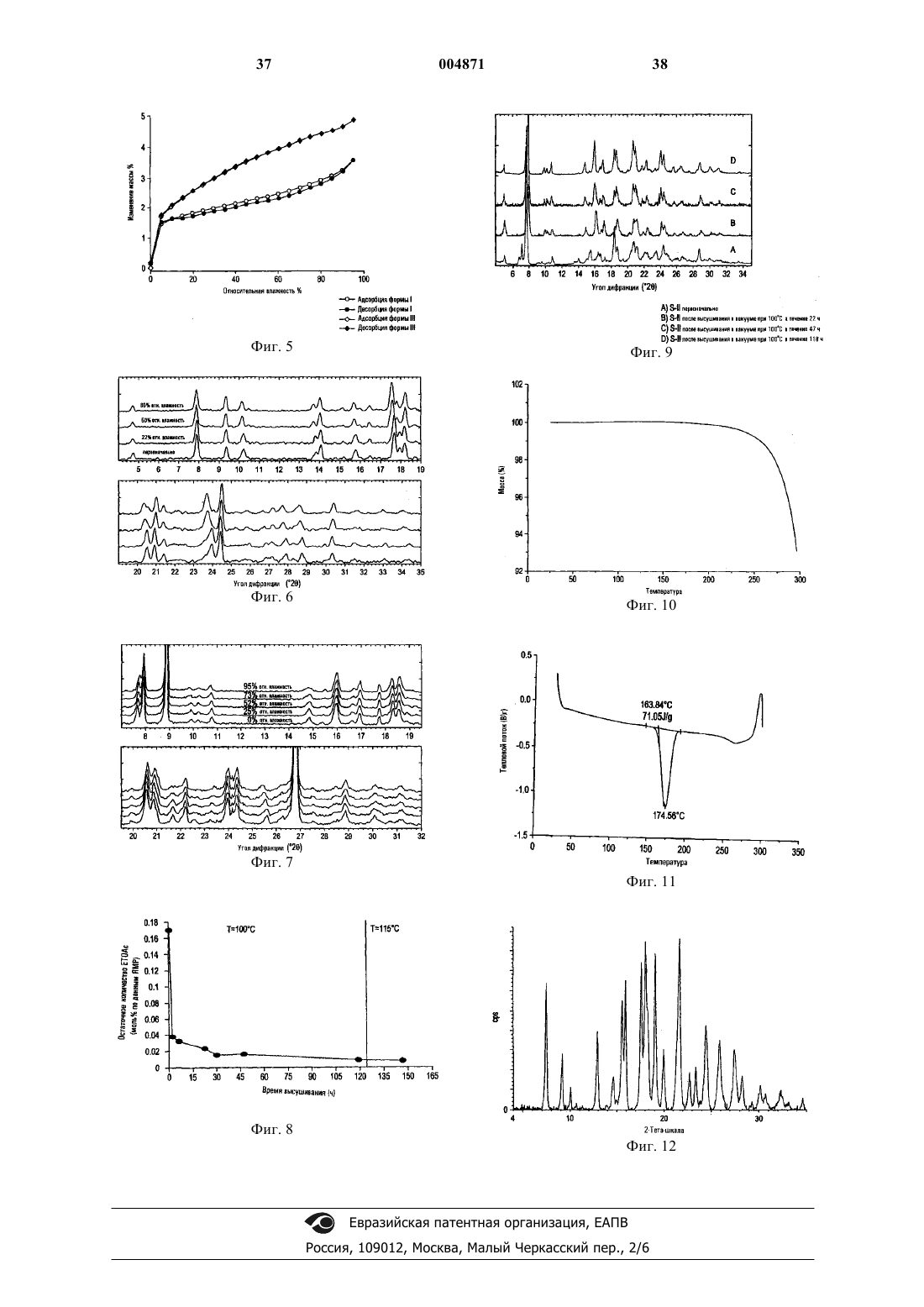
5. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-I), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 7,91+0,2, 10,74+0,2, 14,86+0,2, 15,92+0,2, 18,28+0,2 и 20,58+0,2ш в 2q , полученный с медью в качестве источника излучения.
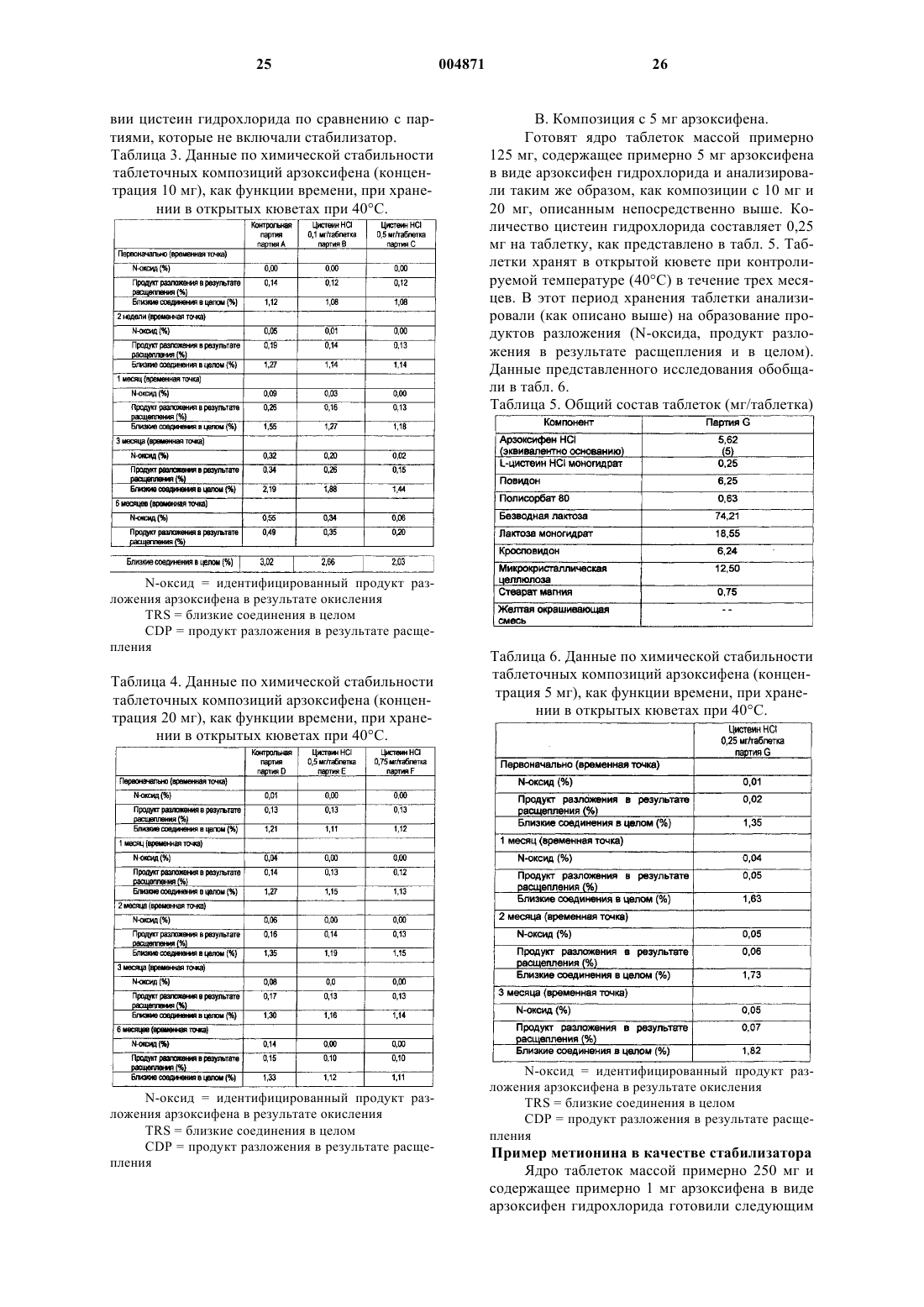
6. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-III), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 4,63+0,2, 7,82+0,2, 9,29+0,2, 13,97+0,2, 17,62+0,2, 20,80+0,2 и 24,31+0,2ш в 2q , полученный при 25+2шC и 35+10% относительной влажности с медью в качестве источника излучения.
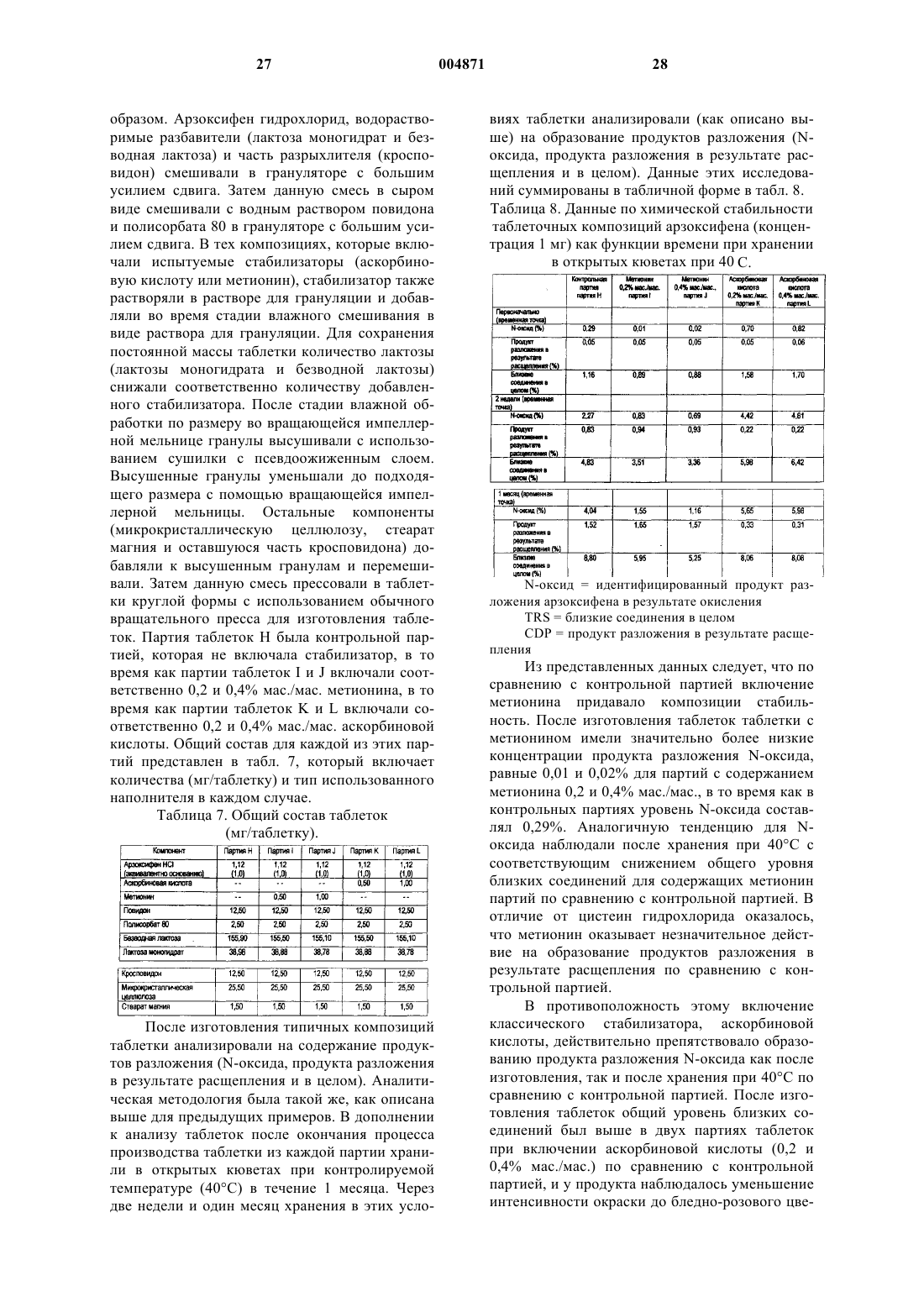
7. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-V), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает по меньшей мере один из следующих пиков: 7,3+0,2, 15,5+0,2, 15,9+0,2 и 17,6+0,2ш в 2q , полученный с медью в качестве источника излучения.
8. Фармацевтическая композиция по п.7, где указанный спектр дифракции рентгеновских лучей дополнительно включает следующие пики: 17,9+0,2, 18,2+0,2, 18,9+0,2 и 21,5+0,2ш в 2q , полученный с медью в качестве источника излучения.
9. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является цистеин или его соль.
10. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является цистеин гидрохлорид.
11. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является моногидрат L-цистеин гидрохлорида.
12. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является метионин или его соль.
13. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является ацетилцистеин или его соль.
14. Фармацевтическая композиция по одному из пп.1-13, которая является таблеткой.
15. Фармацевтическая композиция по одному из пп.1-13, которая является капсулой.
16. Фармацевтическая композиция по одному из пп.4-8, содержащая 20-23 мг, предпочтительно примерно 21,53 мг гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена и 0,2-0,8 мг, предпочтительно примерно 0,5 мг цистеин гидрохлорида.
17. Фармацевтическая композиция по п.16, которая является таблеткой массой 220-280 мг, предпочтительно примерно 250 мг.
18. Фармацевтическая композиция по одному из пп.4-8, содержащая 5,3-5,9 мг, предпочтительно примерно 5,62 мг гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена и 0,2-0,3 мг, предпочтительно примерно 0,25 мг цистеин гидрохлорида.
19. Фармацевтическая композиция по п.18, которая является таблеткой массой 120-130 мг, предпочтительно примерно 125 мг.
20. Фармацевтическая композиция по одному из пп.16-19, в которой цистеин гидрохлорид является моногидратом L-цистеин гидрохлорида.
21. Способ ингибирования патологического состояния, выбранного из группы, состоящей из фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС и болезни Альцгеймера, который включает введение млекопитающему, при его необходимости, эффективного количества фармацевтической композиции по п.1.
22. Способ по п.21, где патологическим состоянием является рак молочной железы.
23. Способ по п.21, где патологическим состоянием является остеопороз.
24. Способ по п.21, где патологическим состоянием является рак эндометрия.
25. Фармацевтическая композиция по одному из пп.1-20, для применения в целях терапевтического лечения человека или животного.
26. Применение фармацевтической композиции по одному из пп.1-20 в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС и болезни Альцгеймера.
27. Способ обеспечения устойчивости фармацевтической композиции, содержащей 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен или его соль, к разложению, где данный способ включает введение в указанную фармацевтическую композицию в дополнение к терапевтически эффективному количеству указанного 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо [b]тиофена или его соли и одному или более фармацевтически приемлемых наполнителей, стабилизирующего агента, выбранного из метионина, ацетилцистеина, цистеина или их солей в количестве, достаточном для обеспечения устойчивости к разложению.
28. Способ по п.27, в котором 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен находится в виде гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена.
29. Способ по п.27 или 28, в котором стабилизирующий агент находится в указанной композиции в количестве примерно от 0,01 до примерно 10% от массы всей композиции.
30. Способ по одному из пп.27-29, в котором стабилизирующий агент является цистеином.
31. Способ по одному из пп.27-30, в котором стабилизирующий агент является цистеин гидрохлоридом.
32. Способ по одному из пп.27-31, в котором цистеин гидрохлорид является моногидратом L-цистеин гидрохлорида.
33. Способ по одному из пп.27-29, в котором стабилизирующий агент является метионином.
34. Способ по одному из пп.27-29, в котором стабилизирующий агент является ацетилцистеином.
35. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-I), имеющего спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 7,91+0,2, 10,74+0,2, 14,86+0,2, 15,92+0,2, 18,28+0,2 и 20,58+0,2ш в 2q , полученный с медью в качестве источника излучения, в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуЁы аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС или болезни Альцгеймера.
36. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-III), имеющего спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 4,63+0,2, 7,82+0,2, 9,29+0,2, 13,97+0,2, 17,62+0,2, 20,80+0,2 и 24,31+0,2ш в 2q , полученный при 25+2шC и 35+10% относительной влажности с медью в качестве источника излучения, в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС или болезни Альцгеймера.
37. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-V), имеющего спектр дифракции рентгеновских лучей, который включает по меньшей мере один из следующих пиков: 7,3+0,2, 15,5+0,2, 15,9+0,2 и 17,6+0,2ш в 2q , полученный с медью в качестве источника излучения в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС или болезни Альцгеймера.
38. Применение по п.37, в котором указанный спектр дифракции рентгеновских лучей дополнительно включает следующие пики: 17,9+0,2, 18,2+0,2, 18,9+0,2 и 21,5+0,2ш в 2q , полученный с медью в качестве источника излучения.
Текст
1 Предпосылки изобретения Гидрохлорид 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил) бензо[b]тиофен (арзоксифенгидрохлорид) впервые был включен в число заявленных соединений в патенте США 5510357 ('357) и отдельно был раскрыт в патенте США 5723474 ('474). Оба патента '357 и '474 указаны в качестве ссылки. Арзоксифен как в форме свободного основания, так и соли, представляет нестероидный смешанный антагонист/агонист эстрогенов,пригодный, помимо всего прочего, для снижения уровня холестерина в сыворотке крови и подавления гиперлипидемии, остеопороза, зависимых от эстрогенов опухолей, включая рак молочной железы и матки, эндометриоза, нарушений ЦНС, включая болезнь Альцгеймера,пролиферации клеток гладкой мускулатуры аорты и повторного стеноза. В настоящее время соединение проходит клинические испытания для лечения и профилактики остеопороза и лечения рака эндометрия и молочной железы у женщин. В частности, арзоксифен пригоден и клинически испытывается для лечения метастатического рака молочной железы с чувствительными рецепторами; адъювантного лечения пациентов с чувствительными рецепторами после соответствующей местной или системной терапии; снижения рецидивов инвазивного и неинвазивного рака молочной железы; уменьшения случаев инвазивного рака молочной железы и карциномы протоков in situ (DCIS). Арзоксифен также пригоден в комбинации с радиотерапией; ингибиторами ароматазы, такими как аминоглутемид (CYTANDREN), анастразол (ARIMIDEX), летрозол (FEMARA),форместан (LENATRON), эксеместан (AROMASIN) и тому подобное; аналогами LHRH,такими как гозерлин (ZOLADEX), лейпролид(LUPRON) и тому подобное; и ингибиторами ацетилхолинэстеразы. Известно, что арзоксифен разлагается в течение времени, о чем свидетельствует образование продуктов разложения, в частности продукта разложения в виде N-оксида и продукта разложения в результате расщепления. Образование продуктов разложения активного фармацевтического компонента обычно нежелательно. Такие продукты разложения обладают потенциальной возможностью проявления побочных эффектов и ненужного воздействия на пациентов. Контроль продуктов разложения или примесей регулируется указаниями Международной конференции по гармонизации(ICH), которые осуществляются национальными контролирующими органами, такими как Администрация по продуктам питания и лекарственным препаратам в США (FDA). В указанияхICH представлены уровни таких продуктов разложения или примесей, выше которых необходимо проводить идентификацию структуры и оценку в соответствующих токсикологических или клинических исследованиях. 2 Первоначальные попытки уменьшить образование продуктов разложения арзоксифена в фармацевтической композиции были неудачными. Включение молекулы классического антиоксиданта (аскорбиновой кислоты) действительно препятствовало образованию продукта разложения арзоксифена N-оксида, а также образованию других продуктов разложения, при более высоких уровнях сразу же после производства и с большей скоростью увеличения во время хранения. Как указывается в фармацевтической литературе (см. Akers M.J., Journal of(1982, отсутствует надежный метод для предсказания эффективности действия антиоксиданта в фармацевтических продуктах. В настоящее время заявители установили,что добавление стабилизирующего агента, выбранного из метионина, ацетилцистеина, цистеина или их солей, в виде части фармацевтической композиции таблеток арзоксифена будет существенно снижать образование продуктов разложения во время процесса производства и/или хранения лекарственного препарата. Краткое описание фигур Фиг. 1 представляет типичную кривую дифференциальной сканирующей калориметрииS-II; фиг. 2 представляет типичную кривую ДСК/ТГА F-I; фиг. 3 представляет типичную кривую ДСК/ТГА F-III; фиг. 4 представляет спектр порошковой дифракции рентгеновских лучей (XRD) F-III при 252 С и 3510% относительной влажности и спектры дифракции рентгеновских лучей S-II и F-I; фиг. 5 представляет изотермы сорбции влаги F-I и F-III; фиг. 6 представляет изменения в спектре дифракции рентгеновских лучей F-III как функцию относительной влажности; фиг. 7 представляет изменения в спектре дифракции рентгеновских лучей F-I как функцию относительной влажности; фиг. 8 представляет десольватацию S-II как функцию времени и температуры высушивания; фиг. 9 представляет спектры дифракции рентгеновских лучей для выбранных временных точек при десольватации S-II; фиг. 10 представляет типичную кривую ТГА F-V; фиг. 11 представляет типичную кривую ДСК F-V; фиг. 12 представляет типичный спектр дифракции рентгеновских лучей F-V. Краткое описание изобретения Настоящее изобретение относится к фармацевтической композиции, содержащей 6 гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фено 3 кси)-2-(4-метоксифенил)бензо[b]тиофен или его соль; стабилизирующий агент, выбранный из метионина, ацетилцистеина, цистеина и их солей, в количестве, достаточном для обеспечения устойчивости к разложению; и фармацевтически приемлемые наполнители. Также раскрывается способ обеспечения устойчивости фармацевтической композиции,содержащей 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b] тиофен или его соль, к разложению во время процесса производства или хранения лекарственного препарата. Способ включает введение в указанную фармацевтическую композицию в дополнении к терапевтически эффективному количеству указанного 6-гидрокси-3-(4-[2(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена или его соли и одному или более фармацевтическим носителям, разбавителям или наполнителям, стабилизирующего агента, выбранного из метионина, ацетилцистеина, цистеина или их солей в количестве,достаточном для обеспечения устойчивости к разложению. Кроме того, раскрывается способ подавления патологического состояния, выбранного из группы, состоящей из фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы,остеопороза,сердечнососудистого заболевания, гиперлипидемии, нарушений ЦНС и болезни Альцгеймера, который включает введение млекопитающему, нуждающемуся в этом, эффективного количества фармацевтической композиции, раскрываемой в данном описании. Кроме того, раскрываются устойчивые фармацевтические композиции, включающие кристаллические формы арзоксифен гидрохлорида F-I, F-III или F-V. Подробное описание изобретения Арзоксифен (т.е. 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен) и его соли можно получить, как описано в патенте США 5510357 ('357) и патенте США 5723474 ('474), оба в полном объеме включены в качестве ссылок. Сыпучий арзоксифен гидрохлорид, полученный способом, описанным в '474 (пример 41,кристаллизация из смеси этанола и этилацетата,фильтрование и высушивание остатка на фильтре в вакууме до постоянной массы при комнатной температуре) охарактеризован спектром дифракции рентгеновских лучей, и было установлено, что он обладает низкой степенью кристалличности. Данные 1 Н ЯМР подтвердили,что сыпучее вещество содержало 6% этилацетата. Способ кристаллизации, описанный в '474,затем модифицировали таким образом, что к 4 суспензии неочищенного арзоксифен гидрохлорида добавляли этанол в кипящем при температуре дефлегмации этилацетате. При охлаждении и фильтровании в вакууме твердое вещество,которое получают в результате данной модифицированной методики, имеет высокую степень кристалличности и является смешанным сольватом арзоксифен гидрохлорида (в последующем именуется S-II) и смеси этилацетат/вода,который позднее был раскрыт в качестве исходного вещества для F-I (другой кристаллической формы арзоксифен гидрохлорида).F-I получают удалением этилацетата из кристаллической решетки S-II высушиванием в вакууме/прокаливанием S-II при повышенной температуре. Время и температура, необходимые для прокаливания S-II в целях получения FI, широко варьируются от партии к партии, но обычно составляют порядка 5 дней при примерно 100 С. Высокая температура необходима для превращения S-II в F-I, поскольку суспендирование S-II в воде при комнатной температуре или хранение пробы при 98% относительной влажности (R.H.) в течение 3 недель не приводит к превращению в F-I. Кроме того, высушивание S-II в обычной печи при высокой температуре не десольватирует вещество, на основании чего можно предположить, что для удаления этилацетата из решетки S-II также необходим вакуум. Предпочтительной формой арзоксифен гидрохлорида является F-III. F-III легко получить и выделить при комнатной температуре. Преимуществом F-III является то, что умеренные условия высушивания необходимы для удаления низких концентраций остаточного растворителя, использованного для кристаллизации. Данные умеренные условия высушивания устойчиво дают твердое вещество высокой чистоты и с высокой степенью кристалличности и, таким образом, применение F-III устраняет токсикологические проблемы, связанные с остаточным и органическим растворителем в кристаллической решетке. Кроме того, получениеF-III является простым и продуктивным, т.е. применимым для масштабного производства.F-III легко получить и выделить при комнатной температуре кристаллизацией арзоксифен гидрохлорида (или его полиморфа/ сольвата) из смеси изопропилового спирта (IPA) и воды. Обычно, арзоксифен гидрохлорид можно суспендировать в смеси IPA и воды и нагревать для эффективного растворения арзоксифен гидрохлорида, как исходного соединения. Как только происходит растворение, раствору дают медленно охладиться до комнатной температуры и затем дополнительно (с помощью ледяной бани или при замораживании) до 0-5 С. По истечении достаточного периода времени для того, чтобы произошла кристаллизация, кристаллы можно отфильтровать в вакууме и высушить 5 до постоянной массы в вакууме для полученияF-III. Подходящий арзоксифен гидрохлорид в качестве исходного вещества для указанной выше кристаллизации включает, но не ограничивается ими, S-II, F-I, арзоксифен гидрохлорид,полученный способами, описанными в '474, или любые их смеси. Не имеет значения, с какой формы арзоксифен гидрохлорида начинать, поскольку кристаллизация из смеси IPA и воды по способам, описанным здесь, приводит к образованию кристаллов F-III. Соотношение воды и изопропанола (об.:об.) обычно составляет 1:15:1. Более предпочтительно соотношение находится в пределах от 2,5 до 3,5:1. Наиболее предпочтительно соотношение составляет от 2,9 до 3,1:1. Соотношение IPA и воды не является решающим для проведения кристаллизации F-III,но оказывает влияние на выход. Предпочтительно при сборе кристаллов фильтрованием в вакууме следует промыть влажный остаток F-III на фильтре холодной деионизированной водой перед высушиванием в вакууме. Кроме того,предпочтительным является немного повышенная температура при сушке (примерно 50 С в течение 12-24 ч). Для синтеза F-III в промышленном масштабе может быть полезно внесение затравки из кристаллов F-III. В предпочтительном способе F-III получают,выделяют и очищают одновременно с химическим удалением 6-изопропилгидроксизащитной группы с гидрохлорида 6-изопропокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (предшественник А). Реакцию снятия защиты контролируют для полного удаления изопропильной защитной группы, и как только устанавливают, что удаление в основном завершено, обработка реакционной смеси будет предпочтительно включать кристаллизацию в условиях, которые обеспечивают F-III, как обсуждалось выше и в последующем. Способы получения предшественника А и удаления изопропильной группы можно найти в патенте США 5723474,методики которого включены в качестве ссылки. В другом предпочтительном способе F-III получают, выделяют и очищают одновременно с химическим восстановлением S-оксида и химическим удалением бензильной защитной группы с 6-гидроксила в S-оксиде 6-бензилокси 3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4 метоксифенил)бензо[b]тиофена (предшественник В). Реакции восстановления и снятия защиты контролируют для полного восстановления сульфоксида до сульфида и полного удаления бензильной гидроксизащитной группы. Как только установлено,что восстановление/удаление в основном завершены, обработка реакционной смеси будет предпочтительно включать кристаллизацию в условиях, которые обеспечивают получение F-III, как здесь обсуждалось. Способы получения предшественника В для удаления бензильной группы и восстанов 004871 6 ления 1-сульфоксида в соответствующий сульфид можно найти в ранее включенном в качестве ссылки патенте США 5723474. Независимо от химизма стадии снятия защиты и восстановления, кристаллизация арзоксифен гидрохлорида из смеси изопропиловый спирт/вода устойчиво дает кристаллы F-III высокой чистоты. Другой предпочтительной формой арзоксифен гидрохлорида является F-V. F-V можно получить высушиванием либо при комнатной температуре, либо при слегка повышенной температуре, кристаллического твердого вещества,выделенного при комнатной температуре при кристаллизации арзоксифен гидрохлорида (или его любого полиморфа/сольвата) из метанола,этанола или изопропанола или водных смесей метанола. При использовании этанола или изопропанола содержание воды в указанных растворителях предпочтительно составляет менее 0,2% (спектрофотометрической чистоты по стандарту Американского химического Общества). Предпочтительно содержание воды в метаноле составляет менее 30% по объему воды. Более предпочтительно F-V получают высушиванием либо при комнатной температуре, либо при слегка повышенной температуре, твердое вещество, выделенное при кристаллизации из водного метанола, в котором объем воды находится между 20 и 5%. Более предпочтительно FV получают высушиванием при 50-70 С в вакууме, твердое вещество, выделенное при комнатной температуре при кристаллизации арзоксифен гидрохлорида (или его любого полиморфа/сольвата) из водного метанола, в котором содержание воды по объему составляет 15%. Обычно арзоксифен гидрохлорид можно растворить в метаноле (примерно 1 г растворяемого соединения/20 мл растворителя) и необязательно нагреть для более эффективного растворения исходного арзоксифен гидрохлорида. Как только растворение достигнуто, раствор можно необязательно сконцентрировать примерно до 1 г растворяемого соединения/5 мл растворителя, например, перегонкой перед медленным охлаждением раствора до комнатной температуры. При достижении комнатной температуры раствор можно охладить дополнительно (с помощью ледяной бани или замораживания) до 0-5 С. По истечении достаточного периода времени для того, чтобы произошла кристаллизация, кристаллы F-V можно отфильтровать в вакууме и промыть холодным(примерно 0 С) метанолом перед высушиванием до постоянной массы в вакууме. Предпочтительной является немного повышенная температура во время сушки (примерно 50 С в течение 12-48 ч) при продувке азотом. Для синтеза F-V в промышленном масштабе полезно вносить затравку из кристаллов F-V. Подходящий арзоксифен гидрохлорид в качестве исходного вещества для указанной 7 выше кристаллизации включает, но не ограничивается ими, S-II, F-I, F-III (сольватированные и нестехиометрические гидратированные кристаллические формы арзоксифен гидрохлорида,описанные в заявках на патент PCT/US 00/16332 и PCT/US 00/16333, методики которых включены в качестве ссылок), арзоксифен гидрохлорид, полученный способами, описанными в 474, или любые их смеси. Не имеет значения, с какой формы арзоксифен гидрохлорида начинать, поскольку кристаллизация из безводного метанола по способам, описанным здесь, приводит к образованию кристаллов F-V. Характеристика и способы определенияS-II, F-I, F-III и F-V Использовали ДСК/ТГА, сорбцию/десорбцию влаги и дифракцию рентгеновских лучей для характеристики S-II, F-I, F-III и F-V. ТГА часто очень пригоден для определения различных твердых форм вещества, поскольку температура(ы), при которой имеет место физическое изменение вещества, обычно является характеристичной для полиморфа или сольвата. ДСК представляет метод, который часто используют для выявления у соединений полиморфизма и образования сольватов. Изотермы сорбции влаги обеспечивают оценку степени гидроскопичности, присущей данному веществу, и характеризуют негидраты и гидраты. Наконец, дифракция рентгеновских лучей представляет метод,которым определяют порядок в дальних пределах в кристаллическом веществе. Арзоксифен гидрохлорид, полученный способами, описанными в '474, дает спектры дифракции рентгеновских лучей с неудовлетворительным отношением сигнала к шуму и поднятой базовой линией, что указывает на низкую степень кристалличности вещества. Следовательно, проводили сравнение F-I и F-III с веществом (S-II), полученным модифицированной кристаллизацией арзоксифен гидрохлорида,обсужденной выше (добавление этанола к суспензии арзоксифен гидрохлорида в кипящем при температуре дефлегмации этилацетате). Типичные кривые ДСК/ТГА для S-II, F-I иF-III представлены соответственно на фиг. 1, 2 и 3. Кривая ДСК S-II показывает широкую эндотерму при 62 С, соответствующую потере этилацетата и воды из решетки. Эндотерма при 152 С представляет плавление. Потеря массы при ТГА, равная примерно 2,5%, происходит одновременно с первым переходом, в то время как остальная 0,5% потеря массы имеют место к началу плавления, на основании чего можно предположить, что некоторые молекулы растворителя более прочно удерживаются решеткой. Кривая ДСК F-I показывает широкую эндотерму при 75 С с последующей второй эндотермой при 155 С, соответствующей плавлению. Кривая ТГА F-I показывает постепенную потерю массы, равную 0,3%, с последующей 1,5% резкой потерей, которые обе вместе пред 004871 8 ставляют дегидратацию решетки. Начало первого перехода при ДСК и соответствующая потеря массы при ТГА не совпадают за счет различия в скорости нагревания. Первоначальная потеря массы представляет слабо удерживаемую воду гидратации, в то время как вторая потеря массы совпадает с примерно 0,5 моль воды, находящейся в решетке при очень низких значениях относительной влажности (ниже 5%, см. данные по сорбции влаги). Кривая ДСК F-III показывает широкую,низкотемпературную эндотерму при 30 С с последующей второй широкой и относительно слабой эндотермой при 70 С и конечный переход при 146 С, соответствующий плавлению. Резкая потеря массы, составляющая 1,5% (0,5 моль) при ТГА, совпадающая с первой эндотермой, соответствует слабо удерживаемым молекулам воды, в то время, как дополнительная потеря массы 1,6%, имеющая место при температуре выше 60 С, представляет потерю более прочно удерживаемых молекул воды, т.е. таковых, которые присутствуют при очень низких значениях относительной влажности. Потеря массы, наблюдаемая выше 170 С, соответствует разложению F-III. Спектр дифракции рентгеновских лучей FIII при 252 С и 3510% R.H. и соответствующие спектры для S-II и F-I представлены на фиг. 4. Спектры F-I и F-III имеют острые пики и плоскую базовую линию, что указывает на высокую степень кристалличности вещества. Соответствующая постоянная d-линия и данные I/Iо представлены в табл. 1. Несмотря на то, что многие интенсивные отражения находятся в основном на одинаковых углах дифракции, каждая из форм дает различный спектр порошковой дифракции, представляя возможность четко различать S-II, F-I и F-III. В области кристаллографии хорошо известно, что для данного полиморфа относительная интенсивность дифракционных пиков может варьировать за счет предпочтительной ориентации, возникающей в результате факторов, таких как морфология кристаллов. В случаях, когда присутствуют эффекты предпочтительной ориентации, интенсивность пиков изменяется, но положения характерных пиков полиморфа остаются без изменений. См., например, Фармакопею США 23, Национальный формуляр 18, стр. 1843-1844,1995. Кроме того, в области кристаллографии также хорошо известно, что для любой данной кристаллической формы угловые положения пиков могут в незначительной степени различаться. Например, положения пиков могут смещаться за счет различия в температуре, при которой анализируется проба, смещения пробы или наличие или отсутствие внутреннего стандарта. В настоящем случае вариабельность положения пика, равная 0,2 в 2, будет учитывать данные потенциальные различия, что не мешает точной идентификации FI, F-III и F-V. 9 Таким образом, основываясь на интенсивности пиков, а также положении пиков, F-III можно идентифицировать по наличию пиков при 4,630,2, 7,820,2, 9,290,2, 13,970,2,17,620,2, 20,800,2 и 24,310,2 в 2; когда кривую снимают при 252 С и 3510% относительной влажности с медью в качестве источника излучения. Хорошо известным и принятым методом исследования форм кристаллов в литературе является метод Финка. В методе Финка используются четыре наиболее интенсивные линии для первоначального исследования, затем последующие четыре наиболее интенсивные линии. По методу Финка, основываясь на интенсивности пиков, а также положении пиков, F-V можно идентифицировать по наличию пиков при 7,30,2, 15,50,2, 15,90,2 и 17,60,2 в 2, когда спектр получен с медью в качестве источника излучения. Наличие F-V можно дополнительно подтвердить пиками при 17,90,2, 18,20,2, 18,90,2 и 21,50,2 в 2, когда спектр получен с медью в качестве источника излучения. Таблица 1F-I, F-III и F-V Исследования по гигроскопичности проводили с F-I и F-III. Изотермы сорбции влаги F-I иF-III представлены на фиг. 5. При первоначальной выдержке проб примерно при 5% R.H. имело место немедленное прибавление массы, равное 1,5 и 1,7% влаги, соответственно для F-I иF-III, эквивалентное примерно 0,5 моль воды. Обе формы показывали постоянную сорбцию влаги во всем ряду значений влажности, что,вероятно, имеет место за счет включения молекул воды в решетку. Различие в поглощении влаги у двух форм,вероятно, отражает количество воды, которое может быть включено в две решетки (т.е. количество доступного пространства в решетке, которое может вместить молекулы воды). Отсутствие гистерезиса в изотермах сорбциидесорбции F-I и F-III указывает на то, что формы кристаллов быстро приходят в состояние равновесия при любой данной влажности. Профили сорбции влаги у F-I и F-III показывают, что данные формы являются в основном нестехиометрическими гидратами. При комнатной относительной влажности (примерно 50% R.H.) F-I содержит примерно 2,2% воды,немного больше, чем настоящий гемигидрат(теоретически 1,7%), в то время, как F-III сорбирует достаточное количество влаги (примерно 3,7%), чтобы считаться моногидратом (теоретически 3,4%). Насыпные формы F-I и F-III быстро уравновешиваются с атмосферой так, что содержание воды, определяемое аналитическими методами, является отражением относительной влажности во время сбора данных. Различия партии от партии, наблюдаемые в данных ДСК,вероятно происходят за счет того, что пробы были гидратированы в различной степени за счет различных внешних условий при хранении. Спектры дифракции рентгеновских лучей были получены для проб F-I и F-III, хранимых при различных значениях относительной влажности. На фиг. 6 показаны изменения, наблюдаемые, когда F-III приходит в состояние равновесия при примерно 0, 22, 50 и 80% относительной влажности (R.H.). Имеется постепенный сдвиг первоначальных (0% R.H.) пиков F-III при примерно 13,8, 17,6, 18,0, 20,5 и 24,0 в 2, а также небольшой сдвиг менее интенсивных пиков, по мере возрастания относительной влажности. Наблюдаемые изменения в спектре F-III указывают, что размеры элементарных ячеек изменяются в основном для размещения слабо удерживаемых молекул воды по мере повышения относительной влажности. Непрерывный сдвиг пиков с возрастанием влажности хорошо коррелирует с данными по сорбции влаги, которые показывают постепенную прибавку массы в данном ряду значений R.H., доказывая образование различных гидратов. 11 Аналогичный опыт провели с F-I, чтобы определить, будет ли изменение относительной влажности оказывать такое же действие на его решетку. На фиг. 7 показаны спектры дифракции рентгеновских лучей проб F-I, находящихся в равновесии при примерно 0, 25, 52, 73 и 95%R.H. Интенсивные отражения при примерно 8,8 и 26,8 в 2 представляют внутренний стандарт. Наблюдается очень незначительный сдвиг пиков при 0% R.H. при примерно 7,7, 18,3, 18,5,20,5, 20,8 в 29 по мере повышения относительной влажности. Также пики при примерно 7,7,20,8 и 24,1 становятся несколько шире и менее размытыми при более высоких значениях относительной влажности, что указывает на то,что вода сорбируется аморфными компонентами (или твердое вещество пластифицируется) особенно при 73 и 95% R.H. (см. фиг. 5). Сдвиг пиков в спектрах F-I менее выражен, чем сдвиги пиков, наблюдаемые для F-III при различных значениях относительной влажности. На основании этого можно предположить, что решеткаF-I не претерпевает такого же расширения и/или сжатия, как решетка F-III. Было установлено, что F-I и F-III физически стабильны во всем ряду значений относительной влажности, независимо от того, что форма III сорбирует почти в два раза больше воды. Обнаружено, что две формы имеют сравнимый размер кристаллов, морфологию, растворимость в воде и скорости растворения. Провели опыт по высушиванию с целью проследить десольватацию S-II, как функцию времени и температуры сушки (см. фиг. 8). Спектры дифракции рентгеновских лучей для выбранных временных точек представлены на фиг. 9. Указанные спектры показывают изменения, которые имеют место по мере снижения уровня этилацетата в кристаллической решетке. Проба, использованная в опыте по высушиванию, могла быть частично десольватированной,поскольку для выделения твердого вещества использовали фильтрование в вакууме. Много пиков дифракции в опыте с десольватацией S-II появляется при одинаковых углах,тем самым подтверждая, что решетки S-II и F-I очень похожи. Исчезновение пиков дифракции при примерно 6,8, 7,2 и 14,0 в 2 после только минимального высушивания (временная точка В) предполагает, что данные отражения можно отнести за счет кристаллографических плоскостей, содержащих частичную электронную плотность молекул этилацетата. Продолжительное прокаливание сольватированного вещества в вакууме при высокой температуре дает F-I. F-I, полученный таким путем, имел высокую степень кристалличности по данным дифракции рентгеновских лучей. Следовательно, вещество, полученное кристаллизацией из раствора в этаноле и этилацетате, с последующей вакуумной сушкой только в тече 004871 12 ние нескольких часов, как указано в '474, имело низкую степень кристалличности, поскольку данный способ дает частично десольватированный S-II. Типичная кривая ТГА F-V представлена на фиг. 10. Термогравиметрический анализ F-V не показывал потери массы, что указывает на выделение несольватированной кристаллической формы. Анализ ДСК F-V показывал острую эндотерму плавления при 174-175 С, как представлено на фиг. 11, которая значительно выше,чем наблюдаемая для F-III. Изотерма сорбции/десорбции влаги, полученная для F-V, показывала увеличение массы,равное 0,11%, в ряду значений R.H. 0-95%, что указывает на стабильную безводную кристаллическую форму с незначительной склонностью к адсорбции воды или превращению в гидратированную форму арзоксифен гидрохлорида. Спектр дифракции рентгеновских лучей FV имеет острые пики и плоскую базовую линию, что указывает на высокую степень кристалличности вещества. Угловые положения пиков в 2 и соответствующие данные I/Iо для всех пиков с интенсивностью, равной или выше 10% от наибольшего пика для F-V, представлены в табл. 1 А. Все данные в табл. 1 А приведены с точностью 0,2. Несмотря на то, что многие из интенсивных отражений находятся в основном при аналогичных углах дифракции, о которых сообщалось для S-II, F-I и F-III, каждая из форм показывает различный спектр порошковой дифракции рентгеновских лучей, что позволяет четко различать S-II, F-I, F-III и F-V. Анализ порошковой дифракцией рентгеновских лучей F-V при различных температурах не выявил значительного изменения в спектрах дифракции до 125 С, что совпадает с профилем ДСК, указывая на наличие стабильной кристаллической формы. Таблица 1 АF-I и F-III имеют несколько преимуществ по сравнению с формой арзоксифен гидрохлорида предшествующего уровня техники, описанной выше. По сравнению с арзоксифен гидрохлоридом, полученным способами, описанными в 474, F-I и F-III являются более физически стабильными при комнатной температуре и,следовательно, более удобны для фармацевтического применения, т.е. для разработки лекарственной формы. Кроме того, F-I и F-III обладают значительно более высокой степенью кристалличности, чем форма, раскрытая в '474. Кристаллические вещества, в основном, явля 13 ются менее гигроскопичными и более стабильными (т.е. менее подвержены химическому разложению), чем аморфные вещества, и являются,следовательно, более желательными для изготовления лекарственных форм. Кроме того, в отличие от формы арзоксифен гидрохлорида,полученной способами, описанными в '474, которая включает этилацетат и воду в своей решетке, F-I и F-III содержат только воду.F-V имеет несколько преимуществ по сравнению с формой арзоксифен гидрохлорида предшествующего уровня, описанной в '474, и по сравнению с F-I и F-III, описанными выше в цитируемых заявках РСТ. По сравнению с арзоксифен гидрохлоридом, полученным способами, описанными в '474, F-V является более стабильной при комнатной температуре и, следовательно, более подходит для фармацевтического применения, т.е. разработки лекарственной формы. Кроме того, в отличие от формы,раскрытой в '474, F-V обладает более высокой степенью кристалличности. Кристаллические вещества, в основном, являются менее гигроскопичными и более стабильными (т.е. менее подвержены химическому разложению), чем аморфные вещества, и являются, следовательно,более желательными для изготовления лекарственных форм. Кроме того, в отличие от формы арзоксифен гидрохлорида, полученной способами, описанными в '474, которая включает этилацетат и воду в своей решетке, F-V не содержит ни того, ни другого. В отличие от S-II, F-I и F-III F-V представляет настоящую безводную форму арзоксифен гидрохлорида, которая не проявляет склонности адсорбировать воду при изменении относительной влажности. Кроме того, кристаллическая решетка F-V стабильна до ее температуры плавления. Кроме того, F-V обладает примерно на 10% большей растворимостью в воде по сравнению с F-III, и является наиболее термодинамически стабильной известной формой арзоксифен гидрохлорида при хранении в условиях окружающей среды. Методы, используемые для получения характеристик S-II, F-I и F-III ДСК проводили на приборе ТА Instruments 2920 Modulated DSC, соединенным с ThermalAnalyst 3100 и снабженным рефрижераторной охлаждающей системой. Пробы (3-5 мг) нагревали в гофрированных алюминиевых чашечках от 10 до 240 С со скоростью нагревания 2 С/мин. ТГА проводили на термогравиметрическом анализаторе ТА Instruments 2050, соединенным с Thermal Analyst 3100. Пробы (5-10 мг) нагревали в открытых чашечках от 25 до 250 С со скоростью нагревания 5 С/мин. Спектры дифракции рентгеновских лучей получали на рентгеновском порошковом дифрактометре Siemens D5000, снабженным источником CuK ( =l, 54056 ) и детектором 14 для твердого вещества Kevex, работающим при 50 кВ и 40 мА. Каждую пробу сканировали в пределах от 4 до 35 в 2. Перед сбором данных пробам давали возможность достичь равновесия, по меньшей мере, в течение 30 мин при желаемой температуре и/или относительной влажности. Определение гигроскопичности проводили для F-I и F-III с использованием метода VTI следующим образом. Каждую пробу высушивали в вакууме при 60 С до тех пор, пока не наблюдалось дальнейшего снижения массы, в это время в камере с пробой создавали 0% относительную влажность. Изотермы сорбции влаги получали при 25 С с использованием весов влагомера в вакуумной камере VTI при следующих условиях: размер пробы 10-15 мг, пределы относительной влажности при адсорбции/десорбции 0-95%, с интервалом 5%, время анализа пробы 10 мин. Методы, используемые для получения характеристик F-V ДСК проводили с использованием прибора ТА Instruments 2920, снабженного автосамплером и рефрижераторным охлаждающим устройством. Пробу помещали в гофрированную алюминиевую чашечку и анализировали против пустой контрольной чашечки. Тепловой поток определяли после уравновешивания при 30 С. Скорость нагревания составляла 5 в мин до 300 С. Интегрировали график зависимости теплового потока от температуры для обнаружения любых эндотермических или экзотермических явлений. ТГА проводили с использованием ТА Instruments 2950, снабженного автосамплером. Пробу помещали в тарированную алюминиевую чашечку и температуру повышали от комнатной до 300 С со скоростью 10 С в мин. Интегрировали график зависимости массы в процентах от температуры для определения потери в процентах. Изотермы сорбции влаги получали с использованием VTI поточного аппарата SGA100. Пробы анализировали при 25 С в пределах относительной влажности 0-95% (R.H.) для адсорбции и в пределах 95-5% (R.H.) для десорбции с интервалами 5% (R.H). Изотермы адсорбции и десорбции получали в виде графика изменения массы в % к % RH. Спектры дифракции рентгеновских лучей получали на рентгеновском порошковом дифрактометре Siemens D5000, снабженным СuK источником (=1,54056 ), работающем при 50 кВ и 40 мА с твердофазным детектором Si (Li)Kevex. Пробы сканировали в пределах от 4 до 35 С в 2 с интервалом 0,04. Сухие порошки упаковывали в утопленные загружаемые сверху держатели для проб и гладкую поверхность получали с помощью стеклянного предметного стекла. 15 Спектры дифракции рентгеновских лучей при различных температурах получали на рентгеновском порошковом дифрактометре Siemens(=1,54056 ), работающим при 50 кВ и 40 мА с сцинтилляционным детектором и никелевым фильтром. Порошок упаковывали в утопленные загружаемые сверху держатели с контролируемой температурой и для дифракции получали гладкую поверхность. Пробы сканировали в пределах от 2 до 35 С при 2 с интервалом 0,04 в течение 2,5 с, начиная при 25 С после достижения равновесия в течение 5 мин. Последующие сканы получали при возрастании температуры на 25 С до максимума 125 С. Последующие препаративные примеры дополнительно иллюстрируют способы получения кристаллических форм арзоксифен гидрохлорида, используемого в фармацевтических композициях по настоящему изобретению. Примеры не предназначены для ограничения объема данных композиций в любом отношении, и их не следует истолковывать таким образом. Получение 1. F-III из гидрохлорида 6 изопропокси-3-(4-[2-(пиперидин-1-ил)этокси] фенокси)-2-(4-метоксифенил)бензо[b]тиофена. К раствору гидрохлорида 6-изопропокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (10 г, 18 ммоль) в метиленхлориде (100 мл) в атмосфере азота при(-10 С)-(-20 С) добавляли ВСl3 (г) (4,23 г, 34 ммоль) со скоростью, при которой температура реакции сохранялась ниже -10 С. После завершения добавления реакционную смесь перемешивали еще в течение 2 ч. К реакционной смеси медленно добавляли изопропиловый спирт (IPA,12,35 мл, 167 ммоль) при температуре ниже-10 С и перемешивали еще в течение 30 мин. В отдельную колбу загружали 100 мл воды и охлаждали на ледяной бане до примерно 0 С. Раствор продукта переносили в воду через трубку при энергичном перемешивании. Полученную суспензию перемешивали при 0 С в течение 1 ч. Продукт выделяли фильтрованием и промывали 25 мл смеси 40% СН 2 Сl2/вода, затем 25 мл холодной воды. Продукт суспендировали в 60 млIPA и 60 мл воды и нагревали до 60 С. При 48 С получали раствор. Добавляли еще воду (120 мл). Раствор охлаждали до 35 С и суспензию дополнительно медленно охлаждали до 0-5 С и перемешивали в течение нескольких часов. Продукт выделяли фильтрованием и промывали холодной деионизированной водой (25 мл). Сырой остаток на фильтре F-III высушивали до постоянной массы в вакууме при 50 С в течение 1224 ч с получением F-III. Получение 2. F-III из S-оксида 6 бензилокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена. 16 В склянку Парра емкостью 250 мл добавляли деионизированную воду (5,25 мл), 1 М НСl(7,74 мл, 7,75 ммоль), 10% Pd/C (тип А 32110,1,37 г, 1,29 ммоль Pd), S-оксид 6-бензилокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (3 г, 5,16 ммоль) и изопропиловый спирт (32 мл) при комнатной температуре. Склянку соединяли со встряхивателем Пара, откачивали воздух и дважды продували азотом, затем откачивали воздух и заполняли газообразным водородом под давлением 30psig (207 кПа). Включали встряхиватель и реакционную смесь нагревали до 60 С. Окончание реакции определяли анализом ВЭЖХ примерно через 4 ч. Реакционную смесь фильтровали через сплавленный слой из диатомовой земли и сплавленный слой промывали 0,1 М НСl (2x10 мл). Растворитель удаляли в вакууме примерно при 50 С. Полученный остаток растворяли в смеси 50% изопропиловый спирт/деионизированная вода (30 мл) и мягко нагревали на паровой бане, пока не получали раствор. К раствору добавляли деионизированную воду (22 мл) и раствору давали охладиться до комнатной температуры. Суспензию продукта дополнительно охлаждали до 0 С. Продукт выделяли фильтрованием, промывали холодной деионизированной водой (2x15 мл) и высушивали в вакууме при 50 С до постоянной массы с получением. F-III. Получение 3. F-I из S-II.S-II высушивали в вакуумной печи (-25 дюймов рт.ст.; -635 мм рт.ст.) при 100 С в течение 118 ч с получением F-I. Получение 4. F-V: кристаллизация из метанола без концентрирования. Пробу арзоксифен гидрохлорида массой 20,0 г смешивают с 500 мл безводного метанола(для ВЭЖХ) и нагревают до кипения с обратным холодильником. Все твердые частицы растворяют с получением гомогенного бледножелтого раствора. Раствор охлаждают до температуры ниже температуры кипения и добавляют еще 5,00 г арзоксифен гидрохлорида. Раствор повторно нагревают до кипения с обратным холодильником для растворения всех твердых частиц. Раствору медленно дают охладиться при перемешивании. При 50 С в раствор вносят затравку из нескольких миллиграммов ранее полученной соли F-V. Суспензии кристаллов дают охладиться от 50 до 30 С в течение 1,25 ч. На этой точке присутствует большое количество белых твердых частиц. Перемешанную суспензию помещают на ледяную баню и перемешивают еще в течение 3 ч. Суспензию фильтруют через фильтровальную бумагу Whatman 1 и белое твердое вещество промывают 50 мл метанола, предварительно охлажденного до 0 С. Неочищенный остаток на фильтре высушивают в течение примерно 48 ч при 50 С в вакууме при слабой продувке N2. Выход 15,94 г (выход 63,8%). Чистота по ВЭЖХ 89,4% (в виде сво 17 бодного основания), общее количество близких соединений (TRS) 0,28%. Сравнение массы продукта до и после высушивания показывало, что первоначальный сырой остаток на фильтре содержал 65% растворителя. Получение 5. F-V: кристаллизация из метанола с концентрированием. Пробу арзоксифен гидрохлорида массой 25,00 г смешивают с 500 мл безводного метанола (для ВЭЖХ) и нагревают до кипения с обратным холодильником. Все твердые частицы растворяются с получением гомогенного бледножелтого раствора. Раствор концентрируют удалением 375 мл дистиллята перегонкой при атмосферном давлении. На этой точке реакционная смесь представляет прозрачный гомогенный желтый раствор. Кипячение с обратным холодильником прерывают и в раствор вносят затравку из нескольких миллиграммов заранее приготовленного F-V. После внесения затравки смесь охлаждают до комнатной температуры при медленном перемешивании в течение 1 ч. Во время этого образуется большое количество белого осадка. Суспензию помещают на ледяную баню и перемешивают еще в течение 3 ч. Суспензию фильтруют с использованием фильтровальной бумаги Whatman 1, и белое вещество промывают 50 мл метанола, предварительно охлажденного до 0 С. Сырой остаток на фильтре высушивают в течение примерно 48 ч при 50 С в вакууме при слабой продувке N2. Выход составляет 22,44 г (выход 89,8%). Чистота по ВЭЖХ 91,3% (в виде свободного основания), TRS 0,26%. Сравнение массы продукта до и после высушивания показывало, что первоначальный сырой остаток на фильтре содержал 31,5% растворителя. Получение 6. F-V: перекристаллизация в объеме 30 галлон из метанола. Пробу арзоксифен гидрохлорида массой 3,08 кг смешивают с 60 л безводного метанола(для ВЭЖХ) и нагревают до кипения с обратным холодильником. Все твердые частицы растворяются с получением бледно-желтого гомогенного раствора. Раствор концентрируют удалением 40 л дистиллята перегонкой при атмосферном давлении. На этой точке реакционная смесь представляет прозрачный гомогенный желтый раствор. Реакционную смесь охлаждают для прекращения кипячения с обратным холодильником и открывают смотровой люк при примерно 40 С для проверки протекания кристаллизации. Наблюдают образование кристаллов и охлаждение продолжают со скоростью 12 в час до конечной температуры 0 С. Суспензию при кристаллизации перемешивают в течение ночи при 0 С и затем фильтруют на фильтрпрессе с одной плитой. Для того чтобы удалить весь продукт из кристаллизатора, маточный раствор используют для промывки кристаллизатора и затем пропускают через пресс. Сырой остаток на фильтре затем промывают 11,3 л безводного 18 метанола, предварительно охлажденного до 0 С. Сырой остаток на фильтре высушивают при подсоединении вакуума к прессу и подаче воды при 50 С в рубашку пресса. Примерно через 24 ч пропускают слабый ток N2. Общее время высушивания составляет примерно 36 ч. Выход составляет 2,588 кг (86,27%); чистота по ВЭЖХ 92,7% (в виде свободного основания); TRS 0,39%. Получение 7. F-V: кристаллизация из этанола. Смешивали особо чистый этанол (250 мл) и арзоксифен гидрохлорид (10,0 г) и нагревали до кипения с обратным холодильником до растворения. Раствор охлаждали до комнатной температуры в течение 3 ч, в течение этого времени образовывался белый кристаллический осадок. Твердые частицы выделяли фильтрованием и высушиванием в вакууме в течение ночи при 50 С при слабой продувке N2. Выход составлял 5,50 г, т. пл. 173 С (ДСК). Был получен спектр порошковой дифракции рентгеновских лучей данной пробы и в основном он был аналогичен таковому спектру для F-V, представленному на фиг. 12. Получение 8. F-V: кристаллизация из изопропанола. Смешивали безводный изопропанол (250 мл) и арзоксифен гидрохлорид (10,0 г) и нагревали до кипения с обратным холодильником для растворения. Нагревание прекращали и в раствор вносили затравку из нескольких миллиграммов F-V. Реакционную смесь охлаждали до комнатной температуры и перемешивали в течение ночи, в это время образовывался белый осадок. Твердые частицы выделяли фильтрованием с получением на фильтре 12,11 г содержащего растворитель осадка. Пробу содержащего растворитель осадка с фильтра массой 4,01 г высушивали в течение ночи при 60 С в вакууме при слабой продувке азотом. Выход составлял 2,72 г, т.п. 171,5 С (ДСК). Был получен спектр порошковой дифракции рентгеновских лучей данной пробы, и, в основном, он был аналогичен таковому для F-V,представленному на фиг. 12. Получение 9. F-V: получение из арзоксифена в форме свободного основания. Арзоксифен в форме свободного основания (5,07 г) суспендировали в 65,0 мл метанола. К реакционной смеси добавляли 1,41 мл концентрированной соляной кислоты и 10,0 мл воды. Реакционную смесь нагревали до 55 С в течение 15 мин для растворения. Реакционную смесь охлаждали до 30 С и вносили затравку из 50 мг F-V. Реакционную смесь охлаждали до 10 С со скоростью 1 С/ч и перемешивали при этой температуре в течение 8 ч. Твердые частицы выделяли фильтрованием, промывали предварительно охлажденным до 10 С метанолом и высушивали в вакууме при 50 С в течение ночи при слабом продувании N2. Выход составлял 19 4,42 г (выход 87,7%); чистота по ВЭЖХ 99,7%;TRS 0,32%. Был получен спектр порошковой дифракции рентгеновских лучей, и в основном он был аналогичен таковому спектру для F-V,представленному на фиг. 12. Термин соль в том смысле, как он используется в формуле изобретения, в основном, относится к фармацевтически приемлемой соли и представляет соли 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена и указанных стабилизирующих агентов, которые физиологически подходят для фармацевтического применения. Фармацевтически приемлемые соли могут быть образованы с 6 гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофеном в виде аддитивных солей первичного, вторичного, третичного или четвертичного аммония, щелочного металла или щелочно-земельного металла. В основном аддитивные соли кислоты получают взаимодействием кислоты с 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил) бензо[b]тиофеном. Соли щелочного металла или щелочно-земельного металла в основном получают взаимодействием гидроксида металла желаемой соли металла с 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофеном. Термин фармацевтический в том смысле, как он используется, в качестве прилагательного, означает в основном не токсичный и в основном не приносящий вред реципиенту. Под фармацевтической композицией дополнительно понимается комбинация растворителей, наполнителей, и соль должна быть совместима с активным компонентом композиции. Термин аддитивная соль кислоты относится к соли 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b] тиофена или стабилизирующих агентов цистеина, ацетилцистеина или метионина, полученной взаимодействием указанного соединения с минеральной или органической кислотой. Примеры фармацевтических аддитивных солей кислоты приведены, например, в Berge S.M., BighleyL.D. and Monkhouse D.C., J. Pharm. Sci., 66:1,1977. Кислоты, обычно используемые для получения таких аддитивных солей кислоты, включают неорганические кислоты, такие как хлористо-водородная, бромисто-водородная, йодистоводородная, серная и фосфорная кислота, а также органические кислоты, такие как толуолсульфоновая, метансульфоновая, щавелевая,парабромфенилсульфоновая, угольная, янтарная, лимонная, бензойная и уксусная кислота, и близкие неорганические и органические кислоты. Таким образом, такие фармацевтически приемлемые соли включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, метафосфат, пирофосфат, хлорид, бромид,йодид, ацетат, пропионат, деканоат, капролат,акрилат, формиат, изобутират, капрат, гептано 004871 20 ат, оксалат, малонат, сукцинат, субарат, себакат,фумарат, гиппурат, малеат, бутин-1,4-диоат,гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и подобные соли. Термин продукт разложения арзоксифен Термин продукт разложения арзоксифена в результате расщепления относится к соединению формулы Было установлено, что фармацевтическим композициям 6-гидрокси-3-(4-[2-(пиперидин-1-ил) этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена или его солям можно придать устойчивость к разложению во время процесса производства или во время хранения добавлением к указанной композиции стабилизирующего агента, выбранного из метионина, ацетилцистеина, цистеина и их солей. Данные соединения представляют промышленно доступные аминокислоты или производные аминокислот, каждое из которых может находиться в виде рацемата или чистых D- илиL-форм. Предпочтительно стабилизирующим агентом является цистеин гидрохлорид; наиболее предпочтительно моногидрат L-цистеин гидрохлорида. Для целей настоящего изобретения один или более (предпочтительно один) раскрываемых стабилизирующих агентов находятся в фармацевтической композиции в количестве,достаточном для обеспечения устойчивости композиции к разложению. Количество стабилизатора может варьироваться примерно от 0,01 до примерно 10% от массы всей композиции и предпочтительно примерно от 0,05 до примерно 5% от массы всей композиции. Как правило, количество данных стабилизирующих агентов будет составлять примерно от 0,01 до примерно 1,00 раз от количества активного ингредиента в композиции. Точное количество стабилизирующего агента, используемого в конкретной композиции, будет,конечно, зависеть от конечного размера лекарственной формы, конкретной выбранной лекарственной формы, количества активного компонента, находящегося в лекарственной 21 форме, количественного содержания наполнителей и тому подобное. Достаточно сказать,что фармацевтическая композиция будет включать стабилизирующий агент в количестве, достаточном для обеспечения устойчивости указанной композиции к разложению. То есть, композиция будет разлагаться в меньшей степени, когда в указанную композицию вводят один из раскрываемых стабилизирующих агентов. Количество стабилизирующего агента, достаточного для обеспечения устойчивости, может легко определить специалист в данной области хорошо известными, общепринятыми методами тестирования. В частности, является или не является количество стабилизатора эффективным, можно установить при тестировании композиции в сравнении с композициями при отсутствии стабилизатора,как будет показано в примерах ниже. Устойчивые раскрываемые фармацевтические композиции включают терапевтически эффективное количество 6-гидрокси-3-(4-[2(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена или его соли. В том смысле, как он использован, термин терапевтически эффективный относится к такому количеству активного компонента или его соли, достаточному для доставки, в одной или разделенных дозах, примерно от 1 до 100 мг активного компонента в день субъекту,которому он назначается. В предпочтительном воплощении, когда в композиции активным компонентом композиции является гидрохлорид 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена, то он находится в количестве,достаточном для доставки в одной или раздельных дозах, от 0,1 до 100 мг активного компонента в день субъекту, которому он вводится. Предпочтительно активный компонент находится в количестве примерно от 1 мг до примерно 40 мг; или примерно от 5 мг до примерно 30 мг. Наиболее предпочтительно примерно 21,53 мг соли 6-гидрокси-3-(4-[2(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена, особенно гидрохлорида, которое эквивалентно примерно 20 мг свободного основания, вводят в одной или разделенных дозах пациенту в количестве примерно 20 мг в день. Специалистам в данной области очевидно, что терапевтически эффективное количество может широко изменяться, особенно, если принять во внимание путь введения и конкретную соль или свободное основание, которые используются. Конечно, при определении терапевтически эффективного количества в данной ситуации следует учитывать другие факторы, такие как масса или возраст субъекта, который подвергается лечению, а также время, частоту и конкретную фармацевтическую композицию, используемую при введении. Данное количество 22 в конкретном случае может легко определить специалист в данной области с использованием обычных методик титрования доз. Фармацевтические композиции 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2(4-метоксифенил)бензо[b]тиофена или его соли,устойчивые к разложению, предпочтительно являются композициями для перорального введения. Такие композиции включают любую из обычных твердых или жидких лекарственных форм, например такие, как таблетки, капсулы,порошки, суспензии и тому подобное, включая любые их препараты с непрерывным высвобождением. В дополнении к 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофену или его соли и стабилизирующему агенту в фармацевтических композициях по настоящему изобретению для перорального введения используются фармацевтически приемлемые наполнители, включая, но не ограничиваясь ими, разбавители, связующие вещества, разрыхлители, поверхностно-активные вещества, смазывающие вещества, пленочные покрывающие полимеры и тому подобное,помимо всего прочего, такие как глюкоза, лактоза (безводная лактоза и лактоза моногидрат),сахароза, дикальций фосфат, кукурузный и картофельный крахмал, микрокристаллическая целлюлоза, повидон, желатин, гидроксипропилметилцеллюлоза, гидроксипропилцеллю-лоза,порошкообразная трагакантовая камедь, метилцеллюлоза, кросповидон, натрийкрахмалгликолят, натрийкарбоксиметилцеллюлоза, полисорбат 80, лаурилсульфат натрия, стеариновая кислота, стеараты кальция и магния, а также различные буферные агенты, эмульгаторы, разрыхляющие вещества, ароматизаторы, окрашивающие вещества, пластификаторы и тому подобное. Получение раскрываемых фармацевтических композиций легко осуществимо специалистом в данной области. Кроме того, специалисту в данной области очевидно, что конечную фармацевтическую композицию можно получить во множественной или дискретной,разовой лекарственной форме, последняя является предпочтительной. В дополнение к представленной в данном описании информации, имеющей отношение к получению фармацевтических композиций по изобретению,дополнительные сведения можно получить из монографий, содержащих стандартные методы, например Remington's Pharmaceutical Sciences, Seventeenth Edition, Mack Publishing Co,Easton, Pa. (1985), которая включена в данное описание в качестве ссылки. Далее изобретение будет проиллюстрировано следующими ниже примерами, которые не следует рассматривать как ограничивающие. 23 Примеры цистеин гидрохдорида в качестве стабилизатора А. Композиции, содержащие 10 мг и 20 мг арзоксифена Ядро таблеток массой 250 мг, содержащее примерно 10 или 20 мг арзоксифена в виде арзоксифен гидрохлорида, готовили следующим образом. Арзоксифен гидрохлорид,водорастворимые разбавители (лактоза моногидрат и безводная лактоза) и часть разрыхлителя (кросповидон) смешивали в грануляторе с большим усилием сдвига. Затем данную смесь в сыром виде смешивали в грануляторе с большим усилием сдвига с водным раствором повидона и полисорбата 80. В тех композициях, которые включали стабилизатор (цистеин гидрохлорид), цистеин гидрохлорид также растворяли в растворе для грануляции и добавляли во время стадии влажного смешивания в виде раствора для грануляции. Цистеин гидрохлорид предпочтительно добавляли к раствору для грануляции после добавления повидона и полисорбата 80. Для сохранения постоянной массы таблетки количество лактозы (лактозы моногидрата и безводной лактозы) снижали соответственно количеству добавленного цистеин гидрохлорида. После стадии влажной обработки по размеру во вращающейся импеллерной мельнице гранулы высушивали с использованием сушилки с псевдоожиженным слоем. Высушенные гранулы уменьшали до подходящего размера с помощью вращающейся импеллерной мельницы. Остальные компоненты (микрокристаллическую целлюлозу, стеарат магния и оставшуюся часть кросповидона) добавляли к высушенным гранулам и перемешивали. Затем данную смесь прессовали в таблетки круглой формы с использованием обычного вращательного пресса для изготовления таблеток. Для партий таблеток А, В и С количество активного арзоксифена на таблетку составляло 10 мг, при количестве цистеин гидрохлорида (на таблетку) в каждой партии соответственно 0,0, 0,1 и 0,5 мг. Для партий таблеток D, Е и F количество активного арзоксифена на таблетку равнялось 20 мг при количестве цистеин гидрохлорида (на таблетку) в каждой партии соответственно 0,0, 0,5 и 0,75 мг. Общий состав для каждой их указанных партий представлен в табл. 2, который включает количества (мг/таблетка) и тип использованного наполнителя в каждом случае. Как следует из таблицы, ядра таблеток партийD, Е и F включали применение пленочной оболочки, которую наносили водным распылением в поддоне для покрытия с входным отверстием, соединенным с агрегатом для кондиционирования воздуха. 24 Таблица 2. Общий состав таблеток (мг/таблетка) После изготовления типичных композиций таблетки анализировали на содержание продуктов разложения (N-оксида, продукта разложения в результате расщепления и в целом). Анализ на содержание продукта разложения арзоксифен Nоксида, продукта в результате расщепления арзоксифена и близких соединений в целом (примеси,относящиеся к способу получения плюс продукты разложения) проводили с использованием градиентной ВЭЖХ. Разделение проводили с использованием колонки Inertsil C8, 5 мкм, 250x4,6 мм внутренний диаметр. При градиентном элюировании использовали ацетонитрил и фосфатный буфер с рН 3,0 (6 г KН 2 РО 4/л). Первоначальный состав подвижной фазы соответствовал смеси 30% ацетонитрил/70% буфер (подвижная фаза А) и в состав конечной подвижной фазы входила смесь 70% ацетонитрил/30% буфер (подвижная фаза В). Подвижная фаза В начиналась при 0% и линейно возрастала со скоростью 1,8% в мин в течение 20 мин до 36% В. Ее сохраняли при 36% в течение 25 мин, увеличивая на 6,4% в мин в течение 10 мин до 100% В и сохраняя при 100% В в течение двух мин. Температуру колонки поддерживали при 40 С, расход подвижной фазы составляла 1,0 мл/мин, и вводили пробу объемом 10 мкл. Близкие к арзоксифену соединения детектировали УФизлучением с длиной волны 310 нм и определяли количественно в виде процента от площади общего пика. Кроме того, таблетки из каждой партии хранили в открытых кюветах при контролируемой температуре (4 0 С) в течение 6 месяцев. В данный период хранения таблетки анализировали (как описано выше) на образование продуктов разложения (N-оксида, продукта разложения в результате расщепления и в целом). Данные этих исследований обобщены в табличной форме в табл. 3 и 4 для 10 мг (А, В и С) и 20 мг (D,Е и F) соответственно. Данные указывают, что присутствие цистеин гидрохлорида в концентрации 0,5 мг/таблетка при обоих содержаниях арзоксифена в таблетках приводило к снижению на порядок концентрации N-оксида после хранения в течение 6 месяцев при 40 С по сравнению с композицией без стабилизатора. Увеличение содержания продукта разложения в результате расщепления также было существенно ингибировано примерно в два раза в присутст 25 вии цистеин гидрохлорида по сравнению с партиями, которые не включали стабилизатор. Таблица 3. Данные по химической стабильности таблеточных композиций арзоксифена (концентрация 10 мг), как функции времени, при хранении в открытых кюветах при 40 С.N-оксид = идентифицированный продукт разложения арзоксифена в результате окисления Таблица 4. Данные по химической стабильности таблеточных композиций арзоксифена (концентрация 20 мг), как функции времени, при хранении в открытых кюветах при 40 С.N-оксид = идентифицированный продукт разложения арзоксифена в результате окисления 26 В. Композиция с 5 мг арзоксифена. Готовят ядро таблеток массой примерно 125 мг, содержащее примерно 5 мг арзоксифена в виде арзоксифен гидрохлорида и анализировали таким же образом, как композиции с 10 мг и 20 мг, описанным непосредственно выше. Количество цистеин гидрохлорида составляет 0,25 мг на таблетку, как представлено в табл. 5. Таблетки хранят в открытой кювете при контролируемой температуре (40 С) в течение трех месяцев. В этот период хранения таблетки анализировали (как описано выше) на образование продуктов разложения (N-оксида, продукт разложения в результате расщепления и в целом). Данные представленного исследования обобщали в табл. 6. Таблица 5. Общий состав таблеток (мг/таблетка) Таблица 6. Данные по химической стабильности таблеточных композиций арзоксифена (концентрация 5 мг), как функции времени, при хранении в открытых кюветах при 40 С.N-оксид = идентифицированный продукт разложения арзоксифена в результате окисления Пример метионина в качестве стабилизатора Ядро таблеток массой примерно 250 мг и содержащее примерно 1 мг арзоксифена в виде арзоксифен гидрохлорида готовили следующим 27 образом. Арзоксифен гидрохлорид, водорастворимые разбавители (лактоза моногидрат и безводная лактоза) и часть разрыхлителя (кросповидон) смешивали в грануляторе с большим усилием сдвига. Затем данную смесь в сыром виде смешивали с водным раствором повидона и полисорбата 80 в грануляторе с большим усилием сдвига. В тех композициях, которые включали испытуемые стабилизаторы (аскорбиновую кислоту или метионин), стабилизатор также растворяли в растворе для грануляции и добавляли во время стадии влажного смешивания в виде раствора для грануляции. Для сохранения постоянной массы таблетки количество лактозы(лактозы моногидрата и безводной лактозы) снижали соответственно количеству добавленного стабилизатора. После стадии влажной обработки по размеру во вращающейся импеллерной мельнице гранулы высушивали с использованием сушилки с псевдоожиженным слоем. Высушенные гранулы уменьшали до подходящего размера с помощью вращающейся импеллерной мельницы. Остальные компоненты(микрокристаллическую целлюлозу, стеарат магния и оставшуюся часть кросповидона) добавляли к высушенным гранулам и перемешивали. Затем данную смесь прессовали в таблетки круглой формы с использованием обычного вращательного пресса для изготовления таблеток. Партия таблеток Н была контрольной партией, которая не включала стабилизатор, в то время как партии таблеток I и J включали соответственно 0,2 и 0,4% мас./мас. метионина, в то время как партии таблеток K и L включали соответственно 0,2 и 0,4% мас./мас. аскорбиновой кислоты. Общий состав для каждой из этих партий представлен в табл. 7, который включает количества (мг/таблетку) и тип использованного наполнителя в каждом случае. Таблица 7. Общий состав таблеток После изготовления типичных композиций таблетки анализировали на содержание продуктов разложения (N-оксида, продукта разложения в результате расщепления и в целом). Аналитическая методология была такой же, как описана выше для предыдущих примеров. В дополнении к анализу таблеток после окончания процесса производства таблетки из каждой партии хранили в открытых кюветах при контролируемой температуре (40 С) в течение 1 месяца. Через две недели и один месяц хранения в этих усло 004871 28 виях таблетки анализировали (как описано выше) на образование продуктов разложения (Nоксида, продукта разложения в результате расщепления и в целом). Данные этих исследований суммированы в табличной форме в табл. 8. Таблица 8. Данные по химической стабильности таблеточных композиций арзоксифена (концентрация 1 мг) как функции времени при хранении в открытых кюветах при 40 C.N-оксид = идентифицированный продукт разложения арзоксифена в результате окисления Из представленных данных следует, что по сравнению с контрольной партией включение метионина придавало композиции стабильность. После изготовления таблеток таблетки с метионином имели значительно более низкие концентрации продукта разложения N-оксида,равные 0,01 и 0,02% для партий с содержанием метионина 0,2 и 0,4% мас./мас., в то время как в контрольных партиях уровень N-оксида составлял 0,29%. Аналогичную тенденцию для Nоксида наблюдали после хранения при 40 С с соответствующим снижением общего уровня близких соединений для содержащих метионин партий по сравнению с контрольной партией. В отличие от цистеин гидрохлорида оказалось,что метионин оказывает незначительное действие на образование продуктов разложения в результате расщепления по сравнению с контрольной партией. В противоположность этому включение классического стабилизатора, аскорбиновой кислоты, действительно препятствовало образованию продукта разложения N-оксида как после изготовления, так и после хранения при 40 С по сравнению с контрольной партией. После изготовления таблеток общий уровень близких соединений был выше в двух партиях таблеток при включении аскорбиновой кислоты (0,2 и 0,4% мас./мас.) по сравнению с контрольной партией, и у продукта наблюдалось уменьшение интенсивности окраски до бледно-розового цве 29 та. Несмотря на то, что аскорбиновая кислота имела некоторое положительное действие в снижении уровня продукта разложения в результате расщепления по сравнению с контролем после хранения при 40 С, эффект в целом был отрицательный в отношении влияния на Nоксид, общие близкие соединения и обесцвечивание продукта. Применимость Термин ингибирующий и ингибировать включают их общепринятые значения, т.е. профилактику, предупреждение, сдерживание,ослабление, улучшение, замедление, остановку или реверсию прогрессирования или тяжести патологического состояния или его последствий, описанных здесь. Термины предупреждающий, предупреждение чего-либо, профилактика, профилактический и предупреждать использованы взаимозаменяемо и относятся к снижению вероятности того, что у реципиента устойчивой композиции будет проявляться или развиваться любое из патологических состояний или их последствий, раскрытых в данном описании. Термин дефицит эстрогенов относится к состоянию, появляющемуся естественно или индуцированному клинически, когда у женщины не может продуцироваться достаточное количество эстрогенных гормонов для поддержания зависимых от эстрогенов функций, например менструаций, гомеостаза костной массы,нервной функции, сердечно-сосудистого состояния и т.д. Подобные ситуации с дефицитом эстрогенов возникают в результате, но не ограничиваясь ими, менопаузы или хирургической,или химической овариэктомии, включая их функциональный эквивалент, например, лечение агонистами или агонистами GnRH, ICI 182780 и тому подобное. В патентах США 5510357 и 5723474 особо подчеркивается, что арзоксифен пригоден, помимо всего прочего, для снижения уровня холестерина в сыворотке крови и подавления гиперлипидемии, остеопороза, зависимых от эстрогенов опухолей, включая рак молочной железы и матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты и повторного стеноза. В настоящее время соединение проходит клинические испытания для лечения и профилактики остеопороза и лечения рака эндометрия и молочной железы у женщин. Как указывалось выше, арзоксифен также пригоден и проходит клинические испытания для лечения метастатического рака молочной железы с чувствительными рецепторами; адъювантного лечения пациентов с чувствительными рецепторами после соответствующей местной или системной терапии; снижения рецидивов инвазивного и неинвазивного рака молочной железы; уменьшения случаев инвазивного рака молочной железы и карциномы протоков in situ(DCIS). Раскрываемые устойчивые компози 004871 30 ции арзоксифена также пригодны при указанных выше показаниях. Кроме того, арзоксифен также пригоден для ингибирования указанных выше состояний в комбинации с соответствующей радиотерапией; и/или эффективным количеством ингибиторов ароматазы; аналогами LHRH; и/или ингибиторами ацетилхолинэстеразы. Касательно ингибиторов ароматазы, по определению, яичники у женщины в постменопаузе не функционируют. Единственным источником эстрогена для нее является превращение андрогенов надпочечников в эстрогены под действием фермента ароматазы, который обнаружен в периферических тканях, (включая жир,мышцы и саму опухоль молочной железы). Таким образом, препараты, которые ингибируют ароматазу (ингибиторы ароматазы) истощают запасы циркулирующего эстрогена у женщины в постменопаузе. Дефицит эстрогенов, создаваемый путем ингибирования ароматазы, представляет важный вариант лечения пациенток с метастатическим раком молочной железы. Промышленно доступными являются различные ингибиторы ароматазы. Ингибиторы ароматазы включают, например, аминоглутемид (CYTANDREN) (250-1250 мг/день, предпочтительно 250 мг четыре раза в день), анастразол (ARIMIDEX) (1-5 мг/день, предпочтительно 1 мг один раз в день), летрозол (FEMARA) (2,5-10 мг/день, предпочтительно 2,5 мг один раз в день), форместан (LENATRON) (250-1250 мг в неделю, предпочтительно 250 мг два раза в неделю), эксеместан (AROMASIN) (25-100 мг/день, предпочтительно 25 мг один раз в день) и тому подобное. В отношении аналогов LHRH то продолжительное воздействие аналогов LHRH (гормона, высвобождающего лютеинизирующий гормон) ингибирует продукцию эстрогенов у женщин в пременопаузе десенсибилизацией гипофиза, который более не стимулирует яичники к продукции эстрогена. Клиническим эффектом является медицинская оофректомия, которая является обратимой при прекращении приема аналогов LHRH. Аналоги LHRH включают, например, гозерлин (ZOLADEX) (3-15 мг/в течение трех месяцев, предпочтительно 3,6-7,2 мг один раз каждые три месяца), льюпролид (LUPRON) (3-15 мг/месяц, предпочтительно 3,757,5 мг один раз каждый месяц) и тому подобное. Выбранные методики тестирования Методики тестирования для фиброза матки Способы по настоящему изобретению в целях подавления фиброза матки можно продемонстрировать с помощью следующих методов. Тест 1. 3-20 женщинам, страдающим фиброзом матки, вводят раскрываемую устойчивую композицию. Вводимое количество арзоксифена находится в пределах от 1 до 100 мг/день, и период введения составляет 3 месяца. Во время 31 введения и вплоть до 3 месяцев после окончания введения у женщин проводят наблюдение за действием на фиброз матки. Тест 2. Используют ту же методику, как в тесте 1,за исключением того, что период введения составляет 6 месяцев. Тест 3. Используют ту же методику, как в тесте 1,за исключением того, что период введения составляет 1 год. Методики тестирования для болезни Альцгеймера Способы по настоящему изобретению в целях лечения или профилактики болезни Альцгеймера, особенно у женщин в постменопаузе,можно продемонстрировать с помощью следующих методов. Для клинических испытаний отбирают 1050 женщин. Критериями отбора являются нахождение по меньшей мере один год в постменопаузе,общее удовлетворительное состояние здоровья и наличие диагноза болезни Альцгеймера (AD) на ранних стадиях. Кроме того, болезнь протекает у пациенток таким образом, что имеется веское основание ожидать, что во время проведения испытаний у большинства пациенток будет наблюдаться заметное усиление тяжести патологических симптомов. Пациенток разделяют на две группы, первой группе назначают плацебо, в то время как опытной группе вводят устойчивую композицию, раскрытую здесь. Количество назначаемого арзоксифена составляет от 1 до 100 мг/день, один раз в день. По продолжительности исследование проводят в течение от шести до тридцати шести месяцев. Всех пациенток вначале, каждые шесть месяцев и в конце исследования обследуют на психическое состояние. Данный профиль используют для оценки степени заболевания, и он включает факторы способности, такие как память, познавательная функция, самодостаточность, способность к логическому мышлению и тому подобное. Также в обследование пациенток входят объективные показатели, такие как изменения в структуре мозга, что определяют компьютерной послойной томографией. Подобные методологии и оценку психического состояния можно найти в стандартных руководствах по данному предмету. Результаты сравнивают между группами в различные временные точки и изменения у каждой пациентки ко времени. На положительный результат указывают подавление типа или тяжести дегенеративных симптомов в опытной группе, которой вводили композицию по настоящему изобретению, по сравнению с пациентками, получавшими плацебо. 32 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая 6-гидрокси-3-(4-[2-(пиперидин-1-ил) этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен или его соль; стабилизирующий агент,выбранный из метионина, ацетилцистеина, цистеина или их солей в количестве, достаточном для обеспечения устойчивости к разложению; и фармацевтически приемлемые наполнители. 2. Фармацевтическая композиция по п.1, в которой стабилизирующий агент находится в указанной композиции в количестве примерно от 0,01 до примерно 10% от массы всей композиции. 3. Фармацевтическая композиция по п.2, в которой стабилизирующий агент находится в указанной композиции в количестве примерно от 0,05 до примерно 5,0% от массы всей композиции. 4. Фармацевтическая композиция по одному из пп.1-3, в которой 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен находится в виде гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена. 5. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-I), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 7,910,2, 10,740,2, 14,860,2, 15,920,2,18,280,2 и 20,580,2 в 2, полученный с медью в качестве источника излучения. 6. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-III), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает следующие пики: 4,630,2, 7,820,2, 9,290,2, 13,970,2,17,620,2, 20,800,2 и 24,310,2 в 2, полученный при 252 С и 3510% относительной влажности с медью в качестве источника излучения. 7. Фармацевтическая композиция по п.4, в которой указанный гидрохлорид 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена является кристаллическим гидратом гидрохлорида 6-гидрокси-3(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена (F-V), имеющим спектр дифракции рентгеновских лучей с постоянной d-линией, который включает по меньшей мере один из следующих пиков: 7,30,2, 33 15,50,2, 15,90,2 и 17,60,2 в 2, полученный с медью в качестве источника излучения. 8. Фармацевтическая композиция по п.7,где указанный спектр дифракции рентгеновских лучей дополнительно включает следующие пики: 17,90,2, 18,20,2, 18,90,2 и 21,50,2 в 2,полученный с медью в качестве источника излучения. 9. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является цистеин или его соль. 10. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является цистеин гидрохлорид. 11. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является моногидрат L-цистеин гидрохлорида. 12. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является метионин или его соль. 13. Фармацевтическая композиция по одному из пп.1-8, в которой стабилизирующим агентом является ацетилцистеин или его соль. 14. Фармацевтическая композиция по одному из пп.1-13, которая является таблеткой. 15. Фармацевтическая композиция по одному из пп.1-13, которая является капсулой. 16. Фармацевтическая композиция по одному из пп.4-8, содержащая 20-23 мг, предпочтительно примерно 21,53 мг гидрохлорида 6 гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена и 0,20,8 мг, предпочтительно примерно 0,5 мг цистеин гидрохлорида. 17. Фармацевтическая композиция по п.16,которая является таблеткой массой 220-280 мг,предпочтительно примерно 250 мг. 18. Фармацевтическая композиция по одному из пп.4-8, содержащая 5,3-5,9 мг, предпочтительно примерно 5,62 мг гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена и 0,20,3 мг, предпочтительно примерно 0,25 мг цистеин гидрохлорида. 19. Фармацевтическая композиция по п.18,которая является таблеткой массой 120-130 мг,предпочтительно примерно 125 мг. 20. Фармацевтическая композиция по одному из пп.16-19, в которой цистеин гидрохлорид является моногидратом L-цистеин гидрохлорида. 21. Способ ингибирования патологическогосостояния, выбранного из группы, состоящей из фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС и болезни Альц 004871 34 геймера, который включает введение млекопитающему, при его необходимости, эффективного количества фармацевтической композиции по п.1. 22. Способ по п.21, где патологическим состоянием является рак молочной железы. 23. Способ по п.21, где патологическим состоянием является остеопороз. 24. Способ по п.21, где патологическим состоянием является рак эндометрия. 25. Фармацевтическая композиция по одному из пп.1-20 для применения в целях терапевтического лечения человека или животного. 26. Применение фармацевтической композиции по одному из пп.1-20 в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы, остеопороза, сердечно-сосудистого заболевания, гиперлипидемии, нарушений ЦНС и болезни Альцгеймера. 27. Способ обеспечения устойчивости фармацевтической композиции, содержащей 6 гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофен или его соль, к разложению, где данный способ включает введение в указанную фармацевтическую композицию в дополнение к терапевтически эффективному количеству указанного 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2(4-метоксифенил)бензо [b]тиофена или его соли и одному или более фармацевтически приемлемых наполнителей, стабилизирующего агента, выбранного из метионина, ацетилцистеина, цистеина или их солей в количестве, достаточном для обеспечения устойчивости к разложению. 28. Способ по п.27, в котором 6-гидрокси 3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4 метоксифенил)бензо[b]тиофен находится в виде гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b]тиофена. 29. Способ по п.27 или 28, в котором стабилизирующий агент находится в указанной композиции в количестве примерно от 0,01 до примерно 10% от массы всей композиции. 30. Способ по одному из пп.27-29, в котором стабилизирующий агент является цистеином. 31. Способ по одному из пп.27-30, в котором стабилизирующий агент является цистеин гидрохлоридом. 32. Способ по одному из пп.27-31, в котором цистеин гидрохлорид является моногидратом L-цистеин гидрохлорида. 33. Способ по одному из пп.27-29, в котором стабилизирующий агент является метионином. 35 34. Способ по одному из пп.27-29, в котором стабилизирующий агент является ацетилцистеином. 35. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b] тиофена (F-I), имеющего спектр дифракции рентгеновских лучей с постоянной d-линией,который включает следующие пики: 7,910,2,10,740,2, 14,860,2, 15,920,2, 18,280,2 и 20,580,2 в 2, полученный с медью в качестве источника излучения, в производстве лекарственного препарата для лечения фиброза матки,эндометриоза, пролиферации клеток гладкой мускулатуры аорты, повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты,потери костной массы, остеопороза, сердечнососудистого заболевания, гиперлипидемии, нарушений ЦНС или болезни Альцгеймера. 36. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b] тиофена (F-III), имеющего спектр дифракции рентгеновских лучей с постоянной d-линией,который включает следующие пики: 4,630,2,7,820,2,9,290,2,13,970,2,17,620,2,20,800,2 и 24,310,2 в 2, полученный при 252 С и 3510% относительной влажности с медью в качестве источника излучения, в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты, по Фиг. 1 36 вторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы,остеопороза, сердечно-сосудистого заболевания,гиперлипидемии, нарушений ЦНС или болезни Альцгеймера. 37. Применение кристаллического гидрата гидрохлорида 6-гидрокси-3-(4-[2-(пиперидин-1 ил)этокси]фенокси)-2-(4-метоксифенил)бензо[b] тиофена (F-V), имеющего спектр дифракции рентгеновских лучей, который включает по меньшей мере один из следующих пиков: 7,30,2, 15,50,2, 15,90,2 и 17,60,2 в 2, полученный с медью в качестве источника излучения в производстве лекарственного препарата для лечения фиброза матки, эндометриоза, пролиферации клеток гладкой мускулатуры аорты,повторного стеноза, рака молочной железы, рака матки, рака простаты или доброкачественной гиперплазии простаты, потери костной массы,остеопороза, сердечно-сосудистого заболевания,гиперлипидемии, нарушений ЦНС или болезни Альцгеймера. 38. Применение по п.37, в котором указанный спектр дифракции рентгеновских лучей дополнительно включает следующие пики: 17,90,2, 18,20,2, 18,90,2 и 21,50,2 в 2,полученный с медью в качестве источника излучения.
МПК / Метки
МПК: A61K 31/445
Метки: устойчивые, солей, бензо[b, тиофена, 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил, композиции
Код ссылки
<a href="https://eas.patents.su/20-4871-ustojjchivye-kompozicii-6-gidroksi-3-4-2-piperidin-1-iletoksifenoksi-2-4-metoksifenil-benzob-tiofena-i-ego-solejj.html" rel="bookmark" title="База патентов Евразийского Союза">Устойчивые композиции 6-гидрокси-3-(4-[2-(пиперидин-1-ил)этокси]фенокси)-2-(4-метоксифенил) бензо[b] тиофена и его солей</a>
Предыдущий патент: Способ обезболивания
Следующий патент: β-карболиновые фармацевтические композиции
Случайный патент: Буксируемая сейсмоприемная коса, используемая при морской сейсмической разведке